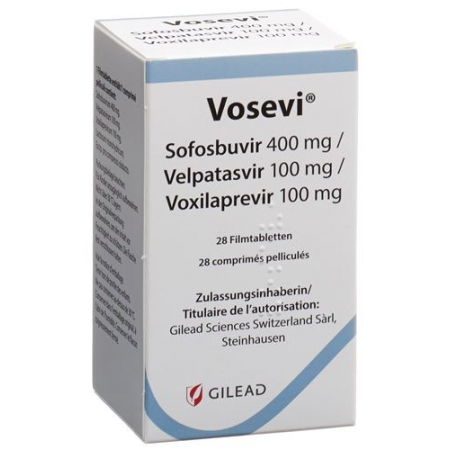


Плівковий стіл Vosevi 400/100/100 Fl 28 шт
VOSEVI Filmtabl 400/100/100
-
2032135.15 RUB
При оплате криптовалютой:
Ваша прибыль 203213.52 RUB / 2290.22 USDT

- Наявність: Немає в наявності
- Модель: 7301644
- EAN 7680665100012
Склад:
Склад:
Magnesium stearat, Lactose-1-Wasser 116.6 mg, Polyvinylalkohol, Titandioxid (E171), Natrium 9.884 mg, Talkum, Eisen(III)-oxid (E172), Siliciumdioxid anhydrat, Croscarmellose natrium, Copovidon, Macrogol 3350, Cellulose, mikrokristalline, Sofosbuvir 400 mg , Velpatasvir 100 mg , Voxilaprevir 100 mg , Überzug:.Sofosbuvir 400 mg
Die gleichzeitige Anwendung mit Arzneistoffen, die den Effluxtransporter P-Glycoprotein induzieren, kann die Elimination von Sofosbuvir bzw. Ledipasvir beschleunigen und seine Plasmakonzentration vermindern.
Verminderte Wirksamkeit von Sofosbuvir bzw. Ledipasvir
Bei gleichzeitiger Behandlung mit mässigen P-Glycoprotein-Induktoren (Modafinil, Letermovir, Oxcarbazepin) wird eine verminderte Wirksamkeit von Sofosbuvir bzw. Ledipasvir erwartet.
Die gleichzeitige Behandlung mit Sofosbuvir bzw. Ledipasvir und mässigen P-Glycoprotein-Induktoren wird nicht empfohlen.
Nicht empfohlen (vorsichtshalber kontraindiziert)
Sofosbuvir und Kombination mit Ledipasvir - P-Glycoprotein-Induktoren, starkeDie gleichzeitige Behandlung mit starken P-Glycoprotein-Induktoren kann die AUC von Sofosbuvir und Ledipasvir vermindern. Rifampicin (600 mg einmal täglich) reduzierte die AUC einer Einzeldosis von Sofosbuvir (400 mg) und Ledipasvir (90 mg) um ca. 72% bzw. 60%.
Verminderte Wirksamkeit von Ledipasvir und Sofosbuvir
Bei gleichzeitiger Behandlung mit starken P-Glycoprotein-Induktoren wird eine verminderte Wirksamkeit von Sofosbuvir und Sofosbuvir/Ledipasvir erwartet.
Die gleichzeitige Behandlung mit Sofosbuvir oder Sofosbuvir/Ledipasvir und starken P-Glycoprotein-Induktoren wird nicht empfohlen.
Nicht empfohlen (vorsichtshalber kontraindiziert)
Amiodaron - SofosbuvirDie Ursache bzw. der Mechanismus dieser Wechselwirkung ist nicht bekannt.
Herzrhythmusstörungen, besonders lebensbedrohliche Bradykardien
Bei gleichzeitiger Behandlung mit Amiodaron und Sofosbuvir zusammen mit einem weiteren Hepatitis-C-Virustatikum (Ledipasvir, Daclatasvir, Simeprevir) wurden mehrere Fälle von teils lebensbedrohliche Bradykardien oder Herzblock berichtet. In den meisten Fällen traten die Herzrhythmusstörungen innerhalb von 24 h nach Beginn der Hepatitis-C-Behandlung auf; sie wurden aber auch bis zu 12 Tage später beobachtet.
Die gleichzeitige Behandlung mit Sofosbuvir-Kombinationen und Amiodaron soll nur dann erwogen werden, wenn andere Antiarrhythmika nicht in Frage kommen. Wird dennoch mit Amiodaron therapiert, muss die Herzfunktion sorgfältig überwacht werden. Die Patienten sollen während der gleichzeitigen Behandlung auf Anzeichen für Herzrhythmusstörungen achten, wie Schwächegefühl, Schwindel, Kurzatmigkeit, Brustschmerz oder Verwirrtheit und in diesem Fall umgehend ärztlichen Rat suchen. Da Amiodaron eine sehr lange Halbwertszeit von über 100 Tagen hat, ist eine entsprechend lange Überwachung auch dann nötig, wenn eine Therapie mit Sofosbuvir-Kombinationen nach dem Absetzen von Amiodaron begonnen wird.
Überwachung bzw. Anpassung nötig
BCRP-Substrate - TivozanibTivozanib kann den Efflux-Transporter BCRP im Darm hemmen und damit möglicherweise die Plasmakonzentrationen von BCRP-Substraten erhöhen. Die Interaktionen wurden nicht untersucht.
Verstärkte Wirkungen der BCRP-Substrate möglich
Die gleichzeitige Einnahme mit Tivozanib kann die Wirkungen von BCRP-Substraten möglicherweise verstärken.
Nach Angaben der Hersteller kann die um 2 Stunden zeitversetzte Einnahme von Tivozanib und BCRP-Substraten die Wechselwirkung minimieren.
Überwachung bzw. Anpassung nötig
Vitamin-K-Antagonisten - Hepatitis-C-VirustatikaDer Mechanismus ist nicht bekannt. Möglicherweise verbessert sich mit der Wirksamkeit der Hepatitis-C-Behandlung der Leberstoffwechsel, so dass die Produktion von Gerinnungsfaktoren steigt, was sich auf die Wirksamkeit der Vitamin-K-Antagonisten auswirkt. In pharmakokinetischen Studien wurde keine veränderte Pharmakokinetik von Warfarin gefunden.
Verminderte Wirksamkeit der Vitamin-K-Antagonisten möglich
Im Verlauf der Therapie mit Hepatitis-C-Virustatika (Boceprevir, Daclatasvir, Dasabuvir, Elbasvir, Grazoprevir, Ledipasvir, Ombitasvir, Paritaprevir, Simeprevir, Sofosbuvir, Telaprevir, Velpatasvir) kann die Wirksamkeit von Vitamin-K-Antagonisten innerhalb weniger Wochen abnehmen; subtherapeutische INR-Werte wurden gemessen.
Bei Patienten unter Vitamin-K-Antagonisten sollen während der gleichzeitigen Behandlung mit Hepatitis-C-Virustatika die Blutgerinnungsparameter (INR) besonders sorgfältig überwacht und die Dosierungen der Vitamin-K-Antagonisten entsprechend angepasst werden.
Überwachung bzw. Anpassung nötig
Antidiabetika - Hepatitis-C-VirustatikaDirekt wirkende HCV-Virustatika vermindern die Viruslast in der Leber, wodurch die metabolische Funktion der Leber verbessert wird, sodass die Blutzuckerspiegel absinken können. Eine Kombination mit Antidiabetika kann somit den Blutzuckerspiegel zusätzlich reduzieren. Mehrere klinische Studien zeigten, dass sich sowohl der Wert der Nüchternglucose als auch der Hb1Ac verbesserten. Über 20 % der Patienten mussten ihre antidiabetische Therapie reduzieren oder beenden.
Verstärkte blutzuckersenkende Wirkung - Hypoglykämien nicht auszuschliessen
Bei Diabetikern kann es nach Einleitung einer Behandlung gegen das Hepatitis-C-Virus (HCV) zu einer Verbesserung des Blutzuckerspiegels und damit potenziell zu einer symptomatischen Hypoglykämie kommen. In 2 Einzelfällen wurde von Hypoglykämien berichet.
Zu Beginn der antiviralen Therapie - insbesondere in den ersten 3 Monaten - ist der Blutzuckerspiegel diabetischer Patienten engmaschig zu überwachen. Bei Bedarf sind Änderungen der Diabetes-Therapie vorzunehmen. Der für die Diabetes-Behandlung des Patienten zuständige Arzt soll über die Einleitung einer antiviralen Therapie in Kenntnis gesetzt werden.
Überwachung bzw. Anpassung nötig
Calcineurin-Inhibitoren - SofosbuvirDie Behandlung mit direkt wirkenden antiviralen Arzneimitteln kann zu einer Verbesserung der Leberfunktion nach einer HCV-Behandlung führen, was die Pharmakokinetik von Calcineurin-Inhibitoren beeinflussen kann.
Mögliche Beeinflussung der Pharmakokinetik durch eine veränderte Leberfunktion
Bei gleichzeitiger Anwendung von direkt wirkenden antiviralen Arzneimitteln kann es zu Veränderungen der Plasmakonzentrationen der Calcineurin-Hemmer kommen.
Eine Überwachung der therapeutischen Konzentration wird empfohlen und erfordert allenfalls eine Dosisänderung der Calcineurin-Inhibitoren.
Vorsichtshalber überwachen
Velpatasvir 100 mg
Velpatasvir ist ein P-Glycoprotein-Substrat und wurde in vitro auch als Substrat von CYP2B6, CYP2C8 und CYP3A4 identifiziert, die das HC-Virustatikum langsam umsetzen. Es wird daher angenommen, dass starke Induktoren dieser Proteine die Clearance von Velpatasvir beschleunigen.
Verminderte Wirksamkeit von Velpatasvir
Die gleichzeitige Behandlung mit starken Induktoren von P-Glycoprotein und/oder CYP3A4, CYP2B6 oder CYP2C8 (Carbamazepin, Enzalutamid, Johanniskraut, Phenobarbital, Phenytoin, Primidon, Rifabutin, Rifampicin) kann die Wirksamkeit von Velpatasvir beeinträchtigen.
Die gleichzeitige Behandlung mit Velpatasvir und starken Induktoren von P-Glycoprotein und/oder CYP3A4, CYP2B6 oder CYP2C8 ist kontraindiziert.
Nicht empfohlen (vorsichtshalber kontraindiziert)
Statine - VelpatasvirStatine sind Substrate von OATP1B1 und BCRP; als Inhibitor von OATP1B1 und BCRP kann Velpatasvir daher zu erhöhten Plasmakonzentrationen von Statinen führen.
Erhöhtes Risiko von Myopathie und Rhabdomyolyse
Bei gleichzeitiger Behandlung mit Statinen und Velpatasvir ist das Risiko seltener, schwerer UAW der Statine wie Myopathie und Rhabdomyolyse mit Nierenversagen erhöht. Symptome sind Muskelschwäche und Myalgien, dunkel gefärbter Urin sowie massiv erhöhte Creatinkinase-Werte (10- bis 100-fach und mehr). Diese UAW können sich einige Tage nach Beginn der gleichzeitigen Behandlung, aber auch im späteren Therapieverlauf manifestieren.
Die gleichzeitige Behandlung mit Statinen und Velpatasvir wird nicht empfohlen.
Nicht empfohlen (vorsichtshalber kontraindiziert)
Velpatasvir - Enzyminduktoren (CYP3A4), mässigeVelpatasvir ist ein CYP3A4-Substrat. Mässige CYP3A4-Induktoren können daher die Bioverfügbarkeit von Velpatasvir verringern.
Verminderte Wirksamkeit von Velpatasvir möglich
Die gleichzeitige Behandlung mit mässigen CYP3A4-Induktoren (Efavirenz, Modafinil, Oxcarbazepin) kann die Wirksamkeit von Velpatasvir beeinträchtigen.
Die gleichzeitige Behandlung mit Velpatasvir und mässigen CYP3A4-Induktoren wird nicht empfohlen.
Nicht empfohlen (vorsichtshalber kontraindiziert)
Hepatitis-C-Virustatika - AntazidaDie Erhöhung des Magen-pH-Wertes kann die Löslichkeit und damit die Absorption von Ledipasvir bzw. Velpatasvir vermindern.
Verminderte antivirale Wirksamkeit von Ledipasvir bzw. Velpatasvir nicht auszuschliessen
Die Einnahme zusammen mit Antazida beeinträchtigt möglicherweise die antivirale Wirksamkeit von Ledipasvir bzw. Velpatasvir.
Es wird empfohlen, zwischen der Einnahme von Ledipasvir bzw. Velpatasvir und Antazida einen zeitlichen Abstand von 4 Stunden einzuhalten.
Überwachung bzw. Anpassung nötig
Tenofovirdisoproxil - Hepatitis-C-VirustatikaLedipasvir bzw. Velpatasvir erhöhten bei gleichzeitiger Behandlung mit Tenofovir disoproxil die Plasmakonzentrationen von Tenofovir, vermutlich durch Hemmung von P-Glycoprotein. In 2 klinischen Studien waren die erhöhten Tenofovir-Plasmakonzentrationen aber nicht mit verstärkter Nephrotoxizität verbunden.
Verstärkte Wirkungen von Tenofovir möglich
Bei gleichzeitiger Behandlung mit Ledipasvir/Sofosbuvir, Velpatasvir/Sofosbuvir bzw. Velpatasvir/Sofosbuvir/Voxilaprevir werden verstärkt unerwünschte Wirkungen von Tenofovir disoproxil befürchtet (Nephrotoxizität), vor allem, wenn zusätzlich Ritonavir oder Cobicistat als metabolischer Booster eingesetzt wird.
Die gleichzeitige Behandlung mit Tenofovir disoproxil und Ledipasvir/Sofosbuvir, Velpatasvir/Sofosbuvir bzw. Velpatasvir/Sofosbuvir/Voxilaprevir soll mit Vorsicht vorgenommen werden, wenn keine anderen Behandlungsmöglichkeiten zur Verfügung stehen. Dabei soll die Nierenfunktion sorgfältig kontrolliert werden (Kreatinin-Clearance und Serumphosphat).
Überwachung bzw. Anpassung nötig
Velpatasvir - ProtonenpumpenblockerDie Erhöhung des Magen-pH-Wertes kann die Löslichkeit und damit die Absorption von Velpatasvir vermindern. Omeprazol, 40 mg täglich, verringerte die AUC von Velpatasvir im Schnitt um 31 %. Durch Einnahme mit Cola verbesserte sich die Bioverfügbarkeit von Velpatasvir wieder auf ca. 161 %.
Verminderte antivirale Wirksamkeit von Velpatasvir nicht auszuschliessen
Die gleichzeitige Behandlung mit Protonenpumpenblockern beeinträchtigt möglicherweise die antivirale Wirksamkeit von Velpatasvir.
Falls die gleichzeitige Behandlung mit Velpatasvir und Protonenpumpenblockern nötig ist, sollen diese höchstens in Tagesdosen angewendet werden, die mit Omeprazol 20 mg vergleichbar sind (Dexlansoprazol 30 mg, Esomeprazol 20 mg, Lansoprazol 30 mg, Pantoprazol 40 mg, Rabeprazol 20 mg). Die Kombination Sofosbuvir/Velpatasvir soll in diesem Fall mit einer Mahlzeit und 4 Stunden vor dem Protonenpumpenblocker eingenommen werden.
Überwachung bzw. Anpassung nötig
Rosuvastatin - VelpatasvirRosuvastatin ist ein Substrat der Effluxtransporter OATP1B1 und BCRP, welche durch Velpatasvir gehemmt werden. Velpatasvir (100 mg täglich) erhöhte die Cmax einer Einzeldosis von Rosuvastatin 10 mg um das 2,6-Fache und die AUC um das 2,7-Fache.
Erhöhtes Risiko von Myopathie und Rhabdomyolyse
Bei gleichzeitiger Behandlung mit Rosuvastatin und Velpatasvir ist das Risiko seltener, schwerer UAW der Statine wie Myopathie und Rhabdomyolyse mit Nierenversagen erhöht. Symptome sind Muskelschwäche und Myalgien, dunkel gefärbter Urin sowie massiv erhöhte Creatinkinase-Werte (10- bis 100-fach und mehr). Diese UAW können sich einige Tage nach Beginn der gleichzeitigen Behandlung, aber auch im späteren Therapieverlauf manifestieren.
Im Allgemeinen wird eine gleichzeitige Behandlung mit Rosuvastatin und Velpatasvir nicht empfohlen, andernfalls soll die Dosis von Rosuvastatin vorsichtig titriert werden und 10 mg/Tag nicht überschreiten. Zusätzlich sollte auf das Auftreten von unerwünschten Wirkungen von Rosuvastatin geachtet werden.
Überwachung bzw. Anpassung nötig
Velpatasvir - H2-BlockerDie Erhöhung des Magen-pH-Wertes kann die Löslichkeit und damit die Absorption von Velpatasvir vermindern. Eine Einzeldosis von 40 mg Famotidin senkte bei gleichzeitiger Gabe mit Sofosbuvir/Velpatasvir (400 mg/100 mg) die Bioverfügbarkeit von Velpatasvir im Schnitt um ca. 20 %.
Verminderte antivirale Wirksamkeit von Velpatasvir möglich
Die gleichzeitige Behandlung mit H2-Blockern beeinträchtigt möglicherweise die antivirale Wirksamkeit von Velpatasvir.
Die gleichzeitige Behandlung mit Velpatasvir und H2-Blockern ist möglich, und zwar in einer Dosierung, die Famotidin 40 mg zweimal täglich entspricht (Cimetidin 800 mg zweimal täglich, Ranitidin 150 mg zweimal täglich). Höhere Dosen der H2-Blocker werden vor allem beim Zollinger-Ellison-Syndrom eingesetzt.
In bestimmten Fällen Überwachung bzw. Anpassung nötig
Digoxin und -Derivate - P-Glycoprotein-InhibitorenDigoxin ist ein Substrat von P-Glycoprotein; P-Glycoprotein-Inhibitoren können daher die Elimination von Digoxin hemmen. Ranolazin erhöhte die Digoxin-Plasmakonzentrationen durchschnittlich um das 1,5-Fache. Ticagrelor erhöhte die Bioverfügbarkeit von Digoxin im Schnitt um 28%; die mittlere Talkonzentration stieg um ca. 30%, in Einzelfällen auf das Doppelte. Daclatasvir, 60 mg/Tag, erhöhte die Bioverfügbarkeit von Digoxin, 0,125 mg, auf etwa das 1,27-Fache. Canagliflozin, 300 mg einmal täglich für 7 Tage, erhöhte die Bioverfügbarkeit von Digoxin, 0,5-mg-Einzeldosis gefolgt von 0,25 mg täglich für 6 Tage, im Schnitt um 20%. Lapatinib erhöhte die AUC von peroralem Digoxin um ungefähr 80%. Venetoclax, 100-mg-Einzeldosis, erhöhte die Digoxin-Plasmakonzentration durchschnittlich um 35% und die AUC von Digoxin, 0,5 mg, im Schnitt um 9%. Telmisartan erhöhte die maximale bzw. minimale Digoxin-Plasmakonzentration um ca. 49% bzw. ca. 20%. Bei einigen Stoffen kann es auch zu additiven kardialen Effekten kommen (z.B. Bradykardie bei Vandetanib). Vemurafenib erhöhte die Bioverfügbarkeit von Digoxin um ca. 80%.
Verstärkte Digoxin-Wirkungen möglich
Bei gleichzeitiger Behandlung mit einem P-Glycoprotein-Inhibitor sind verstärkte Digoxin-Wirkungen (Übelkeit, Erbrechen, Schwindel, Müdigkeit, Farbensehen (gelb), Gesichtsfeldausfälle, Herzrhythmusstörungen) nicht auszuschliessen.
Bei gleichzeitiger Behandlung mit P-Glykoprotein-Inhibitoren sollen die Patienten klinisch sorgfältig überwacht und die Digoxin-Plasmakonzentrationen kontrolliert werden. Eine Verringerung der Digoxin-Dosis kann erforderlich sein.
Vorsichtshalber überwachen
Dabigatran - P-Glycoprotein-InhibitorenDabigatran ist Substrat des Effluxtransporters P-Glycoprotein. Dieser vermittelt den Transport von Dabigatran in das Darmlumen und in die renalen Tubuli. Wird P-Glycoprotein gehemmt, ist die Clearance von Dabigatran vermindert. Daher werden bei gleichzeitiger Behandlung mit P-Glycoprotein-Inhibitoren verstärkte Wirkungen von Dabigatran erwartet.
Verstärkte blutgerinnungshemmende Wirkung von Dabigatran möglich
Bei gleichzeitiger Behandlung mit P-Glycoprotein-Inhibitoren (Alectinib, Boceprevir, Cabozantinib, Cariprazin, Crizotinib, Daclatasvir, Elbasvir, Enzalutamid, Fidaxomicin, Idebenon, Isavuconazol, Ivacaftor, Lapatinib, Mirabegron, Netupitant, Olaparib, Osimertinib, Ponatinib, Rolapitant, Ruxolitinib, Tolvaptan, Velpatasvir, Vemurafenib, Ginkgo) werden verstärkte Wirkungen von Dabigatran befürchtet, vor allem eine erhöhte Inzidenz von Blutungen.
Bei gleichzeitiger Behandlung mit Dabigatran und P-Glycoprotein-Inhibitoren werden eine engmaschige Überwachung auf Blutungs- bzw. Anämiezeichen sowie ggf. Dosisanpassungen empfohlen.
Vorsichtshalber überwachen
Pravastatin - VelpatasvirPravastatin ist ein Substrat der Effluxtransporter OATP1B1 und OATP1B3, welche durch Velpatasvir gehemmt werden. Velpatasvir (100 mg/Tag) erhöhte die Cmax von Pravastatin um das 1,3-Fache und die AUC um das 1,4-Fache.
Erhöhtes Risiko von Myopathie und Rhabdomyolyse
Bei gleichzeitiger Behandlung mit Pravastatin und Velpatasvir ist das Risiko seltener, schwerer UAW der Statine wie Myopathie und Rhabdomyolyse mit Nierenversagen erhöht. Symptome sind Muskelschwäche und Myalgien, dunkel gefärbter Urin sowie massiv erhöhte Creatinkinase-Werte (10- bis 100-fach und mehr). Diese UAW können sich einige Tage nach Beginn der gleichzeitigen Behandlung, aber auch im späteren Therapieverlauf manifestieren.
Eine Dosisanpassung von Velpatasvir oder Pravastatin ist nicht erforderlich, es sollte jedoch auf das Auftreten von unerwünschten Wirkungen von Pravastatin geachtet werden.
Vorsichtshalber überwachen
Voxilaprevir 100 mg
Dabigatran ist Substrat für den Effluxtransporter P-Glycoprotein. Das P-Glycoprotein vermittelt den Transport von Dabigatran in das Darmlumen und in die renalen Tubuli. Wird das P-Glycoprotein gehemmt, ist die Clearance von Dabigatran vermindert. Eine Einzeldosis von Dronedaron erhöhte die Dabigatran-Exposition um das 2,1-fache (+114%) und mehrere Dosen um das 2,4-fache (+136%).
Verstärkte Wirkungen von Dabigatran - Blutungsgefahr
Bei gleichzeitiger Behandlung mit P-Glycoprotein-Inhibitoren werden verstärkte Wirkungen von Dabigatran befürchtet, vor allem eine erhöhte Inzidenz von Blutungen.
Die gleichzeitige Behandlung mit Dabigatran und den genannten P-Glycoprotein-Inhibitoren ist kontraindiziert.
Schwerwiegende Folgen wahrscheinlich - kontraindiziert
Rosuvastatin - VoxilaprevirRosuvastatin ist ein Substrat der Effluxtransporter BCRP und OATP, die durch Voxilaprevir gehemmt werden. Die Kombination Sofosbuvir/Velpatasvir/Voxilaprevir, 400/100/200 mg, erhöhte die AUC von Rosuvastatin im Schnitt auf das 7,4-Fache.
Erhöhtes Risiko von Myopathie und Rhabdomyolyse
Bei gleichzeitiger Behandlung mit Rosuvastatin und Voxilaprevir ist das Risiko seltener, schwerer UAW der Statine wie Myopathie und Rhabdomyolyse mit Nierenversagen erhöht. Symptome sind Muskelschwäche und Myalgien, dunkel gefärbter Urin sowie massiv erhöhte Creatinkinase-Werte (10- bis 100-fach und mehr). Diese UAW können sich einige Tage nach Beginn der gleichzeitigen Behandlung, aber auch im späteren Therapieverlauf manifestieren.
Die gleichzeitige Behandlung mit Rosuvastatin und Voxilaprevir ist kontraindiziert. Wird während der Behandlung mit Voxilaprevir ein Statin benötigt, kann Pravastatin verwendet werden; zu Beginn beträgt die Dosis 10 mg/Tag und kann bei Bedarf auf maxmal 20 mg/Tag erhöht werden.
Schwerwiegende Folgen wahrscheinlich - kontraindiziert
Sofosbuvir/Velpatasvir/Voxilaprevir - Ethinylestradiol (hormonale Kontrazeptiva)Additive hepatotoxische Wirkungen werden vermutet: Erhöhte ALT-Werte wurden bei gleichzeitiger Behandlung mit Sofosbuvir/Velpatasvir/Voxilaprevir und Ethinylestradiol beobachtet.
Erhöhtes Risiko von Leberschäden
Bei gleichzeitiger Behandlung mit Sofosbuvir/Velpatasvir/Voxilaprevir und Ethinylestradiol wurden vermehrt Anstiege der Alanin-Aminotransferase (ALT) als Zeichen einer Leberschädigung beobachtet.
Nach Angaben der Hersteller ist die gleichzeitige Behandlung mit Sofosbuvir/Velpatasvir/Voxilaprevir und Ethinylestradiol kontraindiziert. Als Alternative kommen nur Gestagen enthaltende Minipillen oder nicht-hormonale Methoden in Frage.
Schwerwiegende Folgen wahrscheinlich - kontraindiziert
Voxilaprevir - Atazanavir, LopinavirAtazanavir hemmt mit CYP3A4, P-Glycoprotein und OATP1B1 mehrere Enzyme bzw. Transportproteine, die am Metabolismus bzw. Transport von Voxilaprevir beteiligt sind. Atazanavir/Ritonavir 300 mg/100 mg erhöhte die AUC von Voxilaprevir aus Sofosbuvir/Velpatasvir/Voxilaprevir im Schnitt auf mehr als das 4-Fache. Lopinavir hemmt OATP1B1; auch hier wird daher eine Erhöhung der AUC von Voxilaprevir erwartet.
Verstärkte Wirkungen von Voxilaprevir möglich
Die gleichzeitige Behandlung mit Atazanavir bzw. Lopinavir kann die Wirkungen von Voxilaprevir verstärken. Die bekannten unerwünschten Wirkungen von Voxilaprevir (Diarrhoe, Übelkeit, Kopfschmerzen) können vermehrt bzw. verstärkt auftreten; das Sicherheitsprofil von Voxilaprevir ist aber noch weitgehend unbekannt.
Die gleichzeitige Behandlung mit Voxilaprevir und Atazanavir-haltigen bzw. Lopinavir-haltigen Therapieregimen wird nicht empfohlen.
Nicht empfohlen (vorsichtshalber kontraindiziert)
Voxilaprevir - CiclosporinDer starke OATP1B-Hemmer Ciclosporin kann die Plasmakonzentration des OATP1B1-Substrats Voxilaprevir wesentlich erhöhen. Eine 600-mg-Einzeldosis von Ciclosporin erhöhte die AUC einer 100-mg-Einzeldosis Voxilaprevir im Schnitt auf das 9,4-Fache. OATP1B1 ist ein Influx-Transporter, der vorwiegend in der Leber exprimiert ist. Eine Hemmung von OATP1B1 bedeutet daher eine gehemmte Elimination von OATP1B1-Substraten.
Verstärkte Wirkungen von Voxilaprevir möglich
Die gleichzeitige Behandlung mit Ciclosporin kann die Wirkungen von Voxilaprevir verstärken. Die bekannten unerwünschten Wirkungen von Voxilaprevir (Diarrhoe, Übelkeit, Kopfschmerzen) können vermehrt bzw. verstärkt auftreten; das Sicherheitsprofil von Voxilaprevir ist aber noch weitgehend unbekannt.
Die gleichzeitige Behandlung mit Voxilaprevir und Ciclosporin wird nicht empfohlen.
Nicht empfohlen (vorsichtshalber kontraindiziert)
Pravastatin - VoxilaprevirPravastatin ist ein Substrat der Effluxtransporter OATP1B1 und OATP1B3, welche durch Voxilaprevir und Velpatasvir gehemmt werden. Daher wird eine Erhöhung der Plasmakonzentration von Pravastatin erwartet.
Erhöhtes Risiko von Myopathie und Rhabdomyolyse
Bei gleichzeitiger Behandlung mit Pravastatin und Sofosbuvir/Velpatasvir/Voxilaprevir ist das Risiko seltener, schwerer UAW der Statine wie Myopathie und Rhabdomyolyse mit Nierenversagen erhöht. Symptome sind Muskelschwäche und Myalgien, dunkel gefärbter Urin sowie massiv erhöhte Creatinkinase-Werte (10- bis 100-fach und mehr). Diese UAW können sich einige Tage nach Beginn der gleichzeitigen Behandlung, aber auch im späteren Therapieverlauf manifestieren.
Die gleichzeitige Behandlung mit Pravastatin und Sofosbuvir/Velpatasvir/Voxilaprevir soll mit einer Dosis von 10 mg Pravastatin begonnen werden. Die Dosis von maximal 20 mg Pravastatin pro Tag soll nicht überschritten werden.
Überwachung bzw. Anpassung nötig
Hepatitis-C-Virustatika - Estradiol (hormonale Kontrazeptiva)In klinischen Studien mit Ombitasvir/Paritaprevir/Ritonavir mit oder ohne Dasabuvir stiegen die ALT-Werte signifikant häufiger auf mehr als das 5-Fache der oberen Norm, wenn die Patientinnen Ethinylestradiol-haltige Kontrazeptiva anwandten. Bei Frauen, die andere Estrogene als Ethinylestradiol anwandten, wie Estradiol, war die Rate erhöhter ALT-Werte ähnlich wie bei jenen, die keine Estrogene erhielten.
Vermehrt Leberschäden nicht auszuschliessen
Bei gleichzeitiger Behandlung mit Estradiol (hormonale Kontrazeptiva) und Dasabuvir/Ombitasvir/Paritaprevir, Glecaprevir/Pibrentasvir bzw. Sofosbuvir/Velpatasvir/Voxilaprevir sind vermehrt Anstiege der Alanin-Aminotransferase (ALT) nicht auszuschliessen.
Auf Grund der begrenzten Anzahl an Frauen, die andere Estrogene als Ethinylestradiol anwandten, ist Vorsicht bei der gleichzeitigen Therapie mit Ombitasvir/Paritaprevir/Ritonavir mit oder ohne Dasabuvir, Glecaprevir/Pibrentasvir bzw. Sofosbuvir/Velpatasvir/Voxilaprevir und der Anwendung Estradiol-haltiger Kontrazeptiva geboten. Ethinylestradiol-haltige Kontrazeptiva sind kontraindiziert; die Hersteller der Virustatika empfehlen nur Gestagen-enthaltende Minipillen oder nicht-hormonale Methoden.
Vorsichtshalber überwachen
Наведіть телефон на qr-код

Поділитися в соціальних мережах
Відгуки (0)
Написати відгук
Пов'язані новини
 11-04-2019
11-04-2019
Совальді – універсальний препарат для лікування гепатиту С
Ефективність препаратів на лікування гепатиту З донедавна становила близько 30%, тобто з допомогою в
Читати більше
Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.
Хіт продажів
HerpoTherm ручка від герпесу
Код продукту: 7798882Herpotherm® - нагрівальна ручка Герпез не тільки непривабливий, але й може бути дуже болючим. Супут..
8642.02 RUB
Burgerstein Coenzyme Q10 капсули 180 шт
Код продукту: 2474044Burgerstein Coenzyme Q10 капсули 180 шт Burgerstein Coenzyme Q10 capsules 180 шт - це дієтична добав..
17411.19 RUB
Extra Cell Matrix C-II TABS для суглобів 120 шт
Код продукту: 5677150Extra Cell Matrix C-II TABS для суглобів 120 шт Extra Cell Matrix C-II TABS for Joints – це високоеф..
13788.79 RUB
Vita Omexanthin капсули 60 шт
Код продукту: 6161945Vita Omexanthin капсули - 60 шт Капсули Vita Omexanthin - це дієтична добавка з комбінацією омега-3 ..
16899.33 RUB
Альгіфор-Л форте таблетки плівка 400 мг 10 шт
Код продукту: 3398902..
3698.27 RUB
Зубна щітка Trisa Flexible Head жорстка
Код продукту: 2841175Зубна щітка Trisa Flexible Head жорстка Жорстка зубна щітка Trisa Flexible Head ідеально підходить д..
1041.23 RUB
Пастилки Phytopharma Islandica без цукру 40 шт
Код продукту: 2561234Пастилки Phytopharma Islandica без цукру 40 шт Опис товару: Пастилки Phytopharma Islandica без цукру..
1903.09 RUB