Галвумет плівка таблетки 50/1000 мг 60 шт
Galvumet 50/1000 mg 60 filmtablets
-
12466.53 RUB
Дата доставки:
27.12.2025 - 10.01.2026
При оплате криптовалютой:
Ваша прибыль 1246.65 RUB / 14.05 USDT
- Наявність: В наявності
- Виробник: NOVARTIS SCHWEIZ AG
- Модель: 4413816
- ATC-код A10BD08
- EAN 7680584510060
Опис
Was ist Galvumet und wann wird es angewendet?
Auf Verschreibung des Arztes oder der Ärztin.
Galvumet ist ein Arzneimittel zum Einnehmen zur Behandlung des Typ 2-Diabetes (Diabetes mellitus: Zuckerkrankheit). Galvumet enthält die Wirkstoffe Vildagliptin und Metformin. Es wird Patienten zusammen mit einer Diät und körperlicher Betätigung verordnet, wenn diese bereits eine Behandlung mit Vildagliptin und Metformin erhalten haben oder aber der Diabetes mit einer alleinigen Gabe von Metformin oder Vildagliptin nicht zufriedenstellend behandelbar ist.
Ihr Arzt bzw. Ihre Ärztin kann Ihnen entweder eine Behandlung mit Galvumet allein oder zusammen mit einem anderen oralen Antidiabetikum verschreiben, um Ihren Blutzuckerspiegel zu kontrollieren.
Galvumet wird auch als Zusatztherapie zu Insulin zusammen mit einer Diät und körperlicher Betätigung zur Verbesserung der Blutzuckerkontrolle bei Patienten verordnet, bei denen mit einer stabilen Dosis Insulin und Metformin allein keine zufriedenstellende Blutzuckerkontrolle erreicht wird.
Galvumet hilft dabei, den Zuckerspiegel im Blut zu kontrollieren. Derartige Arzneimittel sind als orale Antidiabetika bekannt.
Bei Typ 2-Diabetes produziert Ihr Körper zu wenig Insulin und/oder zu viel Glukagon. Ausserdem kann die Wirkung Ihres körpereigenen Insulins beeinträchtigt sein. Insulin (produziert durch die Bauchspeicheldrüse) hilft, den Blutzuckerspiegel - vor allem nach Mahlzeiten - zu senken. Glukagon, das auch durch die Bauchspeicheldrüse produziert wird, regt die Produktion von Zucker an, was zu einem Anstieg des Blutzuckerspiegels führt.
Galvumet bewirkt, dass die Bauchspeicheldrüse mehr Insulin und dafür weniger Glukagon produziert (Wirkung von Vildagliptin) und das Insulin besser nutzt (Wirkung von Metformin). Auf diese Weise hilft Galvumet, den Blutzuckerspiegel zu kontrollieren.
Es ist wichtig, dass Sie während Ihrer Behandlung mit Galvumet die Empfehlungen hinsichtlich Ihrer Diät und/oder körperlichen Betätigung befolgen.
Was sollte dazu beachtet werden?
Die gute Blutzuckereinstellung hängt nicht nur von der medikamentösen Behandlung ab, sondern entscheidend sind auch die Einhaltung der Diät und ausreichende körperliche Aktivität. Befolgen Sie deshalb die diesbezüglichen Anweisungen Ihres Arztes bzw. Ihrer Ärztin oder der Diabetesberatung.
Wann darf Galvumet nicht angewendet werden?
Galvumet darf nicht eingenommen werden:
- Wenn Sie auf einen der Inhaltsstoffe allergisch reagieren.
- Wenn Sie unter einer starken Beeinträchtigung der Nierenfunktion leiden.
- Wenn Sie kürzlich einen Herzinfarkt erlitten haben, an einer Herzinsuffizienz oder an schwerwiegenden Kreislaufstörungen, einschliesslich eines Schocks, leiden oder Schwierigkeiten bei der Atmung haben.
- Wenn Sie unter schwerwiegenden Komplikationen Ihres Diabetes leiden oder gelitten haben. Hierzu gehören z.B. eine diabetische Ketoazidose (eine Komplikation des Diabetes mit raschem Gewichtsverlust, Übelkeit und Erbrechen) oder ein diabetisches Koma.
- Wenn bei Ihnen eine Röntgenuntersuchung mit Kontrastmitteln durchgeführt werden soll (eine besondere Röntgenuntersuchung, bei der ein Farbstoff injiziert wird). In diesem Fall müssen Sie die Behandlung mit Galvumet unterbrechen und zwar vor oder am Tag der Untersuchung sowie für einige Tage danach.
Wann ist bei der Einnahme von Galvumet Vorsicht geboten?
Falls bei Ihnen Schwindel auftritt, sollten Sie kein Fahrzeug führen oder Maschinen bedienen.
Wenn Sie an einer Leberstörung oder an Diabetes Typ 1 leiden, sollten Sie Galvumet nicht einnehmen. Galvumet ist kein Ersatz für Insulin.
Sofern eines oder mehrere der folgenden Symptome auftritt/auftreten: Kältegefühl und Unwohlsein, Muskelschmerzen, Benommenheit, schwere Übelkeit oder schweres Erbrechen, Bauchschmerzen, Schwindel, Herzrhythmusstörungen oder schnelle Atmung. Dies können Anzeichen einer Laktazidose sein, einer schweren Stoffwechselentgleisung. In diesem Fall müssen Sie sofort Ihren Arzt bzw. Ihre Ärztin kontaktieren. Die Wahrscheinlichkeit des Auftretens einer Laktazidose ist bei Patienten mit einer gestörten Nierenfunktion erhöht.
Wenn bei Ihnen Übelkeit, Schwitzen, Schwächegefühl, Schwindel, Zittern oder Kopfschmerzen (Zeichen eines niedrigen Zucker-Spiegels im Blut) auftritt. Dies kann durch einen Mangel an Nahrung, eine zu anstrengende körperliche Belastung ohne entsprechende Nahrungsaufnahme oder einen übermässigen Alkoholkonsum verursacht werden.
Sofern bei Ihnen einige dieser Symptome auftreten, unterbrechen Sie die Einnahme von Galvumet und konsultieren Sie unverzüglich einen Arzt bzw. eine Ärztin.
Wenn Sie Galvumet in Kombination mit einem anderen oralen Antidiabetikum oder Insulin einnehmen, kann das Risiko eines zu niedrigen Blutzuckerspiegels (Hypoglykämie) erhöht sein. Ihr Arzt oder Ihre Ärztin wird ggf. deren Dosierung erdniedrigen.
Während der Einnahme von Galvumet wurden Fälle von Bauchspeicheldrüsenentzündungen (Pankreatitis) berichtet. Eine Pankreatitis ist eine schwerwiegende, potentiell lebensbedrohende Krankheit. Beenden Sie die Einnahme von Galvumet und suchen Sie Ihren Arzt bzw. Ihre Ärztin auf, falls Sie starke und anhaltende Bauchschmerzen mit oder ohne Erbrechen bekommen, da Sie an Pankreatitis leiden könnten.
Sofern bei Ihnen ein operativer Eingriff unter Vollnarkose durchgeführt werden soll, muss die Behandlung mit Galvumet einige Tage vor und nach dem Eingriff unterbrochen werden. Ihr Arzt bzw. Ihre Ärztin wird entscheiden, wann Sie die Behandlung mit Galvumet unterbrechen und wann wieder aufnehmen sollen.
Galvumet sollte nur dann bei älteren Patienten angewendet werden, wenn keinerlei Einschränkungen der Nierenfunktion vorliegen. Wenn Sie älter sind, wird daher Ihr Arzt bzw. Ihre Ärztin mehrmals jährlich Ihre Nierenfunktion überprüfen.
Es liegen keine Informationen zur Anwendung von Galvumet bei Kindern und Jugendlichen (jünger als 18 Jahre) vor. Daher wird die Anwendung von Galvumet bei diesen Patienten nicht empfohlen.
Wenn Sie entweder täglich oder von Zeit zu Zeit übermässig Alkohol konsumieren.
Trinken Sie nicht übermässig Alkohol oder nehmen Sie keine Medikamente ein, welche Alkohol enthalten während Sie Galvumet einnehmen.
Nehmen Sie bitte Kontakt mit Ihrem Arzt bzw. Ihrer Ärztin auf, sofern sich Ihre Blutzuckerwerte plötzlich verschlechtern, Ihre Blutzuckertests ungewöhnlich ausfallen oder Sie sich krank fühlen.
Konsultieren Sie lhren Arzt bzw. lhre Ärztin sofort, wenn Sie unerklärliche Muskelschmerzen, -empfindlichkeit oder -schwäche verspüren. In seltenen Fällen können Muskelprobleme schwerwiegend sein, einschliesslich Muskelabbau, der Nierenschäden zur Folge haben kann. Das Risiko kann bei höheren Dosierungen von Galvumet und bei Patienten mit abnormaler Nierenfunktion höher sein.
Informieren Sie ebenfalls Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie:
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbstgekaufte!) einnehmen.
Darf Galvumet während einer Schwangerschaft oder in der Stillzeit eingenommen werden?
Schwangerschaft
Informieren Sie Ihren Arzt bzw. Ihre Ärztin, wenn Sie schwanger sind oder wenn Sie während der Behandlung schwanger werden sollten.
Während der Schwangerschaft dürfen Sie Galvumet nur mit ausdrücklicher Genehmigung Ihres Arztes bzw. Ihrer Ärztin einnehmen.
Stillzeit
Es ist nicht bekannt, ob die Wirkstoffe von Galvumet, Vildagliptin und Metforminhydrochlorid, in die Milch übergehen. Falls Sie stillen, dürfen Sie Galvumet nicht einnehmen.
Sprechen Sie mit Ihrem Arzt bzw. Ihrer Ärztin.
Wie verwenden Sie Galvumet?
Ihr Arzt bzw. Ihre Ärztin wird Ihnen sagen, zu welchen Tageszeiten Sie wie viele Filmtabletten Galvumet einnehmen müssen.
In der Regel ist es zweimal täglich 1 Filmtablette.
Die maximale Tagesdosis von 1 Filmtablette zweimal täglich darf nicht überschritten werden.
Die von Ihrem Arzt bzw. Ihrer Ärztin verschriebene Dosis darf nicht überschritten werden.
Abhängig von Ihrem Zustand wird Ihr Arzt bzw. Ihre Ärztin Galvumet entweder alleine oder in Kombination mit anderen Arzneimitteln zur Behandlung von Diabetes verordnen.
Wann und wie sollen Sie Galvumet einnehmen?
Wenn Sie Galvumet entweder mit oder unmittelbar nach einer Mahlzeit einnehmen, wird die Möglichkeit einer Magenverstimmung reduziert.
Galvumet sollte unzerkaut und zusammen mit einem Glas Wasser geschluckt werden.
Wie lange müssen Sie Galvumet einnehmen?
Nehmen Sie solange Galvumet ein, wie Ihnen Ihr Arzt bzw. Ihre Ärztin verschreibt. Regelmässige Kontrolluntersuchungen beim Arzt bzw. bei der Ärztin sind wichtig, um sicherzustellen, dass die Behandlung die gewünschte Wirkung zeigt.
Beenden Sie die Einnahme von Galvumet nicht, ausser Ihr Arzt bzw. Ihre Ärztin sagt Ihnen dies ausdrücklich.
Was sollen Sie tun, wenn Sie die Galvumet Einnahme vergessen haben?
Es ist ratsam, Ihr Medikament jeden Tag zur gleichen Zeit einzunehmen. Wenn Sie aber dennoch die Einnahme von Galvumet vergessen haben sollten, holen Sie dies nach, sobald Sie sich daran erinnern. Nehmen Sie dann die nächste Dosis wieder zur gewohnten Zeit ein. Sofern allerdings schon die Zeit für die nächste Dosis fast erreicht ist, lassen Sie die vergessene Dosierung aus. Nehmen Sie keine doppelte Dosis Galvumet ein, um die vergessene Tablette auszugleichen.
Wenn Sie mehr Galvumet als erforderlich eingenommen haben?
Wenn Sie versehentlich zu viele Tabletten eingenommen haben oder, wenn eine andere Person Ihr Medikament eingenommen haben sollte, benachrichtigen Sie unverzüglich Ihren Arzt bzw. Ihre Ärztin. Möglicherweise benötigen Sie eine medizinische Betreuung. Bitte zeigen Sie Ihrem Arzt bzw. Ihrer Ärztin die Packung, wenn dies möglich ist.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker, bzw. mit Ihrer Ärztin oder Apothekerin.
Welche Nebenwirkungen kann Galvumet haben?
Folgende Nebenwirkungen können bei der Einnahme von Galvumet auftreten:
Sehr häufig (betrifft mehr als einen von 10 Anwendern): Übelkeit, Erbrechen, Durchfall, Bauchschmerzen, Appetitverlust.
Häufig (betrifft 1 bis 10 von 100 Anwendern): Schwindel, Zittern, metallischer Geschmack, Schüttelfrost, Sodbrennen, Kopfschmerzen, starkes Schwitzen, zu tiefer Blutzucker (Hypoglykämie).
Gelegentlich (betrifft 1 bis 10 von 1000 Anwendern): Müdigkeit, Schwellungen an den Händen und Füssen (periphere Ödeme), Gelenkschmerzen, Verstopfung, Schwächegefühl, Gewichtszunahme, Durchfall, Blähungen.
Sehr selten (betrifft weniger als 1 von 10'000 Anwendern): Infektionen der oberen Atemwege, Entzündung des Nasen Rachen Raumes (Nasopharyngitis), Abnahme der Vitamin B12 Aufnahme, Laktazidose, Entzündung der Leber, Hautreaktionen wie Hautrötung, Juckreiz, Nesselsucht (Quaddeln).
Selten kann es unter Behandlung mit Galvumet, speziell in Kombination mit einem ACE-Hemmer (blutdrucksenkendes Medikament), zu Atem- und Schluckbeschwerden, Schwellung im Gesicht, der Arme und Beine, Augen, Lippen oder Zunge kommen. Bei diesen Anzeichen sollten Sie die Behandlung sofort abbrechen und Ihren Arzt oder Ihre Ärztin informieren.
Wenn Sie eine Gelbsucht oder andere Zeichen einer Leberfunktionsstörung (gelbe Augen und Haut, Übelkeit, Appetitlosigkeit oder dunkel gefärbter Urin) bemerken, sollten Sie die Behandlung sofort abbrechen und Ihren Arzt bzw. Ihre Ärztin kontaktieren.
Wenn Sie die Symptome einer Laktazidose wie Gefühl von Kälte und Unwohlsein, Muskelschmerzen, Benommenheit, schwere Übelkeit oder schweres Erbrechen, Durchfall, Bauchschmerzen, unerklärter Gewichtsverlust, Schwindel, Herzrhythmusstörungen oder schnelle Atmung bemerken, müssen Sie die Behandlung sofort abbrechen und Ihren Arzt bzw. Ihre Ärztin kontaktieren. Eine Laktazidose kann zu einem Koma führen.
Wenn Sie starke und anhaltende Bauchschmerzen mit oder ohne Erbrechen bemerken (möglicher Hinweis auf eine entzündete Bauchspeicheldrüse), sollten Sie die Behandlung sofort abbrechen und Ihren Arzt bzw. Ihre Ärztin kontaktieren.
Kontaktieren Sie unverzüglich lhren Arzt bzw. lhre Ärztin, wenn Sie Muskelschmerzen, Muskelempfindlichkeit oder -schwäche verspüren. Dies, weil in seltenen Fällen die Muskelprobleme schwerwiegend sein können einschliesslich mit Muskelversagen, das zu einem Nierenschaden und im Weiteren zum Tod führen kann. Dieses Risiko für Muskelversagen ist evtl. grösser bei älteren Patienten und Patientinnen (65 Jahre und älter), das weibliche Geschlecht, bei Patienten und Patientinnen, die an einer Nierenfunktionsstörung leiden, bei Patienten und Patientinnen mit Schilddrüsenproblemen und bei Patienten und Patientinnen, die höhere Dosen von Galvumet einnehmen.
Nach der Markteinführung wurde über die folgenden zusätzlichen unerwünschten Arzneimittelreaktionen berichtet (Häufigkeit unbekannt): Hautabschilferung oder Hautbläschen, Hautblasen, Bauchspeichelentzündung.
Teilen Sie Ihrem Arzt bzw. Ihrer Ärztin mit, wenn Sie eine dieser Nebenwirkungen stark beeinträchtigt.
Wenn Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind, sollten Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin informieren.
Was ist ferner zu beachten?
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Lagerungshinweis
Arzneimittel müssen für Kinder unerreichbar aufbewahrt werden.
Das Arzneimittel soll nicht über 30°C und vor Feuchtigkeit geschützt in der Originalpackung aufbewahrt werden.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Galvumet enthalten?
Jede Galvumet Filmtablette enthält Vildagliptin und Metforminhydrochlorid als Wirkstoffe und Hilfsstoffe.
Es sind drei Dosierungsstärken erhältlich:
- Filmtabletten zu 50 mg Vildagliptin und 500 mg Metforminhydrochlorid.
- Filmtabletten zu 50 mg Vildagliptin und 850 mg Metforminhydrochlorid.
- Filmtabletten zu 50 mg Vildagliptin und 1'000 mg Metforminhydrochlorid.
Wirkstoffe
Vildagliptin und Metforminhydrochlorid
Hilfsstoffe
Filmtabletten zu 50/500mg: Hydroxypropylcellulose, Magnesiumstearat , Hypromellose, Titandioxid (E 171), Eisenoxid gelb (E 172), Eisenoxid rot (E 172), Macrogol 4000, Talk
Filmtabletten zu 50/850mg: Hydroxypropylcellulose, Magnesiumstearat , Hypromellose, Titandioxid (E 171), Eisenoxid gelb (E 172), Macrogol 4000, Talk
Filmtabletten zu 50/1000mg: Hydroxypropylcellulose, Magnesiumstearat, Hypromellose, Titandioxid (E 171), Eisenoxid gelb (E 172), Macrogol 4000, Talk
Zulassungsnummer
58451 (Swissmedic)
Wo erhalten Sie Galvumet? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
- Filmtabletten zu 50/500 mg: zu 60 und 180 Filmtabletten.
- Filmtabletten zu 50/850 mg: zu 60 und 180 Filmtabletten.
- Filmtabletten zu 50/1000 mg: zu 60 und 180 Filmtabletten.
Zulassungsinhaberin
Novartis Pharma Schweiz AG, Risch; Domizil: 6343 Rotkreuz
Diese Packungsbeilage wurde im September 2020 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Qu’est-ce que Galvumet et quand doit-il être utilisé?
Selon prescription du médecin.
Galvumet est un médicament utilisé dans le traitement du diabète de type 2 (diabète sucré). Galvumet contient les principes actifs vildagliptine et metformine. Il est prescrit en complément à un régime et à l'activité physique chez des patients ayant déjà reçu un traitement par la vildagliptine et la metformine ou en cas de contrôle insuffisant du diabète sous metformine seule ou vildagliptine seule.
Votre médecin peut vous prescrire un traitement par Galvumet soit seul soit en association avec un autre antidiabétique oral dans le but de contrôler votre glycémie.
Galvumet est aussi prescrit en traitement adjuvant à l'insuline, en complément à un régime et à l'activité physique, pour améliorer le contrôle de la glycémie chez les patients chez lesquels une dose stable d'insuline et de metformine ne permet pas d'obtenir un contrôle satisfaisant de la glycémie.
Galvumet aide à contrôler la glycémie (taux de sucre dans le sang). Il fait partie d'un groupe de médicaments appelés antidiabétiques oraux.
Dans le diabète de type 2, votre corps ne produit pas assez d'insuline et/ou trop de glucagon. De plus, l'effet de l'insuline produite par votre organisme peut être altéré. L'insuline est une substance (sécrétée par le pancréas) qui aide à abaisser le taux de sucre dans le sang, en particulier après les repas. Le glucagon est une autre substance également produite par le pancréas. Il stimule la production de sucre, ce qui a pour effet d'augmenter la glycémie.
Galvumet induit au niveau du pancréas une augmentation de la sécrétion d'insuline et une diminution de la libération du glucagon (effet de la vildagliptine), ainsi qu'une meilleure utilisation de l'insuline (effet de la metformine). Galvumet contribue donc au contrôle de la glycémie.
Il est très important que vous vous conformiez scrupuleusement, tout au long de votre traitement par Galvumet, aux recommandations concernant votre régime alimentaire et/ou votre activité physique.
De quoi faut-il tenir compte en dehors du traitement?
Un bon contrôle de la glycémie ne dépend pas uniquement du traitement médicamenteux, mais aussi et surtout du suivi scrupuleux d'un régime alimentaire approprié et de l'accomplissement d'une activité physique régulière. Conformez-vous à ce propos aux recommandations de votre médecin ou de votre spécialiste du diabète.
Quand Galvumet ne doit-il pas être utilisé?
Galvumet ne doit pas être utilisé dans les situations suivantes:
- Si vous présentez des réactions allergiques à l'un des composants du médicament.
- Si vous souffrez d'une altération sévère de la fonction rénale.
- Si vous avez subi récemment un infarctus du myocarde, si vous souffrez d'une insuffisance cardiaque ou de troubles circulatoires graves, y compris un choc, ou si vous avez des difficultés à respirer.
- Si vous souffrez ou avez souffert par le passé de complications graves de votre diabète. Celles-ci incluent une acidocétose diabétique (une complication du diabète caractérisée notamment par une perte de poids rapide, des nausées et des vomissements) ou un coma diabétique.
- Si vous devez vous soumettre à un examen radiologique avec injection de produit de contraste (un examen radiologique particulier au cours duquel on injecte un colorant). Vous devez dans ce cas interrompre votre traitement par Galvumet et ceci avant ou le jour de l'examen et durant les quelques jours qui suivent.
Quelles sont les précautions à observer lors de la prise de Galvumet?
Ne conduisez pas de véhicule et n'utilisez pas de machines en cas de vertiges.
Galvumet ne doit pas être pris si vous souffrez de troubles du foie ou d'un diabète de type 1. Galvumet ne remplace pas l'insuline.
La survenue d'un ou plusieurs symptômes tels que sensation de froid et malaise, douleurs musculaires, somnolence, fortes nausées ou vomissements profus, maux de ventre, vertiges, palpitations (troubles du rythme cardiaque) ou respiration rapide, pourrait indiquer la présence d'une acidose lactique, autrement dit d'un dérèglement grave du métabolisme. Contactez immédiatement votre médecin si vous ressentez de tels symptômes. La probabilité de développer une acidose lactique est plus grande chez les patients atteints d'insuffisance rénale.
Si vous présentez des nausées, des sudations, une sensation de faiblesse, des vertiges, des tremblements ou des maux de tête (signes d'hypoglycémie - taux de sucre trop bas dans le sang), il pourrait s'agir d'un manque de nourriture, d'un effort physique intense sans prise adéquate de nourriture ou d'une consommation excessive d'alcool.
Si vous ressentez certains de ces symptômes, interrompez votre traitement par Galvumet et consultez immédiatement votre médecin.
Si vous prenez Galvumet en association avec un autre antidiabétique oral ou de l'insuline, le risque que vous présentiez un taux de sucre trop bas dans le sang (hypoglycémie) peut être augmenté. Votre médecin diminuera le cas échéant la posologie de ces médicaments.
Pendant la prise de Galvumet des cas d'inflammations du pancréas (pancréatite) ont été rapportés. Une pancréatite est une maladie grave, pouvant mettre la vie en danger. Arrêtez de prendre Galvumet et consultez votre médecin si vous présentez des maux de ventre intenses et persistants, avec ou sans vomissements, car vous pourriez souffrir d'une pancréatite.
Si vous devez vous soumettre à une intervention chirurgicale sous anesthésie générale, le traitement par Galvumet doit être interrompu quelques jours avant et après l'opération. Votre médecin décidera quand vous devrez interrompre votre traitement par Galvumet et quand vous devrez le reprendre.
Galvumet ne devrait être pris par des personnes âgées qu'en l'absence d'insuffisance rénale. Si vous êtes une personne d'un certain âge, votre médecin contrôlera par conséquent votre fonction rénale plusieurs fois par an.
On ne dispose d'aucune information sur l'utilisation de Galvumet chez les enfants et les adolescents (de moins de 18 ans). L'utilisation de Galvumet n'est donc pas conseillée chez ces patients.
Si vous consommez de l'alcool tous les jours ou occasionnellement de manière excessive.
Ne consommez pas d'alcool en excès ou ne prenez pas de médicaments contenant de l'alcool pendant que vous suivez un traitement par Galvumet.
Prenez contact avec votre médecin en cas de péjoration soudaine de vos glycémies, en cas de contrôles de glycémie anormaux ou si vous vous sentez malade.
Veuillez consulter immédiatement votre médecin si vous ressentez des douleurs, des sensibilités ou des faiblesses musculaires inexpliquées. Dans de rares cas, les problèmes musculaires peuvent être graves, notamment une perte musculaire qui peut entraîner des lésions rénales. Le risque peut être accru pour des dosages plus élevés de Galvumet et chez les patients présentant une fonction rénale anormale.
Informez également votre médecin ou votre pharmacien si:
- vous souffrez d'une autre maladie;
- vous êtes allergique;
- vous prenez déjà d'autres médicaments (même en automédication!).
Galvumet peut-il être pris/utilisé pendant la grossesse ou l’allaitement?
Grossesse
Veuillez informer votre médecin si vous êtes enceinte ou si vous tombez enceinte durant le traitement.
Vous ne devez prendre Galvumet durant la grossesse qu'avec l'autorisation explicite de votre médecin.
Allaitement
On ne sait pas si les principes actifs contenus dans Galvumet, c'est-à-dire la vildagliptine et l'hydrochlorure de metformine, passent dans le lait maternel. Vous ne devez pas prendre Galvumet si vous allaitez.
Parlez-en à votre médecin.
Comment utiliser Galvumet?
Votre médecin vous dira combien de comprimés pelliculés de Galvumet vous devez prendre et à quels moments de la journée.
Il s'agit en règle générale d'un comprimé pelliculé deux fois par jour.
La dose quotidienne maximale de 1 comprimé pelliculé deux fois par jour ne doit pas être dépassée.
La dose prescrite par votre médecin ne doit pas être dépassée.
En fonction de votre état, votre médecin vous prescrira Galvumet seul ou en association avec d'autres médicaments pour le traitement du diabète.
Quand et comment prendre Galvumet?
Le risque de troubles gastriques sera éventuellement réduit si vous prenez Galvumet avec ou immédiatement après un repas.
Les comprimés pelliculés de Galvumet doivent être avalés entiers sans les mâcher avec un verre d'eau.
Pendant combien de temps devez-vous prendre Galvumet?
Prenez Galvumet aussi longtemps que votre médecin vous l'a prescrit. Il est important de faire des contrôles réguliers chez votre médecin pour s'assurer que le traitement produit bien les effets souhaités.
N'arrêtez pas les prises de Galvumet de votre propre chef, à moins que votre médecin ne vous l'ait expressément ordonné.
Que faire si vous avez oublié de prendre une dose de Galvumet?
Il est conseillé de prendre votre médicament chaque jour à la même heure. Si vous deviez malgré tout avoir oublié un jour de prendre Galvumet, rattrapez ce retard dès que vous vous apercevez de votre oubli. Prenez ensuite la dose suivante à l'heure habituelle. Si l'heure de la dose suivante est très proche, laissez simplement tomber la dose oubliée. Ne prenez pas une double dose de Galvumet pour compenser celle que vous avez oubliée.
Si vous avez pris plus de Galvumet que nécessaire?
Avertissez immédiatement votre médecin si vous avez avalé trop de comprimés par inadvertance ou qu'une autre personne a pris votre médicament. Il se peut qu'un suivi médical soit nécessaire. Montrez l'emballage à votre médecin dans toute la mesure du possible.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Quels effets secondaires Galvumet peut-il provoquer?
Les effets indésirables suivants peuvent survenir pendant la prise de Galvumet:
Très fréquent (concerne plus d'un utilisateur sur 10): nausées, vomissements, diarrhées, douleurs abdominales, perte d'appétit.
Fréquent (concerne 1 à 10 utilisateurs sur 100): vertiges, tremblement, goût métallique, frissons, brûlures d'estomac, maux de tête, forte transpiration, taux de sucre trop bas dans le sang (hypoglycémie).
Occasionnel (concerne 1 à 10 utilisateurs sur 1000): fatigue, gonflement des mains et des pieds (œdèmes périphériques), douleurs des articulations, constipation, sensation de faiblesse, prise de poids, diarrhée, ballonnements.
Très rare (concerne moins d'un utilisateur sur 10 000): infections des voies respiratoires supérieures, inflammation de la région du nez et de la gorge (rhinopharyngite), diminution de la résorption de la vitamine B12, acidose lactique, inflammation du foie, réactions cutanées, telles que rougeurs, prurit (démangeaisons), urticaire.
Il arrive dans de rares cas que surviennent sous Galvumet, en particulier lorsqu'il est associé avec un médicament de la famille des inhibiteurs de l'ECA (médicaments abaissant la tension artérielle), des troubles respiratoires et de la déglutition, un gonflement du visage, des bras et des jambes, des yeux, des lèvres ou de la langue. Si vous observez de tels signes, arrêtez immédiatement le traitement et informez-en votre médecin sans tarder.
Si vous constatez que vous avez une jaunisse ou que vous présentez d'autres signes indiquant un trouble de la fonction du foie (yeux et peau jaune, nausées, perte d'appétit ou urines de couleur foncée), interrompez votre traitement et contactez immédiatement votre médecin.
Si vous présentez les symptômes d'une acidose lactique, tels que sensation de froid et malaise, douleurs musculaires, somnolence, fortes nausées ou vomissements profus, diarrhées, douleurs abdominales, perte de poids d'origine indéterminée, vertiges, troubles du rythme cardiaque ou respiration accélérée, vous devez immédiatement interrompre votre traitement et contacter votre médecin. Une acidose lactique peut entraîner un coma.
Si vous ressentez des maux de ventre intenses et persistants avec ou sans vomissements (signe éventuel d'une inflammation du pancréas), vous devez immédiatement arrêter le traitement et contacter votre médecin.
Veuillez contacter immédiatement votre médecin si vous ressentez des douleurs musculaires, des sensibilités ou des faiblesses musculaires, les problèmes musculaires pouvant dans de rares cas être graves, notamment accompagnés d'une défaillance musculaire qui peut entraîner une lésion rénale, puis la mort. Ce risque de défaillance musculaire est éventuellement plus grand chez les patients et patientes âgés (65 ans et plus), chez les personnes de sexe féminin, chez les patients et les patientes souffrant de troubles de la fonction rénale, chez les patients et les patientes ayant des problèmes de la glande thyroïde et chez les patients et les patientes prenant des doses plus élevées de Galvumet.
Les effets secondaires supplémentaires suivants ont été rapportés après l'introduction du médicament sur le marché (fréquence inconnue): desquamation de la peau ou vésicules cutanées, ampoules, inflammation du pancréas.
Avertissez votre médecin si l'un de ces effets indésirables vous gêne de façon importante.
Si vous remarquez des effets secondaires qui ne sont pas mentionnés dans cette notice d'emballage, veuillez en informer votre médecin ou votre pharmacien.
À quoi faut-il encore faire attention?
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
Les médicaments doivent être conservés hors de portée des enfants.
Ne pas conserver le médicament au-dessus de 30 °C. Conserver dans l'emballage d'origine à l'abri de l'humidité.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Galvumet?
Chaque comprimé pelliculé de Galvumet contient les principes actifs vildagliptine et hydrochlorure de metformine, ainsi que des excipients.
Trois dosages sont disponibles:
- comprimés pelliculés à 50 mg de vildagliptine et 500 mg d'hydrochlorure de metformine.
- comprimés pelliculés à 50 mg de vildagliptine et 850 mg d'hydrochlorure de metformine.
- comprimés pelliculés à 50 mg de vildagliptine et 1000 mg d'hydrochlorure de metformine.
Principes actifs
Vildagliptine et hydrochlorure de metformine.
Excipients
Comprimés pelliculés à 50/850 mg: hydroxypropylcellulose, stéarate de magnésium, hypromellose, dioxyde de titane (E 171), oxyde jaune de fer (E 172), macrogol 4000, talc.
- Comprimés pelliculés à 50/1000 mg: hydroxypropylcellulose, stéarate de magnésium, hypromellose, dioxyde de titane (E 171), oxyde jaune de fer (E 172), macrogol 4000, talc.
- Comprimés pelliculés à 50/500 mg: hydroxypropylcellulose, stéarate de magnésium, hypromellose, dioxyde de titane (E 171), oxyde jaune de fer (E 172), oxyde rouge de fer (E 172), macrogol 4000, talc.
Numéro d’autorisation
58 451 (Swissmedic)
Où obtenez-vous Galvumet? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Comprimés pelliculés à 50/500 mg: à 60 et 180 comprimés pelliculés.
Comprimés pelliculés à 50/850 mg: à 60 et 180 comprimés pelliculés.
Comprimés pelliculés à 50/1000 mg: à 60 et 180 comprimés pelliculés.
Titulaire de l’autorisation
Novartis Pharma Schweiz AG, Risch; Domicile: 6343 Rotkreuz
Cette notice d'emballage a été vérifiée pour la dernière fois en septembre 2020 par l'autorité de contrôle des médicaments (Swissmedic).
Che cos’è Galvumet e quando si usa?
Galvumet è un medicamento da assumere per il trattamento del diabete di tipo 2. Galvumet contiene i principi attivi vildagliptin e metformina. Viene prescritto ai pazienti assieme a una dieta e a dell'attività fisica, se questi pazienti hanno già ricevuto una terapia a base di vildagliptin e metformina o se il diabete non è trattato in modo soddisfacente con l'assunzione di metformina o vildagliptin in monoterapia.
Il suo medico può prescriverle un trattamento solo con Galvumet o in combinazione con un altro medicamento antidiabetico orale per tenere sotto controllo la sua glicemia.
Galvumet viene prescritto anche, insieme a una dieta e ad attività fisica, come terapia supplementare all'insulina per migliorare il controllo della glicemia nei pazienti in cui una dose stabile di insulina e metformina da sole non portano a un controllo della glicemia soddisfacente.
Galvumet contribuisce a controllare la glicemia (tasso di zucchero) nel sangue. Questo tipo di medicamenti è conosciuto con la denominazione di antidiabetici orali.
Nel diabete di tipo 2, l'organismo produce troppa poca insulina e/o troppo glucagone. Inoltre, l'effetto dell'insulina prodotta dall'organismo può essere limitato. L'insulina (prodotta dal pancreas) aiuta a diminuire la glicemia, soprattutto dopo i pasti. Il glucagone, anch'esso prodotto dal pancreas, stimola la produzione di zucchero, cosa che porta a un aumento della glicemia.
Galvumet fa in modo che il pancreas produca più insulina e meno glucagone (effetto del vildagliptin) e che l'insulina faccia meglio effetto (effetto della metformina). In questo modo Galvumet contribuisce a un migliore controllo della glicemia.
È importante che durante la terapia con Galvumet lei segua i consigli riguardanti la sua alimentazione e/o l'attività fisica.
Di che cosa occorre inoltre tener conto durante il trattamento?
Un buon controllo della glicemia non dipende solamente dalla terapia medicamentosa bensì anche, in modo decisivo, dal rispetto della dieta e da una sufficiente attività fisica. È quindi importante che lei segua le indicazioni in questo senso ricevute dal suo medico o dalla consulenza sul diabete.
Quando non si può usare Galvumet?
Galvumet non può essere assunto:
- Se reagisce con un'allergia a uno delle componenti.
- Se soffre di una forte disfunzione renale.
- Se ha da poco avuto un infarto cardiaco, se soffre di insufficienza cardiaca o di gravi disturbi della circolazione, shock incluso, o se ha difficoltà respiratorie.
- Se soffre o ha sofferto di gravi complicazioni del suo diabete. Di queste complicazioni fanno parte ad es. una chetoacidosi diabetica (una complicazione del diabete con rapida perdita di peso, nausea e vomito) o un coma diabetico.
- Se deve sottoporsi a un esame radiologico con un mezzo di contrasto (uno speciale esame radiologico durante il quale le viene iniettato un colorante). In questo caso deve interrompere la terapia con Galvumet, nella fattispecie prima o il giorno dell'esame e per alcuni giorni a seguire.
Quando è richiesta prudenza nella somministrazione di Galvumet?
Se manifesta vertigini, non guidi un veicolo né utilizzi attrezzi o macchine.
Se soffre di un disturbo del fegato o di diabete di tipo 1, non dovrebbe assumere Galvumet. Galvumet non è un sostituto dell'insulina.
Se insorgono uno o più dei seguenti sintomi: sensazione di freddo e malessere, dolori muscolari, stordimento, forte nausea o forte vomito, mal di pancia, vertigini, disturbi del ritmo cardiaco o respirazione rapida. Questi possono essere sintomi di un'acidosi lattica, un grave scompenso metabolico. In questo caso deve contattare immediatamente il suo medico. La probabilità di insorgenza di un'acidosi lattica è maggiore nei pazienti che hanno una funzione renale disturbata.
Se manifesta nausea, sudorazione, sensazione di debolezza, vertigini, tremito o mal di testa (segnali di una glicemia troppo bassa). Ciò può essere provocato da una carenza nell'alimentazione, da un'eccessiva attività fisica senza la corrispondente assunzione di alimenti o da un consumo eccessivo di alcol.
Se manifesta alcuni di questi sintomi, interrompa l'assunzione di Galvumet e consulti immediatamente un medico.
Se assume Galvumet in combinazione con un altro antidiabetico orale o con l'insulina, il rischio di ipoglicemia (concentrazione di zucchero troppo bassa nel sangue) può essere maggiore. Eventualmente il suo medico ne ridurrà la dose.
Durante l'assunzione di Galvumet sono stati documentati casi di pancreatite. La pancreatite è una malattia grave che può mettere in pericolo la vita. Interrompa l'assunzione di Galvumet e si rechi dal medico se soffre di dolori addominali forti e persistenti, con o senza vomito, poiché potrebbe trattarsi di una pancreatite.
Se deve essere sottoposto a un intervento chirurgico sotto anestesia generale, è necessaria un'interruzione della terapia con Galvumet per alcuni giorni prima e dopo l'operazione. Il suo medico deciderà quando dovrà interrompere il trattamento con Galvumet e quando lo dovrà riprendere.
Galvumet dovrebbe essere utilizzato nei pazienti anziani esclusivamente in assenza di qualsiasi limitazione della funzione renale. Se lei è anziano, il suo medico controllerà perciò più volte l'anno la sua funzione renale.
Non sono disponibili informazioni sull'utilizzo di Galvumet nei bambini e negli adolescenti (con meno di 18 anni). Perciò l'utilizzo di Galvumet in questi pazienti non è consigliato.
Se consuma alcol giornalmente o di quando in quando in eccessive quantità.
Durante l'assunzione di Galvumet non consumi eccessive quantità di alcol o non assuma medicamenti che contengono alcol.
Contatti il suo medico se le sue glicemie improvvisamente peggiorano, se i suoi test della glicemia danno risultati inconsueti o se si sente malato/a.
Consulti immediatamente il suo medico se avverte dolori, sensibilità o debolezza muscolari inspiegabili. In rari casi i problemi muscolari, tra cui danni ai muscoli, possono essere gravi e causare danni ai reni. Il rischio può essere più alto a dosi più elevate di Galvumet e nei pazienti con funzione renale anormale.
Informi il suo medico e il suo farmacista, nel caso in cui
- soffre di altre malattie
- soffre di allergie o
- assume altri medicamenti (anche se acquistati di sua iniziativa).
Si può usare Galvumet durante la gravidanza o l’allattamento?
Gravidanza
Informi il suo medico se è incinta o se dovesse restare incinta durante la terapia.
Durante la gravidanza può assumere Galvumet unicamente con l'espressa autorizzazione del suo medico.
Allattamento
Non è risaputo se le sostanze attive di Galvumet, vildagliptin e cloridrato di metformina, passino nel latte materno. Se allatta, non deve assumere Galvumet.
Ne parli con il suo medico.
Come usare Galvumet?
Il suo medico le dirà quante compresse rivestite con film di Galvumet dovrà assumere e in quali ore della giornata.
Di regola si tratta di una compressa rivestita con film, due volte al giorno.
Non superare la dose giornaliera massima di 1 compressa rivestita con film due volte al giorno.
Non superi la dose prescritta dal suo medico.
A seconda del suo stato di salute, il suo medico le prescriverà Galvumet da solo o associato ad altri medicamenti per trattare il diabete.
Quando e come deve assumere Galvumet?
Se assume Galvumet durante oppure subito dopo un pasto, la possibilità di disturbi gastrici diminuisce.
Galvumet dovrebbe essere ingerito senza essere masticato e con un bicchiere d'acqua.
Per quanto tempo deve assumere Galvumet?
Assuma Galvumet per tutto il tempo che le viene prescritto dal suo medico. È importante effettuare dei regolari controlli dal medico per assicurarsi che la terapia sortisca l'effetto desiderato.
Non interrompa l'assunzione di Galvumet, tranne nel caso in cui il suo medico le dica espressamente di farlo.
Cosa deve fare se ha dimenticato di prendere Galvumet?
È consigliabile assumere il medicamento ogni giorno alla stessa ora. Se però si è dimenticato/a di prendere Galvumet, recuperi l'assunzione non appena se ne ricorda. Prenda poi la prossima dose di nuovo all'orario abituale. Se però è già quasi l'ora della prossima assunzione, tralasci l'assunzione della dose dimenticata. Non assuma una doppia dose di Galvumet per compensare la compressa dimenticata.
Cosa deve fare se ha assunto più Galvumet del necessario?
Se per errore ha assunto troppe compresse o se un'altra persona dovesse aver preso il suo medicamento, informi immediatamente il suo medico. È possibile che necessiti di assistenza medica. Se possibile, mostri la confezione al suo medico.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Quali effetti collaterali può avere Galvumet?
I seguenti effetti collaterali possono insorgere durante l'assunzione di Galvumet:
Molto comune (riguarda più di 1 utilizzatore su 10): nausea, vomito, diarrea, mal di pancia, perdita dell'appetito.
Comune (riguarda da 1 a 10 utilizzatori su 100): vertigini, tremito, sapore metallico in bocca, brividi, acidità di stomaco, mal di testa, sudorazione intensa, ipoglicemia (abbassamento eccessivo del livello di zucchero nel sangue).
Non comune (riguarda da 1 a 10 utilizzatori su 1000): stanchezza, gonfiore delle mani e dei piedi (edemi periferici), dolori articolari, stitichezza, sensazione di debolezza, aumento di peso, diarrea, flatulenza.
Molto raro (riguarda meno di 1 utilizzatore su 10 000): infezioni delle vie respiratorie superiori, infiammazioni del naso e della gola (rinofaringite), diminuzione dell'assimilazione della vitamina B12, acidosi lattica, infiammazione del fegato, reazioni cutanee come arrossamento cutaneo, prurito, orticaria (pomfi).
Molto raramente, durante la terapia con Galvumet, specialmente se in combinazione con un ACE-inibitore (medicamento per abbassare la pressione sanguigna), possono insorgere disturbi respiratori e della deglutizione e gonfiore di volto, braccia e gambe, occhi, labbra o lingua. In presenza di questi sintomi dovrebbe interrompere immediatamente la terapia e informare il suo medico.
Se dovesse osservare un ittero o altri segni di un disturbo della funzione epatica (occhi e pelle gialli, nausea, inappetenza o colorazione scura delle urine), dovrebbe interrompere immediatamente la terapia e contattare il suo medico.
Se osserva i sintomi di un'acidosi lattica come sensazione di freddo e malessere, dolori muscolari, intontimento, forte nausea o forte vomito, diarrea, mal di pancia, perdita di peso inspiegabile, vertigini, disturbi del ritmo cardiaco o respirazione rapida, deve interrompere immediatamente la terapia e contattare il suo medico. L'acidosi lattica può portare a coma.
Se dovesse notare dolori addominali intensi e persistenti con o senza vomito (possibile segno di una pancreatite), dovrà interrompere immediatamente il trattamento e mettersi in contatto con il suo medico.
Contatti immediatamente il medico se avverte dolore, sensibilità o debolezza muscolari. Questo perché in rari casi i problemi muscolari, tra cui danni muscolari, possono essere gravi e causare a danni ai reni e possono portare alla morte. Questo rischio di danni muscolari può essere maggiore nei pazienti più anziani (65 anni e più), nelle pazienti di sesso femminile, nei pazienti con disfunzioni renali, nei pazienti con problemi alla tiroide e nei pazienti che assumono dosi più elevate di Galvumet.
Dopo l'introduzione sul mercato sono state riportate le seguenti ulteriori reazioni indesiderate (frequenza non nota): distacco della pelle o vescicole cutanee, vesciche cutanee, pancreatite.
Informi il suo medico se uno di questi effetti collaterali la disturba molto.
Se osserva effetti collaterali non descritti in questo foglietto informativo si rivolga al suo medico o al suo farmacista.
Di che altro occorre tener conto?
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazione di stoccaggio
Conservare il medicamento fuori dalla portata dei bambini.
Il medicamento dev'essere conservato al riparo dall'umidità, non a temperature superiori a 30°C e nella confezione originale.
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Galvumet?
Ogni compressa rivestita con film di Galvumet contiene vildagliptin e cloridrato di metformina, quali principi attivi, e sostanze ausiliarie.
Sono ottenibili in tre dosaggi:
- Compresse rivestite con film da 50 mg di vildagliptin e 500 mg di cloridrato di metformina.
- Compresse rivestite con film da 50 mg di vildagliptin e 850 mg di cloridrato di metformina.
- Compresse rivestite con film da 50 mg di vildagliptin e 1000 mg di cloridrato di metformina.
Principi attivi
Vildagliptin e cloridrato di metformina
Sostanze ausiliarie
Compresse rivestite con film da 50/500 mg: idrossipropilcellulosa, magnesio stearato, ipromellosa, biossido di titanio (E 171), ossido di ferro giallo (E 172), ossido di ferro rosso (E 172), macrogol 4000, talco
Compresse rivestite con film da 50/850 mg: idrossipropilcellulosa, magnesio stearato, ipromellosa, biossido di titanio (E 171), ossido di ferro giallo (E 172), macrogol 4000, talco
Compresse rivestite con film da 50/1000 mg: idrossipropilcellulosa, magnesio stearato, ipromellosa, biossido di titanio (E 171), ossido di ferro giallo (E 172), macrogol 4000, talco
Numero dell’omologazione
58 451 (Swissmedic)
Dove è ottenibile DESIGNAZIONE DEL MEDICAMENTO? Quali confezioni sono disponibili?
In farmacia, dietro presentazione della prescrizione medica.
Compresse rivestite con film da 50/500 mg: confezioni da 60 e 180 compresse rivestite con film.
Compresse rivestite con film da 50/850 mg: confezioni da 60 e 180 compresse rivestite con film.
Compresse rivestite con film da 50/1000 mg: confezioni da 60 e 180 compresse rivestite con film.
Titolare dell’omologazione
Novartis Pharma Schweiz AG, Risch; Domicilio: 6343 Rotkreuz
Questo foglietto illustrativo è stato controllato l'ultima volta nel settembre 2020 dall'autorità competente in materia di medicamenti (Swissmedic).
Zusammensetzung
Wirkstoffe
Vildagliptinum und Metformini hydrochloridum
Hilfsstoffe
50/500 mg: Hydroxypropylcellulosum, Magnesii stearas, Hypromellosum, Titanii dioxidum, Ferri oxidum luteum, Ferri oxidum rubrum, Macrogolum 4000, Talcum
50/850 mg: Hydroxypropylcellulosum, Magnesii stearas, Hypromellosum, Titanii dioxidum, Ferri oxidum luteum, Macrogolum 4000, Talcum
50/1000 mg: Hydroxypropylcellulosum, Magnesii stearas, Hypromellosum, Titanii dioxidum, Ferri oxidum luteum, Macrogolum 4000, Talcum
Darreichungsform und Wirkstoffmenge pro Einheit
Filmtabletten zu
- 50 mg Vildagliptin und 500 mg Metforminhydrochlorid oder
- 50 mg Vildagliptin und 850 mg Metforminhydrochlorid oder
- 50 mg Vildagliptin und 1'000 mg Metforminhydrochlorid
50 mg/500 mg: hellgelb, ovalär, abgeschrägte Kanten, Filmtablette; auf der einen Seite «NVR», auf der anderen «LLO» eingepresst.
50 mg/850 mg: gelb, ovalär, abgeschrägte Kanten, Filmtablette; auf der einen Seite «NVR», auf der anderen «SEH» eingepresst.
50 mg/1'000 mg: dunkelgelb, abgeschrägte Kanten, Filmtablette; auf der einen Seite «NVR», auf der anderen «FLO» eingepresst.
Indikationen/Anwendungsmöglichkeiten
Patienten mit Diabetes mellitus Typ 2 (T2DM):
Galvumet ist indiziert als Zusatz zu Diät und körperlicher Bewegung bei Patienten, deren Behandlung mit Metforminhydrochlorid oder Vildagliptin allein keine ausreichende Blutzuckerkontrolle bietet, oder bei Patienten, die bereits mit einer freien Kombination von Metforminhydrochlorid und Vildagliptin behandelt werden.
Galvumet ist indiziert in Kombination mit einem Sulfonylharnstoff (d.h. als Dreifach-Kombinationstherapie) als Zusatz zu Diät und körperlicher Bewegung bei Patienten, deren Behandlung mit Metformin und einem Sulfonylharnstoff allein keine ausreichende Blutzuckerkontrolle bietet.
Galvumet ist indiziert in Kombination mit Insulin zur Verbesserung der Blutzuckerkontrolle bei Patienten, bei denen durch Diät, körperliche Bewegung sowie der Behandlung mit einer stabilen Dosis Insulin und Metformin keine ausreichende Blutzuckerkontrolle erreicht werden kann.
Dosierung/Anwendung
Die antidiabetische Behandlung sollte basierend auf Wirksamkeit und Verträglichkeit individuell angepasst werden. Bei der Anwendung von Galvumet sollte die empfohlene Tageshöchstdosis von 100 mg Vildagliptin nicht überschritten werden.
Die empfohlene Initialdosis von Galvumet sollte auf der bestehenden Behandlung mit Vildagliptin und/oder Metformin basieren. Um die unerwünschten gastrointestinalen Wirkungen von Metformin zu vermindern, sollte die tägliche Gesamtdosis von Metformin in 2-3 gleichen Dosen zu den Mahlzeiten über den Tag verteilt eingenommen werden, wobei Galvumet 2 mal pro Tag eingenommen wird.
Therapieeinleitung
Initialdosis bei nicht adäquat kontrollierten Patienten mit einer Vildagliptin-Monotherapie
Basierend auf der üblichen Initialdosis von Metformin (Tagesdosis: 500 mg-1'000 mg) soll mit Galvumet der Tablettenstärke 50 mg/500 mg oder 50 mg/850 mg 2 mal pro Tag begonnen werden. Die Dosis Metformin ist je nach Bewertung des therapeutischen Ansprechens schrittweise anzupassen.
Initialdosis bei nicht adäquat kontrollierten Patienten mit einer Metformin-Monotherapie
Basierend auf der gegenwärtigen Dosis von Metformin soll mit Galvumet der Tablettenstärke 50 mg/500 mg, 50 mg/850 mg oder 50 mg/1000 mg 2 mal pro Tag begonnen werden.
Initialdosis bei Patienten, die von einer freien Kombination mit Metformin und Vildagliptin zu Galvumet wechseln
Basierend auf der gegenwärtig eingenommenen Dosis von Metformin oder Vildagliptin sollte mit Galvumet der Tablettenstärke 50 mg/500 mg, 50 mg/850 mg oder 50 mg/1'000 mg begonnen werden.
Kombinationstherapie
Anwendung in Kombination mit Insulin oder mit Sulfonylharnstoff
Basierend auf der gegenwärtigen Dosis von Metformin soll Galvumet in der Tablettenstärke 50 mg/500 mg, 50 mg/850 mg oder 50 mg/1000 mg 2 mal pro Tag eingenommen werden.
Bei Kombination mit einem Sulfonylharnstoff kann eine niedrigere Dosierung des Sulfonylharnstoffes erwogen werden, um das Risiko einer Hypoglykämie zu reduzieren.
Patienten mit Leberfunktionsstörungen
Die Anwendung von Galvumet ist nicht empfohlen bei Patienten mit einer Leberfunktionsstörung, inkl. Patienten die vor Behandlungsbeginn AST- oder ALT-Werte von >2.5x ULN aufweisen (s. «Warnhinweise und Vorsichtsmassnahmen»).
Patienten mit Nierenfunktionsstörungen
Vor Beginn der Behandlung mit Metformin-haltigen Produkten (wie Galvumet) und danach mindestens einmal pro Jahr, soll die glomeruläre Filtrationsrate (GFR) geprüft werden. Bei Patienten mit einem erhöhten Risiko für ein Fortschreiten einer Nierenfunktionsstörung sowie bei älteren Patienten, soll die Nierenfunktion häufiger untersucht werden, z.B. alle 3 bis 6 Monate.
Bevor die Behandlung mit Metformin-haltigen Produkten (wie Galvumet) bei Patienten mit einer GFR <60 ml/min in Betracht gezogen wird, sollen Faktoren die das Risiko einer Laktatazidose erhöhen (s. «Warnhinweise und Vorsichtsmassnahmen») überprüft werden. Galvumet ist aufgrund des Wirkstoffes Metformin bei Patienten mit einer GFR <30 ml/min kontraindiziert (s. «Kontraindikationen»).
Abhängig vom aktuellen Status der Nierenfunktion sind die folgenden Dosisempfehlungen zu beachten:
Kreatinin-Clearance ml/min eGFR ml/min/1.73 m2 | Metformin | Vildagliptin |
|---|---|---|
60‑89 | Die maximale tägliche Dosis beträgt 3'000 mg*. Eine Reduktion der Dosis kann in Betracht gezogen werden, falls sich die Nierenfunktion verschlechtert. | Die maximale tägliche Dosis beträgt 100 mg. |
45‑59 | Die Therapie sollte mit 500 mg oder 850 mg Metformin pro Tag begonnen werden. Die maximale Tagesdosis beträgt 1000 mg, aufgeteilt auf 2 Einzeldosen Die renale Funktion (Kreatinin-Clearance, resp. eGFR) soll engmaschig, alle 3–6 Monate, kontrolliert werden | Die maximale tägliche Dosis beträgt 50 mg. |
30‑44 | Die Therapie sollte mit 500 mg oder 850 mg Metformin pro Tag begonnen werden. Die maximale Tagesdosis beträgt 1000 mg, aufgeteilt auf 2 Einzeldosen. Die renale Funktion (Kreatinin-Clearance, resp. eGFR) soll engmaschig, mindestens alle 3 Monate, kontrolliert werden. | |
<30 | Metformin ist kontraindiziert. | |
*Falls eine Metformin Dosis höher als mit Galvumet allein erzielbar als notwendig erachtet wird. | ||
Falls mit Galvumet die erforderliche Dosis für einen der beiden Wirkstoffe nicht zur Verfügung steht, sollen die beiden Einzelsubstanzen anstelle des Kombinationspräparates verwendet werden.
Ältere Patienten
Da Metformin über die Nieren ausgeschieden wird und ältere Patienten eine Tendenz zu verringerter Nierenfunktion haben, sollte bei älteren Patienten, die Metformin-haltige Produkte (wie Galvumet) einnehmen, regelmässig die Nierenfunktion kontrolliert werden. Galvumet sollte nur bei älteren Patienten mit normaler Nierenfunktion eingesetzt werden (s. «Kontraindikationen» und «Warnhinweise und Vorsichtsmassnahmen»).
Kinder und Jugendliche
Die Wirksamkeit und Sicherheit von Galvumet wurde bei Patienten unter 18 Jahren nicht nachgewiesen. Daher wird die Anwendung von Galvumet bei pädiatrischen Patienten nicht empfohlen.
Kontraindikationen
- Überempfindlichkeit gegen die Wirkstoffe oder einen der Hilfstoffe
- Laktatazidose, diabetische Ketoazidose oder diabetisches Präkoma
- Schwere Nierenfunktionsstörung (GFR <30 ml/min) (s. «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»)
- Akute Zustände, die potenziell mit einer Veränderung der Nierenfunktion einhergehen, wie
- Dehydratation
- schwere Infektionen
- Schockzustände
- intravaskuläre Gabe jodhaltiger Kontrastmittel (s. «Warnhinweise und Vorsichtsmassnahmen»)
- Akute oder chronische Erkrankungen, die eine Gewebshypoxie hervorrufen können, wie
- Herzinsuffizienz
- respiratorische Insuffizienz
- ein frischer Myokardinfarkt
- Schockzustand
- Einschränkung der Leberfunktion (s. «Dosierung/Anwendung», «Warnhinweise und Vorsichtsmassnahmen» und «Unerwünschte Wirkungen»)
- Akute Alkoholintoxikation, Alkoholismus
- Stillzeit (s. «Schwangerschaft, Stillzeit»)
Warnhinweise und Vorsichtsmassnahmen
Galvumet
Generell
Galvumet ist kein Ersatz für Insulin bei insulinpflichtigen Patienten. Galvumet sollte bei Patienten mit Diabetes Typ 1 oder bei Patienten mit Ketoazidose nicht angewendet werden.
Hypoglykämien
Patienten, die Galvumet in Kombination mit einem Sulfonylharnstoff oder Insulin erhalten, sind möglicherweise einem erhöhten Hypoglykämierisiko ausgesetzt. Daher sollte ggf. eine niedrigere Dosierung des Sulfonylharnstoffs bzw. des Insulins in Betracht gezogen werden, um das Risiko einer Hypoglykämie zu reduzieren.
Vildagliptin
Leberschädigungen
Vildagliptin ist nicht empfohlen bei Patienten mit Leberfunktionsstörung, inkl. Patienten die vor Behandlungsbeginn AST- oder ALT-Werte von >2.5x ULN aufweisen.
Galvumet ist daher bei Patienten mit Leberschädigungen nicht empfohlen.
Überwachung der Leberenzyme
Es wurde über Fälle von Leberfunktionsstörungen (inkl. seltene Fälle von Hepatitis) berichtet. In diesen Fällen waren die Patienten meist asymptomatisch ohne klinische Folgen und die Leberfunktionsteste normalisierten sich nach Abbruch der Behandlung. Leberfunktionsteste sollten vor Behandlungsbeginn mit Galvumet vorgenommen werden, um die Grundwerte der Patienten zu bestimmen. Die Leberfunktion sollte während der Behandlung mit Galvumet während des ersten Jahres in einem drei-Monate Intervall und danach periodisch überwacht werden. Bei Patienten, die erhöhte Transaminasewerte entwickeln, sollte dieser Test wiederholt werden und bei Bestätigung des Ergebnisses der Patient in kurzen Zeitabständen bis zur Normalisierung überwacht werden. Bei erhöhtem AST oder ALT von ≥3x ULN wird empfohlen, Galvumet abzusetzen.
Patienten, die einen Ikterus oder andere Zeichen einer Leberdysfunktion entwickeln, sollten die Therapie mit Galvumet abbrechen.
Nach einem Abbruch der Behandlung mit Galvumet und der Normalisierung der Leberfunktionstests sollte eine Behandlung mit Galvumet nicht mehr begonnen werden.
Pankreatitis
Nach Markteinführung wurden im Rahmen der Spontanberichterstattung Fälle von akuter Pankreatitis als Nebenwirkung gemeldet. Die Patienten sollten deshalb über die charakteristischen Symptome einer akuten Pankreatitis informiert werden: Andauernde, starke abdominale Schmerzen.
Nach Absetzen von Vildagliptin wurde eine Rückbildung der Pankreatitis beobachtet. Bei Verdacht auf eine Pankreatitis sollten Vildagliptin und andere potenziell infrage kommende Arzneimittel abgesetzt werden.
Herzinsuffizienz
Eine klinische Studie zu Vildagliptin bei Patienten mit Herzinsuffizienz der NYHA (New York Heart Association)-Funktionsklasse I-III zeigte, dass die Behandlung mit Vildagliptin im Vergleich zu Placebo nicht zu einer Änderung der linksventrikulären Ejektionsfraktion oder einer Verschlechterung von vorbestehender kongestiver Herzinsuffizienz führte. Die klinische Erfahrung bei mit Vildagliptin behandelten Patienten der NYHA-Funktionsklasse III ist noch begrenzt und die Ergebnisse der oben erwähnten Studie sind nicht beweiskräftig (siehe «Eigenschaften/Wirkungen»). Da keine Erfahrungen aus klinischen Studien zur Anwendung von Vildagliptin bei Patienten mit Herzinsuffizienz der NYHA-Funktionsklasse IV vorliegen, wird eine Anwendung bei diesen Patienten nicht empfohlen.
Hauterkrankungen
In nicht klinischen toxikologischen Studien wurden unter Vildagliptin Hautläsionen wie Blasenbildung und Ulzera an Extremitäten von Affen berichtet (siehe Abschnitt «Präklinische Daten»). Obwohl in klinischen Studien keine erhöhte Inzidenz von Hautläsionen beobachtet wurde, gibt es nur begrenzte Erfahrung bei Patienten mit diabetischen Hautkomplikationen. Daher wird eine Überwachung von Hauterkrankungen hinsichtlich Blasenbildung und Ulzera, wie es bei diabetischen Patienten Routine ist, empfohlen.
Myopathie/Rhabdomyolyse
Im Zusammenhang mit der Einnahme von Galvumet wurde über Myopathien berichtet, welche sich in Form von Muskelschmerz, -schwäche oder -empfindlichkeit zusammen mit stark erhöhter Kreatinkinase (CK, auf das Zehnfache der oberen Normgrenze) äussert. Myopathie kann manchmal in Form einer Rhabdomyolyse mit oder ohne akutem Nierenversagen aufgrund einer Myoglobinurie auftreten und selten sind Todesfälle vorgekommen.
Die Ärzte sollten Galvumet mit Vorsicht bei Patienten mit prädisponierenden Faktoren für eine Rhabdomyolyse verschreiben. Ein Kreatinkinase-Wert sollte vor Beginn der Behandlung in den folgenden Situationen bestimmt werden:
- Einschränkung der Nierenfunktion
- Nicht-kontrollierte Hypothyreose
- Persönliche oder familiäre Vorgeschichte von erblichen Muskelerkrankungen
- Vorgeschichte von Muskeltoxizität mit einem Statin oder Fibrat
- Alkoholabhängigkeit
- Ältere Personen (≥65 Jahre): die Notwendigkeit einer solchen Messung sollte bei Vorhandensein von anderen prädisponierenden Faktoren für eine Rhabdomyolyse in Betracht gezogen werden
- Weibliches Geschlecht
In solchen Situationen sollte das Risiko einer Behandlung in Relation zum möglichen Nutzen betrachtet werden.
Metformin
Herzinsuffizienz
Metformin ist bei Patienten mit Herzinsuffizienz kontraindiziert, weshalb auch Galvumet in dieser Patientenpopulation kontraindiziert ist (siehe Abschnitt «Kontraindikationen»).
Laktatazidose
Laktatazidose ist eine sehr seltene (3 Fälle pro 100'000 Patientenjahre), aber ernste metabolische Komplikation, die in den meisten Fällen mit einer akuten Verschlechterung der Nierenfunktion, kardiorespiratorischen Erkrankung oder Sepsis auftritt und mit einer hohen Mortalität assoziiert ist, wenn keine frühzeitige Behandlung erfolgt. Metforminakkumulation erfolgt mit einer akuten Verschlechterung der Nierenfunktion und erhöht das Risiko einer Laktatazidose. Eine akute Niereninsuffizienz (organisch oder funktionell) kann die Ursache einer Metforminakkumulation sein.
Die vorausgehende Symptomatik ist unspezifisch und kann sich durch das Auftreten von Muskelkrämpfen, begleitet von gastrointestinalen Störungen, Bauchschmerzen, erhöhter Atemfrequenz und grosser Schwäche äussern. Diese Symptome sollten vom behandelnden Arzt beachtet werden. Auch sollte der Arzt den Patienten über mögliche Anzeichen einer Laktatazidose informieren.
Im Falle einer Dehydrierung (z.B. durch schwere Diarrhöe oder Erbrechen, Fieber oder reduzierte Flüssigkeitseinnahme) sollte der Patient die Einnahme von Metformin-haltigen Produkten (wie Galvumet) einstellen und unverzüglich ärztliche Hilfe aufsuchen.
Iodhaltige Kontrastmittel
Die intravaskuläre Applikation von iodhaltigen Kontrastmitteln für Röntgenuntersuchungen (i.v.-Urographie, Angiographie, usw.) kann zu einer Metforminakkumulierung und einem erhöhten Risiko von Laktatazidose führen. Metformin-haltige Produkte (wie Galvumet) sollen vor oder zum Zeitpunkt eines bildgebenden Verfahrens abgesetzt werden und dürfen frühestens 48 h nach der Kontrastmitteluntersuchung und nur nach Überprüfung der Nierenfunktion und beim Vorliegen stabiler Werte wiederverwendet werden (s. «Dosierung/Anwendung» und «Interaktionen»).
Die Anwendung von Präparaten welche akut die Nierenfunktion beeinträchtigen können (wie Antihypertensiva, Diuretika und NSAIDs) soll nur mit Vorsicht bei Patienten in Behandlung mit Metformin-haltigen Produkten (wie Galvumet) eingeleitet werden. Weitere Risikofaktoren für Laktatazidose sind exzessiver Alkoholkonsum, Leberfunktionsstörung, unzureichend behandelte Diabetes, Ketose, andauerndes Fasten und jegliche Zustände assoziiert mit Hypoxie sowie die gleichzeitige Verwendung von Präparaten die eine Laktatazidose verursachen können (s. «Kontraindikationen» und «Interaktionen»).
Patienten und/oder Betreuungspersonen sollten über das Risiko einer Laktatazidose informiert werden. Laktatazidose ist durch azidotische Dyspnoe, Abdominalschmerzen, Muskelkrämpfe, Asthenie und Hypothermie gefolgt von Koma charakterisiert. Anhand folgender Laborparameter kann die Symptomatik erkannt werden: erniedrigter Blut-pH-Wert (<7.35), erhöhter Plasmalaktatspiegel (>5 mmol/l), vergrösserte Anionenlücke sowie ein erhöhtes Laktat/Pyruvat-Verhältnis.
Bei Verdacht auf Laktatazidose sollten Metformin-haltige Produkte (wie Galvumet) abgesetzt und der Patient unverzüglich hospitalisiert werden. Am effektivsten werden sowohl Laktat als auch Metformin durch Hämodialyse eliminiert (s. «Überdosierung»).
Nierenfunktion (s. «Kontraindikationen»)
Die GFR soll vor Behandlungsbeginn und danach in regelmässigen Abständen kontrolliert werden (s. «Dosierung/Anwendung»). Metformin-haltige Produkte (wie Galvumet) sind bei Patienten mit einer GFR <30 ml/min kontraindiziert und die Behandlung damit sollte vorübergehende eingestellt werden, falls Bedingungen vorliegen, welche die Nierenfunktion verändern (s. «Kontraindikationen»).
Chirurgische Eingriffe
Metformin-haltige Produkte (wie Galvumet) müssen 48 h vor einer geplanten Operation unter Narkose, Spinal- oder Epiduralanästhesie abgesetzt werden. Die Therapie mit Metformin kann frühestens 48 h nach dem Eingriff und nur nach Wiederaufnahme der oralen Ernährung und bei Vorliegen einer stabilen Nierenfunktion fortgeführt werden.
Alkoholeinnahme
Alkohol potenziert die Wirkung von Metformin im Laktatmetabolismus. Patienten sollten daher vor übermässigem Alkoholkonsum während der Therapie mit Metformin-haltigen Produkten (wie Galvumet) gewarnt werden.
Alkoholvergiftungen sind mit einem erhöhtem Laktatazidose Risiko verbunden, insbesondere bei vorherigem Fasten, Vorliegen einer Mangelernährung oder Leberfunktionsstörung.
Vitamin B12-Spiegel
Metformin ist bei etwa 7% der Patienten mit einer Abnahme des Vitamin B12-Serum-Spiegels ohne klinische Manifestationen assoziiert worden. Eine solche Abnahme ist sehr selten mit einer Anämie gekoppelt und scheint bei Unterbrechung der Verabreichung von Metformin und/oder einer Ergänzungstherapie mit Vitamin B12 schnell reversibel zu sein. Die Untersuchung der hämatologischen Parameter mindestens einmal im Jahr ist bei Patienten mit Galvumet angezeigt. Jede auftretende Störung sollte angemessen untersucht und angegangen werden.
Wechsel des klinischen Status bei Patienten mit vorher kontrolliertem Typ 2 Diabetes
Patienten mit Diabetes Typ 2, die vorher unter Galvumet gut kontrolliert waren, dann jedoch Abweichungen in den Laborwerten oder eine klinische Erkrankung (besonders eine unbestimmte oder nicht klar definierte Erkrankung) entwickeln, sollten sofort auf Keto- und/oder Laktazidose untersucht werden. Wenn eine Azidose auftritt, muss Galvumet sofort abgesetzt und die notwendigen Massnahmen müssen ergriffen werden.
Hypoglykämie
Üblicherweise tritt bei alleiniger Gabe von Galvumet keine Hypoglykämie auf; eine solche kann jedoch auftreten, wenn die Kalorienaufnahme ungenügend ist, wenn starke körperliche Aktivität kalorienmässig nicht kompensiert wird oder auch bei Alkoholkonsum. Ältere, geschwächte oder unterernährte Patienten und solche mit adrenaler oder pituitärer Insuffizienz oder mit einer Alkoholintoxikation sind gegenüber hypoglykämischen Störungen anfällig. Eine Hypoglykämie kann im Alter und bei Patienten, die β-Blocker einnehmen, schwierig zu erkennen sein.
Sulfonylharnstoffe verursachen bekanntermassen Hypoglykämie. Patienten, die Galvumet in Kombination mit einem Sulfonylharnstoff erhalten, können dem Risiko einer Hypoglykämie ausgesetzt sein. Deshalb kann eine niedrigere Dosierung des Sulfonylharnstoffes erwogen werden, um das Risiko einer Hypoglykämie bei Kombination mit Galvumet zu reduzieren.
Verlust der Blutzuckerkontrolle
Wenn ein Patient unter einer antidiabetischen Therapie, Stress ausgesetzt wird, wie Fieber, Trauma, Infektion, chirurgischer Eingriff usw., kann ein temporärer Verlust der Blutzuckerkontrolle eintreten. In solchen Situationen kann es nötig werden, die Verabreichung von Galvumet auszusetzen und temporär Insulin anzuwenden. Galvumet kann dann nach durchstandener akuter Episode wieder eingesetzt werden.
Interaktionen
Galvumet
Es wurden keine formalen Interaktionsstudien für Galvumet durchgeführt. Die folgenden Stellungnahmen widerspiegeln die Informationen, die für die einzelnen Wirkstoffe erhältlich sind.
Vildagliptin
Studien zu Arzneimittelinteraktionen wurden durchgeführt mit den für Patienten mit Diabetes Typ 2 üblicherweise gleichzeitig verschriebenen Arzneimitteln oder Medikamenten mit schmalem therapeutischem Fenster. Als Resultat dieser Studien wurden keine klinisch relevanten Interaktionen mit anderen oralen Antidiabetika (Glibenclamid, Pioglitazon, Metformin), Amlodipin, Digoxin, Ramipril, Simvastatin, Valsartan oder Warfarin beobachtet.
Metformin
Weitere Interaktionen
Einige Medikamente wie z.B. NSAIDs, einschliesslich selektive Cyclooxygenase (COX) II Hemmer, ACE-Hemmer, Angiotensin II Rezeptor Antagonisten und Diuretika, insbesondere Schleifendiuretika können die Nierenfunktion nachteilig beeinflussen, was das Risiko einer Laktatazidose erhöht. Die gleichzeitige Anwendung solcher Präparate mit Metformin-haltigen Produkten (wie Galvumet) erfordert eine engmaschige Überwachung der Nierenfunktion.
Unter dem Einfluss von sympatholytisch wirkenden Substanzen (z.B. Betablocker, Clonidin, Guanethidin, Reserpin) kann die Wahrnehmung der Warnzeichen einer Hypoglykämie beeinträchtigt sein.
Enzyminduktoren / Enzyminhibitoren
Vildagliptin
Da Vildagliptin CYP 450 Enzyme weder hemmt noch induziert, ist es nicht wahrscheinlich, dass es mit Begleitmedikamenten interagiert, welche über CYP450 metabolisiert werden oder als Inhibitoren oder Induktoren dieser Enzyme wirken.
Wirkung von Galvumet auf andere Arzneimittel
Metformin erniedrigt die Plasmakonzentration von Furosemid (Cmax um 33%, AUC um 12%), und die terminale Halbwertzeit wird um 32% reduziert, ohne Veränderung der renalen Clearance von Furosemid.
Die Wirkung von Phenprocoumon kann verringert werden, da seine Ausscheidung durch Metformin beschleunigt wird.
Interaktionsstudien mit Glibenclamid, Nifedipin, Ibuprofen oder Propranolol ergaben keine klinisch relevanten Effekte auf die pharmakokinetischen Parameter dieser Substanzen.
Wirkung anderer Arzneimittel auf Galvumet
Interaktionen, welche die Wirkung von Metformin beeinflussen
Reduktion der blutzuckersenkenden Wirkung
Glukokortikoide (systemisch und lokal), β2-Sympathomimetica, Diuretika, Phenothiazine (z.B. Chlorpromazin), Schilddrüsenhormone, Östrogene, orale Kontrazeptiva, Hormonersatzpräparate, Phenytoin, Nicotinsäure, Calciumkanalblocker, Isoniazid und Tetracosactid können den Blutzucker erhöhen.
Verstärkung der blutzuckersenkenden Wirkung
Furosemid erhöht die Plasmakonzentration von Metformin (Cmax um 22%, AUC um 15%) ohne signifikante Veränderung der renalen Clearance.
Nifedipin erhöht die Plasmakonzentration von Metformin (Cmax um 20%, AUC um 9-20%) durch Erhöhung der Metformin-Absorption.
Cimetidin erhöht die Cmax von Metformin um 60% und die AUC um 40%. Die Eliminationshalbwertszeit von Metformin wird nicht beeinflusst. Andere Wirkstoffe (Amilorid, Digoxin, Morphin, Procainamid, Chinidin, Chinin, Ranitidin, Triamteren, Trimethoprim oder Vancomycin), welche über aktive renale tubuläre Sekretion eliminiert werden, können potentiell eine Interaktion mit Metformin aufweisen. Patienten, die solche Arzneimittel erhalten, sollten bei der Behandlung mit Metformin-haltigen Produkten (wie Galvumet) deshalb sorgfältig beobachtet werden.
ACE-Hemmer können den Blutzucker reduzieren.
Ebenso kann der Blutzucker durch Betarezeptorenblocker reduziert werden, wobei kardioselektive (β1-selektive) Betablocker solche Wechselwirkungen in sehr viel geringerem Mass zeigen als nicht-kardioselektive.
Die gleichzeitige Anwendung von MAO-Hemmern und oralen Antidiabetika kann die Glukosetoleranz verbessern und den hypoglykämischen Effekt verstärken.
Bei gleichzeitiger Anwendung mit Alkohol kann es zur Verstärkung der blutzuckersenkenden Wirkung von Metformin bis zum hypoglykämischen Koma kommen.
Verstärkung oder Reduktion der blutzuckersenkenden Wirkung von Metformin
H2-Antagonisten, Clonidin und Reserpin können die Wirkung von Metformin verstärken oder abschwächen.
Störungen der Blutzuckerkontrolle (einschliesslich Hyper- oder Hypoglykämie) wurden bei gleichzeitiger Gabe von Chinolonen und Metformin beobachtet.
Interaktionen, welche die Nebenwirkungen von Metformin erhöhen
Diuretika: Infolge einer durch Diuretika (insbesondere Schleifendiuretika) bedingten Nierenfunktionsstörung kann eine Laktatazidose auftreten. Des Weiteren haben Diuretika einen blutzuckersteigernden Effekt.
Iodhaltige Kontrastmittel: Zu Wechselwirkungen mit iodhaltigen Röntgenkontrastmitteln und der Gefahr einer hierdurch ausgelösten Laktatazidose vgl. Rubrik «Warnhinweise und Vorsichtsmassnahmen».
Alkohol: Unter Metformin besteht bei akuter Alkoholintoxikation, insbesondere bei vorherigem Fasten oder beim Vorliegen von Mangelernährung oder Lebefunktionsstörung, ein erhöhtes Risiko für Laktatazidose.
Schwangerschaft/Stillzeit
Schwangerschaft
Es liegen keine hinreichenden Daten für die Anwendung von Galvumet bei Schwangeren vor. Für Vildagliptin haben tierexperimentelle Studien bei hohen Dosen eine Reproduktionstoxizität gezeigt. Für Metformin haben tierexperimentelle Studien keine Reproduktionstoxizität gezeigt. Tierexperimentelle Studien mit Vildagliptin und Metformin zeigten keine Teratogenität, jedoch fetotoxische Effekte in Dosen, die für das Muttertier toxisch waren (s. «Präklinische Daten»). Das potenzielle Risiko für den Menschen ist nicht bekannt. Galvumet sollte nicht während der Schwangerschaft verwendet werden.
Stillzeit
Tierexperimentelle Studien zeigten, dass sowohl Vildagliptin als auch Metformin in die Muttermilch ausgeschieden werden. Es ist nicht bekannt, ob Vildagliptin beim Menschen in die Muttermilch übertritt, allerdings wird Metformin in geringen Dosen in die menschliche Muttermilch sezerniert. Wegen des potenziellen Risikos für eine Hypoglykämie beim Neugeborenen im Zusammenhang mit Metformin und aufgrund fehlender Daten beim Menschen hinsichtlich Vildagliptin sollte Galvumet nicht bei stillenden Frauen angewendet werden (s. «Kontraindikationen»).
Fertilität
Es wurden keine Studien über den Einfluss von Galvumet auf die menschliche Fertilität durchgeführt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine Studien über die Wirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt. Patienten, bei welchen Schwindel auftritt, sollten daher keine Fahrzeuge führen oder Maschinen bedienen.
Unerwünschte Wirkungen
Galvumet
Die dargestellten Daten beziehen sich auf die gleichzeitige Gabe von Vildagliptin und Metformin, als freie oder als fixe Kombination.
Unter Vildagliptin wurden seltene Fälle von Angioödem berichtet, ähnlich der Zahl in der Kontrollgruppe. Über eine grössere Anzahl von Fällen wurde bei gleichzeitiger Gabe von Vildagliptin mit ACE-Hemmern berichtet. Der Grossteil der Ereignisse war schwach ausgeprägt und verschwand mit fortlaufender Vildagliptin-Behandlung.
Es wurden seltene Fälle von Leberfunktionsstörung (einschliesslich Hepatitis) unter Vildagliptin berichtet. In diesen Fällen waren die Patienten im Allgemeinen asymptomatisch, zeigten keine klinischen Folgeerscheinungen und die Leberfunktion normalisierte sich nach Absetzen der Behandlung. In kontrollierten Monotherapie- und Kombinationsstudien mit einer Dauer bis zu 24 Wochen betrug die Inzidenz von ALT- oder AST-Erhöhungen auf das Dreifache der Obergrenze des Normbereichs und darüber hinaus (Nachweis bei mindestens zwei aufeinanderfolgenden Messungen oder bei der letzten Visite während der Behandlung) unter 50 mg Vildagliptin einmal täglich 0.2%, unter Vildagliptin 50 mg zweimal täglich 0.3% und unter allen Vergleichswirkstoffen 0.2%. Diese Erhöhungen der Transaminasen waren im Allgemeinen asymptomatisch, nicht progredient und nicht mit Cholestase oder Gelbsucht assoziiert.
In kontrollierten Studien trat eine Hypoglykämie gelegentlich bei Patienten auf, welche Vildagliptin zusammen mit Metformin erhielten und bei Patienten, welche Placebo und Metformin erhielten. In der Vildagliptin-Gruppe traten keine schweren Fälle von Hypoglykämie auf.
Unerwünschte gastrointestinale Wirkungen inkl. Diarrhöe und Nausea kommen während der Einführungsphase von Metformin sehr häufig vor.
Insgesamt wurde bei 12.9% der Patienten, die gleichzeitig mit Vildagliptin und Metformin behandelt wurden, über gastrointestinale Symptome berichtet; bei Patienten, die Metformin allein erhielten, lag die Rate bei 18.1%.
In kontrollierten Monotherapie-Vergleichsstudien trat Hypoglykämie gelegentlich auf.
Unerwünschte Wirkungen aus Doppelblindstudien, in welchen Patienten Vildagliptin als Monotherapie und als Zusatztherapie bekommen haben, sind untenstehend nach Organklasse und absoluter Frequenz aufgelistet. Häufigkeiten werden definiert als:
«Sehr häufig» (≥1/10); «häufig» (≥1/100, <1/10); «gelegentlich» (≥1/1'000, <1/100); «selten» (≥1/10'000, <1/1'000); «sehr selten» (<1/10'000), nicht bekannt (kann mit den verfügbaren Daten nicht eingeschätzt werden). Innerhalb einer Frequenzgruppe, sind unerwünschte Wirkungen in der Folge abnehmender Bedeutung aufgelistet.
Infektionen
Sehr selten: Infektionen der oberen Atemwege, Nasopharyngitis.
Nervensystem
Häufig: Schwindel, Tremor.
Gelegentlich: Kopfschmerzen.
Gefässe
Gelegentlich: periphere Ödeme.
Gastrointestinale Störungen
Häufig: Übelkeit.
Gelegentlich: Diarrhöe, Obstipation.
Leber
Selten: Transaminasenerhöhung.
Muskel- und Skelettsystem
Gelegentlich: Arthralgie.
Stoffwechsel
Gelegentlich: Hypoglykämie, Gewichtszunahme.
Allgemeine Erkrankungen
Gelegentlich: Asthenie.
Keine der bei der Vildagliptin Monotherapie beobachteten unerwünschte Wirkungen wurde klinisch signifikant häufiger beobachtet, wenn Vildagliptin kombiniert mit Metformin verabreicht wurde.
Metformin
Die bekannten unerwünschten Wirkungen von Metformin sind untenstehend zusammengefasst.
Störungen des Blut- und Lymphsystems
Vereinzelte Fälle von Leukopenie, Thrombopenie und hämolytischer Anämie.
Sehr selten: erniedrigter Vitamin B12 Blutspiegel.
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Appetitverlust.
Sehr selten: Laktatazidose (Inzidenz 3 Fälle/100'000 Patientenjahre, s. «Warnhinweise und Vorsichtsmassnahmen»).
Störungen des Nervensystems
Häufig: Dysgeusie (3%).
Gelegentlich: Müdigkeit.
Gastrointestinale Beschwerden
Häufig bis sehr häufig: Gastrointestinale Störungen (5-15%) wie z.B. Übelkeit, Erbrechen, Diarrhöe, Bauchschmerzen.
Diese Symptome treten meist zu Beginn der Therapie auf und gehen in der Regel spontan zurück.
Funktionsstörungen der Leber und Galle
In Einzelfällen: abnorme Werte in Leberfunktionstests, z.B. erhöhte Transaminasen oder Hepatitis (nach Absetzen von Metformin reversibel)
Funktionsstörungen der Haut und des Unterhautzellgewebes
Sehr selten: Hautreaktionen wie Erythem, Pruritus, Urtikaria
Kombination von Vildagliptin mit Insulin (mit/ohne Metformin)
Die Häufigkeit von Hypoglykämien war in den durchgeführten kontrollierten klinischen Studien in beiden Behandlungsgruppen ähnlich (14.0% der Patienten unter Vildagliptin versus 16.4 % der Patienten unter Placebo). Schwere Hypoglykämien ereigneten sich bei n=2 Patienten unter Vildagliptin versus n=6 unter Placebo. Der Einfluss auf das mittlere Gewicht war in beiden Behandlungsgruppen insgesamt gering (+ 0.6 kg unter Vildagliptin versus +/‑ 0 kg unter Placebo).
Unerwünschte Wirkungen unter Vildagliptin, die bei diesen Studien auftraten, waren:
Nervensystem
Häufig: Kopfschmerzen.
Gastrointestinaltrakt
Häufig: Übelkeit, gastroösophageale Refluxkrankheit.
Gelegentlich: Diarrhöe, Flatulenz.
Allgemeine Störungen
Häufig: Schüttelfrost.
Untersuchungen
Häufig: Blutzucker erniedrigt.
Studienabbrüche auf Grund dieser unerwünschten Wirkungen waren insgesamt selten.
Kombination mit einem Sulfonylharnstoff
Hypoglykämie war bei beiden Behandlungsgruppen häufig (5.1% für Vildagliptin + Metformin + Glimepirid vs. 1.9 % für Placebo + Metformin + Glimepirid). Über ein schweres Ereignis von Hypoglykämie wurde in der Vildagliptin-Gruppe berichtet. Am Ende der Studie war die Auswirkung auf das mittlere Körpergewicht gering (+ 0.6 kg bei der Vildagliptin-Gruppe und 0.1 kg bei der Placebo-Gruppe).
Unerwünschte Wirkungen bei Patienten, die Galvus 50 mg zweimal täglich in Kombination mit Metformin und einem Sulfonylharnstoff (n=157) einnahmen:
Stoffwechsel und Ernährungsstörungen
Häufig: Hypoglykämie.
Nervensystem
Häufig: Schwindelgefühl, Tremor.
Haut:
Häufig: Hyperhidrosis.
Allgemeine Störungen
Häufig: Asthenie.
Unerwünschte Wirkungen nach Markteinführung
Galvumet
Die dargestellten Daten beziehen sich auf die gleichzeitige Gabe von Vildagliptin und Metformin, als freie oder als fixe Kombination.
Über die folgenden unerwünschten Arzneimittelreaktionen wurde von Erfahrungen nach der Markteinführung via Spontanberichte und Literatur berichtet. Da diese Reaktionen freiwillig von einer Population unbekannter Grösse gemeldet werden, ist es nicht möglich ihre Häufigkeit zuverlässig zu schätzen. Die Häufigkeit wird daher als «nicht bekannt» kategorisiert.
- Hepatitis, die nach dem Absetzen von Galvumet wieder verschwand (s. «Warnhinweise und Vorsichtsmassnahmen»).
- Urtikaria, bullöse Exantheme, lokale Hautexfoliationen und Bläschenbildung auf der Haut, einschliesslich bullöses Pemphigoid.
- Pankreatitis.
- Rhabdomyolyse (Beobachtung aus dem Postmarketing. Häufigkeit unbekannt).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Anzeichen und Symptome
Vildagliptin
In klinischen Studien waren Ödeme und Muskelschmerzen dosislimitierend. Bei 600 mg erlitt eine Versuchsperson Ödeme an Händen und Füssen sowie einen übermässigen Anstieg der Kreatinphosphokinase (CPK), begleitet von erhöhten Werten der Aspartataminotransferase (AST), des C-reaktiven Proteins und von Myoglobin. Drei weitere Versuchspersonen in dieser Dosis-Gruppe erlitten Ödeme an beiden Füssen, in zwei Fällen begleitet von einer Parästhesie. Alle Symptome und Laborwerte normalisierten sich nach Absetzen des Studienmedikamentes.
Metformin
Auch bei Einnahme extrem hoher Metformin-Dosen (bis 85 g) wurden keine Hypoglykämien beobachtet, jedoch trat unter diesen Umständen eine Laktatazidose auf. Laktatazidose ist ein medizinischer Notfall und bedingt die Hospitalisation des Patienten (s. «Warnhinweise und Vorsichtsmassnahmen»).
Behandlung
Vildagliptin
Bei Überdosierung soll das Arzneimittel abgesetzt und der Patient symptomatisch und unterstützend behandelt werden.
Vildagliptin ist nicht dialysierbar; der Haupt-Hydrolysemetabolit kann durch Hämodialyse entfernt werden.
Metformin
Sowohl Laktat als auch Metformin werden durch Hämodialyse eliminiert.
Eigenschaften/Wirkungen
ATC-Code
A10BD08
Wirkungsmechanismus
Galvumet
Galvumet kombiniert zwei blutzuckersenkende Wirkstoffe mit verschiedenen Wirkungsmechanismen, um die Blutzuckerkontrolle bei Patienten mit Diabetes Typ 2 zu verbessern: Vildagliptin ist ein DPP-4(dipeptyl-peptidase-4)-Inhibitor und Metformin gehört zur Klasse der Biguanide.
Vildagliptin
Die Verabreichung von Vildagliptin bewirkt eine Hemmung der DPP-4-Aktivität, was zu nüchtern und postprandial erhöhten endogenen Spiegeln der Inkretinhormone GLP-1 (glukagonartiges Peptid-1) und GIP (glukoseabhängiges insulinotropes Polypeptid) führt.
Metformin
Metformin ist ein orales Antidiabetikum, welches zur Klasse der Biguanide gehört. Die blutzuckersenkende Wirkung von Metformin beruht primär auf einem die Insulinresistenz durchbrechenden Effekt in Leber und Muskel.
Pharmakodynamik
Vildagliptin
Durch Erhöhung der endogenen Spiegel dieser Inkretinhormone verstärkt Vildagliptin die Empfindlichkeit der Betazellen gegenüber Glukose, was zu einer verbesserten glukoseabhängigen Insulinsekretion führt. Die Behandlung mit täglich 50-100 mg Vildagliptin führte bei Patienten mit Typ-2-Diabetes zu einer signifikanten Verbesserung der Betazellenfunktionsmarker, einschliesslich des HOMA-β (Homeostasis Model Assessment–β), des Proinsulin/Insulin-Verhältnisses und der Messgrössen für die Betazellenempfindlichkeit des oft angewendeten Mahlzeiten-Toleranztests. Bei nicht-diabetischen (normoglykämischen) Personen führt Vildagliptin weder zu einer Stimulation der Insulinsekretion noch zu einer Reduktion der Glukosespiegel.
Durch Erhöhung der endogenen GLP-1-Spiegel verstärkt Vildagliptin die Empfindlichkeit der Alphazellen gegenüber Glukose, was zu einer besser an die Glukosespiegel angepassten Glukagon-Freisetzung führt.
Der verstärkte Anstieg des Insulin/Glukagon-Verhältnisses während der Hyperglykämie infolge erhöhter Inkretinhormonspiegel bewirkt eine Abnahme der hepatischen Glukoseproduktion nüchtern und postprandial, was zu einer reduzierten Glykämie führt.
Der bekannte Effekt einer Verzögerung der Magenentleerung bei erhöhten GLP-1-Spiegeln wird unter der Behandlung mit Vildagliptin nicht beobachtet.
Metformin
Es senkt in Gegenwart von Insulin sowohl den basalen als auch den postprandialen Plasma-Glukosespiegel. Metformin hat keine stimulierende Wirkung auf die Insulinsekretion und löst bei alleiniger Anwendung keine Hypoglykämie aus.
Die blutzuckersenkende Wirkung beruht auf drei Mechanismen:
In der Leber
Im nüchternen Zustand ist die hepatische Glukoseproduktion zum grossen Teil für Hyperglykämien verantwortlich. Metformin reduziert die durch Insulinresistenz aktivierte hepatische Glukoseproduktion, in dem es die Glukoneogenese und Glykogenolyse inhibiert, was gleichzeitig der blutzuckersteigernden Wirkung von Glucagon entgegenwirkt. Durch diesen Mechanismus reduziert Metformin die Nüchtern-Hyperglykämie.
Im Muskel
Störungen der peripheren Glukoseaufnahme und -speicherung sind für die postprandiale Hyperglykämie hauptverantwortlich. Metformin erhöht die zelluläre Sensibilität für Insulin durch Stimulierung der Tyrosinkinase-Aktivität des Insulinrezeptors und begünstigt so die zelluläre Glukoseaufnahme. Metformin erhöht die Kapazität aller Glukosetransport-Mechanismen der Zellmembran (GLUT). Dieser Effekt von Metformin ist bei hyperglykämischen Zuständen besonders deutlich. Durch Stimulation des Schlüsselenzyms Glykogensynthetase wird die intrazelluläre Glykogensynthese erhöht. Durch diese Mechanismen reduziert Metformin die postprandiale Hyperglykämie.
Im Darm
Metformin verzögert die intestinale Glukoseaufnahme, was die postprandiale Glukosebelastung reduziert.
Wirkungen auf den Lipidstoffwechsel und die Fibrinolyse
Ausserdem hat Metformin beim Menschen, unabhängig von seiner Wirkung auf den Blutzucker, einen positiven Effekt auf den Lipidstoffwechsel. In kontrollierten klinischen Mittel- und Langzeitstudien konnte nachgewiesen werden, dass Metformin in therapeutischer Dosierung die Spiegel für Gesamt- und LDL-Cholesterin sowie Triglyceride senkt. Zudem konnte in einigen Studien gezeigt werden, dass Metformin den HDL-Cholesterin-Spiegel erhöhen kann.
Ausserdem besitzt Metformin fibrinolytische Eigenschaften.
Klinische Wirksamkeit
Galvumet
Es gibt keine Studien über die klinische Wirksamkeit von Galvumet. Die Wirksamkeit und Sicherheit der einzelnen Komponenten sind bereits vorher nachgewiesen worden. Die kombinierte Verabreichung beider Komponenten wurde in zwei klinischen Studien auf ihre Wirksamkeit und Sicherheit hin untersucht. Diese beiden Studien bewiesen einen zusätzlichen Nutzen für Vildagliptin bei Patienten mit inadäquat kontrolliertem Diabetes Typ 2, die mit Metformin behandelt worden waren.
In einer 24 Wochen dauernden, doppel-blinden und placebo-kontrollierten Studie bei Patienten mit Diabetes Typ 2, deren Glykämie unter einer Metformin-Monotherapie mit Dosen von ≥2'000 mg ungenügend eingestellt war, zeigte Vildagliptin kombiniert mit Metformin eine statistisch signifikant grössere Senkung des HbA1c gegenüber der Gruppe mit Metformin und Placebo (der Unterschied betrug im Mittel -0.7% in der Gruppe mit 50 mg 1x täglich Vildagliptin und -1.1% in jener mit 50 mg 2x täglich Vildagliptin).
Die Wirksamkeit von Vildagliptin kombiniert mit Metformin 1'000 mg wurde in einer weiteren doppel-blinden und placebo-kontrollierten klinischen Studie über insgesamt 52 Wochen untersucht (12 Wochen Kernstudie (n=132), dann erweitert über 40 Wochen (n=71)). Die Zugabe von Vildagliptin (50 mg einmal täglich) zum Metformin führte am Ende der ersten 12 Wochen der Studie (mittlerer HbA1c-Ausgangswert von 7.7% respektive 7.9%) zu einer zusätzlichen und statistisch signifikanten Verminderung des mittleren HbA1c -Wertes gegenüber dem Ausgangswert (0.55%) im Vergleich zur Gruppe mit Metformin und Placebo (+0.1%). Nach 52 Wochen war die mittlere Abweichung vom Ausgangswert des HbA1c statistisch signifikant grösser und ausgeprägter in der Gruppe mit Vildagliptin (50 mg) kombiniert mit Metformin gegenüber jener Gruppe mit der Monotherapie mit Metformin (der Unterschied der Gruppen betrug -1.1%).
In einer 24-wöchigen Studie wurde bei Patienten, deren Blutzucker unter Metformin ungenügend eingestellt war, Vildagliptin 50 mg 2x/d mit Pioglitazon 30 mg 1x/d verglichen. Gegenüber dem Ausgangswert von 8.4% HbA1c betrug die mittlere Senkung zusätzlich zu Metformin 0.9% unter Vildagliptin und 1.0% unter Pioglitazon. Bei einem HbA1c-Ausgangswert > 9.0% war die Abnahme in beiden Behandlungsgruppen grösser, nämlich 1.5%. Bei Patienten, die Pioglitazon zusätzlich zu Metformin erhielten, nahm das Gewicht um 1.9 kg zu und bei denjenigen die Vildagliptin zusätzlich zu Metformin erhielten, betrug die Zunahme 0.3 kg. In einer bis zu zwei Jahre dauernden Langzeitstudie wurde Vildagliptin 50 mg 2x/d mit Glimepirid bis zu 6 mg 1x/d bei Patienten unter Behandlung mit Metformin verglichen. Nach 2 Jahren hatte das HbA1c im Durchschnitt unter der Kombination Vildagliptin/Metformin um 0.06% und unter Glimepirid/Metformin um 0.14% abgenommen. Die Änderung des Körpergewichts betrug unter Vildagliptin – 0.2 kg und unter Glimepirid + 1.2 kg. Die Inzidenz hypoglykämischer Episoden war in der Gruppe mit Vildagliptin signifikant geringer (2.3%) als in derjenigen mit Glimepirid (18.2%).
In einer 52-wöchigen Studie wurde bei Patienten, deren Blutzucker unter Metformin ungenügend eingestellt war, Vildagliptin 50 mg 2x/d zusätzlich zu Metformin mit Gliclazid mit einer Dosis bis zu 320 mg/d zusätzlich zu Metformin verglichen. Nach einem Jahr hatte das HbA1c im Durchschnitt unter der Kombination Vildagliptin/Metformin um 0.81% (HbA1c-Ausgangswert 8.4%) und unter Gliclazid/Metformin um 0.85% (HbA1c-Ausgangswert 8.5%) abgenommen; statistisch wurde Nicht-Unterlegenheit demonstriert. Bei Patienten, die Gliclazid zusätzlich zu Metformin erhielten, nahm das Gewicht um 1.4 kg zu und bei denjenigen, die Vildagliptin zusätzlich zu Metformin erhielten, betrug die Zunahme 0.1 kg. Je fünf Patienten (1.0%) in beiden Gruppen hatten mindestens eine hypoglykämische Episode.
In einer Studie über 24 Wochen wurde die Wirksamkeit der Fixdosis-Kombination von Vildagliptin und Metformin (schrittweise titriert auf eine Dosis von 50 mg/500 mg zweimal täglich oder 50 mg/1000 mg zweimal täglich) als Anfangstherapie bei Wirkstoff-naiven Patienten evaluiert. Der durchschnittliche Ausgangswert des HbA1c von 8,6% wurde durch die zweimal tägliche Gabe von 50 mg/1000 mg Vildagliptin/Metformin um -1,82%, durch zweimal täglich 50 mg/500 mg Vildagliptin/Metformin um -1,61%, durch zweimal täglich 1000 mg Metformin um -1,36% und durch zweimal täglich 50 mg Vildagliptin um -1,09% gesenkt. Die Abnahme des HbA1c bei Patienten mit einem mittleren Ausgangswert von ≥10% war höher.
In einer 24-wöchigen, randomisierten, doppelblinden, placebokontrollierten Studie mit 449 Patienten wurde die Wirksamkeit und Sicherheit von Vildagliptin (50 mg zweimal täglich) in Kombination mit einer stabilen Dosis Basis-Insulin oder vorgemischtem Insulin (mittlere tägliche Dosis 41 U) mit oder ohne Metformin untersucht. Vildagliptin in Kombination mit Insulin verringerte signifikant den HbA1c-Wert im Vergleich zu Placebo: In der Gesamtpopulation betrug die placebo-adjustierte Reduktion bei einem mittleren HbA1c-Ausgangswert von 8,8% -0,72%. In den Untergruppen mit Insulin mit bzw. ohne zusätzliches Metformin betrug die placebo-adjustierte, mittlere HbA1c-Reduktion -0,63 bzw. -0,84%. Hypoglykämien traten bei 8,4% bzw. 7,2% bei mit Vildagliptin bzw. Placebo behandelten Patienten auf. Das mittlere Gewicht der Patienten zeigte insgesamt wenig Veränderungen (+0,2 kg unter Vildagliptin bzw. -0,7 kg unter Placebo).
In einer 24-wöchigen, randomisierten, doppelblinden, placebokontrollierten Studie mit 318 Patienten wurde die Wirksamkeit und Sicherheit von Vildagliptin (50 mg zweimal täglich) in Kombination mit Metformin (≥1500 mg täglich) und Glimepirid (≥4 mg täglich) untersucht. Vildagliptin in Kombination mit Metformin und Glimepirid verringerte signifikant den HbA1c-Wert im Vergleich zu Placebo: die placebo-adjustierte mittlere Reduktion bei einem mittleren HbA1c-Ausgangswert von 8,8% war -0,76%.
Vildagliptin
Es wurden zwei 24-wöchige doppelblinde, plazebokontrollierte Studien mit behandlungsnaiven Patienten mit Typ-2-Diabetes durchgeführt. Diese Studien ergaben für einmal täglich verabreichte 50 mg Vildagliptin statistisch signifikante mittlere Veränderungen des HbA1c gegenüber dem Ausgangswert (-0.8% bzw. -0.5%) und gegenüber Plazebo.
Darüber hinaus wurde die Vildagliptin Monotherapie bei behandlungsnaiven Patienten in mehreren Studien mit Metformin, Rosiglitazon oder Pioglitazon verglichen. Die Patienten litten seit durchschnittlich zwei Jahren an Diabetes. In diesen Studien zeigte Vildagliptin eine klinisch relevante Reduktion des HbA1c gegenüber dem Ausgangswert. Für Rosiglitazon wurde die Noninferiorität statistisch belegt, nicht aber für Metformin und Pioglitazon.
In einer zweijährigen Langzeitstudie wurde Vildagliptin 50 mg 2x/d mit Gliclazid bis zu 320 mg /d verglichen. Nach zwei Jahren hatte das HbA1c im Durchschnitt unter Vildagliptin um 0,5% und unter Gliclazid um 0.6% abgenommen. Unter Vildagliptin zeigten sich eine geringere Zunahme des Körpergewichts (0,75 kg) und weniger hypoglykämische Episoden (0.7%) als unter Gliclazid (1.6 kg bzw. 1.7%).
Eine 52-wöchige, multizentrische, randomisierte doppelblinde Studie wurde bei Patienten mit Diabetes mellitus Typ 2 und kongestiver Herzinsuffizienz (NYHA I-III) durchgeführt, um den Effekt von Vildagliptin 50 mg 2x/Tag (N=128) im Vergleich zu Placebo (N=126) auf die linksventrikuläre Ejektionsfraktion (LVEF) zu bestimmen. Vildagliptin war nicht mit einer Änderung der linksventrikulären Ejektionsfraktion oder einer Verschlechterung von vorbestehender kongestiver Herzinsuffizienz assoziiert. Die Inzidenz kardiovaskulärer Ereignisse während der Studie war insgesamt ausgeglichen zwischen dem Vildagliptin-Arm und dem Placebo-Arm. In der Untergruppe mit NYHA III war die Inzidenz kardiovaskulärer Nebenwirkungen unter Vildagliptin höher als unter Placebo (31.9% vs. 21.3%). Die Unterschiede waren vor allem bedingt durch eine höhere Rate an VHF und an akutem Koronarsyndrom. Bei der Wertung dieser Unterschiede ist zu berücksichtigen, dass es ein Ungleichgewicht bei den kardiovaskulären Risikofaktoren zu Gunsten von Placebo gab und dass die Anzahl kardiovaskulärer Ereignisse gering war. Deshalb kann aus diesen Daten nicht mit ausreichender Sicherheit auf ein höheres Risiko bei NYHA-III Patienten geschlossen werden. Bezüglich Wirksamkeit gab es keine Unterschiede.
Kardiovaskuläres Risiko
Eine Metaanalyse über 37 klinischen Phase-III- und Phase IV-Studien (Behandlungsdauer 2 Wochen bis ≥2 Jahre) zeigte keinen klinisch relevanten Unterschied im kardiovaskulären Risiko zwischen Vildagliptin (als Mono- oder Kombinationstherapie; N=9599) und den Komparatoren (aktive Wirkstoffe oder Placebo; N=7102): die Punktschätzung für das Risikoverhältnis Vildagliptin versus Komparatoren für den kombinierte Endpunkt schwerwiegendes unerwünschtes kardiovaskuläres Ereignis (MACE: kardiovaskulärer Tod, nicht-tödlicher Myokardinfarkt, nicht-tödlicher Schlaganfall) war 0.82 [95%-Konfidenzintervall 0.61-1.1]. Die Ergebnisse der Punktschätzung für das Risikoverhältnis der individuellen MACE Komponenten stimmten damit überein.
Die Kombinationsstudien mit Metformin sind oben beschrieben.
Metformin
Die prospektive und randomisierte Studie (UKPDS / UK Prospective Diabetes Study) hat den langzeitlichen Nutzen einer intensiven Blutzuckerkontrolle bei Patienten mit Diabetes Typ 2 nachgewiesen. Die Analyse der Resultate bei mit Metformin behandelten übergewichtigen Patienten, bei denen die alleinige Diättherapie versagt hatte, zeigte:
- eine signifikante Verminderung des absoluten Risikos bei den Diabetes-bedingten Komplikation in der Metformin-Gruppe (29.8 Ereignisse/1'000 Patienten-Jahre) vs. Diät allein (43.3 Ereignisse/1'000 Patienten-Jahre) p=0.0023 und vs. in den Gruppen mit kombiniertem Sulphonylharnstoff (SU) und Insulin Monotherapiegruppen (40.1 Ereignisse/1'000 Patienten-Jahre) p=0.0034
- eine signifikante Verminderung des absoluten Risiko der Diabetes-bedingten Mortalitätsrate: bei Metformin 7.5 Ereignisse/1'000 Patientenjahre, mit Diät allein 12.7 Ereignisse/1'000 Patientenjahre (p=0.017)
- eine signifikante Verminderung des absoluten Risiko der Gesamtmortalität: bei Metformin 13.5 Ereignisse/1'000 Patientenjahre vs. Diät allein 20.6 Ereignisse/1'000 Patientenjahre (p=0.011), und vs. die Gruppen mit SU kombiniert und Insulin Monotherapie 18.9 Ereignisse/1'000 Patientenjahre (p=0.021)
- eine signifikante Verminderung des absoluten Risikos eines Myokardinfarktes: bei Metformin 11 Ereignisse/1000 Patientenjahre, vs. Diät allein 18 Ereignisse/1'000 Patientenjahre (p=0.01)
Pharmakokinetik
Absorption
Galvumet
In Bioäquivalenzstudien mit Galvumet mit drei Dosierungen (50 mg/500 mg, 50 mg/850 mg und 50 mg/1'000 mg) vs. die freie Kombination von Vildagliptin und Metformin in den entsprechenden Dosierungen wurde nachgewiesen, dass die Bioverfügbarkeit sowohl von Vildagliptin als auch von Metformin gleich waren.
Nahrung beeinflusst weder das Ausmass noch die Geschwindigkeit der Aufnahme von Vildagliptin. Die Cmax und die AUC von Metformin verringerten sich um 26% bzw. 7% bei Verabreichung zusammen mit der Nahrung, die Resorption von Metformin wurde verzögert (Tmax, 2.0 bis 4.0 h). Diese Veränderungen der Cmax und der AUC sind konsistent, aber geringer als jene, die beobachtet wurden, wenn Metformin bei Nahrungszufuhr allein verabreicht wurde. Die Wirkungen durch die Nahrung auf die Pharmakokinetik beider Komponenten des Galvumet, das Vildagliptin und das Metformin, waren ähnlich wie diejenigen, wenn Vildagliptin und Metformin einzeln mit der Nahrung verabreicht wurden.
Vildagliptin
Vildagliptin wird rasch resorbiert, mit einer oralen Bioverfügbarkeit von 85%. Die maximale Plasmakonzentration wird nach ca. 1 h erreicht. Die Absorption wird nicht relevant durch Aufnahme von Nahrung beeinflusst. Die Nahrungsaufnahme beeinflusst die Gesamtexposition (AUC) nicht.
Metformin
Nach oraler Applikation beträgt die Tmax 2.5 h, die Absorption ist nach 6 h abgeschlossen. Es wird angenommen, dass die Absorption primär im oberen Gastrointestinaltrakt stattfindet. Die absolute Bioverfügbarkeit bei einer Dosis von 500 mg oder 850 mg beträgt beim Gesunden ca. 50-60%. Nach oraler Einnahme einer Einzeldosis von 500-2'500 mg wurde ein unterproportionaler Anstieg der Cmax beobachtet, was möglicherweise auf einem sättigbaren Mechanismus beruht. Bei Verwendung üblicher Metformin-Dosierungen werden im Plasma innerhalb von 24-48 h steady-state-Spiegel erreicht. Diese sind i.d.R. geringer als 1 µg/ml. In kontrollierten klinischen Studien wurde festgestellt, dass Cmax, auch bei Verwendung von Maximaldosen, 4 µg/ml nicht übersteigt.
Nahrung verringert und verzögert die Absorption von Metformin. Bei Einnahme einer Dosis von 850 mg mit Nahrung wurde eine um 40% tiefere Cmax, eine um 25% verminderte AUC und eine um 35 Min verlängerte Tmax beobachtet. Die klinische Relevanz dieser Veränderungen ist bislang noch unbekannt.
Distribution
Vildagliptin
Vildagliptin wird nur wenig an Plasmaproteine gebunden (9.3%) und verteilt sich gleichmässig zwischen Plasma und roten Blutkörperchen. Das mittlere Verteilungsvolumen von Vildagliptin beträgt im Steady-state nach intravenöser Verabreichung (Vss) 71 l.
Metformin
Die Plasmaproteinbindung von Metformin ist vernachlässigbar. Metformin diffundiert zum Teil in die Erythrozyten. Die maximale Blutkonzentration ist geringer als die maximale Plasmakonzentration und wird ungefähr gleichzeitig erreicht. Die Erythrozyten repräsentieren wahrscheinlich ein sekundäres Verteilungskompartiment.
Das durchschnittliche Verteilungsvolumen beträgt 63-276 l.
Es ist nicht bekannt, ob Metformin die Plazentaschranke passiert und ob es in die Muttermilch gelangt. Bei der Ratte gelangen geringe Mengen in die Muttermilch.
Metabolismus
Vildagliptin
Vildagliptin wird weitgehend (69% der Dosis) metabolisiert, teilweise durch DPP-4. Der durch Hydrolyse gebildete Hauptmetabolit LAY151 (57% der Dosis) ist inaktiv. Weiter gibt es ein Amid-Hydrolyseprodukt (4% der Dosis). Vildagliptin wird nicht über Cytochrom P450 Enzyme metabolisiert.
Metformin
Metformin wird beim Menschen nicht metabolisiert.
Elimination
Vildagliptin
85% der Dosis werden in den Urin ausgeschieden und 15% der Dosis finden sich in den Fäces. Unverändertes Vildagliptin macht 23% der Dosis aus. Die Eliminationshalbwertszeit beträgt ca. 3 h.
Metformin
Metformin wird unverändert im Urin ausgeschieden. Die renale Clearance beträgt >400 ml/min und ist somit etwa 3.5-fach höher als die Kreatinin-Clearance. Überwiegend wird es also durch aktive tubuläre Sekretion eliminiert. Die Plasmaeliminationshalbwertszeit nach oraler Verabreichung beträgt annähernd 6.5 h. Gemessen im Vollblut beträgt die Halbwertzeit etwa 17.6 h.
Bei normaler Nierenfunktion akkumuliert Metformin bei üblicher Dosierung (1'500-2'000 mg) nicht im Organismus.
Kinetik spezieller Patientengruppen
Geschlecht
Vildagliptin
Es sind keine Unterschiede in der Pharmakokinetik von Vildagliptin zwischen Männern und Frauen beobachtet worden.
Leberfunktionsstörungen
Vildagliptin
Die Exposition gegenüber Vildagliptin (100 mg) nach einer Einzeldosis von 100 mg war bei leichter und moderater Leberinsuffizienz nicht erhöht, bei schwerer Leberinsuffizienz um 22% (obere Grenze des CI 68%) erhöht.
Nierenfunktionsstörungen
Vildagliptin
Verglichen mit gesunden Probanden war die AUC von Vildagliptin in einer pharmakokinetischen Studie bei Patienten mit leichter (Kreatinin-Clearance [CrCl] 50 bis <80 ml/min), mittelschwerer (CrCl 30 bis <50 ml/min) bzw. schwerer (CrCl <30 ml/min) Nierenfunktionsstörung im Durchschnitt um das 1.4-, 1.7- bzw. 2-fache vergrössert. Die AUC des Metaboliten LAY151 vergrösserte sich um das 1.6-, 3.2- bzw. 7.3-fache und diejenige des Metaboliten BQS867 vergrösserte sich um das 1.4-, 2.7- und 7.3-fache bei Patienten mit leichter, mittelschwerer bzw. schwerer Nierenfunktionsstörung. Begrenzte Daten von Patienten mit einer Nierenerkrankung im Endstadium (ESRD) weisen darauf hin, dass die Vildagliptin-Exposition ähnlich hoch ist wie bei Patienten mit schwerer Beeinträchtigung der Nierenfunktion. Die AUC von LAY151 bei ESRD-Patienten war 6.8-fach höher als bei Patienten mit normaler Nierenfunktion.
Vildagliptin wurde durch Hämodialyse in begrenztem Ausmass entfernt (3% durch eine 3- bis 4‑stündige Hämodialyse, die 4 Stunden nach Verabreichung begann).
Metformin
Bei Patienten mit eingeschränkter Nierenfunktion ist die renale Clearance proportional zur Kreatinin-Clearance vermindert bzw. die Eliminationshalbwertszeit verlängert und es besteht ein Akkumulationsrisiko.
Ältere Patienten
Vildagliptin
Bei Patienten über 70 Jahren sind die Plasmakonzentrationen erhöht. Die Veränderung in der Exposition gegenüber Vildagliptin ist jedoch klinisch nicht relevant.
Präklinische Daten
An Tieren wurden Studien bis zu 13 Wochen mit den kombinierten Wirkstoffen des Galvumet durchgeführt. Es wurden keine neuen Toxizitäten in Verbindung mit der Kombination gefunden. Die folgenden Daten sind Ergebnisse aus Studien, die mit Vildagliptin oder Metformin einzeln durchgeführt worden sind.
Vildagliptin
In einer Verteilungsstudie an Ratten wurden in der Niere und der Leber 10-30 mal höhere Konzentrationen im Gewebe als im Plasma gemessen.
Bei In-vitro-Konzentrationen und bei In-vivo-Plasmakonzentrationen im Hund, welche deutlich über den auf Cmax beruhenden Expositionswerten im Menschen bei 50 mg Vildagliptin lagen (80-260-fach bei den In-vitro-Befunden und 43-fach bei den In-vivo-Befunden), wurde eine Inhibitionswirkung auf die kardialen Natriumkanäle, eine verringerte Depolarisationsrate von Purkinjefasern, eine verlangsamte Leitung in isolierten Kaninchenherzen und eine QRS-Verbreiterung im EKG von Hunden beobachtet.
Metformin
Daten aus präklinischen Studien, basierend auf Studien der pharmakologischen Sicherheit, Toxizität nach wiederholter Gabe, Genotoxizität, Karzinogenität und Reproduktionstoxizität, haben keine Hinweise auf besondere Risiken für die Anwendung am Menschen ergeben.
Langzeittoxizität (bzw. Toxizität bei wiederholter Verabreichung)
Vildagliptin
Bei Ratten wurde eine Karzinogenitätsstudie über 2 Jahre mit oralen Dosen bis zu 900mg/kg (ungefähr 370 mal die humane AUC-Exposition bei 50 mg) durchgeführt. Es wurde keine Zunahme der Tumorinzidenz aufgrund von Vildagliptin beobachtet. Eine zweijährige Karzinogenitätsstudie mit oralen Dosen bis zu 1'000 mg/kg (bis zu 420 mal die humane AUC-Exposition bei der Dosierung von 50 mg) wurde bei Mäusen durchgeführt. Die Inzidenz von Mammatumoren bei weiblichen Mäusen war unter einer ungefähr 260-fach höheren Dosis als die Humandosis von 50 mg Vildagliptin erhöht; bei ungefähr der 100-fachen Humanexposition waren Mammatumoren nicht häufiger. Die Inzidenz von Hämangiosarkomen war bei männlichen Mäusen unter AUC-Expositionsspiegeln von ≥74 mal die Humandosis von 50 mg Vildagliptin und bei weiblichen Mäusen, die ungefähr dem 260-fachen der Humanexposition ausgesetzt waren, erhöht. Keine signifikante Zunahme der Inzidenz von Hämangiosarkomen wurde bei der ungefähr 27-fachen Humanexposition von Vildagliptin bei Männchen und bei der ungefähr 100-fachen Humanexposition bei Weibchen beobachtet.
Vildagliptin erwies sich in einer Reihe von Mutagenitätstests wie dem bakteriellen Rückmutations-Amestest und einem humanen Lymphozyten-Chromosomenaberrationstest als nicht mutagen. Ein oraler Knochenmark-Mikronukleustest bei Ratten und Mäusen zeigte kein klastogenes oder aneugenes Potential bei bis zu 2'000 mg/kg oder dem ca. 2'000-Fachen der Humandosis. Ein in-vivo Mausleber-Kometenassay mit der gleichen Dosierung war ebenfalls negativ.
In einer 13-wöchigen Toxizitätsstudie an Cynomolgus-Affen, wurden bei ≥5 mg/kg/d-Dosen Hautläsionen registriert. Diese Läsionen waren auf die Extremitäten (Hände, Füsse, Ohren und Schwanz) beschränkt.
Bei 5 mg/kg/d (einer AUC Exposition, die leicht über der humanen Exposition bei der 50-mg-Dosierung liegt) wurden nur Blasen beobachtet. Diese waren reversibel trotz kontinuierlicher Behandlung und wurden nicht mit histopathologischen Abnormalitäten verbunden.
Hautabschuppungen und –abblätterungen sowie Schorfbildung und Schwanzwunden in Verbindung mit histopathologischen Veränderungen wurden bei Dosen über 20 mg/kg/d (entspricht etwa der 5-fachen humanen AUC Exposition bei 50 mg Dose) beobachtet.
Nekrotische Läsionen des Schwanzes wurden bei ≥80 mg/kg/d beobachtet.
Hautläsionen waren reversibel (bis mindestens 80 mg/kg), wenn die Behandlung vor dem Erscheinen von Nekrosen gestoppt wurde.
Hautläsionen wurden weder beim Menschen noch bei einer anderen Spezies, welche mit Vildagliptin behandelt wurden beobachtet.
Mutagenität
Metformin
Alle Untersuchungsergebnisse (Ames-Test, Genmutationstest, Chromosomenaberrationstest, Mikronucleustest) zeigten, dass Metformin keine mutagene oder clastogene Wirkung hat.
Karzinogenität
Metformin
Metformin ist bei Nagern in Dosierungen von bis zu 900 mg/kg/Tag (Ratte) bzw. 1'500 mg/kg/Tag (Maus) nicht karzinogen.
Reproduktionstoxizität
Metformin
Metformin hat keinen Einfluss auf die Fertilität, zeigt keine teratogene Wirkung und beeinflusst die Entwicklung des Neugeborenen nicht.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Nicht über 30°C und vor Feuchtigkeit geschützt in der Originalpackung aufbewahren.
Galvumet sollte für Kinder unerreichbar aufbewahrt werden.
Zulassungsnummer
58451 (Swissmedic)
Zulassungsinhaberin
Novartis Pharma Schweiz AG, Risch; Domizil: 6343 Rotkreuz
Stand der Information
September 2020
Composizione
Principi attivi
Vildagliptin e clorinato di metformina
Sostanze ausiliarie
50/500 mg: idrossipropilcellulosa, stearato di magnesio, ipromellosa, biossido di titanio, ossido di ferro giallo, ossido di ferro rosso, macrogol 4000, talco.
50/850 mg: idrossipropilcellulosa, stearato di magnesio, ipromellosa, biossido di titanio, ossido di ferro giallo, macrogol 4000, talco.
50/1000 mg: idrossipropilcellulosa, stearato di magnesio, ipromellosa, biossido di titanio, ossido di ferro giallo, macrogol 4000, talco.
Forma farmaceutica e quantità di principio attivo per unità
Compresse rivestite con film da
- 50 mg di vildagliptin e 500 mg di cloridrato di metformina oppure
- 50 mg di vildagliptin e 850 mg di cloridrato di metformina oppure
- 50 mg di vildagliptin e 1000 mg di cloridrato di metformina oppure
50 mg/500 mg: compressa giallo chiaro, bordi ovali, smussati rivestita con film; con impresso da un lato «NVR» e «LLO» dall'altro.
50 mg/850 mg: compressa gialla, bordi ovali, smussati rivestita con film; con impresso da un lato «NVR» e «SEH» dall'altro.
50 mg/1000 mg: giallo scuro, bordi smussati, compressa rivestita con film; con impresso da un lato «NVR» e dall'altro «FLO».
Indicazioni/Possibilità d'impiego
Pazienti con diabete mellito tipo 2 (T2DM):
Galvumet è indicato come integratore della dieta e dell'esercizio fisico in pazienti il cui trattamento con cloridrato di metformina o vildagliptin in monoterapia non fornisce un adeguato controllo degli zuccheri nel sangue o in pazienti che sono già in trattamento con una combinazione libera di cloridrato di metformina e vildagliptin.
Galvumet è indicato in combinazione con una sulfonilurea (cioè una terapia a tripla combinazione) come integratore della dieta e dell'esercizio fisico in pazienti il cui trattamento con metformina e sulfonilurea da sola non fornisce un adeguato controllo degli zuccheri nel sangue.
Galvumet è indicato in combinazione con l'insulina per migliorare il controllo della glicemia in pazienti che non ottengono un adeguato controllo della glicemia attraverso la dieta, l'esercizio fisico e il trattamento con una dose stabile di insulina e metformina.
Posologia/Impiego
Il trattamento antidiabetico deve essere adattato individualmente in base all'efficacia e alla tollerabilità. Quando si utilizza Galvumet, la dose massima giornaliera raccomandata di 100 mg di vildagliptin non deve essere superata.
La dose iniziale raccomandata di Galvumet dovrebbe essere basata sul trattamento esistente con vildagliptin e/o metformina. Per ridurre gli effetti gastrointestinali indesiderati della metformina, la dose giornaliera totale di metformina deve essere assunta in 2–3 dosi uguali al giorno insieme ai pasti, mentre Galvumet deve essere assunto 2 volte al giorno.
Inizio della terapia
Dose iniziale in pazienti non adeguatamente controllati con monoterapia con vildagliptin
Sulla base della dose iniziale abituale di metformina (dose giornaliera: 500 mg–1000 mg), Galvumet deve essere iniziato con un dosaggio di 50 mg/500 mg o 50 mg/850 mg 2 volte al giorno. La dose di metformina deve essere gradualmente adeguata in base alla valutazione della risposta terapeutica.
Dose iniziale in pazienti non adeguatamente controllati con monoterapia con metformina
Sulla base della dose attuale di metformina, Galvumet deve essere iniziato con un dosaggio di 50 mg/500 mg, 50 mg/850 mg o 50 mg/1000 mg 2 volte al giorno.
Dose iniziale nei pazienti che passano da una combinazione libera con metformina e vildagliptin a Galvumet
Sulla base della dose attuale di metformina o vildagliptin, Galvumet deve essere iniziato con un dosaggio di 50 mg/500 mg, 50 mg/850 mg o 50 mg/1000 mg.
Terapia combinata
Uso in combinazione con insulina o sulfonilurea
Sulla base della dose attuale di metformina, Galvumet deve essere assunto con un dosaggio di 50 mg/500 mg, 50 mg/850 mg o 50 mg/1000 mg 2 volte al giorno.
Se combinato con una sulfonilurea, può essere valutato un dosaggio inferiore di sulfonilurea per ridurre il rischio di ipoglicemia.
Pazienti con disturbi della funzionalità epatica
L'uso di Galvumet non è raccomandato nei pazienti con disfunzione epatica, compresi i pazienti con valori AST o ALT > 2.5x ULN prima del trattamento (vedere «Avvertenze e misure precauzionali»).
Pazienti con disturbi della funzionalità renale
Prima di iniziare il trattamento con prodotti contenenti metformina (come Galvumet) e successivamente almeno una volta all'anno, occorre controllare la velocità di filtrazione glomerulare (GFR). Nei pazienti con un aumentato rischio di progressione della disfunzione renale e nei pazienti più anziani, tale funzione dovrebbe essere esaminata più frequentemente, ad esempio ogni 3–6 mesi.
Prima di considerare il trattamento con prodotti contenenti metformina (come Galvumet) in pazienti con GFR < 60 ml/min, è necessario valutare i fattori che aumentano il rischio di acidosi lattica (vedere «Avvertenze e misure precauzionali»). Galvumet è controindicato nei pazienti con GFR < 30 ml/min a causa del principio attivo metformina (vedere «Controindicazioni»).
A seconda dello stato attuale della funzione renale, devono essere osservate le seguenti raccomandazioni di dosaggio:
Clearance della creatinina ml/min eGFR ml/min/1.73 m2 | Metformina | Vildagliptin |
|---|---|---|
60–89 | La dose massima giornaliera è di 3000 mg*. Una riduzione della dose può essere presa in considerazione se la funzione renale peggiora. | La dose massima giornaliera è di 100 mg*. |
45–59 | La terapia deve essere iniziata con 500 mg o 850 mg di metformina al giorno. La dose massima giornaliera è di 1000 mg, suddivisi in 2 dosi La funzione renale (clearance della creatinina, o eGFR) deve essere monitorata attentamente ogni 3–6 mesi. | La dose massima giornaliera è di 50 mg*. |
30–44 | La terapia deve essere iniziata con 500 mg o 850 mg di metformina al giorno. La dose massima giornaliera è di 1000 mg, suddivisi in 2 dosi. La funzione renale (clearance della creatinina, o eGFR) deve essere monitorata attentamente almeno ogni 3 mesi. | |
< 30 | La metformina è controindicata. | |
*Nel caso in cui si ritenga necessaria una dose di metformina superiore a Galvumet da solo. | ||
Se Galvumet non fornisce la dose richiesta per una delle due sostanze attive, al posto del preparato combinato devono essere utilizzate le due sostanze singole.
Pazienti anziani
Poiché la metformina viene smaltita attraverso i reni e i pazienti più anziani tendono ad avere una funzionalità renale ridotta, nei pazienti che assumono prodotti contenenti metformina (come Galvumet) la funzionalità renale deve essere monitorata regolarmente. Galvumet deve essere usato solo in pazienti anziani con funzionalità renale nella norma (vedere «Controindicazioni» e «Avvertenze e misure precauzionali»).
Bambini e adolescenti
L'efficacia e la sicurezza di Galvumet non sono state dimostrate in pazienti di età inferiore ai 18 anni. Pertanto, l'uso di Galvumet in pazienti pediatrici non è raccomandato.
Controindicazioni
- Ipersensibilità ai principi attivi o a una delle sostanze ausiliarie.
- Acidosi lattica, chetoacidosi diabetica o precoma diabetico.
- Grave disfunzione renale (GFR < 30 ml/min) (vedere «Posologia/impiego» e «Avvertenze e misure precauzionali»).
- Condizioni acute potenzialmente associate a un cambiamento della funzione renale, come ad esempio:
- disidratazione,
- infezioni gravi,
- stati di shock,
- somministrazione intravascolare di mezzi di contrasto contenenti iodio (vedere «Avvertenze e misure precauzionali»).
- Malattie acute o croniche che possono causare ipossia tissutale, quali:
- insufficienza cardiaca,
- insufficienza respiratoria,
- infarto del miocardio,
- stato di shock.
- Limitazione della funzione epatica (vedere «Posologia/impiego», «Avvertenze e misure precauzionali» e «Effetti indesiderati»).
- Intossicazione alcolica acuta, alcolismo.
- Allattamento al seno (vedere «Gravidanza, allattamento»).
Avvertenze e misure precauzionali
Galvumet
Informazioni generali
Galvumet non è un sostituto dell'insulina in pazienti che ne necessitino. Galvumet non deve essere usato in pazienti con diabete di tipo 1 o in pazienti con chetoacidosi.
Ipoglicemie
I pazienti che ricevono Galvumet in combinazione con una sulfonilurea o insulina possono essere a maggior rischio di ipoglicemia. Pertanto, un dosaggio inferiore di sulfonilurea o insulina dovrebbe essere considerato per ridurre il rischio di ipoglicemia.
Vildagliptin
Lesioni epatiche
Vildagliptin non è raccomandato nei pazienti con disfunzione epatica, compresi i pazienti con valori AST o ALT > 2.5x ULN prima del trattamento.
Galvumet non è quindi raccomandato per i pazienti con danni al fegato.
Monitoraggio degli enzimi epatici
Sono stati riportati casi di disfunzione epatica (compresi rari casi di epatite). In questi casi, i pazienti erano per lo più asintomatici senza conseguenze cliniche e i test di funzionalità epatica si sono normalizzati dopo l'interruzione del trattamento. I test di funzionalità epatica devono essere eseguiti prima del trattamento con Galvumet per determinare i valori di base del paziente. La funzione epatica deve essere monitorata durante il trattamento con Galvumet per il primo anno ad intervalli di tre mesi e successivamente con regolarità. Nei pazienti che sviluppano elevati livelli di transaminasi, il test deve essere ripetuto e, dopo la conferma del risultato, il paziente deve essere monitorato a brevi intervalli fino alla normalizzazione. Con livelli AST o ALT ≥3x ULN si raccomanda la sospensione di Galvumet.
I pazienti che sviluppino ittero o altri segni di disfunzione epatica dovrebbero interrompere il trattamento con Galvumet.
Dopo l'interruzione del trattamento con Galvumet e la normalizzazione dei test di funzionalità epatica, il trattamento con Galvumet non deve più essere ripreso.
Pancreatite
Dopo l'introduzione sul mercato, i casi di pancreatite acuta sono stati segnalati come effetto collaterale tramite segnalazione spontanea. I pazienti devono quindi essere informati sui sintomi caratteristici della pancreatite acuta, ad esempio dolore addominale intenso e persistente.
Dopo la sospensione di vildagliptin è stata osservata una regressione della pancreatite. In caso di sospetta pancreatite, vildagliptin e altri farmaci potenzialmente responsabili devono essere sospesi.
Insufficienza cardiaca
Uno studio clinico sul vildagliptin nei pazienti con insufficienza cardiaca di classe I‑III della NYHA (New York Heart Association) ha dimostrato che il trattamento con vildagliptin rispetto al placebo non ha modificato la frazione di eiezione ventricolare sinistra o peggiorato l'insufficienza cardiaca congestizia preesistente. L'esperienza clinica in pazienti di classe III NYHA trattati con vildagliptin è ancora limitata e i risultati dello studio di cui sopra non sono conclusivi (vedere «Proprietà/Effetti»). Poiché non vi è alcuna esperienza da studi clinici sull'uso di vildagliptin in pazienti con insufficienza cardiaca di classe IV NYHA, il suo utilizzo in questi pazienti non è raccomandato.
Patologie della pelle
In studi tossicologici non clinici con trattamento a base di vildagliptin, sono state riportate lesioni cutanee come vesciche e ulcere agli arti delle scimmie (vedere paragrafo «Dati preclinici»). Sebbene negli studi clinici non sia stata osservata una maggiore incidenza di lesioni cutanee, l'esperienza nei pazienti con complicanze cutanee diabetiche è limitata. Si raccomanda pertanto di monitorare le patologie della pelle in termini di vesciche e le ulcere, come avviene di routine nei pazienti diabetici.
Miopatia/rabdomiolisi
In relazione all'uso del Galvumet sono state segnalate miopatie che si manifestano come dolore, debolezza o sensibilità muscolare insieme a un forte aumento della creatinchinasi (CK, fino a dieci volte il limite superiore della norma). La miopatia può a volte manifestarsi sotto forma di rabdomiolisi con o senza insufficienza renale acuta dovuta alla mioglobinuria, e raramente si sono verificati decessi.
I medici devono utilizzare il Galvumet con cautela nei pazienti con fattori predisponenti per la rabdomiolisi. Il livello della creatinchinasi deve essere determinato prima di iniziare il trattamento nelle seguenti situazioni:
- limitazione della funzionalità renale,
- ipotiroidismo non controllato,
- anamnesi personale o familiare di malattie muscolari ereditarie,
- anamnesi di tossicità muscolare in relazione a una statina o a un fibrato,
- dipendenza da alcol,
- anziani (≥65 anni): la necessità di tale misurazione deve essere considerata in presenza di altri fattori predisponenti per la rabdomiolisi,
- sesso femminile.
In tali situazioni, il rischio di trattamento deve essere considerato in relazione ai possibili benefici.
Metformina
Insufficienza cardiaca
La metformina è controindicata nei pazienti con insufficienza cardiaca, motivo per cui Galvumet è controindicato in questa tipologia di pazienti (vedere paragrafo «Controindicazioni»).
Acidosi lattica
L'acidosi lattica è una complicanza metabolica molto rara ma grave (3 casi ogni 100 000 anni-paziente), che nella maggior parte dei casi si verifica con degenerazione renale acuta, malattia cardiorespiratoria o sepsi ed è associata ad alta mortalità se non trattata precocemente. L'accumulo di metformina si verifica con un acuto peggioramento della funzione renale e aumenta il rischio di acidosi lattica. L'insufficienza renale acuta (organica o funzionale) può essere la causa dell'accumulo di metformina.
La sintomatologia precedente non è specifica e può manifestarsi attraverso l'insorgenza di crampi muscolari, accompagnati da patologie gastrointestinali, dolori addominali, aumento della frequenza respiratoria e grave debolezza. Questi sintomi devono essere notati dal medico curante. Il medico dovrebbe anche informare il paziente sui possibili segni di acidosi lattica.
In caso di disidratazione (ad es. diarrea o vomito, febbre o riduzione dell'assunzione di liquidi), il paziente deve interrompere l'assunzione di prodotti contenenti metformina (come Galvumet) e consultare immediatamente un medico.
Mezzi di contrasto iodati
L'applicazione intravascolare di mezzi di contrasto contenenti iodio per gli esami radiologici (urografia e.v., angiografia, ecc.) può portare a un accumulo di metformina e a un aumento del rischio di acidosi lattica. I prodotti contenenti metformina (come Galvumet) devono essere interrotti prima o al momento di una procedura di imaging e possono essere riutilizzati al più presto 48 ore dopo l'esame in questione e solo dopo aver controllato la funzione renale e solo in presenza di valori stabili (vedere «Posologia/impiego» e «Interazioni»).
L'uso di preparati che possono compromettere gravemente la funzione renale (come gli antiipertensivi, i diuretici e i FANS) deve essere iniziato con cautela nei pazienti trattati con prodotti contenenti metformina (come Galvumet). Altri fattori di rischio per l'acidosi lattica sono l'eccessivo consumo di alcol, la disfunzione epatica, il diabete trattato in modo inadeguato, la chetosi, il digiuno prolungato e qualsiasi condizione associata all'ipossia, nonché l'uso concomitante di farmaci che possono causare acidosi lattica (vedere «Controindicazioni» e «Interazioni»).
I pazienti e/o gli operatori sanitari devono essere informati del rischio di acidosi lattica. L'acidosi lattica è caratterizzata da dispnea acidotica, dolore addominale, crampi muscolari, astenia e ipotermia seguita da coma. I seguenti parametri di laboratorio possono essere utilizzati per identificare i sintomi: riduzione del pH del sangue (< 7.35), aumento del livello di lattato plasmatico (> 5 mmol/l), aumento del gap anionico e aumento del rapporto lattato/piruvato.
In caso di acidosi lattica sospetta, i prodotti contenenti metformina (come Galvumet) devono essere sospesi e il paziente deve essere ricoverato immediatamente. Sia il lattato che la metformina sono eliminati più efficacemente con l'emodialisi (vedere «Posologia eccessiva»).
Funzionalità renale (vedere «Controindicazioni»)
La GFR deve essere controllata prima dell'inizio del trattamento e successivamente a intervalli regolari (vedere «Posologia/Impiego»). I prodotti contenenti metformina (come Galvumet) sono controindicati in pazienti con GFR < 30 ml/min e il trattamento deve essere interrotto temporaneamente se esistono condizioni che alterano la funzione renale (vedere «Controindicazioni»).
Interventi chirurgici
I prodotti contenenti metformina (come Galvumet) devono essere sospesi 48 ore prima di un intervento programmato in anestesia generale, anestesia spinale o anestesia epidurale. La terapia con metformina può essere continuata al più presto 48 ore dopo l'intervento e solo dopo la ripresa dell'alimentazione orale e in presenza di una funzionalità renale stabile.
Consumo di alcol
L'alcol rafforza l'effetto della metformina nel metabolismo dei lattati. I pazienti devono quindi essere informati sulle conseguenze del consumo eccessivo di alcol durante la terapia con prodotti contenenti metformina (come Galvumet).
L'avvelenamento da alcol è associato a un aumento del rischio di acidosi lattica, specialmente in caso di digiuno precedente, presenza di malnutrizione o disfunzione epatica.
Livelli di vitamina B12
La metformina è stata associata a una diminuzione dei livelli sierici di vitamina B12 in circa il 7% dei pazienti senza manifestazioni cliniche. Tale diminuzione è molto raramente associata all'anemia e sembra essere rapidamente reversibile quando la metformina e/o l'integrazione di vitamina B12 viene interrotta. Ai pazienti che assumono Galvumet si raccomanda un esame dei parametri ematici almeno una volta all'anno. Qualsiasi anomalia si verifichi deve essere adeguatamente studiata e risolta.
Cambiamento del quadro clinico in pazienti con diabete di tipo 2 già sotto controllo
I pazienti con diabete di tipo 2 in trattamento con Galvumet che in precedenza erano sotto controllo, ma che poi hanno sviluppato anomalie nei valori di laboratorio o una malattia clinica (in particolare una malattia non definita o poco chiara) devono essere immediatamente sottoposti a screening per la cheto e/o lattacidosi. In caso di acidosi, Galvumet deve essere interrotto immediatamente e devono essere prese le misure necessarie.
Ipoglicemia
Di solito, Galvumet da solo non causa ipoglicemia; tuttavia, l'ipoglicemia può verificarsi se l'assunzione di calorie è insufficiente, se un'attività fisica intensa non è compensata da calorie o se si consuma alcol. I pazienti più anziani, deboli o malnutriti e quelli con insufficienza surrenale o ipofisaria o con intossicazione da alcol possono essere soggetti a disturbi ipoglicemici. L'ipoglicemia può essere difficile da rilevare in età avanzata e nei pazienti che assumono betabloccanti.
Le sulfoniluree sono note per causare ipoglicemia. I pazienti che assumono Galvumet in combinazione con una sulfonilurea possono essere a rischio di ipoglicemia. Può essere pertanto valutato un dosaggio inferiore di sulfonilurea in combinazione con Galvumet per ridurre il rischio di ipoglicemia.
Perdita del controllo della glicemia
Se un paziente sottoposto a terapia antidiabetica è esposto a stress quali febbre, traumi, infezioni, interventi chirurgici, ecc. può verificarsi una temporanea perdita del controllo della glicemia. In tali situazioni può essere necessario sospendere la somministrazione di Galvumet e sostituirlo temporaneamente con l'insulina. Galvumet può essere usato di nuovo dopo la fine dell'episodio acuto.
Interazioni
Galvumet
Non sono stati eseguiti studi formali sulle interazioni con Galvumet. I seguenti pareri riflettono le informazioni disponibili per ogni singolo principio attivo.
Vildagliptin
Sono stati condotti studi sulle interazioni farmacologiche con farmaci solitamente prescritti simultaneamente per pazienti con diabete di tipo 2 o con indici terapeutici ristretti. Come risultato di questi studi, non sono state osservate interazioni clinicamente rilevanti con altri antidiabetici orali (glibenclamide, pioglitazone, metformina), amlodipina, digossina, ramipril, simvastatina, valsartan o warfarin.
Metformina
Altre interazioni
Alcuni medicamenti come i FANS, compresi gli inibitori selettivi della cicloossigenasi (COX) II, gli inibitori della AEC, gli antagonisti del recettore dell'angiotensina II e i diuretici, in particolare i diuretici dell'ansa, possono influenzare negativamente la funzionalità renale, aumentando il rischio di acidosi lattica. L'uso contemporaneo di tali preparati con prodotti contenenti metformina (come Galvumet) richiede pertanto un attento monitoraggio della funzionalità renale.
Sotto l'influenza di sostanze simpatiche (ad es. betabloccanti, clonidina, guanetidina, reserpina) la percezione dei sintomi di ipoglicemia può essere compromessa.
Induttori enzimatici/Inibitori enzimatici
Vildagliptin
Poiché vildagliptin non inibisce né induce gli enzimi CYP450, è improbabile che interagisca con i farmaci concomitanti metabolizzati tramite CYP450 o che agiscono come inibitori o induttori di questi enzimi.
Effetti di Galvumet su altri medicamenti
La metformina abbassa la concentrazione plasmatica del furosemide (Cmax del 33%, AUC del 12%) e l'emivita terminale si riduce del 32% senza modificare la clearance renale del furosemide.
L'effetto del fenprocumone può essere ridotto perché la sua escrezione è accelerata dalla metformina.
Studi di interazione con glibenclamide, nifedipina, ibuprofene o propranololo non hanno mostrato effetti clinicamente rilevanti sui parametri farmacocinetici di queste sostanze.
Effetti di altri medicamenti su Galvumet
Interazioni che influenzano l'efficacia della metformina
Riduzione dell'effetto ipoglicemico
Glucocorticoidi (sistemici e locali), beta-2-simpaticomimetici, diuretici, fenotiazine (ad es. clorpromazina), ormoni tiroidei, estrogeni, contraccettivi orali, prodotti ormonali sostitutivi, fenitoina, acido nicotinico, calcioantagonisti, isoniazide e tetracosactide possono aumentare la glicemia.
Aumento dell'effetto ipoglicemico
Furosemide aumenta la concentrazione plasmatica di metformina (Cmax del 22%, AUC del 15%) senza variazioni significative nella clearance renale.
Nifedipina aumenta la concentrazione plasmatica di metformina (Cmax del 20%, AUC del 9–20%) a causa dell'assorbimento della metformina.
Cimetidina aumenta il Cmax di metformina del 60% e l'AUC del 40%. L'emivita di eliminazione della metformina non viene influenzata. Altri principi attivi (amiloride, digossina, morfina, procainamide, chinidina, chinino, ranitidina, triamterene, trimetoprim o vancomicina) che vengono eliminati dalla secrezione renale tubolare attiva possono potenzialmente interagire con la metformina. I pazienti che ricevono tali farmaci devono pertanto essere attentamente monitorati quando vengono trattati con prodotti contenenti metformina (come Galvumet).
Gli ACE‑inibitori possono ridurre lo zucchero nel sangue.
Allo stesso modo, lo zucchero nel sangue può essere ridotto dai beta- bloccanti, per cui i beta-bloccanti cardioselettivi (β1‑selettivi) mostrano tali interazioni in misura molto minore rispetto a quelli non cardioselettivi.
L'uso simultaneo di inibitori MAO e antidiabetici orali può migliorare la tolleranza al glucosio e aumentare l'effetto ipoglicemico.
Quando venga utilizzata in combinazione con l'alcol, l'effetto di abbassamento dello zucchero nel sangue della metformina può essere intensificato e risultare in un coma ipoglicemico.
Aumento o riduzione dell'effetto ipoglicemico della metformina
H2 antagonisti, clonidina e reserpina possono aumentare o diminuire l'effetto della metformina.
Sono stati osservati disturbi del controllo della glicemia (inclusa iper- o ipoglicemia) con somministrazione simultanea di chinoloni e metformina.
Interazioni che aumentano gli effetti indesiderati della metformina
Diuretici: l'acidosi lattica può verificarsi come risultato di una disfunzione renale causata da diuretici (in particolare diuretici dell'ansa). I diuretici hanno anche un effetto di aumento della glicemia.
Mezzi di contrasto contenenti iodio: per dettagli sulle interazioni con mezzi di contrasto a raggi X contenenti iodio e sul rischio di acidosi lattica da essi causato, vedere «Avvertenze e misure precauzionali».
Alcol: la metformina aumenta il rischio di acidosi lattica nei casi di intossicazione acuta da alcol, specialmente in caso di precedente digiuno o di malnutrizione o disfunzioni epatiche.
Gravidanza/Allattamento
Gravidanza
Non sono disponibili dati sufficienti sull'utilizzo di Galvumet in gravidanza. Per vildagliptin, studi sugli animali hanno dimostrato tossicità per la riproduzione a dosi elevate. Gli studi sugli animali non hanno dimostrato alcuna tossicità per la riproduzione per la metformina. Gli studi sugli animali con vildagliptin e metformina non hanno mostrato teratogenicità, ma effetti fetotossici in dosi tossiche per la madre (vedere «Dati preclinici»). I rischi potenziali per l'uomo non sono noti. Non si raccomanda pertanto l'utilizzo di Galvumet durante la gravidanza.
Allattamento
Gli studi sugli animali hanno dimostrato che sia vildagliptin che la metformina sono escreti nel latte materno. Non è noto se vildagliptin passi nel latte materno negli esseri umani, ma piccole dosi di metformina vengono escrete nel latte materno umano. Galvumet non deve essere usato nelle donne che allattano a causa del potenziale rischio di ipoglicemia neonatale associata alla metformina e per la mancanza di dati umani su vildagliptin (vedere «Controindicazioni»).
Fertilità
Non sono stati condotti studi sull'influenza di Galvumet sulla fertilità umana.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Non sono stati effettuati studi sugli effetti sulla capacità di guidare veicoli e sulla capacità di utilizzare macchine. I pazienti che soffrono di vertigini non devono quindi guidare veicoli o utilizzare macchinari.
Effetti indesiderati
Galvumet
I dati presentati si riferiscono alla somministrazione simultanea di vildagliptin e metformina, come combinazione libera o fissa.
Con vildagliptin, sono stati riportati rari casi di angioedema, simili al numero nel gruppo di controllo. Più casi sono stati segnalati con la somministrazione simultanea di vildagliptin e ACE-inibitori. La maggior parte degli eventi sono stati lievi e sono scomparsi continuando il trattamento con vildagliptin.
Sono stati riportati rari casi di disfunzione epatica (compresa l'epatite) in trattamento con vildagliptin. In questi casi, i pazienti erano perlopiù asintomatici, non hanno mostrato alcuna conseguenza clinica e la funzione epatica si è normalizzata dopo l'interruzione del trattamento. Negli studi monoterapici controllati e negli studi combinati di durata fino a 24 settimane, l'incidenza di aumenti di ALT o AST fino a tre volte il limite superiore dell'intervallo normale e anche oltre (rilevato in almeno due misurazioni consecutive o all'ultima visita durante il trattamento) era dello 0.2% per 50 mg di vildagliptin una volta al giorno, dello 0.3% per 50 mg di vildagliptin due volte al giorno e dello 0.2% per tutti i principi attivi comparabili. Questi aumenti delle transaminasi erano generalmente asintomatici, non progressivi e non associati a colestasi o ittero.
Negli studi controllati, l'ipoglicemia si è verificata occasionalmente in pazienti che ricevevano vildagliptin insieme alla metformina e in pazienti che ricevevano placebo e metformina. Nel gruppo del vildagliptin non ci sono stati casi gravi di ipoglicemia.
Effetti gastrointestinali indesiderati, tra cui diarrea e nausea, si verificano con frequenza molto comune durante la fase iniziale della somministrazione di metformina.
In totale, il 12.9% dei pazienti trattati con vildagliptin e metformina allo stesso tempo ha riportato sintomi gastrointestinali; mentre nei pazienti trattati con la sola metformina il tasso era del 18.1%.
In studi comparativi controllati di monoterapia, l'ipoglicemia si è verificata con frequenza non comune.
Gli effetti indesiderati da studi in doppio cieco in cui i pazienti abbiano ricevuto vildagliptin come monoterapia e terapia aggiuntiva, sono elencati di seguito secondo la classe di organi e la frequenza assoluta. Le frequenze sono definite come segue:
«Molto comune» (≥1/10); «comune» (≥1/100, < 1/10); «non comune» (≥1/1000, < 1/100); «raro» (≥1/10'000, < 1/1000); «molto raro» (< 1/10 000), non nota (la frequenza non può essere stimata con i dati disponibili). All'interno di un gruppo di frequenza, gli effetti indesiderati sono elencati con frequenza decrescente.
Infezioni
Molto raro: infezioni delle vie respiratorie superiori, nasofaringite.
Sistema nervoso
Comune: vertigini, tremor.
Non comune: cefalea.
Vasi sanguigni
Non comune: edema periferico.
Disturbi gastrointestinali
Comune: nausea.
Non comune: diarrea, stipsi.
Fegato
Raro: transaminasi aumentate.
Sistema muscoloscheletrico
Non comune: artralgia.
Metabolismo
Non comune: ipoglicemia, aumento ponderale.
Patologie generali
Non comune: astenia.
Nessuno degli effetti indesiderati osservati nella monoterapia con vildagliptin è stato osservato con maggiore significatività clinica rispetto alla con metformina.
Metformina
Gli effetti indesiderati noti della metformina sono riassunti di seguito.
Disturbi del sistema emolinfopoietico
Casi singoli di leucopenia, trombopenia e anemia emolitica.
Molto raro: abbassamento del livello ematico di vitamina B12.
Disturbi del metabolismo e della nutrizione
Molto comune: perdita dell'appetito.
Molto raro: acidosi lattica (incidenza 3 casi/100 000 anni-paziente, vedere «Avvertenze e misure precauzionali»).
Disturbi del sistema nervoso
Comune: disgeusia (3%).
Non comune: stanchezza.
Fastidi gastrointestinali
Da comune a molto comune: patologie gastrointestinali (5–15%) come nausea, vomito, diarrea, dolore addominale.
Questi sintomi si manifestano principalmente all'inizio della terapia e di solito scompaiono spontaneamente.
Disturbi funzionali
In casi singoli: valori anomali nei test di funzionalità epatica, ad esempio transaminasi elevate o epatite (reversibile dopo la sospensione della metformina).
Disturbi funzionali della cute e del tessuto sottocutaneo
Molto raro: reazioni cutanee come eritema, prurito, orticaria.
Terapia combinata di vildagliptin con insulina (con/senza metformina)
La frequenza dell'ipoglicemia è risultata simile in entrambi i gruppi di trattamento negli studi clinici controllati eseguiti (14.0% dei pazienti in trattamento con vildagliptin contro il 16.4% dei pazienti con placebo). Grave ipoglicemia si è verificata in n = 2 pazienti con vildagliptin contro n = 6 pazienti con placebo. L'influenza sul peso medio era bassa in entrambi i gruppi di trattamento (+0.6 kg con vildagliptin contro +/-0 kg con placebo).
Gli effetti indesiderati verificatisi con vildagliptin in questi studi sono:
Sistema nervoso
Comune: cefalea.
Tratto gastrointestinale
Comune: nausea, reflusso gastroesofageo.
Non comune: diarrea, flatulenza.
Disturbi generali
Comune: brividi.
Esami diagnostici
Comune: abbassamento della glicemia.
Il ritiro dagli studi a causa di questi effetti avversi è stato, nel complesso, raro.
Terapia combinata con una sulfonilurea
L'ipoglicemia era comune in entrambi i gruppi di trattamento (5.1% per vildagliptin + metformina + glimepirid contro 1.9% per placebo + metformina + glimepirid). Un grave evento di ipoglicemia è stato segnalato nel gruppo vildagliptin. Alla fine dello studio, l'effetto sul peso corporeo medio è stato ridotto (+0.6 kg per il gruppo vildagliptin e 0.1 kg per il gruppo placebo).
Effetti indesiderati in pazienti che assumevano Galvus 50 mg due volte al giorno in combinazione con metformina e una sulfonilurea (n = 157):
Disturbi del metabolismo e della nutrizione
Comune: ipoglicemia.
Sistema nervoso
Comune: vertigini, tremor.
Cute
Comune: iperidrosi.
Disturbi generali
Comune: astenia.
Effetti indesiderati dopo l'introduzione sul mercato
Galvumet
I dati presentati si riferiscono alla somministrazione simultanea di vildagliptin e metformina, come combinazione libera o fissa.
I seguenti effetti indesiderati sono stati segnalati dall'esperienza post-commercializzazione attraverso segnalazioni spontanee e letteratura. Poiché queste reazioni sono segnalate volontariamente da una popolazione di dimensioni sconosciute, non è possibile stimarne in modo affidabile la frequenza. La frequenza è quindi classificata come «non nota»
- Epatite, scomparsa dopo l'interruzione di Galvumet (vedere «Avvertenze e misure precauzionali»).
- Orticaria, esantema bolloso, esfoliazioni cutanee locali e vesciche sulla pelle, compreso il pemfigoide bolloso.
- Pancreatite.
- Rabdomiolisi (osservazione dalla post-commercializzazione. Frequenza sconosciuta).
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-benefico del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Segni e sintomi
Vildagliptin
Negli studi clinici, l'edema e il dolore muscolare sono stati dose-limitante. A 600 mg, un soggetto ha manifestato un edema delle mani e dei piedi e un eccessivo aumento della creatina fosfochinasi (CPK) accompagnato da elevati livelli di aspartato aminotransferasi (AST), proteina C‑reattiva e mioglobina. Altri tre soggetti di questo gruppo di dosaggio hanno manifestato di edema su entrambi i piedi, in due casi accompagnati da parestesia. Tutti i sintomi e i valori di laboratorio si sono normalizzati dopo l'interruzione dello studio farmacologico.
Metformina
Anche assumendo dosi estremamente elevate di metformina (fino a 85 g) non è stata osservata alcuna ipoglicemia tuttavia, in queste circostanze, si è verificata l'acidosi lattica. L'acidosi lattica è un'emergenza medica e richiede l'ospedalizzazione del paziente (vedere «Avvertenze e misure precauzionali»).
Trattamento
Vildagliptin
In caso di sovradosaggio, il medicamento deve essere interrotto e il paziente deve essere trattato sintomaticamente e di sostegno.
Vildagliptin non è dializzabile; il principale metabolita dell'idrolisi può essere rimosso mediante emodialisi.
Metformina
Sia il lattato che la metformina vengono eliminati mediante emodialisi.
Proprietà/Effetti
Codice ATC
A10BD08
Meccanismo d'azione
Galvumet
Galvumet combina due agenti ipoglicemici con diversi meccanismi d'azione per migliorare il controllo della glicemia nei pazienti con diabete di tipo 2: Vildagliptin è un inibitore DPP-4 (dipeptil-peptidasi-4) e la metformina appartiene alla classe dei biguanidi.
Vildagliptin
La somministrazione di vildaglinptin inibisce l'attività DPP‑4, portando a elevati livelli endogeni a digiuno e postprandiali degli ormoni incretinici GLP‑1 (peptide‑1 simile al glucagone) e GIP (polipeptide insulino tropico glucosio-dipendente).
Metformina
La metformina è un antidiabetico orale appartenente alla classe dei biguanidi. L'effetto ipoglicemico della metformina è dovuto principalmente a un effetto nel fegato e nei muscoli che rompe la resistenza all'insulina.
Farmacodinamica
Vildagliptin
Aumentando i livelli endogeni di questi ormoni incretinici, vildagliptin aumenta la sensibilità delle cellule beta al glucosio, migliorando la secrezione di insulina dipendente dal glucosio. Il trattamento con 50–100 mg di vildagliptin al giorno ha portato a un significativo miglioramento dei marcatori di funzione delle cellule beta in pazienti con diabete di tipo 2, comprese le misure di HOMA‑β (Homeostasis Model Assessment‑β), il rapporto proinsulina/insulina e le misure di sensibilità alle cellule beta del test di tolleranza ai pasti comunemente usato. Nei soggetti non diabetici (normoglicemici), vildagliptin non stimola la secrezione di insulina né riduce i livelli di glucosio.
Aumentando i livelli endogeni di GLP‑1, vildagliptin aumenta la sensibilità delle cellule alfa al glucosio, ottenendo un rilascio di glucagone che si adatta meglio ai livelli di glucosio.
L'aumento del rapporto insulina/glucagone durante l'iperglicemia dovuto all'aumento dei livelli di ormoni della cretina provoca una diminuzione della produzione di glucosio epatico a digiuno e postprandiale, con conseguente riduzione della glicemia.
L'effetto noto di ritardare lo svuotamento gastrico a livelli elevati di GLP‑1 non è osservato nel trattamento con vildagliptin.
Metformina
Abbassa i livelli di glucosio plasmatico basale e postprandiale in presenza di insulina. La metformina non ha alcun effetto stimolante sulla secrezione di insulina e non causa ipoglicemia se usata da sola.
L'effetto di abbassamento dello zucchero nel sangue si basa su tre meccanismi:
Nel fegato
In uno stato di digiuno, la produzione di glucosio epatico è in gran parte responsabile dell'iperglicemia. La metformina riduce la produzione di glucosio epatico attivato dall'insulino-resistenza inibendo la gluconeogenesi e la glicogenolisi che, allo stesso tempo, contrasta l'effetto di aumento degli zuccheri nel sangue del glucagone. Attraverso questo meccanismo, la metformina riduce l'iperglicemia a digiuno.
Nei muscoli
I disturbi nell'assorbimento e nella conservazione del glucosio periferico sono i principali responsabili dell'iperglicemia postprandiale. La metformina aumenta la sensibilità cellulare all'insulina stimolando l'attività tirosin-chinasica del recettore dell'insulina favorendo l'assorbimento del glucosio cellulare. La metformina aumenta la capacità di tutti i meccanismi di trasporto del glucosio della membrana cellulare (GLUT). Questo effetto della metformina è particolarmente evidente in condizioni iperglicemiche. Attraverso la stimolazione dell'enzima chiave, la glicogeno sintasi aumenta la sintesi intracellulare di glicogeno. Attraverso questi meccanismi, la metformina riduce l'iperglicemia postprandiale.
Nell'intestino
La metformina ritarda l'assorbimento intestinale del glucosio, che riduce il carico di glucosio postprandiale.
Effetti sul metabolismo lipidico e sulla fibrinolisi
La metformina ha anche un effetto positivo sul metabolismo lipidico negli esseri umani, indipendentemente dal suo effetto sullo zucchero nel sangue. In studi clinici controllati a medio e lungo termine, è stato dimostrato che la metformina in dosi terapeutiche abbassa i livelli di colesterolo totale, colesterolo LDL e trigliceridi. Inoltre, alcuni studi hanno dimostrato che la metformina può aumentare i livelli di colesterolo HDL.
La metformina ha anche proprietà fibrinolitiche.
Efficacia clinica
Galvumet
Non esistono studi sull'efficacia clinica di Galvumet. L'efficacia e la sicurezza dei singoli componenti sono già state dimostrate in precedenza. La sicurezza e l'efficacia della somministrazione combinata di entrambi i componenti sono state valutate in due studi clinici. Questi due studi hanno dimostrato un ulteriore beneficio per vildagliptin in pazienti con diabete di tipo 2 non adeguatamente controllato e che sono stati trattati con metformina.
In uno studio di 24 settimane, in doppio cieco, controllato con placebo in pazienti con diabete di tipo 2, la cui glicemia non era adeguatamente controllata con monoterapia a base di metformina alla dose di ≥2000 mg, vildagliptin combinato con metformina ha mostrato una riduzione statisticamente maggiore dell'HbA1c rispetto al gruppo con metformina e placebo (la differenza media era ‑0.7% nel gruppo con 50 mg vildagliptin 1 volta al giorno e ‑1.1% nel gruppo con 50 mg vildagliptin due volte al giorno).
L'efficacia di vildagliptin combinato con metformina 1000 mg è stata esaminata in un altro studio clinico in doppio cieco e controllato con placebo per un totale di 52 settimane (12 settimane di studio di base (n = 132), poi prolungate su 40 settimane (n = 71)). L'aggiunta di vildagliptin (50 mg una volta al giorno) alla metformina alla fine delle prime 12 settimane di studio (HbA1c media alla baseline pari a 7.7% e 7.9%, rispettivamente) ha portato a un'ulteriore e statisticamente significativa riduzione dell'HbA1c medio rispetto al baseline (0.55%) messa a confronto a quella del gruppo con metformina e placebo (+0.1%). Dopo 52 settimane, la deviazione media dall'HbA1c alla baseline era statisticamente e significativamente maggiore e più pronunciata nel gruppo con vildagliptin (50 mg) combinato con metformina rispetto al gruppo con metformina in monoterapia (la differenza tra i gruppi era di ‑1.1%).
In uno studio di 24 settimane, vildagliptin 50 mg 2 volte/die è stato confrontato con pioglitazone 30 mg 1 volta/die in pazienti in cui la glicemia non era sufficientemente controllata in trattamento con metformina. Rispetto al valore iniziale dell'8.4% di HbA1c, la riduzione media con aggiunta della metformina è stata dello 0.9% per il vildagliptin e dell'1.0% per il pioglitazone. Con un valore iniziale di HbA1c > 9.0%, la diminuzione è stata maggiore in entrambi i gruppi di trattamento, cioè, pari all'1.5%. I pazienti che ricevono pioglitazone oltre alla metformina hanno acquisito 1.9 kg di peso e quelli che ricevono vildagliptin oltre alla metformina sono aumentati di 0.3 kg. In uno studio a lungo termine della durata massima di due anni, vildagliptin 50 mg 2 volte/die è stato messo a confronto con glimepiride fino a 6 mg 1 volta/die in pazienti trattati con metformina. Dopo 2 anni, l'HbA1c è diminuito in media dello 0.06% con la combinazione vildagliptin/metformina e dello 0.14% con glimepiride/metformina. La variazione del peso corporeo è stata di -0.2 kg per soggetti trattati con vildagliptin e +1.2 kg per quelli con glimepiride. L'incidenza di episodi ipoglicemici è stata significativamente più bassa nel gruppo con vildagliptin (2.3%) che nel gruppo con glimepiride (18.2%).
In uno studio di 52 settimane, gli effetti di vildagliptin 50 mg 2 volte/die in aggiunta alla metformina con gliclazide sono stati messi a confronto con quelli di una dose fino a 320 mg/die in aggiunta alla metformina in pazienti il cui zucchero nel sangue non era sufficientemente controllato con metformina. Dopo un anno, l'HbA1c è diminuito in media dello 0.81% con la combinazione vildagliptin/metformina (HbA1c baseline 8.4%) e dello 0.85% con gliclazide/metformina (HbA1c baseline 8.5%); statisticamente, ne è stata dimostrata la non inferiorità. I pazienti che ricevono gliclazide oltre alla metformina hanno preso 1.4 kg di peso e quelli che ricevono vildagliptin oltre alla metformina hanno preso 0.1 kg. Un paziente su cinque (1.0%) in entrambi i gruppi ha avuto almeno un episodio ipoglicemico.
Uno studio di 24 settimane ha valutato l'efficacia della combinazione a dose fissa di vildagliptin e metformina (gradualmente titolata a una dose di 50 mg/500 mg due volte al giorno o 50 mg/1000 mg due volte al giorno) come terapia iniziale nei pazienti nuovi al trattamento. Il valore di riferimento medio di HbA1c dell'8.6% è stato ridotto dell'‑1.82% con una somministrazione due volte al giorno di 50 mg/1000 mg di vildagliptin/metformina, dell'‑1.61% con una somministrazione due volte al giorno di 50 mg/500 mg di vildagliptin/metformina, dell'‑1.36% con una somministrazione due volte al giorno di 1000 mg di metformina e dell'‑1.09% con una somministrazione due volte al giorno di 50 mg di vildagliptin/metformina. La diminuzione di HbA1c in pazienti con una baseline media ≥10% è stata maggiore.
In uno studio di 24 settimane, randomizzato, in doppio cieco, controllato con placebo su 449 pazienti, sono state studiate l'efficacia e la sicurezza di vildagliptin (50 mg due volte al giorno) in combinazione con una dose stabile di insulina di base o di insulina premiscelata (dose media giornaliera 41 U) con o senza metformina. Vildagliptin in combinazione con l'insulina ha ridotto significativamente l'HbA1c rispetto al placebo: nella popolazione totale, la riduzione aggiustata con placebo per un valore di partenza medio dell'HbA1c dell'8.8% è stata dello ‑0.72%. Nei sottogruppi con insulina con o senza l'aggiunta di metformina, la riduzione aggiustata media dell'HbA1c per placebo è stata rispettivamente di ‑0.63 e ‑0.84%. L'ipoglicemia si è verificata nell'8.4% e nel 7.2% dei pazienti trattati rispettivamente con vildagliptin e placebo. Il peso medio dei pazienti ha mostrato uno scarso cambiamento complessivo (+0.2 kg con vildagliptin e ‑0.7 kg con placebo).
In uno studio di 24 settimane, randomizzato, in doppio cieco, controllato con placebo su 318 pazienti, sono state studiate l'efficacia e la sicurezza di vildagliptin (50 mg due volte al giorno) in combinazione con metformina (≥1500 mg al giorno) e glimepiride (≥4 mg al giorno). Vildagliptin in combinazione con metformina e glimepiride ha ridotto significativamente l'HbA1c rispetto al placebo: la riduzione media aggiustata con placebo per un valore medio alla baseline dell'HbA1c dell'8.8% era di ‑0.76%.
Vildagliptin
Due studi in doppio cieco, controllati con placebo, della durata di 24 settimane, sono stati condotti in pazienti nuovi al trattamento con diabete di tipo 2. Questi studi hanno mostrato cambiamenti medi statisticamente significativi nell'HbA1c rispetto alla baseline (-0.8% e -0.5%, rispettivamente) e rispetto al placebo per 50 mg di vildagliptin somministrato una volta al giorno.
Inoltre, la monoterapia con vildagliptin è stata confrontata con metformina, rosiglitazone o pioglitazone in diversi studi su pazienti nuovi al trattamento. I pazienti soffrivano di diabete da una media di due anni. In questi studi, vildagliptin ha mostrato una riduzione clinicamente rilevante di HbA1c rispetto alla baseline. Per il rosiglitazone, la non inferiorità è stata statisticamente provata, ma non per la metformina e il pioglitazone.
In uno studio di due anni a lungo termine, vildagliptin 50 mg 2 volte/die è stato confrontato con gliclazide fino a 320 mg /die. Dopo due anni, l'HbA1c è diminuito in media dello 0.5% con vildagliptin e dello 0.6% con gliclazide. Vildagliptin ha mostrato un minore aumento del peso corporeo (0.75 kg) e meno episodi ipoglicemici (0.7%) rispetto al gliclazide (1.6 kg e 1.7%, rispettivamente).
Uno studio di 52 settimane, multicentrico, randomizzato, in doppio cieco, è stato condotto in pazienti con diabete mellito tipo 2 e insufficienza cardiaca congestizia (NYHA I‑III) per determinare l'effetto di vildagliptin 50 mg 2 volte/die (N = 128) contro placebo (n= 126) sulla frazione di eiezione ventricolare sinistra (LVEF). Vildagliptin non è stato associato a un cambiamento nella frazione di eiezione ventricolare sinistra o a un peggioramento dell'insufficienza cardiaca congestizia preesistente. L'incidenza degli eventi cardiovascolari durante lo studio è stata complessivamente equilibrata tra il braccio vildagliptin e il braccio placebo. Nel sottogruppo NYHA III, l'incidenza degli effetti collaterali cardiovascolari è stata maggiore con vildagliptin rispetto al placebo (31.9% contro 21.3%). Le differenze erano dovute principalmente a un più alto tasso di FA e alla sindrome coronarica acuta. Nel valutare queste differenze, va tenuto presente che vi è stato uno squilibrio dei fattori di rischio cardiovascolare a favore del placebo e che il numero di eventi cardiovascolari è stato basso. Pertanto, da questi dati non si può concludere con sufficiente certezza che i pazienti NYHA III sono a più alto rischio. Non ci sono state differenze di efficacia.
Rischio cardiovascolare
Una meta-analisi di 37 studi clinici di FASE III e FASE IV (durata del trattamento da 2 settimane a ≥2 anni) non ha mostrato differenze clinicamente rilevanti nel rischio cardiovascolare tra vildagliptin (come monoterapia o combinata; N = 9599) e i comparatori (agenti attivi o placebo; N = 7102): la stima puntuale per il rapporto di rischio vildagliptin rispetto ai comparatori per l'endpoint combinato evento cardiovascolare avverso grave (MACE: morte cardiovascolare, infarto miocardico non fatale, ictus non fatale) era pari a 0.82 [intervallo di confidenza del 95% 0.61–1.1]. I risultati della stima puntuale per il rapporto di rischio delle singole componenti MACE sono stati coerenti.
Gli studi di combinazione con la metformina sono descritti sopra.
Metformina
Lo studio prospettico e randomizzato (UKPDS/UK Prospective Diabetes Study) ha dimostrato i benefici a lungo termine di un controllo intensivo della glicemia nei pazienti con diabete di tipo 2. L'analisi dei risultati in pazienti sovrappeso trattati con metformina, in cui la sola terapia dietetica aveva fallito, ha dimostrato:
- una significativa riduzione del rischio assoluto di complicanze correlate al diabete nel gruppo della metformina (29.8 eventi/1000 anni-paziente) rispetto alla sola dieta (43.3 eventi/1000 anni-paziente) p = 0.0023 e rispetto ai gruppi di con sulfonilurea (SU) e monoterapia di insulina (40.1 eventi/1000 anni paziente) p = 0.0034,
- una significativa riduzione del rischio assoluto di mortalità correlata al diabete: con metformina 7.5 eventi/1000 anni-paziente, solo dieta 12.7 eventi/1000 anni-paziente (p = 0.017),
- una significativa riduzione del rischio assoluto di mortalità per tutte le cause: con metformina 13.5 eventi/1000 anni-paziente rispetto alla sola dieta 20.6 eventi/1000 anni-paziente (p = 0.011) e rispetto ai gruppi combinati con SU e monoterapia di insulina 18.9 eventi/1000 anni-paziente (p = 0.021),
- una significativa riduzione del rischio assoluto di infarto del miocardio: con metformina 11 eventi/1000 anni-paziente rispetto alla sola dieta 18 eventi/1000 anni-paziente (p = 0.01)
Farmacocinetica
Assorbimento
Galvumet
Studi di bioequivalenza con Galvumet a tre dosaggi (50 mg/500 mg, 50 mg/850 mg e 50 mg/1000 mg) contro la combinazione libera di vildagliptin e metformina alle dosi appropriate hanno dimostrato che la biodisponibilità di vildagliptin e metformina era uguale.
L'alimentazione non influenza l'entità o la velocità di assorbimento di vildagliptin. Cmax e AUC della metformina sono diminuiti rispettivamente del 26% e del 7% se somministrati insieme al cibo e l'assorbimento della metformina è stato ritardato (Tmax, da 2.0 a 4.0 ore). Questi cambiamenti di Cmax e AUC sono coerenti, ma inferiori a quelli osservati quando la metformina è stata somministrata da sola con l'assunzione di cibo. Gli effetti alimentari sulla farmacocinetica di entrambi i componenti di Galvumet, vildagliptin e metformina, si sono rivelati simili a quelli in cui vildagliptin e metformina sono stati somministrati separatamente con il cibo.
Vildagliptin
Vildagliptin viene rapidamente assorbito con una biodisponibilità orale dell'85%. La concentrazione massima nel plasma viene raggiunta dopo circa 1 ora. L'assorbimento non è influenzato in modo significativo dall'assunzione di cibo. L'assunzione di cibo non influisce sull'esposizione totale (AUC).
Metformina
Dopo la somministrazione orale il Tmax è di 2.5 ore, l'assorbimento è completo dopo 6 ore. Si presume che l'assorbimento avvenga principalmente nel tratto gastrointestinale superiore. La biodisponibilità assoluta alla dose di 500 mg o di 850 mg è di circa il 50-60% in soggetti sani. Dopo la somministrazione orale di una singola dose di 500–2500 mg, è stato osservato un aumento sproporzionato del Cmax , forse a causa di un meccanismo di saturazione. Utilizzando dosi standard di metformina, i livelli di stato di equilibrio dinamico sono raggiunti nel plasma entro 24–48 ore. Questi sono generalmente inferiori a 1 µg/ml. Studi clinici controllati hanno dimostrato che Cmax non supera i 4 µg/ml anche utilizzando dosi massime.
Il cibo riduce e ritarda l'assorbimento della metformina. Una dose di 850 mg con il cibo ha portato a un Cmax inferiore del 40%, un'AUC inferiore del 25% e un Tmax più lungo di 35 minuti. La rilevanza clinica di questi cambiamenti è ancora sconosciuta.
Distribuzione
Vildagliptin
Vildagliptin si lega solo leggermente alle proteine plasmatiche (9.3%) ed è distribuito uniformemente tra plasma e globuli rossi. Il volume medio di distribuzione di vildagliptin allo stato di equilibrio dinamico dopo somministrazione endovenosa (Vss) è di 71 l.
Metformina
Il legame delle proteine plasmatiche della metformina è trascurabile. La metformina si diffonde parzialmente negli eritrociti. La concentrazione massima del sangue è inferiore alla concentrazione massima del plasma e viene raggiunta quasi simultaneamente. Gli eritrociti probabilmente rappresentano un compartimento secondario di distribuzione.
Il volume medio di distribuzione è di 63–276 l.
Non è noto se la metformina passi la barriera placentare e venga escreta nel latte materno. Nel ratto, piccole quantità sono state rilevate nel latte materno.
Metabolismo
Vildagliptin
Vildagliptin è in gran parte metabolizzato (69% della dose), parzialmente dalla DPP‑4. Il principale metabolita LAY151 formato da idrolisi (57% della dose) è inattivo. Inoltre è presente un prodotto di idrolisi dell'ammide (4% della dose). Vildagliptin non è metabolizzato tramite gli enzimi del citocromo P450.
Metformina
La metformina non è metabolizzata negli esseri umani.
Eliminazione
Vildagliptin
L'85% della dose viene escreto nelle urine e il 15% della dose si trova nelle feci. Il vildagliptin immodificato rappresenta il 23% della dose. L'emivita di eliminazione è di circa 3 ore.
Metformina
La metformina è escreta immodificata nelle urine. La clearance renale è > 400 ml/min ed è quindi circa 3.5 volte superiore a quella della creatinina. Viene quindi eliminata prevalentemente con la secrezione tubolare attiva. L'emivita di eliminazione del plasma dopo somministrazione orale è di circa 6.5 ore. Misurato nel sangue intero, l'emivita è di circa 17.6 ore.
Con una normale funzionalità renale, la metformina non si accumula nell'organismo alla dose abituale (1500–2000 mg).
Cinetica di gruppi di pazienti speciali
Sesso
Vildagliptin
Non sono state osservate differenze nella farmacocinetica di vildagliptin tra uomini e donne.
Disturbi della funzionalità epatica
Vildagliptin
L'esposizione a vildagliptin (100 mg) dopo una singola dose di 100 mg non è aumentata in caso di insufficienza epatica lieve e moderata, mentre aumentava del 22% in caso di insufficienza epatica grave (limite superiore di CI 68%).
Disturbi della funzionalità renale
Vildagliptin
In uno studio farmacocinetico, l'AUC di vildagliptin in pazienti con disfunzione renale lieve (clearance della creatinina [CrCl] da 50 a < 80 ml/min), moderata (CrCl da 30 a < 50 ml/min) e grave (CrCl < 30 ml/min) era in media rispettivamente di 1.4, 1.7 e 2 volte maggiore rispetto a quella dei soggetti sani. L'AUC del metabolita LAY151 è aumentata di 1.6, 3.2 e 7.3 volte e quella del metabolita BQS867 di 1.4, 2.7 e 7.3 volte rispettivamente in pazienti con disfunzione renale lieve, moderata e grave. Dati limitati provenienti da pazienti con malattia renale allo stadio terminale (ESRD) suggeriscono che l'esposizione a vildagliptin è simile a quella di pazienti con insufficienza renale grave. L'AUC di LAY151 in pazienti con ESRD era 6.8 volte superiore rispetto a quella dei pazienti con funzionalità renale normale.
Vildagliptin è stato eliminato in misura limitata dall'emodialisi (3% con un'emodialisi della durata di
3–4 ore iniziata 4 ore dopo la somministrazione).
Metformina
Nei pazienti con compromissione della funzione renale, la clearance renale è ridotta proporzionalmente alla clearance della creatinina o l'emivita di eliminazione è prolungata e sussiste un rischio di accumulo.
Pazienti anziani
Vildagliptin
Le concentrazioni plasmatiche sono elevate nei pazienti di età superiore ai 70 anni. Tuttavia, la variazione dell'esposizione al vildagliptin non è clinicamente rilevante.
Dati preclinici
Gli studi con i principi attivi combinati di Galvumet sono stati condotti su animali per un massimo di 13 settimane. Non sono state riscontrate nuove tossicità in associazione con la combinazione. I seguenti dati sono i risultati di studi condotti individualmente con vildagliptin o metformina.
Vildagliptin
In uno studio sulla distribuzione nei ratti sono state misurate concentrazioni, nel rene e nel fegato, di10–30 volte superiori nei tessuti rispetto a quelle nel plasma.
Con concentrazioni in vitro e concentrazioni plasmatiche in vivo nei cani significativamente maggiori rispetto ai livelli di esposizione umana basati su Cmax a 50 mg di vildagliptin (80–260 volte per i reperti in vitro e 43 volte per i reperti in vivo), sono stati osservati un effetto inibitorio sui canali del sodio cardiaco, una diminuzione del tasso di depolarizzazione delle fibre di Purkinje, una conduzione rallentata nei cuori di coniglio isolati e un allargamento del QRS nell'ECG nei cani.
Metformina
I dati di studi preclinici basati su studi di sicurezza farmacologica, tossicità a dose ripetuta, genotossicità, cancerogenicità e tossicità per la riproduzione non hanno indicato alcun rischio particolare per l'uso umano.
Tossicità cronica (o tossicità per somministrazione ripetuta)
Vildagliptin
Nei ratti, uno studio di cancerogenicità è stato eseguito per 2 anni con dosi orali fino a 900 mg/kg (circa 370 volte l'esposizione umana all'AUC a 50 mg). Non è stato osservato alcun aumento dell'incidenza tumorale dovuta a vildagliptin. Nei topi è stato condotto uno studio biennale di cancerogenicità con dosi orali fino a 1000 mg/kg (fino a 420 volte l'esposizione umana all'AUC a 50 mg di dose). L'incidenza di tumori mammari nei topi di sesso femminile era maggiore con una dose di vildagliptin circa 260 volte superiore alla dose umana di 50 mg; a circa 100 volte l'esposizione umana, i tumori mammari non erano più frequenti. L'incidenza dell'emangiosarcoma è stata aumentata nei topi maschi con livelli di esposizione AUC ≥74 volte la dose umana di 50 mg di vildagliptin e nelle femmine esposte a circa 260 volte l'esposizione umana. Non è stato osservato alcun aumento significativo dell'incidenza dell'emangiosarcoma con circa 27 volte l'esposizione umana di vildagliptin nei maschi e circa 100 volte l'esposizione umana nelle femmine.
Vildagliptin non è risultato mutageno in una serie di test di mutagenicità come il test di mutazione battericida inverso (test di Ames) e un test di aberrazione cromosomica dei linfociti umani. Un test del micronucleo di midollo osseo orale in ratti e topi non ha mostrato alcun potenziale clastogenico o oculare fino a 2000 mg/kg o circa 2000 volte la dose umana. Anche un test in vivo su cometa epatica di topo con lo stesso dosaggio è risultato negativo.
In uno studio di tossicità di 13 settimane sulle scimmie cynomolgus, le lesioni cutanee sono state registrate a dosi ≥5 mg/kg/die. Queste lesioni erano limitate alle estremità (mani, piedi, orecchie e coda).
A 5 mg/kg/die (esposizione AUC leggermente superiore a quella umana a 50 mg di dosaggio) sono state osservate solo bolle. Queste lesioni erano comunque reversibili nonostante il trattamento continuo e non erano associate ad anomalie istopatologiche.
Sono state osservate desquamazione ed esfoliazione della pelle, nonché formazione di croste e ferite alla coda associate a cambiamenti istopatologici a dosi superiori a 20 mg/kg/die (equivalenti a circa 5 volte l'esposizione umana all'AUC a 50 mg di dose).
Lesioni necrotiche della coda sono state osservate a ≥80 mg/kg/die.
Le lesioni cutanee erano reversibili (ad almeno 80 mg/kg) se il trattamento è stato interrotto prima della comparsa della necrosi.
Le lesioni cutanee non sono state osservate nell'uomo o in qualsiasi altra specie trattata con vildagliptin.
Mutagenicità
Metformina
Tutti i risultati dei test (test di Ames, test di mutazione genica, test delle aberrazioni cromosomiche, test del micronucleo) hanno dimostrato che la metformina non ha alcun effetto mutageno o clastogeno.
Cancerogenicità
Metformina
La metformina non è cancerogena nei roditori a dosi fino a 900 mg/kg/giorno (ratto) o 1500 mg/kg/giorno (topo).
Tossicità per la riproduzione
Metformina
La metformina non ha alcuna influenza sulla fertilità, non ha alcun effetto teratogeno e nessun effetto sullo sviluppo del neonato.
Altre indicazioni
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sulla confezione.
Indicazioni particolari concernenti l'immagazzinamento
Non conservare a temperature superiori a 30°C.
Conservare nella confezione originale e al riparo dall'umidità.
Conservare Galvumet fuori dalla portata dei bambini.
Numero dell'omologazione
58451 (Swissmedic)
Titolare dell’omologazione
Novartis Pharma Schweiz AG, Risch; domicilio: 6343 Rotkreuz
Stato dell'informazione
Settembre 2020
Composition
Principes actifs
Vildagliptinum et Metformini hydrochloridum.
Excipients
50/500 mg: Hydroxypropylcellulosum, Magnesii stearas, Hypromellosum, Titanii dioxidum, Ferri oxidum luteum, Ferri oxidum rubrum, Macrogolum 4000, Talcum.
50/850 mg: Hydroxypropylcellulosum, Magnesii stearas, Hypromellosum, Titanii dioxidum, Ferri oxidum luteum, Macrogolum 4000, Talcum.
50/1000 mg: Hydroxypropylcellulosum, Magnesii stearas, Hypromellosum, Titanii dioxidum, Ferri oxidum luteum, Macrogolum 4000, Talcum.
Forme pharmaceutique et quantité de principe actif par unité
Comprimés pelliculés de
- 50 mg de vildagliptine et 500 mg de chlorhydrate de metformine ou
- 50 mg de vildagliptine et 850 mg de chlorhydrate de metformine ou
- 50 mg de vildagliptine et 1000 mg de chlorhydrate de metformine.
50 mg/500 mg: comprimés pelliculés jaune clair, de forme ovalaire, à bords biseautés; «NVR» est gravé sur une face et «LLO» sur l'autre.
50 mg/850 mg: comprimés pelliculés jaunes, de forme ovalaire, à bords biseautés; «NVR» est gravé sur une face et «SEH» sur l'autre.
50 mg/1000 mg: comprimés pelliculés jaune foncé, de forme ovalaire, à bords biseautés; «NVR» est gravé sur une face et «FLO» sur l'autre.
Indications/Possibilités d’emploi
Patients atteints de diabète sucré de type 2 (DT2):
Galvumet est indiqué dans le traitement adjuvant avec un régime et de l'activité physique chez les patients chez lesquels une monothérapie par chlorhydrate de metformine ou par vildagliptine n'a pas permis d'atteindre un contrôle suffisant de la glycémie, ou chez les patients déjà sous traitement par une association libre de chlorhydrate de metformine et de vildagliptine.
Galvumet est indiqué en association avec une sulfonylurée (c.-à-d. en triple association) dans le traitement adjuvant avec un régime et de l'activité physique chez les patients chez lesquels le traitement par la metformine et une sulfonylurée ne permet pas à lui seul d'obtenir un contrôle suffisant de la glycémie.
Galvumet est indiqué en association avec l'insuline pour améliorer le contrôle de la glycémie chez les patients chez lesquels le régime, l'activité physique ainsi que le traitement par une dose stable d'insuline et de metformine ne permettent pas d'obtenir un contrôle suffisant de la glycémie.
Posologie/Mode d’emploi
Le traitement antidiabétique doit être dosé de façon individuelle en se fondant sur l'efficacité et la tolérance. Lors de l'utilisation de Galvumet, la dose maximale recommandée de 100 mg de vildagliptine par jour ne doit pas être dépassée.
La dose recommandée initiale de Galvumet doit se fonder sur le traitement par vildagliptine et/ou par metformine en cours jusque-là. Afin de réduire les effets indésirables gastro-intestinaux de la metformine, la dose quotidienne totale de metformine doit être prise en 2–3 doses identiques réparties dans la journée au moment des repas, Galvumet étant pris 2 fois par jour.
Instauration du traitement
Dose initiale chez les patients dont le contrôle est inadéquat sous monothérapie par la vildagliptine
En se fondant sur la dose initiale habituelle de metformine (dose journalière: 500 mg–1000 mg), il faudra commencer le traitement par Galvumet avec les comprimés dosés à 50 mg/500 mg ou à 50 mg/850 mg 2 fois par jour. La dose de metformine devra être ajustée par étapes en fonction de l'évaluation de la réponse thérapeutique.
Dose initiale chez les patients dont le contrôle est inadéquat sous monothérapie par la metformine
En se fondant sur la dose actuelle de metformine, il faudra commencer le traitement par Galvumet avec les comprimés dosés à 50 mg/500 mg, à 50 mg/850 mg ou à 50 mg/1000 mg 2 fois par jour.
Dose initiale chez les patients passant d'une association libre de metformine et de vildagliptine à Galvumet
En se fondant sur les doses actuellement prises de metformine ou de vildagliptine, il faudra commencer le traitement par Galvumet avec les comprimés dosés à 50 mg/500 mg, à 50 mg/850 mg ou à 50 mg/1000 mg.
Traitement associé
Utilisation en association avec l'insuline ou une sulfonylurée
En se fondant sur la dose actuellement prise de metformine, le traitement par Galvumet doit être pris avec les comprimés dosés à 50 mg/500 mg, à 50 mg/850 mg ou à 50 mg/1000 mg 2 fois par jour.
En cas d'association avec une sulfonylurée, une posologie plus faible de la sulfonylurée peut être envisagée pour réduire le risque d'hypoglycémie.
Patients présentant des troubles de la fonction hépatique
L'utilisation de Galvumet n'est pas recommandée chez les patients présentant des troubles de la fonction hépatique, y compris chez les patients dont les taux d'ASAT ou d'ALAT sont > 2.5x la limite supérieure de la norme (voir «Mises en garde et précautions»).
Patients présentant des troubles de la fonction rénale
Le débit de filtration glomérulaire (DFG) doit être vérifié avant de commencer un traitement par des produits contenant de la metformine (comme Galvumet) et par la suite au moins une fois par an. La fonction rénale doit être vérifiée plus souvent, par ex. tous les 3 à 6 mois, chez les patients présentant un risque élevé de progression d'un trouble de la fonction rénale ainsi que chez les patients âgés.
Avant d'envisager un traitement par des produits contenant de la metformine (comme Galvumet) chez des patients présentant un DFG < 60 ml/min, les facteurs augmentant le risque d'acidose lactique doivent être vérifiés (voir «Mises en garde et précautions»). En raison de son principe actif, la metformine, Galvumet est contre-indiqué chez les patients présentant un DFG < 30 ml/min (voir «Contre-indications»).
Les recommandations posologiques suivantes doivent être prises en compte en fonction du statut actuel de la fonction rénale:
Clairance de la créatinine ml/min DFGe ml/min/1.73 m2 | Metformine | Vildagliptine |
|---|---|---|
60–89 | La dose quotidienne maximale s'élève à 3000 mg*. Une réduction de la dose peut être envisagée si la fonction rénale se détériore. | La dose quotidienne maximale s'élève à 100 mg. |
45–59 | Le traitement doit être initié à une dose de 500 mg ou 850 mg de metformine par jour. La dose quotidienne maximale s'élève à 1000 mg, répartie en 2 doses individuelles. La fonction rénale (clairance de la créatinine, DFGe) doit être étroitement contrôlée tous les 3 à 6 mois. | La dose quotidienne maximale s'élève à 50 mg. |
30–44 | Le traitement doit être initié à une dose de 500 mg ou 850 mg de metformine par jour. La dose quotidienne maximale s'élève à 1000 mg, répartie en 2 doses individuelles. La fonction rénale (clairance de la créatinine, DFGe) doit être étroitement contrôlée au moins tous les 3 mois. | |
< 30 | La metformine est contre-indiquée. | |
* Si une dose de metformine supérieure à celle pouvant être atteinte par Galvumet seul est considérée comme nécessaire. | ||
Si, pour un des deux principes actifs, la dose nécessaire n'est pas disponible avec Galvumet, les deux principes actifs individuels doivent être utilisés à la place de la forme combinée.
Patients âgés
Etant donné que la metformine est éliminée par voie urinaire et que les patients âgés présentent une tendance à la diminution de la fonction rénale, la fonction rénale doit être régulièrement contrôlée chez les patients âgés prenant des produits contenant de la metformine (comme Galvumet). Galvumet ne doit être utilisé chez les patients âgés que si leur fonction rénale est normale (voir «Contre-indications» et «Mises en garde et précautions»).
Enfants et adolescents
L'efficacité et la sécurité d'emploi de Galvumet n'ont pas été démontrées chez les patients de moins de 18 ans. Par conséquent, l'utilisation de Galvumet n'est pas recommandée chez les patients pédiatriques.
Contre-indications
- Hypersensibilité aux principes actifs ou à l'un des excipients.
- Acidose lactique, acidocétose diabétique ou précoma diabétique.
- Trouble sévère de la fonction rénale (DFG < 30 ml/min) (voir «Posologie/Mode d'emploi» et «Mises en garde et précautions»).
- États aigus potentiellement accompagnés d'une altération de la fonction rénale, tels que
- déshydratation,
- infections sévères,
- états de choc,
- administration intravasculaire de produits de contraste contenant de l'iode (voir «Mises en garde et précautions»).
- Maladies aiguës ou chroniques susceptibles de provoquer une hypoxie tissulaire, telles que
- insuffisance cardiaque,
- insuffisance respiratoire,
- infarctus du myocarde récent,
- état de choc.
- Altération de la fonction hépatique (voir «Posologie/Mode d'emploi», «Mises en garde et précautions» et «Effets indésirables»).
- Intoxication alcoolique aiguë, alcoolisme.
- Allaitement (voir «Grossesse/Allaitement»).
Mises en garde et précautions
Galvumet
De manière générale
Galvumet n'est pas un substitut de l'insuline chez les patients insulinodépendants. Galvumet ne doit pas être utilisé chez les patients diabétiques de type 1, ni chez les patients en acidocétose.
Hypoglycémies
Les patients recevant Galvumet en association avec une sulfonylurée ou de l'insuline sont éventuellement exposés à un risque accru d'hypoglycémie. Par conséquent, une diminution de la dose de la sulfonylurée ou de l'insuline doit éventuellement être envisagée pour réduire le risque d'hypoglycémie.
Vildagliptine
Lésions hépatiques
La vildagliptine n'est pas recommandée chez les patients présentant des troubles de la fonction hépatique, y compris chez les patients dont les taux d'ASAT ou d'ALAT sont > 2.5x la limite supérieure de la norme avant le traitement.
Par conséquent, Galvumet n'est pas recommandé chez les patients avec lésions hépatiques.
Surveillance des enzymes hépatiques
Des cas de troubles de la fonction hépatique (y compris de rares cas d'hépatite) ont été rapportés. Les patients étaient alors en général asymptomatiques, sans manifestations cliniques, et les tests hépatiques se sont normalisés après l'arrêt du traitement. Des tests de la fonction hépatique sont indiqués avant le début du traitement par Galvumet, afin de déterminer les valeurs de base des patients. Durant le traitement par Galvumet, la fonction hépatique doit être contrôlée à intervalles de trois mois durant la première année, puis périodiquement. Chez les patients développant une augmentation des valeurs des transaminases, ces tests doivent être répétés et, en cas de confirmation du résultat, le patient devra être surveillé à intervalles raccourcis jusqu'à la normalisation. En cas d'augmentation de l'ASAT ou de l'ALAT à ≥3x la limite supérieure de la norme, il est recommandé d'arrêter le traitement par Galvumet.
Le traitement par Galvumet devra être interrompu chez les patients développant un ictère ou d'autres signes d'une dysfonction hépatique.
Après l'arrêt du traitement par Galvumet et la normalisation des tests de la fonction hépatique, le traitement par Galvumet ne doit pas être repris.
Pancréatite
Depuis la commercialisation, des cas de pancréatite aigüe ont spontanément été rapportés comme effet indésirable. Les patients doivent donc être informés des symptômes caractéristiques d'une pancréatite aigüe: des douleurs abdominales intenses et persistantes.
Une régression des pancréatites a été observée après l'arrêt de la vildagliptine. En cas de suspicion de pancréatite, il convient d'arrêter la vildagliptine ainsi que les autres médicaments potentiellement suspects.
Insuffisance cardiaque
Une étude clinique menée avec la vildagliptine chez des patients présentant une insuffisance cardiaque de la classe fonctionnelle I‑III selon la NYHA (New York Heart Association) a montré que le traitement par la vildagliptine n'entraîne pas de modification de la fraction d'éjection ventriculaire gauche ni d'aggravation d'une insuffisance cardiaque congestive préexistante par rapport au placebo. L'expérience clinique chez les patients en classe fonctionnelle III selon la NYHA traités par la vildagliptine est encore limitée et les résultats de l'étude susmentionnée ne sont pas probants (voir «Propriétés/Effets»). L'utilisation de la vildagliptine n'a fait l'objet d'aucune expérience chez les patients présentant une insuffisance cardiaque de la classe fonctionnelle IV selon la NYHA au cours d'études cliniques. Son utilisation chez ces patients n'est donc pas recommandée.
Affections de la peau
Au cours des études toxicologiques non-cliniques, des lésions cutanées telles que la formation de phlyctènes et des ulcérations des extrémités ont été rapportées chez les singes (voir le paragraphe «Données précliniques»). Bien qu'une incidence accrue des lésions cutanées n'ait pas été observée lors des essais cliniques, l'expérience est limitée chez les patients souffrant de complications cutanées du diabète. Une surveillance des affections de la peau à la recherche de phlyctènes et d'ulcères est donc recommandée, comme cela se fait dans la pratique courante chez les patients diabétiques.
Myopathie/Rhabdomyolyse
En rapport avec la prise de Galvumet, des cas de myopathie se manifestant sous la forme d'une douleur, d'une faiblesse ou d'une sensibilité musculaires associées à une concentration fortement accrue de créatine kinase (CK, à une concentration dix fois plus élevée que la limite supérieure de la normale) ont été rapportés. La myopathie peut parfois survenir sous la forme d'une rhabdomyolyse avec ou sans insuffisance rénale aiguë en raison d'une myoglobinurie et des cas de décès se sont rarement produits.
Les médecins doivent prescrire Galvumet avec prudence chez les patients présentant des facteurs prédisposant à une rhabdomyolyse. Un taux de créatine kinase doit être déterminé avant le début du traitement dans les situations suivantes:
- Insuffisance rénale
- Hypothyréose non contrôlée
- Antécédents personnels ou familiaux d'affections musculaires héréditaires
- Antécédents de toxicité musculaire avec une statine ou un fibrate
- Dépendance à l'alcool
- Personnes âgées (≥65 ans): la nécessité d'une telle mesure doit être prise en considération en présence d'autres facteurs de prédisposition à une rhabdomyolyse
- Sexe féminin
Dans de telles situations, le risque d'un traitement doit être considéré par rapport au bénéfice éventuel.
Metformine
Insuffisance cardiaque
La metformine est contre-indiquée chez les patients insuffisants cardiaques, ce qui explique que Galvumet soit contre-indiqué chez cette population de patients (voir le paragraphe «Contre‑indications»).
Acidose lactique
L'acidose lactique est une complication métabolique grave mais très rare (3 cas pour 100 000 patients-années), qui survient dans la plupart des cas avec une détérioration aiguë de la fonction rénale, une maladie cardiorespiratoire ou un sepsis et qui est associée à une mortalité élevée lorsqu'elle n'est pas traitée suffisamment tôt. Une accumulation de metformine se produit avec une détérioration aiguë de la fonction rénale et augmente le risque d'acidose lactique. Une insuffisance rénale aiguë (organique ou fonctionnelle) peut être à l'origine d'une accumulation de metformine.
La symptomatologie est peu spécifique, l'acidose lactique peut se manifester par l'apparition de crampes musculaires, accompagnées de troubles gastro-intestinaux, de douleurs abdominales, d'une augmentation de la fréquence respiratoire et d'une asthénie intense. Ces symptômes doivent toujours attirer l'attention du médecin traitant, et il devrait expliquer à son patient quels sont les signes évoquant une acidose lactique.
En cas de déshydratation (par ex. par diarrhées ou vomissements sévères, fièvre ou apport réduit de liquides), le patient doit arrêter la prise des produits contenant de la metformine (comme Galvumet) et consulter immédiatement un médecin.
Produits de contraste contenant de l'iode
L'administration intravasculaire de produits de contraste contenant de l'iode pour des examens radiographiques (urographie i.v., angiographie, etc.) peut entraîner une accumulation de metformine et un risque accru d'acidose lactique. La prise de produits contenant de la metformine (comme Galvumet) doit être interrompue avant ou au moment de procéder à un examen par imagerie et ne peut être poursuivie qu'au plus tôt 48 h après l'examen avec un produit de contraste, et uniquement après contrôle de la fonction rénale et avec des valeurs stables (voir «Posologie/Mode d'emploi» et «Interactions»).
Les préparations pouvant fortement nuire à la fonction rénale (telles que les antihypertenseurs, les diurétiques et les AINS) ne doivent être instaurées qu'avec prudence chez les patients traités par des produits contenant de la metformine (comme Galvumet). La consommation excessive d'alcool, les troubles de la fonction hépatique, un diabète insuffisamment traité, une cétose, un jeûne durable et tout autre état associé à une hypoxie, ainsi que l'utilisation concomitante de préparations pouvant provoquer une acidose lactique, sont d'autres facteurs de risque de l'acidose lactique (voir «Contre‑indications» et «Interactions»).
Les patients et/ou les personnes les prenant en charge doivent être informés du risque d'acidose lactique. L'acidose lactique se caractérise par une dyspnée acidosique, des douleurs abdominales, des crampes musculaires, une asthénie et une hypothermie suivie d'un coma. Les paramètres de laboratoire suivants permettent de poser le diagnostic devant une telle symptomatologie: diminution du pH sanguin (< 7.35), taux plasmatique de lactate élevé (> 5 mmol/l), trou anionique augmenté et rapport lactates/pyruvates augmenté.
En cas de suspicion d'acidose lactique, les médicaments contenant de la metformine (comme Galvumet) doivent être arrêtés et il convient d'hospitaliser le patient sans tarder. La manière la plus efficace d'éliminer tant le lactate que la metformine est l'hémodialyse (voir «Surdosage»).
Fonction rénale (voir «Contre-indications»)
Le DFG doit être contrôlé avant le début du traitement puis à intervalles réguliers par la suite (voir «Posologie/Mode d'emploi»). Les produits contenant de la metformine (comme Galvumet) sont contre-indiqués chez les patients présentant un DFG < 30 ml/min et tout traitement avec ces médicaments doit être provisoirement arrêté en présence de conditions pouvant altérer la fonction rénale (voir «Contre-indications»).
Interventions chirurgicales
Les produits contenant de la metformine (comme Galvumet) doivent être arrêtés 48 heures avant une opération programmée sous anesthésie générale, spinale ou épidurale. Le traitement par la metformine ne pourra être repris, au plus tôt, que 48 heures après l'intervention et seulement après reprise de l'alimentation par voie orale et en présence d'une fonction rénale stable.
Consommation d'alcool
L'alcool potentialise l'effet de la metformine sur le métabolisme du lactate. Les patients doivent par conséquent être mis en garde contre la consommation excessive d'alcool pendant le traitement par des produits contenant de la metformine (comme Galvumet).
Les intoxications alcooliques sont associées à un risque accru d'acidose lactique, en particulier après un jeûne, en cas de malnutrition ou en présence d'un trouble de la fonction hépatique.
Taux de vitamine B12
La metformine a été associée, chez près de 7% des patients, à une diminution du taux sérique de vitamine B12 sans manifestations cliniques. Une telle diminution ne s'accompagne que rarement d'une anémie et semble rapidement réversible à l'arrêt de l'administration de metformine et/ou d'un traitement de supplémentation par de la vitamine B12. Un contrôle des paramètres hématologiques au moins une fois par an est indiqué chez les patients sous Galvumet. Toute perturbation doit faire l'objet d'investigations appropriées et, le cas échéant, des mesures adéquates doivent être entreprises.
Modification du statut clinique chez des patients dont le diabète de type 2 était bien équilibré auparavant
Une acidocétose ou une acidose lactique doit être immédiatement recherchée chez les diabétiques de type 2 bien équilibrés jusque-là et qui présentent subitement des modifications des paramètres de laboratoire ou une affection clinique (notamment s'il s'agit d'une affection indéterminée ou mal définie). En cas de survenue d'une acidose, Galvumet doit être immédiatement arrêté et les mesures appropriées doivent être entreprises sans tarder.
Hypoglycémie
Sous traitement par Galvumet seul, on n'observe habituellement pas d'hypoglycémie; une telle manifestation peut toutefois survenir en cas de prise calorique insuffisante ou de forte activité corporelle non adéquatement compensée par les apports caloriques ou encore en cas de consommation d'alcool. Les patients âgés, affaiblis ou mal nourris, ainsi que ceux atteints d'une insuffisance surrénale ou hypophysaire, ou sous l'emprise d'une intoxication alcoolique, sont plus enclins à présenter des hypoglycémies. Une hypoglycémie peut être difficile à reconnaître chez les patients âgés et chez ceux sous bétabloquants.
Les sulfonylurées sont connues pour provoquer une hypoglycémie. Les patients recevant Galvumet en association avec une sulfonylurée peuvent être exposés à un risque d'hypoglycémie. Par conséquent, une posologie plus faible de la sulfonylurée peut être envisagée pour réduire le risque d'hypoglycémie lors d'une association avec Galvumet.
Détérioration du contrôle de la glycémie
Lorsqu'un patient sous traitement antidiabétique est soumis à un stress tel que fièvre, traumatisme, infection, intervention chirurgicale etc., le contrôle de la glycémie peut temporairement se détériorer. Dans de telles situations, il peut s'avérer nécessaire d'arrêter l'administration de Galvumet et d'avoir recours, pendant un certain temps, à de l'insuline. Une fois l'épisode aigu surmonté, le traitement par Galvumet peut être repris.
Interactions
Galvumet
Aucune étude spécifiquement consacrée aux interactions de Galvumet n'a été menée. Les prises de positions suivantes reflètent les informations disponibles pour chacun des principes actifs.
Vildagliptine
Des études ont été menées sur les interactions médicamenteuses avec les médicaments habituellement prescrits en association chez les diabétiques de type 2 ou avec des médicaments à fenêtre thérapeutique étroite. Selon les résultats de ces études, aucune interaction cliniquement pertinente avec d'autres antidiabétiques oraux (glibenclamide, pioglitazone, metformine), avec l'amlodipine, la digoxine, le ramipril, la simvastatine, le valsartan ou la warfarine n'a été observée.
Metformine
Autres interactions
Certains médicaments, tels que les AINS, y compris les inhibiteurs sélectifs de la cyclo‑oxygénase (COX) II, les inhibiteurs de l'ECA, les antagonistes des récepteurs de l'angiotensine II et les diurétiques, en particulier les diurétiques de l'anse, peuvent nuire à la fonction rénale, ce qui augmente le risque d'acidose lactique. L'utilisation concomitante de telles préparations avec des produits contenant de la metformine (comme Galvumet) nécessite une surveillance étroite de la fonction rénale.
La perception des signaux d'alarme d'une hypoglycémie peut être perturbée sous l'influence de substances à effet sympatholytiques (par ex. bêtabloquants, clonidine, guanéthidine, réserpine).
Inducteurs enzymatiques / Inhibiteurs enzymatiques
Vildagliptine
Comme la vildagliptine n'inhibe ni n'induit les enzymes du CYP450, il est peu probable qu'elle interagisse avec les médicaments concomitants métabolisés par le CYP450 ou ayant un effet inhibiteur ou inducteur de ce cytochrome.
Effet de Galvumet sur d'autres médicaments
La metformine réduit la concentration plasmatique du furosémide (Cmax de 33%, AUC de 12%), et la demi-vie terminale est diminuée de 32%, sans modification de la clairance rénale du furosémide.
L'effet de la phenprocoumone peut être réduit, car son élimination est accélérée par la metformine.
Les études d'interactions avec le glibenclamide, la nifédipine, l'ibuprofène ou le propranolol n'ont mis en évidence aucun effet cliniquement pertinent sur les paramètres pharmacocinétiques de ces substances.
Effet d'autres médicaments sur Galvumet
Interactions influençant les effets de la metformine
Réduction de l'effet hypoglycémiant
Les glucocorticoïdes (systémiques et locaux), les β2‑sympathomimétiques, les diurétiques, les phénothiazines (par ex. chlorpromazine), les hormones thyroïdiennes, les œstrogènes, les contraceptifs oraux, les préparations de substitution hormonale, la phénytoïne, l'acide nicotinique, les antagonistes calciques, l'isoniazide et le tétracosactide peuvent augmenter la glycémie.
Renforcement de l'effet hypoglycémiant
Le furosémide augmente la concentration plasmatique de la metformine (Cmax de 22%, AUC de 15%) sans modification significative de la clairance rénale.
La nifédipine augmente la concentration plasmatique de la metformine (Cmax de 20%, AUC de 9–20%) par augmentation de l'absorption de la metformine.
La cimétidine augmente la Cmax de la metformine de 60% et l'AUC de 40%. La durée de demi-vie d'élimination de la metformine n'est pas influencée. D'autres principes actifs (amiloride, digoxine, morphine, procaïnamide, quinidine, quinine, ranitidine, triamtérène, triméthoprime ou vancomycine) éliminés par sécrétion tubulaire active au niveau des reins pourraient présenter des interactions avec la metformine. Pour cette raison, les patients prenant de tels médicaments doivent être soigneusement surveillés en cas de traitement par des produits contenant de la metformine (comme Galvumet).
Les inhibiteurs de l'ECA peuvent réduire la glycémie.
De même, la glycémie peut être réduite par les bêtabloquants, cet effet étant cependant nettement moins marqué pour les bêtabloquants cardiosélectifs (β1-sélectifs) que pour les bêtabloquants non cardiosélectifs.
L'utilisation concomitante d'inhibiteurs de la MAO et d'antidiabétiques oraux peut améliorer la tolérance au glucose et renforcer l'effet hypoglycémiant.
En cas de consommation concomitante d'alcool, l'effet hypoglycémiant de la metformine peut être renforcé au point d'entraîner un coma hypoglycémique.
Renforcement ou réduction de l'effet hypoglycémiant de la metformine
Les antagonistes H2, la clonidine et la réserpine peuvent soit renforcer soit affaiblir l'effet hypoglycémiant de la metformine.
Des perturbations du contrôle de la glycémie (y compris des hyperglycémies ou des hypoglycémies) ont été observées sous administration concomitante de quinolones et de metformine.
Interactions pouvant augmenter les effets secondaires de la metformine
Diurétiques: une acidose lactique peut survenir en raison des perturbations de la fonction rénale par les diurétiques (et notamment les diurétiques de l'anse). Par ailleurs, les diurétiques ont un effet hyperglycémiant.
Produits de contraste contenant de l'iode: en ce qui concerne les interactions avec les produits de contraste contenant de l'iode et le risque de déclenchement d'une acidose lactique, voir la rubrique «Mises en garde et précautions».
Alcool: en cas d'intoxication alcoolique aiguë sous traitement par la metformine, notamment en cas de jeune préalable ou en présence d'une dénutrition ou d'un trouble de la fonction hépatique, le risque d'acidose lactique est augmenté.
Grossesse/Allaitement
Grossesse
Il n'existe pas de données suffisantes concernant l'emploi de Galvumet chez la femme enceinte. Les expérimentations animales ont révélé une toxicité de reproduction de la vildagliptine à doses élevées. Pour la metformine, les expérimentations animales n'ont révélé aucune toxicité de reproduction. Les expérimentations animales sur la vildagliptine et la metformine n'ont pas révélé de tératogénicité mais ont mis en évidence des effets toxiques pour le fœtus à des doses toxiques pour la femelle gestante (voir «Données précliniques»). Le risque potentiel pour l'être humain n'est pas connu. Galvumet ne doit pas être employé pendant la grossesse.
Allaitement
Les expérimentations animales ont révélé que tant la vildagliptine que la metformine passent dans le lait maternel. On ne sait pas si la vildagliptine passe dans le lait maternel chez l'être humain, la metformine est toutefois sécrétée à faibles doses dans le lait maternel humain. En raison du risque potentiel pour le nouveau-né d'hypoglycémies dues à la metformine et en l'absence de données sur la vildagliptine chez l'être humain, Galvumet ne doit pas être employé par les femmes qui allaitent (voir «Contre-indications»).
Fertilité
Aucune étude portant sur l'influence de Galvumet sur la fertilité humaine n'a été réalisée.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude sur l'aptitude à la conduite et l'utilisation de machines n'a été effectuée. Les patients souffrant de vertiges ne doivent par conséquent pas conduire de véhicules, ni utiliser des machines.
Effets indésirables
Galvumet
Les données disponibles se réfèrent à l'administration concomitante de vildagliptine et de metformine, en association libre ou fixe.
De rares cas d'angioedème ont été rapportés sous vildagliptine, leur nombre étant comparable à celui observé dans le groupe témoin. Un nombre plus important de cas a été rapporté en cas d'administration concomitante de vildagliptine et d'inhibiteurs de l'ECA. La majorité de ces événements étaient de faible intensité et ont disparu au cours de la poursuite du traitement par la vildagliptine.
De rares cas de perturbations de la fonction hépatique (y compris des hépatites) ont été rapportés sous vildagliptine. Les patients étaient généralement asymptomatiques, n'ont présenté aucune séquelle clinique et la fonction hépatique s'est normalisée après l'arrêt du traitement. Au cours d'études contrôlées sur la monothérapie et sur le traitement combiné d'une durée allant jusqu'à 24 semaines, l'incidence des augmentations supérieures ou égales à trois fois la limite supérieure de la normale des ALAT ou des ASAT (mises en évidence lors d'au moins deux examens consécutifs ou lors de la dernière consultation pour le traitement) était de 0.2% sous 50 mg de vildagliptine une fois par jour, de 0.3% sous 50 mg de vildagliptine deux fois par jour et de 0.2% sous tous les médicaments de comparaison. Ces augmentations des transaminases étaient généralement asymptomatiques, ne progressaient pas et n'étaient pas associées à une cholestase ou à un ictère.
Au cours d'études contrôlées, des cas occasionnels d'hypoglycémie ont été observés chez des patients ayant reçu de la vildagliptine en même temps que de la metformine ainsi que chez des patients ayant reçu un placebo en même temps que de la metformine. Dans le groupe vildagliptine, aucun cas d'hypoglycémie sévère n'est survenu.
Les effets indésirables gastro-intestinaux, y compris des diarrhées et des nausées, sont très fréquents lors de la phase d'introduction de la metformine.
Dans l'ensemble, des symptômes gastro-intestinaux ont été rapportés chez 12.9% des patients sous traitement associé par vildagliptine et metformine; chez les patients ayant reçu de la metformine seule, ce taux s'élevait à 18.1%.
Au cours d'études contrôlées comparant des monothérapies, des cas occasionnels d'hypoglycémie ont été constatés.
Les effets indésirables relevés au cours d'études en double aveugle lors desquelles les patients ont reçu de la vildagliptine en monothérapie ou en traitement adjuvant sont présentés ci-dessous par classe d'organes et par fréquences absolues. Les fréquences sont définies de la manière suivante:
«très fréquents» (≥1/10); «fréquents» (≥1/100 à < 1/10); «occasionnels» (≥1/1000 à < 1/100); «rares» (≥1/10 000 à < 1/1000); «très rares» (< 1/10 000); «inconnu»(les données disponibles n'en permettent pas l'estimation). Dans un même groupe de fréquence, les effets indésirables sont cités par fréquences décroissantes.
Infections
Très rares: infections des voies aériennes supérieures, rhinopharyngite.
Système nerveux
Fréquents: vertiges, tremblement.
Occasionnels: céphalées.
Vaisseaux sanguins
Occasionnels: œdèmes périphériques.
Troubles gastro-intestinaux
Fréquents: nausées.
Occasionnels: diarrhées, constipation.
Foie
Rares: transaminases augmentées.
Système musculaire et squelettique
Occasionnels: arthralgies.
Métabolisme
Occasionnels: hypoglycémie, gain pondéral.
Troubles généraux
Occasionnels: asthénie.
Aucun des effets indésirables survenus sous monothérapie par la vildagliptine n'a été observé à une fréquence cliniquement pertinente plus élevée lorsque la vildagliptine était administrée en association à la metformine.
Metformine
Les effets indésirables connus de la metformine sont présentés ci-dessous.
Troubles hématologiques et du système lymphatique
Cas isolés de leucopénie, de thrombopénie et d'anémie hémolytique.
Très rares: diminution du taux sanguin de vitamine B12.
Troubles du métabolisme et de la nutrition
Très fréquents: perte de l'appétit.
Très rares: acidose lactique (incidence 3 cas/100 000 patients-années, voir «Mises en garde et précautions»).
Troubles du système nerveux
Fréquents: dysgueusie (3%).
Occasionnels: fatigue.
Troubles gastro-intestinaux
Fréquents à très fréquents: troubles gastro-intestinaux (5–15%) tels que, par ex. nausées, vomissements, diarrhées, douleurs abdominales.
Ces symptômes surviennent le plus souvent au début du traitement et régressent en règle générale spontanément
Troubles de la fonction du foie et de la bile
Cas isolés: valeurs anormales aux tests fonctionnels, par ex. transaminases augmentées ou hépatite (réversibles après l'arrêt de la metformine).
Troubles de la fonction de la peau et des tissus sous-cutanés
Très rares: réactions de la peau telles qu'érythème, prurit, urticaire.
Association de la vildagliptine avec l'insuline (avec/sans metformine)
Au cours des études cliniques contrôlées réalisées, la fréquence des hypoglycémies a été similaire dans les deux groupes de traitement (14.0% des patients sous vildagliptine versus 16.4% des patients sous placebo). Des hypoglycémies sévères sont survenues chez n = 2 patients sous vildagliptine versus n = 6 sous placebo. L'influence sur le poids moyen a été globalement faible dans les deux groupes de traitement (+0.6 kg sous vildagliptine versus +/‑0 kg sous placebo).
Les effets indésirables survenus sous vildagliptine dans ces études ont été:
Système nerveux
Fréquents: céphalées.
Tractus gastro-intestinal
Fréquents: nausées, reflux gastro-œsophagien.
Occasionnels: diarrhée, flatulence.
Troubles généraux
Fréquents: frissons.
Investigations
Fréquents: glycémie diminuée.
Les sorties d'étude dues à ces effets indésirables ont globalement été rares.
Association avec une sulfonylurée
Une hypoglycémie a été fréquente dans les deux groupes thérapeutiques (5.1% pour vildagliptine + metformine + glimépiride vs 1.9% pour placebo + metformine + glimépiride). Un cas sévère d'hypoglycémie a été rapporté dans le groupe vildagliptine. À la fin de l'étude, l'effet sur le poids corporel moyen était faible (+0.6 kg dans le groupe vildagliptine et 0.1 kg dans le groupe placebo).
Effets indésirables survenus chez les patients ayant pris 50 mg de Galvus deux fois par jour en association avec la metformine et une sulfonylurée (n = 157):
Troubles du métabolisme et de la nutrition
Fréquents: hypoglycémie.
Système nerveux
Fréquents: sensation vertigineuse, tremblement.
Peau
Fréquents: hyperhidrose.
Troubles généraux
Fréquents: asthénie.
Effets indésirables après commercialisation
Galvumet
Les données disponibles se réfèrent à l'administration concomitante de vildagliptine et de metformine, en association libre ou fixe.
Après la commercialisation, les réactions indésirables suivantes ont été rapportées spontanément ou dans la littérature. Dans la mesure où ces réactions ont été signalées volontairement par une population de taille inconnue, il est impossible d'estimer leur fréquence de manière fiable. Celle-ci est donc considérée comme «inconnue».
- Hépatite ayant régressé après l'arrêt de Galvumet (voir «Mises en garde et précautions»).
- Urticaire, exanthèmes bulleux, exfoliations cutanées locales ou formation de vésicules sur la peau, y compris pemphigoïde bulleuse.
- Pancréatite.
- Rhabdomyolyse (observation après commercialisation. Fréquence inconnue).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch
Surdosage
Signes et symptômes
Vildagliptine
Dans les essais cliniques, les œdèmes et les douleurs musculaires étaient dose-limitants. Sous 600 mg, un sujet a présenté des œdèmes des mains et des pieds, ainsi qu'une élévation excessive de la créatine phosphokinase (CPK), associée à une augmentation des taux d'aspartate aminotransférase (ASAT), de protéine C‑réactive et de myoglobine. Trois autres participants de ce groupe posologique ont souffert d'œdèmes aux deux pieds, s'accompagnant dans deux cas de paresthésies. Tous les symptômes et tous les paramètres de laboratoires se sont normalisés après l'arrêt de la prise du médicament à l'étude.
Metformine
Même en cas de prise de doses extrêmement élevées de metformine (jusqu'à 85 g), aucune hypoglycémie n'a été observée; toutefois, dans de telles circonstances, une acidose lactique est survenue. L'acidose lactique est une urgence médicale imposant l'hospitalisation du patient (voir «Mises en garde et précautions»).
Traitement
Vildagliptine
En cas de surdosage, la prise du médicament doit être interrompue et le patient doit bénéficier d'un traitement symptomatique et de soutien.
La vildagliptine n'est pas dialysable; son principal métabolite d'hydrolyse peut être éliminé par hémodialyse.
Metformine
Le lactate de même que la metformine peuvent être éliminés par hémodialyse.
Propriétés/Effets
Code ATC
A10BD08
Mécanisme d'action
Galvumet
Galvumet combine deux principes actifs hypoglycémiants aux mécanismes d'action différents afin d'améliorer le contrôle de la glycémie chez les patients atteints d'un diabète de type 2: la vildagliptine est un inhibiteur de la DPP‑4 (dipeptyl‑peptidase‑4) et la metformine fait partie de la classe des biguanides.
Vildagliptine
L'administration de vildagliptine provoque une inhibition de l'activité de la DPP‑4, ce qui entraîne une augmentation tant à jeun que postprandiale des taux endogènes de deux incrétines, les hormones GLP‑1 (glucagon‑like peptide 1) et GIP (glucose‑dependent insulinotropic polypeptide).
Metformine
La metformine est un antidiabétique oral appartenant à la classe des biguanides. L'effet hypoglycémiant de la metformine repose principalement sur son action contre l'insulino-résistance au niveau hépatique et musculaire.
Pharmacodynamique
Vildagliptine
Par l'augmentation des taux endogènes de ces deux incrétines, la vildagliptine renforce la sensibilité des cellules bêta au glucose, ce qui entraîne une amélioration de la sécrétion d'insuline glucose-dépendante. Le traitement par 50–100 mg de vildagliptine par jour a entraîné chez les patients diabétiques de type 2 une amélioration significative des marqueurs de la fonction des cellules bêta, y compris de l'HOMA‑β (Homeostasis Model Assessment‑β), du rapport proinsuline/insuline et des paramètres de la sensibilité des cellules bêta du test de tolérance au glucose souvent utilisé. Chez les personnes non diabétiques (normoglycémiques), la vildagliptine ne provoque ni stimulation de la sécrétion d'insuline, ni abaissement de la glycémie.
Avec l'augmentation des taux de GLP‑1 endogène, la vildagliptine renforce la sensibilité des cellules alpha au glucose, ce qui améliore l'adaptation de la libération du glucagon aux glycémies.
L'augmentation accrue du rapport insuline/glucagon dans l'hyperglycémie due à l'augmentation des taux d'hormones incrétines entraîne une diminution de la production hépatique de glucose à jeun et postprandial, entraînant un abaissement de la glycémie.
L'effet connu d'un ralentissement de la vidange gastrique en cas de taux augmentés de GLP‑1 ne s'observe pas sous vildagliptine.
Metformine
En présence d'insuline, elle réduit aussi bien le taux de glycémie basale que postprandiale. La metformine ne stimule pas la sécrétion d'insuline et n'entraîne pas d'hypoglycémie en monothérapie.
L'effet hypoglycémiant repose sur trois mécanismes:
Au niveau hépatique
La production hépatique de glucose est largement responsable de l'hyperglycémie à jeun. La metformine réduit la production hépatique du glucose activée par le phénomène de l'insulinorésistance en inhibant la néoglucogénèse et la glycogénolyse. Elle s'oppose ainsi également à l'action hyperglycémiante du glucagon. Par ces mécanismes, la metformine diminue l'hyperglycémie à jeun.
Au niveau musculaire
Les troubles de la captation périphérique du glucose et de son stockage sont largement responsables de l'hyperglycémie postprandiale. La metformine augmente la sensibilité cellulaire à l'insuline en stimulant l'activité tyrosine‑kinase du récepteur de l'insuline et favorise ainsi la pénétration cellulaire du glucose. La metformine augmente la capacité de transport de tous les types de transporteurs membranaires du glucose (GLUT). Cet effet de la metformine est particulièrement évident en état hyperglycémique. Elle stimule la synthèse intracellulaire du glycogène en agissant sur une enzyme clé, la glycogène-synthétase. Par ces mécanismes, la metformine diminue l'hyperglycémie postprandiale.
Au niveau intestinal
La metformine ralentit l'absorption intestinale du glucose, réduisant ainsi la charge glucosée postprandiale.
Effets sur le métabolisme lipidique et la fibrinolyse
Chez l'homme, indépendamment de son action sur la glycémie, la metformine a également des effets positifs sur le métabolisme lipidique. Ceci a été démontré à des doses thérapeutiques dans des études contrôlées à moyen ou long terme: la metformine réduit les taux de cholestérol total et de cholestérol LDL, ainsi que celui des triglycérides. De plus, quelques études ont démontré que la metformine peut augmenter le cholestérol HDL.
Par ailleurs, elle est dotée de propriétés fibrinolytiques.
Efficacité clinique
Galvumet
Il n'existe pas d'études cliniques sur l'efficacité de Galvumet. L'efficacité et la sécurité d'emploi de chacun de ses composants ont déjà été démontrées. L'efficacité et la sécurité d'emploi en cas d'administration associée des deux composants ont été évaluées lors de deux études cliniques. Ces deux études ont confirmé l'effet bénéfique supplémentaire apporté par la vildagliptine chez les patients dont le diabète de type 2 était mal équilibré sous traitement par la metformine.
Au cours d'une étude en double aveugle, contrôlée contre placebo, d'une durée de 24 semaines, portant sur des patients diabétiques de type 2 dont la glycémie était insuffisamment contrôlée sous une monothérapie par la metformine à des doses ≥2000 mg, la vildagliptine associée à la metformine a entraîné une baisse du taux d'HbA1c statistiquement significative par rapport au groupe sous metformine et placebo (la différence était de -0.7% en moyenne dans le groupe sous 50 mg de vildagliptine 1x/jour et de ‑1.1% dans celui sous 50 mg de vildagliptine 2x/jour).
L'efficacité de la vildagliptine, associée à 1000 mg de metformine, a été évaluée dans une autre étude clinique en double aveugle, contrôlée contre placebo, d'une durée totale de 52 semaines (12 semaines pour l'étude principale [n = 132] avec une prolongation de 40 semaines [n = 71]). L'ajout de la vildagliptine (50 mg une fois par jour) à la metformine a entraîné, à la fin des 12 premières semaines de l'étude (taux d'HbA1c moyen à l'inclusion de 7.7% respectivement 7.9%), une diminution supplémentaire et statistiquement significative du taux moyen d'HbA1c, comparé à sa valeur à l'inclusion (0.55%), par rapport au groupe sous metformine et placebo (+0.1%). Après 52 semaines, la différence moyenne par rapport à la valeur à l'inclusion était plus importante – la différence étant statistiquement significative – dans le groupe sous 50 mg de vildagliptine plus metformine que dans n'importe lequel des groupes sous monothérapie par metformine (la différence entre les groupes était de ‑1.1%).
Dans une étude sur 24 semaines, 50 mg de vildagliptine 2x/j a été comparée à 30 mg de pioglitazone 1x/j chez des patients dont la glycémie n'était pas contrôlée de manière suffisante sous metformine. Par rapport au taux initial d'HbA1c de 8.4%, la diminution moyenne s'additionnant à celle obtenue sous metformine était de 0.9% sous vildagliptine et de 1.0% sous pioglitazone. Pour une HbA1c initiale > 9.0%, cette diminution était plus prononcée dans les deux groupes de traitement, en l'occurrence 1.5%. Chez les patients qui ont reçu de la pioglitazone en plus de la metformine, le poids corporel a augmenté de 1.9 kg, et chez ceux qui ont reçu de la vildagliptine en plus de la metformine, le poids a augmenté de 0.3 kg. Dans une étude au long cours sur une période allant jusqu'à deux ans, la vildagliptine 50 mg 2x/j a été comparée au glimépiride jusqu'à 6 mg 1x/j chez des patients traités par la metformine. Après 2 ans, les taux d'HbA1c avaient en moyenne baissé de 0.06% sous l'association vildagliptine/metformine et de 0.14% sous l'association glimépiride/metformine. La modification du poids corporel était de -0.2 kg sous vildagliptine et de +1.2 kg sous glimépiride. L'incidence des épisodes d'hypoglycémie était significativement inférieure dans le groupe vildagliptine (2.3%) par rapport au groupe glimépiride (18.2%).
Au cours d'une étude de 52 semaines menée chez des patients dont la glycémie était insuffisamment contrôlée sous metformine, l'addition de vildagliptine 50 mg 2x/j à la metformine a été comparée à l'addition de gliclazide, à une posologie allant jusqu'à 320 mg/j, à la metformine. Après un an, l'HbA1c sous association vildagliptine/metformine avait diminué en moyenne de 0.81% (valeur initiale de l'HbA1c 8.4%) et de 0.85% sous gliclazide/metformine (valeur initiale de l'HbA1c 8.5%); la non-infériorité a été démontrée statistiquement. L'augmentation du poids des patients recevant du gliclazide en plus de la metformine était de 1.4 kg alors que les patients traités par la vildagliptine associée à la metformine enregistraient une prise de poids de 0.1 kg. Dans chacun des deux groupes, cinq patients (1.0%) ont présenté au moins un épisode hypoglycémique.
L'efficacité de l'association à dose fixe de vildagliptine et metformine (titration par paliers jusqu'à une dose de 50 mg/500 mg deux fois par jour ou 50 mg/1000 mg deux fois par jour) a été évaluée au cours d'une étude d'une durée de 24 semaines en traitement initial chez des patients naïfs de ce principe actif. La valeur initiale moyenne de l'HbA1c de 8.6% a été abaissée de -1.82% lors de la prise de 50 mg/1000 mg de vildagliptine/metformine deux fois par jour, de -1.61% lors de la prise de 50 mg/500 mg de vildagliptine/metformine deux fois par jour, de -1.36% lors de la prise de 1000 mg de metformine deux fois par jour et de -1.09% lors de la prise de 50 mg de vildagliptine deux fois par jour. La diminution de l'HbA1c chez les patients qui présentaient des valeurs initiales moyennes de ≥10% était plus élevée.
L'efficacité et la sécurité de la vildagliptine (50 mg deux fois par jour) en association avec une dose stable d'insuline basale ou d'insuline prémélangée (dose quotidienne moyenne de 41 U) avec ou sans metformine ont été évaluées dans une étude de 24 semaines, randomisée, en double aveugle, contrôlée par placebo, réalisée chez 449 patients. La vildagliptine en association avec l'insuline a significativement diminué le taux d'HbA1c par rapport au placebo: dans la population totale, la réduction ajustée en fonction du placebo a été de -0.72% pour un taux initial moyen d'HbA1c de 8.8%. Dans les sous-groupes traités par l'insuline avec ou sans metformine supplémentaire, la réduction moyenne du taux d'HbA1c, ajustée en fonction du placebo, a été resp. de -0.63 et -0.84%. Des hypoglycémies sont survenues chez resp. 8.4% et 7.2% des patients traités par la vildagliptine et le placebo. Le poids moyen des patients a présenté globalement peu de modifications (+0.2 kg sous vildagliptine et -0.7 kg sous placebo).
L'efficacité et la sécurité de la vildagliptine (50 mg deux fois par jour) en association avec la metformine (≥1500 mg par jour) et le glimépiride (≥4 mg par jour) ont été évaluées dans une étude de 24 semaines, randomisée, en double aveugle, contrôlée contre placebo, réalisée chez 318 patients. La vildagliptine en association avec la metformine et le glimépiride a significativement diminué le taux d'HbA1c par rapport au placebo: la réduction moyenne ajustée par rapport au placebo a été de -0.76%, pour un taux initial moyen d'HbA1c de 8.8%.
Vildagliptine
Deux études en double aveugle, contrôlées contre placebo, sur 24 semaines ont été réalisées chez des patients diabétiques de type 2 encore jamais traités. Ces études ont mis en évidence, pour une prise journalière unique de 50 mg de vildagliptine, des modifications moyennes statistiquement significatives de l'HbA1c par rapport à la valeur initiale et au placebo (-0.8% et -0.5% resp.).
La monothérapie avec la vildagliptine a d'autre part été comparée dans plusieurs essais à la metformine, à la rosiglitazone ou à la pioglitazone chez des patients n'ayant encore jamais été traités. Les patients souffraient d'un diabète depuis deux ans en moyenne. La vildagliptine a entraîné dans ces deux études une réduction cliniquement significative de l'HbA1c par rapport à la valeur initiale. La non-infériorité a été prouvée par rapport à la rosiglitazone, mais pas par rapport à la metformine et à la pioglitazone.
Dans une étude au long cours de 2 ans, la vildagliptine 50 mg 2x/j a été comparée au gliclazide jusqu'à 320 mg/j. Après deux ans, l'HbA1c avait diminué en moyenne de 0.5% sous vildagliptine et de 0.6% sous gliclazide. Sous vildagliptine, on a rapporté une prise pondérale moins importante ainsi que moins d'épisodes hypoglycémiques (0.7%) que sous gliclazide (1.6 kg et 1.7%).
Une étude multicentrique, randomisée, en double aveugle, de 52 semaines a été réalisée chez des patients atteints de diabète de type 2 et d'insuffisance cardiaque congestive (classe I‑III selon la NYHA) afin de déterminer l'effet de de la vildagliptine à la posologie de 50 mg 2 fois par jour (N = 128) sur la fraction d'éjection ventriculaire gauche (FEVG) par rapport au placebo (N = 126). La vildagliptine n'a pas été associée à une modification de la fraction d'éjection ventriculaire gauche ni à une aggravation d'une insuffisance cardiaque congestive préexistante. L'incidence des événements cardiovasculaires survenus pendant l'étude a globalement été équilibrée entre le bras vildagliptine et le bras placebo. Dans le sous-groupe en classe III selon la NYHA, l'incidence des effets indésirables cardiovasculaires a été plus élevée sous vildagliptine que sous placebo (31.9% vs 21.3%). Les différences ont surtout été dues au taux plus élevé de FA et de syndrome coronarien aigu. Lors de l'évaluation de ces différences, il faut tenir compte du fait qu'il existait un déséquilibre en termes de facteurs de risque cardiovasculaires en faveur du placebo et que le nombre d'événements cardiovasculaires était faible. Ces données ne permettent donc pas de conclure avec une sécurité suffisante à l'existence d'un risque accru chez les patients en classe III selon la NYHA. Il n'y a pas eu de différence quant à l'efficacité.
Risque cardiovasculaire
Une méta-analyse de 37 études cliniques de phase III et IV (durée de traitement de 2 semaines à ≥2 ans) n'a montré aucune différence cliniquement significative du risque cardiovasculaire entre la vildagliptine (en monothérapie ou en association; N = 9599) et les produits de comparaison (substances actives ou placebo; N = 7102): le rapport des risques estimé ponctuellement entre la vildagliptine et les comparateurs pour le critère composite d'évaluation d'événement cardiovasculaire indésirable majeur (MACE: décès cardiovasculaire, infarctus du myocarde non fatal, accident vasculaire cérébral non fatal) était de 0.82 [intervalle de confiance à 95% 0.61–1.1]. Les résultats du rapport des risques estimé ponctuellement pour les composantes MACE individuelles étaient ainsi concordants.
Les études sur le traitement associé avec la metformine ont été décrites précédemment.
Metformine
L'étude randomisée prospective UKPDS (UK Prospective Diabetes Study) a démontré l'effet bénéfique à long terme d'un contrôle intensif de la glycémie chez les patients souffrant d'un diabète de type 2. L'analyse des résultats chez les patients en surcharge pondérale traités par la metformine et chez qui le régime seul avait échoué, a mis en évidence:
- une diminution significative du risque absolu de complications liées au diabète dans le groupe sous metformine (29.8 événements/1000 patients‑années) par rapport au régime seul (43.3 événements/1000 patients‑années) p = 0.0023 et par rapport aux groupes sous traitement associé avec des sulfonylurées (SU) ou sous monothérapie avec de l'insuline (40.1 événements/1000 patients‑années) p = 0.0034
- une diminution significative du risque absolu de la mortalité liée au diabète: 7.5 événements/1000 patients‑années sous metformine, 12.7 événements/1000 patients‑années sous régime seul (p = 0.017)
- une diminution significative du risque absolu de la mortalité globale: 13.5 événements/1000 patients‑années sous metformine contre 20.6 événements/1000 patients‑années sous régime seul (p = 0.011), et contre 18.9 événements/1000 patients‑années pour les groupes sous SU associées ou monothérapie avec de l'insuline (p = 0.021)
- une diminution significative du risque absolu d'infarctus du myocarde: 11 événements/1000 patients‑années sous metformine contre 18 événements/1000 patients‑années sous régime seul (p = 0.01)
Pharmacocinétique
Absorption
Galvumet
Les études de bioéquivalence ayant comparé trois dosages (50 mg/500 mg, 50 mg/850 mg et 50 mg/1000 mg) de Galvumet contre l'association libre de vildagliptine et de metformine aux doses correspondantes ont permis de démontrer que la biodisponibilité de la vildagliptine de même que celle de la metformine étaient identiques.
L'alimentation n'influence ni l'importance quantitative ni la vitesse de l'absorption de la vildagliptine. La Cmax et l'AUC de la metformine ont diminué de 26% resp. 7% en cas d'administration en même temps que la prise de nourriture, et la résorption de la metformine a été retardée (Tmax, 2.0 à 4.0 h). Ces modifications de la Cmax et de l'AUC sont cohérentes mais moins marquées que celles observées après prise de metformine seule en même temps que de la nourriture. Les effets de l'alimentation sur la pharmacocinétique des deux composants de Galvumet, la vildagliptine et la metformine, étaient comparables à ceux observés en cas de prise d'une association libre de vildagliptine et de metformine en même temps que de la nourriture.
Vildagliptine
La vildagliptine est rapidement résorbée, avec une biodisponibilité orale de 85%. La concentration plasmatique maximale est atteinte après env. 1 h. L'absorption n'est pas significativement influencée par la prise de nourriture. Cette dernière n'affecte pas l'exposition totale (AUC).
Metformine
Après administration orale, le Tmax est de 2.5 h et l'absorption est complète après 6 h. On admet que l'absorption a essentiellement lieu dans la partie supérieure du tractus gastro-intestinal. La biodisponibilité absolue d'une dose de 500 mg ou de 850 mg est d'env. 50–60% chez une personne en bonne santé. Après prise orale d'une dose unique de 500–2500 mg, la Cmax observée n'augmente pas proportionnellement à la dose administrée, en relation probablement avec un mécanisme saturable. Aux posologies usuelles de metformine, des concentrations plasmatiques à l'état d'équilibre sont atteintes en 24 à 48 heures, et sont généralement inférieures à 1 µg/ml. Lors des études cliniques contrôlées, les Cmax observées n'ont pas excédé 4 µg/ml, même aux doses maximales.
La nourriture diminue et ralentit l'absorption de la metformine. Après administration d'une dose de 850 mg et la prise de nourriture, une diminution de la Cmax de 40%, une diminution de l'AUC de 25% et un allongement de 35 minutes du Tmax ont été observés. La signification clinique de ces modifications est encore inconnue à ce jour.
Distribution
Vildagliptine
La vildagliptine n'est que peu liée aux protéines plasmatiques (9.3%) et se répartit régulièrement entre le plasma et les globules rouges. Le volume de distribution moyen de la vildagliptine à l'état d'équilibre est de 71 l (Vss) après administration intraveineuse.
Metformine
La liaison aux protéines plasmatiques de la metformine est négligeable. La metformine diffuse en partie dans les érythrocytes. Le pic sanguin est plus faible que le pic plasmatique et apparaît approximativement au même moment. Les érythrocytes représentent probablement un compartiment secondaire de distribution.
Le volume de distribution moyen est de l'ordre de 63–276 l.
Il n'est pas établi si la metformine passe la barrière placentaire et si elle parvient dans le lait maternel. Chez la rate, de faibles quantités sont retrouvées dans le lait maternel.
Métabolisme
Vildagliptine
La vildagliptine est largement métabolisée (69% de la dose), en partie par la DPP4. LAY151 (57% de la dose), le principal métabolite formé par hydrolyse, est inactif. De plus, il existe un produit d'hydrolyse amide (4% de la dose). La vildagliptine n'est pas métabolisée par les enzymes du cytochrome P450.
Metformine
Chez l'être humain, la metformine n'est pas métabolisée.
Élimination
Vildagliptine
85% de la dose sont éliminés par voie urinaire et 15% de la dose se retrouvent dans les fèces. La vildagliptine inchangée représente 23% de la dose. La demi-vie d'élimination est d'environ 3 h.
Metformine
La metformine est excrétée dans l'urine sous forme inchangée. La clairance rénale est de > 400 ml/min, et donc de 3.5 fois supérieure à la clairance de la créatinine. L'élimination intervient donc principalement par sécrétion tubulaire active. Après administration orale, la demi-vie d'élimination plasmatique est d'environ 6.5 heures. Dans le sang complet, la demi-vie se situe à près de 17.6 heures.
En cas de fonction rénale normale, la metformine ne s'accumule pas dans l'organisme à la posologie usuelle recommandée (1500–2000 mg).
Cinétique pour certains groupes de patients
Sexe
Vildagliptine
Aucune différence au niveau de la pharmacocinétique de la vildagliptine n'a été observée entre les hommes et les femmes.
Troubles de la fonction hépatique
Vildagliptine
L'exposition à la vildagliptine après une dose unique de 100 mg n'était pas augmentée en cas d'insuffisance hépatique légère à modérée; elle était en revanche augmentée de 22% (limite supérieure de l'IC à 68%) en cas d'insuffisance hépatique sévère.
Troubles de la fonction rénale
Vildagliptine
Dans une étude pharmacocinétique, l'AUC de la vildagliptine a augmenté en moyenne d'un facteur 1.4, 1.7 et 2 chez des patients présentant respectivement des troubles de la fonction rénale légers (clairance de la créatinine [CrCl] comprise entre 50 et < 80 ml/min), modérés (CrCl entre 30 et < 50 ml/min) et sévères (CrCl < 30 ml/min) par rapport à l'AUC chez les volontaires sains. L'AUC du métabolite LAY151 a augmenté d'un facteur 1.6, 3.2 et 7.3 et celle du métabolite BQS867 a augmenté d'un facteur 1.4, 2.7 et 7.3 chez les patients présentant des troubles de la fonction rénale respectivement légers, modérés et sévères. Des données limitées indiquent que l'exposition à la vildagliptine est aussi élevée chez les patients atteints d'une insuffisance rénale au stade terminal (ESRD) que chez les patients présentant une altération de la fonction rénale sévère. L'AUC du LAY151 était 6.8 fois plus élevée chez les patients atteints d'une ESRD que chez les patients présentant une fonction rénale normale.
La vildagliptine a été éliminée de manière limitée par hémodialyse (3% au cours d'une séance d'hémodialyse de 3 à 4 heures, commencée 4 heures après l'administration).
Metformine
En cas d'atteinte de la fonction rénale, la clairance rénale est diminuée proportionnellement à celle de la créatinine, respectivement la demi-vie d'élimination prolongée, avec un risque d'accumulation.
Patients âgés
Vildagliptine
Chez les patients de plus de 70 ans, les concentrations plasmatiques sont augmentées. Les changements d'exposition à la vildagliptine ne sont toutefois pas cliniquement significatifs.
Données précliniques
Des études d'une durée allant jusqu'à 13 semaines ont été menées chez l'animal avec les principes actifs contenus dans Galvumet. Aucune nouvelle toxicité liée à l'association n'a été mise en évidence. Les données suivantes proviennent d'études menées sur la vildagliptine ou la metformine prises seules.
Vildagliptine
Dans une étude de distribution chez le rat, les concentrations mesurées dans les reins et dans le foie étaient de 10–30 fois plus élevées dans les tissus que dans le plasma.
Pour des concentrations in vitro et des concentrations plasmatiques in vivo chez le chien, situées nettement au-dessus des valeurs d'exposition à la Cmax chez l'homme pour 50 mg de vildagliptine (80–260 fois dans les mesures in vitro et 43 fois dans les valeurs in vivo), on a observé un effet inhibiteur sur les canaux sodiques cardiaques, une diminution des taux de dépolarisation des fibres de Purkinje, un ralentissement de la conduction dans des cœurs isolés de lapin et un élargissement du QRS à l'ECG chez le chien.
Metformine
Des données issues d'études précliniques, basées sur des essais portant sur la sécurité pharmacologique, la toxicité après administration répétée, la génotoxicité, la carcinogénicité et la toxicité sur la reproduction n'ont fourni aucun indice suggérant des risques particuliers pour l'utilisation chez l'homme.
Toxicité à long terme (ou toxicité en cas d'administration répétée)
Vildagliptine
Une étude de carcinogénicité a été effectuée chez le rat avec une dose orale jusqu'à 900 mg/kg (environ 370 fois l'exposition AUC de 50 mg chez l'homme) sur deux ans. Aucune augmentation de l'incidence des tumeurs due à la vildagliptine n'a été constatée. Une étude de carcinogénicité avec des doses orales atteignant 1000 mg/kg (près de 420 fois l'exposition AUC observée chez l'homme avec une dose de 50 mg) d'une durée de deux ans a été menée chez la souris. L'incidence du cancer du sein chez les souris femelles était augmentée sous une dose environ 260 fois plus élevée que la dose humaine de 50 mg de vildagliptine; les tumeurs mammaires n'étaient pas plus fréquentes à des doses de l'ordre de 100 fois supérieures à l'exposition humaine. L'incidence des hémangiosarcomes était augmentée chez des rats mâles avec une exposition AUC de ≥74 fois celle de la dose humaine de 50 mg de vildagliptine et chez des souris femelles exposées à des doses de l'ordre de 260 fois l'exposition humaine. Aucune augmentation significative de l'incidence des hémangiosarcomes n'a été observée pour des doses de vildagliptine équivalant à environ 27 fois l'exposition humaine chez les mâles et à environ 100 fois chez les femelles.
La vildagliptine n'a pas eu d'effet mutagène dans une série de tests de mutagénicité, tel que le test de rétromutation d'Ames et un test d'aberration chromosomique de lymphocytes humains. Un test micro‑nucléique oral sur moelle osseuse chez le rat et la souris n'a pas révélé de potentiel clastogène ou aneugène avec des doses allant jusqu'à 2000 mg/kg ou équivalant à environ 2000 fois la dose humaine. Un test des comètes sur le foie de souris in vivo avec les mêmes doses a également donné un résultat négatif.
Dans une étude de toxicité sur 13 semaines chez le singe Cynomolgus, des lésions cutanées ont été rapportées pour des doses ≥ à 5 mg/kg/j. Ces lésions concernaient uniquement les extrémités (mains, pieds, oreilles et queue).
Avec 5 mg/kg/j (une exposition AUC se situant légèrement au-dessus de l'exposition humaine avec la dose de 50 mg), seules des phlyctènes ont pu être observées. Celles-ci étaient réversibles malgré la poursuite du traitement et n'étaient pas associés à des anomalies histopathologiques.
Des desquamations et des exfoliations, ainsi que la formation de croûtes et des lésions de la queue avec des atteintes histopathologiques ont été constatées pour des doses supérieures à 20 mg/kg/j (correspondant à environ 5 fois l'exposition AUC humaine avec la dose de 50 mg).
Des lésions nécrotiques de la queue ont été observées à ≥80 mg/kg/j.
Les lésions cutanées étaient réversibles (jusqu'à 80 mg/kg au moins) lorsque le traitement a été interrompu avant l'apparition de nécroses.
Il n'a pas été observé de lésions cutanées chez l'homme, ni chez aucune autre espèce, ayant été traitée par la vildagliptine.
Mutagénicité
Metformine
Tous les résultats de tests (test d'Ames, test de mutation génétique, test d'aberrations chromosomiques, test micro-nucléique) ont montré que la metformine n'a pas d'effet mutagène ou clastogène.
Carcinogénicité
Metformine
La metformine n'est pas carcinogène chez les rongeurs à des doses allant jusqu'à 900 mg/kg/jour (rat) ou 1500 mg/kg/jour (souris).
Toxicité sur la reproduction
Metformine
La metformine n'a aucune influence sur la fertilité, ne fait preuve d'aucun effet tératogène et n'affecte pas le développement du nouveau-né.
Remarques particulières
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 30 °C. Conserver à l'abri de l'humidité dans l'emballage d'origine.
Galvumet doit être conservé hors de portée des enfants.
Numéro d’autorisation
58451 (Swissmedic)
Titulaire de l’autorisation
Novartis Pharma Schweiz AG, Risch; Domicile: 6343 Rotkreuz
Mise à jour de l’information
Septembre 2020
Відгуки (0)
Рекомендовані товари
Ви переглядали

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.






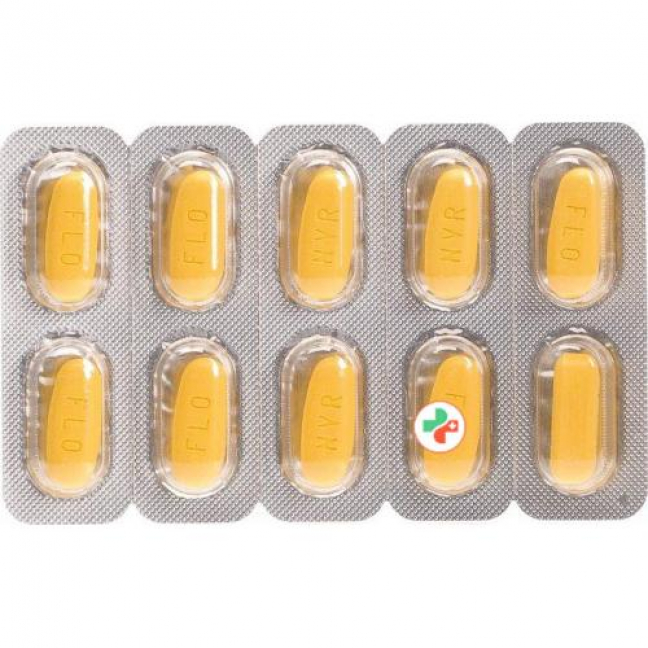


 Deutsch
Deutsch French
French Italian
Italian