Філграстим-Тева 48 млн ОД/0,8мл Ферцпр 0,8 мл
Filgrastim-Teva Injektionslösung 48 Mio E / 0.8 ml 1 Fertigsprit
-
31225.50 RUB
Дата доставки:
26.12.2025 - 09.01.2026
При оплате криптовалютой:
Ваша прибыль 3122.55 RUB / 37.09 USDT
- Наявність: В наявності
- Виробник: Teva Pharma AG
- Модель: 4494772
- ATC-код L03AA02
- EAN 7680607220044
Опис
Zusammensetzung
Wirkstoffe
Filgrastim (G-CSF). Aus E. coli Bakterien biotechnologisch hergestellt.
G-CSF steht für: rekombinierter unglykosylierter humaner Methionin-Granulozyten-Kolonien stimulierender Faktor.
Hilfsstoffe
Filgrastim-Teva 30: Natriumacetat* (maximal 0.026 mg Natrium), Sorbitol (E420) 25 mg, Polysorbat 80, Wasser für Injektionszwecke.
Filgrastim-Teva 48: Natriumacetat* (maximal 0.042 mg Natrium), Sorbitol (E420) 40 mg, Polysorbat 80, Wasser für Injektionszwecke.
*Natriumacetat wird durch Titration von Essigsäure 99% mit Natriumhydroxid gebildet.
Darreichungsform und Wirkstoffmenge pro Einheit
Injektionslösung in Fertigspritzen.
Filgrastim-Teva 30: 1 Fertigspritze (0,5 ml Injektionslösung) enthält 30 Millionen Einheiten (entsprechend 300 µg) Filgrastim.
Filgrastim-Teva 48: 1 Fertigspritze (0,8 ml Injektionslösung) enthält 48 Millionen Einheiten (entsprechend 480 µg) Filgrastim.
Indikationen/Anwendungsmöglichkeiten
Filgrastim-Teva ist indiziert zur:
- Verkürzung der Dauer und Verminderung der Schwere von Neutropenien bei Patienten (Erwachsene und Kinder), die wegen einer malignen Erkrankung mit einer stark myelosuppressiven, zytotoxischen Chemotherapie behandelt werden (ausgenommen sind die chronische myeloische Leukämie und das myelodysplastische Syndrom).
- Bei Kindern mit akuter myeloischer Leukämie sind keine randomisierten Studien durchgeführt worden, aber es gibt sequentielle unkontrollierte oder nicht randomisierte Studien.
- Verkürzung der Dauer von Neutropenien bei hochdosierter zytotoxischer Chemotherapie mit anschliessender autologer oder allogener Knochenmarktransplantation.
- Mobilisierung von Vorläuferzellen des peripheren Blutes (PBPC).
- Langzeitanwendung zur Erhöhung der Neutrophilenzahl und Verminderung der Infektionen bei Kindern und Erwachsenen mit klinisch signifikanten Infektionen während der vergangenen 12 Monate und dreimalig dokumentierter Neutropenie ANC <0,5× 109/l bei schwerer kongenitaler Neutropenie, zyklischer Neutropenie und idiopathischer Neutropenie.
- Behandlung einer persistierenden Neutropenie (ANC ≤1,0× 109/l) bei Patienten mit fortgeschrittener HIV-Infektion zur Verminderung des Risikos einer bakteriellen Infektion,
wenn andere Möglichkeiten zur Behandlung der Neutropenie nicht geeignet sind.
Dosierung/Anwendung
Patienten, die wegen einer malignen Erkrankung mit einer zytotoxischen Chemotherapie behandelt werden
Dosierung
Die empfohlene Dosis von Filgrastim-Teva beträgt 0,5 Mio.E. (5 µg) pro Kilogramm Körpergewicht pro Tag. Die Behandlung mit Filgrastim-Teva sollte frühestens 24 Stunden nach Anwendung einer zytotoxischen Chemotherapie begonnen werden.
Der Inhalt einer Fertigspritze Filgrastim-Teva 30 (60 Millionen Einheiten/ml) entspricht der benötigten Tagesdosis für einen Patienten mit 60 Kilogramm Körpergewicht. Der Inhalt einer Fertigspritze Filgrastim-Teva 48 entspricht der benötigten Tagesdosis für einen Patienten mit 96 Kilogramm Körpergewicht.
Behandlungsdauer
Die tägliche Verabreichung von Filgrastim-Teva sollte so lange andauern, bis die erwartete Neutrophilenzahl nach dem tiefsten Absinken der Werte (Nadir) wieder den normalen Bereich erreicht hat. Im Anschluss an eine bewährte Standard-Chemotherapie solider Tumoren, Lymphome und lymphatischer Leukämie ist mit einer Behandlungsdauer von bis zu 14 Tagen zu rechnen. Im Anschluss an die Induktions- und Konsolidierungstherapie einer akuten myeloischen Leukämie kann die Behandlungsdauer wesentlich länger sein (bis zu 38 Tage), je nach Art, Dosis und Dosierungsschema der verwendeten zytotoxischen Chemotherapie.
Bei Patienten, die eine zytotoxische Chemotherapie erhalten, wird typischerweise 1 bis 2 Tage nach Beginn einer Behandlung eine vorübergehende Steigerung der Neutrophilenzahl beobachtet. Zur Erzielung eines anhaltenden Therapieerfolges sollte Filgrastim-Teva jedoch nicht abgesetzt werden, bevor der zu erwartende Nadir (tiefstes Absinken) überwunden ist und die Neutrophilenzahl wieder im normalen Bereich liegt. Ein vorzeitiger Abbruch der Behandlung mit Filgrastim-Teva, d.h. noch vor Erreichen des zu erwartenden Nadirs (tiefstes Absinken), wird nicht empfohlen. Wenn die Neutrophilenzahl nach Durchlaufen des Nadirs (tiefstes Absinken) 1,0× 109/l erreicht hat, sollte die Behandlung abgesetzt werden.
Art der Anwendung
Filgrastim-Teva kann als tägliche subkutane Injektion oder als tägliche intravenöse Infusion über 30 Minuten nach Verdünnen mit 5%iger Glukose-Lösung verabreicht werden (siehe «Hinweise zur Verdünnung» im Kapitel «Sonstige Hinweise»).
In den meisten Fällen wird die subkutane Verabreichung vorgezogen. Es liegen Hinweise aus einer Studie mit Einzeldosisverabreichung vor, wonach eine intravenöse Verabreichung die Wirkungsdauer verkürzen kann. Die klinische Bedeutung dieser Beobachtung hinsichtlich der Mehrdosenverabreichung ist nicht geklärt.
Patienten die mit einer zytotoxischen Chemotherapie behandelt werden mit anschliessender Knochenmarktransplantation
Dosierung
Die empfohlene Anfangsdosis von Filgrastim-Teva beträgt 1,0 Mio.E. (10 µg) pro Kilogramm Körpergewicht pro Tag. Die erste Behandlung mit Filgrastim-Teva sollte frühestens 24 Stunden nach Verabreichung der zytotoxischen Chemotherapie und spätestens 24 Stunden nach der Knochenmarktransplantation erfolgen.
Behandlungsdauer
Für eine Anwendung von mehr als 28 Tagen in dieser Indikation sind die Wirksamkeit und Sicherheit von Filgrastim nicht belegt.
Dosisanpassung
Nachdem die Neutrophilenzahl den Nadir (tiefstes Absinken) durchschritten hat, sollte die tägliche Gabe von Filgrastim-Teva den Veränderungen im Blutbild wie folgt angepasst werden:
Neutrophilenzahl | Filgrastim-Teva Dosisanpassung |
|---|---|
>1,0× 109/l an 3 aufeinanderfolgenden Tagen | Dosis reduzieren auf 0,5 Mio.E. |
Falls ANC für weitere 3 Tage noch >1,0× 109/l | Filgrastim-Teva absetzen |
Falls die ANC im Verlauf der Behandlung unter 1,0× 109/l abfällt, sollte die Dosis von Filgrastim-Teva gemäss den oben genannten Schritten wieder erhöht werden. | |
ANC = Absolute Neutrophilenzahl
Art der Anwendung
Filgrastim-Teva wird als intravenöse Infusion über 30 Minuten oder 24 Stunden, oder als subkutane Dauertropfinfusion über 24 Stunden verabreicht. Filgrastim-Teva sollte mit 20 ml 5%iger Glukose-Lösung verdünnt werden (siehe «Hinweise zur Verdünnung» im Kapitel «Sonstige Hinweise»).
Mobilisierung von Vorläuferzellen des peripheren Blutes (PBPC)
Mobilisierung peripherer Blutstammzellen bei Patienten, die sich einer myelosuppressiven Therapie mit nachfolgender autologer PBPC Transfusion mit oder ohne Knochenmarktransplantation unterziehen oder bei Patienten, die sich einer aplastischen Therapie mit nachfolgender PBPC Infusion unterziehen
Dosierung
Die empfohlene Dosierung von Filgrastim-Teva beträgt 1,0 Mio.E. (10 µg) pro Kilogramm Körpergewicht pro Tag an 5 bis 7 aufeinanderfolgenden Tagen.
Behandlungsdauer
Meist sind ein oder zwei Leukapheresen an den Tagen 5 und 6 ausreichend. Unter Umständen kann die Durchführung zusätzlicher Leukapheresen notwendig sein. Die Behandlung mit Filgrastim-Teva sollte bis zur letzten Leukapherese aufrechterhalten werden.
Art der Anwendung
Filgrastim-Teva kann entweder als subkutane Dauerinfusion über 24 Stunden, oder als einzelne subkutane Injektion verabreicht werden. Für Infusionen sollte Filgrastim-Teva mit 20 ml 5%iger Glukose-Lösung verdünnt werden (siehe «Hinweise zur Verdünnung» im Kapitel «Sonstige Hinweise»).
Mobilisierung von PBPC nach einer myelosuppressiven Chemotherapie
Dosierung
Die empfohlene Dosierung von Filgrastim-Teva beträgt 0,5 Mio.E. (5 µg) pro Kilogramm Körpergewicht pro Tag vom ersten Tag nach der Beendigung der Chemotherapie, bis der zu erwartende Nadir (tiefstes Absinken) durchschritten wurde und die Neutrophilenzahl wieder Normalwerte erreicht hat. Die Leukapherese sollte während des Zeitraums durchgeführt werden, in dem die absolute Neutrophilenzahl (ANC) von <0,5× 109/l auf >5,0× 109/l ansteigt. Für Patienten, die sich vorher keiner umfangreichen Chemotherapie unterzogen haben, reicht oft schon eine Leukapherese aus. Anderenfalls werden zusätzliche Leukapheresen empfohlen.
Patienten, die sich vorher einer sehr umfangreichen myelosuppressiven Therapie unterzogen haben und denen Filgrastim-Teva zur Mobilisierung von PBPC verabreicht wurde, können ungenügende PBPC aufweisen, um den empfohlenen Mindestertrag zu produzieren (minimaler Gesamtertrag aus den Leukaphereseproben: ≥10 bis 30× 104 GM-CFC/kg oder ≥1 bis 2,5× 106 CD34+-Zellen/kg).
Art der Anwendung
Filgrastim-Teva wird als subkutane Injektion verabreicht.
Mobilisierung von PBPC bei gesunden Spendern für die allogene Transplantation
Die Mobilisierung von Progenitorzellen sollte nur unter Aufsicht von Zentren vorgenommen werden, die Erfahrung bei der Gewinnung von Progenitorzellen bei gesunden Spendern haben.
Dosierung
Die empfohlene Dosierung von Filgrastim-Teva beträgt 1,0 Mio.E. (10 µg) pro Kilogramm Körpergewicht pro Tag an 4 bis 5 aufeinanderfolgenden Tagen. Mit der Leukapherese sollte an Tag 5 begonnen werden und sollte – falls nötig – bis Tag 6 fortgeführt werden, um 4× 106 CD34+-Zellen pro Kilogramm Körpergewicht des Empfängers zu gewinnen.
Die Sicherheit und Wirksamkeit von Filgrastim-Teva bei gesunden Spendern <16 Jahren oder >60 Jahren wurde nicht untersucht.
Art der Anwendung
Filgrastim-Teva wird als subkutane Injektion verabreicht.
Patienten mit schwerer kongenitaler Neutropenie, zyklischer Neutropenie und idiopathischer
Neutropenie
Dosierung
Kongenitale Neutropenie: Die empfohlene Initialdosis von Filgrastim-Teva beträgt 1,2 Mio.E. (12 µg) pro Kilogramm Körpergewicht pro Tag als Monodosis oder aufgeteilt.
Idiopathische oder zyklische Neutropenie: Die empfohlene Initialdosis von Filgrastim-Teva beträgt 0,5 Mio.E. (5 µg) pro Kilogramm Körpergewicht pro Tag als Monodosis oder aufgeteilt.
Dosisanpassung
Bei jedem Patienten muss die Dosis individuell so gewählt werden, dass ein ANC Minimalwert von 1,5× 109/l erreicht wird.
Eine tägliche Langzeitanwendung ist angezeigt, um eine adäquate Neutrophilenzahl aufrechtzuerhalten. Die Dosis soll verdoppelt werden, wenn nach 1-2 Wochen der ANC Zielwert von 1,5× 109/l nicht erreicht wurde, und halbiert werden, wenn ein ANC Wert von >10,0× 109/l überschritten wird. Eine schnellere Erhöhung der Dosis ist bei Patienten mit schweren Infektionen angezeigt. Dosen von mehr als 14,5 Mio.E. (145 µg) pro Kilogramm Körpergewicht pro Tag sind sicher und gut vertragen worden.
Art der Anwendung
Filgrastim-Teva wird als subkutane Injektion verabreicht.
Patienten mit HIV-Infektion
Dosierung
Zur Behebung der Neutropenie
Die empfohlene Initialdosis von Filgrastim-Teva beträgt 0,1 Mio.E. (1 µg) pro Kilogramm Körpergewicht pro Tag mit Titration bis maximal 0,4 Mio.E. (4 µg) pro Kilogramm Körpergewicht pro Tag, bis sich die Neutrophilenzahl normalisiert hat und auf diesem Niveau gehalten werden kann (ANC >2,0× 109/l). In klinischen Studien sprachen >90% der Patienten auf diese Dosierung an und erreichten im Median innerhalb von 2 Tagen einen normalen Neutrophilenwert.
Bei einer geringen Anzahl Patienten (<10%) waren Dosen von bis zu 1,0 Mio.E. (10 µg) pro Kilogramm Körpergewicht pro Tag notwendig, um die Neutropenie zu beheben.
Zur Aufrechterhaltung einer normalen Neutrophilenzahl
Sobald die Neutropenie behoben worden ist, sollte die wirksamste Mindestdosis ermittelt werden, mit der sich eine normale Neutrophilenzahl aufrechterhalten lässt. Eine anfängliche Dosisanpassung, die auf die subkutane Verabreichung von 300 µg/Tag alle zwei Tage durch subkutane Injektion ausgerichtet ist, wird empfohlen. Eine weitere Dosisanpassung kann je nach ANC des Patienten erforderlich sein, um die Neutrophilenzahl auf >2,0× 109/l zu halten. In klinischen Studien war es nötig, an 1 bis 7 Tagen pro Woche 300 µg pro Tag zu verabreichen, damit ein ANC von >2,0× 109/l aufrechterhalten werden konnte; die Verabreichung erfolgte im Median an 3 Tagen pro Woche. Eine Langzeitmedikation kann erforderlich sein, um einen ANC von 2,0× 109/l aufrechtzuerhalten.
Art der Anwendung
Filgrastim-Teva wird als subkutane Injektion verabreicht.
Spezielle Dosierungsanweisungen
Ältere Patienten
Da zurzeit erst wenige Erfahrungen in der Behandlung älterer Patienten vorliegen, ist es nicht möglich spezielle Dosierungsempfehlungen für diese Patientengruppe anzugeben.
Patienten mit Nieren- oder Leberfunktionsstörungen
Studien mit Filgrastim bei Patienten mit Einschränkungen der Nieren- oder Leberfunktion haben gezeigt, dass sich das pharmakokinetische oder pharmakodynamische Profil kaum von dem bei Gesunden unterscheidet (siehe «Pharmakokinetik»). Eine Dosisanpassung ist daher bei diesen Patienten nicht erforderlich.
Kinder und Jugendliche
Die Dosierungsempfehlungen pro Kilogramm Körpergewicht für pädiatrische Patienten, die eine myelosuppressive zytotoxische Chemotherapie erhalten oder pädiatrische Patienten mit schwerwiegender kongenitaler Neutropenie, zyklischer Neutropenie und idiopathischer Neutropenie, sind identisch mit denjenigen für Erwachsene.
Daten aus klinischen Studien mit pädiatrischen Patienten zeigen, dass die Sicherheit und Wirksamkeit von Filgrastim bei Erwachsenen und Kindern, die eine myelosuppressive Chemotherapie erhalten, vergleichbar sind.
65% der im Rahmen klinischer Studien zu schwerer chronischer Neutropenie behandelten Patienten waren jünger als 18 Jahre. Die Behandlung hat sich bei dieser Altersgruppe, die überwiegend aus Patienten mit kongenitaler Neutropenie bestand, als wirksam erwiesen. Bei pädiatrischen Patienten, die wegen schwerer chronischer Neutropenie behandelt wurden, zeigten sich im Vergleich zu Erwachsenen keine Unterschiede beim Sicherheitsprofil des Präparates.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Kontraindikationen
Filgrastim-Teva darf nicht angewendet werden bei Patienten mit bekannter Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und Vorsichtsmassnahmen
WARNHINWEISE UND VORSICHTSMASSNAHMEN IM ZUSAMMENHANG MIT ALLGEMEINEN RISIKEN UND UNERWÜNSCHTEN WIRKUNGEN
Überempfindlichkeit
Überempfindlichkeitsreaktionen, darunter Anaphylaxie, wurden bei Patienten, die Filgrastim erhielten, bei der Erst- oder Folgebehandlung berichtet. Filgrastim-Teva sollte dauerhaft abgesetzt werden bei Patienten, die eine klinisch signifikante Überempfindlichkeit zeigen. Filgrastim-Teva darf nicht angewendet werden bei Patienten mit bekannter Überempfindlichkeit gegenüber Filgrastim oder Pegfilgrastim.
Pulmonale Nebenwirkungen
Es wurde über pulmonale Nebenwirkungen, insbesondere interstitielle Pneumonie, nach G-CSF Verabreichung berichtet. Für Patienten mit einer kürzlichen Vorgeschichte von Lungeninfiltraten oder Pneumonie kann ein erhöhtes Risiko bestehen. Das Auftreten von pulmonalen Beschwerden wie Husten, Fieber und Atemnot in Verbindung mit radiologischen Hinweisen auf pulmonale Infiltrate sowie einer Verschlechterung der Lungenfunktion können erste Anzeichen eines akuten Atemnotsyndrom (Acute Respiratory Distress Syndrom, ARDS) sein. Die Behandlung mit Filgrastim-Teva sollte abgebrochen und eine angemessene Therapie eingeleitet werden.
Glomerulonephritis
Bei Patienten, die Filgrastim und Pegfilgrastim erhielten, wurde über Glomerulonephritis berichtet. Im Allgemeinen klangen die Fälle von Glomerulonephritis nach einer Dosisreduktion oder Absetzen der Behandlung mit Filgrastim und Pegfilgrastim ab. Eine Überwachung der Urinwerte wird empfohlen.
Kapillarlecksyndrom
Über Kapillarlecksyndrom, das bei Verzögerung der Behandlung lebensbedrohlich sein kann, wurde nach Verabreichung von Granulozyten-Kolonie-stimulierenden Faktoren berichtet, das durch Hypotonie, Hypoalbuminämie, Ödem und Hämokonzentration charakterisiert ist. Patienten, die Symptome des Kapillarlecksyndroms entwickeln, sollten engmaschig überwacht werden und eine symptomatische Standardbehandlung erhalten, die die Notwendigkeit einer Behandlung auf der Intensivstation einschliessen kann (siehe Kapitel «Unerwünschte Wirkungen»).
Splenomegalie und Milzruptur
Nach Verabreichung von Filgrastim wurde bei Patienten und gesunden Spendern über Fälle von Splenomegalie, die im Allgemeinen asymptomatisch verliefen, und Fälle von Milzruptur berichtet. Einige Fälle von Milzrupturen verliefen tödlich. Deshalb sollte die Grösse der Milz sorgfältig überwacht werden (z.B. durch klinische Untersuchung, Ultraschall). Die Diagnose einer Milzruptur sollte bei Spendern und/oder Patienten in Betracht gezogen werden, die über linksseitige Oberbauchschmerzen oder Schmerzen in der Schulterregion berichten. Es wurde festgestellt, dass durch eine Verringerung der Dosis von Filgrastim das Fortschreiten der Milzvergrösserung bei Patienten mit schwerer chronischer Neutropenie verlangsamt oder verhindert wurde. Bei 3% der Patienten erwies sich eine Splenektomie als erforderlich.
Wachstum von malignen Zellen
Granulozyten-Kolonie-stimulierende Faktoren können in vitro neben dem Wachstum von Zellen myeloischen Ursprungs in ähnlicher Weise auch das Wachstum von Zellen nicht-myeloischen Ursprungs fördern. Da auch Zellen von nicht-myeloischen Tumoren G-CSF-Rezeptoren exprimieren können, sollte bei Patienten mit ungenügendem Ansprechen auf die Chemotherapie ein Abbruch der G-CSF-Behandlung erwogen werden.
Chronische myeloische Leukämie oder myelodysplastisches Syndrom
Die Sicherheit und Wirksamkeit der Verabreichung von Filgrastim-Teva an Patienten mit myelodysplastischem Syndrom oder chronischer myeloischer Leukämie sind nicht ermittelt worden. Filgrastim-Teva ist für die Anwendung bei diesen Erkrankungen nicht indiziert. Besondere Vorsicht ist bei der diagnostischen Unterscheidung zwischen der Blastentransformation einer chronischen myeloischen Leukämie und einer akuten myeloischen Leukämie geboten.
Thrombozytopenie
Es wurde über Thrombozytopenie bei Patienten, die Filgrastim erhielten, berichtet.
Die Thrombozytenzahlen sollten engmaschig überwacht werden, v.a. in den ersten paar Wochen der Behandlung mit Filgrastim-Teva. Eine vorübergehende Unterbrechung der Behandlung oder Reduzierung der Dosis von Filgrastim-Teva sollte bei Patienten mit schwerer chronischer Neutropenie in Betracht gezogen werden, die eine Thrombozytopenie entwickeln (Plättchenzahl <100× 109/l).
Leukozytose
Während der Behandlung mit Filgrastim in Dosen von mehr als 0,3 Mio.E. (3 µg) pro Kilogramm und Tag wurden gelegentlich Leukozytosen von 100× 109/l und darüber beobachtet. Über Nebenwirkungen, die direkt mit einem solchen Grad der Leukozytose assoziiert werden können, wurde nicht berichtet. Wegen der möglichen Risiken im Zusammenhang mit einer Leukozytose sollten regelmässige Kontrollen des weissen Blutbildes erfolgen. Bei Leukozytenzahlen von mehr als 50× 109/l nach Durchschreiten des zu erwartenden Nadirs (tiefstes Absinken) sollte Filgrastim-Teva sofort abgesetzt werden. Wenn während der Verabreichung von Filgrastim-Teva zur Mobilisierung von PBPC die Leukozytenzahl auf über 70× 109/l ansteigt, muss Filgrastim-Teva abgesetzt werden.
Eine vorübergehende Leukozytose (WBC >50× 109/l) wurde bei 41% der untersuchten gesunden Spender beobachtet. WBC-Zahlen von >75× 109/l wurden bei 2% der gesunden Spender beobachtet.
Immunogenität
Wie bei allen therapeutischen Proteinen besteht ein Potenzial für Immunogenität.
Daten zur potentiellen Immunogenität von 677 Patienten stehen aus den Studien zum Nachweis der Wirksamkeit und Sicherheit von Filgrastim-Teva zur Verfügung. Nach Elimination von vorbestehenden positiven Antikörpertests in der Analyse wurden nur noch vereinzelt bindende Antikörper identifiziert.
Aortitis
Bei Patienten, die G-CSF (wie z.B. Filgrastim) erhielten, wurde über Aortitis berichtet. Zu den Symptomen, die auftraten, zählten Fieber, abdominale Schmerzen, Unwohlsein, Rückenschmerzen und erhöhte Entzündungsmarker (z.B. C-reaktives Protein und Anzahl weisser Blutkörperchen). In den meisten Fällen wurde die Aortitis durch CT-Scan diagnostiziert und klang nach Absetzen von G-CSF im Allgemeinen wieder ab (siehe auch Kapitel «Unerwünschte Wirkungen»).
Hämaturie/Proteinurie
Hämaturie/Proteinurie tritt bei einer kleinen Anzahl von Patienten auf. Regelmässige Harnanalysen sind deshalb angezeigt.
Hilfsstoffe:
Natriumacetat:
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Fertigspritze, d.h. es ist nahezu «natriumfrei».
Sorbitol:
Patienten mit hereditärer Fructoseintoleranz (HFI) dürfen dieses Arzneimittel nicht erhalten, es sei denn, es ist zwingend erforderlich.
Bei Babies und Kleinkindern (unter 2 Jahren) wurde eine hereditäre Fructoseintoleranz (HFI) möglicherweise noch nicht diagnostiziert. Intravenös angewendete Arzneimittel (die Fructose enthalten) können lebensbedrohlich sein und sind bei dieser Personengruppe kontraindiziert, es sei denn, es besteht eine zwingende klinische Notwendigkeit und es sind keine Alternativen verfügbar.
Vor Anwendung dieses Arzneimittels ist bei jedem Patienten eine detaillierte Anamnese im Hinblick auf Symptome einer HFI zu erheben.
WARNHINWEISE UND VORSICHTSMASSNAHMEN IM ZUSAMMENHANG MIT CO-MORBIDITÄTEN
Osteoporose
Bei Patienten mit vorbestehender Osteoporose wird eine Überwachung der Knochendichte empfohlen, wenn länger als sechs Monate ununterbrochen mit Filgrastim behandelt wird, da unter Langzeittherapie Fälle von Osteoporose beobachtet wurden.
Besondere Vorsichtsmassnahmen bei Patienten mit Sichelzellanämie
Publikationen zufolge ist bei Patienten mit Sichelzellanämie eine hohe Leukozytenzahl nachteilig. Aus diesem Grund sollte der Arzt bei diesen Patienten Filgrastim-Teva nur unter Vorsicht anwenden und die entsprechenden Laborwerte engmaschig überwachen. Er sollte den möglichen Zusammenhang zu Splenomegalie und vaso-okklusiven Krisen berücksichtigen.
Bei Patienten mit Sichelzellanämie, die Filgrastim erhielten, wurde über Sichelzellkrisen berichtet, die in einigen Fällen tödlich verliefen. Aus diesem Grund ist eine Behandlung von Patienten mit Sichelzellanlage oder Sichelzellanämie mit Filgrastim-Teva nur unter Vorsicht angezeigt.
WARNHINWEISE UND VORSICHTSMASSNAHMEN IM ZUSAMMENHANG MIT DER CHEMOTHERAPIE
Risiken bei hochdosierter Chemotherapie
Filgrastim-Teva darf nicht angewendet werden, um die Dosierung der zytotoxischen Chemotherapeutika über das empfohlene Dosierungsschema hinaus zu erhöhen. Besondere Vorsicht sollte bei der Behandlung von Patienten mit hochdosierter Chemotherapie angewendet werden, da zum einen ein verbessertes Ansprechen von Tumoren auf eine solche Behandlung bis jetzt nicht nachgewiesen werden konnte, und zum anderen hohe Dosen an Chemotherapeutika zu verstärkten toxischen Wirkungen, einschliesslich kardialen, pulmonalen, neurologischen und dermatologischen Wirkungen führen können (vgl. hierzu auch die Fachinformationen der jeweils verwendeten Chemotherapeutika).
Chemotherapie mit verzögerter Myelosuppression
Die Wirksamkeit von Filgrastim bei Chemotherapie mit verzögerter Myelosuppression, z.B. mit Nitroseharnstoffen oder mit Mitomycin C oder mit myelosuppressiven Dosen von Antimetaboliten wie 5-FU oder Cytosinarabinosid, ist noch nicht genügend dokumentiert.
Einfluss der Chemotherapie auf Erythrozyten und Thrombozyten
Filgrastim-Teva reduziert die Inzidenz von schwerer und febriler Neutropenie signifikant.
Trotzdem bleibt für den Patienten, der nach einem myelotoxischen Chemotherapie-Schema behandelt wird, das Risiko, eine Thrombozytopenie und Anämie zu entwickeln, bestehen. Deshalb wird empfohlen, die Thrombozytenzahl und den Hämatokrit regelmässig zu überprüfen. Besondere Vorsicht wird bei Chemotherapeutika (Einzelsubstanzen und Kombinationen) geboten, die bekanntermassen schwere Thrombozytopenien verursachen können.
Thrombozytopenie
Patienten die Filgrastim-Teva nach höheren Dosen an myelosuppressiven Chemotherapeutika erhalten, können einem grösseren Risiko ausgesetzt sein, eine Thrombozytopenie zu entwickeln.
EMPFEHLUNGEN FÜR BLUTBILD MONITORING
Die Behandlung mit Filgrastim-Teva allein verhindert nicht, dass es unter myelosuppressiven Medikamenten zu einer Thrombozytopenie und einer Anämie kommt.
Da dem Patienten unter der Behandlung mit Filgrastim-Teva solche Medikamente grundsätzlich in höheren Dosen oder in grösserer Zahl verabreicht werden können, erhöht sich unter Umständen auch das Risiko für eine Thrombozytopenie und Anämie. Eine regelmässige Überwachung des Blutbildes wird empfohlen. Eine Anämie und eine vorübergehende Erhöhung myeloischer Stammzellen sind weitere Veränderungen des Blutbildes, die ebenfalls einer engen Überwachung bedürfen (siehe auch Kapitel WARNHINWEISE UND VORSICHTSMASSNAHMEN IM ZUSAMMENHANG MIT ALLGEMEINEN RISIKEN UND UNERWÜNSCHTEN WIRKUNGEN Thrombozytopenie und WARNHINWEISE UND VORSICHTSMASSNAHMEN IM ZUSAMMENHANG MIT DER CHEMOTHERAPIE).
Infektionen, die eine Myelosuppression verursachen
Die Ursache einer Neutropenie kann eine opportunistische Infektion sein, die zum Beispiel durch den Mycobacterium-avium-Komplex, die das Knochenmark infiltriert, oder eine maligne Erkrankung wie ein Lymphom hervorgerufen wird. Bei Patienten, die bekanntermassen an einer knochenmarkinfiltrierenden Infektion oder einem Malignom leiden, sollte zusätzlich zur Behandlung der Neutropenie mit Filgrastim-Teva eine geeignete Behandlung der zugrundeliegenden Erkrankung erwogen werden. Der Wirkmechanismus von Filgrastim auf die Neutropenie im Zusammenhang mit eben erwähnten Krankheitsbildern ist nicht hinreichend bekannt.
BESONDERE PATIENTENGRUPPEN/SPEZIFISCHE INDIKATIONEN
Spezielle Vorsichtsmassnahmen bei Patienten die sich einer PBPC Mobilisierung unterziehen
Überprüfung der Ausbeute an Progenitorzellen
Bei der quantitativen Bestimmung der Progenitorzellen von mit Filgrastim behandelten Patienten sollte besondere Aufmerksamkeit auf die zu verwendende Methode gelegt werden. Die Ergebnisse der CD34+-Zellzahlbestimmung mittels Durchflusszytometrie hängen von der Genauigkeit der verwendeten Methodik ab. Empfehlungen von Zahlen, die auf den Untersuchungen anderer Laboratorien basieren, sollten daher mit Vorsicht interpretiert werden.
Statistische Auswertungen weisen auf eine zwar komplexe, jedoch in gleichbleibendem Verhältnis zueinander stehende Wechselbeziehung zwischen der Anzahl reinfundierter CD34+-Zellen und der Plättchenregenerationsrate nach hochdosierter Chemotherapie hin.
Die Empfehlung einer Minimalanzahl von ≥2,0× 106 CD34+-Zellen pro Kilogramm Körpergewicht basiert auf veröffentlichten Erfahrungswerten, die zu einer angemessenen hämatologischen Regeneration führten. Über diesen Wert hinausgehende Mengen scheinen mit einer schnelleren, geringere Mengen mit einer langsameren Erholung zu korrelieren.
Mobilisierung
Es gibt keine prospektiv randomisierten Vergleichsuntersuchungen der beiden empfohlenen Methoden zur Mobilisierung peripherer Stammzellen (Filgrastim allein oder in Kombination mit myelosuppressiver Chemotherapie) innerhalb desselben Patientenkollektivs. Der Grad der Unterschiede zwischen den einzelnen Patienten und zwischen den Laborbestimmungen der CD34+-Zellmengen erschwert einen direkten Vergleich zwischen unterschiedlichen Studien. Da es aus diesem Grund schwierig ist, eine optimale Methode zu empfehlen, sollte die Wahl der geeigneten Mobilisierungsmethode jeweils unter Berücksichtigung der Gesamtbehandlungsziele für den einzelnen Patienten erfolgen.
Vorangegangene Behandlung mit zellschädigenden Substanzen und Mobilisierung von PBPC
Bei zuvor sehr extensiv mit myelosuppressiver Therapie behandelten Patienten, bei denen nachfolgend Filgrastim zur Mobilisierung der peripheren Blutstammzellen eingesetzt wird, kann es vorkommen, dass die Mobilisierung dieser Blutzellen nicht ausreicht, um die empfohlene Minimalanzahl von ≥2,0× 106 CD34+-Zellen pro Kilogramm Körpergewicht zu erzielen.
Einige zytotoxische Substanzen weisen eine besondere Toxizität auf die Blutstammzellen auf und können die Mobilisierung dieser Zellen negativ beeinflussen. Werden vor der beabsichtigten Mobilisierung der Stammzellen über längere Zeit Substanzen wie Melphalan, Carmustin (BCNU) und Carboplatin eingesetzt, so können diese die Ausbeute an Stammzellen vermindern. Dagegen hat sich die Gabe von Melphalan, Carboplatin oder BCNU in Kombination mit Filgrastim als förderlich für die Mobilisierung der Stammzellen erwiesen. Ist die Transplantation peripherer Blutstammzellen beabsichtigt, so sollte die Mobilisierung der Stammzellen in einer frühen Behandlungsphase des Patienten erfolgen. Bei solchermassen behandelten Patienten sollte die Anzahl mobilisierter Stammzellen vor Durchführung einer hochdosierten Chemotherapie besonders beachtet werden. Wenn die Ausbeuten den oben ausgeführten Kriterien zufolge nicht ausreichend sind, so sollten alternative Behandlungsformen in Erwägung gezogen werden, bei denen der Einsatz von Blutstammzellen nicht erforderlich ist.
Spezielle Vorsichtsmassnahmen bei gesunden Spendern, die sich einer PBPC Mobilisierung unterziehen
Die Mobilisierung von peripheren Blutstammzellen bietet keinen direkten klinischen Nutzen für gesunde Spender und sollte nur zum Zwecke allogener Stammzelltransplantation in Erwägung gezogen werden.
Die PBPC Mobilisierung sollte nur bei Spendern erwogen werden, die die Auswahlkriterien für eine Stammzellspende in Bezug auf normale Laborparameter unter spezieller Berücksichtigung der hämatologischen Werte erfüllen.
Falls mehr als eine Leukapherese angezeigt ist, sollte vor der Apherese den Spendern mit einer Plättchenzahl von <100× 109/l spezielle Beachtung geschenkt werden.
Im Allgemeinen sollte bei einer Plättchenzahl <75× 109/l keine Apherese durchgeführt werden.
Bei 35% der untersuchten gesunden Spender wurde nach Verabreichung von Filgrastim und Durchführung einer Leukapherese über eine vorübergehende Thrombozytopenie (Thrombozytenwerte <100× 109/l) berichtet. Vereinzelte Fälle mit Werten <50× 109/l wurden ebenfalls beobachtet.
Bei Spendern, die mit Antikoagulantien behandelt werden oder bei denen Störungen der Hämostase bekannt sind, sollte keine Leukapherese durchgeführt werden.
Die Gabe von Filgrastim-Teva sollte unterbrochen werden oder die Dosis reduziert werden, wenn die Leukozytenzahl auf >70× 109/l steigt.
Spender, die Granulozyten Kolonie-stimulierende Faktoren zur Mobilisierung von peripheren Blutstammzellen erhalten, sollten bis zur Normalisierung der Blutwerte überwacht werden.
Bei gesunden Spendern sind die Daten zur Langzeitanwendung beschränkt.
Im Rahmen von Post-Marketing-Erfahrungen wurde bei gesunden Spendern über pulmonale Nebenwirkungen (Hämoptyse, Lungeninfiltrate) berichtet.
Die Erhebung von Langzeitdaten zur Sicherheit bei Spendern dauert an.
Für einen Zeitraum von bis zu 4 Jahren liegen keine Berichte über Störungen der Hämatopoese bei gesunden Spendern vor. Trotzdem kann das Risiko einer Stimulation eines malignen myeloischen Klons nicht ausgeschlossen werden.
Es wird empfohlen, dass die Apherese-Zentren eine systematische Berichterstattung und Erfassung der Stammzellspender vornehmen, um die Überwachung der Langzeitsicherheit zu gewährleisten.
Besondere Vorsichtsmassnahmen bei Empfängern allogener, durch Filgrastim mobilisierter peripherer Blutstammzellen
Bei Patienten, die G-CSF nach einer allogenen Knochenmarktransplantation erhalten hatten, wurde über GvHD und Todesfälle berichtet (siehe «Eigenschaften/Wirkungen»).
Spezielle Vorsichtsmassnahmen bei Patienten mit schwerwiegender, kongenitaler, zyklischer und idiopathischer Neutropenie
Die Verträglichkeit und Wirksamkeit von Filgrastim bei Neugeborenen und bei Neutropenien autoimmuner Genese ist nicht belegt.
Filgrastim-Teva darf bei Patienten mit schwerer kongenitaler Neutropenie, die eine Leukämie entwickeln oder bei denen Anzeichen für eine leukämische Entwicklung bestehen nicht angewendet werden.
Transformation zu Leukämie oder Prä-Leukämien
Besondere Aufmerksamkeit ist der Differentialdiagnose der schweren chronischen Neutropenie zu widmen, um sie von anderen hämatologischen Störungen wie der aplastischen Anämie, der myeloischen Dysplasie und der myeloischen Leukämie zu unterscheiden.
Vor der Therapie sind ein komplettes Blutbild mit Differentialblutbild und Thrombozytenzahl,, eine Beurteilung der Morphologie des Knochenmarkes und eine Karyotypisierung durchzuführen.
Bei Patienten mit kongenitaler Neutropenie sind unter Langzeitbehandlung mit Filgrastim (12,1% über 5 Jahre) myeloische Dysplasien oder Leukämien aufgetreten. Diese Beobachtungen wurden nur bei Patienten mit kongenitaler Neutropenie gemacht. Dies sind normale Komplikationen der Krankheit und deren Zusammenhang mit der Therapie mit Filgrastim ist unklar. Bei einer Untergruppe von ca. 12% der Patienten, die bei der Erhebung der Ausgangswerte zytogenetisch ohne Befund waren, wurden in der Folge bei wiederholten Routinekontrollen abnorme Veränderungen festgestellt, zu denen auch die Monosomie 7 gehörte. Es ist zurzeit unklar, ob die Weiterführung der Therapie bei Patienten mit gestörter Zytogenese diese für zytogenetische Anormalitäten, myeloische Dysplasien oder eine leukämische Transformation prädisponiert. Es wird empfohlen, ca. alle 12 Monate morphologische und zytogenetische Knochenmarkuntersuchungen durchzuführen.
Andere spezielle Vorsichtsmassnahmen bei Patienten mit HIV-Infektion
Blutbild
Die Absolute Neutrophilenzahl (ANC) sollte – insbesondere in den ersten Behandlungswochen mit Filgrastim-Teva – engmaschig überwacht werden. Gewisse Patienten sprechen unter Umständen sehr rasch und mit einem beträchtlichen Anstieg der Neutrophilenzahl auf die ersten Gaben von Filgrastim an. Es wird empfohlen, die ANC in den ersten Tagen der Verabreichung von Filgrastim-Teva täglich zu bestimmen. Für die ersten 2 Wochen gilt die Empfehlung, die ANC mindestens zweimal wöchentlich zu messen und anschliessend, während der Erhaltungstherapie, einmal pro Woche oder einmal alle zwei Wochen. Während der intermittierenden Verabreichung von 300 µg/Tag Filgrastim kann die ANC der Patienten im zeitlichen Verlauf beträchtlich schwanken. Zur Bestimmung der Minimalwerte der ANC eines Patienten wird empfohlen, die für die ANC-Messung vorgesehenen Blutproben unmittelbar vor der Verabreichung von Filgrastim-Teva zu entnehmen.
Besondere Patientenpopulationen
Die Erfahrungen bei Patienten mit schwerer Leber- und/oder Nierenfunktionsstörung sind beschränkt (siehe «Pharmakokinetik» und «Dosierung/Anwendung»).
Die Wirkung von Filgrastim bei Patienten mit einer stark verminderten Anzahl von myeloischen Progenitorzellen ist noch nicht untersucht worden. Da Filgrastim-Teva hauptsächlich auf die Reifung der neutrophilen Vorläuferzellen wirkt, mit entsprechender Erhöhung der Neutrophilenwerte im Blut, kann die Wirkung bei Patienten mit geringerer Anzahl von Vorläuferzellen vermindert sein (wie bei denjenigen Patienten mit vorausgegangener extensiver Strahlen- oder Chemotherapie).
WARNHINWEISE UND VORSICHTSMASSNAHMEN IM ZUSAMMENHANG MIT DIAGNOSTISCHEN VERFAHREN
Knochenimaging
Eine erhöhte hämatopoetische Aktivität des Knochenmarks als Antwort auf eine Therapie mit Wachstumsfaktoren wurde mit vorübergehend abnormalen Knochenscans in Verbindung gebracht. Dies sollte bei der Interpretation der Ergebnisse von Darstellungen der Knochen mittels bildgebender Verfahren berücksichtigt werden.
Interaktionen
Die Wirksamkeit und die Sicherheit von Filgrastim-Teva bei Verabreichung am selben Tag wie myelosuppressive zytotoxische Chemotherapeutika sind nicht eindeutig belegt. Wegen der Empfindlichkeit von sich schnell teilenden myeloischen Zellgruppen gegenüber einer myelosuppressiven zytotoxischen Chemotherapie, sollte Filgrastim-Teva innerhalb eines Zeitraums von 24 Stunden vor oder nach einer entsprechenden Chemotherapie nicht verabreicht werden. Es gibt Hinweise, dass bei einer gleichzeitigen Verabreichung von Filgrastim und 5-Fluorouracil der Schweregrad der Neutropenie unter Umständen akut verschlimmert werden kann.
Möglicherweise auftretende Wechselwirkungen mit anderen hämatopoetischen Wachstumsfaktoren und Zytokinen sind im Rahmen klinischer Studien bisher nicht untersucht worden (vgl. auch Abschnitt «Inkompatibilitäten» im Kapitel «Sonstige Hinweise»).
Da Lithium die Freisetzung von neutrophilen Granulozyten fördert, potenziert Lithium wahrscheinlich die Effekte von Filgrastim. Obwohl diese Wechselwirkung nicht direkt untersucht wurde, gibt es keine Hinweise darauf, dass eine solche Interaktion schädlich ist.
Schwangerschaft/Stillzeit
Schwangerschaft
Es liegen keine Erfahrungen zur Sicherheit einer Anwendung von Filgrastim-Teva während der Schwangerschaft vor. Es gibt Berichte in der Literatur, die aufzeigen, dass Filgrastim bei schwangeren Frauen durch die Plazentaschranke tritt. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt.
Bei Kaninchen wurde bei Anwendung von hohen Dosen, bei denen die Exposition um ein Vielfaches über der üblichen klinischen Exposition lag und bei gleichzeitig vorliegender maternaler Toxizität eine erhöhte Inzidenz der embryonalen Letalität beobachtet. Filgrastim-Teva soll während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist klar notwendig.
Stillzeit
Da nicht bekannt ist, inwieweit Filgrastim-Teva in die Muttermilch übertritt, sollte Filgrastim-Teva während der Stillzeit nicht angewendet werden. Ein Risiko für das Neugeborene/Kleinkind kann nicht ausgeschlossen werden. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Filgrastim-Teva verzichtet werden soll bzw. die Behandlung mit Filgrastim-Teva zu unterbrechen ist. Dabei ist sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau zu berücksichtigen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Filgrastim-Teva hat einen geringen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen. Nach Verabreichung von Filgrastim-Teva kann Schwindel auftreten (siehe «Unerwünschte Wirkungen»).Es wurden keine Studien zu den Auswirkungen auf die Fahrtüchtigkeit und das Bedienen von Maschinen durchgeführt.
Unerwünschte Wirkungen
Zusammenfassung der Nebenwirkungen
In klinischen Studien wurde Filgrastim-Teva an 541 an Krebs erkrankte Patienten und 188 gesunde Freiwillige verabreicht. Die in diesen Studien beobachteten Sicherheitsprofile von Filgrastim-Teva und dem in den Studien eingesetzten Referenzarzneimittel waren einheitlich.
Die untenstehenden Daten beinhalten Nebenwirkungen aus klinischen Studien sowie aus Spontanmeldungen. Innerhalb jeder Häufigkeitsgruppe werden die unerwünschten Wirkungen nach abnehmendem Schweregrad angegeben.
Systemorganklassen gemäss MedDRA | Unerwünschte Wirkungen | |||
|---|---|---|---|---|
Sehr häufig | Häufig | Gelegentlich | Selten | |
Infektionen und Infestationen | Sepsis Bronchitis Infektion der oberen Atemwege Infektion der Harnwege | |||
Erkrankungen des Blutes und des Lymphsystems | Anämie (21.1%) | Splenomegaliea | Leukozytosea | Milzruptura |
Erkrankungen des Immunsystems | Arzneimittelüber-empfindlichkeit Überempfindlichkeit Graft-versus-Host Reaktionb | Anaphylaktische Reaktion | ||
Stoffwechsel- und Ernährungsstörungen | Verminderter Appetit Anstieg der Laktatdehydrogenase | Hyperurikämie | Absinken des Blutzuckers Chondrokalzinose- Störungen des Flüssigkeitsvolumens | |
Psychiatrische Erkrankungen | Schlaflosigkeit | |||
Erkrankungen des Nervensystems | Kopfschmerzen (13.9%) | Schwindel Hypästhesie Parästhesie | ||
Gefässerkrankungen | Hypertonie Hypotonie | Venenverschluss-krankheite | Angiopathie Kapillarlecksyndroma Aortitis | |
Erkrankungen der Atemwege, des Brustraums und des Mediastinums | Hämoptyse Dyspnoe Husten Oropharyngeale Schmerzen Epistaxis | Nicht kardiale Brustschmerzen Pulmonale Hämorrhagie Interstitielle Lungenerkrankung Hypoxie | Pulmonale Fibrosea | |
Erkrankungen des Gastrointestinaltrakts | Erbrechen (21.2%) | Schmerzen im Mundd Verstopfungd | ||
Leber- und Gallenerkrankungen | Hepatomegalie Erhöhte alkalische Phosphatase | Erhöhte Aspartat-Aminotransferase Erhöhte γ-Glutamyltransferase | ||
Erkrankungen der Haut und des Unterhautzellgewebes | Alopezie (13.6%) | Erythem Ausschlag | Makulopapulöser Hautausschlag | Akute febrile neutrophile Dermatose (Sweet's syndrome) Kutane Vaskulitisa |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | Muskuloskelettale Schmerzenc (27.7%) | Muskelkrämpfe | Osteoporose | Verminderung der Knochendichte Verschlimmerung einer rheumatoiden Arthritis |
Erkrankungen der Nieren und Harnwege | Hämaturie Dysurie | Proteinurie | Miktionsstörungen Glomerulonephritis Harnabnormalitäten | |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | Fatigue (11.9%) Fieber (28.9%) | Asthenie Unwohlseind Periphere Ödemed | Reaktionen an der Einstichstelle | |
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen | Transfusionsreaktiond | |||
a siehe Abschnitt «Beschreibung ausgewählter unerwünschter Wirkungen»
b Es gibt Berichte über GvHD und Todesfälle bei Patienten nach allogener Knochenmarktransplantation
c einschliesslich Knochenschmerzen, Rückenschmerzen, Arthralgie, Myalgie, Schmerzen in den Extremitäten, muskuloskelettale Schmerzen, muskuloskelettale Schmerzen im Brustkorb, Nackenschmerzen
d unerwünschte Ereignisse mit höherer Inzidenz bei Patienten unter Behandlung mit Filgrastim im Vergleich mit Placebo und in Verbindung mit Spätfolgen der zugrunde liegenden Krebserkrankung oder der zytotoxischen Chemotherapie
Beschreibung ausgewählter unerwünschter Wirkungen
Arzneimittel-Überempfindlichkeitsreaktionen
Überempfindlichkeitsreaktionen, darunter Anaphylaxie, Hautausschlag, Urtikaria, Angioödem, Dyspnoe und Hypotonie, wurden bei Erst- und Folgebehandlung in klinischen Studien und nach Marktzulassung berichtet. Insgesamt wurden diese Symptome nach i.v. Verabreichung häufiger berichtet. In einigen Fällen traten die Symptome bei einer Reexposition erneut auf, was auf einen kausalen Zusammenhang hindeutet. Filgrastim-Teva sollte dauerhaft abgesetzt werden, falls eine schwerwiegende allergische Reaktion auftritt.
Pulmonale Nebenwirkungen
In klinischen Studien und nach Markteinführung wurde über pulmonale Nebenwirkungen einschliesslich interstitieller Lungenerkrankung, Lungenödem und Lungeninfiltration berichtet, die in einigen Fällen zu einer Atemfehlfunktion oder einem akuten Atemnotsyndrom (ARDS) führten, welche tödlich verlaufen können (siehe Kapitel «Warnhinweise und Vorsichtsmassnahmen»).
Kapillarlecksyndrom
Nach Anwendung von Granulozyten-Kolonie-stimulierenden Faktoren wurde über Fälle von Kapillarlecksyndrom berichtet. Diese sind im Allgemeinen aufgetreten bei Patienten mit fortgeschrittenen malignen Erkrankungen, bei Sepsis, bei Patienten, die mehrere chemotherapeutische Behandlungen erhalten haben oder die sich einer Apherese nach PBPC Mobilisierung unterzogen haben (siehe Kapitel «Warnhinweise und Vorsichtsmassnahmen»).
Splenomegalie und Milzruptur
Nach Anwendung von Filgrastim wurde über Fälle von Splenomegalie und Milzruptur berichtet. Einige Fälle von Milzrupturen verliefen tödlich (siehe Kapitel «Warnhinweise und Vorsichtsmassnahmen»).
Leukozytose und Thrombozytopenie
Nach Anwendung von Filgrastim wurde Leukozytose und Thrombozytopenie berichtet (siehe Kapitel «Warnhinweise und Vorsichtsmassnahmen»).
Sichelzellkrisen
In Einzelfällen wurde nach Markteinführung bei Patienten mit Sichelzellanlage oder Sichelzellanämie über Sichelzellkrisen berichtet (siehe Kapitel «Warnhinweise und Vorsichtsmassnahmen»).
Kutane Vaskulitis
Es wurde über kutane Vaskulitis bei Patienten berichtet, die mit Filgrastim behandelt wurden.
Kinder und Jugendliche
Daten aus klinischen Studien an Kindern und Jugendlichen zeigen, dass die Sicherheit und Wirksamkeit von Filgrastim sowohl bei Erwachsenen als auch bei Kindern, die eine zytotoxische Chemotherapie erhalten, ähnlich sind. Es wird angenommen, dass es keine altersabhängigen Unterschiede in der Pharmakokinetik von Filgrastim gibt. Das einzige immer wieder berichtete unerwünschte Ereignis war muskuloskelettaler Schmerz, was sich nicht von den Erfahrungen bei Erwachsenen unterscheidet.
Für eine weitergehende Beurteilung der Anwendung von Filgrastim bei Kindern und Jugendlichen liegen keine ausreichenden Daten vor.
Andere besondere Patientengruppen
Ältere Patienten
Insgesamt wurden keine Unterschiede in der Sicherheit und Wirksamkeit bei Patienten über 65 Jahre im Vergleich zu jüngeren Erwachsenen (>18 Jahre), die eine zytotoxische Chemotherapie erhielten, beobachtet. Die klinische Erfahrung zeigt auch keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten. Es gibt keine ausreichenden Daten, um die Anwendung von Filgrastim bei älteren Patienten für die anderen zugelassenen Filgrastim-Indikationen zu beurteilen.
Kinder und Jugendliche mit SCN
Bei Kindern und Jugendlichen mit schwerer chronischer Neutropenie, die eine chronische Behandlung mit Filgrastim erhielten, wurde über Fälle von verminderter Knochendichte und Osteoporose berichtet.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Die Auswirkungen einer Überdosierung von Filgrastim sind noch nicht bekannt. Patienten mit schwerer chronischer Neutropenie mit Dosen über 14,5 Mio.E (145 µg) pro Kilogramm Körpergewicht und Tag zeigten keine Krankheitssymptome. Bei Patienten die eine zytotoxische Chemotherapie mit anschliessender Knochenmarktransplantation erhielten, haben sich Dosierungen bis zu 7,0 Mio.E. (70 µg) pro Kilogramm Körpergewicht als verträglich erwiesen.
Im Falle einer Überdosierung führt das Absetzen von Filgrastim in der Regel innerhalb von 1 bis 2 Tagen zu einem Abfall der Neutrophilenzahl auf die Hälfte und zu einer Normalisierung der Werte innerhalb von 1 bis 7 Tagen.
Eigenschaften/Wirkungen
ATC-Code: L03AA02
Filgrastim ist ein hochgradig gereinigtes, unglykosyliertes Protein aus 175 Aminosäuren und wird aus E. coli-Bakterien gewonnen, in deren Genom biotechnologisch das Gen für den humanen Granulozyten-Kolonie-stimulierenden Faktor eingefügt wurde.
Wirkungsmechanismus
Der humane Granulozyten-Kolonie-stimulierende Faktor ist ein Glykoprotein, das die Bildung von funktionsfähigen neutrophilen Granulozyten und deren Freisetzung aus dem Knochenmark steuert.
Pharmakodynamik
G-CSF in Filgrastim-Teva führt innerhalb von 24 Stunden nach Verabreichung zu einer deutlichen Steigerung der Anzahl der neutrophilen Granulozyten in der Blutbahn, begleitet von einem leichten Anstieg der Monozytenzahl. Bei einigen Patienten mit schwerer chronischer Neutropenie kann Filgrastim auch die Anzahl der zirkulierenden eosinophilen und basophilen Granulozyten geringfügig bis zum Normwert erhöhen. Einige dieser Patienten weisen bereits vor Beginn der Therapie eine Eosinophilie oder Basophilie auf. Diese Erhöhung des Neutrophilenspiegels im Blut ist im empfohlenen Dosierungsbereich dosisabhängig. Wie in klinischen Studien gezeigt werden konnte, verfügen die als Reaktion auf eine Behandlung mit Filgrastim vom menschlichen Körper produzierten Neutrophilen über eine normale bis erhöhte Fähigkeit zur Phagozytose und zur Superoxidproduktion.
Die Verwendung von Filgrastim allein oder nach einer Chemotherapie mobilisiert die Freisetzung hämatopoetischer Vorläuferzellen in das periphere Blut. Diese Progenitorzellen des peripheren Blutes (Peripheral Blood Progenitor Cells, PBPC) können isoliert und nach einer aplasierenden, zytotoxischen Therapie entweder anstelle von oder zusätzlich zu einer Knochenmarktransplantation infundiert werden. Die PBPC können auch nach einer (stark) myelosuppressiven zytotoxischen Therapie unterstützend gegeben werden. Die Infusion von PBPC beschleunigt die hämatopoetische Wiederherstellung und verkürzt die Risikodauer für hämorrhagische Komplikationen und reduziert die Notwendigkeit von Thrombozytentransfusionen.
Bei gesunden Spendern führt eine für 4 bis 5 aufeinanderfolgende Tage subkutan applizierte Dosis von 10 µg pro kg Körpergewicht und Tag bei der Mehrzahl der Spender zur Gewinnung von ≥4×106 CD34+-Zellen pro kg Körpergewicht des Empfängers nach zwei Leukapheresen.
Nach Beendigung der Behandlung mit Filgrastim fallen die Neutrophilenspiegel im Blut innerhalb von 1 bis 2 Tagen auf ca. die Hälfte ab und erreichen nach ca. 1 bis 7 Tagen wieder normale Werte. Die Therapie mit Filgrastim führt zu einer signifikanten Verringerung von Auftreten, Schweregrad und Dauer einer Neutropenie bzw. des neutropenischen Fiebers, die häufig nach Durchführung einer zytostatischen Chemotherapie oder einer aplasierenden Chemotherapie mit anschliessender Knochenmarktransplantation beobachtet werden. Patienten, die zusätzlich zu einer Chemotherapie auch mit Filgrastim behandelt werden, müssen weniger häufig und weniger lange stationär aufgenommen werden. Ferner benötigen sie weniger Antibiotikagaben verglichen mit Patienten, die sich einer Chemotherapie ohne Zusatzbehandlung unterzogen haben.
Die Behandlung mit Filgrastim verringert die Dauer der febrilen Neutropenie, des Einsatzes von Antibiotika sowie der Hospitalisierung im Anschluss an eine Induktionschemotherapie bei Patienten mit akuter myeloischer Leukämie signifikant. Das Auftreten von Fieber sowie von dokumentierten Infekten wurde unter diesen Bedingungen nicht reduziert. Bei Patienten mit bereits vor Therapiebeginn tiefen Leukozytenwerten aufgrund reduzierter Markreserven (z.B. nach ausgedehnter Strahlentherapie und/oder nach wiederholten Chemotherapiezyklen) ist die Wirkung von G-CSF noch nicht bewiesen. Bei diesen Patienten kann eine G-CSF-Therapie die übliche Dosisadaptation der Chemotherapeutika vorläufig nicht ersetzen.
Eine retrospektive europäische Studie untersuchte die Anwendung von G-CSF nach allogener Knochenmarktransplantation bei Patienten mit akuter Leukämie. Diese Studie wies darauf hin, dass bei der Anwendung von G-CSF eine Erhöhung des Risikos von Graft-versus-Host-Disease (GvHD), behandlungsbedingter Mortalität (treatment related mortality, TRM) und Mortalität vorliegt. Bei einer separaten retrospektiven internationalen Studie bei Patienten mit akuter und chronisch-myeloischer Leukämie wurde kein Einfluss auf GvHD, TRM und Mortalität beobachtet. Eine Metaanalyse von allogenen Transplantationsstudien, die Ergebnisse von neun prospektiven randomisierten Studien, acht retrospektiven Studien und einer Fall-kontrollierten Studie beinhaltete, zeigte keinen Einfluss auf das Risiko für eine akute oder chronische GvHD oder eine frühzeitige behandlungsbedingte Mortalität.
Relatives Risiko (95% KI) von Graft-versus-Host-Reaktion (GvHD) und behandlungsbedingter Mortalität (TRM) nach Behandlung mit G-CSF nach Knochenmarktransplantation | |||||
|---|---|---|---|---|---|
Publikation | Zeitraum der Studie | N | Akute | Chronische | TRM |
Meta-Analyse | 1986-2001a | 1198 | 1,08 | 1,02 | 0,70 |
Europäische retrospektive | 1992-2002b | 1789 | 1,33 | 1,29 | 1,73 |
Internationale retrospektive | 1995-2000b | 2110 | 1,11 | 1,10 | 1,26 |
a Die Analyse beinhaltete Studien, bei denen während dieser Zeit Knochenmarktransplantationen eingeschlossen waren; einige Studien verwendeten GM-CSF (Granulocyte-macrophage colony-stimulating factor)
b Die Analyse beinhaltete Patienten, die in diesem Zeitraum eine Knochenmarktransplantation erhalten hatten
Die Behandlung mit Filgrastim-Teva bei Kindern oder Erwachsenen mit schwerer chronischer Neutropenie (schwere kongenitale Neutropenie, zyklische Neutropenie, idiopathische Neutropenie) führt zu einer Erhöhung der absoluten Neutrophilenzahl im peripheren Blut und einer Verminderung von Infektionen und den damit zusammenhängenden Folgen.
Die Verwendung von Filgrastim-Teva bei HIV Patienten hält die Neutrophilenzahl im Normalbereich, wodurch antivirale Medikamente und/oder andere myelosuppressive Präparate in der üblichen Dosierung verabreicht werden können. Es gibt keine Anhaltspunkte dafür, dass bei HIV Patienten, die mit Filgrastim behandelt werden, die Proliferation des HIV-Virus angeregt wird.
Wie auch bei anderen hämatopoetischen Wachstumsfaktoren beobachtet, zeigt G-CSF in vitro einen stimulierenden Effekt auf das Wachstum menschlicher Endothelzellen.
Klinische Wirksamkeit
Die Wirksamkeit und Sicherheit von Filgrastim-Teva wurde in randomisierten, kontrollierten Phase-III-Studien bei Brustkrebs, Lungenkrebs und Non-Hodgkin-Lymphom-Patienten belegt.
In der pivotalen Studie bei 348 Patientinnen/en mit Brustkrebs wurde die Dauer der schweren Neutropenie während des 1. Chemotherapiezyklus als primärer Wirksamkeitsparameter im Vergleich zur Referenz und im Vergleich zu Plazebo untersucht. Während die Dauer der schweren Neutropenie in beiden Verumgruppen durchschnittlich 1,1 Tage betrug, war in der Plazebogruppe mit durchschnittlich 3,8 Tagen die Dauer der schweren Neutropenie signifikant verlängert.
Im ersten Chemotherapiezyklus fiel die Neutrophilenzahl (ANC) unter Plazebo nach dem 2. Tag ab und erreichte den Nadir am Tag 11.
In der Filgrastim-Teva-Gruppe und der Referenzgruppe stiegen die ANC-Werte bis auf ein Maximum am Tag 3 an, erreichten am Tag 7 den Nadir um anschliessend wieder auf ein zweites Maximum am Tag 11 anzusteigen.
Während des 1. Chemotherapiezyklus war der mittlere ANC Nadir in der Plazebo-Gruppe mit 0,16× 109/l tiefer als in den beiden Verumgruppen (0,66× 109/l).
Die Zeit bis zur Wiederherstellung des ANC war während des 1. Chemotherapiezyklus für Filgrastim-Teva und das Referenzpräparat mit ca. 8 Tagen vergleichbar, während in der Plazebogruppe der ANC erst nach 14 Tagen wiederhergestellt war.
In einer weiteren Studie an 240 Patienten mit Lungenkarzinom wurde die Sicherheit und die Verträglichkeit von Filgrastim-Teva im Vergleich zur Referenz über maximal 6 Chemotherapie-Behandlungszyklen untersucht. Ab dem zweiten Zyklus wurden die Patienten der Referenzgruppe auf Filgrastim-Teva umgestellt.
Während des 1. Chemotherapiezyklus betrug die mittlere Dauer der schweren Neutropenie (DSN) in der Filgrastim-Teva-Gruppe 0,5 Tage und in der Referenzgruppe 0,3 Tage. Während des 1. Chemotherapiezyklus erreichte der ANC sowohl unter Filgrastim-Teva als auch unter der Referenz nach 5 Tagen ein erstes Maximum. Der Nadir wurde nach 11 Tagen unter Filgrastim-Teva und nach 12 Tagen unter der Referenz erreicht.
In einer dritten Studie an 90 Patienten mit Non-Hodgkin Lymphomen wurde die Wirksamkeit und Verträglichkeit von Filgrastim-Teva im Vergleich zur Referenz über einen Zeitraum von maximal 6 Chemotherapiezyklen untersucht. Ab dem zweiten Zyklus wurden die Patienten der Referenzgruppe auf Filgrastim-Teva umgestellt.
Die mittlere Dauer der schweren Neutropenie während des 1. Chemotherapiezyklus betrug in der Filgrastim-Teva-Gruppe 0,5 Tage und in der Referenzgruppe 0,9 Tage.
Der ANC erreichte während des 1. Chemotherapiezyklus sowohl unter Filgrastim-Teva als auch unter der Referenz nach 4 Tagen ein erstes Maximum und nach 11 Tagen ein zweites Maximum. Der Nadir wurde jeweils nach 9 Tagen in beiden Behandlungsgruppen erreicht.
Der mittlere ANC während des 1. Chemotherapiezyklus betrug in der Filgrastim-Teva-Gruppe 1,7× 109/l und in der Referenzgruppe 1,1× 109/l.
Im Durchschnitt erholte sich der ANC Wert während des 1. Chemotherapiezyklus nach 6 Tagen (Filgrastim-Teva) bzw. nach 6,7 Tagen (Referenz) wieder.
Pharmakokinetik
Absorption
Sowohl nach subkutaner als auch intravenöser Gabe von Filgrastim-Teva wurde ein linearer Zusammenhang zwischen der Dosis und der Serumkonzentration von Filgrastim festgestellt. Nach einmaliger Verabreichung von Filgrastim in Dosen zwischen 1,7 und 69,0 µg/kg Körpergewicht (i.v. Kurzinfusion über 30 Minuten) wurden Spitzenkonzentrationen im Serum zwischen 5 und 1840 ng/ml gefunden. Nach s.c. Verabreichung der empfohlenen Dosis wurden Serumkonzentrationen von bis zu 118 ng/ml gemessen, die während eines Zeitraums von 8 bis 16 Stunden oberhalb von 10 ng/ml geblieben sind. Das ermittelte Verteilungsvolumen im Blut lag bei ca. 150 ml/kg.
Elimination
Sowohl nach s.c. als auch nach i.v. Verabreichung folgte die Clearance von Filgrastim einer Kinetik erster Ordnung. Die bestimmte Gesamtkörper-Clearance war 0,6 ml pro Minute und kg. Die durchschnittliche Eliminationshalbwertzeit betrug ca. 3,5 Stunden.
Zwei randomisierte, single-dose, Crossover-Studien mit 196 gesunden Freiwilligen zeigten, dass das pharmakokinetische Profil von Filgrastim-Teva und dem Referenzpräparat nach subkutaner und intravenöser Verabreichung vergleichbar ist. Nach einmaliger i.v. Applikation von 5 bzw. 10 µg/kg Körpergewicht wurden durchschnittliche Maximalkonzentrationen von 130 und 231 ng/ml erreicht (Referenzarzneimittel: 126 und 222 ng/ml). Nach s.c. Applikation von 5 bzw. 10 µg/kg Körpergewicht wurden durchschnittliche maximale Serumkonzentrationen von 18 und 46 ng/ml (Referenzarzneimittel: 18 und 43 ng/ml) gemessen. Die Serumkonzentrationen lagen während rund 8–16 Stunden (Referenzarzneimittel: 8–16 Stunden) oberhalb von 10 ng/ml. Die Eliminationshalbwertszeit betrug durchschnittlich rund 3,5 Stunden.
Unter einer Dauerinfusion mit Filgrastim über bis zu 28 Tage bei Patienten nach autologer Knochenmarktransplantation ergaben sich vergleichbare Halbwertzeiten ohne Anzeichen einer Kumulation.
Das pharmakokinetische Profil bei einer Konzentration von 0,96 mg/ml weist einen unbedeutenden, konzentrationsbedingten Unterschied gegenüber den niedrigeren Konzentrationen von 0,6 mg/ml und 0,3 mg/ml auf. Dieser Unterschied hat keinen Einfluss auf das pharmakodynamische Ansprechen insgesamt (gemessen anhand des Ansprechens der Neutrophilen).
Kinetik spezieller Patientengruppen
Patienten mit Nieren- und Leberinsuffizienz
In einer Studie an 12 Patienten mit unterschiedlichen Nierenfunktionsstufen wurden bei Probanden mit Nierenerkrankungen im Endstadium im Vergleich zu gesunden Probanden und Patienten mit mässiger Niereninsuffizienz eine Zunahme von Cmax und der AUC sowie eine Abnahme des Verteilungsvolumens und der Clearance beobachtet. Da die ANC Mittelwertprofile über die unterschiedlichen Nierenfunktionsstufen, einschliesslich Nierenerkrankungen im Endstadium, ähnlich waren, ist eine Dosisanpassung von Filgrastim-Teva bei Patienten mit Nierenfunktionsstörungen nicht notwendig. Die Resultate einer Studie an 12 Patienten mit Beeinträchtigung der Leberfunktion zeigen, dass die Pharmakokinetik und die Pharmakodynamik von Filgrastim bei Probanden mit eingeschränkter Leberfunktion und Gesunden ähnlich sind. Daher ist eine Dosisanpassung bei Patienten mit eingeschränkter Leberfunktion nicht notwendig.
Präklinische Daten
Bei bestimmten malignen Zellen wurde die Expression von Rezeptoren für G-CSF (Granulozyten-Kolonie-stimulierender Faktor) nachgewiesen. Die Möglichkeit, dass Filgrastim bei manchen Tumortypen als Wachstumsfaktor wirkt, ist nicht auszuschliessen.
Das karzinogene Potenzial von Filgrastim ist nicht untersucht worden. Filgrastim induzierte weder bei Vorliegen noch bei Fehlen eines arzneimittel-metabolisierenden Enzymsystems Genmutationen in Bakterien. Filgrastim hatte keine beobachtbare Wirkung auf die Fertilität männlicher oder weiblicher Ratten oder deren Trächtigkeitsverlauf bei Dosierungen bis zu 500 mcg/kg.
Sonstige Hinweise
Inkompatibilitäten
Filgrastim-Teva sollte nicht mit Kochsalzlösung verdünnt werden. Bezüglich der Kompatibilität von Filgrastim-Teva mit Kunststoffen nach Verdünnen zur Infusion siehe «Hinweise für die Handhabung».
Haltbarkeit
Filgrastim-Teva Fertigspritzen sind nur zum einmaligen Gebrauch bestimmt. Nicht gebrauchte Restlösung ist zu verwerfen.
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
In der Originalverpackung, vor Licht geschützt und im Kühlschrank (2–8 °C) lagern. Ausser Reichweite von Kindern aufbewahren.
Sollte Filgrastim-Teva versehentlich Temperaturen unter dem Gefrierpunkt ausgesetzt sein, hat dies keine nachteiligen Auswirkungen auf die Stabilität des Präparates.
Die chemische und physikalische Stabilität der verdünnten Infusionslösung wurde für 24 Stunden bei 2 °C bis 8 °C nachgewiesen. Aus mikrobiologischer Sicht sollte das Präparat sofort verwendet werden. Wenn es nicht sofort eingesetzt wird, ist der Anwender für die Dauer und die Bedingungen der Aufbewahrung verantwortlich. Sofern die Verdünnung nicht unter kontrollierten und validierten aseptischen Bedingungen erfolgt, ist diese nicht länger als 24 Stunden bei 2 °C bis 8 °C aufzubewahren.
Hinweise für die Handhabung
Hinweise zur Verdünnung von Filgrastim-Teva zur Infusion
Filgrastim-Teva kann bei Bedarf mit 5%iger Glukoselösung für Injektionszwecke verdünnt werden. Aus der verdünnten Lösung heraus kann Filgrastim an Glas oder Kunststoffe adsorbiert werden. Nach vorschriftsmässiger Verdünnung zur Infusion ist die Lösung jedoch kompatibel zu Polypropylen. Beträgt die Konzentration von Filgrastim nach Verdünnung weniger als 1,5 Mio.E. (15 µg) pro ml Infusionslösung, so sollte Humanalbumin (Endkonzentration 2 mg Albumin/ml Infusionslösung) zugesetzt werden.
Verdünnungsbeispiel: Beträgt das angestrebte Volumen der verdünnten Lösung 20 ml, der Gehalt an Filgrastim darin aber weniger als 30 Mio.E. (300 µg), so sollten 0,2 ml einer 20%igen Humanalbuminlösung zugesetzt werden.
Filgrastim-Teva sollte jedoch keinesfalls Fall auf eine Konzentration unter 0,2 Mio.E. (2 µg) pro ml Infusionslösung verdünnt werden.
Verwendung der Fertigspritze mit Nadelschutzsystem
Das Nadelschutzsystem bedeckt die Nadel nach der Injektion, um Nadelstichverletzungen vorzubeugen. Die normale Bedienung der Spritze wird hierdurch nicht beeinträchtigt. Den Kolben langsam und gleichmässig herabdrücken, bis die gesamte Dosis gegeben worden ist und der Kolben nicht weiter herabgedrückt werden kann. Spritze mit weiterhin gedrücktem Kolben herausziehen. Das Nadelschutzsystem bedeckt die Nadel, wenn der Kolben losgelassen wird.
Zulassungsnummer
60722 (Swissmedic).
Zulassungsinhaberin
Teva Pharma AG, Basel.
Stand der Information
Januar 2020.
Interne Versionsnummer: 5.2
Composition
Principes actifs
Filgrastim (G-CSF). Produit à partir de bactéries E. coli génétiquement modifiées.
G-CSF signifie: facteur de croissance granulocytaire humain méthionylé, recombinant et non glycosylé
Excipients
Filgrastim-Teva 30: Acétate de sodium* (maximum 0.026 mg de sodium), sorbitol (E420) 25 mg, polysorbate 80, eau pour préparations injectables.
Filgrastim-Teva 48: Acétate de sodium* (maximum 0.042 mg de sodium), sorbitol (E420) 40 mg, polysorbate 80, eau pour préparations injectables.
*L'acétate de sodium est obtenu par réaction entre l'acide acétique 99% et l'hydroxyde de sodium.
Forme pharmaceutique et quantité de principe actif par unité
Solution injectable en seringues préremplies.
Filgrastim-Teva 30: 1 seringue préremplie (0,5 ml de solution injectable) renferme 30 millions d'unités (soit 300 µg) de filgrastim.
Filgrastim-Teva 48: 1 seringue préremplie (0,8 ml de solution injectable) renferme 48 millions d'unités (soit 480 µg) de filgrastim.
Indications/Possibilités d’emploi
Filgrastim-Teva est indiqué:
- Dans la réduction de la durée et de la sévérité des neutropénies observées chez les patients (adultes et enfants) traités par une chimiothérapie cytotoxique à effet fortement myélosuppressif pour une affection maligne (exception faite de la leucémie myéloïde chronique et du syndrome myélodysplasique).
- Chez l'enfant souffrant de leucémie myéloïde aiguë, il n'a pas été effectué d'étude randomisée, mais il existe des études séquentielles non contrôlées ou non randomisées.
- Dans la réduction de la durée des neutropénies observées chez les patients traités par des chimiothérapies cytotoxiques à hautes doses et soumis par la suite à une autogreffe ou à une allogreffe de moelle osseuse.
- Pour la mobilisation des cellules précurseurs du sang périphérique (PBPC).
- Pour l'utilisation à long terme visant à accroître le nombre de granulocytes neutrophiles et à réduire les infections chez des enfants et des adultes ayant présenté des infections cliniquement significatives au cours des 12 derniers mois ainsi qu'une neutropénie ANC <0,5× 109/l documentée à trois reprises, s'inscrivant dans le cadre d'une neutropénie congénitale, d'une neutropénie cyclique ou d'une neutropénie idiopathique sévères.
- Pour le traitement d'une neutropénie persistante (ANC ≤1,0× 109/l) chez les patients infectés par le VIH à un stade avancé afin de réduire le risque d'infection bactérienne lorsque d'autres options destinées à corriger la neutropénie sont inadéquates.
Posologie/Mode d’emploi
Patients traités par chimiothérapie cytotoxique à cause d'une affection maligne
Posologie
La dose recommandée de Filgrastim-Teva est de 0,5 MU (5 µg) par kilogramme de poids corporel par jour. Le traitement par Filgrastim-Teva doit être instauré au plus tôt 24 heures après l'administration d'une chimiothérapie cytotoxique.
Le contenu d'une seringue préremplie de Filgrastim-Teva 30 (60 millions d'unités/ml) correspond à la dose journalière nécessaire pour un patient pesant 60 kilogrammes. Le contenu d'une seringue préremplie de Filgrastim-Teva 48 correspond à la dose journalière nécessaire pour un patient pesant 96 kilogrammes.
Durée du traitement
L'administration quotidienne de Filgrastim-Teva doit être poursuivie jusqu'à ce que le nombre de neutrophiles attendu se soit de nouveau normalisé, une fois le taux le plus faible de neutrophiles (nadir) dépassé. Après une chimiothérapie standard validée pour tumeurs solides, lymphomes et leucémies lymphoïdes, la durée du traitement peut aller jusqu'à 14 jours. Après le traitement d'induction et de consolidation d'une leucémie myéloïde aiguë, la durée du traitement peut être nettement plus longue (jusqu'à 38 jours), en fonction du type, de la dose et du schéma posologique de la chimiothérapie cytotoxique administrée.
Chez les patients recevant une chimiothérapie cytotoxique, une hausse transitoire du nombre des neutrophiles est typiquement observée 1 à 2 jours après le début du traitement. Néanmoins, pour assurer un succès thérapeutique durable, Filgrastim-Teva ne doit pas être interrompu avant que le nadir attendu (taux le plus faible) n'ait été dépassé et que le nombre de neutrophiles se soit normalisé. Un arrêt prématuré du traitement par Filgrastim-Teva, à savoir avant l'atteinte du nadir attendu (taux le plus faible), n'est pas recommandé. Il convient d'arrêter le traitement lorsque le nombre de neutrophiles a atteint 1,0× 109/l, une fois le nadir (taux le plus faible) dépassé.
Mode d'emploi
Filgrastim-Teva peut être administré en injection sous-cutanée quotidienne ou en perfusion intraveineuse quotidienne de 30 minutes après dilution dans une solution de glucose à 5% (voir «Instructions pour la dilution» dans la rubrique «Remarques particulières»).
Dans la plupart des cas, l'administration sous-cutanée est préférable. Les résultats d'une étude portant sur l'administration de doses uniques donnent à penser qu'une administration par voie intraveineuse peut réduire la durée d'action. La signification clinique de cette observation dans le cas d'une administration répétée n'est pas établie.
Patients traités par chimiothérapie cytotoxique et soumis par la suite à une greffe de moelle osseuse
Posologie
La dose initiale recommandée de Filgrastim-Teva est de 1,0 MU (10 µg) par kilogramme de poids corporel par jour. La première dose par Filgrastim-Teva doit être instaurée au plus tôt 24 heures après l'administration de la chimiothérapie cytotoxique, mais dans les 24 heures suivant la greffe de moelle osseuse.
Durée du traitement
L'efficacité et l'innocuité du filgrastim administré pendant plus de 28 jours dans cette indication n'ont pas été établies.
Adaptation de la dose
Une fois passé le plus faible taux de neutrophiles (nadir), la dose quotidienne de Filgrastim-Teva doit être adaptée selon le schéma suivant, en fonction des modifications de la formule sanguine:
Nombre de neutrophiles | Adaptation de la dose de Filgrastim-Teva |
|---|---|
| >1,0× 109/l pendant 3 jours consécutifs | Réduire à 0,5 MU (5 µg)/kg/jour |
| Si l'ANC est >1,0× 109/l pendant 3 jours consécutifs supplémentaires | Arrêter le traitement par Filgrastim-Teva |
| Si l'ANC devient inférieur à 1,0× 109/l en cours de traitement, la dose de Filgrastim-Teva devra être réaugmentée selon schéma thérapeutique décrit ci-dessus. | |
ANC = nombre absolu de neutrophiles
Mode d'emploi
Filgrastim-Teva est administré en perfusion intraveineuse de 30 minutes ou de 24 heures, ou en perfusion sous-cutanée continue de 24 heures. Filgrastim-Teva doit être dilué dans 20 ml de solution de glucose à 5% (voir «Instructions pour la dilution» dans la rubrique «Remarques particulières»).
Mobilisation des cellules précurseurs du sang périphérique (PBPC)
Mobilisation de cellules souches du sang périphérique chez des patients soumis à un traitement myélosuppressif suivi d'une transfusion de PBPC autologues, avec ou sans greffe de moelle osseuse, ou chez des patients soumis à un traitement aplasiant suivi d'une perfusion de PBPC
Posologie
La dose recommandée de Filgrastim-Teva est de 1,0 MU (10 µg) par kilogramme de poids corporel par jour pendant 5 à 7 jours consécutifs.
Durée du traitement
Une ou deux leucaphérèses aux jours 5 et 6 sont souvent suffisantes. Dans d'autres circonstances, des leucaphérèses supplémentaires peuvent être nécessaires. Le traitement par Filgrastim-Teva doit être poursuivi jusqu'à la dernière leucaphérèse.
Mode d'emploi
Filgrastim-Teva est administré en perfusion sous-cutanée continue sur 24 heures ou sous forme d'injection sous-cutanée unique. Avant d'être perfusé, Filgrastim-Teva doit être dilué avec 20 ml d'une solution de glucose à 5% (voir «Instructions pour la dilution» dans la rubrique «Remarques particulières»).
Mobilisation de PBPC après chimiothérapie myélosuppressive
Posologie
La dose recommandée de Filgrastim-Teva est de 0,5 MU (5 µg) par kilogramme de poids corporel par jour à partir du premier jour suivant la fin de la chimiothérapie jusqu'à ce que le nombre de neutrophiles soit redevenu normal après le nadir attendu (taux le plus faible). La leucaphérèse doit avoir lieu au cours de la période pendant laquelle le nombre absolu de neutrophiles (ANC) passe de <0,5× 109/l à >5,0× 109/l. Chez les patients n'ayant pas été soumis antérieurement à une chimiothérapie intensive, une seule leucaphérèse est souvent déjà suffisante. Dans les autres cas, des leucaphérèses complémentaires sont recommandées.
Chez les patients ayant été soumis antérieurement à une chimiothérapie très intensive et auxquels Filgrastim-Teva a été administré pour la mobilisation des PBPC, il se peut que le nombre de PBPC soit insuffisant pour que le gain minimal recommandé soit garanti (gain minimal global à partir des échantillons de leucaphérèse: ≥10 à 30× 104 GM-CFC/kg ou ≥1 à 2,5× 106 cellules CD34+/kg).
Mode d'emploi
Filgrastim-Teva est administré par voie sous-cutanée.
Mobilisation des PBPC chez les donneurs sains pour la transplantation allogénique
La mobilisation des cellules progénitrices ne doit être entreprise que sous la surveillance de centres expérimentés dans la collecte de cellules progénitrices chez des donneurs sains.
Posologie
La dose recommandée de Filgrastim-Teva est de 1 MU (10 µg) par kilogramme de poids corporel par jour pendant 4 à 5 jours consécutifs. Les leucaphérèses doivent être commencées au jour 5 et poursuivies jusqu'au jour 6 si nécessaire, afin de collecter une quantité de 4× 106 cellules CD34+ par kilogramme de poids corporel du receveur.
La sécurité et l'efficacité de Filgrastim-Teva chez des donneurs sains <16 ans ou >60 ans n'ont pas été étudiées.
Mode d'emploi
Filgrastim-Teva est administré par voie sous-cutanée.
Patients avec neutropénie congénitale, neutropénie cyclique ou neutropénie idiopathique sévères
Posologie
Neutropénie congénitale: La dose initiale recommandée de Filgrastim-Teva est de 1,2 MU (12 µg) par kilogramme de poids corporel par jour, en dose unique ou en plusieurs doses.
Neutropénie idiopathique ou cyclique: La dose initiale recommandée de Filgrastim-Teva est de 0,5 MU (5 µg) par kilogramme de poids corporel par jour en dose unique ou en plusieurs doses.
Adaptation de la dose
Chez chaque patient, la dose doit à tout prix être fixée individuellement, de manière à atteindre un ANC minimal de 1,5× 109/l.
L'administration quotidienne au long cours est indiquée pour maintenir un nombre de neutrophiles adéquat. La dose doit être doublée si, après 1-2 semaines, la valeur cible de 1,5× 109 ANC/l n'a pas été atteinte, et réduite de moitié si l'ANC dépasse 10× 109/l. Une augmentation plus rapide de la dose est indiquée chez les patients présentant des infections graves. Des doses supérieures à 14,5 MU (145 µg) par kilogramme de poids corporel par jour sont sûres et ont été bien tolérées.
Mode d'emploi
Filgrastim-Teva est administré par voie sous-cutanée.
Patients infectés par le VIH
Posologie
Pour corriger la neutropénie
La dose initiale recommandée de Filgrastim-Teva est de 0,1 MU (1 µg) par kilogramme de poids corporel par jour avec titrage jusqu'au maximum de 0,4 MU (4 µg) par kilogramme de poids corporel par jour, jusqu'à ce que le nombre des neutrophiles se soit normalisé et puisse se maintenir à ce niveau (ANC >2,0× 109/l). Au cours des études cliniques, plus de 90% des patients ont répondu à ce dosage et leur neutropénie s'est normalisée en 2 jours (médiane).
Chez un faible nombre de patients (<10%), des doses allant jusqu'à 1,0 MU (10 µg) par kilogramme de poids corporel par jour se sont avérées nécessaires pour corriger la neutropénie.
Pour maintenir un taux de neutrophiles normal
Dès que la neutropénie est corrigée, la dose minimale la plus efficace permettant de maintenir un nombre de neutrophiles normal doit être déterminée. On recommande un premier ajustement posologique avec une administration sous-cutanée de 300 µg par jour tous les deux jours. En fonction de l'ANC du patient, une adaptation posologique supplémentaire peut se révéler nécessaire pour que le nombre des neutrophiles reste supérieur à 2,0× 109/l. Au cours des études cliniques, il a été nécessaire d'administrer 300 µg par jour durant 1 à 7 jours par semaine pour maintenir l'ANC supérieur à 2,0× 109/l; la durée médiane d'administration de cette dose était de 3 jours par semaine. Un traitement à long terme peut s'avérer nécessaire pour maintenir un ANC de 2,0× 109/l.
Mode d'emploi
Filgrastim-Teva est administré par voie sous-cutanée.
Instructions spéciales pour la posologie
Patients âgés
Etant donné que l'expérience acquise chez les patients âgés est encore peu importante, il n'est pas possible d'émettre des recommandations posologiques spéciales à l'intention de ce groupe de patients.
Patients présentant une insuffisance rénale ou hépatique
Des études avec le filgrastim chez des patients présentant une insuffisance rénale ou hépatique sévère ont montré que les profils pharmacocinétique et pharmacodynamique sont pratiquement similaires à ceux observés chez les sujets normaux (voir «Pharmacocinétique»). Un ajustement des doses n'est pas nécessaire chez ces patients.
Enfants et adolescents
Les recommandations posologiques pour les patients pédiatriques qui reçoivent une chimiothérapie cytotoxique myélosuppressive ou pour des patients pédiatriques avec une neutropénie congénitale, une neutropénie cyclique ou une neutropénie idiopathique sévères sont identiques à celles valant pour les adultes.
Des données provenant d'études cliniques portant sur des patients pédiatriques montrent que la sécurité et l'efficacité du filgrastim sont comparables chez des adultes et des enfants qui avaient été soumis à une chimiothérapie myélosuppressive.
65% des patients traités dans le cadre d'études cliniques pour une neutropénie chronique sévère avaient moins de 18 ans. Le traitement dans ce groupe d'âge, qui comprenait essentiellement des patients souffrant de neutropénie congénitale, s'est révélé efficace. En ce qui concerne les patients pédiatriques traités pour une neutropénie chronique sévère, aucune différence n'a été constatée pour le profil de sécurité du produit par rapport aux adultes.
Pour garantir la traçabilité des médicaments fabriqués à partir des biotechnologies, il est recommandé de documenter la marque commerciale et le numéro de lot pour chaque traitement.
Contre-indications
Filgrastim-Teva ne doit pas être administré aux patients présentant une hypersensibilité connue au principe actif ou à l'un des excipients conformément à la composition.
Mises en garde et précautions
MISES EN GARDE ET PRÉCAUTIONS RELATIVES AUX RISQUES ET EFFETS INDÉSIRABLES GÉNÉRAUX
Hypersensibilité
Des cas de réactions d'hypersensibilité, incluant une anaphylaxie, ont été rapportés chez des patients traités par le filgrastim, lors du traitement initial ou des traitements suivants. Filgrastim-Teva doit être arrêté de façon définitive chez les patients présentant une hypersensibilité cliniquement significative. Ne pas administrer Filgrastim-Teva chez les patients ayant des antécédents d'hypersensibilité au filgrastim et pegfilgrastim.
Effets indésirables pulmonaires
Des effets indésirables pulmonaires, notamment une pneumonie interstitielle après administration de G-CSF ont été rapportés. Le risque peut être accru chez les patients ayant une anamnèse récente d'infiltrats pulmonaires ou de pneumonie. L'apparition de troubles pulmonaires, tels que toux, fièvre et dyspnée associés à des signes radiologiques d'infiltrats pulmonaires ainsi que la détérioration de la fonction pulmonaire peuvent être les premiers signes d'un syndrome de détresse respiratoire aigu (SDRA). Le traitement par Filgrastim-Teva doit être arrêté et un traitement approprié doit être instauré.
Glomérulonéphrite
Des cas de glomérulonéphrite ont été signalés chez des patients ayant reçu le filgrastim et le pegfilgrastim. En règle générale, ces cas ont disparu après une réduction posologique ou l'arrêt du traitement par le filgrastim et le pegfilgrastim. Une surveillance des valeurs urinaires est recommandée.
Syndrome de fuite capillaire
Un syndrome de fuite capillaire, pouvant menacer le pronostic vital si le traitement est retardé, a été signalé après l'administration de facteurs de croissance de la lignée granulocytaire et est caractérisé par une hypotension, une hypoalbuminémie, des œdèmes et une hémoconcentration. Les patients développant des symptômes du syndrome de fuite capillaire doivent être étroitement surveillés et recevoir un traitement symptomatique standard, qui peut inclure la nécessité d'un traitement aux soins intensifs (voir rubrique «Effets indésirables»).
Splénomégalie et rupture splénique
Après l'administration de filgrastim à des patients et à des donneurs sains, des cas de splénomégalie qui ont généralement évolué de façon asymptomatique et des cas de ruptures de la rate ont été rapportés. Quelques cas de rupture splénique ont été d'issue fatale. C'est la raison pour laquelle la taille de la rate doit être surveillée étroitement (p.ex. par examen clinique, échographie). Le diagnostic de rupture de la rate devra être évoqué chez les donneurs et/ou chez les patients qui se plaignent de douleurs au niveau de l'hypochondre gauche ou de la région de l'épaule. Il a été constaté qu'une réduction de la dose de filgrastim a permis un ralentissement ou l'arrêt de l'évolution de la splénomégalie chez les patients présentant une neutropénie chronique sévère. Chez 3% des patients, une splénectomie a été nécessaire.
Croissance de cellules malignes
Les facteurs de croissance granulocytaire peuvent promouvoir in vitro la croissance non seulement de cellules myéloïdes, mais aussi de cellules non myéloïdes. Etant donné que des cellules de tumeurs non myéloïdes peuvent également exprimer des récepteurs de G-CSF, l'arrêt du traitement par le G-CSF doit être envisagé chez les patients présentant une réponse insuffisante à la chimiothérapie.
Leucémie myéloïde chronique ou syndrome myélodysplasique
La sécurité et l'efficacité de Filgrastim-Teva chez les patients présentant un syndrome myélodysplasique ou une leucémie myéloïde chronique n'ont pas été déterminées. L'emploi de Filgrastim-Teva n'est pas indiqué dans ces maladies. Il convient de faire preuve d'une prudence toute particulière lorsqu'il s'agit d'établir la distinction diagnostique entre la transformation aiguë d'une leucémie myéloïde chronique et une leucémie aiguë myéloblastique.
Thrombocytopénie
Une thrombocytopénie a été observée chez les patients traités par le filgrastim.
Le nombre des thrombocytes doit être surveillé étroitement, et ce tout particulièrement pendant les premières semaines du traitement par Filgrastim-Teva. Un arrêt transitoire ou une réduction de la dose de Filgrastim-Teva doivent être envisagés chez les patients présentant une neutropénie chronique sévère qui développent une thrombocytopénie (nombre de thrombocytes <100× 109/l).
Leucocytose
Une leucocytose de 100× 109/l ou plus a été observée occasionnellement chez des patients recevant du filgrastim à des doses supérieures à 0,3 MU (3 µg) par kilogramme et par jour. Aucun effet indésirable directement imputable à ce degré de leucocytose n'a été signalé. Toutefois, en raison des risques que fait courir une hyperleucocytose, des contrôles réguliers de la formule leucocytaire doivent être réalisés à intervalles réguliers. Si le nombre de leucocytes dépasse 50× 109/l après le nadir attendu (taux le plus faible), Filgrastim-Teva doit être arrêté immédiatement. Par ailleurs, si le nombre de leucocytes dépasse 70× 109/l pendant l'administration de Filgrastim-Teva au titre de la mobilisation des PBPC, l'arrêt de Filgrastim-Teva est nécessaire.
Une leucocytose transitoire (numération leucocytaire >50× 109/l) a été observée chez 41% des donneurs sains examinés. On a relevé une numération leucocytaire >75× 109/l chez 2% des donneurs sains.
Immunogénicité
Comme avec toutes les protéines thérapeutiques, il existe un risque potentiel d'immunogénicité.
On dispose de données sur l'immunogénicité potentielle de 677 patients, provenant des études destinées à prouver l'efficacité et l'innocuité de Filgrastim-Teva. Après élimination de l'analyse des anticorps positifs préexistants, seuls des anticorps liants isolés ont encore été identifiés.
Aortite
Une aortite a été signalée après administration de G-CSF chez des sujets sains et des patients atteints d'un cancer. Les symptômes ressentis comprenaient: fièvre, douleurs abdominales, malaise, maux de dos et augmentation des marqueurs inflammatoires (p.ex. protéine C-réactive et nombre de globules blancs). Dans la plupart des cas, l'aortite a été diagnostiquée par un examen TDM et a été résolue après l'arrêt du traitement par G-CSF (voir également rubrique «effets indesirables»).
Hématurie et protéinurie
Une hématurie et une protéinurie ont été observées chez un petit nombre de patients. Il convient donc de procéder régulièrement à des analyses d'urine.
Excipients:
Acétate de sodium:
Ce médicament contient moins de 1 mmol (23 mg) de sodium par solution injectable c.-à-d. qu'il est essentiellement «sans sodium».
Sorbitol:
Les patients présentant une intolérance héréditaire au fructose (IHF) ne doivent pas recevoir ce médicament, sauf en cas de nécessité uniquement.
Les bébés et les jeunes enfants (moins de 2 ans) peuvent ne pas avoir été diagnostiqués avec une intolérance héréditaire au fructose (IHF). Les médicaments (contenant du sorbitol/fructose) administrés par voie intraveineuse peuvent être mortels et doivent être contre-indiqués dans cette population, sauf nécessité clinique impérieuse et en l'absence de solution alternative.
L'historique détaillé des symptômes d'IHF doit être obtenu pour chaque patient avant de prescrire ce médicament.
MISES EN GARDE ET PRÉCAUTIONS RELATIVES AUX COMORBIDITÉS
Ostéoporose
Un contrôle de la densité des os est recommandé chez les patients présentant déjà une ostéoporose et traités par le filgrastim pendant plus de six mois en continu, car des cas d'ostéoporose ont été observés lors de traitements au long cours.
Précautions particulières chez les patients atteints d'une anémie falciforme
D'après les publications, un nombre élevé de leucocytes est défavorable chez les patients souffrant d'une anémie falciforme. Pour cette raison, le médecin ne doit utiliser Filgrastim-Teva qu'avec prudence chez ces patients et doit surveiller étroitement les valeurs de laboratoire correspondantes. Il doit prendre en considération le rapport éventuel avec une splénomégalie et des crises vaso-occlusives.
Des crises de drépanocytose, ayant entraîné une issue fatale dans certains cas, ont été rapportées lors de l'utilisation de filgrastim chez des patients atteints d'anémie falciforme. Le médecin doit être prudent lors de la prescription de Filgrastim-Teva chez les patients porteurs du trait drépanocytaire ou atteints d'anémie falciforme.
MISES EN GARDE ET PRÉCAUTIONS RELATIVES À LA CHIMIOTHÉRAPIE
Risques associés à la chimiothérapie à hautes doses
Filgrastim-Teva ne doit pas être utilisé pour augmenter la posologie de chimiothérapies cytotoxiques au-delà du schéma posologique recommandé. Des précautions particulières doivent être prises pour le traitement des patients sous chimiothérapie à hautes doses car d'une part, une amélioration de la réponse de tumeurs à un tel traitement n'a pas été démontrée jusqu'à présent et d'autre part, une chimiothérapie hautement dosée peut conduire à des effets toxiques accrus y compris des effets cardiaques, pulmonaires, neurologiques et dermatologiques (voir aussi l'information professionnelle des chimiothérapies respectives utilisées).
Chimiothérapie avec myélosuppression retardée
Les données relatives à l'efficacité du filgrastim en cas de chimiothérapie induisant une myélosuppression retardée - par des nitroso-urées ou la mitomycine C, p.ex. ou impliquant l'administration de doses myélosuppressives d'antimétabolites tels que le 5-FU ou le cytosine-arabinoside sont encore insuffisantes.
Influence de la chimiothérapie sur les érythrocytes et les thrombocytes
Filgrastim-Teva réduit significativement l'incidence des neutropénies sévères et fébriles.
Il reste néanmoins un risque, chez les patients traités selon un schéma de chimiothérapie myélotoxique, de développer une thrombopénie et une anémie. On recommande par conséquent de contrôler régulièrement le nombre de thrombocytes et l'hématocrite. Une prudence particulière est de rigueur pour l'utilisation avec les agents chimiothérapeutiques (associés ou en monothérapie) connus pour provoquer une thrombopénie sévère.
Thrombopénie
Les patients qui reçoivent Filgrastim-Teva après l'administration de doses élevées d'une chimiothérapie myélosuppressive peuvent présenter un risque accru de développer une thrombopénie.
RECOMMANDATIONS EN MATIÈRE DE CONTRÔLE DE LA FORMULE SANGUINE
Le traitement par Filgrastim-Teva seul n'empêche pas l'apparition d'une thrombopénie et d'une anémie sous médicaments myélosuppresseurs. Comme, au cours du traitement par Filgrastim-Teva, de tels médicaments peuvent par principe être administrés à hautes doses ou en grande quantité au patient, le risque de thrombopénie et d'anémie peut également augmenter. Il est recommandé de surveiller régulièrement la formule sanguine. Une anémie et une augmentation passagère des cellules souches myéloïdes sont d'autres manifestations hématologiques nécessitant également une étroite surveillance (voir aussi rubriques MISES EN GARDE ET PRÉCAUTIONS RELATIVES AUX RISQUES ET EFFETS INDÉSIRABLES GÉNÉRAUX et EFFETS INDÉSIRABLES Thrombopénie et MISES EN GARDE ET PRÉCAUTIONS RELATIVES À LA CHIMIOTHÉRAPIE).
Infections susceptibles d'entraîner une myélosuppression
L'origine d'une neutropénie peut être une infection opportuniste, par exemple due au complexe Mycobacterium avium qui infiltre la moelle osseuse, ou une atteinte maligne comme un lymphome. Chez les patients souffrant d'une infection infiltrant la moelle osseuse ou d'un cancer, un traitement adapté de la pathologie de base doit être envisagé en plus du traitement de la neutropénie par Filgrastim-Teva. Le mécanisme d'action du filgrastim sur la neutropénie en rapport avec les tableaux cliniques mentionnés n'est pas suffisamment connu.
GROUPES DE PATIENTS PARTICULIERS/INDICATIONS SPECIFIQUES
Précautions particulières chez les patients qui se soumettent à une mobilisation des PBPC
Estimation des rendements en cellules souches progénitrices
Il convient d'attacher une attention particulière à la méthode de quantification utilisée pour déterminer le taux de cellules progénitrices collectées chez les patients traités par du filgrastim. Les résultats de la quantification des cellules CD34+ par cytométrie de flux varient suivant la précision de la méthode utilisée. Les recommandations de taux basées sur des études d'autres laboratoires doivent donc être interprétées avec prudence.
L'analyse statistique montre qu'il existe une relation complexe mais continue entre le nombre de CD34+ réinjectés et la rapidité de la récupération plaquettaire après chimiothérapie à haute dose.
La recommandation d'un rendement minimum de cellules CD34+ ≥2× 106 par kilogramme de poids corporel est basée sur les valeurs empiriques publiées qui ont entraîné une récupération hématologique correcte. Il semble que des rendements en CD34+ supérieurs à cette norme soient liés à une récupération plus rapide, et des rendements inférieurs à une récupération plus lente.
Mobilisation
Il n'y a pas d'étude comparative prospective randomisée des deux méthodes recommandées de mobilisation des cellules souches périphériques (filgrastim seul ou en association avec une chimiothérapie myélosuppressive) chez les mêmes populations de patients. Le degré de variation des taux de cellules CD34+ entre les patients et entre les dosages rend difficile la comparaison directe entre les études. Il est donc difficile de recommander la méthode idéale. Le choix de la méthode de mobilisation appropriée doit prendre en compte l'objectif thérapeutique global pour chaque patient.
Traitement préalable par des agents cytotoxiques et une mobilisation des PBPC
Les patients ayant reçu au préalable un traitement myélosuppresseur très intensif, puis traités par du filgrastim pour une mobilisation des cellules souches périphériques peuvent ne pas présenter une mobilisation suffisante des cellules souches pour obtenir le rendement minimal recommandé (cellules CD34+ ≥2,0× 106 par kilogramme de poids corporel).
Certains agents cytotoxiques sont particulièrement toxiques pour les cellules souches sanguines et peuvent diminuer leur mobilisation. Des agents tels que le melphalan, la carmustine (BCNU) et le carboplatine peuvent réduire le rendement en cellules souches s'ils sont administrés pendant de longues périodes avant l'initiation de la mobilisation des cellules souches envisagée. En revanche, l'administration de ces produits associée à celle du filgrastim s'est montrée favorable pour la mobilisation de cellules souches. Si une greffe de cellules souches périphériques est envisagée, la mobilisation de ces cellules doit être réalisée dans une phase précoce du traitement du patient. Une attention particulière doit être apportée chez ces patients au nombre de cellules souches mobilisées avant l'administration de chimiothérapie à haute dose. Si des rendements insuffisants sont constatés, selon les critères définis ci-dessus, d'autres schémas de traitement ne nécessitant pas l'utilisation de cellules souches sanguines doivent être envisagés.
Précautions particulières chez les donneurs sains qui se soumettent à une mobilisation des PBPC
La mobilisation des cellules souches sanguines périphériques est sans bénéfice clinique direct pour le donneur sain et doit être envisagée uniquement dans le cadre d'une allogreffe de cellules souches.
La mobilisation des PBPC ne doit être envisagée que chez des donneurs qui répondent aux critères de sélection pour un don de cellules souches, à savoir des paramètres biologiques normaux, avec une attention particulière pour les valeurs hématologiques.
S'il est nécessaire de pratiquer plus d'une leucaphérèse, une attention particulière doit être accordée avant l'aphérèse aux donneurs dont le nombre de plaquettes est <100× 109/l.
En général, aucune aphérèse ne doit être effectuée si la numération plaquettaire est <75× 109/l.
Des thrombopénies transitoires (nombre de plaquettes <100× 109/l) ont été observées après administration de filgrastim et leucaphérèse chez 35% des donneurs sains examinés. Des cas isolés avec des valeurs <50× 109/l ont également été rapportés.
La leucaphérèse ne doit pas être effectuée chez les donneurs sous traitement anticoagulant ou présentant des troubles connus de l'hémostase.
L'administration de Filgrastim-Teva doit être arrêtée ou la dose diminuée si le nombre de leucocytes dépasse 70× 109/l.
Les donneurs ayant reçu du facteur de croissance granulocytaire pour la mobilisation des cellules souches sanguines périphériques doivent être suivis jusqu'à ce que les paramètres hématologiques soient redevenus normaux.
Chez les donneurs sains, les données sur l'administration à long terme sont limitées.
Dans le cadre de la surveillance post-commercialisation, des effets indésirables pulmonaires (hémoptysie, infiltrats pulmonaires) ont été rapportés chez les donneurs sains.
Un suivi de sécurité à long terme des donneurs est en cours.
Au cours d'une période de surveillance allant jusqu'à 4 ans, aucune anomalie de l'hématopoïèse n'a été rapportée chez les donneurs sains. Néanmoins, le risque de développement d'un clone de cellules myéloïdes malignes ne peut être exclu.
Il est recommandé que chaque don de cellules souches fasse l'objet d'un rapport et d'un enregistrement systématiques par les centres d'aphérèses afin d'assurer le suivi de la sécurité à long terme.
Précautions particulières chez les receveurs de cellules souches sanguines périphériques allogéniques obtenues après mobilisation par le filgrastim
Des cas de réaction du greffon contre l'hôte (GvHD) et des cas de décès ont été rapportés chez des patients ayant reçu du G-CSF après une greffe allogénique de moelle osseuse (voir «Propriétés/Effets»).
Précautions particulières chez des patients avec neutropénies congénitale, cyclique ou idiopathique sévères
La tolérance et l'efficacité du filgrastim n'ont pas été établies chez le nouveau-né et les patients souffrant de neutropénie auto-immune.
Filgrastim-Teva ne doit pas être utilisé chez les patients atteints de neutropénie congénitale sévère qui développent une leucémie ou présentent des signes d'évolution vers une leucémie.
Transformation en leucémie ou préleucémie
Une attention particulière doit être accordée au diagnostic différentiel d'une neutropénie chronique sévère afin de la distinguer d'autres troubles hématologiques tels que l'anémie aplastique, les syndromes myélodysplasiques et la leucémie myéloïde.
Une numération-formule sanguine complète avec numérations leucocytaire et plaquettaire ainsi qu'une évaluation de la morphologie et du caryotype de la moelle osseuse doivent être effectuées avant le traitement.
Chez des patients présentant une neutropénie congénitale et traités à long terme par du filgrastim (12,1% pendant 5 ans), des cas de syndrome myélodysplasique ou de leucémie ont été enregistrés. Ces observations ont été faites uniquement chez des patients atteints de neutropénie congénitale. Les syndromes myélodysplasiques et la leucémie sont des complications naturelles de la maladie, dont la relation avec le traitement par du filgrastim est incertaine. Chez un sous-groupe composé d'environ 12% des patients qui ne présentaient aucune anomalie cytogénétique lors de l'évaluation initiale, des contrôles de routine répétés ont mis en évidence des modifications anormales, notamment une monosomie 7. On ne sait pas encore très bien si la poursuite du traitement chez des patients présentant un trouble de la cytogénèse favorise la survenue d'anomalies cytogénétiques, de myélodysplasies ou d'une transformation leucémique. Il est recommandé d'effectuer, tous les 12 mois environ, des examens morphologiques et cytogénétiques de la moelle osseuse.
Précautions particulières chez les patients infectés par le VIH
Numération formule sanguine
Le nombre absolu des neutrophiles (ANC) doit être étroitement surveillé, particulièrement au cours des premières semaines de traitement par Filgrastim-Teva. Selon les circonstances, certains patients réagissent très rapidement aux premières administrations de filgrastim par une élévation considérable du nombre des neutrophiles. Il est recommandé de mesurer quotidiennement l'ANC au cours des premiers jours où Filgrastim-Teva est administré. Pendant les deux premières semaines, il est recommandé de mesurer l'ANC au moins deux fois par semaine, puis, pendant le traitement d'entretien, une fois par semaine ou une fois toutes les deux semaines. Durant l'administration intermittente de 300 µg/jour de filgrastim, l'ANC des patients peut considérablement varier dans le temps. Pour déterminer la valeur minimale de l'ANC d'un patient, on recommande de prélever les échantillons sanguins prévus pour cette mesure immédiatement avant l'administration de Filgrastim-Teva.
Populations particulières de patients
L'expérience chez les patients souffrant de troubles sévères des fonctions hépatique et/ou rénale est limitée (voir «Pharmacocinétique» et «Posologie/Mode d'emploi»).
Les effets du filgrastim chez les patients présentant une baisse significative du nombre des cellules progénitrices myéloïdes n'ont pas encore été étudiés. Etant donné que Filgrastim-Teva agit principalement sur la maturation des précurseurs de polynucléaires neutrophiles, et accroît ainsi le nombre des neutrophiles dans le sang, son effet peut être réduit chez les patients ayant un faible nombre de précurseurs (comme chez les patients ayant suivi une radiothérapie ou chimiothérapie intensives préalables).
MISES EN GARDE ET PRÉCAUTIONS RELATIVES AUX PROCÉDURES DIAGNOSTIQUES
Imagerie osseuse
Une augmentation de l'activité hématopoїétique de la moelle osseuse en réponse à un traitement par des facteurs de croissance a été associée à des résultats de scintigraphie osseuse transitoirement anormaux. Ce phénomène doit être pris en compte lors de l'interprétation des résultats de l'imagerie osseuse.
Interactions
L'efficacité et l'innocuité de Filgrastim-Teva en cas d'administration le même jour qu'un traitement chimiothérapique cytotoxique à effet myélosuppressif n'ont pas été établies de manière explicite. En raison de la sensibilité à la chimiothérapie cytotoxique myélosuppressive des cellules myéloïdes se multipliant rapidement, Filgrastim-Teva ne doit pas être administré au cours des 24 heures précédant ou suivant la chimiothérapie. Il existe des indices permettant de penser que l'administration concomitante de filgrastim et de 5-fluorouracile peut parfois entraîner une aggravation aiguë de la neutropénie.
D'éventuelles interactions avec d'autres facteurs de croissance hématopoïétiques et d'autres cytokines n'ont jusqu'à présent pas été évaluées au cours d'études cliniques (voir paragraphe «Incompatibilités» dans la rubrique «Remarques particulières»).
Etant donné que le lithium favorise le relargage des neutrophiles, il est vraisemblable qu'il potentialise l'effet du filgrastim. Bien que cette interaction n'ait pas été spécifiquement étudiée, il n'existe aucun indice de nocivité liée à cette interaction.
Grossesse/Allaitement
Grossesse
Il n'existe aucune donnée sur la sécurité de l'utilisation de Filgrastim-Teva chez la femme enceinte. Il existe dans la littérature des observations montrant que le filgrastim traverse la barrière placentaire chez les femmes enceintes. Les expérimentations animales ont montré une toxicité de reproduction.
Chez le lapin ayant reçu des doses élevées (exposition très supérieure à l'exposition clinique habituelle), entraînant une toxicité maternelle, une incidence accrue de létalité embryonnaire a été observée. Filgrastim-Teva ne doit pas être administré pendant la grossesse, sauf en cas de nécessité absolue.
Allaitement
Etant donné que l'on ignore dans quelle mesure Filgrastim-Teva passe dans le lait maternel, Filgrastim-Teva ne doit pas être administré aux femmes qui allaitent. Un risque pour le nouveau-né/enfant en bas âge ne peut pas être exclu. Il est nécessaire de décider s'il convient d'arrêter l'allaitement ou de s'abstenir/interrompre le traitement par Filgrastim-Teva, en tenant compte du bénéfice de l'allaitement pour l'enfant et du bénéfice du traitement pour la femme.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Filgrastim-Teva a une légère influence sur l'aptitude à la conduite ou l'utilisation de machines.
Des vertiges peuvent survenir après l'administration de Filgrastim-Teva (voir «Effets indésirables»).
Aucune étude sur l'aptitude à la conduite et l'utilisation de machines n'a été effectuée.
Effets indésirables
Résumé des effets indésirables
Dans les études cliniques, Filgrastim-Teva a été administré à 541 patients cancéreux et à 188 volontaires sains. Le profil de sécurité de Filgrastim-Teva observé dans ces études a correspondu à celui du médicament de référence employé dans les études.
Les données figurant dans le tableau ci-dessous concernent les effets indésirables rapportés lors des études cliniques et dans le cadre des notifications spontanées. Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Classe de systèmes d'organes MedDRA | Effets indésirables | |||
Très fréquent | Fréquent | Peu fréquent | Rare | |
Infections et infestations | Septicémie Bronchite Infections des voies respiratoires supérieures Infections des voies urinaires | |||
Affections hématologiques et du système lymphatique | Anémie (21,1%) Thrombopénie (15,7%)a | Splénomégaliea Diminution de l'hémoglobinémied | Leucocytosea | Rupture spléniquea Anémie falciforme associée à une crisea |
Affections du système immunitaire | Hypersensibilité médicamenteuse Hypersensibilitéa Réaction du greffon contre l'hôteb | Réaction anaphylactique | ||
Troubles du métabolisme et de la nutrition | Perte d'appétit Elévation du taux de lactate déshydrogénase | Hyperuricémie Elévation du taux d'acide urique | Diminution du glucose dans le sang Chondrocalcinose pyrophosphate Déséquilibre du volume liquidien | |
Affections psychiatriques | Insomnie | |||
Affections du système nerveux | Céphalées (13,9%) | Vertiges Hypoesthésie Paresthésie | ||
Affections vasculaires | Hypertension Hypotension | Maladie veinoocclusivee | Angiopathie Syndrome de fuite capillairea Aortite | |
Affections respiratoires, thoraciques et médiastinales | Hémoptysie Dyspnée Toux Douleurs oropharyngées Epistaxis | Douleurs thoraciques non cardiaques Syndrome de détresse respiratoire aiguëa Insuffisance respiratoirea Œdème pulmonairea Hémorragie pulmonaire Maladie pulmonaire interstitielle Infiltrats pulmonaires Hypoxie | Fibrose pulmonairea Douleurs laryngo-pharyngées | |
Affections gastro-intestinales | Vomissements (21,2%) Nausées (19,5%) Diarrhée (18,6%) | Douleurs buccalesd Constipationd | ||
Affections hépatobiliaires | Hépatomégalie Elévation des phosphatases alcalines | Elévation des aspartates aminotransférases Elévation des gammaglutamyl transférases | ||
Affections de la peau et du tissu sous-cutané | Alopécie (13,6%) | Erythème Rash | Rash maculo-papuleux | Dermatose aiguë fébrile neutrophilique (syndrome de Sweet) Vascularite cutanéea |
Affections musculo-squelettiques et du tissu conjonctif | Douleurs musculosquelettiquesc (27,7%) | Spasmes musculaires | Ostéoporose | Diminution de la densité osseuse Exacerbation de la polyarthrite rhumatoïde |
Affections du rein et des voies urinaires | Hématurie Dysurie | Protéinurie | Troubles de la miction Glomérulonéphrite Anomalie urinaire | |
Troubles généraux et anomalies au site d'administration | Fatigue (11,9%) Inflammation des muqueuses (12,9%) Fièvre (28,9%) | Asthénie Douleurs Malaised Œdème périphériqued | Réaction au site d'injection | |
Lésions, intoxications et complications liées aux procédures | Réaction à la transfusiond | |||
a voir rubrique «Description d'effets indésirables sélectionnés»
b Des cas de GvHD et des décès ont été rapportés chez des patients après greffe allogénique de moelle osseuse
c incluant douleur osseuse, douleur au dos, arthralgie, myalgie, douleur dans les extrémités, douleur musculo-squelettique, douleur musculo-squelettique de la poitrine, douleur de la nuque
d Effets indésirables avec les incidences les plus élevées chez les patients traités par le filgrastim par rapport au placebo et associés aux séquelles de la malignité sous-jacente ou de la chimiothérapie cytotoxique
Description d'effets indésirables sélectionnés
Réactions d'hypersensibilité aux médicaments
Des réactions d'hypersensibilité, notamment anaphylaxie, éruption cutanée, urticaire, angio-œdème, dyspnée et hypotension, ont été rapportés lors du premier traitement et lors de la poursuite du traitement au cours des études cliniques et après la commercialisation. Dans l'ensemble, ces symptômes ont été rapportés plus fréquemment après administration IV. Parfois, la réadministration du produit a entraîné la réapparition des symptômes, suggérant ainsi une relation de cause à effet. Filgrastim-Teva doit être définitivement arrêté en cas de réaction allergique grave.
Effets indésirables pulmonaires
Des cas d'effets indésirables pulmonaires incluant pneumonie interstitielle, œdème pulmonaire et infiltrats pulmonaires ont été rapportés au cours des études cliniques et après la commercialisation. Certains de ces cas ont entraîné une insuffisance respiratoire ou un syndrome de détresse respiratoire aigüe (SDRA) pouvant avoir une issue fatale (voir rubrique «Mises en garde et précautions»).
Syndrome de fuite capillaire
Des cas de syndrome de fuite capillaire ont été signalés après l'utilisation de facteurs de croissance de la lignée granulocytaire. Ces évènements sont généralement apparus chez des patients ayant des pathologies malignes à un stade avancé, une septicémie, traités par de multiples chimiothérapies ou ayant subi une aphérèse après mobilisation des PBPC (voir rubrique «Mises en garde et précautions»).
Splénomégalie et rupture splénique
Des cas de splénomégalie et rupture splénique ont été observés après l'administration de filgrastim. Certains cas de rupture splénique ont été d'issue fatale (voir rubrique «Mises en garde et précautions»).
Leucocytose et thrombocytopénie
Après l'administration de filgrastim, des cas de leucocytose et de thrombocytopénie ont été observés (voir rubrique «Mises en garde et précautions»).
Crises drépanocytaires
Après la commercialisation, des cas isolés de crises drépanocytaires ont été rapportés chez des patients porteurs du trait drépanocytaire ou atteints d'anémie falciforme (voir rubrique «Mises en garde et précautions»).
Vascularite cutanée
Des cas de vascularite cutanée ont été rapportés chez des patients traités par le filgrastim.
Enfants et adolescents
Les données fournies par les études cliniques effectuées chez des enfants et des adolescents montrent que la sécurité et l'efficacité du filgrastim sont comparables chez les adultes et les enfants recevant des chimiothérapies cytotoxiques, suggérant l'absence de différence liée à l'âge dans la pharmacocinétique du filgrastim. Le seul effet indésirable systématiquement rapporté a été les douleurs musculo-squelettiques‚ ce qui n'est pas différent de l'expérience dans la population adulte.
Les données sont insuffisantes pour évaluer davantage l'utilisation du filgrastim chez les enfants et les adolescents.
Autres groupes particuliers de patients
Patients âgés
Aucune différence globale de sécurité ou d'efficacité n'a été observée entre les personnes âgées de plus de 65 ans et les adultes plus jeunes (>18 ans) recevant des chimiothérapies cytotoxiques. L'expérience clinique n'a identifié aucune différence dans les réponses obtenues chez les patients âgés et les patients adultes plus jeunes. Les données sont insuffisantes pour évaluer l'utilisation du filgrastim chez les personnes âgées dans d'autres indications approuvées.
Enfants et adolescents atteints de NCS
Des cas de diminution de la densité osseuse et d'ostéoporose ont été rapportés chez des enfants et adolescents atteints de neutropénie chronique sévère et traités de façon chronique par du filgrastim.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Les conséquences d'un surdosage de filgrastim ne sont pas encore connues. Des patients atteints de neutropénie chronique sévère et ayant reçu des doses supérieures à 14,5 MU (145 µg) par kilogramme de poids corporel par jour n'ont présenté aucun symptôme pathologique. Chez les patients ayant reçu une chimiothérapie cytotoxique suivie d'une greffe de moelle osseuse, des doses allant jusqu'à 7,0 MU (70 µg) par kilogramme de poids corporel se sont avérées bien tolérées.
En cas de surdosage, l'arrêt du traitement par le filgrastim est habituellement suivi d'une chute de 50% du nombre de neutrophiles en 1 à 2 jours et d'une normalisation de leur taux en 1 à 7 jours.
Propriétés/Effets
Code ATC: L03AA02
Le filgrastim est une protéine non glycosylée, hautement purifiée, composée de 175 acides aminés. Le filgrastim est produit à partir de souches d'E. coli modifiée génétiquement par l'adjonction du gène codant pour le facteur de croissance granulocytaire humain.
Mécanisme d'action
Le facteur de croissance granulocytaire humain est une glycoprotéine induisant la production et la libération de granulocytes neutrophiles fonctionnels à partir de la moelle osseuse.
Pharmacodynamique
Le G-CSF contenu dans Filgrastim-Teva entraîne, au cours des 24 heures suivant son administration, une nette augmentation du nombre des neutrophiles circulant dans le sang, qui s'accompagne d'une légère élévation du nombre des monocytes. Chez certains patients atteints de neutropénie chronique sévère, le filgrastim peut également accroître faiblement le nombre d'éosinophiles et de basophiles circulants jusqu'aux valeurs normales. Une éosinophilie ou basophilie s'observent chez certains patients avant même l'instauration du traitement. Aux posologies recommandées, l'augmentation du taux sanguin de neutrophiles est fonction de la dose administrée. Des études cliniques ont montré que les neutrophiles produits par le corps humain en réponse à un traitement par le filgrastim présentent une faculté de phagocytose et de production de superoxydes normales ou accrues.
L'utilisation de filgrastim, seul ou après une chimiothérapie, mobilise la libération de précurseurs hématopoïétiques dans le sang périphérique. Ces cellules progénitrices du sang périphérique (PBPC) peuvent être isolées, puis reperfusées après un traitement cytotoxique aplasiant, soit à la place, soit en plus d'une greffe de moelle osseuse. Les PBPC peuvent aussi être administrées à titre de soutien après une chimiothérapie cytotoxique (fortement) myélosuppressive. La perfusion de PBPC accélère la récupération hématopoïétique, raccourcit la période de risque de complications hémorragiques et réduit la nécessité de transfuser des thrombocytes.
Chez des donneurs sains, une dose de 10 µg par kilogramme de poids de corporel par jour administrée par voie sous-cutanée durant 4 à 5 jours consécutifs génère, dans la majorité des cas un rendement ≥4× 106 cellules CD34+ par kilogramme de poids corporel du receveur après deux leucaphérèses.
Au terme du traitement par le filgrastim, le nombre de neutrophiles dans le sang décroît d'environ 50% en 1 à 2 jours, et retrouve des valeurs normales en 1 à 7 jours. Le traitement par le filgrastim entraîne une réduction significative de l'incidence, de la sévérité et de la durée tant de la neutropénie que des épisodes fébriles fréquemment observés après un traitement par une chimiothérapie cytostatique ou une chimiothérapie aplasiante suivie d'une greffe de moelle osseuse. Les patients sous chimiothérapie traités également par le filgrastim doivent être hospitalisés moins souvent et moins longtemps. De plus, ils doivent avoir moins souvent recours aux traitements antibiotiques, que les patients ayant été soumis à une chimiothérapie sans traitement complémentaire.
Le traitement par le filgrastim réduit significativement la durée de la neutropénie fébrile, le recours aux antibiotiques et les hospitalisations consécutives à une chimiothérapie d'induction chez des patients présentant une leucémie myéloïde aiguë. La survenue de fièvre et d'infections documentées n'a pas été réduite dans de telles conditions. L'efficacité du G-CSF n'a pas encore été établie chez les patients qui, par suite d'une diminution de leur réserve médullaire, présentent déjà une leucopénie avant l'instauration du traitement (p.ex. après radiothérapie étendue et/ou cycles répétés de chimiothérapie). Chez ces malades, le traitement par le G-CSF ne peut pas remplacer temporairement l'adaptation habituelle des doses de chimiothérapie.
Une étude européenne rétrospective a examiné l'utilisation du G-CSF après une greffe allogénique de moelle osseuse chez des patients souffrant d'une leucémie aiguë. Elle a indiqué que l'utilisation de G-CSF est associée à un risque accru de réaction du greffon contre l'hôte (GvHD), de mortalité associée au traitement (treatment related mortality, TRM) et de mortalité. Une autre étude rétrospective internationale auprès de patients souffrant d'une leucémie myéloïde aiguë ou chronique n'a constaté aucune influence sur la GvHD, la TRM et la mortalité. Une méta-analyse d'études sur la transplantation allogénique, incluant les résultats de neuf études randomisées prospectives, de huit études rétrospectives et d'une étude cas-témoins, n'a révélé aucune influence sur le risque de GvHD aiguë ou chronique ou de mortalité précoce due au traitement.
Risque relatif (CI à 95%) de réactions du greffon contre l'hôte (GvHD) et de mortalité associée au traitement (TRM) après un traitement par le G-CSF à la suite d'une greffe de moelle osseuse | |||||
Publication | Période de l'étude | n | GvHD aiguë de grade II à IV | GvHD chronique | TRM |
Méta-analyse (2003) | 1986-2001a | 1198 | 1,08 | 1,02 | 0,70 |
Etude européenne rétrospective (2004) | 1992-2002b | 1789 | 1,33 | 1,29 | 1,73 |
Etude internationale rétrospective (2006) | 1995-2000b | 2110 | 1,11 | 1,10 | 1,26 |
a L'analyse a inclus des études impliquant des greffes de moelle durant cette période; certaines études utilisaient du GM-CSF (granulocyte-macrophage colony-stimulating factor)
b L'analyse a inclus des patients recevant une greffe de moelle durant cette période
Le traitement par Filgrastim-Teva de l'enfant ou de l'adulte atteints de neutropénie chronique sévère (neutropénies congénitale, cyclique ou idiopathique sévères) induit une augmentation du nombre absolu de neutrophiles dans le sang périphérique ainsi qu'une diminution des infections et de leurs conséquences.
L'utilisation de Filgrastim-Teva chez les patients infectés par le VIH maintient le nombre des neutrophiles dans les limites de la normale, ce qui permet d'administrer des médicaments antiviraux et/ou d'autres préparations myélosuppressives à leur dose habituelle. Rien n'indique que la prolifération du VIH est stimulée chez les patients infectés par le virus et traités par le filgrastim.
Comme pour d'autres facteurs de croissance hématopoïétique, le G-CSF a montré in vitro un effet stimulant sur la croissance des cellules endothéliales humaines.
Efficacité clinique
L'efficacité et l'innocuité de Filgrastim-Teva ont été démontrées dans des études de phase III randomisées, contrôlées, chez des patients atteints de cancer du sein, de cancer du poumon et de lymphome non hodgkinien.
Dans l'étude pivot réalisée chez 348 patients(es) atteints(es) de cancer du sein, la durée de la neutropénie sévère pendant le 1er cycle de chimiothérapie a été pris comme critère d'efficacité primaire en comparaison au produit de référence et au placebo. Alors que la durée de la neutropénie sévère a été en moyenne de 1,1 jour dans les deux groupes verum, celle-ci a été significativement prolongée dans le groupe placebo, à savoir en moyenne de 3,8 jours.
Pendant le premier cycle de chimiothérapie, le nombre de neutrophiles (ANC) a diminué sous placebo à partir du 2e jour et a atteint le nadir au 11e jour.
Dans le groupe Filgrastim-Teva et dans le groupe de référence, les valeurs de l'ANC ont augmenté jusqu'à un maximum le 3e jour, ont atteint le nadir le 7e jour, puis ont augmenté jusqu'à un deuxième maximum le 11e jour.
Pendant le 1er cycle de chimiothérapie, le nadir moyen de l'ANC a été de 0,16× 109/l dans le groupe placebo, c.-à-d. plus bas que dans les deux groupes verum (0,66× 109/l).
Pendant le 1er cycle de chimiothérapie, la durée jusqu'au rétablissement de l'ANC a été comparable (environ 8 jours) avec Filgrastim-Teva et le produit de référence, tandis que l'ANC ne s'est rétabli qu'au bout de 14 jours dans le groupe placebo.
Dans une autre étude réalisée chez 240 patients atteints d'un cancer du poumon, la sécurité et la tolérance de Filgrastim-Teva ont été évaluées en comparaison au produit de référence pendant au maximum 6 cycles de chimiothérapie. A partir du deuxième cycle, les patients du groupe de référence ont été mis sous Filgrastim-Teva.
Pendant le 1er cycle de chimiothérapie, la durée moyenne de la neutropénie sévère (DSN) a été de 0,5 jour dans le groupe Filgrastim-Teva et de 0,3 jour dans le groupe de référence. Pendant le 1er cycle de chimiothérapie, l'ANC a atteint un premier maximum au bout de 5 jours, aussi bien sous Filgrastim-Teva que sous le produit de référence. Le nadir a été atteint après 11 jours sous Filgrastim-Teva et après 12 jours sous le produit de référence.
Dans une troisième étude menée chez 90 patients atteints de lymphomes non hodgkiniens, l'efficacité et la tolérance de Filgrastim-Teva ont été évaluées par rapport au produit de référence pendant une durée de 6 cycles maximum de chimiothérapie. A partir du deuxième cycle, les patients du groupe de référence ont été mis sous Filgrastim-Teva.
La durée moyenne de la neutropénie sévère pendant le 1er cycle de chimiothérapie a été de 0,5 jour dans le groupe Filgrastim-Teva et de 0,9 jour dans le groupe de référence.
Pendant le 1er cycle de chimiothérapie, l'ANC a atteint un premier maximum au bout de 4 jours aussi bien sous Filgrastim-Teva que sous le produit de référence et un deuxième maximum au bout de 11 jours. Le nadir a été atteint après 9 jours dans les deux groupes thérapeutiques.
L'ANC moyen pendant le 1er cycle de chimiothérapie a été de 1,7× 109/l dans le groupe Filgrastim-Teva et de 1,1× 109/l dans le groupe de référence.
En moyenne, la valeur de l'ANC s'est rétablie pendant le 1er cycle de chimiothérapie au bout de 6 jours (Filgrastim-Teva) et de 6,7 jours (référence).
Pharmacocinétique
Absorption
Il existe une corrélation linéaire positive entre la dose et la concentration sérique du filgrastim, que Filgrastim-Teva soit administré par voie intraveineuse ou par voie sous-cutanée. Des concentrations sériques maximales de filgrastim comprises entre 5 et 1840 ng/ml ont été mises en évidence après administration de doses uniques allant de 1,7 à 69,0 µg par kilogramme de poids corporel (perfusion i.v. brève de 30 minutes). Après l'administration sous-cutanée de la dose recommandée, des concentrations sériques atteignant au maximum 118 ng/ml ont été mesurées et elles sont demeurées supérieures à 10 ng/ml pendant 8 à 16 heures. Le volume de distribution calculé dans le sang était approximativement de 150 ml/kg.
Élimination
La clairance du filgrastim suit une cinétique de premier ordre après administration tant sous-cutanée qu'intraveineuse. La clairance totale déterminée a été de 0,6 ml/min/kg. La demi-vie moyenne d'élimination a été de 3,5 heures environ.
Deux études randomisées, à dose unique, en crossover, menées chez 196 volontaires sains ont montré que le profil pharmacocinétique de Filgrastim-Teva et du produit de référence sont comparables après administration sous-cutanée et intraveineuse. Après des doses i.v. uniques de 5 et 10 µg/kg de poids corporel, des concentrations sériques maximales moyennes respectivement de 130 et 231 ng/ml ont été atteintes (médicament de référence: 126 et 222 ng/ml). Après l'administration s.c. de doses de 5 et 10 µg/kg de poids corporel, des concentrations sériques maximales moyennes respectivement de 18 et 46 ng/ml (médicament de référence: 18 et 43 ng/ml) ont été mesurées. Les concentrations sériques sont demeurées supérieures à 10 ng/ml pendant environ 8 à 16 heures (médicament de référence: 8 à 16 heures). La demi-vie d'élimination a été en moyenne d'environ 3,5 heures.
Lors de perfusions continues de filgrastim effectuées pendant une durée maximale de 28 jours chez des patients ayant subi une autogreffe de moelle osseuse, il n'a été constaté aucun signe d'accumulation du produit, la demi-vie étant demeurée comparable.
Le profil pharmacocinétique établi à la concentration de 0,96 mg/ml présente une différence négligeable liée à la concentration par rapport aux concentrations plus faibles de 0,6 mg/ml et 0,3 mg/ml. Cette différence n'a aucune influence sur la réponse pharmacodynamique globale (mesurée d'après la réponse des neutrophiles).
Cinétique pour certains groupes de patients
Patients en insuffisance rénale et hépatique
Dans le cadre d'une étude portant sur 12 patients présentant différents degrés de fonction rénale, une augmentation de la Cmax et de l'AUC ainsi qu'une diminution du volume de distribution et de la clairance ont été observées chez les sujets atteints d'insuffisance rénale terminale en comparaison à des volontaires sains et à des patients atteints d'insuffisance rénale modérée. Dans la mesure où les profils des moyennes d'ANC étaient similaires entre les différents degrés de fonction rénale, y compris lors d'insuffisance rénale terminale, un ajustement de la dose de Filgrastim-Teva n'est pas nécessaire chez les patients présentant une insuffisance rénale. Les résultats d'une étude portant sur 12 patients présentant une insuffisance hépatique montrent que la pharmacocinétique et la pharmacodynamique du filgrastim sont comparables chez les sujets présentant une insuffisance hépatique et chez les sujets sains. Par conséquent, un ajustement posologique n'est pas nécessaire chez les patients présentant une insuffisance hépatique.
Données précliniques
L'expression de récepteurs du facteur de croissance granulocytaire (G-CSF) a été mise en évidence dans certaines cellules malignes. On ne peut exclure que le filgrastim agisse éventuellement comme un facteur de croissance dans certains types de tumeurs.
Le potentiel cancérigène du filgrastim n'a pas été étudié. Le filgrastim n'a pas induit de mutations génétiques dans les bactéries, ni en présence, ni en l'absence d'un système enzymatique métabolisant le médicament. Le filgrastim n'a pas eu d'effet perceptible sur la fertilité du rat mâle ou femelle ou sur le temps de gestation des femelles à une dose allant jusqu'à 500 µg/kg.
Remarques particulières
Incompatibilités
Filgrastim-Teva ne doit pas être dilué dans des solutions salines. Pour la compatibilité de Filgrastim-Teva avec des matériaux plastiques après dilution pour perfusion, voir «Remarques concernant la manipulation».
Stabilité
Les seringues préremplies de Filgrastim-Teva sont à usage unique. Jeter toute la solution restante non utilisée.
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Conserver dans l'emballage d 'origine, à l'abri de la lumière et au réfrigérateur (2-8 °C).
Conserver hors de la portée des enfants.
L'exposition accidentelle de Filgrastim-Teva à des températures inférieures au point de congélation n'a aucune répercussion néfaste sur la stabilité du produit.
La stabilité physico-chimique de la solution pour perfusion diluée a été démontrée pendant 24 heures à une température comprise entre 2 °C et 8 °C. D'un point de vue microbiologique, la préparation doit être utilisée immédiatement. Si elle n'est pas utilisée immédiatement, la durée et les conditions de conservation de la préparation sont sous la seule responsabilité de l'utilisateur. Si la dilution n'est pas effectuée sous des conditions aseptiques contrôlées et validées, la solution ne doit pas être conservée plus de 24 heures à une température comprise entre 2 °C et 8 °C.
Remarques concernant la manipulation
Remarques concernant la dilution de Filgrastim-Teva pour perfusion
Si nécessaire, Filgrastim-Teva peut être dilué dans une solution de glucose à 5% pour injection. Le filgrastim contenu dans la solution diluée peut être adsorbé sur le verre ou les matières plastiques. Cependant, si la dilution est correctement effectuée, la solution pour perfusion est compatible avec le polypropylène. Si, après dilution, la concentration de filgrastim est inférieure à 1,5 MU (15 µg) par ml de solution pour perfusion, de l'albumine humaine doit être ajoutée (concentration finale de 2 mg d'albumine par ml de solution pour perfusion).
Exemple de dilution: Si le volume final de la solution diluée est de 20 ml, mais que la teneur en filgrastim est inférieure à 30 MU (300 µg), il faut ajouter 0,2 ml d'une solution d'albumine humaine à 20%.
Filgrastim-Teva ne doit cependant en aucun cas être dilué à une concentration finale inférieure à 0,2 MU (2 µg) par ml de solution pour perfusion.
Utilisation de la seringue préremplie munie d'un dispositif de sécurité
Le dispositif de sécurité de l'aiguille couvre l'aiguille après l'injection pour prévenir toute blessure. Le dispositif de sécurité n'affecte en rien le fonctionnement normal de la seringue. Appuyer doucement et régulièrement sur le piston jusqu'à ce que la dose entière ait été administrée et qu'il ne soit plus possible d'appuyer sur le piston. En maintenant une certaine pression sur le piston, retirer la seringue. Le dispositif de sécurité couvrira l'aiguille dès que le piston sera relâché.
Numéro d’autorisation
60722 (Swissmedic).
Titulaire de l’autorisation
Teva Pharma AG, Basel.
Mise à jour de l’information
Janvier 2020.
Numéro de version interne: 5.2
Відгуки (0)

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.


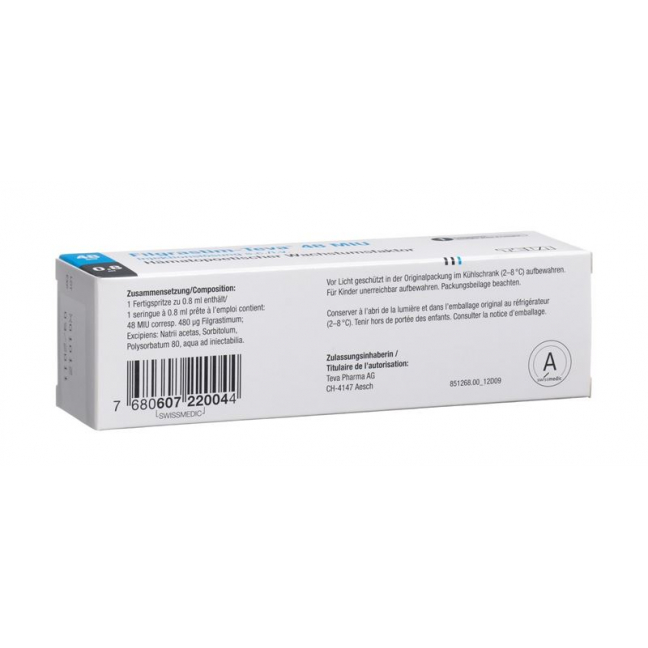


 Deutsch
Deutsch French
French























