Praluent Inj Lös 75 мг/мл попередньо заповнена шприц-ручка
Praluent Injektionslösung 75mg/ml Fertigpen
-
48134.83 RUB
Дата доставки:
24.12.2025 - 07.01.2026
При оплате криптовалютой:
Ваша прибыль 4813.48 RUB / 56.35 USDT
- Наявність: В наявності
- Виробник: Sanofi-Aventis (Suisse) SA
- Модель: 7752214
- ATC-код C10AX14
- EAN 7680658820071
Склад:
Варіанти
Опис
Was ist Praluent und wann wird es angewendet?
Praluent enthält den Wirkstoff Alirocumab. Es ist ein Arzneimittel zum Injizieren (Spritzen) aus der Wirkstoffklasse der sogenannten PCSK9-Inhibitoren.
- Praluent ist ein vollständig humaner monoklonaler Antikörper, der das Protein PCSK9 (Proproteinkonvertase Subtilisin/Kexin Typ 9) hemmt.
- PCSK9 wird von den Zellen der Leber hergestellt.
- Normalerweise wird LDL-Cholesterin (das «schlechte» Cholesterin) aus dem Blut entfernt, indem es durch spezifische Rezeptoren (Bindungsstellen) auf den Leberzellen abgefangen wird. PCSK9 bewirkt, dass weniger dieser LDL-Rezeptoren zur Verfügung stehen, um das LDL-Cholesterin aus dem Blut zu entfernen.
- Praluent inhibiert (blockiert) das PCSK9, sodass wieder mehr LDL-Rezeptoren zur Verfügung stehen, um das LDL-Cholesterin aus dem Blut zu entfernen. Dadurch sinkt der LDL-Cholesterinspiegel im Blut.
Praluent wird in Verbindung mit einer Diät und anderen cholesterinsenkenden Massnahmen bei Erwachsenen mit erhöhtem Cholesterinspiegel (nicht-familiäre oder heterozygote familiäre Hypercholesterinämie oder gemischte Dyslipidämie) angewendet, um die folgenden Werte zu senken:
- LDL-Cholesterin («schlechtes» Cholesterin)
- Gesamtcholesterin
- Non-HDL-Cholesterin (nicht an Lipoprotein höherer Dichte gebundenes Cholesterin)
- Apolipoprotein B (Protein, welches das «schlechte» Cholesterin im Blut transportiert)
- Triglyzeride
- Lipoprotein (a)
Praluent wird ausserdem bei Erwachsenen mit erhöhtem Cholesterinspiegel im Blut und erhöhtem Herz-Kreislauf-Risiko angewendet, um das Risiko für einen Herzinfarkt, Schlaganfall oder eine stationär behandlungsbedürftige instabile Angina pectoris («Herzenge») zu senken.
Praluent erhöht ausserdem den Blutspiegel von HDL-Cholesterin (dem «guten» Cholesterin) und Apolipoprotein A-1.
Praluent kann allein oder zusammen mit anderen Arzneimitteln zur Senkung des Cholesterinspiegels angewendet werden. Halten Sie weiterhin Ihre cholesterinsenkende Diät ein, während Sie dieses Arzneimittel anwenden.
Auf Verschreibung des Arztes oder der Ärztin.
Wann darf Praluent nicht angewendet werden?
Wenden Sie Praluent nicht an, wenn Sie allergisch gegen Alirocumab oder einen anderen Bestandteil dieses Arzneimittels sind (siehe Abschnitt «Was ist in Praluent enthalten?»).
Wann ist bei der Anwendung von Praluent Vorsicht geboten?
Bevor Sie mit der Anwendung von Praluent beginnen, informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin über jegliche Krankheiten einschliesslich Allergien sowie darüber, ob Sie noch weitere Arzneimittel nehmen, kürzlich genommen haben oder zu nehmen beabsichtigen.
Im Falle einer schweren allergischen Reaktion (siehe Abschnitt «Welche Nebenwirkungen kann Praluent haben?») müssen Sie sofort die Anwendung von Praluent beenden und sich an Ihren Arzt bzw. Ihre Ärztin wenden, damit angemessene Notfallmassnahmen eingeleitet werden können. Mögliche Anzeichen einer schweren allergischen Reaktion sind Schwierigkeiten zu atmen oder zu schlucken, stark erniedrigter Blutdruck (mit Benommenheit, Schwitzen, beschleunigtem Puls, Ohrenpfeifen), Hautausschlag (Quaddeln), Schwellung der Haut und Schleimhäute (z.B. Gesicht, Lippen, Mund oder Hals), Durchfall.
Die Anwendung von Praluent bei Kindern und Jugendlichen unter 18 Jahren ist bisher nicht geprüft worden. Daher wird die Anwendung dieses Arzneimittels in dieser Altersgruppe nicht empfohlen.
Dieses Arzneimittel kann die Reaktionsfähigkeit, die Fahrtüchtigkeit und die Fähigkeit, Werkzeuge oder Maschinen zu bedienen, beeinträchtigen!
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbst gekaufte!) einnehmen!
Darf Praluent während einer Schwangerschaft oder in der Stillzeit angewendet werden?
Die Anwendung von Praluent während einer Schwangerschaft oder in der Stillzeit wird nicht empfohlen.
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Einnahme dieses Arzneimittels Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin um Rat.
Wie verwenden Sie Praluent?
Wenden Sie dieses Arzneimittel stets genauso an, wie es in dieser Patienteninformation bzw. Bedienungsanleitung beschrieben ist bzw. wie Ihr Arzt, Ihr Apotheker bzw. Ihre Ärztin, Ihre Apothekerin oder Ihr Pflegepersonal es Ihnen vorgeschrieben haben. Im Zweifelsfall fragen Sie Ihren Arzt, Ihren Apotheker bzw. Ihre Ärztin, Ihre Apothekerin oder Ihr Pflegepersonal.
Wie viel injiziert wird
Ihr Arzt bzw. Ihre Ärztin sagt Ihnen, dass Sie zunächst eine Dosis von 75 mg einmal alle 2 Wochen erhalten.
Die Dosis kann bei Bedarf auf 150 mg einmal alle 2 Wochen oder 300 mg einmal alle 4 Wochen geändert werden.
Wenn die LDL-C-Senkung unter 300 mg einmal alle 4 Wochen nicht ausreichend ist, kann Ihr Arzt bzw. Ihre Ärztin Ihnen die Maximaldosis von 150 mg einmal alle 2 Wochen verordnen.
Wann injiziert wird
Sie spritzen sich Praluent einmal alle 2 Wochen, wenn Ihre Dosis 75 mg oder 150 mg beträgt, oder einmal alle 4 Wochen/monatlich, wenn Ihre Dosis 300 mg beträgt. Für die Dosis von 300 mg geben Sie sich nacheinander zwei Spritzen zu je 150 mg an zwei unterschiedlichen Injektionsstellen.
Wo und wie injiziert wird
Praluent wird am Bauch, am Oberschenkel oder am Oberarm unter die Haut gespritzt (subkutane Injektion).
Überprüfen Sie vor jeder Injektion die Etikette Ihres Fertigpens, um sicherzugehen, dass Sie das richtige Arzneimittel und die richtige Dosis Praluent verwenden.
Wählen Sie immer eine andere Injektionsstelle als beim vorigen Mal (z.B. rechter Oberschenkel, dann linker Oberschenkel, oder rechte Bauchseite, dann linke Bauchseite).
Wählen Sie keine Injektionsstellen, an denen die Haut verletzt, gereizt, verhärtet, gerötet oder heiss ist.
Injizieren Sie Praluent nicht gleichzeitig mit anderen Arzneimitteln zum Spritzen an derselben Injektionsstelle.
Lassen Sie Praluent vor der Anwendung stets auf Raumtemperatur aufwärmen. Wenn Sie einen Fertigpen aus dem Kühlschrank genommen haben, um ihn auf Raumtemperatur aufwärmen zu lassen, legen Sie ihn nicht in die Nähe einer Wärmequelle oder in direktes Sonnenlicht.
Schulung in der Verwendung des Fertigpens
Bevor Sie die Fertigpens das erste Mal verwenden, zeigt Ihr Arzt, Ihr Apotheker bzw. Ihre Ärztin, Ihre Apothekerin oder Ihr Pflegepersonal Ihnen, wie man Praluent spritzt.
- Lesen Sie immer die Bedienungsanleitung in der Packung.
- Verwenden Sie den Fertigpen stets so, wie es in der Bedienungsanleitung beschrieben ist.
Wenn Sie eine grössere Menge Praluent angewendet haben, als Sie sollten
Wenn Sie mehr Praluent angewendet haben, als Sie sollten, informieren Sie Ihren Arzt bzw. Ihre Ärztin, Ihr Pflegepersonal oder Ihren Apotheker bzw. Ihre Apothekerin.
Wenn Sie die Anwendung von Praluent vergessen haben
Wenn Sie einmal eine Dosis Praluent vergessen haben, holen Sie die Injektion so schnell wie möglich nach. Nehmen Sie dann die nächste Dosis zwei Wochen nach dem Tag, an dem Sie die Dosis vergessen haben. So können Sie Ihren ursprünglichen Dosis-Zeitplan beibehalten. Wenn Sie sich in Bezug auf den Tag der Anwendung von Praluent nicht sicher sind, fragen Sie Ihren Arzt bzw. Ihre Ärztin, Ihr Pflegepersonal oder Ihren Apotheker bzw. Ihre Apothekerin.
Wenn Sie die Behandlung mit Praluent beenden
Beenden Sie die Anwendung von Praluent nicht, ohne vorher mit Ihrem Arzt bzw. Ihrer Ärztin zu sprechen. Wenn Sie die Behandlung mit Praluent beenden, kann Ihr Cholesterinspiegel steigen.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Die Anwendung und Sicherheit von Praluent bei Kindern und Jugendlichen/bei Kindern unter 18 Jahren ist bisher nicht geprüft worden.
Welche Nebenwirkungen kann Praluent haben?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Häufig (betrifft mehr als einen von 10 Anwendern)
- Hautrötung, Schwellung, Schmerzen oder Bluterguss an der Injektionsstelle (lokale Reaktionen an der Injektionsstelle)
- Erkältungsbeschwerden
- Muskelschmerzen
- Muskelkrämpfe
- Schmerzen des Bewegungsapparates
- Pruritus (Juckreiz)
- Durchfall
- Harnwegsentzündung
Selten (betrifft 1 bis 10 von 10'000 Anwendern)
- Allergische Reaktionen / Überempfindlichkeitsreaktionen
- Hypersensitivitätsvaskulitis (eine Sonderform von Überempfindlichkeitsreaktion); mögliche Symptome sind Durchfall, Hautausschlag oder Purpura (violette Flecken auf der Haut)
- Urtikaria (Quaddeln)
- Nummuläres Ekzem (rötliche Flecken auf der Haut, zum Teil mit Bläschenbildung)
Folgende Nebenwirkungen sind nach der Markteinführung von Praluent gemeldet worden, jedoch ist ihre Häufigkeit nicht bekannt:
- Angioödem (Schwellungen im Gesicht, im Hals und in den Atemwegen; Juckreiz).
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Dies gilt insbesondere auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Was ist ferner zu beachten?
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden. Das Verfallsdatum ist der letzte Tag des angegebenen Monats.
Lagerungshinweis
Ausser Reichweite von Kindern aufbewahren.
Im Kühlschrank (2–8 °C) lagern. Nicht einfrieren.
Fertigpens im Original-Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Nicht hoher Hitze aussetzen.
Bei Bedarf können die Fertigpens bis maximal 30 Tage ausserhalb des Kühlschranks bei einer Temperatur von höchstens + 25 °C aufbewahrt werden. Vor Licht schützen. Nach der Entnahme aus dem Kühlschrank muss Praluent innerhalb von 30 Tagen verwendet oder entsorgt werden.
Nachdem Praluent sich einmal auf Raumtemperatur erwärmt hat, dürfen Sie es nicht wieder in den Kühlschrank legen.
Weitere Hinweise
Das Arzneimittel nicht verwenden, wenn die Lösung verfärbt oder trüb ist oder Partikel erkennbar sind.
Was ist in Praluent enthalten?
Eine Dosis enthält 75 Milligramm (75 Milligramm pro ml) bzw. 150 Milligramm (150 Milligramm pro ml) Alirocumab zur subkutanen Injektion.
Wirkstoffe
Alirocumab.
Hilfsstoffe
Histidin, Saccharose, Polysorbat 20, Wasser für Injektionszwecke.
Zulassungsnummer
65882 (Swissmedic).
Wo erhalten Sie Praluent? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Praluent ist in Kartons mit 1, 2 oder 6* Fertigpens erhältlich.
* Zurzeit nicht im Handel
Zulassungsinhaberin
sanofi-aventis (schweiz) ag, 1214 Vernier/GE.
Diese Packungsbeilage wurde im Mai 2020 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Praluent® (alirocumab) 75 mg Injektionslösung in einem Fertigpen
Bedienungsanleitung
Die folgende Abbildung zeigt die Bestandteile des Praluent-Pens.

Wichtige Informationen
- Das Gerät ist ein Fertigpen zur einmaligen Anwendung. Es enthält 75 mg Praluent (Alirocumab) in 1 ml.
- Das Arzneimittel wird unter die Haut gespritzt und kann von Ihnen selbst oder einer anderen Person verabreicht werden.
- Dieser Pen kann nur für eine einzige Injektion verwendet werden und muss nach der Anwendung entsorgt werden.
Was Sie tun sollten
- Bewahren Sie den Praluent-Pen für Kinder unzugänglich auf.
- Lesen Sie alle Anweisungen sorgfältig durch, bevor Sie den Praluent-Pen anwenden.
- Befolgen Sie diese Anweisungen jedes Mal, wenn Sie einen Praluent-Pen anwenden.
- Bewahren Sie unbenutzte Pens im Kühlschrank bei +2 °C bis +8 °C auf.
- Ausführliche Informationen zu den Aufbewahrungsbedingungen entnehmen Sie bitte der Patienteninformation.
Was Sie nicht tun sollten
- Berühren Sie nicht die gelbe Schutzabdeckung.
- Verwenden Sie den Pen nicht, wenn er fallen gelassen wurde oder beschädigt ist.
- Verwenden Sie den Pen nicht, wenn die blaue Kappe fehlt oder nicht sicher befestigt ist.
- Verwenden Sie den Pen nicht nochmals.
- Schütteln Sie den Pen nicht.
- Frieren Sie den Pen nicht ein.
- Setzen Sie den Pen nicht direktem Sonnenlicht aus.
Heben Sie diese Bedienungsanleitung auf. Falls Sie Fragen haben, wenden Sie sich an Ihren Arzt, Ihren Apotheker bzw. Ihre Ärztin, Ihre Apothekerin oder das Pflegepersonal.
SCHRITT A: Vorbereitung einer Injektion
Vor Beginn benötigen Sie:
- den Praluent-Pen,
- Alkohol-Feuchttücher,
- Wattebausch oder Gaze,
- ein durchstichsicheres Behältnis (siehe Schritt B, 8).
1 Schauen Sie sich das Etikett auf dem Pen an.
- Überprüfen Sie, ob Sie das richtige Produkt und die richtige Dosis haben.
- Überprüfen Sie das Verfalldatum: Verwenden Sie das Produkt nicht, wenn dieses Datum überschritten wurde. Das Verfallsdatum ist der letzte Tag des angegebenen Monats.

2 Schauen Sie sich das Fenster an.
- Überprüfen Sie, ob die Flüssigkeit klar, farblos bis blassgelb und frei von Partikeln ist. Verwenden Sie das Produkt nicht, wenn dies nicht der Fall ist.
- Sie bemerken möglicherweise eine Luftblase. Das ist normal.
- Verwenden Sie den Pen nicht, wenn das Fenster durchgehend gelb ist (siehe Abbildung B).

3 Lassen Sie den Pen bei Raumtemperatur für 30 bis 40 Minuten warm werden.
- Den Pen nicht erhitzen, lassen Sie ihn von selbst Raumtemperatur erreichen.
- Legen Sie den Pen nicht zurück in den Kühlschrank.

4 Vorbereiten der Injektionsstelle.
- Waschen Sie Ihre Hände mit Wasser und Seife und trocknen Sie sie mit einem Handtuch ab.
- Sie können in folgende Bereiche injizieren (siehe Abbildung):
- Oberschenkel,
- Bauch (nicht jedoch in einen Bereich von 5 cm um Ihren Nabel herum),
- die Aussenseite Ihrer Oberarme.
- Sie können sich die Injektion im Stehen oder Sitzen verabreichen.
- Reinigen Sie die Haut im Injektionsbereich mit einem Alkohol-Feuchttuch.
- Injizieren Sie nicht in Hautbereiche, die empfindlich, hart, gerötet oder heiss sind.
- Injizieren Sie nicht in der Nähe einer sichtbaren Vene.
- Wählen Sie bei jeder Injektion eine andere Stelle.
- Injizieren Sie Praluent nicht zusammen mit anderen Arzneimitteln an derselben Stelle.

SCHRITT B: Wie wird injiziert?
1 Nachdem Sie alle Schritte von «SCHRITT A: Vorbereitung einer Injektion» abgeschlossen haben, ziehen Sie die blaue Kappe ab.
- Ziehen Sie die Kappe erst unmittelbar vor der Injektion ab.
- Setzen Sie die blaue Kappe nicht wieder auf.

2 So halten Sie den Praluent-Pen richtig.
- Die gelbe Schutzabdeckung nicht berühren.
- Stellen Sie sicher, dass Sie das Fenster sehen können.

3 Drücken Sie die gelbe Schutzabdeckung in einem Winkel von ungefähr 90° (senkrecht) auf die Haut.
- Drücken Sie den Pen auf die Haut und halten Sie ihn fest auf die Haut gedrückt, bis die gelbe Sicherheitsabdeckung nicht mehr sichtbar ist. Der Pen funktioniert nur, wenn von der gelben Sicherheitsabdeckung nichts mehr zu sehen ist.
- Falls notwendig, kneifen Sie eine Hautfalte zusammen, um für eine feste Injektionsstelle zu sorgen.

4 Drücken Sie den grünen Knopf mit dem Daumen und lassen Sie ihn sofort wieder los.
- Sie hören einen «Klick». Ihre Injektion hat nun begonnen.
- Bewegen Sie nun den Fertigpen bis zum Ende der Injektion nicht mehr.
- Das Fenster beginnt, gelb zu werden.

5 Drücken Sie den Pen nach dem Loslassen des Knopfes weiterhin fest auf Ihre Haut.
- Die Injektion kann bis zu 20 Sekunden dauern.

6 Überprüfen Sie, ob das Fenster vollständig gelb geworden ist, bevor Sie den Pen entfernen.
- Den Pen nicht entfernen, bevor das ganze Fenster gelb geworden ist.
- Ihre Injektion ist abgeschlossen, wenn das Fenster vollständig gelb ist. Unter Umständen hören Sie dann einen zweiten „Klick“.
- Wenn das Fenster nicht vollständig gelb wird, sprechen Sie bitte mit Ihrem Arzt, Ihrem Apotheker bzw. Ihrer Ärztin, Ihrer Apothekerin oder dem Pflegepersonal, bevor Sie sich eine zweite Dosis verabreichen.

7 Heben Sie den Pen von der Haut ab.
- Reiben Sie nach der Injektion nicht über die Hautstelle.
- Falls Sie etwas Blut sehen, drücken Sie einen Wattebausch oder Gaze auf die Stelle, bis es nicht mehr blutet.

8 Entsorgen Sie den Pen und die blaue Kappe.
- Setzen Sie die blaue Kappe nicht wieder auf die Schutzabdeckung.
- Entsorgen Sie den Pen und die Kappe unmittelbar nach der Anwendung in ein durchstichsicheres Behältnis.
- Fragen Sie Ihren Arzt, Ihren Apotheker bzw. Ihre Ärztin, Ihre Apothekerin oder das Pflegepersonal, wie das Behältnis zu entsorgen ist.
- Bewahren Sie das Behältnis immer für Kinder unzugänglich auf.

Qu’est-ce que Praluent et quand doit-il être utilisé?
Praluent contient le principe actif alirocumab. Il s'agit d'un médicament à injecter, appelé inhibiteur de la PCSK9.
- Praluent est un anticorps monoclonal entièrement humain qui bloque une protéine appelée PCSK9 (proprotéine convertase subtilisine/kexine de type 9).
- La protéine PCSK9 est sécrétée par les cellules du foie.
- Normalement, le cholestérol LDL (le «mauvais» cholestérol) est éliminé du sang en se fixant à des récepteurs spécifiques (stations d'amarrage) sur des cellules du foie. La PCSK9 réduit le nombre de récepteurs LDL disponibles pour éliminer le cholestérol LDL du sang.
- Praluent inhibe la PCSK9, ce qui augmente le nombre de récepteurs disponibles pour éliminer le cholestérol LDL du sang. Cela entraîne des taux de cholestérol LDL réduits.
Praluent est utilisé en association avec un régime alimentaire et d'autres traitements hypolipémiants chez les adultes présentant un taux élevé de cholestérol (hypercholestérolémie non familiale et familiale hétérozygote ou dyslipidémie mixte) pour réduire:
- le cholestérol LDL («mauvais» cholestérol);
- le cholestérol total;
- le cholestérol non transporté par les lipoprotéines de haute densité (non-HDL-C);
- une protéine qui transporte le «mauvais» cholestérol dans le sang (apolipoprotéine B);
- les triglycérides;
- la lipoprotéine (a).
Praluent est également utilisé chez les adultes ayant un taux élevé de cholestérol dans le sang et présentant un risque cardiovasculaire élevé afin de réduire le risque de crise cardiaque, d'accident vasculaire cérébral et d'angor instable (angine de poitrine) nécessitant une hospitalisation.
Praluent augmente également le cholestérol HDL (le «bon» cholestérol) et l'apolipoprotéine A-1.
Praluent peut être utilisé seul ou en association avec d'autres médicaments pour traiter le cholestérol élevé. Continuez à suivre votre régime réducteur de cholestérol tout en prenant ce médicament.
Selon prescription du médecin.
Quand Praluent ne doit-il pas être utilisé?
N'utilisez pas Praluent si vous êtes allergique à l'alirocumab ou à l'un des autres composants de ce médicament (voir section «Que contient Praluent?»).
Quelles sont les précautions à observer lors de l’utilisation de Praluent?
Avant d'utiliser Praluent, informez votre médecin, pharmacien de toutes vos pathologies, y compris les allergies et si vous prenez, avez récemment pris ou êtes susceptible de prendre tout autre médicament.
En cas de réaction allergique grave (voir section «Quels effets secondaires Praluent peut-il provoquer?»), arrêtez d'utiliser Praluent et consultez immédiatement votre médecin pour un traitement d'urgence adéquat. Les symptômes d'une réaction allergique grave peuvent se manifester par une difficulté à respirer ou à avaler, une chute de la tension artérielle (étourdissement, sueurs, accélération du pouls, sifflement d'oreille), une éruption cutanée (urticaire), des tuméfactions de la peau et des muqueuses (par ex. gonflement du visage, des lèvres, de la bouche ou gorge), des diarrhées.
L'utilisation de Praluent chez l'enfant et l'adolescent de moins de 18 ans n'a pas fait l'objet d'études. Par conséquent, l'utilisation de Praluent dans cette tranche d'âge n'est pas recommandée.
Ce médicament peut affecter les réactions, l'aptitude à conduire et la capacité à utiliser des outils ou des machines!
Veuillez informer votre médecin ou votre pharmacien si
- vous souffrez d'une autre maladie
- vous êtes allergique
- vous prenez déjà d'autres médicaments (même en automédication!).
Praluent peut-il être utilisé pendant la grossesse ou l’allaitement?
Praluent n'est pas recommandé pendant la grossesse ou l'allaitement.
Si vous êtes enceinte ou allaitez, si vous pensez être enceinte ou envisagez d'avoir un enfant, demandez conseil à votre médecin ou pharmacien avant d'utiliser ce médicament.
Comment utiliser Praluent?
Utilisez toujours ce médicament exactement comme décrit dans cette notice ou le mode d'emploi, ou comme indiqué par votre médecin, pharmacien ou infirmier. Consultez votre médecin, pharmacien ou infirmier en cas de doute.
Quelle dose injecter?
Votre médecin vous indiquera la dose initiale de 75 mg une fois toutes les 2 semaines.
La dose pourra être ajustée au besoin à 150 mg une fois toutes les 2 semaines ou 300 mg une fois toutes les 4 semaines.
Si la réduction du LDL-C est insuffisante avec 300 mg une fois toutes les 4 semaines, votre médecin pourra vous prescrire la dose maximale de 150 mg une fois toutes les 2 semaines.
Quand procéder à l'injection?
Injectez Praluent une fois toutes les 2 semaines pour des posologies de 75 mg et 150 mg ou une fois toutes les 4 semaines/mensuellement pour une posologie de 300 mg. Pour administrer la posologie de 300 mg, procédez à deux injections de 150 mg à la suite sur deux sites d’injections différents.
Où injecter le médicament?
Praluent est injecté dans la peau (administration sous-cutanée) de l'abdomen, de la cuisse ou de la partie supérieure du bras.
Vérifiez toujours l'étiquette de votre stylo pour vous assurer d'avoir le médicament approprié et la dose appropriée de Praluent avant chaque injection.
Choisissez un site d'injection différent à chaque fois (p.ex. cuisse droite, puis cuisse gauche, ou côté droit puis gauche de l'abdomen).
Ne l'injectez pas dans des zones où la peau est blessée, délicate, dure, rouge ou chaude.
N'injectez pas Praluent conjointement avec d'autres médicaments à injecter, sur le même site d'injection.
Laisser Praluent atteindre la température ambiante avant toute utilisation. Une fois sorti du réfrigérateur pour amener le stylo à température ambiante, ne pas placer à proximité d'une source de chaleur ou de la lumière directe du soleil.
Apprendre à utiliser le stylo pré-rempli
Avant d'utiliser le stylo pour la première fois, votre médecin, pharmacien ou infirmier vous montrera comment injecter Praluent.
- Lisez toujours les instructions d'utilisation fournies dans la boîte.
- Utilisez toujours le stylo comme décrit dans les instructions d'utilisation.
Si vous utilisez plus de Praluent que vous devriez
Si vous utilisez plus de Praluent que vous devriez, informez-en votre médecin, infirmier ou pharmacien.
Si vous oubliez d'utiliser Praluent
Si vous oubliez une dose de Praluent, injectez la dose oubliée aussi vite que possible. Prenez ensuite la prochaine dose deux semaines après le jour d'oubli de la dose. Cela vous permettra de reprendre le schéma posologique initial. En cas de doute sur le jour de prise de Praluent, appelez vote médecin, infirmier ou pharmacien.
Si vous arrêtez d'utiliser Praluent
N'arrêtez pas l'utilisation de Praluent sans en parler à votre médecin. Si vous arrêtez d'utiliser Praluent, votre taux de cholestérol peut augmenter.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
L'utilisation et la sécurité de Praluent n'ont pas été établies à ce jour pour les enfants et les adolescents / pour les enfants de moins de 18 ans).
Quels effets secondaires Praluent peut-il provoquer?
Comme tous les médicaments, ce médicament est susceptible d'entraîner des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Fréquent (concerne 1 à 10 utilisateurs sur 100)
- Rougeur, gonflement, douleur ou hématome sur le site d'injection (réactions localisées au site d'injection)
- Symptômes de refroidissement.
- Douleurs musculaires
- Convulsions musculaires
- Douleurs de l'appareil locomoteur
- Démangeaisons (prurit)
- Diarrhée
- Infection des voies urinaires
Rare (concerne 1 à 10 utilisateurs sur 10 000)
- Réactions allergiques/d'hypersensibilité
- Vascularite d'hypersensibilité, qui est une forme spécifique de réaction allergique. Les symptômes peuvent inclure la diarrhée, les éruptions cutanées ou des taches pourpres sur la peau (purpura)
- Urticaire
- Taches de peau rougeâtres, parfois accompagnées d'ampoules (eczéma nummulaire)
Les effets indésirables suivants ont été rapportés depuis la mise sur le marché de Praluent mais leur fréquence de survenue n'est pas connue:
- Angiœdème (gonflement du visage, de la gorge, des voies respiratoires, démangeaisons).
Si vous remarquez des effets secondaires, veuillez en informer votre médecin, votre pharmacien. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d'emballage.
À quoi faut-il encore faire attention?
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient. La date de péremption correspond au dernier jour du mois indiqué.
Remarques concernant le stockage
Conserver hors de la vue et de la portée des enfants.
Conserver au réfrigérateur (2-8 °C).
Ne pas congeler.
Conserver le stylo dans l'emballage extérieur d'origine pour le protéger de la lumière.
Ne pas exposer à une chaleur extrême.
Si besoin, les stylos pré-remplis peuvent être conservés en dehors du réfrigérateur à une température ne dépassant pas + 25 °C jusqu'à 30 jours maximum. Protéger de la lumière. Une fois sorti du réfrigérateur, Praluent doit être utilisé dans les 30 jours ou éliminé.
Praluent ne doit pas être remis au réfrigérateur une fois qu'il a été mis à température ambiante.
Remarques complémentaires
Ne pas utiliser ce médicament si la solution est décolorée ou trouble ou si elle contient des particules visibles.
Que contient Praluent?
Chaque dose contient 75 milligrammes (75 milligrammes par ml) ou 150 milligrammes (150 milligrammes par ml) d'alirocumab injectable par voie sous-cutanée.
Principes actifs
Alirocumab.
Excipients
Histidine, saccharose, polysorbate 20, eau pour préparation injectable.
Numéro d’autorisation
65882 (Swissmedic).
Où obtenez-vous Praluent? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Praluent est disponible en boites de 1, 2 ou 6* stylos pré-remplis.
* Actuellement indisponible
Titulaire de l’autorisation
sanofi-aventis (suisse) sa, 1214 Vernier/GE.
Cette notice d'emballage a été vérifiée pour la dernière fois en mai 2020 par l'autorité de contrôle des médicaments (Swissmedic).
Praluent (alirocumab), solution de 75 mg à injecter en stylo pré-rempli
Instructions d’utilisation
Les différentes pièces du stylo Praluent sont illustrées dans cette image.

Informations importantes
- Le dispositif est un stylo pré-rempli à usage unique. Il contient 75 mg de Praluent (alirocumab) dans 1 ml.
- Le médicament est injecté sous votre peau et peut être administré par vous-même ou par quelqu’un d’autre.
- Ce stylo pré-rempli ne peut être utilisé que pour une seule injection et doit être jeté après utilisation.
À faire
- Tenez le stylo de Praluent hors de la vue et de la portée des enfants.
- Lisez attentivement toutes les instructions avant d’utiliser le stylo Praluent.
- Suivez ces instructions chaque fois que vous utilisez un stylo Praluent.
- Conserver les stylos non utilisés au réfrigérateur, à une température comprise entre 2 °C et 8 °C.
- Pour obtenir les conditions de conservation détaillées, consultez l’information destinée aux patients de Praluent.
À ne pas faire
- Ne touchez pas l’embout de sécurité jaune.
- N’utilisez pas le stylo s’il est tombé ou endommagé.
- N’utilisez pas le stylo si le capuchon bleu est manquant ou n’est pas attaché de manière sécurisée.
- Ne réutilisez pas un stylo.
- Ne secouez pas le stylo.
- Ne congelez pas le stylo.
- Ne pas exposer le stylo à une chaleur extrême.
Gardez ces instructions d’utilisation. Pour toute question, consultez votre médecin, pharmacien ou infirmier/infirmière.
ÉTAPE A: SE PRÉPARER POUR UNE INJECTION
Avant de commencer, vous aurez besoin des éléments suivants:
- le stylo de Praluent,
- des lingettes imbibées d’alcool,
- du coton ou une gaze,
- récipient résistant à la perforation (voir Étape B, 8).
1 Consultez l’étiquette sur le stylo.
- Vérifiez que vous avez le bon produit et le bon dosage.
- Vérifiez la date de péremption: ne pas utiliser le médicament si la date est dépassée. La date de péremption correspond au dernier jour du mois indiqué.

2 Regardez la fenêtre.
- Vérifiez que le liquide est limpide, incolore à jaune pâle et ne comporte aucune particule (voir image A). Si ce n’est pas le cas, n’utilisez pas le médicament.
- Il est possible que vous aperceviez une bulle d’air. Cela est normal.
- N’utilisez pas le stylo si la fenêtre apparaît jaune uni (voir image B).

3 Laissez le stylo revenir à température ambiante pendant 30 à 40 minutes.
- Ne chauffez pas le stylo, laissez-le revenir à température ambiante tout seul.
- Ne remettez pas le stylo au réfrigérateur.

4 Préparez le site d’injection.
- Lavez-vous les mains à l’eau et au savon et séchez-les avec une serviette.
- Vous pouvez injecter le médicament dans les zones suivantes (voir image):
- cuisse
- ventre (sauf dans un rayon de 5 cm autour du nombril)
- la partie externe du haut du bras
- Vous pouvez être en position debout ou assise pour vous injecter le médicament.
- Nettoyez la peau du site d’injection à l’aide d’une lingette imbibée d’alcool.
- N’utilisez pas un endroit où la peau est sensible, dure, rouge ou chaude.
- N’utilisez pas un endroit à proximité d’une veine visible.
- Utilisez un endroit différent à chaque injection.
- N’injectez pas Praluent avec d’autres médicaments au même endroit.

ÉTAPE B: COMMENT INJECTER
1 Après avoir suivi toutes les instructions de l’«ÉTAPE A: SE PRÉPARER À UNE INJECTION», retirez le capuchon bleu
- Ne retirez pas le capuchon avant d’être prêt(e) à injecter le médicament.
- Ne replacez pas le capuchon bleu.

2 Tenez le stylo Praluent de la manière suivante.
- Ne touchez pas l’embout de sécurité jaune.
- Assurez-vous de pouvoir voir la fenêtre.

3 Appuyez l’embout de sécurité jaune contre votre peau à un angle de 90° environ.
- Appuyez sur le stylo et tenez-le fermement contre votre peau jusqu’à ce que l’embout de sécurité jaune ne soit plus visible. Le stylo ne fonctionnera pas si l’embout de sécurité jaune n’est pas entièrement caché.
- Si nécessaire, pincez la peau pour vous assurer d’avoir un site d’injection ferme

4 À l’aide de votre pouce, appuyez sur le bouton vert et relâchez-le immédiatement.
- Vous entendrez un clic. L’injection a désormais commencé.
- Ne bougez pas le stylo jusqu’à la fin de l’injection.
- La fenêtre va commencer à devenir jaune.

5 Continuez à appuyer le stylo fermement contre votre peau après avoir relâché le bouton vert.
- L’injection peut durer jusqu’à 20 secondes.

6 Vérifiez que la fenêtre soit devenue entièrement jaune avant de retirer le stylo.
- Ne retirez pas le stylo avant que l’intégralité de la fenêtre soit devenue jaune.
- L’injection est terminée lorsque la fenêtre est entièrement jaune. Il est possible que vous entendiez un second clic.
- Si la fenêtre ne devient pas entièrement jaune, ne vous faites pas une deuxième injection sans en avoir parlé à votre médecin, pharmacien ou infirmier/infirmière.

7 Retirez le stylo de votre peau.
- Ne vous frottez pas la peau après l’injection.
- En cas de saignement, appliquez un coton ou une gaze sur le site jusqu’à ce que le saignement cesse.

8 Jetez le stylo et le capuchon bleu
- Ne replacez pas le capuchon bleu sur l’embout de sécurité.
- Jetez-le dans un récipient résistant à la perforation immédiatement après utilisation.
- Demandez à votre médecin, pharmacien ou infirmier/infirmière comment éliminer le récipient.
- Tenez toujours le conteneur hors de la vue et de la portée des enfants.

Che cos’è Praluent e quando si usa?
Praluent contiene il principio attivo alirocumab. È un medicamento da iniettare, chiamato inibitore della PCSK9.
- Praluent è un anticorpo monoclonale interamente umano che blocca una proteina chiamata PCSK9 (proproteina convertasi subtilisina/kexina di tipo 9).
- La proteina PCSK9 è secreta dalle cellule del fegato.
- Il colesterolo LDL (colesterolo «cattivo») viene normalmente rimosso dal sangue legandosi a specifici «recettori» (punti di connessione) presenti nel fegato. La PCSK9 diminuisce il numero di questi recettori LDL disponibili per eliminare dal sangue il colesterolo LDL.
- Bloccando la PCSK9, Praluent aumenta il numero di recettori disponibili per eliminare dal sangue il colesterolo LDL e abbassa pertanto i livelli del colesterolo LDL.
Praluent viene impiegato in combinazione con una dieta e con altri trattamenti ipolipemizzanti negli adulti che presentano un tasso elevato di colesterolo (ipercolesterolemia non familiare e familiare eterozigote o dislipidemia mista) per ridurre i livelli di:
- colesterolo LDL (colesterolo «cattivo»);
- colesterolo totale;
- colesterolo non trasportato dalle lipoproteine ad alta densità (non-HDL-C);
- una proteina che trasporta il colesterolo «cattivo» nel sangue (apolipoproteina B);
- i trigliceridi;
- la lipoproteina (a).
Praluent è utilizzato anche negli adulti con tasso elevato di colesterolo nel sangue e con rischio cardiovascolare elevato per ridurre il rischio di infarto, ictus e angina instabile (angina pectoris), che richiedono ricovero ospedaliero.
Praluent aumenta inoltre il colesterolo HDL (il colesterolo «buono») e l'apolipoproteina A-1.
Praluent può essere impiegato in monoterapia oppure in associazione con altri medicamenti per trattare i valori elevati di colesterolo. Continui a seguire la dieta per abbassare il colesterolo mentre prende questo medicamento.
Secondo prescrizione medica
Quando non si può usare Praluent?
Praluent non deve essere usato in presenza di un'allergia al principio attivo alirocumab o a uno degli altri componenti (vedere la sezione «Cosa contiene Praluent?»).
Quando è richiesta prudenza nell’uso di Praluent?
Prima di prendere Praluent informi il medico o il farmacista di tutte le sue patologie, comprese le allergie, e gli comunichi se di recente ha preso altri medicamenti o se sta per iniziare una terapia con altri medicamenti. In caso di grave reazione allergica (vedere sezione «Quali effetti collaterali può avere Praluent?»), sospenda l'assunzione e consulti immediatamente il suo medico affinché istituisca un trattamento d'urgenza adeguato. I sintomi di una reazione allergica grave possono manifestarsi sotto forma di difficoltà a respirare o a deglutire, calo della pressione arteriosa (stordimento, sudorazione, polso accelerato, fischio nelle orecchie), eruzione cutanea (orticaria), tumefazioni della pelle e delle mucose (per es. gonfiore del viso, delle labbra, della bocca o della gola), diarrea.
L'uso di Praluent nei bambini e negli adolescenti sotto i 18 anni finora non è stato esaminato; si sconsiglia pertanto il trattamento con Praluent in questa fascia d'età.
Questo medicamento può modificare la capacità di reagire, di guidare veicoli o di utilizzare strumenti o macchinari!
Informi il suo medico o farmacista nel caso in cui
- soffre di altre malattie,
- soffre di allergie o
- assume altri medicamenti (anche acquistati di sua iniziativa!)
Si può assumere Praluent durante la gravidanza o l’allattamento?
Si sconsiglia l'uso di Praluent durante la gravidanza o l'allattamento.
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando, chieda consiglio al medico o al farmacista prima di usare questo medicamento.
Come usare Praluent?
Si attenga alla posologia indicata nel foglietto illustrativo o nelle istruzioni per l'uso oppure alle indicazioni del medico, farmacista o infermiere. In caso di dubbi, consulti il suo medico, il farmacista o l'infermiere.
Qual è la dose da iniettare?
Il medico le indicherà la dose iniziale di 75 mg una volta ogni due settimane.
All’occorrenza, la dose potrà essere adattata a 150 mg una volta ogni due settimane o 300 mg una volta ogni quattro settimane.
Se la diminuzione del colesterolo LDL- è insufficiente con 300 mg una volta ogni quattro settimane, il suo medico potrà prescriverle la dose massima di 150 mg una volta ogni due settimane.
Quando si effettua l'iniezione?
Praluent va iniettato una volta ogni due settimane per dosaggi di 75 mg e 150 mg, oppure una volta ogni quattro settimane/mensilmente per un dosaggio di 300 mg. Per somministrare la dose di 300 mg, proceda con due iniezioni da 150 mg alla volta in due siti di iniezione diversi.
Dove deve essere praticata l'iniezione del medicamento?
Praluent si inietta nella pelle (somministrazione sottocutanea) dell'addome, della coscia o della parte superiore del braccio.
Prima di ciascuna iniezione controlli sempre l'etichetta della penna per accertarsi di stare iniettando il medicamento appropriato e la dose prescritta di Praluent.
Scelga ogni volta un sito diverso per l'iniezione (ad es. coscia destra e poi coscia sinistra, lato destro e poi lato sinistro dell'addome).
Non pratichi l'iniezione in zone con ferite oppure dove la pelle si presenta delicata, dura, arrossata o calda.
Non inietti Praluent contemporaneamente ad altri medicamenti iniettabili nello stesso sito d'iniezione.
Praluent deve essere usato a temperatura ambiente. Estragga la penna dal frigorifero affinché il medicamento raggiunga la temperatura ambiente, senza collocare vicino a una sorgente di calore o esporre alla luce diretta del sole.
Come utilizzare la penna preriempita
Il medico, il farmacista o l'infermiere le mostrerà come iniettare Praluent prima di utilizzare la penna per la prima volta.
- Legga sempre le istruzioni per l'uso contenute nella confezione.
- Utilizzi sempre la penna come indicato nelle istruzioni per l'uso.
Se usa un dosaggio di Praluent maggiore di quello prescritto
Se erroneamente usa un dosaggio maggiore di quello prescritto, informi il suo medico, farmacista o infermiere.
Se dimentica di usare Praluent
Se dimentica una dose di Praluent, deve effettuare l'iniezione il prima possibile e riprendere quindi il trattamento due settimane dopo il giorno della dose dimenticata. Così facendo potrà riprendere lo schema posologico iniziale. Se ha dubbi sul giorno in cui deve usare Praluent, consulti il medico, il farmacista o l'infermiere.
Se interrompe l'uso di Praluent
Non interrompa l'uso di Praluent senza avere prima consultato il suo medico. L'interruzione di Praluent può infatti causare l'aumento del suo tasso di colesterolo.
Non modifichi di sua iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte, ne parli al suo medico o al suo farmacista.
L'uso e la sicurezza di Praluent nei i bambini e negli adolescenti al di sotto di 18 anni non sono stati esaminati finora.
Quali effetti collaterali può avere Praluent?
Come tutti i medicamenti, anche Praluent può avere effetti indesiderati, che tuttavia non si presentano sistematicamente in tutte le persone.
Comune (riguarda da 1 a 10 utilizzatori su 100)
- arrossamento, gonfiore, dolore o ematoma nel sito d'iniezione (reazioni localizzate nel sito d'iniezione)
- sintomi da raffreddamento
- dolori muscolari
- contrazioni muscolari
- dolori dell'apparato locomotore
- prurito cutaneo
- diarrea
- infezione delle vie urinarie
Raro (riguarda da 1 a 10 utilizzatori su 10 000)
- reazioni allergiche/di ipersensibilità;
- vasculite da ipersensibilità, una forma specifica di reazione allergica, i cui sintomi possono includere diarrea, eruzioni cutanee o macchie violacee sulla pelle (porpora);
- orticaria;
- chiazze rossastre sulla pelle, talvolta accompagnate da vesciche (eczema nummulare).
I seguenti effetti indesiderati sono stati segnalati dopo l'introduzione sul mercato di Praluent, ma la loro frequenza di insorgenza non è nota:
- angioedema (gonfiore del viso, della gola, delle vie respiratorie, prurito).
Se osserva effetti collaterali si rivolga al suo medico o al suo farmacista, soprattutto se si tratta di effetti collaterali non descritti in questo foglietto illustrativo.
Di che altro occorre tener conto?
Il medicamento non dev'essere utilizzato oltre la data di scadenza indicata con «EXP» sul contenitore. La data di scadenza corrisponde all'ultimo giorno del mese indicato.
Indicazione di stoccaggio
Tenere il medicamento al di fuori della vista e della portata dei bambini.
Conservare in frigorifero (2 °C-8 °C).
Non congelare.
Conservare la penna nell'imballaggio esterno originale per proteggere il medicamento dalla luce.
Non esporre a temperature elevate.
Le penne preriempite possono essere conservate all'occorrenza fuori dal frigorifero a una temperatura che non deve superare i 25 °C, fino a un massimo di 30 giorni, al riparo dalla luce. Una volta estratto dal frigorifero, Praluent deve essere utilizzato entro 30 giorni oppure dovrà essere gettato.
Una volta raggiunta la temperatura ambiente, Praluent non deve essere rimesso in frigorifero.
Ulteriori indicazioni
Non utilizzare il medicamento se la soluzione appare scolorita o torbida, oppure se contiene materiale particellare visibile.
Cosa contiene Praluent?
Ciascuna dose contiene 75 milligrammi (75 milligrammi per ml) oppure 150 milligrammi (150 milligrammi per ml) di alirocumab iniettabile per via sottocutanea.
Principi attivi
Alirocumab
Sostanze ausiliarie
Istidina, saccarosio, polisorbato 20 e acqua per preparazioni iniettabili.
Numero dell’omologazione
65882 (Swissmedic).
Dove è ottenibile Praluent? Quali confezioni sono disponibili?
In farmacia, dietro presentazione della prescrizione medica.
Praluent è disponibile in scatole da 1, 2 o 6* penne preriempite.
* Non disponibili al momento.
Titolare dell’omologazione
sanofi-aventis (suisse) sa, 1214 Vernier/GE.
Questo foglietto illustrativo è stato controllato l'ultima volta nel maggio 2020 dall'autorità competente in materia di medicamenti (Swissmedic).
Praluent® (alirocumab) 75 mg soluzione iniettabile in penna preriempita
Istruzioni per l’uso
Le parti della penna Praluent sono illustrate in questa immagine.

Informazioni importanti
- Il dispositivo è una penna preriempita monouso. Contiene 75 mg di Praluent (alirocumab) in 1 ml.
- Il medicinale viene iniettato sottocute; può essere auto-somministrato o somministrato da qualcun altro.
- Questa penna può essere usata per un’unica iniezione e deve essere gettata dopo l’uso.
Cosa fare
- Tenere la penna di Praluent fuori dalla vista e dalla portata dei bambini.
- Leggere attentamente tutte le istruzioni prima di usare la penna Praluent.
- Seguire le istruzioni ogni volta che si usa una penna Praluent.
- Conservare le penne non utilizzate in frigorifero a una temperatura compresa tra +2 °C e +8 °C.
- Per maggiori informazioni sulle condizioni di conservazione vedere la sezione «Di che altro occorre tener conto?».
Cosa non fare
- Non toccare il dispositivo di sicurezza giallo.
- Non usare la penna se è caduta o è danneggiata.
- Non usare la penna se il cappuccio blu è assente o non è attaccato saldamente.
- Non riutilizzare una penna.
- Non agitare la penna.
- Non congelare la penna.
- Non esporre la penna alla luce solare diretta.
Conservi questo foglietto. Se ha qualsiasi dubbio si rivolga al medico, al farmacista o all’infermiere.
FASE A: Preparazione all’iniezione
Prima di iniziare sono necessari i seguenti materiali:
- la penna di Praluent
- salviettine imbevute di alcol
- un batuffolo di cotone o una garza
- un contenitore resistente alla perforazione (vedere Fase B, 8).
1 Esaminare l’etichetta della penna.
- Controllare di avere il prodotto giusto e la dose giusta.
- Controllare la data di scadenza: non usare il medicinale se tale data è stata superata. La data di scadenza corrisponde all’ultimo giorno del mese indicato.

2 Esaminare la finestrella.
- Controllare che il liquido sia limpido, da incolore a giallo pallido e privo di particelle (vedere la figura A). In caso contrario non usarlo.
- È possibile notare una bollicina d’aria. È normale.
- Non usare la penna se la finestrella appare completamente gialla (vedere figura B).

3 Lasciare riscaldare la penna a temperatura ambiente per 30–40 minuti.
- Non riscaldare la penna, lasciare che raggiunga la temperatura ambiente da sola.
- Non rimettere la penna in frigorifero.

4 Preparare il sito di iniezione.
- Lavare le mani con acqua e sapone e asciugarle con un asciugamano.
- È possibile eseguire l’iniezione (vedere l’illustrazione):
- nella coscia
- nella pancia (ad eccezione dell’area di 5 cm immediatamente attorno all’ombelico)
- nel lato esterno della parte superiore del braccio.
- L’iniezione può essere somministrata in piedi o seduti.
- Pulire la pelle del sito di iniezione con una salviettina imbevuta di alcol.
- Non iniettare in zone in cui la pelle è sensibile, indurita, arrossata o calda.
- Non iniettare in zone adiacenti a una vena visibile.
- Utilizzare un sito diverso ogni volta che si fa l’iniezione.
- Non iniettare Praluent con altri medicinali iniettabili nello stesso sito
.
FASE B: Come eseguire l’iniezione
1 Dopo aver completato tutti i punti della «Fase A: Preparazione all’iniezione», togliere il cappuccio blu.
- Togliere il cappuccio solo quando si è pronti a eseguire l’iniezione.
- Non rimettere il cappuccio blu.

2 Tenere la penna nel modo seguente.
- Non toccare il dispositivo di sicurezza giallo.
- Assicurarsi di essere in grado di vedere la finestrella.

3 Premere il dispositivo di sicurezza giallo sulla pelle a un’angolazione di circa 90°.
- Premere e tenere saldamente la penna contro la pelle fino a quando il dispositivo di sicurezza giallo non è più visibile. La penna non funziona se il dispositivo di sicurezza giallo non è completamente scomparso.
- Se necessario, pizzicare la pelle per tenere fermo il sito di iniezione.

4 Premere il pulsante verde con il pollice e rilasciarlo immediatamente.
- Si udrà un clic. L’iniezione è ora iniziata.
- Non spostare la penna per la fine della iniezione.
- La finestrella inizierà a diventare gialla.

5 Continuare a tenere la penna contro la pelle dopo aver rilasciato il pulsante.
- L’iniezione potrebbe richiedere fino a 20 secondi.

6 Prima di rimuovere la penna controllare che la finestrella sia diventata completamente gialla.
- Rimuovere la penna solo dopo che la finestrella è diventata completamente gialla.
- L’iniezione è completa quando la finestrella è diventata completamente gialla; è possibile udire un secondo clic.
- Se la finestrella non diventa completamente gialla, non somministrare una seconda iniezione senza consultare prima il medico, il farmacista o l’infermiere.

7 Allontanare la penna dalla pelle.
- Non strofinare la pelle dopo l’iniezione.
- Se si osserva del sangue, premere un batuffolo di cotone o una garza sul sito fino a quando il sanguinamento si interrompe.

8 Gettare penna e cappuccio.
- Non rimettere il cappuccio blu sull’attacco di sicurezza.
- Gettare penna e cappuccio in un contenitore resistente alla perforazione immediatamente dopo l’uso.
- Chiedere al medico, al farmacista o all’infermiere come smaltire il contenitore.
- Tenere sempre il contenitore fuori dalla vista e dalla portata dei bambini.

Zusammensetzung
Wirkstoffe
Alirocumab*.
Hilfsstoffe
Histidin, Saccharose, Polysorbat 20, Wasser für Injektionszwecke.
* Alirocumab ist ein vollständig humaner monoklonaler Antikörper (Isotyp IgG1), der an Proproteinkonvertase Subtilisin Kexin Typ 9 (PCSK9) bindet. Alirocumab wird mittels rekombinanter DNA-Technologie aus einer Suspensionskultur von Ovarialzellen des chinesischen Hamsters gewonnen.
Darreichungsform und Wirkstoffmenge pro Einheit
Praluent 75 mg, Injektionslösung in einer Fertigspritze: Jede 1-ml-Fertigspritze zur einmaligen Anwendung enthält 75 mg Alirocumab zur subkutanen Verabreichung.
Praluent 150 mg, Injektionslösung in einer Fertigspritze: Jede 1-ml-Fertigspritze zur einmaligen Anwendung enthält 150 mg Alirocumab zur subkutanen Verabreichung.
Praluent 75 mg, Injektionslösung in einem Fertigpen: Jeder 1-ml-Fertigpen zur einmaligen Anwendung enthält 75 mg Alirocumab zur subkutanen Verabreichung.
Praluent 150 mg, Injektionslösung in einem Fertigpen: Jeder 1-ml-Fertigpen zur einmaligen Anwendung enthält 150 mg Alirocumab zur subkutanen Verabreichung.
Indikationen/Anwendungsmöglichkeiten
Praluent ist indiziert begleitend zu einer Diät und zusätzlich zu einer maximal tolerierten Statin-Dosis, mit oder ohne weitere lipidmodifizierende Therapien, bei Erwachsenen mit Hypercholesterinämie (einschliesslich heterozygoter familiärer Hypercholesterinämie), welche eine zusätzliche Low-Density-Lipoprotein-Cholesterin (LDL-C) Senkung benötigen.
Praluent ist zur Verminderung des Risikos für kardiovaskuläre Ereignisse (Myokardinfarkt, ischämischer Schlaganfall, instabile Angina pectoris mit erforderlicher Hospitalisierung) bei Patienten mit hohem kardiovaskulärem Risiko indiziert.
Zur Wirkung von Praluent auf die kardiovaskuläre Mortalität, siehe Abschnitt «Eigenschaften/Wirkungen».
Dosierung/Anwendung
Übliche Dosierung
Die empfohlene Anfangsdosis für Praluent beträgt 75 mg alle 2 Wochen. Der LDL-C-Spiegel sollte 4 bis 8 Wochen nach Beginn der Behandlung untersucht Praluent werden.
Die Dosis kann auf 150 mg einmal alle 2 Wochen oder 300 mg einmal alle 4 Wochen erhöht werden.
Wenn die LDL-C-Senkung unter 300 mg alle 4 Wochen nicht ausreichend ist, kann die Dosis bis auf die Maximaldosis von 150 mg einmal alle 2 Wochen erhöht werden.
Praluent wird subkutan injiziert.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Spezielle Dosierungsanweisungen
Es ist keine Dosisanpassung je nach Körpergewicht des Patienten erforderlich (siehe Abschnitt «Pharmakokinetik»).
Patienten mit Leberfunktionsstörungen
Bei Patienten mit einer leicht oder mässig eingeschränkten Leberfunktion ist keine Dosisanpassung erforderlich. Es liegen keine Daten für Patienten mit einer stark eingeschränkten Leberfunktion vor (siehe Abschnitt «Pharmakokinetik»).
Patienten mit Nierenfunktionsstörungen
Bei Patienten mit einer leicht oder mässig eingeschränkten Nierenfunktion ist keine Dosisanpassung erforderlich. Es liegen keine Daten für Patienten mit einer stark eingeschränkten Nierenfunktion vor (siehe Abschnitt «Pharmakokinetik»).
Ältere Patienten
Bei älteren Patienten ist keine Dosisanpassung erforderlich (siehe Abschnitt «Pharmakokinetik»).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Praluent bei Kindern und Jugendlichen unter 18 Jahren wurde bisher noch nicht erwiesen. Es liegen keine Daten vor.
Verspätete Dosisgabe
Wenn eine Dosis vergessen wurde, ist die vergessene Injektion so bald wie möglich nachzuholen und danach die Behandlung gemäss dem ursprünglichen Zeitplan fortzusetzen.
Art der Anwendung
Praluent wird subkutan in Oberschenkel, Bauch oder Oberarm injiziert.
Für eine Dosis von 300 mg werden nacheinander zwei Injektionen zu je 150 mg an zwei unterschiedlichen Injektionsstellen verabreicht.
Es wird empfohlen, die Einstichstelle bei jeder Injektion zu wechseln.
Praluent sollte nicht in Bereiche mit einer aktiven Hauterkrankung oder Verletzung, wie zum Beispiel Sonnenbrand, Hautausschläge, Entzündungen oder Hautinfektionen, injiziert werden.
Praluent darf nicht zusammen mit anderen injizierbaren Arzneimitteln an derselben Injektionsstelle angewendet werden.
Vorsichtsmassnahmen vor der Anwendung des Arzneimittels
Die Lösung sollte klar, farblos bis blassgelb sein. Wenn die Lösung verfärbt ist oder sichtbare Partikel enthält, sollte die Lösung nicht verwendet werden.
Nach entsprechender Instruktion in die richtige subkutane Injektionstechnik durch medizinisches Fachpersonal kann Praluent vom Patienten selbst oder von einer Pflege- oder Betreuungsperson injiziert werden.
Lassen Sie Praluent vor jeder Anwendung auf Raumtemperatur aufwärmen. Nach Erreichen der Raumtemperatur soll Praluent so bald wie möglich angewendet werden.
Kontraindikationen
Überempfindlichkeit gegen den Wirkstoff oder einen der im Abschnitt «Zusammensetzung» genannten Hilfsstoffe.
Für die Kontraindikationen der gleichzeitig verabreichten Statine oder anderen lipidmodifizierenden Therapien sollte die jeweils geltende Fachinformation des entsprechenden Produkts berücksichtigt werden.
Warnhinweise und Vorsichtsmassnahmen
Allgemeine allergische Reaktionen, einschliesslich Pruritus, sowie seltene und manchmal schwerwiegende allergische Reaktionen, wie Überempfindlichkeit, nummuläres Ekzem, Urtikaria und Hypersensitivitätsvaskulitis, wurden in klinischen Studien berichtet (siehe Abschnitt «Unerwünschte Wirkungen»). Im Rahmen der Anwendungsbeobachtung wurde das Auftreten von Angioödemen gemeldet. Wenn klinische Zeichen oder Symptome schwerwiegender allergischer Reaktionen auftreten, muss die Behandlung mit Praluent abgesetzt und eine geeignete symptomatische Behandlung eingeleitet werden (siehe Abschnitt «Kontraindikationen»).
Interaktionen
Wirkung von Alirocumab auf andere Arzneimittel
Da es sich bei Alirocumab um ein biologisches Arzneimittel handelt, werden keine pharmakokinetischen Effekte auf andere Arzneimittel erwartet. In klinischen Studien, in denen Alirocumab zusammen mit Atorvastatin oder Rosuvastatin verabreicht wurde, wurden bei wiederholter Anwendung von Alirocumab keine wesentlichen Veränderungen der Statinkonzentrationen beobachtet. Dies deutet darauf hin, dass die Cytochrom-P450-Enzyme (hauptsächlich CYP3A4 und CYP2C9) und die Transportproteine wie P-gp und OATP von Alirocumab nicht beeinflusst wurden.
Wirkung von anderen Arzneimitteln auf Alirocumab
Von Statinen und anderen lipidmodifizierenden Therapien ist bekannt, dass sie die Expression von PCSK9, dem Zielprotein von Alirocumab, erhöhen. Da eine Komponente der Clearance von Alirocumab zielvermittelt ist, könnte eine Erhöhung von PCSK9 zu einer verringerten Exposition gegenüber Alirocumab führen. Dieser Effekt hat jedoch keinen Einfluss auf die Wirksamkeit, wenn Alirocumab alle zwei Wochen verabreicht wird.
Schwangerschaft/Stillzeit
Schwangerschaft
Es liegen keine Daten zur Anwendung von Praluent bei Schwangeren vor. Es wird davon ausgegangen, dass Alirocumab wie die anderen IgG-Antikörper die Plazentaschranke (siehe Abschnitt «Präklinische Daten») überwindet. Tierexperimentelle Studien ergaben keine Hinweise auf eine direkte oder indirekte Toxizität hinsichtlich Schwangerschaft, Embryonal- und
Fötalentwicklung und/oder der post-natalen Entwicklung. Praluent sollte während der Schwangerschaft nicht angewendet werden, es sei denn, der klinische Zustand der Patientin erfordert eine Behandlung mit Praluent.
Wird Praluent Frauen im fortpflanzungsfähigen Alter gleichzeitig mit einem Statin oder einem anderen lipidmodifizierenden Arzneimittel (z.B. Ezetimib) verabreicht, sollte der Abschnitt «Schwangerschaft» in der Fachinformation der anderen Arzneimittel berücksichtigt werden.
Anwendung im Rahmen einer gleichzeitigen Therapie mit einem Statin
Statine sollten bei Schwangeren nicht angewendet werden. Siehe geltende Zusammenfassung der Merkmale des jeweiligen Arzneimittels.
Stillzeit
Es ist nicht bekannt, ob Alirocumab in die Muttermilch übergeht. Da zahlreiche Arzneimittel und Immunglobuline in die Muttermilch übergehen, kann bei Neugeborenen und gestillten Säuglingen ein Risiko nicht ausgeschlossen werden.
Es muss entschieden werden, ob entweder das Stillen oder die Behandlung mit Praluent zu unterbrechen ist, resp. keine Behandlung mit Praluent einzuleiten ist. Dabei sind der Nutzen des Stillens für das Kind und der Nutzen der Behandlung für die Mutter abzuwägen.
Anwendung im Rahmen einer gleichzeitigen Therapie mit einem Statin
Statine sollten bei stillenden Frauen nicht angewendet werden. Siehe geltende Zusammenfassung der Merkmale des jeweiligen Arzneimittels.
Fertilität
Tierexperimentelle Studien ergaben keine negativen Hinweise auf Beeinträchtigung der Fertilität (siehe Abschnitt «Präklinische Daten»). Es liegen keine Daten zu einer schädlichen Wirkung auf die Fertilität beim Menschen vor.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Das Reaktionsvermögen sowie die Fahrtüchtigkeit und die Fähigkeit zum Bedienen von Maschinen und Werkzeugen können aufgrund möglicher unerwünschter Wirkungen beeinträchtigt werden.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Das Sicherheitsprofil erwies sich bei Patienten mit schwerer heterozygoter familiärer Hypercholesterinämie oder klinisch manifester atherosklerotischer kardiovaskulärer Erkrankung und bei Patienten mit primärer Hypercholesterinämie und einer gemischten Dyslipidämie als vergleichbar.
Zwischen den beiden im Phase-III-Programm verwendeten Dosierungen (75 mg alle zwei Wochen und 150 mg alle zwei Wochen) wurde kein Unterschied hinsichtlich des Sicherheitsprofils beobachtet.
Tabellarische Zusammenfassung der unerwünschten Wirkungen
Die folgenden unerwünschten Wirkungen wurden in gepoolten kontrollierten Studien bei mit Alirocumab behandelten Patienten berichtet:
Die Nebenwirkungen werden nach Systemorganklasse und in absteigender Häufigkeit aufgeführt; hierbei gelten die folgenden Häufigkeitsangaben: «sehr häufig» (≥1/10), «häufig» (≥1/100, <1/10), «gelegentlich» (≥1/1000, <1/100), «selten» (≥1/10'000, <1/1000), «sehr selten» (<1/10'000).
Tabelle 1 – Unerwünschte Wirkungen bei mit Alirocumab in gepoolten kontrollierten Phase-III-Studien behandelten Patienten
Systemorganklasse | Häufig | Selten |
|---|---|---|
Erkrankungen des Immunsystems | Überempfindlichkeit, Hypersensitivitätsvaskulitis | |
Erkrankungen der Atemwege, des Brustraums und Mediastinums | Symptome im Bereich der oberen Atemwegea Rhinopharyngitis Bronchitis Sinusitis Husten | |
Allgemeine Beschwerden und Anomalien am Verabreichungsort | Reaktionen an der Injektionsstelleb | |
Durch den Eingriff bedingte Verletzungen, Vergiftungen und Komplikationen | Kontusionen | |
Erkrankungen der Skelettmuskulatur und systemische Erkrankungen | Myalgie Muskelkrämpfe Muskuloskelettale Schmerzen | |
Erkrankungen der Haut und des Unterhautzellgewebes | Pruritus | Urtikaria, nummuläres Ekzem |
Erkrankungen des Gastrointestinaltrakts | Durchfall | |
Erkrankungen der Nieren und der Harnwege | Harnwegsinfektionen |
a Einschliesslich Schmerzen im Oropharynx, Rhinorrhoe, Niesen.
b Einschliesslich Erythem/Rötung, Juckreiz, Schwellung, Schmerzen/Empfindlichkeit.
Die Häufigkeitsangaben zu unerwünschten Wirkungen in Tabelle 1 entsprechen den Daten der gepoolten kontrollierten klinischen Phase-III-Studien sowie der Studie ODYSSEY OUTCOMES.
Unerwünschte Wirkungen nach Markteinführung
Die Häufigkeit von Nebenwirkungen, die nach der Markteinführung beobachtet wurden, kann nicht bestimmt werden, da es sich um Spontanmeldungen handelte. Daher wird die Häufigkeit dieser Nebenwirkungen als «unbestimmt» bezeichnet.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Selten: grippeähnliche Beschwerden.
Erkrankungen der Haut und des Unterhautzellgewebes
Unbestimmte Häufigkeit: Angioödem.
Beschreibung ausgewählter unerwünschter Wirkungen
Lokale Reaktionen an der Injektionsstelle
Lokale Reaktionen an der Injektionsstelle einschliesslich Erythem/Rötung, Schwellung, Schmerzen und Hämatome wurden bei 6,1% der mit Alirocumab behandelten Patienten gegenüber 4,1% in der Kontrollgruppe berichtet. Die Abbruchrate aufgrund von lokalen Reaktionen an der Injektionsstelle war bei beiden Gruppen vergleichbar (0,2% in der Alirocumab-Gruppe versus 0,4% in der Kontrollgruppe). In der kardiovaskulären Endpunktstudie (ODYSSEY OUTCOMES) traten Reaktionen an der Injektionsstelle bei den mit Alirocumab behandelten Patienten ebenfalls häufiger auf als bei den Patienten, die Placebo erhielten (3,8% unter Alirocumab versus 2,1% unter Placebo).
Allgemeine allergische Reaktionen
Allgemeine allergische Reaktionen wurden häufiger in der Alirocumab-Gruppe als in der Kontrollgruppe berichtet. Der Prozentsatz der Patienten, die die Behandlung mit Praluent aufgrund allergischer Reaktionen abbrachen, war in der Praluent-Gruppe höher (0,6% gegenüber 0,2%). Darüber hinaus wurden in kontrollierten klinischen Studien seltene und manchmal schwerwiegende allergische Reaktionen wie Überempfindlichkeit, nummeruläres Ekzem, Urtikaria und Hypersensitivitätsvaskulitis berichtet (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
In der kardiovaskulären Endpunktstudie (ODYSSEY OUTCOMES) traten allgemeine allergische Reaktionen bei den mit Alirocumab behandelten Patienten vergleichbar häufig auf wie bei den Patienten, die Placebo erhielten (7,9% unter Alirocumab versus 7,8% unter Placebo). Bei der Auftretenshäufigkeit von Pruritus war kein Unterschied festzustellen.
Studie zur Verabreichung alle 4 Wochen
Das Sicherheitsprofil bei den Patienten, die mit der Dosierung von 300 mg alle 4 Wochen (einmal monatlich) behandelt wurden, war vergleichbar wie im klinischen Studienprogramm für die Dosierung von 150 mg alle 2 Wochen beschrieben. Lokale Reaktionen an der Injektionsstelle wurden mit einer Häufigkeit von 16,6% in der Gruppe der mit 300 mg alle 4 Wochen behandelten Patienten und 7,9% in der Placebogruppe beobachtet. Die mit 300 mg alle 4 Wochen behandelten Patienten erhielten im Wechsel mit den Alirocumab-Spritzen jeweils eine Placebo-Injektion, um die Verblindung bezüglich der Injektionshäufigkeit aufrechtzuerhalten. Wenn man diejenigen Reaktionen an der Injektionsstelle ausklammert, die nach den Placeboinjektionen auftraten, beträgt die Häufigkeit solcher Reaktionen in der Behandlungsgruppe 11,8%. Die Rate vorzeitiger Therapieabbrüche aufgrund von lokalen Reaktionen an der Injektionsstelle betrug 0,7% in der Gruppe der mit 300 mg alle 4 Wochen behandelten Patienten und 0% in der Placebogruppe.
Niedrige LDL-C-Werte <0,65 mmol/l
Die Studien zu Alirocumab haben zwar keine unerwünschten Auswirkungen von sehr niedrigen LDL-Cholesterinwerten gezeigt, doch die Langzeitfolgen solcher Werte sind nicht bekannt. In Publikationen von genetischen sowie klinischen Studien und Beobachtungsstudien zu lipidsenkenden Therapien sind niedrigere LDL-C-Werte mit einem erhöhten Risiko, an Diabetes zu erkranken, in Zusammenhang gebracht worden.
In kontrollierten Studien zur Verabreichung alle 2 Wochen hatten 796 von 3 340 (23,8%) mit Praluent behandelten Patienten zwei aufeinanderfolgende LDL-C-Werte <0,65 mmol/l, darunter 288 von 3 340 (8,6%) mit Praluent behandelten Patienten mit zwei aufeinanderfolgenden Werten <0,39 mmol/l. Dies kam hauptsächlich vor, wenn Patienten, unabhängig vom LDL-C-Ausgangswert oder dem Ansprechen auf die Behandlung, 150 mg Praluent alle zwei Wochen als Anfangs- und Erhaltungsdosis erhielten.
In der Studie zur Beurteilung der 4-wöchentlichen Anwendung hatten 113 (24,7%) der 458 Patienten, die mit 300 mg alle 4 Wochen/150 mg alle 2 Wochen behandelt wurden, zweimal nacheinander berechnete LDL-C-Werte von <0,65 mmol/l, und 45 (9,8%) der 458 Patienten hatten zwei aufeinanderfolgende berechnete LDL-C-Werte von <0,39 mmol/l.
Es wurden keine speziellen Nebenwirkungen im Zusammenhang mit diesen LDL-C-Werten festgestellt.
Immunogenität/Anti-Drug-Antikörper (ADA)
Wie bei allen therapeutischen Proteinen besteht ein Immunogenitätsrisiko. In der Studie ODYSSEY OUTCOMES traten bei 5,5% der mit Alirocumab in einer Dosierung von 75 mg und/oder 150 mg alle 2 Wochen behandelten Patienten nach Behandlungsbeginn Antikörper gegen den Wirkstoff (ADA; Anti-Drug-Antibodies) auf, im Vergleich zu 1,6% der Patienten, die Placebo erhielten; der Grossteil dieser Immunreaktionen war vorübergehender Natur.
Persistierende ADA traten bei 0,7% der Patienten unter Alirocumab und 0,4% der Patienten unter Placebo auf. Neutralisierende Antikörper (NAb) traten bei 0,5% der Patienten unter Alirocumab und 0,1% der Patienten unter Placebo auf.
Die Antikörper gegen den Wirkstoff (einschliesslich NAb) lagen in geringen Titern vor und schienen keine klinisch bedeutsamen Auswirkungen auf die Wirksamkeit oder Sicherheit von Alirocumab zu haben, abgesehen von einer erhöhten Rate von Reaktionen an der Injektionsstelle bei den Patienten mit unter der Therapie aufgetretenen ADA im Vergleich zu den Patienten ohne ADA (7,5% versus 3,6%). Die langfristigen Folgen einer Fortführung der Behandlung mit Alirocumab bei Vorliegen von ADA sind nicht bekannt.
In einem Pool von zehn placebo- oder aktiv kontrollierten Studien zu Alirocumab 75 mg und/oder 150 mg alle zwei Wochen sowie einer separaten klinischen Studie zu Alirocumab 75 mg alle zwei Wochen oder 300 mg alle vier Wochen (mit einer Dosisanpassung auf 150 mg alle zwei Wochen bei bestimmten Patienten) war die Nachweishäufigkeit von ADA und NAb vergleichbar mit den weiter oben wiedergegebenen Werten in der Studie ODYSSEY OUTCOMES.
Daten zur Immunogenität sind weitgehend abhängig von der Sensitivität und Spezifität des Tests sowie anderen Faktoren. Darüber hinaus kann das in einem Test beobachtete Auftreten positiver Antikörper von mehreren Faktoren beeinflusst werden. Dazu zählen insbesondere die Handhabung der Probe, der Zeitpunkt der Probenentnahme, die Begleitmedikation und die zugrundeliegende Erkrankung. Aus diesen Gründen kann der Vergleich der Inzidenz von Antikörpern gegen Alirocumab mit der Inzidenz von Antikörpern gegen andere Arzneimittel irreführend sein.
Neurokognitive Ereignisse
Gelegentlich kam es zum Auftreten von neurokognitiven Ereignissen. In kontrollierten klinischen Studien wurden neurokognitive Ereignisse bei 0,9% der mit Alirocumab behandelten Patienten und 0,7% der mit Placebo behandelten Patienten berichtet. Verwirrung oder Gedächtnisstörungen wurden häufiger in der Alirocumab-Gruppe (0,2%) als in der Placebo-Gruppe (<0,1%) beobachtet.
Veränderung der Leberenzymwerte
Leberfunktionsstörungen (hauptsächlich in Zusammenhang mit den Leberenzymen) wurden bei 2,5% der mit Alirocumab behandelten Patienten und 1,8% der mit Placebo behandelten Patienten beobachtet. Aufgrund dieser Leberfunktionsstörungen brachen 0,4% der mit Praluent behandelten Patienten im Vergleich zu 0,2% der Patienten unter Placebo die Behandlung ab. Eine Erhöhung der Serumtransaminasen auf mehr als das Dreifache der oberen Grenze des Normalwertes wurde bei 1,7% der Patienten unter Alirocumab und bei 1,4% der Patienten unter Placebo beobachtet.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Bislang wurden keine Fälle von Überdosierung berichtet.
Eigenschaften/Wirkungen
ATC-Code
C10AX14
Wirkmechanismus:
Alirocumab ist ein vollständig humaner monoklonaler Antikörper, der mit hoher Affinität und Spezifität an Proproteinkonvertase Subtilisin Kexin Typ 9 (PCSK9) bindet. PCSK9 bindet an die Low-Density-Lipoprotein-Rezeptoren (LDLR) auf der Oberfläche von Hepatozyten, um den LDLR-Abbau in der Leber zu fördern. LDLR ist der primäre Rezeptor, der zirkulierendes LDL beseitigt. Dadurch führt die Senkung der Anzahl von LDLR durch PCSK9 zu höheren LDL-C-Spiegeln im Blut. Indem es die Bindung von PCSK9 an LDLR hemmt, erhöht Alirocumab die Anzahl der zur Beseitigung von LDL verfügbaren LDLR und führt dadurch zu einer Senkung der LDL-C-Spiegel.
Pharmakodynamik
Alirocumab ist ein vollständig humaner monoklonaler Antikörper, der in in-vitro-Versuchen wie auch in in-vivo-Modellsystemen die Aktivität von PCSK9 hemmt. In zahlreichen Studien am Tier und am Menschen wurde die zentrale Rolle belegt, die hohe LDL-C-Werte bei der Auslösung und beim Fortschreiten von Atherosklerose spielen.
Klinische Wirksamkeit
Die Mehrzahl der Patienten in dem Phase-III-Programm nahm eine lipidmodifizierende Hintergrundtherapie ein, die aus einer maximal verträglichen Dosis von Statinen mit oder ohne weitere lipidmodifizierende Therapien bestand, und wies ein hohes bzw. sehr hohes kardiovaskuläres Risiko (KV-Risiko) auf.
Klinische Wirksamkeit bei Patienten mit atherosklerotischer kardiovaskulärer Erkrankung (ASCVD)
Zusammenfassung der Phase-III-Studien zur Anwendung von 75 mg und/oder 150 mg alle 2 Wochen
Die Wirksamkeit von Praluent wurde in fünf placebokontrollierten Doppelblindstudien bei 3 499 Patienten untersucht; 54% wiesen keine familiäre Hypercholesterinämie auf, sondern litten unter einer diagnostizierten atherosklerotischen kardiovaskulären Erkrankung. Alle Patienten erhielten ein Statin in der maximal verträglichen Dosis mit oder ohne weitere lipidmodifizierende Therapien. Die Dauer der Studien betrug mindestens 52 Wochen. Der primäre Wirksamkeitsendpunkt war die mittlere prozentuale LDL-C-Senkung gegenüber dem Ausgangswert nach 24 Wochen.
Drei Studien wurden mit einer Anfangsdosis von 75 mg alle 2 Wochen und einer Auftitration in Woche 12 auf 150 mg alle 2 Wochen bei Patienten, die ihre vordefinierten LDL-C-Zielwerte in Woche 8 nicht erreichten, durchgeführt. Die meisten Patienten (57% bis 83%) benötigten nach 12 Wochen Behandlung keine Auftitration. Zwei Studien wurden ausschliesslich mit einer Dosis von 150 mg alle 2 Wochen durchgeführt.
Studie 1 war eine multizentrische, placebokontrollierte Doppelblindstudie, in der die Patienten randomisiert entweder 150 mg Praluent alle 2 Wochen (1 553 Patienten) oder Placebo (788 Patienten) erhielten. Alle Patienten nahmen Statine in der maximal verträglichen Dosis mit oder ohne weitere lipidmodifizierende Therapien ein und es war bei ihnen eine stärkere Senkung der LDL-C-Werte erforderlich. Das Durchschnittsalter betrug 61 Jahre (Spanne: 18–89 Jahre), 38% waren Frauen, 93% kaukasischer Herkunft, 3% afrikanischer Herkunft und 5% hispanischer/lateinamerikanischer Herkunft. Insgesamt wiesen 69% der Patienten keine familiäre Hypercholesterinämie auf, litten aber unter einer nachgewiesenen kardiovaskulären Erkrankung, 18% hatten eine HeFH. Der durchschnittliche LDL-C-Ausgangswert lag bei 3,16 mmol/l.
Der Prozentsatz der Patienten, die die Studienmedikation vor Woche 24 (Beurteilung des Wirksamkeitsendpunktes) vorzeitig beendeten, betrug 8% bei den Praluent- und 8% bei den Placebo-Patienten.
In Woche 24 betrug die therapeutische Differenz zwischen der Praluent-Gruppe und der Placebo-Gruppe hinsichtlich der durchschnittlichen prozentualen Veränderung des LDL-C-Werts -58% (0,95% KI: -61%, -56%; p-Wert: <0,0001).
Detaillierte Ergebnisse siehe Tabelle 2.
Tabelle 2 - Mittlere prozentuale Veränderung der Lipidparameter gegenüber den Ausgangswerten und Unterschieda gegenüber Placebo in Woche 24 der Studie 1b (ITT-Population)
Behandlungsgruppe | LDL-C | Total-C | Non-HDL-C | Apo B |
|---|---|---|---|---|
Woche 24 (durchschnittliche prozentuale Veränderung gegenüber den Ausgangswerten) | ||||
Placebo | 1 | 0 | 1 | 1 |
Praluent (150 mg) | -58 | -36 | -49 | -50 |
Unterschied (Durchschnitt mithilfe der Methode der kleinsten Quadrate) gegenüber Placebo (95% KI): | -58 (-61, -56) | -36 (-37, -34) | -50 (-52, -47) | -51 (-53, -48) |
a Differenz = Praluent minus Placebo b Es wurde der Ansatz über das Schema-Mischmodell gewählt. Dabei erfolgten eine multiple Imputation für die fehlenden Postbehandlungswerte auf der Grundlage des jeweiligen Ausgangswerts der Patienten und eine multiple Imputation der fehlenden Werte während der Therapie auf der Basis eines Modells, das die verfügbaren Werte während der Behandlung mit einbezog. | ||||
Studie 2 war eine multizentrische, placebokontrollierte Doppelblindstudie, in der die Patienten randomisiert entweder Praluent (209 Patienten) oder Placebo (107 Patienten) erhielten. Die Patienten nahmen Statine in der maximal verträglichen Dosis mit oder ohne weitere lipidmodifizierende Therapien ein und es war bei ihnen eine stärkere Senkung der LDL-C-Werte erforderlich.
Das Durchschnittsalter betrug 63 Jahre (Spanne: 39–87 Jahre), 34% waren Frauen, 82% kaukasischer Herkunft, 16% afrikanischer Herkunft und 11% hispanischer/lateinamerikanischer Herkunft. Insgesamt litten 84% unter einer nachgewiesenen kardiovaskulären Erkrankung. Der durchschnittliche LDL-C-Ausgangswert lag bei 2,64 mmol/l.
Der Prozentsatz der Patienten, die die Studienmedikation vor Woche 24 (Beurteilung des Wirksamkeitsendpunktes) vorzeitig beendeten, betrug 11% bei den Praluent- und 12% bei den Placebo-Patienten.
In Woche 12 betrug die durchschnittliche prozentuale Veränderung gegenüber dem LDL-C-Ausgangswert -45% unter Praluent gegenüber 1% unter Placebo. Die therapeutische Differenz zwischen Praluent 75 mg alle 2 Wochen und Placebo hinsichtlich der durchschnittlichen prozentualen Veränderung des LDL-C-Werts lag bei -46% (95% KI: -53%, -39%).
In Woche 12 wurde die Praluent-Dosis, wenn mit Bezug auf die vorab festgelegten Kriterien eine zusätzliche LDL-C-Senkung erforderlich war, für den restlichen Studienzeitraum auf 150 mg alle 2 Wochen auftitriert. In Woche 24 betrug die durchschnittliche prozentuale Veränderung gegenüber dem LDL-C-Ausgangswert -44% unter Praluent gegenüber -2% unter Placebo. Die therapeutische Differenz zwischen Praluent 75 mg alle 2 Wochen und Placebo hinsichtlich der durchschnittlichen prozentualen Veränderung des LDL-C-Werts lag bei -43% (95% KI: -50%, -35%; p-Wert: <0,0001). Bei 32 der 191 Patienten (17%), die mindestens über 12 Wochen mit Praluent behandelt waren, wurde die Dosis auf 150 mg alle 2 Wochen auftitriert.
Klinische Wirksamkeit bei schwerer heterozygoter familiärer Hypercholesterinämie
Die Studien 3 und 4 waren multizentrische, placebokontrollierte Doppelblindstudien, in denen alle Patienten randomisiert Praluent (490 Patienten) oder Placebo (245 Patienten) erhielten. Die Studien waren hinsichtlich des Versuchsprotokolls und der Auswahlkriterien vergleichbar. Alle Patienten litten unter HeFH, nahmen Statine in der maximal verträglichen Dosis mit oder ohne weitere lipidmodifizierende Therapien ein und bei allen Patienten war eine stärkere Senkung der LDL-C-Werte erforderlich. Das Durchschnittsalter betrug 52 Jahre (Spanne: 20–87 Jahre), 45% waren Frauen, 94% kaukasischer Herkunft, 1% afrikanischer Herkunft und 3% hispanischer/lateinamerikanischer Herkunft. Insgesamt wiesen 45% der HeFH-Patienten auch eine manifeste kardiovaskuläre Erkrankung auf. Der durchschnittliche LDL-C-Ausgangswert lag bei 3,65 mmol/l.
In beiden Studien zusammen betrug der Prozentsatz der Patienten, die die Studienmedikation vor Woche 24 (Beurteilung des Wirksamkeitsendpunktes) vorzeitig beendeten, 6% bei den Praluent- und 4% bei den Placebo-Patienten.
In Woche 12 betrug die therapeutische Differenz zwischen der Gruppe, die Praluent 75 mg alle 2 Wochen erhielt, und der Placebo-Gruppe hinsichtlich der durchschnittlichen prozentualen Veränderung des LDL-C-Werts -48% (0,95% KI: -52%, -44%).
In Woche 12 wurde die Praluent-Dosis, wenn mit Bezug auf die vorab festgelegten Kriterien eine weitere LDL-C-Senkung erforderlich war, für den restlichen Studienzeitraum auf 150 mg alle 2 Wochen auftitriert. In Woche 24 betrug die mittlere therapeutische Differenz zwischen der Praluent-Gruppe und der Placebo-Gruppe hinsichtlich der durchschnittlichen prozentualen Änderung des LDL-C-Werts -54% (0,95% KI: -59%, -50%; p-Wert: <0,0001). Bei 196 der 469 Patienten (42%), die mindestens über 12 Wochen mit Praluent behandelt waren, wurde die Dosis auf 150 mg alle 2 Wochen auftitriert. Die LDL-C-senkende Wirkung wurde bis Woche 52 aufrechterhalten.
Detaillierte Ergebnisse siehe Tabelle 3.
Tabelle 3 - Mittlere prozentuale Veränderung der Lipidparameter gegenüber den Ausgangswerten und Unterschieda gegenüber Placebo in den Wochen 12 und 24 bei Patienten mit HeFH (Studien 3 und 4 gruppiert)b (ITT-Population)
Behandlungsgruppe | LDL-C | Total-C | Non-HDL-C | Apo B |
|---|---|---|---|---|
Woche 12 (durchschnittliche prozentuale Veränderung gegenüber den Ausgangswerten) | ||||
Placebo | 5 | 4 | 5 | 2 |
Praluent 75 mg | -43 | -27 | -38 | -34 |
Unterschied (Durchschnitt mithilfe der Methode der kleinsten Quadrate) gegenüber Placebo (95% KI) | -48 (-52, -44) | -31 (-34, -28) | -42 (-46, -39) | -36 (-39, -33) |
Woche 24 (durchschnittliche prozentuale Veränderung gegenüber den Ausgangswerten) | ||||
Placebo | 7 | 5 | 7 | 2 |
Praluent (75 mg, auftitriert auf 150 mgc) | -47 | -30 | -42 | -40 |
Unterschied (Durchschnitt mithilfe der Methode der kleinsten Quadrate) gegenüber Placebo (95% KI) | -54 (-59, -50) | -36 (-39, -33) | -49 (-53, -45) | -42 (-45, -39) |
a Differenz = Praluent minus Placebo b Es wurde der Ansatz über das Schema-Mischmodell gewählt. Dabei erfolgten eine multiple Imputation für die fehlenden Postbehandlungswerte auf der Grundlage des jeweiligen Ausgangswerts der Patienten und eine multiple Imputation der fehlenden Werte während der Therapie auf der Basis eines Modells, das die verfügbaren Werte während der Behandlung mit einbezog. c Bei 196 (42%) der 469 Patienten, die mindestens über 12 Wochen mit Praluent behandelt waren, wurde die Dosis auf 150 mg alle 2 Wochen auftitriert. Die LDL-C-senkende Wirkung wurde bis Woche 52 aufrechterhalten. | ||||
Studie 5 war eine multizentrische, placebokontrollierte Doppelblindstudie, in der die Patienten randomisiert entweder 150 mg Praluent alle 2 Wochen (72 Patienten) oder Placebo (35 Patienten) erhielten. Die Patienten litten unter HeFH und ihr LDL-C-Ausgangswert lag trotz der Einnahme eines Statins in der maximal verträglichen Dosis mit oder ohne weitere lipidmodifizierende Therapien über 4,14 mmol/l. Das Durchschnittsalter betrug 51 Jahre (Spanne: 18–80 Jahre), 47% waren Frauen, 88% kaukasischer Herkunft, 2% afrikanischer Herkunft und 6% hispanischer/lateinamerikanischer Herkunft. Insgesamt litten 50% unter einer manifesten kardiovaskulären Erkrankung. Der durchschnittliche LDL-C-Ausgangswert lag bei 5,13 mmol/l.
Der Prozentsatz der Patienten, die die Studienmedikation vor Woche 24 (Beurteilung des Wirksamkeitsendpunktes) vorzeitig beendeten, betrug 10% bei den Praluent- und 0% bei den Placebo-Patienten.
In Woche 24 betrug die durchschnittliche prozentuale Veränderung gegenüber dem LDL-C-Ausgangswert -43% unter Praluent gegenüber ‑7% unter Placebo. Die therapeutische Differenz zwischen Praluent und Placebo hinsichtlich der durchschnittlichen prozentualen Veränderung des LDL-‑C-Werts lag bei -36% (95% KI: -49%, -24%; p-Wert: <0,0001).
Zusammenfassung der Phase- III-Studien zur Anwendung alle 4 Wochen
Studie CHOICE I
Multizentrische, placebokontrollierte Doppelblindstudie über einen Zeitraum von 48 Wochen bei 540 Patienten, die ein Statin in der höchsten verträglichen Dosis und begleitend dazu zum Teil einen weiteren Lipidsenker erhielten (308 Teilnehmer in der mit 300 mg Alirocumab alle 4 Wochen und 76 in der mit 75 mg alle 2 Wochen behandelten Gruppe sowie 156 in der Placebogruppe), sowie 252 Patienten, die kein Statin erhielten (davon 144 in der mit 300 mg Alirocumab einmal alle 4 Wochen und 37 in der mit 75 mg einmal alle 2 Wochen behandelten Gruppe sowie 71 in der Placebogruppe). Die Patienten erhielten entweder Alirocumab in einer Dosierung von 300 mg einmal alle 4 Wochen oder 75 mg einmal alle 2 Wochen oder Placebo, jeweils zusätzlich zu ihrer bestehenden lipidsenkenden Therapie (Statin, sonstiger Lipidsenker oder nur Diät). Der Anteil der Patienten, deren kardiovaskuläres Risiko als hoch oder sehr hoch eingestuft wurde und die ihr LDL-C-Ziel nicht erreichten, betrug insgesamt 71,6%. In den Alirocumab-Behandlungsgruppen wurde in Woche 12 die Dosis auf 150 mg alle 2 Wochen angepasst, wenn der LDL-C-Spiegel ≥1,81 mmol/l bzw. ≥2,59 mmol/l mg/dl betrug (je nach kardiovaskulärer Risikokategorie) oder wenn der LDL-C-Spiegel gegenüber dem Ausgangswert um weniger als 30% zurückgegangen war.
In der Kohorte der Patienten unter Statin-Basistherapie betrug der mittlere LDL-C-Wert zu Studienbeginn 2,91 mmol/l. In Woche 12 belief sich die mittlere prozentuale Veränderung des LDL-C-Werts (ITT-Analyse) gegenüber Studienbeginn auf -55,3% unter Alirocumab 300 mg einmal alle 4 Wochen, verglichen mit +1,1% unter Placebo. In Woche 12 (vor der Dosisanpassung) hatten 77,3% der Patienten, die mit 300 mg Alirocumab alle 4 Wochen behandelt wurden, einen LDL-C-Wert <1,81 mmol/l erreicht, verglichen mit 9,3% der Patienten aus der Placebogruppe. In Woche 24 belief sich die mittlere prozentuale Veränderung des LDL-C-Werts (ITT-Analyse) gegenüber Studienbeginn auf -58,8% unter Alirocumab 300 mg einmal alle 4 Wochen/150 mg alle 2 Wochen, verglichen mit -0,1% unter Placebo. Der mittlere Unterschied zwischen den Behandlungsgruppen im Hinblick auf die Veränderung des LDL-C-Werts von Studienbeginn bis Woche 24 betrug -58,7% für Alirocumab 300 mg einmal alle 4 Wochen/150 mg alle 2 Wochen (97,5-%-KI: -65,0%, -52,4%; p <0,0001). Von den Patienten, die länger als 12 Wochen behandelt werden, wurde die Dosis bei 56 (19,3%) der 290 mit 300 mg einmal alle 4 Wochen behandelten Patienten auf 150 mg einmal alle 2 Wochen geändert. In der Untergruppe der Patienten, deren Dosis in Woche 12 auf 150 mg einmal alle 2 Wochen geändert wurde, war in Woche 24 eine weitere LDL-C-Senkung um 25,4% zu verzeichnen.
In der Kohorte der Patienten, die nicht begleitend Statine einnahmen, betrug der mittlere LDL-C-Wert zu Studienbeginn 3,67 mmol/l. In Woche 12 belief sich die mittlere prozentuale Veränderung des LDL-C-Werts (ITT-Analyse) gegenüber Studienbeginn auf -58,4% unter Alirocumab 300 mg einmal alle 4 Wochen, verglichen mit +0,3% unter Placebo. In Woche 12 (vor der Dosisanpassung) hatten 65,2% der Patienten, die mit 300 mg Alirocumab alle 4 Wochen behandelt wurden, einen LDL-C-Wert <70 mg/dl erreicht, verglichen mit 2,8% der Patienten aus der Placebogruppe. In Woche 24 belief sich die mittlere prozentuale Veränderung des LDL-C-Werts (ITT-Analyse) gegenüber Studienbeginn auf -52,7% unter Alirocumab 300 mg einmal alle 4 Wochen/150 mg alle 2 Wochen, verglichen mit -0,3% unter Placebo. Der mittlere Unterschied zwischen den Behandlungsgruppen (Alirocumab 300 mg einmal alle 4 Wochen/150 mg alle 2 Wochen versus Placebo) im Hinblick auf die Veränderung des LDL-C-Werts von Studienbeginn bis Woche 24 betrug -52,4% (97,5-%-KI: -59,8%, -45,0%; p <0,0001). Von den Patienten, die länger als 12 Wochen behandelt werden, wurde die Dosis bei 19 (14,7%) der 129 mit 300 mg einmal alle 4 Wochen behandelten Patienten auf 150 mg einmal alle 2 Wochen geändert. In der Untergruppe der Patienten, deren Dosis in Woche 12 auf 150 mg einmal alle 2 Wochen geändert wurde, war in Woche 24 eine weitere LDL-C-Senkung um 7,3% zu verzeichnen.
Studie ODYSSEY OUTCOMES
Multizentrische placebokontrollierte doppelblinde Studie bei 18 924 Erwachsenen mit erhöhtem kardiovaskulärem Risiko (9462 erhielten Alirocumab und 9462 Placebo). Die mediane Nachbeobachtungsdauer betrug 33 Monate (2,8 Jahre). Alle Patienten erhielten nach Randomisierung im Verhältnis 1:1 entweder Alirocumab 75 mg oder Placebo alle zwei Wochen. Im zweiten Monat wurde bei denjenigen Patienten, deren Dosis auf 150 mg alle zwei Wochen angepasst worden war und die bei zwei aufeinanderfolgenden Messungen einen LDL-C-Wert unter 0,65 mmol/l (25 mg/dl) hatten, die Dosis von 150 mg alle zwei Wochen auf 75 mg alle zwei Wochen gesenkt. Diejenigen Patienten, die 75 mg alle zwei Wochen erhielten und die bei zwei aufeinanderfolgenden Messungen einen LDL-C-Wert unter 0,39 mmol/l (15 mg/dl) hatten, wurden verblindet auf Placebo umgestellt und weiterhin in der Alirocumab-Gruppe untersucht. Von 9451 Patienten unter Alirocumab wurde bei etwa 2615 (27,7%) die Dosis auf 150 mg alle zwei Wochen angepasst. Von diesen 2615 Patienten wurden nachfolgend 805 (30,8%) auf eine Dosis von 75 mg alle zwei Wochen umgestellt. Insgesamt 730 von 9451 Patienten (7,7%) wurden verblindet auf Placebo umgestellt und weiterhin in der Alirocumab-Gruppe untersucht. Eine Unterbrechung der Behandlung erfolgte bei 14,2% der Patienten in der Alirocumab-Gruppe und 15,8% in der Placebogruppe. Insgesamt wurden 99,5% aller Patienten bezüglich des Überlebens bis zum Ende der Studie nachbeobachtet.
Das erste ACS-Ereignis war bei 83,2% der Patienten ein Myokardinfarkt (34,6% STEMI, 48,6% NSTEMI) und bei 16,8% der Patienten eine instabile Angina pectoris.
Alirocumab bewirkte eine signifikante Verminderung des Risikos für den primären kombinierten Endpunkt (bestehend aus Tod durch koronare Herzkrankheit, nicht-tödlichem Myokardinfarkt, tödlichem oder nicht-tödlichem ischämischem Schlaganfall oder instabiler Angina pectoris mit erforderlicher Hospitalisierung). Signifikante Senkungen waren bei individuellen Komponenten des primären Endpunkts (nicht-tödlicher Myokardinfarkt, tödlicher oder nicht-tödlicher ischämischer Schlaganfall sowie instabile Angina pectoris mit erforderlicher Hospitalisierung) ausser bei dem durch koronare Herzkrankheit bedingten Tod zu verzeichnen (siehe Tabelle 4).
Tabelle 4 – Wirksamkeit von Alirocumab in der Studie ODYSSEY OUTCOMES (Gesamtpopulation)
Alirocumab (N = 9462) n (%) | Placebo (N = 9462) n (%) | Hazard Ratio (95-%-KI)a | p-Wertb | |
|---|---|---|---|---|
Primärer Endpunkt: kombinierter Endpunkt aus Tod durch koronare Herzkrankheit, nicht-tödlichem Myokardinfarkt, tödlichem oder nicht-tödlichem ischämischem Schlaganfall sowie instabiler Angina pectoris mit erforderlicher Hospitalisierung | 903 (9,5) | 1052 (11,1) | 0,85 (0,78–0,93) | 0,0003 |
Tod durch koronare Herzkrankheit | 205 (2,2) | 222 (2,3) | 0,92 (0,76–1,11) | 0,38 |
Nicht-tödlicher Myokardinfarkt | 626 (6,6) | 722 (7,6) | 0,86 (0,77–0,96) | 0,006c |
Ischämischer Schlaganfall (tödlich oder nicht-tödlich) | 111 (1,2) | 152 (1,6) | 0,73 (0,57–0,93) | 0,01c |
Instabile Angina pectoris mit erforderlicher Hospitalisierung | 37 (0,4) | 60 (0,6) | 0,61 (0,41–0,92) | 0,02c |
Gesamtmortalität | 334 (3,5) | 392 (4,1) | 0,85 (0,73–0,98) | 0,0261 c |
a Auf der Grundlage eines Cox-Modells
b Zweiseitiger Log-Rank-Test
c Nominale Signifikanz
Pharmakokinetik
Absorption
Nach subkutaner Applikation von 50 mg bis 300 mg Alirocumab betrugen die mittleren Zeiten bis zur maximalen Serumkonzentration (tmax) 3 bis 7 Tage. Die Pharmakokinetik von Alirocumab nach einmaliger subkutaner Applikation von 75 mg in Bauch, Oberarm oder Oberschenkel war vergleichbar. Die absolute Bioverfügbarkeit von Alirocumab nach subkutaner Applikation betrug etwa 85 %, ermittelt durch eine populationspharmakokinetische Analyse.
Nach der Applikation von 75 mg und 150 mg wurde der Steady State nach 2 bis 3 Dosen mit einem Akkumulationsverhältnis von etwa dem Zweifachen erreicht.
Die monatliche Gesamtexposition war unter der Behandlung mit 300 mg alle 4 Wochen war vergleichbar mit der unter 150 mg alle 2 Wochen. Die Schwankungen bei der Cmax und der Restkonzentration waren beim vierwöchentlichen Dosisschema grösser. Der Gleichgewichtszustand wurde nach 2 bis 3 Dosen erreicht, mit einem Akkumulationsverhältnis von maximal dem Zweifachen.
Distribution
Nach intravenöser Applikation betrug das Verteilungsvolumen etwa 0,04 bis 0,05 l/kg, was darauf hinweist, dass Alirocumab hauptsächlich im Blutkreislauf verteilt wird.
Metabolismus
Spezifische Stoffwechselstudien wurden nicht durchgeführt, da Alirocumab ein Protein ist. Erwartungsgemäss wird Alirocumab in kleine Peptide und einzelne Aminosäuren abgebaut.
Elimination
Es wurden zwei Eliminationsphasen für Alirocumab beobachtet. Bei niedrigen Konzentrationen erfolgt die Elimination überwiegend durch sättigbare Bindung an das Zielmolekül (PCSK9), während bei höheren Konzentrationen die Elimination von Alirocumab weitgehend über einen nicht sättigbaren proteolytischen Abbau erfolgt.
Basierend auf einer populationspharmakokinetischen Analyse betrug die mittlere scheinbare Halbwertszeit von Alirocumab im Steady State bei Patienten, die Alirocumab als Monotherapie in subkutanen Dosen von 75 mg alle 2 Wochen oder 150 mg alle 2 Wochen erhielten, 17 bis 20 Tage. Bei Gabe in Kombination mit einem Statin betrug die mittlere scheinbare Halbwertszeit von Alirocumab 12 Tage.
Linearität/Nicht-Linearität
Bei einer Verdoppelung der Dosis von 75 mg auf 150 mg alle 2 Wochen wurde mit einem 2,1- bis 2,7-fachen Anstieg der Gesamtkonzentrationen von Alirocumab ein etwas mehr als dosisproportionaler Anstieg beobachtet.
Kinetik spezieller Patientengruppen
Körpergewicht
Eine populationspharmakokinetische Analyse zeigte, dass das Körpergewicht einen leichten Einfluss auf die Alirocumab-Exposition hat, wahrscheinlich ohne Auswirkungen auf Wirksamkeit und Sicherheit. Die Alirocumab-Exposition (AUC0-14T) im Steady State war bei Patienten, die über 100 kg wogen, verglichen mit Patienten, die zwischen 50 kg und 100 kg wogen, bei Dosierungen von 75 und 150 mg alle zwei Wochen um 29% bzw. 36% verringert.
Pharmakokinetische/pharmakodynamische Zusammenhänge
Die pharmakodynamische Wirkung von Alirocumab, nämlich die Senkung von LDL-C, ist indirekt und wird durch die Bindung an PCSK9 vermittelt. Eine konzentrationsabhängige Reduktion von freiem PCSK9 und LDL-C wird beobachtet, bis eine Zielsättigung erreicht ist. Nach Sättigung der PCSK9-Bindung führt eine weitere Erhöhung der Alirocumab-Konzentrationen zu keiner weiteren LDL-C-Reduktion. Es wird jedoch eine verlängerte Dauer der LDL-C-senkenden Wirkung beobachtet.
Leberfunktionsstörungen
In einer Phase-I-Studie war die Alirocumab-Exposition bei Probanden mit einer leicht oder mässig eingeschränkten Leberfunktion nach subkutaner Injektion einer Einzeldosis von 75 mg gegenüber Probanden mit normaler Leberfunktion etwas geringer. Es liegen keine Daten für Patienten mit einer stark eingeschränkten Leberfunktion vor.
Nierenfunktionsstörungen
Da monoklonale Antikörper bekanntermassen nicht über die Nieren ausgeschieden werden, ist nicht zu erwarten, dass die Nierenfunktion die Pharmakokinetik von Alirocumab beeinflusst. Populationspharmakokinetische Analysen deuten darauf hin, dass eine leicht oder mässig eingeschränkte Nierenfunktion wahrscheinlich keinen relevanten Einfluss auf die Pharmakokinetik von Alirocumab hat. Es liegen keine Daten für Patienten mit einer stark eingeschränkten Nierenfunktion vor.
Ältere Patienten
Basierend auf einer populationspharmakokinetischen Analyse ging das Alter mit einem kleinen Unterschied bei der Alirocumab-Exposition im Steady State einher, wahrscheinlich ohne Einfluss auf die Wirksamkeit oder Sicherheit. Die Alirocumab-Exposition im Steady State (AUC0-14T) bei Dosierungen von 75 mg und 150 mg alle 2 Wochen war bei Patienten über 75 Jahren im Vergleich zu Patienten unter 65 Jahren um 10% bis 36% erhöht.
Genetische Polymorphismen
Basierend auf einer populationspharmakokinetischen Analyse hatte die ethnische Zugehörigkeit keinen Einfluss auf die Pharmakokinetik von Alirocumab. Nach subkutaner Applikation einer Einzeldosis von 100 mg bis 300 mg Alirocumab gab es keinen relevanten Unterschied hinsichtlich der Exposition bei japanischen und weissen Probanden.
Basierend auf einer populationspharmakokinetischen Analyse hatte das Geschlecht keinen Einfluss auf die Pharmakokinetik von Alirocumab.
Präklinische Daten
Basierend auf den Beurteilungen zur Sicherheitspharmakologie, zur Toxizität nach wiederholter Gabe und zur Reproduktions- und Entwicklungstoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Mutagenität
Es wurden keine Studien hinsichtlich Genotoxizität und Mutagenizität durchgeführt.
Karzinogenität
Es wurden keine Studien hinsichtlich Karzinogenizität durchgeführt.
Reproduktionstoxizität
Studien zur Reproduktionstoxizität bei Ratten und Affen deuteten darauf hin, dass Alirocumab, wie andere IgG-Antikörper, die Plazentaschranke überwindet.
Bei Affen gab es keine schädlichen Auswirkungen auf Surrogatmarker der Fertilität (zum Beispiel Östrus-Zyklizität, Hodenvolumen, Ejakulatvolumen, Spermienbeweglichkeit oder Gesamtspermienzahl pro Ejakulat) und in allen bei Ratten oder Affen durchgeführten Toxizitätsstudien keinerlei Alirocumab-bedingte abnormale anatomische, pathologische oder histopathologische Befunde in reproduktiven Geweben.
Die Nachkommen der Affen, die während der gesamten Trächtigkeit einmal wöchentlich hohe Dosen von Alirocumab erhielten, zeigten eine schwächere sekundäre Immunantwort nach Antigenprovokation als die Nachkommen der Kontrolltiere. Bei den Nachkommen gab es keine anderen Hinweise auf eine Störung des Immunsystems.
Sonstige Hinweise
Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Praluent darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Arzneimittel ausserhalb der Reichweite von Kindern aufbewahren.
Im Kühlschrank lagern (2 °C bis 8 °C). Nicht einfrieren.
Praluent kann lichtgeschützt bis maximal 30 Tage ausserhalb des Kühlschranks bei Temperaturen von höchstens + 25 °C aufbewahrt werden. Nach der Entnahme aus dem Kühlschrank ist das Medikament innerhalb von 30 Tagen zu verwenden oder zu entsorgen.
Die Spritze oder den Pen im Original-Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Nicht hoher Hitze aussetzen.
Zulassungsnummer
65661, 65882 (Swissmedic)
Zulassungsinhaberin
sanofi-aventis (schweiz) sa, 1214 Vernier/GE
Stand der Information
Mai 2020
Composizione
Principi attivi
Alirocumab*.
Sostanze ausiliarie
Istidina, saccarosio, polisorbato 20 e acqua per preparazioni iniettabili.
*Alirocumab è un anticorpo monoclonale completamente umano (isotipo IgG1) che ha come target la proproteina convertasi subtilisina/kexina tipo 9 (PSCK 9). Alirocumab è prodotto mediante la tecnica del DNA ricombinante in una coltura in sospensione di cellule di ovaio di criceto cinese.
Forma farmaceutica e quantità di principio attivo per unità
Praluent 75 mg, soluzione iniettabile in siringa preriempita: ogni siringa preriempita monouso da 1 ml contiene 75 mg di alirocumab da somministrare per via sottocutanea.
Praluent 150 mg, soluzione iniettabile in siringa preriempita: ogni siringa preriempita monouso da 1 ml contiene 150 mg di alirocumab da somministrare per via sottocutanea.
Praluent 75 mg, soluzione iniettabile in penna preriempita: ogni penna preriempita monouso da 1 ml contiene 75 mg di alirocumab da somministrare per via sottocutanea.
Praluent 150 mg, soluzione iniettabile in penna preriempita: ogni penna preriempita monouso da 1 ml contiene 150 mg di alirocumab da somministrare per via sottocutanea.
Indicazioni/Possibilità d'impiego
Praluent è indicato in aggiunta alla dieta e all'assunzione di una statina alla dose massima tollerata, con o senza altro trattamento ipolipemizzante, in adulti affetti da ipercolesterolemia (compresa l'ipercolesterolemia familiare eterozigote) che richiede un'ulteriore riduzione del colesterolo con lipoproteine a bassa densità (C-LDL).
Praluent è indicato per ridurre il rischio di eventi cardiovascolari (infarto miocardico, ictus ischemico, angina instabile che richiede ricovero) nei pazienti con rischio cardiovascolare elevato.
Per gli effetti sulla mortalità cardiovascolare, vedere la rubrica «Proprietà/Effetti».
Posologia/Impiego
Posologia abituale
La dose iniziale raccomandata di Praluent è di 75 mg ogni 2 settimane. Il livello di C-LDL dovrebbe essere valutato dopo 4-8 settimane dall'inizio del trattamento.
Il dosaggio può essere modificato a 150 mg una volta ogni due settimane o a 300 mg una volta ogni 4 settimane.
Se è necessaria un'ulteriore riduzione di C-LDL in pazienti trattati con 300 mg ogni 4 settimane, la posologia può essere modificata fino a una dose massima di 150 mg una volta ogni due settimane.
Praluent è somministrato per via sottocutanea.
Per garantire la tracciabilità dei medicamenti biotecnologici, si raccomanda di prendere nota del nome commerciale e del numero di lotto in occasione di ogni trattamento.
Istruzioni posologiche speciali
Non è necessario alcun aggiustamento della posologia in base al peso corporeo del paziente (cfr. la rubrica «Farmacocinetica»).
Pazienti con patologie epatiche
Non sono necessari aggiustamenti della dose nei pazienti con insufficienza epatica lieve o moderata. Non sono disponibili dati nei pazienti con insufficienza epatica grave (cfr. la rubrica «Farmacocinetica»).
Pazienti con patologie renali
Non sono necessari aggiustamenti della dose nei pazienti con insufficienza renale lieve o moderata. Non sono disponibili dati nei pazienti con compromissione renale severa (cfr. la rubrica «Farmacocinetica»).
Pazienti anziani
Non sono necessari aggiustamenti della dose per i pazienti anziani (cfr. la rubrica «Farmacocinetica»).
Bambini e adolescenti
La sicurezza e l'efficacia di Praluent nei bambini e negli adolescenti di età inferiore a 18 anni non sono state stabilite. Non ci sono dati disponibili.
Somministrazione ritardata
Se viene dimenticata una dose, il paziente dovrà effettuare l'iniezione il prima possibile e riprendere successivamente il trattamento secondo il calendario iniziale.
Modo di somministrazione
Praluent viene iniettato come iniezione sottocutanea nella coscia, nell'addome o nella parte superiore del braccio.
Per somministrare la dose da 300 mg, praticare due iniezioni da 150 mg consecutive in due differenti siti di iniezione.
Si raccomanda di sottoporre a rotazione i siti di iniezione a ogni iniezione.
Praluent non deve essere iniettato in aree della pelle che presentano una malattia cutanea attiva o lesioni quali eritemi solari, eruzioni cutanee, infiammazione o infezioni cutanee.
Praluent non deve essere co-somministrato nello stesso sito di iniezione assieme ad altri medicamenti iniettabili.
Precauzioni da osservare prima della manipolazione o somministrazione del medicamento
La soluzione deve essere limpida, da incolore a giallo pallido. Se la soluzione presenta cambiamenti di colore o contiene materiale particellare visibile, non deve essere utilizzata.
Dopo che un operatore sanitario abbia fornito opportune istruzioni sulla corretta tecnica di iniezione sottocutanea, il paziente può iniettarsi Praluent da solo o farselo somministrare da una persona che si prende cura di lui.
Praluent deve raggiungere la temperatura ambiente prima dell'uso. Raggiunta tale temperatura, Praluent deve essere utilizzato il prima possibile.
Controindicazioni
Ipersensibilità al principio attivo o a una delle sostanze ausiliarie indicate nella rubrica «Composizione».
Per conoscere le controindicazioni legate alle statine assunte in maniera concomitante o ad altri ipolipemizzanti, consultare le informazioni professionali vigenti per i rispettivi prodotti.
Avvertenze e misure precauzionali
Negli studi clinici sono state riferite reazioni allergiche generali, compreso prurito, nonché reazioni allergiche rare e talvolta gravi come ipersensibilità, eczema nummulare, orticaria e vasculite da ipersensibilità (cfr. la rubrica «Effetti indesiderati»). Nella fase post-marketing sono stati segnalati casi di angioedema. Se compaiono segni o sintomi di reazioni allergiche gravi, il trattamento con Praluent deve essere interrotto e deve essere avviato un opportuno trattamento sintomatico (cfr. la rubrica «Controindicazioni»).
Interazioni
Effetto dell'alirocumab su altri medicamenti
Dato che alirocumab è un medicamento biologico, non si prevedono effetti farmacocinetici su altri medicamenti. Negli studi clinici in cui l'alirocumab è stato somministrato in associazione con atorvastatina o rosuvastatina, non è stata osservata alcuna modificazione importante delle concentrazioni di statina nei casi di somministrazione ripetuta di alirocumab, il che indica che l'alirocumab non ha avuto alcun effetto sugli enzimi del citocromo P450 (prevalentemente CYP3A4 e CYP2C9) e sulle proteine di trasporto quali la P-gp e l'OATP.
Effetto di altri medicamenti sull'alirocumab
È noto che le statine e altri ipolipemizzanti aumentano la produzione di PCSK9, la proteina su cui agisce alirocumab. Poiché un componente della clearance di alirocumab è mediato dal bersaglio, un aumento di quest'ultimo potrebbe comportare una ridotta esposizione sistemica ad alirocumab. Tuttavia, tale effetto non ha alcuna influenza sulla durata dell'efficacia quando alirocumab è somministrato ogni due settimane.
Gravidanza/Allattamento
Gravidanza
Non esistono dati clinici sufficienti sull'utilizzo in gravidanza. Si prevede che alirocumab, come tutti gli altri anticorpi IgG1, attraversi la barriera placentare (cfr. la rubrica «Dati preclinici»). Gli studi sugli animali non hanno mostrato una tossicità diretta o indiretta sulla gravidanza, sullo sviluppo embrionale, sullo sviluppo del feto e/o sullo sviluppo postnatale.
Praluent non è raccomandato durante la gravidanza, salvo quando le condizioni cliniche della donna rendano necessario il trattamento con alirocumab.
Se Praluent è somministrato a donne in età fertile in associazione a una statina o a un altro medicamento ipolipemizzante (ad esempio l'ezetimibe), il medico che lo prescrive deve fare riferimento alla rubrica «Gravidanza» dell'informazione professionale di tali altri medicamenti.
Per l'utilizzo nel trattamento in associazione con una statina
Le statine sono controindicate nella donna incinta. Fare riferimento al riepilogo delle vigenti caratteristiche del rispettivo prodotto.
Allattamento
Non è noto se alirocumab sia escreto nel latte materno. Poiché numerosi medicamenti e immunoglobuline sono escreti nel latte materno, non si può escludere un rischio per i neonati e gli infanti allattati al seno.
Bisogna scegliere se interrompere l'allattamento, interrompere il trattamento con Praluent o non instaurare il trattamento con Praluent. Pertanto, vanno valutati i benefici dell'allattamento per il bambino e i benefici del trattamento per la madre.
Per l'utilizzo nel trattamento in associazione con una statina
Le statine sono controindicate nelle donne che allattano. Fare riferimento al riepilogo delle vigenti caratteristiche del rispettivo prodotto.
Fertilità
Negli studi sugli animali non sono stati osservati effetti avversi sui marcatori surrogati della fertilità (cfr. la rubrica «Dati preclinici»). Non sono disponibili dati relativi agli effetti indesiderati sulla fertilità umana.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
A causa dei possibili effetti indesiderati, Praluent può influenzare la capacità di guidare veicoli e di usare strumenti e macchinari.
Effetti indesiderati
Riepilogo del profilo di sicurezza
Il profilo di sicurezza si è rivelato equivalente nei pazienti affetti da ipercolesterolemia eterozigote familiare severa o da malattia cardiovascolare aterosclerotica accertata e nei pazienti con ipercolesterolemia primaria e dislipidemia mista.
Non è stata osservata alcuna differenza del profilo di sicurezza delle due dosi (75 mg ogni due settimane e 150 mg ogni due settimane) utilizzate nel programma di studi di fase 3.
Riepilogo delle reazioni avverse
La tabella che segue riporta le reazioni avverse segnalate nei pazienti trattati con alirocumab in alcuni studi controllati aggregati:
Gli effetti indesiderati sono presentati in base alla classificazione per sistemi e organi e per ordine decrescente di frequenza. La frequenza è indicata come segue: «molto comune» (≥1/10), «comune» (≥1/100 a <1/10), «non comune» (≥1/1000 a <1/100,), «rara» (≥1/10'000 a <1/1000), «molto rara» (<1/10'000).
Tabella 1 – Reazioni avverse segnalate nei pazienti trattati con alirocumab in studi controllati di fase 3 aggregati
Classificazione persistemi e organi | Comune | Rara |
Disturbi del sistema immunitario | Ipersensibilità, vasculite daipersensibilità | |
Patologie respiratorie, toraciche e mediastiniche | Segni e sintomi delle alte vie respiratoriea Rinofaringite Bronchite Sinusite Tosse | |
Patologie sistemiche e condizioni relative alla sede di somministrazione | Reazioni nel sito di iniezioneb | |
Lesioni, intossicazioni e complicanze legate alle procedure | Contusioni | |
Patologie del sistema muscoloscheletrico e del tessuto connettivo | Mialgia Spasmi muscolari Dolore muscoloscheletrico | |
Patologie della cute e del tessuto sottocutaneo | Prurito | Orticaria, Eczema nummulare |
Patologie gastrointestinali | Diarrea | |
Patologie renali e urinarie | Infezioni delle vie urinarie |
a Compresi dolori orofaringei, rinorree, starnuti.
b Compresi eritema/rossore, prurito, gonfiore, dolore/indolenzimento.
I dati di frequenza delle reazioni avverse riportati nella Tabella 1 sono conformi ai dati degli studi clinici controllati aggregati di fase 3 e dello studio ODYSSEY OUTCOMES.
Effetti indesiderati dopo l'introduzione sul mercato
La frequenza degli effetti indesiderati segnalati nella fase post-marketing non può essere determinata poiché è frutto di segnalazioni spontanee. Pertanto è classificata come «non nota».
Patologie sistemiche e condizioni relative alla sede di somministrazione
Rara: malattia simil-influenzale.
Patologie della cute e del tessuto sottocutaneo
Frequenza non nota: angioedema.
Descrizione di alcuni effetti indesiderati
Reazioni nel sito d'iniezione
Sono state riferite reazioni locali nel sito d'iniezione, compresi eritema/rossore, gonfiore, dolore ed ematomi nel 6,1% dei pazienti trattati con alirocumab rispetto al 4,1% del gruppo di controllo. Il tasso d'interruzione della terapia a causa di reazioni nel sito d'iniezione era comparabile tra i due gruppi (0,2% nel gruppo trattato con alirocumab contro lo 0,4% del gruppo di controllo). Nello studio sui risultati cardiovascolari (ODYSSEY OUTCOMES), le reazioni nel sito di iniezione sono state segnalate con maggiore frequenza nei pazienti trattati con alirocumab rispetto a quelli del braccio placebo (il 3,8% per alirocumab contro il 2,1% per il placebo).
Reazioni allergiche generali
Sono state segnalate reazioni allergiche generali più spesso nel gruppo alirocumab rispetto al gruppo di controllo. La percentuale di pazienti che ha interrotto il trattamento con Praluent a causa delle reazioni allergiche è stata maggiore nel gruppo che riceveva Praluent (0,6% contro 0,2%).Inoltre, studi clinici controllati hanno segnalato reazioni allergiche rare e talvolta gravi quali l'ipersensibilità, l'eczema nummulare, l'orticaria e la vasculite daipersensibilità (cfr. la rubrica «Avvertenze e misure precauzionali»).
Nello studio sui risultati cardiovascolari (ODYSSEY OUTCOMES), le reazioni allergiche generali sono state simili nei pazienti del gruppo alirocumab e del gruppo placebo (rispettivamente il 7,9% e il 7,8%). Non è stata riscontrata alcuna differenza nell'incidenza del prurito.
Studio che valuta la somministrazione ogni 4 settimane
Il profilo di sicurezza nei pazienti trattati con un regime posologico di 300 mg ogni 4 settimane (una volta al mese) è stato simile a quello descritto nel programma di studi clinici con regime posologico di 150 mg ogni 2 settimane. Le reazioni locali nel sito di iniezione sono state riportate con una frequenza del 16,6% nel gruppo di trattamento con alirocumab 300 mg una volta ogni 4 settimane e del 7,9% nel gruppo placebo. I pazienti del gruppo alirocumab 300 mg una volta ogni 4 settimane hanno ricevuto a rotazione iniezioni di placebo per mantenere in cieco la frequenza delle iniezioni. Escludendo le reazioni locali nel sito d'iniezione (ISR) che si sono verificate dopo queste iniezioni di placebo, la frequenza delle ISR era dell'11,8%. Il tasso d'interruzione del trattamento dovuto a reazioni locali nel sito d'iniezione è stato dello 0,7% nel gruppo trattato con alirocumab 300 mg una volta ogni 4 settimane e dello 0% nel gruppo placebo.
Valori bassi di C-LDL <0,65 mmol/l
Sebbene negli studi con alirocumab non siano state identificate conseguenze avverse di un C-LDL molto basso, gli effetti a lungo termine di valori molto bassi di C-LDL non sono noti. Un aumento del rischio di nuova insorgenza di diabete è stato associato in letteratura a livelli più bassi di C-LDL sia in studi genetici che in studi clinici e osservazionali con terapie ipolipemizzanti.
Negli studi controllati aggregati che somministrano le dosi ogni 2 settimane, 796 pazienti trattati con Praluent su 3340 (23,8%) hanno presentato due valori consecutivi di C-LDL < 0,65 mmol/l, tra cui 288 pazienti (8,6%) con due valori consecutivi di C-LDL <0,39 mmol/l. Questi risultati sono stati ottenuti prevalentemente nei pazienti per i quali è stato istituito e mantenuto un trattamento con Praluent 150 mg ogni due settimane, a prescindere dal tasso basale di C-LDL o della risposta al trattamento.
Nello studio che valuta la somministrazione ogni 4 settimane, 113 su 458 pazienti (24,7%) trattati con Praluent 300 mg ogni 4 settimane / 150 mg ogni 2 settimane, presentavano due valori consecutivi di C-LDL di <0,65 mmol/l, e 45 su 458 pazienti (9,8%) presentavano due valori consecutivi di C-LDL di <0,39 mmol/l.
Non è stato individuato alcun segnale disicurezza specifica associato a tali valori diC-LDL.
Immunogenicità/anticorpi anti-medicamento (Anti-Drug-Antibodies, ADA)
Come con tutte le proteine terapeutiche, esiste un rischio d'immunogenicità. Nello studio ODYSSEY OUTCOMES, la presenza di anticorpi anti-medicamento (ADA) dopo l'inizio del trattamento è stata rilevata nel 5,5% dei pazienti trattati con alirocumab 75 mg e/o 150 mg ogni 2 settimane rispetto all'1,6% dei pazienti trattati con placebo; la maggior parte di queste risposte sono state transitorie.
Risposte ADA persistenti sono state osservate nello 0,7% dei pazienti nel braccio alirocumab e nello 0,4% dei pazienti del gruppo placebo. Risposte degli anticorpi neutralizzanti (neutralising antibodies, NAb) sono state osservate nello 0,5% dei pazienti trattati con alirocumab e in <0,1% dei pazienti del gruppo placebo.
Il titolo degli anticorpi anti-medicamento, inclusi i NAb, era basso e non sembrava avere effetti clinicamente significativi sull'efficacia o la sicurezza di alirocumab, ad eccezione di un tasso più alto di reazioni nel sito di iniezione nei pazienti con ADA rilevato in corso di trattamento rispetto ai pazienti ADA-negativi (7,5% contro 3,6%). Le conseguenze a lungo termine di un trattamento continuato con alirocumab in presenza di ADA non sono note.
In un gruppo di dieci studi controllati verso placebo e verso il principio attivo in pazienti trattati con alirocumab 75 mg e/o 150 mg una volta ogni due settimane, così come in uno studio clinico separato in pazienti trattati con alirocumab 75 mg ogni due settimane o 300 mg ogni 4 settimane (inclusi alcuni pazienti con aggiustamento della dose a 150 mg ogni due settimane), l'incidenza di rilevazione di ADA e NAb era simile ai risultati ottenuti dallo studio ODYSSEY OUTCOMES descritto in precedenza.
I dati riguardanti l'immunogenicità sono fortemente dipendenti dalla sensibilità e specificità dello studio e daaltri fattori. Inoltre, l'incidenza della positività agli anticorpi osservata in uno studio può essere influenzata da numerosi fattori, in particolare la manipolazione del campione, il momento in cui il campione viene prelevato, i trattamenti farmacologici concomitanti e la patologia sottostante. Per questi motivi, il confronto fra l'incidenza degli anticorpi contro alirocumab e l'incidenza degli anticorpi contro altri medicamenti può indurre in errore.
Eventi neurocognitivi
Occasionalmente sono stati riscontrati eventi neurocognitivi. Negli studi controllati iniziali, sono stati riferiti eventi neurocognitivi nello 0,9% dei pazienti trattati con alirocumab e nello 0,7% dei pazienti trattati con placebo. Stato confusionale o disturbi della memoria sono stati osservati con maggiore frequenza nel gruppo trattato con PRALUENT (0,2%) rispetto al gruppo placebo (<0,1%).
Modifica dei livelli di enzimi epatici
Patologie epatiche (prevalentemente legate agli enzimi epatici) sono state osservate nel 2,5% dei pazienti trattati con PRALUENT e nell'1,8% dei pazienti del gruppo placebo. A causa di tali disturbi epatici, il trattamento è stato interrotto nello 0,4% dei pazienti del braccio Praluent contro lo 0,2% dei pazienti trattati con placebo. Un innalzamento delle transaminasi sieriche di più del triplo del limite superiore del valore normale è stato osservato nell'1,7% dei pazienti trattati con PRALUENT e nell'1,4% dei pazienti trattati con placebo.
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-benefico del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Finora non sono stati riportati casi di sovradosaggio.
Proprietà/Effetti
Codice ATC
C10AX14
Meccanismo d'azione
Alirocumab è un anticorpo monoclonale completamente umano che si lega con alta affinità e specificità alla proproteina convertasi subtilisina/kexina tipo 9 (PCSK9 9). La PCSK9 si lega ai recettori delle lipoproteine a bassa densità (low-density lipoprotein receptor, LDLR) sulla superficie degli epatociti favorendone la degradazione all'interno del fegato. Gli LDLR sono i principali recettori che eliminano le LDL circolanti. Pertanto, la riduzione dei livelli di LDLR da parte della PCSK9 determina livelli ematici più alti di C-LDL. Inibendo il legame della PCSK9 con LDLR, alirocumab aumenta il numero di LDLR disponibili per eliminare le LDL, abbassando pertanto i livelli di C-LDL.
Farmacodinamica
Alirocumab è un anticorpo monoclonale completamente umano, che inibisce l'attività della PCSK9, sia negli studi in vitro che nei modelli in vivo. Numerosi studi condotti su animali e nell'uomo hanno dimostrato il ruolo centrale svolto dagli elevati livelli di C-LDL nell'innesco e nella progressione dell'aterosclerosi.
Efficacia clinica
La maggior parte dei pazienti degli studi di fase 3 seguiva una terapia di base ipolipemizzante composta da una dose massima tollerata di statine, con o senza ipolipemizzanti supplementari, e presentava un rischio cardiovascolare (CV) alto o molto alto.
Efficacia clinica nei pazienti affetti da malattia cardiovascolare aterosclerotica (Atherosclerotic Cardiovascular Disease, ASCVD)
Riepilogo degli studi di fase 3 con regime posologico di 75 mg e/o 150 mg ogni 2 settimane
L'efficacia di Praluent è stata studiata nei cinque studi controllati verso placebo realizzati in doppio cieco su 3499 pazienti; il 54% non presentava ipercolesterolemia familiare, ma soffriva di una patologia cardiovascolare aterosclerotica diagnosticata. Tutti i pazienti hanno ricevuto una statina alla dose massima tollerata, con o senza ulteriore terapia ipolipemizzante. La durata minima degli studi è stata di 52 settimane, l'endpoint di efficacia primario è stato valutato alla settimana 24 (variazione media del C-LDL rispetto ai valori basali, espressa in percentuale).
Tre studi anni hanno utilizzato una dose iniziale di 75 mg ogni 2 settimane; successivamente, in base a criteri prestabiliti, alla settimana 12 hanno aumentato la dose a 150 mg ogni 2 settimane ai pazienti che alla settimana 8 non avevano raggiunto l'obiettivo prefissato di C-LDL. Per la maggior parte dei pazienti (57%-83%) trattati per 12 settimane non è stato necessario aumentare la dose. Due studi hanno utilizzato esclusivamente una dose di 150 mg ogni 2 settimane.
Lo studio 1 era uno studio multicentrico, in doppio cieco, controllato con placebo, nel quale i pazienti sono stati randomizzati a ricevere 150 mg di PRALUENT ogni 2 settimane (1553 pazienti) o placebo (788 pazienti). Tutti i pazienti assumevano statine alla dose massima tollerata, con o senza ulteriore terapia ipolipemizzante, e avevano bisogno di ridurre maggiormente i valori di C-LDL. L'età media era di 61 anni (range: 18-89 anni), il 38% dei pazienti era costituito da donne, il 93% era di origine caucasica, il 3% di origine africana e il 5% di origine ispanica-latinoamericana. Complessivamente, il 69% dei pazienti non presentava ipercolesterolemia familiare, ma era affetto da una malattia cardiovascolare accertata, e il 18% presentava una ipercolesterolemia familiare eterozigote (heFH). Al basale, il livello medio di C-LDL era di 3,16 mmol/l.
La percentuale di pazienti che ha interrotto prematuramente il medicamento oggetto della sperimentazione prima della settimana 24 (valutazione dell'endpoint di efficacia) è stata dell'8% tra i pazienti trattati con PRALUENT e dell'8% tra quelli che hanno ricevuto placebo.
Alla settimana 24, la differenza di trattamento tra il gruppo trattato con PRALUENT e il gruppo placebo, per quanto riguarda la variazione media percentuale del livello di C-LDL, è stata di -58% (IC al 95%: -61%, -56%; valore di p: <0,0001).
Per il dettaglio dei dati vedere la Tabella 2.
Tabella 2 - Variazione media (%) dei parametri lipidici rispetto ai valori basali e differenzaa rispetto al placebo, alla settimana 24 dello Studio 1b (popolazione ITT)
Gruppo di trattamento | C-LDL | C totale | C-non HDL | Apo B |
Settimana 24 (variazione percentuale media rispetto ai valori basali) | ||||
Placebo | 1 | 0 | 1 | 1 |
PRALUENT (150 mg) | -58 | -36 | -49 | -50 |
Differenza (media secondo il metodo dei minimi quadrati) rispetto al placebo (IC al 95%) | -58 (-61, -56) | -36 (-37, -34) | -50 (-52, -47) | -51 (-53, -48) |
a Differenza = PRALUENT meno Placebo b È stato utilizzato un approccio basato sul modello di combinazione dei regimi terapeutici, con un'imputazione multipla dei valori post-trattamento mancanti basata sul basale di un soggetto, e un'imputazione multipla dei valori in corso di trattamento mancanti basata su un modello che include i valori in corso di trattamento disponibili. | ||||
Lo studio 2 era uno studio multicentrico, in doppio cieco controllato con placebo, nel quale i pazienti sono stati randomizzati a ricevere PRALUENT (209 pazienti) o placebo (107 pazienti). I pazienti assumevano statine alla dose massima tollerata, con o senza ulteriore terapia ipolipemizzante, e avevano bisogno di ridurre maggiormente i valori di C-LDL.
L'età media era di 63 anni (range: 39-87 anni), il 34% dei pazienti costituito da donne, l'82% era di origine caucasica, il 16% di origine africana e l'11% di origine ispanica-latinoamericana. Complessivamente, l'84% dei pazienti era affetto da una malattia cardiovascolare accertata. Al basale, il valore medio di C-LDL era di 2,64 mmol/l.
La percentuale di pazienti che ha interrotto prematuramente il medicamento oggetto della sperimentazione prima della settimana 24 (valutazione dell'endpoint di efficacia) è stata dell'11% tra i pazienti trattati con PRALUENT e del 12% tra quelli che hanno ricevuto placebo.
Alla settimana 12, la variazione percentuale media del C-LDL rispetto al basale era di -45% nei pazienti del braccio PRALUENT, contro l'1% nel gruppo di controllo con placebo. La differenza di trattamento tra PRALUENT 75 mg ogni due settimane e il placebo relativamente alla variazione media percentuale del C-LDL è stata di -46% (IC al 95%: -53%, -39%).
Se, alla settimana 12, era necessario ridurre ulteriormente il C-LDL rispetto agli endpoint stabiliti, la dose di PRALUENT veniva aumentata a 150 mg ogni due settimane per il resto della sperimentazione. Alla settimana 24, la variazione percentuale media del C-LDL rispetto al basale era di -44% nei pazienti trattati con PRALUENT e di -2% per il placebo. La differenza di trattamento tra PRALUENT e il placebo relativamente alla variazione media percentuale del C-LDL è stata di -43% (IC al 95%: -50%, -35%; valore di p: <0,0001). La dose è stata aumentata a 150 mg ogni due settimane in 32 pazienti (17%) dei 191 pazienti trattati con PRALUENT per almeno 12 settimane.
Efficacia clinica nell'ipercolesterolemia familiare eterozigote severa
Gli studi 3 e 4 erano studi multicentrici in doppio cieco, controllati con placebo, nei quali tutti i pazienti sono stati randomizzati a ricevere PRALUENT (490 pazienti) o placebo (245 pazienti). Il piano sperimentale e i criteri di ammissibilità erano simili per entrambi gli studi. Tutti i pazienti erano affetti da heFH, assumevano statine alla dose massima tollerata, con o senza ulteriore terapia ipolipemizzante, e necessitavano di ridurre ulteriormente i valori di C-LDL. L'età media era di 52 anni (range: 20-87 anni), il 45% dei pazienti era costituito da donne, il 94% era di origine caucasica, l'1% di origine africana e il 3% di origine ispanica-latinoamericana. Complessivamente, il 45% dei pazienti con ipercolesterolemia familiare eterozigote (heFH) era anche affetto da una malattia cardiovascolare accertata. Al basale, il livello medio di C-LDL era di 3,65 mmol/l.
Per entrambi i due studi, la percentuale di pazienti che ha interrotto prematuramente il medicamento oggetto della sperimentazione prima della settimana 24 (valutazione dell'endpoint di efficacia) è stata del 6% tra i pazienti trattati con PRALUENT e del 4% tra quelli che hanno ricevuto placebo.
Alla settimana 12, la differenza di trattamento tra il gruppo trattato con PRALUENT 75 mg 2 volte alla settimana e il gruppo placebo, per quanto riguarda la variazione media percentuale del livello di C-LDL, è stata di -48% (IC al 95%: -52%, -44%).
Se, alla settimana 12, era necessario ridurre ulteriormente il C-LDL rispetto agli endpoint stabiliti, la dose di PRALUENT veniva aumentata a 150 mg ogni due settimane per il resto della sperimentazione. Alla settimana 24, la differenza media di trattamento tra il gruppo trattato con PRALUENT e il gruppo placebo, per quanto riguarda la variazione media percentuale del livello di C-LDL, è stata di -54% (IC al 95%: -59%, -50%; valore di p: <0,0001). La dose è stata aumentata a 150 mg ogni due settimane in 196 pazienti (42%) dei 469 pazienti trattati con PRALUENT per almeno 12 settimane. L'effetto di riduzione del livello di D-LDL è stato mantenuto fino alla settimana 52
I risultati dettagliati sono riportati nella Tabella 3.
Tabella 3 - Variazione media (%) dei parametri lipidici rispetto ai valori basali e differenzaa rispetto al placebo, alle settimane 12 e 24 nei pazienti affetti da heFH (Studi 3 et 4 aggregati)b(popolazione ITT).
Gruppo di trattamento | C-LDL | C totale | C-non HDL | Apo B |
Settimana 12 (variazione percentuale media rispetto ai valori basali) | ||||
Placebo | 5 | 4 | 5 | 2 |
PRALUENT (75 mg) | -43 | -27 | -38 | -34 |
Differenza (media secondo il metodo dei minimi quadrati) rispetto al placebo (IC al 95%) | -48 (-52, -44) | -31 (-34, -28) | -42 (-46, -39) | -36 (-39, -33) |
Settimana 24 (variazione percentuale media rispetto ai valori basali) | ||||
Placebo | 7 | 5 | 7 | 2 |
PRALUENT (75 mg, dose aumentata a 150 mgc) | -47 | -30 | -42 | -40 |
Differenza (media secondo il metodo dei minimi quadrati) rispetto al placebo (IC al 95%) | -54 (-59, -50) | -36 (-39, -33) | -49 (-53, -45) | -42 (-45, -39) |
a Différenza = PRALUENT meno Placebo b È stato utilizzato un approccio basato sul modello di combinazione dei regimi terapeutici, con un'imputazione multipla dei valori post-trattamento mancanti basata sul basale di un soggetto, e un'imputazione multipla dei valori in corso di trattamento mancanti basata su un modello che include i valori in corso di trattamento disponibili. c La dose è stata aumentata a 150 mg ogni due settimane in 196 pazienti (42%) trattati per almeno 12 settimane. | ||||
Lo studio 5 era uno studio multicentrico, in doppio cieco, controllato con placebo, nel quale i pazienti sono stati randomizzati a ricevere 150 mg di PRALUENT ogni 2 settimane (72 pazienti) o placebo (35 pazienti). I pazienti erano affetti da heFH e il loro livello iniziale di C-LDL era superiore a 4,14 mmol/l nonostante assumessero una statina alla dose massima tollerata, con o senza ulteriore terapia ipolipemizzante. L'età media era di 51 anni (range: 18-80 anni), il 47% dei pazienti era costituito da donne, l'88% era di origine caucasica, il 2% di origine africana e il 6% di origine ispanica-latinoamericana. Complessivamente, il 50% dei pazienti era affetto da una malattia cardiovascolare accertata. Al basale, il livello medio di C-LDL era di 5,13 mmol/l.
La percentuale di pazienti che ha interrotto prematuramente il medicamento oggetto della sperimentazione prima della settimana 24 (valutazione dell'endpoint di efficacia) è stata del 10% tra i pazienti trattati con PRALUENT e dello 0% tra quelli che hanno ricevuto placebo.
Alla settimana 24, la variazione percentuale media del C-LDL rispetto al basale era di -43% nei pazienti trattati con PRALUENT e di -7% per il placebo. La differenza di trattamento tra PRALUENT e il placebo relativamente alla variazione media percentuale del C-LDL è stata di -36% (IC al 95%: -49%, -24%; valore di p: <0,0001).
Riepilogo degli studi di fase 3 con somministrazione ogni 4 settimane
Studio CHOICE I
Studio multicentrico in doppio cieco, controllato con placebo, condotto per 48 settimane su 540 pazienti che hanno ricevuto una statina alla dose massima tollerata, con o senza un'altra terapia ipolipemizzante (308 nel gruppo alirocumab 300 mg una volta ogni 4 settimane, 76 nel gruppo alirocumab 75 mg una volta ogni 2 settimane e 156 nel gruppo placebo) e 252 pazienti non trattati con statine (144 nel gruppo alirocumab 300 mg una volta ogni 4 settimane, 37 nel gruppo alirocumab 75 mg una volta ogni 2 settimane e 71 nel gruppo placebo). I pazienti hanno ricevuto alirocumab 300 mg una volta ogni 4 settimane, o alirocumab 75 mg una volta ogni 2 settimane, o placebo, in aggiunta alla terapia ipolipemizzante in corso (statine, terapia non statinica o solo dieta). In totale, il 71,6% dei pazienti è stato classificato a rischio cardiovascolare alto o molto alto e non aveva raggiunto l'obiettivo di C-LDL. La modifica della dose nei gruppi di alirocumab a 150 mg ogni 2 settimane si è verificata alla settimana 12 in pazienti con C-LDL ≥1,81 mmol/l o ≥2,59 mmol/l mg/dl, a seconda del loro livello di rischio cardiovascolare, o in pazienti che non avevano raggiunto una riduzione di almeno il 30% di C-LDL rispetto ai valori basali.
Nella coorte dei pazienti in terapia con statine, la media basale di C-LDL era 2,91 mmol/l. Alla settimana 12, la variazione percentuale media del C-LDL (analisi ITT) rispetto ai valori basali è stata di -55,3% con alirocumab 300 mg una volta ogni 4 settimane, contro +1,1% con il placebo. Alla settimana 12 (prima dell'aggiustamento della dose), il 77,3% dei pazienti trattati con alirocumab 300 mg una volta ogni quattro settimane ha raggiunto un C-LDL <1,81 mmol/l, contro il 9,3% dei pazienti nel gruppo placebo. Alla settimana 24, la variazione percentuale media del C-LDL (analisi ITT) rispetto ai valori basali è stata di -58,8% con alirocumab 300 mg una volta ogni 4 settimane/150 mg una volta ogni due settimane, contro -0,1% con il placebo. Alla settimana 24, la differenza media di trattamento relativa alla variazione percentuale del C-LDL rispetto ai valori basali è stata di -58,7% con alirocumab 300 mg una volta ogni 4 settimane/150 mg una volta ogni due settimane (IC al 97,5%: -65,0%, -52,4%; valore di p: <0,0001). Nei pazienti trattati per più di 12 settimane, la dose è stata modificata a 150 mg una volta ogni due settimane in 56 pazienti (19,3%) su 290 pazienti del braccio alirocumab 300 mg una volta ogni 4 settimane. Nel sottogruppo di pazienti ai quali, alla settimana 12, era stata aggiustata la dose a 150 mg una volta ogni 2 settimane, è stata ottenuta un'ulteriore riduzione del 25,4% del C-LDL alla settimana 24.
Nella coorte dei pazienti non in terapia concomitante con statine, la media basale di C-LDL era 3,67 mmol/l. Alla settimana 12, la variazione percentuale media del C-LDL (analisi ITT) rispetto ai valori basali è stata di -58,4% con alirocumab 300 mg una volta ogni 4 settimane, contro +0,3% con il placebo. Alla settimana 12 (prima dell'aggiustamento della dose), il 65,2% dei pazienti trattati con alirocumab 300 mg una volta ogni quattro settimane ha raggiunto un C-LDL <70 mg/dl rispetto al 2,8% del gruppo placebo. Alla settimana 24, la variazione percentuale media del C-LDL (analisi ITT) rispetto ai valori basali è stata di -52,7% con alirocumab 300 mg una volta ogni 4 settimane/150 mg una volta ogni due settimane, contro -0,3% nel gruppo placebo. Alla settimana 24, la differenza media di trattamento rispetto al placebo riguardante la variazione percentuale del C-LDL rispetto ai valori basali è stata di -52,4% con alirocumab 300 mg una volta ogni 4 settimane/150 mg una volta ogni due settimane (IC al 97,5%: -59,8%, -45,0%; valore di p: <0,0001). Nei pazienti trattati per più di 12 settimane, la dose è stata modificata a 150 mg una volta ogni due settimane in 19 (14,7%) dei 129 pazienti del braccio che riceveva alirocumab 300 mg una volta ogni 4 settimane. Nel sottogruppo di pazienti ai quali, alla settimana 12, era stata aggiustata la dose a 150 mg una volta ogni 2 settimane, è stata raggiunta un'ulteriore riduzione media del 7,3% del C-LDL alla settimana 24.
Studio ODYSSEY OUTCOMES
Studio multicentrico in doppio cieco, controllato verso placebo, condotto su 18 924 adulti a rischio cardiovascolare elevato (9462 trattati con alirocumab e 9462 con placebo). La durata mediana del follow-up è stata di 33 mesi (2,8 anni). Tutti i pazienti sono stati randomizzati con un rapporto di allocazione 1:1 per ricevere alirocumab 75 mg o placebo una volta ogni due settimane. Al secondo mese, per i pazienti sottoposti ad aggiustamento della dose a 150 mg una volta ogni due settimane e che avevano due valori consecutivi di C-LDL inferiore a 0,65 mmol/l (25 mg/dl), la dose di alirocumab è stata ridotta da 150 mg una volta ogni due settimane a 75 mg una volta ogni due settimane. I pazienti in trattamento con 75 mg una volta ogni due settimane e che hanno avuto due valori consecutivi di C-LDL inferiori a 0,39 mmol/l (15 mg/dl) sono stati fatti passare al placebo mantenendo il cieco pur essendo valutati nel gruppo alirocumab. Sui 9451 pazienti trattati con alirocumab, la dose è stata modificata a 150 mg una volta ogni due settimane in circa 2615 pazienti (27,7%). 805 (30,8%) di questi 2615 pazienti sono poi passati a 75 mg una volta ogni due settimane. Nel complesso, 730 (7,7%) dei 9451 pazienti sono stati fatti passare al placebo mantenendo il cieco, pur essendo valutati nel gruppo alirocumab. Il trattamento è stato interrotto dal 14,2% dei pazienti nel gruppo alirocumab e dal 15,8% dei pazienti nel gruppo placebo. In totale, il 99,5% dei pazienti è stato sottoposto a follow-up per un'analisi della sopravvivenza fino alla fine dello studio.
L'evento indice (SCA) era un infarto del miocardio nell'83,2% dei pazienti (34,6% STEMI, 48,6% NSTEMI) e un episodio di angina instabile nel 16,8% dei pazienti.
Alirocumab ha ridotto significativamente il rischio per l'enpoint primario composito (morte per malattia coronarica, infarto del miocardio non fatale, ictus ischemico fatale e non fatale, angina instabile che richiede ricovero). Sono state osservate riduzioni significative di alcuni endpoint compositi (infarto del miocardio non fatale, ictus ischemico fatale e non fatale, angina instabile che richiede ricovero), ad eccezione della morte per malattia coronarica (cfr. Tabella 4).
Tabella 4 - Efficacia di alirocumab nello studio ODYSSEY OUTCOMES (popolazione complessiva)
Alirocumab | Placebo | Hazard Ratio | Valore di pb | |
Endopoint primario: composito comprendente morte per malattia coronarica, infarto del miocardio non fatale, ictus ischemico fatale e non fatale, o angina instabile che richiede ricovero | 903 (9.5) | 1052 (11.1) | 0.85 (0.78–0.93) | 0.0003 |
Morte per malattia coronarica | 205 (2.2 ) | 222 (2.3) | 0.92 (0.76–1.11) | 0.38 |
Infarto del miocardio (non fatale) | 626 (6.6) | 722 (7.6) | 0.86 (0.77–0.96) | 0,006 c |
Ictus ischemico (fatale/non fatale) | 111 (1.2) | 152 (1.6) | 0.73 (0.57–0.93) | 0,01 c |
Angina instabile che richiede ricovero | 37 (0.4) | 60 (0.6) | 0.61 (0.41–0.92) | 0,02 c |
Mortalità per tutte le cause | 334 (3.5) | 392 (4.1) | 0.85 (0.73–0.98) | 0,0261 c |
a Basato sul modello di Cox
b Test bilaterale dei ranghi logaritmici
c Significatività nominale
Farmacocinetica
Assorbimento
In seguito alla somministrazione sottocutanea di 50-300 mg di alirocumab, il tempo mediano per il raggiungimento della concentrazione sierica massima (tmax) era di 3-7 giorni. La farmacocinetica di alirocumab in seguito asomministrazione sottocutanea di una dose unica di 75 mg nell'addome, nella parte superiore del braccio o nella coscia era simile. La biodisponibilità assoluta di alirocumab in seguito a somministrazione sottocutanea era pari a circa l'85%, come stabilito dall'analisi farmacocinetica di popolazione.
Dopo somministrazione di 75 mg e 150 mg è stato raggiunto lo stato stazionario dopo 2-3 dosi, con un tasso di accumulo di circa il doppio.
L'esposizione mensile al trattamento con 300 mg ogni 4 settimane era simile a quella con 150 mg ogni 2 settimane. Le fluttuazioni tra Cmax e la concentrazione residua erano più alte nel regime posologico con somministrazione ogni 4 settimane. Lo stato stazionario è stato raggiunto dopo 2-3 dosi, con un tasso di accumulo massimo del doppio.
Distribuzione
In seguito a somministrazione endovenosa, il volume di distribuzione era pari a circa 0,04-0,05 l/kg, segno che alirocumab è distribuito principalmente nel sistema circolatorio.
Metabolismo
Non sono stati condotti studi specifici sul metabolismo perché alirocumab è una proteina. Si prevede che alirocumab sia degradato in piccoli peptidi e singoli aminoacidi.
Eliminazione
Sono state osservate due fasi di eliminazione per alirocumab. A concentrazioni basse, l'eliminazione avviene prevalentemente attraverso un legame saturabile al bersaglio (PCSK9), mentre a concentrazioni più alte l'eliminazione di alirocumab avviene per lo più attraverso una via proteolitica non saturabile.
In base a un'analisi farmacocinetica di popolazione, l'emivita mediana apparente di alirocumab allo stato stazionario era di 17-20 giorni nei pazienti che ricevevano alirocumab in monoterapia, a dosi sottocutanee di 75 mg ogni 2 settimane o di 150 mg ogni 2 settimane. In caso di co-somministrazione con una statina, l'emivita apparente mediana di alirocumab era di 12 giorni.
Linearità/non linearità
Quando si è passati da 75 mg a 150 mg ogni 2 settimane si è osservato un aumento delle concentrazioni totali di alirocumab leggermente superiore all'aumento proporzionale alla dose, compresa tra 2,1 e 2,7 volte.
Cinetica di gruppi di pazienti speciali
Peso
Un'analisi farmacocinetica di popolazione ha mostrato che il peso corporeo esercita una leggera influenza sull'esposizione ad alirocumab, probabilmente senza conseguenza sull'efficacia o la sicurezza. L'esposizione ad alirocumab (AUC0-14j) allo stato stazionario con dosi di 75 e 150 mg 2 volte alla settimana si è ridotta del 29% e del 36% nei pazienti di peso superiore a 100 kg rispetto ai pazienti di peso compreso tra 50 kg e 100 kg.
Relazione farmacocinetica/farmacodinamica
L'effetto farmacodinamico di alirocumab nell'abbassamento del C-LDL è indiretto e mediato dal legame con PCSK9. Si osserva una riduzione dipendente dalla concentrazione di PCSK9 libero e del C-LDL fino all'ottenimento della saturazione del bersaglio. Dopo la saturazione del legame a PCSK9, ulteriori aumenti della concentrazione di alirocumab non determinano ulteriori riduzioni del C-LDL. Si osserva, tuttavia, una maggiore durata dell'effetto di abbassamento del C-LDL.
Disturbi della funzionalità epatica
In uno studio di fase 1 dopo somministrazione di una singola dose sottocutanea di 75 mg, l'esposizione ad alirocumab dei soggetti affetti da insufficienza epatica da leggera a moderata è stata lievemente ridotta rispetto a quella dei soggetti che presentavano una funzionalità epatica normale. Non sono disponibili dati nei pazienti con grave insufficienza epatica.
Disturbi della funzionalità renale
Poiché è noto che gli anticorpi monoclonali non sono escreti per via renale, la funzionalità del rene non dovrebbe incidere sulle proprietà farmacocinetiche di alirocumab. Le analisi farmacocinetiche di popolazione indicano che un'insufficienza renale da leggera a moderata non ha probabilmente esercitato alcuna influenza particolare sulle proprietà farmacocinetiche di alirocumab. Non sono disponibili dati per i pazienti affetti da grave insufficienza renale.
Pazienti anziani
In base a un'analisi farmacocinetica di popolazione, l'età è associata a una leggera differenza dell'esposizione ad alirocumab allo stato stazionario, probabilmente senza alcuna influenza sull'efficacia ola sicurezza. L'esposizione ad alirocumab allo stato stazionario (AUC0-14j) con dosi di 75 e 150 mg 2 volte alla settimana è aumentata dal 10% al 36% nei pazienti con più di 75 anni rispetto ai pazienti con età inferiore a 65 anni.
Polimorfismi genetici
Un analisi farmacocinetica di popolazione ha dimostrato che la razza non ha inciso sulle proprietà farmacocinetiche di alirocumab. In seguito alla somministrazione sottocutanea di una singola dose di 100-300 mg di alirocumab, non è stata osservata alcuna differenza significativa in termini di esposizione tra i soggetti sani giapponesi e bianchi.
In base a un'analisi farmacocinetica di popolazione, il sesso non ha inciso sulle proprietà farmacocinetiche di alirocumab.
Dati preclinici
I dati non clinici non rivelano alcun rischio particolare per l'uomo in base alle valutazioni di sicurezza farmacologica, di tossicità a dosi ripetute e di tossicità per la riproduzione e lo sviluppo.
Mutagenicità
Non sono stati condotti studi sulla genotossicità e la mutagenicità.
Cancerogenesi
Non sono stati condotti studi di cancerogenicità.
Tossità per la riproduzione
Studi relativi alla tossicologia riproduttiva, realizzati nel ratto e nella scimmia, hanno indicato che alirocumab, come gli altri anticorpi IgG, attraversa la barriera placentare.
Nelle scimmie non sono stati segnalati effetti indesiderati sui marcatori surrogati della fertilità (ad esempio, ciclo estrale, volume testicolare volume dell'eiaculato, motilità dello sperma o conta spermatica totale per eiaculato) né sono stati evidenziati risultati anomali legati ad alirocumab nei tessuti riproduttivi – sul piano anatomico, patologico o istopatologico – negli studi di tossicologia condotti nel ratto o nella scimmia.
La prole di scimmie che hanno ricevuto dosi elevate di alirocumab una volta alla settimana durante tutta la gravidanza ha evidenziato una risposta immunitaria secondaria più debole dopo esposizione agli antigeni rispetto alla progenie degli animali di controllo. Non sono state osservate altre evidenze di disfunzione immunitaria correlata ad alirocumab nella prole.
Altre indicazioni
Incompatibilità
In assenza di studi di tolleranza, questo medicamento non deve essere miscelato con altri medicamenti.
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazioni particolari concernenti l'immagazzinamento
Conservare il medicamento al di fuori della vista e della portata dei bambini.
Conservare in frigorifero (2-8 °C).
Non congelare.
Praluent può essere conservato fuori del frigorifero a una temperatura inferiore a 25 °C e al riparo dalla luce per 30 giorni al massimo. Una volta estratto dal frigorifero, il medicamento deve essere utilizzato entro 30 giorni o gettato.
Conservare la siringa o la penna nella scatola originale per proteggerla dalla luce.
Non esporre a fonti di calore eccessive.
Numero dell'omologazione
65661, 65882 (Swissmedic).
Titolare dell’omologazione
sanofi-aventis (suisse) sa, 1214 Vernier/GE.
Stato dell'informazione
Maggio 2020.
Composition
Principes actifs
Alirocumab*.
Excipients
Histidinum, Saccharum, Polysorbatum 20, Aqua ad iniectabilia.
* L'alirocumab est un anticorps monoclonal entièrement humain (isotype IgG1) qui cible la proprotéine convertase subtilisine/kexine de type 9 (PCSK 9). L'alirocumab est produit par la technologie de l'ADN recombinant dans une culture en suspension de cellules d'ovaires de hamster chinois.
Forme pharmaceutique et quantité de principe actif par unité
Praluent 75 mg, solution pour injection en seringue pré-remplie: chaque seringue pré-remplie à usage unique d'1 ml contient 75 mg d'alirocumab destiné à être administré par voie sous-cutanée.
Praluent 150 mg, solution pour injection en seringue pré-remplie: chaque seringue pré-remplie à usage unique d'1 ml contient 150 mg d'alirocumab destiné à être administré par voie sous-cutanée.
Praluent 75 mg, solution pour injection en stylo pré-rempli: chaque stylo pré-rempli à usage unique d'1 ml contient 75 mg d'alirocumab destiné à être administré par voie sous-cutanée.
Praluent 150 mg, solution pour injection en stylo pré-rempli: chaque stylo pré-rempli à usage unique d'1 ml contient 150 mg d'alirocumab destiné à être administré par voie sous-cutanée.
Indications/Possibilités d’emploi
Praluent est indiqué en complément d'un régime alimentaire et d'une statine à la dose maximale tolérée, avec ou sans autre traitement hypolipémiant chez les adultes présentant une hypercholestérolémie (incluant l'hypercholestérolémie familiale hétérozygote) nécessitant une réduction complémentaire du cholestérol à lipoprotéines de basse densité (LDL-C).
Praluent est indiqué pour réduire le risque d'évènements cardiovasculaires (infarctus du myocarde, accident ischémique cérébral, angor instable nécessitant une hospitalisation) chez les patients à risque cardiovasculaire élevé.
Pour l'effet sur la mortalité cardiovasculaire, voir la section «Propriétés/Effets».
Posologie/Mode d’emploi
Posologie usuelle
La dose initiale recommandée de Praluent est de 75 mg toutes les 2 semaines. Le taux de LDL-C devrait être évalué 4 à 8 semaines après le début du traitement.
La dose peut être ajustée à 150 mg une fois toutes les 2 semaines ou 300 mg une fois toutes les 4 semaines.
Si la réduction du LDL-C est insuffisante avec 300 mg toutes les 4 semaines, la dose peut être augmentée jusqu'à la dose maximale de 150 mg une fois toutes les 2 semaines.
Praluent est administré par voie sous-cutanée.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Instructions posologiques particulières
Aucun ajustement posologique n'est nécessaire en fonction du poids du patient (voir section «Pharmacocinétique»).
Patients présentant des troubles de la fonction hépatique
Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance hépatique légère ou modérée. Aucune donnée n'est disponible pour les patients souffrant d'une insuffisance hépatique grave (voir section «Pharmacocinétique»).
Patients présentant des troubles de la fonction rénale
Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance rénale légère ou modérée. Aucune donnée n'est disponible pour les patients souffrant d'une insuffisance rénale grave (voir section «Pharmacocinétique»).
Patients âgés
Aucun ajustement posologique n'est nécessaire chez les patients âgés (voir section «Pharmacocinétique»).
Enfants et adolescents
L'innocuité et l'efficacité de Praluent chez l'enfant et l'adolescent de moins de 18 ans n'ont pas été établies. Aucune donnée n'est disponible.
Prise retardée
En cas d'oubli d'une dose, le patient devra recevoir son injection dès que possible puis reprendre le traitement selon le calendrier initial.
Mode d'administration
Praluent est injecté par voie sous-cutanée dans la cuisse, l'abdomen ou le haut du bras.
Pour administrer la dose de 300 mg, effectuer consécutivement deux injections de 150 mg sur deux sites d'injection différents.
Il est recommandé d'alterner les sites d'injection à chaque injection.
Praluent ne doit pas être injecté dans des zones d'affections cutanées actives ou dans des zones lésées, telles qu'érythèmes solaires, éruptions cutanées, zones inflammatoires ou infectées.
Praluent ne doit pas être co-administré avec d'autres médicaments injectables au même site d'injection.
Précautions à prendre avant de manipuler ou d'administrer le médicament
La solution doit être limpide, incolore à jaune pâle. Si la solution est décolorée ou contient des matières particulaires visibles, elle ne doit pas être utilisée.
Après une formation sur la bonne technique d'injection sous-cutanée par un professionnel de santé, le patient peut s'injecter lui-même Praluent ou un soignant ou un accompagnant peut le lui administrer.
Laisser Praluent atteindre la température ambiante avant toute utilisation. Une fois à température ambiante, Praluent doit être utilisé aussi vite que possible.
Contre-indications
Hypersensibilité à la substance active ou à l'un des excipients répertoriés à la section «Composition».
Pour connaître les contre-indications liées aux statines concomitantes ou à d'autres hypolipémiants, se reporter à l'information professionnelle du produit respectif en vigueur.
Mises en garde et précautions
Des réactions allergiques générales, y compris le prurit, ainsi que des réactions allergiques rares et parfois graves telles que l'hypersensibilité, l'eczéma nummulaire, l'urticaire et la vascularite d'hypersensibilité ont été signalées dans des essais cliniques (voir section «Effets indésirables»). Des angiœdèmes ont été rapportés après commercialisation. Si des signes ou des symptômes de réactions allergiques graves apparaissent, il est nécessaire d'arrêter le traitement par Praluent et de commencer un traitement symptomatique approprié (voir section «Contre-indications»).
Interactions
Effet de l'alirocumab sur d'autres médicaments
Comme l'alirocumab est un produit biologique, on ne s'attend à aucun effet pharmacocinétique sur d'autres médicaments. Dans les essais cliniques où l'alirocumab a été administré en association avec l'atorvastatine ou la rosuvastatine, aucune modification importante des concentrations de statine n'a été observée lors d'une administration répétée d'alirocumab, ce qui indique que les enzymes cytochromes P450 (principalement CYP3A4 et CYP2C9) et les protéines de transport, telles que la P-gp et l'OATP, n'ont pas été affectés par l'alirocumab.
Effet d'autres médicaments sur l'alirocumab
Les statines et autres hypolipémiants sont connus pour accroître la production de la PCSK9, la protéine que cible l'alirocumab. Étant donné qu'un composant de la clairance de l'alirocumab est médié par la cible, une augmentation de la cible pourrait entraîner une exposition réduite à l'alirocumab. Cependant, cet effet n'a pas d'influence sur la durée de l'efficacité lorsque l'alirocumab est administré toutes les deux semaines.
Grossesse/Allaitement
Grossesse
Il n’existe pas de données cliniques concernant l’emploi chez la femme enceinte. On s’attend à ce que l’alirocumab, tout comme les autres anticorps IgG, franchisse la barrière placentaire (voir section «Données précliniques»). Les expérimentations animales n’ont révélé aucune toxicité directe ou indirecte ayant une incidence sur la grossesse, le développement embryonnaire, le développement fœtal et/ou le développement post-natal.
Praluent ne doit pas être utilisé pendant la grossesse, à moins que l’état clinique de la patiente ne nécessite un traitement par Praluent.
Si Praluent est administré à des femmes en âge de procréer en même temps qu’une statine ou un autre médicament hypolipémiant (par ex. l’ézétimibe), le médecin prescripteur doit se référer à la rubrique «Grossesse» de l’information professionnelle des autres médicaments.
Pour une utilisation dans un traitement d'association avec une statine
Les statines sont contre-indiquées chez la femme enceinte. Se reporter au résumé des caractéristiques du produit respectif en vigueur.
Allaitement
On ne sait pas si l'alirocumab est excrété dans le lait humain. Étant donné que de nombreux médicaments et immunoglobulines sont excrétés dans le lait humain, un risque ne peut être exclu chez les nouveau-nés et nourrissons allaités.
Il convient de choisir entre interrompre l'allaitement, interrompre le traitement par Praluent ou ne pas instaurer de traitement par Praluent. Pour cela, il convient de tenir compte du bénéfice de l'allaitement pour l'enfant et du bénéfice du traitement pour la mère.
Pour une utilisation dans un traitement d'association avec une statine
Les statines sont contre-indiquées chez la femme allaitante. Se reporter au résumé des caractéristiques du produit respectif en vigueur.
Fertilité
Les essais réalisés sur des animaux n'ont révélé aucun effet indésirable sur les marqueurs de substitution de la fertilité (voir section «Données précliniques»). Il n'existe aucune donnée relative aux effets indésirables sur la fertilité chez l'humain.
Effet sur l’aptitude à la conduite et l’utilisation de machines
La capacité de réaction et l'aptitude à la conduite et à l'utilisation d'outils et de machines peuvent être altérées en raison des effets indésirables possibles.
Effets indésirables
Résumé du profil d'innocuité
Le profil d'innocuité s'est avéré équivalent chez les patients présentant une hypercholestérolémie hétérozygote familiale sévère ou une maladie cardiovasculaire athérosclérotique cliniquement manifeste et chez les patients présentant une hypercholestérolémie primaire et une dyslipidémie mixte.
Aucune différence n'a été observée dans le profil d'innocuité entre les deux doses (75 mg toutes les deux semaines et 150 mg toutes les deux semaines) utilisées dans le programme de phase 3.
Liste récapitulative des réactions indésirables
Les réactions indésirables suivantes ont été signalées chez des patients traités par l'alirocumab dans des études contrôlées groupées:
Les effets indésirables sont présentés par classes de systèmes d'organes et par ordre décroissant de fréquence, La fréquence est indiquée comme suit: «très fréquents» (≥1/10), «fréquents» (≥1/100 à <1/10) «occasionnels» (≥1/1000 à <1/100), «rares» (≥1/10'000 à <1/1000), «très rares» (<1/10'000).
Tableau 1 - Réactions indésirables signalées chez des patients traités par l'alirocumab dans des études contrôlées de phase III groupées
Classe d'organe/de système | Fréquents | Rares |
|---|---|---|
Affections du système immunitaire | Hypersensibilité, vasculitis d'hypersensibilité | |
Affections respiratoires, thoraciques et médiastinales | Symptômes des voies aériennes supérieuresa Rhino-pharyngite Bronchite Sinusite Toux | |
Troubles généraux et anomalies au site d'administration | Réactions au site d'injectionb | |
Lésions, intoxications et complications liées aux procédures | Contusions | |
Affections musculo-squelettiques et systémiques | Myalgie Spasmes musculaires Douleurs musculosquelettiques | |
Affections de la peau et du tissu sous-cutané | Prurit | Urticaire, Eczéma nummulaire |
Affections gastro-intestinales | Diarrhée | |
Affections du rein et des voies urinaires | Infection des voies urinaires |
a Incluant douleurs oropharyngées, rhinorrhées, éternuements.
b Incluant érythème/rougeur, démangeaisons, gonflement, douleur/sensibilité.
Les données de fréquence des réactions indésirables indiquées dans le tableau 1 sont conformes aux données des études cliniques contrôlées poolées de phase 3 et de l'étude ODYSSEY OUTCOMES.
Effets indésirables après commercialisation
La fréquence des effets indésirables rapportés au cours d’utilisation après commercialisation ne peut pas être déterminée car ils proviennent de déclarations spontanées. En conséquence, la fréquence de ces effets indésirables est qualifiée d’«indéterminée».
Troubles généraux et anomalies au site d’administration
Rares: maladie pseudo-grippale.
Affections de la peau et du tissu sous-cutané
Fréquence indéterminée: Angiœdème.
Description de certains effets indésirables
Réactions localisées au site d'injection
Des réactions localisées au site d'injection, y compris des érythèmes/rougeurs, des gonflements, des douleurs et des hématomes, ont été signalées chez 6,1% des patients traités par l'alirocumab, contre 4,1% dans le groupe témoin. Le taux d'arrêt dû aux réactions localisées au site d'injection était comparable dans les deux groupes (0,2% dans le groupe sous alirocumab, contre 0,4% dans le groupe témoin). Dans l'étude sur les résultats cardiovasculaires (ODYSSEY OUTCOMES), les réactions au site d'injection sont aussi survenues plus fréquemment chez les patients sous alirocumab que chez les patients recevant le placebo (3,8% pour l'alirocumab contre 2,1% pour le placebo).
Réactions allergiques générales
Des réactions allergiques générales ont été rapportées plus fréquemment dans le groupe recevant de l'alirocumab que dans le groupe témoin. Le pourcentage de patients ayant arrêté le traitement par Praluent en raison de réactions allergiques a été supérieur dans le groupe recevant Praluent (0,6% contre 0,2%). En outre, des réactions allergiques rares et parfois graves telles que l'hypersensibilité, l'eczéma nummulaire, l'urticaire et la vascularite d'hypersensibilité ont été signalées dans des essais cliniques contrôlés (voir section «Mises en garde et précautions»).
Dans l'étude sur les résultats cardiovasculaires (ODYSSEY OUTCOMES), les réactions allergiques générales ont été similaires chez les patients sous alirocumab et chez les patients recevant le placebo (7,9% pour l'alirocumab contre 7,8% pour le placebo). Aucune différence en termes d'incidence du prurit n'a été observée.
Etude évaluant l'administration toutes les 4 semaines
Le profil d'innocuité chez les patients recevant une posologie de 300 mg toutes les 4 semaines (une fois par mois) a été similaire à celui décrit pour le programme d'essais cliniques utilisant une posologie 150 mg toutes les 2 semaines. Des réactions locales au site d'injection ont été signalées à une fréquence de 16,6% dans le groupe de traitement recevant 300 mg une fois toutes les 4 semaines et de 7,9% dans le groupe recevant le placebo. Les patients du groupe de traitement à 300 mg d'alirocumab une fois toutes les quatre semaines ont reçu en alternance des injections de placebo afin de maintenir la procédure d'insu concernant la fréquence des injections. Si l'on exclut les réactions au site d'injection qui sont survenues après les injections du placebo, la fréquence de ces réactions était de 11,8%. Le taux d'interruptions dues à des réactions locales au site d'injection a été de 0,7% dans le groupe de traitement recevant 300 mg une fois toutes les 4 semaines et de 0% dans le groupe recevant le placebo.
Valeurs LDL-C faibles <0.65 mmol/L
Même si les essais sur l'alirocumab n'ont pas montré de conséquences indésirables d'une valeur LDL-C très faible, les effets à long terme de valeurs LDL-C très faibles ne sont pas connus. Dans des études génétiques publiées, ainsi que des essais cliniques et des études d'observation avec des traitements hypolipémiants, un risque accru d'apparition de diabète était associé à des valeurs de LDL-C plus faibles.
Dans des études contrôlées groupées utilisant les doses administrées toutes les 2 semaines, 796 patients traités par Praluent sur 3340 (23,8%) ont présenté deux valeurs consécutives de LDL-C <0.65 mmol/L, y compris 288 patients (8,6%) avec deux valeurs consécutives <0.39 mmol/L. Ces résultats ont principalement été obtenus chez les patients pour lesquels un traitement par Praluent à raison de 150 mg toutes les deux semaines a été initié et maintenu, indifféremment du taux initial de LDL-C ou de la réponse au traitement.
Dans l'étude évaluant l'administration toutes les 4 semaines, 113 des 458 patients (24,7%) traités avec 300 mg toutes les 4 semaines/150 mg toutes les 2 semaines, avaient deux valeurs consécutives de LDL -C calculées <0.65 mmol/L, et 45 de 458 patients (9,8%) avait deux valeurs consécutives de LDL- C calculées <0.39 mmol/L.
Aucun signal d'innocuité spécifique relatif à ces valeurs de LDL-C n'a été identifié.
Immunogénicité/anticorps anti-médicaments (ADA)
Comme avec toutes les protéines thérapeutiques, il existe un risque d'immunogénicité. Dans l'étude ODYSSEY OUTCOMES 5.5% des patients traités sous alirocumab à des doses de 75 mg et/ou 150 mg toutes les 2 semaines ont présenté des anticorps anti-médicaments (AAM) décelés après le début du traitement, contre 1,6% des patients sous placebo, la plupart de ces réponses immunitaires étant transitoires.
Une persistance des AAM a été observée chez 0,7% des patients sous alirocumab et chez 0,4% des patients recevant le placebo. Des anticorps neutralisants (AcN) ont été observés chez 0,5% des patients sous alirocumab et chez <0,1% des patients recevant le placebo.
Le titre des anticorps anti-médicament, y compris les AcN, était faible et ne semblait pas avoir de conséquences cliniquement significatives sur l'efficacité ou l'innocuité de l'alirocumab, hormis un taux supérieur de réactions au site d'injection chez les patients avec AAM émergeant en cours de traitement par rapport aux patients ne présentant aucun AAM (7,5% contre 3,6%). Les conséquences à long terme de la poursuite du traitement sous alirocumab en présence d'AAM ne sont pas connues.
Dans un groupe de dix essais contrôlés contre placebo et contre substance active conduits chez des patients recevant l'alirocumab 75 mg et/ou 150 mg une fois toutes les deux semaines, ainsi que dans une étude clinique distincte chez des patients recevant l'alirocumab 75 mg une fois toutes les deux semaines ou 300 mg toutes les 4 semaines (dont certains patients avec ajustement posologique à 150 mg une fois toutes les deux semaines), l'incidence de détection d'AAM et d'AcN était similaire à celle rapportée dans l'essai ODYSSEY OUTCOMES décrite ci-dessus.
Les données sur l'immunogénicité dépendent fortement de la sensibilité et de la spécificité de l'essai ainsi que d'autres facteurs. En outre, l'incidence de la positivité des anticorps observée dans un essai peut être influencée par plusieurs facteurs, notamment la manipulation de l'échantillon, le moment du prélèvement de l'échantillon, les médicaments concomitants et la pathologie sous-jacente. Pour ces raisons, la comparaison de l'incidence des anticorps dirigés contre l'alirocumab avec l'incidence des anticorps dirigés contre d'autres médicaments peut induire en erreur.
Evénements neurocognitifs
Des événements neurocognitifs sont survenus occasionnellement. Lors des études contrôlées initiales, des événements neurocognitifs ont été rapportés chez 0,9% des patients traités par l'alirocumab et chez 0,7% des patients recevant le placebo. Une confusion ou des troubles de la mémoire ont été observés plus fréquemment dans le groupe Praluent (0,2%) que dans le groupe placebo (<0,1%).
Modification des taux d'enzymes hépatiques
Des troubles hépatiques (principalement liés aux enzymes hépatiques) ont été observés chez 2,5% des patients recevant Praluent et chez 1,8% des patients recevant le placebo. En raison de ces troubles hépatiques, 0,4% des patients recevant Praluent contre 0,2% des patients recevant le placebo ont arrêté le traitement. Une élévation des transaminases sériques supérieure à trois fois la limite supérieure de la normale a été observée chez 1,7% des patients recevant Praluent et chez 1,4% des patients recevant le placebo.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Aucun cas de surdosage n'a été rapporté à ce jour.
Propriétés/Effets
Code ATC
C10AX14
Mécanisme d'action
L'alirocumab est un anticorps monoclonal entièrement humain qui se lie à la proprotéine convertase subtilisine/kexine de type 9 (PCSK9) avec une affinité et une spécificité élevées. La PCSK9 se lie aux récepteurs des lipoprotéines de basse densité (LDLR) à la surface des hépatocytes pour favoriser la dégradation des LDLR dans le foie. Le LDLR est le récepteur primaire qui nettoie le LDL en circulation. Par conséquent, la diminution des taux de récepteurs LDLR par la PCSK9 entraîne des taux plus élevés de LDL-C dans le sang. En inhibant la liaison de la PCSK9 au récepteur LDLR, l'alirocumab augmente le nombre de récepteurs LDLR disponibles pour nettoyer le LDL, ce qui réduit les taux de LDL-C.
Pharmacodynamique
L'alirocumab est un anticorps monoclonal entièrement humain qui inhibe l'activité de la PCSK9, à la fois dans les essais in vitro et dans les systèmes de modèle in vivo. De nombreuses études réalisées chez l'animal et chez l'humain ont démontré le rôle central que jouent les taux élevés de LDL-C dans le déclenchement et la progression de l'athérosclérose.
Efficacité clinique
La majorité des patients du programme de phase 3 prenaient un traitement de fond hypolipémiant, composé d'une dose maximale tolérée de statine, avec ou sans hypolipémiants supplémentaires, et présentaient un risque cardiovasculaire (CV) élevé ou très élevé.
Efficacité clinique chez les patients atteints de maladie cardiovasculaire athérosclérotique (ASCVD)
Résumé des études de Phase 3 avec administration de 75 mg et/ou 150 mg toutes les 2 semaines
L'efficacité de Praluent a été étudiée dans cinq essais contre placebo réalisés en double insu auprès de 3499 patients; 54% ne présentaient pas d'hypercholestérolémie familiale mais souffraient d'une pathologie cardiovasculaire athérosclérotique diagnostiquée. Tous les patients recevaient une statine à la dose maximale tolérée, avec ou sans autre traitement hypolipémiant. La durée des essais a été au minimum de 52 semaines, le critère d'efficacité principal étant évalué à la semaine 24 (variation moyenne du LDL-C par rapport aux valeurs initiales, exprimée en pourcentage).
Trois études ont utilisé une dose initiale de 75 mg toutes les 2 semaines, puis, sur des critères préétablis, ont augmenté la dose à 150 mg toutes les 2 semaines à la semaine 12 pour les patients qui n'ont pas atteint, à la semaine 8, leur objectif de LDL-C préalablement défini. La majorité des patients (57% à 83%) traités pendant 12 semaines n'a pas nécessité d'augmentation de la dose. Deux études ont utilisé exclusivement une dose de 150 mg toutes les 2 semaines.
L'étude 1 était un essai multicentrique, réalisé en double insu, contre placebo, dans lequel les patients ont été randomisés pour recevoir soit 150 mg de Praluent toutes les 2 semaines (1553 patients), soit un placebo (788 patients). Tous les patients prenaient des statines à la dose maximale tolérée, avec ou sans autre traitement hypolipémiant, et nécessitaient une réduction plus importante de leur LDL-C. L'âge moyen était de 61 ans (fourchette: 18-89 ans), 38% étaient des femmes, 93% étaient d'origine caucasienne, 3% d'origine africaine et 5% d'origine hispanique/latino-américaine. Globalement, 69% des patients ne présentaient pas d'hypercholestérolémie familiale mais étaient atteints d'une maladie cardiovasculaire établie, et 18% présentaient une heFH. Le taux initial moyen de LDL-C était de 3.16 mmol/L.
Le pourcentage de patients ayant arrêté prématurément le médicament à l'étude avant la semaine 24 (évaluation du critère d'efficacité) a été de 8% parmi les patients traités par Praluent et de 8% parmi ceux recevant le placebo.
À la semaine 24, la différence thérapeutique entre le groupe Praluent et le groupe placebo, en ce qui concerne la variation moyenne du taux de LDL-C (exprimée en %), a été de -58% (IC à 95%: -61%, -56%; valeur de p: <0,0001).
Pour connaître les résultats détaillés, voir le Tableau 2.
Tableau 2 - Variation moyenne (en %) des paramètres lipidiques par rapport aux valeurs initiales et différencea par rapport au placebo, à la semaine 24 de l'Étude 1b (population ITT)
Groupe de traitement | LDL-C | Total-C | Non HDL-C | Apo B |
|---|---|---|---|---|
Semaine 24 (variation moyenne, en %, par rapport aux valeurs initiales) | ||||
Placebo | 1 | 0 | 1 | 1 |
Praluent (150 mg) | -58 | -36 | -49 | -50 |
Différence (moyenne par les moindres carrés) par rapport au placebo (IC à 95%) | -58 (-61, -56) | -36 (-37, -34) | -50 (-52, -47) | -51 (-53, -48) |
a Différence = Praluent moins Placebo b Une approche par le modèle du mélange des schémas a été utilisée avec une imputation multiple des valeurs post-traitement manquantes sur la base de la propre valeur initiale d'un sujet, et une imputation multiple des valeurs en cours de traitement manquantes sur la base d'un modèle incluant les valeurs en cours de traitement disponibles. | ||||
L'étude 2 était un essai multicentrique, réalisé en double insu, contre placebo, dans lequel les patients ont été randomisés pour recevoir soit Praluent (209 patients), soit un placebo (107 patients). Les patients prenaient des statines à la dose maximale tolérée, avec ou sans autre traitement hypolipémiant, et nécessitaient une réduction plus importante de leur LDL-C.
L'âge moyen était de 63 ans (fourchette: 39-87 ans), 34% étaient des femmes, 82% étaient d'origine caucasienne, 16% d'origine africaine et 11% d'origine hispanique/latino-américaine. Globalement, 84% étaient atteints d'une maladie cardiovasculaire établie. La valeur initiale moyenne de LDL-C était de 2.64 mmol/L.
Le pourcentage de patients ayant arrêté prématurément le médicament à l'étude avant la semaine 24 (évaluation du critère d'efficacité) a été de 11% parmi les patients traités par Praluent et de 12% parmi ceux recevant le placebo.
À la semaine 12, la variation moyenne (en %) du LDL-C par rapport à la valeur initiale a été de -45% avec Praluent, contre 1% avec le placebo, et la différence thérapeutique entre Praluent 75 mg toutes les 2 semaines et le placebo quant à la variation moyenne (en %) du LDL-C a été de -46% (IC à 95%: -53%, -39%).
À la semaine 12, si une réduction supplémentaire du LDL-C était nécessaire au regard de critères préétablis, la dose de Praluent a été augmentée à 150 mg toutes les 2 semaines pendant le reste de l'essai. À la semaine 24, la variation moyenne (en %) du LDL-C par rapport à la valeur initiale a été de -44% avec Praluent, et de -2% avec le placebo, et la différence thérapeutique entre Praluent et le placebo quant à la variation moyenne (en %) du LDL-C a été de -43% (IC à 95%: -50%, -35%; valeur de p: <0,0001). La dose a été augmentée à 150 mg toutes les 2 semaines chez 32 (17%) des 191 patients traités par Praluent pendant au moins 12 semaines.
Efficacité clinique dans l'hypercholestérolémie familiale hétérozygote sévère
Les études 3 et 4 étaient des essais multicentriques, réalisés en double insu, contre placebo, dans lequel l'ensemble des patients a été randomisé pour recevoir soit Praluent (490 patients) soit un placebo (245 patients). Les essais étaient similaires dans leur plan expérimental et leurs critères d'éligibilité. Tous les patients étaient atteints de heFH, prenaient des statines à la dose maximale tolérée, avec ou sans autre traitement hypolipémiant, et nécessitaient une réduction plus importante de leur LDL-C. L'âge moyen était de 52 ans (fourchette: 20-87 ans), 45% étaient des femmes, 94% étaient d'origine caucasienne, 1% d'origine africaine et 3% d'origine hispanique/latino-américaine. Globalement, 45% des patients atteints de heFH présentaient également une maladie cardiovasculaire établie. Le taux initial moyen de LDL-C était de 3.65 mmol/L.
Pour l'ensemble de ces deux essais, le pourcentage de patients ayant arrêté prématurément le médicament à l'étude avant la semaine 24 (évaluation du critère d'efficacité) a été de 6% parmi les patients traités par Praluent et de 4% parmi ceux recevant le placebo.
À la semaine 12, la différence thérapeutique entre le groupe recevant Praluent 75 mg 2 fois par semaine et le groupe recevant le placebo quant à la variation moyenne du taux de LDL-C (exprimée en %) a été de -48% (IC à 95%: -52%, -44%).
À la semaine 12, si une réduction supplémentaire du LDL-C était nécessaire au regard de critères préétablis, la dose de Praluent a été augmentée à 150 mg toutes les 2 semaines pendant le reste des essais. À la semaine 24, la différence thérapeutique moyenne entre Praluent et le placebo quant à la variation moyenne du taux de LDL-C (exprimée en %) a été de -54% (IC à 95%: -59%, -50%; valeur de p: <0,0001). La dose a été augmentée à 150 mg toutes les 2 semaines chez 196 (42%) des 469 patients traités par Praluent pendant au moins 12 semaines. L'effet réducteur du taux de LDL-C a été maintenu jusqu'à la semaine 52.
Pour connaître les résultats détaillés, voir le Tableau 3.
Tableau 3 - Variation moyenne (en %) des paramètres lipidiques par rapport aux valeurs initiales et différencea par rapport au placebo, aux semaines 12 et 24 chez les patients atteints de heFH (Études 3 et 4 groupées)b (population ITT).
Groupe de traitement | LDL-C | Total-C | Non HDL-C | Apo B |
|---|---|---|---|---|
Semaine 12 (variation moyenne, en %, par rapport aux valeurs initiales) | ||||
Placebo | 5 | 4 | 5 | 2 |
Praluent (75 mg) | -43 | -27 | -38 | -34 |
Différence (moyenne par les moindres carrés) par rapport au placebo (IC à 95%) | -48 (-52, -44) | -31 (-34, -28) | -42 (-46, -39) | -36 (-39, -33) |
Semaine 24 (variation moyenne, en %, par rapport aux valeurs initiales) | ||||
Placebo | 7 | 5 | 7 | 2 |
Praluent (75 mg, augmentée à 150 mgc) | -47 | -30 | -42 | -40 |
Différence (moyenne par les moindres carrés) par rapport au placebo (IC à 95%) | -54 (-59, -50) | -36 (-39, -33) | -49 (-53, -45) | -42 (-45, -39) |
a Différence = Praluent moins Placebo b Une approche par le modèle du mélange des schémas a été utilisée avec une imputation multiple des valeurs post-traitement manquantes sur la base de la propre valeur initiale d'un sujet, et une imputation multiple des valeurs en cours de traitement manquantes sur la base d'un modèle incluant les valeurs en cours de traitement disponibles. c La dose a été augmentée à 150 mg toutes les 2 semaines chez 196 patients (42%) traités pendant au moins 12 semaines. | ||||
L'étude 5 était un essai multicentrique, réalisé en double insu, contre placebo, dans lequel les patients ont été randomisés pour recevoir soit 150 mg de Praluent toutes les 2 semaines (72 patients), soit un placebo (35 patients). Les patients étaient atteints de heFH et leur taux initial de LDL-C était supérieur à 4.14 mmol/L malgré la prise d'une statine à la dose maximale tolérée, avec ou sans autre traitement hypolipémiant. L'âge moyen était de 51 ans (fourchette: 18-80 ans), 47% étaient des femmes, 88% étaient d'origine caucasienne, 2% d'origine africaine et 6% d'origine hispanique/latino-américaine. Globalement, 50% étaient atteints d'une maladie cardiovasculaire établie. Le taux initial moyen de LDL-C était de 5.13 mmol/L.
Le pourcentage de patients ayant arrêté prématurément le médicament à l'étude avant la semaine 24 (évaluation du critère d'efficacité) a été de 10% parmi les patients traités par Praluent et de 0% parmi ceux recevant le placebo.
À la semaine 24, la variation moyenne (en %) du LDL-C par rapport à la valeur initiale a été de -43% avec Praluent, et de ‑7% avec le placebo, et la différence thérapeutique entre Praluent et le placebo quant à la variation moyenne (en %) du LDL‑C a été de -36% (IC à 95%: -49%, -24%; valeur de p: <0,0001).
Résumé des études de Phase 3 avec administration toutes les 4 semaines
Etude CHOICE I
Etude multicentrique en double aveugle contrôlée contre placebo, réalisée sur une période de 48 semaines auprès de 540 patients recevant une statine à la dose maximale tolérée, avec ou sans autre traitement hypolipémiant (308 patients dans le groupe recevant l'alirocumab à raison de 300 mg une fois toutes les 4 semaines, 76 dans le groupe recevant l'alirocumab à raison de 75 mg une fois toutes les 2 semaines et 156 dans le groupe recevant le placebo), et 252 patients ne recevant pas de statine (144 dans le groupe recevant l'alirocumab à raison de 300 mg une fois toutes les 4 semaines, 37 dans le groupe recevant l'alirocumab à raison de 75 mg une fois toutes les 2 semaines et 71 dans le groupe recevant le placebo). Les patients ont reçu soit de l'alirocumab à raison de 300 mg une fois toutes les 4 semaines ou de 75 mg une fois toutes les 2 semaines, soit un placebo, en plus de leur traitement hypolipémiant en cours (statine, hypolipémiant autre qu'une statine ou régime alimentaire seul). Globalement, 71,6% des patients étaient classés parmi les patients à risque cardiovasculaire élevé ou très élevé et n'avaient pas atteint leur objectif LDL-C. Dans les groupes recevant de l'alirocumab, l'ajustement de la dose à 150 mg toutes les 2 semaines a eu lieu à la semaine 12 chez les patients dont le taux de LDL-C ≥1.81 mmol/L ou ≥2.59 mmol/L mg/dl, en fonction de leur niveau de risque cardiovasculaire, ou chez les patients qui n'avaient pas obtenu une réduction d'au moins 30% de leur LDL-C par rapport aux valeurs initiales.
Dans la cohorte de patients prenant un traitement de fond par statine, le taux moyen de LDL-C initial était de 2.91 mmol/L. A la semaine 12, le pourcentage moyen de variation du LDL-C (analyse ITT) par rapport aux valeurs initiales a été de -55,3% avec l'alirocumab à raison de 300 mg une fois toutes les 4 semaines, contre +1,1% avec le placebo. A la semaine 12 (avant l'ajustement de la dose), 77,3% des patients du groupe traité par l'alirocumab à raison de 300 mg une fois toutes les 4 semaines ont atteint un taux de LDL-C <1.81 mmol/L, contre 9,3% des patients du groupe placebo. A la semaine 24, le pourcentage moyen de variation du LDL-C (analyse ITT) par rapport aux valeurs initiales a été de -58,8% avec l'alirocumab à raison de 300 mg une fois toutes les 4 semaines/150 mg une fois toutes les 2 semaines, contre -0,1% avec le placebo. A la semaine 24, la différence thérapeutique moyenne quant au pourcentage de variation du LDL-C par rapport aux valeurs initiales a été de -58,7% avec l'alirocumab à raison de 300 mg une fois toutes les 4 semaines/150 mg une fois toutes les 2 semaines (IC à 97,5%: -65,0%, -52,4%; valeur de p: <0,0001). Chez les patients traités au-delà de 12 semaines, la dose a été ajustée à 150 mg une fois toutes les 2 semaines chez 56 (19,3%) des 290 patients du groupe recevant l'alirocumab à raison de 300 mg une fois toutes les 4 semaines. Au sein du sous-groupe de patients dont la dose a été ajustée à 150 mg une fois toutes les 2 semaines à la semaine 12, une réduction supplémentaire de 25,4% du LDL-C a été atteinte en semaine 24.
Dans la cohorte de patients ne prenant pas de traitement concomitant par statine, le taux moyen de LDL-C initial était de 3.67 mmol/L. A la semaine 12, le pourcentage moyen de variation du LDL-C (analyse ITT) par rapport aux valeurs initiales a été de -58,4% avec l'alirocumab à raison de 300 mg une fois toutes les 4 semaines, contre +0,3% avec le placebo. A la semaine 12 (avant l'ajustement de la dose), 65,2% des patients du groupe traité par l'alirocumab à raison de 300 mg une fois toutes les 4 semaines ont atteint un taux de LDL-C <70 mg/dl, contre 2,8% des patients du groupe placebo. A la semaine 24, le pourcentage moyen de variation du LDL-C (analyse ITT) par rapport aux valeurs initiales a été de -52,7% avec l'alirocumab à raison de 300 mg une fois toutes les 4 semaines/150 mg une fois toutes les 2 semaines, contre -0,3% avec le placebo. A la semaine 24, la différence thérapeutique moyenne par rapport au placebo quant au pourcentage de variation du LDL-C par rapport aux valeurs initiales a été de -52,4% avec l'alirocumab à raison de 300 mg une fois toutes les 4 semaines/150 mg une fois toutes les 2 semaines (IC à 97,5%: -59,8%, -45,0%; valeur de p: <0,0001). Chez les patients traités au-delà de 12 semaines, la dose a été ajustée à 150 mg une fois toutes les 2 semaines chez 19 (14,7%) des 129 patients du groupe recevant l'alirocumab à raison de 300 mg une fois toutes les 4 semaines. Au sein du sous-groupe de patients dont la dose a été ajustée à 150 mg une fois toutes les 2 semaines à la semaine 12, une réduction moyenne supplémentaire de 7,3% du LDL-C a été atteinte à la semaine 24.
Etude ODYSSEY OUTCOMES
Essai multicentrique contrôlé contre placebo en double aveugle chez 18 924 adultes à risque cardiovasculaire élevé (9462 recevant l'alirocumab et 9462 le placebo). La durée médiane du suivi était de 33 mois (2.8 ans). Tous les patients étaient randomisés à raison de 1:1 pour recevoir l'alirocumab 75 mg ou le placebo une fois toutes les deux semaines. Au deuxième mois, pour les patients chez qui la dose avait été ajustée à 150 mg une fois toutes les deux semaines et qui présentaient, deux fois consécutives, une valeur LDL-C inférieure à 0,65 mmol/l (25 mg/dl), une réduction posologique était appliquée, à savoir le passage de 150 mg une fois toutes les deux semaines à 75 mg une fois toutes les deux semaines. Les patients recevant 75 mg une fois toutes les deux semaines et qui présentaient, deux fois consécutives, une valeur LDL-C inférieure à 0,39 mmol/l (15 mg/dl ) ont été changés sur placebo en aveugle tout en étant évalué dans le groupe alirocumab. Sur 9451 patients sous alirocumab, environ 2615 (27,7%) étaient passés à 150 mg une fois toutes les deux semaines. Sur ces 2615 patients, 805 (30,8%) sont ensuite passés à 75 mg une fois toutes les deux semaines. Dans l'ensemble, 730 (7,7%) patients sur 9451 ont été changés sur placebo en aveugle tout en étant évalué dans le groupe alirocumab. Le traitement a été interrompu par 14.2% des patients dans le groupe alirocumab et par 15.8% dans le groupe placebo. Au total, 99,5% des patients ont fait l'objet d'un suivi concernant la survie jusqu'à la fin de l'essai.
L'événement SCA initial était un infarctus du myocarde chez 83,2% des patients (34,6% STEMI, 48,6% NSTEMI) et un épisode d'angor instable chez 16,8% des patients.
L'alirocumab a significativement réduit le risque pour le critère d'évaluation composite primaire (décès par coronaropathie, infarctus du myocarde non fatal, accident ischémique cérébral fatal et non fatal, angor instable nécessitant une hospitalisation). Des réductions significatives des composants individuels (infarctus du myocarde non fatal, accident ischémique cérébral fatal et non fatal, angor instable nécessitant une hospitalisation) ont été observées sauf pour les décès par coronaropathie (voir Tableau 4).
Tableau 4 - Efficacité de l'alirocumab dans l'essai ODYSSEY OUTCOMES (ensemble de la population)
Alirocumab (N=9462) n (%) | Placebo (N=9462) n (%) | Hazard Ratio (95% IC)a | Valeur pb | |
|---|---|---|---|---|
Critère d'évaluation primaire: composite comprenant décès par coronaropathie, infarctus du myocarde non fatal, accident vasculaire cérébral fatal et non fatal, ou angor instable nécessitant une hospitalisation | 903 (9.5) | 1052 (11.1) | 0.85 (0.78–0.93) | 0.0003 |
Décès par coronaropathie | 205 (2.2 ) | 222 (2.3) | 0.92 (0.76–1.11) | 0.38 |
Infarctus du myocarde (non fatal) | 626 (6.6) | 722 (7.6) | 0.86 (0.77–0.96) | 0.006c |
Accident vasculaire cérébral (fatal/non fatal) | 111 (1.2) | 152 (1.6) | 0.73 (0.57–0.93) | 0.01c |
Angor instable nécessitant une hospitalisation | 37 (0.4) | 60 (0.6) | 0.61 (0.41–0.92) | 0.02c |
Mortalité toutes causes | 334 (3.5) | 392 (4.1) | 0.85 (0.73–0.98) | 0.0261c |
a Basé sur un modèle de Cox
b Test bilatéral du log rank
c Significativité nominale
Pharmacocinétique
Absorption
Après l'administration sous-cutanée de 50 mg à 300 mg d'alirocumab, la durée médiane pour atteindre la concentration sérique maximale (tmax) était de 3 à 7 jours. Les propriétés pharmacocinétiques de l'alirocumab suite à l'administration sous-cutanée d'une dose unique de 75 mg dans l'abdomen, la partie supérieure du bras ou la cuisse étaient similaires. La biodisponibilité absolue de l'alirocumab suite à l'administration sous-cutanée était d'environ 85%, tel que déterminé par l'analyse pharmacocinétique de la population.
Après l'administration de 75 mg et 150 mg, l'état d'équilibre a été atteint après 2 à 3 doses, avec un rapport d'accumulation d'environ 2 fois.
L'exposition mensuelle au traitement à 300 mg toutes les 4 semaines était similaire à celle de 150 mg toutes les 2 semaines. Les fluctuations entre la Cmax et la concentration résiduelle étaient plus élevées pour le schéma posologique de quatre semaines. L'état d'équilibre a été atteint après 2 à 3 doses, avec un rapport d'accumulation maximum de 2 fois.
Distribution
Suite à une administration intraveineuse, le volume de distribution était d'environ 0,04 à 0,05 L/kg, ce qui indique que l'alirocumab est distribué principalement dans le système circulatoire.
Métabolisme
Aucune étude spécifique sur le métabolisme n'a été menée car l'alirocumab est une protéine. L'alirocumab est censé se dégrader en petits peptides et en acides aminés individuels.
Élimination
Deux phases d'élimination ont été observées pour l'alirocumab. À de faibles concentrations, l'élimination a principalement lieu par l'intermédiaire d'une liaison saturable à la cible (PCSK9), tandis qu'à des concentrations plus élevées, l'alirocumab est essentiellement éliminé via une voie protéolytique non saturable.
Sur la base d'une analyse pharmacocinétique de la population, la demi-vie apparente médiane de l'alirocumab à l'état d'équilibre était de 17 à 20 jours chez des patients recevant l'alirocumab en monothérapie, à des doses sous-cutanées de 75 mg toutes les deux semaines ou de 150 mg toutes les deux semaines. Lors d'une co-administration avec une statine, la demi-vie apparente médiane de l'alirocumab était de 12 jours.
Linéarité/non-linéarité
Une augmentation des concentrations totales d'alirocumab légèrement supérieure à une augmentation proportionnelle à la dose, comprise entre 2,1 et 2,7 fois, a été observée en passant de 75 mg à 150 mg toutes les 2 semaines.
Cinétique pour certains groupes de patients
Poids
Une analyse pharmacocinétique de population a montré que le poids corporel exerce une légère influence sur l’exposition à l’alirocumab, probablement sans conséquence sur l’efficacité ou l’innocuité. L’exposition à l’alirocumab (ASC0-14j) à l’état d’équilibre pour des posologies de 75 mg et 150 mg 2 fois par semaine a diminué de 29% et 36% chez les patients pesant plus de 100 kg, par comparaison avec les patients pesant entre 50 kg et 100 kg.
Relations pharmacocinétiques/pharmacodynamiques
L’effet pharmacodynamique de l’alirocumab, c’est-à-dire de réduction du taux de LDL-C, est indirect et médié par la liaison à la PCSK9. Une réduction concentration-dépendante des taux de PCSK9 libre et de LDL-C est observée jusqu’à ce que la saturation de la cible soit atteinte. À saturation de la liaison à la PCSK9, des augmentations supplémentaires des concentrations d’alirocumab n’entraînent pas de réduction supplémentaire du taux de LDL-C. Cependant, une durée prolongée de l’effet réducteur du taux de LDL-C est observée.
Troubles de la fonction hépatique
Dans une étude de phase 1, après l’administration d’une dose sous-cutanée unique de 75 mg, l’exposition à l’alirocumab des sujets présentant une insuffisance hépatique légère à modérée a été légèrement reduit comparée à celle des sujets présentant une fonction hépatique normale. Aucune donnée n’est disponible pour les patients souffrant d’une insuffisance hépatique grave.
Troubles de la fonction rénale
Étant donné que les anticorps monoclonaux ne sont pas connus pour être éliminés par la voie rénale, la fonction rénale ne devrait pas influencer les propriétés pharmacocinétiques de l’alirocumab. Les analyses pharmacocinétiques de la population indiquent qu’une insuffisance rénale légère à modérée n’exerçait probablement pas d’influence pertinent sur les propriétés pharmacocinétiques de l’alirocumab. Aucune donnée n’est disponible pour les patients souffrant d’une insuffisance rénale grave.
Patients âgés
Sur la base d’une analyse pharmacocinétique de la population, l’âge a été associé à une légère différence de l’exposition à l’alirocumab au stade d’équilibre, probablement sans influence sur l’efficacité ou l’innocuité. L’exposition à l’alirocumab à l’état d’équilibre (ASC0-14j) pour des posologies de 75 mg et 150 mg 2 fois par semaine a augmenté de 10% à 36% chez les patients âgés de plus de 75 ans par comparaison avec les patients âgés de moins de 65 ans.
Polymorphismes génétiques
Sur la base d’une analyse pharmacocinétique de la population, la race n’a pas exercé d’influence sur les propriétés pharmacocinétiques de l’alirocumab. Suite à l’administration sous-cutanée d’une dose unique de 100 mg à 300 mg d’alirocumab, aucune différence significative n’a été observée en termes d’exposition entre les sujets sains japonais et blancs.
Sur la base d’une analyse pharmacocinétique de la population, le sexe n’a pas exercé d’influence sur les propriétés pharmacocinétiques de l’alirocumab.
Données précliniques
Les données non cliniques ne révèlent aucun risque spécifique pour les humains, sur la base d’évaluations de la pharmacologie de sécurité, de la toxicité des doses répétées et de la toxicité pour la reproduction et le développement.
Mutagénicité
Aucune étude relative à la génotoxicité et à la mutagénicité n’a été réalisée.
Carcinogénicité
Aucune étude relative à la carcinogénicité n’a été réalisée.
Toxicité sur la reproduction
Des études relatives à la toxicologie reproductive, réalisées chez le rat et le singe, ont indiqué que l’alirocumab, comme les autres anticorps IgG, traverse la barrière placentaire.
Aucun effet indésirable n’a été observé sur les marqueurs de substitution de la fertilité (p.ex. cyclicité œstrale, volume testiculaire, volume d’éjaculation, motilité du sperme ou nombre total de spermatozoïdes par éjaculation) chez le singe, et aucun résultat anormal lié à l’alirocumab n’a été observé au niveau des tissus reproducteurs sur les plans anatomique, pathologique ou histopathologique dans les études de toxicologie réalisées chez le rat ou le singe.
Les descendants de singes ayant reçu des doses élevées d’alirocumab une fois par semaine tout au long de la gestation ont présenté une réponse immunitaire secondaire plus faible après provocation antigénique que les animaux témoins. Aucun autre signe de trouble immunitaire n’a été observé chez les descendants.
Remarques particulières
Incompatibilités
Aucune étude de tolérance n'ayant été effectuée, ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Conserver ce médicament hors de la vue et de la portée des enfants.
Conserver au réfrigérateur (2 °C à 8 °C).
Ne pas congeler.
Praluent peut être conservé en dehors du réfrigérateur à une température ne dépassant pas 25 °C et à l'abri de la lumière jusqu'à 30 jours maximum. Une fois sorti du réfrigérateur, le médicament doit être utilisé dans les 30 jours ou éliminé.
Conserver la seringue ou le stylo dans l'emballage extérieur d'origine pour la protéger de la lumière.
Ne pas exposer à une chaleur extrême.
Numéro d’autorisation
65661, 65882 (Swissmedic)
Titulaire de l’autorisation
sanofi-aventis (suisse) sa, 1214 Vernier/GE
Mise à jour de l’information
Mai 2020
Відгуки (0)
Ви переглядали

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.



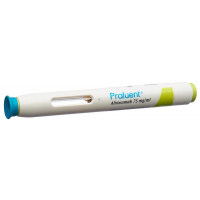
 Deutsch
Deutsch French
French Italian
Italian