Linezolid Pfizer Filmtable 600 мг 10 шт
Linezolid Pfizer Filmtabl 600 mg 10 Stk
-
97753.08 RUB
При оплате криптовалютой:
Ваша прибыль 9775.31 RUB / 115.38 USDT
Опис
Was ist Linezolid Pfizer und wann wird es angewendet?
Linezolid Pfizer ist ein Antibiotikum, das den Wirkstoff Linezolid enthält und gegen bakterielle Infektionskrankheiten mit bestimmten Keimen wirksam ist. Linezolid Pfizer darf nur auf Verschreibung des Arztes oder der Ärztin zur Behandlung von schweren, im Spital erworbenen Lungenentzündungen, sowie komplizierten Hautinfektionen und Weichteilinfektionen eingesetzt werden, wenn andere Antibiotika gegen diese Keime unwirksam sind.
Was sollte dazu beachtet werden?
Dieses Arzneimittel wurde Ihnen von Ihrem Arzt oder Ihrer Ärztin zur Behandlung Ihrer gegenwärtigen Erkrankung verschrieben.
Das Antibiotikum in Linezolid Pfizer ist nicht gegen alle Mikroorganismen, welche Infektionskrankheiten verursachen, wirksam. Die Anwendung eines falsch gewählten oder nicht richtig dosierten Antibiotikums kann Komplikationen verursachen. Wenden Sie es deshalb nie von sich aus für die Behandlung anderer Erkrankungen oder anderer Personen an.
Wann darf Linezolid Pfizer nicht angewendet werden?
Bei einer bekannten oder vermuteten Überempfindlichkeit (Allergie) auf einen der Inhaltsstoffe von Linezolid Pfizer.
Wann ist bei der Einnahme von Linezolid Pfizer Vorsicht geboten?
Linezolid Pfizer kann mit zahlreichen Arzneimitteln Wechselwirkungen eingehen, z.B. mit Antidepressiva, gewissen Herz- und Asthmamitteln, gewissen Arzneimitteln gegen Schnupfen oder Husten (z.B. mit den Wirkstoffen Pseudoephedrin, Phenylpropanolamin), Appetitzüglern, rifampicinhaltigen Arzneimitteln, bestimmten Migränemitteln (sog. Triptanen), Schmerzmitteln (z.B. mit den Wirkstoffen Pethidin, Tramadol), angstlösenden Arzneimitteln mit dem Wirkstoff Buspiron, Adrenalin-, Noradrenalin- sowie dopaminhaltigen Arzneimitteln und Arzneimitteln gegen Parkinson mit dem Wirkstoff Selegilin. Informieren Sie deshalb Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin über alle Arzneimittel, die Sie einnehmen.
Wenn Sie ein empfängnisverhütendes Mittel («Pille») nehmen, beachten Sie, dass seine Wirksamkeit während einer Antibiotika-Therapie herabgesetzt werden kann. Deshalb kann Ihr Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin weitere Massnahmen zur Empfängnisverhütung empfehlen.
Linezolid Pfizer kann sich mit gewissen Nahrungsbestandteilen schlecht vertragen. Vermeiden Sie es daher, zu viel reifen Käse, Hefeextrakte, Sojaprodukte (z.B. Sojasauce) oder alkoholische Getränke einzunehmen. Wenn Sie nach dem Essen hämmernde Kopfschmerzen haben, teilen Sie dies dem Arzt oder Apotheker bzw. der Ärztin oder Apothekerin mit.
Leiden Sie unter nicht-kontrolliertem Bluthochdruck, Blutdruckkrisen infolge eines Tumorleidens (wie Phäochromozytom oder Karzinoid), einer Überfunktion der Schilddrüse, bestimmten psychischen Erkrankungen (wie Depressionen, bipolaren Psychosen oder Verwirrtheit), sollten Sie Linezolid Pfizer nur dann einnehmen, wenn die Möglichkeit zur genauen Beobachtung und zur Kontrolle des Blutdrucks besteht.
Informieren Sie Ihren Arzt, Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie unter Epilepsie leiden oder früher bei Ihnen epileptische Anfälle aufgetreten sind. Bitte teilen Sie diesen Personen auch mit, wenn Ihre Nieren- oder Leberfunktion stark eingeschränkt ist.
Dieses Arzneimittel kann die Reaktionsfähigkeit, Fahrtüchigkeit und Fähigkeit Werkzeuge oder Maschinen zu bedienen beeinträchtigen (vgl. «Welche Nebenwirkungen kann Linezolid Pfizer haben?»). Bei Teilnahme am Strassenverkehr und beim Bedienen von Maschinen ist insbesondere zu Beginn der Behandlung sowie bei längerer Behandlung (Sehstörungen) Vorsicht geboten.
Informieren Sie Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin, wenn Sie an anderen Krankheiten leiden, Allergien haben oder andere Arzneimittel (auch selbstgekaufte!) einnehmen.
Darf Linezolid Pfizer während einer Schwangerschaft oder in der Stillzeit eingenommen werden?
Wenn Sie schwanger sind, es werden möchten oder stillen, darf Linezolid Pfizer nur mit ausdrücklicher Genehmigung des Arztes oder Apothekers bzw. der Ärztin oder Apothekerin eingenommen werden.
Wie verwenden Sie Linezolid Pfizer?
Der Arzt oder die Ärztin legt aufgrund der Schwere der Erkrankung die Dosierung und Behandlungsdauer fest. Ändern Sie nicht von sich aus die verschriebene Dosierung oder Therapiedauer. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Im Allgemeinen gelten folgende Dosierungsrichtlinien:
Erwachsene
Zwei mal täglich 600 mg.
Linezolid Pfizer Suspension zum Einnehmen wird in der Regel vom Apotheker aus dem Granulat folgendermassen hergestellt:
Granulat leicht aufschütteln und 123 ml Leitungswasser bereit stellen. Zuerst eine Hälfte des Wassers der Flasche beifügen und kräftig schütteln. Anschliessend den Rest des Wassers ebenfalls beifügen und nochmals kräftig schütteln, bis eine homogene Suspension entsteht. Dies ergibt 150 ml gebrauchsfertige Linezolid Pfizer Suspension zum Einnehmen. Linezolid Pfizer Suspension und Linezolid Pfizer Filmtabletten können vor, während oder nach einer Mahlzeit eingenommen werden.
Dialysepatienten sollten Linezolid Pfizer nach der Dialyse einnehmen.
Eine begonnene Antibiotika-Therapie sollte so lange wie vom Arzt oder der Ärztin verordnet durchgeführt werden. Die Krankheitssymptome verschwinden oft bevor die Infektion vollständig ausgeheilt ist. Eine ungenügende Anwendungsdauer oder ein zu frühes Beenden der Behandlung kann ein erneutes Aufflammen der Erkrankung zur Folge haben.
Sollten Sie versehentlich zu viel Linezolid Pfizer Filmtabletten oder Suspension geschluckt haben, melden Sie dies sofort dem Arzt oder Apotheker bzw. der Ärztin oder Apothekerin.
Sollten Sie einmal eine Dosis vergessen haben, fahren Sie mit der Therapie normal weiter, sobald Sie dies feststellen. Verdoppeln Sie auf keinen Fall die Dosis.
Im Allgemeinen dauert eine Therapie mit Linezolid Pfizer 10–14 Tage, kann aber bis maximal 28 Tage dauern.
Kinder und Jugendliche unter 18 Jahren
Es liegen nur beschränkte Daten zur Wirksamkeit und Sicherheit bei Kindern und Jugendlichen (unter 18 Jahren) vor. Bis weitere Daten vorliegen, wird die Anwendung von Linezolid Pfizer in dieser Altersgruppe daher nicht empfohlen.
Welche Nebenwirkungen kann Linezolid Pfizer haben?
Folgende Nebenwirkungen können bei der Einnahme oder Anwendung von Linezolid Pfizer auftreten:
Am häufigsten treten Durchfall, Übelkeit, Erbrechen, Krämpfe, Blähungen und Kopfschmerzen sowie Geschmacksveränderungen (Metallgeschmack), hohe Blutzuckerwerte (Hyperglykämie) und Pilzinfektionen, veränderte Leberwerte auf. Treten schwere, anhaltende Durchfälle mit Bauchkrämpfen und Fieber auf, ist das Arzneimittel abzusetzen und der behandelnde Arzt oder die behandelnde Ärztin unverzüglich zu benachrichtigen. Beim Auftreten von Durchfall dürfen keine Arzneimittel, die die Darmperistaltik (Darmbewegung) hemmen, eingenommen werden.
Fälle von sog. Laktazidose wurden nach Einnahme von Linezolid Pfizer beobachtet; bei sehr starker und wiederkehrender Übelkeit und Erbrechen ist der behandelnde Arzt oder die behandelnde Ärztin ebenfalls unverzüglich zu benachrichtigen.
Ausserdem treten gelegentlich folgende Nebenwirkungen auf: Frösteln, Fieber, Schwindel, verschwommenes Sehen, Müdigkeit, Schlaflosigkeit, Ohrensausen (Tinnitus), Mundtrockenheit, vermehrter Durst, Magen-Darmbeschwerden, Bauchschmerzen, Verstopfung, Mundschleimhautentzündung, geschwollene oder verfärbte Zunge, Bauchspeicheldrüsenentzündungen (Pankreatitis, gekennzeichnet durch: plötzlich auftretende, heftige Schmerzen im Oberbauch, Übelkeit und Erbrechen), gesteigerte Harnproduktion, Kribbeln, Taubheitsgefühl, veränderter Blutdruck, Hautreaktionen (Rötung, Juckreiz), vermehrtes Schwitzen, Scheidenentzündung.
Selten wurden nach der Einnahme von Linezolid Pfizer Krampfanfälle (Konvulsionen) beobachtet, vor allem bei Personen mit entsprechender Veranlagung (vgl. auch Hinweis unter «Wann ist bei der Einnahme von Linezolid Pfizer Vorsicht geboten?»).
Unter der Behandlung mit Linezolid Pfizer kann es zu Blutbildveränderungen kommen wie zum Beispiel Mangel an roten oder weissen Blutkörperchen oder an Blutplättchen. Symptome solcher Blutbildveränderungen können Leistungsabfall, Müdigkeit, Fieber, Schüttelfrost, kleine Blutergüsse, Schleimhautblutungen, sowie gestörte Wundheilung sein.
Auch über schwerwiegende Haut- und Überempfindlichkeitsreaktionen wurde berichtet. Linezolid Pfizer ist bei den ersten Anzeichen von allergischen Reaktionen (z.B. Hautrötungen, Hautausschlag mit Bläschenbildung, Schwellungen von Gesicht, Haut oder Schleimhäuten, Asthma, Atemnot, Kreislaufbeschwerden) abzusetzen und umgehend der Arzt/die Ärztin zu kontaktieren.
Der Wirkstoff von Linezolid Pfizer kann bestimmte körpereigene Stoffe (die sog. Monoaminoxidasen, MAO) schwach hemmen. Infolge von Wechselwirkungen mit anderen Arzneimitteln oder auch Nahrungsbestandteilen (vgl. Hinweis unter «Wann ist bei der Einnahme von Linezolid Pfizer Vorsicht geboten?»), kam es in Einzelfällen zu unerwünschten Arzneimittelwirkungen, welche auf diese Eigenschaft zurückzuführen sind. Anzeichen einer solchen Wechselwirkung können Ängstlichkeit, Zittern, Krämpfe, Rotanlaufen, Kopfschmerzen, Herzrasen, Kurzatmigkeit und Bluthochdruck sein.
Sehr selten wurden Empfindungsstörungen und/oder Sehstörungen wie verschwommenes oder unscharfes Sehen, Änderungen im Farbsehen, blinde Flecken (sog. periphere und/oder optische Neuropathien) beobachtet. Wenn Sie derartige Sehstörungen bei sich bemerken, kontaktieren Sie bitte umgehend Ihren Arzt oder Ihre Ärztin.
Ebenfalls sehr selten wurden nach der Anwendung von Linezolid Pfizer oberflächliche Zahnverfärbungen beobachtet. In den Fällen mit bekanntem Ausgang konnten die Verfärbungen mit zahnhygienischen Massnahmen (manuell) entfernt werden.
Wenn Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind, sollten Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin informieren.
Was ist ferner zu beachten?
Linezolid Pfizer Filmtabletten und Linezolid Pfizer Granulat zur Herstellung einer Suspension zum Einnehmen dürfen nur bis zu dem auf dem Behälter mit «EXP». bezeichneten Verfalldatum verwendet werden.
Bei Raumtemperatur (15-25 °C) und ausser Reichweite von Kindern aufbewahren.
Die gebrauchsfertige Linezolid Pfizer Suspension zum Einnehmen ist 3 Wochen bei Raumtemperatur (15‑25 °C) haltbar. Flasche vor Gebrauch 3-5 mal kippen. Nicht schütteln.
Nach Beendigung der Behandlung das Arzneimittel mit dem restlichen Inhalt dem Arzt oder Apotheker bzw. der Ärztin oder Apothekerin zur fachgerechten Entsorgung zurückbringen.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Linezolid Pfizer enthalten?
1 Linezolid Pfizer Filmtablette enthält 600 mg Linezolid sowie die folgenden Hilfsstoffe:
Tablettenkern: Mikrokristalline Cellulose (E460), Maisstärke, Carboxymethylstärke-Natrium, Hydroxypropylzellulose (E463), Magnesiumstearat (E572).
Filmüberzug: Hypromellose (E464), Macrogol 400, Titandioxid (E171), Carnaubawachs (E903).
Weisse, länglich-ovale Filmtablette mit Prägung «LZD» auf der einen und «600» auf der anderen Seite.
1 ml Linezolid Pfizer Suspension zum Einnehmen enthält, nach Auflösen des Granulats in 123 ml Wasser, 20 mg Linezolid sowie die folgenden Hilfsstoffe: Zucker 210.6 mg/ml, Mannitol (E421), Mikrokristalline Cellulose (E460), Carmellose-Natrium (E466), Aspartam (E951), modifizierte Stärke*, Sorbitol*, Fructose*, Maltodextrin*, Hochdisperses Siliciumdioxid (E551), Natriumcitrat (E331), Xanthangummi (E415), Zitronensäure (E330), Natriumchlorid, das Konservierungsmittel Natriumbenzoat (E211) sowie Geschmacksstoffe sowie Vanillin und Ethylvanillin.
* hergestellt aus gentechnisch verändertem Organismus: Mais.
30 ml Suspension zum Einnehmen (6 Messlöffel à 5 ml) entsprechen einer Einzeldosis von 600 mg Linezolid und enthalten 6.32 g verwertbare Kohlenhydrate.
Zulassungsnummer
66253 (Filmtabletten), 66250 (Granulat zur Herstellung einer Suspension zum Einnehmen) (Swissmedic)
Wo erhalten Sie Linezolid Pfizer? Welche Packungen sind erhältlich?
In Apotheken gegen ärztliches Rezept, das nur zum einmaligen Bezug berechtigt, erhalten Sie folgende Packungen:
Linezolid Pfizer 600 mg: 10 Filmtabletten
Linezolid Pfizer 20 mg/ml: 1 Flasche mit Granulat zur Herstellung von 150 ml Suspension zum Einnehmen.
Zulassungsinhaberin
Pfizer AG, Zürich
Diese Packungsbeilage wurde im März 2018 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
PIL V005
Qu'est-ce que Linezolid Pfizer et quand est-il utilisé?
Linezolid Pfizer est un antibiotique contenant le principe actif linézolide et agissant contre les infections bactériennes dues à certains germes. Linezolid Pfizer doit être utilisé uniquement sur prescription médicale pour le traitement des pneumonies sévères contractées à l'hôpital, ainsi que des infections compliquées de la peau et des tissus mous lorsque d'autres antibiotiques sont inefficaces contre ces germes.
De quoi faut-il tenir compte en dehors du traitement?
Votre médecin vous a prescrit ce médicament pour le traitement de la maladie dont vous souffrez actuellement.
L'antibiotique présent dans Linezolid Pfizer n'agit pas contre tous les microorganismes provoquant des maladies infectieuses. L'emploi d'un antibiotique mal choisi ou mal dosé peut être à l'origine de complications. En conséquence, ne l'employez jamais de votre propre initiative pour le traitement d'autres maladies ou d'autres personnes.
Quand Linezolid Pfizer ne doit-il pas être utilisé?
Lors d'une hypersensibilité (allergie) connue ou supposée à de l'un des composants de Linezolid Pfizer.
Quelles sont les précautions à observer lors de la prise de Linezolid Pfizer?
Des interactions sont possibles entre Linezolid Pfizer et de nombreux médicaments, comme par ex. les antidépresseurs; certains médicaments pour le cœur ou contre l'asthme; certains médicaments utilisés lors de rhume ou de toux (contenant par ex. les principes actifs pseudoéphédrine ou phénylpropanolamine); les anorexigènes; les médicaments contenant de la rifampicine; certains médicaments contre la migraine (appelés triptans); les antalgiques (par ex. avec les principes actifs péthidine ou tramadol); les anxiolytiques contenant la buspirone comme principe actif; les médicaments contenant de l'adrénaline, de la noradrénaline ainsi que de la dopamine comme principes actifs; les médicaments utilisés dans la maladie de Parkinson contenant de la sélégiline comme principe actif. C'est pourquoi vous êtes prié(e) d'informer votre médecin ou votre pharmacien au sujet de tous les médicaments que vous prenez.
Si vous prenez un contraceptif oral («pilule»), veuillez prendre en considération que son efficacité peut être diminuée durant une antibiothérapie. C'est pourquoi votre médecin ou votre pharmacien pourront vous recommander des mesures contraceptives supplémentaires.
Linezolid Pfizer n'est parfois pas bien supporté lorsqu'il est pris en même temps que certains composants alimentaires. Par conséquent, évitez de consommer des quantités importantes de fromage corsé, d'extraits de levure, de produits à base de soja (par ex. sauce au soja) ou des boissons alcoolisées. Si vous développez des maux de tête de type martelant après les repas, veuillez le communiquer à votre médecin ou à votre pharmacien.
Si vous souffrez d'une hypertension artérielle non maîtrisée, de crises d'hypertension dues à une tumeur (comme un phéochromocytome ou une tumeur carcinoïde), d'une hyperactivité de la glande thyroïde, de certaines maladies psychiques (comme la dépression, les psychoses bipolaires ou la confusion mentale), vous ne devez prendre Linezolid Pfizer que si la possibilité d'une surveillance étroite et d'un contrôle de la tension artérielle est présente.
Si vous souffrez d'une épilepsie ou si vous avez présenté par le passé des crises épileptiques, veuillez en informer votre médecin ou votre pharmacien. Veuillez également informer ces personnes si vous souffrez d'une limitation sévère de la fonction rénale ou hépatique.
Ce médicament peut entraver la faculté de réaction, l'aptitude à la conduite et au maniement d'outils ou de machines (voir «Quels effets indésirables Linezolid Pfizer peut-il avoir?»). La prudence est recommandée chez les conducteurs de véhicules et les utilisateurs de machines, en particulier au début du traitement, ainsi que lors d'un traitement de longue durée (troubles de la vision).
Veuillez informer votre médecin ou votre pharmacien si vous souffrez d'une autre maladie, si vous êtes allergique ou si vous prenez déjà d'autres médicaments en usage interne ou externe (même en automédication)!
Linezolid Pfizer peut-il être pris pendant la grossesse ou l'allaitement?
Si vous êtes enceinte, si vous envisagez une grossesse ou si vous allaitez, vous ne devez prendre Linezolid Pfizer qu'avec l'accord explicite de votre médecin ou de votre pharmacien.
Comment utiliser Linezolid Pfizer?
Votre médecin fixera la posologie et la durée du traitement en fonction de la gravité de la maladie. Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
En général, les posologies recommandées sont les suivantes:
Adultes
600 mg deux fois par jour.
La suspension buvable Linezolid Pfizer est généralement préparée par le pharmacien à partir du granulé selon la procédure suivante:
Secouer légèrement le granulé et préparer 123 ml d'eau du robinet. Commencer par ajouter la moitié de l'eau dans le flacon et agiter vigoureusement. Ajouter ensuite le reste de l'eau et agiter à nouveau vigoureusement jusqu'à ce que la suspension soit homogène. On obtient ainsi 150 ml de suspension buvable Linezolid Pfizer prête à l'emploi. La suspension Linezolid Pfizer et les comprimés Linezolid Pfizer peuvent être pris avant, pendant ou après un repas.
Les patients dialysés doivent prendre Linezolid Pfizer après la dialyse.
Une fois instaurée, l'antibiothérapie doit être poursuivie aussi longtemps que le médecin l'a prescrit. Les symptômes de la maladie disparaissent souvent avant la guérison complète de l'infection. Une durée d'utilisation trop courte ou un arrêt prématuré du traitement peut provoquer une rechute de la maladie.
Si vous avez accidentellement avalé trop de comprimés ou de suspension Linezolid Pfizer, veuillez le signaler immédiatement à votre médecin ou votre pharmacien.
S'il vous arrive d'oublier une dose, poursuivez le traitement normalement dès que vous vous rendez compte de l'oubli. Ne doublez en aucun cas la dose.
En général, un traitement par Linezolid Pfizer dure 10 à 14 jours, mais il peut également être poursuivi durant 28 jours au maximum.
Enfants et adolescents de moins de 18 ans
Les données disponibles sur l'efficacité et la sécurité d'emploi chez l'enfant et l'adolescent (de moins de 18 ans) sont limitées. En conséquence, l'utilisation n'est pas recommandée chez les patients de cette tranche d'âge.
Quels effets secondaires Linezolid Pfizer peut-il provoquer?
La prise de Linezolid Pfizer peut provoquer les effets indésirables suivants:
diarrhée, nausées, vomissements, crampes, ballonnements et céphalées ainsi que modifications du goût (goût métallique), un taux de sucre élevé dans le sang (hyperglycémie), infections fongiques et altérations des tests hépatiques sont les effets indésirables les plus fréquents. Si des diarrhées sévères et persistantes accompagnées de crampes abdominales et de fièvre devaient apparaître, le médicament doit être arrêté et le médecin traitant averti immédiatement. Si une diarrhée survient, il ne faut pas prendre de médicaments qui inhibent le péristaltisme intestinal (les mouvements de l'intestin).
Des cas d'acidose lactique ont été observés après l'administration de Linezolid Pfizer. Veuillez immédiatement informer le médecin traitant lorsqu'une nausée forte et récidivante ainsi que des vomissements se manifestent.
En outre, les effets indésirables suivants apparaissent occasionnellement: frissons, fièvre, vertiges, vision floue, fatigue, insomnie, bourdonnements d'oreille (acouphènes), sécheresse buccale, soif plus intense, troubles gastro-intestinaux, douleurs abdominales, constipation, inflammation de la muqueuse buccale, langue gonflée ou colorée, inflammation du pancréas (pancréatite caractérisée par l'apparition soudaine de douleur forte dans la région épigastrique, nausée et vomissements), augmentation de la production d'urine, picotements, engourdissements, modification de la pression artérielle, réaction cutanée (rougeur, démangeaisons), augmentation de la transpiration, inflammation du vagin.
Dans des rares cas, des convulsions ont été observées après l'administration de Linezolid Pfizer, principalement chez des personnes prédisposées (voir remarque sous «Quelles sont les précautions à observer lors de la prise de Linezolid Pfizer?»).
Des modifications de la formule sanguine comme un déficit en globules rouges ou blancs ou en plaquettes peuvent apparaître durant un traitement par Linezolid Pfizer. Les symptômes de telles modifications de la formule sanguine peuvent être une baisse des performances, une fatigue, de la fièvre, des frissons, de petits épanchements sanguins, des hémorragies des muqueuses ainsi que des troubles de la cicatrisation.
Des graves réactions cutanées et d'hypersensibilité ont également été rapportées. Linezolid Pfizer doit être arrêté dès les premiers signes d'une réaction allergique (par ex. rougeurs de la peau, éruption cutanée avec cloques, tuméfactions du visage, de la peau ou des muqueuses, asthme, détresse respiratoire, troubles circulatoires) et le médecin doit être contacté immédiatement.
Le principe actif de Linezolid Pfizer peut légèrement inhiber certaines substances propres à l'organisme (appelées monoamine-oxydases, MAO). Suite à des interactions avec d'autres médicaments ou avec des composants alimentaires (voir remarque sous «Quelles sont les précautions à observer lors de la prise de Linezolid Pfizer?»), des cas isolés d'effets indésirables médicamenteux ont été rapportés qui sont à mettre sur le compte de cette propriété. Des signes de ces interactions peuvent regrouper anxiété, tremblements, crampes, rougeur, céphalées, palpitations cardiaques, essoufflement et hypertension artérielle.
Très rarement, des troubles de la sensibilité et/ou de la vue comme une vision floue ou imprécise, des modifications de la perception des couleurs, des taches dans le champ visuel (appelées neuropathies périphérique et/ou optique) ont été observés. Veuillez informer votre médecin immédiatement en cas d'apparition de tels effets oculaires.
De même, des colorations superficielles des dents ont été observées après l'utilisation de Linezolid Pfizer. Dans les rares cas qui ont pu être suivis, la coloration a été éliminée avec des mesures d'hygiène dentaire (manuellement).
Si vous remarquez d'autres effets indésirables, veuillez en informer votre médecin ou votre pharmacien.
A quoi faut-il encore faire attention?
Les comprimés filmés Linezolid Pfizer et le granulé Linezolid Pfizer pour la préparation d'une suspension buvable ne doivent pas être utilisés au-delà de la date figurant après la mention «EXP» sur le récipient.
Conserver à température ambiante (15-25 °C) et hors de la portée des enfants.
La suspension buvable prête à l'emploi Linezolid Pfizer se conserve durant 3 semaines à température ambiante (15 à 25 °C). Retourner le flacon 3 à 5 fois avant emploi. Ne pas agiter.
Après l'arrêt du traitement, rapporter les éventuels restes du médicament au médecin ou au pharmacien pour une élimination appropriée.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Linezolid Pfizer?
1 comprimé filmé Linezolid Pfizer contient 600 mg de linézolide et les excipients suivants:
Noyau du comprimé: cellulose microcristalline (E460), amidon de maïs, carboxyméthylamidon sodique, hydroxypropylcellulose (E463), stéarate de magnésium (E572).
Pelliculage: hypromellose (E464), macrogol 400, dioxyde de titane (E171), cire de carnauba (E903).
Comprimé pelliculé blanc, oblong-ovale portant les inscriptions gravées «LZD» sur une face et «600» sur l'autre face.
1 ml de suspension buvable Linezolid Pfizer contient, après dissolution du granulé dans 123 ml d'eau, 20 mg de linézolide et les excipients suivants: sucre 210.6 mg/ml, mannitol (E421), cellulose microcristalline (E460), carmellose sodique (E466), aspartame (E951), amidon modifié*, sorbitol*, fructose*, maltodextrine*, silice colloïdale anhydre (E551), citrate de sodium (E331), gomme xanthane (E415), acide citrique (E330), chlorure de sodium, le conservateur benzoate de sodium (E211) et des aromatisants, ainsi que de la vanilline et de l'éthylvanilline.
* produits à partir de maïs génétiquement modifié.
30 ml de suspension buvable (6 mesurettes de 5 ml) correspondent à une dose unique de 600 mg de linézolide et contiennent 6.32 g d'hydrates de carbone digestibles.
Numéro d’autorisation
66253 (comprimés filmés), 66250 (granulé pour la préparation d'une suspension buvable) (Swissmedic).
Où obtenez-vous Linezolid Pfizer? Quels sont les emballages à disposition sur le marché?
Les emballages ci-après sont disponibles en pharmacie, seulement sur ordonnance médicale non renouvelable:
Linezolid Pfizer à 600 mg: 10 comprimés filmés.
Linezolid Pfizer à 20 mg/ml: 1 flacon de granulé pour la préparation de 150 ml de suspension buvable.
Titulaire de l’autorisation
Pfizer AG, Zürich
Cette notice d'emballage a été vérifiée pour la dernière fois en mars 2018 par l'autorité de contrôle des médicaments (Swissmedic).
PIL V005
Che cos'è Linezolid Pfizer e quando si usa?
Linezolid Pfizer, contenente il principio attivo linezolide, è un antibiotico efficace contro malattie infettive d'origine batterica sostenute da determinati germi patogeni.
Linezolid Pfizer si può usare solo su prescrizione medica per il trattamento di gravi polmoniti nosocomiali (acquisite in ospedale), nonché di infezioni con complicazioni a carico della pelle e dei tessuti molli, qualora altri antibiotici siano inefficaci contro tali germi patogeni.
Di che cosa occorre inoltre tener conto durante il trattamento?
Questo medicamento le è stato prescritto dal suo medico per il trattamento della malattia di cui lei soffre attualmente.
L'antibiotico contenuto in Linezolid Pfizer non è efficace contro tutti microorganismi che causano malattie infettive. L'uso di un antibiotico mal scelto o non dosato correttamente può causare complicazioni. Non lo usi quindi di sua iniziativa per curare altre patologie o altre persone.
Quando non si può usare Linezolid Pfizer?
In caso d'ipersensibilità (allergia) nota o supposta ad uno dei costituenti di Linezolid Pfizer.
Quando è richiesta prudenza nella somministrazione di Linezolid Pfizer?
Linezolid Pfizer può avere delle interazioni con numerosi medicamenti, per esempio antidepressivi, certi farmaci per il cuore e contro l'asma, certi medicamenti contro il raffreddore o la tosse (per es. con i principi attivi pseudoefedrina, fenilpropanolamina), anoressizzanti, farmaci contenenti rifampicina, determinati medicamenti contro l'emicrania (i cosiddetti triptani), analgesici (per es. col principio attivo petidina, tramadolo), ansiolitici col principio attivo buspirone, farmaci contenenti adrenalina, noradrenalina o dopamina, medicamenti contro il morbo di Parkinson col principio attivo selegina. Perciò informi il suo medico o il suo farmacista di tutti i medicamenti che prende.
A chi prende un preparato anticoncezionale («pillola») si fa presente che la sua efficacia terapeutica può risultare ridotta durante una terapia con antibiotici. A tale riguardo, il suo medico o il suo farmacista potranno consigliarle altre misure anticoncezionali.
Linezolid Pfizer può risultare incompatibile con certi componenti di cibi. Bisogna quindi evitare di assumere durante la cura quantità eccessive di formaggio stagionato, estratti di lievito, prodotti a base di soia (per es. salsa di soia) o bevande alcooliche. Se dopo i pasti accusa cefalee di tipo martellante, ne informi il suo medico o il suo farmacista.
Nel caso in cui lei soffra d'ipertensione non controllata, di crisi ipertensive causate da malattie tumorali (quali il feocromocitoma o i carcinoidi), di un'iperfunzione della tiroide o di determinate malattie psichiche (quali la depressione, le psicosi bipolari o gli stati confusionali), può assumere Linezolid Pfizer solo se c'è la possibilità di tenere la pressione arteriosa sotto attenta osservazione e stretto controllo.
Informi il suo medico o il suo farmacista se soffre di epilessia o se sono comparse in passato delle crisi epilettiche. Si prega di riferire a queste persone anche se la funzione del rene o del fegato è molto ridotta.
Questo medicamento può ridurre la capacità di reazione, la capacità di condurre un veicolo e la capacità di utilizzare attrezzi o macchine (vedi «Quali effetti collaterali può avere Linezolid Pfizer? »). In modo particolare all'inizio del trattamento come pure in caso di trattamento prolungato (disturbi della vista), è richiesta prudenza nella guida di autoveicoli o nell'utilizzo di macchinari.
Informi il suo medico o il suo farmacista nel caso in cui soffre di altre malattie, soffre di allergie o assume o applica altri medicamenti (anche se acquistati di sua iniziativa).
Si può somministrare Linezolid Pfizer durante la gravidanza o l'allattamento?
Se lei ha in corso o in programma una gravidanza, o se allatta, può assumere Linezolid Pfizer solo su espressa approvazione del medico o del farmacista.
Come usare Linezolid Pfizer?
Il medico stabilisce la posologia e la durata del trattamento in base alla gravità della malattia. Non modifichi di propria iniziativa la posologia prescritta o la durata del trattamento. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
In linea generale, valgono le seguenti indicazioni di dosaggio:
Adulti
600 mg due volte al giorno.
La sospensione orale di Linezolid Pfizer viene generalmente preparata dal farmacista a partire dal granulato nel modo seguente:
Scuotere leggermente il granulato e preparare 123 ml di acqua di rubinetto. Aggiungere in un primo tempo metà dell'acqua al contenuto della bottiglia e scuotere energicamente. Unire poi anche il resto dell'acqua e scuotere di nuovo con energia fino ad ottenere una sospensione omogenea. Si otterranno così 150 ml di sospensione orale di Linezolid Pfizer pronta per l'uso. La sospensione di Linezolid Pfizer e le compresse di Linezolid Pfizer si possono assumere prima, durante o dopo i pasti.
I pazienti in dialisi devono prendere Linezolid Pfizer dopo il trattamento dialitico.
Una volta iniziata una terapia con antibiotici, bisogna continuarla per tutto il tempo ordinato dal suo medico. Spesso i sintomi della malattia scompaiono prima che l'infezione sia completamente guarita. Una durata del trattamento insufficiente o un'interruzione prematura della terapia possono avere come conseguenza una riaccensione della malattia.
Se ha assunto per errore una quantità eccessiva delle compresse o della sospensione di Linezolid Pfizer, informi subito il suo medico o il suo farmacista.
Se ha dimenticato di prendere una dose, continui con la terapia normale non appena se ne rende conto. Non raddoppi in nessun caso la dose.
In genere una terapia con Linezolid Pfizer dura 10-14 giorni, ma può protrarsi fino a 28 giorni al massimo.
Bambini e adolescenti sotto i 18 anni
I dati sull'efficacia e la sicurezza nei bambini e adolescenti (al di sotto di 18 anni) sono limitati. Perciò, fino a quando non saranno disponibili altri dati, non si consiglia l'uso di Linezolid Pfizer in questo gruppo di età.
Quali effetti collaterali può avere Linezolid Pfizer?
In seguito all'assunzione di Linezolid Pfizer possono manifestarsi i seguenti effetti collaterali:
I più frequenti sono diarrea, nausea, vomito, crampi, flatulenza e cefalee nonché alterazioni del gusto (sapore metallico), valori glicemici alti (iperglicemia), infezioni fungine e valori epatici alterati.
Se si manifestano diarree gravi e persistenti con crampi addominali e febbre, bisogna interrompere l'assunzione del medicamento e informare immediatamente il medico curante. In caso di diarrea, non si deve assumere nessun medicamento che inibisca la peristalsi intestinale (il movimento dell'intestino).
In seguito all'assunzione di Linezolid Pfizer, si sono osservati casi di cosiddetta lattacidosi; anche in caso di nausea e vomito molto forte e ripetuto, ci si deve rivolgere immediatamente al medico curante.
Inoltre, possono comparire occasionalmente i seguenti altri effetti collaterali: brividi, febbre, vertigini, sfocature della vista, stanchezza, insonnia, ronzio auricolare (tinnitus), secchezza della bocca, aumento della sete, disturbi gastrointestinali, mal di pancia, stitichezza, infiammazione della mucosa della bocca, tumefazione o colorazione della lingua, infiammazione del pancreas (pancreatite caratterizzata da: forti dolori ad insorgenza improvvisa localizzati nei quadranti superiori dell'addome, nausea e vomito), aumento della produzione di urina, formicolio, intorpidimento, alterazione della pressione sanguigna, reazioni cutanee (arrossamenti, prurito), aumento della sudorazione, vaginite.
Raramente, in seguito all'assunzione di Linezolid Pfizer, si sono osservate crisi epilettiche (convulsioni), soprattutto in persone particolarmente predisposte (vedi anche l'avvertenza in «Quando è richiesta prudenza nella somministrazione di Linezolid Pfizer? »).
Durante il trattamento con Linezolid Pfizer possono verificarsi alterazioni del quadro ematologico quali carenza di globuli rossi, di globuli bianchi o di piastrine. Tali alterazioni del quadro ematologico possono essere annunciate da sintomi quali diminuzione del rendimento, stanchezza, febbre, brividi, ecchimosi, emorragie delle mucose e difficoltà di guarigione delle ferite.
Sono state riportate anche gravi reazioni della pelle e d'ipersensibilità. Ai primi segni di reazione allergica (per es. arrossamenti della pelle, eruzione cutanea con formazione di vescicole, tumefazioni del volto, della pelle o delle mucose, asma, dispnea, disturbi circolatori) occorre sospendere Linezolid Pfizer e informare immediatamente il medico.
Il principio attivo di Linezolid Pfizer è in grado di inibire debolmente determinate sostanze proprie dell'organismo (le cosiddette monoaminossidasi, MAO). In casi isolati, in seguito alle interazioni con altri medicamenti o anche con componenti alimentari (vedi l'avvertenza in «Quando è richiesta prudenza nella somministrazione di Linezolid Pfizer?»), sono comparsi alcuni effetti farmacologici indesiderati, i quali sono da ricondurre a questa caratteristica. Segni di una tale interazione possono essere rappresentati da ansia, tremori, crampi, vampate, mal di testa, accelerazione del ritmo cardiaco, affanno e ipertensione arteriosa.
Molto raramente sono stati osservati disturbi della sensibilità e/o della vista come vista offuscata o sfocata, modificazioni della percezione dei colori, macchie nel campo visivo (neuropatie periferiche e/o ottiche). Se si manifestano questi disturbi visivi, dovrebbe immediatamente informare il suo medico.
Anche molto raramente, si sono osservate dopo l'impiego di Linezolid Pfizer colorazioni superficiali dei denti. Nei casi ad esito noto, è stato possibile eliminare queste colorazioni mediante misure di igiene dentale (manualmente).
Se osserva effetti collaterali qui non descritti, dovrebbe informare il suo medico, il suo farmacista o il suo droghiere.
Di che altro occorre tener conto?
Le compresse filmate di Linezolid Pfizer e il granulato per sospensione orale di Linezolid Pfizer non devono essere utilizzate oltre la data indicata con «EXP» sulla confezione.
Conservare a temperatura ambiente (15-25 °C) e fuori dalla portata dei bambini.
La sospensione orale di Linezolid Pfizer pronta per l'uso si conserva 3 settimane a temperatura ambiente (15‑25 °C). Prima dell'uso capovolgere il flacone 3-5 volte. Non scuotere.
Una volta terminata la cura, riportare la confezione con il contenuto residuo al medico o al farmacista, per la corretta eliminazione.
Il medico o il farmacista, che sono in possesso di documentazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Linezolid Pfizer?
1 compressa filmata di Linezolid Pfizer contiene 600 mg di linezolide e le seguenti sostanze ausiliarie:
Nucleo della compressa: cellulosa microcristallina (E460), amido di mais, carbossimetilamido sodico, idrossipropilcellulosa (E463), magnesio stearato (E572).
Film di rivestimento: ipromellosa (E464), macrogol 400, titanio diossido (E171), cera di carnauba (E903).
Compressa filmata bianca, oblunga, con scritta «LZD» incisa su un lato e «600» sull'altro.
1 ml di sospensione orale di Linezolid Pfizer contiene, dopo scioglimento del granulato in 123 ml d'acqua, 20 mg di linezolide e le seguenti sostanze ausiliarie: zucchero 210.6 mg/ml, mannitolo (E421), cellulosa microcristallina (E460), carmellosa sodica (E466), aspartame (E951), amido modificato*, sorbitolo*, fruttosio*, maltodestrina*, silice colloidale anidra (E551), sodio citrato (E331), gomma di xantano (E415), acido citrico (E330), sodio cloruro, il conservante sodio benzoato (E211) e aromi nonché vanillina e ethylvanillina.
* prodotto da mais geneticamente modificato.
30 ml di sospensione orale (6 misurini da 5 ml) corrispondono ad una dose singola di 600 mg di linezolide e contengono 6.32 g di carboidrati utilizzabili.
Numero dell’omologazione
66253 (compresse filmate), 66250 (granulato per sospensione orale) (Swissmedic).
Dov'è ottenibile Linezolid Pfizer? Quali confezioni sono disponibili?
In farmacia dietro presentazione della prescrizione medica non rinnovabile, sono ottenibili le seguenti confezioni:
Linezolid Pfizer 600 mg: 10 compresse filmate.
Linezolid Pfizer 20 mg/ml: 1 flacone di granulato per la preparazione di 150 ml di sospensione orale.
Titolare dell’omologazione
Pfizer AG, Zürich
Questo foglietto illustrativo è stato controllato l'ultima volta nel marzo 2018 dall'autorità competente in materia di medicamenti (Swissmedic).
PIL V005
Zusammensetzung
Wirkstoff: Linezolid.
Hilfsstoffe:
Infusionslösung 2 mg/ml
Glucose-wasserfrei (45.7 mg/ml), Natriumcitrat (E331), wasserfreie Zitronensäure (E330), Salzsäure (E507), Natriumhydroxid (E524), Wasser für Injektionszwecke.
Filmtabletten 600 mg
Tablettenkern: Mikrokristalline Cellulose (E460), Maisstärke, Carboxymethylstärke-Natrium, Hydroxypropylzellulose (E463), Magnesiumstearat (E572).
Filmüberzug: Hypromellose (E464), Macrogol 400, Titandioxid (E171), Carnaubawachs (E903).
Granulat zur Herstellung einer Suspension zum Einnehmen 20 mg/ml
Saccharum 210.6 mg/ml, Mannitol (E421), Mikrokristalline Cellulose (E460), Carmellose-Natrium (E466), Aspartam (E951), modifizierte Stärke*, Sorbitol*, Fructose*, Maltodextrin*, Hochdisperses Siliciumdioxid wasserfrei (E551), Natriumcitrat wasserfrei (E331), Xanthangummi (E415), Zitronensäure (E330), Natriumchlorid, Conserv.: Natriumbenzoat (E211); Aromatica, Vanillin und Ethylvanillin.
* hergestellt aus gentechnisch verändertem Organismus Mais.
30 ml Suspension zum Einnehmen (6 Messlöffel à 5 ml) entsprechen einer Einzeldosis von 600 mg Linezolid und enthalten 6.32 g verwertbare Kohlenhydrate.
Galenische Form und Wirkstoffmenge pro Einheit
Infusionslösung: 1 ml enthält 2 mg Linezolid.
Filmtabletten: 1 Tablette enthält 600 mg Linezolid.
Weisse, länglich-ovale Filmtablette mit Prägung «LZD» auf der einen und «600» auf der anderen Seite.
Granulat zur Herstellung einer Suspension zum Einnehmen: Nach Rekonstitution mit 123 ml Wasser enthält 1 ml Suspension 20 mg Linezolid.
Indikationen/Anwendungsmöglichkeiten
Behandlung erwachsener Patienten mit den folgenden Infektionen:
- Nosokomiale Pneumonien, sofern nachgewiesenermassen oder mit hoher Wahrscheinlichkeit durch gegen Linezolid empfindliche Stämme von Staphylococcus aureus oder Streptococcus pneumoniae verursacht. Die Erfahrung bei Infektionen durch Penicillin-resistente Pneumokokken ist noch beschränkt. Linezolid ist nicht wirksam gegen Gram-negative Infektionen. Wird eine Mischinfektion mit Gram-negativen Erregern vermutet oder nachgewiesen, muss gleichzeitig eine spezifische Behandlung gegen Gram-negative Erreger eingeleitet werden. Geprüft wurden bisher nur Aztreonam und Aminoglykoside.
- Komplizierte Haut- und Weichteilinfektionen: Für die Behandlung von komplizierten Haut- und Weichteilinfektionen ist Linezolid Pfizer nur dann angezeigt, wenn nach mikrobiologischer Sensibilitätsprüfung feststeht, dass die Infektion durch empfindliche Gram-positive Bakterien der Arten Staphylococcus aureus, Streptococcus pyogenes oder Streptococcus agalactiae verursacht ist.
Linezolid ist nicht wirksam gegen Gram-negative Infektionen. Bei Patienten mit komplizierten Haut- und Weichteilinfektionen, bei welchen eine Co-Infektion mit Gram-negativen Erregern vermutet oder nachgewiesen wird, darf Linezolid nur angewendet werden, wenn keine alternativen Behandlungsmöglichkeiten bestehen (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»). In diesen Fällen muss gleichzeitig eine Behandlung gegen Gram-negative Erreger eingeleitet werden. Geprüft wurden bisher nur Aztreonam und Aminoglykoside.
Es liegen keine Erfahrungen vor bei der Behandlung von diabetischen oder Decubitus-Ulcera. - Vancomycin-resistente Enterococcus faecium Infektionen, einschliesslich Bakteriämie.
Es liegen keine Erfahrungen vor bei Infektionen des ZNS, Osteomyelitis und Endokarditis.
Offizielle Empfehlungen zum angemessenen Gebrauch von Antibiotika sollten beachtet werden, insbesondere Anwendungsempfehlungen zur Verhinderung der Zunahme von Antibiotikaresistenz.
Daher wird empfohlen, dass die Indikationsstellung und der Therapiebeginn mit Linezolid im Spital unter Anleitung eines Spezialisten, wie z.B. eines Infektiologen, erfolgt. Die Therapie kann ambulant weitergeführt werden.
Dosierung/Anwendung
Sowohl die Linezolid Pfizer Infusionslösung wie auch die Filmtablette oder die orale Suspension kann als Initialtherapie verwendet werden. Patienten, die eine Behandlung mit der parenteralen Form starten, können auf eine der beiden oralen Formen umgestellt werden. Es sind dabei keine Dosisanpassungen erforderlich, da Linezolid eine orale Bioverfügbarkeit von etwa 100% besitzt.
Die Infusionslösung sollte über einen Zeitraum von 30 bis 120 Minuten verabreicht werden. Die Filmtabletten und die Suspension können mit oder ohne Nahrung eingenommen werden.
Die empfohlene Dosis sollte 2× täglich verabreicht bzw. eingenommen werden.
Empfohlene Dosierung und Dauer der Anwendung bei Erwachsenen:
Infektionen | 2× tägliche Dosis und Verabreichungsart | Behandlungsdauer |
|---|---|---|
Nosokomiale Pneumonie | 600 mg i.v. oder oral | 10-14 aufeinanderfolgende Tage |
Komplizierte Haut- und Weichteilinfektionen | ||
Vancomycin resistente Enterococcus faecium Infektionen einschliesslich Bakteriämie | 600 mg i.v. oder oral | 14-28 aufeinanderfolgende Tage |
Die Dauer der Behandlung ist variabel und abhängig vom Erreger, Infektionsort und Schweregrad sowie von der klinischen Reaktion des Patienten. Die maximale Behandlungsdauer beträgt 28 Tage. Die Sicherheit und Wirksamkeit von Linezolid bei einer Therapiedauer von mehr als 28 Tagen ist nicht etabliert (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Es liegen nur beschränkte Daten zur Sicherheit und Effizienz von Linezolid bei Kindern und Jugendlichen (<18 Jahre) vor. Bis weitere Daten vorliegen, wird die Anwendung von Linezolid in dieser Altersgruppe daher nicht empfohlen (siehe auch «Kinetik spezieller Patientengruppen»).
Bei älteren Patienten und Frauen ist keine Dosisanpassung notwendig.
Bei Patienten mit eingeschränkter Nierenfunktion jeden Schweregrades wurde keine Akkumulation von Linezolid beobachtet.
Bei Patienten mit milder bis mässiger Niereninsuffizienz (CLCR >30 ml/min) ist ebenfalls keine Dosisanpassung notwendig.
Bei Patienten mit schwerer Niereninsuffizienz (CLCR <30 ml/min) ist keine Dosisanpassung notwendig. Da die klinische Bedeutung der erhöhten Konzentration (bis 10 fach) der zwei primären Metaboliten von Linezolid bei Patienten mit schwerer Niereninsuffizienz unklar ist, soll Linezolid bei diesen Patienten mit besonderer Vorsicht, angewendet werden und nur wenn der erwartete Nutzen das theoretische Risiko überwiegt.
Da ungefähr 30% einer Linezoliddosis während einer 3 stündigen Hämodialyse entfernt werden, sollte Linezolid bei diesen Patienten nach der Dialyse verabreicht werden. Die primären Metaboliten von Linezolid werden zu einem gewissen Teil durch Hämodialyse eliminiert, die Konzentrationen dieser Metaboliten sind jedoch deutlich höher nach der Dialyse als bei Patienten mit normaler Nierenfunktion oder mit leichter bis mittelschwerer Niereninsuffizienz. Bei Patienten mit schwerer Niereninsuffizienz und Dialysebehandlung sollte Linezolid daher mit besonderer Vorsicht angewendet werden und nur wenn der erwartete Nutzen das theoretische Risiko überwiegt.
Bislang fehlen Erfahrungen zur Anwendung von Linezolid bei Patienten, die eine kontinuierliche ambulante Peritonealdialyse (CAPD) oder andere Behandlungsverfahren bei Nierenversagen (ausser Hämodialyse) durchlaufen.
Patienten mit Leberinsuffizienz: Bei Patienten mit eingeschränkter Leberfunktion ist keine Dosisanpassung notwendig. Es gibt jedoch nur wenig klinische Daten und es wird empfohlen, dass Linezolid bei diesen Patienten nur angewendet werden soll, wenn der erwartete Nutzen das theoretische Risiko überwiegt (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Pharmakokinetik»).
Kontraindikationen
Überempfindlichkeit gegenüber Linezolid oder anderen Inhaltsstoffen des Präparates.
Warnhinweise und Vorsichtsmassnahmen
Lactazidose wurde bei der Behandlung mit Linezolid beobachtet. Patienten mit wiederkehrender Übelkeit und Erbrechen, unerklärbarer Azidosen oder tiefen Bicarbonatspiegeln sollten sofort medizinisch überwacht werden.
Linezolid zeigt auch eine schwache, reversible, nichtselektive Monoaminoxidase (MAO) hemmende Wirkung; es wurden in Einzelfällen unerwünschte Arzneimittelwirkungen und Interaktionen mit anderen Arzneimitteln gemeldet, die möglicherweise auf diese Eigenschaft zurückzuführen sind und sich z.B. in Blutdruckanstieg und Serotoninsyndrom (Anzeichen hierfür können sein: Verwirrtheit, Delirium, Koma, vegetative Labilität mit möglicherweise raschen Schwankungen der Lebenszeichen, Ruhelosigkeit, Tremor, Erröten, Schwitzen, Hyperpyrexie) äussern können, siehe «Interaktionen».
Linezolid sollte daher bei Patienten mit folgender zu Grunde liegender klinischer Symptomatik oder unter folgenden Begleitmedikationen nicht angewendet werden, es sei denn, es liegen Möglichkeiten zur genauen Beobachtung und zur Kontrolle des Blutdrucks vor:
- Patienten mit unkontrollierter Hypertonie, Phäochromozytom, Karzinoid, Thyreotoxikose, bipolarer Depression, schizoaffektiver Psychose, akuten Verwirrtheitszuständen.
- Patienten, die eines der folgenden Arzneimittel einnehmen: Serotonin-Wiederaufnahmehemmer, trizyklische Antidepressiva, Serotonin-5HT 1 Rezeptoragonisten (Triptane), direkt oder indirekt wirkende Sympathomimetika (einschliesslich adrenerger Bronchodilatatoren, Pseudoephedrin oder Phenylpropanolamin), vasopressorische Mittel (z.B. Adrenalin, Noradrenalin), dopaminerge Mittel (z.B. Dopamin, Dobutamin), Pethidin oder Buspiron.
Es liegen begrenzte Daten aus Studien zu Arzneimittelwechselwirkungen und Daten zur Unbedenklichkeit von Linezolid für Patienten vor, die auf Grund einer Grunderkrankung oder Begleitmedikation durch eine MAO-Hemmung einem Risiko ausgesetzt sein könnten. Deshalb ist die Anwendung von Linezolid in Kombination mit adrenergen oder serotonergen Substanzen oder bei entsprechenden Grunderkrankungen nicht empfohlen, es sei denn, eine genaue Beobachtung und Kontrolle des Patienten ist möglich. Linezolid sollte nicht angewendet werden bei Patienten, die ein Arzneimittel, das die Monoaminoxidase A oder B (z.B. Phenelzin, Isocarboxazid, Selegilin, Moclobemid) hemmt, einnehmen oder innerhalb der letzten zwei Wochen eingenommen haben (siehe auch «Interaktionen»).
Bei gleichzeitiger Verabreichung von Rifampicin und Linezolid wurde die Cmax bzw. AUC von Linezolid bei gesunden Probanden um 21 resp. 32% gesenkt. (siehe «Interaktionen»). Die klinische Signifikanz dieser Interaktion ist nicht bekannt.
Clostridium difficile assoziierte Diarrhoe (CDAD) wurde bei Anwendung von praktisch allen Antibiotika - einschliesslich Linezolid – beobachtet; der Schweregrad kann von einer leichter Diarrhoe bis zu einer tödlich verlaufenden Colitis variieren. Die Anwendung von Antibiotika verändert die übliche Kolon-Flora und kann so zu übermässigem Wachstum von Clostridium difficile führen. Beim Auftreten einer solchen Superinfektion muss sofort eine spezifische Therapie eingeleitet werden. Peristaltikhemmende Präparate sind kontraindiziert.
C. difficile bildet die Toxine A und B, welche zur Entwicklung von CDAD beitragen. Hypertoxin produzierende Stämme von C. difficile verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen auf eine antimikrobielle Behandlung u. U. nicht ansprechen und eine Kolektomie bedingen können.
Eine CDAD ist bei allen Patienten, welche nach Verabreichung eines Antibiotikums unter Diarrhoe leiden, in Betracht zu ziehen. Da ein Auftreten von CDAD auch über zwei Monate nach Antibiotikaanwendung beobachtet wurde, ist eine sorgfältige medizinische Anamnese erforderlich.
In einer offenen klinischen Studie an schwerkranken Patienten mit (intravaskulär-)katheter-assoziierten Infektionen wurde bei den mit Linezolid behandelten Patienten eine erhöhte Mortalität im Vergleich zu den mit Vancomycin/Dicloxacillin/Oxacillin behandelten Patienten beobachtet. Während der Behandlung, einschliesslich der Nachbeobachtungszeit von 7 Tagen nach Ende der Behandlung, verstarben im Linezolidarm 43/363 (12%) Patienten, im Vergleichsarm jedoch nur 22/363 (6%) Patienten (Odds Ratio 2.12; 95% Konfidenzintervall 1.23–3.66), ein auch statistisch signifikanter Unterschied. Im weiteren Verlauf der Nachbeobachtungszeit (Tag 8 nach Ende der Behandlung bis 84 Tage nach der ersten Dosis) verstarben in beiden Armen der Studie etwa gleich viele Patienten (35 vs. 36 Patienten), was als Folge der schweren Grunderkrankungen der in dieser Studie aufgenommenen Patienten angesehen werden kann.
Trotz vertiefter Analysen der in dieser Studie beobachteten Todesfälle bis zum Nachbeobachtungszeitpunkt von 7 Tagen nach Ende der Behandlung, konnte eine Ursache für die Mortalitätsunterschiede in den beiden Studienarmen nicht gefunden werden. Feststellbare Risikofaktoren (ohne Nachweis der Kausalität) für den Unterschied in der Mortalität zwischen den Studienarmen waren insbesondere (ein Wert über 1 für die untere Limite des Vertrauensintervalls zeigt ein höheres Mortalitätsrisiko für mit Linezolid behandelte Patienten an):
- Patienten mit Gram-negativen Infektionen zu Beginn der Therapie, inkl. Gram-positiven/Gram-negativen Mischinfektionen (Odds Ratio 2.35; 95% Konfidenzintervall 0.69–8.01) oder gar keinem nachgewiesenen Erreger zu Behandlungsbeginn (Odds Ratio 3.59; 95% Konfidenzintervall 1.22–10.59).
- Aufenthalt der Patienten in der Intensivstation direkt vor Studieneintritt (Odds Ratio 2.95; 95% Konfidenzintervall 1.49–5.84).
- Sehr schwere Erkrankungen basierend auf MPM II scores >24 (Odds Ratio 1.82; 95% Konfidenzintervall 0.98–3.36).
Weitere Risikofaktoren, die jedoch das Mortalitätsrisiko in beiden Studienarmen gleichermassen erhöhten, wurden ebenfalls identifiziert, z.B. eine gleichzeitige Behandlung mit Steroiden.
Die Mortalitätsraten waren bei Patienten mit rein Gram-positiven Infektionen in beiden Behandlungsgruppen vergleichbar (Odds Ratio 1.54; 95% Konfidenzintervall 0.75–3.18).
Zusätzliche Beobachtungen in dieser Studie:
- Im Linezolidarm kam es während der Behandlung bei einer grösseren Anzahl von Patienten zu Neuinfektionen mit Gram-negativen Erregern.
- Bei Patienten mit Gram-negativen Bakteriämien wurde auch bei der Untergruppe von Patienten mit eigentlich adäquater, gegen Gram-negative Erreger gerichteter Zusatztherapie im Linezolidarm eine gegenüber dem Vergleichsarm erhöhte Mortalität beobachtet (3/15 vs. 0/10).
Wegen dieser Beobachtungen darf Linezolid bei komplizierten Haut- und Weichteilinfektionen bei Patienten mit vermuteter oder nachgewiesener Co-Infektion mit Gram-negativen Erregern nur angewendet werden, wenn keine alternativen Behandlungsmöglichkeiten bestehen (siehe Abschnitt «Indikationen»). In diesen Fällen muss gleichzeitig eine Behandlung gegen Gram-negative Erreger eingeleitet werden.
Die Anwendung von Linezolid Pfizer wurde nicht untersucht bei Patienten mit unkontrollierter Hypertonie, Phäochromozytom, Karzinoid-Syndrom oder unbehandelter Hyperthyreose.
Die Sicherheit und Wirksamkeit einer Linezolidbehandlung von mehr als 28 Tagen wurde nicht untersucht.
Über Fälle von Myelosuppression (einschliesslich Anämie, Leukopenie, Panzytopenie und Thrombozytopenie) wurde bei einigen mit Linezolid behandelten Patienten berichtet. In den Fällen mit bekanntem Ausgang waren die veränderten Parameter meist vollständig reversibel nach Absetzen von Linezolid. Das Risiko für diese Effekte scheint in einem Zusammenhang mit der Therapiedauer zu stehen. Thrombozytopenie kann bei Patienten mit schwerer Niereninsuffizienz, mit oder ohne Dialysebehandlung häufiger vorkommen. Während einer Linezolid-Therapie sollten wöchentliche Blutbildkontrollen vorgenommen werden. Bei Patienten, welche unter einer schweren Niereninsuffizienz leiden, bei Patienten, welche länger als 2 Wochen behandelt werden, solche mit vorbestehender Myelosuppression, bei Patienten mit Begleitmedikation, die eine Knochenmarkssuppression verursachen können oder bei Patienten mit chronischem Infekt und vorhergehender oder gleichzeitiger Antibiotika-Therapie sollte eine engmaschige Überwachung gewährleistet sein. Bei Auftreten oder Verschlechterung einer Myelosuppression sollte ein Therapieabbruch in Erwägung gezogen werden.
Bei Patienten mit schwerer Niereninsuffizienz sollte Linezolid mit besonderer Vorsicht angewendet werden und nur, wenn der erwartete Nutzen das theoretische Risiko überwiegt (siehe «Dosierung/Anwendung» und «Pharmakokinetik»).
Es wird empfohlen, dass bei Patienten mit schwerer Leberinsuffizienz Linezolid nur angewendet werden soll, wenn der erwartete Nutzen das theoretische Risiko überwiegt (siehe «Dosierung/Anwendung» und «Pharmakokinetik»).
Periphere Neuropathie und optische Neuropathie, welche in einigen Fällen zu Sehverlust führten, wurden bei Patienten beobachtet, die mit Linezolid Pfizer behandelt wurden. Es waren vorwiegend Patienten betroffen, welche länger als die maximal empfohlene Therapiedauer von 28 Tagen behandelt wurden.
Alle Patienten sollten angewiesen werden, Zeichen von Sehverschlechterung wie Änderungen der Sehschärfe, des Farbsehens, verschwommenes Sehen oder Gesichtsfeldausfälle zu melden. In diesen Fällen ist eine sofortige Kontrolle empfohlen, wenn nötig mit einer Überweisung an den Ophtalmologen. Bei Patienten, welche Linezolid Pfizer länger als die empfohlene Therapiedauer von 28 Tagen einnehmen, sollte die Sehfunktion regelmässig überprüft werden. Beim Auftreten von peripherer oder optischer Neuropathie sollte das Weiterführen der Linezolid Pfizer Therapie gegen das potentielle Risiko abgewogen werden.
Es wurde über seltene Fälle von Konvulsionen bei Patienten berichtet, welche mit Linezolid behandelt wurden. In den meisten Fällen waren bereits früher Anfälle aufgetreten oder es bestanden Risikofaktoren für Anfälle. Patienten sollten aufgefordert werden, ihrem Arzt eine allfällige Vorgeschichte von Anfällen und Konvulsionen mitzuteilen.
Interaktionen
Linezolid ist ein schwacher, reversibler, nicht-selektiver Monoaminoxidasehemmer (MAOH). Die Möglichkeit einer Interaktion mit Adrenergika (z.B. direkt oder indirekt wirksame Sympathomimetika einschliesslich adrenerger Bronchodilatatoren, Pseudoephedrin oder Phenylpropanolamin, Vasopressiva wie Adrenalin und Noradrenalin, dopaminerge Mittel wie Dopamin und Dobutamin) oder Serotonergika (z.B. Serotonin-Wiederaufnahme-Inhibitoren (= SSRIs), trizyklische Antidepressiva, Triptane, Buspiron, Bupropion) inklusive einiger Opioide (z.B. Tramadol, Pethidin oder Dextromethorphan) sollte daher in Betracht gezogen werden.
Adrenergika: Bei Patienten, die Linezolid Pfizer erhalten, kann es zu einer reversiblen Verstärkung des durch indirekt wirksame Sympathomimetika, Vasopressiva oder Dopaminergika hervorgerufenen Blutdruckanstiegs kommen. Spezifisch untersucht wurden häufig eingesetzte Wirkstoffe wie Phenylpropanolamin und Pseudoephedrin. Initialdosen von Adrenergika wie Dopamin und Adrenalin sollten reduziert und bis zum gewünschten Ansprechen titriert werden.
Serotonergika: Das Auftreten eines Serotonin Syndroms konnte in Studien der Phase 1, 2 und 3 nicht mit der gleichzeitigen Verabreichung von Linezolid und Serotonergika assoziiert werden. Es liegen aber Spontanmeldungen von Serotonin Syndrom Fällen vor, welche mit der gleichzeitigen Einnahme von Linezolid und Serotonergika, einschliesslich Antidepressiva wie selektiven Serotonin-Wiederaufnahme-Inhibitoren (SSRIs), in Verbindung gebracht wurden. Patienten, welche Linezolid Pfizer zusammen mit Serotonergika erhalten, sollten sorgfältig in Hinblick auf Symptome eines Serotonin Syndroms (Verwirrtheit, Hyperpyrexie, Hyperreflexie, Koordinationsstörungen) beobachtet werden. Treten entsprechende Anzeichen auf, sollte das Absetzen eines oder beider Medikationen (Linezolid Pfizer oder der gleichzeitig verabreichten Serotonergika) erwogen werden, siehe «Warnhinweise und Vorsichtsmassnahmen».
Keine Blutdruckreaktionen wurden bei Versuchspersonen beobachtet, die Linezolid zusammen mit weniger als 100 mg Tyramin erhalten haben. Dies legt nahe, dass nur übermässiger Konsum von tyraminhaltigen Ess- und Trinkwaren (z.B. reifer Käse, Hefeextrakte, undestillierte alkoholische Getränke, fermentierte Sojaprodukte wie Sojasauce) zu vermeiden ist.
Das Potential der durch MAO-Hemmung verursachten Arzneimittelinteraktionen wurde in Studien mit gesunden Probanden untersucht. Eine moderate, schnell reversible Wirkungsverstärkung der adrenergen Substanzen Pseudoephedrin oder Phenylpropanolamin auf den Blutdruck wurde bei der Verabreichung von Linezolid an normotensive Personen beobachtet. Keine Interaktion wurde zwischen Linezolid und dem adrenergen Bronchodilatator Salbutamol beobachtet. Bei gesunden Probanden, welche Linezolid und die serotonergen Substanzen Dextromethorphan, Pethidin oder Paroxetin erhielten, wurden ebenfalls keine Serotoninsyndromeffekte beobachtet.
Der Metabolismus von Linezolid erfolgt nicht durch das Cytochrom P450 (CYP) Enzymsystem und Linezolid induziert oder inhibiert keine der klinisch relevanten humanen CYP-Isoformen (1A2, 2C9, 2C19, 2D6, 2E1, 3A4). Es sind daher keine CYP450-induzierten Interaktionen mit Linezolid zu erwarten. CYP2C9-Substrate wie Warfarin und Phenytoin können ohne Dosisanpassungen zusammen mit Linezolid verabreicht werden.
Weder mit Aztreonam noch mit Gentamycin wurden in pharmakokinetischen Studien Interaktionen beobachtet. Der Effekt von Rifampicin auf die Pharmakokinetik von Linezolid wurde in einer Studie an 16 gesunden, männlichen Erwachsenen untersucht, welche zweimal täglich 600 mg Linezolid über 2.5 Tage ohne bzw. zusammen mit einmal täglich 600 mg Rifampicin über 8 Tage erhielten. Rifampicin verminderte die Cmax bzw. AUC von Linezolid um ein Mittel von 21% [90% CI, 15, 27], resp. 32% [90% CI, 27, 37]. Der Mechanismus dieser Interaktion sowie deren klinische Signifikanz sind nicht bekannt (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
In einer pharmakokinetischen Studie wurde gezeigt, dass die gleichzeitige Verabreichung von Antazida mit Magnesiumhydroxid und Aluminiumhydroxid keinen Effekt auf die Pharmakokinetik von oral eingenommenem Linezolid hat.
Schwangerschaft/Stillzeit
Kontrollierte Studien mit Linezolid bei schwangeren Frauen sind nicht verfügbar. Reproduktionsstudien bei Ratten und Mäusen haben keine teratogenen Effekte von Linezolid gezeigt. Schwache fötale Toxizität wurde bei Mäusen nur für maternell toxische Dosen beobachtet. Bei Ratten manifestierte sich die fötale Toxizität in Form von reduziertem fötalem Körpergewicht und reduzierter Ossifikation des Sternums (was oft in Zusammenhang mit reduziertem fötalen Körpergewicht beobachtet wird). Eine reduzierte Anzahl überlebender Nachkommen und verlangsamtes Wachstum wurde bei Ratten beobachtet. Bei Paarung dieser Nachkommen zeigte sich eine reversible, dosisabhängige Erhöhung der Frühaborte (vor der Einnistung).
Bei Ratten wird Linezolid in die Muttermilch sezerniert. Es ist hingegen nicht bekannt, ob Linezolid auch beim Menschen in die Muttermilch ausgeschieden wird.
In der Schwangerschaft und Stillzeit soll Linezolid Pfizer deshalb nur verwendet werden, wenn der Nutzen das potentielle Risiko für den Foetus, resp. Säugling, übersteigt.
Linezolid reduzierte die Fertilität bei männlichen Ratten.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Aufgrund der möglichen Nebenwirkungen (vgl. «Unerwünschte Wirkungen») ist, insbesondere zu Beginn der Behandlung sowie nach längerer Behandlung (Sehstörungen), bei Teilnahme am Strassenverkehr und beim Bedienen von Maschinen Vorsicht geboten.
Unerwünschte Wirkungen
Die nachfolgenden Informationen basieren auf Daten aus klinischen Studien mit Erwachsenen. Über 2’000 Patienten erhielten die empfohlenen Dosen Linezolid während bis zu 28 Tagen. In diesen Studien waren die meisten unerwünschten Wirkungen von milder bis mässiger Intensität, von beschränkter Dauer und bedingten keinen Therapieabbruch. Die unerwünschten Wirkungen waren nicht dosisabhängig.
Die unerwünschten Wirkungen sind nach Organklassen und Häufigkeitsgraden gegliedert unter Berücksichtigung folgender Definition: sehr häufig (≥1/10); häufig (≥1/100, <1/10); gelegentlich (≥1/1’000, <1/100); selten (≥1/10'000, <1/1’000); sehr selten (<1/10'000); nicht bekannt: überwiegend auf Meldungen aus der Marktüberwachung basierend, Häufigkeit kann aufgrund der vorhandenen Angaben nicht abgeschätzt werden.
Infektionen und parasitäre Erkrankungen
Häufig: Moniliose oder Pilzinfektion, vaginale Moniliose.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Anämie, Eosinophilie, Leukopenie, Neutropenie, Thrombozytopenie.
Selten: Sideroblastische Anämie.
Nicht bekannt: Reversible Panzytopenie.
Erkrankungen des Immunsystems
Nicht bekannt: Anaphylaxien, Angioödeme.
Stoffwechsel- und Ernährungsstörungen
Häufig: Hyperglykämie.
Nicht bekannt. Laktazidose (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen, Geschmacksveränderungen (Metallgeschmack).
Gelegentlich: Schwindel, Hypaesthesie, Insomnie, Paraesthesie.
Nicht bekannt. Konvulsionen (siehe «Warnhinweise und Vorsichtsmassnahmen»), periphere Neuropathie (vorwiegend Patienten betroffen, welche länger als die maximal empfohlene Dauer von 28 Tagen mit Linezolid behandelt wurden, siehe «Warnhinweise und Vorsichtsmassnahmen»).
Augenerkrankungen
Gelegentlich: verschwommenes Sehen.
Nicht bekannt. optische Neuropathie (welche manchmal zu Sehverlust führen kann; es sind vorwiegend Patienten betroffen, welche länger als die maximal empfohlene Dauer von 28 Tagen mit Linezolid behandelt wurden, siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen des Ohrs und des Labyrinths
Gelegentlich: Tinnitus.
Gefässerkrankungen
Gelegentlich: Hypertension, Phlebitis/Thrombophlebitis.
Selten: Hypotension.
Erkrankungen des Gastrointestinaltrakts
Häufig: Diarrhoe, Übelkeit, Erbrechen, Krämpfe, Blähungen
Gelegentlich: Abdominalschmerzen, Konstipation, Mundtrockenheit, Dyspepsie, Gastritis, Glossitis, Pankreatitis, Stomatitis, Zungenverfärbung, -schwellung.
Sehr selten: oberflächliche Zahnverfärbungen (in den Fällen mit bekanntem Ausgang konnten die Verfärbungen mit zahnhygienischen Massnahmen (manuell) entfernt werden.)
Leber und Gallenerkrankungen
Häufig: abnormale Leberfunktionstests.
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Dermatitis, Diaphorese, Juckreiz, Rash, Urticaria.
Sehr selten: bullöse Hautveränderungen einschliesslich schwerer Hautreaktionen wie Toxische epidermale Nekrolyse und Stevens-Johnson Syndrom.
Erkrankungen der Nieren und Harnwege
Gelegentlich: Polyurie.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gelegentlich: Vulvovaginale Störungen, Vaginitis.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Gelegentlich: Frösteln, Müdigkeit, Fieber, Schmerzen an der Injektionsstelle, lokalisierte Schmerzen, gesteigerter Durst.
Untersuchungen
Häufig: erhöhte Serum Kreatinphosphokinase Werte.
In Zusammenhang mit einer Behandlung mit Linezolid Pfizer in Dosierungen bis zu 600 mg alle 12 Stunden während bis zu 28 Tagen wurden Thrombozytopenien beobachtet. In kontrollierten Phase III Vergleichsstudien war der Anteil der Patienten, welche eine tiefe Thrombozytenzahl (definiert als weniger als 75% der unteren Grenze des Normalbereiches bzw. des Wertes vor Medikation) aufwiesen mit Linezolid Pfizer 2.4% (Einzelstudien: 0.3-10%) und mit der Vergleichssubstanz 1.5% (Einzelstudien: 0.4-0.7%). In Zusammenhang mit Linezolid Pfizer stehende Thrombozytopenien scheinen abhängig von der Therapiedauer zu sein (generell länger als 2 Behandlungswochen). In der Follow-up Periode normalisierten sich jedoch die Thrombozytenzahlen der meisten Patienten wieder. In Phase III Studien wurden bei Patienten mit Thrombozytopenie keine damit in Zusammenhang stehenden unerwünschten Arzneimittelwirkungen festgestellt. Während eines «compassionate use» Programms wurden bei Patienten mit Thrombozytopenie Blutungen festgestellt, deren Zusammenhang mit Linezolid allerdings nicht erwiesen ist (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Veränderungen von anderen Laborparametern, unabhängig vom Zusammenhang zum Arzneimittel, zeigten keine grundsätzlichen Unterschiede zwischen Linezolid Pfizer und den Vergleichssubstanzen. Die Veränderungen waren normalerweise nicht klinisch signifikant, führten nicht zum Abbruch der Therapie und waren reversibel.
Überdosierung
Bis heute liegen keine Berichte über Überdosierungen vor.
Im Falle eine Überdosierung sind unterstützende Massnahmen zusammen mit Aufrechterhaltung der glomerulären Filtration angezeigt. Etwa 30% einer Linezoliddosis wird während einer dreistündigen Hämodialyse eliminiert. Auch die primären Metaboliten werden mit der Hämodialyse ausgeschieden. Für die Elimination via Peritonealdialyse oder Hämoperfusion sind keine Daten vorhanden.
Intoxikationssymptome bei Ratten nach Dosen von 3'000 mg/kg/Tag waren reduzierte Aktivität und Ataxie, bei Hunden wurde nach Dosen von 2'000 mg/kg/Tag Erbrechen und Tremor beobachtet.
Eigenschaften/Wirkungen
ATC-Code: J01XX08
Wirkungsmechanismus und Pharmakodynamik
Mikrobiologie
Linezolid ist eine synthetische, antibakteriell wirksame Substanz, die zur neuen Antibiotikaklasse der Oxazolidinone gehört. Linezolid ist in-vitro gegen aerobe Gram-positive Bakterien und anaerobe Mikroorganismen wirksam. Es stoppt die bakterielle Proteinsynthese durch einen neuartigen Wirkmechanismus. Es bindet an bakterielle Ribosomen und verhindert die Bildung eines funktionellen 70S Initiationskomplexes, und damit einen essentiellen Schritt während des Translationsprozesses. Es wirkt bakteriostatisch gegen Enterokokken und Staphylokokken und ist bakterizid gegen die meisten Streptokokken-Stämme.
Grenzwerte
Die folgenden MHK Grenzwerte unterscheiden empfindliche von unempfindlichen Isolaten (gemäss EUCAST [European Committee on Antimicrobial Susceptibility Testing]):
Empfindlich: MHK ≤4 µg/ml
Resistent: MHK >4 µg/ml
Empfindlichkeit
Die Resistenzprävalenz kann für bestimmte Stämme geographisch und zeitlich variieren. Lokale Resistenzdaten sind daher wünschenswert, speziell bei der Behandlung von schweren Infektionen. Die folgende Information ist daher nur als Anhaltspunkt über die Empfindlichkeitswahrscheinlichkeit von Mikroorganismen zu betrachten. Ausserdem sind nur Mikroorganismen aufgeführt, die bei den belegten Indikationen relevant sind. Die Einteilung der Organismen beruht auf in vitro Daten für Mikroorganismen, die für die belegten Indikationen relevant sind. Mikroorganismen für die die klinische Wirksamkeit belegt ist, sind mit einem Stern (*) markiert:
Empfindliche Organismen (MHK ≤4 µg/ml)Gram-positive Aerobier: Corynebacterium jeikeium Enterococcus faecalis (einschliesslich Glycopeptid resistente Stämme)* Enterococcus faecium (einschliesslich Glycopeptid resistente Stämme)* Enterococcus casseliflavus Enterococcus gallinarum Listeria monocytogenes Staphylococcus aureus (einschliesslich Methicillin resistente Stämme)* Staphylococcus aureus (Glycopeptid intermediäre Stämme) Staphylococcus epidermidis (einschliesslich Methicillin resistente Stämme)* Staphylococcus haemolyticus Staphylococcus lugdunensis Streptococcus agalactiae* Streptococcus intermedius Streptococcus pneumoniae (nur Penicillin-empfindliche Stämme)* Streptococcus pyogenes* Viridans group streptococci Group C streptococci Group G streptococci Gram-positive Anaerobier: Clostridium perfringens Peptostreptococcus anaerobius Peptostreptococcus species Andere Chlamydia pneumoniae |
Resistente Organismen (MHK >4 µg/ml)Legionella species Moraxella catarrhalis Mycoplasma species Haemophilus influenzae Neisseria species Enterobacteriaceae Pseudomonas species |
Resistenz
Der Wirkungsmechanismus von Linezolid unterscheidet sich von dem anderer Antibiotikaklassen (z.B. Aminoglykoside, Beta-Lactame, Folsäureantagonisten, Glykopeptide, Lincosamine, Chinolone, Rifamycine, Streptogramine, Tetrazykline und Chloramphenicol). Deshalb ist eine Kreuzresistenz zwischen Linezolid und diesen Antibiotikaklassen unwahrscheinlich. Linezolid ist gegen pathogene Keime wirksam, die gegenüber solchen Antibiotika empfindlich oder resistent sind.
In klinischen Studien entwickelte sich bei 6 Patienten eine Resistenz gegen Linezolid, welche mit E. faecium infiziert waren (4 Patienten erhielten 200 mg alle 12 Stunden; also weniger als die empfohlene Dosis, und 2 Patienten erhielten 600 mg alle 12 Stunden). In einem «compassionate use» Programm entwickelten sich bei 8 mit E. faecium und einem mit E. faecalis infizierten Patienten Resistenzen. Alle Patienten waren Träger von nicht entferntem medizinischen Material oder unbehandelten Abszessen. In vitro tritt Linezolid Resistenz mit einer Häufigkeit von 1× 10-9 bis 1× 10-11 auf. In vitro Studien haben gezeigt, dass Punktmutationen in der 23 S ribosomalen RNS mit Linezolidresistenz assoziiert sind. Resistenzen wurden keine gesehen in klinischen Studien mit Patienten, welche mit Staphylokokken oder Streptokokken, einschliesslich S. pneumoniae infiziert waren.
Klinische Studien
Vancomycin resistente Enterokokken-Infektionen:
145 erwachsene Patienten mit dokumentierter oder vermuteter Vancomycin resistenter Enterokokken-Infektion wurden in eine randomisierte, multizentrische Doppelblind-Studie eingeschlossen in welcher hochdosiertes Linezolid Pfizer (600 mg alle 12 Stunden i.v. oder oral) mit niedrigdosiertem Linezolid Pfizer (200 mg alle 12 Stunden i.v. oder oral) während 7 bis 28 Tagen verglichen wurde. Begleittherapie mit Aztreonam oder Aminoglykosiden war erlaubt.
Heilungsrate bei ITT-Patienten mit dokumentierter Vancomycin resistenter Enterokokken-Infektion (ITT: intent-to-treat)
Infektionsquelle | geheilt | |
|---|---|---|
Linezolid Pfizer 600 mg | Linezolid Pfizer 200 mg | |
Alle Infektionsquellen | 39/58 (67) | 24/46 (52) |
Alle Infektionsquellen mit assoziierter Bakteriämie | 10/17 (59) | 4/14 (29) |
Bakteriämie unbekannter Ursache | 5/10 (50) | 2/7 (29) |
Haut- und Weichteile | 9/13 (69) | 5/5 (100) |
Harntrakt | 12/19 (63) | 12/20 (60) |
Pneumonie | 2/3 (67) | 0/1 (0) |
Andere* | 11/13 (85) | 5/13 (39) |
* Einschliesslich Infektionsquellen wie Leberabszess, biliäre Sepsis, nekrotische Gallenblase, Perikolon-Abszess, Pankreatitis und Katheter bedingte Infektionen.
Nosokomiale Pneumonie:
Erwachsene Patienten mit klinisch und radiologisch dokumentierter nosokomialer Pneumonie wurden in eine randomisierte, multizentrische, Doppelblind-Studie eingeschlossen. Die Patienten wurden 7 bis 21 Tage lang behandelt. Eine Gruppe erhielt 600 mg Linezolid Pfizer i.v. alle 12 Stunden und die andere Gruppe 1 g Vancomycin i.v. alle 12 Stunden. Beide Gruppen erhielten als Begleittherapie Aztreonam (1 bis 2 g i.v. alle 8 Stunden), welche fortgesetzt werden konnte, falls klinisch indiziert. 396 Patienten waren in die Studie eingeschlossen worden, insgesamt 225 konnten ausgewertet werden. Die Heilungsrate bei mit Linezolid behandelten Patienten betrug 57%, bei mit Vancomycin behandelten 60%. Für Pneumonien, welche bei intubierten Patienten («ventilator-associated») auftraten, ergaben sich Heilungsraten von 47% für mit Linezolid behandelte und 40% für mit Vancomycin behandelte Patienten.
Komplizierte Haut- und Weichteilinfektionen:
819 erwachsene Patienten mit klinisch dokumentierter komplizierter Haut- und Weichteilinfektion wurden in eine randomisierte, multizentrische doppelblinde und «double-dummy» Vergleichsstudie eingeschlossen. Auf die i.v. Studienmedikation folgte die orale Applikation für gesamthaft 10 bis 21 Tage. Eine Gruppe erhielt 600 mg Linezolid Pfizer i.v. alle 12 Stunden gefolgt von 600 mg Linezolid Pfizer Filmtabletten alle 12 Stunden, die andere Gruppe erhielt 2 g Oxacillin alle 6 Stunden i.v. gefolgt von 500 mg Dicloxacillin oral alle 6 Stunden. Falls klinisch indiziert, konnte Aztreonam als Begleittherapie eingesetzt werden. Insgesamt 487 Patienten konnten klinisch evaluiert werden. Die Heilungsrate betrug 90% bei den mit Linezolid behandelten und 85% bei den mit Oxacillin behandelten Patienten. Die Heilungsrate in der MITT (modified intent-to-treat) Analyse betrug 86% in den mit Linezolid behandelten Patienten und 82% in den mit Oxacillin behandelten Patienten. In der folgenden Tabelle sind die Heilungsraten aufgeteilt nach Krankheitserregern für mikrobiologisch auswertbare Patienten dargestellt.
Krankheitserreger | geheilt | |
|---|---|---|
Linezolid Pfizer | Oxacillin/Dicloxacillin | |
Staphylococcus aureus | 73/83 (88) | 72/84 (86) |
Methicillin resistenter S. aureus | 2/3 (67) | 0/0 (-) |
Streptococcus agalactiae | 6/6 (100) | 3/6 (50) |
Streptococcus pyogenes | 18/26 (69) | 21/28 (75) |
In einer randomisierten offenen Studie an 460 hospitalisierten Patienten mit dokumentierter oder vermuteter Methicillin-resistenter Staphylococcus aureus (MRSA) Infektion erhielt eine Gruppe der Patienten 600 mg Linezolid Pfizer i.v. alle 12 Stunden gefolgt von 600 mg Linezolid Pfizer Filmtabletten alle 12 Stunden. Die andere Gruppe erhielt 1 g Vancomycin alle 12 Stunden. Beide Gruppen wurden während 7 bis 28 Tagen therapiert und konnten als Begleittherapie Aztreonam oder Gentamicin erhalten, falls klinisch indiziert. Die Heilungsrate bei den mikrobiologisch auswertbaren Patienten mit MRSA Haut- und Weichteilinfektionen betrug 26/33 (79%) für die mit Linezolid behandelten und 24/33 (73%) für die mit Vancomycin behandelten Patienten.
Pharmakokinetik
Linezolid Pfizer enthält hauptsächlich (S)-Linezolid, welches biologisch aktiv ist und zu inaktiven Derivaten metabolisiert wird. Die Wasserlöslichkeit von Linezolid ist etwa 3 mg/ml und pH-unabhängig zwischen pH 3 und 9.
In der folgenden Tabelle sind die Mittelwerte (und Standardabweichungen) der pharmakokinetischen Parameter von Linezolid nach einmaliger und multipler (d.h. zweimal täglicher Verabreichung bis zum «steady-state») i.v. und oraler Gabe aufgeführt:
Gesunde Erwachsene | ||||||
|---|---|---|---|---|---|---|
Linezolid Dosierungsschema | Cmax | Cmin | Tmax | AUC* | t½ | CL |
600 mg Infusionslösung‡ | ||||||
Einzeldosis | 12.90 | - | 0.50 | 80.20 | 4.40 | 138 |
2× täglich | 15.10 | 3.68 | 0.51 | 89.70 | 4.80 | 123 |
600 mg Filmtabletten | ||||||
Einzeldosis† | 12.70 | - | 1.28 | 91.40 | 4.26 | 127 |
2× täglich | 21.20 | 6.15 | 1.03 | 138.00 | 5.40 | 80 |
600 mg orale Suspension | ||||||
Einzeldosis | 11.00 | - | 0.97 | 80.80 | 4.60 | 141 |
* AUC für Einzeldosen = AUC0-∞
* AUC für Mehrfachdosen = AUC0-τ
‡ Werte normalisiert von 625 mg Dosis
† Werte normalisiert von 375 mg Dosis
Cmax = Maximale Plasmakonzentration
Cmin = Minimale Plasmakonzentration
Tmax = Zeit bis Cmax
AUC = Fläche unter der «Konzentration vs. Zeit»-Kurve
t½ = Eliminationshalbwertszeit
CL = Systemische Clearance
Wie aus der obenstehenden Tabelle ersichtlich, entsprechen die erreichten durchschnittlichen Cmin-Werte bei der 2× täglichen Gabe von 600 mg Linezolid etwa den höchsten MHK90 Werten (4 µg/ml) für die am wenigsten empfindlichen Mikroorganismen.
Absorption
Linezolid wird nach oraler Gabe rasch und vollständig absorbiert. Die maximale Plasmakonzentration wird innerhalb von 2 Stunden nach Gabe erreicht und die absolute Bioverfügbarkeit ist etwa 100%. Die Absorption der oralen Suspension ist vergleichbar mit derjenigen der Filmtabletten. Die Absorption wird durch Nahrung nicht wesentlich beeinflusst. Bei gleichzeitiger Einnahme einer fettreichen Mahlzeit ist die Cmax um 17% reduziert; die totale Exposition (AUC) ist aber nicht beeinflusst. Steady-state Bedingungen werden am zweiten bis dritten Behandlungstag erreicht.
Distribution
Linezolid verteilt sich sofort in gut durchblutetes Gewebe. Das Verteilungsvolumen im steady-state beträgt bei gesunden Erwachsenen 40–50 Liter und entspricht etwa dem totalen Körperwasser. Die Plasmaproteinbindung beträgt etwa 31% und ist nicht konzentrationsabhängig.
Metabolismus
Linezolid wird in vitro weder durch Cytochrom P450 (CYP)-Isoenzyme metabolisiert, noch hemmt es die Aktivität klinisch relevanter humaner CYP-Isoformen (1A2, 2C9, 2C19, 2D6, 2E1, 3A4). Bei Ratten wurde keine signifikante Induktion wichtiger Cytochrom P450 Isoenzyme beobachtet und auch humanes CYP2C9 wurde nicht induziert. Metabolische Oxidation des Morpholin-Rings resultiert primär in zwei inaktiven Derivaten mit offenen Carbonsäuren. Der Hydroxyethylglycin-Metabolit (A) ist der prädominante Metabolit beim Menschen und wird durch einen nichtenzymatischen Prozess gebildet. Der Aminoethoxy-Essigsäure-Metabolit (B) ist weniger häufig. Es wurden weitere inaktive Metaboliten charakterisiert.
Elimination
Unter steady-state-Bedingungen wird Linezolid primär als Metabolit A (40%), unverändert (30-35%) und als Metabolit B (10%) im Urin ausgeschieden. In den Faeces wurde praktisch kein unverändertes Linezolid gefunden, jedoch etwa 6% jeder Dosis als Metabolit A und 3% als Metabolit B. Die Eliminationshalbwertszeit beträgt 5-7 Stunden.
Die nicht-renale Clearance macht etwa 65% der totalen Clearance von Linezolid aus. Mit steigender Linezolid-Dosis wurde ein kleiner Anteil an Nichtlinearität in der Clearance beobachtet. Dies scheint eine Folge geringerer renaler und nicht-renaler Clearance bei höheren Dosen von Linezolid zu sein. Die Differenz ist allerdings so klein, dass sich dies nicht auf die Eliminationshalbwertszeit auswirkt.
Kinetik spezieller Patientengruppen
Kinder und Jugendliche (<18 Jahre)
Es liegen nur beschränkte Daten zur Sicherheit und Effizienz von Linezolid bei Kindern und Jugendlichen (<18 Jahre alt) vor (siehe Abschnitt «Dosierung/Anwendung»).
Die Cmax sowie das Verteilvolumen (Vss) von Linezolid sind bei paediatrischen Patienten – unabhängig vom Alter – ähnlich; die Clearance von Linezolid variiert jedoch in Abhängigkeit vom Alter. Lässt man Frühgeborene unter 1 Woche ausser Betracht, ist die Clearance in der niedrigsten Altersgruppe (>1 Woche bis 11 Jahre) am schnellsten, was nach Einzeldosisgabe zu einer niedrigeren systemischen Exposition (AUC) und kürzerer Halbwertszeit als bei Erwachsenen führt. Mit zunehmendem Lebensalter der Kinder nimmt die Clearance von Linezolid schrittweise ab, um sich in der Adoleszenz den mittleren Clearance Werten von Erwachsenen anzunähern. Insgesamt war in allen pädiatrischen Altersgruppen eine grössere interindividuelle Variabilität der Linezolid Clearance und der systemischen Wirkstoffexposition (AUC) als bei Erwachsenen festzustellen.
Nach Verabreichung von 10 mg/kg KG alle 8 Stunden konnte bei Kindern im Alter von 1 Woche bis 12 Jahren eine ähnliche Exposition festgestellt werden wie bei Erwachsenen nach der Gabe von 600 mg Linezolid 2mal täglich. Bei bis zu einer Woche alten Neugeborenen erhöhte sich die systemische Clearance von Linezolid (pro kg Körpergewicht) in der ersten Lebenswoche rasch. Daher haben Neugeborene, denen 10 mg/kg KG alle 8 Stunden täglich verabreicht werden, die grösste systemische Exposition am ersten Tag nach der Geburt.
Jugendliche (12 bis 17 Jahre)
Die Linezolid Pharmakokinetik nach einer 600 mg Dosierung war ähnlich (vergleichbar) bei Jugendlichen und Erwachsenen. Daher erfahren Jugendliche eine den Erwachsenen ähnliche Exposition nach der Gabe von 600 mg alle 12 Stunden.
Zusammenfassung pharmakokinetische Parameter nach einmaliger intravenöser Infusion von 10 mg/kg oder 600 mg Linezolid bei Kindern und Erwachsenen (MW: (%CV); [Min, Max Werte])
Altersgruppe | Cmax | Vss | AUC* | t½ | CL |
|---|---|---|---|---|---|
Neugeborene | |||||
Frühgeborene** <1 Woche (N=9)† | 12.7 (30%) | 0.81 (24%) | 108 (47%) | 5.6 (46%) | 2.0 (52%) |
Termin-Geborene*** | |||||
<1 Woche (N=10)† | 11.5 (24%) | 0.78 (20%) | 55 (47%) | 3.0 (55%) | 3.8 (55%) |
Termin-Geborene*** | |||||
≥1 Woche bis ≤28 Tage (N=10)† | 12.9 (28%) | 0.66 (29%) | 34 (21%) | 1.5 (17%) | 5.1 (22%) |
Kleinkinder | |||||
>28 Tage bis <3 Monate (N=12 )† | 11.0 (27%) | 0.79 (26%) | 33 (26%) | 1.8 (28%) | 5.4 (32%) |
Kinder | |||||
3 Monate bis 11 Jahre† (N=59) | 15.1 (30%) | 0.69 (28%) | 58 (54%) | 2.9 (53%) | 3.8 (53%) |
Adoleszente Patienten | |||||
12 bis 17 Jahre‡ (N=36) | 16.7 (24%) | 0.61 (15%) | 95 (44%) | 4.1 (46%) | 2.1 (53%) |
Erwachsene§ | |||||
(N=29) | 12.5 (21%) | 0.65 (16%) | 91 (33%) | 4.9 (35%) | 1.7 (34%) |
* AUC = AUC0-∞ nach einmaliger Gabe
** «Frühgeborene» hier definiert als vor der 34. Schwangerschaftswoche Geborene (Bitte beachten: eingeschlossen wurde auch 1 Frühgeburt der Altersgruppe 1 Woche bis 28 Tage)
*** «Termin-Geborene» hier definiert als ab der 34. Schwangerschaftswoche Geborene
† Dosis von 10 mg/kg
‡ Dosis von 600 mg oder 10 mg/kg bis zu einem Maximum von 600 mg
§ Dosis normiert auf 600 mg
Cmax = Maximale Plasma Konzentration; Vss = Verteilungsvolumen; AUC = Area under concentration-time curve; t½ = Apparente Eliminationshalbwertszeit; CL = Systemische Clearance auf Körpergewicht normiert
Ältere Patienten
Die pharmakokinetischen Eigenschaften von Linezolid sind bei Patienten über 65 nicht verändert.
Frauen
Einige pharmakokinetische Parameter von Linezolid weichen bei Frauen ab. Frauen haben ein geringfügig kleineres Verteilungsvolumen als Männer und die Clearance ist um etwa 20% reduziert, wenn sie nach Körpergewicht korrigiert wird. Die Plasmakonzentrationen sind bei Frauen etwas höher, was dem unterschiedlichen Körpergewicht zugeschrieben werden kann. Da die mittlere Halbwertszeit von Linezolid von Frauen und Männern sich nicht signifikant unterscheidet, ist nicht zu erwarten, dass sich die Plasmakonzentration bei Frauen substantiell über gut tolerierte erhöht. Dosisanpassungen sind nicht erforderlich.
Patienten mit Niereninsuffizienz
Nach Einzeldosen von 600 mg wurde im Plasma von Patienten mit schwerer Niereninsuffizienz (Kreatininclearance <30 ml/min) eine 7–8 fache Erhöhung der beiden primären Metaboliten von Linezolid gemessen. Die AUC der Muttersubstanz war jedoch nicht erhöht. Obwohl ein gewisser Teil der Hauptmetaboliten von Linezolid bei der Hämodialyse eliminiert wird, waren die Plasmakonzentrationen der Metaboliten nach Einzeldosen von 600 mg bei Patienten nach Hämodialyse deutlich höher als bei Patienten mit normaler Nierenfunktion oder mit leichter bis mittelschwerer Niereninsuffizienz.
Bei 24 Patienten mit schwerer Niereninsuffizienz, von welchen 21 regelmässig hämodialysiert wurden, war die maximale Plasmakonzentration der beiden Hauptmetaboliten nach einigen Therapietagen ungefähr um das 10 fache erhöht verglichen mit den Patienten mit normaler Nierenfunktion. Cmax von Linezolid war unverändert.
Aufgrund der beschränkten Datenlage ist die klinische Bedeutung dieser Beobachtung momentan unklar (siehe «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
Bei Hämodialysepatienten soll Linezolid nach der Dialyse verabreicht werden, da etwa 30% der verabreichten Dosis während einer 3-stündigen Dialyse ausgeschieden wird. Es liegen keine Daten vor bei Patienten unter Peritonealdialyse.
Patienten mit Leberinsuffizienz
Es gibt nur wenige Daten. Diese weisen darauf hin, dass die pharmakokinetischen Eigenschaften von Linezolid, PNU-142300 und PNU-142586 bei Patienten mit leichter bis mässiger Leberinsuffizienz (Child-Pugh Klasse A oder B) nicht verändert sind. Eine Dosisanpassung ist bei diesen Patienten deshalb nicht erforderlich. Bei Patienten mit schwerer Leberinsuffizienz (Child-Pugh Klasse C) wurden die pharmakokinetischen Eigenschaften von Linezolid nicht ermittelt. Da Linezolid durch nicht-enzymatische Prozesse metabolisiert wird, ist nicht zu erwarten, dass der Abbau von Linezolid durch eine beeinträchtigte Leberfunktion beeinflusst wird (siehe «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
Präklinische Daten
Bei der männlichen Ratte kam es zu einer Abnahme der Fertilität und Reproduktionsleistung bei Dosierungen, die ungefähr den beim Menschen erwartenden entsprachen. Bei geschlechtsreifen Tieren waren diese Wirkungen reversibel.
Bei Jungtieren, die während fast der gesamten Zeit ihrer sexuellen Reifung mit Linezolid behandelt wurden, zeigte sich keine Normalisierung. Bei erwachsenen männlichen Ratten wurde in den Hoden eine veränderte Spermienmorphologie gefunden, im Nebenhoden lag eine Hypertrophie und Hyperplasie der Epithelialzellen vor. Linezolid schien die Reifung der Spermatozoen der Ratten zu beeinflussen. Die Gabe von Testosteron hatte keinen Einfluss auf die unerwünschten Fertilitätswirkungen. Eine Hypertrophie des Nebenhodens wurde bei Hunden nach einer Behandlungsdauer von einem Monat nicht beobachtet. Allerdings zeigten sich Gewichtsveränderungen von Prostata, Hoden und Nebenhoden.
Bei Reproduktionsstudien zur Toxizität an Mäusen und Ratten zeigten sich keine Anhaltspunkte für einen teratogenen Effekt bei einer Exposition bis zum vierfachen der beim Menschen erwarteten.
Bei Mäusen allerdings waren die gleichen Linezolid-Konzentrationen für Muttertiere toxisch, mit Anstieg der Todesrate bei Embryonen einschliesslich Verlust des gesamten Wurfes, einer Verringerung des fetalen Körpergewichtes sowie einer Exazerbation der normalen genetischen Prädisposition und Veränderungen des Brustbeines im verwendeten Mäusestamm. Bei der Ratte wurde eine leichte Toxizität bei Muttertieren in Form einer verminderten Gewichtszunahme bei einer Exposition beobachtet, die niedriger lag als die beim Menschen erwartete.
Eine leichte fetale Toxizität wurde beobachtet. Diese manifestierte sich als verringertes Körpergewicht des Feten, verminderte Verknöcherung der Brustbeine, höhere Sterblichkeit der Jungtiere und als leichte Reifungsverzögerung. Nach der Paarung zeigten diese Jungtiere Hinweise auf eine reversible, dosisabhängige Verminderung der Einnistung mit einer daraus folgenden Verringerung der Fertilität.
Linezolid und seine Stoffwechselprodukte gehen in die Muttermilch von stillenden Ratten über; die dabei erreichten Konzentrationen lagen höher als die im Plasma der Muttertiere.
Linezolid verursachte bei Ratten und Hunden eine reversible Myelosuppression.
Die präklinischen Befunde, die auf Studien zur Toxizität nach Mehrfachgabe und Genotoxizität basieren, ergaben kein spezifisches Risiko für die Anwendung beim Menschen, die über die in anderen Abschnitten dieser Fachinformation aufgeführten Informationen hinausgehen. Auf Grund der kurzen Anwendungsdauer und dem Fehlen einer Toxizität bei genetischen Studien wurden Untersuchungen zur Karzinogenität und Tumorbildung nicht durchgeführt.
Sonstige Hinweise
Inkompatibilitäten
Infusionslösung
Es sollen der Infusionslösung keine Zusätze beigefügt werden. Muss Linezolid gleichzeitig mit anderen Medikamenten verabreicht werden, soll jedes Medikament separat gemäss den eigenen Anwendungshinweisen verabreicht werden.
Falls dieselbe Zuleitung für die sequentielle Verabreichung verschiedener Medikamente benutzt wird, muss die Zuleitung vor und nach einer Linezolidgabe mit einer kompatiblen Infusionslösung gespült werden.
Linezolid Pfizer Infusionslösung ist mit folgenden Substanzen physikalisch inkompatibel: Amphotericin B, Chlorpromazinhydrochlorid, Diazepam, Pentamidin-Isothionate, Erythromycinlactobionat, Phenytoin-Natrium und Trimethoprim-Sulfamethoxazol. Ausserdem ist Linezolid Pfizer mit Ceftriaxon-Natrium chemisch inkompatibel.
Siehe auch «Hinweise für die Handhabung» für die Infusionslösung.
Beeinflussung diagnostischer Methoden
Linezolid Pfizer hatte keinen substantiellen klinischen Effekt auf Laborparameter. Die beobachteten Änderungen (unabhängig von der Kausalität) reflektierten im Allgemeinen die Infektion, waren nicht klinisch signifikant, führten nicht zum Abbruch der Therapie und waren reversibel.
Haltbarkeit
Linezolid Pfizer Granulat ist nach Rekonstitution als Suspension 3 Wochen bei Raumtemperatur (15‑25 °C) haltbar.
Besondere Lagerungshinweise
Bei Raumtemperatur (15‑25 °C) und ausser Reichweite von Kindern aufbewahren.
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Die Beutel mit Infusionslösung sollten bis zur Verwendung in der Schutzfolie und im Karton aufbewahrt werden.
Hinweise für die Handhabung
Infusionslösung
Schutzfolie erst kurz vor dem Gebrauch entfernen und den Beutel auf Dichtigkeit prüfen. Undichte Beutel dürfen nicht verwendet werden, da die Sterilität nicht mehr garantiert ist. Die Infusionslösung muss nach Anbruch sofort verwendet werden. Restmengen unverbrauchter Lösung müssen vernichtet werden. Teilweise verwendete Beutel dürfen nicht wiederverwendet werden.
Die Linezolid Pfizer-Infusionslösung darf nicht mit anderen Medikamenten in Kontakt kommen, ausser wenn die Kompatibilität belegt ist. Falls die gleiche i.v. Leitung zur sequentiellen Infusion verschiedener Medikamente verwendet wird, muss diese vor Gabe von Linezolid Pfizer mit einer kompatiblen Lösung gespült werden. Linezolid Pfizer-Infusionslösung ist kompatibel mit folgenden Infusionslösungen: Glukoselösung 5%, NaCl 0.9%, Ringer-Laktat.
Inkompatibilitäten siehe «Sonstige Hinweise».
Granulat zur Herstellung einer Suspension zum Einnehmen
Granulat leicht aufschütteln und 123 ml Leitungswasser bereitstellen. Zuerst eine Hälfte des Wassers der Flasche beifügen und kräftig schütteln. Anschliessend den Rest des Wassers ebenfalls beifügen und nochmals kräftig schütteln, bis eine homogene Suspension entsteht. Dies ergibt 150 ml gebrauchsfertige Linezolid Pfizer Suspension zum Einnehmen. 1 ml enthält 20 mg Linezolid. Ein Messlöffel (à 2.5 bzw. 5 ml) liegt der Packung bei. Flasche vor Gebrauch 3-5 Mal kippen. Nicht schütteln.
Zulassungsnummer
66253 (Filmtabletten), 66250 (Granulat zur Herstellung einer Suspension zum Einnehmen), 66252 (Infusionslösung) (Swissmedic).
Zulassungsinhaberin
Pfizer AG, Zürich
Stand der Information
März 2018.
LLD V006
Composition
Principe actif: linézolide.
Excipients:
Solution pour perfusion à 2 mg/ml
glucose anhydre (45.7 mg/ml), citrate de sodium (E331), acide citrique anhydre (E330), acide chlorhydrique (E507), hydroxyde de sodium (E524), eau pour préparations injectables.
Comprimés filmés à 600 mg
Noyau: cellulose microcristalline (E460), amidon de maïs, carboxyméthylamidon sodique, hyprolose (E463), stéarate de magnésium (E572).
Pelliculage: hypromellose (E464), macrogol 400, dioxyde de titane (E171), cire de carnauba (E903).
Granulé pour la préparation d’une suspension buvable à 20 mg/ml
Saccharum 210.6 mg/ml, mannitol (E421), cellulose microcristalline (E460), carmellose sodique (E466), aspartame (E951), amidon modifié*, sorbitol*, fructose*, maltodextrine*, silice colloïdale anhydre (E551), citrate de sodium anhydre (E331), gomme xanthane (E415), acide citrique (E330), chlorure de sodium, conserv.: benzoate de sodium (E211); arômes, vanilline et éthylvanilline.
* produits à partir de maïs génétiquement modifié.
30 ml de suspension buvable (6 mesurettes de 5 ml) correspondent à une dose unique de 600 mg de linézolide et contiennent 6.32 g d’hydrates de carbone digestibles.
Forme galénique et quantité de principe actif par unité
Solution pour perfusion: 1 ml contient 2 mg de linézolide.
Comprimés filmés: 1 comprimé contient 600 mg de linézolide.
Comprimé pelliculé blanc, oblong-ovale portant les inscriptions gravées «LZD» sur une face et «600» sur l'autre face.
Granulé pour la préparation d'une suspension buvable: après reconstitution avec 123 ml d'eau, 1 ml de suspension contient 20 mg de linézolide.
Indications/Possibilités d’emploi
Traitement de patients adultes souffrant des infections suivantes:
- Pneumonie nosocomiale, pour autant qu'il soit avéré ou très probable qu'elle est causée par des souches de Staphylococcus aureus ou Streptococcus pneumoniae sensibles au linézolide. L'expérience dans les infections causées par des pneumocoques résistants à la pénicilline est limitée. Le linézolide n'est pas efficace en cas d'infections à Gram négatif. Si une infection mixte due à des germes Gram négatif est suspectée ou attestée, il faut instaurer simultanément un traitement spécifique contre les germes Gram négatif. À ce jour, seuls l'aztréonam et les aminosides ont été testés.
- Infections compliquées de la peau et des tissus mous: en ce qui concerne le traitement des infections compliquées de la peau et des tissus mous, Linezolid Pfizer est indiqué uniquement lorsqu'il est établi, après détermination de la sensibilité microbiologique, que l'infection est provoquée par des bactéries à Gram positif sensibles appartenant aux espèces Staphylococcus aureus, Streptococcus pyogenes ou Streptococcus agalactiae. Le linézolide n'est pas efficace en cas d'infections à Gram négatif. Chez les patients souffrant d'infections compliquées de la peau et des tissus mous, chez lesquels une co-infection due à des germes Gram négatif est présumée ou attestée, le linézolide doit être utilisé uniquement s'il n'existe aucun autre traitement possible (voir la rubrique «Mises en garde et précautions»). Dans de tels cas, il faut simultanément instaurer un traitement contre les germes Gram négatif. À ce jour, seuls l'aztréonam et les aminosides ont été testés.
On ne dispose d'aucune expérience dans le traitement des ulcères diabétiques ou de décubitus. - Infections à Enterococcus faecium résistant à la vancomycine, y compris bactériémie.
On ne dispose d'aucune expérience dans le traitement des infections du SNC, des ostéomyélites et des endocardites.
Les recommandations officielles pour un usage mesuré approprié des antibiotiques doivent être respectées, en particulier les recommandations d'utilisation destinées à empêcher la prolifération d'une résistance aux antibiotiques. Il est par conséquent recommandé de poser le diagnostic et de débuter le traitement par le linézolide en milieu hospitalier, sous le contrôle d'un spécialiste, par exemple un infectiologue. Le traitement peut être poursuivi ambulatoirement.
Posologie/Mode d’emploi
L'instauration du traitement peut avoir lieu aussi bien avec la solution pour perfusion que les comprimés filmés ou la suspension orale de Linezolid Pfizer. Les patients qui débutent un traitement par la forme parentérale peuvent ensuite passer à l'une des deux formes orales. Aucune adaptation posologique n'est nécessaire car le linézolide possède une biodisponibilité orale d'environ 100%.
La solution pour perfusion doit être administrée en l'espace de 30 à 120 minutes. Les comprimés filmés et la suspension peuvent être pris avec ou en dehors d'un repas.
La dose recommandée doit être administrée ou prise deux fois par jour.
Posologie recommandée et durée d'utilisation chez l'adulte:
Infections | Dose administrée 2× par jour et type d'administration | Durée du traitement |
|---|---|---|
Pneumonie nosocomiale | 600 mg i.v. ou par voie orale | 10-14 jours consécutifs |
Infections compliquées de la peau et des tissus mous | ||
Infections à Enterococcus faecium résistant à la vancomycine, y compris bactériémie | 600 mg i.v. ou par voie orale | 14-28 jours consécutifs |
La durée du traitement est variable et dépend du germe responsable, de la localisation de l'infection et de son degré de gravité, ainsi que de la réaction clinique du patient. La durée maximale du traitement est de 28 jours. La sécurité d'emploi et l'efficacité du linézolide pendant une durée de traitement supérieure à 28 jours n'ont pas été établies (voir «Mises en garde et précautions»).
Les données de tolérance et d'efficacité du linézolide sont insuffisantes chez l'enfant et l'adolescent (<18 ans). Par conséquent, dans l'attente de données complémentaires, l'utilisation du linézolide dans cette population n'est pas recommandée (voir «Cinétique pour certains groupes de patients»).
Il n'est pas nécessaire d'adapter la posologie chez les patients âgés ni chez les femmes.
Aucune accumulation du linézolide n'a été observée chez les patients présentant une limitation de la fonction rénale, quelle que soit sa gravité.
Aucune adaptation posologique n'est pas non plus nécessaire chez les patients présentant une insuffisance rénale légère à modérée (CLCR >30 ml/min).
Aucune adaptation posologique n'est nécessaire chez les patients présentant une insuffisance rénale grave (CLCR <30 ml/min). Les conséquences cliniques d'une exposition plus élevée (jusqu'à 10 fois) aux deux principaux métabolites du linézolide chez le patient présentant une insuffisance rénale sévère étant inconnues, le linézolide sera utilisé avec une précaution particulière chez ces patients et uniquement lorsque les bénéfices attendus sont supérieurs aux risques potentiels.
L'élimination d'une dose de linézolide après 3 heures d'hémodialyse étant d'environ 30%, le linézolide devra être administré après la dialyse chez les patients soumis à ce type de traitement. Les principaux métabolites du linézolide sont en partie éliminés lors de l'hémodialyse, mais leur concentration après dialyse reste néanmoins bien plus élevée que chez les patients ayant une fonction rénale normale ou présentant une insuffisance rénale légère à modérée.
En conséquence, le linézolide sera utilisé avec une prudence particulière chez les patients hémodialysés et uniquement lorsque les bénéfices attendus sont supérieurs aux risques potentiels.
On ne dispose à ce jour d'aucune expérience au sujet de l'utilisation du linézolide chez les patients soumis à une dialyse péritonéale continue ambulatoire (DPCA) ou à d'autres procédés thérapeutiques utilisés en cas d'insuffisance rénale (hormis l'hémodialyse).
Insuffisance hépatique: Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance hépatique. Cependant, les données cliniques sont limitées et il est recommandé d'utiliser le linézolide chez ces patients uniquement lorsque les bénéfices attendus sont supérieurs aux risques potentiels (voir «Mises en garde et précautions» et «Pharmacocinétique»).
Contre-indications
En cas d'hypersensibilité au linézolide ou aux autres composants du produit.
Mises en garde et précautions
Une acidose lactique a été observée sous un traitement par linézolide. Surveiller immédiatement les patients souffrant de nausée répétée et de vomissements, d'acidoses inexplicables ou de taux bas de bicarbonate.
Le linézolide est également un inhibiteur faible, réversible et non sélectif de la monoamine-oxydase (MAO). Des cas isolés d'effets indésirables et d'interactions médicamenteuses ont été rapportés qui sont vraisemblablement à mettre sur le compte de cette propriété, et qui se manifestent par exemple par une augmentation de la pression artérielle et par un syndrome sérotoninergique (les signes annonciateurs suivants sont possibles: confusion mentale, délire, coma, instabilité végétative avec parfois modifications rapides des signes vitaux, agitation, tremblements, rougeurs, transpiration, hyperpyrexie), voir «Interactions».
Par conséquent, le linézolide ne sera pas utilisé chez les patients présentant les symptômes cliniques mentionnés ci-après ou prenant l'une des associations médicamenteuses citées, à moins qu'une observation étroite et un contrôle de la pression artérielle ne soient possibles:
- patients présentant une hypertension non maîtrisée, un phéochromocytome, une tumeur carcinoïde, une hyperthyroïdie, une dépression bipolaire, une psychose schizo-affective, des états confusionnels aigus;
- patients prenant l'un des médicaments suivants: inhibiteurs de la recapture de la sérotonine, antidépresseurs tricycliques, agonistes des récepteurs 5HT 1 de la sérotonine (triptans), sympathomimétiques d'action directe ou indirecte (y compris les bronchodilatateurs adrénergiques, la pseudoéphédrine ou la phénylpropanolamine), médicaments vasopresseurs (par ex. adrénaline, noradrénaline), substances dopaminergiques (par ex. dopamine, dobutamine), péthidine ou buspirone.
Des données limitées provenant d'études d'interactions ainsi que des données concernant l'innocuité du linézolide chez les patients font état d'un risque lié à l'inhibition de la MAO soit en raison d'une maladie sous-jacente, soit en raison d'une co-médication. C'est pourquoi l'utilisation du linézolide en association avec des substances adrénergiques ou sérotoninergiques de même qu'en cas de maladies sous-jacentes correspondantes n'est pas recommandée, à moins qu'une observation étroite et un contrôle du patient ne soient possibles. Le linézolide ne sera pas utilisé chez les patients qui prennent ou ont pris au cours des deux semaines précédentes un médicament inhibant la monoamine-oxydase A ou B (par ex. phénelzine, isocarboxazide, sélégiline, moclobémide), voir aussi «Interactions».
Lors de l'administration simultanée de rifampicine et de linézolide, la Cmax et l'AUC du linézolide ont été diminués respectivement de 21% et de 32% chez des volontaires sains (voir «Interactions»). La portée clinique de cette interaction n'est pas connue.
Des diarrhées associées à Clostridium difficile (CDAD) ont été observées lors de l'utilisation de pratiquement tous les antibiotiques, y compris le linézolide; leur sévérité peut aller de diarrhées légères jusqu'à une colite d'issue fatale. L'utilisation d'antibiotiques modifie la flore colique normale et peut ainsi entraîner une prolifération excessive du Clostridium difficile. Un traitement spécifique doit être immédiatement mis en œuvre en cas d'apparition d'une telle surinfection. Les inhibiteurs du péristaltisme sont contre-indiqués.
Le C. difficile produit les toxines A et B qui contribuent au développement de la CDAD. Les souches de C. difficile hyperproductrices de toxines sont à l'origine d'une morbidité et d'une mortalité accrues car ces infections ne répondent éventuellement pas au traitement antimicrobien et peuvent nécessiter une colectomie.
Une CDAD doit être envisagée chez tous les patients présentant une diarrhée consécutive à une antibiothérapie. Il faut procéder à un recueil soigneux de l'anamnèse médicale car des cas de CDAD ont même été observés plus de deux mois après un traitement antibiotique.
Dans une étude clinique ouverte réalisée auprès de patients gravement malades présentant des infections associées à un cathéter (intravasculaire), un taux de mortalité accru a été observé chez les patients traités par le linézolide par rapport aux patients traités par la vancomycine/dicloxacilline/oxacilline. Pendant le traitement, y compris le suivi de 7 jours après la fin du traitement, 43 patients sur 363 (12%) sont décédés dans le groupe linézolide contre 22 patients sur 363 (6%) dans le bras comparatif (rapport de cotes 2.12; intervalle de confiance à 95%, 1.23–3.66), ce qui représente également une différence statistiquement significative. Dans l'évolution ultérieure du suivi (du 8e jour après la fin du traitement au 84e jour suivant l'administration de la première dose), le nombre de décès était similaire dans les deux bras de l'étude (35 vs 36), conséquence possible des maladies sous-jacentes graves dont souffraient les patients inclus dans cette étude.
En dépit de l'analyse approfondie des décès observés dans cette étude jusqu'au suivi de 7 jours après la fin du traitement, il a été impossible de déterminer la cause de la différence entre les taux de mortalité dans les deux bras de l'étude. Les facteurs de risque identifiables (sans lien de causalité) pour la différence entre les taux de mortalité des deux bras de l'étude étaient en particulier comme suit (une valeur supérieure à 1 pour la limite inférieure de l'intervalle de confiance indique un risque de mortalité supérieur pour les patients traités par le linézolide):
- Patients présentant des infections à Gram négatif au début du traitement, y compris des infections mixtes à Gram positif/Gram négatif (rapport de cotes 2.35; intervalle de confiance à 95%, 0.69-8.01) ou chez lesquels le germe n’a pas été identifié au début du traitement (rapport de cotes 3.59; intervalle de confiance à 95%, 1.22-10.59).
- Séjour des patients aux soins intensifs juste avant leur inclusion dans l’étude (rapport de cotes 2.95; intervalle de confiance à 95%, 1.49-5.84).
- Maladies très graves sur la base de scores MPM II >24 (rapport de cotes 1.82; intervalle de confiance à 95%, 0.98-3.36).
D'autres facteurs de risque, qui ont toutefois augmenté dans les mêmes proportions le risque de mortalité dans les deux bras de l'étude, ont également été identifiés, comme par exemple un traitement concomitant avec des stéroïdes.
Chez les patients présentant des infections à Gram positif uniquement, les taux de mortalité étaient comparables dans les deux groupes de traitement (rapport de cotes 1.54; intervalle de confiance à 95%, 0.75–3.18).
Autres observations dans cette étude:
- Dans le groupe linézolide, de nouvelles infections dues à des germes Gram négatif sont survenues chez un plus grand nombre de patients pendant le traitement.
- Chez les patients présentant des bactériémies à Gram négatif, un taux de mortalité accru a également été observé dans le sous-groupe de patients recevant un traitement d'appoint approprié, ciblant les germes à Gram négatif, par rapport au bras comparatif (3/15 vs 0/10).
Compte tenu de ces observations, le linézolide doit être utilisé en cas d'infections compliquées de la peau et des tissus mous chez des patients souffrant d'une co-infection présumée ou attestée à germes Gram négatif uniquement s'il n'existe aucun autre traitement possible (voir rubrique «Indications»). Dans de tels cas, il faut simultanément instaurer un traitement contre les germes à Gram négatif.
L'utilisation de Linezolid Pfizer n'a pas été étudiée chez les patients souffrant d'hypertension non maîtrisée, de phéochromocytome, de syndrome carcinoïde ou d'hyperthyroïdie non traitée.
La sécurité d'emploi et l'efficacité d'un traitement de plus de 28 jours par le linézolide n'ont pas été étudiées.
Des cas de myélosuppression (incluant anémie, leucopénie, pancytopénie et thrombopénie) ont été rapportés chez quelques patients traités par le linézolide. Dans les cas qui ont pu être suivis, la modification des paramètres a été généralement totalement réversible après l'arrêt du linézolide. Le risque de tels effets semble être lié à la durée du traitement. Une thrombopénie peut apparaître chez les patients ayant une insuffisance rénale sévère avec ou sans dialyse. Pendant un traitement par le linézolide, des contrôles hebdomadaires de la formule sanguine sont nécessaires. Une surveillance étroite doit être assurée chez les patients souffrant d'une insuffisance rénale sévère, chez les patients dont le traitement dure plus de deux semaines, chez les patients présentant une myélosuppression préalable, chez les patients recevant un traitement associé susceptible de provoquer une myélosuppression, ou encore chez les patients souffrant d'une infection chronique qui ont reçu ou qui reçoivent simultanément des antibiotiques. Si une myélosuppression apparaît ou s'aggrave, une interruption du traitement par le linézolide doit être prise en considération. Chez les patients avec insuffisance rénale sévère, il est recommandé d'utiliser le linézolide avec précaution et uniquement lorsque les bénéfices attendus sont supérieurs aux risques potentiels (voir «Posologie/Mode d'emploi» et «Pharmacocinétique»).
En cas d'insuffisance hépatique sévère, il est recommandé d'utiliser le linézolide uniquement lorsque les bénéfices attendus sont supérieurs aux risques potentiels (voir «Posologie/Mode d'emploi» et «Pharmacocinétique»).
Des cas de neuropathies périphériques et optiques, évoluant parfois vers une perte de la vision, ont été rapportés chez les patients traités par Linezolid Pfizer. Il s'agissait essentiellement de patients traités au-delà de la durée maximale de traitement recommandée de 28 jours.
Tous les patients doivent être informés qu'ils doivent signaler des symptômes de déficience visuelle, tels qu'une modification de l'acuité visuelle, une modification de la vision des couleurs, une vision trouble ou une anomalie du champ visuel. Dans ces cas, il est recommandé de procéder immédiatement à un contrôle, si nécessaire avec un transfert à un ophtalmologue. La fonction visuelle doit être contrôlée régulièrement chez les patients qui prennent Linezolid Pfizer pendant une durée de traitement supérieure à celle recommandée de 28 jours. La poursuite du traitement par Linezolid Pfizer doit être évaluée par rapport au risque potentiel lors de l'apparition d'une neuropathie périphérique ou optique.
Des rares cas de convulsions ont été rapportés chez les patients traités par le linézolide. Dans la plupart des cas, des convulsions étaient apparues antérieurement ou des facteurs de risque étaient présents. Les patients doivent être invités à rapporter des antécédents éventuels de crises et de convulsions.
Interactions
Le linézolide est un inhibiteur faible, réversible et non sélectif de la monoamine-oxydase (IMAO). En conséquence, la possibilité d'une interaction avec des agents adrénergiques (par ex. sympathomimétiques agissant directement ou indirectement, y compris bronchodilatateurs adrénergiques, pseudoéphédrine ou phénylpropanolamine, vasopresseurs comme adrénaline et noradrénaline, substances dopaminergiques comme dopamine et dobutamine) ou sérotoninergiques (par ex. inhibiteurs de la recapture de la sérotonine (= ISRS), antidépresseurs tricycliques, triptans, buspirone, bupropion), ainsi que certains opioïdes (par ex. tramadol, péthidine ou dextrométhorphane) doit être prise en considération.
Adrénergiques: Une accentuation réversible de l'élévation de la pression artérielle induite par des sympathomimétiques à effet indirect, par des vasopresseurs ou des substances dopaminergiques peut apparaître chez les patients recevant Linezolid Pfizer. Des principes actifs fréquemment utilisés comme la phénylpropanolamine et la pseudoéphédrine ont été étudiés spécifiquement. Les doses initiales des agents adrénergiques comme la dopamine et l'adrénaline doivent être réduites et être augmentées par paliers jusqu'à la réponse souhaitée.
Sérotoninergiques: Dans des études de phase 1, 2 et 3, l'apparition d'un syndrome sérotoninergique n'a pas été associée à l'administration concomitante de linézolide et d'agents sérotoninergiques. Toutefois, des rapports spontanés de cas de syndrome sérotoninergique existent qui ont été liés à une administration concomitante de linézolide et d'agents sérotoninergiques, y compris des antidépresseurs comme les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS). Les patients recevant Linezolid Pfizer en association avec des agents sérotoninergiques doivent être soigneusement observés pour détecter l'apparition de symptômes d'un syndrome sérotoninergique (confusion mentale, hyperpyrexie, hyperréflexie, troubles de la coordination). En cas d'apparition de tels signes, l'arrêt d'un ou des deux médicaments (Linezolid Pfizer ou les agents sérotoninergiques administrés en association) doit être pris en considération, voir «Mises en garde et précautions».
Aucun effet sur la pression artérielle n'a été observé chez les volontaires recevant du linézolide avec moins de 100 mg de tyramine. Cela signifie que seule une consommation excessive d'aliments et de boissons contenant de la tyramine (par exemple fromages corsés, extraits de levure, boissons alcooliques non distillées, produits fermentés à base de soja comme la sauce au soja) doit être évitée.
Le potentiel d'interactions médicamenteuses provoquées par l'inhibition de la MAO a fait l'objet d'études réalisées chez des volontaires sains. Un renforcement modéré et rapidement réversible de l'effet des substances adrénergiques pseudoéphédrine ou phénylpropanolamine sur la pression artérielle a été observé lors de l'administration de linézolide à des personnes normotensives. Aucune interaction n'a été observée entre le linézolide et le bronchodilatateur adrénergique salbutamol. De même, aucun signe de syndrome sérotoninergique n'a été observé chez les volontaires sains ayant reçu en plus du linézolide les substances sérotoninergiques dextrométhorphane, péthidine ou paroxétine.
Aucune métabolisation du linézolide par le système enzymatique du cytochrome P450 (CYP) n'a été mise en évidence et les isoformes CYP humains pertinents en clinique (1A2, 2C9, 2C19, 2D6, 2E1 et 3A4) ne sont pas induits ou inhibés par le linézolide. En conséquence, aucune interaction induite par le cytochrome CYP 450 n'est attendue avec le linézolide. Les substrats du CYP2C9 comme la warfarine et la phénytoïne peuvent être administrés sans adaptations posologiques en association au linézolide.
Aucune interaction n'a été observée, ni avec l'aztréonam, ni avec la gentamycine dans les études pharmacocinétiques. L'effet de la rifampicine sur la pharmacocinétique du linézolide a été évalué au cours d'une étude menée chez 16 adultes sains de sexe masculin qui ont reçu 600 mg de linézolide deux fois par jour pendant 2.5 jours, seul ou en association avec 600 mg de rifampicine une fois par jour pendant 8 jours. En moyenne, la rifampicine a respectivement diminué la Cmax et l'AUC du linézolide de 21% (IC à 90%: 15, 27) et de 32% (IC à 90%: 27, 37). Le mécanisme de cette interaction et sa portée clinique ne sont pas connus (voir «Mises en garde et précautions»).
Une étude pharmacocinétique a montré que l'administration concomitante d'antacides contenant de l'hydroxyde d'aluminium et de l'hydroxyde de magnésium n'a aucun effet sur la pharmacocinétique du linézolide administré par voie orale.
Grossesse/Allaitement
On ne dispose pas d'études contrôlées sur le linézolide chez les femmes enceintes. Les études de reproduction menées chez le rat et la souris n'ont mis en évidence aucun effet tératogène du linézolide. Chez la souris, une faible toxicité foetale a été observée uniquement à des doses toxiques pour la mère. Chez le rat, la toxicité foetale s'est manifestée sous la forme d'une réduction du poids foetal et de l'ossification du sternum (ce qui est souvent observé avec un poids foetal réduit). Chez le rat, un nombre réduit de survivants et un ralentissement de la croissance ont été observés. En cas d'accouplement de ces survivants, une augmentation réversible dose-dépendante des avortements précoces (avant la nidation) a été mise en évidence.
Chez le rat, le linézolide passe dans le lait maternel. On ignore par contre si le linézolide passe également dans le lait maternel chez l'être humain.
En conséquence, Linezolid Pfizer ne doit être administré durant la grossesse et l'allaitement que si le bénéfice dépasse le risque potentiel pour le foetus ou le nourrisson.
Le linézolide réduit la fertilité du rat mâle.
Effet sur l’aptitude à la conduite et l’utilisation de machines
En raison d'un possible effet indésirable (voir «Effets indésirables»), la prudence est de rigueur lors de la participation au trafic routier ou de l'utilisation de machines, particulièrement en début de traitement ainsi que lors d'un traitement de longue durée (troubles de la vision).
Effets indésirables
Les informations suivantes se basent sur les données des études cliniques réalisées chez l’adulte. Plus de 2'000 patients ont reçu les doses recommandées de linézolide durant une période allant jusqu'à 28 jours. Dans ces études, la plupart des effets indésirables ont été d'intensité faible à modérée, de durée limitée et n'ont pas nécessité d'interruption du traitement. Les effets indésirables ne dépendaient pas de la dose administrée.
Les effets indésirables sont classés par organe et par groupe de fréquence selon la convention suivante: très fréquents (≥1/10); fréquents (≥1/100, <1/10); occasionnels (≥1/1’000, <1/100); rares (≥1/10'000, <1/1’000); très rares (<1/10'000); inconnus: la fréquence ne peut être estimée sur la base des données disponibles, qui sont principalement tirées des rapports de surveillance du marché.
Infections et infestations
Fréquents: moniliose ou mycose, moniliose vaginale.
Affections hématologiques et du système lymphatique
Occasionnels: anémie, éosinophilie, leucopénie, neutropénie, thrombopénie.
Rares: anémie sidéroblastique.
Inconnus: pancytopénie réversible.
Affections du système immunitaire
Inconnus: anaphylaxies, angioœdèmes.
Troubles du métabolisme et de la nutrition
Fréquents: hyperglycémie.
Inconnus: acidose lactique (voir «Mises en garde et précautions»).
Affections du système nerveux
Fréquents: céphalées, altérations du goût (goût métallique).
Occasionnels: vertiges, hypoesthésie, insomnie, paresthésie.
Inconnus: convulsions (voir «Mises en garde et précautions»), neuropathie périphérique (affectant essentiellement les patients traités par le linézolide au-delà de la durée maximale recommandée de 28 jours, voir «Mises en garde et précautions»).
Affections oculaires
Occasionnels: vision floue.
Inconnus: neuropathie optique (évoluant parfois vers une perte de la vision; il s’agissait essentiellement de patients traités par le linézolide au-delà de la durée maximale de traitement recommandée de 28 jours, voir «Mises en garde et précautions»).
Affections de l’oreille et du labyrinthe
Occasionnels: acouphènes.
Affections vasculaires
Occasionnels: hypertension, phlébite/thrombophlébite.
Rares: hypotension.
Affections gastro-intestinales
Fréquents: diarrhées, nausées, vomissements, crampes, flatulences.
Occasionnels: douleurs abdominales, constipation, sécheresse buccale, dyspepsie, gastrite, glossite, pancréatite, stomatite, coloration de la langue, tuméfaction de la langue.
Très rares: colorations superficielles des dents (dans les cas qui ont pu être suivis, la coloration a été éliminée avec des mesures d’hygiène dentaire (manuellement)).
Affections hépatobiliaires
Fréquents: anomalies des tests hépatiques.
Affections de la peau et du tissu sous-cutané
Occasionnels: dermatite, diaphorèse, prurit, rash, urticaire.
Très rares: lésions cutanées bulleuses y compris des réactions cutanées sévères telles que nécrolyse épidermique toxique et syndrome de Stevens-Johnson.
Affections du rein et des voies urinaires
Occasionnels: polyurie.
Affections des organes de reproduction et du sein
Occasionnels: troubles au niveau de la vulve et du vagin, vaginite.
Troubles généraux et anomalies au site d’administration
Occasionnels: frissons, fatigue, fièvre, douleurs au site d’injection, douleurs localisées, soif accrue.
Investigations
Fréquents: augmentation de la créatinine-phosphokinase sérique.
On a observé des cas de thrombopénie en rapport avec un traitement par Linezolid Pfizer à des doses de 600 mg toutes les 12 heures durant une période allant jusqu'à 28 jours. Dans des études comparatives contrôlées de phase III, la proportion des patients ayant un faible nombre de thrombocytes (défini comme moins de 75% de la limite inférieure du domaine normal ou de la valeur mesurée avant la médication) était de 2.4% avec Linezolid Pfizer (études isolées: 0.3-10%) et de 1.5% avec la substance de comparaison (études isolées: 0.4-0.7%). Les thrombopénies en rapport avec Linezolid Pfizer semblent dépendre de la durée du traitement (généralement supérieure à 2 semaines). Dans la période de suivi, le nombre des thrombocytes s'est toutefois normalisé chez la plupart des patients. Dans les études de phase III, aucun effet indésirable médicamenteux en rapport avec une thrombopénie n’a été observé chez les patients présentant une thrombopénie. Au cours d'un programme d’usage compassionnel, on a relevé des hémorragies chez les patients souffrant de thrombopénie, dont le rapport avec le linézolide n'est toutefois pas prouvé (voir «Mises en garde et précautions»).
Des modifications d'autres paramètres biologiques, indépendamment d'un rapport avec le médicament, n'ont pas montré de différence fondamentale entre Linezolid Pfizer et les substances de comparaison. Les modifications étaient normalement sans pertinence clinique, n'ont pas conduit à l'arrêt du traitement et se sont avérées réversibles.
Surdosage
Aucun rapport de surdosage n'est disponible jusqu'ici.
En cas de surdosage, mettre en place des mesures de soutien et maintenir la filtration glomérulaire. Environ 30% d'une dose de linézolide sont éliminés au cours d'une hémodialyse de 3 heures. Les métabolites principaux sont également éliminés par l'hémodialyse. On ne dispose d'aucune donnée concernant l'élimination par une dialyse péritonéale ou par une hémoperfusion.
Les symptômes d'intoxication observés chez le rat après des doses de 3'000 mg/kg/jour regroupaient une réduction de l'activité et une ataxie, et, chez le chien, des vomissements et des tremblements ont été observés après des doses de 2'000 mg/kg/jour.
Propriétés/Effets
Code ATC: J01XX08
Mécanisme d'action et pharmacodynamique
Microbiologie
Le linézolide est une substance synthétique pourvue d'un effet antibactérien qui appartient à une nouvelle classe d'antibiotiques dénommée oxazolidinones. Le linézolide agit in vitro contre les bactéries aérobies Gram positives et contre des micro-organismes anaérobies. Il bloque la synthèse protéique bactérienne par un mécanisme d'action d'un nouveau type. Il se lie aux ribosomes bactériens et inhibe la formation du complexe d'initiation 70S fonctionnel, et bloque par conséquent une étape essentielle du processus de translation. Il développe un effet bactériostatique contre les entérocoques et les staphylocoques et une action bactéricide contre la plupart des souches de streptocoques.
Valeurs-limite
Les valeurs-limite des CMI suivantes distinguent les souches isolées sensibles des souches résistantes (selon l'EUCAST [European Committee on Antimicrobial Susceptibility Testing]):
Sensibles: CMI ≤4 µg/ml
Résistantes: CMI >4 µg/ml
Sensibilité
La prévalence d'une résistance peut présenter des variabilités géographiques et temporelles pour certaines souches. Les données relatives à une résistance locale sont par conséquent précieuses, spécialement en cas de traitement d'infections graves. En conséquence, l'information suivante doit être considérée uniquement comme un point de départ quant à la vraisemblance de la sensibilité des micro-organismes. De plus n'y figurent que des micro-organismes entrant en ligne de compte pour les indications reconnues. La classification des germes repose sur des données in vitro concernant des micro-organismes pertinents pour les indications reconnues. Les micro-organismes pour lesquels l'efficacité clinique est établie sont marqués d'un astérisque (*):
Organismes sensibles (CMI ≤4 µg/ml)Aérobies Gram positif: Corynebacterium jeikeium Enterococcus faecalis (y compris souches résistantes aux glycoprotéines)* Enterococcus faecium (y compris souches résistantes aux glycoprotéines)* Enterococcus casseliflavus Enterococcus gallinarum Listeria monocytogenes Staphylococcus aureus (y compris souches résistantes à la méticilline)* Staphylococcus aureus (souches de sensibilité intermédiaire aux glycoprotéines) Staphylococcus epidermidis (y compris souches résistantes à la méticilline)* Staphylococcus haemolyticus Staphylococcus lugdunensis Streptococcus agalactiae* Streptococcus intermedius Streptococcus pneumoniae (souches sensibles à la pénicilline uniquement)* Streptococcus pyogenes* Streptocoques du groupe viridans Streptocoques du groupe C Streptocoques du groupe G Anaérobies Gram positif: Clostridium perfringens Peptostreptococcus anaerobius Peptostreptococcus species Autres Chlamydia pneumoniae |
Organismes résistants (CMI >4 µg/ml)Legionella species Moraxella catarrhalis Mycoplasma species Haemophilus influenzae Neisseria species Enterobacteriaceae Pseudomonas species |
Résistance
Le mécanisme d'action du linézolide se distingue de celui des autres classes d'antibiotiques (par exemple aminosides, bêta-lactames, antagonistes de l'acide folique, glycoprotéines, lincosamines, quinolones, rifamycine, streptogramine, tétracyclines et chloramphénicol). En conséquence, une résistance croisée entre le linézolide et ces classes d'antibiotiques est improbable. Le linézolide est actif contre des germes pathogènes sensibles ou résistants à ces antibiotiques.
Au cours des études cliniques, une résistance au linézolide s'est développée chez 6 patients infectés par E. faecium (4 patients recevaient 200 mg toutes les 12 heures, soit moins que la dose recommandée, et 2 patients recevaient 600 mg toutes les 12 heures). Dans un programme de «compassionate use», des résistances se sont développées chez 8 patients infectés par E. faecium et chez un patient infecté par E. faecalis. Tous les patients étaient encore porteurs de matériel médical ou présentaient des abcès non traités. In vitro, une résistance au linézolide est apparue avec une fréquence de 1× 10-9 à 1× 10-11. Des études in vitro ont montré que des mutations ponctuelles au niveau de l'ARN ribosomal 23 S sont associées à une résistance au linézolide. Aucune résistance n'a été observée au cours des études cliniques où les patients étaient infectés par des staphylocoques ou des streptocoques, y compris S. pneumoniae.
Etudes cliniques
Infections par des entérocoques résistants à la vancomycine
Une étude multicentrique randomisée en double aveugle a inclus 145 patients adultes souffrant d'une infection documentée ou présumée à entérocoques résistants à la vancomycine et a comparé l'administration de Linezolid Pfizer hautement dosé (600 mg toutes les 12 heures par i.v. ou oralement) à celle de Linezolid Pfizer faiblement dosé (200 mg toutes les 12 heures par i.v. ou oralement) durant 7 à 28 jours. Un traitement concomitant par l'aztréonam ou les aminosides était autorisé.
Taux de guérison chez les patients ITT atteints d'une infection documentée par des entérocoques résistants à la vancomycine (ITT: intent-to-treat)
Source d'infection | guérison | |
|---|---|---|
Linezolid Pfizer 600 mg toutes les 12 heures | Linezolid Pfizer 200 mg toutes les 12 heures | |
Toutes les sources d'infection | 39/58 (67) | 24/46 (52) |
Toutes les sources d'infection avec bactériémie associée | 10/17 (59) | 4/14 (29) |
Bactériémie d'origine inconnue | 5/10 (50) | 2/7 (29) |
Peau et parties molles | 9/13 (69) | 5/5 (100) |
Voies urinaires | 12/19 (63) | 12/20 (60) |
Pneumonie | 2/3 (67) | 0/1 (0) |
Autres* | 11/13 (85) | 5/13 (39) |
* Y compris sources d'infection comme abcès hépatique, septicémie d'origine biliaire, vésicule biliaire nécrotique, abcès péricolique, pancréatite et infections dues à des cathéters.
Pneumonie nosocomiale
Des patients adultes atteints d'une pneumonie nosocomiale documentée cliniquement et radiologiquement ont été inclus dans une étude multicentrique randomisée en double aveugle. Les patients ont été traités durant 7 à 21 jours. Un groupe a reçu 600 mg de Linezolid Pfizer i.v. toutes les 12 heures et l'autre groupe 1 g de vancomycine i.v. toutes les 12 heures. Les deux groupes ont reçu un traitement associé à base d'aztréonam (1 à 2 g i.v. toutes les 8 heures) qui pouvait être poursuivi en cas d'indication clinique. 396 patients ont été inclus dans l'étude, dont 225 au total ont pu être évalués. Le taux de guérison chez les patients traités par le linézolide a atteint 57% et 60% chez ceux traités par la vancomycine. Pour les pneumonies qui se sont développées chez les patients intubés («ventilator-associated»), des taux de guérison de 47% ont été déterminés chez les patients traités par le linézolide et de 40% chez les patients traités par la vancomycine.
Infections compliquées de la peau et des tissus mous
819 patients adultes souffrant d'une infection compliquée de la peau et des tissus mous documentée cliniquement ont été inclus dans une étude comparative multicentrique randomisée en double aveugle et avec double placebo. A la médication i.v. de l'étude a succédé une administration orale durant 10 à 21 jours au total. Un groupe a reçu 600 mg de Linezolid Pfizer i.v. toutes les 12 heures, puis 600 mg sous forme de comprimés filmés Linezolid Pfizer toutes les 12 heures, l'autre groupe a reçu 2 g d'oxacilline i.v. toutes les 6 heures puis 500 mg de dicloxacilline oralement toutes les 6 heures. En cas d'indication clinique, il était possible d'introduire un traitement associé à base d'aztréonam. Un total de 487 patients a pu faire l'objet d'une évaluation clinique. Le taux de guérison a atteint 90% chez les patients traités par le linézolide et 85% chez les patients traités par l'oxacilline. Le taux de guérison dans l'analyse MITT (modified intent-to-treat) a atteint 86% chez les patients traités par le linézolide et 82% chez les patients traités par l'oxacilline. Le tableau suivant montre les taux de guérison répartis selon les agents pathogènes responsables pour les patients ayant pu faire l'objet d'une évaluation microbiologique.
Agents pathogènes | guérison | |
|---|---|---|
Linezolid Pfizer | Oxacilline/dicloxacilline | |
Staphylococcus aureus | 73/83 (88) | 72/84 (86) |
S. aureus résistant à la méticilline | 2/3 (67) | 0/0 (-) |
Streptococcus agalactiae | 6/6 (100) | 3/6 (50) |
Streptococcus pyogenes | 18/26 (69) | 21/28 (75) |
Dans une étude randomisée ouverte réalisée sur 460 patients hospitalisés souffrant d'une infection documentée ou supposée à Staphylococcus aureus résistant à la méticilline (MRSA), un groupe de patients a reçu 600 mg de Linezolid Pfizer i.v. toutes les 12 heures, puis 600 mg sous forme de comprimés filmés Linezolid Pfizer toutes les 12 heures. L'autre groupe a reçu 1 g de vancomycine toutes les 12 heures. Les deux groupes ont été traités durant 7 à 28 jours et pouvaient recevoir un traitement associé à base d'aztréonam ou de gentamicine en cas d'indication clinique. Le taux de guérison chez les patients atteints d'infections de la peau et des tissus mous dues à un MRSA ayant pu faire l'objet d'une évaluation microbiologique a atteint 26/33 (79%) pour les patients traités par le linézolide et 24/33 (73%) pour les patients traités par la vancomycine.
Pharmacocinétique
Linezolid Pfizer contient essentiellement du (S)-linézolide, qui est biologiquement actif et qui est métabolisé en dérivés inactifs. La solubilité aqueuse du linézolide est d'environ 3 mg/ml; elle ne dépend pas du pH lorsque ce dernier se situe entre 3 et 9.
Le tableau suivant indique les valeurs moyennes (et les déviations-standard) des paramètres pharmacocinétiques du linézolide après administration i.v. et orale unique ou répétée (à savoir administration biquotidienne jusqu'à l'état d'équilibre):
Adultes sains | ||||||
|---|---|---|---|---|---|---|
Schéma posologique du | Cmax | Cmin | Tmax | AUC* | t½ | CL |
Solution pour perfusion 600 mg‡ | ||||||
Dose unique | 12.90 | - | 0.50 | 80.20 | 4.40 | 138 |
2× par jour | 15.10 | 3.68 | 0.51 | 89.70 | 4.80 | 123 |
Comprimés filmés 600 mg | ||||||
Dose unique† | 12.70 | - | 1.28 | 91.40 | 4.26 | 127 |
2× par jour | 21.20 | 6.15 | 1.03 | 138.00 | 5.40 | 80 |
Suspension orale 600 mg | ||||||
Dose unique | 11.00 | - | 0.97 | 80.80 | 4.60 | 141 |
* AUC pour doses uniques = AUC0-∞
* AUC pour doses répétées = AUC0-τ
‡ valeurs normalisées pour une dose de 625 mg
† valeurs normalisées pour une dose de 375 mg
Cmax = concentration plasmatique maximale
Cmin = concentration plasmatique minimale
Tmax = temps nécessaire pour atteindre la Cmax
AUC = surface sous la courbe «concentration vs. temps»
t½ = demi-vie d'élimination
CL = clairance systémique
Comme le montre le tableau ci-dessus, les valeurs moyennes de la Cmin obtenues avec l'administration biquotidienne de 600 mg de linézolide correspondent environ aux valeurs de la CMI90 (4 µg/ml) les plus élevées pour les micro-organismes les moins sensibles.
Absorption
L'absorption du linézolide est rapide et complète après administration orale. La concentration plasmatique maximale est atteinte en l'espace de 2 heures après l'administration et la biodisponibilité absolue est d'environ 100%. L'absorption de la suspension orale est comparable à celle des comprimés filmés. La prise de nourriture ne modifie pas notablement l'absorption. En cas de prise simultanée d'un repas riche en graisses, la Cmax est réduite de 17%; l'exposition totale (AUC) n'est toutefois pas modifiée. Les conditions d'équilibre sont atteintes entre le deuxième et le troisième jour de traitement.
Distribution
La distribution du linézolide est immédiate dans les tissus bien vascularisés. A l'équilibre, le volume de distribution est de 40 à 50 litres chez les adultes sains et correspond à peu près au volume total d'eau corporelle. La liaison aux protéines plasmatiques s'élève à environ 31% et ne dépend pas de la concentration.
Métabolisme
In vitro, le linézolide n'est pas métabolisé par les isoenzymes du cytochrome P450 (CYP); il ne possède aucun effet inhibiteur sur l'activité des isoformes du CYP humain cliniquement pertinentes (1A2, 2C9, 2C19, 2D6, 2E1, 3A4). Chez le rat, aucune induction significative des isoenzymes importants du cytochrome P 450 n'a été observée, ni aucune induction du CYP2C9 humain. L'oxydation métabolique du cycle morpholine produit en premier lieu deux dérivés inactifs porteurs de groupes carboxyliques en noyau ouvert. Le métabolite hydroyéthylglycine (A) prédomine chez l'être humain; sa formation résulte d'un processus non enzymatique. Le métabolite aminoéthoxy-acétique (B) apparaît en moindre quantité. D'autres métabolites inactifs ont été identifiés.
Elimination
Aux conditions d'équilibre, le linézolide est excrété par voie urinaire principalement sous la forme du métabolite A (40%), sous forme inchangée (30 à 35%) et sous la forme du métabolite B (10%). Pratiquement aucune trace de linézolide inchangé n'est retrouvée dans les fèces, tandis qu'environ 6% de chaque dose s'y trouve sous la forme du métabolite A et 3% sous la forme du métabolite B. La demi-vie d'élimination oscille entre 5 et 7 heures.
La clairance non rénale représente environ 65% de la clairance totale du linézolide. La courbe des clairances n'est pas strictement linéaire lors de l'augmentation des doses. Cela semble être dû au fait que les clairances rénales et non rénales sont plus faibles lorsque les concentrations en linézolide augmentent. Cependant, cette différence de clairance est faible et n'a pas d'impact sur la demi-vie apparente d'élimination.
Cinétique pour certains groupes de patients
Enfants et adolescents (<18 ans)
Les données de tolérance et d'efficacité sont limitées chez l'enfant et l'adolescent (<18 ans) (voir «Posologie/Mode d'emploi»).
La Cmax ainsi que le volume de distribution (Vss) du linézolide sont similaires chez les patients en pédiatrie – indépendamment de l'âge. Toutefois, la clairance du linézolide est variable en fonction de l'âge. Sans tenir compte des prématurés de moins de 1 semaine, la clairance est la plus rapide dans le groupe d'âge le plus bas (>1 semaine jusqu'à 11 ans) ce qui conduit, après administration d'une dose unique, à une exposition systémique plus faible (AUC) et à une demi-vie plus courte que chez l'adulte. La clairance du linézolide diminue progressivement avec l'âge de l'enfant pour se rapprocher pendant l'adolescence des valeurs moyennes de la clairance des adultes. Au total, la variabilité interindividuelle de la clairance du linézolide et de l'exposition systémique à la substance active (AUC) était plus grande dans les groupes pédiatriques que chez l'adulte.
L'administration de 10 mg/kg PC toutes les 8 heures chez l'enfant âgé de 1 semaine à 12 ans conduit à des expositions approchant celles obtenues après administration quotidienne de 600 mg deux fois par jour à des adultes. Chez les nouveau-nés âgés d'une semaine au maximum, la clairance systémique du linézolide (par kg de poids corporel) augmente rapidement au cours de la 1ère semaine de vie. Par conséquent, chez les nouveau-nés recevant quotidiennement 10 mg/kg toutes les 8 heures, l'exposition systémique sera la plus importante le 1er jour après la naissance.
Adolescents (de 12 à 17 ans)
Les paramètres pharmacocinétiques du linézolide après administration d'une dose de 600 mg sont similaires chez les adultes et les adolescents. Par conséquent, l'administration quotidienne de 600 mg toutes les 12 heures chez les adolescents conduit à une exposition similaire à celle observée chez les adultes recevant la même dose.
Résumé des paramètres pharmacocinétiques après perfusion intraveineuse unique de 10 mg/kg ou 600 mg de linézolide chez l'enfant et l'adulte (Moyenne (%CV); [valeurs Min, Max])
Tranche d'âge | Cmax | Vss | AUC* | t½ | CL |
|---|---|---|---|---|---|
Nouveau-nés | |||||
Prématurés** <1 semaine (N=9)† | 12.7 (30%) | 0.81 (24%) | 108 (47%) | 5.6 (46%) | 2.0 (52%) |
Nés à terme*** | |||||
<1 semaine (N=10)† | 11.5 (24%) | 0.78 (20%) | 55 (47%) | 3.0 (55%) | 3.8 (55%) |
Nés à terme*** | |||||
≥1 semaine jusqu'à ≤28 jours (N=10)† | 12.9 (28%) | 0.66 (29%) | 34 (21%) | 1.5 (17%) | 5.1 (22%) |
Petits enfants | |||||
>28 jours jusqu'à <3 mois (N=12)† | 11.0 (27%) | 0.79 (26%) | 33 (26%) | 1.8 (28%) | 5.4 (32%) |
Enfants | |||||
3 mois jusqu'à 11 ans† (N=59) | 15.1 (30%) | 0.69 (28%) | 58 (54%) | 2.9 (53%) | 3.8 (53%) |
Adolescents patients entre | |||||
12 et 17 ans‡ (N=36) | 16.7 (24%) | 0.61 (15%) | 95 (44%) | 4.1 (46%) | 2.1 (53%) |
Adultes§ | |||||
(N=29) | 12.5 (21%) | 0.65 (16%) | 91 (33%) | 4.9 (35%) | 1.7 (34%) |
* AUC = AUC0-∞ après administration unique
** «prématurés» défini ici comme nés avant la 34ème semaine de la grossesse (Veuillez noter: y compris 1 prématuré du groupe d'âge de 1 semaine jusqu'à 28 jours)
*** «nés à terme» défini ici comme nés à partir de la 34ème semaine de la grossesse
† Posologie de 10 mg/kg
‡ Posologie de 600 mg ou 10 mg/kg jusqu'à un maximum de 600 mg
§ dose normalisée pour 600 mg
Cmax = concentration plasmatique maximale; Vss = volume de distribution; AUC = surface sous la courbe concentration vs temps; t½ = demi-vie d'élimination apparente; CL = clairance systémique normalisée pour le poids corporel.
Patients âgés
Les propriétés pharmacocinétiques du linézolide ne sont pas modifiées chez les patients de plus de 65 ans.
Femmes
Quelques paramètres pharmacocinétiques du linézolide diffèrent chez les femmes. Le volume de distribution de la femme est légèrement inférieur à celui de l'homme et la clairance est diminuée d'environ 20% après ajustement sur le poids corporel. Les concentrations plasmatiques sont plus élevées chez la femme, ce qui s'explique par la différence de poids corporel. Cependant, étant donné que la demi-vie moyenne du linézolide n'est pas significativement différente entre les deux sexes, les concentrations plasmatiques observées chez la femme ne devraient pas être supérieures à celles connues pour être bien tolérées. Un ajustement de la dose n'est pas nécessaire.
Patients avec insuffisance rénale
Après administration de doses uniques de 600 mg, l'exposition aux deux principaux métabolites du linézolide était 7 à 8 fois supérieure chez les patients ayant une insuffisance rénale sévère (clairance de la créatinine <30 ml/min). Cependant, il n'y avait pas d'augmentation de l'aire sous la courbe du linézolide. Bien qu'une certaine partie des principaux métabolites du linézolide soit éliminée par hémodialyse, leur concentration plasmatique, après administration de doses uniques de 600 mg, restait considérablement plus élevée après dialyse que chez les patients ayant une fonction rénale normale ou présentant une insuffisance rénale légère à modérée.
Chez 24 patients présentant une insuffisance rénale sévère, dont 21 hémodialysés chroniques, les pics de concentration plasmatique des deux principaux métabolites après plusieurs jours de traitement étaient environ 10 fois supérieurs à ceux observés chez les patients dont la fonction rénale était normale. La Cmax du linézolide n'était pas modifiée.
La signification clinique de ces observations est actuellement incertaine, car les données disponibles sont limitées (voir «Posologie/Mode d'emploi» et «Mises en garde et précautions»).
Chez les patients hémodialysés, le linézolide doit être administré après la dialyse, car près de 30% de la dose administrée sont excrétés durant une dialyse de 3 heures. Il n'existe aucune donnée chez les patients qui subissent des dialyses péritonéales.
Patients avec insuffisance hépatique
Des données limitées indiquent que la pharmacocinétique du linézolide et de ses métabolites, PNU-142300 et PNU-142586, n'est pas modifiée chez les patients présentant une insuffisance hépatique légère à modérée (Child-Pugh classe A ou B). En conséquence, une adaptation posologique n'est pas nécessaire chez ces patients. Chez les patients atteints d'une insuffisance hépatique grave (Child-Pugh classe C), les propriétés pharmacocinétiques du linézolide n'ont pas été évaluées. Comme le linézolide est métabolisé par des processus non enzymatiques, il est peu probable que la dégradation du linézolide soit influencée par une altération de la fonction hépatique (voir «Posologie/Mode d'emploi» et «Mises en garde et précautions»).
Données précliniques
Le linézolide diminue la fertilité et les paramètres de la fonction de reproduction chez le rat mâle à des expositions approximativement équivalentes à celles attendues chez l'homme. Chez les animaux ayant atteint leur maturité sexuelle, ces effets étaient réversibles.
Cependant, ces effets n'étaient pas réversibles chez les animaux jeunes traités par le linézolide durant presque toute la période de leur maturation sexuelle. Chez le rat adulte mâle, une morphologie anormale du sperme a été observée au niveau des testicules ainsi qu'une hypertrophie et une hyperplasie des cellules épithéliales dans les épididymes. Le linézolide semble affecter la maturation des spermatozoïdes chez le rat. Une supplémentation en testostérone n'a eu aucun impact sur les effets indésirables sur la fertilité. Aucune hypertrophie de l'épididyme n'a été observée chez le chien traité pendant 1 mois, bien qu'une modification du poids de la prostate, des testicules et des épididymes était apparente.
Lors d'études de toxicité sur la reproduction menées chez la souris et le rat, aucun signe d'effet tératogène n'a été mis en évidence à des expositions pouvant atteindre 4 fois celles attendues chez l'être humain.
Cependant, les mêmes concentrations de linézolide ont provoqué une toxicité maternelle chez la souris entraînant une augmentation de l'embryolétalité, avec perte de la portée complète, une diminution du poids corporel foetal et une exacerbation de la prédisposition génétique naturelle aux variations sternales dans la souche de souris sélectionnée. Chez le rat, une faible toxicité maternelle a été constatée sous forme de diminution de la prise de poids à des concentrations inférieures aux concentrations attendues chez l'être humain.
Une toxicité foetale modérée, se manifestant par une diminution du poids corporel foetal, une diminution de l'ossification du sternum, une réduction de la survie des jeunes rats et des retards modérés de maturation, a été constatée. Après accouplement, ces mêmes jeunes rats ont présenté une augmentation réversible des pertes avant implantation proportionnelle à la dose administrée avec une diminution consécutive de la fertilité.
Le linézolide et ses métabolites sont éliminés dans le lait des rates allaitantes et atteignent des concentrations supérieures à celles mesurées dans le plasma maternel.
Le linézolide a entraîné une myélosuppression réversible chez le rat et chez le chien.
Les données précliniques basées sur des études de toxicité après administration répétée et de génotoxicité n'ont révélé aucun risque particulier pour l'être humain autres que ceux déjà signalés dans les autres paragraphes de cette information professionnelle. Le traitement étant de courte durée et aucune génotoxicité n'ayant été constatée dans les tests menés, aucune étude de carcinogenèse ou d'oncogenèse n'a été conduite.
Remarques particulières
Incompatibilités
Solution pour perfusion:
Aucune adjonction ne doit être faite à la solution pour perfusion. Si le linézolide doit être administré en même temps que d'autres médicaments, chaque médicament doit être administré séparément selon ses propres recommandations d'utilisation.
Au cas où la même voie est utilisée pour la perfusion séquentielle de différents médicaments, elle doit être rincée avec une solution pour perfusion compatible avant et après l'administration de Linezolid Pfizer.
La solution pour perfusion Linezolid Pfizer présente des incompatibilités physiques avec les substances suivantes: amphotéricine B, chlorhydrate de chlorpromazine, diazépam, isothionate de pentamidine, lactobionate d'érythromycine, phénytoïne sodique et triméthoprime-sulfaméthoxazole. De plus, Linezolid Pfizer présente une incompatibilité chimique avec la ceftriaxone sodique.
Voir «Remarques concernant la manipulation» pour la solution pour perfusion.
Influence sur les méthodes diagnostiques
Linezolid Pfizer n'a pas d'effet clinique substantiel sur les paramètres biologiques. Les modifications observées (indépendantes de la causalité) reflétaient généralement l'infection, n'étaient pas cliniquement pertinentes, ne conduisaient pas à l'arrêt du traitement et étaient réversibles.
Stabilité
Après reconstitution de la suspension, Linezolid Pfizer granulé peut être conservé durant 3 semaines à température ambiante (15-25 °C).
Remarques concernant le stockage
Conserver à température ambiante (15-25 °C) et hors de la portée des enfants.
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Les poches de solution pour perfusion doivent être conservées jusqu'à leur utilisation dans la feuille de protection et dans leur carton.
Remarques concernant la manipulation
Solution pour perfusion
Retirer la feuille de protection uniquement juste avant l'utilisation et vérifier l'étanchéité de la poche. Les poches non étanches ne doivent pas être utilisées, car leur stérilité n'est plus garantie. La solution pour perfusion doit être utilisée immédiatement après avoir été entamée. Les restes de solution inutilisés doivent être éliminés. Les poches partiellement utilisées ne doivent pas être réutilisées.
La solution pour perfusion Linezolid Pfizer ne doit pas être mise en contact avec d'autres médicaments, sauf si leur compatibilité est établie. Au cas où la même voie i.v. est utilisée pour la perfusion séquentielle de différents médicaments, elle doit être rincée avec une solution compatible avant l'administration de Linezolid Pfizer. La solution pour perfusion Linezolid Pfizer est compatible avec les solutions pour perfusion suivantes: solution de glucose à 5%, NaCl à 0.9%, Ringer-lactate.
Incompatibilités: voir «Remarques particulières».
Granulés pour la préparation d'une suspension buvable
Agiter légèrement les granulés. Préparer 123 ml d'eau du robinet. Ajouter tout d'abord de l'eau jusqu'à la moitié du flacon et agiter vigoureusement. Ajouter ensuite le reste de l'eau et agiter à nouveau vigoureusement, jusqu'à la formation d'une suspension homogène. On obtient ainsi 150 ml de suspension buvable Linezolid Pfizer prête à l'emploi. 1 ml contient 20 mg de linézolide. Une mesurette (à 2.5 ou 5 ml) est jointe à l'emballage.
Retourner 3 à 5 fois la bouteille sans l'agiter avant l'emploi.
Numéro d’autorisation
66253 (comprimés filmés), 66250 (granulé pour la préparation d’une suspension buvable), 66252 (solution pour perfusion) (Swissmedic).
Titulaire de l’autorisation
Pfizer AG, Zürich
Mise à jour de l’information
Mars 2018.
LLD V006
Відгуки (0)
Ви переглядали

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.


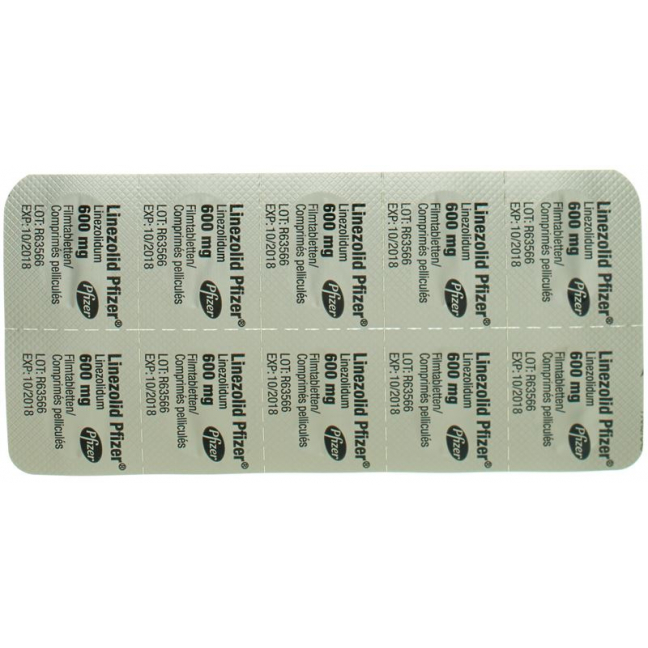


 Deutsch
Deutsch French
French Italian
Italian