Tremfya Inj Lös 100 мг/мл попередньо наповнений шприц 1 мл
Tremfya Inj Lös 100 mg/ml Fertigspritze 1 ml
-
427486.71 RUB
Дата доставки:
25.12.2025 - 08.01.2026
При оплате криптовалютой:
Ваша прибыль 42748.67 RUB / 504.58 USDT
- Наявність: В наявності
- Виробник: JANSSEN-CILAG AG
- Модель: 7505625
- ATC-код L04AC16
- EAN 7680665830018
Склад:
Опис
Was ist TREMFYA und wann wird es angewendet?
TREMFYA enthält den Wirkstoff Guselkumab; dies ist eine Art von Eiweiss, das als monoklonaler Antikörper bezeichnet wird.
Dieses Arzneimittel wirkt, indem es die Aktivität eines Eiweisses namens IL-23 blockiert, das bei Patienten mit Psoriasis und Psoriasis-Arthritis in erhöhter Menge vorkommt.
Plaque-Psoriasis
TREMFYA wird angewendet zur Behandlung von Erwachsenen mit mittelschwerer bis schwerer «Plaque-Psoriasis», einer Entzündungskrankheit, die Haut und Nägel betrifft.
TREMFYA kann den Zustand der Haut und das Aussehen der Nägel verbessern und die Symptome wie Schuppung, Hautablösung, Abblättern, Jucken, Schmerzen und Brennen vermindern.
Psoriasis-Arthritis
TREMFYA wird angewendet zur Behandlung von Erwachsenen mit «Psoriasis-Arthritis», einer entzündlichen Erkrankung der Gelenke, die häufig mit Psoriasis einhergeht, wenn diese auf eine andere Therapie mit einem krankheitsmodifizierenden Antirheumatikum (DMARD) unzureichend angesprochen oder dieses nicht vertragen haben. Wenn bei Ihnen Psoriasis-Arthritis vorliegt, erhalten Sie TREMFYA alleine oder zusammen mit Methotrexat, einem krankheitsmodifizierenden Antirheumatikum (DMARD).
Auf Verschreibung des Arztes oder der Ärztin.
Was sollte dazu beachtet werden?
Befolgen Sie die Anweisungen Ihres Arztes bzw. Ihrer Ärztin genau.
Wann darf TREMFYA nicht angewendet werden?
TREMFYA sollte nicht angewendet werden:
Wenn Sie eine klinisch bedeutsame aktive Infektion haben (z.B. eine aktive Tuberkulose).
Wenn Sie allergisch sind gegen Guselkumab oder gegen einen der Hilfsstoffe dieses Arzneimittels.
Wenn Sie glauben, dass Sie allergisch sein könnten, fragen Sie vor der Anwendung Ihren Arzt bzw. Ihre Ärztin um Rat.
Wann ist bei der Anwendung von TREMFYA Vorsicht geboten?
Sprechen Sie mit Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin oder mit dem Pflegefachpersonal, bevor Sie TREMFYA anwenden:
- wenn Sie wegen einer Infektion in Behandlung sind;
- wenn Sie eine Infektion haben, die nicht verschwindet oder immer wieder zurückkommt;
- wenn Sie Tuberkulose (TB) haben oder in engem Kontakt mit einer an TB erkrankten Person waren;
- wenn Sie glauben, eine Infektion zu haben, oder Symptome einer Infektion haben (siehe unter «Achten Sie auf Infektionen und allergische Reaktionen»);
- wenn Sie kürzlich geimpft wurden oder wenn bei Ihnen eine Impfung fällig ist während der Behandlung mit TREMFYA, da gewisse Impfstoffe (sogenannte Lebendvakzinen) während der Behandlung mit TREMFYA nicht verabreicht werden dürfen;
- wenn Sie eine Phototherapie erhalten oder zuvor erhalten haben; in dem Falle wird Ihr Arzt bzw. Ihre Ärztin vor und während der Behandlung mit TREMFYA auf das Vorliegen von Hauttumoren untersuchen.
Wenn Sie nicht sicher sind, ob einer der oben genannten Punkte auf Sie zutrifft, sprechen Sie mit Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin oder mit dem Pflegefachpersonal, bevor Sie TREMFYA anwenden.
Achten Sie auf Infektionen und allergische Reaktionen
Durch TREMFYA können Ihre Abwehrkräfte gegen Infektionen verringert und deshalb Ihre Infektionsanfälligkeit und das Risiko für allergische Reaktionen erhöht sein. Die allergischen Reaktionen können mehrere Tage bis Wochen nach der Behandlung mit TREMFYA auftreten. Informieren Sie Ihren Arzt bzw. Ihre Ärztin oder suchen Sie sofort einen Arzt bzw. eine Ärztin auf, wenn Sie Anzeichen einer Infektion oder einer allergischen Reaktion bemerken, während Sie TREMFYA anwenden. Im Folgenden sind derartige Anzeichen aufgeführt:
Infektionen
Fieber oder grippeähnliche Symptome, Muskelschmerzen, Husten, Kurzatmigkeit, Brennen beim Wasserlassen oder häufigeres Wasserlassen als gewöhnlich, blutiger Auswurf (Schleim), Gewichtsverlust, Durchfall oder Magenschmerzen, warme, rote oder schmerzende Haut oder Wunden am Körper, bei denen es sich nicht um Ihre Psoriasis handelt.
Allergische Reaktionen
Atem- oder Schluckbeschwerden, Schwellung von Gesicht, Lippen, Mund, Zunge oder Rachen, starkes Hautjucken mit rotem Ausschlag oder erhabenen Beulen.
Fahrtüchtigkeit und das Bedienen von Maschinen
Es ist nicht bekannt, ob TREMFYA einen Einfluss auf die Fahrtüchtigkeit und das Bedienen von Maschinen hat.
Informieren Sie Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben,
- andere Arzneimittel (auch selbst gekaufte!) einnehmen bzw. anwenden, kürzlich eingenommen bzw. angewendet haben oder einnehmen bzw. anwenden möchten.
Darf TREMFYA während einer Schwangerschaft oder in der Stillzeit angewendet werden?
Es ist besser, während der Schwangerschaft auf die Anwendung von TREMFYA zu verzichten. Die Auswirkungen dieses Arzneimittels bei schwangeren Frauen sind nicht bekannt. Wenn Sie eine Frau im gebärfähigen Alter sind, wird Ihnen angeraten, eine Schwangerschaft zu vermeiden, und Sie müssen während der Anwendung von TREMFYA und für mindestens 12 Wochen nach der letzten TREMFYA-Dosis eine wirksame Empfängnisverhütung anwenden.
Wenn Sie schwanger sind oder vermuten schwanger zu sein oder planen, ein Kind zu bekommen, sprechen Sie mit Ihrem Arzt bzw. Ihrer Ärztin.
Sprechen Sie mit Ihrem Arzt bzw. Ihrer Ärztin, wenn Sie stillen oder stillen möchten. Sie sollten zusammen mit Ihrem Arzt bzw. Ihrer Ärztin entscheiden, ob Sie stillen und auf die Behandlung mit TREMFYA verzichten werden oder ob Sie TREMFYA anwenden und auf das Stillen verzichten werden. Beides zusammen ist nicht ratsam.
Wie verwenden Sie TREMFYA?
Verwenden Sie dieses Arzneimittel immer genau so, wie Ihr Arzt bzw. Ihre Ärztin oder das Pflegefachpersonal es Ihnen verordnet hat. Fragen Sie bei Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin oder beim Pflegefachpersonal nach, wenn Sie sich nicht sicher sind.
TREMFYA wird als Injektion unter die Haut (subkutane Injektion) gegeben. Jede Fertigspritze und jeder Fertigpen ist für den einmaligen Gebrauch bestimmt. Die vollständige Menge der Fertigspritze oder des Fertigpens soll injiziert werden. Zu Beginn kann die TREMFYA-Injektion durch Ihren Arzt, bzw. Ihre Ärztin oder das Pflegefachpersonal gegeben werden. Sie können jedoch gemeinsam mit Ihrem Arzt bzw. Ihrer Ärztin beschliessen, dass Sie sich TREMFYA selber spritzen (injizieren) können. In diesem Falle werden Sie geschult, wie Sie TREMFYA selber injizieren können. Sprechen Sie mit Ihrem Arzt bzw. Ihrer Ärztin, wenn Sie Fragen zur Selbstinjektion haben. Es ist wichtig, dass Sie nicht versuchen, sich selber eine Injektion zu geben, bevor Sie durch Ihren Arzt bzw. Ihre Ärztin oder das Pflegefachpersonal geschult worden sind.
Für ausführliche Informationen zum Gebrauch von TREMFYA bitte die Broschüre «Anleitung zur Anwendung», die separat in der Packung beiliegt, vor dem Gebrauch sorgfältig durchlesen.
Wieviel TREMFYA wird angewendet?
Plaque-Psoriasis
- Die Dosis beträgt 100 mg (der Inhalt 1 Fertigspritze oder 1 Fertigpen) als Injektion unter die Haut (subkutane Injektion). Diese kann durch Ihren Arzt bzw. Ihre Ärztin oder durch das Pflegefachpersonal verabreicht werden.
- Nach der ersten Dosis werden Sie 4 Wochen später die nächste Dosis erhalten, und dann alle 8 Wochen.
Psoriasis-Arthritis
- Die Dosis beträgt 100 mg (der Inhalt 1 Fertigspritze oder 1 Fertigpen) als Injektion unter die Haut (subkutane Injektion). Diese kann durch Ihren Arzt bzw. Ihre Ärztin oder durch das Pflegefachpersonal verabreicht werden.
- Nach der ersten Dosis werden Sie 4 Wochen später die nächste Dosis erhalten, und dann alle 8 Wochen.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Wie lange soll TREMFYA angewendet werden?
Ihr Arzt bzw. Ihre Ärztin wird Ihren Krankheitsverlauf regelmässig kontrollieren, um zu überprüfen, ob die Behandlung die gewünschte Wirkung hat. Er bzw. sie wird entscheiden, für wie lange Sie TREMFYA brauchen.
Wenn Sie mehr TREMFYA injiziert haben als Sie sollten
Wenn Sie mehr TREMFYA injiziert haben als Sie sollten oder wenn die Dosis früher als vorgeschrieben gegeben wurde, informieren Sie Ihren Arzt bzw. Ihre Ärztin.
Wenn Sie die Anwendung von TREMFYA vergessen haben
Wenn Sie vergessen haben, eine Dosis von TREMFYA zu injizieren, informieren Sie Ihren Arzt bzw. Ihre Ärztin.
Wenn Sie die Anwendung von TREMFYA abbrechen
Sie sollten den Gebrauch von TREMFYA nicht abbrechen, ohne zuerst mit Ihrem Arzt bzw. Ihrer Ärztin darüber zu sprechen. Es ist nicht gefährlich, den Gebrauch von TREMFYA abzubrechen. Jedoch können Ihre Symptome wieder auftreten, wenn Sie die Behandlung abbrechen.
Kinder und Jugendliche (unter 18 Jahren)
Die Anwendung und Sicherheit von TREMFYA bei Kindern und Jugendlichen unter 18 Jahren ist bisher nicht geprüft worden.
Bei dieser Altersgruppe wird TREMFYA daher nicht angewendet.
Welche Nebenwirkungen kann TREMFYA haben?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Die folgenden Nebenwirkungen sind alle leicht oder mittelschwer. Wenn eine dieser Nebenwirkungen schwerwiegend wird, informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin oder das Pflegefachpersonal.
Einige Nebenwirkungen treten sehr häufig auf (können mehr als 1 von 10 Personen betreffen): Atemwegsinfektionen.
Einige Nebenwirkungen treten häufig auf (können bis zu 1 von 10 Personen betreffen): Kopfschmerzen, Gelenkschmerzen, Durchfall, Rötung oder Reizung an der Injektionsstelle, erhöhte Leberenzymwerte im Blut, erhöhte Bilirubinwerte im Blut (ein Abbauprodukt aus den roten Blutzellen).
Einige Nebenwirkungen treten gelegentlich auf (können bis zu 1 von 100 Personen betreffen): Allergische Reaktion, Hautausschlag, verringerte Anzahl eines bestimmten Typs von weissen Blutzellen (Neutrophile), Herpes-simplex-Infektionen, Pilzinfektionen der Haut (Dermatophytosen), Magengrippe (Gastroenteritis), Nesselausschlag (Urtikaria).
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin. Dies gilt insbesondere auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Was ist ferner zu beachten?
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Lagerungshinweis
Im Kühlschrank (2-8 °C) lagern.
Nicht einfrieren.
Die Fertigspritze oder den Fertigpen im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Ausser Reichweite von Kindern aufbewahren.
Nicht schütteln.
Weitere Hinweise
TREMFYA ist eine klare, farblose bis hellgelbe Lösung. Verwenden Sie dieses Arzneimittel nicht, wenn Sie bemerken, dass das Arzneimittel trüb oder verfärbt ist oder grosse Partikel enthält.
Vor Gebrauch die Packung aus dem Kühlschrank nehmen und die Fertigspritze oder den Fertigpen im Umkarton lassen, dann 30 Minuten warten, damit sie Raumtemperatur annehmen kann.
Dieses Arzneimittel ist nur für den einmaligen Gebrauch bestimmt. Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin oder das Pflegefachpersonal, wie Arzneimittel zu entsorgen sind, wenn Sie sie nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
Weitere Auskünfte erteilt Ihnen Ihr Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in TREMFYA enthalten?
Injektionslösung in einer Fertigspritze oder einem Fertigpen.
Wirkstoffe
Jede Fertigspritze oder jeder Fertigpen enthält 100 mg Guselkumab in 1 ml Lösung.
Hilfsstoffe
L-Histidin, L-Histidin-Monohydrochlorid-Monohydrat, Polysorbat 80, Saccharose und Wasser für Injektionszwecke.
Zulassungsnummer
66583, 67490 (Swissmedic).
Wo erhalten Sie TREMFYA? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Faltschachtel mit 1 Fertigspritze.
Faltschachtel mit 1 Fertigpen.
Zulassungsinhaberin
Janssen-Cilag AG, Zug, ZG.
Diese Packungsbeilage wurde im Dezember 2020 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Gebrauchsanweisung
TREMFYA Fertigspritze

Wichtig
Wenn Ihr Arzt oder Ihre Ärztin entscheidet, dass Sie oder eine Betreuungsperson Ihnen die TREMFYA-Injektionen zu Hause geben können, sollten Sie eine Schulung erhalten, wie TREMFYA bei Verwendung der Fertigspritze korrekt vorbereitet und injiziert wird, bevor Sie versuchen sich die Injektion selbst zu verabreichen.
Lesen Sie diese Gebrauchsanweisung VOLLSTÄNDIG durch, bevor Sie die TREMFYA-Fertigspritze anwenden und jedes Mal, wenn Sie eine neue Packung erhalten. Es können neue Informationen enthalten sein. Diese Gebrauchsanweisung ersetzt keinesfalls ein Gespräch mit Ihrem Arzt oder Ihrer Ärztin über Ihre Krankheit oder Ihre Behandlung.
Lesen Sie auch die Packungsbeilage sorgfältig, bevor Sie mit Ihrer Injektion beginnen, und besprechen Sie Ihre Fragen mit Ihrem Arzt oder Ihrer Ärztin.
Die TREMFYA-Fertigspritze ist für die Injektion unter die Haut bestimmt, nicht für die Injektion in den Muskel oder in die Vene. Nach der Injektion wird die Nadel in den Spritzenschaft zurückgezogen und bleibt dort blockiert.
Ihre Fertigspritze im Überblick


Dieses Zubehör werden Sie brauchen:
- 1 Alkoholtupfer
- 1 Wattebausch oder Gazetupfer
- 1 Pflaster
- 1 Durchstichfester Behälter (siehe Schritt 3)
1. Vorbereitung für Ihre Injektion

Packung kontrollieren
Nehmen Sie die Packung mit der Fertigspritze aus dem Kühlschrank. Lassen Sie die Fertigspritze in der Packung und legen Sie sie auf eine flache Oberfläche bei Raumtemperatur für mind. 30 Minuten vor der Anwendung.
Nicht auf andere Weise erwärmen.
Kontrollieren Sie das Verfalldatum («EXP») auf der Rückseite der Packung.
Nicht verwenden, wenn das Verfalldatum überschritten ist.
Nicht injizieren, wenn die Perforationen auf der Packung beschädigt sind. Verlangen Sie von Ihrem Arzt/Apotheker bzw. Ihrer Ärztin/Apothekerin eine neue Packung.

Injektionsstelle wählen
Wählen Sie einen der folgenden Bereiche für Ihre Injektion:
- Vorderseite der Oberschenkel (empfohlen)
- Unterbauch
Nicht den Bereich von 5 cm um den Bauchnabel verwenden.
Nicht in empfindliche, verletzte, gerötete, schuppende oder verhärtete Haut injizieren.
Nicht in Bereiche mit Narben oder Dehnungsstreifen injizieren.

Injektionsstelle reinigen
Waschen Sie Ihre Hände gründlich mit Seife und warmem Wasser.
Wischen Sie die gewählte Stelle mit einem Alkoholtupfer ab und lassen Sie sie trocknen.
Nicht die Injektionsstelle berühren, keine Luft darauf fächeln und nicht darauf blasen, nachdem Sie sie gereinigt haben.

Injektionslösung kontrollieren
Nehmen Sie die Fertigspritze aus der Packung.
Kontrollieren Sie die Lösung im Sichtfenster. Sie sollte farblos bis leicht gelb sein und kann winzige weisse oder durchsichtige Partikel enthalten. Sie können möglicherweise auch eine oder mehrere Luftblasen sehen. Dies ist normal.
Nicht injizieren, wenn die Lösung trüb oder verfärbt ist oder grosse Partikel enthält. Wenn Sie nicht sicher sind, verlangen Sie bei Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin eine neue Packung.
2. Injektion von TREMFYA mit der Fertigspritze

Nadelschutzhülle entfernen
Halten Sie die Spritze am Spritzenschaft und ziehen Sie die Nadelhülle gerade ab. Es ist normal, einen Tropfen Lösung zu sehen.
Injektion innert 5 Minuten nach Entfernen der Nadelhülle geben.
Nicht die Nadelhülle wieder aufsetzen, dies könnte die Nadel beschädigen.
Nicht die Nadel berühren bzw. Nadel nichts berühren lassen.
Nicht die Fertigspritze verwenden, wenn sie heruntergefallen ist. Verlangen Sie eine neue Packung.

Fingerposition und Nadel einführen
Platzieren Sie Daumen, Zeige- und Mittelfinger direkt unter den Fingergriffen, wie abgebildet.
Nicht Kolben oder Bereich oberhalb der Fingergriffe berühren; dies kann den Nadelschutz aktivieren. Mit der anderen Hand drücken Sie eine Hautfalte an der Injektionsstelle zusammen. Positionieren Sie die Spritze etwa im Winkel von 45° auf die Haut.
Wichtig: genügend grosse Hautfalte zusammendrücken, damit Sie unter die Haut und nicht in den Muskel injizieren.
Führen Sie die Nadel mit einer schnellen, pfeilartigen Bewegung ein.

Hautfalte loslassen und Hand neu positionieren
Benutzen Sie Ihre freie Hand, um den Spritzenschaft zu fassen.

Kolben hinunterdrücken
Platzieren Sie den Daumen der anderen Hand auf dem Kolben und drücken Sie den Kolben ganz hinunter, bis er stoppt.

Daumen langsam vom Kolben nehmen
Die Nadelschutzvorrichtung wird nun die Nadel aus der Haut ziehen, die Nadel vollständig umschliessen und so blockiert halten.
3. Nach Ihrer Injektion

Gebrauchte Fertigspritze verwerfen
Die Fertigspritze darf nicht wiederverwendet werden. Geben Sie die gebrauchte Fertigspritze sofort nach Gebrauch in einen durchstichfesten Entsorgungsbehälter.
Achten Sie darauf, dass der Behälter nach den Anweisungen Ihres Arztes, Ihrer Ärztin oder des Pflegefachpersonals entsorgt wird, wenn er voll ist.

Injektionsstelle kontrollieren
An der Injektionsstelle kann sich ein wenig Blut oder Injektionslösung befinden. Drücken Sie einen Wattebausch oder Gazetupfer auf die Injektionsstelle, bis das Bluten aufhört.
Nicht die Injektionsstelle reiben.
Bei Bedarf decken Sie die Injektionsstelle mit einem Pflaster ab.
Ihre Injektion ist jetzt beendet!
 Brauchen Sie Hilfe?
Brauchen Sie Hilfe?
Sollten Sie noch weitere Fragen haben, wenden Sie sich bitte an Ihren behandelnden Arzt/Ihre behandelnde Ärztin.
Gebrauchsanweisung TREMFYA Fertigpen

Wichtig
Wenn Ihr Arzt oder Ihre Ärztin entscheidet, dass Sie oder eine Betreuungsperson Ihnen die TREMFYA-Injektionen zu Hause geben können, sollten Sie eine Schulung erhalten, wie TREMFYA bei Verwendung des Fertigpens korrekt vorbereitet und injiziert wird, bevor Sie versuchen sich die Injektion selbst zu verabreichen.
Lesen Sie diese Gebrauchsanweisung VOLLSTÄNDIG durch, bevor Sie den TREMFYA-Fertigpen anwenden und jedes Mal, wenn Sie eine neue Packung erhalten.
Es können neue Informationen enthalten sein. Diese Gebrauchsanweisung ersetzt keinesfalls ein Gespräch mit Ihrem Arzt oder Ihrer Ärztin über Ihre Krankheit oder Ihre Behandlung.
Lesen Sie auch die Packungsbeilage sorgfältig, bevor Sie mit Ihrer Injektion beginnen, und besprechen Sie Ihre Fragen mit Ihrem Arzt oder Ihrer Ärztin.
Der TREMFYA-Fertigpen ist für die Injektion unter die Haut bestimmt, nicht für die Injektion in den Muskel oder in die Vene. Nach der Injektion wird die Nadel in den Penschaft zurückgezogen und bleibt dort blockiert.
Ihr Fertigpen im Überblick

Packung kontrollieren
Nehmen Sie die Packung mit dem Fertigpen aus dem Kühlschrank.
Lassen Sie den Fertigpen in der Packung und legen Sie sie auf eine flache Oberfläche bei Raumtemperatur für mind. 30 Minuten vor der Anwendung.
Nicht auf andere Weise erwärmen.
Kontrollieren Sie das Verfalldatum («EXP») auf der Rückseite der Packung.
Nicht verwenden, wenn das Verfalldatum überschritten ist.
Nicht injizieren, wenn die Perforationen auf der Packung beschädigt sind. Verlangen Sie von Ihrem Arzt/Apotheker bzw. Ihrer Ärztin/Apothekerin eine neue Packung.

Injektionsstelle wählen
Wählen Sie einen der folgenden Bereiche für Ihre Injektion:
- Vorderseite der Oberschenkel (empfohlen)
- Unterer Bauch
Nicht den Bereich von 5 Zentimetern um den Bauchnabel verwenden.
- Rückseite der Oberarme (wenn eine Pflegeperson die Injektion vornimmt).
Nicht in empfindliche, verletzte, gerötete, schuppende oder verhärtete Haut injizieren.
Nicht in Bereiche mit Narben oder Dehnungsstreifen injizieren.

Injektionsstelle reinigen
Waschen Sie Ihre Hände gründlich mit Seife und warmem Wasser.
Wischen Sie die gewählte Stelle mit einem Alkoholtupfer ab und lassen Sie sie trocknen.
Nicht die Injektionsstelle berühren, keine Luft darauf fächeln und nicht darauf blasen, nachdem Sie sie gereinigt haben.

Injektionslösung kontrollieren
Nehmen Sie den Fertigpen aus der Packung
Kontrollieren Sie die Lösung im Sichtfenster. Sie sollte farblos bis leicht gelb sein und kann winzige weisse oder durchsichtige Partikel enthalten. Sie können möglicherweise auch eine oder mehrere Luftblasen sehen. Dies ist normal.
Nicht injizieren, wenn die Lösung trüb oder verfärbt ist oder grosse Partikel enthält. Wenn Sie nicht sicher sind, verlangen Sie bei Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin eine neue Packung.
2. Injektion von Tremfya mit dem Fertigpen

Drehen und entfernen Sie den Verschluss
Nicht den Nadelschutz berühren, nachdem Sie den Verschluss entfernt haben.
Injektion innert 5 Minuten nach Entfernen des Verschlusses.
Nicht den Verschluss wieder aufsetzen, da dies die Nadel beschädigen kann.
Nicht den Fertigpen verwenden, wenn er fallen gelassen wurde. Verlangen Sie eine neue Packung.

Auf die Haut setzen
Platzieren Sie den Fertigpen direkt auf die Haut (in einem Winkel von ungefähr 90 Grad zur Injektionsstelle).

Drücken Sie den Griff gerade nach unten
Das Arzneimittel wird injiziert, wenn Sie drücken. Wählen Sie eine Injektionsgeschwindigkeit, die für Sie angenehm ist.
Heben Sie den Fertigpen während der Injektion nicht an. Der Nadelschutz wird einrasten und es kann nicht die gesamte Dosis injiziert werden.

Vollständige Injektion
Die Injektion ist vollständig, wenn der Griff komplett nach unten gedrückt ist und Sie ein Klicken hören, das grüne Gehäuse ist nicht mehr sichtbar.

Gerade hochheben
Ein gelber Streifen zeigt Ihnen, dass der Nadelschutz eingerastet ist.
3. Nach Ihrer Injektion

Gebrauchten Fertigpen verwerfen
Der Fertigpen darf nicht wiederverwendet werden.
Geben Sie den gebrauchten Fertigpen sofort nach Gebrauch in einen durchstichfesten Entsorgungsbehälter.
Achten Sie darauf, dass der Behälter nach den Anweisungen Ihres Arztes, Ihrer Ärztin oder des Pflegefachpersonals entsorgt wird, wenn er voll ist.

Injektionsstelle kontrollieren
An der Injektionsstelle kann sich ein wenig Blut oder Injektionslösung befinden. Drücken Sie einen Wattebausch oder Gazetupfer auf die Injektionsstelle, bis das Bluten aufhört.
Nicht die Injektionsstelle reiben.
Bei Bedarf decken Sie die Injektionsstelle mit einem Pflaster ab.
Ihre Injektion ist jetzt beendet!
 Brauchen Sie Hilfe?
Brauchen Sie Hilfe?
Sollten Sie noch weitere Fragen haben, wenden Sie sich bitte an Ihren behandelnden Arzt/Ihre behandelnde Ärztin.
Qu'est-ce que TREMFYA et quand doit-il être utilisé?
TREMFYA contient comme principe actif le guselkumab qui est un type de protéine appelé anticorps monoclonal.
Ce médicament agit en bloquant l'activité d'une protéine appelée IL-23 qui est présente en plus grande quantité chez les patients atteints de psoriasis ou d'arthrite psoriasique.
Psoriasis en plaques
TREMFYA est utilisé chez l'adulte dans le traitement du «psoriasis en plaques» modéré à sévère, une maladie inflammatoire qui touche la peau et les ongles.
TREMFYA peut améliorer l'état de la peau et l'aspect des ongles et atténuer les symptômes tels que la peau qui s'écaille ou pèle, les desquamations, les démangeaisons, les douleurs et la sensation de brûlure.
Arthrite psoriasique
TREMFYA est utilisé chez l'adulte dans le traitement de l'«arthrite psoriasique», une maladie inflammatoire des articulations souvent associée au psoriasis, en cas de réponse insuffisante à un autre traitement par un médicament antirhumatismal de fond (DMARD) ou d'intolérance à celui-ci. Si vous souffrez d'arthrite psoriasique, vous recevrez TREMFYA seul ou en association avec le méthotrexate, un antirhumatismal de fond (DMARD).
Selon prescription du médecin.
De quoi faut-il tenir compte en dehors du traitement?
Suivez exactement les instructions de votre médecin.
Quand TREMFYA ne doit-il pas être pris/utilisé?
TREMFYA ne doit pas être utilisé:
si vous avez une infection active cliniquement significative (p.ex. une tuberculose active);
si vous êtes allergique au guselkumab ou à l'un des excipients de ce médicament;
si vous pensez que vous pourriez y être allergique, demandez conseil à votre médecin avant d'utiliser ce médicament.
Quelles sont les précautions à observer lors de la prise/de l'utilisation de TREMFYA?
Veuillez vous adresser à votre médecin, votre pharmacien ou au personnel infirmier, avant d'utiliser TREMFYA si:
- vous suivez un traitement pour une infection;
- vous avez une infection qui ne disparaît pas ou réapparaît sans cesse;
- vous avez une tuberculose ou avez été en contact étroit avec une personne atteinte de tuberculose;
- vous pensez avoir une infection ou présentez des symptômes d'une infection (voir «Surveillance des infections et des réactions allergiques»);
- vous avez été vacciné(e) récemment ou vous devez vous faire vacciner pendant le traitement par TREMFYA, car certains vaccins (vaccins dits vivants) ne doivent pas être administrés pendant le traitement par TREMFYA;
- vous suivez ou avez suivi un traitement par photothérapie; dans ce cas, votre médecin vous examinera avant et pendant le traitement par TREMFYA pour rechercher la présence de tumeurs cutanées.
Si vous n'êtes pas certain(e) que l'un des points ci-dessus vous concerne, adressez-vous à votre médecin, à votre pharmacien ou au personnel infirmier avant d'utiliser TREMFYA.
Surveillance des infections et des réactions allergiques
TREMFYA peut diminuer vos défenses immunitaires contre les infections et par conséquent augmenter votre susceptibilité aux infections et le risque de développer des réactions allergiques. Les réactions allergiques peuvent survenir plusieurs jours à plusieurs semaines après le traitement par TREMFYA. Informez votre médecin ou consultez immédiatement un médecin si vous remarquez les signes d'une infection ou d'une réaction allergique pendant que vous utilisez TREMFYA. De tels signes sont mentionnés ci-dessous:
Infections
Fièvre ou symptômes pseudo-grippaux, douleurs musculaires, toux, essoufflement, brûlures en urinant ou besoin d'uriner plus fréquent que d'habitude, crachats sanguinolents (mucus), perte de poids, diarrhée ou maux d'estomac, peau chaude, rouge ou douloureuse ou lésions sur le corps autres que celles de votre psoriasis.
Réactions allergiques
Difficultés à respirer ou à avaler, gonflement du visage, des lèvres, de la bouche, de la langue ou de la gorge, fortes démangeaisons cutanées avec une éruption rouge ou des boutons en relief.
Aptitude à conduire et capacité à utiliser des machines
On ignore si TREMFYA a une influence sur l'aptitude à la conduite et la capacité à utiliser des machines.
Veuillez informer votre médecin ou votre pharmacien si
- vous souffrez d'une autre maladie,
- vous êtes allergique ou
- vous prenez ou utilisez, avez pris ou utilisé récemment ou souhaitez prendre ou utiliser d'autres médicaments (même en automédication!).
TREMFYA peut-il être pris/utilisé pendant la grossesse ou l'allaitement?
Il vaut mieux renoncer à l'utilisation de TREMFYA pendant la grossesse. Les effets de ce médicament chez la femme enceinte ne sont pas connus. Si vous êtes une femme en âge de procréer, il vous est conseillé d'éviter de tomber enceinte et vous devez utiliser une méthode contraceptive efficace pendant l'utilisation de TREMFYA et pendant au moins 12 semaines après la dernière dose de TREMFYA.
Si vous êtes enceinte, pensez être enceinte ou envisagez une grossesse, adressez-vous à votre médecin.
Si vous allaitez ou souhaitez allaiter, adressez-vous à votre médecin. Vous devez décider avec votre médecin si vous allaitez et renoncez au traitement par TREMFYA, ou si vous utilisez TREMFYA et renoncez à l'allaitement. Les deux ensemble sont déconseillés.
Comment utiliser TREMFYA?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin ou du personnel infirmier. Demandez conseil à votre médecin, à votre pharmacien ou au personnel infirmier en cas de doute.
TREMFYA est administré en injection sous la peau (injection sous-cutanée). Chaque seringue préremplie et chaque stylo prérempli est destiné à un usage unique. Il est nécessaire d'injecter tout le contenu de la seringue préremplie ou du stylo prérempli. Au début, votre médecin ou le personnel infirmier peuvent réaliser l'injection de TREMFYA. Vous pouvez cependant décider avec votre médecin de vous injecter vous-même TREMFYA. Dans ce cas, vous recevrez une formation appropriée pour apprendre à vous injecter vous-même TREMFYA. Adressez-vous à votre médecin si vous avez des questions au sujet de l'auto-injection. Il est important de ne pas essayer de vous faire vous-même l'injection avant d'y avoir été formé(e) par votre médecin ou le personnel infirmier.
Pour obtenir des informations détaillées concernant l'utilisation de TREMFYA, veuillez lire attentivement, avant l'utilisation, la brochure contenant les «Instructions d'utilisation», fournie séparément dans l'emballage.
Quelle quantité de TREMFYA est utilisée?
Psoriasis en plaques
- La dose est de 100 mg (le contenu d'une seringue préremplie ou d'un stylo prérempli) sous forme d'injection sous la peau (injection sous-cutanée). Cette injection peut être administrée par votre médecin ou par le personnel infirmier.
- Après cette première dose, vous recevrez la dose suivante 4 semaines plus tard, puis toutes les 8 semaines.
Arthrite psoriasique
- La dose est de 100 mg (le contenu d'une seringue préremplie ou d'un stylo prérempli) sous forme d'injection sous la peau (injection sous-cutanée). Cette injection peut être administrée par votre médecin ou par le personnel infirmier.
- Après cette première dose, vous recevrez la dose suivante 4 semaines plus tard, puis toutes les 8 semaines.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien, si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Pendant combien de temps faut-il utiliser TREMFYA?
Votre médecin surveillera régulièrement l'évolution de votre maladie pour vérifier si le traitement produit l'effet souhaité. Il déterminera la durée du traitement par TREMFYA dont vous avez besoin.
Si vous avez injecté plus de TREMFYA que vous n'auriez dû
Si vous avez injecté plus de TREMFYA que vous n'auriez dû ou si la dose a été administrée plus tôt que ce qui vous a été prescrit, informez-en votre médecin.
Si vous avez oublié d'utiliser TREMFYA
Si vous avez oublié d'injecter une dose de TREMFYA, informez-en votre médecin.
Si vous arrêtez d'utiliser TREMFYA
Vous ne devez pas arrêter d'utiliser TREMFYA sans en avoir parlé au préalable avec votre médecin. Il n'est pas dangereux d'arrêter d'utiliser TREMFYA. Cependant, vos symptômes peuvent réapparaître si vous arrêtez le traitement.
Enfants et adolescents (de moins de 18 ans)
L'utilisation et la sécurité de TREMFYA n'ont pas été établies à ce jour pour les enfants et les adolescents de moins de 18 ans.
TREMFYA n'est donc pas utilisé dans ce groupe d'âge.
Quels effets secondaires TREMFYA peut-il provoquer?
Comme tous les médicaments, ce médicament peut provoquer des effets secondaires, mais ils ne surviennent pas systématiquement chez tous les patients.
Les effets secondaires suivants sont tous d'intensité légère ou modérée. Si l'un de ces effets secondaires devient sévère, informez-en votre médecin, votre pharmacien ou le personnel infirmier.
Certains effets secondaires sont très fréquents (peuvent affecter plus de 1 personne sur 10): infections des voies respiratoires.
Certains effets secondaires sont fréquents (peuvent affecter jusqu'à 1 personne sur 10): maux de tête, douleurs articulaires, diarrhée, rougeur ou irritation au niveau du site d'injection, élévation des concentrations d'enzymes hépatiques dans le sang, élévation des concentrations de bilirubine dans le sang (un déchet métabolique provenant des globules rouges).
Certains effets secondaires sont occasionnels (peuvent affecter jusqu'à 1 personne sur 100): réaction allergique, éruption cutanée, réduction du nombre d'un certain type de globules blancs (neutrophiles), infections par le virus Herpes simplex, mycoses de la peau (dermatophytoses), grippe intestinale (gastroentérite), urticaire.
Si vous remarquez des effets secondaires, veuillez en informer votre médecin ou votre pharmacien. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d'emballage.
À quoi faut-il encore faire attention?
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
Conserver au réfrigérateur (2-8 °C).
Ne pas congeler.
Conserver la seringue préremplie ou le stylo prérempli dans leur carton pour protéger leur contenu de la lumière.
Conserver hors de portée des enfants.
Ne pas agiter.
Remarques complémentaires
TREMFYA est une solution limpide, incolore à jaune clair. N'utilisez pas ce médicament si vous remarquez que la solution est trouble, qu'elle présente un changement de coloration ou qu'elle contient des particules de grande taille.
Avant utilisation, sortez l'emballage du réfrigérateur, laissez la seringue préremplie ou le stylo prérempli dans le carton et attendez 30 minutes afin qu'elle atteigne la température ambiante.
Ce médicament est exclusivement destiné à un usage unique. Ne jetez pas de médicaments avec les eaux usées ou avec les déchets ménagers. Demandez à votre médecin, à votre pharmacien ou au personnel infirmier comment éliminer les médicaments lorsque vous ne les utilisez plus. Vous contribuez ainsi à la protection de l'environnement.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient TREMFYA?
Solution injectable dans une seringue préremplie ou un stylo prérempli.
Principes actifs
Chaque seringue préremplie ou stylo prérempli contient 100 mg de guselkumab dans 1 ml de solution.
Excipients
L-histidine, monochlorhydrate de L-histidine monohydraté, polysorbate 80, saccharose et eau pour préparations injectables.
Numéro d'autorisation
66583, 67490 (Swissmedic).
Où obtenez-vous TREMFYA? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Boîte de 1 seringue préremplie.
Boîte de 1 stylo prérempli.
Titulaire de l'autorisation
Janssen-Cilag AG, Zoug, ZG.
Cette notice d'emballage a été vérifiée pour la dernière fois en décembre 2020 par l'autorité de contrôle des médicaments (Swissmedic).
Mode d’emploi
TREMFYA Seringue préremplie

Important
Lorsque votre médecin décide que vous-même ou une personne qui s’occupe de vous pouvez administrer les injections de TREMFYA à domicile, vous devez suivre une formation sur la manière de préparer et d’injecter correctement TREMFYA en seringue préremplie avant d’essayer de vous administrer vous-même l’injection.
Lisez ENTIÈREMENT ce mode d’emploi avant d’utiliser la seringue préremplie TREMFYA et chaque fois que vous recevez un nouvel emballage. Il pourrait contenir de nouvelles informations. Ce mode d’emploi ne remplace en aucun cas un entretien avec votre médecin à propos de votre maladie ou de votre traitement.
Lisez aussi attentivement la notice d’emballage avant de commencer votre injection, et abordez toutes vos questions avec votre médecin.
La seringue préremplie TREMFYA est conçue pour une injection sous la peau et non pour une injection dans un muscle ou dans une veine. Après l’injection, l’aiguille se rétracte dans le corps de la seringue et y reste bloquée.
Votre seringue préremplie en un coup d’œil


Vous aurez besoin de ces accessoires:
- 1 tampon imbibé d’alcool
- 1 tampon d’ouate ou compresse de gaze
- 1 pansement
- 1 récipient résistant aux perforations (voir étape 3)
1. Préparation de votre injection

Contrôler l’emballage
Sortez l’emballage contenant la seringue préremplie du réfrigérateur. Laissez la seringue préremplie dans son emballage et posez ce dernier sur une surface plane à température ambiante pendant au moins 30 minutes avant l’utilisation.
Ne pas réchauffer la seringue d’une autre manière.
Contrôlez la date de péremption («EXP») au verso de l’emballage.
Ne pas utiliser la seringue préremplie au-delà de la date de péremption.
Ne pas injecter si les perforations de l’emballage sont endommagées. Demandez un nouvel emballage à votre médecin ou à votre pharmacien(ne).

Choisir le site de l’injection
Choisissez l’une des zones suivantes pour votre injection:
- Partie antérieure de la cuisse (recommandée)
- Bas-ventre
Ne pas injecter à moins de 5 cm du nombril.
Ne pas injecter dans une zone de peau sensible, lésée, rougie, squameuse ou indurée.
Ne pas injecter dans des zones présentant des cicatrices ou des vergetures.

Nettoyer le site de l’injection
Lavez-vous soigneusement les mains avec du savon et de l’eau chaude.
Nettoyez le site choisi avec le tampon imbibé d’alcool et laissez sécher.
Ne pas toucher le site de l’injection et ne pas l’éventer ou souffler dessus après l’avoir nettoyé.

Contrôler la solution injectable
Sortez la seringue préremplie de son emballage.
Contrôlez la solution injectable par la fenêtre de contrôle. Elle doit être incolore ou légèrement jaune et peut présenter de minuscules particules blanches ou transparentes. Vous pouvez parfois aussi voir une ou plusieurs bulles d’air, ce qui est normal.
Ne pas injecter si la solution injectable est trouble ou colorée ou si elle contient de grandes particules. En cas de doute, demandez un nouvel emballage à votre médecin ou à votre pharmacien(ne).
2. Injection de TREMFYA à l’aide de la seringue préremplie

Retirer le capuchon de protection de l’aiguille
Tenez la seringue par son corps, puis retirez le capuchon de l’aiguille d’un mouvement rectiligne. Il est normal d’apercevoir une goutte de solution.
Administrer l’injection dans les 5 minutes qui suivent le retrait du capuchon de protection.
Ne pas remettre le capuchon de protection, cela pourrait endommager l’aiguille.
Ne pas toucher l’aiguille et ne pas laisser l’aiguille toucher quoi que ce soit.
Ne pas utiliser la seringue préremplie si elle est tombée par terre. Demandez un nouvel emballage.

Position des doigts et introduction de l’aiguille
Placez le pouce, l’index et le majeur directement sous les prises pour les doigts, comme illustré.
Ne pas toucher le piston ou la zone au-dessus des prises pour les doigts car cela pourrait activer le dispositif de retrait de l’aiguille. Avec l’autre main, formez un pli cutané au niveau du site de l’injection. Positionnez la seringue à un angle d’environ 45 ° par rapport à la peau.
Important: formez un pli cutané suffisamment épais pour pouvoir effectuer l’injection sous la peau et non dans un muscle.
Insérez l’aiguille dans le pli de la peau d’un mouvement rapide et rectiligne.

Lâcher le pli cutané et repositionner la main
Tenez le corps de la seringue avec votre main libre.

Appuyer sur le piston
Placez le pouce de l’autre main sur le piston et appuyez sur le piston jusqu’à ce qu’il soit parvenu au fond du corps de la seringue et s’arrête.

Enlever lentement le pouce du piston
Le dispositif de protection de l’aiguille va maintenant retirer l’aiguille hors de la peau, la protéger complètement et la maintenir ainsi bloquée.
3. Après votre injection

Éliminer la seringue préremplie utilisée
La seringue préremplie ne doit pas être réutilisée. Immédiatement après l’utilisation, déposez la seringue préremplie dans un récipient résistant aux perforations.
Une fois le récipient plein, veillez à l’éliminer conformément aux instructions de votre médecin ou du personnel soignant.

Contrôler le site de l’injection
Un peu de sang ou de solution injectable peut se trouver au niveau du site de l’injection. Appliquez un tampon d’ouate ou une compresse de gaze sur le site de l’injection, jusqu’à ce que le saignement s’arrête.
Ne pas frotter le site de l’injection.
Si nécessaire, couvrez le site de l’injection avec un pansement.
Votre injection est maintenant terminée !
 Avez-vous besoin d’aide?
Avez-vous besoin d’aide?
Si vous avez d’autres questions, veuillez-vous adresser à votre médecin traitant.
Mode d’emploi TREMFYA Stylo prérempli

Important
Lorsque votre médecin décide que vous-même ou une personne qui s’occupe de vous pouvez administrer les injections de TREMFYA à domicile, vous devez suivre une formation sur la manière de préparer et d’injecter correctement TREMFYA en stylo prérempli avant d’essayer de vous administrer vous-même l’injection.
Lisez ENTIÈREMENT ce mode d’emploi avant d’utiliser le stylo prérempli TREMFYA et chaque fois que vous recevez un nouvel emballage.
Il pourrait contenir de nouvelles informations. Ce mode d’emploi ne remplace en aucun cas un entretien avec votre médecin à propos de votre maladie ou de votre traitement.
Lisez aussi attentivement la notice d’emballage avant de commencer votre injection, et abordez toutes vos questions avec votre médecin.
Le stylo prérempli TREMFYA est conçu pour une injection sous la peau et non pour une injection dans un muscle ou dans une veine. Après l’injection, l’aiguille se rétracte dans le corps du stylo et y reste bloquée.
Votre stylo prérempli en un coup d’œil

1. Préparation de votre injection

Contrôler l’emballage
Sortez l’emballage contenant le stylo prérempli du réfrigérateur.
Laissez le stylo prérempli dans son emballage et posez ce dernier sur une surface plane à température ambiante pendant au moins 30 minutes avant l’utilisation.
Ne pas réchauffer le stylo d’une autre manière.
Contrôlez la date de péremption («EXP») au verso de l’emballage.
Ne pas utiliser le stylo prérempli au-delà de la date de péremption.
Ne pas injecter si les perforations de l’emballage sont endommagées. Demandez un nouvel emballage à votre médecin ou à votre pharmacien(ne).

Choisir le site de l’injection
Choisissez l’une des zones suivantes pour votre injection:
- Partie antérieure de la cuisse (recommandée)
- Bas-ventre
Ne pas injecter à moins de 5 centimètres du nombril.
- Partie postérieure du bras (si l’injection est effectuée par un soignant).
Ne pas injecter dans une zone de peau sensible, lésée, rougie, squameuse ou indurée.
Ne pas injecter dans des zones présentant des cicatrices ou des vergetures.

Nettoyer le site de l’injection
Lavez-vous soigneusement les mains avec du savon et de l’eau chaude.
Nettoyez le site choisi avec le tampon imbibé d’alcool et laissez sécher.
Ne pas toucher le site de l’injection et ne pas l’éventer ou souffler dessus après l’avoir nettoyé.

Contrôler la solution injectable
Sortez le stylo prérempli de son emballage
Contrôlez la solution injectable par la fenêtre de contrôle. Elle doit être incolore ou légèrement jaune et peut présenter de minuscules particules blanches ou transparentes. Vous pouvez parfois aussi voir une ou plusieurs bulles d’air, ce qui est normal.
Ne pas injecter si la solution injectable est trouble ou colorée ou si elle contient de grandes particules. En cas de doute, demandez un nouvel emballage à votre médecin ou à votre pharmacien(ne).
2. Injection de Tremfya à l’aide du stylo prérempli

Tournez et retirez le capuchon inférieur
Ne pas toucher la protection de l’aiguille après avoir retiré le capuchon inférieur.
Administrer l’injection dans les 5 minutes qui suivent le retrait du capuchon inférieur.
Ne pas remettre le capuchon inférieur, cela pourrait endommager l’aiguille.
Ne pas utiliser le stylo prérempli s’il est tombé par terre. Demandez un nouvel emballage.

Poser le stylo sur la peau
Placez le stylo prérempli directement sur la peau (à un angle d’environ 90 degrés par rapport au site de l’injection).

Poussez la poignée verticalement vers le bas
Le médicament est injecté en poussant. Choisissez une vitesse d’injection que vous trouvez agréable.
Ne soulevez pas le stylo prérempli pendant l’injection, car la protection de l’aiguille se verrouillerait et la dose ne serait pas administrée dans sa totalité.

Injection complète
L’injection est complète lorsque la poignée est entièrement enfoncée, que vous entendez un clic et que le corps vert n’est plus visible.

Levez le stylo verticalement
Une bande jaune vous indique que la protection de l’aiguille est verrouillée.
3. Après votre injection

Éliminer le stylo prérempli utilisé
Le stylo prérempli ne doit pas être réutilisé.
Immédiatement après l’utilisation, déposez le stylo prérempli dans un récipient résistant aux perforations.
Une fois le récipient plein, veillez à l’éliminer conformément aux instructions de votre médecin ou du personnel soignant.

Contrôler le site de l’injection
Un peu de sang ou de solution injectable peut se trouver au niveau du site de l’injection. Appliquez un tampon d’ouate ou une compresse de gaze sur le site de l’injection, jusqu’à ce que le saignement s’arrête.
Ne pas frotter le site de l’injection.
Si nécessaire, couvrez le site de l’injection avec un pansement.
Votre injection est maintenant terminée!
 Avez-vous besoin d’aide?
Avez-vous besoin d’aide?
Si vous avez d’autres questions, veuillez vous adresser à votre médecin traitant.
Che cos'è TREMFYA e quando si usa?
TREMFYA contiene il principio attivo guselkumab, che è un tipo di proteina chiamata anticorpo monoclonale.
Questo medicamento agisce bloccando l'attività di una proteina chiamata IL-23, che è presente in quantità elevata nei pazienti affetti da psoriasi e da artrite psoriasica.
Psoriasi a placche
TREMFYA viene utilizzato per il trattamento degli adulti affetti da «psoriasi a placche», una malattia infiammatoria che colpisce la pelle e le unghie, di entità da moderata a grave.
TREMFYA può migliorare le condizioni della pelle e l'aspetto delle unghie e alleviare i sintomi, come desquamazione, distacco della pelle, esfoliazione, prurito, dolore e bruciore.
Artrite psoriasica
TREMFYA viene utilizzato per il trattamento di adulti affetti da artrite psoriasica, una malattia infiammatoria delle articolazioni frequentemente associata alla psoriasi, che sono risultati intolleranti o non hanno risposto adeguatamente a un'altra terapia con un antireumatico modificante la malattia (DMARD). Se soffre di artrite psoriasica, riceverà TREMFYA da solo o in combinazione con metotrexato, un antireumatico modificante la malattia (DMARD).
Su prescrizione medica.
Di che cosa occorre inoltre tener conto durante il trattamento?
Segua esattamente le istruzioni del suo medico.
Quando non si può usare TREMFYA?
Non dovrebbe usare TREMFYA:
se ha un'infezione attiva clinicamente significativa (p. es. una tubercolosi attiva);
se è allergico a guselkumab o a una delle sostanze ausiliarie di questo medicamento;
se pensa di essere allergico, chieda consiglio al suo medico prima dell'uso.
Quando è richiesta prudenza nell'uso di TREMFYA?
Parli con il suo medico o con il suo farmacista o con il personale infermieristico prima di utilizzare TREMFYA:
- se è in terapia per un'infezione;
- se ha un'infezione che non guarisce o si ripresenta continuamente;
- se è affetto da tubercolosi (TB) o è stato a stretto contatto con una persona affetta da TB;
- se pensa di avere un'infezione o presenta i sintomi di un'infezione (vedere paragrafo «Prestare attenzione alle infezioni e alle reazioni allergiche»);
- se è stato vaccinato di recente o se prevede di vaccinarsi durante il trattamento con TREMFYA, perché determinati vaccini (i cosiddetti vaccini vivi) non possono essere somministrati durante il trattamento con TREMFYA;
- se si sta sottoponendo o si è sottoposto in passato a una fototerapia; in tal caso, il medico controllerà prima e durante il trattamento con TREMFYA che non vi siano tumori cutanei.
Se non è sicuro se una delle condizioni sopra menzionate la riguarda, parli con il suo medico o con il suo farmacista o con il personale infermieristico prima di usare TREMFYA.
Prestare attenzione alle infezioni e alle reazioni allergiche
Il trattamento con TREMFYA potrebbe ridurre le sue difese immunitarie contro le infezioni e aumentare quindi la sua suscettibilità alle infezioni e il rischio di reazioni allergiche. Le reazioni allergiche possono insorgere giorni o settimane dopo il trattamento con TREMFYA. Informi il suo medico o si rivolga immediatamente a un medico se durante l'uso di TREMFYA nota i segni di un'infezione o di una reazione allergica, elencati qui di seguito.
Infezioni
Febbre o sintomi simil-influenzali, dolori muscolari, tosse, fiato corto, bruciore durante la minzione o minzione più frequente del normale, espettorato (muco) con sangue, perdita di peso, diarrea o mal di stomaco, pelle calda, arrossata o dolorante o lesioni sul corpo non correlate alla psoriasi.
Reazioni allergiche
Difficoltà a respirare o a inghiottire, gonfiore del viso, delle labbra, della bocca, della lingua o della gola, forte prurito accompagnato da eruzione cutanea con arrossamento o rigonfiamenti.
Effetti sulla capacità di guidare e sull'uso di macchinari
Non è noto se TREMFYA influisca sulla capacità di guidare e sull'uso di macchinari.
Informi il suo medico o il suo farmacista se
- soffre di altre malattie,
- soffre di allergie,
- assume o usa, ha assunto o usato di recente oppure desidera assumere o usare altri medicamenti (anche se acquistati di sua iniziativa!).
Si può usare TREMFYA durante la gravidanza o l'allattamento?
È preferibile evitare l'uso di TREMFYA durante la gravidanza. Gli effetti di questo medicamento sulle donne in gravidanza non sono noti. Se lei è una donna in età fertile, le sarà consigliato di evitare una gravidanza e dovrà utilizzare un metodo contraccettivo affidabile durante l'uso di TREMFYA e per almeno 12 settimane dopo l'ultima dose di TREMFYA.
Se è incinta, sospetta di essere incinta o sta pensando di avere un bambino, parli con il suo medico.
Se allatta o vorrebbe allattare, parli con il suo medico. Dovrà decidere insieme al suo medico se allattare e rinunciare al trattamento con TREMFYA o se usare TREMFYA e rinunciare all'allattamento. Allattare durante il trattamento con TREMFYA è sconsigliato.
Come usare TREMFYA?
Usi questo medicamento sempre esattamente come prescritto dal suo medico o dal personale infermieristico. Se ha dei dubbi, chieda al suo medico, al suo farmacista o al personale infermieristico.
TREMFYA viene somministrato sotto forma di iniezione sotto la pelle (iniezione sottocutanea). Ciascuna siringa preriempita e ciascuna penna preriempita sono esclusivamente monouso. Dovrebbe essere iniettato l'intero contenuto della siringa preriempita o della penna preriempita. Inizialmente, l'iniezione di TREMFYA può essere somministrata dal medico o dal personale infermieristico. Tuttavia, lei può decidere insieme al suo medico di iniettarsi da solo TREMFYA. In questo caso, sarà istruito su come somministrarsi da solo l'iniezione di TREMFYA. Se ha delle domande sull'autoiniezione, ne parli con il suo medico. È importante che lei non provi a somministrarsi da solo un'iniezione senza prima essere stato istruito dal suo medico o dal personale infermieristico.
Per conoscere tutte le informazioni sull'uso di TREMFYA, legga attentamente – prima di usare il medicamento – l'opuscolo «Guida all'utilizzo» incluso nella confezione.
Quanto TREMFYA si usa?
Psoriasi a placche
- La dose è di 100 mg (il contenuto di 1 siringa preriempita o di 1 penna preriempita) sotto forma di iniezione sotto la pelle (iniezione sottocutanea). Questa può essere somministrata dal suo medico o dal personale infermieristico.
- Dopo la prima dose, riceverà la dose successiva dopo 4 settimane, quindi ogni 8 settimane.
Artrite psoriasica
- La dose è di 100 mg (il contenuto di 1 siringa preriempita o di 1 penna preriempita) sotto forma di iniezione sotto la pelle (iniezione sottocutanea). Questa può essere somministrata dal suo medico o dal personale infermieristico.
- Dopo la prima dose, riceverà la dose successiva dopo 4 settimane, quindi ogni 8 settimane.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte, ne parli al suo medico o al suo farmacista.
Per quanto tempo bisogna usare TREMFYA?
Il suo medico controllerà regolarmente il decorso della sua malattia per verificare se il trattamento produce gli effetti desiderati e deciderà per quanto tempo le occorre TREMFYA.
Se ha iniettato una quantità eccessiva di TREMFYA
Se ha iniettato una quantità eccessiva di TREMFYA o se la dose è stata somministrata prima del momento prescritto, informi il suo medico.
Se ha dimenticato di usare TREMFYA
Se ha dimenticato di iniettare una dose di TREMFYA, informi il suo medico.
Se interrompe l'uso di TREMFYA
Non interrompa l'uso di TREMFYA senza prima averne parlato con il suo medico. Interrompere l'uso di TREMFYA non è pericoloso, ma se interrompe il trattamento i suoi sintomi potrebbero ricomparire.
Bambini e adolescenti (sotto i 18 anni)
L'uso e la sicurezza di TREMFYA nei bambini e negli adolescenti di età inferiore ai 18 anni finora non sono stati esaminati.
TREMFYA non sarà quindi somministrato a questo gruppo di età.
Quali effetti collaterali può avere TREMFYA?
Come tutti i medicamenti, anche TREMFYA può avere effetti collaterali, che tuttavia non compaiono necessariamente in ogni paziente.
Tutti i seguenti effetti collaterali sono di entità lieve o moderata. Informi il suo medico, il suo farmacista o il personale infermieristico se uno di questi effetti collaterali diventa grave.
Alcuni effetti collaterali sono molto frequenti (possono colpire più di 1 persona su 10): infezioni delle vie respiratorie.
Alcuni effetti collaterali sono frequenti (possono colpire fino a 1 persona su 10): mal di testa, dolori alle articolazioni, diarrea, arrossamento o irritazione nel punto di iniezione, aumento dei livelli degli enzimi epatici nel sangue, aumento dei livelli di bilirubina (un prodotto di degradazione dei globuli rossi) nel sangue.
Alcuni effetti collaterali sono occasionali (possono colpire fino a 1 persona su 100): reazioni allergiche, eruzioni cutanee, diminuzione del numero di un particolare tipo di globuli bianchi (neutrofili), infezioni da herpes simplex, infezioni fungine della pelle (dermatofitosi), influenza intestinale (gastroenterite), orticaria.
Se osserva effetti collaterali, si rivolga al suo medico o al farmacista, soprattutto se si tratta di effetti collaterali non descritti in questo foglietto illustrativo.
Di che altro occorre tener conto?
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazione di stoccaggio
Conservare in frigorifero (2-8 °C).
Non congelare.
Conservare la siringa preriempita o la penna preriempita nella scatola originale per proteggere il contenuto dalla luce.
Tenere fuori dalla portata dei bambini.
Non scuotere.
Ulteriori indicazioni
TREMFYA è una soluzione limpida, incolore o di colore giallo chiaro. Non usi questo medicamento se nota che il medicamento è torbido, ha un colore anomalo o contiene particelle di grandi dimensioni.
Prima dell'uso, rimuovere la confezione dal frigorifero e lasciare la siringa preriempita o la penna preriempita all'interno del suo cartone per 30 minuti, in modo che raggiunga la temperatura ambiente.
Questo medicamento è esclusivamente monouso. Non smaltire i medicamenti né insieme alle acque di scarico né con i rifiuti domestici. Chieda al suo medico, al suo farmacista o al personale infermieristico come smaltire il medicamento quando non lo utilizza più. In questo modo, contribuirà a proteggere l'ambiente.
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene TREMFYA?
Soluzione per iniezione in siringa preriempita o penna preriempita.
Principi attivi
Ciascuna siringa preriempita o penna preriempita contiene 100 mg di guselkumab in 1 ml di soluzione.
Sostanze ausiliarie
L-istidina, L-istidina monocloridrato monoidrato, polisorbato 80, saccarosio e acqua per preparazioni iniettabili.
Numero dell'omologazione
66583, 67490 (Swissmedic).
Dove è ottenibile TREMFYA? Quali confezioni sono disponibili?
In farmacia, solo dietro presentazione della prescrizione medica.
Scatola pieghevole con 1 siringa preriempita.
Scatola pieghevole con 1 penna preriempita.
Titolare dell'omologazione
Janssen-Cilag AG, Zugo, ZG.
Questo foglietto illustrativo è stato controllato l'ultima volta nel dicembre 2020 dall'autorità competente in materia di medicamenti (Swissmedic).
Istruzioni per l’uso
TREMFYA Siringa preriempita
Importante
Se il suo medico ha deciso che lei può somministrarsi a casa le iniezioni di TREMFYA, o che una persona che la assiste può farlo per lei, lei deve essere istruito alla corretta preparazione e iniezione di TREMFYA per mezzo della siringa preriempita, prima di provare a effettuare da solo l’iniezione.
Legga queste istruzioni per l’uso PER INTERO prima di utilizzare la siringa preriempita di TREMFYA e ogni volta che riceve una nuova confezione, perché le informazioni potrebbero essere state aggiornate. Queste istruzioni per l’uso non sostituiscono in alcun modo un colloquio con il suo medico sulla sua malattia o sul suo trattamento.
Prima di cominciare con l’iniezione, legga attentamente anche il foglietto illustrativo e parli con il suo medico di eventuali dubbi.
La siringa preriempita di TREMFYA è concepita per l’iniezione sotto la pelle, non nel muscolo o in una vena. Dopo l’iniezione, l’ago viene ritirato nel cilindro della siringa e rimane bloccato al suo interno.
Struttura della sua siringa preriempita


Le saranno necessari i seguenti accessori:
- 1 tampone imbevuto di alcool
- 1 batuffolo di cotone o tampone di garza
- 1 cerotto
- 1 contenitore resistente alle punture (vedere passo 3)
1. Preparazione dell’iniezione

Controllare la confezione
Prelevi la confezione con la siringa preriempita dal frigorifero. Non apra la confezione e la lasci su una superficie piana a temperatura ambiente per almeno 30 minuti prima dell’uso.
Non riscaldare la siringa preriempita in altri modi.
Controlli la data di scadenza («EXP») sul lato posteriore della confezione.
Non usare dopo la data di scadenza.
Non effettuare l’iniezione se le perforazioni sulla confezione sono danneggiate. Chieda al suo medico/farmacista una nuova confezione.

Scegliere il punto di iniezione
Per l’iniezione, scelga una delle seguenti zone:
- parte anteriore della coscia (consigliata)
- parte inferiore dell’addome;
evitare la zona compresa entro 5 cm dall’ombelico;
Non effettui l’iniezione in punti in cui la pelle è sensibile, danneggiata, arrossata, desquamata o callosa.
Non effettui l’iniezione in zone con cicatrici o smagliature.

Pulire il punto di iniezione
Si lavi accuratamente le mani con acqua calda e sapone.
Pulisca il punto prescelto con un tampone imbevuto di alcool e lo lasci asciugare.
Eviti di toccare il punto di iniezione, di ventilarlo o di soffiarci sopra dopo averlo pulito.

Controllare la soluzione iniettabile
Prelevi la siringa preriempita dalla confezione.
Controlli la soluzione dalla finestra di controllo. Dovrebbe essere da incolore a lievemente giallastra e può contenere minuscole particelle bianche o trasparenti. Potrebbero essere visibili anche una o più bolle d’aria. Questo è normale.
Non effettui l’iniezione se la soluzione è torbida, ha un colore anomalo o contiene particelle di grandi dimensioni. Se non è sicuro, chieda al suo medico o al suo farmacista un’altra confezione.
2. Iniezione di TREMFYA con la siringa preriempita

Rimuovere il cappuccio di protezione dell’ago
Tenga la siringa dal cilindro e rimuova il cappuccio dell’ago senza inclinarlo. La presenza di una goccia di soluzione è normale.
Effettuare l’iniezione entro 5 minuti dalla rimozione del cappuccio protettivo.
Non rimettere il cappuccio di protezione sull’ago, che potrebbe danneggiarsi.
Non toccare l’ago ed evitare che l’ago tocchi qualsiasi superficie.
Non utilizzi la siringa preriempita se le è caduta. Chieda una nuova confezione.

Posizione delle dita e inserimento dell’ago
Posizioni il pollice, l’indice e il medio appena sotto il supporto per le dita, come illustrato nella figura.
Non toccare lo stantuffo o l’area al di sopra del supporto per le dita; questo potrebbe attivare la protezione dell’ago. Con l’altra mano, comprima tra le dita il punto di iniezione per formare una piega di pelle. Posizioni la siringa sulla pelle a un angolo di circa 45°.
Importante: formare una piega di pelle abbastanza grande da permettere l’iniezione sotto la pelle e non nel muscolo.
Introduca l’ago con un movimento rapido e lineare.

Lasciare la piega di pelle e riposizionare la mano
Utilizzi la mano libera per prendere il cilindro della siringa.

Premere lo stantuffo
Posizioni il pollice dell’altra mano sullo stantuffo e spinga lo stantuffo completamente verso il basso, fino a quando non si sarà fermato.

Togliere lentamente il pollice dallo stantuffo
Il dispositivo di protezione dell’ago ritira l’ago dalla pelle, lo circonda completamente e lo mantiene bloccato.
3. Dopo l’iniezione

Smaltire la siringa preriempita usata
La siringa preriempita non può essere riutilizzata. Subito dopo l’uso, getti la siringa preriempita usata in un contenitore per rifiuti resistente alle punture.
Si assicuri che il contenitore, una volta pieno, sia smaltito secondo le istruzioni del suo medico o del personale infermieristico.

Controllare il punto di iniezione
Nel punto di iniezione può essere presente un po’ di sangue o di soluzione di iniezione. Tenga premuto sul punto di iniezione un batuffolo di cotone o un tampone di garza fino a quando il sanguinamento non si sia fermato.
Non strofinare il punto di iniezione.
Se necessario, applichi un cerotto sul punto di iniezione.
La procedura di iniezione è terminata!
 Le serve aiuto?
Le serve aiuto?
Per qualsiasi ulteriore domanda si rivolga al suo medico curante.
Istruzioni per l’uso TREMFYA Penna preriempita

Importante
Se il suo medico ha deciso che lei può somministrarsi a casa le iniezioni di TREMFYA, o che una persona che la assiste può farlo per lei, lei deve essere istruito alla corretta preparazione e iniezione di TREMFYA per mezzo della penna preriempita, prima di provare a effettuare da solo l’iniezione.
Legga queste istruzioni per l’uso PER INTERO prima di utilizzare la penna preriempita di TREMFYA e ogni volta che riceve una nuova confezione.
Le informazioni contenute potrebbero essere state aggiornate. Queste istruzioni per l’uso non sostituiscono in alcun modo un colloquio con il suo medico sulla sua malattia o sul suo trattamento.
Prima di cominciare con l’iniezione, legga attentamente anche il foglietto illustrativo e parli con il suo medico di eventuali dubbi.
La penna preriempita di TREMFYA è concepita per l’iniezione sotto la pelle, non nel muscolo o in una vena. Dopo l’iniezione, l’ago viene ritirato nel cilindro della penna e rimane bloccato al suo interno.
Struttura della sua penna preriempita

1. Preparazione dell iniezione

Controllare la confezione
Prelevi la confezione con la penna preriempita dal frigorifero. Lasci la penna preriempita nella confezione chiusa su una superficie piana a temperatura ambiente per almeno 30 minuti prima dell’uso.
Non riscaldare in altri modi.
Controlli la data di scadenza («EXP») sul lato posteriore della confezione.
Non usare dopo la data di scadenza.
Non effettuare l’iniezione se le perforazioni sulla confezione sono danneggiate. Chieda al suo medico/farmacista una nuova confezione.

Scegliere il punto di iniezione
Per l’iniezione, scelga una delle seguenti zone:
- parte anteriore della coscia (consigliata)
- parte inferiore dell’addome;
evitare la zona compresa entro 5 cm dall’ombelico.
- retro della parte superiore del braccio (se l’iniezione è effettuata da una persona che la assiste).
Non effettui l’iniezione in punti in cui la pelle è sensibile, danneggiata, arrossata, desquamata o callosa.
Non effettui l’iniezione in zone con cicatrici o smagliature.

Pulire il punto di iniezione
Si lavi accuratamente le mani con acqua calda e sapone.
Pulisca il punto prescelto con un tampone imbevuto di alcool e lo lasci asciugare.
Eviti di toccare il punto di iniezione, di ventilarlo o di soffiarci sopra dopo averlo pulito.

Controllare la soluzione iniettabile
Prelevi la penna preriempita dalla confezione.
Controlli la soluzione dalla finestra di controllo. Dovrebbe essere da incolore a lievemente giallastra e può contenere minuscole particelle bianche o trasparenti. Potrebbero essere visibili anche una o più bolle d’aria. Questo è normale.
Non effettui l’iniezione se la soluzione è torbida, ha un colore anomalo o contiene particelle di grandi dimensioni. Se non è sicuro, chieda al suo medico o al suo farmacista un’altra confezione.
2. Iniezione di TREMFYA con la penna preriempita

Ruotare e rimuovere il cappuccio
Non toccare la protezione dell’ago dopo aver tolto il cappuccio.
Effettuare l’iniezione entro 5 minuti dalla rimozione del cappuccio protettivo.
Non rimettere il cappuccio, poiché potrebbe danneggiare l’ago.
Non utilizzi la penna preriempita se le è caduta. Chieda una nuova confezione.

Posizionare sulla pelle
Posizioni la penna preriempita direttamente sulla pelle (mantenendo un’angolazione di circa 90 gradi rispetto al punto di iniezione).

Premere l’impugnatura verso il basso in linea retta
Il medicamento viene iniettato quando si preme l’impugnatura: scelga una velocità di iniezione che le risulta confortevole.
Non sollevi la penna preriempita durante l’iniezione: questo farebbe scattare il meccanismo di protezione dell’ago e non verrebbe iniettata la dose completa.

Iniezione completa
L’iniezione è completa quando l’impugnatura è premuta completamente in basso e si sente un clic; la custodia verde non è più visibile.

Sollevare in linea retta
Una striscia gialla le indica che è scattato il meccanismo di protezione dell’ago.
3. Dopo l’iniezione

Smaltire la penna preriempita usata
La penna preriempita non può essere riutilizzata.
Subito dopo l’uso, getti la penna preriempita usata in un contenitore per rifiuti resistente alle punture.
Si assicuri che il contenitore, una volta pieno, sia smaltito secondo le istruzioni del suo medico o del personale infermieristico.

Controllare il punto di iniezione
Nel punto di iniezione può essere presente un po’ di sangue o di soluzione di iniezione. Tenga premuto sul punto di iniezione un batuffolo di cotone o un tampone di garza fino a quando il sanguinamento non si sia fermato.
Non strofinare il punto di iniezione.
Se necessario, applichi un cerotto sul punto di iniezione.
La procedura di iniezione è terminata!
 Le serve aiuto?
Le serve aiuto?
Per qualsiasi ulteriore domanda si rivolga al suo medico curante.
Zusammensetzung
Wirkstoffe
Guselkumab, aus gentechnisch veränderten CHO (Chinese Hamster Ovary)-Zellen hergestellt.
Hilfsstoffe
L-Histidin, L-Histidin-Monohydrochlorid-Monohydrat, Polysorbat 80, Saccharose, Wasser für Injektionszwecke q.s. ad solutionem pro 1 ml.
Darreichungsform und Wirkstoffmenge pro Einheit
Injektionslösung in einer Fertigspritze zur subkutanen Anwendung:
Jede Fertigspritze enthält 100 mg Guselkumab in 1 ml Lösung.
Injektionslösung in einem Fertigpen zur subkutanen Anwendung:
Jeder Fertigpen enthält 100 mg Guselkumab in 1 ml Lösung.
Indikationen/Anwendungsmöglichkeiten
Plaque-Psoriasis
TREMFYA ist indiziert zur Behandlung von erwachsenen Patienten mit mittelschwerer bis schwerer, chronischer Plaque-Psoriasis, die für eine systemische Therapie in Frage kommen.
Psoriasis-Arthritis
TREMFYA ist allein oder in Kombination mit Methotrexat (MTX) indiziert zur Behandlung von erwachsenen Patienten mit aktiver Psoriasis-Arthritis, die auf eine vorgängige Therapie mit einem krankheitsmodifizierenden Antirheumatikum (DMARD) unzureichend angesprochen oder dieses nicht vertragen haben (siehe «Eigenschaften/Wirkungen»).
Dosierung/Anwendung
Die Anwendung von TREMFYA sollte unter Anleitung und Aufsicht eines in der Diagnose und Behandlung der indizierten Therapiegebiete erfahrenen Arztes erfolgen.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Übliche Dosierung
Plaque-Psoriasis
Die empfohlene Dosis von TREMFYA beträgt 100 mg als subkutane Injektion in Woche 0 und 4, gefolgt von einer Erhaltungsdosis alle 8 Wochen.
Bei Patienten, die nach 16-wöchiger Behandlung kein Ansprechen zeigen, sollte der Abbruch der Behandlung in Erwägung gezogen werden.
Psoriasis-Arthritis
Die empfohlene Dosis von TREMFYA beträgt 100 mg als subkutane Injektion in Woche 0 und 4, gefolgt von einer Erhaltungsdosis alle 8 Wochen.
Bei Patienten, die nach 24-wöchiger Behandlung kein Ansprechen zeigen, sollte der Abbruch der Behandlung in Erwägung gezogen werden.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
TREMFYA wurde in dieser Patientenpopulationen nicht untersucht. Es können keine Dosisempfehlungen gegeben werden.
Patienten mit Nierenfunktionsstörungen
TREMFYA wurde in dieser Patientenpopulationen nicht untersucht. Es können keine Dosisempfehlungen gegeben werden.
Ältere Patienten
Es wurden keine spezifischen Studien bei älteren Patienten durchgeführt. Es wird keine Dosisanpassung bei älteren Patienten empfohlen.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Tremfya bei Kindern und Jugendlichen unter 18 Jahren wurden nicht untersucht. Es liegen keine Daten vor.
Art der Anwendung
TREMFYA ist für die subkutane Injektion bestimmt und soll in das Abdomen oder den Oberschenkel verabreicht werden. Wenn möglich sollten Hautbezirke mit Anzeichen von Psoriasis nicht als Injektionsstelle verwendet werden.
Nach geeigneter Schulung in der Technik der subkutanen Injektion können die Patienten TREMFYA selbst injizieren, wenn ein Arzt dies für angemessen erachtet. Jedoch sollte der Arzt für eine geeignete Nachbeobachtung der Patienten sorgen. Die Patienten sollten angewiesen werden, die vollständige Dosis von TREMFYA gemäss der separat in der Packung beiliegenden «Gebrauchsanweisung» zu injizieren. Für weitere Hinweise zu Vorbereitung und besonderen Vorsichtsmassnahmen bei der Handhabung, siehe «Sonstige Hinweise: Hinweise für die Handhabung».
Kontraindikationen
Schwere Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Klinisch relevante aktive Infektionen (z.B. aktive Tuberkulose).
Warnhinweise und Vorsichtsmassnahmen
Infektionen
TREMFYA kann das Risiko für Infektionen erhöhen. Bei Patienten mit einer klinisch bedeutsamen aktiven Infektion sollte die Behandlung mit TREMFYA nicht eingeleitet werden, bevor die Infektion abgeklungen oder angemessen behandelt ist.
Infektionen traten in klinischen Studien bei Plaque-Psoriasis (23% vs. 21% für Placebo; ≤0,2% schwere Infektionen in beiden Gruppen) und bei Psoriasis-Arthritis (21% in TREMFYA- und Placebogruppen; ≤0,8% schwere Infektionen in beiden Gruppen) auf.
Patienten, die in Bezug auf HCV- oder HIV seropositiv waren, solche, die positiv auf eine Hepatitis-B-Infektion getestet wurden, und solche mit chronischen oder rezidivierenden Infektionen in der Vorgeschichte, waren von den klinischen Studien ausgeschlossen.
Patienten unter Behandlung mit TREMFYA sollen angehalten werden, ärztliche Hilfe aufzusuchen, wenn Anzeichen oder Symptome einer klinisch bedeutsamen chronischen oder akuten Infektion auftreten. Wenn ein Patient eine klinisch bedeutsame oder schwerwiegende Infektion entwickelt oder nicht auf die Standardtherapie anspricht, ist der Patient sorgfältig zu überwachen und TREMFYA ist abzusetzen, bis die Infektion abgeklungen ist.
Beurteilung bezüglich Tuberkulose vor der Behandlung
In klinischen Studien entwickelten Patienten mit latenter Tuberkulose (TB), die gleichzeitig mit TREMFYA und mit einer angemessenen TB-Prophylaxe behandelt wurden, keine TB. Vor der Einleitung einer Behandlung mit TREMFYA sind die Patienten bezüglich einer TB-Infektion zu beurteilen. Die Behandlung einer latenten TB ist einzuleiten, bevor TREMFYA verabreicht wird. Patienten, die TREMFYA erhalten, sollten während und nach der Behandlung auf Anzeichen und Symptome einer aktiven TB überwacht werden. TREMFYA darf nicht angewendet werden bei Patienten mit aktiver TB-Infektion. Eine Anti-TB-Therapie vor der Einleitung einer Behandlung mit TREMFYA sollte in Betracht gezogen werden bei Patienten mit der Anamnese einer früheren latenten oder aktiven TB, bei denen ein adäquater Behandlungsverlauf nicht bestätigt werden kann.
Maligne Erkrankungen
In klinischen Studien zeigt die Behandlung mit TREMFYA kein erhöhtes Risiko für maligne Erkrankungen.
Psoriasis-Patienten, die zuvor eine UV-Therapie erhalten haben, sollten vor und während der Behandlung mit TREMFYA gründlich auf das Vorliegen von Hauttumoren untersucht werden.
Begleitende Therapie mit anderen systemischen Immunsuppressiva oder Phototherapie
Die Sicherheit und Wirksamkeit von TREMFYA in Kombination mit Immunsuppressiva, einschliesslich Biologika, oder Phototherapie sind nicht untersucht worden.
Überempfindlichkeit
Nach Markteinführung wurde über schwerwiegende Überempfindlichkeitsreaktionen, inklusive Anaphylaxie, berichtet. Einige schwerwiegende Überempfindlichkeitsreaktionen traten mehrere Tage bis Wochen nach der Behandlung mit Guselkumab auf, einschliesslich Fälle von Urtikaria und Dyspnoe. Wenn eine schwerwiegende Überempfindlichkeitsreaktion auftritt, soll die Verabreichung von TREMFYA umgehend abgebrochen und eine geeignete Therapie eingeleitet werden.
Immunisierungen
Bevor eine Behandlung mit TREMFYA eingeleitet wird, ist die Durchführung aller nötigen Impfungen gemäss den gegenwärtigen Impfrichtlinien abzuschliessen. Es liegen keine Daten zum Ansprechen und Aufrechterhaltung der Antwort auf Totimpfstoffe vor, die vor oder während einer Therapie mit TREMFYA verabreicht wurden. Lebendvakzine sollen nicht gleichzeitig mit TREMFYA verabreicht werden. Ein genügender zeitlicher Abstand zwischen Impfungen mit Lebendimpfstoffen und dem Beginn der Therapie gemäss den aktuellen Impfrichtlinien zu immunsuppressiven Wirkstoffen ist einzuhalten.
Sachdienliche Informationen zur Anwendung von immunsuppressiven Wirkstoffen mit spezifischen Impfstoffen können auch den jeweiligen Fachinformationen entnommen werden.
Interaktionen
In einer Phase-I-Studie bei Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis waren die nach einer Einzeldosis von Guselkumab beobachteten Veränderungen der systemischen Expositionen (Cmax und AUCinf) gegenüber Midazolam, S-Warfarin, Omeprazol, Dextromethorphan und Koffein klinisch nicht relevant. Dies lässt darauf schliessen, dass Arzneimittelinteraktionen zwischen Guselkumab und Substraten verschiedener CYP-Enzyme (CYP3A4, CYP2C9, CYP2C19, CYP2D6 und CYP1A2) unwahrscheinlich sind. Eine Dosisanpassung ist bei gleichzeitiger Anwendung von Guselkumab und CYP450-Substraten nicht erforderlich.
Über das Ansprechen auf Vakzine unter der Behandlung mit TREMFYA liegen keine Daten vor, Lebendvakzine sollen nicht gleichzeitig mit TREMFYA verabreicht werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Schwangerschaft/Stillzeit
Frauen im gebärfähigen Alter
Frauen im gebärfähigen Alter sollten während der Behandlung und für mindestens 12 Wochen nach der Behandlung wirksame Methoden zur Empfängnisverhütung anwenden.
Schwangerschaft
Es liegen keine Daten zur Anwendung von Guselkumab bei Schwangeren vor. Tierexperimentelle Studien zeigten keine direkte oder indirekte Toxizität mit Auswirkung auf Schwangerschaft, Embryonalentwicklung, Entwicklung des Fötus, Entbindung oder die postnatale Entwicklung (siehe «Präklinische Daten»). Als Vorsichtsmassnahme soll eine Anwendung von TREMFYA während der Schwangerschaft vermieden werden.
Stillzeit
Es ist nicht bekannt, ob Guselkumab in die Muttermilch ausgeschieden wird. Es ist bekannt, dass menschliche IgGs in den ersten Tagen nach der Geburt in die Muttermilch übergehen und bald darauf auf niedrige Konzentrationen absinken; daher kann ein Risiko für das gestillte Kind während dieser Zeit nicht ausgeschlossen werden. Unter Berücksichtigung des Nutzens des Stillens für das Kind und des Nutzens der Tremfya-Therapie für die Frau, muss entschieden werden, ob die Behandlung mit Tremfya zu unterbrechen ist oder auf die Einleitung der Therapie verzichtet werden soll. Bezüglich Angaben zum Übergang von Guselkumab in die Muttermilch von Tieren siehe «Präklinische Daten».
Fertilität
Die Auswirkungen von Guselkumab auf die menschliche Fertilität wurden nicht untersucht. Tierexperimentelle Studien zeigten keine direkten oder indirekten schädigenden Auswirkungen auf die Fertilität (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Das Sicherheitsprofil von Tremfya basiert auf Daten von Phase 2 und Phase 3 Studien an 3940 Patienten, darunter 2711 Patienten mit Plaque-Psoriasis, die mit Tremfya 100 mg in den Wochen 0 und 4 und danach alle 8 Wochen (q8w) behandelt wurden, und 1229 Patienten mit Psoriasis-Arthritis, die entweder mit Tremfya 100 mg in den Wochen 0 und 4 und danach mit q8w oder Tremfya 100 mg alle 4 Wochen behandelt wurden. 2925 Patienten in Phase-2 und Phase-3 Plaque Psoriasis- und Psoriasis Arthritis-Studien waren mindestens 1 Jahr exponiert, und 1516 und 692 Psoriasis Patienten mindestens 2 bzw. 3 Jahre.
Die häufigste unerwünschte Arzneimittelwirkung waren Atemwegsinfektionen (13,9%).
Auflistung der unerwünschten Wirkungen
Die unerwünschten Wirkungen aus klinischen Psoriasis-Studien, klinischen Studien zu Psoriasis-Arthritis und aus Erfahrungen nach Markteinführung, sind nach MedDRA-Systemorganklasse und Häufigkeit gemäss folgender Konvention klassifiziert: sehr häufig (≥1/10), häufig (≥1/100 bis <1/10), gelegentlich (≥1/1'000 bis <1/100), selten (≥1/10'000 bis <1/1'000), sehr selten (<1/10'000), nicht bekannt (auf Grundlage der verfügbaren Daten nicht abschätzbar).
Infektionen und parasitäre Erkrankungen
Sehr häufig: Atemwegsinfektionen (13,9%).
Gelegentlich: Herpes-simplex-Infektionen, Dermatophytosen, Gastroenteritis.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Neutropenie
Erkrankungen des Immunsystems
Gelegentlich: Überempfindlichkeit, Anaphylaxie.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen.
Erkrankungen des Gastrointestinaltrakts
Häufig: Diarrhö.
Leber- und Gallenerkrankungen
Häufig: Transaminasen erhöht, Bilirubin erhöht.
Erkrankungen der Haut und des Unterhautzellgewebes.
Gelegentlich: Urtikaria, Hautausschlag.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Arthralgie.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Reaktionen an der Injektionsstelle.
Beschreibung ausgewählter unerwünschter Wirkungen
Transaminasen, Bilirubin erhöht
In zwei klinischen Phase-III-Studien zu Psoriasis-Arthritis wurde in der mit Tremfya behandelten Gruppe in der placebokontrollierten Phase erhöhte Transaminasen (einschließlich Alanin-Aminotransferase (ALT) erhöht, Aspartat-Aminotransferase (AST) erhöht, hepatisches Enzym erhöht, Transaminasen erhöht, Leberfunktionstest abnormal, Hypertransaminasämie) als unerwünschte Wirkung häufiger berichtet (8,4%) als in der Placebogruppe (4,6%). Über einen Zeitraum von 1 Jahr wurden bei 12,3% der Patienten in der mit Tremfya behandelten Gruppe unerwünschte Ereignisse mit erhöhten Transaminasen berichtet. In den meisten Fällen war die Erhöhung der Transaminasen leicht und vorübergehend und führte nicht zum Abbruch der Behandlung. Basierend auf Laborwerten wurden in der mit Tremfya behandelten Gruppe während des gesamten placebokontrollierten Zeitraums ebenfalls Erhöhungen des Bilirubins häufiger berichtet (5.8%) als in der Placebogruppe (2.2%). Es wurden keine Erhöhungen von mehr als dem 3-fachen der oberen Normgrenze beobachtet. Die Bilirubinerhöhungen waren im Allgemeinen nicht mit einem Anstieg des direkten Bilirubins verbunden. Über einen Zeitraum von 1 Jahr wurden bei 6,8% der Patienten in der mit Tremfya behandelten Gruppe unerwünschte Ereignisse mit erhöhtem Bilirubin berichtet.
Anzahl der Neutrophilen verringert
In zwei klinischen Phase-III-Studien zu Psoriasis-Arthritis wurde in der mit Tremfya behandelten Gruppe in der placebokontrollierten Phase häufiger von einer verringerten Anzahl der Neutrophilen als unerwünschtes Ereignis berichtet (0,9%) als in der Placebogruppe (0%). Über einen Zeitraum von 1 Jahr wurden bei 0,9 % der Patienten in der mit Tremfya behandelten Gruppe unerwünschte Wirkungen mit verringerten Anzahl der Neutrophilen berichtet. In den meisten Fällen war die Verringerung der Neutrophilenzahl im Blut leicht und vorübergehend, nicht mit einer Infektion assoziiert und führte nicht zum Abbruch der Behandlung.
Gastroenteritis
In zwei klinischen Phase-III-Studien trat Gastroenteritis während der placebokontrollierten Periode in der mit TREMFYA behandelten Gruppe häufiger auf (1,1%) als in der Placebogruppe (0,7%). Bis Woche 156 berichteten 4,9% aller mit TREMFYA behandelten Patienten über Gastroenteritis. Unerwünschte Ereignisse in Form von Gastroenteritis waren nicht schwerwiegend und führten nicht zum Absetzen von TREMFYA bis zu Woche 48.
Reaktionen an der Injektionsstelle
In zwei klinischen Phase-III-Studien traten bis Woche 48 bei 0.7% der TREMFYA-Injektionen und bei 0,3% der Placebo-Injektionen Reaktionen an der Injektionsstelle auf. Bis Woche 156 waren 0,5% der TREMFYA-Injektionen mit Reaktionen an der Injektionsstelle assoziiert. Unerwünschte Wirkungen in Form von Erythem an der Injektionsstelle und Schmerzen an der Injektionsstelle waren die am meisten berichteten Ereignisse von Reaktionen an der Injektionsstelle und alle waren von leichter bis mittelschwerer Ausprägung. Keines der Ereignisse war schwerwiegend und keines führte zum Absetzen von TREMFYA.
Immunogenität
Gepoolte Phase-II- und Phase-III-Analysen bei Patienten mit Psoriasis und Psoriasis-Arthritis zeigten, dass während einer bis zu 52-wöchigen Behandlung 5% (n=145) der mit TREMFYA behandelten Patienten Antikörper gegen das Arzneimittel entwickelten. Von den Patienten, die Antikörper gegen das Arzneimittel entwickelten, hatten ungefähr 8% (n=12) Antikörper, die als neutralisierend eingestuft wurden, was 0,4% aller mit TREMFYA behandelten Patienten entspricht. In gepoolten Phase-III-Analysen in bis zu 156 Behandlungswochen entwickelten etwa 9% der mit TREMFYA behandelten Patienten Antikörper gegen das Arzneimittel. Zu den möglichen Auswirkungen von Antikörpern gegen das Arzneimittel auf die Wirksamkeit und Sicherheit sind aufgrund der geringen Häufigkeit einer Immunogenität keine schlüssigen Aussagen möglich.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Intravenöse Einzeldosen von bis zu 987 mg (10 mg/kg) Guselkumab wurden an gesunde freiwillige Probanden verabreicht, und subkutane Einzeldosen von bis zu 300 mg Guselkumab wurden an Patienten mit Plaque-Psoriasis in klinischen Studien verabreicht, ohne dass eine dosislimitierende Toxizität beobachtet wurde. Im Falle einer Überdosierung ist der Patient auf Anzeichen und Symptome unerwünschter Wirkungen zu überwachen, und es ist unverzüglich eine geeignete symptomatische Behandlung einzuleiten.
Eigenschaften/Wirkungen
ATC-Code
L04AC16
Wirkungsmechanismus
Guselkumab ist ein humaner IgG1λ-mAb, der mit hoher Spezifität und Affinität selektiv an das Interleukin-23 (IL-23)-Protein bindet. IL-23 beeinflusst unter anderem die Differenzierung, Expansion und das Überleben von T-Zell-Untergruppen (z.B. Th17-Zellen) und von Untergruppen der angeborenen Immunzellen sowie die Freisetzung der entzündungsfördernder Zytokine IL-17A, IL-17F und IL-22. Beim Menschen wurde gezeigt, dass die selektive Blockade von IL-23 die Produktion dieser Zytokine eindämmt.
In In-vitro- Modellen wurde gezeigt, dass Guselkumab die Bioaktivität von IL-23 hemmt, indem es dessen Interaktion mit dem IL-23-Rezeptor an der Zelloberfläche blockiert und somit durch IL-23 vermittelte Signal-, Aktivierungs- und Zytokinkaskaden unterbricht.
Plaque-Psoriasis
In der Haut von Patienten mit Plaque-Psoriasis sind die IL-23-Konzentrationen erhöht. Guselkumab bewirkt durch die Inhibition des Zytokin IL-23-Signalwegs klinische Effekte bei Plaque-Psoriasis durch die Modulierung von Genexpressionsmustern in den betroffenen Hautarealen. Diese lokalen Effekte führen zu einer der Reduktion von Epidermisdicke und T-Zell-Dichte. Zusätzlich wurden in Phase-II- und Phase-III-Studien bei Plaque-Psoriasis bei mit Guselkumab behandelten Patienten im Vergleich zu Placebo reduzierte Serumkonzentrationen von IL-17A, IL-17F und IL-22 beobachtet.
Psoriasis Arthritis
In Phase-III-Studien bei Patienten mit Psoriasis-Arthritis waren die Serumspiegel der Akuten-Phase-Proteine C-reaktives Protein, Serumamyloid A und IL-6 und Th17 Effektorzytokine IL-17A, IL-17F und IL-22 zu Studienbeginn erhöht. Guselkumab senkte den Gehalt dieser Proteine innerhalb von 4 Wochen nach Beginn der Behandlung. Guselkumab reduzierte den Gehalt dieser Proteine bis Woche 24 im Vergleich zur Baseline und auch zum Placebo weiter.
Pharmakodynamik
Siehe Wirkungsmechanismus.
Klinische Wirksamkeit
Plaque-Psoriasis
Die Wirksamkeit und Sicherheit von Guselkumab wurde geprüft in vier randomisierten, doppelblinden, placebo- und/oder aktiv-kontrollierten Phase-III-Studien bei erwachsenen Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis, die Kandidaten für Phototherapie oder systemische Therapie waren. Zwei Studien (VOYAGE 1 und VOYAGE 2) beurteilten die Wirksamkeit und Sicherheit von Guselkumab versus Placebo und Adalimumab bei 1829 erwachsenen Patienten. In VOYAGE 2 wurde zudem in Woche 28 bei Patienten mit erfolgreichem Ansprechen das Absetzen von Guselkumab und die Wiederbehandlung im Vergleich zur kontinuierlichen Weiterbehandlung untersucht. Patienten, die schon einmal mit Guselkumab oder Adalimumab behandelt worden waren, sowie Patienten mit erythrodermischer Psoriasis, Psoriasis guttata oder pustulöser Psoriasis waren von der Teilnahme an den Studien VOYAGE 1 und VOYAGE 2 ausgeschlossen. Eine weitere Studie (NAVIGATE) beurteilte die Wirksamkeit und Sicherheit von Guselkumab versus Ustekinumab bei 268 erwachsenen Patienten, die ungenügend auf Ustekinumab ansprachen.
In der klinischen Studie (ORION) wurden die Wirksamkeit, Sicherheit, PK, Immunogenität, Anwendbarkeit und Akzeptanz von per Fertigpen abgegebenem Guselkumab beurteilt.
VOYAGE 1 und VOYAGE 2
Patienten, die zu Guselkumab randomisiert wurden, erhielten 100 mg in Woche 0 und 4 und danach alle 8 Wochen bis zu Woche 48 (VOYAGE 1) und Woche 20 (VOYAGE 2). Patienten, die zu Adalimumab randomisiert wurden, erhielten 80 mg in Woche 0 und 40 mg in Woche 1, gefolgt von 40 mg alle 2 Wochen bis zu Woche 48 (VOYAGE 1) bzw. Woche 23 (VOYAGE 2). In beiden Studien erhielten die zu Placebo randomisierten Patienten in Woche 16, 20 und danach alle 8 Wochen 100 mg Guselkumab. In der VOYAGE 1 erhielten alle Patienten, einschliesslich derer, die in Woche 0 in die Adalimumab-Gruppe randomisiert worden waren, in Woche 52 und danach alle 8 Wochen unverblindet 100 mg Guselkumab. In VOYAGE 2 wurden Patienten, die in Woche 0 zu Guselkumab randomisiert worden waren und in Woche 28 eine Verbesserung des Psoriasis Area and Severity Index (PASI) von mindestens 90% (PASI-90-Ansprechen) erreichten, erneut randomisiert: entweder zur Fortsetzung der Behandlung mit Guselkumab alle 8 Wochen (Erhaltungstherapie) oder zur Gabe von Placebo (Absetzen). Die Patienten in der letzten Gruppe (Rerandomisierung nach Placebo) wurden nach Verlust von mindestens 50% ihrer PASI-Verbesserung in Woche 28 erneut mit Guselkumab behandelt (Dosierung zum Zeitpunkt der erneuten Behandlung sowie 4 Wochen später und danach alle 8 Wochen). Patienten ohne PASI-90-Ansprechen aus der Guselkumab-Gruppe setzten die Behandlung mit Guselkumab fort. Bei Patienten, die zu Adalimumab randomisiert worden waren und in Woche 28 ein PASI-90-Ansprechen aufwiesen, wurde die Behandlung abgesetzt und die Behandlung mit Guselkumab eingeleitet, wenn in Woche 28 ein Verlust der PASI-Verbesserung um mindestens 50% festgestellt wurde. Patienten, die in Woche 0 in die Adalimumab-Gruppe randomisiert worden waren und PASI90-Non-Responder waren, erhielten in den Wochen 28, 32 und danach alle 8 Wochen Guselkumab. Alle Teilnehmer erhielten ab Woche 76 alle 8 Wochen unverblindet Guselkumab.
Die Krankheits-Charakteristika bei Baseline der Studienpopulationen in VOYAGE 1 und 2 waren vergleichbar: im Mittel betrug der Anteil der betroffenen Körperoberfläche (BSA) 22% bzw. 24%, der mediane Baseline-PASI-Score betrug 19 in beiden Studien, der Baseline-IGA-Score (Investigator's Global Assessment, Gesamtbeurteilung durch den Prüfarzt) war «mittelschwer» bzw. «schwer» bei 74,6% und 75,5% bzw. 25,1% und 24,5% der Patienten. 19% bzw. 18% der Patienten hatten eine Vorgeschichte einer Psoriasis-Arthritis.
Von allen in VOYAGE 1 und 2 aufgenommenen Patienten hatten 32% bzw. 29% vorher noch nie eine konventionelle systemische Therapie und auch keine Biologika-Therapie erhalten; 54% bzw. 57% hatten vorher schon Phototherapie und 62% bzw. 64% schon eine konventionelle systemische Therapie erhalten. In beiden Studien hatten 21% der Patienten vorher schon eine Biologika-Therapie erhalten; diese umfassten 11%, die mindestens einen Anti-Tumornekrosefaktor-alpha (TNF-α)-Wirkstoff, und rund 10%, die einen Anti-IL-12/IL-23-Wirkstoff erhalten hatten.
Eine Begleitbehandlung mit einer topischen oder systemischen Therapie oder Phototherapie gegen Psoriasis war in der Studie nicht zulässig.
Die Wirksamkeit von Guselkumab wurde beurteilt in Bezug auf den Gesamtbefall der Haut, dem lokalisierten Befall der Kopfhaut, Hände, Füsse und Nägel sowie in Bezug auf die Lebensqualität. Die ko-primären Endpunkte in VOYAGE 1 und 2 waren der Prozentsatz von Patienten, die in Woche 16 einen IGA-Score «abgeheilt» oder «minimal» (IGA 0/1) bzw. ein PASI-90-Ansprechen erreichten Vergleich zu Placebo (siehe Tabelle 1).
Effekte auf die Hautsymptomatik
Die Behandlung mit Guselkumab bewirkte signifikante Verbesserungen der Parameter für die Krankheitsaktivität im Vergleich zu Placebo in Woche 16, und im Vergleich zu Adalimumab in Woche 16 bis 48. Die wichtigsten Wirksamkeitsergebnisse sind in Tabelle 1 unten aufgeführt.
Tabelle 1: Zusammenfassung des klinischen Ansprechens in VOYAGE 1 und VOYAGE 2
Anzahl Patienten (%) | ||||||
|---|---|---|---|---|---|---|
Placebo (n = 174) | VOYAGE 1 Guselkumab (n = 329) | Adalimumab (n = 334) | Placebo (n = 248) | VOYAGE 2 Guselkumab (n = 496) | Adalimumab (n = 248) | |
Woche 16 | ||||||
PASI 75 | 10 (5,7) | 300 (91,2)a | 244 (73,1)b | 20 (8,1) | 428 (86,3)a | 170 (68,5)b |
PASI 90 | 5 (2,9) | 241 (73,3)c | 166 (49,7)b | 6 (2,4) | 347 (70,0)c | 116 (46,8)b |
IGA 0/1 | 12 (6,9) | 280 (85,1)c | 220 (65,9)b | 21 (8,5) | 417 (84,1)c | 168 (67,7)b |
IGA 0 | 2 (1,1) | 157 (47,7)a | 88 (26,3)d | 2 (0,8) | 215 (43,3)a | 71 (28,6)d |
Woche 48 | ||||||
PASI 75 | - | 289 (87,8) | 209 (62,6)e | - | - | - |
PASI 90 | - | 251 (76,3) | 160 (47,9)b | - | - | - |
IGA 0/1 | - | 265 (80,5) | 185 (55,4)b | - | - | - |
IGA 0 | - | 166 (50,5) | 86 (25,7)b | - | - | - |
a p <0,001 für den Vergleich zwischen Guselkumab und Placebo.
b p <0,001 für den Vergleich zwischen Guselkumab und Adalimumab für wichtige sekundäre Endpunkte.
c p <0,001 für die Vergleiche zwischen Guselkumab und Placebo für die ko-primären Endpunkte.
d Vergleiche zwischen Guselkumab und Adalimumab wurden nicht durchgeführt.
e p <0,001 für den Vergleich zwischen Guselkumab und Adalimumab.
Es wurden auch Verbesserungen bei Nagel-Psoriasis, Befall der Kopfhaut und palmoplantaren Befall beobachtet, die in Woche 16 im Vergleich zu Placebo statistisch signifikant überlegen waren.
Ansprechen im Lauf der Zeit
Guselkumab zeigte eine schnell einsetzende Wirksamkeit, mit einer signifikant höheren prozentualen Verbesserung des PASI im Vergleich zu Placebo schon in Woche 2 (p <0,001); der Unterschied erreichte ein Maximum um Woche 20 (VOYAGE 1 und 2) und blieb bis Woche 48 (VOYAGE 1) erhalten.
Abbildung 1: Prozentsatz von Patienten, die bis Woche 48 ein PASI-90-Ansprechen erreichten, aufgegliedert nach Visite (Patienten randomisiert in Woche 0) in VOYAGE 1

In der VOYAGE 1 blieb das PASI-90-Ansprechen bei Patienten unter fortlaufender Behandlung mit Guselkumab in der unverblindeten Phase von Woche 52 bis Woche 156 in den meisten Fällen erhalten. Bei Patienten, die in Woche 0 in die Adalimumab-Gruppe randomisiert worden waren und in Woche 52 auf Guselkumab umgestellt wurden, erhöhte sich das PASI90-Ansprechen von Woche 52 bis einschliesslich Woche 76 und blieb bis Woche 156 erhalten.
Der Nachweis für die Wirksamkeit und Sicherheit von Guselkumab wurde unabhängig von Alter, Geschlecht, ethnischer Zugehörigkeit, Körpergewicht, Plaquelokalisation, PASI-Baseline-Schweregrad, gleichzeitig bestehender Psoriasis-Arthritis und vorheriger Behandlung mit einem Biologikum erbracht. Guselkumab war wirksam bei Patienten ohne frühere konventionelle systemische Therapie, bei Patienten ohne frühere Biologika-Therapie und bei Patienten mit früherer Biologika-Exposition.
Absetzen der Therapie und anschliessende Wiederaufnahme der Therapie
In VOYAGE 2 erreichten 88,6% der Patienten, die eine Guselkumab-Erhaltungstherapie erhielten, in Woche 48 ein PASI-90-Ansprechen, verglichen mit 36,8% der Patienten, bei denen in Woche 28 die Behandlung abgesetzt worden war (p <0,001). Ein Verlust des PASI-90-Ansprechens wurde schon 4 Wochen nach Absetzen der Guselkumab-Behandlung bei einer medianen Zeitspanne bis zum Verlust des PASI-90-Ansprechens von ungefähr 15 Wochen beobachtet. Von den Patienten, bei denen die Behandlung beendet und anschliessend wieder mit Guselkumab begonnen wurde, hatten 80% bei der Beurteilung 20 Wochen nach Beginn der Wiederbehandlung eine PASI90-Remission erzielt. In der VOYAGE 2 erzielten von 95 Patienten, die randomisiert Guselkumab erhielten und kein PASI90-Ansprechen in Woche 28 erzielten, 36% bzw. 41% ein PASI90-Ansprechen nach 20- bzw. 44-wöchiger Weiterbehandlung mit Guselkumab.
Behandlungsergebnisse in Bezug auf einzelne Krankheitsregionen
In den Studien VOYAGE 1 und VOYAGE 2 wurden bei Patienten unter Behandlung mit Guselkumab in Woche 16 signifikant stärkere Verbesserungen des Befalls der Kopfhaut (ss-IGA), des Befalls der Hände und Füsse (hf-PGA) und des Befalls der Nägel (NAPSI, f-PGA) festgestellt als bei den Patienten in der Placebogruppe.
Gesundheitsbezogene Lebensqualität/von Patienten berichtete Ergebnisse
In VOYAGE 1 und 2 zusammen wurden bei Guselkumab-Patienten signifikant grössere Verbesserungen bei der gesundheitsbezogenen Lebensqualität gemäss Dermatology Life Quality Index (DLQI) und bei den von Patienten berichteten Psoriasis-Symptomen (Juckreiz, Schmerzen, Brennen, Stechen und Spannen der Haut) und Anzeichen (Hauttrockenheit, Risse, Schuppung, Hautablösung oder Abblättern, Rötung und Bluten) gemäss dem Tagebuch Psoriasis Symptoms and Signs Diary (PSSD) beobachtet, verglichen mit Placebo-Patienten in Woche 16.
NAVIGATE
Die Studie NAVIGATE untersuchte die Wirksamkeit von Guselkumab bei Patienten, die in Woche 16 ungenügend auf Ustekinumab angesprochen hatten (d.h. die kein Ansprechen der Qualität «abgeheilt» oder «minimal» erreichten, definiert als IGA ≥2). Die Patienten durften keine frühere Vortherapie mit Guselkumab und/oder Ustekinumab erhalten haben. Alle Patienten erhielten unverblindet Ustekinumab in Woche 0 und 4. In Woche 16 wurden 268 Patienten mit einem IGA-Score ≥2 randomisiert: entweder zur Weiterführung der Ustekinumab-Behandlung alle 12 Wochen oder zur Einleitung der Guselkumab-Behandlung in Woche 16, 20 und danach alle 8 Wochen. Die Charakteristika bei Baseline für die randomisierten Patienten waren ähnlich wie die in VOYAGE 1 und 2 beobachteten.
12 Wochen nach der Randomisierung wies ein höherer Anteil von Guselkumab-Patienten als Ustekinumab-Patienten einen IGA-Score 0/1 und Verbesserung von ≥2 Skalenstufen (31,1% vs. 14,3%, p = 0,001) und ein PASI-90-Ansprechen (48% vs. 23%, p <0,001) auf. Zum Wechsel in umgekehrter Richtung von Guselkumab zu Ustekinumab sind keine Daten verfügbar.
ORION
In der ORION-Studie wurden die Wirksamkeit, Sicherheit, PK, Immunogenität, Anwendbarkeit und Akzeptanz von per Fertigpen abgegebenem Guselkumab beurteilt. In dieser Studie wurden 78 Patienten mit mittelschwerer bis schwerer Plaques Psoriasis randomisiert, um entweder TREMFYA (100 mg in den Wochen 0 und 4 und danach alle 8 Wochen) oder ein Placebo zu erhalten. Die Studienpopulation in der ORION Studie war vergleichbar mit der Studienpopulation in VOYAGE 1 und 2. Die Wirksamkeit, gemessen an IGA-Score (0,1) und PASI 90 in Woche 16 war in den drei Studien ORION, VOYAGE 1 und 2 vergleichbar. Die Patientenakzeptanz und sichere Anwendung des Pens wurden belegt.
ECLIPSE
Die Wirksamkeit und Sicherheit von Guselkumab wurde auch in einer Doppelblindstudie im Vergleich zu Secukinumab untersucht. Die Patienten erhielten randomisiert Guselkumab (N = 534; 100 mg in den Wochen 0, 4 und danach alle 8 Wochen) oder Secukinumab (N = 514; 300 mg in den Wochen 0, 1, 2, 3, 4 und danach alle 4 Wochen). Die letzte Dosisgabe erfolgte in beiden Behandlungsgruppen in Woche 44.
Guselkumab war in Bezug auf den primären Endpunkt des PASI90-Ansprechens in Woche 48 gegenüber Secukinumab überlegen (84,5% gegenüber 70,0%, p < 0,001).
Psoriasis-Arthritis (PsA)
Es wurde gezeigt, dass Guselkumab Anzeichen und Symptome, die körperliche Funktion und die gesundheitsbezogene Lebensqualität verbessert.
DISCOVER 1 und DISCOVER 2
In zwei randomisierten, doppelblinden, placebokontrollierten Phase-III-Studien (DISCOVER 1 und DISCOVER 2) wurden die Wirksamkeit und Sicherheit von Guselkumab im Vergleich zu einem Placebo bei erwachsenen Patienten mit aktiver PsA (≥3 geschwollene und ≥3 druckempfindliche Gelenke und eine Konzentration des C-reaktiven Proteins (CRP) von ≥0,3 mg/dl in der DISCOVER 1 sowie ≥5 geschwollene und ≥5 druckempfindliche Gelenke und eine CRP-Konzentration von ≥0,6 mg/dl in der DISCOVER 2) trotz Anwendung einer Therapie mit einem konventionellen synthetischen (cs) DMARD, Apremilast oder einem nichtsteroidalen Antirheumatikum bewertet. Die Patienten in diesen Studien hatten eine diagnostizierte PsA auf Basis der Klassifikationskriterien für Psoriasis-Arthritis [CASPAR]) mit einer medianen Dauer von 4 Jahren. In beiden Studien waren Patienten mit verschiedenen Unterformen von PsA aufgenommen worden, einschliesslich polyartikulärer Arthritis ohne Vorliegen von Rheumaknoten (40%), Spondylitis mit peripherer Arthritis (30%), asymmetrischer peripherer Arthritis (23%), Einbeziehung der distalen Interphalangealgelenke (7%) und Arthritis mutilans (1%). Aufgrund der wenigen Studienpatienten mit Arthritis mutilans (N=6) sind schlüssige Aussagen zur Wirksamkeit und Sicherheit zu dieser Subgruppe nicht möglich. Bei über 65% und 42% der Patienten lag zu Beginn der Studie eine Enthesitis bzw. Daktylitis vor, und bei über 75% der Patienten waren ≥3% der Körperoberfläche (BSA) von der Psoriasis betroffen. In den Studien DISCOVER 1 und DISCOVER 2 wurden 381 bzw. 739 Patienten bewertet, die eine Behandlung mit 100 mg Guselkumab in Woche 0 und 4 und danach alle 8 Wochen (q8w) oder mit 100 mg Guselkumab q4w oder Placebo erhielten. In Woche 24 erhielten die Patienten, welche Placebo bekamen, Guselkumab 100 mg alle vier Wochen in beiden Studien. Ungefähr 58% der Patienten in beiden Studien erhielten kontinuierlich stabile Dosen von MTX (≤25 mg/Woche).
In beiden Studien war bei über 90% der Patienten vorgängig bereits ein csDMARD angewendet worden. In der Studie DISCOVER 1 hatten 31% der Patienten vorgängig eine biologische Anti-TNFα-Behandlung erhalten. In der Studie DISCOVER 2 war keiner der Patienten vorgängig mit einem Biologikum behandelt worden.
Anzeichen und Symptome
Die Behandlung mit Guselkumab hatte in Woche 24 im Vergleich zu Placebo zu signifikanten Verbesserungen der Indikatoren für die Krankheitsaktivität geführt. Der primäre Endpunkt in beiden Studien war der prozentuale Anteil der Patienten mit einem American College of Rheumatology(ACR)20-Ansprechen in Woche 24. Zwischen den Erhaltungstherapien mit Guselkumab 100 mg alle 4 Wochen bzw. alle 8 Wochen waren betreffend Wirksamkeit keine klinisch relevanten Unterschiede erkennbar. In Tabelle 2 sind die wichtigsten Wirksamkeitsergebnisse gezeigt.
Tabelle 2: Klinisches Ansprechen in der DISCOVER 1 und der DISCOVER 2
DISCOVER 1 i | DISCOVER 2 j | |||
Placebo | 100 mg q8w | Placebo | 100 mg q8w | |
(N=126) | (N=127) | (N=246) | (N=248) | |
ACR20-Ansprechen | ||||
Woche 16 | 25.40% | 52.0% b | 33.70% | 55.2% g |
Woche 24 | 22.20% | 52.0% a | 32.90% | 64.1% a |
ACR50-Ansprechen | ||||
Woche 16 | 12.70% | 22.8% d | 9.30% | 28.6% g |
Woche 24 | 8.70% | 29.9% b | 14.20% | 31.5% g |
ACR70-Ansprechen | ||||
Woche 24 | 5.60% | 11.8% d | 4.10% | 18.5% g |
DAS 28 (CRP)-LS mean Veränderung gegenüber Baseline | ||||
Woche 24 c | -0.70 | -1.43 b | -0.97 | -1.59 b |
a p < 0,001 (primärer Endpunkt)
b p < 0,001 (wichtiger sekundärer Endpunkt)
c p = 0,006 (wichtiger sekundärer Endpunkt)
d nicht statistisch signifikant p=0,086 (wichtiger sekundärer Endpunkt)
f nominal p < 0,012
g Es wurde keine formelle Prüfung im Rahmen des hierarchischen Prüfverfahrens durchgeführt, nominal p < 0,001 (wichtiger sekundärer Endpunkt)
i einschließlich >90% der Patienten mit früherer csDMARD-Behandlung
j einschließlich 31% der Patienten mit vorheriger biologischer Anti-TNFα-Behandlung
Bei Patienten mit aktiver PsA mit ≥3% BSA-Psoriasis-Beteiligung und einem IGA-Score ≥2 zu Studienbeginn wurden in der Guselkumab-q8w-Gruppe im Vergleich zu Placebo signifikante Verbesserungen der Hautkrankheit beobachtet, ähnlich wie in den Psoriasis-Studien VOYAGE 1 und VOYAGE 2.
Ansprechen im Zeitverlauf
In der Studie DISCOVER 2 wurde in beiden Guselkumab-Gruppen bereits in Woche 4 im Vergleich zu Placebo ein stärkeres ACR20-Ansprechen festgestellt, und der Behandlungsunterschied verstärkte sich im Zeitverlauf bis zum Ende der Woche 24 (Abb. 2).
Abb. 2: ACR20-Ansprechen nach Besuch bis zum Ende der Woche 24 in der DISCOVER 2

Das in den Guselkumab-Gruppen festgestellte Ansprechen war ähnlich, unabhängig von der begleitenden Anwendung eines csDMARD, einschliesslich MTX (DISCOVER 1 und 2). Darüber hinaus ergaben sich bei der Untersuchung von Alter, Geschlecht, Ethnie, Körpergewicht und vorgängiger csDMARD-Anwendung (DISCOVER 1 und 2) und vorgängiger Anwendung von biologischen Anti-TNFα (DISCOVER 1) keine Unterschiede zwischen diesen Teilgruppen hinsichtlich des Ansprechens auf Guselkumab.
Das klinische Ansprechen wurde bis zur 52. Woche aufrechterhalten, wie die Ansprechraten nach ACR 20/50/70 und DAS 28 (CRP) zeigen.
Es gab zu wenige PsA-Patienten mit Arthritis mutilans, um eine aussagekräftige Beurteilung zu machen.
In den Studien DISCOVER 1 und 2 zeigten sich Verbesserungen in allen Komponenten der ACR-Scores, einschliesslich der Schmerzbewertung durch die Patienten.
Die Beurteilung von Daktylitis und Enthesitis wurde auf der Grundlage gepoolter Daten der Patienten mit einer Daktylitis bzw. Enthesitis aus den Studien DISCOVER 1 und 2 durchgeführt (N=160 bzw. 230). Der Anteil der Teilnehmer mit Daktylitis zur Baseline und abgeklungener Daktylitis in Woche 24 war in den mit Guselkumab q8w behandelten Gruppen grösser (59,4%, nominal p<0,001 als bei Placebogabe (42,2%). Der Anteil der Teilnehmer mit Enthesitis zur Baseline und abgeklungener Enthesitis in Woche 24 war in den mit Guselkumab q8w Gruppe grösser (49,6%, nominal p<0,001) als bei Placebogabe (29,4%). In Woche 52 wurden in der Guselkumab-q8w-Gruppe die Abklingung der Dactylitis (81,2%) und die Abklingung der Enthesitis (62,7%) aufrechterhalten.
Radiographisches Ansprechen
In der Studie DISCOVER 2 wurde die Hemmung der Progression der Strukturschädigung radiographisch gemessen und als Veränderung des modifizierten van der Heijde-Sharp (vdH-S)-Scores gegenüber dem Baseline-Wert dargestellt. In Woche 24 zeigte die Guselkumab-q8w-Gruppe numerisch weniger Progression als Placebo (kleinste quadratische Mittelwertänderung (Least square mean change) gegenüber dem Ausgangswert von 0,52 bzw. 0,95, p=0,068). In Woche 52 betrug die mittlere Veränderung gegenüber dem Ausgangswert für die Guselkumab-q8w-Gruppe 0,97.
Körperliche Funktion und gesundheitsbezogene Lebensqualität
In den Studien DISCOVER 1 und 2 zeigten mit Guselkumab behandelte Patienten in Woche 24 bei Beurteilung anhand des Fragebogens zur Beurteilung der Gesundheit-Behinderungsindex (Health Assessment Questionnaire-Disability Index, HAQ-DI) eine signifikante Verbesserung (p<0,001) der körperlichen Funktion im Vergleich zu Placebo. Die Verbesserungen des HAQ-DI wurden von Woche 24 bis Woche 52 beibehalten.
Pharmakokinetik
Absorption
Nach einer subkutan verabreichten Einzeldosis von 100 mg an gesunde Probanden erreichte Guselkumab ungefähr 5,5 Tage nach Verabreichung eine mittlere (± SD) maximale Serumkonzentration (Cmax) von 8,09 ± 3,68 µg/ml.
Steady-State-Serumkonzentrationen von Guselkumab nach subkutanen Verabreichungen von 100 mg Guselkumab in Woche 0 und 4 und danach alle 8 Wochen wurden um Woche 20 erzielt. Die mittleren (± SD) Serum-Talkonzentrationen von Guselkumab im Steady-State (Woche 20) in zwei Phase-III-Studien bei Patienten mit Plaque-Psoriasis betrugen 1,15 ± 0,73 µg/ml bzw. 1,23 ± 0,84 µg/ml.
Die Pharmakokinetik von Guselkumab bei Patienten mit Psoriasis-Arthritis war ähnlich wie bei Patienten mit Psoriasis. Nach subkutaner Gabe von 100 mg Tremfya in Woche 0 und 4 und danach alle 8 Wochen betrug die mittlere Serum-Talkonzentration von Guselkumab im Steady-State ebenfalls ungefähr 1,2 µg/ml. Nach subkutaner Gabe von 100 mg Tremfya alle 4 Wochen betrug die mittlere Serum-Talkonzentration von Guselkumab im Steady-State ungefähr 3,8 µg/ml.
Die absolute Bioverfügbarkeit von Guselkumab nach einer subkutan in den Oberschenkel verabreichten Einzeldosis von 100 mg wurde bei gesunden Probanden auf ungefähr 49% geschätzt.
Distribution
Das mittlere Verteilungsvolumen während der terminalen Phase (Vz) nach einer intravenös verabreichten Einzeldosis an gesunde Probanden betrug in allen Studien ungefähr 7 bis 10 l.
Metabolismus
Der genaue Stoffwechselweg, durch den Guselkumab metabolisiert wird, ist noch nicht charakterisiert worden. Da Guselkumab ein humaner IgG-mAb ist, wird erwartet, dass es gleich wie endogenes IgG über katabole Stoffwechselwege zu kleinen Peptiden und Aminosäuren abgebaut wird.
Elimination
Die mittlere systemische Clearance (CL) nach einer intravenös verabreichten Einzeldosis an gesunde Probanden lag in allen Studien im Bereich von 0,288 bis 0,479 l/Tag. Die mittlere Halbwertszeit (t½) von Guselkumab betrug ungefähr 17 Tage bei gesunden Probanden und ungefähr 15 bis 18 Tage bei Patienten mit Plaque-Psoriasis in den Studien.
Populations-Pharmakokinetik-Analysen ergaben, dass die gleichzeitige Anwendung von NSARs, oralen Kortikosteroiden und csDMARDs wie Methotrexat keine Auswirkungen auf die Clearance von Guselkumab hatte.
Linearität/Nicht Linearität
Die Zunahme der systemischen Exposition gegenüber Guselkumab (Cmax und AUC) verlief ungefähr dosisproportional nach einer subkutan verabreichten Einzeldosis in Dosierungen im Bereich von 10 mg bis 300 mg an gesunde Probanden oder Patienten mit Plaque-Psoriasis.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen/Nierenfunktionsstörungen
Es wurden keine spezifischen Studien durchgeführt, um die Auswirkungen einer eingeschränkten Nieren- oder Leberfunktion auf die Pharmakokinetik von Guselkumab zu ermitteln. Es ist zu erwarten, dass die renale Elimination von intaktem Guselkumab, einem IgG-mAb, niedrig und von geringer Bedeutung ist; ebenso ist zu erwarten, dass eine eingeschränkte Leberfunktion die Clearance von Guselkumab nicht beeinflussen wird, da IgG-mAbs hauptsächlich via intrazellulären Katabolismus eliminiert werden.
Ältere Patienten
Populations-Pharmakokinetik-Analysen bei Patienten mit Plaque-Psoriasis und Psoriasis-Arthritis zeigten, dass es keine offensichtlichen Veränderungen gab in der CL/F-Schätzung bei Patienten im Alter von ≥65 Jahren verglichen mit Patienten im Alter von <65 Jahren, was darauf hindeutet, dass für ältere Patienten keine Dosisanpassungen erforderlich sind.
Präklinische Daten
Basierend auf konventionellen Studien zur Sicherheitspharmakologie, zur Toxizität bei wiederholter Verabreichung und zur Toxizität hinsichtlich Reproduktion weisen die präklinischen Daten auf keine besonderen Gefahren für den Menschen hin.
Toxizität bei wiederholter Verabreichung
In Studien zur Toxizität bei wiederholter Verabreichung bei Javaneraffen wurde Guselkumab gut toleriert bei intravenöser und subkutaner Verabreichung in Dosen von bis zu 50 mg/kg/Woche während bis zu 5 Wochen i.v. und 24 Wochen s.c. Ausserdem wurden keine unerwünschten pharmakologischen Wirkungen bezüglich Immunotoxizität oder kardiovaskulärer Sicherheit beobachtet während der Durchführung der Studien zur Toxizität bei wiederholter Verabreichung oder einer gezielten pharmakologischen Studie zur kardiovaskulären Sicherheit bei Javaneraffen.
Reproduktionstoxizität
In einer Studie zur kombinierten Untersuchung der Toxizität während der embryofötalen Entwicklung und der prä- und postnatalen Entwicklung erhielten trächtige Javaneraffen (19, 20 bzw. 20 Tiere in den Gruppen, die 0, 10 bzw. 50 mg/kg erhielten) ab dem Beginn der Organogenese bis zum Gebären wöchentliche subkutane Dosen von Guselkumab. Bei einer postnatalen Messung an Tag 28 war Guselkumab in der Muttermilch von Javaneraffen nicht nachweisbar. Bei 1 von 16 Affen in der Kontrollgruppe und bei 3 von 14 Affen in jeder Gruppe, die Guselkumab erhalten hatten, traten unter den Jungen neonatale Todesfälle auf (die Cmax- und AUClast-Werte waren gegenüber den Konzentrationen beim Menschen um das 31- bzw. 8-Fache erhöht). Diese neonatalen Todesfälle wurden einer Vernachlässigung durch die Mutter, einem Trauma oder einer Früh- oder Spätgeburt zugeschrieben, wenngleich ein wirkstoffbedingter Einfluss nicht auszuschliessen war. Bei allen Dosisstufen wurden ausserdem fötale Verluste (Spontanaborte, einschliesslich Totgeburten) beobachtet, die alle innerhalb des historischen Kontrollbereichs in der Prüfeinrichtung lagen, bei denen aber ein wirkstoffbedingter Einfluss nicht auszuschliessen war. Die klinische Relevanz dieser Befunde ist nicht bekannt. Es wurden keine Guselkumab-bedingten Einflüsse auf die funktionelle oder immunologische Entwicklung der Jungtiere ab der Geburt bis zum Alter von 6 Monaten festgestellt.
Es wurden keine präneoplastischen Veränderungen festgestellt bei der histopathologischen Untersuchung von Tieren, die bis zu 24 Wochen behandelt worden waren, oder nach der 12-wöchigen Erholungsphase, während der das Arzneimittel im Serum nachweisbar war. Die Dosisniveaus in tierexperimentellen Studien waren ungefähr bis zu 45-fach höher als die Dosis von 100 mg, die für die Verabreichung an Patienten mit Plaque-Psoriasis vorgesehen ist (basierend auf einem Patienten von 90 kg Körpergewicht), und sie resultierten bei den Affen in maximalen Serumkonzentrationen, die mehr als 100-fach höher waren als die beim Menschen beobachteten.
Mutagenität/Karzinogenität
Es wurden mit Guselkumab keine Studien zur Mutagenität oder Karzinogenität durchgeführt.
Sonstige Hinweise
Inkompatibilitäten
Da keine Verträglichkeitsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Ausser Reichweite von Kindern aufbewahren.
Im Kühlschrank (2-8 °C) aufbewahren. Nicht einfrieren.
Die Fertigspritze und den Fertigpen im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Hinweise für die Handhabung
Nach der Entnahme von TREMFYA aus dem Kühlschrank, ist die Fertigspritze oder der Fertigpen im Umkarton zu belassen und bis zur Injektion 30 Minuten zu warten, damit die Lösung Raumtemperatur annehmen kann. Die Fertigspritze oder den Fertigpen nicht schütteln.
Vor Gebrauch wird eine Sichtkontrolle der Fertigspritze oder des Fertigpens empfohlen. Die Lösung sollte klar, farblos bis hellgelb sein und kann ein paar kleine, weisse oder durchsichtige Eiweisspartikel enthalten. TREMFYA sollte nicht verwendet werden, wenn die Lösung trüb oder verfärbt ist oder grosse Partikel enthält.
Jede TREMFYA-Packung enthält eine separate Broschüre «Gebrauchsanweisung» mit einer vollständigen Beschreibung der Vorbereitung und Anwendung der Fertigspritze oder des Fertigpens.
TREMFYA enthält keine Konservierungsmittel; deshalb sind in der Spritze oder dem Pen verbleibende nicht verwendete Reste des Arzneimittels zu verwerfen.
Nicht verwendetes Arzneimittel und/oder das Abfallmaterial sind entsprechend den nationalen Anforderungen zu entsorgen.
TREMFYA wird angeboten als sterile Lösung zur einmaligen Verwendung in
- einer 1 ml Fertigspritze aus Glas mit einer fixierten Nadel und einem latexfreien Nadelschutz, die in einer passiven Nadelschutzvorrichtung eingebaut ist.
- einer 1 ml Fertigspritze aus Glas, die in einem Fertigpen mit einem Nadelschutz eingebaut ist.
Zulassungsnummer
66583, 67490 (Swissmedic).
Zulassungsinhaberin
Janssen-Cilag AG, Zug, ZG.
Stand der Information
Dezember 2020.
Composition
Principes actifs
Guselkumab, produit par des cellules CHO (Chinese Hamster Ovary) génétiquement modifiées.
Excipients
L-histidine, monochlorhydrate de L-histidine monohydraté, polysorbate 80, saccharose, eau pour préparations injectables q.s. ad solutionem pour 1 ml.
Forme pharmaceutique et quantité de principe actif par unité
Solution injectable en seringue préremplie pour administration sous-cutanée:
Chaque seringue préremplie contient 100 mg de guselkumab dans 1 ml de solution.
Solution injectable en stylo prérempli pour administration sous-cutanée:
Chaque stylo prérempli contient 100 mg de guselkumab dans 1 ml de solution.
Indications/Possibilités d’emploi
Psoriasis en plaques
TREMFYA est indiqué dans le traitement de patients adultes atteints de psoriasis en plaques chronique, modéré à sévère, qui sont éligibles à un traitement systémique.
Arthrite psoriasique
TREMFYA est indiqué, seul ou en association avec le méthotrexate (MTX), dans le traitement de patients adultes atteints d'arthrite psoriasique active ayant présenté une réponse insuffisante à un traitement antérieur par un agent antirhumatismal de fond (DMARD) ou n'ayant pas toléré celui-ci (voir «Propriétés/Effets).
Posologie/Mode d’emploi
TREMFYA doit être utilisé sous la conduite et la surveillance d'un médecin expérimenté dans le diagnostic et le traitement des domaines thérapeutiques indiqués.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Posologie usuelle
Psoriasis en plaques
La dose recommandée de TREMFYA est de 100 mg en injection sous-cutanée aux semaines 0 et 4, suivie d'une dose d'entretien toutes les 8 semaines.
L'arrêt du traitement doit être envisagé chez les patients ne présentant pas de réponse au bout de 16 semaines de traitement.
Arthrite psoriasique
La dose recommandée de TREMFYA est de 100 mg en injection sous-cutanée aux semaines 0 et 4, suivie d'une dose d'entretien toutes les 8 semaines.
L'arrêt du traitement doit être envisagé chez les patients ne présentant pas de réponse au bout de 24 semaines de traitement.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
TREMFYA n'a pas été étudié chez cette population de patients. Aucune recommandation posologique ne peut être faite.
Patients présentant des troubles de la fonction rénale
TREMFYA n'a pas été étudié chez cette population de patients. Aucune recommandation posologique ne peut être faite.
Patients âgés
Aucune étude spécifique n'a été réalisée chez des patients âgés. Aucun ajustement de la posologie n'est recommandé chez les patients âgés.
Enfants et adolescents
La sécurité et l'efficacité de TREMFYA n'ont pas été évaluées chez les enfants et les adolescents de moins de 18 ans. Aucune donnée n'est disponible.
Mode d'administration:
TREMFYA doit être administré par voie sous-cutanée, dans l'abdomen ou la cuisse. Dans la mesure du possible, les zones cutanées présentant des signes de psoriasis ne doivent pas être utilisées comme sites d'injection.
Après une formation adaptée à la technique d'injection sous-cutanée, les patients peuvent s'injecter eux-mêmes TREMFYA si le médecin estime cela approprié. Cependant, le médecin doit assurer un suivi médical adéquat des patients. Les patients doivent être informés de la nécessité d'injecter la dose complète de TREMFYA conformément aux «Instructions d'utilisation» fournies séparément dans l'emballage. Pour des informations plus précises concernant la préparation et les précautions particulières de manipulation, voir «Remarques particulières: Remarques concernant la manipulation».
Contre-indications
Hypersensibilité sévère au principe actif ou à l'un des excipients selon la composition.
Infections actives cliniquement importantes (p.ex. tuberculose active).
Mises en garde et précautions
Infections
TREMFYA peut augmenter le risque d'infections. Chez les patients présentant une infection active cliniquement importante, le traitement par TREMFYA ne doit pas être instauré tant que l'infection n'est pas guérie ou convenablement traitée.
Dans les études cliniques, des infections sont survenues lors de psoriasis en plaques (23% vs 21% pour le placebo; ≤0,2% d'infections sévères dans les deux groupes) et lors d'arthrite psoriasique (21% dans les groupes TREMFYA et placebo; ≤0,8% d'infections sévères dans les deux groupes).
Les patients séropositifs au VHC ou au VIH, les patients pour lesquels le test de dépistage de l'hépatite B est positif et les patients ayant des antécédents d'infections chroniques ou récidivantes ont été exclus des études cliniques.
Les patients traités par TREMFYA doivent être informés de la nécessité de consulter un médecin en cas de survenue de signes ou de symptômes d'une infection aiguë ou chronique cliniquement importante. Si un patient développe une infection sévère ou cliniquement importante, ou ne répond pas à un traitement standard, il devra être étroitement surveillé et le traitement par TREMFYA devra être interrompu jusqu'à guérison de l'infection.
Dépistage de la tuberculose avant le traitement
Dans les études cliniques, les patients présentant une tuberculose (TB) latente et recevant simultanément un traitement par TREMFYA et une prophylaxie anti-TB appropriée n'ont pas développé de TB. Avant d'instaurer le traitement par TREMFYA, les patients doivent être examinés pour dépister une infection TB. Le traitement d'une TB latente doit être instauré avant d'administrer TREMFYA. Les patients recevant TREMFYA doivent être surveillés pendant et après le traitement afin de dépister des signes et des symptômes d'une TB active. TREMFYA ne doit pas être utilisé chez les patients présentant une TB active. Chez les patients présentant des antécédents de TB latente ou active pour lesquels le suivi d'un traitement adapté ne peut être confirmé, un traitement anti-TB devra être envisagé avant l'instauration d'un traitement par TREMFYA.
Tumeurs malignes
Dans les études cliniques, le traitement par TREMFYA n'a pas été associé à un risque accru d'affections malignes.
Les patients atteints de psoriasis ayant reçu auparavant un traitement UV devront faire l'objet d'un examen minutieux avant et pendant le traitement par TREMFYA afin de dépister la présence de tumeurs cutanées.
Traitement concomitant par d'autres immunosuppresseurs systémiques ou une photothérapie
La sécurité et l'efficacité de TREMFYA en association avec des immunosuppresseurs, y compris des agents biologiques, ou la photothérapie n'ont pas été évaluées.
Hypersensibilité
De graves réactions d'hypersensibilité, y compris anaphylaxie, ont été rapportées après la commercialisation. Certaines graves réactions d'hypersensibilité, dont des cas d'urticaire et de dyspnée, sont survenus plusieurs jours à plusieurs semaines après le traitement par le guselkumab. En cas de survenue d'une réaction d'hypersensibilité grave, l'administration de TREMFYA doit être immédiatement interrompue et un traitement approprié doit être instauré.
Immunisations
Avant d'instaurer le traitement par TREMFYA, la réalisation de toutes les vaccinations nécessaires doit être achevée conformément aux recommandations vaccinales en vigueur. Aucune donnée n'est disponible concernant la réponse et le maintien de la réponse aux vaccins inactivés qui ont été administrés avant ou pendant le traitement par TREMFYA. L'administration concomitante de TREMFYA et de vaccins vivants doit être évitée. Un délai suffisant entre des vaccinations avec des vaccins vivants et le début du traitement devra être respecté conformément aux recommandations vaccinales actuelles sur les principes actifs immunosuppresseurs.
Des informations pertinentes sur l'utilisation de principes actifs immunosuppresseurs avec des vaccins spécifiques sont également disponibles dans les informations professionnelles correspondantes.
Interactions
Dans une étude de phase I menée chez des sujets atteints de psoriasis en plaques modéré à sévère, les modifications de l'exposition systémique (Cmax et AUCinf) au midazolam, à la S-warfarine, à l'oméprazole, au dextrométhorphane et à la caféine, observées après une dose unique de guselkumab, n'étaient pas cliniquement significatives. Ceci indique que des interactions médicamenteuses entre le guselkumab et les substrats de différentes enzymes du CYP (CYP3A4, CYP2C9, CYP2C19, CYP2D6 et CYP1A2) sont peu probables. Aucun ajustement posologique n'est nécessaire en cas d'administration concomitante de guselkumab et de substrats du CYP450.
Comme aucune donnée n'est disponible concernant la réponse aux vaccins sous traitement par TREMFYA, l'administration concomitante de TREMFYA et de vaccins vivants doit être évitée (voir «Mises en garde et précautions»).
Grossesse/Allaitement
Femmes en âge de procréer
Les femmes en âge de procréer doivent utiliser des méthodes de contraception efficaces pendant le traitement et au moins 12 semaines après la fin de celui-ci.
Grossesse
Il n'existe pas de données concernant l'emploi du guselkumab chez la femme enceinte. Les expérimentations animales n'ont révélé aucune toxicité directe ou indirecte ayant une incidence sur la grossesse, le développement embryonnaire, le développement fœtal, l'accouchement ou le développement postnatal (voir «Données précliniques»). Par mesure de précaution, l'utilisation de TREMFYA doit être évitée pendant la grossesse.
Allaitement
On ignore si le guselkumab est excrété dans le lait maternel humain. Les IgG humaines sont connues pour être excrétées dans le lait maternel au cours des premiers jours suivant l'accouchement et pour diminuer à de faibles concentrations peu de temps après; par conséquent, un risque pour le nourrisson allaité ne peut être exclu pendant cette période. La décision d'interrompre le traitement par TREMFYA ou de s'abstenir d'instaurer le traitement doit être prise en prenant en compte le bénéfice de l'allaitement pour l'enfant au regard du bénéfice du traitement par TREMFYA pour la femme. Pour les informations relatives à l'excrétion du guselkumab dans le lait maternel chez l'animal, voir «Données précliniques».
Fertilité
Les effets du guselkumab sur la fertilité humaine n'ont pas été évalués. Les études effectuées chez l'animal n'ont pas mis en évidence d'effets délétères directs ou indirects sur la fertilité (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude correspondante n'a été effectuée.
Effets indésirables
Résumé du profil de sécurité
Le profil de sécurité de TREMFYA repose sur les données d'études de phase II et de phase III incluant 3940 patients, dont 2711 patients atteints de psoriasis en plaques ayant été traités par 100 mg de TREMFYA aux semaines 0 et 4, puis toutes les 8 semaines (q8s), et 1229 patients atteints d'arthrite psoriasique ayant été traités soit par 100 mg de TREMFYA aux semaines 0 et 4, puis q8s, soit par 100 mg de TREMFYA toutes les 4 semaines. Dans les études de phase II et de phase III portant sur le psoriasis en plaques et l'arthrite psoriasique, 2925 patients ont été exposés pendant au moins 1 an, et respectivement 1516 et 692 patients atteints de psoriasis pendant au moins 2 et 3 ans.
Les infections des voies respiratoires ont constitué l'effet indésirable (EI) le plus fréquent (13,9%).
Liste des effets indésirables
Les effets indésirables provenant d'études cliniques portant sur le psoriasis, d'études cliniques portant sur l'arthrite psoriasique et de l'expérience post-commercialisation sont présentés par classes de systèmes d'organes MedDRA et par fréquence, selon la convention suivante: très fréquents (≥1/10), fréquents (≥1/100 et <1/10), occasionnels (≥1/1000 et <1/100), rares (≥1/10'000 et <1/1000), très rares (≥1/10'000) et fréquence inconnue (ne peut être estimée sur la base des données disponibles).
Infections et infestations
Très fréquents: infections des voies respiratoires (13,9%).
Occasionnels: infections à Herpes simplex, dermatophytoses, gastroentérite.
Affections hématologiques et du système lymphatique
Occasionnels: neutropénie.
Affections du système immunitaire
Occasionnels: hypersensibilité, anaphylaxie.
Affections du système nerveux
Fréquents: céphalées.
Affections gastro-intestinales
Fréquents: diarrhée.
Affections hépatobiliaires
Fréquents: transaminases élevées, bilirubine élevée.
Affections de la peau et du tissu sous-cutané
Occasionnels: urticaire, éruption cutanée.
Affections musculosquelettiques et du tissu conjonctif
Fréquents: arthralgie.
Troubles généraux et anomalies au site d'administration
Fréquents: réactions au site d'injection.
Description de certains effets indésirables
Transaminases élevées, bilirubine élevée
Pendant la période contrôlée contre placebo de deux études cliniques de phase III portant sur l'arthrite psoriasique, une élévation des transaminases (incluant: alanine aminotransférase (ALT) élevée, aspartate aminotransférase (AST) élevée, enzymes hépatiques élevées, transaminases élevées, tests de la fonction hépatique anormaux, hypertransaminasémie) a été plus fréquemment rapportée comme effet indésirable dans le groupe traité par TREMFYA (8,4%) que dans le groupe placebo (4,6%). Sur une période de 1 an, des événements indésirables comprenant une élévation des transaminases ont été rapportés chez 12,3% des patients dans le groupe traité par TREMFYA. Dans la majorité des cas, l'augmentation des transaminases a été légère et transitoire et n'a pas entraîné l'arrêt du traitement. Sur la base des analyses de laboratoire, pendant toute la période contrôlée contre placebo, des élévations de la bilirubine ont également été plus fréquemment rapportées dans le groupe traité par TREMFYA (5,8%) que dans le groupe placebo (2,2%). Aucune augmentation supérieure à 3 fois la valeur normale supérieure n'a été observée. Les élévations de la bilirubine n'étaient généralement pas liées à une augmentation de la bilirubine directe. Sur une période de 1 an, des événements indésirables avec élévation de la bilirubine ont été rapportés chez 6,8% des patients du groupe traité par TREMFYA.
Diminution de la numération des neutrophiles
Pendant la période contrôlée contre placebo de deux études cliniques de phase III portant sur l'arthrite psoriasique, une diminution du nombre de neutrophiles a été plus fréquemment rapportée comme effet indésirable dans le groupe traité par TREMFYA (0,9%) que dans le groupe placebo (0%). Sur une période de 1 an, des effets indésirables avec diminution de la numération des neutrophiles ont été rapportés chez 0,9% des patients du groupe traité par TREMFYA. Dans la majorité des cas, la diminution des neutrophiles sanguins a été légère et transitoire, n'était associée à aucune infection et n'a pas conduit à l'arrêt du traitement.
Gastroentérite
Pendant la période contrôlée contre placebo de deux études cliniques de phase III, l'incidence des gastro-entérites a été plus élevée dans le groupe traité par TREMFYA (1,1%) que dans le groupe placebo (0,7%). Jusqu'à la semaine 156, 4,9% de tous les patients traités par TREMFYA ont rapporté une gastro-entérite. Ces effets indésirables à type de gastro-entérite étaient non graves et n'ont pas conduit à l'arrêt du traitement par TREMFYA jusqu'à la semaine 48.
Réactions au site d'injection
Lors de deux études cliniques de phase III, des réactions au site d'injection sont survenues lors de 0,7% des injections de TREMFYA et de 0,3% des injections de placebo jusqu'à la semaine 48. Jusqu'à la semaine 156, 0,5% des injections de TREMFYA ont été associées à des réactions au site d'injection. Les effets indésirables de type d'érythème et de douleurs au site d'injection étaient les événements associés aux réactions au site d'injection les plus fréquemment rapportés et étaient tous d'intensité légère à modérée. Aucun de ces événements n'a été grave et aucun n'a conduit à l'arrêt du traitement par TREMFYA.
Immunogénicité
D'après l'analyse des données regroupées des études de phase II et de phase III auprès de patients atteints de psoriasis et d'arthrite psoriasique, 5% (N=145) des patients traités par TREMFYA ont développé des anticorps anti-médicament pendant une durée de traitement allant jusqu'à 52 semaines. Parmi les patients ayant développé des anticorps anti-médicament, environ 8% (N=12) présentaient des anticorps considérés comme neutralisants, soit 0,4% de l'ensemble des patients traités par TREMFYA. Dans l'analyse des données regroupées des études de phase III, environ 9% des patients traités par TREMFYA ont développé des anticorps anti-médicament pendant une période allant jusqu'à 156 semaines de traitement. Vu la faible fréquence de l'immunogénicité, aucune déclaration pertinente ne peut être faite concernant les éventuels effets des anticorps anti-médicament sur l'efficacité et la sécurité.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Au cours des études cliniques, des doses uniques de guselkumab allant jusqu'à 987 mg (10 mg/kg) ont été administrées par voie intraveineuse à des volontaires sains, et des doses uniques de guselkumab allant jusqu'à 300 mg ont été administrées par voie sous-cutanée à des patients atteints de psoriasis en plaques, sans qu'une toxicité dose-limitante n'ait été observée. En cas de surdosage, le patient doit être surveillé afin de détecter tout signe ou symptôme d'effets indésirables et un traitement symptomatique approprié doit immédiatement être instauré.
Propriétés/Effets
Code ATC
L04AC16
Mécanisme d'action
Le guselkumab est un anticorps monoclonal (AcM) IgG1λ humain qui se lie de façon sélective à l'interleukine 23 (IL-23) avec une spécificité et une affinité élevées. L'IL-23 agit notamment sur la différenciation, l'expansion et la survie de certaines sous-populations de lymphocytes T (lymphocytes Th17 p. ex.) et de certaines sous-populations de cellules de l'immunité innée, ainsi que sur la libération des cytokines proinflammatoires IL-17A, IL-17F et IL-22. Chez l'homme, il a été montré que le blocage sélectif de l'IL-23 permet de normaliser la production de ces cytokines.
Dans les modèles in vitro, il a été montré que le guselkumab inhibe la bioactivité de l'IL-23 en bloquant son interaction avec le récepteur de surface cellulaire de l'IL-23, perturbant ainsi la signalisation, l'activation et la cascade cytokinique médiées par l'IL-23.
Psoriasis en plaques
Les taux d'IL-23 sont élevés dans la peau des patients atteints de psoriasis en plaques. Le guselkumab exerce ses effets cliniques sur le psoriasis en plaques en inhibant la voie cytokinique de l'IL-23 par modulation de profils d'expression de gènes dans les zones cutanées concernées. Ces effets locaux entraînent une réduction de l'épaisseur de l'épiderme et de la concentration des lymphocytes T. Par ailleurs, lors des études de phase II et de phase III, une réduction des taux sériques d'IL-17A, d'IL-17F et d'IL-22 a été observée chez les patients atteints de psoriasis en plaques traités par le guselkumab comparés au groupe placebo.
Arthrite psoriasique
Dans les études de phase III conduites chez des patients présentant une arthrite psoriasique, les taux sériques de protéines de phase aiguë, protéine C-réactive, sérum amyloïde A et IL-6 ainsi que les taux de cytokines effectrices des Th17 (IL-17A, IL-17F et IL-22) étaient élevés au début de l'étude. Le guselkumab a abaissé la concentration de ces protéines en l'espace de 4 semaines suivant l'instauration du traitement. Le guselkumab a réduit la concentration de ces protéines jusqu'à la semaine 24 par rapport à la valeur initiale et au placebo.
Pharmacodynamique
Voir Mécanisme d'action.
Efficacité clinique
Psoriasis en plaques
L'efficacité et la sécurité du guselkumab ont été étudiées au cours de quatre études de phase III randomisées, en double aveugle, contrôlées versus placebo et/ou comparateur actif, menées chez des patients adultes atteints de psoriasis en plaques modéré à sévère, candidats à une photothérapie ou à un traitement systémique. Deux études (VOYAGE 1 et VOYAGE 2) ont évalué l'efficacité et la sécurité du guselkumab versus placebo et adalimumab chez 1829 patients adultes. Dans l'étude VOYAGE 2, l'arrêt du guselkumab et la reprise du traitement ont été en outre étudiés à la semaine 28 chez les patients répondeurs, par rapport à la poursuite du traitement en continu. Les patients qui avaient déjà été traités par le guselkumab ou l'adalimumab, ainsi que les patients présentant un psoriasis érythrodermique, un psoriasis en gouttes ou un psoriasis pustuleux ont été exclus des études VOYAGE 1 et VOYAGE 2. Une autre étude (NAVIGATE) a évalué l'efficacité et la sécurité du guselkumab versus ustékinumab chez 268 patients adultes ayant présenté une réponse insuffisante à l'ustékinumab.
L'étude clinique (ORION) visait à évaluer l'efficacité, la sécurité, la PK, l'immunogénicité, les possibilités d'utilisation et l'acceptation du guselkumab administré avec le stylo prérempli.
VOYAGE 1 et VOYAGE 2
Les patients randomisés dans le groupe guselkumab ont reçu 100 mg aux semaines 0 et 4, puis toutes les 8 semaines jusqu'à la semaine 48 (VOYAGE 1) ou jusqu'à la semaine 20 (VOYAGE 2). Les patients randomisés dans le groupe adalimumab ont reçu 80 mg à la semaine 0 et 40 mg à la semaine 1, puis 40 mg toutes les deux semaines jusqu'à la semaine 48 (VOYAGE 1) ou jusqu'à la semaine 23 (VOYAGE 2). Dans les deux études, les patients randomisés dans le groupe placebo ont reçu 100 mg de guselkumab aux semaines 16 et 20, puis toutes les 8 semaines. Dans l'étude VOYAGE 1, tous les patients, y compris ceux qui avaient été randomisés dans le groupe sous adalimumab à la semaine 0, ont reçu 100 mg de guselkumab en ouvert à la semaine 52, puis toutes les 8 semaines. Dans l'étude VOYAGE 2, les patients qui avaient été randomisés dans le groupe guselkumab à la semaine 0 et présentaient une amélioration du PASI (Psoriasis Area and Severity Index) d'au moins 90% (réponse PASI 90) à la semaine 28 ont été re-randomisés soit pour poursuivre le traitement par le guselkumab toutes les 8 semaines (traitement d'entretien), soit pour recevoir le placebo (arrêt du traitement). Les patients appartenant au dernier groupe (re-randomisation après placebo) ont à nouveau été traités par le guselkumab après la perte d'au moins 50% de l'amélioration de leur PASI à la semaine 28 (posologie au moment de la reprise du traitement ainsi que 4 semaines plus tard, puis toutes les 8 semaines). Les patients du groupe guselkumab sans réponse PASI 90 ont poursuivi le traitement par le guselkumab. Chez les patients qui avaient été randomisés dans le groupe sous adalimumab et qui présentaient une réponse PASI 90 à la semaine 28, le traitement a été arrêté et un traitement par le guselkumab a été instauré en cas de perte d'au moins 50% de l'amélioration du PASI à la semaine 28. Les patients qui avaient été randomisés dans le groupe sous adalimumab à la semaine 0 et qui n'avaient pas obtenu de réponse PASI 90 ont reçu le guselkumab aux semaines 28 et 32, puis toutes les 8 semaines. Tous les sujets de l'étude ont reçu le guselkumab en ouvert toutes les 8 semaines à partir de la semaine 76.
Dans les études VOYAGE 1 et 2, les caractéristiques de la maladie à l'inclusion étaient homogènes au sein des populations des études, avec respectivement une moyenne de surface corporelle atteinte (SCA) de 22% et 24%, une médiane de score PASI à l'inclusion de 19 dans les deux études, un score IGA à l'inclusion (Investigator's Global Assessment, évaluation globale par l'investigateur) respectivement jugé «modéré» ou «sévère» chez 74,6% et 75,5% ou 25,1% et 24,5% des patients. 19% et 18% des patients avaient des antécédents d'arthrite psoriasique.
Parmi l'ensemble des patients inclus dans VOYAGE 1 et 2, respectivement 32% et 29% étaient naïfs à la fois de traitement systémique conventionnel et de traitement biologique, 54% et 57% avaient déjà reçu précédemment une photothérapie et 62% et 64% avaient déjà reçu un traitement systémique conventionnel. Dans les deux études, 21% des patients avaient déjà reçu précédemment un traitement biologique, parmi lesquels 11% avaient reçu au moins un anti-TNFα (facteur de nécrose tumorale alpha) et environ 10% un anti-IL-12/IL-23.
Un traitement topique ou systémique associé ou une photothérapie concomitante contre le psoriasis n'étaient pas autorisés dans l'étude.
L'efficacité du guselkumab a été évaluée sur la base de l'atteinte cutanée globale, de l'atteinte localisée du cuir chevelu, des mains, des pieds et des ongles, ainsi que de la qualité de vie. Les co-critères principaux d'évaluation dans les études VOYAGE 1 et 2 étaient le pourcentage de patients ayant obtenu un score IGA de type «blanchi» ou «lésion minime» (IGA 0/1) et une réponse PASI 90 à la semaine 16 versus placebo (voir le tableau 1).
Effets sur les symptômes cutanés
Le traitement par le guselkumab a entraîné des améliorations significatives des paramètres de l'activité de la maladie par rapport au placebo à la semaine 16 et par rapport à l'adalimumab aux semaines 16 et 48. Les principaux résultats d'efficacité sont présentés dans le tableau 1 ci-dessous.
Tableau 1: résumé des réponses cliniques observées lors des études VOYAGE 1 et VOYAGE 2
Nombre de patients (%) | ||||||
|---|---|---|---|---|---|---|
Placebo (n = 174) | VOYAGE 1 Guselkumab (n = 329) | Adalimumab (n = 334) | Placebo (n = 248) | VOYAGE 2 Guselkumab (n = 496) | Adalimumab (n = 248) | |
Semaine 16 | ||||||
PASI 75 | 10 (5,7) | 300 (91,2)a | 244 (73,1)b | 20 (8,1) | 428 (86,3)a | 170 (68,5)b |
PASI 90 | 5 (2,9) | 241 (73,3)c | 166 (49,7)b | 6 (2,4) | 347 (70,0)c | 116 (46,8)b |
IGA 0/1 | 12 (6,9) | 280 (85,1)c | 220 (65,9)b | 21 (8,5) | 417 (84,1)c | 168 (67,7)b |
IGA 0 | 2 (1,1) | 157 (47,7)a | 88 (26,3)d | 2 (0,8) | 215 (43,3)a | 71 (28,6)d |
Semaine 48 | ||||||
PASI 75 | - | 289 (87,8) | 209 (62,6)e | - | - | - |
PASI 90 | - | 251 (76,3) | 160 (47,9)b | - | - | - |
IGA 0/1 | - | 265 (80,5) | 185 (55,4)b | - | - | - |
IGA 0 | - | 166 (50,5) | 86 (25,7)b | - | - | - |
a p <0,001 pour la comparaison entre le guselkumab et le placebo.
b p <0,001 pour la comparaison entre le guselkumab et l'adalimumab sur les critères secondaires majeurs d'évaluation.
c p <0,001 pour la comparaison entre le guselkumab et le placebo sur les co-critères principaux d'évaluation.
d Des comparaisons entre le guselkumab et l'adalimumab n'ont pas été effectuées.
e p <0,001 pour la comparaison entre le guselkumab et l'adalimumab.
Des améliorations statistiquement significatives du psoriasis des ongles, de l'atteinte du cuir chevelu et de l'atteinte palmoplantaire ont également été observées à la semaine 16 par rapport au placebo.
Réponse au cours du temps
Le guselkumab a montré une efficacité d'apparition rapide, avec un pourcentage d'amélioration du score PASI significativement plus élevé comparé au placebo dès la semaine 2 (p <0,001), avec une différence maximale atteinte autour de la semaine 20 (VOYAGE 1 et 2) et se maintenant jusqu'à la semaine 48 (VOYAGE 1).
Figure 1: pourcentage de patients ayant obtenu une réponse PASI 90 lors des différentes visites jusqu'à la semaine 48 (patients randomisés à la semaine 0) dans l'étude VOYAGE 1

Dans l'étude VOYAGE 1, le taux de réponse PASI 90 chez les patients sous traitement continu par le guselkumab a été maintenu dans la plupart des cas pendant la période en ouvert de la semaine 52 à la semaine 156. Chez les patients qui avaient été randomisés dans le groupe sous adalimumab à la semaine 0 et qui sont passés au guselkumab à la semaine 52, le taux de réponse PASI 90 a augmenté entre la semaine 52 et la semaine 76 comprise, puis a été maintenu pendant la période en ouvert jusqu'à la semaine 156.
L'efficacité et la sécurité du guselkumab ont été démontrées indépendamment de l'âge, du sexe, de l'appartenance ethnique, du poids corporel, de la localisation des plaques, du score de sévérité PASI à l'inclusion, de la présence concomitante d'une arthrite psoriasique et de la prise d'un traitement antérieur biologique. Le guselkumab s'est avéré efficace chez les patients naïfs de traitement systémique conventionnel, chez les patients naïfs de traitement biologique et chez les patients précédemment exposés à un traitement biologique.
Arrêt, puis reprise du traitement
Dans l'étude VOYAGE 2, à la semaine 48, 88,6% des patients ayant reçu un traitement d'entretien par le guselkumab présentaient une réponse PASI 90 versus 36,8% des patients ayant arrêté le traitement à la semaine 28 (p <0,001). Une perte de la réponse PASI 90 a été observée dès 4 semaines après l'arrêt du traitement par le guselkumab avec un délai médian de perte de la réponse PASI 90 d'environ 15 semaines. Quatre-vingts pour cent des patients ayant arrêté le traitement par le guselkumab et l'ayant repris ultérieurement ont obtenu une rémission PASI 90 lors de l'évaluation réalisée 20 semaines après le début de la reprise du traitement. Dans l'étude VOYAGE 2, respectivement 36% et 41% des 95 patients qui avaient été randomisés dans le groupe sous guselkumab et qui n'avaient pas obtenu de réponse PASI 90 à la semaine 28 ont obtenu une réponse PASI 90 après 20 et 44 semaines de poursuite du traitement par le guselkumab.
Résultats du traitement concernant différentes régions atteintes
Dans les études VOYAGE 1 et 2, à la semaine 16, des améliorations significativement plus importantes de l'atteinte du cuir chevelu (ss-IGA), des mains et des pieds (hf-PGA) et des ongles (NAPSI, f-PGA) ont été observées chez les patients traités par le guselkumab par rapport aux patients du groupe placebo.
Qualité de vie liée à la santé/Résultats rapportés par les patients
Dans les études VOYAGE 1 et 2, à la semaine 16, des améliorations significativement plus importantes de la qualité de vie liée à la santé, mesurée à l'aide du Dermatology Life Quality Index (DLQI), et des symptômes (démangeaisons, douleurs, brûlures, picotements et tiraillements cutanés) et signes (sécheresse cutanée, fissures, desquamation, exfoliation, rougeurs et saignements) du psoriasis, rapportés par les patients dans le carnet de suivi Psoriasis Symptoms and Signs Diary (PSSD) ont été observées chez les patients traités par le guselkumab par rapport aux patients ayant reçu le placebo.
NAVIGATE
L'étude NAVIGATE a évalué l'efficacité du guselkumab chez des patients ayant présenté une réponse insuffisante à l'ustékinumab à la semaine 16 (c.-à-d. n'ayant pas de réponse de type «blanchi» ou «lésion minime», définie par un score IGA ≥2). Les patients ne devaient pas avoir reçu un traitement antérieur par le guselkumab et/ou l'ustékinumab. Tous les patients ont reçu un traitement par l'ustékinumab en ouvert aux semaines 0 et 4. À la semaine 16, 268 patients présentant un score IGA ≥2 ont été randomisés pour poursuivre le traitement par l'ustékinumab toutes les 12 semaines ou pour débuter un traitement par le guselkumab aux semaines 16 et 20, puis toutes les 8 semaines. Les caractéristiques à l'inclusion des patients randomisés étaient similaires à celles des patients des études VOYAGE 1 et 2.
12 semaines après la randomisation, la proportion de patients ayant obtenu un score IGA 0/1 et une amélioration ≥2 points a été plus élevée dans le groupe guselkumab que dans le groupe ustékinumab (31,1% vs 14,3%; p = 0,001), de même que la proportion de patients ayant obtenu une réponse PASI 90 (48% vs 23%; p <0,001). Aucune donnée n'est disponible sur le passage inverse du guselkumab à l'ustékinumab.
ORION
L'étude ORION visait à évaluer l'efficacité, la sécurité, la PK, l'immunogénicité, les possibilités d'utilisation et l'acceptation du guselkumab administré avec le stylo prérempli. Dans cette étude, 78 patients atteints de psoriasis en plaques modéré à sévère ont été randomisés pour recevoir soit TREMFYA (100 mg aux semaines 0 et 4, puis toutes les 8 semaines) soit un placebo. La population de l'étude ORION était comparable à celle des études VOYAGE 1 et 2. L'efficacité, mesurée par le score IGA (0,1) et le PASI 90 à la semaine 16, était comparable dans les trois études ORION, VOYAGE 1 et 2. L'acceptation par les patients et la sécurité d'emploi du stylo ont été établies.
ECLIPSE
L'efficacité et la sécurité du guselkumab ont également été évaluées dans une étude en double aveugle versus sécukinumab. Les patients ont été randomisés pour recevoir le guselkumab (N = 534;100 mg aux semaines 0 et 4, puis toutes les 8 semaines) ou le sécukinumab (N = 514; 300 mg aux semaines 0, 1, 2, 3, 4, puis toutes les 4 semaines). La dernière dose était administrée à la semaine 44 dans les deux groupes de traitement.
Le guselkumab était supérieur au sécukinumab en ce qui concerne le critère d'évaluation principal, la réponse PASI 90 à la semaine 48 (84,5% contre 70,0%, p < 0,001).
Arthrite psoriasique (AP)
Il a été établi que le guselkumab améliore les signes et les symptômes, la fonction physique et la qualité de vie liée à la santé.
DISCOVER 1 et DISCOVER 2
L'efficacité et la sécurité du guselkumab ont été évaluées, en comparaison avec un placebo, au cours de deux études de phase III, randomisées, en double aveugle et contrôlées contre placebo (DISCOVER 1 et DISCOVER 2), conduites chez des patients adultes atteints d'AP active (≥3 articulations enflées, ≥3 articulations douloureuses à la pression et un taux de protéine C-réactive (CRP) de ≥0,3 mg/dl dans l'étude DISCOVER 1, et ≥5 articulations enflées, ≥5 articulations douloureuses à la pression et un taux de CRP de ≥0,6 mg/dl dans l'étude DISCOVER 2) malgré l'administration d'un traitement par un (cs)DMARD conventionnel synthétique, par l'aprémilast ou par un antirhumatismal non stéroïdien. L'AP des patients inclus dans ces études a été diagnostiquée sur la base des critères de classification pour l'arthrite psoriasique [CASPAR], avec une durée médiane de 4 ans. Des patients présentant différentes sous-formes d'AP – y compris l'arthrite polyarticulaire sans nodules rhumatoïdes (40%), la spondylarthrite avec arthrite périphérique (30%), l'arthrite périphérique asymétrique (23%), l'atteinte des articulations interphalangiennes distales (7%) et l'arthrite mutilante (1%) – ont été inclus dans les deux études. En raison du faible nombre de patients à l'étude présentant une arthrite mutilante (N=6), aucune déclaration pertinente ne peut être faite à propos de l'efficacité et de la sécurité dans ce sous-groupe. Respectivement plus de 65% et 42% des patients présentaient une enthésite ou une dactylite au début de l'étude, et plus de 75% des patients présentaient ≥3% de la surface corporelle (SC) affectée par le psoriasis. Respectivement 381 et 739 patients ont été évalués dans les études DISCOVER 1 et DISCOVER 2; ces patients ont été traités soit par 100 mg de guselkumab aux semaines 0 et 4, puis toutes les 8 semaines (q8s), soit par 100 mg de guselkumab q4s, soit par un placebo. Dès la semaine 24, les sujets qui avaient reçu le placebo ont été traités par 100 mg de guselkumab toutes les 4 semaines dans les deux études. Environ 58% des patients des deux études ont reçu des doses stables de MTX en continu (≤25 mg/semaine).
Dans les deux études, plus de 90% des patients avaient déjà reçu précédemment un csDMARD. Dans l'étude DISCOVER 1, 31% des patients avait été traités antérieurement par un anti-TNFα biologique. Dans l'étude DISCOVER 2, aucun patient n'avait été traité au préalable par un agent biologique.
Signes et symptômes
À la semaine 24, le traitement par le guselkumab a entraîné des améliorations significatives des indicateurs de l'activité de la maladie, comparé au placebo. Le critère d'évaluation principal dans les deux études était le pourcentage de patients présentant une réponse ACR 20 de l'American College of Rheumatology à la semaine 24. Dans l'intervalle des traitements d'entretien par 100 mg de guselkumab respectivement toutes les 4 et 8 semaines, aucune différence cliniquement significative n'a été observée en matière d'efficacité. Le tableau 2 montre les événements principaux portant sur l'efficacité.
Tableau 2: réponse clinique dans les études DISCOVER 1 et DISCOVER 2
DISCOVER 1 i | DISCOVER 2 j | |||
Placebo | 100 mg q8s | Placebo | 100 mg q8s | |
(N=126) | (N=127) | (N=246) | (N=248) | |
Réponse ACR20 | ||||
Semaine 16 | 25,40% | 52,0% b | 33,70% | 55,2% g |
Semaine 24 | 22,20% | 52,0% a | 32,90% | 64,1% a |
Réponse ACR50 | ||||
Semaine 16 | 12,70% | 22,8% d | 9,30% | 28,6% g |
Semaine 24 | 8,70% | 29,9% b | 14,20% | 31,5% g |
Réponse ACR70 | ||||
Semaine 24 | 5,60% | 11,8% d | 4,10% | 18,5% g |
DAS 28 (CRP)-LS mean Modification par rapport à la valeur initiale | ||||
Semaine 24 c | -0,7 | -1,43 b | -0,97 | -1,59 b |
a p <0,001 (critère d'évaluation principal)
b p <0,001 (critère d'évaluation secondaire important)
c p =0,006 (critère d'évaluation secondaire important)
d statistiquement non significatif p =0,086 (critère d'évaluation secondaire important)
f nominal p <0,012
g Aucun examen spécifique n'a été réalisé dans le cadre de la procédure de test hiérarchisée, nominal p <0,001 (critère d'évaluation secondaire important)
i incluant >90% des patients avec un traitement antérieur par un csDMARD
j incluant 31% des patients avec un traitement antérieur par un anti-TNFα biologique
Chez les patients atteints d'AP active et présentant ≥3% de la SC affectée ainsi qu'un score IGA ≥2 au début de l'étude, des amélioration significatives de la maladie cutanée ont été observées dans le groupe guselkumab-q8s, comparé au groupe placebo, tout comme cela avait été observé dans les études sur le psoriasis VOYAGE 1 et VOYAGE 2.
Réponse au cours du temps
Dans l'étude DISCOVER 2, une réponse ACR20 plus importante a été obtenue dès la semaine 4 dans les deux groupes traités par le guselkumab par rapport au placebo, et la différence entre les traitements s'est accentuée au cours du temps jusqu'au terme de la semaine 24 (Fig. 2).
Fig. 2: réponse ACR20 lors des visites médicales jusqu'au terme de la semaine 24 dans l'étude DISCOVER 2

La réponse observée était comparable dans les groupes traités par le guselkumab, indépendamment de l'utilisation concomitante d'un csDMARD, y compris le MTX (DISCOVER 1 et 2). Par ailleurs, l'analyse de l'âge, du sexe, de l'ethnie, du poids corporel, de l'utilisation antérieure d'un csDMARD (DISCOVER 1 et 2) et de l'administration antérieure d'un anti-TNFα biologique (DISCOVER 1) n'a révélé aucune différence entre ces sous-groupes en matière de réponse au guselkumab.
La réponse clinique s'est maintenue jusqu'à la semaine 52, comme le montrent les taux de réponse selon ACR 20/50/70 et DAS 28 (CRP).
Le nombre de patients atteints d'AP avec une arthrite mutilante était trop faible pour permettre une évaluation pertinente.
Dans les études DISCOVER 1 et 2 des améliorations se sont produites pour tous les critères des scores ARC, y compris pour l'évaluation de la douleur par le patient.
L'évaluation de la dactylite et de l'enthésite a reposé sur les données regroupées des patients présentant une dactylite ou une enthésite dans les études DISCOVER 1 et 2 (N=160 et N=230 respectivement). Le pourcentage de participants présentant une dactylite à l'inclusion et une rémission de la dactylite à la semaine 24 était plus élevé dans les groupes traités par le guselkumab q8s (59,4%, nominal p<0,001) que dans le groupe placebo (42,2%). Le pourcentage de participants présentant une enthésite à l'inclusion et une rémission de l'enthésite à la semaine 24 était plus élevé dans les groupes traités par le guselkumab q8s (49,6%, nominal p<0,001) que dans le groupe placebo (29,4%). À la semaine 52, la rémission de la dactylite (81,2%) et la rémission de l'enthésite (62,7%) se sont' maintenues dans le groupe traité par le guselkumab q8s.
Réponse radiographique
Au cours de l'étude DISCOVER 2, l'inhibition de la progression des lésions structurelles a été évaluée radiographiquement et présentée comme une variation du score de Sharp modifié selon van der Heijde (vdH-S) par rapport à la valeur initiale. À la semaine 24, le groupe traité par le guselkumab q8s a présenté une progression moindre sur le plan numérique que le groupe placebo (modification des moyennes des moindres carrés [least square mean change] par rapport à la valeur initiale, respectivement de 0,52 et de 0,95, p=0,068). À la semaine 52, la modification moyenne par rapport à la valeur initiale a été de 0,97 dans le groupe guselkumab q8s.
Fonction physique et qualité de vie liée à la santé
Au cours des études DISCOVER 1 et 2, les patients traités par le guselkumab ont présenté une amélioration significative (p<0,001) de la fonction physique à la semaine 24, évaluée à l'aide du questionnaire pour l'évaluation de la limitation physique (Health Assessment Questionnaire-Disability Index, HAQ-DI), par rapport au placebo. Les améliorations du HAQ-DI se sont maintenues de la semaine 24 jusqu'à la semaine 52.
Pharmacocinétique
Absorption
Après administration d'une dose unique de 100 mg par voie sous-cutanée chez des sujets sains, le guselkumab a atteint une concentration sérique maximale (Cmax) moyenne (± ET) de 8,09 ± 3,68 μg/ml environ 5,5 jours après l'injection.
Après administration de 100 mg de guselkumab par voie sous-cutanée aux semaines 0 et 4, puis toutes les 8 semaines, les concentrations sériques de guselkumab ont atteint l'état d'équilibre autour de la semaine 20. Dans deux études de phase III menées chez des patients atteints de psoriasis en plaques, les concentrations sériques résiduelles moyennes (± ET) du guselkumab à l'état d'équilibre ont été de 1,15 ± 0,73 μg/ml et de 1,23 ± 0,84 μg/ml.
La pharmacocinétique du guselkumab chez les patients atteints d'arthrite psoriasique était similaire à celle des patients souffrant de psoriasis. Après administration de 100 mg de TREMFYA par voie sous-cutanée aux semaines 0 et 4, puis toutes les 8 semaines, la concentration sérique résiduelle moyenne du guselkumab à l'état d'équilibre a également été de 1,2 µg/ml environ. Après administration de 100 mg de TREMFYA par voie sous-cutanée toutes les 4 semaines, la concentration sérique résiduelle moyenne du guselkumab à l'état d'équilibre a été de 3,8 µg/ml environ.
La biodisponibilité absolue du guselkumab après injection sous-cutanée d'une dose unique de 100 mg dans la cuisse a été estimée à environ 49% chez les sujets sains.
Distribution
Le volume de distribution moyen pendant la phase terminale (Vz) après administration unique par voie intraveineuse chez le sujet sain était dans toutes les études compris entre 7 et 10 l environ.
Métabolisme
La voie exacte de métabolisation du guselkumab n'a pas encore été caractérisée. Le guselkumab étant un AcM IgG humain, il devrait être dégradé en petits peptides et en acides aminés par les voies cataboliques, de la même manière que les IgG endogènes.
Élimination
Dans toutes les études, la clairance systémique (Cl) moyenne après administration unique par voie intraveineuse chez les sujets sains est comprise entre 0,288 et 0,479 l/jour. La demi-vie (t½) moyenne du guselkumab était d'environ 17 jours chez les sujets sains et d'environ 15 à 18 jours chez les patients atteints de psoriasis en plaques dans les études.
Des analyses pharmacocinétiques de population ont révélé que l'administration concomitante d'AINS, de corticostéroïdes oraux et de csDMARD tels que le méthotrexate n'a aucun effet sur la clairance du guselkumab.
Linéarité/non-linéarité
Après injection sous-cutanée unique de doses comprises entre 10 mg et 300 mg chez des sujets sains ou chez des patients atteints de psoriasis en plaques, l'exposition systémique au guselkumab (Cmax et AUC) a augmenté approximativement de façon dose-proportionnelle.
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique/Troubles de la fonction rénale
Aucune étude spécifique n'a été réalisée pour déterminer les effets de l'insuffisance rénale ou hépatique sur la pharmacocinétique du guselkumab. On s'attend à ce que l'élimination rénale du guselkumab intact, un AcM IgG, soit faible et d'importance mineure; de même, l'insuffisance hépatique ne devrait pas influer sur la clairance du guselkumab, car les AcM IgG sont principalement éliminés par catabolisme intracellulaire.
Patients âgés
Les analyses pharmacocinétiques de population chez les patients atteints de psoriasis en plaques et d'arthrite psoriasique n'ont révélé aucune modification apparente de la Cl/F estimée chez les patients âgés de 65 ans ou plus par rapport aux patients âgés de moins de 65 ans. Ceci suggère qu'aucun ajustement posologique n'est nécessaire chez les patients âgés.
Données précliniques
Les données précliniques issues des études conventionnelles de pharmacologie de sécurité, de toxicité après administration répétée, et de toxicité de la reproduction n'ont pas révélé de risque particulier pour l'homme.
Toxicité en cas d'administration répétée
Lors des études de toxicité après administration répétée chez des macaques crabiers, le guselkumab administré par voie intraveineuse et sous-cutanée a été bien toléré à des doses allant jusqu'à 50 mg/kg/semaine pendant jusqu'à 5 semaines par voie i.v. et 24 semaines par voie s.c. Par ailleurs, aucun effet indésirable pharmacologique à type d'immunotoxicité ou de toxicité cardiovasculaire n'a été observé au cours des études de toxicité après administration répétée ou lors d'une étude spécifique de pharmacologie de sécurité cardiovasculaire chez des macaques crabiers.
Toxicité sur la reproduction
Dans une étude sur l'évaluation combinée de la toxicité pendant le développement embryofœtal et le développement prénatal et postnatal, des macaques crabiers gravides (respectivement 19, 20 et 20 animaux dans les groupes ayant reçu 0, 10 ou 50 mg/kg) ont reçu des doses sous-cutanées hebdomadaires de guselkumab du début de l'organogenèse jusqu'à la mise bas. Lors d'une mesure réalisée au jour 28 après la naissance, le guselkumab n'était pas détectable dans le lait maternel de macaques crabiers. Chez 1 des 16 guenons du groupe contrôle et chez 3 des 14 guenons de tous les groupes ayant reçu le guselkumab, des morts néonatales sont survenues chez les jeunes (les taux de Cmax et d'AUClast étaient 31 et 8 fois supérieurs aux concentrations chez l'homme). Ces morts néonatales ont été attribuées à un manque de soins de la part de la mère, à un traumatisme ou à une naissance prématurée ou tardive, même si un effet dû au principe actif n'était pas exclu. À tous les paliers de doses, des pertes fœtales (avortements spontanés, y compris mort-nés) ont en outre été observées, toutes situées dans la fourchette du contrôle historique du laboratoire, mais pour lesquelles un effet dû au principe actif n'était pas exclu. L'importance clinique de ces observations n'est pas connue. Aucun effet du guselkumab sur le développement fonctionnel ou immunologique des jeunes animaux n'a été constaté entre la naissance et l'âge de 6 mois.
Aucune modification prénéoplasique n'a été observée à l'examen histopathologique d'animaux traités pendant jusqu'à 24 semaines, ou après la phase de rétablissement de 12 semaines pendant laquelle le médicament était décelable dans le sérum. Les niveaux de dose dans les études chez l'animal étaient environ 45 fois supérieurs à la dose de 100 mg prévue pour l'administration à des patients atteints de psoriasis en plaques (sur la base d'un patient d'un poids corporel de 90 kg) et ont entraîné chez les singes des concentrations sériques maximales plus de 100 fois supérieures à celles observées chez l'homme.
Mutagénicité/Carcinogénicité
Aucune étude de mutagénicité ou de carcinogénicité n'a été réalisée avec le guselkumab.
Remarques particulières
Incompatibilités
Aucune étude de tolérance n'ayant été effectuée, ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver hors de portée des enfants.
Conserver au réfrigérateur (2-8 °C). Ne pas congeler.
Conserver la seringue préremplie et le stylo prérempli dans leur carton pour les protéger de la lumière.
Remarques concernant la manipulation
Après avoir sorti TREMFYA du réfrigérateur, laisser la seringue préremplie ou le stylo prérempli dans le carton et attendre 30 minutes avant d'injecter TREMFYA, afin que la solution puisse atteindre la température ambiante. Ne pas secouer la seringue préremplie ou le stylo prérempli.
Un contrôle visuel de la seringue préremplie ou du stylo prérempli est recommandé avant l'utilisation. La solution doit être limpide, incolore à jaune clair et peut contenir quelques petites particules protéiques blanches ou translucides. TREMFYA ne doit pas être utilisé si la solution est trouble ou présente un changement de coloration, ou si elle contient de grosses particules.
Chaque emballage de TREMFYA contient une brochure séparée intitulée «Instructions d'utilisation», décrivant en détail la préparation et l'utilisation de la seringue préremplie ou du stylo prérempli.
TREMFYA ne contenant pas de conservateur, tout médicament non utilisé restant dans la seringue ou dans le stylo doit être jeté.
Le médicament non utilisé et/ou les déchets doivent être éliminés conformément aux exigences nationales.
TREMFYA est proposé sous forme de solution stérile à usage unique dans
- une seringue préremplie en verre de 1 ml avec une aiguille fixe et un protège aiguille sans latex, intégrée dans un dispositif de protection passive de l'aiguille.
- une seringue préremplie en verre de 1 ml, intégrée dans un stylo prérempli avec un protège-aiguille.
Numéro d’autorisation
66583, 67490 (Swissmedic).
Titulaire de l’autorisation
Janssen-Cilag AG, Zoug, ZG.
Mise à jour de l’information
Décembre 2020.
Відгуки (0)
Ви переглядали

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.

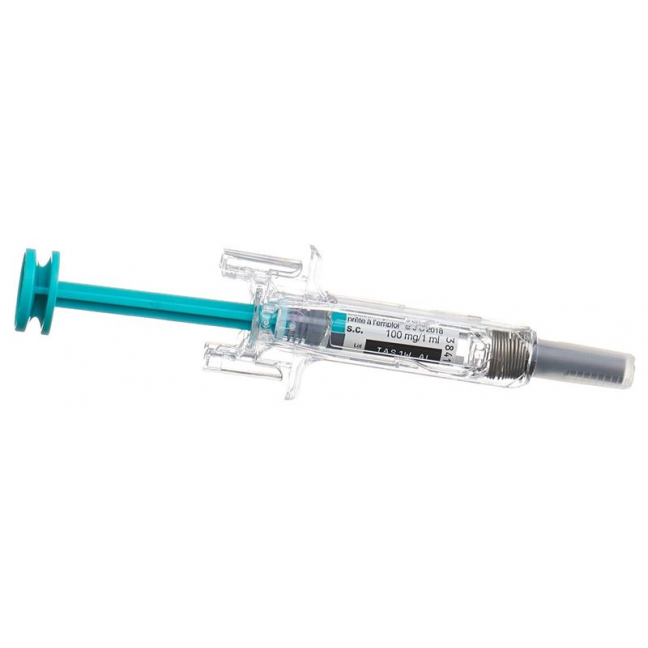


 Deutsch
Deutsch French
French Italian
Italian