Recormon PS Inj Lös 10000 МО/0,6 мл із захистом голки Fertspr 6 шт.
Recormon PS Inj Lös 10000 IE/0.6ml mit Nadelschutz Fertspr 6 Stk
-
107156.62 RUB
При оплате криптовалютой:
Ваша прибыль 10715.66 RUB / 126.48 USDT
- Наявність: Немає в наявності
- Виробник: ROCHE PHARMA (SCHWEIZ)
- Модель: 7582873
- ATC-код B03XA01
- EAN 7680547660054
Опис
Was ist Recormon und wann wird es angewendet?
Der Wirkstoff von Recormon ist Erythropoetin, eine Substanz, die bei gesunden Menschen von der Niere gebildet wird. Über das Blut gelangt sie in das Knochenmark, wo sie die Bildung von roten Blutkörperchen anregt. Beim Vorliegen einer chronischen Nierenerkrankung, fehlt das körpereigene Erythropoetin und es werden zu wenig rote Blutkörperchen gebildet. Die dadurch verursachte symptomatische Blutarmut wird durch die Gabe von Recormon bei Patienten bzw. Patientinnen korrigiert.
Recormon wird auch bei der Eigenblutspende vor einer Operation angewendet.
Recormon ist zur Behandlung der symptomatischen Blutarmut bei erwachsenen Patientinnen und Patienten mit bestimmten Krebserkrankungen unter Chemotherapie indiziert. Für weitere Informationen zu dieser Anwendungsmöglichkeit steht Ihnen Ihr Arzt oder Ihre Ärztin gerne zur Verfügung.
Recormon darf nur auf Verschreibung des Arztes oder der Ärztin angewendet werden.
Wann darf Recormon nicht angewendet werden?
Recormon darf von Patientinnen und Patienten, die an einem schwer kontrollierbaren Bluthochdruck (Hypertonie) leiden, nicht angewendet werden sowie bei Überempfindlichkeit gegenüber Erythropoetin bzw. den anderen Inhaltsstoffen.
Recormon darf nicht angewendet werden, wenn vor einer Operation eine Eigenblutspende geplant ist und, Sie innerhalb eines Monats vor der Behandlung einen Herzinfarkt oder Schlaganfall erlitten haben, oder Sie an instabiler Angina pectoris leiden, oder Sie ein Risiko für die Entstehung von tiefen Venenthrombosen (Blutgerinnsel in den Gefässen) haben.
Recormon darf auch während der Schwangerschaft und der Stillzeit sowie bei Kindern, die jünger als zwei Jahre sind, nicht eingesetzt werden, da hierzu bisher noch keine Erfahrungen vorliegen.
Wann ist bei der Anwendung von Recormon Vorsicht geboten?
Recormon sollte bei von Krampfanfällen begleiteten (epileptiformen) Erkrankungen, bei zu hohem Gehalt an Blutplättchen (Thrombozytose), bei einer chronischen Lebererkrankung mit Vorsicht angewendet werden.
Besondere Vorsicht ist geboten, wenn sich Ihre Anämie unter der Behandlung mit Recormon nicht verbessert.
Wenn Sie Antikörper gegen Erythropoetin und eine Erythroblastopenie (verminderte oder gar keine Produktion von roten Blutkörperchen) während einer früheren Behandlung mit einem anderen Erythropoetin-Präparat entwickelt haben, dürfen Sie nicht auf Recormon umgestellt werden.
Die insbesondere zu Beginn der Behandlung häufig auftretende, dosisabhängige Erhöhung des Blutdruckes wird vom Arzt bzw. von der Ärztin mit geeigneten Arzneimitteln behandelt. Vereinzelt können auch bei Patientinnen und Patienten mit normalem oder niedrigem Blutdruck Blutdruckentgleisungen vorkommen. Ein Warnsignal dafür können plötzlich auftretende, stechende, migräneartige Kopfschmerzen darstellen. Gehen Sie bei einem solchen Vorfall sofort zum Arzt oder zur Ärztin!
Sollten Sie ein Krebspatient bzw. Krebspatientin sein, beachten Sie bitte, dass Epoetine wie Wachstumsfaktoren wirken können. Bitte besprechen Sie mögliche Risiken mit Ihrem Arzt oder Ihrer Ärztin.
Sollten Sie ein Patient bzw. eine Patientin mit einer chronischen Nierenerkrankung sein, wird Ihr Arzt bzw. Ihre Ärztin sich vergewissern, dass Ihr Hämoglobin einen bestimmten Wert nicht überschreitet. Ein hohes Hämoglobin könnte Sie der Gefahr von Herz- und Blutgefässproblemen wie Thrombosen (Blutgerinnsel in den Gefässen) aussetzen und die Todesfallgefahr erhöhen.
Durch die erhöhte Zahl roter Blutkörperchen wird das Blut dickflüssiger. Der Arzt oder die Ärztin wird Sie darüber informieren, dass im Verlauf der Behandlung deshalb häufig eine Erhöhung der Heparindosis während der Hämodialyse notwendig ist.
Es wurde über schwere Hautreaktionen, einschliesslich Stevens-Johnson Syndrom (SJS) und Toxischer Epidermaler Nekrolyse (TEN), im Zusammenhang mit Epoetin-Behandlungen berichtet. Schwerere Fälle wurden im Zusammenhang mit langwirksamen Epoetinen beobachtet. SJS/TEN können zu Beginn als rötliche, zielscheibenartige Punkte oder als kreisrunde Flecken, oft mit in der Mitte gelegenen Blasen auf dem Rumpf, auftreten. Es können auch Geschwüre im Bereich von Mund, Rachen, Nase, Genitalien und Augen (rote und geschwollene Augen) auftreten. Diesen schweren Hautreaktionen gehen oftmals Fieber und/oder grippeähnliche Symptome voraus. Die Hautausschläge können zu einem grossflächigen Ablösen der Haut und lebensbedrohlichen Komplikationen führen. Wenn bei Ihnen ein schwerwiegender Hautausschlag oder ein anderes dieser Hautsymptome auftritt, beenden Sie sofort die Behandlung mit Recormon und setzen Sie sich unverzüglich mit Ihrem Arzt oder Ihrer Ärztin in Verbindung oder begeben Sie sich unverzüglich in medizinische Behandlung.
Warnhinweis
Missbräuchliche Verwendung bei Gesunden, z.B. zu Dopingzwecken, kann zu einem übermässigen Anstieg der Anzahl roter Blutkörperchen (des Hämatokrits) führen. In diesem Zusammenhang wurde über lebensbedrohliche Komplikationen des Herz-Kreislauf-Systems (Thrombosen) berichtet.
Recormon enthält Phenylalanin; dies stellt ein Problem bei Patienten mit Pheylketonurie (eine angeborene Erkrankung des Stoffwechsels) dar. Wenn Sie daran erkrankt sind, sollten Sie die Behandlung mit Ihrem Arzt bzw. Ihrer Ärztin besprechen.
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbstgekaufte!) einnehmen oder äusserlich anwenden (Externa!).
Darf Recormon während einer Schwangerschaft oder in der Stillzeit angewendet werden?
Recormon darf während einer Schwangerschaft oder in der Stillzeit nicht angewendet werden.
Wie verwenden Sie Recormon?
Recormon Formulierungen können sowohl subkutan (unter die Haut) als auch intravenös (in eine Vene) verabreicht werden, wobei die intravenöse Verabreichung nur durch medizinisches Fachpersonal erfolgen sollte. Ihr Arzt oder Ihre Ärztin wird Ihnen laufend genaue Dosierungsanweisungen geben.
Behandlung mit Recormon bei Patientinnen und Patienten mit einer Nierenerkrankung
Die Behandlung mit Recormon bei Patientinnen und Patienten mit einer Nierenerkrankung gliedert sich in zwei Phasen:
Korrekturphase
Das Ziel der Korrekturphase ist es, den sogenannten Hämoglobinwert, auf 10 bis 12 g/dl anzuheben. Der Arzt bzw. die Ärztin wird das Ergebnis der Behandlung ständig überwachen, damit ein Wert von 12 g/dl nicht überschritten wird.
Ihr Arzt oder Ihre Ärztin wird Ihnen laufend genaue Dosierungsanweisungen geben.
Im Allgemeinen gelten folgende Dosierungsrichtlinien:
Die Anfangsdosis ist 3× 20 IE/kg Körpergewicht und Woche.
Bei nicht ausreichendem Anstieg des Hämoglobinwertes kann die Dosis in monatlichen Abständen um 3× 20 IE/kg Körpergewicht und Woche erhöht werden.
Die Wochendosis kann auch auf tägliche Einzelgaben verteilt werden.
Die maximale Dosis von 720 IE/kg Körpergewicht und Woche sollte unter keinen Umständen überschritten werden.
Erhaltungsphase
Ihr Arzt oder Ihre Ärztin wird Ihnen laufend genaue Dosierungsanweisungen geben.
Im Allgemeinen gelten folgende Dosierungsrichtlinien:
Zur Aufrechterhaltung eines Hämoglobinwertes zwischen 10 und 12 g/dl wird die Dosierung zunächst auf die Hälfte der zuletzt eingesetzten Dosis der Korrekturphase gesenkt. Ein Hämoglobinwert von 12 g/dl soll nicht überschritten werden. Anschliessend wird der Arzt bzw. die Ärztin die Dosierung in ein- bis zweiwöchigen Abständen individuell auf Ihren Bedarf einstellen.
Die Verabreichung der Erhaltungsdosis kann in einer einmal wöchentlichen subkutanen Gabe oder verteilt auf drei bis sieben Einzeldosen pro Woche erfolgen. Patienten, die in der einmal wöchentlichen Anwendung stabil sind, können auf eine Anwendung alle zwei Wochen umgestellt werden. In diesem Fall können Dosiserhöhungen nötig werden.
Für die Anwendung bei Kindern wird empfohlen, sich an das angeführte Dosierungsschema zu halten, da die individuelle Ansprechbarkeit nicht vorhersagbar ist.
Die Behandlung mit Recormon ist normalerweise eine Langzeitbehandlung. Eine Unterbrechung kann gegebenenfalls vom Arzt oder von der Ärztin veranlasst werden und jederzeit erfolgen.
Behandlung mit Recormon bei Patientinnen und Patienten mit Tumorerkrankungen
Ihr Arzt oder Ihre Ärztin leitet die Behandlung mit Recormon ein, wenn Ihr Hämoglobinspiegel bei 10 g/dl oder darunter liegt. Nach Einleitung der Therapie stellt Ihr Arzt oder Ihre Ärztin Ihren Hämoglobinspiegel auf einen Wert zwischen 10 und 12 g/dl ein.
Zur Behandlung der symptomatischen Blutarmut bei erwachsenen Patientinnen und Patienten mit bestimmten Krebserkrankungen beträgt die Anfangsdosis 450 IE/kg Körpergewicht pro Woche. Dabei wird normalerweise eine fixe Dosis von 30'000 IE einmal pro Woche gegeben. Wenn nötig wird Ihr Arzt bzw. Ihre Ärztin die Dosis gemäss Ihrem Körpergewicht anpassen. Die Dosis kann bei nicht ausreichendem Behandlungserfolg verdoppelt werden. Ein Hämoglobinwert von 12 g/dl sollte nicht überschritten werden. Die Dauer der Behandlung richtet sich nach den Bedürfnissen der Patientin bzw. des Patienten. Bei Patientinnen und Patienten mit festen Tumoren sollte nach Beendigung der Chemotherapie die Behandlung mit Recormon bis zu 3 Wochen weitergeführt werden.
Die Verabreichung der Dosis kann in einer einmal wöchentlichen subkutanen Gabe oder verteilt auf drei bis sieben Einzeldosen pro Woche erfolgen.
Ihr Arzt bzw. Ihre Ärztin bestimmt die für Sie zutreffende Dosierung und das Zeitintervall, in welchem Recormon injiziert werden soll. Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Anwendungshinweise
Die Injektion unter die Haut muss unter keimfreien Bedingungen erfolgen. Bevor Sie die erste Verabreichung von Recormon PS gemäss dem am Ende des Textes beschriebenen Vorgehen durchführen, ist es unerlässlich, dass der Arzt oder die Ärztin Sie genau schult, und dass Sie seine/ihre Weisungen genau befolgen. Während der weiteren Behandlung wird der Arzt oder die Ärztin Ihre Selbstverabreichung regelmässig überprüfen (siehe «Gebrauchsanweisung für Recormon PS» am Ende des Textes).
Welche Nebenwirkungen kann Recormon haben?
Folgende Nebenwirkungen können bei der Anwendung von Recormon auftreten:
Schwere Hautausschläge, einschliesslich Stevens-Johnson Syndrom und Toxische Epidermale Nekrolyse wurden im Zusammenhang mit der Injektion von Recormon beobachtet, die Folgendes beinhalten können:
- Rötliche, zielscheibenartige Punkte oder kreisrunde Flecken, oft mit in der Mitte gelegenen Blasen auf dem Rumpf,
- Ablösen der Haut,
- Geschwüre an Mund, Rachen, Nase, Genitalien und Augen,
- Vorangehendes Fieber und grippeähnliche Symptome.
Beenden Sie sofort die Behandlung mit Recormon, wenn bei Ihnen diese Symptome auftreten, und setzen Sie sich unverzüglich mit Ihrem Arzt oder Ihrer Ärztin in Verbindung oder begeben Sie sich unverzüglich in medizinische Behandlung.
Bei den meisten Patienten kann sich der Blut-Eisenwert verringern. Viele Patienten müssen daher während der Behandlung mit Recormon ein Eisen-Präparat erhalten.
Zu Beginn der Behandlung kann die Zahl der für die Blutgerinnung wichtigen Blutplättchen (Thrombozytenzahl) ansteigen; der Arzt oder die Ärztin wird diese Zahl in den ersten 8 Wochen regelmässig kontrollieren. Es kann zu einer Thrombose (Blutgerinnsel in den Gefässen) kommen.
Selten kam es zu Allergien oder Hautreaktionen, wie z.B. Ausschlag, Nesselsucht, Juckreiz oder Reaktionen an der Injektionsstelle.
Sehr selten kam es zu ernsthaften allergische Reaktionen, insbesondere direkt nach der Injektion.
Sehr selten wurde insbesondere zu Beginn der Behandlung von grippeähnlichen Symptomen wie Fieber, Frösteln, Kopfschmerzen, Gliederschmerzen, Unwohlsein und/oder Knochenschmerzen berichtet. Diese Reaktionen waren mild bis mässig-gradig und verschwanden nach wenigen Stunden oder Tagen.
Zusätzliche Nebenwirkungen bei Patientinnen und Patienten mit chronischer Nierenerkrankung
Die häufigsten Nebenwirkungen unter der Behandlung mit Recormon ist eine dosisabhängige Erhöhung des Blutdruckes bzw. die Verstärkung eines bereits bestehenden Bluthochdruckes und Kopfschmerzen. Diese Blutdruckerhöhungen lassen sich medikamentös behandeln. Darüber hinaus wird Ihr Arzt oder Ihre Ärztin auch insbesondere zu Beginn der Behandlung eine Blutdruckkontrolle vornehmen.
Bei einzelnen Patientinnen und Patienten mit normalem oder niedrigem Blutdruck können auch Blutdruckentgleisungen mit Anzeichen auftreten, die gewissen Gehirnerkrankungen ähneln, wie z.B. Kopfschmerzen, Verwirrtheitszustände, Sinnes- und Bewegungsstörungen (Sprachstörungen, Gangstörungen) sowie Krampfanfälle. In diesen Fällen muss sofort ein Arzt bzw. eine Ärztin beigezogen werden, der bzw. die die notwendigen Notfallmassnahmen einleitet.
Während der Therapie mit Erythropoetin wurden Fälle von sog. Erythroblastopenie beobachtet (pure red cell aplasia, PRCA: der Körper bildet keine oder nur verminderte rote Blutkörperchen). Einzelfälle hat es auch mit Recormon gegeben. In solchen Fällen darf Recormon oder ein anderes Erythropoetin nicht mehr angewendet werden. Sehr selten kann es zu Thrombose (Blutgerinnsel in den Gefässen) kommen.
Zusätzliche Nebenwirkungen bei Patientinnen und Patienten mit Tumorerkrankungen
Gelegentlich kann es zu einem Anstieg des Blutdrucks kommen, der medikamentös behandelt werden kann. Gelegentlich können auch Kopfschmerzen auftreten.
Ein Anstieg im Auftreten von Thrombosen (Blutgerinnseln) wurde beobachtet.
Wenn Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind, sollten Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin informieren.
Was ist ferner zu beachten?
Um einen Wirkungsverlust auszuschliessen, sind folgende Hinweise zu beachten:
Zur Injektion nur die beigefügte, steril verpackte Injektionsnadel verwenden!
Recormon PS muss im Umkarton aufbewahrt werden, um den Inhalt vor Licht zu schützen und ist im Kühlschrank (2-8 °C) zu lagern.
Die Kühlkette darf nicht unterbrochen werden. Im Rahmen der ambulanten Behandlung kann Recormon PS einmalig für einen Zeitraum von maximal 3 Tagen ausserhalb des Kühlschranks bei Raumtemperatur (nicht über 25 °C) gelagert werden.
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Das Arzneimittel ist ausserhalb der Reichweite von Kindern aufzubewahren.
Jede Fertigspritze darf nur für eine Injektion verwendet werden.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin; diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Recormon PS enthalten?
Recormon PS enthält als Wirkstoff Epoetin beta (rekombinantes humanes Erythropoetin). Dieser Wirkstoff wird aus gentechnisch veränderten Tierzellen hergestellt. Der Hilfsstoff Polysorbat 20 wird aus gentechnisch verändertem Mais hergestellt.
Recormon PS 2000
Wirkstoff
1 Fertigspritze enthält 2000 IE Epoetin beta.
Hilfsstoffe
Harnstoff, Natriumchlorid, Natriumdihydrogenphosphat, Natriummonohydrogenphosphat, Kalziumchlorid, Polysorbat 20, Glycin, Leucin, Isoleucin, Threonin, Glutaminsäure, Phenylalanin.
Lösungsmittel: steriles Wasser.
Recormon PS 3000
Wirkstoff
1 Fertigspritze enthält 3000 IE Epoetin beta.
Hilfsstoffe
Harnstoff, Natriumchlorid, Natriumdihydrogenphosphat, Natriummonohydrogenphosphat, Kalziumchlorid, Polysorbat 20, Glycin, Leucin, Isoleucin, Threonin, Glutaminsäure, Phenylalanin. Lösungsmittel: steriles Wasser.
Recormon PS 4000
Wirkstoff
1 Fertigspritze enthält 4000 IE Epoetin beta.
Hilfsstoffe
Harnstoff, Natriumchlorid, Natriumdihydrogenphosphat, Natriummonohydrogenphosphat, Kalziumchlorid, Polysorbat 20, Glycin, Leucin, Isoleucin, Threonin, Glutaminsäure, Phenylalanin. Lösungsmittel: steriles Wasser.
Recormon PS 5000
Wirkstoff
1 Fertigspritze enthält 5000 IE Epoetin beta.
Hilfsstoffe
Harnstoff, Natriumchlorid, Natriumdihydrogenphosphat, Natriummonohydrogenphosphat, Kalziumchlorid, Polysorbat 20, Glycin, Leucin, Isoleucin, Threonin, Glutaminsäure, Phenylalanin. Lösungsmittel: steriles Wasser.
Recormon PS 10'000
Wirkstoff
1 Fertigspritze enthält 10'000 IE Epoetin beta.
Hilfsstoffe
Harnstoff, Natriumchlorid, Natriumdihydrogenphosphat, Natriummonohydrogenphosphat, Kalziumchlorid, Polysorbat 20, Glycin, Leucin, Isoleucin, Threonin, Glutaminsäure, Phenylalanin. Lösungsmittel: steriles Wasser.
Recormon PS 30'000
Wirkstoff
1 Fertigspritze enthält 30'000 IE Epoetin beta.
Hilfsstoffe
Harnstoff, Natriumchlorid, Natriumdihydrogenphosphat, Natriummonohydrogenphosphat, Kalziumchlorid, Polysorbat 20, Glycin, Leucin, Isoleucin, Threonin, Glutaminsäure, Phenylalanin. Lösungsmittel: steriles Wasser.
Zulassungsnummer
54766 (Swissmedic).
Wo erhalten Sie Recormon PS? Welche Packungen sind erhältlich?
In Apotheken gegen ärztliche Verschreibung, die nur zum einmaligen Bezug berechtigt.
Recormon PS 2000
Packung mit 6 Fertigspritzen mit gebrauchsfertiger Injektionslösung und 6 Kanülen 27G ½.
Recormon PS 3000
Packung mit 6 Fertigspritzen mit gebrauchsfertiger Injektionslösung und 6 Kanülen 27G ½.
Recormon PS 4000
Packung mit 6 Fertigspritzen mit gebrauchsfertiger Injektionslösung und 6 Kanülen 27G ½.
Recormon PS 5000
Packung mit 6 Fertigspritzen mit gebrauchsfertiger Injektionslösung und 6 Kanülen 27G ½.
Recormon PS 10'000
Packung mit 6 Fertigspritzen mit gebrauchsfertiger Injektionslösung und 6 Kanülen 27G ½.
Recormon PS 30'000
Packung mit 4 Fertigspritzen mit gebrauchsfertiger Injektionslösung und 4 Kanülen 27G ½.
Zulassungsinhaberin
Roche Pharma (Schweiz) AG, Basel.
Diese Packungsbeilage wurde im Juli 2019 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Gebrauchsanweisung für Recormon PS
Recormon PS wird als gebrauchsfertige Injektionslösung in Fertigspritzen angeboten. Die Lösung wird subkutan (das heisst unter die Haut) gespritzt. Die intravenöse Verabreichung darf nur durch medizinisches Fachpersonal erfolgen. Üblicherweise wird die erste Dosis unter ärztliche Kontrolle verabreicht, da die Möglichkeit einer allergischen Reaktion besteht. Wenn es Ihnen gezeigt wurde, wie man die Lösung verabreicht, können Sie sich auch selbst die Lösung spritzen.
Nur klare oder leicht opaleszierende (schillernde), farblose und von sichtbaren Teilchen freie Lösungen dürfen gespritzt werden.
Zuerst Hände waschen!
- Fertigspritze der Verpackung entnehmen und Lösung auf Klarheit überprüfen
Nehmen Sie eine Fertigspritze aus der Verpackung und überprüfen Sie, ob die Lösung klar, farblos und frei von sichtbaren Schwebeteilen ist. - Schutzkappe der Fertigspritze entfernen und Nadel aufsetzen
Entfernen Sie die Gummi-Schutzkappe von der Fertigspritze. Nehmen Sie die steril verpackte Nadel aus demselben Fach der Packung und setzen Sie anschliessend die Nadel auf die Fertigspritze. Drehen Sie die Nadel vorsichtig, bis sie fest sitzt. Bewegen Sie das Sicherheitsschild von der Nadel weg in Richtung Spritzenkörper. Entfernen Sie die Schutzkappe von der Nadel durch gerades Auseinanderziehen. - Entfernen der Luft aus der Fertigspritze
Entfernen Sie die Luft aus der Spritze und der Nadel, indem Sie die Spritze senkrecht nach oben halten und den Kolben leicht nach oben drücken. Drücken Sie den Kolben danach soweit nach oben, dass die verordnete Menge an Recormon in der Spritze bleibt. - Injizieren
Desinfizieren Sie die Haut an der Einstichstelle mit einem Alkoholtupfer. Bilden Sie mit Hilfe von Daumen und Zeigefinger eine Hautfalte. Stechen Sie die Nadel ruckartig in die Hautfalte und spritzen Sie die Recormon-Lösung. Ziehen Sie die Nadel schnell heraus und drücken Sie einen trockenen, sterilen Tupfer fest auf die Einstichstelle. - Nach der Injektion
Schieben Sie das Sicherheitsschild in einem Winkel von 90° vom Spitzenkörper weg nach vorne. Halten Sie die Spritze mit einer Hand und drücken Sie das Sicherheitsschild mit einer festen, raschen Bewegung gegen eine ebene Fläche, bis Sie ein Klickgeräusch hören.
Qu’est-ce que le Recormon et quand doit-il être utilisé?
La substance active de Recormon est l'érythropoïétine, substance sécrétée par les reins de l'homme et de la femme en bonne santé. Transportée par le sang, elle atteint la moelle osseuse où elle stimule la formation des globules rouges. En présence d'une maladie rénale chronique, l'organisme ne peut plus produire assez d'érythropoïétine, et la production de globules rouges baisse. Il en résulte chez les patients une anémie symptomatique, qui est corrigée par l'administration de Recormon.
Recormon est aussi utilisé pour augmenter le volume du sang du patient lorsqu'il est prélevé en vue d'une intervention. Recormon est indiqué pour traiter une anémie chez des adultes souffrant de certaines formes de cancer et traités par chimiothérapie. Votre médecin vous renseignera volontiers sur ces possibilités d'utilisation.
Recormon ne doit être utilisé que sur prescription du médecin.
Quand Recormon ne doit-il pas être utilisé?
Recormon ne doit pas être utilisé par des patients souffrant d'une hypertension difficile à contrôler, ni en cas d'hypersensibilité à l'érythropoïétine ou à d'autres composants du médicament.
Recormon ne doit pas être utilisé si un prélèvement de sang autologue est prévu avant une opération et si vous avez souffert d'un infarctus du myocarde ou d'une attaque cérébrale dans le mois précédant le traitement ou si vous souffrez d'une angine de poitrine instable ou si vous présentez un risque de thromboses veineuses profondes (caillots de sang dans les vaisseaux).
Recormon ne doit pas non plus être utilisé pendant la grossesse et l'allaitement, pas plus que chez l'enfant de moins de 2 ans, faute d'expérience suffisante.
Quelles sont les précautions à observer lors de l’utilisation de Recormon?
Recormon doit être utilisé avec prudence en présence d'une maladie accompagnée de convulsions de type épileptique, d'un taux de plaquettes trop élevé (thrombocytose) ou d'une maladie hépatique chronique.
Une prudence particulière s'impose si votre anémie ne s'améliore pas sous le traitement par Recormon.
Vous ne devez pas être traité par Recormon si vous avez développé des anticorps contre l'érythropoïétine et une érythroblastopénie (diminution ou même absence de production de globules rouges) pendant un traitement antérieur par un autre produit contenant de l'érythropoïétine.
L'augmentation de la tension artérielle fréquemment constatée en fonction de la dose administrée, surtout en début de traitement, sera traitée par des médicaments adéquats que le médecin vous prescrira. Dans des cas isolés, même des patients dont la tension artérielle est normale ou basse peuvent présenter des poussées d'hypertension, parfois annoncées par de brusques maux de tête lancinants, de type migraineux. Consultez sans tarder le médecin dès l'apparition de tels symptômes!
Si vous souffrez d'un cancer, veuillez noter que les époétines peuvent agir comme des facteurs de croissance. Veuillez discuter des possibles risques avec votre médecin.
Si vous êtes atteint d'une maladie rénale chronique, votre médecin s'assurera que votre hémoglobine ne dépasse pas une certaine valeur. Un taux élevé d'hémoglobine est susceptible de vous exposer à un risque de problèmes cardiaques et vasculaires, tels que des thromboses (caillots de sang dans les vaisseaux), et d'augmenter le risque de décès.
Vu que le nombre de globules rouges augmente, le sang devient plus visqueux. Le médecin vous informera qu'au cours du traitement, une augmentation de la dose d'héparine est donc fréquemment nécessaire pendant l'hémodialyse.
Des réactions cutanées graves, telles que le syndrome de Stevens-Johnson (SSJ) et la nécrolyse épidermique toxique (NET, syndrome de Lyell), ont été rapportées chez des patients traités par de l'époétine. Des cas particulièrement graves ont été observés lors de l'administration de formes retard. Au début, le SSJ / la NET peut se manifester par des lésions en cocarde (cercles concentriques) rouges ou des taches rondes, dont le centre se couvre en général d'une bulle, au niveau du tronc. Des ulcérations peuvent aussi apparaître dans les régions de la bouche, de la gorge, du nez, des parties génitales et des yeux (yeux rouges et gonflés). Ces réactions graves d'hypersensibilité cutanée sont souvent précédées de fièvre et/ou de symptômes grippaux. Les éruptions cutanées peuvent entraîner le décollement de la peau sur une grande surface et des complications potentiellement mortelles. Si une éruption grave ou un autre de ces symptômes cutanés survient chez vous, arrêtez aussitôt le traitement par Recormon et consultez immédiatement votre médecin ou rendez-vous directement au service des urgences.
Mise en garde
L'abus de ce médicament par des personnes en bonne santé, par exemple à des fins de dopage, peut entraîner une augmentation excessive du nombre de globules rouges dans le sang (hématocrite). A cet égard, des complications cardiovasculaires (sous forme de thromboses) risquant d'être fatales aux personnes concernées ont été rapportées.
Recormon contient de la phénylalanine; ceci pose un problème chez les patients présentant une phénylcétonurie (une maladie métabolique héréditaire). Si vous en êtes atteint, vous devez vous parler du traitement avec votre médecin.
Veuillez informer votre médecin ou votre pharmacien si
- vous souffrez d'une autre maladie,
- vous êtes allergique,
- vous prenez déjà d'autres médicaments en usage interne ou externe (même en automédication!).
Recormon peut-il être utilisé pendant la grossesse ou l’allaitement?
Recormon ne doit pas être utilisé pendant la grossesse ou l'allaitement.
Comment utiliser Recormon?
Les formulations de Recormon peuvent être administrées par voie sous-cutanée (sous la peau) ou intraveineuse (dans une veine). Dans le deuxième cas, l'administration doit être effectuée par une personne compétente.
Votre médecin vous donnera régulièrement des directives détaillées sur les doses à prendre.
Traitement par Recormon chez des patients souffrant d'une maladie rénale
Le traitement par Recormon chez les patients souffrant d'une affection rénale comporte deux phases distinctes:
Phase de correction
La phase de correction a pour but d'augmenter le taux d'hémoglobine entre 10 et 12 g/dl. Le médecin contrôlera en permanence le résultat du traitement et veillera à ce que ce taux ne dépasse pas les 12 g/dl.
Votre médecin vous donnera régulièrement des directives détaillées sur les doses à prendre.
En général, les doses prescrites sont les suivantes:
la dose initiale est de 3× 20 UI par kg de poids corporel par semaine;
si le taux d'hémoglobine ne remonte pas suffisamment, la dose pourra être augmentée chaque mois de 3× 20 UI/kg de poids corporel par semaine.
La dose hebdomadaire peut aussi être répartie en doses quotidiennes.
En aucun cas, on ne dépassera la dose maximale de 720 UI/kg de poids corporel par semaine.
Phase d'entretien
Votre médecin vous donnera régulièrement des directives détaillées sur les doses à prendre.
En général, les doses prescrites sont les suivantes:
Afin de maintenir le taux d'hémoglobine entre 10 et 12 g/dl, la dose est tout d'abord fixée à la moitié de la dernière dose administrée en phase de correction. On ne doit pas dépasser un taux d'hémoglobine de 12 g/dl. Par la suite, le médecin adaptera toutes les semaines ou toutes les deux semaines la dose à vos besoins individuels.
La dose d'entretien hebdomadaire peut être injectée par voie sous-cutanée en une seule fois ou répartie en trois à sept doses unitaires. Les patients dont l'état est stable lors d'une administration monohebdomadaire peuvent passer à un rythme d'administration d'une fois toutes les deux semaines. Dans ce cas, une augmentation de la dose peut s'avérer nécessaire.
En cas d'utilisation chez l'enfant, on s'en tiendra au schéma posologique recommandé puisqu'on ne peut préjuger de la réponse individuelle.
Le traitement par Recormon est conçu pour une longue durée. L'interruption du traitement, qui peut se faire en tout temps, peut être ordonnée le cas échéant par le médecin.
Traitement par Recormon chez des patients souffrant d'une affection tumorale
Votre médecin commence le traitement par Recormon lorsque votre taux d'hémoglobine est inférieur ou égal à 10 g/dl. Après le commencement du traitement, votre médecin stabilisera votre taux d'hémoglobine entre 10 et 12 g/dl.
Traitement d'une anémie symptomatique chez des adultes souffrant de certaines formes de cancer: la dose initiale est de 450 UI/kg par semaine. Une dose fixe de 30 000 UI est normalement donnée une fois par semaine. Si nécessaire, votre médecin ajustera la dose en fonction de votre poids corporel. Si l'effet du traitement s'avère insuffisant, la dose peut être doublée. On ne doit pas dépasser un taux d'hémoglobine de 12 g/dl. La durée du traitement est fonction des besoins du patient.
Au terme de la chimiothérapie, le traitement par Recormon devrait être poursuivi chez les patients souffrant de tumeur solide pendant une période pouvant aller jusqu'à 3 semaines.
La dose peut être administrée en une injection sous-cutanée une fois par semaine ou être fractionnée en trois à sept doses unitaires par semaine.
C'est à votre médecin de déterminer la dose et l'intervalle auxquels doit être injecté Recormon. Ne changez pas de votre propre chef la dose prescrite. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou, au contraire, trop forte.
Précisions sur le mode d'emploi
L'injection sous-cutanée doit se faire dans des conditions stériles. Avant de procéder à la première injection de Recormon PS selon les indications figurant en fin de texte, il est indispensable que le médecin vous instruise avec précision et que vous suiviez ses instructions à la lettre. Tout au long du traitement, le médecin contrôlera à intervalles réguliers les injections que vous vous ferez (voir «Mode d'emploi de Recormon PS» en fin de texte).
Quels effets secondaires Recormon peut-il provoquer?
La prise de Recormon peut entraîner les effets secondaires ci-après.
Des éruptions cutanées graves, telles que le syndrome de Stevens-Johnson et la nécrolyse épidermique toxique, ont été observées lors de l'injection de Recormon. Elles peuvent comprendre les symptômes suivants:
- Lésions en cocarde (cercles concentriques) rouges ou taches rondes, dont le centre se couvre en général d'une bulle, au niveau du tronc,
- Décollement de la peau,
- Ulcérations au niveau de la bouche, de la gorge, du nez, des parties génitales et des yeux,
- Fièvre et symptômes grippaux (auparavant).
Arrêtez aussitôt le traitement par Recormon si vous présentez ces symptômes et consultez immédiatement votre médecin ou rendez-vous directement au service des urgences.
Le taux de fer sanguin peut diminuer chez la plupart des patients. De nombreux patients doivent donc prendre une préparation à base de fer pendant le traitement par Recormon.
Au début du traitement, le nombre de plaquettes sanguines (nombre de thrombocytes) qui jouent un rôle important dans la coagulation sanguine, peut augmenter: le médecin contrôlera régulièrement ce nombre pendant les 8 premières semaines. La survenue d'une thrombose (caillot de sang dans les vaisseaux) est possible.
Des allergies ou réactions cutanées, telles qu'éruption cutanée, urticaire, démangeaisons ou réactions au site d'injection, ont rarement été observées.
De très rares cas de réactions allergiques sérieuses, notamment juste après l'injection ont été observés.
Des symptômes d'allure grippale, tels que fièvre, frissons, maux de tête, courbatures, malaise et/ou douleurs des os, ont très rarement été rapportés, notamment au début du traitement. Ces réactions ont été d'intensité légère à modérée et ont disparu au bout de quelques heures ou jours.
Effets secondaires supplémentaires chez les patients atteints d'une maladie rénale chronique
L'effet indésirable le plus souvent observé sous traitement par Recormon est – en fonction de la dose administrée – une augmentation de la tension artérielle ou l'aggravation d'une hypertension déjà existante et des maux de tête. Le traitement de cette tension accrue se fait par voie médicamenteuse.
Par ailleurs, votre médecin contrôlera aussi votre tension artérielle surtout en début de traitement.
Dans des cas isolés, des patients ayant une tension artérielle normale ou basse peuvent présenter des poussées d'hypertension accompagnées de symptômes évoquant certains troubles cérébraux: maux de tête, confusion, troubles affectant les phénomènes sensoriels et l'activité motrice (troubles du langage et de la marche), et même convulsions. Dans de tels cas, on alertera sans tarder le médecin, qui ordonnera les mesures d'urgence nécessaires.
Des cas «d'érythroblastopénie» (pure red cell aplasia, PRCA: le corps ne produit plus ou que peu de globules rouges) ont été observés pendant le traitement par l'érythropoïétine. Des cas isolés sont aussi survenus avec Recormon. Dans de tels cas, il ne faut plus utiliser Recormon ni une autre érythropoïétine. La survenue d'une thrombose (caillot de sang dans les vaisseaux) est très rare.
Effets secondaires supplémentaires chez les patients atteints d'affections tumorales
Une augmentation de la tension artérielle qui peut être traitée par des médicaments peut occasionnellement survenir. Des maux de tête peuvent aussi se voir occasionnellement.
Une augmentation de la fréquence des thromboses (caillots de sang) a été observée.
Si vous remarquez d'autres effets secondaires, veuillez en informer votre médecin ou votre pharmacien.
À quoi faut-il encore faire attention?
Se référer aux instructions ci-après pour éviter une perte d'efficacité du produit:
Pour l'injection, utiliser uniquement l'aiguille sous emballage stérile livrée avec le médicament!
Recormon PS doit être conservé dans le carton d'origine, à l'abri de la lumière et au réfrigérateur (2-8 °C).
La chaîne du froid ne doit pas être interrompue. Au cours du traitement ambulatoire, Recormon PS peut rester une seule fois à température ambiante (pas au-dessus de 25 °C) hors du réfrigérateur, pendant une durée maximale de 3 jours.
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Le médicament doit être tenu hors de portée des enfants.
Chaque seringue préremplie ne doit être utilisée que pour une injection.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information scientifique détaillée.
Que contient Recormon PS?
Recormon PS contient comme principe actif de l'époétine bêta (érythropoïétine humaine recombinante). Ce principe actif est fabriqué à partir de cellules animales génétiquement modifiées. L'adjuvant polysorbate 20 est produit à partir de maïs génétiquement modifié.
Recormon PS 2000
Principe actif
1 seringue préremplie contient 2000 UI d'époétine bêta.
Excipients
Urée, chlorure de sodium, phosphate dibasique de sodium, phosphate monobasique de sodium, chlorure de calcium, polysorbate 20, glycine, leucine, isoleucine, thréonine, acide glutamique, phénylalanine. Solvant: eau stérile.
Recormon PS 3000
Principe actif
1 seringue préremplie contient 3000 UI d'époétine bêta.
Excipients
Urée, chlorure de sodium, phosphate dibasique de sodium, phosphate monobasique de sodium, chlorure de calcium, polysorbate 20, glycine, leucine, isoleucine, thréonine, acide glutamique, phénylalanine. Solvant: eau stérile.
Recormon PS 4000
Principe actif
1 seringue préremplie contient 4000 UI d'époétine bêta.
Excipients
Urée, chlorure de sodium, phosphate dibasique de sodium, phosphate monobasique de sodium, chlorure de calcium, polysorbate 20, glycine, leucine, isoleucine, thréonine, acide glutamique, phénylalanine. Solvant: eau stérile.
Recormon PS 5000
Principe actif
1 seringue préremplie contient 5000 UI d'époétine bêta.
Excipients
Urée, chlorure de sodium, phosphate dibasique de sodium, phosphate monobasique de sodium, chlorure de calcium, polysorbate 20, glycine, leucine, isoleucine, thréonine, acide glutamique, phénylalanine. Solvant: eau stérile.
Recormon PS 10'000
Principe actif
1 seringue préremplie contient 10'000 UI d'époétine bêta.
Excipients
Urée, chlorure de sodium, phosphate dibasique de sodium, phosphate monobasique de sodium, chlorure de calcium, polysorbate 20, glycine, leucine, isoleucine, thréonine, acide glutamique, phénylalanine. Solvant: eau stérile.
Recormon PS 30'000
Principe actif
1 seringue préremplie contient 30'000 UI d'époétine bêta.
Excipients
Urée, chlorure de sodium, phosphate dibasique de sodium, phosphate monobasique de sodium, chlorure de calcium, polysorbate 20, glycine, leucine, isoleucine, thréonine, acide glutamique, phénylalanine. Solvant: eau stérile.
Numéro d’autorisation
54766 (Swissmedic).
Où obtenez-vous Recormon PS? Quels sont les emballages à disposition sur le marché?
En pharmacie, seulement sur ordonnance médicale non renouvelable.
Recormon PS 2000
Emballage comprenant 6 seringues préremplies de solution injectable et 6 canules 27 G ½.
Recormon PS 3000
Emballage comprenant 6 seringues préremplies de solution injectable et 6 canules 27 G ½.
Recormon PS 4000
Emballage comprenant 6 seringues préremplies de solution injectable et 6 canules 27 G ½.
Recormon PS 5000
Emballage comprenant 6 seringues préremplies de solution injectable et 6 canules 27 G ½.
Recormon PS 10'000
Emballage comprenant 6 seringues préremplies de solution injectable et 6 canules 27 G ½.
Recormon PS 30'000
Emballage comprenant 4 seringues préremplies de solution injectable et 4 canules 27 G ½.
Titulaire de l’autorisation
Roche Pharma (Suisse) SA, Bâle.
Cette notice d'emballage a été vérifiée pour la dernière fois en juillet 2019 par l'autorité de contrôle des médicaments (Swissmedic).
Mode d’emploi de Recormon PS
Recormon PS est présenté sous forme de solution injectable prête à l’emploi, contenue dans des seringues. La solution est injectée par voie sous-cutanée (c'est-à-dire sous la peau). L’administration intraveineuse doit impérativement être effectuée par une personne compétente. La première dose est habituellement administrée sous contrôle médical, étant donné l’éventualité d’une réaction allergique. Si l’on vous a montré comment administrer la solution, vous pouvez aussi vous l’injecter vous-même.
Seules des solutions limpides ou légèrement opalescentes (irisées), incolores et exemptes de particules visibles peuvent être injectées.
Commencez par vous laver les mains!
- Sortir la seringue de l’emballage et vérifier la limpidité de la solution
Retirez la seringue de l’emballage et contrôlez si la solution est limpide, incolore et exempte de particules visibles en suspension. - Oter le capuchon de la seringue et fixer l’aiguille
Retirez le capuchon en caoutchouc de la seringue. Prenez l’aiguille sous emballage stérile dans le même compartiment de l’emballage et fixez-la sur la seringue préremplie. Vissez l’aiguille avec précaution jusqu’à ce qu’elle soit solidement fixée. Déplacez le dispositif de sécurité de l’aiguille en direction du corps de la seringue. Otez le capuchon de protection de l’aiguille en le tirant dans l’axe sans exercer de mouvement rotatif. - Expulser l’air contenu dans la seringue
Expulsez l’air contenu dans la seringue et dans l’aiguille en tenant la seringue verticalement vers le haut et en poussant légèrement le piston vers le haut. Poussez ensuite le piston vers le haut jusqu’à ce qu’il ne reste plus dans la seringue que la quantité prescrite de Recormon. - Injecter la solution
Désinfectez la peau au point d'injection avec un tampon imbibé d'alcool. Formez un pli avec la peau à l'aide du pouce et de l’index, et piquez l’aiguille d’un geste décidé dans le pli cutané. Injectez la solution de Recormon. Retirez vivement l’aiguille et pressez un tampon sec et stérile sur le point d’injection. - Après l’injection
Poussez le dispositif de sécurité de l’aiguille vers l’avant suivant un angle de 90° par rapport au corps de la seringue. Tenez la seringue d’une main et appuyez le dispositif de sécurité contre une surface plane d’un mouvement ferme et rapide jusqu’à ce que vous entendiez un clic.
Che cos'è Recormon e quando si usa?
Il principio attivo del Recormon è l'eritropoietina, una sostanza che nelle persone sane viene sintetizzata nei reni. Attraverso il circolo sanguigno, l'eritropoietina penetra nel midollo osseo, dove stimola la produzione dei globuli rossi. In caso di una malattia renale cronica, l'organismo non è più in grado di sintetizzare l'eritropoietina e di conseguenza vengono prodotti troppo pochi globuli rossi. L'anemia sintomatica che ne consegue viene corretta somministrando Recormon.
Recormon si usa anche per l'autoemotrasfusione prima di un intervento chirurgico.
Recormon è indicato per il trattamento dell'anemia sintomatica nei soggetti adulti affetti da alcuni tumori e sottoposti a chemioterapia. Per ulteriori informazioni circa questa possibilità d'uso può rivolgersi al Suo medico curante.
Recormon si può usare solamente su prescrizione medica.
Quando non si può usare Recormon?
Recormon non dovrebbe essere somministrato a soggetti con ipertensione arteriosa difficilmente controllabile e a pazienti con ipersensibilità verso l'eritropoietina o gli altri componenti del farmaco.
Recormon non può essere utilizzato in previsione di un'autoemotrasfusione prima di un intervento chirurgico se nel mese precedente al trattamento il paziente ha subito un infarto miocardico o un ictus cerebrale, se soffre di angina pectoris o se presenta un rischio di trombosi venosa profonda (formazione di coaguli nelle vene).
Recormon è controindicato anche in gravidanza, allattamento e nei bambini di età inferiore ai due anni, in quanto finora non si hanno esperienze in merito a tale utilizzo.
Quando è richiesta prudenza nell’uso di Recormon?
Recormon va usato con prudenza in caso di malattie accompagnate da accessi convulsivi di tipo epilettico, tassi troppo elevati di piastrine (trombocitosi), insufficienza epatica cronica.
Va usata particolare prudenza se l'anemia non migliora con il trattamento con Recormon.
Se lei ha sviluppato anticorpi contro l'eritropoietina e un'eritroblastopenia (produzione diminuita o totalmente assente di globuli rossi) nel corso di un trattamento precedente con un altro preparato a base di eritropoietina, non deve assumere Recormon.
L'aumento dose-dipendente della pressione sanguigna, che si manifesta spesso soprattutto all'inizio della terapia, verrà trattato dal medico con farmaci specifici. Vi sono stati rari casi di alterazione dei valori pressori anche in pazienti con pressione sanguigna normale o bassa. Mal di testa improvvisi (tipo emicrania), con dolori acuti e lancinanti possono essere un campanello d'allarme. In questo caso si rivolga immediatamente al medico!
Qualora Lei fosse un paziente oncologico, ricordi che le epoetine possono agire da fattori di crescita. Parli delle possibilita di questo argomento con il Suo medico.
Qualora Lei soffrisse di una malattia renale cronica, il medico controllerà che il tasso di emoglobina non superi un valore prestabilito. Un'eccessiva presenza di emoglobina potrebbe esporla al rischio di disturbi cardiaci e vascolari come una trombosi (formazione di coaguli nei vasi sanguigni) e metterla in pericolo di morte.
A causa dell'aumento del numero dei globuli rossi, il sangue diventa più denso. Per questo motivo la terapia con Recormon richiede spesso di dover aumentare la dose di eparina durante l'emodialisi.
Gravi reazioni cutanee, tra cui la sindrome di Stevens-Johnson (SJS) e la necrolisi epidermica tossica (TEN), sono state riportate in associazione con trattamenti con epoetina. Sono stati osservati casi gravi in associazione alle epoetine a lunga durata d'azione. SJS/TEN possono insorgere inizialmente con macule rossastre a bersaglio o macchie circolari, spesso con una bolla al centro, sul tronco. Potrebbero manifestarsi anche ulcere della bocca, gola, naso, genitali e occhi (occhi gonfi e arrossati). Queste reazioni cutanee gravi sono spesso precedute da febbre e/o sintomi simil-influenzali. Le eruzioni cutanee possono progredire con una esfoliazione diffusa della pelle e complicazioni pericolose per la vita. Se manifesta un'eruzione cutanea grave o un altro di questi sintomi cutanei, interrompa immediatamente il trattamento con Recormon e contatti tempestivamente il Suo medico o si sottoponga immediatamente a una visita medica.
Avvertenza
L'abuso di questo farmaco nelle persone sane, p.es. a scopo di doping, può determinare un aumento eccessivo del numero dei globuli rossi (ematocrito). In questo contesto sono state descritte complicanze cardiovascolari (trombosi) che possono mettere in pericolo la vita del soggetto.
Recormon contiene fenilalanina, il che può costituire un problema nei pazienti affetti da fenilchetonuria (una malattia congenita del metabolismo). Se è il Suo caso, ne discuta con il medico prima di iniziare il trattamento.
Informi il Suo medico o il Suo farmacista nel caso in cui
- soffre di altre malattie,
- soffre di allergie o
- assume o applica (medicamento per uso esterno!) altri medicamenti (anche se acquistati di Sua iniziativa!).
Si può usare Recormon durante la gravidanza o l'allattamento?
Non somministrare Recormon durante la gravidanza e l'allattamento.
Come usare Recormon?
Le formulazioni di Recormon possono essere somministrate sia per via sottocutanea che per via endovenosa. La somministrazione endovenosa dovrebbe essere effettuata soltanto dal personale medico qualificato. Il Suo medico Le darà regolarmente indicazioni precise riguardo al dosaggio.
Terapia con Recormon nei pazienti affetti da una malattia renale
La terapia con Recormon nei pazienti con una malattia renale si articola in due fasi:
Fase di correzione
Lo scopo della fase di correzione è di aumentare il tasso di emoglobina a 10-12 g/dl. Il medico controllerà regolarmente il risultato della terapia, affinché non venga superato il valore di 12 g/dl.
Il Suo medico Le darà regolarmente indicazioni precise per quanto riguarda il dosaggio.
In generale vale il seguente schema posologico:
la dose iniziale è di 3× 20 UI/kg di peso corporeo/settimana.
Se il valore dell'emoglobina non aumenta in misura sufficiente, si può incrementare la dose di 3× 20 UI/kg di peso corporeo/settimana ad intervalli mensili.
La dose settimanale può anche essere ripartita in singole somministrazioni giornaliere.
In nessun caso si deve superare la dose massima di 720 UI/kg di peso corporeo/settimana.
Fase di mantenimento
Il Suo medico Le darà regolarmente indicazioni precise per quanto riguarda il dosaggio.
In generale vale il seguente schema posologico:
per mantenere i valori dell'emoglobina tra 10 e 12 g/dl, si riduce dapprima il dosaggio alla metà dell'ultima dose impiegata nella fase di correzione. Non si deve superare il valore di 12 g/dl. In seguito il medico stabilirà il dosaggio caso per caso (secondo le necessità del paziente) ad intervalli di una o due settimane.
La dose di mantenimento può essere somministrata una sola volta la settimana mediante iniezione sottocutanea oppure suddivisa in più dosi singole (da tre a sette). I pazienti che sono stabili con una sola iniezione settimanale, possono passare ad una somministrazione ogni due settimane. In questo caso potrebbe essere necessario aumentare la dose.
Per quanto riguarda la somministrazione di Recormon ai bambini, si consiglia di attenersi allo schema posologico descritto, in quanto non è possibile prevedere la risposta individuale.
La terapia con Recormon è generalmente di lunga durata. Un'eventuale interruzione può essere ordinata dal medico ed avvenire in qualsiasi momento.
Trattamento dei pazienti oncologici con Recormon
Il medico avvia il trattamento con Recormon se il valore dell'emoglobina è di 10 g/dl o inferiore. Dopo la fase di avvio, il medico stabilizzerà il tasso di emoglobina tra i 10 e i 12 g/dl.
Per il trattamento dell'anemia sintomatica nei pazienti adulti affetti da determinate malattie oncologiche, la dose iniziale è di 450 UI/kg di peso corporeo/settimana. Di solito viene somministrata una dose fissa di 30'000 UI una volta alla settimana. Se necessario, il medico potrà adattare la dose al Suo peso corporeo. La dose può essere raddoppiata qualora la terapia non risulti sufficientemente efficace. Il valore dell'emoglobina non deve superare 12 g/dl. La durata della terapia dipende dalle necessità del paziente.
Nei pazienti affetti da tumori solidi è opportuno continuare il trattamento con Recormon per altre 3 settimane dopo il termine della chemioterapia.
La somministrazione della dose può avvenire una volta alla settimana per via sottocutanea o essere distribuita in tre fino a sette somministrazioni alla settimana.
Il Suo medico deve stabilire il dosaggio appropriato di Recormon e l'intervallo di tempo tra un'iniezione e l'altra. Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del farmaco sia troppo debole o troppo forte, ne parli al Suo medico o al Suo farmacista.
Avvertenze circa l'uso
L'iniezione sottocutanea deve essere praticata in opportune condizioni di asepsi. Quando si effettua la prima somministrazione di Recormon PS secondo il procedimento illustrato alla fine di questo foglietto, è indispensabile che il medico Le dia istruzioni precise a cui Lei deve attenersi scrupolosamente. Nel corso della terapia il medico controllerà regolarmente come il paziente pratica l'autoiniezione.
(Si veda «Modo d'uso del Recormon PS» in appendice al foglietto illustrativo).
Quali effetti collaterali può avere Recormon?
Con la somministrazione di Recormon possono manifestarsi gli effetti collaterali seguenti:
Gravi eruzioni cutanee, tra cui la sindrome di Stevens-Johnson e la necrolisi epidermica tossica, sono state osservate in associazione con l'iniezione di Recormon. Tra queste si annoverano:
- macule rossastre a bersaglio o macchie circolari, spesso con una bolla al centro, sul tronco;
- esfoliazione della pelle;
- ulcere della bocca, gola, naso, genitali e occhi;
- febbre precedente e sintomi simil-influenzali.
Interrompa immediatamente il trattamento con Recormon, se manifesta uno di questi sintomi, e contatti tempestivamente il Suo medico o si sottoponga immediatamente a una visita medica.
Nella maggior parte dei pazienti può verificarsi una riduzione del livello di ferro nel sangue. Di conseguenza, molte persone devono assumere un preparato a base di ferro nel corso del trattamento con Recormon.
All'inizio della terapia si può avere un aumento del numero di piastrine (importanti per la coagulazione del sangue). Durante le prime 8 settimane di terapia, il medico La sottoporrà a controlli regolari per il rischio di trombosi (formazione di coaguli sanguigni nei vasi).
In rari casi possono manifestarsi reazioni allergiche sulla pelle, come ad esempio eruzione, orticaria, prurito o reazioni nel punto di iniezione.
Molto raramente sono state descritte reazioni allergiche gravi, specialmente subito dopo l'iniezione.
Molto raramente, soprattutto all'inizio del trattamento, sono stati descritti sintomi pseudoinfluenzali quali febbre, brividi, mal di testa, dolori agli arti, malessere diffuso e/o dolori alle ossa. Si è trattato di reazioni di entità da lieve a moderata e scomparse in poche ore o pochi giorni.
Ulteriori effetti collaterali in pazienti con malattie renali croniche
Gli effetti collaterali più frequenti nel trattamento con Recormon sono un aumento dose-dipendente della pressione sanguigna o l'accentuazione di un'ipertensione e il mal di testa. Gli aumenti di pressione si possono curare con farmaci.
Il Suo medico controllerà la pressione sanguigna, soprattutto all'inizio della terapia.
Alcuni pazienti con pressione sanguigna normale o bassa possono pure avere delle alterazioni dei valori pressori, con disturbi simili a quelli causati da determinate malattie cerebrali, come per esempio cefalea, confusione mentale, disturbi sensoriali e motori (disturbi del linguaggio, disturbi della deambulazione), nonché crisi convulsive. In questi casi bisogna rivolgersi subito ad un medico che prenderà le misure d'emergenza necessarie.
Durante la terapia con eritropoietine sono stati descritti casi di cosiddetta eritroblastopenia (pure red cell aplasia, PRCA: il corpo non produce più globuli rossi o solo in misura limitata). In casi isolati ciò è avvenuto anche con Recormon. In tali situazioni bisogna sospendere l'uso di Recormon o della relativa eritropoietina. Molto raramente può verificarsi una trombosi (formazione di coaguli nei vasi sanguigni).
Ulteriori effetti collaterali in pazienti con malattie oncologiche
Occasionalmente può manifestarsi un aumento della pressione sanguigna tale da richiedere un trattamento farmacologico. Talvolta compare anche un mal di testa.
È stato osservato un aumento della frequenza di trombosi (formazione di coaguli nei vasi sanguigni).
Se osserva effetti collaterali qui non descritti, dovrebbe informare il Suo medico o il Suo farmacista.
Di che altro occorre tener conto?
Per escludere una perdita di efficacia del farmaco, occorre osservare quanto segue:
Per l'iniezione utilizzare soltanto l'ago sterile accluso!
Recormon PS deve essere conservato nell'imballaggio esterno, per tenere il contenuto al riparo dalla luce e in frigorifero (2-8 °C).
Generalmente la catena del freddo non deve essere interrotta. È possibile interromperla una sola volta e tenere Recormon PS fuori dal frigorifero a temperatura ambiente (non superiore a 25 °C) per non più di 3 giorni. Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sulla confezione.
Conservare il medicamento fuori della portata dei bambini.
Ogni siringa preriempita deve essere impiegata per una sola iniezione.
Il medico o il farmacista, che sono in possesso di documentazione professionale, possono darle ulteriori informazioni.
Cosa contiene Recormon PS?
Recormon PS contiene come principio attivo l'epoetina beta (eritropoietina umana ricombinante). Questo principio attivo viene prodotto da cellule animali geneticamente modificate. La sostanza ausiliaria polisorbato 20 viene prodotta da mais geneticamente modificato.
Recormon PS 2000
Principio attivo
1 siringa preriempita contiene 2000 UI di epoetina beta.
Sostanze ausiliarie
Urea, sodio cloruro, sodio fosfato bibasico, sodio fosfato monobasico, calcio cloruro, polisorbato 20, glicina, leucina, isoleucina, treonina, acido glutammico, fenilalanina. Solvente: acqua sterile.
Recormon PS 3000
Principio attivo
1 siringa preriempita contiene 3000 UI di epoetina beta.
Sostanze ausiliarie
Urea, sodio cloruro, sodio fosfato bibasico, sodio fosfato monobasico, calcio cloruro, polisorbato 20, glicina, leucina, isoleucina, treonina, acido glutammico, fenilalanina. Solvente: acqua sterile.
Recormon PS 4000
Principio attivo
1 siringa preriempita contiene 4000 UI di epoetina beta.
Sostanze ausiliarie
Urea, sodio cloruro, sodio fosfato bibasico,sodio fosfato monobasico, calcio cloruro, polisorbato 20, glicina, leucina, isoleucina, treonina, acido glutammico, fenilalanina. Solvente: acqua sterile.
Recormon PS 5000
Principio attivo
1 siringa preriempita contiene 5000 UI di epoetina beta.
Sostanze ausiliarie
Urea, sodio cloruro, sodio fosfato bibasico, sodio fosfato monobasico, calcio cloruro, polisorbato 20, glicina, leucina, isoleucina, treonina, acido glutammico, fenilalanina. Solvente: acqua sterile.
Recormon PS 10'000
Principio attivo
1 siringa preriempita contiene 10'000 UI di epoetina beta.
Sostanze ausiliarie
Urea, sodio cloruro, sodio fosfato bibasico, sodio fosfato monobasico, calcio cloruro, polisorbato 20, glicina, leucina, isoleucina, treonina, acido glutammico, fenilalanina. Solvente: acqua sterile.
Recormon PS 30'000
Principio attivo
1 siringa preriempita contiene 30'000 UI di epoetina beta.
Sostanze ausiliarie
Urea, sodio cloruro, sodio fosfato bibasico, sodio fosfato monobasico, calcio cloruro, polisorbato 20, glicina, leucina, isoleucina, treonina, acido glutammico, fenilalanina. Solvente: acqua sterile.
Numero dell’omologazione
54766 (Swissmedic).
Dove è ottenibile Recormon PS? Quali confezioni sono disponibili?
In farmacia dietro presentazione della prescrizione medica non rinnovabile.
Recormon PS 2000
Confezione da 6 siringhe preriempite con soluzione iniettabile pronta all'uso e 6 cannule 27 G ½.
Recormon PS 3000
Confezione da 6 siringhe preriempite con soluzione iniettabile pronta all'uso e 6 cannule 27 G ½.
Recormon PS 4000
Confezione da 6 siringhe preriempite con soluzione iniettabile pronta all'uso e 6 cannule 27 G ½.
Recormon PS 5000
Confezione da 6 siringhe preriempite con soluzione iniettabile pronta all'uso e 6 cannule 27 G ½.
Recormon PS 10'000
Confezione da 6 siringhe preriempite con soluzione iniettabile pronta all'uso e 6 cannule 27 G ½.
Recormon PS 30'000
Confezione da 4 siringhe preriempite con soluzione iniettabile pronta all'uso e 4 cannule 27 G ½.
Titolare dell’omologazione
Roche Pharma (Svizzera) SA, Basilea.
Questo foglietto illustrativo è stato controllato l'ultima volta nel luglio 2019 dall'autorità competente in materia di medicamenti (Swissmedic).
Modo d'uso del Recormon PS
Recormon PS è in vendita sotto forma di soluzione iniettabile pronta all'uso in siringhe preriempite. La soluzione si inietta per via sottocutanea. La somministrazione endovenosa deve essere effettuata soltanto dal personale medico qualificato. Di solito la prima dose viene somministrata sotto sorveglianza medica per il rischio di reazioni allergiche. Dopo che Le è stata mostrata la procedura di somministrazione della soluzione, può praticare da sé l'iniezione. Si possono iniettare soltanto soluzioni limpide o leggermente opalescenti (iridescenti), incolori e prive di particelle visibili.
Prima di tutto lavare le mani!
- Estrarre la siringa preriempita dalla confezione e verificare la limpidezza della soluzione
Estrarre la siringa dalla confezione e controllare se la soluzione è limpida, incolore e priva di particelle in sospensione. - Rimuovere il cappuccio di protezione della siringa preriempita e inserire l’ago
Togliere il cappuccio protettivo di gomma dalla siringa preriempita. Prendere l’ago sterile dallo stesso scomparto della confezione e inserire l’ago sulla siringa preriempita. Ruotare l’ago delicatamente fino a fissarlo. Allontanare la protezione di sicurezza dall’ago in direzione del corpo della siringa. Rimuovere il cappuccio di protezione dall’ago senza inclinarlo. - Fare uscire l’aria dalla siringa preriempita
Per fare uscire l'aria dalla siringa e dall'ago, tenere la siringa con l'ago rivolto verso l’alto. Premere leggermente lo stantuffo, finché nella siringa rimane la quantità prescritta di Recormon. - Iniezione
Disinfettare la pelle nel sito di iniezione con una salvietta imbevuta di alcol. Sollevare la pelle tenendola tra il dito pollice e l'indice, in modo da formare una piega e con un gesto deciso far penetrare l'ago nella pelle. Iniettare la soluzione di Recormon. Estrarre rapidamente l'ago e premere un tampone asciutto sterile sul punto dove è stato inserito l’ago. - Dopo l’iniezione
Allontanare la protezione di sicurezza dal corpo della siringa in avanti fino a formare un angolo di 90°. Tenere la siringa con una mano e premere la protezione di sicurezza contro una superficie piana con un movimento rapido e deciso, fino a quando non si percepisca un clic.
Zusammensetzung
Wirkstoff
Epoetinum beta (rekombinantes humanes Erythropoetin (rhEPO): gentechnologisch hergestellt in CHO-Zellen).
Hilfsstoffe
Recormon PS, Fertigspritze
Ureum, natrii chloridum, natrii dihydrogenphosphas, dinatrii phosphas, calcii chloridum, polysorbatum 20 (aus gentechnisch verändertem Mais hergestellt), glycinum, leucinum, isoleucinum, threoninum, acidum glutamicum, phenylalaninum, aqua ad injectabilia.
Galenische Form und Wirkstoffmenge pro Einheit
Recormon PS 2000
1 Fertigspritze mit gebrauchsfertiger Injektionslösung enthält 2000 IE entsprechend 16,6 µg Epoetin beta.
Excip. q.s. ad solutionem 0,3 ml.
Recormon PS 3000
1 Fertigspritze mit gebrauchsfertiger Injektionslösung enthält 3000 IE entsprechend 24,9 µg Epoetin beta.
Excip. q.s. ad solutionem 0,3 ml.
Recormon PS 4000
1 Fertigspritze mit gebrauchsfertiger Injektionslösung enthält 4000 IE entsprechend 33,2 µg Epoetin beta.
Excip. q.s. ad solutionem 0,3 ml.
Recormon PS 5000
1 Fertigspritze mit gebrauchsfertiger Injektionslösung enthält 5000 IE entsprechend 41,5 µg Epoetin beta.
Excip. q.s. ad solutionem 0,3 ml.
Recormon PS 10’000
1 Fertigspritze mit gebrauchsfertiger Injektionslösung enthält 10’000 IE entsprechend 83 µg Epoetin beta.
Excip. q.s. ad solutionem 0,6 ml.
Recormon PS 30’000
1 Fertigspritze mit gebrauchsfertiger Injektionslösung enthält 30’000 IE entsprechend 249 µg Epoetin beta.
Excip. q.s. ad solutionem 0,6 ml.
Indikationen/Anwendungsmöglichkeiten
Anämie bei Patienten mit chronischer Nierenerkrankung
Behandlung der symptomatischen, transfusionsbedürftigen, renalen Anämie bei chronischer Nierenerkrankung bei dialysierten und nicht dialysierten erwachsenen Patienten und Kindern über 2 Jahre (für Hb-Grenzwerte, siehe «Dosierung/Anwendung»).
Tumorpatienten
Behandlung der symptomatischen Anämie bei erwachsenen Patienten mit nicht-myeloiden malignen Erkrankungen, die eine Chemotherapie erhalten (für Hb-Grenzwerte, siehe «Dosierung/Anwendung»).
Gewinnung von Eigenblut (Eigenblutspendeprogramm)
Steigerung der Menge an Eigenblut bei Patienten, die in ein Eigenblutspendeprogramm zur Vermeidung von Fremdbluttransfusionen einbezogen sind. Die Anwendung in dieser Indikation muss gegenüber dem berichteten erhöhten Risiko für thromboembolische Ereignisse abgewogen werden. Die Behandlung ist bei Patienten mit mässiggradiger Anämie (Hb 10-13 g/dl (6,21-8,07 mmol/l), kein Eisenmangel) indiziert, falls blutsparende Verfahren nicht verfügbar oder unzureichend sind, sofern der geplante grössere chirurgische Eingriff grosse Mengen an Blut erfordert (4 oder mehr Blutkonserven bei Frauen bzw. 5 oder mehr bei Männern) oder die Zeitspanne zu kurz ist, um die benötigte Eigenblutmenge zu gewinnen.
Dosierung/Anwendung
Eine Therapie mit Recormon sollte von Ärztinnen oder Ärzten eingeleitet werden, die Erfahrung in den oben genannten Indikationen haben.
Anämie bei Patienten mit chronischer Nierenerkrankung
Patienten sollten engmaschig überwacht werden, um sicherzustellen, dass die niedrigste zugelassene wirksame Dosis von Recormon angewandt wird um die Symptome der Anämie adäquat zu kontrollieren und dabei einen Hämoglobinwert unter oder gleich 12 g/dl (7.5 mmol/l) einzuhalten. Recormon-Dosissteigerungen bei Patienten mit chronischer Niereninsuffizienz sollten mit Vorsicht erfolgen. Bei Patienten mit schlechtem Ansprechen des Hämoglobinwerts auf Recormon sollten verschiedene Ursachen für das schlechte Ansprechen abgeklärt werden (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen» und «Eigenschaften/Wirkungen»). Die Anämiesymptome und ihre Folgeerscheinungen können sich abhängig von Alter, Geschlecht und allgemeinem Schweregrad der Erkrankung unterscheiden; daher ist eine Beurteilung des klinischen Verlaufs und des Zustandes des jeweiligen Patienten durch eine Ärztin oder einen Arzt erforderlich. Alle Recormon Formulierungen können sowohl subkutan als auch intravenös verabreicht werden, um das Hämoglobin auf einen Wert von maximal 12 g/dl (7,5 mmol) anzuheben.
Dabei wird bei subkutaner im Vergleich zu intravenöser Verabreichung das Ziel eines maximalen Hämoglobinwertes von 12 g/dl (7,5 mmol) mit einer um etwa 20-25% geringeren Dosis erreicht.
Aufgrund intraindividueller Schwankungen bei den Patienten können gelegentlich einzelne Hämoglobinwerte beobachtet werden, die über oder unter dem erwünschten Hämoglobinspiegel liegen. Derartige Hämoglobin-Schwankungen sollten mittels Anpassung der Dosis ausgeglichen werden, wobei der Hämoglobin-Zielbereich von 10 g/dl (6,2 mmol/l) bis 12 g/dl (7,5 mmol/l) zu berücksichtigen ist. Ein anhaltender Hämoglobinspiegel über 12 g/dl (7,5 mmol/l) sollte vermieden werden; Leitlinien für die richtige Anpassung der Dosis bei Auftreten von Hämoglobinwerten über 12 g/dl (7,5 mmol/l) werden weiter unten beschrieben.
Ein Hämoglobin-Anstieg um mehr als 2 g/dl (1,25 mmol/l) innerhalb eines Zeitraums von vier Wochen ist zu vermeiden. Falls es dazu kommt, ist wie vorgesehen eine geeignete Dosisanpassung vorzunehmen. Falls die Anstiegsrate von Hämoglobin 2 g/dl (1,25 mmol/l) in einem Monat überschreitet oder wenn der Hämoglobinspiegel ansteigt und sich dem Grenzwert von 12 g/dl (7,45 mmol/l) nähert, sollte die Dosis um ca. 25% gesenkt werden. Falls der Hämoglobinspiegel weiter ansteigt, sollte die Therapie unterbrochen werden, bis der Hämoglobinspiegel wieder zu sinken beginnt; an diesem Punkt sollte die Therapie mit einer Dosis, die um ca. 25% unter der zuvor verabreichten Dosis liegt, erneut begonnen werden.
Zur Aufrechterhaltung des Hämoglobinzielwertes soll sichergestellt werden, dass die niedrigste effektive Dosis zur Kontrolle der Anämie-Symptome von Recormon verwendet wird.
Bei Vorliegen einer Hypertonie oder kardiovaskulären, zerebrovaskulären oder peripheren vaskulären Erkrankungen sollten der wöchentliche Hämoglobinanstieg und der Hämoglobin-Zielwert individuell unter Berücksichtigung des klinischen Zustandsbilds ermittelt werden.
Die Therapie mit allen Recormon Formulierungen unterteilt sich in zwei Behandlungsphasen:
Korrekturphase
Subkutane Verabreichung
Die Anfangsdosis beträgt 3× 20 IE/kg Körpergewicht pro Woche. Bei nicht ausreichendem Anstieg des Hämoglobinwertes (<0,25 g/dl pro Woche), kann die Dosis in Abständen von 4 Wochen um jeweils 3× 20 IE/kg/Woche erhöht werden. Die wöchentliche Dosierung kann auch auf tägliche Gaben verteilt verabreicht werden.
Intravenöse Verabreichung
Die Anfangsdosis beträgt 3× 40 IE/kg Körpergewicht pro Woche. Die Dosis kann nach 4 Wochen auf 80 IE/kg Körpergewicht, 3× pro Woche, und, falls erforderlich, in monatlichen Abständen um weitere 20 IE/kg Körpergewicht, 3× pro Woche, erhöht werden.
Die maximale Wochendosis sollte unabhängig von der Art der Verabreichung 720 IE/kg Körpergewicht nicht überschreiten.
Erhaltungsphase
Zur Aufrechterhaltung eines Hämoglobinspiegels zwischen 10-12 g/dl wird die Dosierung zunächst auf 50% der zuletzt eingesetzten Dosis der Korrekturphase reduziert. Anschliessend wird die Dosierung in ein- bis zweiwöchigen Abständen individuell entsprechend dem Bedarf des Patienten eingestellt (Erhaltungsdosis).
Die Verabreichung der Erhaltungsdosis kann in einer einmal wöchentlichen subkutanen Gabe oder verteilt auf drei bis sieben Einzeldosen pro Woche erfolgen. Patienten, die in der einmal wöchentlichen Anwendung stabil sind, können auf eine Anwendung alle zwei Wochen umgestellt werden. In diesem Fall können Dosiserhöhungen nötig werden. Erfahrungsgemäss benötigen Patienten mit einem anfänglichen Hämoglobinwert unter 6 g/dl höhere Erhaltungsdosen als solche mit einem höheren anfänglichen Hämoglobinwert. Ein Hämoglobinwert von 12 g/dl sollte nicht überschritten werden.
Anwendung bei pädiatrischen Patienten
Pädiatrische klinische Studien haben ergeben, dass die Erhaltungsdosis im Mittel bei jüngeren Kindern höher als bei älteren war. Trotzdem wird empfohlen, sich an das angeführte Dosierungsschema zu halten, da die individuelle Ansprechbarkeit nicht vorhersagbar ist.
Anwendung bei älteren Patienten
Es wurden keine spezifischen Studien mit älteren Patienten durchgeführt. In die klinischen Prüfungen von Recormon war ein grosser Anteil älterer Patienten eingeschlossen. Es wurde keine Notwendigkeit einer speziellen Dosisanpassung bei älteren Patienten festgestellt.
Patienten mit beeinträchtigter Leberfunktion
Es wurden keine spezifischen klinischen Prüfungen mit Patienten mit beeinträchtigter Leberfunktion durchgeführt. Es liegen keine speziellen Dosierungsanweisungen vor.
Therapiedauer
Die Behandlung mit allen Recormon Formulierungen ist normalerweise eine Langzeittherapie. Die Unterbrechung der Therapie ist möglich und kann jederzeit erfolgen.
Tumorpatienten
Recormon sollte den Anämiepatienten (z.B. Hämoglobinwert ≤10 g/dl [6,2 mmol/l]) subkutan verabreicht werden. Die Anämiesymptome und ihre Folgeerscheinungen können sich je nach Alter, Geschlecht und allgemeinem Schweregrad der Erkrankung unterscheiden; daher ist eine Beurteilung des klinischen Verlaufs und des Zustands des jeweiligen Patienten durch einen Arzt erforderlich.
Die Wochendosis kann in einer einzigen Injektion oder verteilt auf 3 bis 7 Einzeldosen verabreicht werden.
Die empfohlene Anfangsdosis beträgt 450 IE/kg Körpergewicht pro Woche. Dabei kann eine fixe Dosis von 30000 IE einmal pro Woche, basierend auf einem Durchschnittsgewicht der Patienten um 67 kg, bei Patienten ohne grössere Gewichtsabweichungen gegeben werden. Bei ungenügendem Ansprechen mit der Notwendigkeit einer Dosiserhöhung ist aber auf eine gewichtsbezogene Dosierung zurückzugreifen.
Aufgrund intraindividueller Schwankungen bei den Patienten können gelegentlich einzelne Hämoglobinwerte beobachtet werden, die über oder unter dem erwünschten Hämoglobinspiegel liegen. Derartige Hämoglobin-Schwankungen sollten mittels Anpassung der Dosis ausgeglichen werden. Der Hämoglobin Zielbereich liegt zwischen 10 g/dl (6,2 mmol/l) bis 12 g/dl (7,5 mmol/l). Ein anhaltender Hämoglobinspiegel über 12 g/dl (7,5 mmol/l) sollte vermieden werden.
Dosisanpassungen
Wenn nach 4-wöchiger Therapie der Hämoglobinwert um mindestens 1 g/dl (0,62 mmol/l) gestiegen ist, sollte die derzeitige Dosis beibehalten werden. Die Dosis sollte verdoppelt werden, wenn nach 4 Wochen der Hämoglobinwert nicht um mindestens 1 g/dl (0,62 mmol/l) gestiegen ist. Wenn nach 8-wöchiger Therapie der Hämoglobinwert nicht um mindestens 1 g/dl (0,62 mmol/l) angestiegen ist, ist ein weiterer Therapieerfolg fraglich.
Die maximale Dosis von 900 IE/kg Körpergewicht pro Woche sollte nicht überschritten werden.
Ist das individuelle Therapieziel eines Patienten erreicht, sollte die Dosis um 25 bis 50% reduziert werden, um diese Hämoglobinkonzentration zu erhalten. Eine entsprechende Dosistitration sollte in Erwägung gezogen werden. Beträgt der Anstieg des Hämoglobinwertes mehr als 2 g/dl (1,3 mmol/l) in 4 Wochen, sollte die Dosis um 25 bis 50% reduziert werden.
Falls der Hämoglobinwert 12 g/dl (7,5 mmol/l) überschreitet, sollte die Dosis um ca. 25 bis 50% gesenkt werden. Die Behandlung mit Recormon ist vorübergehend zu unterbrechen, wenn der Hämoglobinspiegel 13 g/dl (8,1 mmol/l) überschreitet. Nachdem der Hämoglobinspiegel wieder auf ≤12 g/dl (7,5 mmol/l) abgesunken ist, sollte die Therapie mit einer Dosis, die um ca. 25% unter der zuvor verabreichten Dosis liegt, erneut begonnen werden.
Nach Beendigung der Chemotherapie sollte die Behandlung mit Recormon bis zu 3 Wochen weitergeführt werden.
Zur Aufrechterhaltung des Hämoglobinzielwertes soll sichergestellt werden, dass die zur Kontrolle der Anämie-Symptome niedrigste effektive Dosis von Recormon verwendet wird.
Gewinnung von Eigenblut (Eigenblutspendeprogramm)
Die Recormon-Lösung wird intravenös über zwei Minuten verabreicht. Besteht die Möglichkeit einer Blutspende (Hämatokrit >33 Vol.-%), so ist die Recormon Formulierung nach der Blutabnahme zu applizieren. Ein Hämatokrit von 48 Vol.-% sollte während des gesamten Behandlungszeitraumes nicht überschritten werden.
Die individuelle Dosis soll vom behandelnden Arzt in Abhängigkeit von der erforderlichen Menge an zu spendendem Eigenblut und der endogenen Erythrozytenreserve des jeweiligen Patienten ermittelt werden.
- Die erforderliche Menge an zu spendendem Eigenblut hängt vom erwarteten Blutverlust, dem Einsatz von blutsparenden Massnahmen und dem körperlichen Zustand des Patienten ab. Diese Menge soll so bemessen sein, dass sie ausreicht, homologe Transfusionen zu vermeiden. Sie ist in der Regel identisch mit der Anzahl angeforderter Blutkonserven. Die erforderliche Menge an zu spendendem Eigenblut wird in Einheiten ausgedrückt. Hierbei entspricht eine Einheit 450 ml Vollblut mit einem Hämatokriten von 40%.
- Die Blutspendefähigkeit des Patienten ist in erster Linie abhängig von seinem Blutvolumen und dem Ausgangshämatokritwert. Diese beiden Variablen bestimmen die endogene Erythrozytenreserve, die wie folgt berechnet wird:
Endogene Erythrozytenreserve (ml) = Blutvolumen (ml) × (Hkt-33): 100.
Berechnung des Blutvolumens
Männer
Blutvolumen (ml) = 44 (ml/kg) × Körpergewicht (kg) + 1600 (ml).
Frauen
Blutvolumen (ml) = 41 (ml/kg) × Körpergewicht (kg) + 1200 (ml) (Körpergewicht >45 kg).
Die Notwendigkeit für eine Behandlung mit einer Recormon Formulierung sowie, falls gegeben, die Einzeldosis wird aus der erforderlichen Menge an zu spendendem Eigenblut und der endogenen Erythrozytenreserve bestimmt (anhand der folgenden Nomogramme).

Die so bestimmte Einzeldosis wird zweimal wöchentlich über 4 Wochen verabreicht. Eine maximale Dosis von 1600 IE/kg Körpergewicht/Woche sollte nicht überschritten werden.
Spezielle Anweisungen für die Applikation
Da in Einzelfällen anaphylaktoide Reaktionen beobachtet wurden, sollte die erste Verabreichung nur unter klinischen Bedingungen und unter Einhaltung einer Nachbeobachtungszeit von mindestens 4 Stunden erfolgen.
Anämie bei Patienten mit chronischer Nierenerkrankung
Alle Recormon Formulierungen können subkutan oder intravenös verabreicht werden. Bei intravenöser Anwendung von Recormon sollte die Lösung über ca. 2 Minuten injiziert werden, z.B. den Hämodialyse-Patienten über die arteriovenöse Fistel im Anschluss an die Dialyse.
Bei nicht hämodialysierten Patienten mit renaler Anämie ist die subkutane Anwendung zu bevorzugen, um die Venen zu schonen. Die subkutane Injektion sollte ebenfalls langsam erfolgen. Dabei sollte nach Möglichkeit nicht mehr als 1 ml Injektionslösung an der gleichen Stelle verabreicht werden, weil bei empfindlichen Patienten lokale Schmerzreaktionen auftreten können. Grössere Volumen sollten an mehreren Stellen injiziert werden, oder die Injektionsnadel sollte intracutan zurückgezogen werden, und die weitere Injektion in eine andere Richtung erfolgen.
Sollte die subkutane Verabreichung vom Patienten selbst durchgeführt werden, so muss dieser über die Selbstverabreichung genau aufgeklärt und instruiert werden. Regelmässige Kontrollen durch den Arzt sind notwendig.
Bei gleichzeitiger Verabreichung von Eisen ist gegebenenfalls die Dosierung von rhEPO zu reduzieren, um einen zu raschen und zu starken Anstieg des Hämoglobins zu verhindern.
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Recormon darf bei unbehandelter oder schwer kontrollierbarer Hypertonie nicht eingesetzt werden.
Recormon darf zur Gewinnung von Eigenblut (Eigenblutspendeprogramm) nicht angewendet werden bei Patienten, die innerhalb eines Monats vor der Behandlung einen Herzinfarkt oder Schlaganfall erlitten haben, bei Patienten mit instabiler Angina pectoris oder bei Patienten mit einem Risiko für die Entstehung tiefer Venenthrombosen, z.B. solchen Patienten mit bereits bekannten venösen Thromboembolien.
Recormon darf während der Schwangerschaft und der Stillzeit sowie bei Kindern, die jünger als zwei Jahre sind, nicht eingesetzt werden, da hierzu bisher noch keine ausreichenden klinischen Erfahrungen vorliegen.
Warnhinweise und Vorsichtsmassnahmen
Für eine bessere Rückverfolgbarkeit von biologischen Arzneimitteln sollten Handelsname und Chargennummer des verabreichten Produkts deutlich in der Krankenakte verzeichnet (oder angegeben) werden.
Bei Vorliegen einer schweren akuten Anämie, die einer sofortigen Korrektur bedarf, stellte Recormon keinen Ersatz für eine Notfalltransfusion dar.
Recormon sollte mit Vorsicht angewendet werden bei refraktärer Anämie mit Blastenexzess in Transformation, bei epileptiformen Erkrankungen, bei Thrombozytose, bei chronischer Leberinsuffizienz und bei ischämischen Gefässerkrankungen. Folsäure-, Vitamin B12- und Eisenmangel sollten ausgeschlossen sein, da hierdurch die Wirksamkeit von Recormon vermindert wird.
Patienten mit chronischer Niereninsuffizienz
Recormon-Dosissteigerungen bei Patienten mit chronischer Niereninsuffizienz sollten mit Vorsicht erfolgen, da hohe kumulative Epoetin-Dosen mit einem erhöhten Mortalitätsrisiko, schweren kardiovaskulären und cerebrovaskulären Ereignissen assoziiert sein können. Bei Patienten mit schlechtem Ansprechen des Hämoglobinwerts auf Epoetine sollten verschiedene Ursachen für das schlechte Ansprechen abgeklärt werden (siehe Abschnitte «Dosierung/Anwendung» und «Eigenschaften/Wirkungen»).
Untersuchungen
Um eine wirksame Erythropoese sicherzustellen, sollte bei allen Patienten vor und während der Behandlung der Eisenwert bestimmt werden und gegebenenfalls eine Eisenersatztherapie gemäss den therapeutischen Richtlinien durchgeführt werden. Die Wirksamkeit von Recormon kann durch eine Aluminiumüberladung infolge der Therapie der chronischen Nierenerkrankung oder durch andere Ursachen einer Anämie, wie z.B. okkulten Blutverlust, hämatologische Krankheiten (z.B. Thalassämie, Myelodysplasien), Osteitis fibrosa cystica abgeschwächt werden.
Serum-Kaliumspiegel sollten während der Behandlung mit Recormon regelmässig überprüft werden. Erhöhte Kaliumspiegel wurden bei einigen urämischen Patienten unter einer Behandlung mit Recormon berichtet, ohne dass ein kausaler Zusammenhang gezeigt wurde. Sollten erhöhte oder ansteigende Kaliumspiegel beobachtet werden, dann sollte eine Unterbrechung der Behandlung mit Recormon in Betracht gezogen werden, bis die Hyperkaliämie korrigiert ist.
Nephrosklerose
Die Anwendung von Recormon bei Prädialyse-Patienten mit Nephrosklerose sollte individuell entschieden werden, da eine beschleunigte Progression der Niereninsuffizienz bei diesen Patienten nicht mit Sicherheit ausgeschlossen werden kann.
Fehlendes Ansprechen
In Verbindung mit einer Therapie mit ESA, einschliesslich der Gabe von Recormon, wurde über eine durch neutralisierende Antikörper gegen Erythropoietin hervorgerufene Erythroblastopenie (PRCA = pure red cell aplasia) berichtet. Für diese Antikörper konnte eine Kreuzreaktivität mit allen erythropoietischen Proteinen gezeigt werden. Patienten, bei denen der Verdacht auf neutralisierende Antikörper gegen Erythropoietin besteht oder bei denen diese nachgewiesen wurden, sollen nicht auf Recormon umgestellt werden (siehe «Unerwünschte Wirkungen»).
Blutdruck
Bei Patienten mit chronischer Nierenerkrankung und bei Krebspatienten kann eine Erhöhung des Blutdrucks erfolgen bzw. die Verstärkung einer bereits bestehenden Hypertension auftreten, insbesondere in Fällen eines schnellen Hämatokrit-Anstiegs. Diese Blutdruckerhöhungen lassen sich medikamentös behandeln.
Wenn der Blutdruckanstieg nicht durch medikamentöse Therapie kontrolliert werden kann, wird eine vorübergehende Unterbrechung der Therapie mit Recormon empfohlen. Insbesondere zu Beginn der Behandlung wird darüber hinaus eine regelmässige Blutdruckkontrolle empfohlen, auch zwischen den Dialysen. Eine hypertonische Krise mit Enzephalopathie-ähnlicher Symptomatik kann vereinzelt auftreten, auch mit Patienten mit initial normalem oder niedrigem Blutdruck, die eine sofortige ärztliche Untersuchung und intensivmedizinische Massnahmen erfordert. Plötzlich auftretende stechende migräneartige Kopfschmerzen sind als mögliches Warnzeichen besonders zu beachten (siehe «Unerwünschte Wirkungen»).
SCAR
Es wurde über schwere arzneimittelinduzierte Hautreaktionen (SCARs; severe cutaneous adverse reactions) einschliesslich Stevens-Johnson Syndrom (SJS) und Toxischer Epidermaler Nekrolyse (TEN), die lebensbedrohlich oder tödlich verlaufen können, im Zusammenhang mit Epoetin-Behandlungen, berichtet. Schwerere Fälle wurden im Zusammenhang mit langwirksamen Epoetinen beobachtet.
Zum Zeitpunkt der Verschreibung sollten Patienten auf die Anzeichen und Symptome hingewiesen und engmaschig im Hinblick auf Hautreaktionen überwacht werden. Typische Anzeichen sind Fieber, ein sich ausbreitender schmerzhafter Hautausschlag, dem oft Fieber und grippale Symptome vorangehen, Blasenbildung sowie Entzündung von Augen und Schleimhäuten. Wenn Anzeichen und Symptome auftreten, die auf solche Überempfindlichkeitsreaktionen hinweisen, sollte die Behandlung mit Recormon unverzüglich beendet werden.
Wenn ein Patient aufgrund der Anwendung von Recormon eine schwere Hautreaktion wie SJS oder TEN entwickelt hat, darf bei diesem Patienten die Behandlung mit Recormon zu keinem Zeitpunkt erneut begonnen werden.
Thrombozyten
Bei Patienten mit chronischer Nierenerkrankung kann es insbesondere bei intravenöser Anwendung zu einem mässiggradigen dosisabhängigen Anstieg der Thrombozytenzahl innerhalb des Normbereiches kommen, der im Verlauf der Therapie wieder zurückgeht. Es wird empfohlen, die Thrombozytenzahl in den ersten 8 Wochen der Therapie regelmässig zu kontrollieren.
Thrombozytenzahl und Hämatokrit/Hämoglobinkonzentration sollten bei allen Patienten in regelmässigen Abständen überprüft werden.
Erhaltungs-Hämoglobinkonzentration
Bei Patienten mit chronischer Nierenerkrankung sollte die Erhaltungs-Hämoglobinkonzentration die unter «Dosierung/Anwendung» empfohlene obere Grenze der Hämoglobin-Zielkonzentration nicht überschreiten. In klinischen Studien wurde bei der Anwendung von Erythropoese stimulierenden Wirkstoffen (ESAs) zur Erzielung eines Hämoglobin-Zielwerts über 12 g/dl (7,5 mmol/l) ein erhöhtes Risiko für Todesfälle und schwerwiegende kardiovaskuläre Ereignisse beobachtet.
Kontrollierte klinische Studien zeigten keine signifikanten Vorteile, wenn die Hämoglobin-Konzentration über das für die Beherrschung der Anämiesymptome und zur Vermeidung einer Bluttransfusion erforderliche Mass hinaus erhöht wurde.
Krebspatienten
ESAs sind Wachstumsfaktoren, welche in erster Linie die Produktion von roten Blutkörperchen stimulieren. Erythropoietin-Rezeptoren können auf der Oberfläche verschiedenster Tumorzellen gebildet werden. Wie bei allen Wachstumsfaktoren besteht die Vermutung, dass auch ESAs das Wachstum von Tumoren stimulieren könnten. In mehreren kontrollierten Studien konnte kein Nachweis für eine Veränderung des Gesamtüberlebens oder des Risikos für eine Tumorprogression bei Patienten mit krebsbedingter Anämie erbracht werden.
In kontrollierten klinischen Studien wurden bei der Anwendung von Recormon und anderen ESAs folgende Beobachtungen gemacht:
- Eine kürzere Zeit bis zur Tumorprogression bei Patienten mit fortgeschrittenen Kopf-und-Hals-Tumoren, die eine Strahlentherapie erhielten, wenn die Verabreichung bis zum Erreichen eines Hämoglobin-Zielwertes über 14 g/dl (8,7 mmol/l) erfolgte.
- Ein kürzeres Gesamtüberleben und mehr Todesfälle, die auf die Krankheitsprogression zurückzuführen waren, nach 4 Monaten bei Patientinnen mit metastasierendem Brustkrebs, die eine Chemotherapie erhielten, wenn die Verabreichung bis zum Erreichen eines Hämoglobin-Zielwertes von 12-14 g/dl (7,5-8,7 mmol/l) erfolgte.
- Ein höheres Todesrisiko bei Verabreichung bis zu einem Hämoglobin-Zielwert von 12 g/dl (7,5 mmol/l) bei Patienten mit aktiven malignen Erkrankungen, die weder eine Chemotherapie noch eine Strahlentherapie erhielten. ESAs sind zur Anwendung bei dieser Patientenpopulation nicht angezeigt.
Thrombozytenzahl und Hämoglobinkonzentration sollten bei Krebspatienten in regelmässigen Abständen überprüft werden.
Vor dem Einsatz von Epoetin-Präparaten bei symptomatischen anämischen Tumor-Patientinnen und –Patienten unter myelosuppressiver Chemotherapie, sollte eine sorgfältige individuelle Evaluation des Nutzen/Risiko-Verhältnisses, unter besonderer Berücksichtigung der Prognose in Absprache mit der Patientin/dem Patienten erfolgen. Bei kurativer Therapie sollen Epoetin-Präparate nicht eingesetzt werden.
Heparin
Bei Patienten mit chronischer Nierenerkrankung ist im Verlauf der Therapie mit Recormon aufgrund des gesteigerten Hämatokritwertes häufig eine Erhöhung der Heparin-Dosis während der Hämodialyse notwendig. Bei nicht optimaler Heparinisierung ist ein Verschluss des Dialyse-Systems möglich. Besonders bei Patienten, die zu hypotonen Reaktionen neigen oder deren arteriovenöse Fisteln Komplikationen (z.B. Stenosen, Aneurysmen o.ä.) aufweisen, können Shunt-Thrombosen auftreten. Eine frühzeitige Shunt-Revision und auch eine Thrombose-Prophylaxe durch Gabe von z.B. Acetylsalicylsäure werden bei diesen Patienten empfohlen.
Die Erfahrung der Anämiebehandlung mit Recormon bei multiplem Myelom, non-Hodgkin-Lymphom und chronischer lymphatischer Leukämie ist beschränkt auf erwachsene Patienten.
Eigenblutspende
Bei Patienten in einem Eigenblutspendeprogramm kann es zu einem Anstieg der Thrombozytenzahl, in der Regel innerhalb des Normbereiches, kommen. Es wird daher empfohlen, die Thrombozytenzahl mindestens einmal wöchentlich zu kontrollieren. Beträgt die Steigerung mehr als 150× 109/l oder liegt die Thrombozytenzahl über dem Normbereich, sollte die Therapie mit Recormon abgebrochen werden.
Für den Einsatz von Recormon im Rahmen der Eigenblutspende müssen die offiziellen Richtlinien zur Blutspende berücksichtigt werden, insbesondere:
- Patienten mit einem Hämatokritwert von >33 Vol.-% (Hämoglobinwert >11 g/dl [6,83 mmol/l]) dürfen Blut spenden.
- Patienten mit einem Körpergewicht unter 50 kg sollten besonders sorgfältig beobachtet werden.
- Das Volumen einer einzelnen Blutspende sollte nicht grösser sein als ca. 12% des Blutvolumens des Patienten.
Phenylalanin
Recormon enthält Phenylalanin als Hilfsstoff. Dieses sollte bei Patienten mit schweren Formen der Phenylketonurie berücksichtigt werden.
Missbrauch
Missbrauch von Gesunden (z.B. für Dopingzwecke) kann zu einem übermässigen Anstieg des Hämatokritwertes führen. Dies ist mit dem Risiko lebensbedrohlicher Komplikationen des Herz-Kreislauf-Systems (Thromboserisiko durch Hämokonzentration bei Polyglobulie) verbunden.
Interaktionen
Die erythropoetische Wirkung von rhEPO kann durch gleichzeitige Anwendung von hämatopoetisch wirksamen Substanzen, wie z.B. Ferrosulfat, Cyanocobalamin und Folsäure, verstärkt werden, wenn ein Mangelzustand besteht.
Bei Aluminiumintoxikation oder Infektionen kann die Wirkung von Recormon verzögert oder abgeschwächt auftreten.
Durch die mittels Recormon erzielte Erhöhung der Hämoglobinkonzentration können Substanzen gegen Angina pectoris in ihrer Wirkung verstärkt werden.
Die Wirkung gleichzeitig verabreichter Antihypertensiva kann reduziert sein.
Bei gleichzeitiger antikonvulsiver Therapie kann es zu einer Erhöhung der Krampfneigung kommen.
Weil Ciclosporin A an Erythrozyten gebunden wird, ist eine potentielle Interaktion mit Ciclosporin A gegeben. Dabei sollte bei gleichzeitiger Gabe von Ciclosporin A und Recormon die Konzentration von Ciclosporin A im Blut bestimmt werden. Gegebenenfalls ist die Ciclosporin-A-Dosierung anzupassen.
Untersuchungen am Tier haben gezeigt, dass Recormon die Knochenmarkstoxizität bezüglich Neutrophilen und Thrombozyten von Zytostatika wie Etoposid, Cisplatin, Cyclophosphamid, Fluorouracil nicht erhöht.
Schwangerschaft/Stillzeit
Reproduktionstudien bei Tieren haben keine Risiken für die Feten gezeigt, aber man verfügt über keine Studien bei schwangeren Frauen.
Aufgrund fehlender Studien bei schwangeren oder stillenden Frauen ist Recormon während der Schwangerschaft und Stillzeit kontraindiziert (siehe «Kontraindikationen»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Recormon hat keine oder eine vernachlässigbare Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen.
Unerwünschte Wirkungen
Folgende unerwünschte Wirkungen wurden beobachtet:
Alle Indikationen
Schwere, arzneimittelinduzierte Hautreaktionen (SCARs) einschliesslich Stevens-Johnson Syndrom (SJS), Toxische Epidermale Nekrolyse (TEN), Exfoliation der Haut und Erythema multiforme wurden berichtet (siehe «Warnhinweise und Vorsichtsmassnahmen»). Häufigkeiten sind nicht bekannt.
Anämie bei Patienten mit chronischer Nierenerkrankung
Die häufigste Nebenwirkung (21,9%) unter der Therapie mit Recormon ist eine dosisabhängige Erhöhung des Blutdrucks bzw. die Verstärkung einer bereits bestehenden Hypertonie, insbesondere in Fällen eines schnellen Hämoglobin-Anstiegs (siehe «Warnhinweise und Vorsichtsmassnahmen»). Vereinzelt können auch bei Patienten mit initial normalem oder niedrigem Blutdruck, hypertensiven Krisen mit Enzephalopathie-ähnlicher Symptomatik (z.B. Kopfschmerzen, Verwirrtheitszustände, sensomotorische Störungen - wie Sprachstörungen, Gangstörungen usw. - bis hin zu generalisiert tonisch-klonischen Krämpfen) auftreten (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Shunt-Thrombosen können auftreten, insbesondere bei Patienten, die zu hypotonen Reaktionen neigen oder deren arteriovenöse Fisteln Komplikationen (z.B. Stenosen, Aneurysmen) aufweisen (siehe «Warnhinweise und Vorsichtsmassnahmen»). Parallel zum Anstieg des Hämatokritwertes kommt es in den meisten Fällen zu einer Abnahme der Serum-Ferritin-Werte (siehe «Warnhinweise und Vorsichtsmassnahmen»). Weiterhin wurde vereinzelt eine vorübergehende Erhöhung des Kalium- und Phosphat-Spiegels beobachtet (siehe «Warnhinweise und Vorsichtsmassnahmen»). Insbesondere bei intravenöser Anwendung von Recormon kann es zu einem mässiggradigen, dosisabhängigen Anstieg der Thrombozytenzahl innerhalb des Normbereiches kommen, der im Verlauf der Therapie wieder zurückgeht. Die Entwicklung einer Thrombozytose ist sehr selten (siehe «Warnhinweise und Vorsichtsmassnahmen»).
In sehr seltenen Fällen traten bei Patienten mit chronischem Nierenversagen unter Therapie mit rhEPO neutralisierende Anti-Erythropoietin-Antikörper mit oder ohne Erythroblastopenie (PRCA) auf. Im Falle einer diagnostizierten PRCA muss die Epoetin-Therapie abgesetzt werden. Die Patienten sollten keinesfalls auf ein anderes ESA umgestellt werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die Häufigkeiten von Nebenwirkungen aus klinischen Studien in Verbindung mit der Recormon Behandlung sind nachfolgend aufgeführt. Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Gefässe
Häufig (≥1%, <10%): Bluthochdruck.
Gelegentlich (≥0,1%, <1%): Hypertensive Krise.
Nervensystem
Häufig (≥1%, <10%): Kopfschmerzen.
Blut und Lymphsystem
Selten (≥0,01%, <0,1%): Shunt-Thrombose.
Sehr selten (<0,01%): Thrombozytose.
Tumorpatienten
Kopfschmerzen und Bluthochdruck bedingt durch eine Behandlung mit Epoetin beta, die medikamentös behandelt werden können, wurden bei 1-10% der Fälle beobachtet (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Bei einigen Patienten wurde eine Abnahme der Serum-Eisen-Parameter beobachtet (siehe «Warnhinweise und Vorsichtsmassnahmen»). In klinischen Studien bei Patienten wurde ein leicht vermehrtes Auftreten thromboembolischer Ereignisse beobachtet bei mit Recormon behandelten Krebspatienten im Vergleich zu unbehandelten Kontroll- oder Placebo-Patienten. Bei Patienten, die mit Recormon behandelt wurden, traten diese Ereignisse in 7% der Fälle auf im Vergleich zu 4% bei den Kontroll-Patienten; verglichen mit der Kontrollgruppe ist dies jedoch nicht verbunden mit einem Anstieg der Mortalität aufgrund thromboembolischer Ereignisse.
Die Häufigkeiten von Nebenwirkungen aus klinischen Studien in Verbindung mit der Recormon Behandlung sind nachfolgend aufgeführt. Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Gefässe
Häufig (≥1%, <10%): Bluthochdruck.
Blut und Lymphsystem
Häufig (≥1%, <10%): Thromboembolische Ereignisse.
Nervensystem
Häufig (≥1%, <10%): Kopfschmerzen.
Gewinnung von Eigenblut (Eigenblutspendeprogramm)
Bei Patienten in einem Eigenblutspendeprogramm wurde über eine leichte Zunahme von thromboembolischen Ereignissen berichtet. Ein kausaler Zusammenhang mit der Recormon Behandlung konnte jedoch nicht gezeigt werden.
In Placebo-kontrollierten Studien war ein zeitweiser Eisenmangel bei mit Recormon behandelten Patienten ausgeprägter als in der Kontrollgruppe (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die Häufigkeiten von Nebenwirkungen aus klinischen Studien in Verbindung mit der Recormon Behandlung sind nachfolgend aufgeführt. Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Nervensystem
Häufig (≥1%, <10%): Kopfschmerzen.
Alle Indikationen
Selten (≥0,01%, <0,1%) kann es zu Hautreaktionen wie Ausschlag, Juckreiz, Nesselsucht oder Reaktionen an der Injektionsstelle kommen. In sehr seltenen Fällen (<0,01%) wurde in Verbindung mit einer Epoetin beta-Behandlung über anaphylaktoide Reaktionen berichtet. In kontrollierten klinischen Studien ergab sich jedoch kein Hinweis auf ein vermehrtes Auftreten von Überempfindlichkeitsreaktionen.
In sehr seltenen Fällen (<0,01%) wurden insbesondere zu Beginn der Behandlung Grippe-ähnliche Symptome wie Fieber, Frösteln, Kopfschmerzen, Gliederschmerzen, Unwohlsein und/oder Knochenschmerzen berichtet. Diese Reaktionen waren mild bis mässiggradig und verschwanden nach wenigen Stunden oder Tagen.
Unerwünschte Wirkungen nach Markteinführung
Nach der Markteinführung von Recormon sind die folgenden unerwünschten Wirkungen beschrieben worden:
Erkrankungen des Blutes und des Lymphsystems
Unbekannt: Erythroblastopenie (PRCA= pure red cell aplasia).1,2
Erkrankungen der Haut und des Unterhautzellgewebes
Unbekannt: Stevens-Johnson Syndrom (SJS)/Toxische Epidermale Nekrolyse (TEN).1,2
1 siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»
2 Anhand der vorliegenden Daten lassen sich weder Inzidenzrate noch Häufigkeitskategorie schätzen.
Überdosierung
Das Ansprechen auf rhEPO ist dosisabhängig und individuell unterschiedlich. Von einer einmalig verabreichten Überdosis sind keine unerwünschten Wirkungen zu erwarten, doch kann eine wiederholte Überdosierung zu Hypertonie und Polyglobulie führen.
Eigenschaften/Wirkungen
ATC-Code: B03XA01
Wirkungsmechanismus/Pharmakodynamik
Rekombinantes, humanes Erythropoetin (rhEPO) ist ein gereinigtes Glykoprotein, welches die Erythropoese stimuliert.
Das gentechnologisch gewonnene Epoetin beta ist in seiner Aminosäure- und Kohlenhydrat-Zusammensetzung identisch mit Erythropoetin, das aus dem Urin anämischer Patienten isoliert wurde.
Rekombinantes humanes Erythropoetin (rhEPO) hat ein Molekulargewicht von 32000-40000 Dalton. Der Proteinanteil des Moleküls beträgt ca. 58% und besteht aus 165 Aminosäuren. Die vier Kohlehydratketten sind über drei N-glykosidische und eine O-glykosidische Bindung mit dem Protein verknüpft.
Erythropoetin wird bei gesunden Menschen von der Niere gebildet und entsprechend dem Grad der Sauerstoffsättigung der Gewebe in die Blutbahn abgegeben. Mit dem Blut gelangt Erythropoetin zum Zielorgan, dem Knochenmark.
Bei therapeutischer Verabreichung von rhEPO an anämischen Patienten beginnt der Anstieg des Hämoglobins im Allgemeinen 2-6 Wochen nach dem Beginn der Behandlung. Bei Kindern konnte bisher nicht nachgewiesen werden, dass dabei auch das retardierte Wachstum beschleunigt wird.
Studien bei Krebspatienten
Erythropoietin ist ein Wachstumsfaktor, welcher in erster Linie die Produktion von roten Blutkörperchen stimuliert. Erythropoietin-Rezeptoren können auf der Oberfläche verschiedenster Tumorzellen gebildet werden.
Die Überlebensdauer und die Tumorprogression wurden in fünf grossen kontrollierten Studien mit insgesamt 2833 Patienten untersucht. Vier dieser Studien waren doppelblinde, placebokontrollierte Studien, in einem Fall handelte es sich um eine offene Studie. Zwei Studien rekrutierten Patienten, die eine Chemotherapie erhielten. Die Hämoglobin-Zielkonzentration betrug in zwei Studien >13 g/dl; in den anderen drei Studien betrug sie 12-14 g/dl. In der offenen Studie gab es bezüglich des Gesamtüberlebens keinen Unterschied zwischen den Patienten, die mit einem ESA behandelt wurden, und den Kontrollen. In den vier placebokontrollierten Studien betrug die Hazard Ratio für das Gesamtüberleben 1,25 bis 2,47 zugunsten der Kontrollen. Diese Studien zeigten gegenüber den Kontrollgruppen einen durchgehenden, ungeklärten, statistisch signifikanten Anstieg der Mortalität bei den Patienten, die eine Anämie im Zusammenhang mit verschiedenen häufigen Karzinomen aufwiesen und ein ESA erhielten. Das Resultat des Gesamtüberlebens in den Studien liess sich durch Unterschiede in der Inzidenz von Thrombosen und damit zusammenhängenden Komplikationen zwischen den Patienten, die ein ESA erhielten und den Patienten in den Kontrollgruppen nicht zufriedenstellend erklären.
Eine Metaanalyse (basiert auf individuellen Patienten Werten), die Daten aus allen 12 kontrollierten klinischen Studien an anämischen Krebspatienten umfasste, die mit Recormon durchgeführt wurden (n= 2301), zeigte eine Punktschätzung für die Hazard Ratio des Gesamtüberlebens von 1,13 zugunsten der Kontrollen (95% KI: 0,87, 1,46). Bei Patienten mit einem Hämoglobin-Ausgangswert von ≤10 g/dl (n= 899) betrug die Punktschätzung für die Hazard Ratio des Überlebens 0,98 (95% KI: 0,68 bis 1,40).
In der Gesamtpopulation wurde ein erhöhtes relatives Risiko für thromboembolische Ereignisse beobachtet (RR 1,62, 95% KI: 1,13; 2,31).
Es wurde eine systematische Überprüfung von mehr als 9000 Krebspatienten vorgenommen, die an 57 klinischen Studien teilnahmen. Eine Metaanalyse der Daten für das Gesamtüberleben ergab eine Punktschätzung für die Hazard Ratio des Gesamtüberlebens von 1,08 zugunsten der Kontrollen (95% KI: 0,99; 1,18; 42 Studien und 8167 Patienten). Ein erhöhtes relatives Risiko für thromboembolische Ereignisse (RR 1,67, 95% KI: 1,35; 2,06, 35 Studien und 6769 Patienten) wurde bei Patienten beobachtet, die mit einem ESA behandelt wurden. Es gibt daher eine einheitliche Evidenz, die darauf schliessen lässt, dass Krebspatienten, die mit einem ESA behandelt werden, keine Vorteile bezüglich Gesamtüberleben haben. Das Ausmass, in dem diese Ergebnisse auf Krebspatienten unter einer Chemotherapie zutreffen könnten, die ein ESA zur Etablierung eines Hämoglobinwertes von weniger als 13 g/dl erhalten, ist unklar, da das überprüfte Datenmaterial nur wenige Patienten mit diesen Merkmalen enthielt.
Die Wirksamkeit von Recormon bei Patienten mit multiplem Myelom, niedrig-malignem Non-Hodgkin-Lymphom oder chronisch lymphatischer Leukämie wurde bei Patienten mit einem relativen Erythropoetinmangel belegt, welche wie folgt definiert war:
Serum-Erythropoietin-Spiegel ≤100 mE/ml bei einem Hämoglobinwert von >9 bis <10 g/dl (>5,58 bis <6,2 mmol/l).
Serum-Erythropoietin-Spiegel ≤180 mE/ml bei einem Hämoglobinwert von >8 bis <9 g/dl (>4,96 bis <5,58 mmol/l).
Serum-Erythropoietin-Spiegel ≤300 mE/ml bei einem Hämoglobinwert von ≤8 g/dl (≤4,96 mmol/l).
Studien bei CRF-Patienten
In einer randomisierten Studie (CREATE) mit Epoetin beta an 603 Patienten mit renaler Anämie wurde in der Gruppe mit Normalisierung der Hämoglobinwerte auf 13 und 15 g/dl im Vergleich zur Gruppe mit niedrigeren Zielwerten von 10,5-11,5 g/dl eine Tendenz zu erhöhten kardiovaskulären Ereignissen beobachtet, die aber nicht statistisch signifikant war (58 vs. 47 Fälle, p= 0.20).
Die Häufigkeit thromboembolischer Ereignisse war 11.3% bei Patienten, die mit den höheren Hämoglobin-Zielwerten (13-15 g/dl) behandelt wurden, gegenüber 7.3% bei Patienten mit einem niedrigerem Hämoglobinzielwert (10.5-12.5 g/dl) (p= 0.06). Die Rate von Thrombosen des arteriovenösen Zugangs bei den Patienten, die einer Dialyse zugeführt wurden war bei höheren Hämoglobinzielwerten ebenfalls höher (4% gegenüber 3%) (p= 0.42).
Die Zeit bis zum Beginn einer Dialyse war in der Gruppe mit höheren Hämoglobin-Zielwerten verkürzt (p= 0.034), obwohl keine Unterschiede in der medianen Kreatinin-Clearance festgestellt werden konnten. Insgesamt sprechen diese Resultate jedoch eher für eine partielle Korrektur als für eine routinemässige Normalisierung des Hämoglobins mit Recormon.
In einer randomisierten Studie mit Epoetin alpha bei Prädialyse-Patienten (CHOIR), in der 1432 Patienten in einem Studienarm mit hohem Hämoglobin-Zielwert von 13,5 g/dl oder einem solchen mit tiefem Hämoglobin-Zielwert von 11,5 g/dl zugeteilt wurden, gab es in der Gruppe mit höheren Hämoglobinwerten signifikant mehr kardiovaskuläre Ereignisse als in derjenigen mit tieferen Hämoglobin-Zielwerten (17% gegenüber 14%; 125 bzw. 97 Fälle; p= 0,03). Die Häufigkeit thromboembolischer Ereignisse betrug im Studienarm mit hohem Hämoglobin 18% und in demjenigen mit tiefem Hämoglobin 17% (p= 0,65).
Zusammenfassende Post-hoc-Analysen von klinischen Sudien mit Erythropoese-stimulierenden Wirkstoffen (ESAs) wurden bei Patienten mit chronischer Niereninsuffizienz (dialysepflichtigen Patienten, Diabetikern und nicht-Diabetikern) durchgeführt. Mit höheren kumulativen ESA-Dosen wurde, unabhängig vom Diabetes- oder Dialyse-Status, ein Trend zu erhöhten Risikoereigniswahrscheinlichkeiten für Gesamtmortalität, kardiovaskuläre und cerebrovaskuläre Ereignisse beobachtet (siehe Abschnitte «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
Pharmakokinetik
Absorption
Nach subkutaner Gabe von Epoetin beta bei urämischen Patienten führte die verzögerte Aufnahme aus dem Gewebe zu einem plateauartigen Verlauf der Serumkonzentration. Maximale Konzentrationen wurden im Mittel nach 12 bis 28 Stunden erreicht. Es besteht keine direkte Beziehung zwischen Serumkonzentration von rhEPO und seiner therapeutischen Wirkung.
Die Bioverfügbarkeit von Epoetin beta nach subkutaner Gabe liegt zwischen 23 und 42% im Vergleich zur intravenösen Gabe.
Distribution
Das Verteilungsvolumen entspricht etwa dem Ein- bis Zweifachen des Plasmavolumens.
Es ist nicht bekannt, ob rhEPO die Plazentaschranke passiert oder in die Muttermilch übertritt, doch passiert es die Blut-Hirn-Schranke nicht.
Elimination
Die pharmakokinetischen Untersuchungen an gesunden Probanden und urämischen Patienten zeigen, dass die Halbwertszeit von intravenös verabreichtem Epoetin beta zwischen 4 und 12 Stunden liegt.
Die terminale Halbwertszeit nach subkutaner Applikation ist länger als bei der i.v. Applikation und beträgt durchschnittlich 13 bis 28 Stunden.
Präklinische Daten
Karzinogenität
Epoetin beta beeinflusst weder die Proliferation von nicht-hämatologischen normalen oder malignen Zelllinien in vitro noch die von transplantierbaren «Modelltumoren» in vivo. Ergebnisse einer Karzinogenitätsstudie mit homologem Erythropoietin bei Mäusen ergaben keine Hinweise auf ein proliveratives oder tumorigenes Potential.
Genotoxizität
In der Mutagenitätsprüfung nach Ames, im Micronucleus-Test, im in vitro HGPRT-Punktmutationstest sowie im Chromosomen-Aberrationstest an kultivierten menschlichen Lymphozyten erwies sich Epoetin beta als nicht genotoxisch.
Reproduktionstoxikologie
Studien an Ratten und Kaninchen erbrachten keinen Hinweis auf embryotoxische, fetotoxische oder teratogene Eigenschaften. Fertilitätsstörungen wurden nicht beobachtet. Eine peri-postnatale Toxizitätsstudie zeigte keine schädlichen Auswirkungen auf die Schwangerschaft und Laktation der Muttertiere sowie die prä- und postnatale Entwicklung der Nachkommen.
Sonstige Hinweise
Inkompatibilitäten
Um einen Wirkungsverlust auszuschliessen, sind folgende Hinweise zu beachten:
Kein anderes Lösungsmittel verwenden!
Nicht mit anderen Arzneimitteln oder Infusionslösungen mischen.
Zur Injektion oder Kurzzeitinfusion nur das beigefügte Kunststoffmaterial verwenden!
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Verpackung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Die Recormon Fertigspritzen vor Licht geschützt in der verschlossenen Originalverpackung bei einer Temperatur zwischen 2-8 °C (im Kühlschrank) lagern.
Die Kühlkette darf nicht unterbrochen werden. Die Lagerung von Recormon PS muss bei der Lieferfirma, dem Grossisten und dem Apotheker ständig im Kühlschrank (2-8 °C) gelagert werden.
Auch der Patient muss das Präparat ständig im Kühlschrank (2-8 °C) lagern. Im Rahmen der ambulanten Behandlung kann das Präparat einmalig für einen Zeitraum von maximal 3 Tagen ausserhalb des Kühlschranks bei Raumtemperatur (nicht über 25 °C) gelagert werden.
Hinweise für die Handhabung
Spezielle Anweisungen für die Applikation
Recormon PS Fertigspritzen sind gebrauchsfertig. Es dürfen nur Lösungen injiziert werden, die klar oder leicht opaleszent, farblos und frei von sichtbaren Partikeln sind. Recormon PS Fertigspritzen sind sterile, jedoch nicht konservierte Produkte. Es darf keinesfalls mehr als 1 Dosis je Fertigspritze verabreicht werden.
Anleitung zur Zubereitung und Injektion der Recormon PS Fertigspritzen
Für die Anwendung der Recormon PS Fertigspritzen siehe Gebrauchsanweisung am Ende der Patienteninformation.
Zulassungsnummer
54766 (Swissmedic).
Zulassungsinhaberin
Roche Pharma (Schweiz) AG, Basel.
Stand der Information
Juli 2019.
Composition
Principe actif
Epoetinum beta (érythropoïétine humaine recombinante) (rHEPO) produit par génie génétique dans des cellules CHO.
Excipients
Recormon PS, seringue préremplie
Ureum, natrii chloridum, natrii dihydrogenphosphas, dinatrii phosphas, calcii chloridum, polysorbatum 20 (à partir de maïs génétiquement modifié), glycinum, leucinum, isoleucinum, threoninum, acidum glutamicum, phenylalaninum, aqua ad injectabilia.
Forme galénique et quantité de principe actif par unité
Recormon PS 2000
1 seringue préremplie de solution injectable contient 2000 UI respectivement 16,6 µg d’époétine bêta.
Excip. q.s. ad solutionem 0,3 ml.
Recormon PS 3000
1 seringue préremplie de solution injectable contient 3000 UI respectivement 24,9 µg d’époétine bêta.
Excip. q.s. ad solutionem 0,3 ml.
Recormon PS 4000
1 seringue préremplie de solution injectable contient 4000 UI respectivement 33,2 µg d’époétine bêta.
Excip. q.s. ad solutionem 0,3 ml.
Recormon PS 5000
1 seringue préremplie de solution injectable contient 5000 UI respectivement 41,5 µg d’époétine bêta.
Excip. q.s. ad solutionem 0,3 ml.
Recormon PS 10’000
1 seringue préremplie de solution injectable contient 10’000 UI respectivement 83 µg d’époétine bêta.
Excip. q.s. ad solutionem 0,6 ml.
Recormon PS 30’000
1 seringue préremplie de solution injectable contient 30’000 UI respectivement 249 µg d’époétine bêta.
Excip. q.s. ad solutionem 0,6 ml.
Indications/Possibilités d’emploi
Anémie chez des patients souffrant de néphropathie chronique
Traitement de l'anémie rénale symptomatique nécessitant une transfusion, dans l'insuffisance rénale chronique chez l'adulte, dialysé et non dialysé, et chez l'enfant de plus de 2 ans (en ce qui concerne les taux d'Hb limites, voir «Posologie/Mode d'emploi»).
Affections tumorales
Traitement de l'anémie symptomatique chez le patient adulte présentant une affection tumorale non myéloïde et traité par chimiothérapie (en ce qui concerne les taux d'Hb limites, voir «Posologie/Mode d'emploi»).
Prélèvement autologue différé (Programme de prélèvement autologue différé)
Augmentation du volume de sang autologue chez un patient participant à un programme de prélèvement autologue différé destiné à éviter les inconvénients de la transfusion homologue. L'utilisation dans cette indication doit être évaluée par rapport au risque accru d'événements thromboemboliques qui a été rapporté. Le traitement est indiqué chez les patients atteints d'une anémie modérée (Hb de 10 à 13 g/dl (de 6,21 à 8,07 mmol/l) sans carence en fer), si les méthodes d'épargne sanguine ne sont pas disponibles ou sont insuffisantes, soit lorsque l'importante intervention prévue nécessite un volume de sang important (au moins 4 unités de sang chez la femme ou au moins 5 unités chez l'homme), soit lorsque la période requise pour obtenir le volume de sang autologue nécessaire est trop courte.
Posologie/Mode d’emploi
Le traitement par Recormon doit être instauré par des médecins possédant une expérience dans les indications susmentionnées.
Anémie chez des patients souffrant de néphropathie chronique
Les patients doivent faire l'objet d'une surveillance étroite afin de s'assurer que la plus faible dose efficace autorisée de Recormon soit utilisée pour contrôler convenablement les symptômes de l'anémie tout en maintenant un taux d'hémoglobine inférieur ou égal à 12 g/dl (7,5 mmol/l). La prudence est de mise lors des augmentations de la dose de Recormon chez les patients présentant une insuffisance rénale chronique. Chez les patients présentant une réponse faible du taux d'hémoglobine à Recormon, d'autres causes de cette faible réponse doivent être recherchées (voir «Mises en garde et précautions» et «Propriétés/Effets»). Les symptômes d'une anémie et ses manifestations secondaires peuvent varier selon l'âge, le sexe et le degré de sévérité général de la maladie; une évaluation médicale de l'évolution clinique et de l'état du patient respectif est donc nécessaire. Toutes les formulations de Recormon peuvent être administrées aussi bien par voie sous-cutanée que par voie intraveineuse pour augmenter le taux d'hémoglobine à une valeur maximale de 12 g/dl (7,5 mmol).
L'injection sous-cutanée permet d'atteindre l'objectif d'un taux maximal d'hémoglobine de 12 g/dl (7,5 mmol) au moyen d'une dose réduite d'environ 20-25% par rapport à l'injection intraveineuse.
En raison des variations intraindividuelles rencontrées chez les patients, on peut observer occasionnellement des taux d'hémoglobine supérieurs ou inférieurs aux concentrations souhaitées. De telles variations de l'hémoglobine peuvent être compensées par un ajustement de la dose, en tenant compte de la fourchette cible de l'hémoglobine de 10 g/dl (6,2 mmol/l) à 12 g/dl (7,5 mmol/l). Il faut éviter la persistance d'un taux d'hémoglobine supérieur à 12 g/dl (7,5 mmol/l); les directives relatives à l'ajustement adéquat de la dose en cas de survenue d'un taux d'hémoglobine supérieur à 12 g/dl (7,5 mmol/l) sont décrites ci-après.
Il faut éviter une augmentation de l'hémoglobine de plus de 2 g/dl (1,25 mmol/l) en l'espace de quatre semaines. Au cas où cela se produirait, il faut procéder comme prévu à un ajustement approprié de la dose. Si l'augmentation du taux d'hémoglobine est supérieure à 2 g/dl (1,25 mmol/l) en un mois ou si le taux d'hémoglobine augmente et approche les 12 g/dl (7,45 mmol/l), la dose doit être réduite d'environ 25%. Si le taux d'hémoglobine continue d'augmenter, le traitement doit être interrompu jusqu'à ce que le taux d'hémoglobine recommence à baisser, puis le traitement doit être repris à une dose réduite d'environ 25% par rapport à la dose précédemment administrée.
Pour stabiliser le taux d'hémoglobine cible, il faut s'assurer que l'on utilise la dose efficace la plus faible de Recormon qui permet d'obtenir le contrôle des symptômes de l'anémie.
En présence d'une hypertension ou d'affections cardiovasculaires, cérébrovasculaires ou vasculaires périphériques, l'augmentation hebdomadaire de l'hémoglobine et le taux cible d'hémoglobine devront être déterminés individuellement en tenant compte du tableau clinique.
Le traitement par toutes les formulations de Recormon comporte deux phases distinctes.
Phase de correction
Administration sous-cutanée
La dose initiale est de 3× 20 UI/kg de poids corporel par semaine. Si l'élévation de la valeur de l'hémoglobine est insuffisante (<0,25 g/dl par semaine), on peut augmenter la dose toutes les 4 semaines de 3× 20 UI/kg/semaine. La posologie hebdomadaire peut aussi être fractionnée en doses quotidiennes.
Administration intraveineuse
La dose initiale est de 3× 40 UI/kg de poids corporel par semaine. On peut, au bout de 4 semaines, porter la dose à 80 UI/kg de poids corporel 3× par semaine, puis l'augmenter au besoin, tous les mois, de 20 UI supplémentaires par kg de poids corporel 3× par semaine.
Indépendamment du mode d'administration, la dose hebdomadaire maximale ne doit pas dépasser 720 UI/kg de poids corporel.
Phase d'entretien
Pour stabiliser le taux d'hémoglobine entre 10 et 12 g/dl, réduire la posologie tout d'abord à 50% de la dernière dose administrée en phase de correction, puis l'ajuster à 1 ou 2 semaines d'intervalle en fonction des besoins individuels du patient pour obtenir la dose d'entretien. La dose d'entretien hebdomadaire peut être injectée par voie sous-cutanée en une seule fois ou répartie en trois à sept doses unitaires. Les patients dont l'état est stable lors d'une administration monohebdomadaire peuvent passer à un rythme d'administration d'une fois toutes les deux semaines. Dans ce cas, une augmentation de la dose peut s'avérer nécessaire. L'expérience enseigne que les patients dont la valeur de l'hémoglobine est initialement inférieure à 6 g/dl ont besoin de doses d'entretien plus importantes que ceux dont l'hémoglobine a une valeur plus élevée au départ. Ne pas dépasser un taux d'hémoglobine de 12 g/dl.
Utilisation chez les patients pédiatriques
Des essais cliniques chez des patients pédiatriques ont montré que les doses d'entretien sont en moyenne d'autant plus élevées que le sujet est plus jeune. On s'en tiendra toutefois au schéma posologique recommandé puisqu'on ne peut préjuger de la réponse individuelle.
Utilisation chez les patients âgés
Aucune étude spécifique n'a été menée. Les essais cliniques sur Recormon ont inclus une forte proportion de sujets âgés, mais rien ne suggérait qu'un ajustement posologique particulier soit nécessaire pour cette population de patients.
Patients présentant une insuffisance hépatique
Aucun essai clinique spécifique n'a été mené chez des sujets atteints d'insuffisance hépatique. Il n'y a pas d'instructions posologiques spéciales pour ces patients.
Durée du traitement
Le traitement par toutes les formulations de Recormon est conçu pour une longue durée. Il peut être interrompu à tout moment.
Affections tumorales
Recormon doit être administré par voie sous-cutanée aux patients anémiques (p.ex. taux d'hémoglobine ≤10 g/dl [6,2 mmol/l]). Les symptômes d'une anémie et ses manifestations secondaires peuvent varier selon l'âge, le sexe et le degré de sévérité général de la maladie; une évaluation médicale de l'évolution clinique et de l'état du patient respectif est donc nécessaire.
La dose hebdomadaire peut être injectée en une seule fois ou répartie en 3 à 7 doses unitaires.
La dose initiale recommandée est de 450 UI par kg de poids corporel et par semaine. On peut donner une dose fixe de 30000 UI une fois par semaine, en se basant sur un poids moyen du patient de 67 kg, chez les patients ne présentant pas de grandes fluctuations de poids. En cas de réponse insuffisante imposant une augmentation de la dose, il faut cependant recourir à une posologie rapportée au poids.
En raison des variations intraindividuelles rencontrées chez les patients, on peut observer occasionnellement des taux d'hémoglobine supérieurs ou inférieurs aux concentrations souhaitées. De telles variations de l'hémoglobine peuvent être compensées par un ajustement de la dose. La fourchette cible de l'hémoglobine est comprise entre 10 g/dl (6,2 mmol/l) et 12 g/dl (7,5 mmol/l). Il faut éviter la persistance d'un taux d'hémoglobine supérieur à 12 g/dl (7,5 mmol/l).
Ajustements de la dose
Si au bout de 4 semaines de traitement, le taux d'hémoglobine a augmenté d'au moins 1 g/dl (0,62 mmol/l), il faut conserver la dose actuelle. La dose doit être doublée si le taux d'hémoglobine n'a pas augmenté d'au moins 1 g/dl (0,62 mmol/l) au bout de 4 semaines. Si la valeur de l'hémoglobine n'a pas augmenté d'au moins 1 g/dl (0,62 mmol/l) après huit semaines de traitement, il y a lieu de douter de l'efficacité ultérieure du traitement.
La dose maximale de 900 UI par kg de poids corporel et par semaine ne doit pas être dépassée.
Une fois l'objectif thérapeutique individuel atteint, il convient de réduire la dose de 25 à 50% afin de stabiliser le taux d'hémoglobine du patient. Une titration correspondante de la dose devra être envisagée. Si l'augmentation du taux d'hémoglobine est supérieure à 2 g/dl (1,3 mmol/l) en 4 semaines, la dose doit être réduite de 25 à 50%.
Si le taux d'hémoglobine dépasse 12 g/dl (7,5 mmol/l), il faut réduire la dose d'environ 25 à 50%. Il faut arrêter passagèrement le traitement par Recormon si le taux d'hémoglobine dépasse 13 g/dl (8,1 mmol/l). Une fois que le taux d'hémoglobine est à nouveau ≤12 g/dl (7,5 mmol/l) le traitement doit être repris à une dose réduite d'environ 25% par rapport à la dose précédemment administrée.
Au terme de la chimiothérapie, le traitement par Recormon doit être poursuivi pendant une période pouvant aller jusqu'à 3 semaines.
Pour stabiliser le taux d'hémoglobine cible, il faut s'assurer que l'on utilise la dose efficace la plus faible de Recormon qui permet d'obtenir le contrôle des symptômes de l'anémie.
Prélèvement autologue différé (Programme de prélèvement autologue différé)
La solution de Recormon est administrée par voie intraveineuse en deux minutes. Si un don de sang est possible (hématocrite >33 vol.-%), Recormon doit être administré après le prélèvement. On ne dépassera pas un hématocrite de 48 vol.-% pendant toute la durée du traitement.
La posologie individuelle doit être déterminée par le médecin traitant en fonction du volume de sang autologue à prélever et de la réserve érythrocytaire endogène du patient en question.
- Le volume de sang autologue à prélever dépend des pertes sanguines prévisibles, de la mise en œuvre de méthodes d'épargne sanguine et de la condition physique du patient. Ce volume doit être suffisant pour éviter le recours à une transfusion homologue. Il correspond généralement au nombre de conserves de sang requises. Le volume de sang autologue nécessaire s'exprime en unités, chaque unité correspondant à 450 ml de sang total avec un hématocrite de 40%.
- La capacité d'un patient à donner du sang est surtout fonction de son volume sanguin et de la valeur initiale de l'hématocrite. Ces deux variables déterminent l'importance de la réserve érythrocytaire endogène, calculée de la manière suivante:
réserve érythrocytaire endogène (en ml) = volume sanguin (en ml) × (hématocrite -33): 100.
Calcul du volume sanguin
Chez l'homme
Volume sanguin (en ml) = 44 (ml/kg) × poids corporel (en kg) + 1600 (ml).
Chez la femme
Volume sanguin (en ml) = 41 (ml/kg) × poids corporel (en kg) + 1200 (ml) (pour un poids corporel >45 kg).
Les nomogrammes suivants permettent de décider si un traitement par une formulation de Recormon est nécessaire et, si oui, de déterminer la dose unitaire, sur la base du volume de sang autologue à prélever et de la réserve érythrocytaire endogène.

La dose unitaire ainsi déterminée est administrée en deux prises hebdomadaires pendant 4 semaines. On ne dépassera pas une dose maximale de 1600 UI/kg de poids corporel par semaine.
Instructions spéciales concernant l'administration
Des réactions anaphylactoïdes ayant été observées dans des cas isolés, la première administration ne doit avoir lieu que dans des conditions cliniques, en respectant un délai de surveillance minimale d'au moins 4 heures.
Anémie chez des patients souffrant de néphropathie chronique
Toutes les formulations de Recormon peuvent être administrées par voie sous-cutanée ou intraveineuse. Par voie intraveineuse, la solution doit être injectée en 2 min environ, aux hémodialysés p.ex. dans l'aiguille à fistule à la suite de la dialyse.
Chez le patient non hémodialysé souffrant d'une anémie d'origine rénale, préférer l'administration sous-cutanée pour éviter de trop solliciter les veines. L'injection sous-cutanée doit également se faire lentement, en veillant à ne pas dépasser si possible 1 ml par point d'injection pour réduire la douleur chez les patients qui y sont sensibles. Les volumes importants seront injectés en plusieurs points ou l'aiguille sera retirée sous la peau et l'injection poursuivie dans une autre direction.
Lorsque le patient s'administre lui-même le médicament par voie sous-cutanée, il convient de lui donner des instructions précises sur la technique d'auto-injection. Un contrôle médical régulier s'impose.
L'administration concomitante de fer implique, le cas échéant, une diminution de la dose de rhEPO afin d'éviter l'élévation trop rapide et trop importante du taux d'hémoglobine.
Contre-indications
Hypersensibilité au principe actif ou à l'un des excipients conformément à la composition.
Recormon ne doit pas être utilisé en présence d'une hypertension artérielle non traitée ou difficilement contrôlable.
Recormon ne doit pas être utilisé pour l'obtention de sang autologue (programme de prélèvement autologue différé) chez les patients ayant présenté un infarctus du myocarde ou un accident vasculaire cérébral au cours du mois précédant le traitement, chez les patients avec angor instable ni chez les patients présentant un risque de thrombose veineuse profonde, par exemple ceux avec antécédent connu de thrombo-embolie veineuse.
En l'absence de données cliniques suffisantes, Recormon ne doit pas être administré aux femmes enceintes ou qui allaitent, ni aux enfants de moins de 2 ans.
Mises en garde et précautions
Pour permettre une meilleure traçabilité des médicaments biologiques, il y a lieu de consigner (ou de mentionner) clairement la désignation commerciale et le numéro de lot du produit administré dans le dossier médical.
En présence d'une anémie aiguë sévère nécessitant une correction immédiate, Recormon ne peut se substituer à une transfusion en urgence.
Recormon doit être utilisé avec prudence lors d'anémie réfractaire avec excès de blastes en transformation, d'affection épileptiforme, de thrombocytose, d'insuffisance hépatique chronique et de maladie vasculaire ischémique. Sont exclus du traitement les patients présentant des déficits en acide folique, en vitamine B12 et en fer, car ils réduisent l'efficacité de Recormon.
Patients présentant une insuffisance rénale chronique
La prudence est de mise lors des augmentations de la dose de Recormon chez les patients présentant une insuffisance rénale chronique, car des doses cumulées élevées d'époétine peuvent être associées à un risque accru de mortalité et à des événements cardiovasculaires et cérébrovasculaires sévères. Chez les patients présentant une faible réponse du taux d'hémoglobine aux époétines, d'autres causes de cette faible réponse doivent être recherchées (voir «Posologie/Mode d'emploi» et «Propriétés/Effets»).
Investigations
Pour assurer une érythropoïèse efficace, il faut, chez tous les patients, mesurer le taux de fer avant et pendant le traitement et, le cas échéant, procéder à une substitution martiale conformément aux directives thérapeutiques.
L'efficacité de Recormon peut être atténuée par une accumulation d'aluminium consécutive au traitement de l'insuffisance rénale chronique ou par d'autres causes d'anémie telles qu'une perte de sang occulte, une maladie du système hématopoïétique (thalassémie, myélodysplasie, par exemple) ou une ostéite fibro-kystique.
La kaliémie doit être régulièrement contrôlée pendant le traitement par Recormon. Une hyperkaliémie a été observée chez quelques patients insuffisants rénaux traités par Recormon, sans qu'un lien direct n'ait toutefois pu être établi. En cas d'hyperkaliémie ou d'augmentation de la kaliémie, on devra envisager l'arrêt du traitement par Recormon, jusqu'à la correction de l'hyperkaliémie.
Néphrosclérose
L'utilisation de Recormon chez un patient en prédialyse pour une néphrosclérose doit être décidée au cas par cas, une progression accélérée de l'insuffisance rénale ne pouvant être totalement exclue chez ces patients.
Absence de réponse
Une érythroblastopénie (PRCA = pure red cell aplasia) provoquée par des anticorps anti-érythropoïétine neutralisants a été rapportée en rapport avec un traitement par des ASE, y compris avec l'administration de Recormon. Une réaction croisée avec toutes les protéines érythropoïétiques a été retrouvée pour ces anticorps. Les patients chez qui l'on suspecte des anticorps anti-érythropoïétine neutralisants ou chez qui de tels anticorps ont été décelés, ne doivent pas être mis sous Recormon (voir «Effets indésirables»).
Tension artérielle
Chez les patients atteints d'une néphropathie chronique ou d'un cancer, une augmentation de la tension artérielle ou l'accentuation d'une hypertension déjà existante peut survenir, notamment en cas d'élévation rapide de l'hématocrite. Ces hypertensions relèvent d'un traitement médicamenteux.
Si le traitement médicamenteux ne permet pas de contrôler l'hypertension, une interruption passagère du traitement par Recormon est recommandée. Par ailleurs, un contrôle régulier de la tension artérielle est recommandé, surtout au début du traitement, ainsi qu'entre les dialyses. Dans des cas isolés, même des patients initialement normotendus ou hypotendus peuvent présenter une crise hypertensive avec des symptômes à type d'encéphalopathie nécessitant une prise en charge médicale immédiate en soins intensifs. La survenue brutale de céphalées lancinantes à type de migraine peut constituer un signal d'alarme à prendre très au sérieux (voir «Effets indésirables»).
SCAR
Des réactions graves d'hypersensibilité cutanée (SCAR; severe cutaneous adverse reactions), telles que le syndrome de Stevens-Johnson (SSJ) et la nécrolyse épidermique toxique (NET, syndrome de Lyell), qui peuvent mettre en jeu le pronostic vital ou avoir une issue fatale, ont été rapportées chez des patients traités par de l'époétine. Des cas particulièrement graves ont été observés lors de l'administration de formes retard.
Il convient d'attirer l'attention des patients sur les signes et symptômes au moment de la prescription et d'assurer une surveillance étroite quant à la survenue de réactions cutanées chez eux. Les signes typiques sont la fièvre, une éruption cutanée douloureuse qui s'étend, souvent précédée de fièvre et de symptômes grippaux, la formation de cloques et une inflammation des yeux et des muqueuses. Si des signes et symptômes évocateurs de telles réactions d'hypersensibilité apparaissent, arrêter immédiatement le traitement par Recormon.
Si un patient a présenté une réaction cutanée grave comme un SSJ ou une NET en raison de l'utilisation de Recormon, le traitement par Recormon ne doit en aucun cas être repris chez lui.
Thrombocytes
Chez les patients atteints d'une néphropathie chronique, il peut se produire une élévation modérée et dose-dépendante du nombre de plaquettes dans les limites de la normale, notamment en cas d'administration intraveineuse. Elle régresse au cours du traitement. Il est recommandé de contrôler régulièrement le nombre de plaquettes dans les 8 premières semaines du traitement. Le nombre de plaquettes et l'hématocrite / le taux d'hémoglobine doivent être systématiquement mesurés à intervalles réguliers, chez tous les patients.
Concentration d'hémoglobine d'entretien
Chez les patients atteints d'une néphropathie chronique, le taux d'hémoglobine d'entretien ne doit pas dépasser la limite supérieure du taux d'hémoglobine cible recommandé sous «Posologie/Mode d'emploi». Dans les études cliniques, un risque accru de décès et d'événements cardio-vasculaires sévères a été observé lors de l'utilisation d'agents stimulant l'érythropoïèse (ASE) destinés à obtenir un taux cible d'hémoglobine supérieur à 12 g/dl (7,5 mmol/l).
Les études cliniques contrôlées n'ont pas montré d'avantages significatifs lorsque le taux d'hémoglobine a été augmenté au-delà de ce qui est nécessaire pour maîtriser les symptômes de l'anémie et éviter une transfusion sanguine.
Patients cancéreux
Les ASE sont des facteurs de croissance qui stimulent principalement la production de globules rouges. Des récepteurs de l'érythropoïétine peuvent être produits à la surface de diverses cellules tumorales. On soupçonne que les ASE pourraient, comme tous les facteurs de croissance, stimuler la croissance de tumeurs. Aucune preuve d'une modification de la survie globale ou du risque de progression tumorale chez des patients atteints d'une anémie liée à un cancer n'a pu être fournie dans plusieurs études cliniques.
Les observations suivantes ont été faites dans des études cliniques contrôlées lors de l'utilisation de Recormon et d'autres ASE:
- Un raccourcissement du délai jusqu'à la progression tumorale chez les patients atteints de tumeurs avancées de la tête et du cou et traités par radiothérapie, lorsque le médicament a été administré jusqu'à atteindre un taux d'hémoglobine supérieur à 14 g/dl (8,7 mmol/l).
- Une survie globale plus courte et plus de décès imputables à la progression de la maladie au bout de 4 mois chez des patientes atteintes d'un cancer du sein métastatique et traitées par une chimiothérapie, lorsque le médicament a été administré jusqu'à atteindre un taux d'hémoglobine supérieur à 12-14 g/dl (7,5-8,7 mmol/l).
- Un risque accru de décès lorsque le médicament a été administré jusqu'à atteindre un taux cible d'hémoglobine de 12 g/dl (7,5 mmol/l) chez des patients atteints d'affections malignes évolutives qui ne recevaient ni chimiothérapie ni radiothérapie. Les ASE ne sont pas indiqués pour le traitement de cette population de patients.
Le nombre de plaquettes et le taux d'hémoglobine doivent être contrôlés à intervalles réguliers chez les patients cancéreux.
Avant l'utilisation de préparations d'époétine chez les patientes et les patients atteints de tumeur et symptomatiques d'une anémie sous chimiothérapie myélosuppressive, il faut procéder avec la patiente/le patient à une évaluation soigneuse et individuelle du rapport risque/bénéfice en tenant particulièrement compte du pronostic. Les préparations d'époétine ne doivent pas être administrées dans le cadre d'un traitement curatif.
Héparine
Chez les patients atteints d'une néphropathie chronique, le taux élevé d'hématocrite nécessite fréquemment au cours du traitement par Recormon une augmentation de la dose d'héparine pendant l'hémodialyse. Si l'héparinisation n'est pas optimale, une obstruction du dialyseur peut se produire. Des thromboses du shunt peuvent survenir, surtout chez les patients ayant tendance à avoir une hypotension ou présentant des complications au niveau de leur fistule artério-veineuse (p.ex. sténoses, anévrysmes, etc.). Une révision précoce du shunt ainsi qu'une prophylaxie antithrombotique par l'acide acétylsalicylique sont recommandées chez ces patients.
L'expérience acquise dans le traitement de l'anémie par Recormon lors de myélome multiple, de lymphome non hodgkinien et de leucémie lymphoïde chronique est limitée aux patients adultes.
Prélèvement autologue différé
Chez les patients participant à un programme de prélèvement autologue différé, une augmentation du nombre de plaquettes, en général dans les limites de la normale, peut survenir. Il est donc recommandé de contrôler au moins une fois par semaine le nombre de plaquettes. Le traitement par Recormon doit être interrompu si l'élévation est supérieure à 150× 109/l ou si le nombre de plaquettes est supérieur à la normale.
L'utilisation de Recormon chez un patient participant à un programme de prélèvement autologue différé doit respecter les directives officielles régissant le don de sang, notamment les suivantes:
- les patients dont l'hématocrite est >33 vol.-% (hémoglobine >11 g/dl (6,83 mmol/l)) peuvent donner leur sang.
- les patients dont le poids corporel est inférieur à 50 kg doivent faire l'objet d'une surveillance particulière.
- le volume d'un don de sang individuel ne doit pas dépasser approximativement 12% du volume sanguin du patient.
Phénylalanine
Recormon contient de la phénylalanine comme excipient. Ceci doit être pris en considération chez les patients présentant des formes sévères de phénylcétonurie.
Abus
L'usage abusif auquel pourraient recourir des sujets sains (à des fins de dopage notamment) peut entraîner une augmentation excessive de l'hématocrite, d'où un risque de complications cardiovasculaires menaçant le pronostic vital (risque de thrombose par polyglobulie avec concentration élevée d'hémoglobine).
Interactions
L'effet érythropoïétique de la rhEPO peut être potentialisé par l'administration concomitante de substances hématopoïétiquement actives destinées à pallier un état de carence, telles que le sulfate ferreux, la cyanocobalamine ou l'acide folique.
L'action de Recormon peut être retardée ou atténuée par une intoxication à l'aluminium ou une infection.
La concentration d'hémoglobine augmentée par l'action de Recormon peut potentialiser l'effet des antiangineux.
Les antihypertenseurs administrés simultanément peuvent avoir une efficacité réduite.
La poursuite concomitante d'un traitement par des anticonvulsivants peut aggraver la tendance aux convulsions.
Etant donné que la cyclosporine A se lie aux hématies, une interaction avec celle-ci reste possible. Si Recormon est administré en association avec la cyclosporine A, les taux sanguins de cette dernière doivent être surveillés. Le cas échéant, la dose de cyclosporine A sera ajustée en conséquence.
L'expérimentation animale a montré que Recormon ne majore pas la toxicité médullaire exercée à l'égard des neutrophiles et des thrombocytes par des cytostatiques tels que l'étoposide, le cisplatine, le cyclophosphamide et le fluorouracil.
Grossesse/Allaitement
Les études de reproduction chez l'animal n'ont pas démontré de risque fœtal, mais on ne dispose d'aucune étude chez la femme enceinte.
En l'absence d'études chez la femme enceinte ou en période d'allaitement, Recormon est contre-indiqué pendant la grossesse et la période d'allaitement (voir «Contre-indications»).
Effet sur l’aptitude à la conduite et l’utilisation de machines
Recormon n'a aucun ou seulement un effet négligeable sur l'aptitude à la conduite ou à l'utilisation de machines.
Effets indésirables
Les effets indésirables ci-après ont été observés:
Toutes les indications
Des réactions graves d'hypersensibilité cutanée (SCAR), telles que le syndrome de Stevens-Johnson (SSJ), la nécrolyse épidermique toxique (NET, syndrome de Lyell), l'exfoliation cutanée et l'érythème polymorphe, ont été rapportées (voir «Mises en garde et précautions»). Leur fréquence n'est pas connue.
Anémie chez des patients souffrant de néphropathie chronique
L'effet indésirable le plus fréquent (21,9%) sous traitement par Recormon est une augmentation dose-dépendante de la pression artérielle ou l'aggravation d'une hypertension artérielle préexistante, notamment en cas d'augmentation rapide du taux d'hématocrite (voir «Mises en garde et précautions»). Dans des cas isolés, même des patients initialement normotendus ou hypotendus peuvent présenter une crise hypertensive avec symptômes à type d'encéphalopathie (céphalées, états confusionnels, troubles sensori-moteurs tels que troubles du langage et de la marche, etc. jusqu'à des crises tonico-cloniques généralisées) nécessitant une prise en charge en soins intensifs (voir «Mises en garde et précautions»).
Des thromboses du shunt peuvent survenir, surtout chez les patients ayant tendance à avoir une hypotension ou présentant des complications au niveau de leur fistule artério-veineuse (p.ex. sténoses, anévrysmes, etc.) (voir «Mises en garde et précautions»). Parallèlement à l'augmentation du taux d'hématocrite, il se produit dans la plupart des cas une diminution de la ferritinémie (voir «Mises en garde et précautions»). En outre, une augmentation transitoire de la kaliémie et de la phosphatémie a été observée dans des cas isolés (voir «Mises en garde et précautions»).
En particulier lors d'administration intraveineuse de Recormon, on peut observer une augmentation modeste, dose-dépendante, du nombre des plaquettes, qui reste dans les limites de la normale et qui régresse au fil du traitement. Il est très rare de voir s'installer une thrombocytose (voir «Mises en garde et précautions»).
Dans de très rares cas, des insuffisants rénaux chroniques traités par la rHEPO ont développé des anticorps anti-érythropoïétine neutralisants avec ou sans érythroblastopénie (PRCA). En présence d'un diagnostic de PRCA, le traitement par l'époétine doit être arrêté. En aucun cas, les patients ne doivent être mis sous une autre époétine (voir «Mises en garde et précautions»).
Les fréquences des effets indésirables rapportés au cours des études cliniques avec Recormon sont mentionnées ci-dessous. A l'intérieur de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Vaisseaux
Fréquent (≥1%, <10%): hypertension artérielle.
Occasionnel (≥0,1%, <1%): crise hypertensive.
Système nerveux
Fréquent (≥1%, <10%): céphalées.
Circulation sanguine et lymphatique
Rare (≥0,01%, <0,1%): thrombose du shunt.
Très rare (<0,01%): thrombocytose.
Affections tumorales
Des céphalées et une hypertension artérielle, causées par un traitement par l'époétine bêta et relevant d'un traitement médicamenteux, ont été observées dans 1 à 10% des cas (voir «Mises en garde et précautions»).
Chez quelques patients, une baisse des paramètres du fer sérique a été observée (voir «Mises en garde et précautions»).
Au cours d'études cliniques, une incidence légèrement accrue d'événements thrombo-emboliques a été observée chez des cancéreux traités par Recormon par rapport à des patients non traités ou recevant un placebo. De tels événements ont été observés chez 7% des patients traités par Recormon, contre 4% des patients du groupe témoin; cette différence par rapport au groupe témoin n'a toutefois été liée à aucune augmentation de la mortalité due à des événements thrombo-emboliques.
Les fréquences des effets indésirables rapportés au cours des études cliniques avec Recormon sont mentionnées ci-dessous. A l'intérieur de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Vaisseaux
Fréquent (≥1%, <10%): hypertension artérielle.
Circulation sanguine et lymphatique
Fréquent (≥1%, <10%): événements thrombo-emboliques.
Système nerveux
Fréquent (≥1%, <10%): céphalées.
Prélèvement autologue différé (Programme de prélèvement autologue différé)
Chez les patients participant à un programme de prélèvement autologue différé, une légère augmentation des événements thromboemboliques a été rapportée, sans qu'un lien de causalité avec le traitement par Recormon n'ait toutefois pu être établi.
Dans les études contrôlées contre placebo, une carence martiale transitoire plus marquée a été observée chez les patients traités par Recormon que dans le groupe témoin (voir «Mises en garde et précautions»).
Les fréquences des effets indésirables rapportés au cours des études cliniques avec Recormon sont mentionnées ci-dessous. A l'intérieur de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Système nerveux
Fréquent (≥1%, <10%): céphalées.
Toutes les indications
Dans de rares cas (≥0,01%, <0,1%), des réactions cutanées telles qu'éruptions, démangeaisons, urticaire ou réactions au point d'injection peuvent se produire. Dans de très rares cas (<0,01%), des réactions anaphylactoïdes ont été rapportées en rapport avec un traitement par l'époétine bêta. Dans le cadre d'études cliniques contrôlées, aucune augmentation des réactions d'hypersensibilité n'a toutefois été mise en évidence.
Des symptômes pseudo-grippaux tels que fièvre, frissons, céphalées, courbatures, sensation de malaise et/ou douleurs osseuses ont été signalés dans de très rares cas (<0,01%), en particulier au début du traitement. Ces réactions étaient d'intensité légère à modérée et ont disparu en quelques heures ou en quelques jours.
Effets indésirables après commercialisation
Les effets indésirables suivants ont été décrits après la commercialisation de Recormon:
Affections hématologiques et du système lymphatique
Fréquence inconnue: érythroblastopénie (PRCA= pure red cell aplasia).1,2
Affections de la peau et du tissu sous-cutané
Fréquence inconnue: syndrome de Stevens-Johnson (SSJ) / nécrolyse épidermique toxique (NET, syndrome de Lyell).1,2
1 Voir rubrique «Mises en garde et précautions»
2 Les données disponibles ne permettent pas d'évaluer le taux d'incidence ni la catégorie de fréquence.
Surdosage
La réponse à la rhEPO est individuelle et dose-dépendante. Si une surdose unique ne risque pas de déclencher d'effets indésirables, il n'en est pas de même de surdoses répétées, qui peuvent entraîner hypertension et polyglobulie.
Propriétés/Effets
Code ATC: B03XA01
Mécanisme d'action/Pharmacodynamique
L'érythropoïétine humaine recombinante (rhEPO) est une glycoprotéine purifiée qui stimule l'érythropoïèse.
L'époétine bêta, obtenue par génie génétique, présente une composition en acides aminés et en glucides identique à celle de l'érythropoïétine native extraite de l'urine de patients anémiques.
L'érythropoïétine humaine recombinante (rhEPO) a un poids moléculaire de 32000 à 40000 daltons. La protéine, qui représente environ 58% de la molécule, comprend 165 acides aminés. Les 4 chaînes glucidiques sont reliées à la protéine par 3 liaisons N-glycosidiques et une liaison O-glycosidique.
Chez le sujet sain, l'érythropoïétine est produite par les reins et déversée dans le flux sanguin en fonction de la saturation des tissus en oxygène. Avec le sang, l'érythropoïétine parvient à son organe cible, qui est la moelle osseuse.
Lors de l'administration de rhEPO à des anémiques, le taux d'hémoglobine commence généralement à remonter 2 à 6 semaines après le début du traitement. On n'a pas encore pu démontrer chez l'enfant d'accélération concomitante d'une croissance retardée.
Etudes chez les patients cancéreux
L'érythropoïétine est un facteur de croissance qui stimule principalement la production de globules rouges. Des récepteurs de l'érythropoïétine peuvent être produits à la surface de diverses cellules tumorales.
Le temps de survie et la progression tumorale ont été évalués dans cinq études contrôlées de grande envergure, menées chez au total 2833 patients. Quatre de ces études étaient des études en double aveugle, contrôlées contre placebo et la cinquième étude était une étude ouverte. Deux études ont recruté des patients recevant une chimiothérapie. Le taux cible d'hémoglobine était >13 g/dl dans deux études et de 12-14 g/dl dans les trois autres études. Dans l'étude ouverte, aucune différence quant à la survie globale n'a été constatée entre les patients traités par un ASE et les témoins. Dans les quatre études contrôlées contre placebo, le hazard ratio pour la survie globale a été de 1,25 à 2,47 en faveur des témoins. Ces études ont montré, par rapport aux groupes témoins, une augmentation continue inexpliquée et statistiquement significative, de la mortalité chez les patients atteints d'une anémie liée à différents cancers fréquents et recevant un ASE. Les différences d'incidence des thromboses et des complications reliées à celles-ci entre les patients ayant reçu un ASE et les patients des groupes témoins n'ont pas permis d'expliquer de manière satisfaisante le résultat de la survie globale dans ces études.
Une méta-analyse (reposant sur des valeurs individuelles de patients) regroupant les données des 12 études cliniques contrôlées, réalisées avec Recormon chez des patients cancéreux anémiques (n= 2301), a montré un hazard ratio estimé ponctuellement pour la survie globale de 1,13 en faveur des témoins (IC 95%: 0,87, 1,46). Chez les patients avec un taux initial d'hémoglobine ≤10 g/dl (n= 899), le hazard ratio estimé ponctuellement pour la survie a été de 0,98 (IC 95%: de 0,68 à 1,40).
Un risque relatif accru d'événements thromboemboliques a été observé dans la population globale (RR 1,62, IC 95%: 1,13; 2,31).
Une analyse systématique de plus de 9000 patients cancéreux ayant participé à 57 études cliniques a été effectuée. Une méta-analyse des données de survie globale a montré un hazard ratio estimé ponctuellement pour la survie globale de 1,08 en faveur des témoins (IC 95%: 0,99; 1,18; 42 études et 8167 patients). Un risque relatif accru d'événements thromboemboliques (RR 1,67, IC 95%: 1,35; 2,06, 35 études et 6769 patients) a été observé chez les patients ayant été traités par un ASE. Il existe donc une preuve cohérente permettant de conclure à l'absence d'avantages en matière de survie globale pour les patients cancéreux traités par un ASE. On ignore dans quelle mesure ces résultats pourraient s'appliquer aux patients cancéreux traités par une chimiothérapie et recevant un ASE avec pour objectif un taux d'hémoglobine inférieur à 13 g/dl, car l'ensemble des données étudiées ne contenait que peu de patients présentant ces caractéristiques.
L'efficacité de Recormon lors de myélome multiple, de lymphome non hodgkinien de faible malignité ou de leucémie lymphoïde chronique a été démontrée chez des patients présentant une carence relative en érythropoïétine, définie comme suit:
taux d'érythropoïétine sérique ≤100 mU/ml pour une valeur de l'hémoglobine de >9 à <10 g/dl (>5,58 à <6,2 mmol/l);
taux d'érythropoïétine sérique ≤180 mU/ml pour une valeur de l'hémoglobine de >8 à <9 g/dl (>4,96 à <5,58 mmol/l);
taux d'érythropoïétine sérique ≤300 mU/ml pour une valeur de l'hémoglobine ≤8 g/dl (≤4,96 mmol/l).
Etudes chez des patients insuffisants rénaux
Dans une étude randomisée (CREATE) avec l'époétine bêta, menée chez 603 patients avec anémie rénale, une tendance à une augmentation des événements cardiovasculaires a été observée dans le groupe avec normalisation du taux d'hémoglobine à 13 et 15 g/dl, par comparaison avec le groupe présentant des taux cibles plus faibles, de 10,5-11,5 g/dl. Cette tendance n'a toutefois pas été statistiquement significative (58 cas contre 47, p= 0,20). La fréquence des événements thromboemboliques a été de 11,3% chez les patients traités avec des taux cibles d'hémoglobine élevés (13-15 g/dl) versus 7,3% chez les patients avec un taux cible d'hémoglobine bas (10,5-12,5 g/dl) (p= 0,06). Le taux de thromboses de l'abord artérioveineux chez les patients ayant subi une dialyse a également été plus élevé avec les taux cibles d'hémoglobine élevés (4% versus 3%) (p= 0,42).
Le délai jusqu'à l'instauration d'une dialyse a été raccourci dans le groupe avec taux d'hémoglobine cibles plus élevés (p= 0,034), bien qu'aucune différence n'ait été constatée sur le plan de la clairance médiane de la créatinine. Dans l'ensemble, les résultats plaident néanmoins plutôt en faveur d'une correction partielle que d'une normalisation de routine du taux d'hémoglobine par Recormon.
Dans une étude randomisée avec l'époétine alpha chez des patients en prédialyse (CHOIR), dans laquelle 1432 patients ont été répartis dans un bras avec un taux d'hémoglobine cible élevé (13,5 g/dl) ou dans un bras avec un taux d'hémoglobine cible bas (11,5 g/dl), le nombre d'événements cardio-vasculaires a été significativement plus élevé dans le groupe avec les taux cibles élevés que dans celui avec les taux cibles bas (17% vs 14%; 125 vs 97 cas; p= 0,03). La fréquence des événements thromboemboliques a été de 18% dans le bras de l'étude avec un taux d'hémoglobine élevé et de 17% dans celui avec un taux d'hémoglobine bas (p= 0,65).
Des analyses post-hoc poolées d'études cliniques avec des agents stimulant l'érythropoïèse (ASE) ont été réalisées chez les patients atteints d'insuffisance rénale chronique (patients dialysés, diabétiques et non diabétiques). Une tendance à l'augmentation du risque de mortalité globale et des événements cardiovasculaires et cérébrovasculaires a été observée à des doses cumulées d'ASE plus élevées, indépendamment du statut de dialysé ou de diabétique des patients (voir «Posologie/Mode d'emploi» et «Mises en garde et précautions»).
Pharmacocinétique
Absorption
Après administration sous-cutanée d'époétine bêta à des patients avec insuffisance rénale, l'absorption retardée a mené à une concentration sérique en plateau. Les concentrations maximales ont été atteintes après 12 à 28 h en moyenne. Il n'y a pas de rapport direct entre la concentration sérique de la rhEPO et son action thérapeutique.
La biodisponibilité de l'époétine bêta en administration sous-cutanée atteint 23 à 42% par rapport à la voie intraveineuse.
Distribution
Le volume de distribution correspond à peu près à 1-2 fois le volume plasmatique.
On ignore si la rhEPO franchit la barrière placentaire et si elle passe dans le lait maternel; elle ne traverse toutefois pas la barrière hémato-encéphalique.
Elimination
Les études pharmacocinétiques réalisées sur des sujets sains et sur des patients avec insuffisance rénale montrent que la demi-vie de l'époétine bêta en injection intraveineuse est de 4 à 12 h.
La demi-vie terminale après administration sous-cutanée est plus longue qu'après injection intraveineuse, soit 13 à 28 h en moyenne.
Données précliniques
Cancérogénicité
L'époétine bêta n'influe ni sur la prolifération in vitro de lignées cellulaires non hématologiques saines ou malignes ni sur celle, in vivo, de «modèles de tumeurs» transplantables. Les résultats d'une étude de cancérogénicité chez la souris traitée par érythropoïétine homologue n'ont mis en évidence aucun potentiel prolifératif ou cancérogène.
Génotoxicité
L'époétine bêta s'est avérée non génotoxique dans le test de mutagénicité d'Ames, dans le test du micronoyau, dans le test de mutation ponctuelle HGPRT in vitro et dans le test d'aberration chromosomique sur cellules lymphocytaires humaines mises en culture.
Toxicologie de la reproduction
Des études chez le rat et le lapin n'ont mis en évidence aucun élément donnant à penser que l'époétine bêta pourrait avoir des propriétés embryotoxiques, fœtotoxiques ou tératogènes. Aucun trouble de la fertilité n'a été observé. Une étude sur la toxicité périnatale et postnatale n'a montré aucun effet nocif sur la grossesse et la lactation des femelles ni sur le développement prénatal et postnatal de leur descendance.
Remarques particulières
Incompatibilités
Se référer aux instructions suivantes pour éviter une perte d'efficacité du produit:
ne pas utiliser d'autre solvant que celui livré avec le lyophilisat;
ne pas mélanger la solution reconstituée avec d'autres médicaments ou à une solution pour perfusion;
pour l'injection ou la perfusion de courte durée, n'utiliser que le matériel synthétique livré avec le médicament.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Les formulations seringues préremplies de Recormon doivent être conservées dans l'emballage original, à l'abri de la lumière et au réfrigérateur (2-8 °C).
La chaîne du froid ne doit pas être interrompue. Chez le distributeur, le grossiste et le pharmacien, Recormon PS doit être constamment conservé au réfrigérateur (2-8 °C).
Le patient doit lui aussi conserver constamment le produit au réfrigérateur (2-8 °C). Dans le cadre d'un traitement ambulatoire, le produit peut être stocké une seule fois hors du réfrigérateur, à température ambiante (pas au-dessus de 25 °C), pour une durée ne dépassant pas 3 jours.
Remarques concernant la manipulation
Instructions spéciales concernant l'administration
Les seringues de Recormon PS sont préremplies. Ne doivent être injectées que les solutions limpides ou légèrement opalescentes, incolores et exemptes de particules visibles. Les seringues préremplies de Recormon PS sont des produits stériles, mais sans agents conservateurs. N'administrer en aucun cas plus d'une dose par seringue préremplie.
Instructions concernant la préparation et l'injection des seringues préremplies de Recormon
Pour l'emploi des seringues préremplies de Recormon PS, voir le mode d'emploi à la fin de l'information destinée aux patients.
Numéro d’autorisation
54766 (Swissmedic).
Titulaire de l’autorisation
Roche Pharma (Suisse) SA, Bâle.
Mise à jour de l’information
Juillet 2019.
Відгуки (0)

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.



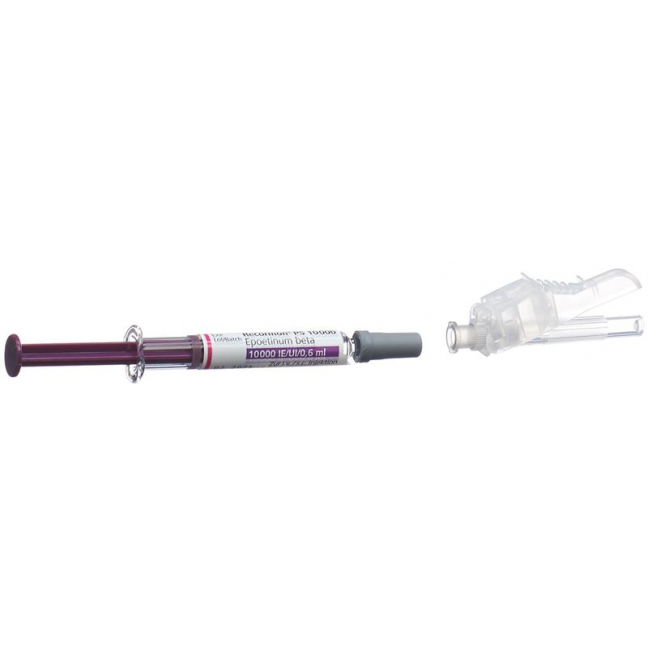


 Deutsch
Deutsch French
French Italian
Italian
























