Ilumetri Inj Lös 100 мг/мл Ферцпр 1 мл
Ilumetri Inj Lös 100 mg/ml Fertspr 1 ml
-
602142.40 RUB
Дата доставки:
25.12.2025 - 08.01.2026
При оплате криптовалютой:
Ваша прибыль 60214.24 RUB / 710.73 USDT
- Наявність: В наявності
- Виробник: ALMIRALL AG
- Модель: 7723428
- ATC-код L04AC17
- EAN 7680667840022
Склад:
Опис
Was ist Ilumetri und wann wird es angewendet?
Ilumetri enthält den Wirkstoff Tildrakizumab, welcher gentechnologisch in tierischen Zellen hergestellt wird. Ilumetri gehört zu einer Gruppe von Arzneimitteln, die als Interleukin-Inhibitoren (IL-Inhibitoren) bezeichnet werden.
Dieses Arzneimittel wirkt durch Blockierung der Aktivität eines Proteins namens IL-23, eines körpereigenen Stoffes, der an normalen Entzündungs- und Immunreaktionen beteiligt ist und bei Krankheiten wie Psoriasis in erhöhten Konzentrationen vorliegt.
Ilumetri wird angewendet zur Behandlung einer Hauterkrankung mit der Bezeichnung «Plaque-Psoriasis» bei Erwachsenen mit einer mittelschweren bis schweren Form dieser Erkrankung, die auf eine herkömmliche Therapie nicht ausreichend angesprochen haben oder bei denen eine Unverträglichkeit oder eine Kontraindikation gegenüber einer solchen Therapie besteht. Die Anwendung von Ilumetri wird bei Ihnen zu einer Verbesserung der Hauterscheinungen und zu einer Linderung Ihrer Symptome führen.
Ilumetri ist nur auf Verschreibung des Arztes oder der Ärztin anzuwenden.
Wann darf Ilumetri nicht angewendet werden?
Ilumetri darf nicht angewendet werden
- wenn Sie allergisch gegen Tildrakizumab oder einen der sonstigen Bestandteile dieses Arzneimittels sind (siehe «Was ist in Ilumetri enthalten?»).
- wenn Sie eine Infektion haben, die Ihr Arzt bzw. Ihre Ärztin als bedeutend einstuft, zum Beispiel aktive Tuberkulose. Tuberkulose ist eine Infektionskrankheit, die hauptsächlich die Lunge befällt.
Wann ist bei der Anwendung von Ilumetri Vorsicht geboten?
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin oder dem medizinischen Fachpersonal, bevor Sie Ilumetri anwenden:
- wenn Sie derzeit an einer Infektion leiden oder wenn Sie eine chronische Infektion oder wiederkehrende Infektionen haben.
- wenn Sie Tuberkulose haben oder in engem Kontakt mit einer an Tuberkulose erkrankten Person waren.
- wenn Sie vor kurzem geimpft wurden oder wenn bei Ihnen eine Impfung vorgesehen ist. Während der Behandlung mit Ilumetri dürfen Sie mit bestimmten Impfstofftypen (Lebendimpfstoffen) nicht geimpft werden.
- Wenn Sie vor der Therapie mit Ilumetri eine UV-Therapie erhalten haben; in dem Falle wird Sie Ihr Arzt bzw. Ihre Ärztin vor und während der Behandlung mit Ilumetri auf das Vorliegen von Hauttumoren untersuchen.
Wenn Sie nicht sicher sind, ob einer der oben genannten Punkte auf Sie zutrifft, sprechen Sie mit Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin oder dem medizinischen Fachpersonal, bevor Sie Ilumetri anwenden.
Achten Sie auf Infektionen und allergische Reaktionen
Ilumetri kann möglicherweise schwerwiegende Nebenwirkungen verursachen, darunter Infektionen und allergische Reaktionen. Während der Behandlung mit Ilumetri müssen Sie daher auf entsprechende Symptome achten:
- Symptome bei allergischen Reaktionen sind Engegefühl in der Brust, pfeifende Atemgeräusche, Schwellung von Gesicht, Lippen oder Rachen.
- Symptome einer Infektion sind Fieber oder grippeähnliche Symptome, Muskelschmerzen, Husten, Kurzatmigkeit, Brennen beim Wasserlassen oder häufigeres Wasserlassen als gewöhnlich, blutiger Auswurf (Schleim), Gewichtsverlust, Durchfall oder Magenschmerzen, warme, rote oder schmerzende Haut oder Wunden am Körper, bei denen es sich nicht um Ihre Psoriasis handelt.
Wenn solche Symptome auftreten, beenden Sie die Anwendung von Ilumetri und setzen Sie sich unverzüglich mit Ihrem Arzt bzw. Ihrer Ärztin in Verbindung.
Fahrtüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Es ist nicht bekannt, ob Ilumetri einen Einfluss auf die Fahrtüchtigkeit und auf die Fähigkeit, Maschinen zu bedienen, hat.
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbst gekaufte!) einnehmen oder äusserlich anwenden. Dazu gehören Impfstoffe und Immunsuppressiva (Arzneimittel, die das Immunsystem beeinflussen).
Darf Ilumetri während einer Schwangerschaft oder in der Stillzeit angewendet werden?
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin um Rat.
Die Anwendung von Ilumetri während der Schwangerschaft sollte vermieden werden. Die Auswirkungen dieses Arzneimittels auf Schwangere sind nicht bekannt.
Wenn Sie eine Frau im gebärfähigen Alter sind, wird Ihnen geraten eine Schwangerschaft zu vermeiden. Sie müssen während der Anwendung von Ilumetri und für mindestens 17 Wochen nach der letzten Ilumetri-Gabe zuverlässige Verhütungsmethoden anwenden.
Sprechen Sie mit Ihrem Arzt bzw. Ihrer Ärztin, wenn Sie stillen oder stillen möchten. Sie sollten zusammen mit Ihrem Arzt bzw. Ihrer Ärztin entscheiden, ob Sie stillen und auf die Behandlung mit Ilumetri verzichten oder diese unterbrechen werden, oder ob Sie Ilumetri anwenden und auf das Stillen verzichten werden. Beides zusammen ist nicht ratsam.
Wie verwenden Sie Ilumetri?
Ilumetri sollte unter Leitung und Überwachung eines Arztes bzw. einer Ärztin angewendet werden, der bzw. die Erfahrungen in der Diagnose und Behandlung von Psoriasis hat.
Wenden Sie dieses Arzneimittel immer genau nach Absprache mit Ihrem Arzt bzw. Ihrer Ärztin an. Fragen Sie bei Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin nach, wenn Sie sich nicht sicher sind.
Die empfohlene Dosis beträgt 100 mg als subkutane Injektion in den Wochen 0 und 4 sowie danach alle 12 Wochen. Bei Patienten mit hoher Krankheitslast oder/und Körpergewicht ≥90 kg können 200 mg eine höhere Wirksamkeit aufweisen.
Ihr Arzt bzw. Ihre Ärztin wird entscheiden, in welcher Dosis und wie lange Ilumetri bei Ihnen angewendet werden soll.
Nach einer sorgfältigen Einweisung in die subkutane Injektionstechnik können Sie sich Ilumetri selbst injizieren, wenn Ihr Arzt bzw. Ihre Ärztin dies für angemessen hält. Ausführliche Hinweise zur Injektion von Ilumetri entnehmen Sie bitte dem Abschnitt «Bedienungsanleitung» am Ende dieser Packungsbeilage.
Besprechen Sie mit Ihrem Arzt bzw. Ihrer Ärztin, wann Sie Ihre Injektionen und Ihre Folgetermine haben werden.
Wenn Sie eine grössere Menge von Ilumetri angewendet haben, als Sie sollten:
Wenn Sie eine grössere Menge von Ilumetri erhalten haben, als Sie sollten, oder wenn die Dosis früher verabreicht wurde, als von Ihrem Arzt bzw. Ihrer Ärztin verschrieben, informieren Sie bitte Ihren Arzt bzw. Ihre Ärztin.
Wenn Sie die Anwendung von Ilumetri vergessen haben:
Wenn Sie einmal eine Injektion vergessen haben, injizieren Sie sich die vergessene Dosis so bald wie möglich. Anschliessend sollte die Dosisverabreichung wieder in den regelmässigen, geplanten Abständen erfolgen.
Wenn Sie die Anwendung von Ilumetri abbrechen:
Die Entscheidung, die Anwendung von Ilumetri abzubrechen, müssen Sie mit Ihrem Arzt bzw. Ihrer Ärztin besprechen. Die Anzeichen Ihrer Erkrankung können nach Abbruch der Behandlung zurückkehren.
Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin oder das medizinische Fachpersonal.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Kinder und Jugendliche
Die Anwendung und Sicherheit von Ilumetri ist bei Kindern und Jugendlichen unter 18 Jahren bisher nicht geprüft worden. Bei dieser Altersgruppe wird Ilumetri nicht angewendet.
Welche Nebenwirkungen kann Ilumetri haben?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Die meisten der folgenden Nebenwirkungen treten normalerweise nur leicht bis mittelschwer auf. Wenn eine dieser Nebenwirkungen Sie erheblich beeinträchtigt, informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin.
Sehr häufige Nebenwirkungen (können mehr als 1 von 10 Personen betreffen):
- Infektionen der oberen Atemwege einschliesslich Entzündungen des Nasen- und Rachenraums. Zu den Symptomen gehören Husten und Schnupfen.
Häufige Nebenwirkungen (können bis zu 1 von 10 Personen betreffen):
- Magen-Darm-Beschwerden
- Übelkeit
- Durchfall
- Schmerzen an der Injektionsstelle
- Rückenschmerzen
- Kopfschmerzen
Wenn Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind, sollten Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin informieren.
Was ist ferner zu beachten?
Ausser Reichweite von Kindern aufbewahren.
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Im Kühlschrank lagern (2-8 °C). Nicht einfrieren. Nicht schütteln. Die Fertigspritzen bis zur Anwendung im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Ilumetri ist eine klare bis leicht opaleszente, farblose bis leicht gelbe Lösung. Verwenden Sie dieses Arzneimittel nicht, wenn Sie bemerken, dass das Arzneimittel trüb oder verfärbt ist oder grosse Partikel enthält.
Nachdem Sie eine Fertigspritze aus dem Kühlschrank genommen haben, warten Sie ca. 30 Minuten, damit die Ilumetri-Lösung in der Fertigspritze Raumtemperatur (15-25 °C) erreichen kann. Erwärmen Sie Ilumetri nicht auf andere Art und Weise.
Wenn Sie Ilumetri aus dem Kühlschrank entnommen haben, bewahren Sie es nicht bei Temperaturen über 25 °C auf. Sobald die Spritze dem Kühlschrank entnommen wurde, um sie bei Raumtemperatur zu lagern, muss sie innerhalb von 30 Tagen oder bis zum Verfalldatum, je nachdem was zuerst eintritt, verwendet werden, auch wenn sie in den Kühlschrank zurückgelegt wird. Notieren Sie das Entnahmedatum aus dem Kühlschrank und das entsprechende Entsorgungsdatum in dem auf dem Umkarton dafür vorgesehenen Feld.
Dieses Arzneimittel ist nur für den Einmalgebrauch bestimmt.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin oder das medizinische Fachpersonal, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Ilumetri enthalten?
Jede Fertigspritze enthält 100 mg Tildrakizumab und die Hilfsstoffe L-Histidin, L-Histidinhydrochlorid-Monohydrat, Polysorbat 80, Saccharose und Wasser für Injektionszwecke.
Zulassungsnummer
66784 (Swissmedic).
Wo erhalten Sie Ilumetri? Welche Packungen sind erhältlich?
In Apotheken gegen ärztliche Verschreibung.
Ilumetri ist als Packung mit 1 Fertigspritze und als Mehrfachpackung aus 2 Faltschachteln mit je 1 Fertigspritze erhältlich (Packung mit 2 Fertigspritzen zurzeit nicht im Handel).
Zulassungsinhaberin
Almirall AG, 8304 Wallisellen.
Diese Packungsbeilage wurde im November 2018 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
BEDIENUNGSANLEITUNG
Bevor Sie Ihre Fertigspritze benutzen:
Wichtig zu wissen
- Bevor Sie die Ilumetri-Fertigspritze anwenden, lesen Sie die Patienteninformation und die Bedienungsanleitung vollständig durch und befolgen Sie alle Anwendungshinweise der Bedienungsanleitung sorgfältig und Schritt für Schritt. Bewahren Sie die Bedienungsanleitung gut auf, falls Sie sie wieder benötigen.
- Die Fertigspritze darf NICHT geschüttelt werden.
PRODUKTBESCHREIBUNG
So sieht die Ilumetri-Fertigspritze aus:
VORBEREITUNG
1. Nachdem Sie die Fertigspritze aus dem Kühlschrank entnommen haben, warten Sie 30 Minuten
- Nehmen Sie vor der Injektion die Kartonpackung mit der Ilumetri-Fertigspritze aus dem Kühlschrank und stellen Sie sie auf eine saubere und ebene Arbeitsfläche.
- Falls Ihre Dosis 200 mg beträgt, benötigen Sie bei jeder Verabreichung 2 Fertigspritzen. Entnehmen Sie deshalb aus dem Kühlschrank 2 Fertigspritzen.
- Lassen Sie die Fertigspritze für 30 Minuten im Karton (mit geschlossenem Deckel), damit sie sich auf Raumtemperatur erwärmt.
2. Überprüfen Sie das Arzneimittel
- Nehmen Sie die Fertigspritze aus dem Karton, wenn Sie für die Injektion bereit sind.
- Prüfen Sie das Verfalldatum auf dem Karton und der Fertigspritze und verwerfen Sie sie, falls das Datum abgelaufen ist.
- Falls das Arzneimittel bei Raumtemperatur gelagert wurde, prüfen Sie das Entsorgungsdatum, das Sie notiert haben. Verwerfen Sie das Arzneimittel, wenn dieses abgelaufen ist.
- Solange Sie nicht für die Injektion vorbereitet sind, sollte die Nadelabdeckung NICHT entfernt werden.
- Überprüfen Sie das Arzneimittel vor der Anwendung visuell auf Partikel und Verfärbungen.
- NICHT anwenden, wenn die Lösung nicht klar bis leicht opaleszent, farblos bis leicht gelb ist.
- NICHT anwenden, wenn die Flüssigkeit sichtbare Partikel enthält oder die Fertigspritze beschädigt ist. Luftblasen können vorhanden sein; es besteht keine Notwendigkeit, sie zu entfernen.
3. Stellen Sie alle Gegenstände zusammen, die Sie benötigen
- Platzieren Sie auf eine saubere, gut beleuchtete Arbeitsfläche:
- Alkoholtupfer
- Wattebausch oder Gazetupfer
- Pflaster
- einen Entsorgungsbehälter
4. Waschen Sie sich die Hände
- Waschen Sie Ihre Hände gründlich mit Wasser und Seife.
5. Wählen Sie Ihre Injektionsstelle
- Wählen Sie eine Injektionsstelle mit intakter Haut und leichtem Zugang wie Bauch, Oberschenkel oder Oberarm (wenn Ihnen die Injektion von einer anderen Person verabreicht wird)
- Wählen Sie für die Injektion jedes Mal eine andere Stelle.
- NICHT anwenden in einem Bereich von 5 cm um den Bauchnabel herum oder an Stellen, an denen die Haut empfindlich, blutunterlaufen, ungewöhnlich rot, verhärtet oder von Psoriasis betroffen ist.
- NICHT direkt in Narben, Dehnungsstreifen oder Blutgefässe injizieren.
- Falls Ihre Dosis 200 mg beträgt und Sie deshalb zwei Injektionen durchführen müssen, wählen Sie für die zweite Injektion eine andere Stelle.
6. Reinigen Sie die Injektionsstelle
- Reinigen Sie die Injektionsstelle mit einem Alkoholtupfer und lassen Sie Ihre Haut trocknen.
- Berühren Sie die Injektionsstelle nicht mehr vor der Injektion.
DIE INJEKTION
Falls Ihre Dosis 200 mg beträgt, müssen Sie bei jeder Verabreichung des Arzneimittels zwei Fertigspritzen anwenden.
7. Ziehen Sie die Nadelschutzkappe ab
- Halten Sie den Spritzenkörper fest, entfernen Sie die Nadelabdeckung wie dargestellt und entsorgen Sie sie. Eventuell bemerken Sie 1 oder 2 Flüssigkeitstropfen. Dies ist normal.
- Den blauen Kolben noch NICHT berühren.
- NICHT verwenden, wenn die Fertigspritze oder die Nadel gebogen ist.
8. Drücken Sie die Haut an der Injektionsstelle zusammen und führen Sie die Nadel ein
- Drücken Sie Ihre Haut sanft zusammen.
- Führen Sie die gesamte Nadel senkrecht in einem 90-Grad-Winkel in Ihre Haut ein.
- NICHT den Finger auf den Kolben legen, während Sie die Nadel einführen.
- Halten Sie die Spritze fest.
9. Injizieren Sie das Arzneimittel
- Nach der Einführung der Nadel lassen Sie die Haut vorsichtig los.
- Drücken Sie den blauen Kolben langsam nach unten, bis er sich nicht weiter bewegt. Dies aktiviert den Sicherheitsmechanismus, der ein vollständiges Zurückziehen der Nadel nach der Injektion gewährleistet.
- Eine vollständige Dosis ist verabreicht, wenn sich der blaue Kolben nicht weiter bewegen kann und keine Flüssigkeit an der Injektionsstelle ausgetreten ist.
- Die Gesamtmenge an Injektionslösung soll injiziert werden.
10. Entsorgen Sie die gebrauchte Spritze
- Ziehen Sie die Nadel vollständig aus der Haut heraus, bevor Sie den blauen Kolben loslassen.
- Nachdem der blaue Kolben losgelassen wurde, zieht die Sicherheitsverriegelung die Nadel in den Nadelschutz.
- Entsorgen Sie die gebrauchte Spritze sofort nach Gebrauch und bei einer Dosis von 200 mg vor der Injektion der zweiten Spritze in einem Entsorgungsbehälter.
- Wenn sich Restflüssigkeit oder etwas Blut auf der Injektionsstelle befindet, reinigen Sie diese mit einem Wattebausch oder Gazetupfer OHNE Druck auf die Stelle auszuüben. Reiben Sie die Injektionsstelle nicht ab. Bei Bedarf können Sie die Injektionsstelle mit einem Pflaster abdecken.
- Falls Ihre Dosis 200 mg beträgt: wiederholen Sie den Vorgang mit der zweiten Spritze an einer anderen Hautstelle.
Qu’est-ce que Ilumetri et quand doit-il être utilisé?
Ilumetri contient comme principe actif le tildrakizumab, une substance qui est produite dans des cellules animales par génie génétique. Ilumetri appartient à une classe de médicaments appelée inhibiteurs des interleukines (IL).
Ce médicament agit en bloquant l'activité d'une protéine appelée IL-23, une substance produite dans l'organisme qui est impliquée dans les réactions inflammatoires et immunitaires normales et dont les concentrations sont augmentées lors des maladies telles que le psoriasis.
Ilumetri est utilisé pour traiter une affection de la peau appelée psoriasis en plaques chez les adultes atteints d'une forme modérée à sévère de cette maladie qui n'ont pas présenté une réponse suffisante au traitement habituel ou qui présentent une intolérance ou une contre-indication à un tel traitement. L'utilisation d'Ilumetri améliorera vos manifestations cutanées et soulagera vos symptômes.
Ilumetri ne doit être utilisé que sur prescription du médecin.
Quand Ilumetri ne doit-il pas être utilisé?
Ilumetri ne doit pas être utilisé
- si vous êtes allergique au tildrakizumab ou à l'un des autres composants de ce médicament (voir «Que contient Ilumetri ?»);
- si vous présentez une infection que votre médecin considère comme importante comme par exemple une tuberculose active. La tuberculose est une maladie infectieuse affectant principalement les poumons.
Quelles sont les précautions à observer lors de l’utilisation d’Ilumetri?
Veuillez vous adresser à votre médecin, à votre pharmacien ou au personnel médical avant d'utiliser Ilumetri:
- si vous souffrez actuellement d'une infection ou si vous présentez une infection chronique ou des infections à répétition;
- si vous avez une tuberculose ou avez été en contact étroit avec une personne atteinte de tuberculose;
- si vous avez été récemment vacciné ou si une vaccination est prévue prochainement. Vous ne devez pas recevoir certains types de vaccins (vaccins vivants) pendant le traitement par Ilumetri.
- si vous avez reçu un traitement par rayons ultraviolets (UV) avant le traitement par Ilumetri; dans ce cas, votre médecin vous examinera avant et pendant le traitement par Ilumetri pour rechercher la présence de tumeurs cutanées.
Si vous n'êtes pas certain(e) que l'un des points ci-dessus vous concerne, adressez-vous à votre médecin, à votre pharmacien ou au personnel médical avant d'utiliser Ilumetri.
Surveillance des infections et des réactions allergiques
Ilumetri est susceptible d'entraîner de graves effets secondaires, parmi lesquels entre autres des infections et des réactions allergiques. Vous devez donc être attentif/attentive à la survenue des symptômes de ces maladies au cours du traitement par Ilumetri:
- Les symptômes survenant lors des réactions allergiques sont les suivants: sensation d'oppression dans la poitrine, respiration sifflante, gonflement du visage, des lèvres ou de la gorge.
- Les symptômes d'une infection sont les suivants: fièvre ou symptômes pseudo-grippaux, douleurs musculaires, toux, essoufflement, brûlures en urinant ou besoin d'uriner plus fréquent que d'habitude, crachats sanguinolents (mucus), perte de poids, diarrhée ou maux d'estomac, peau chaude, rouge ou douloureuse, ou lésions sur le corps autres que celles de votre psoriasis.
Si vous présentez de tels symptômes, arrêtez d'utiliser Ilumetri et contactez immédiatement votre médecin.
Aptitude à la conduite et capacité à utiliser des machines
On ignore si Ilumetri a une influence sur l'aptitude à la conduite et la capacité à utiliser des machines.
Veuillez informer votre médecin ou votre pharmacien si
- vous souffrez d'une autre maladie,
- vous êtes allergique ou
- vous prenez ou utilisez déjà d'autres médicaments (même en automédication!) en usage externe. Cela inclut les vaccins et les immunosuppresseurs (médicaments qui affectent le système immunitaire).
Ilumetri peut-il être utilisé pendant la grossesse ou l’allaitement?
Si vous êtes enceinte, si vous allaitez, si vous pensez être enceinte ou si vous envisagez une grossesse, demandez conseil à votre médecin ou à votre pharmacien avant d'utiliser ce médicament.
L'utilisation d'Ilumetri doit être évitée pendant la grossesse. Les effets de ce médicament chez la femme enceinte ne sont pas connus.
Si vous êtes une femme en âge de procréer, il vous est conseillé d'éviter de devenir enceinte. Vous devez utiliser une méthode de contraception fiable pendant l'utilisation d'Ilumetri et pendant au moins 17 semaines après la dernière administration d'Ilumetri.
Si vous allaitez ou souhaitez allaiter, adressez-vous à votre médecin. Vous devez décider avec votre médecin si vous allaitez et renoncez au traitement par Ilumetri ou l'interrompez, ou si vous utilisez Ilumetri et renoncez à l'allaitement. Les deux ensemble sont déconseillés.
Comment utiliser Ilumetri?
Ilumetri doit être utilisé sous la conduite et la surveillance d'un médecin expérimenté dans le diagnostic et le traitement du psoriasis.
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin. Demandez conseil à votre médecin ou à votre pharmacien en cas de doute.
La dose recommandée est de 100 mg, administrée par injection sous-cutanée aux semaines 0 et 4, puis toutes les 12 semaines. Chez les patients présentant une charge élevée de la maladie et/ou un poids corporel ≥90 kg, 200 mg peuvent montrer une plus grande efficacité.
Votre médecin décidera de la dose et de la durée de l'utilisation d'Ilumetri.
Après avoir été correctement formé(e) à la technique d'injection sous-cutanée, vous pourrez vous injecter vous-même Ilumetri si votre médecin le juge approprié. Pour de plus amples informations sur l'injection d'Ilumetri, consultez la rubrique «Mode d'emploi» à la fin de cette notice d'emballage.
Demandez à votre médecin quand vous recevrez vos injections et vous aurez vos rendez-vous de contrôle.
Si vous avez utilisé plus d'Ilumetri que vous n'auriez dû:
Si vous avez reçu plus d'Ilumetri que vous n'auriez dû ou si la dose a été administrée plus tôt que ce que votre médecin a prescrit, informez-en votre médecin.
Si vous avez oublié d'utiliser Ilumetri:
Si vous avez une fois oublié une injection, injectez la dose oubliée dès que possible. Reprenez ensuite l'administration des doses aux intervalles réguliers prévus.
Si vous arrêtez d'utiliser Ilumetri:
La décision d'arrêter Ilumetri doit être discutée avec votre médecin. Les signes de votre maladie peuvent réapparaître après l'arrêt du traitement.
Si vous avez d'autres questions au sujet de l'utilisation de ce médicament, consultez votre médecin, votre pharmacien ou le personnel médical.
Ne changez pas de votre propre chef le dosage prescrit. Si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte, veuillez vous adresser à votre médecin ou à votre pharmacien.
Enfants et adolescents
L'utilisation et la sécurité d'Ilumetri n'ont pas été établies à ce jour chez les enfants et les adolescents de moins de 18 ans. Ilumetri n'est donc pas utilisé dans ce groupe d'âge.
Quels effets secondaires Ilumetri peut-il provoquer?
Comme tous les médicaments, ce médicament peut lui aussi provoquer des effets secondaires, mais ils ne surviennent pas systématiquement chez tous les patients.
La plupart des effets secondaires ci-dessous sont habituellement d'intensité légère à modérée. Si l'un de ces effets secondaires devient très gênant, informez-en votre médecin ou votre pharmacien.
Effets secondaires très fréquents (pouvant affecter plus d'1 personne sur 10):
- Infections des voies respiratoires supérieures, y compris inflammations de la cavité rhinopharyngée. Les symptômes sont notamment une toux et un rhume.
Effets secondaires fréquents (pouvant affecter jusqu'à 1 personne sur 10):
- Troubles gastro-intestinaux
- Nausées
- Diarrhée
- Douleurs au niveau du site d'injection
- Maux de dos
- Maux de tête
Si vous remarquez des effets secondaires qui ne sont pas mentionnés dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
À quoi faut-il encore faire attention?
Conserver hors de la portée des enfants.
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Conserver au réfrigérateur (2–8 °C). Ne pas congeler. Ne pas agiter. Conserver les seringues préremplies dans leur carton d'emballage jusqu'à leur utilisation pour les protéger de la lumière.
Ilumetri est une solution limpide à légèrement opalescente, incolore à jaune pâle. N'utilisez pas ce médicament si vous remarquez que la solution est trouble, qu'elle présente un changement de coloration ou qu'elle contient des particules de grande taille.
Après avoir sorti une seringue préremplie du réfrigérateur, attendez environ 30 minutes pour permettre à la solution d'Ilumetri contenue dans la seringue préremplie de se réchauffer à température ambiante (15-25ºC). Ne réchauffez pas Ilumetri d'une autre manière.
Une fois que vous avez sorti Ilumetri du réfrigérateur, ne le conservez pas à une température supérieure à 25 °C. Après avoir sorti la seringue du réfrigérateur pour la conserver à température ambiante, vous devez l'utiliser dans les 30 jours ou jusqu'à la date de péremption, selon ce qui survient en premier, même si vous l'avez remise au réfrigérateur. Notez dans le champ prévu à cet effet sur le carton d'emballage la date de sortie du réfrigérateur et la date à laquelle la seringue doit être éliminée.
Ce médicament est exclusivement destiné à un usage unique.
N'éliminez pas de médicaments avec les eaux usées ou avec les déchets ménagers. Demandez à votre médecin, à votre pharmacien ou au personnel médical comment éliminer le médicament lorsque vous ne l'utilisez plus.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien. Ces personnes disposent d'une information détaillée destinée aux professionnels.
Que contient Ilumetri?
Chaque seringue préremplie contient 100 mg de tildrakizumab et les excipients L-histidine, chlorhydrate de L-histidine monohydraté, polysorbate 80, saccharose et eau pour préparations injectables.
Numéro d’autorisation
66784 (Swissmedic).
Où obtenez-vous Ilumetri? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Ilumetri est disponible dans une boîte contenant 1 seringue préremplie et dans un emballage multiple de 2 boîtes contenant chacune 1 seringue préremplie (la boîte de 2 seringues préremplies n’est pas commercialisée actuellement).
Titulaire de l'autorisation
Almirall AG, 8304 Wallisellen.
Cette notice d'emballage a été vérifiée pour la dernière fois en novembre 2018 par l'autorité de contrôle des médicaments (Swissmedic).
MODE D’EMPLOI
Avant d’utiliser votre seringue préremplie:
Ce qu’il faut savoir
- Avant d’utiliser la seringue préremplie d’Ilumetri, lisez attentivement l’information destinée aux patients et le mode d’emploi et suivez exactement toutes les instructions du mode d’emploi étape par étape. Conservez bien ce mode d’emploi au cas où vous en auriez à nouveau besoin.
- La seringue préremplie NE doit PAS être agitée.
DESCRIPTION DU PRODUIT
Voici à quoi ressemble la seringue préremplie d’Ilumetri:

PRÉPARATION
1. Après avoir sorti la seringue préremplie du réfrigérateur, attendez 30 minutes
- Avant l’injection, sortez la boîte en carton contenant la seringue préremplie d’Ilumetri du réfrigérateur et posez-la sur une surface de travail propre et plane.
- Si votre dose est de 200 mg, vous aurez besoin de 2 seringues préremplies pour chaque administration. Sortez donc 2 seringues préremplies du réfrigérateur.
- Laissez la seringue préremplie pendant 30 minutes dans le carton (avec le couvercle fermé), afin qu’elle se réchauffe à température ambiante.
2. Inspectez le médicament
- Sortez la seringue préremplie du carton lorsque vous êtes prêt(e) à faire l’injection.
- Vérifiez la date de péremption figurant sur le carton et sur la seringue préremplie et éliminez cette dernière si la date est dépassée.
- Si le médicament a été conservé à température ambiante, vérifiez la date que vous avez notée à laquelle la seringue doit être éliminée. Éliminez le médicament si cette date est dépassée.
- NE retirez PAS le capuchon de l’aiguille tant que vous n’êtes pas prêt(e) à faire l’injection.
- Inspectez visuellement le médicament avant l’utilisation pour vérifier l’absence de particules et de changement de coloration.
- NE l’utilisez PAS si la solution n’est pas limpide à légèrement opalescente, incolore à jaune pâle.
- NE l’utilisez PAS si le liquide contient des particules visibles ou si la seringue préremplie est endommagée. Des bulles d’air peuvent être présentes; il n’est pas nécessaire de les éliminer.

3. Rassemblez tous les objets dont vous avez besoin
- Sur une surface de travail propre et bien éclairée, placez:
- un tampon imbibé d’alcool
- un tampon d’ouate ou une compresse de gaze
- un pansement
- un récipient collecteur de déchets
4. Lavez-vous les mains
- Lavez-vous soigneusement les mains à l’eau et au savon.

5. Choisissez le site d’injection
- Choisissez un site d’injection où la peau est intacte et dont l’accès est facile, tel que le ventre, la cuisse ou le haut du bras (si l’injection est administrée par une autre personne)
- Choisissez un site différent pour chaque injection.
- N’administrez PAS le médicament dans une zone de 5 cm autour du nombril ou dans une zone de la peau qui est sensible au toucher, qui présente un hématome, qui est anormalement rouge, qui est indurée ou qui est atteinte de psoriasis.
- N’injectez PAS le médicament directement dans des cicatrices, des vergetures ou des vaisseaux sanguins.
- Si votre dose est de 200 mg et que vous devez donc faire deux injections, choisissez un site différent pour la deuxième injection.
6. Nettoyez le site d’injection
- Nettoyez le site d’injection avec un tampon imbibé d’alcool et laissez la peau sécher.
- Ne touchez plus la zone d’injection avant l’injection.

L’INJECTION
Si votre dose est de 200 mg, vous devez utiliser deux seringues préremplies pour chaque administration du médicament.
7. Retirez le capuchon protecteur de l’aiguille
- Tout en maintenant fermement le corps de la seringue, retirez le capuchon de l’aiguille comme illustré, puis éliminez-le. Il est possible qu’une ou deux gouttes de liquide soient visibles. C’est normal.
- NE touchez PAS encore le piston bleu.
- N’utilisez PAS le médicament si la seringue préremplie ou l’aiguille sont tordues.

8. Pincez la peau au niveau du site d’injection et insérez l’aiguille
- Pincez délicatement la peau.
- Insérez la totalité de l’aiguille dans la peau, à la verticale à un angle de 90 degrés.
- NE posez PAS le doigt sur le piston pendant que vous insérez l’aiguille.
- Tenez fermement la seringue.


9. Injectez le médicament
- Après avoir inséré l’aiguille, relâchez prudemment la peau.
- Enfoncez le piston bleu lentement jusqu’à ce qu’il ne puisse plus aller plus loin. Cela active le mécanisme de sécurité qui garantit la rétraction complète de l’aiguille après l’injection.
- La dose complète est administrée lorsque le piston bleu ne peut plus aller plus loin et qu’il n’y a eu aucune fuite de liquide au niveau du site d’injection.
- La totalité de la solution injectable doit être injectée.

10. Éliminez la seringue usagée
- Retirez entièrement l’aiguille de la peau avant de relâcher le piston bleu.
- Une fois que le piston bleu a été relâché, le verrouillage de sécurité rétracte l’aiguille à l’intérieur du protège-aiguille.

- Éliminez la seringue usagée dans un récipient collecteur de déchets immédiatement après l’utilisation et, en cas de dose de 200 mg, avant l’injection avec la deuxième seringue.
- En présence de liquide résiduel ou d’une toute petite quantité de sang au niveau du site d’injection, nettoyez ce dernier avec un tampon d’ouate ou une compresse de gaze SANS appuyer sur le site. Ne frottez pas le site d’injection. Si nécessaire, vous pouvez recouvrir le site de l’injection avec un pansement.
- Si votre dose est de 200 mg: répétez la procédure avec la deuxième seringue au niveau d’un autre site d’injection.
Che cos'è Ilumetri e quando si usa?
Ilumetri contiene il principio attivo tildrakizumab, prodotto in cellule animali con tecniche di ingegneria genetica. Ilumetri appartiene a un gruppo di medicamenti chiamati inibitori delle interleuchine (IL-inibitori).
Questo medicamento agisce bloccando l'attività di una proteina chiamata IL-23, una sostanza endogena che è coinvolta nelle normali reazioni infiammatorie e immunitarie ed è presente in concentrazioni elevate in alcune malattie, come la psoriasi.
Ilumetri viene utilizzato per il trattamento di una malattia della pelle chiamata «psoriasi a placche» negli adulti affetti da una forma moderata o grave di questa malattia che non hanno risposto in maniera sufficiente a una terapia convenzionale o che presentano un'intolleranza o una controindicazione per tale terapia. L'uso di Ilumetri porta a un miglioramento delle manifestazioni cutanee e a un'attenuazione dei sintomi.
Ilumetri deve essere usato solo su prescrizione medica.
Quando non si può usare Ilumetri?
Non deve usare Ilumetri
- se è allergico al tildrakizumab o a uno degli altri componenti di questo medicamento (vedere «Cosa contiene Ilumetri?»);
- se ha un'infezione che il medico considera significativa, per esempio una tubercolosi in fase attiva. La tubercolosi è una malattia infettiva che colpisce prevalentemente i polmoni.
Quando è richiesta prudenza nell'uso di Ilumetri?
Parli con il suo medico, il suo farmacista o il personale medico prima di usare Ilumetri:
- se ha attualmente un'infezione o se soffre di infezioni croniche o ricorrenti;
- se è affetto da tubercolosi o è stato a stretto contatto con una persona affetta da tubercolosi;
- se si è vaccinato di recente o prevede di vaccinarsi. Durante il trattamento con Ilumetri non deve sottoporsi a vaccinazioni con determinati tipi di vaccini (vaccini vivi);
- se prima del trattamento con Ilumetri è stato sottoposto a fototerapia; in tal caso, il medico controllerà prima e durante il trattamento con Ilumetri che non vi siano tumori cutanei.
Se non è sicuro se una delle condizioni sopra menzionate la riguarda, parli con il suo medico, con il suo farmacista o con il personale medico prima di usare Ilumetri.
Prestare attenzione alle infezioni e alle reazioni allergiche
Ilumetri potrebbe provocare gravi effetti collaterali, tra cui infezioni e reazioni allergiche. Pertanto, durante il trattamento con Ilumetri deve prestare attenzione ai sintomi di questi disturbi:
- i sintomi delle reazioni allergiche sono senso di costrizione al petto, respiro sibilante, gonfiore del volto, delle labbra o della gola;
- i sintomi delle infezioni sono febbre o sintomi simil-influenzali, dolori muscolari, tosse, fiato corto, bruciore durante la minzione o minzione più frequente del normale, espettorato (muco) con sangue, perdita di peso, diarrea o mal di stomaco, pelle calda, arrossata o dolorante o lesioni sul corpo non correlate alla psoriasi.
Se insorgono questi sintomi interrompa il trattamento con Ilumetri e contatti immediatamente il suo medico.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Non è noto se Ilumetri influisca sulla capacità di condurre veicoli e sull'impiego di macchine.
Informi il suo medico o il suo farmacista nel caso in cui
- soffre di altre malattie,
- soffre di allergie o
- assume o applica esternamente altri medicamenti (anche se acquistati di sua iniziativa!), tra cui vaccini e immunosoppressori (medicamenti che influenzano il sistema immunitario).
Si può somministrare Ilumetri durante la gravidanza o l'allattamento?
Se è incinta o allatta, sospetta di essere incinta o sta pianificando una gravidanza, chieda consiglio al suo medico o al suo farmacista prima di usare questo medicamento.
L'uso di Ilumetri durante la gravidanza deve essere evitato. Gli effetti di questo medicamento sulle donne in gravidanza non sono noti.
Se lei è una donna in età fertile, le sarà consigliato di evitare una gravidanza. Durante l'uso di Ilumetri e per almeno 17 settimane dopo l'ultima dose di Ilumetri dovrà utilizzare metodi contraccettivi affidabili.
Se allatta o vorrebbe allattare, parli con il suo medico. Dovrà decidere insieme a lui se rinunciare al trattamento o interromperlo e allattare, o se usare Ilumetri e rinunciare all'allattamento. Allattare durante il trattamento con Ilumetri è sconsigliato.
Come usare Ilumetri?
Ilumetri deve essere utilizzato sotto la guida e la supervisione di un medico esperto nella diagnosi e nel trattamento della psoriasi.
Prenda questo medicamento seguendo sempre esattamente le istruzioni del medico. Se ha dei dubbi, chieda al medico o al farmacista.
La dose consigliata è di 100 mg sotto forma di iniezione sottocutanea nelle settimane 0 e 4 e poi ogni 12 settimane. Nei pazienti con un elevato carico di malattia e/o con un peso corporeo ≥90 kg una dose di 200 mg può dimostrarsi più efficace.
Il suo medico deciderà quale dose di Ilumetri va utilizzata nel suo caso, e per quanto tempo.
Se il suo medico lo riterrà opportuno, lei potrà somministrarsi da solo Ilumetri dopo essere stato accuratamente istruito alla tecnica di iniezione sottocutanea. Per indicazioni dettagliate sull'iniezione di Ilumetri legga il paragrafo «Istruzioni per l'uso» alla fine di questo foglietto illustrativo.
Parli con il suo medico per sapere quando dovrà somministrarsi le iniezioni e quando presentarsi alle visite di controllo.
Se ha utilizzato una quantità di Ilumetri maggiore del dovuto:
informi il suo medico se ha ricevuto una quantità di Ilumetri maggiore del dovuto o se la dose è stata somministrata prima del momento prescritto.
Se ha dimenticato di usare Ilumetri:
se dimentica un'iniezione, si inietti la dose dimenticata il prima possibile, quindi prosegua con la somministrazione programmata delle dosi a intervalli regolari.
Se interrompe l'uso di Ilumetri:
la decisione di interrompere l'uso di Ilumetri deve essere discussa con il medico. I segni della malattia possono ripresentarsi dopo l'interruzione del trattamento.
Se ha delle domande sull'uso di questo medicamento, si rivolga al suo medico, al suo farmacista o al personale medico.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte, ne parli al suo medico o al suo farmacista.
Bambini e adolescenti
L'uso e la sicurezza di Ilumetri nei bambini e negli adolescenti sotto i 18 anni finora non sono stati esaminati. Ilumetri non è utilizzato in questa fascia di età.
Quali effetti collaterali può avere Ilumetri?
Come tutti i medicamenti, anche questo medicamento può avere effetti collaterali, che tuttavia non compaiono necessariamente in ogni paziente.
Solitamente, la maggior parte dei seguenti effetti collaterali è di entità lieve o moderata. Se uno di questi effetti collaterali le crea grave fastidio informi il suo medico o il suo farmacista.
Effetti collaterali molto comuni (possono colpire più di 1 persona su 10):
- infezioni delle vie respiratorie superiori, incluse infiammazioni nasofaringee. Tra i sintomi di queste infezioni vi sono tosse e rinite.
Effetti collaterali comuni (possono colpire fino a 1 persona su 10):
- disturbi gastrointestinali;
- nausea;
- diarrea;
- dolore nel punto d'iniezione;
- mal di schiena;
- mal di testa.
Se osserva effetti collaterali qui non descritti, dovrebbe informare il suo medico o il suo farmacista.
Di che altro occorre tener conto?
Tenere fuori dalla portata dei bambini.
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Conservare in frigorifero (2-8 °C). Non congelare. Non scuotere. Conservare le siringhe preriempite nella confezione fino al momento dell'uso, per tenere il contenuto al riparo dalla luce.
Ilumetri è una soluzione trasparente o leggermente opalescente, incolore o di colore giallo chiaro. Non usi questo medicamento se nota che il medicamento è torbido, ha un colore anomalo o contiene particelle di grandi dimensioni.
Dopo aver prelevato una siringa preriempita dal frigorifero attenda circa 30 minuti, per permettere alla soluzione di Ilumetri nella siringa preriempita di arrivare a temperatura ambiente (15-25 °C). Non riscaldi Ilumetri in nessun altro modo.
Quando rimuove Ilumetri dal frigorifero non lo conservi a temperature superiori a 25 °C. Dopo che la siringa è stata rimossa dal frigorifero per essere conservata a temperatura ambiente, deve essere utilizzata entro 30 giorni – o entro la data di scadenza, se questa decorre prima – anche nel caso in cui la siringa venga posta nuovamente in frigorifero. Annoti la data in cui ha rimosso il medicamento dal frigorifero e la corrispondente data di smaltimento nell'apposito spazio sulla confezione.
Questo medicamento è esclusivamente monouso.
Non smaltire i medicamenti né insieme alle acque di scarico né con i rifiuti domestici. Chieda al suo medico, al suo farmacista o al personale medico come smaltire il medicamento quando non lo utilizza più.
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Ilumetri?
Ciascuna siringa preriempita contiene 100 mg di tildrakizumab e le sostanze ausiliarie L-istidina, L-istidina cloridrato monoidrato, polisorbato 80, saccarosio e acqua per preparazioni iniettabili.
Numero dell’omologazione
66784 (Swissmedic).
Dove è ottenibile Ilumetri? Quali confezioni sono disponibili?
In farmacia dietro presentazione della prescrizione medica.
Ilumetri è disponibile nelle confezioni da 1 siringa preriempita e nella confezione multipla con 2 scatole contenenti ciascuna 1 siringa preriempita (la confezione da 2 siringhe preriempite non è attualmente in commercio).
Titolare dell'omologazione
Almirall AG, 8304 Wallisellen.
Questo foglietto illustrativo è stato controllato l'ultima volta nel novembre 2018 dall'autorità competente in materia di medicamenti (Swissmedic).
ISTRUZIONI PER L'USO
Prima di usare la siringa preriempita
Importante a sapersi
- Prima di usare la siringa preriempita di Ilumetri legga per intero l'informazione destinata ai pazienti e le istruzioni per l'uso e segua tutte le istruzioni passo passo e con attenzione. Conservi con cura le istruzioni per l'uso, perché potrebbe averne nuovamente bisogno.
- La siringa preriempita NON deve essere agitata.
DESCRIZIONE DEL PRODOTTO
Struttura della siringa preriempita di Ilumetri:

PREPARAZIONE
1. Attenda 30 minuti dopo aver rimosso la siringa preriempita dal frigorifero
- Prima dell'iniezione, prenda dal frigorifero la confezione di cartone contenente la siringa preriempita di Ilumetri e la appoggi su una superficie di lavoro piana e pulita.
- Se la sua dose è di 200 mg, le servono due siringhe preriempite per ogni somministrazione. Pertanto, prenda dal frigorifero 2 siringhe preriempite.
- Lasci la siringa preriempita per 30 minuti nella confezione (con il coperchio chiuso), in modo che raggiunga la temperatura ambiente.
2. Verifichi il medicamento
- Quando è pronto per l'iniezione, estragga la siringa preriempita dalla confezione.
- Verifichi la data di scadenza sulla confezione e sulla siringa preriempita; se la data di scadenza è già trascorsa, getti via il medicamento.
- Se il medicamento è stato conservato a temperatura ambiente, verifichi la data di smaltimento che ha annotato. Se questa è già trascorsa, getti via il medicamento.
- NON rimuova la copertura dell'ago finché non è pronto per l'iniezione.
- Prima dell'uso, verifichi che il medicamento non contenga particelle e non abbia un colore anomalo.
- NON usi il medicamento se la soluzione non è trasparente o leggermente opalescente, incolore o di colore giallo chiaro.
- NON usi il medicamento se il liquido contiene particelle visibili o se la siringa preriempita è danneggiata. Possono essere presenti delle bolle d'aria; non è necessario rimuoverle.

3. Prepari tutti gli oggetti di cui ha bisogno
- Disponga su una superficie di lavoro pulita e ben illuminata:
- tampone imbevuto d'alcool;
- batuffolo di cotone o tampone di garza;
- cerotto;
- un cestino dei rifiuti.
4. Si lavi le mani
- Si lavi accuratamente le mani con acqua e sapone.

5. Scelga il punto di iniezione
- Scelga un punto di iniezione in cui la pelle è intatta e facilmente accessibile, come l'addome, la coscia o il braccio (se l'iniezione viene somministrata da un'altra persona).
- Cambi il punto di somministrazione a ogni iniezione.
- NON somministrare l'iniezione in un'area di 5 cm attorno all'ombelico o in punti in cui la pelle è sensibile, congestionata, insolitamente rossa o indurita o in cui sono presenti lesioni psoriasiche.
- NON iniettare il medicamento direttamente in cicatrici, smagliature o vasi sanguigni.
- Se la sua dose è di 200 mg, e quindi sono necessarie due iniezioni, scelga un punto di somministrazione diverso per la seconda iniezione.
6. Pulisca il punto di iniezione
- Pulisca il punto di iniezione con un tampone imbevuto d'alcool e lasci asciugare la pelle.
- Non tocchi più il punto di iniezione prima della somministrazione.

L’INIEZIONE
Se la sua dose è di 200 mg, deve usare due siringhe preriempite per ogni somministrazione del medicamento.
7. Rimuova il cappuccio di protezione dell'ago
- Tenga fermo il corpo della siringa, rimuova la copertura dell'ago come illustrato nella figura e la getti via. Potrebbe notare 1 o 2 gocce di liquido. Questo è normale.
- In questa fase NON tocchi il pistone blu.
- NON usi il medicamento se la siringa preriempita o l'ago sono piegati.

8. Comprima la pelle del punto di iniezione e introduca l'ago
- Comprima delicatamente la pelle tra le dita.
- Introduca per intero l'ago nella pelle tenendolo in verticale, con un angolo di 90 gradi.
- NON appoggi il dito sul pistone mentre introduce l'ago nella pelle.
- Tenga ferma la siringa.


9. Inietti il medicamento
- Dopo aver introdotto l'ago, rilasci con cautela la pelle.
- Spinga lentamente verso il basso il pistone blu fino a quando si arresta. Questo attiva il meccanismo di sicurezza, che fa rientrare completamente l'ago nella siringa dopo l'iniezione.
- La dose è stata somministrata per intero quando il pistone blu non è più in grado di muoversi e non ci sono state fuoriuscite di liquido nel punto di iniezione.
- Deve essere somministrata tutta la soluzione iniettabile.

10. Smaltimento della siringa usata
- Estragga completamente l'ago dalla pelle prima di rilasciare il pistone blu.
- Dopo che il pistone blu è stato rilasciato, il blocco di sicurezza ritrae l'ago all'interno della protezione dell'ago.

- Smaltisca la siringa usata in un cestino dei rifiuti subito dopo l'uso e, nel caso in cui la dose sia da 200 mg, prima di usare la seconda siringa.
- Se nel punto di iniezione è presente del liquido residuo o un po' di sangue, lo pulisca con un batuffolo di cotone o un tampone di garza SENZA fare pressione sulla pelle. Non strofini il punto di iniezione. Se necessario, può applicare un cerotto sul punto di iniezione.
- Se la sua dose è di 200 mg, ripeta la procedura con la seconda siringa in un altro punto di iniezione.
Zusammensetzung
Wirkstoff: Tildrakizumab, aus gentechnisch veränderten Ovarialzellen des chinesischen Hamsters (CHO-Zellen) hergestellt.
Hilfsstoffe: L-Histidin, L-Histidinhydrochlorid-Monohydrat, Polysorbat 80, Saccharose, Wasser für Injektionszwecke q.s ad solutionem.
Galenische Form und Wirkstoffmenge pro Einheit
Injektionslösung zur subkutanen Verabreichung.
Jede Fertigspritze enthält 100 mg Tildrakizumab in 1 ml.
Indikationen/Anwendungsmöglichkeiten
Ilumetri ist für die Behandlung erwachsener Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis indiziert, die auf eine vorgängige konventionelle systemische Therapie und/oder PUVA unzureichend angesprochen haben oder bei denen eine Kontraindikation oder Unverträglichkeit gegenüber solchen Therapien besteht.
Dosierung/Anwendung
Die Anwendung von Ilumetri sollte unter der Anleitung und Aufsicht eines in der Diagnose und Behandlung der Psoriasis erfahrenen Arztes bzw. einer Ärztin erfolgen.
Der Nutzen bei Psoriatischer Arthritis ist nicht belegt.
Vor Beginn der Therapie muss der Arzt Folgendes sicherstellen: Der Patient hat verstanden, dass Ilumetri eine neuartige Therapie mit limitierter Erfahrung und unbekannten Langzeitrisiken darstellt. Wirksamkeit und Sicherheit von Ilumetri sind über einen Zeitraum von bis zu 2 Jahren belegt.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Dosierung
Die empfohlene Dosis von Ilumetri beträgt 100 mg als subkutane Injektion in den Wochen 0, 4 und danach alle 12 Wochen.
Bei Patienten mit hoher Krankheitslast oder/und Körpergewicht ≥90 kg können 200 mg eine höhere Wirksamkeit aufweisen (siehe «Eigenschaften/Wirkungen»).
Bei Patienten, die nach einer Behandlungsdauer von 28 Wochen kein Ansprechen zeigen, sollte ein Absetzen der Therapie erwogen werden. Bei Patienten mit anfänglich partiellem Ansprechen kann sich das Ansprechen bei Fortsetzung der Behandlung nach 28 Wochen verbessern.
Falls eine Dosis versäumt wird, ist diese so bald wie möglich nachzuholen. Danach ist die Dosierung zum regulären planmässigen Zeitpunkt wiederaufzunehmen.
Art der Anwendung
Ilumetri wird als subkutane Injektion verabreicht. Die Injektionsstellen sollten abgewechselt werden. Ilumetri soll nicht in schmerzempfindliche, blutunterlaufene, rote, harte, dicke, schuppige oder von Psoriasis betroffene Hautbereiche injiziert werden.
Nach einer sachgemässen Schulung zur subkutanen Injektionstechnik können sich Patienten Ilumetri selbst injizieren, wenn der behandelnde Arzt bzw. die behandelnde Ärztin dies für zweckmässig hält und die erforderliche ärztliche Überwachung gewährleistet ist. Die Patienten sollten angewiesen werden, die gesamte Menge an Ilumetri entsprechend den Hinweisen in der Packungsbeilage zu injizieren. Ausführliche Anwendungshinweise finden sich in der Packungsbeilage.
Spezielle Dosierungsanweisungen
Besondere Patientengruppen
Ältere Patienten (ab 65 Jahren)
Keine Dosisanpassung ist erforderlich (siehe «Pharmakokinetik»).
Nieren- oder Leberfunktionsstörungen
Ilumetri wurde bisher in diesen Patientengruppen nicht untersucht. Es können keine Dosisempfehlungen gegeben werden.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Ilumetri bei Kindern und Jugendlichen im Alter von unter 18 Jahren ist nicht untersucht. Es liegen keine Daten vor.
Kontraindikationen
Ilumetri darf nicht angewendet werden
- bei Überempfindlichkeit gegenüber dem Wirk- oder einem der Hilfsstoffe gemäss Zusammensetzung;
- bei klinisch relevanten aktiven Infektionen (z.B. bei aktiver Tuberkulose, siehe «Warnhinweise und Vorsichtsmassnahmen»).
Warnhinweise und Vorsichtsmassnahmen
Infektionen
Tildrakizumab kann das Risiko für Infektionen erhöhen. In klinischen Studien wurden in der 12-wöchigen Placebo-kontrollierten Phase 21,0% Infektionen unter Placebo gegenüber 20,9% / 20,7% unter Ilumetri 100 mg bzw. 200 mg beobachtet. Schwerwiegende Infektionen wurden in 0,3% unter Placebo gegenüber 0,2% / 0,3% unter Ilumetri 100 mg bzw. 200 mg beobachtet. Patienten mit aktiven Infektionen oder rezidivierenden Infektionen in der Anamnese wurden von den klinischen Studien ausgeschlossen (z.B. HCV-, HBV- und HIV-positive Patienten). Bei Patienten unter immunsuppressiver Therapie kann es zur Reaktivierung von latenten Infektionen kommen.
Bei Anwendung von Ilumetri bei Patienten mit einer chronischen Infektion oder einer rezidivierenden oder kürzlich aufgetretenen schweren Infektion in der Anamnese ist Vorsicht geboten.
Die Patienten sind anzuweisen, einen Arzt bzw. eine Ärztin aufzusuchen, wenn Anzeichen oder Symptome auftreten, die auf eine klinisch relevante oder akute Infektion hinweisen. Wenn ein Patient eine schwere Infektion entwickelt, sollte der Patient engmaschig überwacht und die Ilumetri-Therapie unterbrochen werden, bis die Infektion abgeklungen ist.
Tuberkulose
Ilumetri darf nicht angewendet werden bei Patienten mit einer aktiven Tuberkulose. Vor der Einleitung einer Behandlung mit Ilumetri sind die Patienten bezüglich einer Tuberkulose-Infektion zu beurteilen. Patienten, die Ilumetri erhalten, sollten während und nach der Behandlung auf Anzeichen und Symptome einer aktiven Tuberkulose überwacht werden. Eine Anti-Tuberkulose-Therapie soll vor der Einleitung einer Behandlung mit Ilumetri durchgeführt werden bei Patienten mit einer latenten oder aktiven Tuberkulose in der Anamnese, bei denen ein adäquater Behandlungsverlauf nicht bestätigt werden kann.
Malignome
In klinischen Studien zeigte die Behandlung mit Ilumetri kein erhöhtes Risiko für maligne Erkrankungen.
Psoriasis-Patienten, die zuvor eine UV-Therapie erhalten haben, sollten vor und während der Behandlung mit Ilumetri gründlich auf das Vorliegen von Hauttumoren untersucht werden.
Begleitende Therapie mit anderen systemischen Immunsuppressiva
Die Sicherheit und Wirksamkeit von Ilumetri in Kombination mit Immunsuppressiva, einschliesslich Biologika, oder Phototherapie sind nicht untersucht worden. Die Komedikation mit anderen systemischen Immunsuppressiva, einschliesslich Biologika, ist nicht zu empfehlen.
Überempfindlichkeit
Falls eine schwerwiegende Überempfindlichkeitsreaktion auftritt, muss die Anwendung von Ilumetri sofort beendet und eine geeignete Therapie eingeleitet werden.
Impfungen
Vor Beginn der Behandlung mit Ilumetri ist die Vervollständigung aller gemäss aktueller Impfrichtlinien angezeigter Immunisierungen zu erwägen. Lebendimpfstoffe sollen nicht gleichzeitig mit Ilumetri verabreicht werden. Es liegen keine Daten zur Impfantwort auf die Totimpfstoffe vor. Ein genügender zeitlicher Abstand zwischen Impfungen mit Lebendimpfstoffen und dem Beginn der Therapie gemäss aktuellen Impfrichtlinien ist einzuhalten. Sachdienliche Informationen zur Anwendung von immunsuppressiven Wirkstoffen können auch den jeweiligen Fachinformationen der Impfstoffe entnommen werden.
Interaktionen
Impfstoffe
Lebendimpfstoffe sollen nicht gleichzeitig mit Ilumetri verabreicht werden (siehe «Warnhinweise und Vorsichtsmassnahmen»). Es liegen keine Daten zur Impfantwort auf die Impfstoffe vor (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Interaktionen mit Cytochrom P450
Es ist nicht zu erwarten, dass Begleitmedikationen die Pharmakokinetik von Ilumetri beeinflussen, da Ilumetri durch allgemeine Proteinabbauprozesse ohne Beteiligung von Cytochrom-P450-Enzymen aus dem Körper ausgeschieden und nicht über renale oder hepatische Wege eliminiert wird.
Die Ergebnisse einer Arzneimittel-Interaktionsstudie bei Psoriasis-Patienten legen nahe, dass Tildrakizumab keine klinisch relevante Wirkung auf Cytochrom P450 (CYP) 1A2, CYP2C9, CYP2C19, CYP2D6 und CYP3A4 hat. Folglich beeinflusst Tildrakizumab die Pharmakokinetik von Begleitmedikationen, die durch ein CYP-Enzym metabolisiert werden, nicht.
Schwangerschaft/Stillzeit
Frauen im gebärfähigen Alter
Frauen im gebärfähigen Alter sollen während und für mindestens 17 Wochen nach der Behandlung eine zuverlässige Verhütungsmethode anwenden.
Schwangerschaft
Es gibt keine aussagekräftigen Daten über die Anwendung von Ilumetri bei Schwangeren. Tierexperimentelle Studien deuten nicht auf direkte oder indirekte schädliche Wirkungen in Bezug auf Reproduktionstoxizität hin (siehe «Präklinische Daten»). Als Vorsichtsmassnahme sollte die Anwendung von Ilumetri in der Schwangerschaft vermieden werden.
Stillzeit
Es ist nicht bekannt, ob Tildrakizumab in die Muttermilch übergeht. Die verfügbaren toxikologischen Daten bei Cynomolgus-Affen am postnatalen Tag 28 (PND 28) haben vernachlässigbare Ilumetri-Spiegel in der Milch gezeigt (siehe «Präklinische Daten»). Beim Menschen können während der ersten Tage nach der Geburt Antikörper mit der Muttermilch auf das Neugeborene übertragen werden. In dieser kurzen Zeit kann ein Risiko für das gestillte Kind nicht ausgeschlossen werden. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Ilumetri verzichtet werden soll/die Behandlung mit Illumetri zu unterbrechen ist. Dabei ist sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau zu berücksichtigen.
Fertilität
Die Wirkung von Ilumetri auf die Fertilität beim Menschen wurde nicht untersucht. Tierexperimentelle Studien zeigen keine Hinweise auf direkte oder indirekte schädliche Wirkungen in Bezug auf die Fertilität (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Drei placebokontrollierte Studien (eine Phase IIb- und zwei Phase III-Studien) wurden integriert, um die Sicherheit von Ilumetri im Vergleich zu Placebo zu bewerten. Insgesamt wurden 1'768 Patienten untersucht (705 Patienten mit 100 mg, 708 Patienten mit 200 mg und 355 Patienten mit Placebo). Insgesamt erhielten 1'994 Patienten Tildrakizumab: 1'556 Patienten (78,0%) wurden über mindestens 1 Jahr und 987 Patienten (49,5%) über 2 Jahre exponiert.
Die häufigsten unerwünschten Wirkungen sind Infektionen der oberen Atemwege, Kopfschmerzen, Gastroenteritis, Übelkeit, Diarrhoe, Schmerzen an der Injektionsstelle und Rückenschmerzen.
Die meisten unerwünschten Wirkungen wurden als mild eingestuft und keine unerwünschte Wirkung führte bei >1% der Patienten zum Abbruch der Behandlung. Für die Behandlung bestimmter unerwünschter Wirkungen siehe «Warnhinweise und Vorsichtsmassnahmen».
Tabellarische Auflistung der unerwünschten Wirkungen
Die unerwünschten Wirkungen aus klinischen Studien (Tabelle 1) sind nach MedDRA-Systemorganklassen aufgelistet. Innerhalb jeder Systemorganklasse werden die unerwünschten Wirkungen nach Häufigkeit angeordnet, beginnend mit den häufigsten. Innerhalb jeder Häufigkeitsgruppe werden die unerwünschten Wirkungen nach abnehmendem Schweregrad angeführt. Zusätzlich basiert die entsprechende Häufigkeitskategorie für jede unerwünschte Wirkung auf den folgenden Häufigkeitsdefinitionen: sehr häufig (≥1/10); häufig (≥1/100, <1/10); gelegentlich (≥1/1000, <1/100); selten (≥1/10'000, <1/1000); sehr selten (<1/10'000); nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Tabelle 1. Liste der unerwünschten Wirkungen
Systemorganklasse | Unerwünschte Wirkung | Häufigkeitskategorie | Häufigkeit | |
|---|---|---|---|---|
Ilumetri 200 mg | Ilumetri 100 mg | |||
Infektionen und parasitäre Erkrankungen | Infektionen der oberen Atemwege, einschliesslich Nasopharyngitis | Sehr häufig | 87 (12,3) | 91 (12,9) |
Erkrankungen des Nervensystems | Kopfschmerzen | Häufig | 30 (4,2) | 26 (3,7) |
Erkrankungen des Gastrointestinaltrakts | Gastroenteritis | Häufig | 13 (1,8) | 8 (1,1) |
Übelkeit | Häufig | 11 (1,6) | 7 (1,0) | |
Diarrhoe | Häufig | 10 (1,4) | 13 (1,8) | |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | Schmerzen an der Injektionsstelle | Häufig | 9 (1,3) | 10 (1,4) |
Rückenschmerzen | Häufig | 12 (1,7) | 9 (1,3) | |
Beschreibung ausgewählter unerwünschter Wirkungen
Immunogenität
In den klinischen Phase-II- und Phase-III-Studien zur Psoriasis entwickelten 7,3% der mit Ilumetri behandelten Patienten Antikörper gegen Ilumetri. Es wurde kein erkennbarer Zusammenhang zwischen der Entwicklung von Antikörpern gegen Ilumetri und einer Verringerung der Wirksamkeit bzw. dem Auftreten von behandlungsbedingten unerwünschten Ereignissen festgestellt.
Überdosierung
Intravenöse Dosen bis zu 10 mg/kg wurden in klinischen Studien sicher verabreicht.
Im Falle einer Überdosierung wird empfohlen, den Patienten auf Anzeichen oder Symptome von unerwünschten Wirkungen zu überwachen und umgehend eine entsprechende symptomatische Behandlung einzuleiten.
Eigenschaften/Wirkungen
ATC-Code: L04AC17
Wirkungsmechanismus/Pharmakodynamik
Tildrakizumab ist ein humanisierter monoklonaler IgG1/κ-Antikörper, der spezifisch an die p19-Proteinuntereinheit des Zytokins Interleukin 23 (IL-23) bindet und dessen Wechselwirkung mit dem IL-23-Rezeptor hemmt.
IL-23 ist ein natürlich vorkommendes Zytokin, das an Entzündungs- und Immunantworten beteiligt ist. Tildrakizumab hemmt die Freisetzung von proinflammatorischen Zytokinen und Chemokinen. In in-vitro-Modellen wurde gezeigt, dass Tildrakizumab IL-23-vermittelte Signal- und Zytokinkaskaden durch Unterbrechung der Interaktion der IL-23-Bindung an seinen spezifischen Rezeptor, IL-23R, unterbindet, ohne an IL-12 zu binden.
Die Expression von IL-23p19 mRNA ist bei psoriatischen Läsionen im Vergleich zu normaler Haut erhöht.
In explorativen Studien an Patienten mit Psoriasis waren entzündliche Infiltrate in läsionalen Gewebebiopsien nach Verabreichung von Ilumetri vermindert. Die IL-23p19 Expression in Läsionshautbiopsien hat bis zu zwei Wochen nach Therapie im Vergleich zu Baseline abgenommen. Genexpressionsmuster weisen auf eine Abschwächung der lokalen Entzündungsreaktion hin.
Klinische Wirksamkeit
In die multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studien reSURFACE 1 und reSURFACE 2 wurden insgesamt 1'862 Patienten im Alter ab 18 Jahren mit Plaque-Psoriasis mit einer Körperoberflächenbeteiligung von mindestens 10% eingeschlossen, die einen Physician Global Assessment (PGA)-Score von ≥3 in der Gesamtbewertung von Psoriasis (Dicke der Plaques, Erythem und Schuppung) auf einer Schweregradskala von 0 bis 5 und einen Psoriasis-Area-and-Severity-Index (PASI)-Score von ≥12 aufwiesen und Kandidaten für eine Phototherapie oder systemische Arzneimitteltherapie waren.
In diesen Studien wurden die Patienten entweder zu Placebo oder zu Ilumetri randomisiert (einschliesslich 200 mg und 100 mg in Wochen 0, 4 und danach alle 12 Wochen [Q12W]) bis zu Woche 64 (reSURFACE 1) oder 52 (reSURFACE 2). In der aktiven Vergleichsstudie (reSURFACE 2) wurden die Patienten ebenfalls randomisiert und erhielten in einem zusätzlichen Studienarm 50 mg Etanercept 12 Wochen lang zweimal wöchentlich und danach einmal wöchentlich bis zu Woche 28.
Die demografischen und Baseline-Charakteristika in den Studien reSURFACE 1 und reSURFACE 2 waren in den einzelnen Studien konsistent. Insgesamt waren die Patienten 18 bis 82 Jahre alt, mit einem Durchschnittsalter von 45,9 Jahren. Der mediane Baseline-PASI-Score lag zwischen 17,7 und 18,4 in allen Behandlungsgruppen. Der Baseline-PGA-Score war bei 33,4% der Patienten «ausgeprägt» oder «schwerwiegend» (Score ≥4). Zur Behandlung der Psoriasis hatten zuvor 35,8% aller Patienten eine Phototherapie erhalten, 41,1% eine konventionelle systemische Arzneimitteltherapie und 16,7% eine Biologika-Therapie (insgesamt hatten 55,7% eine Phototherapie oder systemische Therapie erhalten). Insgesamt hatten 15,4% der Studienpatienten eine Vorgeschichte von Psoriasis-Arthritis. Der Baseline-DLQI (Dermatology Life Quality Index) reichte von 13,0 bis 14,8.
Die Studien reSURFACE 1 und reSURFACE 2 bewerteten die Veränderungen gegenüber Baseline in Woche 12 der beiden co-primären Endpunkte: 1) PASI-75 und 2) PGA von «0» (erscheinungsfrei) oder «1» (minimal), mit mindestens 2-Punkt-Verbesserung gegenüber Baseline. Weitere bewertete Ergebnisse umfassten den Anteil der Patienten, die PASI 90 und PASI 100 erreichten, den Anteil der Patienten mit DLQI 0 oder 1 und die Aufrechterhaltung der Wirksamkeit bis zu 64/52 Wochen.
Die Ergebnisse in den Wochen 12, 28 und bis Woche 64 (in reSURFACE 1) und bis Woche 52 (in reSURFACE 2) sind in Tabelle 2 bzw. in Tabelle 3 aufgeführt.
Tabelle 2. Zusammenfassung der Ansprechraten in den Studien reSURFACE 1 und reSURFACE 2
Woche 12 | Woche 28 | ||||||
|---|---|---|---|---|---|---|---|
200 mg | 100 mg | Placebo | Etanercept | 200 mg | 100 mg | Etanercept | |
reSURFACE1 | |||||||
Anzahl Patienten | 308 | 309 | 154 | - | 298 | 299 | - |
PASI 75a (%) | 62,3†b | 63,8†b | 5,8b | - | 81,9c | 80,4c | - |
PGA: «erscheinungsfrei» oder «minimal» mit einer Verbesserung um ≥2 Punkte gegenüber Baselinea (%) | 59,1†b | 57,9†b | 7,1b | - | 69,1c | 66,0c | - |
PASI 90 (%) | 35,4†b | 34,6†b | 2,6b | - | 59,0c | 51,6c | - |
PASI 100 (%) | 14,0†b | 13,9†b | 1,3b | - | 31,5c | 23,5c | - |
DLQI-Score 0 oder 1 (%) | 44,2† | 41,5† | 5,3 | - | 56,7c | 52,4c | - |
reSURFACE2 | |||||||
Anzahl Patienten | 314 | 307 | 156 | 313 | 299 | 294 | 289 |
PASI 75a (%) | 65,6†‡b | 61,2†‡b | 5,8b | 48,2b | 72,6‡b | 73,5‡b | 53,6b |
PGA: «erscheinungsfrei» oder «minimal» mit einer Verbesserung um ≥2 Punkte gegenüber Baselinea (%) | 59,2†¥b | 54,7†b | 4,5b | 47,6b | 69,2‡b | 64,6‡b | 45,3b |
PASI 90 (%) | 36,6†‡b | 38,8†‡b | 1,3b | 21,4b | 57,7‡c | 55,5‡c | 29,4c |
PASI 100 (%) | 11,8†‡b | 12,4†‡b | 0 | 4,8b | 27,0‡c | 22,8‡c | 10,7c |
DLQI Score 0 oder 1 (%) | 47,4†¥ | 40,2† | 8,0 | 35,5 | 65,0‡c | 54,1‡c | 39,4c |
a Co-primärer Wirksamkeitsendpunkt in Woche 12.
b Imputation als Non-Responder für fehlende Daten
c Keine Imputation für fehlende Daten
n = Anzahl der Patienten im vollständigen Analyse-Set, für die Daten verfügbar waren, nach Imputation, falls zutreffend.
p-Werte, berechnet mittels Cochran-Mantel-Haenszel (CMH)-Test, stratifiziert nach Körpergewicht (≤90 kg, >90 kg) und vorheriger biologischer Psoriasis-Therapie (ja / nein)
† p ≤0,001 versus Placebo; ‡ p ≤0,001 versus Etanercept; ¥ p ≤0,05 versus Etanercept.
Aufrechterhaltung des Ansprechens
Die Aufrechterhaltung des Ansprechens in den Studien reSURFACE 1 und reSURFACE 2 ist in Tabelle 3 dargestellt.
Tabelle 3. Aufrechterhaltung des Ansprechens in den Studien reSURFACE 1 und reSURFACE 2
Langzeit-Ansprechenab | ||
|---|---|---|
200 mg | 100 mg | |
reSURFACE 1 | Woche 64 | |
Anzahl Patienten | 114 | 112 |
PASI 75, n (%) | 107 (93,9) | 98 (87,5) |
PGA: «erscheinungsfrei» oder «minimal» mit einer Verbesserung um ≥2 Punkte gegenüber Baseline, n (%) | 87 (76,3) | 69 (61,6) |
PASI 90, n (%) | 85 (74,6) | 65 (58,0) |
PASI 100, n (%) | 46 (40,4) | 36 (32,1) |
DLQI-Score 0 oder 1, n (%) | 78 (68,4) | 59 (52,2) |
reSURFACE 2 | Woche 52 | |
Anzahl Patienten | 105 | 204 |
PASI 75, n (%) | 102 (97,1) | 191 (93,6) |
PGA: «erscheinungsfrei» oder «minimal» mit einer Verbesserung um ≥2 Punkte gegenüber Baseline, n (%) | 89 (84,8) | 162 (79,4) |
PASI 90, n (%) | 86 (81,9) | 160 (78,4) |
PASI 100, n (%) | 49 (46,7) | 72 (35,3) |
DLQI-Score 0 oder 1, n (%) | 76 (72,4) | 141 (68,8) |
a Langzeit-Ansprechen bei Patienten, die Responder (haben mindestens PASI 75 erreicht) in Woche 28 waren.
b Keine Imputation für fehlende Daten
n = Anzahl der Patienten im vollständigen Analyse-Set, für die Daten verfügbar waren
Lebensqualität/Patientenberichtete Ergebnisse
In verschiedenen Studien war Ilumetri in Woche 12 mit einer statistisch signifikanten Verbesserung der gesundheitsbezogenen Lebensqualität assoziiert, die durch den DLQI (Dermatology Life Quality Index) (Tabelle 2) ermittelt wurde. Die Verbesserungen blieben über die Zeit erhalten (Tabelle 3). In der 52. Woche hatten 63,7% (100 mg) und 73,3% (200 mg) in reSURFACE 1, bzw. 68,8% (100 mg) und 72,4% (200 mg) in reSURFACE 2 der Patienten, die in Woche 28 PASI 75-Responder waren, einen DLQI von 0 oder 1.
Fortsetzung der Behandlung bei partiellen Respondern
Von den zu Ilumetri 100 mg randomisierten Patienten, die in Woche 28 (3 Dosen) nicht PASI 75, aber mindestens PASI 50 erreichten, erzielten bei Fortführung der Therapie mit 100 mg bis zu 58.8% (reSURFACE1) und 68.4% (reSURFACE2) in Woche 52 ein PASI 75-Ansprechen (3 zusätzliche Dosen).
Wirksamkeit in Subgruppen
Höheres Körpergewicht
Bei Patienten mit einem Gewicht von über 90 kg waren die klinische Ansprechrate und die gesundheitsbezogene Lebensqualität nach 28 Wochen Behandlung mit 200 mg Tildrakizumab vergleichbar mit denen bei Patienten mit geringerem Körpergewicht, die mit 100 mg Tildrakizumab behandelt wurden.
In Woche 52 wurde die Ansprechrate auf Tildrakizumab von Patienten mit höherem Körpergewicht, die kontinuierlich mit 200 mg Tildrakizumab behandelt wurden, besser aufrechterhalten als die unter 100 mg Tildrakizumab: PASI 75 von 92,1 vs. 80,6%, PASI 90 von 72,7 vs. 61,9%, PASI 100 von 44,3 vs. 25,4%, PGA 0/1 von 76,1 vs. 64,2%, DLQI 0/1 von 77,3 vs. 50,8%.
Höhere Krankheitslast
Bei Patienten, bei denen eine höhere Krankheitslast festgestellt wurde, waren die Ansprechraten, die in Woche 28 mit der 200 mg Tildrakizumab-Behandlung erreicht wurden, nummerisch höher als mit der 100 mg Tildrakizumab-Behandlung.
- Bei Patienten mit einem Baseline-PASI-Score von 20 und mehr: PASI 75 von 75,3 vs. 70,4%, PASI 90 von 57,7 vs. 46,9%, PASI 100 von 28,6 vs. 15,5% und PGA 0/1 von 66,5 vs. 55,3%.
- Bei Patienten mit einer Baseline-BSA von 30% und mehr: PASI 75 von 75,3 vs. 72,4%, PASI 90 von 55,6 vs. 49,6%, PASI 100 von 27,4 vs. 17,7% und PGA0/1 von 66,8 vs. 59,1%.
Pharmakokinetik
Absorption
Die subkutane Formulierung von Tildrakizumab hat eine absolute Bioverfügbarkeit im Bereich von 73% (90% KI: 46-115%, 200 mg s.c. versus 3 mg/kg i.v.) bis 80% (90% KI: 62-103%, 50 mg s.c. versus 0,5 mg/kg i.v.) als Ergebnis einer cross-over Einzeldosis-Vergleichsstudie bei gesunden Erwachsenen. Die maximale Konzentration wurde 6,2 Tage nach der Injektion erreicht. Populations-PK-Analysen zeigten eine 31% höhere Bioverfügbarkeit bei gesunden Erwachsenen als bei Patienten.
Der Steady-State wird mit dem klinischen Behandlungsschema – Wochen 0 und 4 sowie danach alle 12 Wochen – nach 16 Wochen erreicht, wobei es zwischen Woche 1 und Woche 12 zu einer 1,1-fachen dosisunabhängigen Akkumulation der Exposition kommt.
Im Steady-State nach Gabe von 100 mg Tildrakizumab an Patienten mit mittelschwerer bis schwerer Psoriasis betrugen die geometrischen Mittel (%CV) der AUC0-τ- bzw. Cmax-Werte 305 µg*Tag/ml (41%) bzw. 8,1 µg/ml (34%), wohingegen sie nach Gabe von 200 mg bei 612 μg*Tag/ml (40%) bzw. 16,3 μg/ml (33%) lagen.
Distribution
Tildrakizumab hat eine begrenzte extravaskuläre Verteilung mit Vd-Werten von 76,9 bis 106 ml/kg.
Metabolismus
Tildrakizumab wird durch allgemeine Proteinabbauprozesse in Aminosäurekomponenten katabolisiert. Kleinmolekulare Stoffwechselwege (z.B. Cytochrom-P450-Enzyme (CYPs), Glucuronosyltransferasen) tragen nicht zu dessen Clearance bei.
Elimination
Die Tildrakizumab Clearance-Werte lagen im Bereich zwischen 2,04 und 2,52 ml/Tag/kg und die Halbwertszeit bei 23,4 Tagen (23%CV).
Linearität/Nicht-Linearität
Nach subkutaner Verabreichung zeigte Tildrakizumab bei Patienten mit Plaque-Psoriasis eine Dosis-proportionale Pharmakokinetik im Dosisbereich von 50 mg bis 400 mg.
Körpergewicht
Populationsbezogene pharmakokinetische Modelle zeigten, dass mit zunehmendem Körpergewicht die Exposition abnahm. Bei erwachsenen Patienten mit einem Körpergewicht von >90 kg war das vorausgesagte geometrische Mittel der Exposition (AUC0-τ im Steady-State) nach einer 100 mg oder 200 mg s.c.-Dosis etwa 30% niedriger als bei erwachsenen Patienten mit einem Körpergewicht von ≤90 kg (siehe «Dosierung/Anwendung»).
Pharmakokinetik in besonderen Patientengruppen
Ältere Patienten
Eine populations-pharmakokinetische Analyse zeigte, dass das Alter keinen klinisch signifikanten Einfluss auf die Clearance von Tildrakizumab bei erwachsenen Patienten mit Plaque-Psoriasis hat. Patienten, die 65 Jahre alt oder älter sind, hatten eine ähnliche Tildrakizumab-Clearance im Vergleich zu Patienten unter 65 Jahren.
Patienten mit eingeschränkter Nieren- oder Leberfunktion
Es wurden keine spezifischen Studien zur Untersuchung der Auswirkungen einer Nieren- oder Leberfunktionseinschränkung auf die Pharmakokinetik von Tildrakizumab durchgeführt.
Präklinische Daten
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie und Toxizität bei wiederholter Gabe lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Nach wiederholter Gabe von Tildrakizumab an Cynomolgus-Affen, die alle 2 Wochen bis zu 9 Monaten mit der NOAEL als höchster verabreichter Dosis (140 mg/kg [i.v. und s.c.] in der 3-Monatsstudie oder 100 mg/kg [s.c.] in der 9-Monatsstudie) behandelt wurden, ergaben sich keine toxikologischen Befunde (einschliesslich Untersuchung der Reproduktionsorgane, hormonelle Wirkungen [Östradiol und Progesteron], oder kardiovaskuläre, respiratorische oder ZNS-Funktionen).
Tierexperimentelle Kanzerogenitätsstudien wurden mit Tildrakizumab nicht durchgeführt. Studien an Maus-Tumormodellen zeigten, dass die selektive Hemmung von IL-23p19 das kanzerogene Risiko nicht erhöht.
Bei Cynomolgus-Affen trat eine vernachlässigbare Sekretion des Produkts in die Muttermilch auf. Einen Monat nach der Geburt betrug das Milch/Serum-Verhältnis ≤0,002. Es wurde gezeigt, dass Tildrakizumab sich über die Plazentaschranke verteilt. Nach wiederholter Gabe an trächtige Cynomolgus-Affen waren die Serumkonzentrationen im Fötus quantifizierbar, jedoch zeigten die Studien zur Reproduktionstoxizität keine ungünstigen Effekte.
Bei männlichen und weiblichen Cynomolgus-Affen, denen Tildrakizumab in Dosierungen verabreicht wurde, die bei der empfohlenen klinischen Dosis, bezogen auf die AUC, mehr als das 100-fache der menschlichen Exposition betrugen, wurden keine Auswirkungen auf Fertilitätsparameter wie Fortpflanzungsorgane, Menstruationszykluslänge und/oder Hormone beobachtet.
In einer prä- und postnatalen Entwicklungstoxizitätsstudie an Affen wurde bei einer maternalen Exposition, die bei der empfohlenen Dosis das 85-fache der Exposition des Menschen betrug, kein Anstieg von Trächtigkeitsverlusten beobachtet. Bei Neugeborenen wurden bei maternalen Expositionen, die bei der empfohlenen Dosis das 9-fache der Exposition des Menschen aufwiesen, keine schädlichen Wirkungen beobachtet. Zwei neonatale Todesfälle bei Affen, denen Tildrakizumab bei einer maternalen Exposition verabreicht wurde, die der 85-fachen Exposition des Menschen bei der empfohlenen Dosis entsprach, wurden einer möglichen Virusinfektion zugeschrieben, wobei der Zusammenhang mit der Behandlung als unsicher angesehen wurde. Die klinische Bedeutung dieser Befunde ist unbekannt.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit EXP bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Ausser Reichweite von Kindern aufbewahren.
Im Kühlschrank (2-8 °C) lagern. Nicht einfrieren.
Ilumetri kann einmalig über einen Zeitraum von maximal 30 Tagen im Umkarton bei Raumtemperatur (15-25 °C) gelagert werden. Wenn Ilumetri aus dem Kühlschrank entnommen wurde und Raumtemperatur (15-25 °C) erreicht hat, muss es entweder innerhalb von 30 Tagen angewendet oder weggeworfen werden, auch wenn es in den Kühlschrank zurückgelegt wird.
Die Fertigspritzen bis zur Anwendung im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Hinweise für die Handhabung
Ilumetri ist eine sterile Injektionslösung in einer Fertigspritze. Die Fertigspritzen sind nur für den einmaligen Gebrauch bestimmt.
Die Fertigspritze sollte 30 Minuten vor der Injektion aus dem Kühlschrank genommen werden, damit sie Raumtemperatur annimmt.
Die Fertigspritze nicht schütteln.
Vor der Anwendung wird empfohlen, die Fertigspritze visuell zu prüfen. Die Flüssigkeit sollte klar sein. Ihre Farbe kann farblos bis leicht gelb sein. Es könnten Luftbläschen zu sehen sein, was normal ist. Nicht verwenden, wenn die Flüssigkeit deutlich sichtbare Partikel enthält, trübe erscheint oder eine eindeutig braune Färbung aufweist.
Die Hinweise zur Verwendung der Fertigspritzen, die in der Packungsbeilage enthalten sind, müssen sorgfältig befolgt werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Zulassungsnummer
66784 (Swissmedic).
Zulassungsinhaberin
Almirall AG, 8304 Wallisellen.
Stand der Information
November 2018.
Composizione
Principio attivo: tildrakizumab, prodotto da cellule ovariche di criceto cinese geneticamente modificate (cellule CHO).
Eccipienti: L-istidina, L-istidina cloridrato monoidrato, polisorbato 80, saccarosio, acqua per preparazioni iniettabili q.s ad solutionem.
Forma farmaceutica e quantità di principio attivo per unità
Soluzione iniettabile per somministrazione sottocutanea.
Ciascuna siringa preriempita contiene 100 mg di tildrakizumab in 1 ml.
Indicazioni/Possibilità d'impiego
Ilumetri è indicato per il trattamento di pazienti adulti affetti da psoriasi a placche da moderata a grave che non hanno risposto in maniera sufficiente a una precedente terapia sistemica convenzionale e/o PUVA o che presentano una controindicazione o un'intolleranza per tali terapie.
Posologia/Impiego
Ilumetri deve essere utilizzato sotto la guida e la supervisione di un medico esperto nella diagnosi e nel trattamento della psoriasi.
L'utilità nell'artrite psoriasica non è stata dimostrata.
Prima dell'inizio della terapia il medico deve accertarsi che il paziente abbia compreso che Ilumetri rappresenta un nuovo tipo di terapia, per la quale sono disponibili esperienze limitate e di cui non sono noti i rischi a lungo termine. L'efficacia e la sicurezza di Ilumetri sono state dimostrate per trattamenti di durata fino a 2 anni.
Per garantire la tracciabilità dei medicamenti biotecnologici, si raccomanda di prendere nota del nome commerciale e del numero di lotto in occasione di ogni trattamento.
Posologia
La dose consigliata di Ilumetri è di 100 mg sotto forma di iniezione sottocutanea nelle settimane 0 e 4 e poi ogni 12 settimane.
Nei pazienti con un elevato carico di malattia e/o con un peso corporeo ≥ 90 kg una dose di 200 mg può dimostrarsi più efficace (cfr. «Proprietà/Effetti»).
Nei pazienti che non mostrano una risposta dopo 28 settimane di trattamento si dovrebbe prendere in considerazione un'interruzione della terapia. Nei pazienti che presentano inizialmente una risposta parziale, la risposta può migliorare continuando il trattamento dopo la 28a settimana.
Se si dimentica una dose, bisogna recuperarla il prima possibile. Quindi si deve riprendere regolarmente il trattamento con la successiva dose programmata.
Modo di somministrazione
Ilumetri viene somministrato mediante iniezione sottocutanea. I siti di iniezione dovrebbero essere alternati. Ilumetri non deve essere iniettato in aree cutanee sensibili, congestionate, arrossate, indurite, ispessite, squamose o affette da psoriasi.
Dopo un'adeguata formazione alla tecnica di iniezione sottocutanea i pazienti possono iniettarsi da soli Ilumetri, se il medico curante lo ritiene opportuno e se viene garantito il necessario monitoraggio medico. I pazienti devono essere istruiti a iniettare l'intero contenuto di Ilumetri seguendo le istruzioni presenti nel foglietto illustrativo. Il foglietto illustrativo contiene istruzioni per l'uso dettagliate.
Istruzioni posologiche speciali
Particolari gruppi di pazienti
Pazienti anziani (a partire da 65 anni)
Non è necessario alcun aggiustamento della dose (cfr. «Farmacocinetica»).
Disturbi della funzionalità renale o epatica
Ilumetri finora non è stato studiato in questi gruppi di pazienti. Non è possibile fornire raccomandazioni posologiche.
Bambini e adolescenti
La sicurezza e l'efficacia di Ilumetri nei bambini e negli adolescenti sotto i 18 anni di età non sono state studiate. Non sono disponibili dati in merito.
Controindicazioni
Ilumetri non deve essere utilizzato:
- in caso di ipersensibilità al principio attivo o a una qualsiasi degli eccipienti secondo la composizione;
- in caso di infezioni attive clinicamente rilevanti (p. es. tubercolosi in fase attiva, cfr. «Avvertenze e misure precauzionali»).
Avvertenze e misure precauzionali
Infezioni
Tildrakizumab può aumentare il rischio di infezioni. Negli studi clinici, nella fase controllata con placebo di 12 settimane è stato osservato il 21,0% di infezioni con il placebo contro il 20,9%/20,7% rispettivamente con Ilumetri 100 mg e 200 mg. Sono state osservate infezioni gravi nello 0,3% dei pazienti trattati con placebo e nello 0,2%/0,3% dei pazienti trattati rispettivamente con Ilumetri 100 mg e 200 mg. I pazienti con anamnesi di infezioni attive o infezioni recidivanti sono stati esclusi dagli studi clinici (p. es. pazienti positivi per HCV, HBV e HIV). Nei pazienti in terapia immunosoppressiva si può avere una riattivazione delle infezioni latenti.
Si raccomanda prudenza in caso di impiego di Ilumetri in pazienti con un'infezione cronica o una grave infezione recidivante o di recente insorgenza all'anamnesi.
I pazienti devono essere istruiti a rivolgersi a un medico quando insorgono segni o sintomi che indicano un'infezione acuta o clinicamente rilevante. Quando un paziente sviluppa un'infezione grave deve essere attentamente monitorato e la terapia con Ilumetri deve essere sospesa fino alla guarigione dell'infezione.
Tubercolosi
Ilumetri non deve essere utilizzato nei pazienti con tubercolosi in fase attiva. Prima dell'inizio del trattamento con Ilumetri i pazienti devono essere esaminati per escludere un'infezione tubercolare. I pazienti trattati con Ilumetri dovrebbero essere monitorati durante e dopo il trattamento per identificare eventuali segni e sintomi di una tubercolosi in fase attiva. Nei pazienti con anamnesi di tubercolosi latente o attiva in cui non può essere confermato un andamento adeguato della terapia, prima dell'inizio del trattamento con Ilumetri deve essere somministrata una terapia antitubercolare.
Neoplasie maligne
Negli studi clinici il trattamento con Ilumetri non ha determinato un aumento del rischio di patologie maligne.
I pazienti psoriasici precedentemente sottoposti a fototerapia devono essere esaminati accuratamente prima e durante il trattamento con Ilumetri per escludere la presenza di tumori cutanei.
Terapia concomitante con altri immunosoppressori sistemici
La sicurezza e l'efficacia di Ilumetri in combinazione con immunosoppressori, inclusi i biologici, o fototerapia non sono ancora state esaminate. L'associazione con altri immunosoppressori sistemici, inclusi i biologici, è sconsigliata.
Ipersensibilità
Se insorge una grave reazione di ipersensibilità si deve interrompere immediatamente l'impiego di Ilumetri e avviare una terapia appropriata.
Vaccinazioni
Prima dell'inizio del trattamento con Ilumetri si dovrebbe prendere in considerazione il completamento di tutte le immunizzazioni raccomandate sulla base delle attuali linee guida sui vaccini. I vaccini vivi non devono essere somministrati in concomitanza con Ilumetri. Non sono disponibili dati sulla risposta vaccinale ai vaccini inattivati. Bisogna mantenere un intervallo di tempo adeguato tra la vaccinazione con vaccini vivi e l'inizio della terapia sulla base delle attuali linee guida sui vaccini. Per informazioni utili sull'uso di principi attivi immunosoppressori consultare anche le rispettive informazioni professionali dei vaccini.
Interazioni
Vaccini
In concomitanza con Ilumetri non devono essere somministrati vaccini vivi (cfr. «Avvertenze e misure precauzionali»). Non sono disponibili dati sulla risposta vaccinale ai vaccini (cfr. «Avvertenze e misure precauzionali»).
Interazioni con il citocromo P450
Non si prevede un'influenza da parte di medicamenti concomitanti sulla farmacocinetica di Ilumetri, visto che Ilumetri viene eliminato dall'organismo mediante processi generali di degradazione proteica, senza il coinvolgimento di enzimi del citocromo P450, e non viene eliminato per via renale o epatica.
I risultati di uno studio di interazione tra medicamenti in pazienti psoriasici indicano che tildrakizumab non ha effetti clinicamente rilevanti sugli enzimi citocromo P450 (CYP) 1A2, CYP2C9, CYP2C19, CYP2D6 e CYP3A4. Di conseguenza, tildrakizumab non influenza la farmacocinetica dei medicamenti concomitanti metabolizzati tramite enzimi CYP.
Gravidanza/Allattamento
Donne in età fertile
Le donne in età fertile devono usare un metodo contraccettivo affidabile durante e per almeno 17 settimane dopo il trattamento.
Gravidanza
Non sono disponibili dati significativi sull'uso di Ilumetri nelle donne in gravidanza. Gli studi sperimentali sugli animali non indicano effetti nocivi diretti o indiretti correlati a una tossicità per la riproduzione (cfr. «Dati preclinici»). A titolo precauzionale, si dovrebbe evitare l'uso di Ilumetri durante la gravidanza.
Allattamento
Non è noto se tildrakizumab passi nel latte materno. I dati tossicologici disponibili nelle scimmie cynomolgus hanno evidenziato quantità trascurabili di Ilumetri nel latte nel giorno 28 dopo la nascita (PND 28) (cfr. «Dati preclinici»). Negli esseri umani, nei primi giorni dopo la nascita gli anticorpi possono essere trasmessi al neonato attraverso il latte materno. In questo breve intervallo di tempo non si può escludere un rischio per il lattante. Bisogna decidere se interrompere l'allattamento oppure rinunciare al trattamento con Ilumetri/interrompere il trattamento con Ilumetri, tenendo conto sia dei benefici dell'allattamento per il bambino sia dei benefici della terapia per la madre.
Fertilità
Gli effetti di Ilumetri sulla fertilità negli esseri umani non sono stati esaminati. Gli studi sperimentali sugli animali non hanno rilevato segni di effetti nocivi diretti o indiretti sulla fertilità (cfr. «Dati preclinici»).
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Non sono stati effettuati studi in merito.
Effetti indesiderati
Riassunto del profilo di sicurezza
Tre studi controllati con placebo (uno di fase IIb e due di fase III) sono stati integrati per valutare la sicurezza di Ilumetri rispetto al placebo. Complessivamente sono stati esaminati 1'768 pazienti (705 trattati con 100 mg, 708 con 200 mg e 355 con il placebo). In totale, hanno ricevuto tildrakizumab 1'994 pazienti: 1'556 pazienti (78,0%) sono stati esposti per almeno 1 anno e 987 pazienti (49,5%) per 2 anni.
Gli effetti indesiderati più comuni sono stati: infezioni delle vie respiratorie superiori, cefalea, gastroenterite, nausea, diarrea, dolore nel sito d'iniezione e dolori alla schiena.
La maggior parte degli effetti indesiderati è stata classificata come lieve e nessuno degli effetti indesiderati ha portato a un'interruzione del trattamento in >1% dei pazienti. Per il trattamento di specifici effetti indesiderati vedere «Avvertenze e misure precauzionali».
Tabella degli effetti indesiderati
Gli effetti indesiderati osservati negli studi clinici (tabella 1) sono elencati per classe sistemico-organica MedDRA. All'interno di ogni classe sistemico-organica gli effetti indesiderati sono elencati in ordine di frequenza, a partire dal più comune. All'intero di ogni gruppo di frequenza, gli effetti indesiderati sono riportati in ordine di gravità decrescente. Inoltre, la categoria di frequenza di ciascun effetto indesiderato si basa sulle seguenti definizioni di frequenza: molto comune (≥1/10); comune (≥1/100, <1/10); non comune (≥1/1000, <1/100); raro (≥1/10'000, <1/1000); molto raro (<1/10'000); frequenza non nota (non è possibile stimare la frequenza sulla base dei dati disponibili).
Tabella 1. Elenco degli effetti indesiderati
Classe sistemico-organica
| Effetto indesiderato
| Categoria di frequenza
| Frequenza | |
|---|---|---|---|---|
Ilumetri 200 mg | Ilumetri 100 mg | |||
Infezioni ed infestazioni | Infezioni delle vie respiratorie superiori, inclusa rinofaringite | Molto comune | 87 (12,3) | 91 (12,9) |
Patologie del sistema nervoso | Cefalea | Comune | 30 (4,2) | 26 (3,7) |
Patologie gastrointestinali | Gastroenterite | Comune | 13 (1,8) | 8 (1,1) |
Nausea | Comune | 11 (1,6) | 7 (1,0) | |
Diarrea | Comune | 10 (1,4) | 13 (1,8) | |
Patologie sistemiche e condizioni relative alla sede di somministrazione | Dolore nel sito d'iniezione | Comune | 9 (1,3) | 10 (1,4) |
Dolori alla schiena | Comune | 12 (1,7) | 9 (1,3) | |
Descrizione di alcuni effetti indesiderati
Immunogenicità
Negli studi clinici di fase II e di fase III sulla psoriasi il 7,3% dei pazienti trattati con Ilumetri ha sviluppato anticorpi anti-Ilumetri. Non è stata riscontrata alcuna associazione identificabile tra lo sviluppo di anticorpi anti-Ilumetri e una riduzione dell'efficacia del trattamento o l'insorgenza di eventi indesiderati correlati al trattamento.
Sovradosaggio
Negli studi clinici sono state somministrate senza problemi di sicurezza dosi endovenose fino a 10 mg/kg.
In caso di sovradosaggio si raccomanda di monitorare i pazienti per identificare eventuali segni o sintomi di effetti indesiderati e di avviare immediatamente un opportuno trattamento sintomatico.
Proprietà/Effetti
Codice ATC: L04AC17
Meccanismo d'azione/farmacodinamica
Tildrakizumab è un anticorpo IgG1/κ monoclonale umanizzato che si lega specificamente alla subunità proteica p19 della citochina interleuchina 23 (IL-23), inibendo la sua interazione con il recettore di IL-23.
IL-23 è una citochina naturalmente presente nell'organismo che è coinvolta nelle risposte infiammatorie e immunitarie. Tildrakizumab inibisce il rilascio di chemochine e citochine proinfiammatorie. In modelli in vitro è stato dimostrato che tildrakizumab sopprime senza legarsi a IL-12 – attraverso il blocco dell'interazione tra IL-23 e il suo recettore specifico, IL-23R – la cascata del segnale e delle citochine innescata da IL-23.
L'espressione dell'mRNA di IL-23p19 è più elevata nelle lesioni psoriasiche rispetto alla cute normale.
In studi esplorativi su pazienti affetti da psoriasi, gli infiltrati infiammatori nelle biopsie dei tessuti lesionali si sono ridotti in seguito alla somministrazione di Ilumetri. L'espressione di IL-23p19 nelle biopsie delle lesioni cutanee è diminuita rispetto al basale fino a due settimane dopo la terapia. Il quadro di espressione genica indica un indebolimento della reazione infiammatoria locale.
Efficacia clinica
Negli studi multicentrici, randomizzati, controllati con placebo, in doppio cieco reSURFACE 1 e reSURFACE 2 sono stati inclusi complessivamente 1'862 pazienti di età superiore a 18 anni affetti da psoriasi a placche con coinvolgimento di almeno il 10% della superficie corporea che presentavano un punteggio Physician Global Assessment (PGA) ≥3 nella valutazione globale della psoriasi (spessore delle placche, eritema e desquamazione) su una scala di gravità da 0 a 5 e un punteggio Psoriasis Area and Severity Index (PASI) ≥12 ed erano candidati a una fototerapia o a una terapia farmacologica sistemica.
In questi studi i pazienti sono stati randomizzati al trattamento con placebo o con Ilumetri (incluso il trattamento con 200 mg e 100 mg nelle settimane 0, 4 e quindi ogni 12 settimane [Q12W]) fino alla settimana 64 (reSURFACE 1) o 52 (reSURFACE 2). Nello studio di confronto con medicamento attivo (reSURFACE 2) i pazienti sono stati randomizzati allo stesso modo e hanno ricevuto, in un ulteriore braccio dello studio, 50 mg di etanercept due volte a settimana per 12 settimane e quindi una volta a settimana per 28 settimane.
Le caratteristiche demografiche e basali negli studi reSURFACE 1 e reSURFACE 2 erano uniformi nei singoli studi. Complessivamente i pazienti avevano un'età compresa tra 18 e 82 anni, con un'età media di 45,9 anni. Il punteggio PASI mediano al basale era compreso tra 17,7 e 18,4 in tutti i gruppi di trattamento. Il punteggio PGA al basale era «lesioni marcate» o «lesioni gravi» (punteggio ≥4) nel 33,4% dei pazienti. Il 35,8% dei pazienti aveva ricevuto in precedenza per il trattamento della psoriasi una fototerapia, il 41,1% una terapia farmacologica sistemica convenzionale e il 16,7% una terapia con biologici (complessivamente aveva ricevuto una fototerapia o una terapia sistemica il 55,7% dei pazienti). Complessivamente, il 15,4% dei pazienti dello studio aveva un'anamnesi di artrite psoriasica. Al basale, il DLQI (Dermatology Life Quality Index) era compreso tra 13,0 e 14,8.
Gli studi reSURFACE 1 e reSURFACE 2 hanno valutato le variazioni dei due endpoint co-primari alla settimana 12 rispetto al basale: 1) PASI 75 e 2) PGA «0» (nessuna lesione) o «1» (lesioni minime), con miglioramento di almeno 2 punti rispetto al basale. Altri risultati esaminati sono stati la percentuale di pazienti che avevano ottenuto una risposta PASI 90 e PASI 100, la percentuale di pazienti con DLQI 0 o 1 e il mantenimento dell'efficacia fino alla settimana 64/52.
I risultati nelle settimane 12, 28 e 64 (in reSURFACE 1) o 52 (in reSURFACE 2) sono elencati nella tabella 2 e nella tabella 3.
Tabella 2. Riepilogo dei tassi di risposta negli studi reSURFACE 1 e reSURFACE 2
Settimana 12 | Settimana 28 | ||||||
|---|---|---|---|---|---|---|---|
200 mg | 100 mg | Placebo | Etanercept | 200 mg | 100 mg | Etanercept | |
reSURFACE1 | |||||||
Numero di pazienti | 308 | 309 | 154 | - | 298 | 299 | - |
PASI 75a (%) | 62,3†b | 63,8†b | 5,8b | - | 81,9c | 80,4c | - |
PGA: «nessuna lesione» o «lesioni minime» con miglioramento di ≥2 punti rispetto al basalea (%) | 59,1†b | 57,9†b | 7,1b | - | 69,1c | 66,0c | - |
PASI 90 (%) | 35,4†b | 34,6†b | 2,6b | - | 59,0c | 51,6c | - |
PASI 100 (%) | 14,0†b | 13,9†b | 1,3b | - | 31,5c | 23,5c | - |
Punteggio DLQI 0 o 1 (%) | 44,2† | 41,5† | 5,3 | - | 56,7c | 52,4c | - |
reSURFACE2 | |||||||
Numero di pazienti | 314 | 307 | 156 | 313 | 299 | 294 | 289 |
PASI 75a (%) | 65,6†‡b | 61,2†‡b | 5,8b | 48,2b | 72,6‡b | 73,5‡b | 53,6b |
PGA: «nessuna lesione» o «lesioni minime» con miglioramento di ≥2 punti rispetto al basalea (%) | 59,2†¥b | 54,7†b | 4,5b | 47,6b | 69,2‡b | 64,6‡b | 45,3b |
PASI 90 (%) | 36,6†‡b | 38,8†‡b | 1,3b | 21,4b | 57,7‡c | 55,5‡c | 29,4c |
PASI 100 (%) | 11,8†‡b | 12,4†‡b | 0 | 4,8b | 27,0‡c | 22,8‡c | 10,7c |
Punteggio DLQI 0 o 1 (%) | 47,4†¥ | 40,2† | 8,0 | 35,5 | 65,0‡c | 54,1‡c | 39,4c |
a Endpoint co-primario di efficacia alla settimana 12.
b Imputazione come non-responder per i dati mancanti
c Nessuna imputazione per i dati mancanti
n = numero di pazienti nella serie di analisi completa per i quali erano disponibili dati, dopo imputazione, se pertinente.
Valori p calcolati mediante test di Cochran-Mantel-Haenszel (CMH), stratificati per peso corporeo (≤90 kg, >90 kg) e precedente terapia biologica per la psoriasi (sì / no)
† p ≤0,001 rispetto al placebo; ‡ p ≤0,001 rispetto a etanercept; ¥ p ≤0,05 rispetto a etanercept.
Mantenimento della risposta
Il mantenimento della risposta negli studi reSURFACE 1 e reSURFACE 2 è illustrato nella tabella 3.
Tabella 3. Mantenimento della risposta negli studi reSURFACE 1 e reSURFACE 2
Risposta a lungo termineab | ||
|---|---|---|
200 mg | 100 mg | |
reSURFACE 1 | Settimana 64 | |
Numero di pazienti | 114 | 112 |
PASI 75, n (%) | 107 (93,9) | 98 (87,5) |
PGA: «nessuna lesione» o «lesioni minime» con miglioramento di ≥2 punti rispetto al basale, n (%) | 87 (76,3) | 69 (61,6) |
PASI 90, n (%) | 85 (74,6) | 65 (58,0) |
PASI 100, n (%) | 46 (40,4) | 36 (32,1) |
Punteggio DLQI 0 o 1, n (%) | 78 (68,4) | 59 (52,2) |
reSURFACE 2 | Settimana 52 | |
Numero di pazienti | 105 | 204 |
PASI 75, n (%) | 102 (97,1) | 191 (93,6) |
PGA: «nessuna lesione» o «lesioni minime» con miglioramento di ≥2 punti rispetto al basale, n (%) | 89 (84,8) | 162 (79,4) |
PASI 90, n (%) | 86 (81,9) | 160 (78,4) |
PASI 100, n (%) | 49 (46,7) | 72 (35,3) |
Punteggio DLQI 0 o 1, n (%) | 76 (72,4) | 141 (68,8) |
a Risposta a lungo termine nei pazienti che erano responder (avevano ottenuto almeno una risposta PASI 75) alla settimana 28.
b Nessuna imputazione per i dati mancanti.
n = numero di pazienti nella serie di analisi completa per i quali erano disponibili dati
Qualità della vita/risultati riferiti dai pazienti
In vari studi Ilumetri è stato associato a un miglioramento statisticamente significativo alla settimana 12 della qualità della vita correlata alla salute, misurata mediante DLQI (Dermatology Life Quality Index) (tabella 2). I miglioramenti sono stati mantenuti nel tempo (tabella 3). Nella 52a settimana, avevano un DLQI pari a 0 o 1 il 63,7% (100 mg) e il 73,3% (200 mg) (in reSURFACE 1) ovvero il 68,8% (100 mg) e il 72,4% (200 mg) (in reSURFACE 2) dei pazienti che erano responder PASI 75 alla settimana 28.
Proseguimento del trattamento nei pazienti con risposta parziale
Dei pazienti randomizzati al trattamento con Ilumetri 100 mg che alla settimana 28 (3 dosi) avevano ottenuto una risposta PASI 50, ma non PASI 75, il 58,8% (reSURFACE1) e il 68,4% (reSURFACE2) hanno ottenuto una risposta PASI 75 alla settimana 52 (dopo altre 3 dosi) in seguito al proseguimento della terapia con 100 mg.
Efficacia nei sottogruppi
Peso corporeo elevato
Nei pazienti con peso corporeo superiore a 90 kg il tasso di risposta clinica e la qualità della vita correlata alla salute dopo 28 settimane di trattamento con 200 mg di tildrakizumab sono stati paragonabili a quelli dei pazienti di peso corporeo inferiore trattati con 100 mg di tildrakizumab.
Alla settimana 52 il tasso di risposta a tildrakizumab dei pazienti di peso corporeo elevato trattati continuativamente con 200 mg di tildrakizumab era stato mantenuto meglio che nel gruppo tildrakizumab 100 mg: 92,1% vs. 80,6% per PASI 75, 72,7% vs. 61,9% per PASI 90, 44,3% vs. 25,4% per PASI 100, 76,1% vs. 64,2% per PGA 0/1, 77,3% vs. 50,8% per DLQI 0/1.
Elevato carico di malattia
Nei pazienti in cui era stato riscontrato un carico di malattia elevato i tassi di risposta ottenuti alla settimana 28 con l'impiego di tildrakizumab 200 mg sono stati numericamente più elevati di quelli ottenuti con tildrakizumab 100 mg.
- Nei pazienti con punteggio PASI basale pari o superiore a 20: 75,3% vs. 70,4% per PASI 75, 57,7% vs. 46,9% per PASI 90, 28,6% vs. 15,5% per PASI 100 e 66,5% vs. 55,3% per PGA 0/1.
- Nei pazienti con BSA basale pari o superiore al 30%: 75,3% vs. 72,4% per PASI 75, 55,6% vs. 49,6% per PASI 90, 27,4% vs. 17,7% per PASI 100 e 66,8% vs. 59,1% per PGA 0/1.
Farmacocinetica
Assorbimento
La formulazione sottocutanea di tildrakizumab ha una biodisponibilità assoluta compresa tra il 73% (IC 90%: 46-115%, 200 mg s.c. contro 3 mg/kg e.v.) e l'80% (IC 90%: 62-103%, 50 mg s.c. contro 0,5 mg/kg e.v.), sulla base dei risultati di uno studio comparativo in cross-over con dose singola su adulti sani. La concentrazione massima è stata raggiunta 6,2 giorni dopo l'iniezione. Le analisi PK di popolazione hanno mostrato una biodisponibilità più elevata del 31% negli adulti sani rispetto ai pazienti.
Con il regime posologico clinico – settimane 0 e 4, quindi ogni 12 settimane – lo stato stazionario viene raggiunto dopo 16 settimane, con un accumulo dell'esposizione di 1,1 volte tra la settimana 1 e la settimana 12, indipendentemente dalla dose.
Allo stato stazionario, in seguito a somministrazione di tildrakizumab 100 mg in pazienti con psoriasi da moderata a grave, le medie geometriche (%CV) dei valori dell'AUC0-τ e della Cmax sono state rispettivamente 305 µg*die/ml (41%) e 8,1 µg/ml (34%), mentre in seguito a somministrazione di 200 mg sono state 612 μg*die/ml (40%) e 16,3 μg/ml (33%).
Distribuzione
Tildrakizumab presenta una limitata distribuzione extravascolare con valori Vd da 76,9 a 106 ml/kg.
Metabolismo
Tildrakizumab viene catabolizzato in amminoacidi mediante processi generali di degradazione proteica. Le vie metaboliche delle sostanze a basso peso molecolare (p. es. enzimi citocromo P450 (CYP), glucuronosiltransferasi) non contribuiscono alla sua clearance.
Eliminazione
I valori di clearance di tildrakizumab vanno da 2,04 a 2,52 ml/die/kg e l'emivita è di 23,4 giorni (23%CV).
Linearità/non linearità
In seguito a somministrazione sottocutanea, tildrakizumab ha mostrato nei pazienti con psoriasi a placche una farmacocinetica proporzionale alla dose nell'intervallo di dosaggio 50-400 mg.
Peso corporeo
I modelli farmacocinetici di popolazione hanno mostrato una riduzione dell'esposizione all'aumentare del peso corporeo. Nei pazienti adulti con peso corporeo >90 kg la media geometrica prevista dell'esposizione (AUC0-τ allo stato stazionario) in seguito a una dose s.c. da 100 mg o 200 mg era di circa il 30% più bassa che negli adulti con peso corporeo ≤90 kg (cfr. «Posologia/Impiego»).
Farmacocinetica in gruppi di pazienti speciali
Pazienti anziani
Un'analisi farmacocinetica di popolazione ha mostrato che l'età non influenza in maniera clinicamente significativa la clearance di tildrakizumab nei pazienti adulti affetti da psoriasi a placche. I pazienti di età pari o superiore a 65 anni avevano una cleareance di tildrakizumab simile a quella dei pazienti sotto i 65 anni.
Pazienti con funzionalità renale o epatica ridotta
Non sono stati effettuati studi specifici per esaminare gli effetti della riduzione della funzionalità renale o epatica sulla farmacocinetica di tildrakizumab.
Dati preclinici
I dati preclinici degli studi convenzionali di farmacologia di sicurezza e tossicità per somministrazione ripetuta non evidenziano alcun rischio particolare per l'essere umano.
In seguito a somministrazione ripetuta di tildrakizumab in scimmie cynomolgus trattate ogni 2 settimane per un massimo di 9 mesi con la NOAEL come dose massima somministrata (140 mg/kg [e.v. e s.c.] nello studio di 3 mesi o 100 mg/kg [s.c.] nello studio di 9 mesi), non si sono avuti reperti tossicologici positivi (inclusi esame degli organi riproduttivi, effetti ormonali [estradiolo e progesterone] e funzionalità cardiovascolare, respiratoria e del SNC).
Non sono stati effettuati studi di cancerogenicità sugli animali con tildrakizumab. Studi su modelli tumorali murini hanno mostrato che l'inibizione selettiva di IL-23p19 non aumenta il rischio di cancro.
Nelle scimmie cynomolgus la secrezione del prodotto nel latte materno è stata trascurabile. Un mese dopo la nascita il rapporto latte/siero era ≤0,002. È stato dimostrato che tildrakizumab attraversa la barriera placentare. In seguito a somministrazione ripetuta in scimmie cynomolgus gravide, le concentrazioni sieriche nel feto erano quantificabili ma gli studi di tossicità per la riproduzione non hanno mostrato effetti deleteri.
Nelle scimmie cynomolgus di sesso maschile e femminile nelle quali tildrakizumab è stato somministrato a dosaggi corrispondenti, sulla base dell'AUC, a più di 100 volte l'esposizione umana alla dose clinica consigliata, non sono stati osservati effetti sui parametri di fertilità come organi riproduttivi, lunghezza del ciclo mestruale e/o ormoni.
In uno studio di tossicità per lo sviluppo pre- e postnatale nelle scimmie, con un'esposizione materna corrispondente a 85 volte l'esposizione umana alla dose consigliata non è stato osservato un aumento degli aborti. Con esposizioni materne corrispondenti a 9 volte l'esposizione umana alla dose consigliata non sono stati osservati effetti nocivi sui neonati. Due casi di morte neonatale in scimmie trattate con tildrakizumab a un'esposizione materna corrispondente a 85 volte l'esposizione umana alla dose consigliata sono stati attribuiti a una possibile infezione virale; pertanto, l'associazione con il trattamento è stata giudicata incerta. Il significato clinico di queste osservazioni non è noto.
Altre indicazioni
Stabilità
Il medicamento non dev'essere utilizzato oltre la data indicata con EXP sulla confezione.
Indicazioni particolari concernenti l'immagazzinamento
Tenere fuori dalla portata dei bambini.
Conservare in frigorifero (2-8 °C). Non congelare.
Ilumetri può essere conservato una sola volta a temperatura ambiente (15-25 °C) nella scatola originale per un periodo massimo di 30 giorni. Una volta che è stato prelevato dal frigorifero e ha raggiunto la temperatura ambiente (15-25 °C), Ilumetri deve essere utilizzato entro 30 giorni o smaltito, anche se è stato rimesso in frigorifero.
Conservare le siringhe preriempite nella confezione fino al momento dell'uso, per tenere il contenuto al riparo dalla luce.
Indicazioni per la manipolazione
Ilumetri è una soluzione iniettabile sterile in siringa preriempita. Le siringhe preriempite sono esclusivamente monouso.
La siringa preriempita dovrebbe essere prelevata dal frigorifero 30 minuti prima dell'iniezione, in modo che arrivi a temperatura ambiente.
Non agitare la siringa preriempita.
Si consiglia di ispezionare visivamente la siringa preriempita prima dell'uso. Il liquido dovrebbe essere limpido e incolore o di colore giallo chiaro. Potrebbe essere visibile bollicine d'aria, che è normale. Non usare il prodotto se il liquido contiene particelle chiaramente visibili, appare torbido o presenta un'evidente colorazione marrone.
Le istruzioni per l'uso delle siringhe preriempite contenute nel foglietto illustrativo devono essere seguite attentamente.
Il medicamento non utilizzato o il materiale di rifiuto vanno smaltiti secondo le normative nazionali.
Numero dell'omologazione
66784 (Swissmedic).
Titolare dell’omologazione
Almirall AG, 8304 Wallisellen.
Stato dell'informazione
Novembre 2018.
Composition
Principe actif: tildrakizumab, produit à partir de cellules ovariennes de hamster chinois (CHO) génétiquement modifiées.
Excipients: L-histidine, chlorhydrate de L-histidine monohydraté, polysorbate 80, saccharose, eau pour préparations injectables q.s. ad solutionem.
Forme galénique et quantité de principe actif par unité
Solution injectable pour administration sous-cutanée.
Chaque seringue préremplie contient 100 mg de tildrakizumab dans 1 ml.
Indications/Possibilités d’emploi
Ilumetri est indiqué dans le traitement du psoriasis en plaques modéré à sévère chez des patients adultes ayant présenté une réponse insuffisante à un traitement systémique conventionnel antérieur et/ou à une PUVA-thérapie ou présentant une contre-indication ou une intolérance à de tels traitements.
Posologie/Mode d’emploi
Ilumetri doit être utilisé sous la conduite et la surveillance d'un médecin expérimenté dans le diagnostic et le traitement du psoriasis.
Le bénéfice du traitement dans l'arthrite psoriasique n'est pas démontré.
Avant d'instaurer le traitement, le médecin doit s'assurer que le patient a compris qu'Ilumetri est un nouveau traitement dont l'expérience est limitée et dont les risques à long terme sont inconnus. L'efficacité et la sécurité d'Ilumetri sont démontrées sur une période allant jusqu'à 2 ans.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Posologie
La dose recommandée d'Ilumetri est de 100 mg, administrée sous forme d'injection sous-cutanée aux semaines 0 et 4, puis toutes les 12 semaines.
Chez les patients présentant une charge élevée de la maladie et/ou un poids corporel ≥90 kg, 200 mg peuvent montrer une plus grande efficacité (voir «Propriétés/Effets»).
L'arrêt du traitement doit être envisagé chez les patients ne présentant pas de réponse après 28 semaines de traitement. Les patients présentant initialement une réponse partielle peuvent obtenir une amélioration de la réponse en poursuivant le traitement au-delà de 28 semaines.
En cas d'oubli d'une dose, administrer celle-ci le plut tôt possible. Reprendre ensuite le schéma d'administration normal prévu.
Mode d'administration
Ilumetri est administré en injection sous-cutanée. Les sites d'injection doivent être alternés. Ilumetri ne doit pas être injecté dans des zones où la peau est sensible à la douleur, présente un hématome, est rouge, indurée, épaissie, squameuse, ou atteinte de psoriasis.
Lorsque le médecin traitant le juge opportun et que la surveillance médicale nécessaire est garantie, les patients peuvent réaliser eux-mêmes les injections d'Ilumetri après une formation appropriée à la technique d'injection sous-cutanée. Les patients doivent être informés de la nécessité d'injecter la quantité totale d'Ilumetri, conformément aux instructions figurant dans la notice d'emballage. Les instructions d'emploi détaillées figurent dans la notice d'emballage.
Instructions posologiques particulières
Groupes de patients particuliers
Patients âgés (à partir de 65 ans)
Aucun ajustement posologique n'est nécessaire (voir «Pharmacocinétique»).
Troubles de la fonction rénale ou hépatique
Ilumetri n'a jusqu'ici pas été étudié chez ces groupes de patients. Aucune recommandation posologique ne peut être faite.
Enfants et adolescents
La sécurité et l'efficacité d'Ilumetri chez les enfants et les adolescents de moins de 18 ans n'ont pas été évaluées. Aucune donnée n'est disponible.
Contre-indications
Ilumetri ne doit pas être utilisé
- en cas d'hypersensibilité au principe actif ou à l'un des excipients selon la composition.
- en cas d'infection active, cliniquement significative (p.ex. tuberculose active, voir «Mises en garde et précautions»).
Mises en garde et précautions
Infections
Le tildrakizumab peut augmenter le risque d'infections. Au cours des études cliniques, des infections ont été observées durant la phase contrôlée contre placebo de 12 semaines dans 21,0% des cas sous placebo contre respectivement 20,9% et 20,7% des cas sous Ilumetri 100 mg et 200 mg. Des infections graves ont été observées dans 0,3% des cas sous placebo contre respectivement 0,2% et 0,3% des cas sous Ilumetri 100 mg et 200 mg. Les patients présentant des antécédents d'infections actives ou récidivantes ont été exclus des études cliniques (p.ex. patients séropositifs au VHC, VHB et VIH). Les patients traités par des immunosuppresseurs peuvent présenter une réactivation d'infections latentes.
La prudence est recommandée lors de l'utilisation d'Ilumetri chez des patients atteints d'une infection chronique ou présentant des antécédents d'infection récidivante ou d'infection sévère récente.
Il convient d'informer les patients de la nécessité de consulter un médecin en cas d'apparition de signes ou de symptômes évocateurs d'une infection cliniquement significative ou aiguë. En cas de développement d'une infection sévère, le patient doit faire l'objet d'une surveillance étroite et le traitement par Ilumetri doit être interrompu jusqu'à la guérison de l'infection.
Tuberculose
Ilumetri ne doit pas être utilisé chez les patients présentant une tuberculose active. Avant d'instaurer un traitement par Ilumetri, les patients doivent être examinés pour dépister une éventuelle infection par la tuberculose. Les patients recevant Ilumetri doivent être surveillés pendant et après le traitement afin de détecter d'éventuels signes et symptômes d'une tuberculose active. Chez les patients présentant des antécédents de tuberculose latente ou active pour lesquels le suivi d'un traitement adapté ne peut être confirmé, un traitement antituberculeux devra être réalisé avant l'instauration du traitement par Ilumetri.
Tumeurs malignes
Dans les études cliniques, le traitement par Ilumetri n'a pas été associé à un risque accru d'affections malignes.
Les patients atteints de psoriasis ayant reçu auparavant un traitement UV devront faire l'objet d'un examen minutieux avant et pendant le traitement par Ilumetri afin de dépister la présence de tumeurs cutanées.
Traitement concomitant par d'autres immunosuppresseurs systémiques
La sécurité et l'efficacité d'Ilumetri en association avec des immunosuppresseurs, y compris des agents biologiques, ou la photothérapie n'ont pas été évaluées. L'association avec d'autres immunosuppresseurs systémiques, y compris des agents biologiques, n'est pas recommandée.
Hypersensibilité
En cas de survenue d'une grave réaction d'hypersensibilité, l'administration d'Ilumetri doit être immédiatement arrêtée et un traitement approprié doit être instauré.
Vaccinations
Avant l'instauration du traitement par Ilumetri, il faut envisager la mise à jour de toutes les vaccinations indiquées conformément aux recommandations vaccinales actuelles. Des vaccins vivants ne doivent pas être administrés en même temps qu'Ilumetri. Aucune donnée sur la réponse immunitaire à des vaccins inactivés n'est disponible. Un délai suffisant entre des vaccinations avec des vaccins vivants et le début du traitement doit être respecté conformément aux recommandations vaccinales actuelles. Des informations utiles sur l'emploi de principes actifs immunosuppresseurs figurent également dans les informations professionnelles correspondantes des vaccinations.
Interactions
Vaccins
Des vaccins vivants ne doivent pas être administrés en même temps qu'Ilumetri (voir «Mises en garde et précautions»). Aucune donnée sur la réponse immunitaire aux vaccins n'est disponible (voir «Mises en garde et précautions»).
Interactions avec le cytochrome P450
Les médicaments concomitants ne devraient pas affecter la pharmacocinétique d'Ilumetri, car Ilumetri est éliminé de l'organisme par des voies générales de catabolisme des protéines sans contribution des enzymes du cytochrome P450 et n'est pas éliminé par voie rénale ou hépatique.
Les résultats d'une étude d'interactions médicamenteuses menée chez des patients atteints de psoriasis suggèrent que le tildrakizumab n'a pas d'effet cliniquement significatif sur le cytochrome P450 (CYP) 1A2, CYP2C9, CYP2C19, CYP2D6 et CYP3A4. Par conséquent, le tildrakizumab n'a pas d'influence sur la pharmacocinétique de médicaments concomitants métabolisés par une enzyme du CYP.
Grossesse/Allaitement
Femmes en âge de procréer
Les femmes en âge de procréer doivent recourir à une méthode de contraception fiable pendant le traitement et au moins 17 semaines après la fin de celui-ci.
Grossesse
Il n'existe pas de données pertinentes concernant l'emploi d'Ilumetri chez la femme enceinte. Les expérimentations animales ne révèlent pas d'effets délétères directs ou indirects sur la reproduction (voir «Données précliniques»). Par mesure de précaution, il faut éviter d'utiliser Ilumetri pendant la grossesse.
Allaitement
On ignore si le tildrakizumab passe dans le lait maternel. Les données toxicologiques disponibles chez le singe cynomolgus ont montré des taux négligeables d'Ilumetri dans le lait maternel au 28e jour après la naissance (PND 28) (voir «Données précliniques»). Chez l'être humain, des anticorps peuvent être transmis au nouveau-né par le lait maternel au cours des premiers jours suivant la naissance. Durant cette courte période, un risque pour l'enfant allaité ne peut être exclu. Il convient de décider soit d'interrompre l'allaitement, soit de renoncer au traitement par Ilumetri/d'interrompre le traitement par Ilumetri, en prenant en compte le bénéfice de l'allaitement pour l'enfant au regard du bénéfice du traitement pour la femme.
Fertilité
Les effets d'Ilumetri sur la fertilité humaine n'ont pas été évalués. Les expérimentations animales ne montrent pas d'effets délétères directs ou indirects sur la fertilité (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude correspondante n'a été effectuée.
Effets indésirables
Résumé du profil de sécurité
Trois études contrôlées contre placebo (une étude de phase IIb et deux de phase III) ont été intégrées pour évaluer la sécurité d'Ilumetri par rapport au placebo. Au total, 1'768 patients ont été examinés (705 patients sous 100 mg, 708 patients sous 200 mg et 355 patients sous placebo). Au total, 1'994 patients ont reçu le tildrakizumab: 1'556 patients (78,0%) y ont été exposés pendant au moins 1 an et 987 patients (49,5%) pendant 2 ans.
Les effets indésirables les plus fréquents sont des infections des voies respiratoires supérieures, des céphalées, une gastroentérite, des nausées, une diarrhée, des douleurs au niveau du site d'injection et des dorsalgies.
La plupart des effets indésirables ont été considérés comme légers et aucun effet indésirable n'a conduit à l'arrêt du traitement chez plus de 1% des patients. Pour le traitement de certains effets indésirables, voir «Mises en garde et précautions».
Tableau synoptique des effets indésirables
Les effets indésirables rapportés dans les études cliniques (Tableau 1) sont présentés par classes de systèmes d'organes selon MedDRA. Dans chaque classe de systèmes d'organes, les effets indésirables sont classés par ordre décroissant de fréquence. Dans chaque groupe de fréquence, les effets indésirables sont énumérés par ordre décroissant de gravité. La catégorie de fréquence de chaque effet indésirable repose en outre sur les définitions suivantes: très fréquents (≥1/10); fréquents (≥1/100, <1/10); occasionnels (≥1/1000, <1/100); rares (≥1/10'000, <1/1000); très rares (<1/10'000); fréquence inconnue (ne peut être estimée sur la base des données disponibles).
Tableau 1. Liste des effets indésirables
Classe de systèmes d'organes | Effet indésirable | Catégorie de fréquence | Fréquence | |
|---|---|---|---|---|
Ilumetri 200 mg | Ilumetri 100 mg | |||
Infections et infestations | Infections des voies respiratoires supérieures, y compris rhinopharyngite | Très fréquents | 87 (12,3) | 91 (12,9) |
Affections du système nerveux | Céphalées | Fréquents | 30 (4,2) | 26 (3,7) |
Affections gastro-intestinales | Gastroentérite | Fréquents | 13 (1,8) | 8 (1,1) |
Nausées | Fréquents | 11 (1,6) | 7 (1,0) | |
Diarrhée | Fréquents | 10 (1,4) | 13 (1,8) | |
Troubles généraux et anomalies au site d'administration | Douleurs au niveau du site d'injection | Fréquents | 9 (1,3) | 10 (1,4) |
Dorsalgies | Fréquents | 12 (1,7) | 9 (1,3) | |
Description de certains effets indésirables
Immunogénicité
Dans les études cliniques de phase II et III sur le psoriasis, 7,3% des patients traités par Ilumetri ont développé des anticorps anti-Ilumetri. Aucune corrélation apparente entre le développement d'anticorps anti-Ilumetri et une baisse de l'efficacité ou l'apparition d'effets indésirables liés au traitement n'a été observée.
Surdosage
Des doses intraveineuses allant jusqu'à 10 mg/kg ont été administrées sans risque dans le cadre d'études cliniques.
En cas de surdosage, il est recommandé de surveiller le patient afin de détecter tout signe ou symptôme d'effets indésirables et d'instaurer immédiatement un traitement symptomatique approprié.
Propriétés/Effets
Code ATC: L04AC17
Mécanisme d'action/pharmacodynamique
Le tildrakizumab est un anticorps monoclonal humanisé de classe IgG1/κ qui se lie de manière spécifique à la sous-unité protéique p19 de la cytokine interleukine-23 (IL-23) et inhibe l'interaction de celle-ci avec le récepteur de l'IL-23.
L'IL-23 est une cytokine naturelle impliquée dans les réponses inflammatoire et immunitaire. Le tildrakizumab inhibe la libération de cytokines pro-inflammatoires et de chimiokines. Des modèles in vitro ont montré que le tildrakizumab inhibe la cascade de signalisation et la cascade des cytokines, médiées par l'IL-23, en bloquant l'interaction de l'IL-23 avec son récepteur spécifique, l'IL-23R, sans se lier à l'IL-12.
L'expression de l'ARNm de l'IL-23p19 est plus élevée dans les lésions psoriasiques que dans la peau normale.
Dans des études exploratoires menées chez des patients atteints de psoriasis, les infiltrats inflammatoires dans les biopsies tissulaires des lésions étaient diminués après l'administration d'Ilumetri. L'expression de l'IL-23p19 dans les biopsies cutanées des lésions a diminué jusqu'à deux semaines après le traitement, par rapport à l'inclusion. Des modèles d'expression génique révèlent une diminution de la réaction inflammatoire locale.
Efficacité clinique
Les études multicentriques, randomisées, en double aveugle, contrôlées contre placebo reSURFACE 1 et reSURFACE 2 ont inclus au total 1862 patients âgés de 18 ans et plus, atteints de psoriasis en plaques atteignant au moins 10% de la surface corporelle qui présentaient un score Physician Global Assessment (PGA) ≥3 lors de l'évaluation globale du psoriasis (épaisseur des plaques, érythème et desquamation) sur une échelle de gravité allant de 0 à 5 et un score Psoriasis-Area-and-Severity-Index (PASI) ≥12 et qui étaient candidats à une photothérapie ou à un traitement médicamenteux systémique.
Dans le cadre de ces études, les patients ont été randomisés soit dans le groupe sous placebo, soit dans l'un des groupes sous Ilumetri (avec 200 mg ou 100 mg aux semaines 0, 4, puis toutes les 12 semaines [Q12W]) jusqu'à la semaine 64 (reSURFACE 1) ou 52 (reSURFACE 2). Dans l'étude avec comparateur actif (reSURFACE 2), les patients ont également été randomisés et ont reçu dans un bras supplémentaire de l'étude 50 mg d'étanercept deux fois par semaine pendant 12 semaines, puis une fois par semaine jusqu'à la semaine 28.
Les caractéristiques démographiques et initiales dans les études reSURFACE 1 et reSURFACE 2 étaient homogènes dans chacune des études. Les patients étaient âgés de 18 à 82 ans, avec une moyenne d'âge de 45,9 ans. Le score PASI médian initial était compris entre 17,7 et 18,4 dans tous les groupes de traitement. Le score PGA initial indiquait des «lésions marquées» ou des «lésions graves» (score ≥4) chez 33,4% des patients. Pour le traitement du psoriasis, 35,8% des patients avaient reçu précédemment une photothérapie, 41,1% un traitement médicamenteux systémique conventionnel et 16,7% un traitement biologique (au total, 55,7% des patients avaient reçu une photothérapie ou un traitement systémique). Au total, 15,4% des patients inclus dans ces études présentaient des antécédents d'arthrite psoriasique. Le score DLQI (Dermatology Life Quality Index) initial était compris entre 13,0 et 14,8.
Les études reSURFACE 1 et reSURFACE 2 ont évalué les modifications entre l'inclusion et la semaine 12 avec deux co-critères d'évaluation principaux: 1) PASI 75 et 2) PGA de «0» (blanchi) ou «1» (lésions minimes), avec une amélioration d'au moins 2 points par rapport à l'inclusion. Les autres résultats évalués comprenaient le pourcentage de patients ayant atteint un score PASI 90 et un score PASI 100, le pourcentage de patients ayant un score DLQI de 0 ou 1 et le maintien de l'efficacité jusqu'à 64/52 semaines.
Les résultats obtenus aux semaines 12, 28 et jusqu'à la semaine 64 (dans l'étude reSURFACE 1) et jusqu'à la semaine 52 (dans l'étude reSURFACE 2) sont présentés dans les tableaux 2 et 3.
Tableau 2. Résumé des taux de réponse dans les études reSURFACE 1 et reSURFACE 2
Semaine 12 | Semaine 28 | ||||||
|---|---|---|---|---|---|---|---|
200 mg | 100 mg | Placebo | Étanercept | 200 mg | 100 mg | Étanercept | |
reSURFACE 1 | |||||||
Nombre de patients | 308 | 309 | 154 | - | 298 | 299 | - |
PASI 75a (%) | 62,3†b | 63,8†b | 5,8b | - | 81,9c | 80,4c | - |
PGA: «blanchi» ou «lésions minimes» avec une amélioration ≥2 points par rapport à l'inclusiona (%) | 59,1†b | 57,9†b | 7,1b | - | 69,1c | 66,0c | - |
PASI 90 (%) | 35,4†b | 34,6†b | 2,6b | - | 59,0c | 51,6c | - |
PASI 100 (%) | 14,0†b | 13,9†b | 1,3b | - | 31,5c | 23,5c | - |
Score DLQI de 0 ou 1 (%) | 44,2† | 41,5† | 5,3 | - | 56,7c | 52,4c | - |
reSURFACE 2 | |||||||
Nombre de patients | 314 | 307 | 156 | 313 | 299 | 294 | 289 |
PASI 75a (%) | 65,6†‡b | 61,2†‡b | 5,8b | 48,2b | 72,6‡b | 73,5‡b | 53,6b |
PGA: «blanchi» ou «lésions minimes» avec une amélioration ≥2 points par rapport à l'inclusiona (%) | 59,2†¥b | 54,7†b | 4,5b | 47,6b | 69,2‡b | 64,6‡b | 45,3b |
PASI 90 (%) | 36,6†‡b | 38,8†‡b | 1,3b | 21,4b | 57,7‡c | 55,5‡ c | 29,4c |
PASI 100 (%) | 11,8†‡b | 12,4†‡b | 0 | 4,8b | 27,0‡c | 22,8‡ c | 10,7c |
Score DLQI de 0 ou 1 (%) | 47,4†¥ | 40,2† | 8,0 | 35,5 | 65,0‡c | 54,1‡ c | 39,4c |
a Co-critère principal d'évaluation de l'efficacité à la semaine 12.
b Imputation en non-répondeur pour les données manquantes.
c Aucune imputation pour les données manquantes
n = nombre de patients dans la population totale analysée pour qui les données étaient disponibles, après imputation le cas échéant.
Valeurs de p calculées à l'aide du test de Cochran-Mantel-Haenszel (CMH), stratifiées selon le poids corporel (≤90 kg, >90 kg) et le traitement biologique antérieur du psoriasis (oui / non).
† p ≤0,001 versus placebo; ‡ p ≤0,001 versus étanercept; ¥ p ≤0,05 versus étanercept.
Maintien de la réponse
Le maintien de la réponse dans les études reSURFACE 1 et reSURFACE 2 est présenté dans le tableau 3.
Tableau 3. Maintien de la réponse dans les études reSURFACE 1 et reSURFACE 2
Réponse à long termeab | ||
|---|---|---|
200 mg | 100 mg | |
reSURFACE 1 | Semaine 64 | |
Nombre de patients | 114 | 112 |
PASI 75, n (%) | 107 (93,9) | 98 (87,5) |
PGA: «blanchi» ou «lésions minimes» avec une amélioration ≥2 points par rapport à l'inclusion, n (%) | 87 (76,3) | 69 (61,6) |
PASI 90, n (%) | 85 (74,6) | 65 (58,0) |
PASI 100, n (%) | 46 (40,4) | 36 (32,1) |
Score DLQI de 0 ou 1, n (%) | 78 (68,4) | 59 (52,2) |
reSURFACE 2 | Semaine 52 | |
Nombre de patients | 105 | 204 |
PASI 75, n (%) | 102 (97,1) | 191 (93,6) |
PGA: «blanchi» ou «lésions minimes» avec une amélioration ≥2 points par rapport à l'inclusion, n (%) | 89 (84,8) | 162 (79,4) |
PASI 90, n (%) | 86 (81,9) | 160 (78,4) |
PASI 100, n (%) | 49 (46,7) | 72 (35,3) |
Score DLQI de 0 ou 1, n (%) | 76 (72,4) | 141 (68,8) |
a Réponse à long terme chez les patients qui étaient répondeurs (ayant atteint au moins un score PASI 75) à la semaine 28.
b Aucune imputation pour les données manquantes.
n = nombre de patients dans la population totale analysée pour qui les données étaient disponibles.
Qualité de vie/Résultats rapportés par les patients
Dans différentes études, Ilumetri a été associé à la semaine 12 à une amélioration statistiquement significative de la qualité de vie liée à la santé, évaluée par le score DLQI (Dermatology Life Quality Index) (Tableau 2). Ces améliorations se sont maintenues au cours du temps (Tableau 3). À la semaine 52, respectivement 63,7% (100 mg) et 73,3% (200 mg) des patients inclus dans reSURFACE 1, et 68,8% (100 mg) et 72,4% (200 mg) des patients inclus dans reSURFACE 2 ayant atteint une réponse PASI 75 à la semaine 28, avaient un score DLQI de 0 ou 1.
Poursuite du traitement chez les répondeurs partiels
Jusqu'à 58,8% (reSURFACE 1) et 68,4% (reSURFACE 2) des patients randomisés dans le groupe sous Ilumetri 100 mg qui, à la semaine 28 (3 doses), n'avaient pas atteint un score PASI 75, mais avaient au moins atteint un score PASI 50, ont obtenu un score PASI 75 à la semaine 52 (3 doses supplémentaires) lors de la poursuite du traitement par 100 mg.
Efficacité dans des sous-groupes
Poids corporel élevé
Chez les patients pesant plus de 90 kg, traités par 200 mg de tildrakizumab pendant 28 semaines, le taux de réponse clinique et la qualité de vie liée à la santé étaient comparables à ceux observés chez les patients ayant un poids corporel plus faible, traités par 100 mg de tildrakizumab.
À la semaine 52, le maintien du taux de réponse au tildrakizumab observé chez les patients ayant un poids corporel élevé et ayant reçu un traitement continu par 200 mg de tildrakizumab, était meilleur que celui obtenu sous 100 mg de tildrakizumab: PASI 75 de 92,1 contre 80,6%, PASI 90 de 72,7 contre 61,9%, PASI 100 de 44,3 contre 25,4%, PGA 0/1 de 76,1 contre 64,2%, DLQI 0/1 de 77,3 contre 50,8%.
Charge élevée de la maladie
Chez les patients présentant une charge élevée de la maladie, les taux de réponse obtenus à la semaine 28 avec le traitement par 200 mg de tildrakizumab étaient numériquement supérieurs à ceux obtenus avec le traitement par 100 mg de tildrakizumab.
- Chez les patients avec un score PASI initial de 20 et plus: PASI 75 de 75,3 contre 70,4%, PASI 90 de 57,7 contre 46,9%, PASI 100 de 28,6 contre 15,5% et PGA 0/1 de 66,5 contre 55,3%.
- Chez les patients avec un BSA initial de 30% et plus: PASI 75 de 75,3 contre 72,4%, PASI 90 de 55,6 contre 49,6%, PASI 100 de 27,4 contre 17,7% et PGA 0/1 de 66,8 contre 59,1%.
Pharmacocinétique
Absorption
La formulation sous-cutanée du tildrakizumab a une biodisponibilité absolue allant de 73% (IC à 90%: 46-115%, 200 mg par voie s.c. contre 3 mg/kg par voie i.v.) à 80% (IC à 90%: 62-103%, 50 mg par voie s.c. contre 0,5 mg/kg par voie i.v.), comme l'a révélé une étude comparative croisée à dose unique chez l'adulte sain. La concentration maximale a été atteinte 6,2 jours après l'injection. Des analyses de pharmacocinétique de population ont montré une biodisponibilité supérieure de 31% chez les adultes sains par rapport aux patients.
L'état d'équilibre est atteint après 16 semaines avec le schéma d'administration clinique (semaines 0 et 4, puis toutes les 12 semaines), avec une accumulation de l'exposition multipliée par 1,1 entre la semaine 1 et la semaine 12, indépendamment de la dose.
À l'état d'équilibre, après l'administration de 100 mg de tildrakizumab à des patients atteints de psoriasis modéré à sévère, les moyennes géométriques (% CV) des valeurs de l'AUC0-τ et de la Cmax étaient respectivement de 305 µg*jour/ml (41%) et 8,1 µg/ml (34%), alors qu'après l'administration de 200 mg, elles étaient respectivement de 612 μg*jour/ml (40%) et 16,3 μg/ml (33%).
Distribution
Le tildrakizumab a une distribution extravasculaire limitée, avec des valeurs de Vd allant de 76,9 à 106 ml/kg.
Métabolisme
Le tildrakizumab est catabolisé en acides aminés par des voies générales de dégradation des protéines. Les voies métaboliques des petites molécules (p.ex. enzymes du cytochrome P450 (CYP), glucuronosyltransférases) ne contribuent pas à sa clairance.
Élimination
Les valeurs de la clairance du tildrakizumab étaient comprises entre 2,04 et 2,52 ml/jour/kg et la demi-vie était de 23,4 jours (23% CV).
Linéarité/Non-linéarité
Après administration sous-cutanée, le tildrakizumab a présenté une pharmacocinétique proportionnelle à la dose dans l'intervalle de doses allant de 50 mg à 400 mg, chez des patients atteints de psoriasis en plaques.
Poids corporel
Des modèles pharmacocinétiques de population ont montré que l'exposition diminuait lorsque le poids corporel augmentait. Chez les patients adultes pesant plus de 90 kg, la moyenne géométrique prévue de l'exposition (AUC0-τ à l'état d'équilibre) après une dose de 100 mg ou 200 mg par voie s.c. était environ 30% inférieure à celle des patients adultes pesant 90 kg ou moins (voir «Posologie/Mode d'emploi»).
Pharmacocinétique pour des groupes de patients particuliers
Patients âgés
Une analyse pharmacocinétique de population a montré que l'âge n'a pas d'influence cliniquement significative sur la clairance du tildrakizumab chez les patients adultes atteints de psoriasis en plaques. Les patients âgés de 65 ans ou plus avaient une clairance du tildrakizumab similaire à celle des patients âgés de moins de 65 ans.
Patients atteints d'insuffisance rénale ou hépatique
Aucune étude spécifique n'a été réalisée pour déterminer les effets de l'insuffisance rénale ou hépatique sur la pharmacocinétique du tildrakizumab.
Données précliniques
Les données précliniques issues des études conventionnelles de pharmacologie de sécurité et de toxicité en cas d'administration répétée n'ont pas révélé de risque particulier pour l'être humain.
Après administration répétée de tildrakizumab à des singes cynomolgus traités toutes les 2 semaines pendant jusqu'à 9 mois avec la DSENO comme dose maximale administrée (140 mg/kg [i.v. et s.c.] dans l'étude de 3 mois ou 100 mg/kg [s.c.] dans l'étude de 9 mois), aucun résultat toxicologique (y compris examen des organes de reproduction, effets hormonaux [estradiol et progestérone] ou fonctions cardiovasculaire, respiratoire ou du SNC) n'a été constaté.
Aucune étude de carcinogénicité chez l'animal n'a été réalisée avec le tildrakizumab. Des études réalisées sur des modèles tumoraux murins ont montré que l'inhibition sélective de l'IL-23p19 n'augmente pas le risque cancérigène.
Chez le singe cynomolgus, une sécrétion négligeable du produit dans le lait maternel a été observée. Un mois après la naissance, le rapport lait/sérum était ≤0,002. Il a été démontré que le tildrakizumab traversait la barrière placentaire. Après administration répétée à des femelles cynomolgus gravides, les concentrations sériques étaient quantifiables chez le fœtus, mais les études de toxicité sur la reproduction n'ont pas révélé d'effets délétères.
Aucun effet sur les paramètres de la fertilité, tels que les organes de reproduction, la durée des cycles menstruels et/ou les hormones, n'a été observé chez des singes cynomolgus mâles et femelles ayant reçu du tildrakizumab à des doses correspondant à plus de 100 fois l'exposition chez l'homme à la dose clinique recommandée basée sur l'AUC.
Dans une étude de toxicité sur le développement prénatal et postnatal menée chez le singe, aucune augmentation des pertes embryonnaires n'a été observée à des expositions maternelles correspondant à 85 fois l'exposition chez l'homme à la dose recommandée. Aucun effet délétère n'a été observé chez les nouveau-nés à des expositions maternelles correspondant à 9 fois l'exposition chez l'homme à la dose recommandée. Deux décès de singes nouveau-nés, survenus après une exposition maternelle au tildrakizumab correspondant à 85 fois l'exposition chez l'homme à la dose recommandée, ont été attribués à une éventuelle infection virale; le lien avec le traitement a toutefois été considéré comme incertain. La signification clinique de ces résultats n'est pas connue.
Remarques particulières
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver hors de portée des enfants.
Conserver au réfrigérateur (2-8 °C). Ne pas congeler.
Ilumetri peut être conservé dans son carton à température ambiante (15-25 °C) pendant une période unique de 30 jours au maximum. Une fois qu'Ilumetri a été sorti du réfrigérateur et a atteint la température ambiante (15-25 °C), il doit être utilisé ou jeté dans un délai de 30 jours, même s'il a été remis au réfrigérateur.
Conserver les seringues préremplies dans leur carton jusqu'à leur utilisation pour les protéger de la lumière.
Remarques concernant la manipulation
Ilumetri est une solution injectable stérile dans une seringue préremplie. Les seringues préremplies sont uniquement destinées à un usage unique.
La seringue préremplie doit être sortie du réfrigérateur 30 minutes avant l'injection pour lui permettre d'atteindre la température ambiante.
Ne pas secouer la seringue préremplie.
Avant l'utilisation, il est recommandé d'inspecter visuellement la seringue préremplie. Le liquide doit être limpide. Sa couleur peut varier d'incolore à jaune pâle. Il est possible que des petites bulles d'air soient visible, ce qui est normal. Ne pas utiliser si le liquide contient des particules bien visibles, est trouble ou a une couleur nettement marron.
Les instructions d'utilisation des seringues préremplies figurant dans la notice d'emballage doivent être scrupuleusement suivies.
Le médicament non utilisé et les déchets doivent être éliminés conformément aux exigences nationales.
Numéro d’autorisation
66784 (Swissmedic).
Titulaire de l’autorisation
Almirall AG, 8304 Wallisellen.
Mise à jour de l’information
Novembre 2018.
Відгуки (0)
Ви переглядали

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.

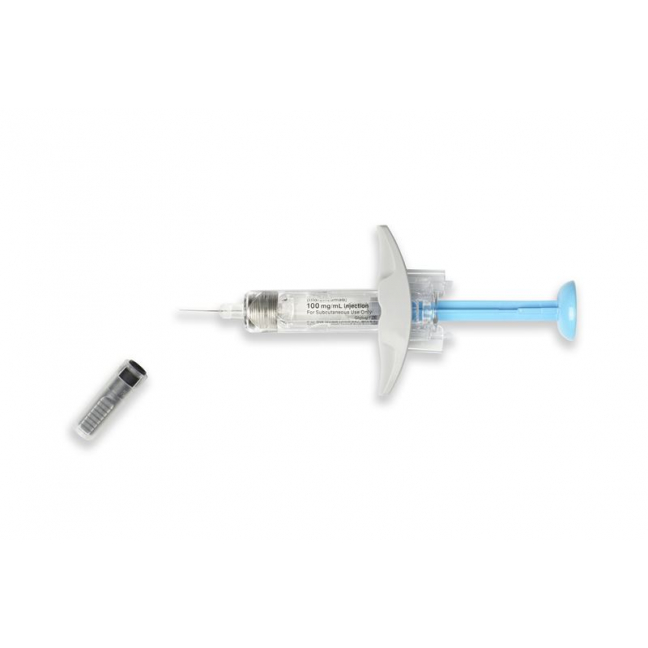


 Deutsch
Deutsch French
French Italian
Italian









































