Emgality Inj Lös 120 мг/мл попередньо заповнена ручка 1 мл
Emgality Inj Lös 120 mg/ml Fertigpen 1 ml
-
92609.26 RUB
Дата доставки:
26.12.2025 - 09.01.2026
При оплате криптовалютой:
Ваша прибыль 9260.93 RUB / 110.00 USDT
- Наявність: В наявності
- Виробник: ELI LILLY (SUISSE) SA
- Модель: 7737146
- ATC-код N02CD02
- EAN 7680670260015
Склад:
Опис
Was ist Emgality und wann wird es angewendet?
Emgality enthält den Wirkstoff Galcanezumab. Galcanezumab ist ein monoklonaler Antikörper. Monoklonale Antikörper sind Eiweisse, die bestimmte Eiweisse im Körper erkennen und an sie binden.
Galcanezumab gehört zu einer Gruppe von Arzneimitteln, die die Aktivität einer natürlich im Körper vorkommenden Substanz, sogennant Calcitonin gene-related peptide (CGRP), hemmen. Eine erhöhte Konzentration von CGRP wurde mit Migräne in Zusammenhang gebracht.
Emgality wird zur Behandlung der Migräne bei erwachsenen Patienten angewendet, bei denen eine vorbeugende Therapie angezeigt ist. Emgality wird auf Verschreibung des Arztes oder der Ärztin angewendet.
Wann darf Emgality nicht eingenommen/angewendet werden?
Emgality darf nicht angewendet werden, wenn Sie auf den Wirkstoff Galcanezumab oder einen der in Emgality enthaltenen Hilfsstoffe (siehe «Was ist in Emgality enthalten?») allergisch sind.
Die Anwendung von Emgality wurde bei Kindern und Jugendlichen unter 18 Jahren nicht untersucht. Es ist nicht bekannt, ob Emgality bei Kindern und Jugendlichen sicher und wirksam ist. Emgality darf daher bei dieser Altersgruppe nicht angewendet werden.
Wann ist bei der Einnahme/Anwendung von Emgality Vorsicht geboten?
Die üblicherweise unter Emgality beobachteten allergischen Reaktionen sind leicht bis mittelschwer (zum Beispiel Hautausschlag oder Juckreiz). Schwerwiegendere Reaktionen wurden aber selten berichtet (siehe «Welche Nebenwirkungen kann Emgality haben?»). Solche schwerwiegenden Überempfindlichkeitsreaktionen können Tage nach der Verabreichung und anhaltend auftreten. Es ist wichtig, die Anwendung von Emgality sofort zu beenden und Ihren Arzt bzw. Ihre Ärztin zu informieren, wenn Sie vermuten, dass Sie eine allergische Reaktion haben.
Da unter der Anwendung von Emgality Schwindel auftreten kann, kann die Reaktionsfähigkeit, die Fahrtüchtigkeit und die Fähigkeit, Werkzeuge oder Maschinen zu bedienen, beeinträchtigt sein. Bitte lenken Sie ein Fahrzeug oder Bedienen Sie Maschinen nur, wenn Ihnen nicht schwindlig ist.
Informieren Sie Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin, wenn Sie
- an anderen Krankheiten leiden
- Allergien haben oder
- andere Arzneimittel (auch selbst gekaufte!) einnehmen.
Darf Emgality während einer Schwangerschaft oder in der Stillzeit eingenommen/angewendet werden?
Emgality wurde bei Schwangeren nicht untersucht. Es ist nicht bekannt, ob Emgality dem ungeborenen Kind schadet, und deshalb sollte Emgality während der Schwangerschaft nicht angewendet werden. Informieren Sie Ihren Arzt bzw. Ihre Ärztin, wenn Sie versuchen, schwanger zu werden, oder denken, möglicherweise schwanger zu sein, während Sie Emgality anwenden.
Es ist nicht bekannt, ob Emgality in die Muttermilch übergeht. Da viele Arzneimittel, darunter Antikörper, in die Muttermilch ausgeschieden werden, kann ein Risiko für das Neugeborene/Kleinkind nicht ausgeschlossen werden. Es ist wichtig, Ihren Arzt bzw. Ihre Ärztin zu informieren, wenn Sie stillen oder vorhaben zu stillen. Ihr Arzt bzw. Ihre Ärztin wird entscheiden, ob Sie das Stillen oder eher die Anwendung von Emgality beenden sollten.
Wie verwenden Sie Emgality?
Die Indikation für die Therapie muss durch einen Arzt oder eine Ärztin mit Erfahrung auf dem Gebiet der Migränebehandlung gestellt werden. Sie werden durch diesen Arzt oder diese Ärztin in der weiteren Behandlung begleitet werden.
Wenden Sie diese Arzneimittel immer genau nach Anweisung Ihres Arztes oder Apothekers bzw. Ihrer Ärztin oder Apothekerin oder der medizinischen Fachperson an. Bitte fragen Sie bei Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin oder bei Ihrer medizinischen Fachperson nach, wenn Sie sich nicht ganz sicher sind, wie das Arzneimittel angewendet wird.
Emgality wird als Injektion unter die Haut (subkutan) verabreicht. Sie und Ihr Arzt bzw. Ihre Ärztin entscheiden, ob Sie sich Emgality selbst injizieren sollen.
Es ist wichtig, dass Sie nicht versuchen, sich selbst zu injizieren, bevor Sie durch Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin oder die medizinische Fachperson ein Training erhalten haben. Eine medizinische Fachperson oder eine im Gebrauch des Emgality Fertigpen ausgebildete Pflegeperson kann Ihnen ebenfalls nach entsprechendem Training Ihre Emgality-Injektion verabreichen.
Lesen Sie die Gebrauchsanweisung für den Fertigpen sorgfältig durch, bevor Sie Emgality verwenden.
Bei der ersten Behandlung werden 240 mg (zwei 120 mg Injektionen) als subkutane Injektion verabreicht.
Nach der ersten Behandlung werden Sie jeden Monat eine 120 mg Dosis (eine Injektion) erhalten.
Ihr Arzt bzw. Ihre Ärztin wird entscheiden, wie lange Sie Emgality anwenden sollen. Wenn Sie Fragen zur Anwendungsdauer von Emgality haben, fragen Sie Ihren Arzt bzw. Ihre Ärztin.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Wenn Sie eine grössere Menge von Emgality angewendet haben, als Sie sollten
Wenn Sie nach der Anfangsdosis von 240 mg, mehr als einmal 120 mg monatlich injiziert haben, wenden Sie sich bitte an Ihren Arzt bzw. Ihre Ärztin.
Wenn Sie die Anwendung von Emgality vergessen haben
Injizieren Sie bei der nächsten Injektion nicht die doppelte Dosis, um eine vergessene Anwendung nachzuholen.
Wenn Sie vergessen haben, die Dosis Emgality zu injizieren, injizieren Sie die vergessene Dosis sobald wie möglich und setzen Sie dann eine monatliche Anwendung ab dem Datum der letzten Injektion fort.
Kinder und Jugendliche
Die Anwendung von Emgality wurde bei Kindern und Jugendlichen unter 18 Jahren bisher nicht untersucht. Es ist nicht bekannt, ob Emgality bei Kindern und Jugendlichen sicher und wirksam ist. Emgality darf daher bei dieser Altersgruppe nicht angewendet werden.
Welche Nebenwirkungen kann Emgality haben?
Schwerwiegende Nebenwirkungen
Selten können schwerwiegende allergische Reaktionen (akute Überempfindichkeitsreaktion sog. Anaphylaxie/ Schwellung der Haut sog. Angioödem) auftreten. Zu den Anzeichen können gehören:
- Schwierigkeiten beim Atmen oder Schlucken;
- Schwellung von Gesicht, Lippen, Zunge oder Hals;
- schweres Jucken der Haut, mit rotem Ausschlag oder Erhebungen (Nesselsucht).
Die folgenden Nebenwirkungen wurden berichtet:
Sehr häufig: Reaktionen an der Injektionsstelle (z.B. gerötete Haut, Schmerzen).
Häufig: Schwindel, Verstopfung, Juckreiz, Hautausschlag.
Gelegentlich: Nesselsucht (erhabene juckende Hautbereiche).
Selten: anaphylaktische (schwerwiegende allergische) Reaktion mit Anzeichen wie Schwellung von Gesicht, Lippen, Zunge oder Hals (siehe «Schwerwiegende Nebenwirkungen»).
Sprechen Sie sofort mit Ihrem Arzt/Ihrer Ärztin bzw. suchen Sie sofort ärztliche Hilfe auf und wenden Sie Emgality nicht mehr an, wenn Sie solche Anzeichen bemerken. Ihr Arzt /Ihre Ärztin wird eine geeignete Therapie einleiten. Auch wenn sich leichte Nebenwirkungen verschlimmern, informieren Sie bitte Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin.
Wenn Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind, sollten Sie Ihren Arzt oder Apotheker, bzw. Ihre Ärztin oder Apothekerin informieren.
Was ist ferner zu beachten?
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden. Ausser Reichweite von Kindern aufbewahren.
Im Kühlschrank (2-8 °C) lagern. Nicht einfrieren.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Wenn die Aufbewahrung im Kühlschrank nicht möglich ist, kann Emgality bis zu insgesamt 7 Tagen bei Temperaturen nicht über 30 °C aufbewahrt werden. Nach der Lagerung ausserhalb des Kühlschranks, nicht mehr in den Kühlschrank zurückstellen. Emgality muss nach 7 Tagen entsorgt werden, falls der Fertigpen ungekühlt aufbewahrt wird.
Jeder Fertigpen ist zum einmaligen Gebrauch bestimmt.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker, bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Emgality enthalten?
Jeder Fertigpen enthält 120 mg Galcanezumab als Wirkstoff in 1 ml Injektionslösung.
Hilfsstoffe: L-Histidin, L-Histidin-Hydrochlorid-Monohydrat, Natriumchlorid, Polysorbat 80, Wasser für Injektionszwecke.
Zulassungsnummer
67026 (Swissmedic).
Wo erhalten Sie Emgality? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Packungen mit 1 oder 2 Fertigpen.
Zulassungsinhaberin
Eli Lilly (Suisse) SA, 1214 Vernier/GE.
Diese Packungsbeilage wurde im Oktober 2019 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Gebrauchsanweisung
Emgality® Injektionslösung im Fertigpen |
|
Bitte lesen Sie die Packungsbeilage (Patienteninformation) und diese Gebrauchsanweisung VOLLSTÄNDIG durch, bevor Sie Ihren Emgality Fertigpen benutzen. |
Wichtig zu wissen:
|
Beschreibung des Emgality Pens |
|
Bevor Sie anfangen | |
Nehmen Sie den Pen aus dem Kühlschrank | Nehmen Sie einen Fertigpen (120 mg) oder zwei Fertigpens (240 mg), falls es sich um die erste Behandlung handelt, aus dem Kühlschrank. Falls es sich nicht um die erste Behandlung handelt, benötigen Sie eine Dosis von 120 mg. Falls Sie eine Packung mit 2 Pens verschrieben bekommen haben, legen Sie die Originalverpackung mit dem Pen, den Sie zur Injektion momentan nicht benötigen, wieder in den Kühlschrank. |
Lassen Sie die Schutzkappe auf dem Pen, bis Sie für die Injektion bereit sind. | |
Nicht schütteln. Damit die Injektion angenehmer ist, lassen Sie den Pen für ca. 30 Minuten bei Raumtemperatur stehen. Nicht in der Mikrowelle aufwärmen, heisses Wasser darüberlaufen lassen oder direktem Sonnenlicht aussetzen. | |
Überprüfen Sie den Pen und die Injektionslösung | Die Lösung im Pen muss klar sein. Die Farbe reicht von farblos bis leicht gelblich. Benutzen Sie den Pen nicht, und entsorgen Sie ihn wie von Ihrem Arzt/Apotheker bzw. Ihrer Ärztin/Apothekerin oder einer medizinischen Fachperson angegeben, wenn
|
Bereiten Sie sich für die Injektion vor | Waschen Sie Ihre Hände mit Seife und Wasser, bevor Sie Emgality injizieren. Stellen Sie sicher, dass Sie ein durchstichsicheres Nadelbehältnis als Entsorgungsbehältnis zur Verfügung haben. |
Wählen Sie Ihre Injektionsstelle. | Ihr Arzt/Apotheker bzw. Ihre Ärztin/Apothekerin oder eine medizinische Fachperson kann Ihnen bei der Auswahl helfen, welche Injektionsstelle für Sie am besten ist. |
|
|
1 Schutzkappe des Pens abnehmen | |
|
|
Es ist normal, Luftblasen im Pen zu sehen. Es hat keinen Einfluss auf die Injektion. Es ist in Ordnung, wenn Sie einen Tropfen Flüssigkeit an der Nadelspitze sehen, nachdem Sie die Schutzkappe entfernt haben. | |
2 Aufsetzen und entriegeln | |
|
Injektion in Rückseite des Oberarms, Bauchdecke, Gesäss oder Oberschenkel |
3 Drücken und festhalten | |
|
Injektion in Rückseite des Oberarms, Bauchdecke, Gesäss oder Oberschenkel |
|
|
Wenn die Nadel nach der Injektion nicht zurückgezogen wird, berühren Sie die Nadel nicht, und setzen Sie die Schutzkappe nicht auf. Entsorgen Sie den Pen, wie unten beschrieben. Wenn sich nach der Injektion ein Tropfen Flüssigkeit oder Blut auf Ihrer Haut befindet, drücken Sie einen Watteball oder ein Stück Gaze auf die Injektionsstelle. Reiben Sie die Injektionsstelle nicht. | |
Nachdem Sie das Arzneimittel injiziert haben Entsorgen des benutzten Pens | |
|
|
| |
Qu’est-ce que Emgality et quand doit-il être utilisé?
Emgality contient le principe actif galcanezumab. Le galcanezumab est un anticorps monoclonal. Les anticorps monoclonaux sont des protéines qui reconnaissent certaines protéines dans le corps et se lient à elles.
Le galcanezumab appartient à un groupe de médicaments qui inhibent l'activité d'une substance naturellement présente dans le corps appelée Calcitonin gene-related peptide (CGRP). Une augmentation de la concentration de CGRP a été associée à la migraine.
Emgality est utilisé pour le traitement de la migraine chez des patients pour lesquels un traitement préventif est indiqué. Emgality est utilisé sur ordonnance d'un médecin.
Quand Emgality ne doit-il pas être pris/utilisé?
Emgality ne doit pas être utilisé si vous êtes allergique au principe actif, le galcanezumab, ou à l'un des excipients contenus dans Emgality (voir «Que contient Emgality?»).
L'utilisation d'Emgality n'a pas été étudiée chez les enfants et les adolescents de moins de 18 ans. On ignore si Emgality est sûr et efficace chez l'enfant et l'adolescent. Par conséquent, Emgality ne doit pas être utilisé dans cette classe d'âge.
Quelles sont les mesures de précaution à observer lors de la prise/ de l’utilisation d’Emgality?
Les réactions allergiques liées à l'utilisation d'Emgality sont habituellement légères à modérées (par exemple éruption cutanée ou démangeaisons). Des réactions plus graves ont cependant été rarement rapportées (voir «Quels effets secondaires Emgality peut-il provoquer?». De telles réactions graves d'hypersensibilité peuvent survenir plusieurs jours après l'administration du médicament et persister. Il est important que vous cessiez immédiatement d'utiliser Emgality et informiez votre médecin si vous soupçonnez que vous faites une réaction allergique.
Comme des vertiges peuvent se manifester lors de l'utilisation d'Emgality, il se peut que la capacité de réaction, l'aptitude à la conduite et la capacité d'utiliser des outils ou des machines soient altérées. Veuillez ne conduire un véhicule ou utiliser des machines que si vous n'avez pas de vertige.
Veuillez informer votre médecin ou votre pharmacien si
- vous souffrez d'une autre maladie,
- vous êtes allergique ou,
- vous prenez déjà d'autres médicaments (même en automédication!).
Emgality peut-il être pris/utilisé pendant la grossesse ou l’allaitement?
Emgality n'a pas été étudié chez la femme enceinte. On ignore si Emgality peut être néfaste pour l'enfant à naître, par conséquent Emgality ne doit pas être utilisé pendant la grossesse. Informez votre médecin si vous envisagez une grossesse ou si vous pensez possiblement être enceinte pendant que vous utilisez Emgality.
On ignore si Emgality passe dans le lait maternel. Comme de nombreux médicaments, notamment des anticorps, sont excrétés dans le lait maternel, on ne peut exclure un risque pour le nouveau-né/le petit enfant. Il est important que vous informiez votre médecin si vous allaitez ou envisagez d'allaiter. Votre médecin décidera si vous devez arrêter d'allaiter ou plutôt cesser d'utiliser Emgality.
Comment utiliser Emgality?
L'indication pour le traitement doit être posée par un médecin expérimenté dans le domaine du traitement de la migraine. Ce médecin vous accompagnera dans la suite de votre traitement.
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin, pharmacien ou un professionnel de santé. Demandez à votre médecin, votre pharmacien ou à un professionnel de santé si vous n'êtes pas tout-à-fait certain de la façon d'utiliser le médicament.
Emgality doit être injecté sous la peau (injection sous-cutanée). Vous et votre médecin déciderez si vous pouvez vous injecter vous-même Emgality.
Il est important de ne pas essayer de vous injecter vous-même ce médicament si vous n'avez pas été formé par votre médecin, votre pharmacien ou un professionnel de santé. Un professionnel de santé ou un soignant formé à l'utilisation du stylo prérempli d'Emgality peut également vous injecter le médicament après avoir suivi une formation adaptée.
Lisez attentivement le manuel d'utilisation du stylo prérempli avant d'utiliser Emgality.
Lors de la première administration, 240 mg (deux injections de 120 mg) sont injectés par voie sous-cutanée.
Après la première administration, vous recevez chaque mois une dose de 120 mg (une injection).
Votre médecin décidera de la durée de votre traitement par Emgality. Si vous avez des questions concernant la durée d'utilisation d'Emgality, veuillez consulter votre médecin.
Ne changez pas de votre propre chef le dosage prescrit. Si vous avez l'impression que l'action du médicament est trop forte ou bien trop faible, veuillez en parler à votre médecin ou à votre pharmacien.
Si vous avez utilisé plus d'Emgality que vous n'auriez dû
Si, après la dose initiale de 240 mg, vous avez injecté plus que 120 mg une fois par mois, veuillez vous adresser à votre médecin.
Si vous avez oublié d'utiliser Emgality
N'injectez pas une double dose à la prochaine injection pour compenser la dose que vous avez oublié de prendre.
Si vous avez oublié l'injection d'une dose d'Emgality, injectez la dose oubliée dès que possible puis continuez avec une administration une fois par mois dès la date de la dernière injection.
Enfants et adolescents
L'utilisation d'Emgality n'a pas été étudiée à ce jour chez les enfants et les adolescents de moins de 18 ans. On ignore si Emgality est sûr et efficace chez l'enfant et l'adolescent. Par conséquent, Emgality ne doit pas être utilisé dans cette classe d'âge.
Quels effets secondaires Emgality peut-il provoquer?
Effets secondaires graves
Rarement, des réactions allergiques graves (réaction d'hypersensibilité aiguë aussi appelée anaphylaxie/gonflement de la peau aussi appelé angiooedème) peuvent survenir. Les signes peuvent inclure:
- difficultés à respirer ou à avaler;
- gonflement du visage, des lèvres, de la langue ou de la gorge;
- démangeaisons sévères de la peau avec une éruption cutanée rouge ou des bosses cutanées (urticaire).
Les effets secondaires suivants ont été rapportés:
Très fréquent: réactions au site d'injection (par ex. rougeur cutanée, douleurs).
Fréquent: vertiges, constipation, démangeaisons, éruption cutanée.
Occasionnel: urticaire (zones de peau en relief qui démangent).
Rare: réaction anaphylactique (allergique grave) avec des signes tels que gonflement du visage, des lèvres, de la langue ou de la gorge (voir «Effets secondaires graves»).
Parlez-en immédiatement à votre médecin ou demandez immédiatement une assistance médicale et n'utilisez plus Emgality si vous remarquez de tels signes. Votre médecin initiera un traitement approprié.
Même si des effets secondaires mineurs s'aggravent, veuillez informer votre médecin ou votre pharmacien.
Si vous remarquez des effets secondaires qui ne sont pas mentionnés dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
A quoi faut-il encore faire attention?
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient. Conserver hors de la portée des enfants.
Conserver au réfrigérateur (2-8 °C). Ne pas congeler.
Conserver dans l'emballage original afin de protéger le contenu de la lumière.
Si la conservation au réfrigérateur n'est pas possible, Emgality peut être conservé pendant une période maximale de 7 jours à une température ne dépassant pas 30 °C. Après la conservation hors du réfrigérateur, ne plus remettre le médicament dans le réfrigérateur. Emgality doit être éliminé après 7 jours si le stylo a été conservé non-réfrigéré.
Chaque stylo prérempli est à usage unique.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien qui disposent d'une information détaillée destinée aux professionnels.
Que contient Emgality?
Chaque stylo prérempli contient 120 mg de galcanezumab comme principe actif dans 1 ml de solution injectable.
Excipients: L-histidine, chlorhydrate de L-histidine monohydraté, chlorure de sodium, polysorbate 80, eau pour préparations injectables.
Numéro d’autorisation
67026 (Swissmedic).
Où obtenez-vous Emgality? Quels sont les emballages à disposition sur le marché?
En pharmacie, uniquement sur prescription médicale.
Emballages de 1 ou 2 stylos préremplis.
Titulaire de l’autorisation
Eli Lilly (Suisse) SA, 1214 Vernier/GE.
Cette notice d'emballage a été vérifiée pour la dernière fois en octobre 2019 par l'autorité de contrôle des médicaments (Swissmedic).
Manuel d’utilisation
Emgality® Solution injectable en stylo prérempli |
|
Veuillez lire ENTIEREMENT la notice d’emballage (Information destinée au patient) et ce mode d’emploi avant d’utiliser votre stylo prérempli Emgality. |
Information importante:
|
Description du stylo Emgality |
|
Avant de commencer | |
Sortez le stylo du réfrigérateur | Sortez du réfrigérateur un stylo prérempli (120 mg) ou deux stylos préremplis (240 mg) s’il s’agit du premier traitement. S’il ne s’agit pas du premier traitement, il vous faut une dose de 120 mg. Si vous avez reçu un emballage contenant 2 stylos, remettez dans le réfrigérateur l’emballage original avec le stylo que vous n’utilisez pas pour le moment pour l’injection. |
Laissez le capuchon de la base sur le stylo jusqu’à ce que vous soyez prêt pour l’injection. | |
N’agitez pas le stylo. Pour une injection plus confortable, laissez le stylo se réchauffer à température ambiante pendant 30 minutes. Ne mettez pas votre stylo au micro-ondes pour le réchauffer, ne faites pas couler de l'eau chaude dessus, ne l'exposez pas à la lumière directe du soleil. | |
Inspectez le stylo et la solution injectable | La solution dans le stylo doit être limpide. La solution est incolore à légèrement jaunâtre. N’utilisez pas le stylo et jetez-le conformément aux directives de votre médecin, de votre pharmacien ou d'un professionnel de santé, si
|
Préparez-vous pour l’injection | Lavez-vous les mains avec du savon et de l’eau avant de vous injecter Emgality. Vérifiez que vous avez un conteneur à aiguilles résistant à la perforation à disposition pour l’élimination. |
Choisissez votre site d’injection. | Votre médecin, votre pharmacien ou un professionnel de santé peut vous aider à choisir le site d’injection qui vous convient le mieux. |
|
|
1 Retirez le capuchon du stylo | |
|
|
Il est normal de voir des bulles d’air dans le stylo. Cela n’a pas d’influence sur l’injection. Il est normal que vous voyiez une goutte de liquide à la pointe de l’aiguille après avoir retiré le capuchon de la base. | |
2 Positionnez et déverrouillez | |
|
Injection à l’arrière du bras, dans l’abdomen, la fesse ou la cuisse |
3. Appuyez et maintenez enfoncé | |
|
Injection à l’arrière du bras, dans l’abdomen, la fesse ou la cuisse |
|
|
Si l’aiguille n’est pas rétractée après l’injection, ne touchez pas l’aiguille et ne remettez pas le capuchon. Jetez le stylo comme décrit ci-dessous. Si, après l’injection, il y a une goutte de liquide ou de sang sur votre peau, appuyez avec un morceau de coton ou une compresse de gaze sur le site d’injection. Ne frottez pas le site d’injection. | |
Après l’injection de votre médicament Jetez le stylo utilisé | |
|
|
| |
Che cos'è Emgality e quando si usa?
Emgality contiene la sostanza attiva galcanezumab. Galcanezumab è un anticorpo monoclonale. Gli anticorpi monoclonali sono proteine che riconoscono e si legano a determinate proteine presenti nell'organismo.
Galcanezumab fa parte di un gruppo di farmaci che inibiscono l'attività di una sostanza presente naturalmente nell'organismo, il cosiddetto peptide correlato al gene della calcitonina (CGRP). Un'elevata concentrazione di CGRP è stata messa in relazione con l'emicrania.
Emgality viene utilizzato per il trattamento dell'emicrania in pazienti adulti in cui è indicata una terapia preventiva. Emgality viene utilizzato dietro prescrizione medica.
Quando non si può assumere/utilizzare Emgality?
Emgality non deve essere assunto in caso di allergia alla sostanza attiva galcanezumab o a una delle sostanze ausiliarie contenute in Emgality (vedere «Cosa contiene Emgality?»).
L'assunzione di Emgality non è stata studiata nei bambini e negli adolescenti di età inferiore a 18 anni. Non è noto se Emgality sia sicuro ed efficace nei bambini e negli adolescenti. Per questo motivo Emgality non deve essere somministrato in questa fascia di età.
Quando è richiesta prudenza nell'assunzione/utilizzo di Emgality?
Le reazioni allergiche osservate con Emgality sono solitamente da lievi a moderate (come eruzione cutanea o prurito). Reazioni più gravi sono state tuttavia segnalate raramente (vedi «Quali effetti collaterali può avere Emgality?»). Tali gravi reazioni di ipersensibilità possono verificarsi giorni dopo la somministrazione e persistere. È importante che interrompa immediatamente la somministrazione di Emgality e informi il suo medico se sospetta di avere una reazione allergica.
Poiché l'assunzione di Emgality può causare vertigini, la capacità di condurre veicoli e usare macchine, così come la capacità di reazione, possono risultare compromesse. Guidi quindi veicoli o utilizzi macchinari solo se non avverte vertigini.
Informi il suo medico o il suo farmacista se
- soffre di altre malattie
- soffre di allergie o
- assume altri medicamenti (anche se acquistati di sua iniziativa!).
Si può assumere/utilizzare Emgality durante la gravidanza o l'allattamento?
Emgality non è stato studiato nelle donne in gravidanza. Non è noto se Emgality possa avere effetti dannosi per il feto e quindi Emgality non dovrebbe essere usato durante la gravidanza. Informi il suo medico se è in corso una gravidanza o se sospetta o sta pianificando una gravidanza mentre sta utilizzando Emgality.
Non è noto se Emgality sia escreto nel latte materno. Molti medicamenti, fra cui gli anticorpi, vengono escreti nel latte materno, pertanto non si possono escludere rischi per i neonati/lattanti. È importante che informi il suo medico se sta allattando o prevede di allattare. Il medico deciderà se deve essere interrotto l'allattamento o piuttosto l'assunzione di Emgality.
Come usare Emgality?
L'indicazione alla terapia deve essere stabilita da un medico con esperienza nel trattamento dell'emicrania. Il medico la seguirà nelle successive fasi del trattamento.
Usi questo medicamento seguendo sempre le istruzioni del medico, del farmacista o dell'operatore sanitario. In caso di dubbi sull'utilizzo del farmaco, consulti il medico, il farmacista o l'operatore sanitario.
Emgality è somministrato mediante un'iniezione sotto la cute (iniezione per via sottocutanea). Lei e il suo medico dovrete decidere se può iniettarsi Emgality da solo.
È importante che non cerchi di iniettarsi il medicamento da solo se non ha ancora ricevuto adeguate istruzioni dal suo medico o farmacista o da un operatore sanitario. Emgality penna preriempita può essere somministrato anche da un operatore sanitario o da una persona che si prende cura di lei dopo aver ricevuto le adeguante istruzioni.
Legga attentamente le istruzioni per l'uso della penna preriempita prima di usare Emgality.
Al primo trattamento vengono somministrati 240 mg (due iniezioni da 120 mg) sotto forma di iniezione sottocutanea.
Dopo il primo trattamento riceverà una dose da 120 mg (un'iniezione) ogni mese.
Il suo medico deciderà per quanto tempo dovrà usare Emgality. In caso di domande sulla durata dell'utilizzo di Emgality, si rivolga al medico.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Se usa più Emgality di quanto deve
Se dopo la dose iniziale di 240 mg ha assunto più di una dose singola da 120 mg al mese, si rivolga al suo medico.
Se dimentica di usare Emgality
Non prenda una dose doppia per compensare un'iniezione dimenticata.
Se ha dimenticato di iniettarsi una dose di Emgality, si inietti la dose mancante al più presto e poi si somministri la dose successiva un mese dopo tale data.
Bambini e adolescenti
L'assunzione di Emgality non è stata finora studiata nei bambini e negli adolescenti di età inferiore a 18 anni. Non è noto se Emgality sia sicuro ed efficace nei bambini e negli adolescenti. Per questo motivo Emgality non deve essere somministrato in questa fascia di età.
Quali effetti collaterali può avere Emgality?
Effetti collaterali gravi
Raramente possono verificarsi gravi reazioni allergiche (reazione acuta di ipersensibilità, la cosiddetta anafilassi / gonfiore cutaneo, il cosiddetto angioedema). Sintomi che possono presentarsi:
- difficoltà a respirare o deglutire;
- gonfiore del viso, delle labbra, della lingua o della gola;
- prurito intenso alla cute con eruzione e arrossamento o pomfi in rilievo (orticaria).
Sono stati segnalati i seguenti effetti collaterali:
Molto comune: reazioni nella sede di iniezione (ad es. arrossamenti, dolori).
Comune: vertigine, stipsi, prurito, eruzione cutanea.
Non comune: orticaria (rilievi cutanei accompagnati da prurito).
Raro: reazione anafilattica (allergica grave) con sintomi quali gonfiore del viso, delle labbra, della lingua o della gola (vedi “Effetti collaterali gravi”). Consultare immediatamente il proprio medico o richiedere assistenza medica immediata e interrompere l'assunzione di Emgality se si osservano tali sintomi. Il suo medico inizierà una terapia appropriata.
Informi il suo medico o farmacista anche nel caso in cui eventuali lievi effetti collaterali dovessero peggiorare.
Se osserva effetti indesiderati qui non descritti dovrebbe informare il suo medico o il suo farmacista.
Di che altro occorre tener conto?
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore. Tenere fuori dalla portata dei bambini.
Conservare in frigorifero (2-8 °C). Non congelare.
Conservare nella confezione originale per proteggere il medicinale dalla luce.
Nel caso in cui non sia possibile conservare il medicinale in frigorifero, Emgality può essere conservato fino a un totale di 7 giorni a temperature non superiori a 30 °C. Una volta conservato fuori dal frigorifero, non rimetterlo in frigorifero. La penna preriempita Emgality deve essere smaltita dopo 7 giorni se è stata conservata fuori dal frigorifero.
Ogni penna preriempita è monouso. Il medico o il farmacista che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Emgality?
Ogni penna preriempita contiene 120 mg di galcanezumab come sostanza attiva in 1 ml di soluzione iniettabile.
Eccipienti: L-istidina, L-istidina monoidrato cloridrato, cloruro di sodio, polisorbato 80, acqua per preparazioni iniettabili.
Numero dell’omologazione
67026 (Swissmedic).
Dove è ottenibile Emgality? Quali confezioni sono disponibili?
In farmacia dietro presentazione della prescrizione medica.
Confezioni da 1 o 2 penne preriempite.
Titolare dell’omologazione
Eli Lilly (Suisse) SA, 1214 Vernier/GE.
Questo foglietto illustrativo è stato controllato l'ultima volta nell'ottobre 2019 dall'autorità competente in materia di medicamenti (Swissmedic).
Istruzioni per l’uso
Emgality® Galcanezumab 120 mg Soluzione iniettabile in una penna preriempita Uso sottocutaneo |
|
Legga INTERAMENTE il foglietto illustrativo (informazione destinata ai pazienti) e le presenti istruzioni d'uso prima di utilizzare la penna preriempita Emgality. |
Importante da sapere: |
|
Descrizione della penna Emgality |
|
Preparazione | |
Prenda la penna dal frigorifero | Estragga una penna preriempita (120 mg) o due penne preriempite (240 mg), se si tratta del primo trattamento, dal frigorifero. Se non si tratta del primo trattamento, necessita di una dose di 120 mg. Se le è stata prescritta una confezione da 2 penne, ricollochi in frigorifero la confezione originale con la penna che ha utilizzato per l'iniezione. |
Lasci il cappuccio sulla penna fino a quando non è pronto a fare l’iniezione. | |
Non agitare. Affinché l'iniezione risulti più gradevole, lasci la penna per circa 30 minuti a temperatura ambiente. Non riscaldare nel forno a microonde, versarci sopra dell'acqua calda o esporla alla luce diretta del sole. | |
Controlli la penna e la soluzione iniettabile | La soluzione all'interno della penna deve essere limpida. Il colore va dall'incolore al leggermente giallo. Non utilizzi la penna e la smaltisca come indicato dal suo medico/farmacista o da un operatore sanitario, se
|
Si prepari per l'iniezione | Si lavi le mani con acqua e sapone prima di praticare l’iniezione con Emgality. Si assicuri di avere a disposizione un contenitore per aghi antiperforante come contenitore per lo smaltimento. |
Scelga il sito d’iniezione | Il suo medico/farmacista o un operatore sanitario può esserle d'aiuto nel decidere il sito di iniezione più idoneo per lei. |
|
|
1 Rimuova il cappuccio di protezione della penna. | |
|
|
È normale vedere bolle d'aria nella penna. Non hanno alcun influsso sull'iniezione. Non si preoccupi se vede una goccia di liquido sulla punta dell'ago dopo avere rimosso il cappuccio. | |
2 Posizionare e sbloccare | |
|
Iniezione sulla parte posteriore del braccio, addome, glutei o coscia |
3 Premere e tenere fermo | |
|
Iniezione sulla parte posteriore del braccio, addome, glutei o coscia |
|
|
Se l'ago non si ritrae dopo l'iniezione, non tocchi l’ago né rimetta il cappuccio alla base. Smaltisca la penna come descritto di seguito. Se dopo l'iniezione è presente una goccia di liquido o di sangue sulla cute, prema un batuffolo di ovatta o un pezzo di garza sul sito di iniezione. Non strofini il sito d’iniezione. | |
Una volta iniettato il medicamento Smaltire la penna utilizzata | |
|
|
| |
Zusammensetzung
Wirkstoffe
Galcanezumab (aus CHO [Chinese Hamster Ovary]-Zellen hergestellter rekombinanter humanisierter monoklonaler Antikörper).
Hilfsstoffe
L-Histidin, L-Histidin-Hydrochlorid-Monohydrat, Natriumchlorid, Polysorbat 80, Wasser für Injektionszwecke.
Darreichungsform und Wirkstoffmenge pro Einheit
Emgality 120 mg Injektionslösung im Fertigpen
1 Fertigpen zu 1 ml enthält 120 mg Galcanezumab (120 mg/ml).
Indikationen/Anwendungsmöglichkeiten
Prophylaktische Behandlung der Migräne bei Erwachsenen, sofern diese indiziert ist.
Dosierung/Anwendung
Die Indikation für die Therapie muss durch einen Arzt oder eine Ärztin mit Erfahrung auf dem Gebiet der Migränebehandlung gestellt und durch diese in der weiteren Behandlung begleitet werden.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Übliche Dosierung
Die empfohlene Dosis beträgt 120 mg als subkutane Injektion einmal monatlich. Zu Beginn der Behandlung ist eine einmalige Anfangsdosis von 240 mg (2 Injektionen) zu verabreichen.
Patienten müssen angewiesen werden, eine vergessene Dosis so bald wie möglich nachzuholen und dann die monatliche Anwendung ab dem Datum der letzten Injektion wieder aufzunehmen.
Bei fehlendem Ansprechen auf die Therapie oder mindestens einmal pro Jahr sollte eine Reevaluation hinsichtlich Notwendigkeit der Fortführung der Therapie vorgenommen werden.
Die Daten zur Sicherheit und Wirksamkeit über 12 Monaten hinaus sind limitiert.
Emgality wird subkutan in die Bauchdecke oder den Oberschenkel, durch den Patienten selbst oder in die Rückseite des Oberarms oder ins Gesäss durch Fachpersonen oder im Gebrauch des Fertigpen ausgebildete Pflegepersonen injiziert.
Wenn mehrere Injektionen an einem Körperbereich vorgenommen werden, sollte die Injektion an derselben Stelle vermieden werden. Emgality sollte nicht in Stellen mit empfindlicher, verletzter, geröteter oder verhärteter Haut injiziert werden.
Spezielle Dosierungsanweisungen
Patienten mit Nierenfunktionsstörungen
Bei Patienten mit leichter oder mittelschwerer Einschränkung der Nierenfunktion ist keine Dosisanpassung erforderlich. Emgality wurde bei Patienten mit schwerer Einschränkung der Nierenfunktion nicht untersucht (siehe «Pharmakokinetik»).
Patienten mit Leberfunktionsstörungen
Emgality wurde bei Patienten mit eingeschränkter Leberfunktion nicht untersucht. Bei Patienten mit Leberinsuffizienz wird keine Dosisanpassung empfohlen, da Galcanezumab, ein humanes Immunglobulin G, nicht von Cytochrom P450-Enzymen metabolisiert wird und seine Clearance nicht in wesentlichem Umfang über die Leber erfolgt (siehe «Pharmakokinetik»).
Ältere Patienten (>65 Jahre)
Dosisanpassungen bei älteren Patienten werden nicht empfohlen, weil keine ausreichenden Daten vorliegen, um eine Aussage darüber zu treffen, ob solche Patienten anders reagieren als jüngere Patienten.
Pädiatrie (unter 18 Jahre)
Die Sicherheit und Wirksamkeit von Emgality bei Kindern und Jugendlichen ist nicht untersucht worden. Emgality darf daher in dieser Altersgruppe nicht angewendet werden.
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und Vorsichtsmassnahmen
Schwerwiegende Überempfindlichkeit
Schwerwiegende Überempfindlichkeitsreaktionen, einschliesslich Fälle von Anaphylaxie, Angioödem und Urtikaria wurden berichtet. Falls eine schwerwiegende Überempfindlichkeitsreaktion auftritt, sollte die Anwendung von Emgality sofort unterbrochen und eine geeignete Therapie begonnen werden. Schwerwiegende Überempfindlichkeitsreaktionen können Tage nach der Verabreichung und anhaltend auftreten.
Pädiatrie (unter 18 Jahre)
Die Sicherheit und Wirksamkeit von Emgality bei Kindern und Jugendlichen ist nicht untersucht worden. Emgality darf daher in dieser Altersgruppe nicht angewendet werden.
Interaktionen
Es wurden keine Interaktionsstudien durchgeführt.
Auf Grundlage der Eigenschaften von Galcanezumab werden keine pharmakokinetischen Interaktionen erwartet.
Schwangerschaft/Stillzeit
Schwangerschaft
Es liegen unzureichende Daten zur Anwendung von Emgality bei Schwangeren vor. Studien zur Entwicklungstoxizität bei trächtigen Kaninchen und Ratten ergaben keine Hinweise auf foetale Schädigung. Es ist bekannt, dass humanes Immunglobulin (IgG) plazentagängig ist; daher kann Galcanezumab von der Mutter auf den sich entwickelnden Foetus übertragen werden. Während einer Schwangerschaft sollte Emgality nicht angewendet werden, es sei denn es ist klar notwendig.
Stillzeit
Es ist nicht bekannt, ob Emgality in die Muttermilch ausgeschieden wird. Da viele Arzneimittel, darunter Antikörper, in die Muttermilch ausgeschieden werden, kann ein Risiko für das Neugeborene/Kleinkind nicht ausgeschlossen werden. Daher sollte eine Entscheidung darüber getroffen werden, ob abgestillt oder auf die Behandlung mit Emgality verzichtet werden soll, wobei der Nutzen der Behandlung mit Emgality für die Mutter und der Nutzen des Stillens für den Säugling berücksichtigt werden müssen.
Fertilität
Es liegen keine Daten zu der Wirkung von Emgality auf die Fertilität beim Menschen vor. Tierexperimentelle Studien zeigten keine Hinweise auf schädliche Wirkungen in Bezug auf die Fertilität auf (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt. Emgality kann einen Einfluss auf die Fahrtüchtigkeit und die Fähigkeit, Werkzeuge oder Maschinen zu bedienen, haben. Schwindel kann nach der Verabreichung von Galcanezumab auftreten (siehe «Unerwünschte Wirkungen»).
Unerwünschte Wirkungen
Die am häufigsten berichteten Nebenwirkungen waren Schmerzen an der Injektionsstelle (10.1% mit 120 mg, 11.6% mit 240 mg) und Reaktionen an der Injektionsstelle (9.9% mit 120 mg, 14.5% mit 240 mg). Die Mehrzahl der Ereignisse an der Injektionsstelle (Erythem, Juckreiz, Blutergüsse, Schwellung) war leicht bis mittelschwer und führte nicht zum Absetzen von Emgality. Die meisten Reaktionen an der Injektionsstelle wurden innerhalb von einem Tag berichtet und verschwanden meist innerhalb weniger Tage. Bei den meisten Patienten, die Schmerzen an der Injektionsstelle berichteten, trat das Ereignis innerhalb von einer Stunde nach Injektion auf und ging am selben Tag zurück.
In klinischen Studien wurden selten schwerwiegende Fälle von Urtikaria zu Galcanezumab berichtet (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Insgesamt haben 2586 Patienten in klinischen Studien zur Prophylaxe der Migräne Emgality erhalten, entsprechend 1250.6 Patientenjahren Exposition. Insgesamt haben 1647 Patienten ≥6 monatliche Dosen (120 oder 240 mg) Galcanezumab erthalten; 279 Patienten haben 12 monatliche Dosen (120 oder 240 mg) erhalten.
Drei placebokontrollierte Studien Phase 3 zur Prophylaxe der Migräne wurden kombiniert ausgewertet, um die Sicherheit von Emgality im Vergleich zu Placebo bis zu 6 Monate nach Beginn der Therapie zu untersuchen. In der doppelblinden Phase haben insgesamt 1435 Patienten Galcanezumab erhalten, entsprechend 536.3 Patientenjahren Exposition.
Liste der in klinischen Studien und nach der Markteinführung berichteten Nebenwirkungen
Die Häufigkeiten der unerwünschten Wirkungen werden wie folgt angegeben: «sehr häufig» (≥1/10), «häufig» (≥1/100 bis <1/10,), «gelegentlich» (≥1/1000 bis <1/100,), «selten» (≥1/10'000 bis <1/1000,), «sehr selten» (<1/10'000).
Erkrankungen des Immunsystems
Selten: Anaphylaxie, Angioödem.
Erkrankungen des Ohrs und des Labyrinths
Häufig: Schwindel.
Erkrankungen des Gastrointestinaltrakts
Häufig: Obstipation.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Juckreiz, Hautausschlag.
Gelegentlich: Urtikaria.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Schmerzen an der Injektionsstelle (10.1% mit 120 mg, 11.6% mit 240 mg), Reaktionen an der Injektionsstelle (9.9% mit 120 mg, 14.5% mit 240 mg).
Immunogenität
In den klinischen Studien betrug die Inzidenz der Entwicklung von Antikörpern gegen den Wirkstoff während der doppelblinden Behandlungsphase 4.8% (33/688) bei Patienten unter Behandlung mit Galcanezumab 120 mg einmal monatlich, und alle ausser einem hatten in vitro neutralisierende Aktivität. Bei Behandlung über 12 Monate entwickelten 12.5% (16/128) der Patienten unter Galcanezumab 120 mg Antikörper gegen den Wirkstoff. Die Titer waren meist niedrig und wurden in-vitro positiv auf neutralisierende Aktivität getestet.
Die Anwesenheit von Antikörpern gegen den Wirkstoff hatte keinen Einfluss auf die Pharmakokinetik, Wirksamkeit oder Sicherheit von Galcanezumab. Die verfügbaren Daten sind jedoch nicht ausreichend, um diesbezüglich verlässliche Aussagen treffen zu können.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Bei Menschen wurden Dosen von bis zu 600 mg subkutan ohne dosislimitierende Toxizität verabreicht. Bei Überdosierung wird empfohlen, Patienten auf Anzeichen und Symptome unerwünschter Wirkungen zu überwachen und unverzüglich eine angemessene symptomatische Behandlung einzuleiten.
Eigenschaften/Wirkungen
ATC-Code
N02CD02
Wirkungsmechanismus
Galcanezumab ist ein rekombinanter humanisierter monoklonaler IgG4 Antikörper. Er bindet an Calcitonin-Gen-abhängige Peptide (calcitonin gene-related peptide, CGRP) und hemmt deren biologische Aktivität, ohne den CGRP-Rezeptor zu blockieren. Erhöhte CGRP-Konzentrationen im Blut wurden mit Migräne in Zusammenhang gebracht. Zudem können CGRP-Infusionen bei manchen Personen mit Migräne in der Vorgeschichte einen Migräne-ähnlichen Anfall auslösen.
Pharmakodynamik
Galcanezumab bindet CGRP mit hoher Affinität (KD = 31 pM) und hoher Spezifität (>10'000-fach im Vergleich zu den verwandten Peptiden Adrenomedullin, Amylin, Calcitonin und Intermedin).
Klinische Wirksamkeit
Die Wirksamkeit und Sicherheit von Emgality wurde in drei randomisierten, placebokontrollierten, doppelblinden Studien Phase 3 bei erwachsenen Patienten (N=2886) nachgewiesen. Die zwei Studien zu episodischer Migräne (EVOLVE-1 und EVOLVE-2) schloss Patienten ein, die die Kriterien der Internationalen Klassifikation der Kopfschmerzerkrankungen (International Classification of Headache Disorders, ICHD) für Diagnose einer Migräne mit oder ohne Aura erfüllten, mit 4 bis 14 Tagen Migräne-Kopfschmerz pro Monat. Die Studie zu chronischer Migräne (REGAIN) schloss Patienten mit chronischer Migräne gemäss ICHD Kriterien und ≥15 Tagen Kopfschmerz pro Monat ein, wovon mindestens 8 die Merkmale einer Migräne aufwiesen. Patienten mit kürzlich aufgetretenen akuten kardiovaskulären Ereignissen (einschliesslich Myokard Infarkt, instabiler Angina, Koronararterien Bypass (CABG), Schlaganfall, tiefe venöse Thromboembolie) und/oder Patienten, bei denen ein schweres kardiovaskuläres Risiko besteht, wurden von den klinischen Studien mit Galcanezumab ausgeschlossen. Patienten >65 Jahre wurden auch ausgeschlossen. Die Studien EVOLVE-1 und EVOLVE-2 hatten eine 6-monatige doppelblinde, placebokontrollierte Behandlungsdauer; die REGAIN Studie enthielt eine 3-monatige doppelblinde, placebokontrollierte Behandlungsperiod, gefolgt von einer offenen Verlängerung über 9 Monate. Die Patienten erhielten Placebo, Emgality 120 mg/Monat (mit einer Anfangsdosis von 240 mg im ersten Monat) oder Emgality 240 mg/Monat und durften Arzneimittel zur Akuttherapie der Migräne anwenden. Zu Studienbeginn betrug die mittlere Anzahl der Tage mit Migräne-Kopfschmerzen 9.13 pro Monat in den Studien EVOLVE-1 und EVOLVE-2 (episodische Migräne) und 19.41 pro Monat in der REGAIN Studie (chronische Migräne), und war innerhalb jeder Studie in allen Behandlungsgruppen ähnlich. In der REGAIN Studie (chronische Migräne) setzten etwa 15% der Patienten die Begleittherapie mit Topiramat oder Propranolol (gemäss Protokoll zur Prophylaxe der Migräne erlaubt) fort, und 64% zeigten zu Studienbeginn einen übermässigen Gebrauch von Arzneimitteln gegen akute Kopfschmerzen. Ungefähr ein Drittel der Patienten in den Studien hatten mindestens 1 vorheriges Versagen bei einer Migräne-Prophylaxe-Behandlung aus Wirksamkeitsgründen und ungefähr 16% der Patienten in den Studien hatten mindestens 2 vorherigen Versagen bei einer prophylaktischen Behandlung aus Wirksamkeitsgründen.
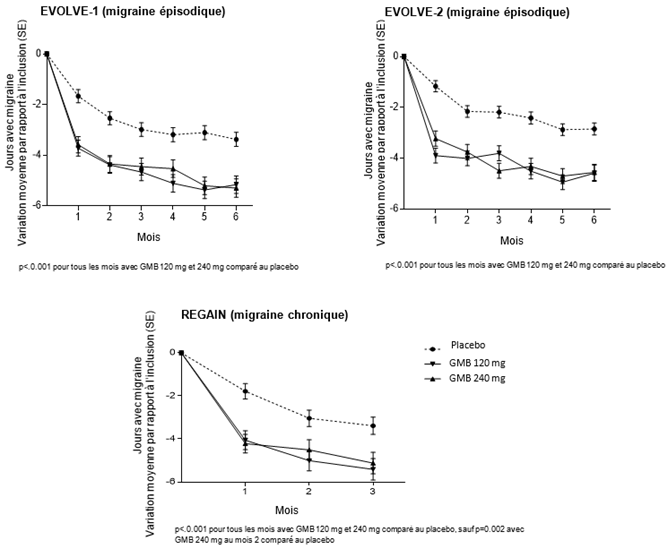
Primärer Wirksamkeitsparameter in allen 3 Studien war die allgemeine mittlere Veränderung der Anzahl der Tage mit Migräne-Kopfschmerz (migraine headache days, MHD) pro Monat im Vergleich zum Ausgangswert. Beide Behandlungsgruppen, Emgality 120 mg und 240 mg, zeigten statistisch signifikante und klinisch relevante Verbesserungen gegenüber dem Ausgangswert im Vergleich zu Placebo (siehe Tabelle).
Tabelle: Wirksamkeit und funktionelle Endpunkte in Phase 3 Studien
Ergebnisse | EVOLVE-1 – Episodische Migräne | EVOLVE-2 - Episodische Migräne | REGAIN – Chronische Migräne | ||||||
Emgality | Placebo N=425 | Emgality | Placebo N=450 | Emgality | Placebo N=538 | ||||
120 mg N=210 | 240 mg N=208 | 120 mg N=226 | 240 mg N=220 | 120 mg N=273 | 240 mg N=274 | ||||
Wirksamkeitsergebnisse (bewertet über Monate 1-6 für EVOLVE-1 und 2 und über Monate 1-3 für REGAIN) | |||||||||
Mittlere Reduktion der Tage mit Migräne-Kopfschmerz pro Monat gegenüber dem Ausgangswert | -4.73a | -4.57a | -2.81 | -4.29a | -4.18a | -2.28 | -4.83a | -4.62a | -2.74 |
Mittlerer Prozentsatz von Patienten, die ≥50% Ansprechrate erreichten | 62.3a | 60.9a | 38.6 | 59.3a | 56.5a | 36.0 | 27.6a | 27.5a | 15.4 |
Mittlere Reduktion der Tage mit Migräne-Kopfschmerz pro Monat, an denen eine Akutmedikation angewendet wurde. Veränderung gegenüber dem Ausgangswert | -3.96a | -3.76a | -2.15 | -3.67a | -3.63a | -1.85 | -4.74b | -4.25a | -2.23 |
Patientenberichtete Endpunkte (bewertet über Monate 4-6 für EVOLVE-1 und 2 und im Monat 3 für REGAIN) | |||||||||
Funktionaler Einfluss der Migräne auf Alltagsaktivitäten. Mittlere Verbesserung gegenüber dem Ausgangswert (MSQ Role Function-Restrictive)c | 32.43a | 32.09a | 24.69 | 28.47a | 27.04a | 19.65 | 21.81b | 23.05a | 16.76 |
a p <0.001 (statistisch signifikant versus Placebo nach Adjustierung für Multiplizität)
b p <0.001 (nicht statistisch signifikant versus Placebo nach Adjustierung für Multiplizität)
c N = 189 für Emgality 120 mg, N = 184 für Emgality 240 mg und N = 377 für Placebo in EVOLVE-1
N = 213 für Emgality 120 mg, N = 210 für Emgality 240 mg and N = 396 für Placebo in EVOLVE-2
N = 252 für Emgality 120 mg, N = 253 für Emgality 240 mg and N = 494 für Placebo in REGAIN
Im Vergleich zu Patienten unter Placebo zeigten Patienten unter Emgality 120 mg oder 240 mg in den Studien EVOLVE-1 und -2 (episodische Migräne) in Monat 1 und in allen nachfolgenden Monaten bis Monat 6 eine signifikant grössere Abnahme der Anzahl der Tage mit Migräne-Kopfschmerz pro Monat gegenüber dem Ausgangswert, ebenso in der REGAIN Studie (chronische Migräne) im ersten Monat und allen folgenden Monaten bis Monat 3 (siehe Abbildung 1). Zudem zeigten Patienten unter Emgality (Anfangsdosis 240 mg) in Monat 1 signifikant weniger MHDs pro Woche im Vergleich zu Placebo in Woche 1 und in jeder nachfolgenden Woche.
Abbildung 1: Reduktion der Tage mit Migräne-Kopfschmerz pro Monat im zeitlichen Verlauf

Patienten unter Emgality 120 mg und 240 mg zeigten in allen drei Studien grössere Ansprechraten im Vergleich zu Patienten unter Placebo. Die Ansprechrate ist der mittlere Prozentsatz von Patienten, die einen definierten Schwellenwert für die Reduktion der Anzahl der monatlichen Migräne-Kopfschmerzen-Tage (≥50%, ≥75% und 100%) während der doppelblindete Behandlungsperiode erreichen (siehe Tabelle oben).
Die mittlere Anzahl der Tage mit Migräne-Kopfschmerz pro Monat, an welchen eine Akutmedikation angewendet wurde, betrug zu Studienbeginn 7.38 und 7.54 pro Monat in den Studien EVOLVE-1 und EVOLVE-2 (episodische Migräne), und 15.16 pro Monat in der REGAIN Studie (chronische Migräne), und war innerhalb jeder Studie in allen Behandlungsgruppen ähnlich. Beide Behandlungsgruppen, Emgality 120 mg und 240 mg, zeigten im Vergleich zu Placebogruppe grössere Reduktionen in der Anzahl der Tage mit Migräne-Kopfschmerz pro Monat, an denen eine Akutmedikation angewendet wurde (siehe Tabelle oben).
Der funktionale Einfluss der Migräne wurde anhand der Role Function-Restrictive Domaine des Migraine-Specific Quality of Life Questionnaire (MSQ) Version 2.1 beurteilt, welcher den Einfluss der Migräne auf die Arbeit oder Alltagsaktivitäten, die Beziehung zu Familie und Freunden, Freizeit, Produktivität, Konzentration, Energie und Müdigkeit misst. Der Wert reicht von 0 bis 100, wobei höhere Werte auf eine besser Funktion hinweisen.
Patienten unter Emgality 120 mg und 240 mg zeigten in allen drei Studien im Vergleich zu Placebo grössere Verbesserungen der Funktion (siehe Tabelle oben). Der mittlere MSQ Role Function-Restrictive Score zu Studienbeginn betrug 51.52 und 51.72 in den Studien EVOLVE-1 und 2 (episodische Migräne) und 38.74 in der REGAIN Studie (chronische Migräne), und war innerhalb jeder Studie in allen Behandlungsgruppen ähnlich.
In gepoolten Daten aus den Studien EVOLVE-1 und EVOLVE-2, bei Patienten, bei denen eine oder mehrere prophylaktische Behandlungen aus Wirksamkeitsgründen versagten, betrug der Behandlungsunterschied für die Reduzierung der mittleren monatlichen MHD zwischen Galcanezumab 120 mg und Placebo -2.69 Tage (p <0.001) und zwischen Galcanezumab 240 mg und Placebo -2.78 Tage (p <0.001). Bei Patienten, bei denen zwei oder mehr prophylaktische Behandlungen versagten, betrug der Behandlungsunterschied -2.64 Tage (p <0.001) zwischen 120 mg und Placebo und -3.04 Tage (p <0.001) zwischen 240 mg und Placebo. In der REGAIN-Studie bei Patienten, bei denen eine oder mehrere prophylaktische Behandlungen aus Wirksamkeitsgründen versagten, betrug der Behandlungsunterschied für die Reduktion der mittleren monatlichen MHD zwischen Galcanezumab 120 mg und Placebo -3.54 (p <0.001) und zwischen Galcanezumab 240 mg und Placebo -1.37 Tage (p <0.05). Bei Patienten, bei denen zwei oder mehr prophylaktische Behandlungen versagten, betrug der Behandlungsunterschied zwischen 120 mg und Placebo -4.48 Tage (p <0.001) und zwischen 240 mg und Placebo -1.86 Tage (p <0.01).
In der REGAIN Studie zeigten 64% der Patienten zu Studienbeginn einen übermässigen Gebrauch von Arzneimitteln gegen akute Kopfschmerzen. Der Behandlungsunterschied zwischen Galcanezumab 120 mg und Placebo und zwischen Galcanezumab 240 mg und Placebo für die Reduktion von MHD bei diesen Patienten betrug -2.53 Tage (p <0.001) und -2.26 Tage (p <0.001). In gepoolten Daten aus den Studien EVOLVE-1 und EVOLVE-2 Studie zeigten etwa 19% der Patienten zu Studienbeginn einen übermässigen Gebrauch von Arzneimitteln gegen akute Kopfschmerzen. Der Behandlungsunterschied zwischen Galcanezumab 120 mg und Placebo und zwischen Galcanezumab 240 mg und Placebo für die Reduktion von MHD bei diesen Patienten betrug -3.55 Tage (p <0.001) und -3.07 Tage (p <0.001).
Pharmakokinetik
Absorption
Basierend auf einer Populations-Pharmakokinetik (PK)-Analyse betrug die maximale Serumkonzentration (Cmax) von Galcanezumab nach einer Anfangsdosis von 240 mg etwa 30 μg/ml (27% Variationskoeffizient [coefficient of variation, CV]). Galcanezumab Steady-State Serumkonzentration wurde nach der ersten Dosis erreicht. Unter einer monatlichen Dosierung von 120 mg wurde im Steady-state ein Cmax (Cmax, ss) von etwa 28 μg/ml (35% CV), eine Zeit bis Cmax, ss von etwa 5 Tagen und eine AUC im Steady State (AUCtau,ss) von 15'900 μg×h/ml erreicht.
Die Injektionsstelle (Bauchdecke, Gesäss, Oberschenkel und Oberarm) hatte keinen signifikanten Einfluss auf die Absorption von Galcanezumab.
Distribution
Basierend auf einer Populations-PK-Analyse betrug das scheinbare Verteilungsvolumen von Galcanezumab 7.3 l.
Metabolismus
Galcanezumab ist ein humanisierter, monoklonaler IgG4-Antikörper, sodass in gleicher Art wie bei endogenen IgGs ein Abbau über katabole Prozesse in kleine Peptide und Aminosäuren erwartet wird.
Elimination
Basierend auf einer Populations-PK-Analyse betrug die scheinbare Clearance von Galcanezumab etwa 0.008 l/h und die Halbwertszeit von Galcanezumab war 27 Tage.
Linearität/Nicht Linearität
Die Galcanezumab-Exposition steigt proportional zur Dosis an.
Basierend auf einer Populations-PK-Analyse, die Dosen im Bereich von 5 bis 300 mg einschloss, waren die Absorptionsrate, die scheinbare Clearance und das scheinbare Verteilungsvolumen unabhängig von der Dosis.
Kinetik spezieller Patientengruppen
Alter, Geschlecht, Gewicht, Abstammung, ethnische Zugehörigkeit
Basierend auf einer Populations-PK-Analyse, sind auf Basis von Alter, Geschlecht, Gewicht, Abstammung oder ethnische Zugehörigkeit keine Dosisanpassungen erforderlich, da kein klinisch relevanter Einfluss dieser Faktoren auf die scheinbare Clearance oder das scheinbare Verteilungsvolumen von Galcanezumab beobachtet wurde.
Nieren- oder Leberfunktionsstörungen
Spezifische klinische pharmakologische Studien zur Untersuchung der Auswirkungen von Nieren- und Leberfunktionseinschränkung auf die PK von Galcanezumab wurden nicht durchgeführt.
Monoklonale IgG Antikörper werden in geringem Umfang renal eliminiert. In ähnlicher Weise werden monoklonale IgG Antikörper überwiegend über intrazellulären Katabolismus eliminiert und es ist nicht zu erwarten, dass eine Leberfunktionseinschränkung die Clearance von Galcanezumab beeinflusst. Basierend auf einer Populations-PK-Analyse hatten Bilirubin-Konzentration (2 bis 46 μmol/l) oder Kreatinin-Clearance (24 bis 308 ml/min) keinen signifikanten Einfluss auf die scheinbare Clearance von Galcanezumab. Es wurden keine Patienten mit schwerer Niereninsuffizienz eingeschlossen.
Präklinische Daten
Toxizität bei wiederholter Verabreichung
Nicht-klinische Daten zeigten keine besonderen Gefahren für den Menschen, basierend auf Studien zur Toxizität bei wiederholter Gabe an Ratten und Cynomolgus-Affen und pharmakologischen Auswertungen zur Sicherheit an Cynomolgus-Affen mit Expositionen, die etwa 10- bis 80-fach höher waren als bei Patienten, die 240 mg bekommen.
Mutagenität/Karzinogenität
Nicht-klinische Studien zur Beurteilung des karzinogenen oder mutagenen Potentials von Galcanezumab wurden nicht durchgeführt. Es gibt keine Hinweise darauf, dass eine chronische Behandlung mit Galcanezumab das Risiko für Karzinogenität erhöhen würde, basierend auf Daten aus den Studien zur Pharmakologie und chronischen Toxizität von Galcanezumab sowie einer Beurteilung der Literatur zu CGRP.
Reproduktionstoxizität
Keine Wirkungen auf Parameter der Fertilität wie Reproduktionsorgane, Östrogenzyklus, Spermienanalyse oder Paarungsverhalten und Fertilität wurden bei Ratten, die Galcanezumab subkutan in Dosierung von 250 mg/kg erhalten haben (einer Exposition entsprechend ungefähr dem 4 bis 20-fachen der Exposition beim Menschen mit 240 mg), beobachtet.
In embryofetalen Entwicklungsstudien an Ratten und Kaninchen wurden, bei Expositionen bis zum 30-fachen der Exposition bei Menschen mit 240 mg, keine Fehlbildungen oder embryofetale Toxizität beobachtet. Es gab keine Auswirkungen auf das Überleben, das Wachstum, die sexuelle Reifung, das Verhalten oder die Reproduktion bei den Nachkommen, die Galcanezumab in utero und während der Laktation bei Expositionen bis zum 18-fachen der Exposition bei Menschen mit 240 mg in der pränatalen und postnatalen Entwicklungsstudie bei Ratten, ausgesetzt waren.
In einer juvenilen Toxikologie-Studie, in der Ratten Galcanezumab zweimal wöchentlich vom 21. bis zum 90. postnatalen Tag verabreicht wurden, traten bei Expositionen bis zum etwa 50-fachen der Exposition bei Menschen mit 240 mg leichte Änderungen an den Knochenparametern auf. Das Risiko für den Menschen wird als gering eingestuft.
Sonstige Hinweise
Inkompatibilitäten
Da keine Kompatibilitätsstudien vorliegen, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Ausser Reichweite von Kindern aufbewahren.
Im Kühlschrank (2-8°C) lagern. Nicht einfrieren.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Wenn die Aufbewahrung im Kühlschrank nicht möglich ist, kann Emgality bis zu insgesamt 7 Tagen bei Temperaturen nicht über 30°C aufbewahrt werden. Nach der Lagerung ausserhalb des Kühlschranks, nicht mehr in den Kühlschrank zurückstellen. Der Fertigpen muss nach 7 Tagen entsorgt werden, falls er ungekühlt aufbewahrt wird.
Hinweise für die Handhabung
Nicht schütteln.
Vor der Verabreichung Emgality mindestens 30 Minuten lang bei Raumtemperatur (15-25°C) stehen lassen.
Emgality ist eine klare und farblose bis leicht gelbliche Lösung.
Vor Gebrauch sollte die Flüssigkeit kontrolliert werden. Emgality nicht injizieren wenn die Lösung wolkig oder verfärbt ist, wenn sichtbare Partikel auftreten oder wenn die Lösung eingefroren wurde.
Der Fertigpen ist zum einmaligen Gebrauch bestimmt.
Die beigelegte Gebrauchsanweisung des Fertigpens muss vor der Anwendung sorgfältig gelesen und beachtet werden.
Zulassungsnummer
67026 (Swissmedic).
Zulassungsinhaberin
Eli Lilly (Suisse) SA, 1214 Vernier/GE.
Stand der Information
September 2020.
Composition
Principes actifs
Galcanezumab (anticorps monoclonal recombinant humanisé produit sur des cellules CHO [ovaire de hamster chinois]).
Excipients
L-histidine, chlorhydrate de L-histidine monohydraté, chlorure de sodium, polysorbate 80, eau pour préparations injectables.
Forme pharmaceutique et quantité de principe actif par unité
Emgality 120 mg, solution injectable en stylo pré-rempli
1 stylo prérempli de 1 ml contient 120 mg de galcanezumab (120 mg/ml).
Indications/Possibilités d’emploi
Traitement prophylactique de la migraine chez l'adulte, pour autant qu'il soit indiqué.
Posologie/Mode d’emploi
L'indication pour le traitement doit être posée par un médecin expérimenté dans le domaine du traitement de la migraine, qui doit ensuite accompagner le traitement.
Afin d'assurer la traçabilité des médicaments biologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Posologie usuelle
La dose recommandée est de 120 mg en injection sous-cutanée une fois par mois, avec au début du traitement une dose initiale unique de 240 mg (2 injections).
Les patients doivent être informés de ratrapper une dose oubliée dès que possible et de reprendre ensuite l'administration mensuelle à partir de la date de la dernière injection.
En cas d'absence de réponse au traitement ou au-moins une fois par année, il faut procéder à une réévaluation de la nécessité de poursuivre le traitement.
Les données relatives à la sécurité et à l'efficacité du traitement sur 12 mois sont limitées.
Emgality est injecté par voie sous-cutanée dans l'abdomen ou la cuisse par le patient lui-même, ou dans l'arrière du bras ou dans la fesse par un professionnel de santé ou un soignant formé à l'utilisation du stylo prérempli.
Si plusieurs injections sont administrées dans une même région du corps, on évitera de faire les injections au même endroit. Emgality ne doit pas être injecté à des endroits où la peau est sensible, lésée, rougie ou durcie.
Instructions posologiques particulières
Patients présentant des troubles de la fonction rénale
Aucun ajustement de la dose n'est nécessaire chez les patients atteints d'insuffisance rénale légère à modérée. Emgality n'a pas été étudié chez des patients atteints d'insuffisance rénale sévère (voir «Pharmacocinétique»).
Patients présentant des troubles de la fonction hépatique
Emgality n'a pas été étudié chez des patients atteints d'insuffisance hépatique. Aucun ajustement de la dose n'est recommandé chez les patients atteints d'insuffisance hépatique car le galcanezumab, une immunoglobuline G humaine, n'est pas métabolisé par les enzymes du cytochrome P450 et sa clairance ne se fait pas de manière significative par le foie (voir «Pharmacocinétique»).
Personnes âgées (>65 ans)
Il n'est pas recommandé d'ajuster la dose chez les personnes âgées car on ne dispose pas de données suffisantes pour déterminer si ces patients réagissent différemment de patients plus jeunes.
Population pédiatrique (moins de 18 ans)
La sécurité et l'efficacité d'Emgality chez l'enfant et l'adolescent n'ont pas été étudiées. Emgality ne doit donc pas être utilisé dans cette classe d'âge.
Contre-indications
Hypersensibilité au principe actif ou à l'un des excipients, selon la composition.
Mises en garde et précautions
Hypersensibilité sévère
Des réactions d'hypersensibilité sévère, y compris des cas d'anaphylaxie, d'angioedème et d'urticaire, ont été rapportées. En cas de réaction d'hypersensibilité sévère, l'administration d'Emgality doit être immédiatement arrêtée et un traitement approprié doit être instauré. Des réactions d'hypersensibilité sévères peuvent survenir plusieurs jours après l'administration et persister.
Population pédiatrique (moins de 18 ans)
La sécurité et l'efficacité d'Emgality chez l'enfant et l'adolescent n'ont pas été étudiées. Emgality ne doit donc pas être utilisé dans cette classe d'âge.
Interactions
Aucune étude d'interaction n'a été réalisée.
Aucune interaction pharmacocinétique n'est attendue en raison des caractéristiques du galcanezumab.
Grossesse/Allaitement
Grossesse
On dispose de données insuffisantes sur l'utilisation d'Emgality chez la femme enceinte. Des études de toxicité sur le développement menées chez des lapines et des rates gestantes n'ont pas révélé de signes d'atteinte foetale. On sait que l'immunoglobuline humaine (IgG) traverse la barrière placentaire; par conséquent, le galcanezumab peut être transmis de la mère au foetus en développement. Emgality ne doit pas être utilisé pendant la grossesse, sauf en cas de nécessité absolue.
Allaitement
On ignore si Emgality est excrété dans le lait maternel. Comme de nombreux médicaments, notamment des anticorps, sont excrétés dans le lait maternel, un risque pour le nouveau-né/l'enfant en bas âge ne peut être exclu. Il faut par conséquent décider soit d'arrêter l'allaitement, soit de renoncer au traitement par Emgality, en tenant compte du bénéfice du traitement avec Emgality pour la mère et du bénéfice de l'allaitement pour le nourrisson.
Fertilité
On ne dispose pas de données sur l'effet d'Emgality sur la fertilité humaine. Les études réalisées chez l'animal n'ont pas mis en évidence d'effets délétères sur la fertilité (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude n'a été réalisée à ce sujet. Emgality peut avoir une influence sur l'aptitude à conduire des véhicules et à utiliser des machines. Des vertiges peuvent survenir suite à l'administration de galcanezumab (voir «Effets indésirables»).
Effets indésirables
Les effets indésirables les plus fréquemment rapportés ont été des douleurs au site d'injection (10.1% avec 120 mg, 11.6% avec 240 mg) et des réactions au site d'injection (9.9% avec 120 mg, 14.5% avec 240 mg). La majorité des événements liés au site d'injection (érythème, prurit, ecchymose, gonflement) ont été d'intensité légère à modérée et n'ont pas entraîné l'arrêt du traitement avec Emgality. La majorité des réactions au site d'injection ont été rapportées le premier jour de traitement et ont généralement disparu en quelques jours. Chez la plupart des patients ayant rapporté une douleur au site d'injection, l'événement est survenu dans l'heure suivant l'injection et a disparu le même jour.
Des cas sévères d'urticaire ont été rarement rapportés dans les études cliniques avec le galcanezumab (voir «Mises en garde et précautions»).
Au total, 2586 patients ont reçu Emgality pour la prophylaxie des migraines dans des études cliniques, ce qui correspond à une exposition de 1250.6 patients-années. Au total, 1647 patients ont reçu ≥6 doses mensuelles (120 ou 240 mg) de galcanezumab; 279 patients ont reçu 12 doses mensuelles (120 ou 240 mg).
Trois études de phase 3 contrôlées avec placebo sur la prophylaxie de la migraine ont été évaluées de façon combinée afin d'examiner la sécurité d'Emgality par rapport au placebo jusqu'à 6 mois après le début du traitement. Dans la phase en double aveugle, 1435 patients au total ont reçu le galcanezumab, ce qui correspond à une exposition de 536.3 patients-années.
Liste des effets indésirables rapportés dans les études cliniques et après la mise sur le marché
Les fréquences des effets indésirables sont indiquées comme suit: «très fréquents» (≥1/10), «fréquents» (<1/10 à ≥1/100), «occasionnels» (<1/100 à ≥1/1000), «rares» <1/1000 à ≥1/10'000), «très rares» (<1/10'000).
Affections du système immunitaire
Rare: anaphylaxie, angioedème.
Affections de l'oreille et du labyrinthe
Fréquent: Vertige.
Affections gastro-intestinales
Fréquent: Constipation.
Affections de la peau et du tissu sous-cutané
Fréquent: Prurit, éruption cutanée.
Occasionnel: Urticaire.
Troubles généraux et anomalies au site d'administration
Très fréquents: Douleurs au site d'injection (10.1% avec 120 mg, 11.6% avec 240 mg), réactions au site d'injection (9.9% avec 120 mg, 14.5% avec 240 mg).
Immunogénicité
Dans les études cliniques, l'incidence du développement d'anticorps contre le principe actif pendant la phase de traitement en double aveugle était de 4.8% (33/688) parmi les patients sous traitement par galcanezumab 120 mg une fois par mois et tous, sauf un, avaient une activité neutralisante in vitro. Après 12 mois de traitement, 12.5% (16/128) des patients traités par le galcanezumab 120 mg ont développé des anticorps contre le principe actif. Les titres étaient pour la plupart faibles et ont été testés positifs pour une activité neutralisante in vitro
La présence d'anticorps contre le principe actif n'a pas eu d'incidence sur la pharmacocinétique, l'efficacité ou la sécurité du galcanezumab. Les données disponibles ne sont toutefois pas suffisantes pour que l'on puisse tirer des conclusions fiables en la matière.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Chez l'homme, des doses allant jusqu'à 600 mg ont été administrées par voie sous-cutanée sans toxicité dose-limitante. En cas de surdosage, il est recommandé de surveiller le patient afin de détecter les signes ou symptômes d'effets indésirables et d'instaurer immédiatement un traitement symptomatique approprié.
Propriétés/Effets
Code ATC
N02CD02
Mécanisme d'action
Le galcanezumab est un anticorps monoclonal IgG4 recombinant humanisé. Il se lie au peptide relié au gène de la calcitonine (calcitonin gene-related peptide, CGRP) et empêche ainsi son activité biologique, sans bloquer le récepteur du CGRP. Des concentrations sanguines élevées de CGRP ont été associées à la migraine. En outre, chez certaines personnes qui ont des antécédents de migraine, des perfusions de CGRP peuvent déclencher des crises de type migraineux.
Pharmacodynamique
Le galcanezumab se lie au CGRP avec une forte affinité (KD = 31 pM) et avec une spécificité élevée (>10'000 fois comparé aux peptides apparentés tels que l'adrénomédulline, l'amyline, la calcitonine et l'intermédine).
Efficacité clinique
L'efficacité et la sécurité d'Emgality ont été démontrées dans trois études de phase III, randomisées, contrôlées versus placebo, en double aveugle chez des patients adultes (N = 2886). Les 2 études sur la migraine épisodique (EVOLVE-1 et EVOLVE-2) ont inclus des patients qui répondaient aux critères de diagnostic de migraine avec ou sans aura de la classification internationale des céphalées (International Classification of Headache Disorders, ICHD), avec 4 à 14 jours de migraine par mois. L'étude sur la migraine chronique (REGAIN) a inclus des patients qui répondaient aux critères ICHD de migraine chronique avec ≥15 jours de céphalées par mois, dont au moins 8 jours avec les caractéristiques d'une migraine. Les patients ayant présenté un événement cardiovasculaire aigu récent (y compris infarctus du myocarde, angor instable, pontage coronarien (CABG), accident vasculaire cérébral, thrombose veineuse profonde) et/ou ceux considérés comme présentant un risque cardiovasculaire grave ont été exclus des études cliniques évaluant le galcanezumab. Les patients âgés de plus de 65 ans ont également été exclus. Les études EVOLVE-1 et EVOLVE-2 comportaient une période de traitement de 6 mois, en double aveugle, contrôlée versus placebo; l'étude REGAIN comportait une période de traitement de 3 mois, en double aveugle, contrôlée versus placebo, suivie d'une période d'extension ouverte de 9 mois. Les patients ont reçu le placebo, Emgality 120 mg/mois (avec une dose de charge initiale de 240 mg le premier mois) ou Emgality 240 mg/mois et ont été autorisés à prendre des médicaments pour le traitement aigu de la migraine. Au début de l'étude, le nombre moyen de jours de migraine par mois était de 9.13 par mois dans les études EVOLVE-1 et EVOLVE-2 (migraine épisodique) et de 19.41 par mois dans l'étude REGAIN (migraine chronique), et il était similaire au sein de chaque étude dans tous les groupes de traitement. Dans l'étude REGAIN, environ 15% des patients ont continué un traitement concomitant par topiramate ou propranolol (autorisé conformément au protocole de prophylaxie de la migraine), et 64% présentaient au début de l'étude une consommation excessive de médicaments contre les céphalées aiguës. Environ un tiers des patients dans les études étaient en échec d'au-moins un traitement prophylactique antérieur pour des raisons d'efficacité et environ 16% des patients étaient en échec d'au-moins deux traitements prophylactiques antérieurs pour des raisons d'efficacité.
Dans les 3 études, le critère principal d'efficacité était la variation moyenne du nombre de jours de migraine par mois (migraine headache days, MHD) par rapport aux valeurs initiales. Les deux groupes de traitement, Emgality 120 mg et 240 mg, ont montré des améliorations statistiquement significatives et cliniquement pertinentes par rapport aux valeurs initiales comparativement au groupe placebo (voir Tableau).
Tableau: Efficacité et critères fonctionnels dans les études de phase 3
Résultats | EVOLVE-1 – Migraine épisodique | EVOLVE-2 - Migraine épisodique | REGAIN – Migraine chronique | ||||||
Emgality | Placebo N=425 | Emgality | Placebo N=450 | Emgality | Placebo N=538 | ||||
120 mg N=210 | 240 mg N=208 | 120 mg N=226 | 240 mg N=220 | 120 mg N=273 | 240 mg N=274 | ||||
Résultats d'efficacité (évaluées sur les mois 1 à 6 pour EVOLVE-1 et 2 et sur les mois 1 à 3 pour REGAIN) | |||||||||
Réduction moyenne du nombre de jours par mois avec migraine par rapport à la valeur initiale | -4.73a | -4.57a | -2.81 | -4.29a | -4.18a | -2.28 | -4.83a | -4.62a | -2.74 |
Pourcentage moyen de patients qui ont atteint un taux de réponse ≥50% | 62.3a | 60.9a | 38.6 | 59.3a | 56.5a | 36.0 | 27.6a | 27.5a | 15.4 |
Réduction moyenne du nombre de jours par mois avec migraine au cours desquels une médication aiguë a été utilisée. Variation par rapport à la valeur initiale | -3.96a | -3.76a | -2.15 | -3.67a | -3.63a | -1.85 | -4.74b | -4.25a | -2.23 |
Résultats rapportés par les patients (évalués sur les mois 4 à 6 pour EVOLVE-1 et 2 et au mois 3 pour REGAIN) | |||||||||
Influence fonctionnelle de la migraine sur les activités de tous les jours. Amélioration moyenne par rapport à la valeur initiale (MSQ Role Function- Restrictive)c | 32.43a | 32.09a | 24.69 | 28.47a | 27.04a | 19.65 | 21.81b | 23.05a | 16.76 |
a p <0.001 (statistiquement significatif versus placebo après ajustement pour comparaisons multiples)
b p <0.001 (non statistiquement significatif versus placebo après ajustement pour comparaisons multiples)
c N = 189 pour Emgality 120 mg, N = 184 pour Emgality 240 mg et N = 377 pour le placebo dans EVOLVE-1
N = 213 pour Emgality 120 mg, N = 210 pour Emgality 240 mg et N = 396 pour le placebo dans EVOLVE-2
N = 252 pour Emgality 120 mg, N = 253 pour Emgality 240 mg et N = 494 pour le placebo dans REGAIN
Comparativement aux patients sous placebo, les patients sous Emgality 120 mg ou 240 mg dans les études EVOLVE-1 et -2 (migraine épisodique) ont présenté une diminution du nombre de jours de migraine par mois significativement plus importante, par rapport aux valeurs initiales, au 1er mois et tous les mois suivants jusqu'au 6ème mois et de même dans l'étude REGAIN (migraine chronique) au 1er mois et tous les mois suivants jusqu'au 3ème mois (voir Illustration 1). En outre, les patients sous Emgality (dose initiale de 240 mg) présentaient au mois 1 significativement moins de MHD par semaine, comparativement au placebo à la semaine 1 et toutes les semaines suivantes.
Illustration 1: Réduction des jours de migraine par mois au fil du temps
Les patients sous Emgality 120 mg et 240 mg ont présenté dans les trois études des taux de réponse plus élevés que les patients sous placebo. Le taux de réponse est le pourcentage moyen de patients atteignant un seuil défini en termes de réduction du nombre de jours de migraine par mois (≥50%, ≥75% et 100%) pendant toute la durée de la période de traitement en double aveugle (voir Tableau ci-dessus).
Le nombre moyen de jours de migraine par mois lors desquels une médication aiguë a été utilisée était respectivement de 7.38 et 7.54 par mois au début de l'étude dans les études EVOLVE-1 et EVOLVE-2 (migraine épisodique), et de 15.16 par mois dans l'étude REGAIN (migraine chronique), et il était similaire dans tous les groupes de traitement au sein de chaque étude. Les deux groupes de traitement, Emgality 120 mg et 240 mg, ont présenté des réductions plus importantes, par rapport au groupe sous placebo, du nombre de jours de migraine par mois au cours desquels une médication aiguë a été utilisée (voir Tableau ci-dessus).
L'impact fonctionnel de la migraine a été évalué à l'aide du domaine Role Function-Restrictive du Migraine-Specific Quality of Life Questionnaire (MSQ) Version 2.1, qui mesure l'effet de la migraine sur le travail ou les activités de tous les jours, les rapports avec la famille et les amis, les loisirs, la productivité, la concentration, l'énergie et la fatigue. La valeur va de 0 à 100, les valeurs plus élevées indiquant une meilleure fonction.
Dans les trois études, les patients sous Emgality 120 mg et 240 mg ont présenté des améliorations plus importantes de la fonction comparativement aux patients sous placebo (voir Tableau ci-dessus). Au début de l'étude, le MSQ Role Function-Restrictive Score moyen était respectivement de 51.52 et de 51.72 dans les études EVOLVE-1 et 2 (migraine épisodique) et de 38.74 dans l'étude REGAIN (migraine chronique), et il était similaire dans tous les groupes de traitement au sein de chaque étude.
Dans les données consolidées des études EVOLVE-1 et EVOLVE-2, chez les patients en échec d'un ou plusieurs traitements prophylactiques pour des raisons d'efficacité, la différence entre les traitements sur la réduction du nombre moyen de jours de migraine par mois observé était de -2.69 jours (p <0.001) entre galcanezumab 120 mg et placebo et de -2.78 jours (p <0.001) entre galcanezumab 240 mg et placebo. Chez les patients en échec de deux ou plusieurs traitements prophylactiques, la différence entre les traitements a été de -2.64 jours (p <0.001) entre 120 mg et placebo et de -3.04 jours (p <0.001) entre 240 mg et placebo. Chez les patients en échec d'un ou plusieurs traitements prophylactiques pour des raisons d'efficacité, la différence de traitement sur la réduction du nombre moyen de jours de migraine par mois observé était de -3.54 jours (p <0.001) entre galcanezumab 120 mg et placebo et de -1.37 jours (p <0.05) entre galcanezumab 240 mg et placebo. Chez les patients en échec de deux ou plusieurs traitements prophylactiques, la différence de traitement était de -4.48 jours (p <0.001) entre 120 mg et placebo et de -1.86 jours (p <0.01) entre 240 mg et le placebo.
Dans l'étude REGAIN, 64% des patients étaient en situation de consommation excessive de médicaments contre les céphalées aiguës à l'inclusion. Chez ces patients, la différence de traitement sur la réduction du MHD était de -2.53 jours (p <0.001) entre galcanezumab 120 mg et placebo et de -2.26 jours (p <0.001) entre galcanezumab 240 mg et placebo. Dans les données consolidées des études EVOLVE-1 et EVOLVE-2, près de 19% des patients étaient en situation de consommation excessive de médicaments contre les céphalées aiguës au début de l'étude. Chez ces patients, la différence de traitement sur la réduction du MHD était de -3.55 jours (p <0.001) entre galcanezumab 120 mg et placebo et de -3.07 jours (p <0.001) entre galcanezumab 240 mg et placebo.
Pharmacocinétique
Absorption
Sur la base d'une analyse pharmacocinétique de population, la concentration sérique maximale (Cmax) de galcanezumab après administration d'une dose de charge de 240 mg est d'environ 30 μg/ml (coefficient de variation [CV] de 27%). La concentration sérique de galcanezumab à l'état d'équilibre a été atteinte après la première dose. Après une dose mensuelle de 120 mg, une Cmax (Cmax, ss) d'environ 28 μg/ml (CV de 35%) a été atteinte à l'état d'équilibre, avec un temps pour atteindre la Cmax, ss d'environ 5 jours et une aire sous la courbe à l'état d'équilibre (AUCtau,ss) de 15'900 μg×h/ml.
L'emplacement du site d'injection (abdomen, cuisse, fesses et bras) n'a pas eu d'effet significatif sur l'absorption du galcanezumab.
Distribution
Sur la base d'une analyse pharmacocinétique de population, le volume de distribution apparent du galcanezumab était de 7.3 l.
Métabolisme
Le galcanezumab est un anticorps monoclonal IgG4 humanisé, on s'attend donc à une décomposition similaire à celle des IgG endogènes, en petits peptides et en acides aminés via des voies cataboliques.
Élimination
Sur la base d'une analyse pharmacocinétique de population, la clairance apparente du galcanezumab était d'environ 0.008 l/h et la demi-vie du galcanezumab était de 27 jours.
Linéarité/non-linéarité
L'exposition au galcanezumab augmente proportionnellement à la dose.
Sur la base d'une analyse pharmacocinétique de population incluant des doses comprises entre 5 et 300 mg, le taux d'absorption, la clairance apparente et le volume de distribution apparent étaient indépendants de la dose.
Cinétique pour certains groupes de patients
Age, sexe, poids, race, origine ethnique
Sur la base d'une analyse pharmacocinétique de population, aucun ajustement posologique n'est nécessaire en fonction de l'âge, du sexe, du poids, de la race ou de l'origine ethnique car ces facteurs n'ont montré aucun effet cliniquement significatif sur la clairance apparente ou le volume apparent de distribution du galcanezumab.
Troubles de la fonction rénale ou hépatique
Aucune étude de pharmacologie clinique spécifique destinée à évaluer les effets de l'insuffisance rénale et de l'insuffisance hépatique sur les paramètres pharmacocinétiques du galcanezumab n'a été menée.
L'élimination rénale des anticorps monoclonaux IgG est faible. De même, les anticorps monoclonaux IgG sont principalement éliminés par catabolisme intracellulaire et une insuffisance hépatique ne devrait pas influencer la clairance du galcanezumab. Sur la base d'une étude pharmacocinétique de population, la concentration de bilirubine (2 à 46 µmol/l) ou la clairance de la créatinine (24 à 308 ml/min) n'a pas montré d'effet significatif sur la clairance apparente du galcanezumab. Aucun patient atteint d'insuffisance rénale sévère n'a été inclus dans les études.
Données précliniques
Toxicité en cas d'administration répétée
Les données non cliniques n'ont pas montré de risque particulier pour l'être humain, sur la base d'études de toxicité en administration répétée menées chez des rats et des singes Cynomolgus ainsi que d'évaluations de pharmacologie de la sécurité menées chez des singes Cynomolgus à des expositions 10 à 80 fois supérieures à l'exposition chez les patients traités avec une dose de 240 mg.
Mutagénicité/Carcinogénicité
Aucune étude non clinique n'a été réalisée pour évaluer le potentiel carcinogène ou mutagène du galcanezumab. Il n'existe aucune preuve suggérant qu'un traitement chronique par galcanezumab soit susceptible d'augmenter le risque de carcinogénicité dur la base des données des études de pharmacologie et de toxicologie chronique menées avec le galcanezumab, ainsi que d'après une évaluation de la littérature sur le CGRP.
Toxicité sur la reproduction
Aucun effet sur les paramètres de fertilité tels que les organes reproducteurs, les cycles menstruels, les analyses de sperme, l'accouplement et la fertilité n'a été observé chez les rats ayant reçu par voie sous-cutanée une dose de 250 mg/kg de galcanezumab (exposition correspondant à environ 4 à 20 fois l'exposition chez l'être humain avec 240 mg).
Dans des études sur le développement embryo-foetal menées chez le rat et le lapin, à des expositions allant jusqu'à 30 fois l'exposition chez l'être humain avec 240 mg, aucune malformation ou toxicité embryo-foetale n'a été observée. Dans une étude sur le développement prénatal et postnatal menée chez le rat, il n'y a eu aucun effet sur la survie, la croissance, la maturation sexuelle, le comportement ou la reproduction dans la descendance qui avait été exposée au galcanezumab in utero et pendant la lactation à des doses allant jusqu'à 18 fois l'exposition chez l'être humain avec 240 mg.
Dans une étude de toxicologie juvénile chez des rats auxquels le galcanezumab a été administré deux fois par semaine du 21e au 90e jour après la naissance, de légères modifications des paramètres osseux sont apparues à des expositions allant jusqu'à environ 50 fois l'exposition chez l'être humain avec 240 mg. Le risque pour l'être humain est considéré comme faible.
Remarques particulières
Incompatibilités
Aucune étude de compatibilité n'ayant été effectuée, ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Conserver hors de portée des enfants.
Conserver au réfrigérateur (2-8°C). Ne pas congeler.
Conserver dans l'emballage d'origine, afin de protéger le contenu de la lumière.
Lorsqu'il n'est pas possible de le conserver au réfrigérateur, Emgality peut être conservé pendant une période maximale de 7 jours à des températures ne dépassant pas 30°C. Après avoir conservé le médicament en dehors du réfrigérateur, ne plus le remettre au réfrigérateur. Il faut jeter le stylo prérempli après 7 jours s'il est conservé non réfrigéré.
Remarques concernant la manipulation
Ne pas agiter.
Avant d'administrer Emgality, le laisser pendant au moins 30 minutes à température ambiante (15-25°C).
Emgality est une solution limpide et incolore à légèrement jaunâtre.
Contrôler le liquide avant l'emploi. Ne pas injecter Emgality si la solution est trouble ou colorée, contient des particules visibles ou a été congelée.
Le stylo prérempli est à usage unique.
Le manuel d'utilisation du stylo prérempli doit être lu attentivement et scrupuleusement respecté.
Numéro d’autorisation
67026 (Swissmedic).
Titulaire de l’autorisation
Eli Lilly (Suisse) SA, 1214 Vernier/GE.
Mise à jour de l’information
Septembre 2020.
Відгуки (0)

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.





 Deutsch
Deutsch French
French Italian
Italian


 Überprüfen Sie, dass der Pen verriegelt ist. Lassen Sie die Schutzkappe auf dem Pen, bis Sie für die Injektion bereit sind.
Überprüfen Sie, dass der Pen verriegelt ist. Lassen Sie die Schutzkappe auf dem Pen, bis Sie für die Injektion bereit sind.
 Drehen Sie den Sicherungsring auf die Position entriegelt.
Drehen Sie den Sicherungsring auf die Position entriegelt.






 Vérifiez que le stylo est verrouillé. Laissez le capuchon de la base sur le stylo jusqu’à ce que vous soyez prêt pour l’injection.
Vérifiez que le stylo est verrouillé. Laissez le capuchon de la base sur le stylo jusqu’à ce que vous soyez prêt pour l’injection.
 Tournez la bague de sécurité en position déverrouillée.
Tournez la bague de sécurité en position déverrouillée.





 Si assicuri che la penna sia in posizione di blocco. Lasci il cappuccio sulla penna fino a quando non è pronto a praticare l’iniezione.
Si assicuri che la penna sia in posizione di blocco. Lasci il cappuccio sulla penna fino a quando non è pronto a praticare l’iniezione.




























