Delstrigo таблетки плівка 100/300/245 мг DS 30 шт
Delstrigo Filmtabl 100/300/245mg Ds 30 Stk
-
134481.57 RUB
Дата доставки:
24.12.2025 - 07.01.2026
При оплате криптовалютой:
Ваша прибыль 13448.16 RUB / 157.43 USDT
- Наявність: В наявності
- Виробник: MERCK SHARP & DOHME AG
- Модель: 7761661
- ATC-код J05AR24
- EAN 7680670660013
Склад:
Склад:
Magnesium stearat, Triacetin, Lactose-1-Wasser, Titandioxid (E171), Hypromellose, Eisen(III)-oxid (E172), Siliciumdioxid anhydrat, Croscarmellose natrium, Lamivudin 300 mg , Carnaubawachs, Tenofovir disoproxil 245 mg , Tenofovir disoproxil fumarat 300 mg, Natriumstearylfumarat, Cellulose, mikrokristalline, Hypromellose acetatsuccinat, Doravirin 100 mg , Überzug:.Опис
Was ist Delstrigo und wann wird es angewendet?
Delstrigo wird zur Behandlung einer HIV-Infektion bei Erwachsenen eingesetzt. HIV ist das Virus, das für AIDS (Acquired Immune Deficiency Syndrome) verantwortlich ist.
Delstrigo ist eine Filmtablette, die eine Kombination der Wirkstoffe Doravirin, Lamivudin und Tenofovirdisoproxilfumarat enthält. Doravirin ist ein gegen HIV-1 gerichteter nicht-nukleosidischer Reverse-Transkriptase-Inhibitor (NNRTI). Lamivudin ist ein Nukleosidanalogon, das die Reverse Transkriptase von HIV-1 hemmt. Tenofovirdisoproxilfumarat (das Fumarsalz der Vorstufe von Tenofovir) ist ein Nukleosidanalogon, das die Reverse Transkriptase von HIV-1 hemmt.
Delstrigo ist für Menschen bestimmt, in deren Krankengeschichte bisher keine Virusresistenz gegen Doravirin, Lamivudin oder Tenofovir aufgetreten ist.
Delstrigo kann helfen, die Anzahl an HI-Viren in Ihrem Blut (die sogenannte «Viruslast») zu senken und die Anzahl der CD4+-(T-)Zellen, die Ihr Immunsystem stärker machen können, zu erhöhen. Dadurch können das Sterberisiko sowie das Risiko, sich Infektionen zuzuziehen, die bei Menschen mit geschwächtem Immunsystem auftreten können, gemindert werden.
Was sollte dazu beachtet werden?
Ihr Arzt oder Ihre Ärztin hat Ihnen Delstrigo zur Behandlung Ihrer HIV-1-Infektion verschrieben. HIV ist eine durch Blut übertragbare Erkrankung, die sich über Kontakt mit Blut oder sexuellen Kontakt mit einer infizierten Person verbreitet.
Delstrigo kann keine Heilung von HIV oder AIDS herbeiführen. Es ist wichtig, Delstrigo dauerhaft einzunehmen, um Ihre HIV-Infektion unter Kontrolle zu halten und das Risiko zu senken, dass Sie sich weitere Infektionen oder Erkrankungen zuziehen.
Delstrigo verringert nicht das Risiko der HIV-Übertragung auf andere Personen über sexuellen Kontakt, Blutkontakt oder durch den gemeinsamen Gebrauch von Injektionsnadeln. Praktizieren Sie weiterhin geschützten Geschlechtsverkehr. Verwenden Sie Kondome aus Latex oder Polyurethan oder andere Barrieremethoden, um das Risiko eines Kontakts mit Körperflüssigkeiten wie Sperma, Vaginalsekret oder Blut beim Geschlechtsverkehr zu mindern. Injektionsnadeln niemals wiederverwenden oder mit anderen teilen.
Wenden Sie sich mit Fragen zu geschütztem Geschlechtsverkehr oder wegen der Vorbeugung einer Übertragung von HIV auf andere Personen an Ihren Arzt oder Ihrer Ärztin.
Wann darf Delstrigo nicht eingenommen werden?
Nehmen Sie Delstrigo nicht ein, wenn Sie:
- Carbamazepin, Oxcarbazepin, Phenobarbital und Phenytoin (Arzneimittel zur Behandlung von Krampfanfällen),
- Rifampicin und Rifapentin (Arzneimittel zur Behandlung von Tuberkulose),
- Johanniskraut (Hypericum perforatum),
- Mitotan (ein Arzneimittel zur Behandlung bestimmter Krebsarten),
- Enzalutamid (ein Arzneimittel zur Behandlung von Prostatakrebs),
- Lumacaftor (ein Arzneimittel zur Behandlung von zystischer Fibrose)
einnehmen.
Nehmen Sie Delstrigo nicht ein, wenn Sie allergisch gegen Doravirin, Lamivudin, Tenofovirdisoproxilfumarat oder einen der anderen Bestandteile dieses Arzneimittels sind.
Wann ist bei der Einnahme von Delstrigo Vorsicht geboten?
Wenn Sie Nebenwirkungen bemerken, sprechen Sie mit Ihrem Arzt/Ihrer Ärztin, Ihrem Apotheker/Ihrer Apothekerin oder Ihrer Pflegefachperson. Dies gilt auch für mögliche Nebenwirkungen, die nicht in dieser Patienteninformation aufgeführt sind. Siehe «Welche Nebenwirkungen kann Delstrigo haben?» für weitere Informationen über Nebenwirkungen.
Übertragung von HIV auf Dritte
HIV wird durch Blutkontakt oder sexuellen Kontakt mit einer HIV-infizierten Person übertragen. Auch während der Einnahme von Delstrigo können Sie HIV auf andere übertragen, obwohl eine wirksame Behandlung das Risiko verringert. Sprechen Sie mit Ihrem Arzt darüber, was Sie tun können, um eine Infektion anderer Menschen zu verhindern.
Interaktionen mit anderen Arzneimitteln
Einige Arzneimittel können mit Delstrigo Wechselwirkungen eingehen. Führen Sie eine Liste der von Ihnen angewendeten Arzneimittel, die Sie Ihrem Arzt/Ihrer Ärztin oder Ihrem Apotheker/Ihrer Apothekerin zeigen können.
Sie können Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin nach einer Liste von Arzneimitteln fragen, welche mit Delstrigo wechselwirken.
Beginnen Sie nicht ein neues Arzneimittel einzunehmen, ohne Ihren Arzt bzw. Ihre Ärztin zu informieren. Ihr Arzt bzw. Ihre Ärztin kann Ihnen mitteilen, ob es sicher ist, Delstrigo mit anderen Arzneimitteln einzunehmen.
Nehmen Sie keine anderen Arzneimittel ein, die Tenofovirdisoproxilfumarat, Tenofoviralafenamid, Lamivudin, Emtricitabin oder Adefovirdipivoxil enthalten.
Hepatitis-B- oder -C-Koinfektion und Lebererkrankung
Informieren Sie Ihren Arzt bzw. Ihre Ärztin, wenn Sie an einer Lebererkrankung, einschliesslich einer Hepatitis, leiden oder gelitten haben. Patienten mit einer Lebererkrankung wie einer chronischen Hepatitis B oder C, die antiretrovirale Arzneimittel erhalten, weisen ein erhöhtes Risiko schwerwiegender, möglicherweise tödlicher Leberkomplikationen auf. Wenn Sie eine Hepatitis-B-Infektion haben, wird Ihr Arzt bzw. Ihre Ärztin das bestmögliche Behandlungsschema sorgfältig für Sie auswählen. Wenn Sie eine Lebererkrankung oder eine chronische Hepatitis-B-Infektion haben oder früher hatten, kann Ihr Arzt bzw. Ihre Ärztin Blutuntersuchungen durchführen, um die Leberfunktion sorgfältig zu überwachen.
Wenn Sie eine Hepatitis-B-Infektion haben, könnten sich Leberprobleme nach dem Absetzen von Delstrigo verschlechtern. Es ist wichtig, dass Sie die Einnahme von Delstrigo nicht beenden, ohne mit Ihrem Arzt bzw. Ihrer Ärztin zu sprechen: siehe «Wie verwenden Sie Delstrigo?».
Neue oder sich verschlechternde Nierenprobleme einschliesslich Nierenversagen
Diese können bei manchen Menschen, die Delstrigo einnehmen, auftreten. Ihr Arzt bzw. Ihre Ärztin wird vor und während der Behandlung mit Delstrigo Blutuntersuchungen zur Prüfung Ihrer Nierenfunktion durchführen.
Knochenprobleme
Diese können bei manchen Menschen, die Delstrigo einnehmen, vorkommen. Knochenprobleme können in Knochenschmerzen, Erweichung oder Ausdünnung der Knochen bestehen (und Knochenbrüche zur Folge haben). Ihr Arzt bzw. Ihre Ärztin muss möglicherweise zusätzliche Tests durchführen, um den Zustand Ihrer Knochen zu prüfen.
Immunreaktivierungssyndrom
Menschen mit fortgeschrittener HIV-Infektion oder AIDS haben ein geschwächtes Immunsystem und entwickeln eher schwerwiegende Infektionen («opportunistische Infektionen»). Solche Infektionen können vor Beginn der Behandlung «stumm» verlaufen und von dem geschwächten Immunsystem unentdeckt geblieben sein. Nach dem Beginn der Behandlung wird das Immunsystem stärker und wehrt sich möglicherweise gegen die Infektionen, wodurch Infektions- bzw. Entzündungssymptome auftreten können. Zu diesen Symptomen zählen im Allgemeinen: Fieber, Kopfschmerzen, Bauchschmerzen, Schwierigkeiten beim Atmen.
In seltenen Fällen, wenn das Immunsystem stärker wird, kann es auch gesundes Körpergewebe angreifen («Autoimmunerkrankungen»). Die Symptome einer Autoimmunerkrankung können sich viele Monate nach Beginn der Einnahme von Medikamenten zur Behandlung Ihrer HIV-Infektion entwickeln. Zu diesen Symptomen zählen: schneller oder unregelmässiger Herzschlag (Palpitationen) oder Zittern, übermässige Unruhe und Bewegungsdrang (Hyperaktivität), Schwäche, die zunächst in Händen und Füssen einsetzt und dann in Richtung Rumpf aufsteigt.
Nehmen Sie keine anderen Medikamente gegen die Infektion ein, ohne Rücksprache mit Ihrem Arzt zu halten.
Laktose
Wenn Ihr Arzt oder Ihre Ärztin Ihnen gesagt hat, dass Sie eine Laktoseunverträglichkeit haben, sprechen Sie mit Ihrem Arzt oder Ihrer Ärztin, bevor Sie dieses Arzneimittel einnehmen.
Informieren Sie Ihren Arzt bzw. Ihre Ärztin oder Ihren Apotheker bzw. Ihre Apothekerin über alle Krankheiten, an denen sie gegenwärtig leiden oder in der Vergangenheit gelitten haben, sowie über eventuelle Allergien. Informieren Sie Ihren Arzt bzw. Ihre Ärztin über alle Medikamente, die Sie einnehmen, einschliesslich verschreibungspflichtiger und nicht verschreibungspflichtiger Medikamente, Vitamine und pflanzlicher Präparate.
Opportunistische Infektionen
Wenn Sie irgendwelche Anzeichen einer Infektion bemerken, informieren Sie bitte unverzüglich Ihren Arzt bzw. Ihre Ärztin. Bei einigen Patienten mit fortgeschrittener HIV-Infektion und mit einer Krankengeschichte opportunistischer Infektionen können kurz nach Beginn der antiretroviralen Behandlung Anzeichen und Symptome einer Entzündung von vorangegangenen Infektionen auftreten. Es wird angenommen, dass diese Symptome auf eine Verbesserung der körpereigenen Immunantwort zurückzuführen sind, die es dem Körper ermöglicht Infektionen zu bekämpfen, die möglicherweise ohne erkennbare Symptome vorhanden waren.
Osteonekrose
Bei einigen Patienten, die eine antiretrovirale Kombinationsbehandlung erhalten, kann sich eine als Osteonekrose (Absterben von Knochengewebe infolge unzureichender Blutversorgung des Knochens) bezeichnete Knochenerkrankung entwickeln. Zu den vielen Risikofaktoren für die Entwicklung dieser Erkrankung können unter anderem die Dauer der antiretroviralen Kombinationsbehandlung, die Anwendung von Kortikosteroiden, Alkoholkonsum, eine starke Unterdrückung des Immunsystems oder ein höherer Body-Mass-Index gehören. Anzeichen einer Osteonekrose sind Gelenksteife und -schmerzen (insbesondere in Hüfte, Knie und Schulter) sowie Schwierigkeiten bei Bewegungen. Falls Sie eines dieser Anzeichen bemerken, informieren Sie bitte Ihren Arzt.
Fahrtüchtigkeit und Bedienen von Maschinen
Bedienen Sie keine Maschinen und fahren Sie weder Auto noch Fahrrad, falls Sie sich nach Einnahme dieses Arzneimittels benommen fühlen.
Darf Delstrigo während einer Schwangerschaft oder in der Stillzeit eingenommen werden?
Wenn Sie schwanger sind oder versuchen, schwanger zu werden, informieren Sie Ihren Arzt bzw. Ihre Ärztin, bevor Sie Delstrigo erhalten.
Es ist nicht bekannt, ob Delstrigo im Fall einer Schwangerschaft das Ungeborene schädigen kann.
Wenn Sie HIV-Medikamente einnehmen und schwanger sind, sprechen Sie mit Ihrem Arzt/Ihrer Ärztin über das Register für Schwangerschaften unter HIV-Therapie (Antiretroviral Pregnancy Registry). In diesem Register werden Informationen über Mütter und deren Kinder zusammengetragen, wenn die Mutter während der Schwangerschaft HIV-Medikamente einnimmt.
Stillen Sie nicht, wenn Sie mit HIV infiziert sind. Es besteht das Risiko, dass sich Ihr Baby über die Muttermilch mit HIV ansteckt.
Wie verwenden Sie Delstrigo?
Nehmen Sie Delstrigo genau nach Anweisung Ihres Arztes oder Ihrer Ärztin ein.
Nehmen Sie jeden Tag ungefähr zur selben Zeit 1 Tablette mit oder ohne Nahrung ein.
Ändern Sie nicht die Dosis dieses oder anderer HIV-Medikamente und beenden Sie deren Einnahme nicht ohne Rücksprache mit Ihrem Arzt bzw. Ihrer Ärztin. Bleiben Sie während der Behandlung mit Delstrigo durchgehend in ärztlicher Betreuung.
Gleichzeitige Verabreichung mit Rifabutin
Wenn Delstrigo zusammen mit Rifabutin eingenommen wird, nehmen Sie eine Tablette Pifeltro etwa 12 Stunden nach der Delstrigo-Dosis ein. Ihr Arzt bzw. Ihre Ärztin wird Ihnen sagen, was zu tun ist.
Was muss ich im Falle einer Überdosis tun?
Wenn Sie eine zu grosse Menge von Delstrigo eingenommen haben, verständigen Sie sofort Ihren Arzt bzw. Ihre Ärztin oder Ihren Apotheker bzw. Ihre Apothekerin.
Es gibt keine bekannte spezifische Behandlung für den Fall einer Überdosis von Delstrigo. Falls es zu einer Überdosis kommt, sollte Ihr Zustand überwacht werden; je nach Notwendigkeit wird eine unterstützende Standardtherapie verabreicht.
Was muss ich tun, wenn ich die Einnahme einer Dosis versäumt habe?
Es ist wichtig, dass Sie keine Einnahme von Delstrigo versäumen oder überspringen.
Wenn Sie eine Dosis vergessen haben, nehmen Sie sie ein, sobald Sie das Versäumnis bemerken. Falls Sie es erst bemerken, wenn es bereits annähernd Zeit für die nächste Einnahme ist, überspringen Sie die versäumte Dosis und fahren Sie mit Ihrem gewohnten Einnahmeschema fort.
Nehmen Sie nicht zwei Dosen von Delstrigo auf einmal ein.
Wenn Sie sich nicht sicher sind, was Sie tun sollen, sprechen Sie mit Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin.
Kinder
Es ist nicht bekannt, ob Delstrigo bei Kindern unter 18 Jahren sicher ist und wirkt.
Welche Nebenwirkungen kann Delstrigo haben?
Alle Arzneimittel können unbeabsichtigte oder unerwünschte Wirkungen haben, sogenannte Nebenwirkungen.
Wenn Sie gegen HIV behandelt werden, kann es schwierig sein zu bestimmen, ob es sich bei einem Symptom um eine Nebenwirkung von Delstrigo oder einem anderen von Ihnen eingenommenen Medikament oder aber um eine Folge der HIV-Infektion selbst handelt. Daher ist es sehr wichtig, dass Sie über jegliche Veränderung Ihrer Gesundheit mit Ihrem Arzt bzw. Ihrer Ärztin sprechen.
Nebst den unten aufgelisteten Nebenwirkungen für Delstrigo, können auch andere Nebenwirkungen während der Kombinationstherapie gegen HIV auftreten.
Schwerwiegende Nebenwirkungen
Sprechen Sie unverzüglich mit Ihrem Arzt/Ihrer Ärztin, wenn Sie bei sich eine der folgenden schwerwiegenden Nebenwirkungen bemerken:
Allergische Reaktionen: Delstrigo enthält Doravirin, Lamivudin und Tenofovirdisoproxil (als Fumarat). Alle diese Wirkstoffe können eine schwerwiegende allergische Reaktion auslösen, die auch als Überempfindlichkeitsreaktion bezeichnet wird.
Die folgenden Nebenwirkungen wurden während der Einnahme von Delstrigo beobachtet:
Häufig (kann bei bis zu 1 von 10 Patienten auftreten): verändertes Träumen, Schlaflosigkeit; Kopfschmerzen, Schwindel, Schläfrigkeit; Husten, gereizte oder laufende Nase (nasale Symptome); Übelkeit, Durchfall, Magenschmerzen, Erbrechen, Blähungen (Flatulenz); Haarausfall, Ausschlag; Muskelbeschwerden (Schmerzen, Steifigkeit); Müdigkeit, Fieber.
Blutuntersuchungen können ausserdem anzeigen: Anstieg der Leberenzymwerte (ALT).
Gelegentlich (kann bei bis zu 1 von 100 Patienten auftreten): Alpträume, Depression, Angst, Reizbarkeit, Verwirrtheit, Gedanken an Selbsttötung; Konzentrationsschwierigkeiten, Gedächtnisprobleme, Kribbeln an Händen und Füssen, steife Muskeln, schlechter Schlaf; Bluthochdruck; Verstopfung, Magenbeschwerden, aufgedunsener oder aufgeblähter Bauch (abdominale Distension), Verdauungsbeschwerden, weicher Stuhl, Magenkrämpfe, häufiger Stuhlgang, Bauchspeicheldrüsenentzündung (Pankreatitis), die zu Magenschmerzen und Erbrechen führen kann; Juckreiz; Gelenkschmerzen, Zerfall von Muskelgewebe, Muskelschwäche; Schwächegefühl, allgemeines Unwohlsein.
Blutuntersuchungen können ausserdem anzeigen: verminderte Anzahl weisser Blutzellen (Neutropenie); verminderte Anzahl roter Blutzellen (Anämie); verminderte Anzahl Blutplättchen (Sie könnten zu Blutungen neigen), Abnahme des Phosphatspiegels, Abnahme des Kaliumspiegels, Anstieg des Kreatininspiegels, Anstieg der Leberenzymwerte (AST), Anstieg des Lipasespiegels, Anstieg des Amylasespiegels, Abnahme der Hämoglobinwerte.
Muskelschmerzen, Muskelschwäche und Abnahme der Kalium- oder Phosphatspiegel im Blut können als Folge einer Schädigung bestimmter Nierenzellen (Tubuluszellen) auftreten.
Selten (kann bei bis zu 1 von 1'000 Patienten auftreten): Aggression, Halluzinationen, Schwierigkeiten bei der Anpassung an Veränderungen, Stimmungsänderungen, Schlafwandeln; Atembeschwerden, vergrösserte Mandeln; Gefühl eines unvollständigen Stuhlgangs; vergrösserte Leber oder Fettleber, Gelbfärbung von Haut oder Augen, Bauchschmerzen durch eine Leberentzündung; allergische Hautentzündung, Rötungen an Wangen, Nase, Kinn oder Stirn, kleine erhöhte Knoten oder Pickel im Gesicht, Schwellungen von Gesicht, Lippen, Zunge oder Rachen; Muskelschwäche, Knochenschwäche (mit Knochenschmerzen und manchmal Brüchen als Folge); Schädigung der Nieren, Nierensteine, Nierenversagen, Schädigung bestimmter Nierenzellen (Tubuluszellen), Nierenerkrankung, Ausscheiden von grossen Urinmengen und Durstgefühl; Schmerzen im Brustkorb, Kältegefühl, Schmerz, Durst.
Blutuntersuchungen können ausserdem anzeigen: Abnahme des Magnesiumspiegels, Anhäufung von Milchsäure im Blut (Laktatazidose), Anstieg des Kreatinphosphokinasespiegels.
Sehr selten (kann bei bis zu 1 von 10'000 Patienten auftreten): Blutuntersuchungen können ausserdem anzeigen: Unvermögen des Knochenmarks neue rote Blutzellen zu bilden (Erythroblastopenie).
Fragen Sie Ihren Arzt bzw. Ihre Ärztin oder Ihren Apotheker bzw. Ihre Apothekerin für weitere Informationen. Beide verfügen über eine umfassendere Auflistung der Nebenwirkungen. Informieren Sie sofort Ihren Arzt bzw. Ihre Ärztin oder Ihren Apotheker bzw. Ihre Apothekerin, wenn Sie die beschriebenen oder sonstige ungewöhnliche Symptome bemerken.
Was ist ferner zu beachten?
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Delstrigo nicht über 30 °C lagern.
Das Arzneimittel ausser Reichweite von Kindern aufbewahren.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, der bzw. die über die ausführlichere Fachinformation verfügt.
Was ist in Delstrigo enthalten?
Delstrigo ist als gelbe, ovale Filmtablette erhältlich, auf einer Seite mit dem Firmenlogo und der Zahl «776» geprägt und auf der anderen Seite ungeprägt.
Jede Delstrigo-Tablette enthält 100 mg Doravirin, 300 mg Lamivudin und 245 mg Tenofovirdisoproxil (entsprechend 300 mg Tenofovirdisoproxilfumarat).
Darüber hinaus enthält Delstrigo folgende Hilfsstoffe: hochdisperses Siliciumdioxid E551, Croscarmellose-Natrium E468, Hypromelloseacetatsuccinat, Magnesiumstearat E470b, mikrokristalline Cellulose E460 und Natriumstearylfumarat. Die Tabletten sind mit einem Film überzogen, der folgende Hilfsstoffe enthält: Hypromellose E464, Eisenoxid gelb E172, Laktosemonohydrat, Titandioxid E171, Triacetin E1518 und Carnaubawachs E903.
Zulassungsnummer
67066 (Swissmedic).
Wo erhalten Sie Delstrigo? Welche Packungen sind erhältlich?
In Apotheken gegen ärztliche Verschreibung, die nur zum einmaligen Bezug berechtigt.
Delstrigo ist in Flaschen zu 30 Tabletten erhältlich.
Zulassungsinhaberin
MSD MERCK SHARP & DOHME AG, Luzern.
Diese Packungsbeilage wurde im August 2019 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
S-CCPPI-MK1439A-T-062019/MK1439A-CHE-2019-021456
Qu’est-ce que Delstrigo et quand doit-il être utilisé?
Delstrigo est utilisé pour traiter l'infection par le VIH chez l'adulte. Le VIH est le virus responsable du SIDA (syndrome d'immunodéficience acquise).
Delstrigo est un comprimé pelliculé contenant une association des principes actifs suivants: doravirine, lamivudine et fumarate de ténofovir disoproxil. La doravirine est un inhibiteur non nucléosidique de la transcriptase inverse (INNTI) dirigé contre le VIH-1. La lamivudine est un analogue nucléosidique qui inhibe la transcriptase inverse du VIH-1. Le fumarate de ténofovir disoproxil (sel de la prodrogue du ténofovir) est un analogue nucléosidique qui inhibe la transcriptase inverse du VIH-1.
Delstrigo est destiné aux personnes dont les antécédents médicaux n'ont pas révélé de résistance à la doravirine, à la lamivudine ou au ténofovir jusqu'à présent.
Delstrigo peut contribuer à réduire la quantité de VIH dans votre sang (appelée «charge virale») et à augmenter le nombre de lymphocytes T CD4+, des cellules capables de renforcer votre système immunitaire. Le traitement permet ainsi de réduire le risque de décès et le risque d'infections auxquelles sont exposées les personnes présentant un système immunitaire affaibli.
De quoi faut-il tenir compte en dehors du traitement?
Votre médecin vous a prescrit Delstrigo pour traiter votre infection par le VIH-1. Le VIH est une maladie transmissible par le sang, qui se transmet par contact avec du sang ou par contact sexuel avec une personne infectée.
Delstrigo ne permet pas de guérir l'infection par le VIH ni de guérir du SIDA. Il est important de prendre Dilstrego de façon continue afin de maîtriser votre infection par le VIH et de réduire le risque de contracter d'autres infections ou maladies.
Delstrigo ne réduit pas le risque de transmission du VIH à d'autres personnes par voie sexuelle, par contact avec du sang ou lors du partage de seringues (aiguilles d'injection). Continuez à vous protéger lors de vos rapports sexuels. Utilisez des préservatifs en latex ou à base de polyuréthane ou bien d'autres méthodes de barrière, afin de diminuer le risque de contact avec les liquides corporels tels que le sperme, les sécrétions vaginales ou le sang lors d'un rapport sexuel. Ne jamais réutiliser ou partager des aiguilles d'injection avec d'autres personnes.
Si vous avez des questions sur la manière appropriée de se protéger lors de rapports sexuels ou sur les précautions à prendre pour éviter de transmettre le VIH à d'autres personnes, adressez-vous à votre médecin.
Quand Delstrigo ne doit-il pas être pris?
Ne prenez pas Delstrigo si vous prenez déjà les médicaments suivants:
- carbamazépine, oxcarbazépine, phénobarbital et phénytoïne (médicaments pour traiter les crises convulsives),
- rifampicine et rifapentine (médicaments pour traiter la tuberculose),
- millepertuis (Hypericum perforatum),
- mitotane (médicament pour traiter certains types de cancers),
- enzalutamide (médicament pour traiter le cancer de la prostate),
- lumacaftor (médicament pour traiter la mucoviscidose).
Ne prenez pas Delstrigo si vous êtes allergique à la doravirine, à la lamivudine, au fumarate de ténofovir disoproxil ou à l'un des autres composants de ce médicament.
Quelles sont les précautions à observer lors de la prise de Delstrigo?
Si vous remarquez des effets secondaires, veuillez en informer votre médecin, votre pharmacien ou votre infirmier/ière. Cela vaut également pour d'éventuels effets secondaires qui ne sont pas mentionnés dans cette notice d'emballage. Voir «Quels effets secondaires Delstrigo peut-il provoquer?» pour de plus amples informations sur les effets secondaires.
Transmission du VIH à d'autres personnes
Le VIH se transmet par contact avec du sang ou par contact sexuel avec une personne infectée par le VIH. Vous pouvez quand même transmettre le VIH à d'autres personnes si vous prenez Delstrigo, bien qu'un traitement efficace diminue le risque. Discutez avec votre médecin des précautions à prendre pour éviter de contaminer d'autres personnes.
Interactions avec d'autres médicaments
Certains médicaments peuvent interagir avec Delstrigo. Dressez une liste de tous les médicaments que vous utilisez afin de pouvoir la montrer à votre médecin ou à votre pharmacien.
Vous pouvez demander à votre médecin ou à votre pharmacien une liste de tous les médicaments qui interagissent avec Delstrigo.
Ne commencez pas à prendre un nouveau médicament sans en avoir informé votre médecin. Il peut vous dire si la prise de Delstrigo avec d'autres médicaments est sûre pour vous.
Ne prenez pas d'autres médicaments contenant du fumarate de ténofovir disoproxil, du ténofovir alafénamide, de la lamivudine, de l'emtricitabine ou de l'adéfovir dipivoxil.
Co-infection par l'hépatite B ou C et maladie hépatique
Informez votre médecin si vous avez, ou avez eu, une maladie hépatique, y compris une hépatite. Les patients ayant une maladie hépatique, comme une hépatite B ou C chronique, et traités par des médicaments antirétroviraux présentent un risque accru de complications hépatiques graves et potentiellement fatales. Si vous avez une hépatite B, votre médecin évaluera avec attention le schéma de traitement qui vous convient le mieux. Si vous avez, ou avez eu par le passé, une maladie hépatique ou une hépatite B chronique, votre médecin peut vous faire effectuer des tests sanguins afin de surveiller attentivement votre fonction hépatique.
Si vous souffrez d'hépatite B, vos problèmes de foie pourraient s'aggraver après l'arrêt de Delstrigo. Il est important de ne pas arrêter la prise de Delstrigo sans en parler à votre médecin: voir «Comment utiliser Delstrigo?».
Apparition ou aggravation de problèmes rénaux, y compris une insuffisance rénale
Ceux-ci peuvent apparaître chez certaines personnes qui prennent Delstrigo. Avant et pendant le traitement par Delstrigo, votre médecin vous vous fera effctuer des tests sanguins afin d'évaluer votre fonction rénale.
Problèmes osseux
Ceux-ci peuvent se produire chez certaines personnes qui prennent Delstrigo. Les problèmes osseux sont notamment des douleurs osseuses, une fragilisation ou un amincissement des os (pouvant conduire à des fractures). Il se peut que votre médecin ait besoin de vous prescrire des examens complémentaires pour vérifier l'état de vos os.
Syndrome de restauration immunitaire
Les personnes atteintes d'une infection par le VIH à un stade avancé ou du SIDA présentent un système immunitaire affaibli et développent plus facilement des infections graves («infections opportunistes»). Avant l'instauration du traitement, de telles infections peuvent évoluer de manière latente, sans que le système immunitaire affaibli n'ait pu les détecter. Après l'instauration du traitement, le système immunitaire se renforce et est susceptible de combattre ces infections, pouvant entraîner l'apparition de symptômes d'infection et d'inflammation. De manière générale, ces symptômes incluent: fièvre, maux de tête, douleurs abdominales, difficulté à respirer.
Dans de rares cas, lorsque le système immunitaire se renforce, ce dernier peut aussi attaquer des tissus sains de l'organisme («maladies auto-immunes»). Les symptômes d'une maladie auto-immune peuvent se développer plusieurs mois après que vous ayez commencé à prendre des médicaments pour traiter votre infection par le VIH. Ces symptômes incluent: rythme cardiaque élevé ou irrégulier (palpitations) ou tremblements,agitation excessive et besoin de bouger (hyperactivité), faiblesse qui débute dans les mains et les pieds puis remonte vers le tronc.
Ne prenez pas d'autres médicaments contre votre infection sans l'avis préalable de votre médecin.
Lactose
Si votre médecin vous a dit que vous aviez une intolérance au lactose, consultez-le avant de prendre ce médicament.
Veuillez informer votre médecin ou votre pharmacien de toutes les maladies dont vous souffrez actuellement ou avez souffert par le passé et faites-lui part d'éventuelles allergies. Veuillez informer votre médecin de tous les médicaments que vous prenez, y compris les médicaments soumis et non soumis à ordonnance, les vitamines et les préparations à base de plantes.
Infections opportunistes
Si vous remarquez de quelconques symptômes d'une infection, veuillez en informer immédiatement votre médecin. Chez certains patients présentant une infection par le VIH à un stade avancé et des antécédents d'infections opportunistes, les signes et symptômes inflammatoires des infections antérieures peuvent survenir peu après le début du traitement antirétroviral. Ces symptômes seraient dus à une amélioration de la réponse immunitaire, permettant alors à l'organisme de combattre les infections qui pouvaient être auparavant présentes sans symptôme évident.
Ostéonécrose
Certains patients traités par une association d'antirétroviraux peuvent développer une maladie des os appelée ostéonécrose (mort de tissu osseux par manque d'irrigation sanguine de l'os). La durée du traitement par association d'antirétroviraux, l'utilisation de corticoïdes, la consommation d'alcool, une importante suppression du système immunitaire ou un indice de masse corporelle élevé peuvent faire partie, entre autres, des nombreux facteurs de risque de développement de cette maladie. Les signes d'ostéonécrose sont une raideur et des douleurs articulaires (en particulier au niveau de la hanche, du genou et de l'épaule), ainsi que des difficultés à se mouvoir. Si vous ressentez l'un de ces symptômes, veuillez en informer votre médecin.
Aptitude à la conduite et l'utilisation de machines
N'utilisez pas de machines et ne conduisez pas de voiture ni de vélo si vous vous sentez étourdi(e) après avoir pris ce médicament.
Delstrigo peut-il être pris pendant la grossesse ou l’allaitement?
Si vous êtes enceinte ou envisagez une grossesse, informez-en votre médecin avant de prendre Delstrigo.
En cas de grossesse, on ignore si Delstrigo peut être nocif pour le fœtus.
Si vous prenez des médicaments anti-VIH et que vous êtes enceinte, parlez avec votre médecin du registre des grossesses sous antirétroviraux (Antiretroviral Pregnancy Registry). Ce registre permet de recueillir des renseignements sur la santé des mères prenant des médicaments anti-VIH durant leur grossesse et celle de leurs enfants.
N'allaitez pas si vous êtes infectée par le VIH, car vous risqueriez de transmettre le VIH à votre bébé via le lait maternel.
Comment utiliser Delstrigo?
Prenez Delstrigo en vous conformant exactement aux instructions de votre médecin.
Prenez un comprimé une fois par jour, toujours à peu près à la même heure, avec ou sans nourriture.
Ne changez pas de votre propre chef le dosage prescrit ni n'interrompez le traitement par ce médicament ou d'autres médicaments anti-VIH sans l'avis de votre médecin. Veillez à rester sous suivi médical tout au long de votre traitement par Delstrigo.
Co-administration avec la rifabutine
En cas de prise concomitante de Delstrigo et de rifabutine, prenez un comprimé de Pifeltro environ 12 heures après la prise de la dose de Delstrigo. Votre médecin vous instruira à ce sujet.
Que dois-je faire en cas de surdosage?
Si vous avez pris trop de Delstrigo, contactez immédiatement votre médecin ou votre pharmacien.
Il n'existe aucun traitement spécifique connu en cas de surdosage par Delstrigo. En cas de surdosage, votre état doit être surveillé; si nécessaire, une thérapie standard de soutien sera administrée.
Que dois-je faire si j'ai oublié de prendre une dose?
Il est important de ne pas oublier ou sauter de dose de Delstrigo.
Si vous avez oublié de prendre une dose, prenez-la dès que vous vous en rendez compte. Si vous n'y pensez qu'au moment où il est presque temps de prendre la dose suivante, ne prenez pas la dose oubliée et poursuivez votre traitement selon le schéma de prise habituel.
Ne prenez jamais deux doses de Delstrigo d'un coup.
Si vous n'êtes pas sûr(e) de quoi faire, adressez-vous à votre médecin ou à votre pharmacien.
Enfants
On ignore si Delstrigo est sûr et efficace chez les enfants de moins de 18 ans.
Quels effets secondaires Delstrigo peut-il provoquer?
Tous les médicaments sont susceptibles de provoquer des effets involontaires ou indésirables que l'on appelle effets secondaires.
Dans le cadre du traitement anti-VIH, il peut être difficile de déterminer si un symptôme constitue un effet secondaire de Delstrigo ou d'un autre médicament que vous prenez, ou s'il est le résultat de l'infection VIH elle-même. Il est donc très important que vous parliez à votre médecin de tout changement de votre état de santé.
Parallèlement aux effets secondaires liés à Delstrigo et mentionnés ci-après, d'autres effets secondaires peuvent se manifester dans le cadre d'un traitement combiné anti-VIH.
Effets secondaires graves
Si vous remarquez un des effets secondaires graves suivants, parlez-en immédiatement à votre médecin:
Réactions allergiques: Delstrigo contient de la doravirine, de la lamivudine et du ténofovir disoproxil (sous forme de fumarate). Ces principes actifs sont susceptibles de déclencher une réaction allergique grave, également appelée réaction d'hypersensibilité.
Les effets secondaires suivants ont été observés durant la prise de Delstrigo:
Fréquents (pouvant affecter jusqu'à 1 patient sur 10): rêves anormaux, insomnie; maux de tête, vertige, somnolence; toux, nez irrité ou qui coule (symptômes nasaux); nausée, diarrhée; douleurs gastriques, vomissements, ballonnements (flatulences); perte de cheveux, éruption cutanée; douleurs musculaires (douleurs, rigidité); fatigue, fièvre.
Par ailleurs, les analyses de sang peuvent révéler une augmentation du taux d'enzymes hépatiques (ALAT).
Occasionnels (pouvant affecter jusqu'à 1 patient sur 100): cauchemars, dépression, anxiété, irritabilité, confusion, pensées suicidaires; difficultés de concentration, problèmes de mémoire, fourmillements dans les mains et les pieds, raideurs musculaires, mauvaise qualité de sommeil; hypertension artérielle; constipation, maux d'estomac, ventre gonflé ou ballonné (distension abdominale), troubles digestifs, selles molles, crampes d'estomac, selles fréquentes, inflammation du pancréas (pancréatite) pouvant causer des maux d'estomac et des vomissements; démangeaisons; douleurs articulaires, rupture du tissu musculaire, faiblesse musculaire; sensation de faiblesse, sensation générale de malaise.
Par ailleurs, les analyses de sang peuvent révéler une diminution du nombre de globules blancs (neutropénie); une diminution du nombre de globules rouges (anémie); une diminution du nombre de plaquettes sanguines (vous pouvez saigner plus facilement), une diminution du taux de phosphate, une diminution du taux de potassium, une augmentation du taux de créatinine, une augmentation du taux d'enzymes hépatiques (ASAT), une augmentation du taux de lipase, une augmentation du taux d'amylase, une diminution du taux d'hémoglobine.
Les douleurs musculaires, la faiblesse musculaire et la diminution du taux de potassium ou de phosphate dans le sang peuvent être la conséquence d'une lésion au niveau de cellules rénales spécifiques (cellules tubulaires).
Rares (pouvant affecter jusqu'à 1 patient sur 1'000): agressivité, hallucinations, difficultés à s'adapter aux changements, changements de l'humeur, somnambulisme; difficultés à respirer, amygdales gonflées; sensation de défécation incomplète; hypertrophie du foie ou fois gras, peau ou yeux jaunes, douleurs abdominales causées par une inflammation du foie; inflammation de la peau due à une allergie, rougeurs au niveau des joues, du nez, du menton ou du front, petites bosses ou boutons sur le visage, gonflements du visage, des lèvres, de la langue ou de la gorge; faiblesse musculaire, fragilisation des os (avec des douleurs osseuses conduisant parfois à des fractures); affections rénales, calculs rénaux, insuffisance rénale, lésions de certaines cellules rénales (cellules tubulaires), maladie rénale, émission d'une quantité d'urine très importante et sensation de soif; douleurs thoraciques, sensation de froid, douleurs, soif.
Par ailleurs, les analyses de sang peuvent révéler une diminution du taux de magnésium, une accumulation d'acide lactique dans le sang (acidose lactique), une augmentation du taux de créatine phosphokinase.
Très rares (pouvant affecter jusqu'à 1 patient sur 10'000): Par ailleurs, les analyses de sang peuvent révéler un échec de la moelle osseuse à produire de nouveaux globules rouges (érythroblastopénie).
Pour de plus amples informations, demandez à votre médecin ou à votre pharmacien qui disposent d'une liste plus exhaustive des effets secondaires. Si vous remarquez des effets secondaires mentionnés dans cette notice ou si vous développez des symptômes inhabituels, veuillez immédiatement en informer votre médecin ou votre pharmacien.
À quoi faut-il encore faire attention?
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Ne pas conserver Delstrigo au-dessus de 30 °C.
Conserver hors de la portée des enfants.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Delstrigo?
Delstrigo est disponible sous forme de comprimé pelliculé jaune et ovale, gravé avec le logo d'entreprise et le nombre «776» sur une face, et lisse sur l'autre face.
Chaque comprimé de Delstrigo contient 100 mg de doravirine, 300 mg de lamivudine et 245 mg de ténofovir disoproxil (correspond à 300 mg de fumarate de ténofovir disoproxil).
De plus, Delstrigo contient les excipients suivants: silice colloïdale anhydre E551, croscarmellose sodique E468, succinate d'acétate d'hypromellose, stéarate de magnésium E470b, cellulose microcristalline E460 et stéarylfumarate de sodium. Les comprimés sont recouverts d'un pelliculage qui contient les excipients suivants: hypromellose E464, oxyde de fer jaune E172, lactose monohydraté, dioxyde de titane E171, triacétine E1518 et cire de carnauba E903.
Numéro d’autorisation
67066 (Swissmedic).
Où obtenez-vous Delstrigo? Quels sont les emballages à disposition sur le marché?
En pharmacie, seulement sur ordonnance médicale non renouvelable.
Delstrigo est disponible en flacon de 30 comprimés.
Titulaire de l’autorisation
MSD MERCK SHARP & DOHME AG, Lucerne.
Cette notice d'emballage a été vérifiée pour la dernière fois en août 2019 par l'autorité de contrôle des médicaments (Swissmedic).
S-CCPPI-MK1439A-T-062019/MK1439A-CHE-2019-021456
Che cos’è Delstrigo e quando si usa?
Delstrigo è usato per il trattamento di un'infezione da HIV negli adulti. L'HIV è il virus responsabile dell'AIDS (Acquired Immune Deficiency Syndrome, sindrome da immunodeficienza acquisita).
Delstrigo è una compressa rivestita con film, contenente una combinazione dei principi attivi doravirina, lamivudina e tenofovir disoproxil fumarato. Doravirina è un inibitore non nucleosidico della trascrittasi inversa (NNRTI) diretto contro l'HIV-1. Lamivudina è un analogo nucleosidico che inibisce la trascrittasi inversa dell'HIV-1. Tenofovir disoproxil fumarato (il sale fumarato del precursore del tenofovir) è un analogo nucleosidico che inibisce la trascrittasi inversa dell'HIV-1.
Delstrigo va usato in persone che nella loro storia clinica non hanno finora presentato resistenza virale a doravirina, lamivudina o tenofovir.
Delstrigo può contribuire a ridurre il numero di virus HI presenti nel suo sangue (la cosiddetta «carica virale») e ad aumentare il numero di cellule (T) CD4+, che possono rafforzare il suo sistema immunitario. In tal modo è possibile diminuire il rischio di morte e il rischio di contrarre infezioni, che possono manifestarsi nelle persone con sistema immunitario indebolito.
Di che cosa occorre inoltre tener conto durante il trattamento?
Il suo medico le ha prescritto Delstrigo per il trattamento della sua infezione da HIV-1. L'HIV è una malattia trasmissibile attraverso il sangue, per contatto con sangue o tramite il contatto sessuale con una persona infetta.
Delstrigo non può guarire dall'infezione da HIV o dall'AIDS. È importante assumere Delstrigo in maniera continuativa per tenere sotto controllo la sua infezione da HIV e ridurre il rischio di contrarre ulteriori infezioni o malattie.
Delstrigo non riduce il rischio di trasmissione dell'HIV ad altre persone tramite contatto sessuale, contatto con il sangue o uso comune di aghi di iniezione. Continui ad avere rapporti sessuali protetti. Utilizzi preservativi in lattice o in poliuretano, oppure altri metodi di barriera, per ridurre il rischio di un contatto con fluidi corporei quali sperma, secrezione vaginale o sangue durante i rapporti sessuali. Non riutilizzi né condivida mai gli aghi di iniezione con altre persone.
Per domande riguardanti i rapporti sessuali protetti o per la prevenzione della trasmissione dell'HIV ad altre persone si rivolga al suo medico.
Quando non si può assumere Delstrigo?
Non prenda Delstrigo se sta assumendo i medicamenti seguenti:
- carbamazepina, oxcarbazepina, fenobarbital e fenitoina (medicamenti per il trattamento delle convulsioni);
- rifampicina e rifapentina (medicamenti per il trattamento della tubercolosi);
- erba di S. Giovanni (Hypericum perforatum);
- mitotano (medicamento per il trattamento di determinate forme di cancro);
- enzalutamide (medicamento per il trattamento del cancro della prostata);
- lumacaftor (medicamento per il trattamento della fibrosi cistica).
Non assuma Delstrigo, se è allergico a doravirina, lamivudina, tenofovir disoproxil fumarato o ad uno qualsiasi degli altri componenti di questo medicamento.
Quando è richiesta prudenza nella somministrazione di Delstrigo?
Se osserva effetti collaterali, si rivolga al suo medico, al suo farmacista o al suo infermiere. Ciò vale anche per gli eventuali effetti collaterali non riportati in questa informazione destinata ai pazienti. Per ulteriori informazioni sugli effetti collaterali vedere «Quali effetti collaterali può avere Delstrigo?»
Trasmissione dell'HIV ad altri
L'infezione da HIV si trasmette attraverso il contatto con il sangue o attraverso il contatto sessuale con una persona affetta da HIV. Lei può ancora trasmettere l'HIV mentre sta prendendo Delstrigo, sebbene una terapia efficace riduca il rischio. Consulti il suo medico su cosa fare per evitare di trasmettere l'infezione ad altre persone.
Interazioni con altri medicamenti
Alcuni medicamenti possono avere interazioni con Delstrigo. Tenga un elenco dei medicamenti che sta usando, per poterlo mostrare al suo medico o al suo farmacista.
Può chiedere al suo medico o al suo farmacista un elenco dei medicamenti che interagiscono con Delstrigo.
Non inizi ad assumere un nuovo medicamento senza aver prima informato il suo medico. Il suo medico può dirle se l'assunzione di Delstrigo assieme ad altri medicamenti è sicura.
Non prenda altri medicamenti contenenti tenofovir disoproxil fumarato, tenofovir alafenamide, lamivudina, emtricitabina o adefovir dipivoxil.
Coinfezione da virus dell'epatite B o C e malattia epatica
Informi il suo medico, se soffre o ha sofferto di malattie del fegato, inclusa l'epatite. I pazienti con malattie del fegato come un'epatite cronica B o C sottoposti a trattamento con medicamenti antiretrovirali presentano un rischio maggiore di complicazioni al fegato gravi e eventualmente fatali. Se è affetto da epatite B, il suo medico sceglierà accuratamente il miglior trattamento per lei. Se ha o ha avuto in passato malattie del fegato o epatite cronica B, il suo medico può eseguire esami del sangue per monitorare accuratamente la funzionalità epatica.
Se è affetto da epatite B, i problemi al fegato possono peggiorare quando interrompe il trattamento con Delstrigo. È importante che non interrompa il trattamento con Delstrigo senza parlarne con il suo medico (vedere «Come usare Delstrigo?».
Nuovi casi o peggioramento di problemi renali, compresa insufficienza renale
Ciò può accadere in alcune persone che assumono Delstrigo. Il suo medico eseguirà esami del sangue per verificare la funzione renale prima e durante il trattamento con Delstrigo.
Problemi alle ossa
Ciò può accadere in alcune persone che assumono Delstrigo. I problemi alle ossa possono comprendere dolore osseo, rammollimento o assottigliamento delle ossa (che può provocare delle fratture). Il suo medico può avere la necessità di effettuare ulteriori test per controllare lo stato delle sue ossa.
Sindrome da riattivazione immunitaria
Le persone con infezione da HIV avanzata o con AIDS hanno un sistema immunitario indebolito e tendono a sviluppare infezioni gravi («infezioni opportunistiche»). Prima dell'inizio del trattamento, tali infezioni possono avere un decorso «silente» e non essere riconosciute dal sistema immunitario indebolito. Dopo aver iniziato il trattamento, il sistema immunitario si rafforza e può iniziare a contrastare queste infezioni, per cui possono manifestarsi sintomi associati all'infezione e sintomi infiammatori. Questi sintomi comprendono in generale febbre, mal di testa, dolori addominali e difficoltà di respirazione.
In casi rari, quando il sistema immunitario si rafforza può attaccare anche i tessuti sani del corpo («malattie autoimmuni»). I sintomi di una malattia autoimmune possono insorgere molti mesi dopo aver iniziato ad assumere i medicamenti per il trattamento dell'infezione da HIV. Questi sintomi comprendono battito cardiaco accelerato o irregolare (palpitazioni) o tremori, profonda agitazione e iperattività, debolezza che comincia inizialmente nelle mani e nei piedi e poi sale verso il tronco del corpo.
Non assuma altri medicamenti contro l'infezione, senza consultare il suo medico.
Lattosio
Se il suo medico le ha detto che soffre di intolleranza al lattosio, parli con lui prima di assumere questo medicamento.
Informi il suo medico o il suo farmacista di tutte le malattie di cui soffre attualmente o di cui ha sofferto in passato, nonché di eventuali allergie. Comunichi al suo medico tutti i medicamenti che assume, compresi quelli soggetti a prescrizione medica e quelli senza obbligo di ricetta, le vitamine e i preparati erboristici.
Infezioni opportunistiche
Informi immediatamente il suo medico se nota qualsiasi sintomo di infezione. In alcuni pazienti con infezione avanzata da HIV e con una storia clinica di infezioni opportunistiche, subito dopo aver iniziato il trattamento anti-HIV, possono insorgere segni e sintomi infiammatori di precedenti infezioni. Si ritiene che tali sintomi siano dovuti ad un miglioramento della risposta immunitaria dell'organismo, che gli permette di combattere le infezioni che possono essersi presentate senza chiari sintomi.
Osteonecrosi
In alcuni pazienti che ricevono un trattamento antiretrovirale di combinazione può insorgere una malattia delle ossa chiamata osteonecrosi (morte del tessuto osseo per mancanza di apporto di sangue all'osso). Fra i vari fattori di rischio di insorgenza di questa malattia vi sono tra l'altro la durata del trattamento antiretrovirale di combinazione, l'uso di corticosteroidi, il consumo di alcol, una forte soppressione del sistema immunitario o un indice di massa corporea elevato. I segni di una osteonecrosi sono rigidità e dolori articolari (in particolare dell'anca, del ginocchio e della spalla), nonché difficoltà di movimenti. Se osserva uno di questi segni, si rivolga al medico.
Capacità di condurre un veicolo e di utilizzare macchine
Non utilizzi macchinari e non guidi veicoli né biciclette, se avverte sonnolenza dopo l'assunzione di questo medicamento.
Si può assumere Delstrigo durante la gravidanza o l’allattamento?
Se è in corso una gravidanza o se sta pianificando una gravidanza, informi il suo medico prima di ricevere Delstrigo.
Non è noto se in caso di gravidanza Delstrigo possa nuocere al nascituro.
Se assume medicamenti contro l'HIV ed è incinta, parli con il suo medico del registro delle gravidanze in corso di trattamento anti-HIV (Antiretroviral Pregnancy Registry). In questo registro vengono raccolte informazioni sulle madri e sui loro figli, nel caso in cui la madre assuma medicamenti contro l'HIV durante la gravidanza.
Non allatti, se ha un'infezione da HIV. Vi è il rischio che suo figlio venga contagiato dall'HIV attraverso il latte materno.
Come usare Delstrigo?
Assuma Delstrigo esattamente secondo le istruzioni del suo medico.
Prenda ogni giorno, all'incirca alla stessa ora, 1 compressa con o senza cibo.
Non modifichi la dose di questo o di altri medicamenti contro l'HIV e non ne sospenda l'assunzione senza consultare il suo medico. Durante il trattamento con Delstrigo rimanga continuamente sotto controllo medico.
Somministrazione in concomitanza con rifabutina
Se Delstrigo viene assunto in concomitanza con rifabutina, assuma una compressa di Pifeltro circa 12 ore dopo la dose di Delstrigo. Il suo medico le dirà cosa fare.
Che cosa devo fare in caso di sovradosaggio?
Se ha assunto una quantità eccessiva di Delstrigo, informi immediatamente il suo medico o il suo farmacista.
Non sono noti trattamenti specifici in caso di sovradosaggio di Delstrigo. Se si verifica un sovradosaggio, occorre tenere sotto controllo le sue condizioni di salute; se necessario, viene somministrata una terapia di supporto standard.
Che cosa devo fare se dimentico di assumere una dose?
È importante che non dimentichi né salti alcuna assunzione di Delstrigo.
Se ha dimenticato una dose, la prenda non appena si accorge della dimenticanza. Qualora dovesse accorgersi della dimenticanza solo quando è già quasi il momento dell'assunzione successiva, non prenda la dose dimenticata e prosegua secondo l'abituale schema di assunzione.
Non assuma due dosi di Delstrigo in una volta sola.
Se non è sicuro su cosa fare, si rivolga al suo medico o al suo farmacista.
Bambini
Non è noto se Delstrigo sia sicuro ed efficace nei bambini sotto i 18 anni.
Quali effetti collaterali può avere Delstrigo?
Tutti i medicamenti possono avere effetti non intenzionali o indesiderati, i cosiddetti effetti collaterali.
Nel caso in cui venga trattato contro l'HIV, può essere difficile stabilire se un determinato sintomo sia un effetto collaterale di Delstrigo o di un altro dei medicamenti da lei assunto o se si tratti invece di una conseguenza dell'infezione stessa da HIV. È quindi molto importante che comunichi al suo medico qualsiasi variazione del suo stato di salute.
Oltre agli effetti collaterali elencati per Delstrigo, durante la terapia combinata contro l'HIV possono manifestarsi anche altri effetti collaterali.
Effetti collaterali seri
Si rivolga immediatamente al suo medico, se manifesta uno dei seguenti effetti collaterali seri.
Reazioni allergiche: Delstrigo contiene doravirina, lamivudina e tenofovir disoproxil (come fumarato). Tutti questi principi attivi possono causare una reazione allergica seria, denominata anche reazione di ipersensibilità.
Durante l'assunzione di Delstrigo sono stati osservati i seguenti effetti collaterali:
Comune (può interessare fino a 1 paziente su 10): sogni anormali, insonnia; mal di testa, capogiri, sonnolenza; tosse, naso irritato o naso che cola (sintomi nasali); nausea, diarrea; mal di stomaco, vomito, meteorismo (flatulenza); perdita di capelli, eruzione cutanea; sintomi muscolari (dolori, rigidezza); stanchezza, febbre.
Gli esami del sangue possono inoltre evidenziare: aumento dei livelli degli enzimi epatici (ALT).
Non comune (può interessare fino a 1 paziente su 100): incubi, depressione, ansia, irritabilità, confusione, pensieri suicidari; problemi di concentrazione, problemi di memoria, formicolio alle mani e ai piedi, rigidità muscolare, scarsa qualità del sonno; pressione del sangue alta; stitichezza, fastidio allo stomaco, stomaco gonfio (distensione addominale), indigestione, feci molli, spasmi dello stomaco, movimenti intestinali frequenti, infiammazione del pancreas (pancreatite) che può causare dolore allo stomaco e vomito; prurito; dolore articolare, rottura del tessuto muscolare, debolezza muscolare; sensazione di debolezza, sensazione generale di malessere.
Gli esami del sangue possono inoltre evidenziare: diminuzione del numero di globuli bianchi nel sangue (neutropenia); diminuzione del numero di globuli rossi nel sangue (anemia); diminuzione dei livelli di piastrine nel sangue (potrebbe predisporre ai sanguinamenti), diminuzione dei livelli di fosfato, diminuzione dei livelli di potassio, aumento dei livelli di creatinina, aumento dei livelli degli enzimi epatici (AST), aumento dei livelli di lipasi, aumento dei livelli di amilasi, diminuzione dei livelli di emoglobina.
Il dolore muscolare, la debolezza muscolare e la riduzione di potassio o fosfato nel sangue possono verificarsi a causa del danno a determinate cellule renali (cellule tubulari).
Raro (può interessare fino a 1 paziente su 1000): aggressività, allucinazioni, difficoltà ad adeguarsi ai cambiamenti, cambiamenti dell'umore, sonnambulismo; difficoltà a respirare, tonsille ingrossate; sensazione di non completa defecazione; ingrossamento del fegato o accumulo di grasso nel fegato, ingiallimento della pelle o degli occhi, dolore alla pancia causato da un'infiammazione del fegato; infiammazione della pelle causata da allergia, arrossamento delle guance, del naso, del mento o della fronte, protuberanze o brufoli sul viso, gonfiore della faccia, delle labbra, della lingua o della gola; debolezza muscolare, indebolimento delle ossa (con dolore osseo e talvolta con conseguenti fratture); danno ai reni, calcoli ai reni, insufficienza renale, danno a determinate cellule renali (cellule tubulari), lesione renale, urine abbondanti e sensazione di sete; dolore al torace, sensazione di freddo, dolore, sete.
Gli esami del sangue possono inoltre evidenziare: diminuzione dei livelli di magnesio, accumulo di acido lattico nel sangue (acidosi lattica), aumento dei livelli di creatinfosfochinasi.
Molto raro (può interessare fino a 1 paziente su 10'000): Gli esami del sangue possono inoltre evidenziare: incapacità del midollo osseo a produrre nuovi globuli rossi del sangue (aplasia specifica della serie rossa).
Per ulteriori informazioni, si rivolga al suo medico o al suo farmacista, che dispongono di un elenco più dettagliato degli effetti collaterali. Informi immediatamente il suo medico o il suo farmacista, se osserva i sintomi descritti o altri sintomi insoliti.
Di che altro occorre tener conto?
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Non conservare Delstrigo a temperature superiori a 30 °C.
Conservare il medicamento fuori dalla portata dei bambini.
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Delstrigo?
Delstrigo è disponibile in compressa gialla, di forma ovale, rivestita con film, con impresso il logo aziendale e il numero «776» su un lato e liscia sull'altro lato.
Ogni compressa di Delstrigo contiene 100 mg di doravirina, 300 mg di lamivudina e 245 mg di tenofovir disoproxil (corrispondenti a 300 mg di tenofovir disoproxil fumarato).
Delstrigo contiene inoltre le sostanze ausiliarie seguenti: silice colloidale anidra (E551), croscarmellosa sodica (E468), ipromellosa acetato succinato, magnesio stearato (E470b), cellulosa microcristallina (E460) e sodio stearil fumarato. Le compresse sono rivestite con un film che contiene le seguenti sostanze ausiliarie: ipromellosa (E464), ferro ossido giallo (E172), lattosio monoidrato, titanio diossido (E171), triacetina (E1518) e cera di carnauba (E903).
Numero dell’omologazione
67066 (Swissmedic).
Dove è ottenibile Delstrigo? Quali confezioni sono disponibili?
In farmacia, su prescrizione medica non rinnovabile.
Delstrigo è disponibile in flaconi da 30 compresse.
Titolare dell’omologazione
MSD MERCK SHARP & DOHME AG, Lucerna.
Questo foglietto illustrativo è stato controllato l'ultima volta nell'agosto 2019 dall'autorità competente in materia di medicamenti (Swissmedic).
S-CCPPI-MK1439A-T-062019/MK1439A-CHE-2019-021456
Zusammensetzung
Wirkstoffe
Eine Tablette enthält 100 mg Doravirin, 300 mg Lamivudin und 245 mg Tenofovirdisoproxil (entsprechend 300 mg Tenofovirdisoproxilfumarat) als Wirkstoffe.
Hilfsstoffe
Eine Tablette enthält die folgenden Hilfsstoffe: hochdisperses Siliciumdioxid (E551), Croscarmellose-Natrium (E468), Hypromelloseacetatsuccinat, Magnesiumstearat (E470b), mikrokristalline Cellulose (E460) und Natriumstearylfumarat. Die Tabletten sind mit einem Film überzogen, der die folgenden Hilfsstoffe enthält: Hypromellose (E464), Eisenoxid gelb (E172), Laktosemonohydrat, Titandioxid (E171) und Triacetin (E1518) und Carnaubawachs (E903).
Darreichungsform und Wirkstoffmenge pro Einheit
Jede Filmtablette enthält 100 mg Doravirin, 300 mg Lamivudin und 245 mg Tenofovirdisoproxil (entsprechend 300 mg Tenofovirdisoproxilfumarat).
Indikationen/Anwendungsmöglichkeiten
Delstrigo ist indiziert für die Behandlung einer Infektion mit dem humanen Immundefizienzvirus Typ 1 (HIV 1) bei therapienaiven Erwachsenen, oder zum Ersatz der aktuellen antiretroviralen Therapie bei Patienten die:
- kein virologisches Therapieversagen in der Vergangenheit hatten, und
- seit mindestens 6 Monate mit einer stabilen antiretroviralen Therapie virologisch supprimiert sind (HIV-1-RNA <50 Kopien/ml), und
- bei denen zu keinem Zeitpunkt HIV-1-Mutationen gefunden wurden, die bekanntermassen mit Resistenzen gegen Doravirin, Lamivudin oder Tenofovir assoziiert sind.
Dosierung/Anwendung
Die Therapie sollte von einem Arzt oder einer Ärztin, der bzw. die Erfahrung in der Behandlung der HIV-Infektion besitzt, eingeleitet und überwacht werden.
Erwachsene
Das empfohlene Dosierungsschema für Delstrigo bei Erwachsenen besteht in einer Tablette per os einmal täglich mit oder ohne Nahrung.
Dosisanpassung aufgrund unerwünschter Wirkungen/Interaktionen
Für Dosierungsanpassungen bei Einnahme von Begleitmedikationen siehe Rubrik «Interaktionen».
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Bei leichter (Child-Pugh-Klasse A) oder mässiger (Child-Pugh-Klasse B) Einschränkung der Leberfunktion ist keine Anpassung der Dosis von Delstrigo erforderlich. Delstrigo wurde bei Patienten mit schwerer Einschränkung der Leberfunktion (Child-Pugh-Klasse C) nicht untersucht (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Pharmakokinetik»).
Patienten mit Nierenfunktionsstörungen
Da es sich bei Delstrigo um eine Fixdosis-Kombinationstablette handelt und die Dosierung von Lamivudin und Tenofovir-DF nicht verändert werden kann, sollten Patienten mit einer geschätzten Kreatinin-Clearance von weniger als 50 ml/min nicht mit Delstrigo behandelt werden (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Pharmakokinetik»).
Ältere Patienten
Zur Anwendung von Doravirin, Lamivudin und Tenofovirdisoproxilfumarat (Tenofovir-DF) bei Patienten ab 65 Jahren liegen nur begrenzte Daten vor. Es liegen keine Hinweise darauf vor, dass ältere Patienten eine andere Dosis benötigen würden als jüngere erwachsene Patienten (siehe «Pharmakokinetik»). Wegen altersbedingter Veränderungen, wie der verminderten Nierenfunktion ist bei dieser Altersgruppe besondere Vorsicht geboten.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Delstrigo bei Patienten unter 18 Jahren wurden nicht untersucht (siehe «Pharmakokinetik»). Delstrigo wird für die Anwendung bei Patienten unter 18 Jahren nicht empfohlen.
Verspätete Dosisgabe
Wenn der Patient eine Dosis von Delstrigo versäumt hat, sollte er Delstrigo so bald wie möglich einnehmen, es sei denn, der Zeitpunkt der nächsten Einnahme steht bereits kurz bevor. Der Patient sollte nicht 2 Dosen auf einmal einnehmen, sondern stattdessen die nächste Dosis zum regulären Zeitpunkt einnehmen.
Kontraindikationen
Delstrigo darf nicht zusammen mit Arzneimitteln verabreicht werden, die starke Enzyminduktoren für Cytochrom P450 (CYP) 3A sind, da es zu bedeutenden Abnahmen der Doravirin-Plasmakonzentrationen kommen kann, die eine Reduktion der Wirksamkeit von Delstrigo nach sich ziehen können (siehe «Interaktionen»). Zu diesen Arzneimitteln gehören unter anderem:
- Carbamazepin, Oxcarbazepin, Phenobarbital, Phenytoin
- Rifampicin, Rifapentin
- Johanniskraut (Hypericum perforatum)
- Mitotan
- Enzalutamid
- Lumacaftor
Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe von Delstrigo.
Warnhinweise und Vorsichtsmassnahmen
HIV-Übertragung
Obwohl es sich gezeigt hat, dass die erfolgreiche Virussuppression durch eine antiretrovirale Therapie das Risiko einer sexuellen Übertragung erheblich reduziert, kann ein Restrisiko nicht ausgeschlossen werden. Es müssen weiterhin geeignete Vorsichtsmassnahmen getroffen werden.
Interaktionen
Im Hinblick auf die Verschreibung von Delstrigo zusammen mit Arzneimitteln, welche die Exposition gegenüber Doravirin reduzieren können, ist Vorsicht geboten, da die Gefahr eines Wirksamkeitsverlustes und möglicher Resistenzbildung besteht (siehe «Kontraindikationen» und «Interaktionen»).
Kombination mit Trimethoprim resp. Co-trimoxazol:
Es zeigte sich, dass die Verabreichung von 1× täglich 160 mg Trimethoprim (einem Bestandteil von Co-trimoxazol) zu einer um 40% erhöhten Lamivudin-Exposition (AUC) führt. Solange keine Niereninsuffizienz vorliegt, ist eine Dosierungsanpassung von Lamivudin nicht notwendig. Die Wirkung von höheren Dosen Trimethoprim auf die Pharmakokinetik von Lamivudin ist nicht untersucht worden.
Schwere akute Exazerbation einer Hepatitis B bei mit HIV-1 und HBV koinfizierten Patienten
Alle Patienten mit HIV-1 sollten vor dem Beginn einer antiretroviralen Therapie auf HBV getestet werden. Delstrigo ist für die Behandlung der chronischen HBV-Infektion nicht zugelassen, und die Sicherheit und Wirksamkeit von Delstrigo wurden bei mit HIV-1 und HBV koinfizierten Patienten nicht nachgewiesen.
Beachten Sie bei einer gleichzeitigen antiviralen Therapie einer Hepatitis B oder C auch die jeweilige Fachinformation dieser Arzneimittel. Delstrigo darf nicht gleichzeitig mit Arzneimitteln angewendet werden, die Tenofovir-Prodrugs, Lamivudin oder Adefovirdipivoxil zur Behandlung einer Hepatitis-B-Infektion enthalten.
Schwere akute Exazerbationen von Hepatitis B (z.B. Leberdekompensation und Leberversagen) wurden bei Patienten berichtet, die mit HIV-1 und HBV coinfiziert sind und Lamivudin oder Tenofovir-DF, zwei der Bestandteile von Delstrigo, abgesetzt haben. HBV/HIV-1-koinfizierte Patienten sollten nach Beendigung der Behandlung mit Delstrigo mindestens mehrere Monate lang sowohl klinisch als auch durch Labortests engmaschig überwacht werden. Gegebenenfalls kann die Einleitung einer Hepatitis-B-Therapie gerechtfertigt sein, insbesondere bei Patienten mit fortgeschrittener Lebererkrankung oder -zirrhose, da eine Exazerbation der Hepatitis nach Behandlungsende zu einer Leberdekompensation und Leberversagen führen kann.
Patienten mit HIV und Hepatitis B- oder C-Virus-Koinfektion
Patienten mit chronischer Hepatitis B oder C, die mit einer antiretroviralen Therapie behandelt werden, weisen ein erhöhtes Risiko für das Auftreten schwerwiegender, möglicherweise letaler hepatischer unerwünschter Wirkungen auf und müssen entsprechend überwacht werden. Bei Anzeichen einer Verschlechterung der Lebererkrankung muss bei diesen Patienten eine Unterbrechung oder ein Absetzen der Therapie erwogen werden.
Für eine optimale Behandlung der HIV-Infektion bei Patienten mit Hepatitis-B-Koinfektion sollten die aktuellen HIV-Therapierichtlinien beachtet werden.
Lebererkrankungen
Patienten mit mittelschwerer und schwerer Leberfunktionsstörung, die Tenofovir-DF erhielten, zeigten einen leichten, zum Schweregrad der Leberfunktionsstörung proportionalen Anstieg der AUC von Tenofovir (mittelschwere Leberfunktionsstörung +13%, schwere Leberfunktionsstörung +34%).
Daten zur Sicherheit und Wirksamkeit bei lebertransplantierten Patienten sind sehr limitiert.
Es liegen limitierte Daten zur Sicherheit und Wirksamkeit von Tenofovir-DF bei HBV-infizierten Patienten mit dekompensierter Lebererkrankung und einem Child-Pugh-Turcotte-Score (CPT-Score) >9 vor. Diese Patienten können ein erhöhtes Risiko für das Auftreten schwerer hepatischer oder renaler unerwünschter Wirkungen haben. Daher sollten bei dieser Patientenpopulation die Leber-, Gallen- und Nierenwerte engmaschig überwacht werden.
Chronische Hepatitis B
Patienten müssen darüber aufgeklärt werden, dass Tenofovir-DF das Risiko einer HBV‑Übertragung auf andere durch sexuellen Kontakt oder kontaminiertes Blut nicht verhindert. Es müssen weiterhin geeignete Vorsichtsmassnahmen getroffen werden.
Neu einsetzende oder zunehmende Beeinträchtigung der Nierenfunktion
Im Zusammenhang mit der Anwendung von Tenofovir-DF, einem Bestandteil von Delstrigo, ist über eine Beeinträchtigung der Nierenfunktion, einschliesslich Fällen von akutem Nierenversagen und Fanconi-Syndrom (Schädigung der Nierentubuli mit schwerer Hypophosphatämie), berichtet worden.
Bei gleichzeitiger oder vor kurzem erfolgter Anwendung mit einem nephrotoxischen Wirkstoff (z.B. hoch dosierte oder multiple nicht-steroidale Antirheumatika [NSAR]) ist Delstrigo zu vermeiden (siehe «Interaktionen»). Fälle von akutem Nierenversagen nach Beginn hoch dosierter oder multipler NSAR sind bei HIV-infizierten Patienten berichtet worden, bei denen Risikofaktoren für Nierenfunktionsstörungen vorlagen und die unter Tenofovir-DF scheinbar stabil waren. Einige Patienten mussten hospitalisiert werden und benötigten eine Nierenersatztherapie. Falls erforderlich, sollten bei Patienten, bei denen das Risiko einer Nierenfunktionsstörung besteht, Alternativen zu NSAR erwogen werden.
Es wird empfohlen, bei allen Patienten vor dem Beginn der Therapie und je nach klinischer Notwendigkeit auch während der Behandlung mit Delstrigo die geschätzte Kreatinin-Clearance und die Glukose- und Proteinkonzentration im Urin zu bestimmen.
Es wird empfohlen, die Kreatinin-Clearance bei allen Patienten vor Beginn der Therapie mit Delstrigo zu berechnen, sowie die Nierenfunktion (Kreatinin-Clearance und Serumphosphat) bei Patienten ohne Risikofaktoren für eine Nierenfunktionsstörung nach 2 bis 4 Behandlungswochen, nach 3 Behandlungsmonaten und danach alle 3-6 Monate zu überwachen.
Bei Patienten mit einem Risiko für eine Nierenfunktionsstörung, einschliesslich Patienten, die bereits renale unerwünschte Wirkungen unter Adefovirdipivoxil entwickelt hatten, ist eine häufigere Überwachung der Nierenfunktion erforderlich.
Die Delstrigo-Bestandteile Lamivudin und Tenofovir-DF werden hauptsächlich über die Nieren ausgeschieden. Falls die geschätzte Kreatinin-Clearance unter 50 ml pro Minute sinkt, sollte Delstrigo abgesetzt werden, da die für Lamivudin und Tenofovir-DF erforderliche Anpassung des Verabreichungsintervalls mit der Fixdosis-Kombinationstablette nicht erreicht werden kann.
Persistierende oder zunehmende Knochenschmerzen, Schmerzen in den Extremitäten, Frakturen und/oder Muskelschmerzen oder -schwäche könnten Manifestationen einer proximalen renalen Tubulopathie darstellen und sollten bei Risikopatienten Anlass zu einer Beurteilung der Nierenfunktion geben.
Knochenschwund und Mineralisierungsdefekte
Knochenmineraldichte: In klinischen Studien bei HIV-1-infizierten Erwachsenen war Tenofovir-DF (ein Bestandteil von Delstrigo) mit einem leicht erhöhten Rückgang der Knochenmineraldichte (KMD) und einer Erhöhung der Knochen-Biomarker verbunden, was auf einen gegenüber den Vergleichspräparaten erhöhten Knochenumsatz hindeutet. Die Parathormon- und 1,25-Vitamin-D-Spiegel im Serum waren bei den Patienten, die Tenofovir-DF erhielten, ebenfalls höher. Zusätzliche Informationen sind der Fachinformation zu Tenofovir-DF zu entnehmen.
Die Auswirkungen von Tenofovir-DF assoziierten Veränderungen der KMD und biochemischen Marker auf die langfristige Knochengesundheit und das zukünftige Frakturrisiko sind nicht bekannt. Bei HIV-1-infizierten erwachsenen Patienten mit anamnestisch bekannten pathologischen Frakturen oder anderen Risikofaktoren für Osteoporose oder Knochenschwund sollte eine Beurteilung der KMD erwogen werden. Obwohl die Wirkung einer Supplementierung mit Calcium und Vitamin D nicht untersucht wurde, könnte eine solche Supplementierung bei allen Patienten von Vorteil sein. Bei Verdacht auf Knochenanomalien sollte eine entsprechende Beratung eingeholt werden.
Mineralisierungsdefekte: Im Zusammenhang mit der Anwendung von Tenofovir-DF sind Fälle einer mit proximaler renalen Tubulopathie assoziierten Osteomalazie berichtet worden, die sich in Form von Knochenschmerzen oder Schmerzen in den Extremitäten manifestierte und zu Frakturen beitragen könnte. In Fällen von proximaler renalen Tubulopathie wurden auch über Gelenk- und Muskelschmerzen oder -schwäche berichtet. Bei Patienten mit einem Risiko für Nierenfunktionsstörung und die unter einem Tenofovir-DF enthaltenden Arzneimittel persistierende oder sich verschlimmernde Knochen- bzw. Muskelsymptome zeigen, sollte eine mögliche Hypophosphatämie und Osteomalazie infolge einer proximalen renalen Tubulopathie in Betracht gezogen werden.
Gleichzeitige Anwendung mit anderen Arzneimitteln
Delstrigo ist eine Fixkombination von Doravirin, Lamivudin und Tenofovir-DF. Delstrigo darf nicht gleichzeitig mit anderen Arzneimitteln, die Lamivudin enthalten, mit Arzneimitteln, die Tenofovir-DF oder Tenofoviralafenamid enthalten, oder mit Adefovirdipivoxil angewendet werden. Delstrigo sollte nicht zusammen mit Doravirin verabreicht werden, sofern dies nicht zur Dosisanpassung (z.B. mit Rifabutin) erforderlich ist (siehe «Dosierung/Anwendung» und «Interaktionen»).
Immunreaktivierungssyndrom
Es liegen Berichte über das Auftreten eines Immunreaktivierungssyndroms bei Patienten unter antiretroviraler Kombinationstherapie vor. Während der Anfangsphase einer antiretroviralen Kombinationstherapie kann sich bei Patienten, deren Immunsystem reagiert, eine entzündliche Reaktion gegen indolente oder residuelle opportunistische Infektionen (wie z.B. Infektionen mit Mycobacterium avium, Cytomegalievirus, Pneumocystis-jirovecii-Pneumonie (PjP) oder Tuberkulose) entwickeln, die eine weitergehende Evaluation und Behandlung erfordern kann.
Im Rahmen einer Immunreaktivierung wurde auch über das Auftreten von Autoimmunerkrankungen (wie z.B. Morbus Basedow, Polymyositis, Guillain-Barré-Syndrom und Autoimmunhepatitis) berichtet; die Zeit bis zum Einsetzen ist jedoch variabler und kann sich über viele Monate nach Behandlungsbeginn erstrecken.
Laktose
Delstrigo enthält Laktosemonohydrat.
Patienten mit der seltenen hereditären Galaktose-Intoleranz, komplettem Laktase-Mangel oder Glukose-Galaktose-Malabsorption sollten dieses Arzneimittel nicht einnehmen.
Exposition in utero: Mitochondriale Dysfunktion
Nukleos(t)id-Analoga können die mitochondriale Funktion in unterschiedlichem Ausmass beeinträchtigen. Dies ist unter Stavudin, Didanosin und Zidovudin am stärksten ausgeprägt. Es liegen Berichte über mitochondriale Funktionsstörungen bei HIV-negativen Kleinkindern vor, die in utero und/oder postnatal gegenüber Nukleosid-Analoga exponiert waren. Diese Berichte betrafen überwiegend Behandlungen mit Zidovudin-haltigen Therapien. Die hauptsächlich berichteten Nebenwirkungen waren hämatologische Störungen (Anämie, Neutropenie) und Stoffwechselstörungen (Hyperlaktatämie, erhöhte Serum-Lipase-Werte). Diese Ereignisse waren meistens vorübergehend. Selten wurde über spät auftretende neurologische Störungen (Hypertonus, Konvulsionen, Verhaltensänderungen) berichtet. Ob solche neurologischen Störungen vorübergehend oder bleibend sind, ist derzeit nicht bekannt. Diese Erkenntnisse sollten bei jedem Kind, das in utero gegenüber Nukleos(t)id-Analoga exponiert war und schwere klinische Befunde unbekannter Ätiologie, insbesondere neurologische Befunde, aufweist, berücksichtigt werden. Jedes Kind, das in utero gegenüber Nukleosid- bzw. Nukleotid-Analoga exponiert war, auch HIV-negative Kinder, soll klinisch und anhand von Laborparametern nachuntersucht werden und soll im Falle von relevanten Anzeichen oder Symptomen vollständig auf mitochondriale Funktionsstörungen hin untersucht werden. Diese Erkenntnisse haben keinen Einfluss auf die derzeitigen nationalen Empfehlungen zur Anwendung der antiretroviralen Therapie bei schwangeren Frauen zur Prävention einer vertikalen HIV-Transmission.
Opportunistische Infektionen
Patienten, die Delstrigo oder eine andere antiretrovirale Therapie erhalten, können weiterhin opportunistische Infektionen und sonstige Komplikationen einer HIV-Infektion entwickeln. Deshalb ist weiterhin eine kontinuierliche engmaschige klinische Überwachung durch Ärzte, die in der Behandlung von Patienten mit HIV-assoziierten Erkrankungen erfahren sind, erforderlich.
Osteonekrose
Obwohl eine multifaktorielle Ätiologie angenommen wird (darunter Anwendung von Kortikosteroiden, Alkoholkonsum, schwere Immunsuppression, höherer Body-Mass-Index), wurden Fälle von Osteonekrose insbesondere bei Patienten mit fortgeschrittener HIV-Erkrankung und/oder Langzeitanwendung einer ART berichtet. Die Patienten sind darauf hinzuweisen, bei Auftreten von Gelenkbeschwerden und -schmerzen, Gelenksteife oder Schwierigkeiten bei Bewegungen den Arzt bzw. die Ärztin aufzusuchen.
Pankreatitis
Fälle von Pankreatitis sind beim Erwachsenen selten, bei Kindern häufiger aufgetreten. Es konnte aber nicht geklärt werden, ob dies auf die Behandlung oder auf die HIV-Erkrankung selbst zurückzuführen ist. Die Behandlung mit Delstrigo sollte unverzüglich abgebrochen werden, wenn klinische Anzeichen, Symptome oder Laboranomalien auftreten, die auf eine Pankreatitis hinweisen. Pankreatitis muss immer dann in Erwägung gezogen werden, wenn ein Patient Abdominalschmerzen, Übelkeit, Erbrechen oder erhöhte biochemische Marker aufweist.
Generalisierte motorische Schwäche
Eine generalisierte motorische Schwäche wurde sehr selten bei Patienten beobachtet, die ART mit Nukleosid-Analoga erhielten. Viele der Fälle, aber nicht alle, traten im Rahmen einer Laktatazidose auf. Diese motorische Schwäche kann klinisch ein Guillain-Barré-Syndrom inklusive Atemlähmung imitieren. Die Symptome können nach Beendigung der Therapie gegebenenfalls weiter bestehen bzw. sich weiter verschlechtern.
Interaktionen
Delstrigo ist ein Komplettpräparat für die Behandlung der HIV-1-Infektion; daher braucht Delstrigo nicht zusammen mit anderen antiretroviralen Arzneimitteln zur Behandlung der HIV-1-Infektion angewendet zu werden. Es werden keine Informationen zu möglichen Interaktionen mit anderen antiretroviralen Arzneimitteln bereitgestellt.
Delstrigo enthält Doravirin, Lamivudin und Tenofovirdisoproxil (als Fumarat), so dass jegliche Interaktionen, die für einen dieser Wirkstoffe festgestellt wurden, für Delstrigo von Bedeutung sind. Zwischen Doravirin, Lamivudin und Tenofovirdisoproxil (als Fumarat) sind keine klinisch relevanten Interaktionen zu erwarten.
Wirkung anderer Arzneimittel auf die Pharmakokinetik von Delstrigo
Arzneimittel, welche die Nierenfunktion beeinträchtigen:
Da Lamivudin und Tenofovir hauptsächlich durch eine Kombination aus glomerulärer Filtration und aktiver tubulärer Sekretion über die Nieren ausgeschieden werden, kann die gleichzeitige Anwendung von Delstrigo mit Arzneimitteln, die die Nierenfunktion vermindern oder um die aktive tubuläre Sekretion konkurrieren, die Serumkonzentrationen von Lamivudin, Tenofovir und/oder der anderen renal ausgeschiedenen Arzneimitteln erhöhen. Beispiele für über aktive tubuläre Sekretion ausgeschiedene Arzneimittel sind unter anderem: Aciclovir, Cidofovir, Ganciclovir, Valaciclovir, Valganciclovir, Aminoglykoside (z.B. Gentamicin) und hoch dosierte oder multiple NSAR.
Doravirin:
Doravirin wird hauptsächlich durch CYP3A metabolisiert, und Arzneimittel, die CYP3A induzieren oder hemmen, können die Clearance von Doravirin beeinflussen.
CYP3A-Induktoren
Die gleichzeitige Verabreichung von Delstrigo und Arzneimitteln, die CYP3A induzieren, kann zu verminderten Doravirin-Plasmakonzentrationen führen und den therapeutischen Effekt von Doravirin mindern (siehe «Kontraindikationen» und «Warnhinweise und Vorsichtsmassnahmen»).
Die gleichzeitige Verabreichung mit Arzneimitteln, die starke Induktoren von CYP3A sind, ist kontraindiziert. Nach Ende einer Behandlung mit starken CYP3A-Induktoren, wird empfohlen Delstrigo frühestens nach 4 Wochen zu verabreichen.
Die gleichzeitige Verabreichung mit Arzneimitteln, die moderate Induktoren von CYP3A sind (z.B. Dabrafenib, Lesinurad, Bosentan, Modafinil, Telotristatethyl) sollte vermieden werden. Falls die gleichzeitige Gabe nicht vermieden werden kann, sollte eine zusätzliche Dosis von 100 mg Doravirin, ca. 12 Studen nach Einnahme von Delstrigo, verabreicht werden.
CYP3A-Inhibitoren
Die gleichzeitige Verabreichung von Delstrigo mit Arzneimitteln, die Inhibitoren von CYP3A sind, kann zu erhöhten Doravirin-Plasmakonzentrationen führen. Bei gleichzeitiger Verabreichung mit CYP3A-Inhibitoren wird jedoch keine Dosisanpassung empfohlen.
Lamivudin:
Lamivudin erweist sich in vitro als Substrat von MATE1, MATE2-K und OCT2. Trimethoprim (ein Hemmer dieser Transportmoleküle) steigert nachweislich die Plasmakonzentrationen von Lamivudin; allerdings wird diese Wechselwirkung nicht als klinisch relevant eingestuft, da keine Dosisanpassung von Lamivudin erforderlich ist.
Die Koadministration einer Sorbitollösung mit Lamivudin führte zu einer dosisabhängigen Abnahme der Lamivudin-Exposition. Die Koadministration von sorbitolhaltigen Arzneimittel mit Lamivudin ist nach Möglichkeit zu vermeiden.
Tenofovirdisoproxil:
Da Tenofovir hauptsächlich über die Nieren mittels einer Kombination aus glomerulärer Filtration und aktiver tubulärer Sekretion eliminiert wird (siehe «Pharmakokinetik»), kann die gleichzeitige Verabreichung von Delstrigo mit Arzneimitteln, welche die Nierenfunktion verringern oder um die aktive tubuläre Sekretion über OAT1, OAT3 oder MRP4 konkurrieren, die Serumkonzentrationen von Tenofovir erhöhen.
Wirkung von Delstrigo auf die Pharmakokinetik anderer Arzneimittel
Doravirin
Es ist unwahrscheinlich, dass Doravirin in einer Dosierung von 100 mg einmal täglich einen klinisch relevanten Effekt auf die Plasmakonzentrationen von durch CYP-Enzyme metabolisierten Arzneimitteln ausübt.
CYP3A-Substrate
Die gleichzeitige Verabreichung von Doravirin und dem sensiblen CYP3A-Substrat Midazolam führte zu einer 18%igen Abnahme der Midazolam-Exposition, was darauf hindeutet, dass Doravirin ein schwacher CYP3A-Induktor sein könnte. Daher ist Vorsicht geboten, wenn Doravirin gleichzeitig mit Arzneimitteln verabreicht wird, die sensible CYP3A-Substrate sind sowie eine geringe therapeutische Breite haben (z.B. Tacrolimus und Sirolimus).
Lamivudin
Lamivudin ist weder Inhibitor noch Induktor des CYP-Enzymsystems.
Tenofovir
Auf der Grundlage von In-vitro-Experimenten und des bekannten Eliminationswegs von Tenofovir ist das Potenzial für CYP-vermittelte Interaktionen zwischen Tenofovir und anderen Arzneimitteln gering. Tenofovir hemmte auch bei Konzentrationen, die wesentlich höher (~300-fach) waren als die In-vivo-Konzentrationen, nicht die In-vitro Metabolisierung von Arzneimitteln, die von einem der wichtigeren humanen, an der Biotransformation von Arzneimitteln beteiligten, CYP450-Isoenzyme (CYP3A4, CYP2D6, CYP2C9, CYP2E1 oder CYP1A1/2) vermittelt wird. Tenofovirdisoproxil in einer Konzentration von 100 µmol/l hatte keinen Einfluss auf die CYP450-Isoenzyme, ausser auf CYP1A1/2, wo eine kleine (6%), aber statistisch signifikante Reduzierung des CYP1A1/2-Substrat-Metabolismus beobachtet wurde. Ausgehend von diesen Daten ist es unwahrscheinlich, dass klinisch relevante Interaktionen zwischen Tenofovir-DF und CYP450-metabolisierten Arzneimitteln auftreten.
Interaktionstabelle
Tabelle 1 zeigt die nachgewiesenen und weitere potenziell bedeutende Arzneimittel-Interaktionen mit den Bestandteilen von Delstrigo, erhebt jedoch keinen Anspruch auf Vollständigkeit. Zu weiteren möglichen Interaktionen zwischen Lamivudin oder Tenofovir-DF und anderen Arzneimitteln siehe «Warnhinweise und Vorsichtsmassnahmen».
Das Verhältnis der geometrischen Mittelwerte der pharmakokinetischen Grössen bei Einnahme mit/ohne Begleitmedikation mit 90% Konfidenzintervallen (KI) ist angegeben. Die Richtung des Pfeils zeigt die Veränderung der Exposition (Cmax, AUC oder C24) gegenüber dem jeweiligen Wirkstoff an (↑ = Anstieg auf mehr als das 1,25-fache, ↓ = Abnahme auf weniger als das 0,8-fache, ↔ = keine Veränderung).
Tabelle 1: Interaktionen und Dosisempfehlungen mit anderen Arzneimitteln
Arzneimittel nach therapeutischem Anwendungsgebiet | Auswirkungen auf die Arzneimittelkonzentrationen | Empfehlungen zur gleichzeitigen Verabreichung mit Delstrigo |
|---|---|---|
Säurereduzierende Arzneimittel | ||
Antazidum (Aluminium- und Magnesiumhydroxid als Suspension zum Einnehmen) (20 ml SD, Doravirin 100 mg SD) | ↔ Doravirin AUC 1,01 (0,92; 1,11) Cmax 0,86 (0,74; 1,01) C24 1,03 (0,94; 1,12) | Keine Dosisanpassung erforderlich. |
Pantoprazol (40 mg QD, Doravirin 100 mg SD) | ↓ Doravirin AUC 0,83 (0,76; 0,91) Cmax 0,88 (0,76; 1,01) C24 0,84 (0,77; 0,92) | Keine Dosisanpassung erforderlich. |
Antiandrogene | ||
Enzalutamid | Interaktion nicht untersucht mit Doravirin oder Doravirin/Lamivudin/Tenofovirdisoproxil. Erwartet: ↓ Doravirin (Induktion von CYP3A) | Gleichzeitige Gabe kontraindiziert. Es wird empfohlen Delstrigo frühestens 4 Wochen nach Ende einer Enzalutamid Behandlung zu verabreichen |
Antikonvulsiva | ||
Carbamazepin Oxcarbazepin Phenobarbital Phenytoin | Interaktion mit Doravirin oder Doravirin/Lamivudin/Tenofovirdisoproxil nicht untersucht. Erwartet: ↓ Doravirin (Induktion von CYP3A) | Gleichzeitige Gabe kontraindiziert. Es wird empfohlen Delstrigo frühestens 4 Wochen nach Ende einer Behandlung mit diesen Wirkstoffen zu verabreichen |
Antidiabetika | ||
Metformin (1000 mg SD, Doravirin 100 mg QD) | ↔ Metformin AUC 0,94 (0,88; 1,00) Cmax 0,94 (0.86; 1,03) | Keine Dosisanpassung erforderlich. |
Antidiarrhoika | ||
Telotristatethyl | Interaktion mit Doravirin oder Doravirin/Lamivudin/Tenofovirdisoproxil nicht untersucht. Erwartet: ↓ Doravirin (Induktion von CYP3A) | Eine gleichzeitige Verabreichung sollte vermieden werden. Falls eine gleichzeitige Verabreichung nicht vermieden werden kann, sollte täglich eine 100 mg Dosis Doravirin eingenommen werden, 12 Stunden nach der Dosis von Delstrigo. |
Arzneimittel gegen Gicht und Urikosurika | ||
Lesinurad | Interaktion mit Doravirin oder Doravirin/Lamivudin/Tenofovirdisoproxil nicht untersucht. Erwartet: ↓ Doravirin (Induktion von CYP3A) | Eine gleichzeitige Verabreichung sollte vermieden werden. Falls eine gleichzeitige Verabreichung nicht vermieden werden kann, sollte täglich eine 100 mg Dosis Doravirin eingenommen werden, ca. 12 Stunden nach der Dosis von Delstrigo. |
Antimykobakterielle Arzneimittel | ||
Einmalgabe Rifampicin (600 mg SD, Doravirin 100 mg SD) Mehrfachgabe Rifampicin (600 mg QD, Doravirin 100 mg SD) | ↔ Doravirin AUC 0,91 (0,78; 1,06) Cmax 1,40 (1,21; 1,63) C24 0,90 (0,80; 1,01) ↓ Doravirin AUC 0,12 (0,10; 0,15) Cmax 0,43 (0,35; 0,52) C24 0,03 (0,02; 0,04) (Induktion von CYP3A) | Gleichzeitige Gabe kontraindiziert. Es wird empfohlen Delstrigo frühestens 4 Wochen nach Ende einer Behandlung mit Rifampicin zu verabreichen. |
Rifapentin | Interaktion mit Doravirin oder Doravirin/Lamivudin/Tenofovirdisoproxil nicht untersucht. Erwartet: ↓ Doravirin (Induktion von CYP3A) | Gleichzeitige Gabe kontraindiziert. Es wird empfohlen Delstrigo frühestens 4 Wochen nach Ende einer Behandlung mit Rifapentin zu verabreichen. |
Rifabutin (300 mg QD, Doravirin 100 mg SD) | ↓ Doravirin AUC 0,50 (0,45; 0,55) Cmax 0,99 (0,85; 1,15) C24 0,32 (0,28; 0,35) (Induktion von CYP3A) | Falls Delstrigo gleichzeitig mit Rifabutin verabreicht wird, sollte eine 100 mg Tablette Doravirin täglich etwa 12 Stunden nach der Gabe von Delstrigo eingenommen werden. |
Antineoplastika | ||
Mitotan | Interaktion mit Doravirin oder Doravirin/Lamivudin/Tenofovirdisoproxil nicht untersucht. Erwartet: ↓ Doravirin (Induktion von CYP3A) | Gleichzeitige Gabe kontraindiziert. Es wird empfohlen Delstrigo frühestens 4 Wochen nach Ende einer Behandlung mit Mitotan zu verabreichen. |
Azol-Antimykotika | ||
Ketoconazol (400 mg QD, Doravirin 100 mg SD) | ↑ Doravirin AUC 3,06 (2,85; 3,29) Cmax 1,25 (1,05; 1,49) C24 2,75 (2,54; 2,98) (Inhibition von CYP3A) | Keine Dosisanpassung. |
Fluconazol Itraconazol Posaconazol Voriconazol | Interaktion mit Doravirin/Lamivudin/Tenofovirdisoproxil nicht untersucht. Erwartet: ↑ Doravirin (Inhibition von CYP3A) | Keine Dosisanpassung. |
Kalziumkanalblocker | ||
Diltiazem Verapamil | Interaktion mit Doravirin oder Doravirin/Lamivudin/Tenofovirdisoproxil nicht untersucht. Erwartet: ↑ Doravirin (Inhibition von CYP3A) | Keine Dosisanpassung. |
Behandlung der zystischen Fibrose | ||
Lumacaftor | Interaktion mit Doravirin oder Doravirin/Lamivudin/Tenofovirdisoproxil nicht untersucht. Erwartet: ↓ Doravirin (Induktion von CYP3A) | Gleichzeitige Gabe kontraindiziert. Es wird empfohlen Delstrigo frühestens 4 Wochen nach Ende einer Behandlung mit Lumacaftor zu verabreichen. |
Endothelin-Rezeptorantagonisten | ||
Bosentan | Interaktion mit Doravirin oder Doravirin/Lamivudin/Tenofovirdisoproxil nicht untersucht. Erwartet: ↓ Doravirin (Induktion von CYP3A) | Eine gleichzeitige Verabreichung sollte vermieden werden. Falls eine gleichzeitige Verabreichung nicht vermieden werden kann, sollte täglich eine 100 mg Dosis Doravirin eingenommen werden, ca. 12 Stunden nach der Dosis von Delstrigo. |
Antivirale Arzneimittel gegen Hepatitis C | ||
Elbasvir + Grazoprevir (50 mg Elbasvir QD + 200 mg Grazoprevir QD, Doravirin 100 mg QD) | ↑ Doravirin AUC 1,56 (1,45; 1,68) Cmax 1,41 (1,25; 1,58) C24 1,61 (1,45; 1,79) (Inhibition von CYP3A) ↔ Elbasvir AUC 0,96 (0,90; 1,02) Cmax 0,96 (0,91; 1,01) C24 0,96 (0,89; 1,04) ↔ Grazoprevir AUC 1,07 (0,94; 1,23) Cmax 1,22 (1,01; 1,47) C24 0,90 (0,83; 0,96) | Keine Dosisanpassung erforderlich. |
Ledipasvir + Sofosbuvir (90 mg Ledipasvir SD + 400 mg Sofosbuvir SD, Doravirin 100 mg SD) | ↑ Doravirin AUC 1,15 (1,07; 1,24) Cmax 1,11 (0,97; 1,27) C24 1,24 (1,13; 1,36) ↔ Ledipasvir AUC 0,92 (0,80; 1,06) Cmax 0,91 (0,80; 1,02) ↔ Sofosbuvir AUC 1,04 (0,91; 1,18) Cmax 0,89 (0,79; 1,00) ↔ GS-331007 AUC 1,03 (0,98; 1,09) Cmax 1,03 (0,97; 1,09) Interaktion mit Doravirin oder Doravirin/Lamivudin/Tenofovirdisoproxil nicht untersucht. Erwartet: ↑ Tenofovir | Patienten, die Delstrigo gleichzeitig mit Ledipasvir/Sofosbuvir erhalten, sollten auf mit Tenofovir-DF assoziierte unerwünschte Wirkungen überwacht werden. |
Sofosbuvir/Velpatasvir | Interaktion mit Doravirin oder Doravirin/Lamivudin/Tenofovirdisoproxil nicht untersucht. Erwartet: ↔ Doravirin ↑ Tenofovir | Patienten, die Delstrigo gleichzeitig mit Sofosbuvir/Velpatasvir erhalten, sollten auf mit Tenofovir-DF assoziierte unerwünschte Wirkungen überwacht werden. |
Pflanzliche Präparate | ||
Johanniskraut (Hypericum perforatum) | Interaktion mit Doravirin oder Doravirin/Lamivudin/Tenofovirdisoproxil nicht untersucht. Erwartet: ↓ Doravirin (Induktion von CYP3A) | Gleichzeitige Gabe kontraindiziert. Es wird empfohlen Delstrigo frühestens 4 Wochen nach Ende einer Behandlung mit Johanniskraut zu verabreichen. |
Antivirale Arzneimittel gegen HIV | ||
Tenofovir-DF (300 mg QD, Doravirin 100 mg SD) | ↔ Doravirin AUC 0,95 (0,80; 1,12) Cmax 0,80 (0,64; 1,01) C24 0,94 (0,78; 1,12) | Es bestehen keine klinisch relevanten Interaktionen zwischen den Bestandteilen von Delstrigo. |
Lamivudin + Tenofovirdisoproxil (300 mg Lamivudin SD + 245 mg Tenofovirdisoproxil SD, Doravirin 100 mg SD) | ↔ Doravirin AUC 0,96 (0,87; 1,06) Cmax 0,97 (0,88; 1,07) C24 0,94 (0,83; 1,06) ↔ Lamivudin AUC 0,94 (0,88; 1,00) Cmax 0,92 (0,81; 1,05) ↔ Tenofovir AUC 1,11 (0,97; 1,28) Cmax 1,17 (0,96; 1,42) | Es bestehen keine klinisch relevanten Interaktionen zwischen den Bestandteilen von Delstrigo. |
Immunosuppressiva | ||
Tacrolimus, Sirolimus | Interaktion mit Doravirin oder Doravirin/Lamivudin/Tenofovirdisoproxil nicht untersucht. Erwartet: ↔ Doravirin ↓ Tacrolimus, Sirolimus (Induktion von CYP3A) | Die Blutkonzentrationen von Tacrolimus und Sirolimus sollten überwacht werden, da für diese Arzneimittel eine Dosisanpassung erforderlich sein kann. |
Kinase-Inhibitoren | ||
Dabrafenib | Interaktion mit Doravirin oder Doravirin/Lamivudin/Tenofovirdisoproxil nicht untersucht. Erwartet: ↓ Doravirin (Induktion von CYP3A) | Eine gleichzeitige Verabreichung sollte vermieden werden. Falls eine gleichzeitige Verabreichung nicht vermieden werden kann, sollte täglich eine 100 mg Dosis Doravirin eingenommen werden, ca. 12 Stunden nach der Dosis von Delstrigo. |
Opioidanalgetika | ||
Methadon (individuell eingestellte Dosis 20–200 mg QD, Doravirin 100 mg QD) | ↓ Doravirin AUC 0,74 (0,61; 0,90) Cmax 0,76 (0,63; 0,91) C24 0,80 (0,63; 1,03) ↔ R-Methadon AUC 0,95 (0,90; 1,01) Cmax 0,98 (0,93; 1,03) C24 0,95 (0,88; 1,03) ↔ S-Methadon AUC 0,98 (0,90; 1,06) Cmax 0,97 (0,91; 1,04) C24 0,97 (0,86; 1,10) | Keine Dosisanpassung erforderlich. |
Orale Kontrazeptiva | ||
Ethinylestradiol + Levonorgestrel (0,03 mg Ethinylestradiol + 0,15 mg Levonorgestrel SD, Doravirin 100 mg QD) | ↔ Ethinylestradiol AUC 0,98 (0,94; 1,03) Cmax 0,83 (0,80; 0,87) ↑ Levonorgestrel AUC 1,21 (1,14; 1,28) Cmax 0,96 (0,88; 1,05) | Keine Dosisanpassung erforderlich. |
Psychostimulanzien | ||
Modafinil | Interaktion mit Doravirin oder Doravirin/Lamivudin/Tenofovirdisoproxil nicht untersucht. Erwartet: ↓ Doravirin (Induktion von CYP3A) | Eine gleichzeitige Verabreichung sollte vermieden werden. Falls eine gleichzeitige Verabreichung nicht vermieden werden kann, sollte täglich eine 100 mg Dosis Doravirin eingenommen werden, ca. 12 Stunden nach der Dosis von Delstrigo. |
Sedativa/Hypnotika | ||
Midazolam (2 mg SD, Doravirin 120 mg QD) | ↓ Midazolam AUC 0,82 (0,70; 0,97) Cmax 1,02 (0,81; 1,28) | Keine Dosisanpassung erforderlich. |
Statine | ||
Atorvastatin (20 mg SD, Doravirin 100 mg QD) | ↔ Atorvastatin AUC 0,98 (0,90; 1,06) Cmax 0,67 (0,52; 0,85) | Keine Dosisanpassung erforderlich. |
Sonstiges | ||
Sorbitol-Lösung (3,2 g; 10,2 g; 13,4 g)/Lamivudin | Einzeldosis Lamivudin orale Lösung 300 mg Lamivudin AUC ↓ 0,86 (0,80; 0,91); 0,68 (0,64; 0,72); 0,64 (0,59; 0,68) Cmax ↓ 0,72 (0,66; 0,80); 0,48 (0,43; 0,53); 0,45 (0,41; 0,50) | Vermeiden Sie nach Möglichkeit eine gleichzeitige Verabreichung von Delstrigo mit Arzneimitteln, die Sorbitol oder andere osmotisch wirkende Polyalkohole (z.B. Xylitol, Mannitol, Lactitol, Maltitol) enthalten. Erwägen Sie eine häufigere Überwachung der HIV-1-Virusbelastung, wenn eine chronische gleichzeitige Verabreichung nicht vermieden werden kann. |
KI = Konfidenzintervall; SD = Einmalgabe (single dose); QD = einmal täglich; BID = zweimal täglich * AUC0-∞ für Einmalgabe, AUC0-24 für einmal täglich. † Die Interaktionsbeurteilung wurde nur mit Ritonavir durchgeführt. | ||
Arzneimittel, für die keine Interaktionen mit Delstrigo beobachtet wurden oder vorhergesagt werden
Interaktionen zwischen Delstrigo und den folgenden Arzneimitteln wurden in klinischen Studien untersucht, und für keines dieser Arzneimittel ist eine Dosisanpassung erforderlich: Aluminiumhydroxid/Magnesiumhydroxid/Simethicon enthaltende Antazida, Pantoprazol, Atorvastatin, ein Ethinylestradiol und Levonorgestrel enthaltendes orales Kontrazeptivum, Metformin, Methadon, Midazolam, Sofosbuvir/Ledipasvir, Elbasvir/Grazoprevir, Dolutegravir, Lamivudin, oder Tenofovir-DF.
Bei gleichzeitiger Anwendung von Delstrigo mit Abacavir, Emtricitabin, Enfuvirtid, Raltegravir, Maraviroc, Tenofoviralafenamid, Buprenorphin, Naloxon, Daclatasvir, Simeprevir, Diltiazem, Verapamil, Rosuvastatin, Simvastatin, Canagliflozin, Liraglutid, Sitagliptin, Lisinopril oder Omeprazol wird keine klinisch relevante Interaktion erwartet.
Basierend auf den Ergebnissen von In-vitro-Versuchen und den bekannten Eliminationswegen von Tenofovir ist das Potenzial für CYP-vermittelte Interaktionen zwischen Tenofovir-DF und anderen Arzneimitteln gering.
Zwischen Tenofovir-DF und den folgenden Arzneimitteln wurden keine klinisch bedeutenden Interaktionen in Studien bei gesunden Probanden beobachtet: Entecavir, Methadon, orale Kontrazeptiva, Sofosbuvir und Tacrolimus.
Lamivudin wird weder in bedeutendem Umfang durch CYP-Enzyme metabolisiert noch hemmt oder induziert es dieses Enzymsystem; daher ist es unwahrscheinlich, dass es über diese Metabolisierungswege zu klinisch relevanten Arzneimittelinteraktionen kommt.
Schwangerschaft/Stillzeit
Schwangerschaft
Register für Schwangerschaften unter antiretroviraler Therapie (Antiretroviral Pregnancy Registry)
Zur Überwachung der maternalen bzw. fetalen Verläufe von schwangeren Patientinnen unter Delstrigo wurde ein internationales Register für Schwangerschaften unter antiretroviraler Therapie (Antiretroviral Pregnancy Registry, APR) eingerichtet. Die Ärzte sind aufgefordert, Patientinnen in dieses Register einzutragen.
Risikozusammenfassung
Doravirin: Es liegen keine ausreichenden Daten beim Menschen vor, um festzustellen, ob Doravirin ein Risiko hinsichtlich des Ausgangs von Schwangerschaften darstellt oder nicht. Zur Anwendung von Doravirin bei Schwangeren liegen keine oder nur begrenzte Daten vor. Die Auswirkung von Doravirin auf die Schwangerschaft beim Menschen ist nicht bekannt.
Tierexperimentelle Studien mit Doravirin deuten nicht auf direkte oder indirekte schädliche Wirkungen im Sinne einer Reproduktionstoxizität hin (siehe «Präklinische Daten»).
Als Vorsichtsmassnahme empfiehlt es sich, die Anwendung von Doravirin während der Schwangerschaft zu vermeiden.
Reproduktionsstudien an Ratten und Kaninchen mit bis zu 9-facher (Ratten) und 8-facher (Kaninchen) Humanexposition bei Anwendung der empfohlenen Humandosis (recommended human dose, RHD) haben nicht auf schädliche Wirkungen von Doravirin im Hinblick auf Schwangerschaft und embryofetale Entwicklung hingedeutet (siehe «Präklinische Daten»).
Lamivudin: Lamivudin ist im APR bei mehr als 11'000 Frauen während der Schwangerschaft und nach der Geburt untersucht worden. Verfügbare Humandaten aus dem APR zeigen kein erhöhtes Risiko für schwere Geburtsdefekte unter Lamivudin im Vergleich zur Hintergrundrate. Es gibt jedoch keine adäquaten und gut kontrollierten Studien bei schwangeren Frauen.
Lamivudin ist plazentagängig. Die Lamivudinserumkonzentrationen des gerade geborenen Kindes entsprachen denen der Mutter resp. den Serumkonzentrationen der Nabelschnur bei der Geburt.
Lamivudin sollte während der Schwangerschaft nicht angewendet werden, es sei denn, es ist klar notwendig.
Bei Neugeborenen und Kindern, die in utero oder unter der Geburt NRTIs (Nukleosid-Reverse Transkriptase-Inhibitoren) ausgesetzt waren, liegen Berichte über leicht und vorübergehend erhöhte Serumlaktatwerte vor, was auf eine Funktionsstörung der Mitochondrien zurückzuführen sein könnte. Die klinische Relevanz dieser vorübergehend erhöhten Serumlaktatwerte ist unbekannt. Ausserdem liegen sehr seltene Berichte über Entwicklungsverzögerungen, Krampfanfälle und andere neurologische Krankheiten vor. Ein kausaler Zusammenhang zwischen dem Auftreten dieser Störungen und der Verabreichung von NRTIs ist jedoch nicht nachgewiesen. Diese Erkenntnisse haben keinen Einfluss auf die geltenden Empfehlungen zum Einsatz einer antiretroviralen Therapie bei Schwangeren zur Vorbeugung einer Mutter-Kind Übertragung von HIV.
Reproduktionsstudien bei Tieren ergaben keinen Hinweis auf eine eventuelle Teratogenität oder einen Effekt auf die männliche oder weibliche Fertilität. Bei Kaninchen gab es Hinweise auf eine frühe Embryoletalität, jedoch nicht bei Ratten (siehe «Präklinische Daten»).
Tenofovir-DF: Die moderate Menge an Daten zu schwangeren Frauen (zwischen 300 und 1'000 Schwangerschaftsverläufe) deutet darauf hin, dass keine Fehlbildungen oder eine fetale/neonatale Toxizität in Verbindung mit Tenofovir-DF vorliegen. Tierexperimentelle Studien ergaben keine Hinweise auf eine Reproduktionstoxizität (siehe «Präklinische Daten»).
Stillzeit
Risikozusammenfassung
Studien bei Menschen haben gezeigt, dass sowohl Lamivudin als auch Tenofovir in die Muttermilch übertreten. Verschiedene Studien bei mit Lamivudin behandelten, stillenden Müttern und ihren Kindern haben gezeigt, dass Lamivudin in der menschlichen Muttermilch in ähnlichen oder sogar höheren Konzentrationen als im Serum nachweisbar ist. Auch im Serum der gestillten Kinder konnte Lamivudin in niedrigen Konzentrationen gemessen werden.
Mütter sollten daher angewiesen werden, während der Behandlung mit Lamivudin nicht zu stillen.
Es wurde gezeigt, dass Tenofovir in die Muttermilch übergeht. Es gibt nur ungenügende Informationen darüber, ob Tenofovir Auswirkungen auf Neugeborene/Kinder hat. Daher sollte Tenofovir während der Stillzeit nicht angewendet werden.
Es ist nicht bekannt, ob Doravirin beim Menschen in die Muttermilch ausgeschieden wird. Wegen der Möglichkeit einer Übertragung von HIV-1 und schwerwiegender Nebenwirkungen bei gestillten Säuglingen sollten Mütter angewiesen werden, nicht zu stillen, wenn sie Delstrigo erhalten.
Tierexperimentelle Daten
Daten, die aus tierexperimentellen Studien zur Pharmakodynamik und Toxikologie zur Verfügung stehen, haben gezeigt, dass Doravirin in die Milch ausgeschieden wird (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Die Patienten sollten in Kenntnis gesetzt werden, dass unter Behandlung mit Delstrigo Müdigkeit, Schwindelgefühl und Schläfrigkeit berichtet worden sind (siehe «Unerwünschte Wirkungen»). Dies ist bei der Beurteilung der Fahrtüchtigkeit eines Patienten und seiner Fähigkeit zum Bedienen von Maschinen zu berücksichtigen.
Unerwünschte Wirkungen
Behandlungsbedingte unerwünschte Arzneimittelwirkungen
Erfahrung aus klinischen Studien bei behandlungsnaiven Erwachsenen
Die Beurteilung der Sicherheit von Delstrigo bei bezüglich antiretroviraler Therapie behandlungsnaiven HIV-1-infizierten Patienten stützt sich auf die Analysen der Daten über einen 96-wöchigen Zeitraum aus zwei randomisierten, internationalen, multizentrischen, doppelblinden, aktivkontrollierten Phase-3-Studien (DRIVE-FORWARD [Protokoll 018] und DRIVE-AHEAD [Protokoll 021]).
In DRIVE-FORWARD erhielten 766 erwachsene Patienten entweder Doravirin 100 mg (n = 383) oder Darunavir 800 mg + Ritonavir 100 mg (DRV+r) (n = 383) einmal täglich, jeweils in Kombination mit Emtricitabin/Tenofovir-DF (FTC/TDF) oder Abacavir/Lamivudin (ABC/3TC). Bis Woche 96 traten bei 2% der Patienten in der Doravirin-Gruppe und bei 3% der Patienten in der DRV+r-Gruppe unerwünschte Ereignisse auf, die zum Absetzen der Studienmedikation führten.
In DRIVE-AHEAD erhielten 728 erwachsene Patienten entweder Delstrigo (n = 364) oder Efavirenz/Emtricitabin/Tenofovir-DF (EFV/FTC/TDF) einmal täglich (n = 364). Bis Woche 96 traten bei 3% der Patienten in der Delstrigo-Gruppe und bei 7% der Patienten in der EFV/FTC/TDF-Gruppe unerwünschte Ereignisse auf, die zum Absetzen der Studienmedikation führten.
Klinische Studien bei virologisch supprimierten Erwachsenen
Die Sicherheit von Delstrigo bei virologisch supprimierten Erwachsenen basierte auf Daten der Woche 48 von 670 Patienten in der DRIVE-SHIFT Studie (Protokoll 024), eine randomisierte, internationale, multizentrische, offene Studie, in der virologisch supprimierte Patienten von einem Basisschema, bestehend aus zwei nukleosidischen Reverse-Transkriptase-Inhibitoren [NRTIs] in Kombination mit einem Ritonavir- oder Cobicistat-geboosteten Protease-Inhibitor (PI) oder Cobicistat-geboostetem Elvitegravir oder ein NNRTI, zu Delstrigo gewechselt haben. Insgesamt war das Sicherheitsprofil in virologisch supprimierten erwachsenen Patienten vergleichbar mit dem bei behandlungsnaiven erwachsenen Patienten.
Zusammenfassung des Sicherheitsprofils
In klinischen Studien mit behandlungsnaiven Patienten, die Delstrigo einnahmen, waren die am häufigsten berichteten unerwünschten Wirkungen, welche möglicherweise oder wahrscheinlich mit Doravrin verbunden sind, Übelkeit (6%) und Kopfschmerzen (5%).
Bei virologisch supprimierten HIV-1-infizierten Erwachsenen stimmte das Sicherheitsprofil von Delstrigo mit den gepoolten Daten aus den klinischen Phase-3-Studien mit behandlungsnaiven Patienten überein.
Die tabellarische Zusammenfassung der unerwünschten Wirkungen von DRIVE-FORWARD, DRIVE-AHEAD und DRIVE-SHIFT ist unten in Tabelle 2 dargestellt.
Unerwünschte Wirkungen mit einem vermuteten (zumindest möglichen) Zusammenhang mit der Behandlung sind unten nach Systemorganklasse und Häufigkeit aufgeführt. Innerhalb der einzelnen Häufigkeitsgruppen sind die unerwünschten Wirkungen nach abnehmendem Schweregrad aufgeführt. Die Häufigkeiten sind wie folgt definiert: sehr häufig (≥1/10); häufig (≥1/100 bis <1/10); gelegentlich (≥1/1'000 bis <1/100), selten (≥1/10'000 bis <1/1'000) oder sehr selten (<1/10'000).
Tabelle 2: Tabellarische Zusammenfassung der unerwünschten Wirkungen in Zusammenhang mit Doravirin/Lamivudin/Tenofovir-DF
Häufigkeit | Unerwünschte Wirkung | |
|---|---|---|
Erkrankungen des Blutes und des Lymphsystems | ||
Gelegentlich | Neutropenie*, Anämie*, Thrombozytopenie* | |
Sehr selten | Erythrozytenaplasie* | |
Infektionen und parasitäre Erkrankungen | ||
Selten | Ausschlag pustulös | |
Stoffwechsel- und Ernährungsstörungen | ||
Gelegentlich | Hypophosphatämie, Hypokaliämie* | |
Selten | Hypomagnesämie, Laktatazidose* | |
Psychiatrische Erkrankungen | ||
Häufig | Abnormale Träume, Schlaflosigkeit1 | |
Gelegentlich | Albtraum, Depression2, Angst3, Reizbarkeit, Verwirrtheitszustand, Suizidgedanken | |
Selten | Aggression, Halluzination, Anpassungsstörung, Stimmungsänderung, Schlafwandeln | |
Erkrankungen des Nervensystems | ||
Häufig | Kopfschmerzen, Schwindelgefühl, Somnolenz | |
Gelegentlich | Aufmerksamkeitsstörung, Erinnerungsvermögen eingeschränkt, Parästhesie, erhöhter Muskeltonus, schlechte Schlafqualität | |
Sehr selten | Periphere Neuropathie (oder Parästhesie)* | |
Gefässerkrankungen | ||
Gelegentlich | Hypertonie | |
Erkrankungen der Atemwege, des Brustraums und des Mediastinums | ||
Häufig | Husten*, nasale Symptome* | |
Selten | Dyspnoe, Hypertrophie der Tonsillen | |
Erkrankungen des Gastrointestinaltrakts | ||
Häufig | Übelkeit, Diarrhoe, Flatulenz, Abdominalschmerz4, Erbrechen | |
Gelegentlich | Obstipation, abdominale Beschwerden5, aufgetriebener Bauch*, Dyspepsie, weicher Stuhl6, gastrointestinale Motilitätsstörung7 | |
Selten | Tenesmus ani, Pankreatitis* | |
Leber- und Gallenerkrankungen | ||
Selten | Steatosis Hepatis*, Hepatitis* | |
Erkrankungen der Haut und des Unterhautgewebes | ||
Häufig | Ausschlag8, Alopezie* | |
Gelegentlich | Pruritus | |
Selten | Allergische Dermatitis, Rosazea, Angiooedem* | |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | ||
Häufig | Erkrankungen der Muskeln* | |
Gelegentlich | Myalgie, Arthralgie, Rhabdomyolyse*†, Muskelschwäche*† | |
Selten | Schmerzen des Muskel- und Skelettsystems, Osteomalazie (manifestiert sich als Knochenschmerzen und trägt selten zu Frakturen bei)*, Myopathie* | |
Erkrankungen der Nieren und der Harnwege | ||
Gelegentlich | Kreatinin erhöht*, proximale renaleTubulopathie (einschliesslich Fanconi Syndrom)* | |
Selten | Akute Nierenschädigung, Nierenerkrankung, Harnstein, Nephrolithiasis, akutes Nierenversagen*, Nierenversagen*, akute Nierentubulusnekrose*, Nephritis (einschliesslich akut interstitiell)*, nephrogener Diabetes insipidus* | |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | ||
Häufig | Ermüdung, Fieber* | |
Gelegentlich | Asthenie, Malaise | |
Selten | Brustkorbschmerz, Schüttelfrost, Schmerz, Durst | |
Untersuchungen | ||
Häufig | Alaninaminotransferase erhöht9 | |
Gelegentlich | Aspartataminotransferase erhöht, Lipase erhöht, Amylase erhöht, Hämoglobin erniedrigt | |
Selten | Kreatinphosphokinase im Blut erhöht | |
* Diese Nebenwirkung wurde nicht in den klinischen Phase-3-Studien für Doravirin identifiziert, sondern in der EU Fachinformation von 3TC und/oder TDF. Es wird die höchste Häufigkeitskategorie verwendet, die in der Schweizer Fachinformation von 3TC oder TDF angegeben ist.
† Diese Nebenwirkung kann als Konsequenz der proximalen renalen Tubulopathie auftreten. Es wird nicht davon ausgegangen, dass sie bei Abwesenheit dieser Erkrankung kausal mit Tenofovirdisoproxil verbunden ist.
1 Schlaflosigkeit schliesst ein: Einschlafstörungen und Schlafstörung
2 Depression schliesst ein: Depression, depressive Verstimmung, endogene Depression und persistierende Depression
3 Angst schliesst ein: Angst und generalisierte Angststörung
4 Abdominalschmerz schliesst ein: Abdominalschmerz und Schmerzen im Oberbauch
5 abdominale Beschwerden schliesst ein: abdominale Beschwerden und epigastrische Beschwerden
6 weicher Stuhl schliesst ein: weicher Stuhl und Stuhlveränderung
7 gastrointestinale Motilitätsstörung schliesst ein: gastrointestinale Motilitätsstörung und häufige Darmentleerungen
8 Ausschlag schliesst ein: Ausschlag, makulöser Ausschlag, erythematöser Hautausschlag, Ausschlag generalisiert, Ausschlag makulo-papulös, Ausschlag papulös und Urtikaria
9 Alaninaminotransferase erhöht schliesst ein: Alaninaminotransferase erhöht und hepatozelluläre Schädigung
Erfahrung nach der Markteinführung
Für Delstrigo liegen keine Postmarketing-Daten vor.
Die folgenden unerwünschten Wirkungen wurden während der Postmarketing-Erfahrung bei Patienten mit Lamivudin- oder Tenofovir-DF-haltigen Therapien festgestellt. Da Postmarketing-Reaktionen freiwillig von einer Population ungewisser Grösse berichtet werden, ist es nicht immer möglich, deren Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Lamivudin:
Stoffwechsel- und Ernährungsstörungen: Umverteilung/Ansammlung von Körperfett.
Endokrine Erkrankungen: Hyperglykämie.
Allgemeine Erkrankungen: Schwäche.
Erkrankungen des Blutes und des Lymphsystems: Anämie (einschliesslich Erythrozytenaplasie und schwerer Anämie, die unter Therapie fortschreitet).
Leber- und Gallenerkrankungen: Laktatazidose, Steatosis hepatis, Exazerbationen der Hepatitis B nach der Behandlung.
Überempfindlichkeit: Anaphylaxie, Urtikaria.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen: Muskelschwäche, Erhöhung der CPK, Rhabdomyolyse.
Erkrankungen der Haut und des Unterhautgewebes: Alopezie, Pruritus.
Tenofovir-DF:
Erkrankungen des Immunsystems: allergische Reaktionen, einschliesslich Angioödem.
Stoffwechsel- und Ernährungsstörungen: Laktatazidose, Hypokaliämie, Hypophosphatämie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums: Dyspnoe.
Erkrankungen des Gastrointestinaltrakts: Pankreatitis, erhöhte Amylase, Bauchschmerzen.
Leber- und Gallenerkrankungen: Steatosis hepatis, Hepatitis, erhöhte Leberenzymwerte (am häufigsten AST, ALT, gamma-GT).
Erkrankungen der Haut und des Unterhautgewebes: Ausschlag.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen: Rhabdomyolyse, Osteomalazie (manifestiert sich als Knochenschmerzen, die zu Frakturen beitragen können), Muskelschwäche, Myopathie.
Erkrankungen der Nieren und Harnwege: akutes Nierenversagen, Nierenversagen, akute Nierentubulusnekrose, Fanconi-Syndrom, proximale Nierentubulopathie, interstitielle Nephritis (einschliesslich akuter Fälle), nephrogener Diabetes insipidus, Niereninsuffizienz, erhöhtes Kreatininin, Proteinurie, Polyurie.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort: Asthenie.
Die folgenden unerwünschten Wirkungen, die unter den Systemorganklassen oben aufgeführt sind, können als Folge der proximalen Nierentubulopathie auftreten: Rhabdomyolyse, Osteomalazie, Hypokaliämie, Muskelschwäche, Myopathie, Hypophosphatämie.
Laboranomalien
Die Prozentsätze der Patienten mit ausgewählten Laboranomalien (die eine Verschlechterung gegenüber dem Ausgangswert darstellen), welche mit Doravirin oder DRV+r in DRIVE-FORWARD oder Delstrigo oder EFV/FTC/TDF in DRIVE-AHEAD behandelt wurden, sind in Tabelle 3 dargestellt.
Tabelle 3: Ausgewählte Laboranomalien bei Erwachsenen ohne vorherige antiretrovirale Behandlung in DRIVE-FORWARD und DRIVE-AHEAD (Woche 96)
DRIVE-FORWARD | DRIVE-AHEAD | |||
Laborparameter bevorzugter Begriff | Doravirine | DRV+r | Delstrigo | EFV/FTC/TDF |
Blutchemie | ||||
Total Bilirubin | ||||
1,1 - <1,6 x ULN | 6% | 2% | 5% | 0% |
1,6 - <2,6 x ULN | 2% | <1% | 2% | 0% |
≥2,6 x ULN | <1% | 0% | 1% | <1% |
Kreatinin (mg/dl) | ||||
>1,3 - 1,8 x ULN oder Anstieg von >0,3 mg/dl über den Ausgangswert | 4% | 6% | 3% | 2% |
>1,8 x ULN oder Anstieg von ≥1,5 x über den Ausgangswert | 4% | 4% | 3% | 2% |
Aspartataminotransferase (IU/l) | ||||
2,5 - <5,0 x ULN | 5% | 4% | 3% | 3% |
≥5,0 x ULN | 2% | 2% | 1% | 4% |
Alaninaminotransferase (IU/l) | ||||
2,5 - <5,0 x ULN | 4% | 2% | 4% | 4% |
≥5,0 x ULN | 2% | 3% | 1% | 3% |
Alkalinphosphatase (IU/l) | ||||
2,5 - <5,0 x ULN | <1% | 1% | <1% | 1% |
≥5,0 x ULN | 0% | <1% | 0% | <1% |
Lipase | ||||
1,5 - <3,0 x ULN | 7% | 6% | 6% | 4% |
≥3,0 x ULN | 3% | 4% | 2% | 3% |
Kreatinkinase (IU/l) | ||||
6,0 - <10,0 x ULN | 3% | 3% | 3% | 3% |
≥10,0 x ULN | 5% | 6% | 4% | 6% |
Cholesterin, nüchtern (mg/dl) | ||||
≥300 mg/dl | 0% | 1% | 1% | <1% |
LDL Cholesterol, nüchtern (mg/dl) | ||||
≥190 mg/dl | <1% | 4% | <1% | 2% |
Triglyzeride, nüchtern (mg/dl) | ||||
>500 mg/dl | 1% | 2% | 1% | 3% |
Jeder Patient wird nur einmal pro Parameter mit dem höchsten Toxizitätsgrad gezählt. Es werden nur Patienten mit einem Ausgangswert und mindestens einem Behandlungswert für einen bestimmten Laborparameter einbezogen. ULN = Upper limit of normal range. Anmerkung: NRTIs = FTC/TDF oder ABC/3TC | ||||
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Es gibt keine bekannte spezifische Behandlung für den Fall einer Überdosierung von Delstrigo. Falls es zu einer Überdosierung kommt, sollte der Patient überwacht werden und nach Erfordernis eine unterstützende Standardtherapie erhalten.
Doravirin: Es gibt keine bekannte spezifische Behandlung für den Fall einer Überdosierung mit Doravirin.
Lamivudin: Da nur eine vernachlässigbare Menge an Lamivudin durch (4-stündige) Hämodialyse, kontinuierliche ambulante Peritonealdialyse und automatisierte Peritonealdialyse eliminiert wurde, ist nicht bekannt, ob eine kontinuierliche Hämodialyse im Fall einer Überdosierung von Lamivudin von klinischem Nutzen wäre.
Tenofovir-DF: Tenofovir-DF wird durch Hämodialyse mit einem Extraktionskoeffizienten von rund 54% effizient eliminiert. Nach Einmalgabe von 300 mg Tenofovir-DF wurde im Verlauf einer 4-stündigen Hämodialysesitzung etwa 10% der verabreichten Tenofovir-Dosis eliminiert.
Eigenschaften/Wirkungen
ATC-Code
J05AR24
Wirkungsmechanismus
Doravirin: Doravirin ist ein Pyridinon und nicht-nukleosidischer Inhibitor der reversen Transkriptase von HIV-1 und hemmt die HIV-1-Replikation durch nicht-kompetitive Inhibition der reversen Transkriptase (RT) von HIV-1. Doravirin inhibiert die humanen zellulären DNA-Polymerasen α, β und die mitochondriale DNA-Polymerase γ nicht.
Lamivudin: Lamivudin ist ein synthetisches Nukleosidanalogon. Lamivudin wird intrazellulär zu dem aktiven 5'-Triphosphat-Metaboliten Lamivudintriphosphat (3TC-TP) phosphoryliert. Die Hauptwirkungsweise von 3TC-TP besteht in einer RT-Hemmung über DNA-Kettenabbruch nach Einbau des Nukleotidanalogons.
Tenofovir-DF: Tenofovir-DF ist ein azyklisches Nukleosidphosphonat-Diester-Analogon von Adenosinmonophosphat. Tenofovir-DF erfordert zuerst eine Diester-Hydrolyse zur Umwandlung in Tenofovir und wird anschliessend über Phosphorylierungen durch zelluläre Enzyme zu Tenofovirdiphosphat umgewandelt. Tenofovirdiphosphat hemmt die Aktivität der HIV-1-RT, indem es mit dem natürlichen Substrat Desoxyadenosin 5'-Triphosphat konkurriert und nach Einbau in die DNA einen Kettenabbruch herbeiführt. Tenofovirdiphosphat ist ein schwacher Inhibitor der DNA-Polymerasen α und β sowie der mitochondrialen DNA-Polymerase γ von Säugetieren.
Pharmakodynamik
Antivirale Aktivität in Zellkulturen
Doravirin: Doravirin zeigte in Gegenwart von 100% normalem Humanserum (NHS) unter Verwendung von MT4-GFP-Reporterzellen einen EC50-Wert von 12,0 ± 4,4 nM gegen Laborstämme des HIV-1-Wildtyps. Doravirin zeigte antivirale Aktivität gegen ein breites Spektrum primärer HIV-1-Isolate (A, A1, AE, AG, B, BF, C, D, G, H) mit EC50-Werten zwischen 1,2 nM und 10,0 nM.
Lamivudin: Die antivirale Aktivität von Lamivudin gegen HIV-1 wurde in einer Reihe von Zelllinien, einschliesslich Monozyten und mononukleärer Zellen des peripheren Bluts (PBMC), unter Verwendung von Standardassays zur Empfindlichkeitsprüfung untersucht. Die EC50-Werte lagen in einem Bereich von 0,003 bis 15 μM (1 μM = 0,23 μg/ml). Die medianen EC50-Werte für Lamivudin betrugen 60 nM (Spanne: 20 bis 70 nM), 35 nM (Spanne: 30 bis 40 nM), 30 nM (Spanne: 20 bis 90 nM), 20 nM (Spanne: 3 bis 40 nM), 30 nM (Spanne: 1 bis 60 nM), 30 nM (Spanne: 20 bis 70 nM), 30 nM (Spanne: 3 bis 70 nM) bzw. 30 nM (Spanne: 20 bis 90 nM) gegen die HIV-1-Subtypen A–G und Gruppe-O-Viren (n = 3 ausser n = 2 für Subtyp B). Zur Behandlung einer chronischen HCV-Infektion eingesetztes Ribavirin (50'000 nM) verminderte die Anti-HIV-1-Aktivität von Lamivudin in MT-4-Zellen um den Faktor 3,5.
Tenofovir-DF: Die antivirale Aktivität von Tenofovir gegen Labor- und klinische Isolate von HIV-1 wurde in T-lymphoblastoiden Zelllinien, primären Monozyten/Makrophagen sowie PBMC geprüft. Die EC50-Werte für Tenofovir lagen in einem Bereich von 0,04–8,5 μM. Tenofovir zeigte in Zellkulturen antivirale Aktivität gegen die HIV-1-Subtypen A, B, C, D, E, F, G und O (die EC50-Werte lagen zwischen 0,5 und 2,2 μM).
Resistenz
In Zellkulturen
Doravirin: Doravirin-resistente Stämme wurden in Zellkulturen aus HIV-1-Wildtyp verschiedener Herkünfte und Subtpyen sowie aus NNRTI-resistentem HIV-1 selektioniert. Unter anderem wurden dabei die folgenden unter Behandlung aufgetretenen Aminosäuresubstitutionen in der RT beobachtet: V106A, V106I, V106M, V108I, H221Y, F227C, F227L, F227V, M230I, L234I, P236L und Y318F.
Lamivudin: In Zellkulturen und bei mit Lamivudin behandelten Patienten wurden Lamivudin-resistente HIV-1-Varianten selektiert. Eine Genotypanalyse hat gezeigt, dass die Resistenz auf einer spezifischen Aminosäuresubstitution in der HIV-1-RT bei Codon 184 beruhte, bei der das Methionin entweder in Isoleucin oder Valin umgewandelt wurde (M184I/V).
Tenofovir-DF: Unter Tenofovir selektierte HIV-1-Isolate exprimierten eine K65R-Substitution in der HIV-1-RT und zeigten eine Reduktion der Tenofovir-Empfindlichkeit um den Faktor 2–4. Darüber hinaus wurde durch Tenofovir eine K70E-Substitution in der HIV-1-RT selektiert, die zu einer niedrigen, reduzierten Empfindlichkeit gegenüber Abacavir, Emtricitabin, Lamivudin und Tenofovir führte.
In klinischen Studien
In erwachsenen Patienten ohne vorherige antiretrovirale Behandlung
Doravirin: In den Doravirin-Behandlungsarmen der an behandlungsnaiven Patienten durchgeführten Studien DRIVE-FORWARD und DRIVE-AHEAD (n = 747) wurden bis Woche 96 neue Doravirinresistenz-assoziierte Substitutionen bei 8 von 30 Patienten im Resistenzanalyse-Subset (Patienten mit mehr als 400 HIV-1-RNA-Kopien pro ml bei virologischem Versagen oder bei vorzeitigem Studienabbruch, für die Resistenzdaten vorlagen) beobachtet.
Zu den neuen Doravirinresistenz-assoziierten Substitutionen in der RT gehörten eine oder mehrere der folgenden: A98G, V106A, V106I, V106M/T, Y188L, H221Y, P225H, F227C, F227C/R und Y318Y/F.
Im DRV+r-Behandlungsarm der Studie DRIVE-FORWARD (n = 383) wurden bei den 11 Patienten im Resistenzanalyse-Subset keine neuen Darunavirresistenz-assoziierten Substitutionen beobachtet. Im EFV/FTC/TDF-Behandlungsarm der Studie DRIVE-AHEAD (n = 364) wurden bei 15 von 24 Patienten im Resistenzanalyse-Subset neue Efavirenzresistenz-assoziierte Substitutionen beobachtet.
Lamivudin und Tenofovir-DF: In einer gepoolten Analyse von antiretroviral naiven Patienten, die Doravirin, Lamivudin und Tenofovir-DF erhielten, wurde eine Genotypisierung von HIV-1-Plasmaisolaten von allen Patienten mit HIV-1 RNA >400 Kopien/ml bei bestätigtem virologischen Versagen oder zum Zeitpunkt eines vorzeitigen Absetzens der Studienmedikation vorgenommen. Bei 8 auswertbaren Patienten, die bis Woche 96 DOR/3TC/TDF erhielten, hatte sich eine genotypische Resistenz entwickelt. Bei den eingetretenen Resistenz-assoziierten Substitutionen handelte es sich um RT A62A/V, M41L, T69T/A und V75V/I (n = 1); K65R (n = 2) und M184V (n = 5).
In virologisch supprimierten erwachsenen Patienten
In der klinischen Studie DRIVE-SHIFT entwickelten keine Patienten während der Behandlung mit Delstrigo eine genotypische oder phänotypische Resistenz gegen Doravirin, Lamivudin oder Tenofovir-DF, weder in der Gruppe mit sofortiger Umstellung (n=447) noch in der Gruppe mit verzögerter Umstellung (n=209). Ein Patient entwickelte eine RT M184M/I-Mutation und phänotypische Resistenz gegen Lamivudin und Emtricitabin während der Behandlung mit seinem Basisschema. Bei keinem der 24 Patienten (11 in der Gruppe mit unmittelbarer Umstellung [Tag 1], 13 in der Gruppe mit verzögerter Umstellung [Woche 24]) mit bereits vorliegenden NNRTI-Mutationen (RT K103N, G190A oder Y181C) kam es bis Woche 48 oder dem Zeitpunkt des Therapieabbruchs zu einem virologischen Versagen.
Kreuzresistenz
Es wurde keine signifikante Kreuzresistenz zwischen Doravirin-resistenten HIV-1-Varianten und Lamivudin/Emtricitabin oder Tenofovir oder zwischen Lamivudin- oder Tenofovir-resistenten Varianten und Doravirin nachgewiesen.
Doravirin: HIV-1-Laborstämme, welche die häufigen NNRTI-assoziierten Mutationen durch K103N-, Y181C- oder K103N/Y181C-Substitutionen in der RT aufweisen, zeigen gegenüber dem Wildtyp eine Abnahme der Empfindlichkeit gegenüber Doravirin um weniger als den Faktor 3. Doravirin konnte folgende NNRTI-assoziierte Substitutionen unter klinisch relevanten Konzentrationen supprimieren: K103N-, Y181C-, G190A- und E138K-Mutanten.
Ein Spektrum von 96 verschiedenen klinischen Isolaten mit NNRTI-assoziierten Substitutionen wurde auf seine Empfindlichkeit gegen Doravirin getestet. Klinische Isolate, welche die Y188L-Substitution alleine oder in Kombination mit K103N oder V106I, V106A in Kombination mit G190A und F227L, oder E138K in Kombination mit Y181C und M230L aufwiesen, zeigten eine um mehr als den Faktor 100 reduzierte Empfindlichkeit gegen Doravirin.
Unter Behandlung auftretende Doravirinresistenz-assoziierte Substitutionen können eine Kreuzresistenz gegen Efavirenz, Rilpivirin, Nevirapin und Etravirin verleihen. Von den 8 Patienten, bei denen sich eine phänotypische Resistenz gegenüber Doravirin entwickelte, war im Monogram Phenosense-Assay bei allen eine phänotypische Resistenz gegenüber Nevirapin festzustellen, bei 6 eine phänotypische Resistenz gegenüber Efavirenz, bei 4 eine phänotypische Resistenz gegen Rilpivirin und bei 4 eine partielle Resistenz gegen Etravirin.
Lamivudin: Unter den NRTIs wurde Kreuzresistenz beobachtet. Die für Resistenz gegenüber Lamivudin verantwortliche Substitution M184I/V verleiht Resistenz gegen Emtricitabin. Lamivudin-resistente HIV-1-Mutanten waren auch kreuzresistent gegenüber Didanosin. Bei einigen mit Zidovudin plus Didanosin behandelten Patienten traten Isolate mit Resistenzen gegen multiple Reverse-Transkriptase-Inhibitoren, einschliesslich Lamivudin, auf.
Tenofovir-DF: Unter den NRTIs wurde Kreuzresistenz beobachtet. Die durch Tenofovir selektierte Substitution K65R in der HIV-1-RT wird auch bei einigen mit Abacavir oder Didanosin behandelten HIV-1-infizierten Patienten selektiert. HIV-1-Isolate mit der Substitution K65R zeigten auch eine verminderte Empfindlichkeit gegenüber Emtricitabin und Lamivudin. Daher könnte es bei Patienten, in deren Virus die Substitution K65R vorliegt, zu einer Kreuzresistenz zwischen diesen NRTI kommen. Die klinisch durch Tenofovir-DF selektierte Substitution K70E führt zu verminderter Empfindlichkeit gegenüber Abacavir, Didanosin, Emtricitabin, Lamivudin und Tenofovir. HIV-1-Isolate von Patienten (N = 20), deren HIV-1 im Mittel 3 Zidovudin-assoziierte Aminosäuresubstitutionen in der RT exprimierte (M41L, D67N, K70R, L210W, T215Y/F oder K219Q/E/N), zeigten eine Abnahme der Empfindlichkeit gegenüber Tenofovir um den Faktor 3,1. Patienten, deren Virus eine L74V-RT-Substitution ohne Zidovudin-Resistenz-assoziierte Substitutionen exprimierte (N = 8), hatten ein vermindertes Ansprechen auf Tenofovir-DF. Zu Patienten, deren Virus eine Y115F-Substitution (N = 3), eine Q151M-Substitution (N = 2) oder eine T69-Insertion (N = 4) in der HIV-1-RT exprimierte, liegen begrenzte Daten vor; alle zeigten in den klinischen Studien ein vermindertes Ansprechen.
Auswirkungen auf das Elektrokardiogramm
Doravirin verursacht in einer Dosis von 1200 mg, nach deren Gabe etwa 4-mal höhere Spitzenkonzentrationen zu beobachten sind als nach Gabe der zugelassenen Höchstdosis, keine Verlängerung des QT-Intervalls von klinisch relevantem Ausmass.
Klinische Wirksamkeit
Erwachsene Patienten ohne vorherige antiretrovirale Behandlung
Die Wirksamkeit von Delstrigo stützt sich auf den Analysen der Daten über einen 96-wöchigen Zeitraum aus zwei randomisierten, multizentrischen, doppelblinden, aktivkontrollierten Phase-3-Studien (DRIVE-FORWARD und DRIVE-AHEAD) bei bezüglich antiretroviraler Therapie behandlungsnaiven HIV-1-infizierten Patienten (n = 1494).
In DRIVE-FORWARD erhielten 766 randomisierte Patienten mindestens 1 Gabe von Doravirin einmal täglich oder DRV+r 800/100 mg einmal täglich, jeweils in Kombination mit Emtricitabin/Tenofovir-DF (FTC/TDF) oder Abacavir/Lamivudin (ABC/3TC), wobei die Auswahl vom Prüfarzt getroffen wurde. Zu Studienbeginn waren die Patienten im Median 33 Jahre alt, 16% waren weiblich, 27% nicht-weisser Hautfarbe, 4% waren mit dem Hepatitis-B- und/oder -C-Virus koinfiziert, bei 10% war AIDS in der Vorgeschichte bekannt, 20% wiesen mehr als 100'000 HIV-1-RNA-Kopien/ml auf, 86% hatten eine CD4+-T-Zell-Zahl von mehr als 200 Zellen/mm3, 13% erhielten ABC/3TC und 87% FTC/TDF. Die Behandlungsgruppen waren bezüglich dieser Merkmale miteinander vergleichbar.
In DRIVE-AHEAD erhielten 728 randomisierte Teilnehmer einmal täglich mindestens 1 Gabe von entweder Delstrigo oder EFV/FTC/TDF. Zu Studienbeginn waren die Teilnehmer im Median 31 Jahre alt, 15% waren weiblich, 52% nicht-weisser Hautfarbe, 3% waren mit dem Hepatitis-B- und/oder -C-Virus koinfiziert, bei 14% war AIDS in der Vorgeschichte bekannt, 21% wiesen mehr als 100'000 HIV-1-RNA-Kopien/ml auf und 88% hatten eine CD4+-T-Zell-Zahl von mehr als 200 Zellen/mm3. Die Behandlungsgruppen waren bezüglich dieser Merkmale miteinander vergleichbar.
Die Ergebnisse der Wochen 48 und 96 aus DRIVE-FORWARD und DRIVE-AHEAD sind in Tabelle 4 dargestellt. Die Nebeneinander-Darstellung in der Tabelle dient der besseren Übersichtlichkeit; direkte Vergleiche zwischen den Studien sollten aufgrund des unterschiedlichen Designs nicht gemacht werden.
In DRIVE-FORWARD zeigte Doravirin eine konsistente Wirksamkeit in Bezug auf demographische und zu Studienbeginn vorliegende prognostische Faktoren wie Geschlecht, Hautfarbe, ethnische Zugehörigkeit, NRTI-Hintergrundtherapie, HIV-1-RNA-Ausgangswert (≤100'000 oder >100'000 Kopien/ml), CD4+-T-Zell-Zahl und virale Subtypen. Die mittleren CD4+-T-Zell-Zahlen in der Doravirin und der DRV+r-Gruppe stiegen gegenüber Studienbeginn um 193 bzw. 186 Zellen/mm3 in Woche 48 und um 224 bzw.207 Zellen/mm3 in Woche 96 an.
In DRIVE-AHEAD zeigte Delstrigo eine konsistente Wirksamkeit in Bezug auf demographische und zu Studienbeginn vorliegende prognostische Faktoren wie Geschlecht, Hautfarbe, ethnische Zugehörigkeit, HIV-1-RNA-Ausgangswert (≤100'000 oder >100'000 Kopien/ml), CD4+-T-Zell-Zahl und virale Subtypen. Die mittleren CD4+-T-Zell-Zahlen in der Delstrigo und der EFV/FTC/TDF-Gruppe stiegen gegenüber Studienbeginn um 198 bzw. 188 Zellen/mm3 in Woche 48 und um 238 bzw.223 Zellen/mm3 in Woche 96 an.
Tabelle 4: Therapieansprechen (HIV-1-RNA <50 Kopien/ml, Snapshot-Analyse) bei erwachsenen HIV-1-Patienten ohne vorherige antiretrovirale Behandlung
Ergebnis | DRIVE-FORWARD | DRIVE-AHEAD | ||
Doravirin | DRV+r | Delstrigo | EFV/FTC/TDF | |
Woche 48 | 84% (N=383) | 80% (N=383) | 84% (N=364) | 81% (N=364) |
Unterschied (95% KI)* | 3,9% (-1,6%; 9,4%) | 3,5% (-2,0%; 9,0%) | ||
Woche 96# | 73% (N=379) | 66% (N=376) | 77% (N=364) | 74% (N=364) |
Unterschied (95%-KI)* | 7,1% (0,5%; 13,7%) | 3,8% (2,4%; 10,0%) | ||
Anteil (%) der Studienteilnehmer mit HIV-1-RNA <50 Kopien/ml in Woche 96 nach Baseline- und demographischer Kategorie | ||||
Geschlecht | ||||
Männlich | 73% (N = 315) | 68% (N = 319) | 78% (N = 305) | 73% (N = 311) |
Weiblich | 73% (N = 64) | 54% (N = 57) | 75% (N = 59) | 75% (N = 53) |
Hautfarbe | ||||
Weiss | 78% (N = 227) | 69% (N = 276) | 80% (N = 176) | 74% (N = 170) |
Nicht weiss | 59% (N = 102) | 59% (N = 99) | 76% (N = 188) | 74% (N = 194) |
Ethnische Zugehörigkeit | ||||
Hispanisch oder lateinamerikanisch | 78% (N = 91) | 64% (N = 85) | 81% (N = 126) | 77% (N = 119) |
Nicht hispanisch oder lateinamerikanisch | 72% (N = 283) | 67% (N = 285) | 76% (N = 238) | 72% (N = 239) |
NRTI-Hintergrundtherapie | ||||
FTC/TDF | 72% (N = 329) | 66% (N = 328) | - | - |
ABC/3TC | 80% (N = 50) | 67% (N = 48) | - | - |
HIV-1-RNA zu Studienbeginn (Kopien/ml) | ||||
≤100'000 Kopien/ml | 76% (N = 297) | 67% (N = 303) | 80% (N = 291) | 77% (N = 282) |
>100'000 Kopien/ml | 62% (N = 82) | 60% (N = 72) | 67% (N = 73) | 62% (N = 82) |
CD4+-T-Zell-Zahl (Zellen/mm3) | ||||
≤200 Zellen/mm3 | 65% (N = 40) | 52% (N = 65) | 59% (N = 44) | 70% (N = 46) |
>200 Zellen/mm3 | 74% (N = 339) | 69% (N = 311) | 80% (N = 320) | 74% (N = 318) |
Viraler Subtyp¶ | ||||
Subtyp B | 72% (N = 262) | 67% (N = 266) | 80% (N = 232) | 72% (N = 253) |
Subtyp Non-B | 75% (N = 117) | 63% (N = 110) | 73% (N = 130) | 77% (N = 111) |
# Für Woche 96 wurden Patienten mit fehlender HIV-1-RNA aufgrund eines Reagenz-Rückrufs durch den Hersteller Abbott von der Analyse ausgeschlossen. * Die 95%-KI für die Behandlungsunterschiede wurden mit der Stratum-bereinigten Mantel-Haenszel-Methode berechnet. ¶ Von zwei Patienten war der virale Subtyp nicht verfügbar. Anmerkung: NRTI = FTC/TDF oder ABC/3TC. | ||||
Bei P007 handelte es sich um eine Phase-2b-Studie bei bezüglich antiretroviraler Therapie behandlungsnaiven HIV-1-infizierten erwachsenen Patienten (n = 340). In Teil I wurden die Patienten zu einer von 4 Doravirin-Dosen oder EFV, jeweils in Kombination mit FTC/TDF, randomisiert. Nach Woche 24 wurden alle Teilnehmer, die Doravirin zugewiesen worden waren, auf Doravirin 100 mg umgestellt (beziehungsweise unter dieser Dosis belassen). Weitere Patienten wurden in Teil II entweder Doravirin 100 mg oder EFV, jeweils in Kombination mit FTC/TDF, zurandomisiert. In beiden Studienteilen wurden Doravirin und EFV verblindet verabreicht, während die Gabe von FTC/TDF offen erfolgte.
In Woche 48 betrug der Anteil der Teilnehmer mit weniger als 50 HIV-1-RNA-Kopien/ml für Doravirin 100 mg und EFV 79% (85/108) bzw. 82% (89/108). In Woche 96 betrug der Anteil der Teilnehmer mit weniger als 50 HIV-1-RNA-Kopien/ml für Doravirin 100 mg und EFV 76% (82/108) bzw. 76% (82/108). In Woche 48 waren die mittleren CD4+-T-Zell-Zahlen in der Gruppe mit Doravirin 100 mg und der EFV-Gruppe gegenüber Studienbeginn um 192 bzw.195 Zellen/mm3 angestiegen. In Woche 96 waren die mittleren CD4+-T-Zell-Zahlen in der Gruppe mit Doravirin 100 mg und der EFV-Gruppe gegenüber Studienbeginn um 259 bzw. 264 Zellen/mm3 angestiegen. Die Subgruppenanalyse für P007 ist in Tabelle 5 unten aufgeführt.
Tabelle 5: Anteil (%) der Patienten mit HIV-1-RNA <50 Kopien/ml in Woche 96 für Protokoll 007 (Snapshot-Analyse der FDA)
Doravirin 100 mg | Efavirenz 600 mg | |
HIV-1-RNA zu Studienbeginn (Kopien/ml) | ||
≤100'000 Kopien/ml | 56/73 (77%) | 55/76 (72%) |
>100'000 Kopien/ml | 26/35 (74%) | 27/32 (84%) |
CD4+-T-Zell-Zahl (Zellen/mm3) | ||
≤200 Zellen/mm3 | 6/7 (86%) | 7/10 (70%) |
>200 Zellen/mm3 | 76/101 (75%) | 75/98 (77%) |
Virologisch supprimierte erwachsene Patienten
Die Wirksamkeit der Umstellung auf Delstrigo von einem Basisschema, das aus zwei nukleosidischen Reverse-Transkriptase-Inhibitoren in Kombination mit einem Ritonavir- oder Cobicistat-geboosteten-Protease-Inhibitor (PI) oder Cobicistat-geboostetem-Elvitegravir oder einem NNRTI besteht, wurde in einer randomisierten, offenen Studie (DRIVE-SHIFT) bei virologisch supprimierten HIV-1-infizierten Erwachsenen untersucht. Die Patienten mussten in ihrem Basisschema mindestens 6 Monate lang vor dem Eintritt in die Studie virologisch supprimiert worden sein (HIV-1-RNA <50 Kopien/ml), ohne virologisches Versagen in der Anamnese. Die Patienten wurden randomisiert, um entweder bei Studienbeginn auf Delstrigo umzustellen (n = 447, Immediate Switch Group ISG) oder bis zur 24. Woche auf ihrem Basisschema zu bleiben, woraufhin sie auf Delstrigo umstellten (n = 223, Delayed Switch Group DSG). Bei Studienbeginn lag das Medianalter der Patienten bei 43 Jahren, 16% waren weiblich und 24% waren nicht-weiss.
In der DRIVE-SHIFT-Studie wurde gezeigt, dass eine sofortige Umstellung auf Delstrigo in Woche 48 einer Fortsetzung des Basisschemas in Woche 24 nicht unterlegen war, beurteilt anhand des Anteils der Patienten mit HIV-1-RNA <50 Kopien/ml. Der Vergleich in der Studienwoche 24 zeigte konsistente Ergebnisse in jeder Behandlungsgruppe. Die Behandlungsergebnisse sind in Tabelle 6 dargestellt.
Tabelle 6: Virologische Ergebnisse in DRIVE-SHIFT bei virologisch supprimierten HIV-1-Patienten, die auf Delstrigo umstellten
| Ansprechen | Delstrigo Einmal täglich ISG | Basisschema DSG |
| Woche 48 N=447 | Woche 24 N=223 | |
| HIV-1 RNA <50 Kopien/ml | 91% | 95% |
| ISG-DSG, Unterschied (95% KI) * | 3,8% (-7,9%; 0,3%)* | |
| HIV-1 RNA ≥50 Kopien/ml† | 2% | 2% |
| Keine virologischen Daten im Woche-48-Fenster | 8% | 4% |
| Studienteilnahme aufgrund von UE oder Tod abgebrochen ‡ | 3% | 0 |
| Studienteilnahme aus anderen Gründen abgebrochen § | 4% | 4% |
| In der Studie, aber fehlende Daten im Zeitfenster | 0 | 0 |
Anteil (%) der Patienten mit HIV-1-RNA <50 Kopien/ml nach Baseline- und demographischer Kategorie | ||
Geschlecht | ||
| Männlich | 91% (N = 372) | 94% (N = 194) |
| Weiblich | 91% (N = 75) | 100% (N = 29) |
Hautfarbe | ||
| Weiss | 90% (N = 344) | 95% (N = 168) |
| Nicht weiss | 93% (N = 103) | 93% (N = 55) |
Ethnische Zugehörigkeit | ||
| Hispanisch oder lateinamerikanisch | 88% (N = 99) | 91% (N = 45) |
| Nicht hispanisch oder lateinamerikanisch | 91% (N = 341) | 95% (N = 175) |
CD4+-T-Zell-Zahl (Zellen/mm³) | ||
| <200 Zellen/mm³ | 85% (N = 13) | 75% (N = 4) |
| ≥200 Zellen/mm³ | 91% (N = 426) | 95% (N = 216) |
* Die 95%-KIs für die Behandlungsunterschiede wurden mittels Stratum-bereinigter Mantel-Haenszel Methode berechnet. † Beinhaltet Patienten, die die Einnahme der Studienmedikation oder die Studienteilnahme vor Woche 48 für ISG oder vor Woche 24 für DSG wegen mangelnder oder verlorener Wirksamkeit abbrachen sowie Patienten mit HIV-1-RNA ≥50 Kopien/ml im Woche-48-Fenster für ISG und im Woche-24-Fenster für DSG. ‡ Schliesst Patienten ein, die aufgrund eines unerwünschten Ereignisses (UE) oder Todes die Studie abgebrochen haben, wenn dies zu fehlenden virologischen Daten während der Behandlung innerhalb des angegebenen Zeitfensters führte. § Weitere Gründe waren: Lost to follow-up, Non-Compliance mit der Studienmedikation, ärztliche Entscheidung, Prüfplanverletzung, Abbruch durch den Teilnehmer. Basisschema = Ritonavir oder Cobicistat-geboostete PI (insbesondere Atazanavir, Darunavir oder Lopinavir), oder Cobicistat-geboostetes Elvitegravir oder NNRTI (insbesondere Efavirenz, Nevirapin oder Rilpivirin), jeweils verabreicht mit zwei NRTIs. | ||
Pharmakokinetik
Nach Einmalgabe einer Delstrigo-Tablette an gesunde Probanden (N = 24) im Nüchternzustand waren vergleichbare Expositionen gegenüber Doravirin, Lamivudin und Tenofovir zu verzeichnen wie bei einer Verabreichung von Doravirin-Tabletten (100 mg) plus Lamivudin-Tabletten (300 mg) plus Tenofovir-DF-Tabletten (300 mg).
Die Pharmakokinetik von Doravirin wurde bei gesunden Probanden sowie bei HIV-1-infizierten Patienten untersucht. Die Pharmakokinetik von Doravirin ist bei gesunden und HIV-1-infizierten Personen vergleichbar. Der Steady-State wird im Allgemeinen bis Tag 2 einer einmal täglich erfolgenden Gabe erreicht, die Akkumulationsverhältnisse für AUC0-24, Cmax und C24 bewegen sich zwischen 1,2 und 1,4 für Dosen von 30 bis 240 mg QD. Unten sind die pharmakokinetischen Steady-State-Parameter für Doravirin nach Verabreichung von 100 mg einmal täglich an HIV-1-infizierte Studienteilnehmer dargestellt, basierend auf einer populationspharmakokinetischen Analyse.
Tabelle 7: pharmakokinetischen Steady-State-Parameter von Doravirin
Parameter | AUC0-24 μM·h | Cmax μM | C24 nM |
Doravirin 100 mg einmal täglich | 37,8 (29) | 2,26 (19) | 930 (63) |
GM: geometrisches Mittel, %CV: Geometrischer Variationskoeffizient | |||
Absorption
Doravirin: Nach oraler Gabe werden die Spitzenkonzentrationen im Plasma 2 Stunden nach Verabreichung erreicht. Die absolute Bioverfügbarkeit von Doravirin wurde für die 100 mg Tablette mittels modellbasierter Analysen auf etwa 64% geschätzt.
Lamivudin: Lamivudin wird nach oraler Verabreichung gut aus dem Gastrointestinaltrakt resorbiert. Die absolute Bioverfügbarkeit liegt beim Erwachsenen normalerweise zwischen 80 und 85%. Nach oraler Verabreichung beträgt die mittlere Zeit (tmax) bis zur maximalen Serumkonzentration (Cmax) ungefähr 1 Stunde. Bei therapeutischer Dosierung, d.h. 4 mg/kg Körpergewicht/Tag, aufgeteilt in eine Einzeldosis alle 12 Stunden, liegt Cmax zwischen 1 und 1,9 µg/ml.
Bei Mehrfachdosierung wurde keine klinisch signifikante Akkumulation des Wirkstoffes festgestellt.
Tenofovir-DF: Nach oraler Verabreichung von Tenofovir-DF an HIV-infizierte Patienten wird Tenofovir-DF rasch absorbiert und in Tenofovir umgewandelt. Bei Einnahme im Nüchternzustand wurde die maximale Tenofovir-Konzentration innerhalb einer Stunde erreicht, die Cmax und die AUC (Mittelwert ± SD) (% CV) betrugen 296 ± 90 ng/ml (30%) und 2287 ± 685 ng·h/ml (30%). Die orale Bioverfügbarkeit von Tenofovir aus Tenofovir-DF betrug bei nüchternen Patienten rund 25%.
Distribution
Doravirin: Basierend auf der i.v. Verabreichung einer 100 µg Mikrodosis beträgt das Distributionsvolumen von Doravirin 60,5 l. Doravirin wird zu etwa 76% an Plasmaproteine gebunden.
Lamivudin: Aus Studien, in denen Lamivudin intravenös verabreicht wurde, ist bekannt, dass das mittlere Verteilungsvolumen 1,3 l/kg beträgt. Lamivudin besitzt ein lineares pharmakokinetisches Verhalten über die therapeutische Dosierungsbreite und eine begrenzte Bindung (16-36%) an das Hauptplasmaprotein Albumin.
Eine begrenzte Anzahl von Daten zeigt, dass Lamivudin liquorgängig ist und in der Zerebrospinalflüssigkeit nachgewiesen werden kann. Der mittlere Quotient der Lamivudin-Konzentration zwischen Zerebrospinalflüssigkeit und Serum betrug 2-4 Stunden nach oraler Verabreichung ca. 0,12. Das exakte Ausmass des Übergangs in die Zerebrospinalflüssigkeit oder dessen Korrelation mit einer klinischen Wirkung ist nicht bekannt.
Tenofovir-DF: Nach intravenöser Verabreichung betrug das Verteilungsvolumen von Tenofovir ungefähr 800 ml/kg. Nach oraler Gabe wird Tenofovir breit im gesamten Körper verteilt. Die in-vitro-Bindung von Tenofovir an humanes Plasma- oder Serumprotein betrug in einem Konzentrationsbereich zwischen 0,01 und 25 µg/ml weniger als 0,7% (Plasmaproteine) bzw. 7,2% (Serumproteine).
Metabolismus
Doravirin: In-vitro-Daten zufolge wird Doravirin vorwiegend durch CYP3A metabolisiert.
Lamivudin: Die Metabolisierung spielt bei der Elimination von Lamivudin eine untergeordnete Rolle (5-10%).
Tenofovir-DF: In-vitro-Untersuchungen haben gezeigt, dass weder Tenofovir-DF noch Tenofovir Substrate für CYP450-Enzyme sind.
Elimination
Doravirin: Die terminale Halbwertszeit (t1/2) von Doravirin beträgt etwa 15 Stunden. Doravirin wird hauptsächlich über den oxidativen, CYP3A4-abhängigen Stoffwechsel eliminiert. Eine Ausscheidung des unveränderten Wirkstoffs über den Urin findet nur in geringem Umfang statt. Eine relevante biliäre Ausscheidung des unveränderten Wirkstoffs wird nicht erwartet.
In einer klinischen Studie mit [14C]Doravirin unter Verwendung einer Kapselformulierung mit geringer Bioverfügbarkeit im Vergleich zur Tablette, wurde der grösste Teil der Dosis im Stuhl als nicht absorbiertes Arzneimittel wieder gefunden. Doravirin und der oxidative Metabolit M9 waren die wichtigsten Spezies im Plasma (75% bzw. 12,9% der gesamten Arzneimittel-bezogenen Komponenten). Basierend auf dem absorbierten Teil der verabreichten Dosis war M9 die wichtigste Arzneimittel-bezogene Spezies im Urin (39,4% der absorbierten Dosis) und im Stuhl (15,9% der absorbierten Dosis). Weniger häufige Metaboliten, die jeweils 1,2% oder weniger der Arzneimittel-bezogenen Komponenten im Plasma oder der in Ausscheidungen wieder gefundenen Dosis ausmachen, umfassten N-dealkylierte und andere oxidative Produkte sowie Konjugate von oxidativen Metaboliten. Etwa 12,9% der absorbierten Dosis wurden bei der Verabreichung als Kapsel als Doravirin im Urin ausgeschieden.
Lamivudin: Die mittlere terminale Eliminationshalbwertszeit beträgt 5 bis 7 Stunden. Die mittlere systemische Clearance von Lamivudin beträgt ca. 0,32 l/h/kg, wobei die renale Clearance über das Transportsystem für organische Kationen stark überwiegt (>70%). Die hepatische Metabolisierung beträgt weniger als 10%. Im Vergleich zur Plasmahalbwertszeit von Lamivudin (5-7 Stunden) besitzt das aktive Molekül (intrazelluläres Lamivudintriphosphat) mit 16-19 Stunden eine lange Halbwertszeit in der Zelle.
Tenofovir-DF: Nach oraler Gabe liegt die Eliminations-Halbwertzeit von Tenofovir bei etwa 12 bis 18 Stunden. Tenofovir wird primär über die Nieren eliminiert, sowohl durch Filtration als auch durch ein aktives tubuläres Transportsystem (die humanen organischen Anionen-Transporter (hOAT) 1 und 3 und das multidrug-resistente Protein 4 (MRP4)), wobei nach intravenöser Verabreichung etwa 70 bis 80% der Dosis unverändert über den Urin ausgeschieden werden. Die scheinbare Clearance von Tenofovir betrug im Durchschnitt 307 ml/min. Die renale Clearance wurde auf ungefähr 210 ml/min geschätzt, was die glomeruläre Filtrationsrate übersteigt. Dies deutet darauf hin, dass die aktive tubuläre Sekretion bei der Ausscheidung von Tenofovir eine wichtige Rolle spielt.
Einfluss von Nahrung auf die orale Absorption
Die Einmalgabe einer Delstrigo-Tablette mit einer fettreichen Mahlzeit an gesunde Probanden resultierte in einem Anstieg der C24 von Doravirin um 26%, während die AUC und Cmax im Wesentlichen unbeeinflusst blieben. Die Cmax von Lamivudin nahm mit einer fettreichen Mahlzeit um 19% ab, während die AUC nicht in signifikantem Mass beeinflusst wurde. Mit einer fettreichen Mahlzeit nahm die Cmax von Tenofovir um 12% ab und die AUC nahm um 27% zu. Diese Unterschiede in der Pharmakokinetik werden als klinisch nicht relevant betrachtet.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Doravirin: Doravirin wird hauptsächlich über die Leber metabolisiert und eliminiert. In einer Studie, in der 8 Patienten mit mässig eingeschränkter Leberfunktion (Child-Pugh-Klasse B) mit 8 Patienten ohne Einschränkung der Leberfunktion verglichen wurden, zeigten sich keine klinisch relevanten Unterschiede in der Pharmakokinetik von Doravirin. Doravirin wurde bei Patienten mit schwerer Einschränkung der Leberfunktion (Child-Pugh-Klasse C) nicht untersucht (siehe «Dosierung/Anwendung»).
Lamivudin: Die pharmakokinetischen Eigenschaften von Lamivudin wurden bei Erwachsenen mit eingeschränkter Leberfunktion untersucht. Die pharmakokinetischen Parameter wurden durch eine nachlassende Leberfunktion nicht verändert. Sicherheit und Wirksamkeit von Lamivudin wurden bei Vorliegen einer dekompensierten Lebererkrankung nicht nachgewiesen.
Tenofovir-DF: Die Pharmakokinetik von Tenofovir nach Gabe von 300 mg Tenofovir-DF wurde an gesunden Probanden mit mässig bis schwer eingeschränkter Leberfunktion untersucht. Zwischen Patienten mit eingeschränkter Leberfunktion und gesunden Probanden wurden keine klinisch relevanten Unterschiede in der Pharmakokinetik von Tenofovir beobachtet.
Nierenfunktionsstörungen
Doravirin: Doravirin wird nur in geringem Umfang über die Nieren ausgeschieden: Rund 6% einer als Tablette verabreichten Dosis werden unverändert mit dem Urin ausgeschieden. In einer Studie, in der 7 Patienten mit einer GFR von <30 ml/min mit 8 Patienten ohne Einschränkung der Nierenfunktion (GFR ≥90 ml/min) verglichen wurden, lag die Exposition gegenüber Doravirin nach Einmalgabe bei Patienten mit schwer eingeschränkter Nierenfunktion um 31% höher. In einer populationspharmakokinetischen Analyse, welche 1102 Patienten mit einer GFR von ≥90 ml/min, 188 Patienten mit einer GFR von 60-89 ml/min, 9 Patienten mit einer GFR von 30-59 ml/min und 7 Patienten mit einer GFR von <30 ml/min einschloss, hatte die Nierenfunktion keinen klinisch relevanten Einfluss auf die Pharmakokinetik von Doravirin. Doravirin wurde bei Patienten mit terminaler Niereninsuffizienz oder bei dialysepflichtigen Patienten nicht untersucht (siehe «Dosierung/Anwendung»).
Lamivudin: Die pharmakokinetischen Eigenschaften von Lamivudin wurden in einer kleinen Gruppe HIV-1-infizierter Erwachsener mit eingeschränkter Nierenfunktion untersucht (Tabelle 8).
Tabelle 8: Pharmakokinetische Parameter (Mittelwert ± SD) nach oraler Einmalgabe von 300 mg Lamivudin in 3 Gruppen von Erwachsenen mit unterschiedlich starker Nierenfunktionseinschränkung
Kriterium Kreatinin-Clearance (Anzahl Patienten) | |||
Parameter | >60 ml/min | 10–30 ml/min | <10 ml/min |
n = 6 | n = 4 | n = 6 | |
Kreatinin-Clearance (ml/min) | 111 ± 14 | 28 ± 8 | 6 ± 2 |
Cmax (μg/ml) | 2,6 ± 0,5 | 3,6 ± 0,8 | 5,8 ± 1,2 |
AUC∞ (μg•h/ml) | 11,0 ± 1,7 | 48,0 ± 19 | 157 ± 74 |
Cl/F (ml/min) | 464 ± 76 | 114 ± 34 | 36 ± 11 |
Tenofovir-DF: Die pharmakokinetischen Parameter von Tenofovirdisoproxil 245 mg (als Fumarat) wurden nach einmaliger Gabe bei nicht-HIV- und nicht-HBV-infizierten Patienten mit unterschiedlich schweren Nierenfunktionsstörungen bestimmt. Der Schweregrad der Nierenfunktionsstörung wurde anhand des Ausgangswerts der Kreatinin-Clearance (ClCr) bestimmt (normale Nierenfunktion bei ClCr >80 ml/min, leichte Nierenfunktionsstörung bei ClCr = 50-79 ml/min, mittelschwere Nierenfunktionsstörung bei ClCr = 30-49 ml/min und schwere Nierenfunktionsstörung bei ClCr = 10-29 ml/min).
Die mittlere Exposition (% Variationskoeffizient [%CV]) gegenüber Tenofovir stieg von 2185 ng·h/ml (12%) bei Patienten mit normaler Nierenfunktion auf 3064 ng·h/ml (30%) bei Patienten mit einer leichten Nierenfunktionsstörung, auf 6009 ng·h/ml (42%) bei Patienten mit einer mittelschweren Nierenfunktionsstörung und auf 15'985 ng·h/ml (45%) bei Patienten mit einer schweren Nierenfunktionsstörung.
Bei dialysepflichtigen Patienten mit einer terminalen Niereninsuffizienz (ESRD [end stage renal disease]) (ClCr <10 ml/min) kam es zwischen zwei Hämodialysebehandlungen zu einem ausgeprägten Anstieg der Tenofovir-Exposition über 48 Stunden auf einen mittleren Cmax-Wert von 1032 ng/ml und eine mittlere AUC0-48h von 42'857 ng·h/ml (29%).
Bei nicht-dialysepflichtigen Patienten mit einer Kreatinin-Clearance <10 ml/min und bei Patienten mit terminaler Niereninsuffizienz, die Peritonealdialyse oder andere Dialyseformen anwenden, wurde die Pharmakokinetik von Tenofovir nicht untersucht.
Ältere Patienten
In einer Phase-1-Studie sowie in einer populationspharmakokinetischen Analyse wurden keine klinisch relevanten Unterschiede in der Pharmakokinetik von Doravirin zwischen Personen ab 65 Jahren und Personen unter 65 Jahren festgestellt. Die Pharmakokinetik von Lamivudin und Tenofovir bei über 65 Jahre alten Personen wurde nicht untersucht (siehe «Dosierung/Anwendung»).
Kinder und Jugendliche
Die Pharmakokinetik und Dosierungsempfehlungen von Delstrigo wurden bei Patienten unter 18 Jahren nicht untersucht (siehe «Dosierung/Anwendung»).
Ethnische Zugehörigkeit
Doravirin: In einer populationspharmakokinetischen Analyse zur Anwendung von Doravirin bei gesunden und HIV-1-infizierten Personen wurden keine klinisch relevanten Unterschiede zwischen den verschiedenen Ethnien festgestellt.
Lamivudin: Es wurden keine signifikanten oder klinisch relevanten Unterschiede in der Pharmakokinetik von Lamivudin zwischen verschiedenen Ethnien festgestellt.
Tenofovir-DF: Angehörige nichtweisser ethnischer Gruppen wurden nicht in ausreichender Anzahl untersucht, um potenzielle pharmakokinetische Unterschiede zwischen diesen Populationen nach der Verabreichung von Tenofovir-DF adäquat zu bestimmen.
Geschlecht
Zwischen Männern und Frauen wurden keine klinisch relevanten Unterschiede im Hinblick auf die Pharmakokinetik von Doravirin, Lamivudin und Tenofovir festgestellt.
Präklinische Daten
Mit Delstrigo wurden keine tierexperimentellen Studien durchgeführt. Die folgenden Daten basieren auf Ergebnissen separater Studien mit den einzelnen Komponenten von Delstrigo (Doravirin, Lamivudin und Tenofovir-DF).
Akute Toxizität
Doravirin: Mit Doravirin wurden keine Studien zur akuten Toxizität durchgeführt.
Lamivudin: An Mäusen und Ratten wurden Studien zur akuten Toxizität von Lamivudin durchgeführt. Bei Mäusen wurden nach akuter oraler Verabreichung sehr hoher Lamivudin-Dosen (zwei Dosen zu je 2000 mg/kg) keine Mortalität und keine Hinweise auf Zielorgantoxizität beobachtet. Die intravenöse Einmalgabe von 2000 mg/kg Lamivudin wurde sowohl von Mäusen als auch von Ratten gut vertragen, wobei nur unspezifische klinische Zeichen von relativ kurzer Dauer beobachtet wurden und nicht mit einer Zielorgantoxizität in Verbindung gebracht wurden.
Tenofovir-DF: Der No-effect-Level (NOEL) nach Einmalgabe betrug bei Ratten 1500 mg/kg. Bei Hunden bestanden die einzigen beobachteten Auswirkungen nach Einmalgabe (bis zu 270 mg/kg) in einer leichten renaltubulären Karyomegalie und/oder Basophilie. In einer Untersuchung der Auswirkungen auf die Nierenfunktion nach Einmalgabe zeigten sich bei Ratten, die 500 mg/kg Tenofovir-DF erhielten, eine erhöhte Elektrolytausscheidung über den Urin und ein erhöhtes Harnvolumen; bei 50 mg/kg waren keine Auswirkungen zu verzeichnen. Nach Verabreichung von Tenofovir-DF (0, 50 oder 500 mg/kg) an Ratten zur Beurteilung der Auswirkungen auf den gastrointestinalen Transit einer Aktivkohlemahlzeit war bei 500 mg/kg/Tag eine reduzierte Magenentleerung zu beobachten, bei 50 mg/kg/Tag hingegen zeigten sich keine Auswirkungen.
Langzeittoxizität (bzw. Toxizität bei wiederholter Verabreichung)
Doravirin: Doravirin wurde in Studien zur oralen Toxizität bei wiederholter Verabreichung von allen tierischen Spezies bis zu den höchsten geprüften Dosen sehr gut vertragen. Bei Ratten, die über einen Zeitraum von 6 Monaten 450 mg/kg/Tag erhielten, und Hunden, die über einen Zeitraum von 9 Monaten 1000 mg/kg/Tag erhielten (ca. das 7-Fache bzw. 18-Fache der Exposition nach Anwendung der RHD), wurden keine unerwünschten Wirkungen beobachtet oder keine Toxizitäts-Zielorgane identifiziert.
Lamivudin: Lamivudin wurde in Toxizitätsstudien bei wiederholter Verabreichung von oralen Dosen von bis zu 2000 mg/kg zweimal täglich über 6 Monate bei der Ratte sowie von bis zu 1000 mg/kg zweimal täglich über bis zu 12 Monate beim Hund sehr gut vertragen. In einer 3-monatigen Studie in Hunden wurden bei einer Dosierung von 1500 mg/kg zweimal täglich tote weibliche Tiere beobachtet. Die in Studien zur chronischen Toxizität beobachteten behandlungsbedingten Wirkungen beschränkten sich auf geringfügige hämatologische (hauptsächlich Erythrozytenparameter), klinisch-chemische und urinanalytische Veränderungen sowie Schleimhauthyperplasie im Caecum (bei Ratten). Die hämatologischen Veränderungen umfassten erniedrigte Erythrozytenzahlen auf allen Dosisstufen, einhergehend mit erhöhten MCV- und MCH-Werten sowie erniedrigten Gesamt-Leukozyten-, Neutrophilen- und Lymphozytenzahlen bei Tieren, die hohe Dosen erhielten; Effekte auf die Knochenmarkzytologie blieben jedoch aus. Der No-(toxicologically important)-Effect-Level betrug 450 mg/kg zweimal täglich bei Ratten und 45 mg/kg/Tag bei Hunden, das entspricht etwa dem 17- bzw. 9-Fachen der Humanexposition bei Verabreichung der RHD.
Tenofovir-DF: Tenofovir und Tenofovir-DF riefen in toxikologischen Studien an Ratten, Hunden und Affen bei Expositionen (bezogen auf die AUC) vom ≥6-Fachen der Humanexposition Knochentoxizität hervor. Bei Affen zeigte sich die Knochentoxizität in Form einer Osteomalazie. Die bei Affen beobachtete Osteomalazie schien nach Dosisminderung oder Absetzen von Tenofovir reversibel zu sein. Bei Ratten und Hunden manifestierte sich die Knochentoxizität als reduzierte Knochenmineraldichte. Es ist nicht bekannt, welcher Mechanismus bzw. welche Mechanismen dieser Knochentoxizität zugrunde liegen.
Bei den 4 untersuchten Tierarten wurden Hinweise auf renale Toxizität verzeichnet. Bei den Tieren waren unterschiedlich starke Erhöhungen von Serum-Kreatinin, BUN, Glukosurie, Proteinurie, Phosphaturie und/oder Kalzurie sowie Verminderungen der Phosphatspiegel im Serum zu beobachten. Diese toxischen Effekte wurden bei Expositionen (bezogen auf die AUC) vom 2- bis 20-Fachen der Humanexposition verzeichnet. In welcher Beziehung die renalen Anomalien, insbesondere die Phosphaturie, zur Knochentoxizität stehen, ist nicht bekannt.
Mutagenität
Doravirin: Doravirin war in einer Reihe von In-vitro- und In-vivo-Tests, einschliesslich Tests zur mikrobiellen Mutagenese und zu Chromosomenaberrationen in CHO-Zellen, sowie in In-vivo-Mikronukleustests an Ratten nicht genotoxisch.
Lamivudin: Lamivudin hat sich in einem L5178Y-Maus-Lymphom-Assay als mutagen und in einem zytogenetischen Assay mit Kulturen humaner Lymphozyten als klastogen erwiesen. Lamivudin war nicht mutagen in einem mikrobiellen Mutagenitätstest, in einem In-vitro-Zelltransformationstest, in einem Mikronukleustest an Ratten, in einem zytogenetischen Test am Knochenmark von Ratten und in einem Test auf unplanmässige DNA-Synthese in der Rattenleber.
Tenofovir-DF: Zwei von drei In-vitro-Studien zur Genotoxizität von Tenofovir-DF waren positiv. Tenofovir-DF zeigte positive Ergebnisse im in-vitro-Maus-Lymphom-Test. Der in-vivo-Mikronukleus-Test war jedoch negativ.
Karzinogenität
Doravirin: Langzeitstudien zur oralen Kanzerogenität von Doravirin an Mäusen und Ratten ergaben keine Hinweise auf ein kanzerogenes Potenzial bei Expositionen von bis zum 6-Fachen (Mäuse) bzw. 7-Fachen (Ratten) der Humanexposition nach Anwendung der RHD.
Lamivudin: Langzeitstudien zur Kanzerogenität von Lamivudin an Mäusen und Ratten ergaben keine Hinweise auf ein kanzerogenes Potenzial bei Expositionen von bis zum 12-Fachen (Mäuse) bzw. 57-Fachen (Ratten) der Humanexposition nach Anwendung der RHD.
Tenofovir-DF: Tenofovir-DF zeigte im Rahmen einer Langzeit-Karzinogenitätsstudie an Ratten bei oraler Anwendung kein karzinogenes Potenzial.
Eine Langzeit-Karzinogenitätsstudie an Mäusen ergab bei oraler Anwendung eine geringe Inzidenz von Duodenal-Karzinomen, die wahrscheinlich mit der hohen lokalen Konzentration von Tenofovir-DFim Gastrointestinaltrakt bei Dosierungen von 600 mg/kg/Tag zusammenhängt. Zwar ist der Entstehungsmechanismus der Tumore unklar, doch ist es unwahrscheinlich, dass diese Studienergebnisse für die Anwendung beim Menschen relevant sind.
Reproduktionstoxizität
Doravirin: Bei Verabreichung von Doravirin an Ratten waren bis zur höchsten geprüften Dosis keine Wirkungen auf Fertilität, Paarungsverhalten oder frühembryonale Entwicklung zu beobachten. Die systemische Exposition (AUC) gegenüber Doravirin belief sich auf das etwa 7-Fache der Humanexposition bei Anwendung der RHD.
Lamivudin: Lamivudin beeinträchtigte in Dosen, die zu Expositionen von etwa dem 112-Fachen der Humanexposition bei Anwendung der RHD führten, die Fertilität männlicher und weiblicher Ratten nicht.
Tenofovir-DF: Nach Verabreichung von Tenofovir-DF in einer Dosis, die dem 10-Fachen der RHD -bezogen auf Körperoberflächenvergleiche- entsprach, an männliche Ratten während 28 Tagen vor der Paarung und an weibliche Ratten während 15 Tagen vor der Paarung bis zum 7. Gestationstag waren keine Auswirkungen auf Fertilität, Paarungsverhalten oder frühembryonale Entwicklung zu beobachten. Bei weiblichen Ratten zeigte sich jedoch eine Veränderung des Estrogenzyklus.
Entwicklung
Doravirin: Reproduktionsstudien mit oral verabreichtem Doravirin wurden an Ratten und Kaninchen mit einem Expositionsniveau von etwa dem 9-Fachen (Ratten) bzw. 8-Fachen (Kaninchen) der Humanexposition bei RHD-Anwendung durchgeführt, wobei keine Wirkungen auf die embryofetale (Ratten und Kaninchen) oder prä-/postnatale Entwicklung (Ratten) auftraten. Doravirin wurde oral in einer Dosierung von bis zu 300 mg/kg/Tag an trächtige Kaninchen an den Gestationstagen 7 bis 20 verabreicht, und in einer Dosierung von bis zu 450 mg/kg/Tag an Ratten an den Gestationstagen 6 bis 20, sowie an Ratten zwischen dem 6. Gestationstag und dem 20. Laktationstag/post-partum-Tag. Studien an trächtigen Ratten und Kaninchen haben gezeigt, dass Doravirin über die Placenta in den fetalen Kreislauf gelangt, wobei fetale Plasmakonzentrationen erreicht wurden, die bis zu 40% (Kaninchen) bzw. 52% (Ratten) der am 20. Gestationstag gemessenen maternalen Konzentrationen entsprachen.
Doravirin trat nach vom 6. Gestationstag bis zum 14. Laktationstag erfolgter oraler Verabreichung (450 mg/kg/Tag) in die Milch säugender Ratten über; die Konzentrationen in der Milch lagen beim etwa 1,5-Fachen der maternalen Plasmakonzentrationen, gemessen 2 Stunden nach Gabe am Laktationstag 14.
Lamivudin: Reproduktionsstudien mit oral verabreichtem Lamivudin wurden an Ratten und Kaninchen in Dosen durchgeführt, die zu Plasmaspiegeln von bis zu etwa dem 32-fachen der beim Menschen gemessenen Konzentration bei RHD-Anwendung führten. Es wurden keine Hinweise auf eine durch Lamivudin verursachte Teratogenität festgestellt. Hinweise auf frühembryonale Letalität wurden bei Kaninchen bei Expositionen verzeichnet, die den beim Menschen beobachteten ähnlich waren; bei Ratten war dieser Effekt auch bei Plasmaspiegeln, die dem 32-Fachen der beim Menschen gemessenen Konzentration entsprachen, nicht festzustellen. Studien an trächtigen Ratten haben gezeigt, dass Lamivudin über die Plazenta in den fetalen Kreislauf gelangt.
Tenofovir-DF: Reproduktionsstudien an Ratten und Kaninchen, die Dosen in Höhe des 14- bzw. 19-Fachen der Humandosis – bezogen auf Körperoberflächenvergleiche – erhielten, ergaben keine Hinweise auf eine Schädigung des Fötus.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Nicht über 30°C lagern.
In der Originalflasche fest verschlossen aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen. Das Trockenmittel nicht entfernen.
Für Kinder unerreichbar aufbewahren.
Zulassungsnummer
67066 (Swissmedic).
Zulassungsinhaberin
MSD MERCK SHARP & DOHME AG, Luzern.
Stand der Information
November 2020.
S-CCDS-MK1439A-T-122018+062020/96week-HA-round1+RCN000013688-CH
Composition
Principes actifs
Un comprimé contient 100 mg de doravirine, 300 mg de lamivudine et 245 mg de ténofovir disoproxil (équivalent à 300 mg de fumarate de ténofovir disoproxil) en tant que principes actifs.
Excipients
Un comprimé contient les excipients suivants: silice colloïdal anhydre (E551), croscarmellose sodique (E468), succinate d'acétate d'hypromellose, stéarate de magnésium (E470b), cellulose microcristalline (E460) et stéarylfumarate de sodium. Les comprimés sont enrobés d'une pellicule contenant les excipients suivants: hypromellose (E464), oxyde de fer jaune (E172), lactose monohydraté, dioxyde de titane (E171), triacétine (E1518) et cire de carnauba (E903).
Forme pharmaceutique et quantité de principe actif par unité
Chaque comprimé pelliculé contient 100 mg de doravirine, 300 mg de lamivudine et 245 mg de ténofovir disoproxil (équivalent à 300 mg de fumarate de ténofovir disoproxil).
Indications/Possibilités d’emploi
Delstrigo est indiqué pour le traitement de l'infection par le virus d'immunodéficience humaine de type 1 (VIH-1) chez des adultes naïfs de tout traitement, ou pour le remplacement du traitement antirétroviral actuel chez des patients
- qui n'ont présenté aucun échec thérapeutique virologique par le passé, et
- qui sont virologiquement contrôlés (taux d'ARN du VIH-1 <50 copies/ml) depuis au moins 6 mois par un traitement antirétroviral stable, et
- chez lesquels on n'a détecté à aucun moment des mutations du VIH-1 connues pour être associées à une résistance à la doravirine, à la lamivudine ou au ténofovir.
Posologie/Mode d’emploi
La thérapie doit être instaurée et surveillée par un médecin expérimenté dans le traitement de l'infection par le VIH.
Adultes
La posologie recommandée de Delstrigo chez l'adulte est d'un comprimé de 100 mg à prendre par voie orale une fois par jour avec ou sans nourriture.
Ajustement de la posologie du fait d'effets indésirables/d'interactions
Pour les ajustements posologiques en cas de prise concomitante d'autres médicaments, voir la rubrique «Interactions».
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
Aucune adaptation de la posologie de Delstrigo n'est nécessaire chez les patients présentant une insuffisance hépatique légère (classe Child-Pugh A) ou modérée (classe Child-Pugh B). Delstrigo n'a pas été étudié chez les patients souffrant d'insuffisance hépatique sévère (classe Child-Pugh C) (voir «Mises en garde et précautions» et «Pharmacocinétique»).
Patients présentant des troubles de la fonction rénale
Le comprimé de Delstrigo étant une association fixe dont les dosages de lamivudine et de ténofovir-DF ne peuvent être modifiés, les patients présentant une clairance de la créatinine estimée à moins de 50 ml/min ne doivent pas être traités avec Delstrigo (voir «Mises en garde et précautions» et «Pharmacocinétique»).
Patients âgés
On ne dispose que de données limitées concernant l'utilisation de la doravirine, de la lamivudine et du fumarate de ténofovir disoproxil (ténofovir DF) chez les patients âgés de 65 ans et plus. Il n'existe pas de données indiquant que les patients âgés nécessitent une posologie différente des patients adultes plus jeunes (voir «Pharmacocinétique»). Certaines altérations dues à l'âge, p.ex. la diminution de la fonction rénale, imposent une prudence particulière chez les patients âgés.
Enfants et adolescents
La sécurité et l'efficacité de Delstrigo n'ont pas été examinées chez les patients de moins de 18 ans (voir «Pharmacocinétique»). L'utilisation de Delstrigo n'est pas recommandée chez les patients de moins de 18 ans.
Prise retardée
Si un patient a oublié de prendre une dose de Delstrigo, il devrait la prendre dès que possible sauf si l'heure de la prise suivante est imminente. Le patient ne doit pas prendre 2 doses en même temps mais doit prendre la dose suivante selon son horaire habituel.
Contre-indications
Delstrigo ne doit pas être co-administré avec des médicaments qui sont des inducteurs enzymatiques puissants du cytochrome P450 (CYP)3A, car l'on peut s'attendre alors à des baisses importantes des concentrations plasmatiques de doravirine, et donc à une diminution de l'efficacité de Delstrigo (voir «Interactions»). En font partie entre autres les médicaments suivants:
- carbamazépine, oxcarbazépine, phénobarbital, phénytoïne
- rifampicine, rifapentine
- millepertuis (Hypericum perforatum)
- mitotane
- enzalutamide
- lumacaftor
Hypersensibilité aux principes actifs ou à l'un des excipients de Delstrigo.
Mises en garde et précautions
Transmission du VIH
Bien qu'il ait été démontré qu'une suppression virale efficace par une thérapie antirétrovirale réduise considérablement le risque de transmission du VIH-1 par voie sexuelle, un risque résiduel de transmission ne peut être exclu. Les mesures de précaution adaptées doivent continuer à être prises.
Interactions
La prudence est de mise lors de la prescription de Delstrigo avec des médicaments susceptibles de réduire l'exposition à la doravirine, étant donné le risque de perte d'efficacité et de développement d'une résistance au traitement antirétroviral (voir «Contre-indications» et «Interactions»).
Association avec le triméthoprime ou le co-trimoxazole:
Il a été démontré que l'administration de 160 mg une fois par jour de triméthoprime (un composant du co-trimoxazole) augmente l'exposition à la lamivudine (ASC) de 40%. Dans la mesure où il n'existe aucune insuffisance rénale, un ajustement de la dose de lamivudine n'est pas nécessaire. L'effet de fortes doses de triméthoprime sur la pharmacocinétique de la lamivudine n'a pas été étudié.
Exacerbation aiguë sévère de l'hépatite B chez des patients co-infectés par le VIH-1 et le VHB
Tous les patients porteurs du VIH-1 doivent être dépistés pour le VHB avant de commencer une thérapie antirétrovirale. Delstrigo n'est pas autorisé pour le traitement des infections chroniques par le VHB, et la sécurité et l'efficacité de Delstrigo n'ont pas été établies chez les patients co-infectés par le VIH-1 et le VHB.
Si vous suivez en même temps une thérapie antivirale contre l'hépatite B ou C, veuillez également lire l'information professionnelle de ces médicaments qui font part de cette thérapie. Delstrigo ne doit pas être co-administré avec des médicaments contenant des promédicaments du ténofovir, de la lamivudine ou de l'adéfovir dipivoxil pour le traitement d'une infection par l'hépatite B.
Des exacerbations aiguës sévères de l'hépatite B (p.ex. décompensation hépatique et insuffisance hépatique) ont été rapportées après arrêt de la lamivudine ou du ténofovir-DF, deux des composants de Delstrigo, chez des patients co-infectés par le VIH-1 et le VHB. Les patients co-infectés par le VIH-1 et le VHB devraient être étroitement surveillés, tant sur le plan clinique qu'au niveau des valeurs de laboratoire, pendant au moins plusieurs mois après l'arrêt du traitement par Delstrigo. L'instauration d'un traitement contre l'hépatite B peut être justifiée dans certains cas, notamment chez des patients atteints d'une maladie hépatique avancée ou d'une cirrhose, car l'exacerbation post-traitement de l'hépatite peut entraîner une décompensation et une défaillance hépatiques.
Patients co-infectés par le VIH et le virus de l'hépatite B ou C
Les patients atteints d'hépatite B ou C chronique qui reçoivent une thérapie antirétrovirale présentent un risque accru d'effets indésirables hépatiques graves et potentiellement fatals et doivent être surveillées en conséquence. En cas de signes d'aggravation de l'atteinte hépatique, l'interruption ou l'arrêt définitif de la thérapie doit être envisagé chez ces patients.
Les recommandations thérapeutiques actuelles pour la prise en charge du VIH devraient être suivies pour un traitement optimal de l'infection par le VIH chez les patients co-infectés par le virus de l'hépatite B.
Affections hépatiques
Des patients avec insuffisance hépatique modérée à sévère qui ont reçu du ténofovir-DF ont montré une légère élévation de l'ASC du ténofovir, proportionnelle au degré de l'insuffisance hépatique (insuffisance hépatique modérée +13%, insuffisance hépatique sévère +34%).
Les données concernant la sécurité et l'efficacité chez les patients ayant bénéficié d'une transplantation hépatique sont très limitées.
On dispose de données limitées sur la sécurité et l'efficacité du ténofovir-DF chez les patients infectés par le VHB présentant une maladie hépatique décompensée et un score de Child-Pugh-Turcotte (CPT) >9. Ces patients sont exposés à un risque plus élevé d'effets indésirables hépatiques ou rénaux. Par conséquent, les paramètres rénaux et hépatobiliaires doivent faire l'objet d'une surveillance étroite dans cette population de patients.
Hépatite B chronique
Les patients doivent être informés que le ténofovir-DF ne prévient pas le risque de transmission du virus VHB par contact sexuel ou par contamination sanguine. Les mesures de précaution adaptées doivent continuer à être prises.
Apparition ou aggravation d'une insuffisance rénale
Des cas d'insuffisance rénale, y compris de défaillance rénale aiguë et de syndrome de Fanconi (lésion des tubules rénaux associée à une hypophosphatémie sévère), ont été rapportés en relation avec l'utilisation de ténofovir-DF, l'un des composants de Delstrigo.
Delstrigo doit être évité en cas d'utilisation concomitante ou récente de principes actifs néphrotoxiques (p.ex. anti-inflammatoires non stéroïdiens [AINS] à doses fortes ou multiples) (voir «Interactions»). Des cas d'insuffisance rénale aiguë ont été rapportés après l'instauration d'AINS à doses fortes ou multiples chez des patients infectés par le VIH ayant des facteurs de risque de dysfonctionnement rénal et qui semblaient stables sous ténofovir-DF. Certains patients ont dû être hospitalisés et avoir une hémodialyse. Des alternatives aux AINS devraient être envisagées si nécessaire chez des patients à risque de dysfonctionnement rénal.
Il est recommandé d'évaluer la clairance estimée de la créatinine et de mesurer la glycosurie et la protéinurie chez tous les patients avant l'instauration du traitement par Delstrigo, et même pendant le traitement si la situation clinique le justifie.
Il est recommandé de calculer la clairance de la créatinine chez tous les patients avant l'initiation du traitement par Delstrigo et également de surveiller la fonction rénale (clairance de la créatinine et phosphatémie) après 2 à 4 semaines de traitement, après 3 mois de traitement et tous les 3 à 6 mois par la suite chez les patients ne présentant pas de facteurs de risque rénaux.
Chez les patients présentant un risque d'insuffisance rénale, y compris les patients qui ont présenté des effets indésirables rénaux lors de l'administration d'adéfovir dipivoxil, une surveillance plus fréquente de la fonction rénale est nécessaire.
La lamivudine et le ténofovir-DF, deux composants de Delstrigo, sont principalement excrétés par les reins. Delstrigo devrait être arrêté si la clairance estimée de la créatinine baisse en-dessous de 50 ml par minute car l'ajustement de l'intervalle de dosage nécessaire pour la lamivudine et le ténofovir-DF ne peut se faire avec l'association fixe en comprimé.
Des douleurs osseuses persistantes ou s'aggravant, des douleurs dans les extrémités, des fractures et/ou des douleurs ou une faiblesse musculaires pourraient être des manifestations d'une tubulopathie rénale proximale et devraient inciter à une évaluation de la fonction rénale chez les patients à risque.
Perte osseuse et défauts de minéralisation
Densité minérale osseuse: Dans des études cliniques chez des adultes infectés par le VIH-1, le ténofovir-DF (un composant de Delstrigo) a été lié à une baisse légèrement plus marquée de la densité minérale osseuse (DMO) et à une augmentation des biomarqueurs osseux, suggérant un renouvellement osseux plus élevé par rapport aux comparateurs. Les taux sériques de parathormone et de 1,25-vitamine D ont également été plus élevés chez les patients recevant le ténofovir-DF. Consulter l'information professionnelle sur le ténofovir-DF pour de plus amples informations.
On ne connaît pas les effets des variations de la DMO et des marqueurs biochimiques associées au ténofovir-DF sur la santé osseuse à long terme et le risque ultérieur de fracture. Une évaluation de la DMO devrait être envisagée chez les patients adultes infectés par le VIH-1 qui ont des antécédents de fracture osseuse pathologique ou d'autres facteurs de risque d'ostéoporose ou de perte osseuse. Une supplémentation en calcium et en vitamine D pourrait être bénéfique à tous les patients, bien que son effet n'ait pas été étudié. L'avis d'un spécialiste devrait être sollicité en cas de suspicion d'anomalies osseuses.
Défauts de minéralisation: Des cas d'ostéomalacie associée à une tubulopathie rénale proximale, se manifestant par des douleurs osseuses ou des douleurs dans les extrémités et pouvant favoriser la survenue de fractures, ont été rapportés en relation avec l'utilisation du ténofovir-DF. Des arthralgies et des douleurs ou une faiblesse musculaires ont également été rapportées dans des cas de tubulopathie rénale proximale. Une hypophosphatémie et une ostéomalacie secondaires à une tubulopathie rénale proximale devraient être évoquées chez des patients à risque de dysfonctionnement rénal présentant des symptômes osseux ou musculaires qui persistent ou s'aggravent au cours d'un traitement par des médicaments contenant du ténofovir-DF.
Co-administration avec d'autres médicaments
Delstrigo est une association fixe de doravirine, de lamivudine et de ténofovir-DF. Delstrigo ne doit pas être co-administré avec d'autres médicaments contenant de la lamivudine, ni avec des médicaments contenant du ténofovir-DF ou du ténofovir alafénamide, ni avec de l'adéfovir dipivoxil. Delstrigo ne doit pas être administré avec la doravirine sauf si c'est nécessaire pour un ajustement de la posologie (p.ex. avec la rifabutine) (voir «Posologie/Mode d'emploi» et «Interactions»).
Syndrome de restauration immunitaire
Des cas de syndrome de restauration immunitaire ont été rapportés chez des patients traités par une association d'antirétroviraux. Pendant la phase initiale d'un traitement antirétroviral combiné, les patients dont le système immunitaire répond au traitement peuvent développer une réaction inflammatoire à des infections opportunistes asymptomatiques ou résiduelles (p.ex. infection à Mycobacterium avium, infection à cytomégalovirus, pneumonie à Pneumocystis jirovecii (PjP) ou tuberculose) qui peut nécessiter une évaluation complémentaire et un traitement.
Des cas de maladies auto-immunes (p.ex. maladie de Basedow, polymyosite, syndrome de Guillain-Barré et hépatite auto-immune) ont également été rapportés dans le cadre de la restauration immunitaire; le délai d'apparition est toutefois plus variable et peut atteindre plusieurs mois après le début du traitement.
Lactose
Delstrigo contient du lactose monohydraté.
Les patients présentant la forme héréditaire rare d'intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose devraient donc s'abstenir de prendre ce médicament.
Exposition in utero: dysfonctionnement mitochondrial
Les analogues nucléos(t)idiques peuvent avoir un effet variable sur la fonction mitochondriale, l'effet le plus marqué étant observé avec la stavudine, la didanosine et la zidovudine. Des cas de dysfonctionnement mitochondrial ont été rapportés chez des nourrissons non infectés par le VIH, exposés in utero et/ou en période post-natale à des analogues nucléosidiques. Il s'agissait principalement de traitements comportant de la zidovudine. Les effets indésirables principalement rapportés étaient des troubles hématologiques (anémie, neutropénie) et des troubles métaboliques (hyperlactatémie, hyperlipasémie). Ces événements étaient transitoires pour la plupart. Des troubles neurologiques d'apparition tardive ont été rapportés dans de rares cas (hypertonie, convulsions, troubles du comportement). Le caractère transitoire ou permanent de ces troubles neurologiques n'est pas établi à ce jour. Ces données doivent être prises en compte chez tout enfant exposé in utero à des analogues nucléos(t)idiques qui présente des manifestations cliniques sévères d'étiologie inconnue, en particulier des manifestations neurologiques. Chaque enfant exposé in utero à des analogues nucléosidiques/-tidiques, y compris les enfants non infecté par le VIH, être examiné sur le plan clinique et des paramètres de laboratoire et doit, en cas de signes ou symptômes significatifs, faire l'objet d'investigations complètes à la recherche de possibles troubles de la fonction mitochondrial. Ces données ne modifient en rien les recommandations nationales actuelles quant à l'utilisation d'un traitement antirétroviral chez la femme enceinte dans la prévention d'une transmission materno-fœtale du VIH.
Infections opportunistes
L'apparition d'infections opportunistes ou d'autres complications d'une infection par le VIH reste possible chez les patients sous Delstrigo ou toute autre thérapie antirétrovirale. Une surveillance clinique étroite continue par un médecin expérimenté dans le traitement des maladies associées à l'infection par le VIH reste par conséquent indispensable.
Ostéonécrose
Bien que l'on suppose une étiologie multifactorielle (incluant l'utilisation de corticoïdes, la consommation d'alcool, une immunosuppression sévère, un indice de masse corporelle élevé), des cas d'ostéonécrose ont été rapportés en particulier chez des patients à un stade avancé de la maladie par le VIH et/ou recevant un ART au long cours. Il est conseillé aux patients de consulter leur médecin s'ils éprouvent des problèmes articulaires, des arthralgies, une raideur articulaire ou des difficultés à se mouvoir.
Pancréatite
Des cas de pancréatite sont survenus rarement chez l'adulte, plus fréquemment chez l'enfant. On ignore cependant s'ils sont à rapporter au traitement ou à la maladie à VIH elle-même. Le traitement par Delstrigo devrait être interrompu immédiatement, si des signes cliniques, des symptômes ou des anomalies des paramètres de laboratoire apparaissent qui indiquent une pancréatite. Il faut toujours penser à l'éventualité d'une pancréatite lorsque le patient se plaint de douleurs abdominales, de nausées, de vomissements ou présente une élévation des marqueurs biochimiques.
Faiblesse motrice généralisée
Une faiblesse motrice généralisée a été observée très rarement chez les patients qui recevaient un ART avec des analogues nucléosidiques. Cette affection a été observée le plus souvent, mais pas toujours, dans le cadre d'une acidose lactique. Cette faiblesse motrice peut cliniquement ressembler à un syndrome de Guillain-Barré, y compris la paralysie respiratoire. Les symptômes peuvent le cas échéant persister après la fin du traitement, voire s'aggraver encore davantage.
Interactions
Delstrigo est un traitement complet de l'infection par le VIH-1; en conséquence Delstrigo ne doit pas être administré avec d'autres médicaments antirétroviraux destinés au traitement de l'infection par le VIH-1. On ne fournit pas d'informations concernant les interactions possibles de Delstrigo avec d'autres médicaments antirétroviraux.
Delstrigo contient de la doravirine, de la lamivudine et du ténofovir disoproxil (sous forme de fumarate), de sorte que toutes les interactions identifiées pour chacun de ces agents peuvent se produire avec Delstrigo. Aucune interaction cliniquement pertinente n'est attendue entre la doravirine, la lamivudine et le ténofovir disoproxil (sous forme de fumarate).
Effet d'autres médicaments sur la pharmacocinétique de Delstrigo
Médicaments affectant la fonction rénale:
La lamivudine et le ténofovir étant principalement éliminés par les reins à la fois par filtration glomérulaire et par sécrétion tubulaire active, la co-administration de Delstrigo avec des médicaments qui diminuent la fonction rénale ou sont en compétition pour la sécrétion tubulaire active peut augmenter les concentrations sériques de lamivudine, de ténofovir et/ou d'autres médicaments éliminés par voie rénale. Exemples de médicaments excrétés par sélection tubulaire active: aciclovir, cidofovir, ganciclovir, valaciclovir, valganciclovir, aminosides (p.ex. gentamicine) et AINS à doses fortes ou multiples.
Doravirine:
La doravirine est principalement métabolisée par le CYP3A et les médicaments inducteurs ou inhibiteurs du CYP3A peuvent affecter la clairance de la doravirine.
Inducteurs du CYP3A
La co-administration de Delstrigo avec des médicaments inducteurs du CYP3A peut diminuer les concentrations plasmatiques de doravirine et réduire de ce fait son efficacité thérapeutique (voir «Contre-indications» et «Mises en garde et précautions»).
La co-administration avec des médicaments qui sont des inducteurs puissants du CYP3A est contre-indiquée. Il est recommandé d'observer un délai minimum de 4 semaines avant d'administrer Delstrigo suite à un traitement par des inducteurs puissants du CYP3A.
La co-administration de Delstrigo avec des médicaments qui sont des inducteurs modérés du CYP3A (p.ex. dabrafénib, lésinurad, bosentan, modafinil, éthyle de telotristat) devrait être évitée. Si la co-administration ne peut pas être évitée, une dose supplémentaire de 100 mg de doravirine devrait être administrée env. 12 heures après la prise de Delstrigo.
Inhibiteurs du CYP3A
La co-administration de Delstrigo avec des médicaments inhibiteurs du CYP3A peut augmenter les concentrations plasmatiques de doravirine. Aucune adaptation de la dose n'est cependant recommandée en cas de co-administration avec des inhibiteurs du CYP3A.
Lamivudine:
In vitro, la lamivudine s'avère être un substrat de MATE1, de MATE2-K et d'OCT2. Il est démontré que le triméthoprime (un inhibiteur de ces molécules de transport) augmente les concentrations plasmatiques de la lamivudine; cette interaction n'est cependant pas considérée comme cliniquement significative, car aucun ajustement posologique de la lamivudine n'est nécessaire.
La co-administration d'une solution à base de sorbitol et de lamivudine a entrainé une baisse dose-dépendante de l'exposition à la lamivudine. La co-administration de médicaments contenant du sorbitol et de lamivudine doit être évitée dans la mesure du possible.
Ténofovir disoproxil:
Le ténofovir étant principalement éliminé par les reins à la fois par filtration glomérulaire et par sécrétion tubulaire active (voir «Pharmacocinétique»), la co-administration de Delstrigo avec des médicaments qui diminuent la fonction rénale ou sont en compétition pour la sécrétion tubulaire active via OAT1, OAT3 ou MRP4 peut augmenter les concentrations sériques de ténofovir.
Effet de Delstrigo sur la pharmacocinétique d'autres médicaments
Doravirine
Il est improbable que la doravirine dosée à 100 mg une fois par jour ait un effet cliniquement pertinent sur les concentrations plasmatiques de médicaments métabolisés par les enzymes du CYP.
Substrats du CYP3A
La co-administration de doravirine et de midazolam (un substrat sensible du CYP3A) a diminué de 18% l'exposition au midazolam, ce qui suggère que la doravirine pourrait être un faible inducteur du CYP3A. La prudence est donc de mise lors de la co-administration de doravirine avec des médicaments qui sont des substrats sensibles du CYP3A et qui possèdent une marge thérapeutique étroite (p.ex. le tacrolimus et le sirolimus).
Lamivudine
La lamivudine n'est ni inhibitrice ni inductrice des enzymes du CYP.
Ténofovir
Sur la base des résultats des études in vitro et de la voie d'élimination connue du ténofovir, le potentiel d'interactions médiées par le CYP impliquant le ténofovir et d'autres médicaments est faible. Même à des concentrations nettement (env. 300 fois) plus élevées que celles atteintes in vivo, le ténofovir n'a pas inhibé in vitro la métabolisation de médicaments médiée par des principales isoenzymes du CYP450 humain impliquées dans leur biotransformation (CYP3A4, CYP2D6, CYP2C9, CYP2E1 ou CYP1A1/2). Le ténofovir disoproxil à la concentration de 100 µmol/l n'a pas eu d'effet sur les isoenzymes du CYP450, à l'exception du CYP1A1/2, pour lequel une réduction faible (6%), mais statistiquement significative, du métabolisme de son substrat a été observée. Sur la base de ces données, l'apparition d'interactions cliniquement significatives entre le ténofovir-DF et des médicaments métabolisés par le CYP450 est improbable.
Tableau des interactions
Le tableau 1, présente les interactions établies et les autres interactions médicamenteuses potentiellement importantes avec les constituants de Delstrigo, mais il n'est pas exhaustif. Pour les autres interactions possibles entre la lamivudine ou le ténofovir-DF et d'autres médicaments, voir «Mises en garde et précautions».
Le tableau indique les rapports entre les moyennes géométriques des paramètres pharmacocinétiques lors de la prise du médicament avec/sans comédication avec les intervalles de confiance (IC) à 90%. La direction de la flèche indique la variation de l'exposition (Cmax, ASC ou C24) à chacun des principes actifs (↑ = hausse d'un facteur de plus de 1,25 fois, ↓ = baisse d'un facteur de moins de 0,8 fois, ↔ = pas de changement).
Tableau 1: Interactions et doses recommandées en co-administration avec d'autres médicaments
Médicaments par classe thérapeutique | Effets sur les concentrations de médicament | Recommandations relatives à la co-administration avec Delstrigo |
|---|---|---|
Médicaments réduisant l'acidité gastrique | ||
antiacide (hydroxydes d'aluminium et de magnésium en suspension buvable) (20 ml DU, doravirine 100 mg DU) | ↔ doravirine ASC 1,01 (0,92; 1,11) Cmax 0,86 (0,74; 1,01) C24 1,03 (0,94; 1,12) | Pas d'ajustement posologique requis. |
pantoprazole (40 mg 1x/j, doravirine 100 mg DU) | ↓ doravirine ASC 0,83 (0,76; 0,91) Cmax 0,88 (0,76; 1,01) C24 0,84 (0,77; 0,92) | Pas d'ajustement posologique requis. |
Anti-androgènes | ||
enzalutamide | Interaction non étudiée avec la doravirine ou avec l'association doravirine/lamivudine/ténofovir disoproxil. Attendu: ↓ doravirine (induction du CYP3A) | La co-administration est contre-indiquée. Il est recommandé d'administrer Delstrigo au plus tôt 4 semaines après la fin d'un traitement par enzalutamide. |
Anticonvulsivants | ||
carbamazépine oxcarbazépine phénobarbital phénytoïne | Interaction non étudiée avec la doravirine ou avec l'association doravirine/lamivudine/ténofovir disoproxil. Attendu: ↓ doravirine (induction du CYP3A) | La co-administration est contre-indiquée. Il est recommandé d'administrer Delstrigo au plus tôt 4 semaines après la fin d'un traitement par ces principes actifs. |
Antidiabétiques | ||
metformine (1000 mg DU, doravirine 100 mg 1x/j) | ↔ metformine ASC 0,94 (0,88; 1,00) Cmax 0,94 (0,86; 1,03) | Pas d'ajustement posologique requis. |
Antidiarrhéiques | ||
éthyle de télotristat | Interaction non étudiée avec la doravirine ou avec l'association doravirine/lamivudine/ténofovir disoproxil. Attendu: ↓ doravirine (induction du CYP3A) | Une co-administration devrait être évitée. Si une co-administration ne peut pas être évitée, une dose de 100 mg de doravirine par jour devrait être prise env. 12 heures après la dose de Delstrigo. |
Agents antigoutteux et uricosuriques | ||
lésinurad | Interaction non étudiée avec la doravirine ou avec l'association doravirine/lamivudine/ténofovir disoproxil. Attendu: ↓ doravirine (induction du CYP3A) | Une co-administration devrait être évitée. Si une co-administration ne peut pas être évitée, une dose de 100 mg de doravirine par jour devrait être prise env. 12 heures après la dose de Delstrigo. |
Antimycobactériens | ||
dose unique de rifampicine (600 mg DU, doravirine 100 mg DU) doses multiples de rifampicine (600 mg 1x/j, doravirine 100 mg DU) | ↔ doravirine ASC 0,91 (0,78; 1,06) Cmax 1,40 (1,21; 1,63) C24 0,90 (0,80; 1,01) ↓ doravirine ASC 0,12 (0,10; 0,15) Cmax 0,43 (0,35; 0,52) C24 0,03 (0,02; 0,04) (induction du CYP3A) | La co-administration est contre-indiquée. Il est recommandé d'administrer Delstrigo au plus tôt 4 semaines après la fin d'un traitement par rifampicine. |
rifapentine | Interaction non étudiée avec la doravirine ou avec l'association doravirine/lamivudine/ténofovir disoproxil. Attendu: ↓ doravirine (induction du CYP3A) | La co-administration est contre-indiquée. Il est recommandé d'administrer Delstrigo au plus tôt 4 semaines après la fin d'un traitement par rifapentine. |
rifabutine (300 mg 1x/j, doravirine 100 mg DU) | ↓ doravirine ASC 0,50 (0,45; 0,55) Cmax 0,99 (0,85; 1,15) C24 0,32 (0,28; 0,35) (induction du CYP3A) | Si Delstrigo est co-administré avec la rifabutine, un comprimé de 100 mg de doravirine devrait être pris une fois par jour env. 12 heures après l'administration de Delstrigo. |
Antinéoplasiques | ||
mitotane | Interaction non étudiée avec la doravirine ou avec l'association doravirine/lamivudine/ténofovir disoproxil. Attendu: ↓ doravirine (induction du CYP3A) | La co-administration est contre-indiquée. Il est recommandé d'administrer Delstrigo au plus tôt 4 semaines après la fin d'un traitement par mitotane. |
Antifongiques azolés | ||
kétoconazole (400 mg 1x/j, doravirine 100 mg DU) | ↑ doravirine ASC 3,06 (2,85; 3,29) Cmax 1,25 (1,05; 1,49) C24 2,75 (2,54; 2,98) (inhibition du CYP3A) | Pas d'ajustement posologique. |
fluconazole itraconazole posaconazole voriconazole | Interaction non étudiée avec l'association doravirine/lamivudine/ténofovir disoproxil. Attendu: ↑ doravirine (inhibition du CYP3A) | Pas d'ajustement posologique. |
Inhibiteurs des canaux calciques | ||
diltiazem vérapamil | Interaction non étudiée avec la doravirine ou avec l'association doravirine/lamivudine/ténofovir disoproxil. Attendu: ↑ doravirine (inhibition du CYP3A) | Pas d'ajustement posologique. |
Traitement de la mucoviscidose | ||
lumacaftor | Interaction non étudiée avec la doravirine ou avec l'association doravirine/lamivudine/ténofovir disoproxil. Attendu: ↓ doravirine (induction du CYP3A) | La co-administration est contre-indiquée. Il est recommandé d'administrer Delstrigo au plus tôt 4 semaines après la fin d'un traitement par lumacaftor. |
Antagonistes des récepteurs de l'endothéline | ||
bosentan | Interaction non étudiée avec la doravirine ou avec l'association doravirine/lamivudine/ténofovir disoproxil. Attendu: ↓ doravirine (induction du CYP3A) | Une co-administration devrait être évitée. Si une co-administration ne peut pas être évitée, une dose de 100 mg de doravirine par jour devrait être prise env. 12 heures après la dose de Delstrigo. |
Médicaments antiviraux contre l'hépatite C | ||
elbasvir + grazoprévir (50 mg elbasvir 1x/jour + 200 mg grazoprévir 1x/jour, doravirine 100 mg 1x/jour) | ↑ doravirine ASC 1,56 (1,45; 1,68) Cmax 1,41 (1,25; 1,58) C24 1,61 (1,45; 1,79) (inhibition du CYP3A) ↔ elbasvir ASC 0,96 (0,90; 1,02) Cmax 0,96 (0,91; 1,01) C24 0,96 (0,89; 1,04) ↔ grazoprévir ASC 1,07 (0,94; 1,23) Cmax 1,22 (1,01; 1,47) C24 0,90 (0,83; 0,96) | Pas d'ajustement posologique requis. |
lédipasvir + sofosbuvir (90 mg lédipasvir DU + 400 mg sofosbuvir DU, doravirine 100 mg DU) | ↑ doravirine ASC 1,15 (1,07; 1,24) Cmax 1,11 (0,97; 1,27) C24 1,24 (1,13; 1,36) ↔ lédipasvir ASC 0,92 (0,80; 1,06) Cmax 0,91 (0,80; 1,02) ↔ sofosbuvir ASC 1,04 (0,91; 1,18) Cmax 0,89 (0,79; 1,00) ↔ GS-331007 ASC 1,03 (0,98; 1,09) Cmax 1,03 (0,97; 1,09) Interaction non étudiée avec la doravirine ou avec l'association doravirine/lamivudine/ténofovir disoproxil. Attendu: ↑ ténofovir | Les patients recevant simultanément Delstrigo et le lédipasvir/sofosbuvir devraient être surveillés pour les effets indésirables associés au ténofovir DF. |
sofosbuvir/velpatasvir | Interaction non étudiée avec la doravirine ou avec l'association doravirine/lamivudine/ténofovir disoproxil. Prédiction: ↔ doravirine ↑ ténofovir | Les patients recevant simultanément Delstrigo et le sofosbuvir/velpatasvir devraient être surveillés pour les effets indésirables associés au ténofovir DF. |
Préparations à base de plantes | ||
millepertuis (Hypericum perforatum) | Interaction non étudiée avec la doravirine ou avec l'association doravirine/lamivudine/ténofovir disoproxil. Attendu: ↓ doravirine (induction du CYP3A) | La co-administration est contre-indiquée. Il est recommandé d'administrer Delstrigo au plus tôt 4 semaines après la fin d'un traitement par millepertuis. |
Médicaments antiviraux contre le VIH | ||
ténofovir-DF (300 mg 1x/j, doravirine 100 mg DU) | ↔ doravirine ASC 0,95 (0,80; 1,12) Cmax 0,80 (0,64; 1,01) C24 0,94 (0,78; 1,12) | Il n'existe pas d'interactions cliniquement pertinentes entre les constituants de Delstrigo. |
lamivudine + ténofovir disoproxil (300 mg lamivudine DU + 245 mg ténofovir disoproxil DU, doravirine 100 mg DU) | ↔ doravirine ASC 0,96 (0,87; 1,06) Cmax 0,97 (0,88; 1,07) C24 0,94 (0,83; 1,06) ↔ lamivudine ASC 0,94 (0,88; 1,00) Cmax 0,92 (0,81; 1,05) ↔ ténofovir ASC 1,11 (0,97; 1,28) Cmax 1,17 (0,96; 1,42) | Il n'existe pas d'interactions cliniquement pertinentes entre les constituants de Delstrigo. |
Immunosuppresseurs | ||
tacrolimus, sirolimus | Interaction non étudiée avec la doravirine ou avec l'association doravirine/lamivudine/ténofovir disoproxil. Attendu: ↔ doravirine ↓ tacrolimus, sirolimus (induction du CYP3A) | Les concentrations sanguines de tacrolimus et de sirolimus devraient être surveillées, car, pour ces médicaments, un ajustement de la dose peut être nécessaire. |
Inhibiteurs de kinase | ||
dabrafénib | Interaction non étudiée avec la doravirine ou avec l'association doravirine/lamivudine/ténofovir disoproxil. Attendu: ↓ doravirine (induction du CYP3A) | Une co-administration devrait être évitée. Si une co-administration ne peut pas être évitée, une dose de 100 mg de doravirine par jour doit être prise env. 12 heures après la dose de Delstrigo. |
Analgésiques opioïdes | ||
méthadone (posologie individuelle 20–200 mg 1x/j, doravirine 100 mg 1x/j) | ↓ doravirine ASC 0,74 (0,61; 0,90) Cmax 0,76 (0,63; 0,91) C24 0,80 (0,63; 1,03) ↔ R-méthadone ASC 0,95 (0,90; 1,01) Cmax 0,98 (0,93; 1,03) C24 0,95 (0,88; 1,03) ↔ S-méthadone ASC 0,98 (0,90; 1,06) Cmax 0,97 (0,91; 1,04) C24 0,97 (0,86; 1,10) | Pas d'ajustement posologique requis. |
Contraceptifs oraux | ||
éthinylestradiol + lévonorgestrel (0,03 mg éthinylestradiol + 0,15 mg lévonorgestrel DU, doravirine 100 mg 1x/j) | ↔ éthinylestradiol ASC 0,98 (0,94; 1,03) Cmax 0,83 (0,80; 0,87) ↑ lévonorgestrel ASC 1,21 (1,14; 1,28) Cmax 0,96 (0,88; 1,05) | Pas d'ajustement posologique requis. |
Psychostimulants | ||
modafinil | Interaction non étudiée avec la doravirine ou avec l'association doravirine/lamivudine/ténofovir disoproxil. Attendu: ↓ doravirine (induction du CYP3A) | Une co-administration devrait être évitée. Si une co-administration ne peut pas être évitée, une dose de 100 mg de doravirine par jour devrait être prise env. 12 heures après la dose de Delstrigo. |
Sédatifs/Hypnotiques | ||
midazolam (2 mg DU, doravirine 120 mg 1x/j) | ↓ midazolam ASC 0,82 (0,70; 0,97) Cmax 1,02 (0,81; 1,28) | Pas d'ajustement posologique requis. |
Statines | ||
atorvastatine (20 mg DU, doravirine 100 mg 1x/j) | ↔ atorvastatine ASC 0,98 (0,90; 1,06) Cmax 0,67 (0,52; 0,85) | Pas d'ajustement posologique requis. |
Autres | ||
solution de sorbitol (3,2 g; 10,2 g; 13,4 g)/lamivudine | dose unique de lamivudine, solution buvable de 300 mg lamivudine ASC ↓ 0,86 (0,80; 0,91); 0,68 (0,64; 0,72); 0,64 (0,59; 0,68) Cmax ↓ 0,72 (0,66; 0,80); 0,48 (0,43; 0,53); 0,45 (0,41; 0,50) | Dans la mesure du possible, évitez la co-administration de Delstrigo avec des médicaments contenant du sorbitol ou d'autres polyalcools à effet osmotique (p.ex. xylitol, mannitol, lactitol, maltitol). Envisagez une surveillance plus fréquente de la charge virale du VIH-1 si une co-administration chronique ne peut être évitée. |
IC = intervalle de confiance; DU = dose unique; 1x/j = une fois par jour; 2x/j = deux fois par jour * ASC0-∞ pour la dose unique, ASC0-24 pour l'administration 1x/jour. † L'interaction a été évaluée avec le ritonavir uniquement. | ||
Médicaments pour lesquels aucune interaction avec Delstrigo n'a été observée ou n'est prédite
Des études cliniques ont examiné les interactions entre Delstrigo et les médicaments suivants, et aucun de ces médicaments ne requiert une adaptation de la dose: antiacides à base d'hydroxyde d'aluminium/hydroxyde de magnésium/siméticone, pantoprazole, atorvastatine, un contraceptif oral contenant de l'éthinylestradiol et du lévonorgestrel, metformine, méthadone, midazolam, sofosbuvir/lédipasvir, elbasvir/grazoprévir, dolutégravir, lamivudine ou ténofovir-DF.
Aucune interaction cliniquement pertinente n'est attendue lors de l'utilisation simultanée de Delstrigo et des principes actifs suivants: abacavir, emtricitabine, enfuvirtide, raltégravir, maraviroc, ténofovir alafénamide, buprénorphine, naloxone, daclatasvir, siméprévir, diltiazem, vérapamil, rosuvastatine, simvastatine, canagliflozine, liraglutide, sitagliptine, lisinopril ou oméprazole.
Sur la base des résultats des études in vitro et des voies d'élimination connues du ténofovir, le potentiel d'interactions médiées par le CYP entre le ténofovir-DF et d'autres médicaments est faible.
Aucune interaction d'importance clinique n'a été observée dans des études chez des volontaires sains entre le ténofovir-DF et les médicaments suivants: entécavir, méthadone, contraceptifs oraux, sofosbuvir et tacrolimus.
D'une part, la lamivudine n'est pas métabolisée dans une mesure significative par les enzymes du CYP, d'autre part, elle n'inhibe ni ne stimule ce système enzymatique; la survenue d'interactions médicamenteuses cliniquement pertinentes par ces voies métaboliques est donc improbable.
Grossesse/Allaitement
Grossesse
Registre des grossesses sous traitement antirétroviral (Antiretroviral Pregnancy Registry)
Un registre international des grossesses sous traitement antirétroviral (Antiretroviral Pregnancy Registry, APR) a été mis en place pour surveiller l'évolution de l'état de la mère et du fœtus chez les patientes enceintes sous Delstrigo. Les médecins sont encouragés à inscrire les patientes dans ce registre.
Résumé des risques
Doravirine: On ne dispose pas de données suffisantes chez l'être humain pour déterminer si la doravirine pose ou non un risque pour l'issue d'une grossesse. Il n'existe pas ou peu de données sur l'utilisation de la doravirine chez les femmes enceintes. L'effet de la doravirine sur la grossesse chez l'être humain n'est pas connu.
Les expérimentations animales avec la doravirine ne révèlent aucune toxicité directe ou indirecte ayant une incidence sur la reproduction (voir «Données précliniques»).
Par mesure de précaution, il est conseillé d'éviter la prise de doravirine pendant la grossesse.
Des études de reproduction réalisées chez des rats et des lapins avec exposition à des doses de doravirine environ 9 fois (rats) et 8 fois (lapins) supérieures à la dose humaine recommandée (DHR) n'ont pas révélé d'effets délétères sur la gestation et le développement embryo-fœtal (voir «Données précliniques»).
Lamivudine: La lamivudine a été étudiée chez plus de 11'000 femmes pendant la grossesse et après la naissance dans l'APR. Les données humaines disponibles dans l'APR ne montrent pas d'augmentation du risque d'anomalies congénitales graves sous lamivudine par rapport à l'incidence de base. Il n'existe toutefois pas d'étude adéquate et bien contrôlée chez les femmes enceintes.
La lamivudine franchit la barrière placentaire. Les taux sériques de lamivudine, établis chez le nouveau-né venant de naître, correspondaient aux concentrations sériques constatées chez la mère et à celles du cordon ombilical à la naissance.
La lamivudine ne doit pas être administrée pendant la grossesse, sauf en cas de nécessité absolue.
Chez les nouveau-nés et les enfants qui ont été – in utero ou pendant la naissance – exposés à des INTI (inhibiteurs nucléosidiques de la transcriptase inverse), des concentrations de lactate plasmatique légèrement ou passagèrement élevées ont été relevées. Elles pourraient être dues à un dysfonctionnement mitochondrial. La signification clinique de l'hyperlactatémie transitoire n'est pas connue. En outre, il existe des cas très rares de retards de développement, de convulsions et autres troubles neurologiques. Le lien de cause à effet entre l'apparition de ces troubles et l'administration des INTI n'est cependant pas démontré. Ces constatations n'ont cependant aucune incidence sur les recommandations actuelles quant à l'utilisation d'un traitement antirétroviral chez la femme enceinte dans la prévention de la transmission materno-foetale du VIH.
Les études de reproduction chez l'animal n'ont pas apporté d'indice en faveur d'un éventuel effet tératogène ou d'une modification de la fertilité masculine ou féminine. Chez le lapin, il existe des indices de létalité embryonnaire précoce, cependant ce n'est pas le cas chez le rat (voir «Données précliniques»).
Ténofovir-DF: Le nombre modéré de données dont on dispose chez la femme enceinte (entre 300 et 1000 grossesses) n'a mis en évidence aucune malformation ni effet toxique pour le fœtus ou le nouveau-né en relation avec le ténofovir-DF. Les expérimentations animales n'ont pas mis en évidence de toxicité de reproduction (voir «Données précliniques»).
Allaitement
Résumé des risques
Des études chez l'être humain ont montré que la lamivudine et le ténofovir passent tous deux dans le lait maternel. Différentes études chez des mères allaitantes traitées par la lamivudine et leurs enfants ont montré que la lamivudine est détectable dans le lait maternel humain à des concentrations similaires ou même supérieures à celles observées dans le sérum. La lamivudine a même été mesurée à de faibles concentrations dans le sérum des enfants allaités.
Les mères doivent donc être informées qu'elles ne doivent pas allaiter pendant le traitement par la lamivudine.
Il a été montré que le ténofovir est excrété dans le lait maternel. Il n'existe pas de données suffisantes sur les effets du ténofovir chez les nouveau-nés/enfants. Par conséquent, ténofovir ne devrait pas être utilisé pendant l'allaitement.
On ignore si la doravirine passe dans le lait maternel chez la femme. Compte tenu du risque de transmission du VIH-1 et du risque d'effets indésirables graves chez les nourrissons allaités, les mères devraient être instruites de ne pas allaiter si elles reçoivent Delstrigo.
Données d'expérimentations animales
Les données pharmacodynamiques et toxicologiques dont on dispose chez l'animal ont mis en évidence une excrétion de doravirine dans le lait (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machines
Les patients devraient être informés que des cas de fatigue, de sensation de vertige et de somnolence ont été rapportés au cours du traitement par Delstrigo (voir «Effets indésirables»). Cela doit être pris en compte dans l'évaluation de l'aptitude d'un patient à conduire des véhicules et à utiliser des machines.
Effets indésirables
Effets indésirables médicamenteux liés au traitement
Expérience tirée d'études cliniques chez des adultes naïfs de traitement
L'évaluation de la sécurité de Delstrigo chez des patients infectés par le VIH-1 et naïfs de traitement antirétroviral est basée sur les analyses des données à 96 semaines de deux études internationales de phase III randomisées, multicentriques, en double aveugle et contrôlées par médicament actif (DRIVE-FORWARD [protocole 018] et DRIVE-AHEAD [protocole 021]).
Dans l'étude DRIVE-FORWARD, 766 patients adultes ont reçu soit la doravirine 100 mg (n = 383), soit darunavir 800 mg + ritonavir 100 mg (DRV+r) (n = 383) une fois par jour, chaque groupe recevant aussi l'association emtricitabine/ténofovir-DF (FTC/TDF) ou l'association abacavir/lamivudine (ABC/3TC). Jusqu'à la semaine 96, 2% des patients du groupe doravirine et 4% des patients du groupe DRV+r ont subi des événements indésirables qui ont conduit à l'arrêt du médicament à l'étude.
Dans l'étude DRIVE-AHEAD, 728 patients adultes ont reçu soit Delstrigo (n = 364), soit l'association éfavirenz/emtricitabine/ténofovir disoproxil (EFV/FTC/TDF) une fois par jour (n = 364). Jusqu'à la semaine 96, 3% des patients du groupe Delstrigo et 7% des patients du groupe EFV/FTC/TDF ont subi des événements indésirables qui ont conduit à l'arrêt du médicament à l'étude.
Études cliniques chez des adultes virologiquement contrôlés
La sécurité de Delstrigo chez les adultes virologiquement contrôlés a été évaluée sur la base des données recueillies à la semaine 48 chez 670 patients inclus dans l'étude DRIVE-SHIFT (protocole 024), une étude internationale ouverte, randomisée et multicentrique dans laquelle des patients virologiquement contrôlés sont passés à Delstrigo après un traitement de base consistant en deux inhibiteurs nucléosidiques de la transcriptase inverse [INTI] associés à un inhibiteur de la protéase (IP) boosté par le ritonavir ou le cobicistat, ou à l'elvitégravir boosté par le cobicistat ou bien à un INNTI. Le profil de sécurité chez les patients adultes virologiquement contrôlés était globalement comparable à celui des patients adultes naïfs de traitement.
Résumé du profil de sécurité
Dans les études cliniques où Delstrigo était donné à des patients naïfs de traitement, les effets indésirables les plus fréquemment rapportés et ayant un lien possible ou probable avec la doravirine étaient des nausées (6%) et des céphalées (5%).
Chez les adultes infectés par le VIH-1 et virologiquement contrôlés, le profil de sécurité de Delstrigo concordait avec les données poolées des études cliniques de phase III chez les patients naïfs de traitement.
Les effets indésirables observés dans les études DRIVE-FORWARD, DRIVE-AHEAD et DRIVE-SHIFT sont résumés dans le tableau 2 ci-dessous.
Les effets indésirables dont on suspecte un lien (au moins possible) avec le traitement sont répertoriés ci-dessous par classe de systèmes d'organes et par fréquence. À l'intérieur de chaque groupe de fréquence, les effets indésirables sont présentés dans l'ordre décroissant de gravité. Les fréquences sont définies comme suit: très fréquents (≥1/10), fréquents (≥1/100 à <1/10), occasionnels (≥1/1000 à <1/100), rares (≥1/10'000 à <1/1000),) ou très rares (<1/10'000).
Tableau 2: Tableau récapitulatif des effets indésirables liés au traitement par doravirine/lamivudine/ténofovir-DF
Fréquence | Effet indésirable | |
|---|---|---|
Affections hématologiques et du système lymphatique | ||
Occasionnels | neutropénie*, anémie*, thrombocytopénie* | |
Très rares | aplasie isolée de la lignée rouge* | |
Infections et infestations | ||
Rares | rash pustuleux | |
Troubles du métabolisme et de la nutrition | ||
Occasionnels | hypophosphatémie, hypokaliémie* | |
Rares | hypomagnésémie, acidose lactique* | |
Affections psychiatriques | ||
Fréquents | rêves anormaux, insomnie1 | |
Occasionnels | cauchemars, dépression2, anxiété3, irritabilité, état confusionnel, idées suicidaires | |
Rares | agressivité, hallucinations, trouble de l'adaptation, altération de l'humeur, somnambulisme | |
Affections du système nerveux | ||
Fréquents | céphalées, sensations vertigineuses, somnolence | |
Occasionnels | troubles de l'attention, altération de la mémoire, paresthésies, hypertonie musculaire, mauvaise qualité de sommeil | |
Très rares | neuropathie périphérique (ou paresthésie)* | |
Affections vasculaires | ||
Occasionnels | hypertension artérielle | |
Affections respiratoires, thoraciques et médiastinales | ||
Fréquents | toux*, symptômes nasaux* | |
Rares | dyspnée, hypertrophie des amygdales | |
Affections gastro-intestinales | ||
Fréquents | nausées, diarrhée, flatulences, douleurs abdominales4, vomissements | |
Occasionnels | constipation, gêne abdominale5, distension abdominale*, dyspepsie, selles molles6, trouble de la motricité gastro-intestinale7 | |
Rares | ténesme rectal, pancréatite* | |
Affections hépatobiliaires | ||
Rares | stéatose hépatique*, hépatite* | |
Affections de la peau et du tissu sous-cutané | ||
Fréquents | rash8, alopécie* | |
Occasionnels | prurit | |
Rares | dermatite allergique, rosacée, angiœdème* | |
Affections musculosquelettiques et du tissu conjonctif | ||
Fréquents | troubles musculaires* | |
Occasionnels | myalgie, arthralgie, rhabdomyolyse*†, faiblesse musculaire*† | |
Rares | douleurs musculosquelettiques, ostéomalacie (se manifestant par des douleurs osseuses et pouvant dans de rares cas favoriser la survenue de fractures)*, myopathie* | |
Affections du rein et des voies urinaires | ||
Occasionnels | créatinine augmentée*, tubulopathie rénale proximale (y compris syndrome de Fanconi)* | |
Rares | atteinte rénale aiguë, trouble rénal, calcul urinaire, lithiase rénale, insuffisance rénale aiguë*, insuffisance rénale*, nécrose tubulaire aiguë*, néphrite (y compris interstitielle aiguë)*, diabète insipide néphrogénique* | |
Troubles généraux et anomalies au site d'administration | ||
Fréquents | fatigue, fièvre* | |
Occasionnels | asthénie, malaise | |
Rares | douleurs thoraciques, frissons, douleurs, soif | |
Investigations | ||
Fréquents | alanine aminotransférase augmentée9 | |
Occasionnels | aspartate aminotransférase augmentée, lipase augmentée, amylase augmentée, hémoglobine diminuée | |
Rares | créatine phosphokinase sanguine augmentée | |
* Cet effet indésirable n'a pas été identifié comme associé à la doravirine lors des études cliniques de phase III, mais il est identifié comme tel dans l'information professionnelle de l'UE sur le 3TC et/ou le TDF. La catégorie de fréquence utilisée est la plus élevée indiquée dans l'information professionnelle suisse sur le 3TC ou le TDF.
† Cet effet indésirable peut être la conséquence d'une tubulopathie rénale proximale. En l'absence de cette maladie, on considère qu'il n'y a pas de lien de cause à effet avec le ténofovir disoproxil.
1 L'insomnie inclut: insomnie de début de nuit et troubles du sommeil
2 La dépression inclut: dépression, humeur dépressive, dépression majeure et trouble dépressif persistant
3 L'anxiété inclut: anxiété et anxiété généralisée
4 Les douleurs abdominales incluent: douleur abdominale et douleur abdominale haute
5 La gêne abdominale inclut: gêne abdominale et gêne épigastrique
6 Les selles molles incluent: selles molles et selles anormales
7 Le trouble de la motricité gastro-intestinale inclut: trouble de la motricité gastro-intestinale et selles fréquentes
8 Le rash inclut: rash, rash maculaire, rash érythémateux, rash généralisé, rash maculo-papuleux, rash papuleux et urticaire
9 L'alanine aminotransférase augmentée inclut: alanine aminotransférase augmentée et lésion hépatocellulaire
Expérience post-marketing
On ne dispose pas de données post-marketing pour Delstrigo.
Les effets indésirables suivants ont été constatés dans le cadre de l'expérience post-marketing chez des patients recevant des traitements contenant le ténofovir-DF ou la lamivudine. Comme les réactions post-marketing sont apportées volontairement par une population de taille non définie, il n'est pas toujours possible d'en déduire une estimation fiable de leur fréquence ou d'établir un lien de cause à effet avec l'exposition au médicament.
Lamivudine:
Troubles du métabolisme et de la nutrition: redistribution/accumulation de graisse corporelle.
Affections endocriniennes: hyperglycémie.
Troubles généraux: faiblesse.
Affections hématologiques et du système lymphatique: anémie (y compris aplasie érythrocytaire et anémie sévère progressant sous traitement).
Affections hépatobiliaires: acidose lactique, stéatose hépatique, exacerbations post-traitement de l'hépatite B.
Hypersensibilité: anaphylaxie, urticaire.
Affections musculosquelettiques et du tissu conjonctif: faiblesse musculaire, élévation de la CPK, rhabdomyolyse.
Affections de la peau et du tissu sous-cutané: alopécie, prurit.
Ténofovir DF:
Affections du système immunitaire: réactions allergiques, y compris angiœdème.
Troubles du métabolisme et de la nutrition: acidose lactique, hypokaliémie, hypophosphatémie.
Affections respiratoires, thoraciques et médiastinales: dyspnée.
Affections gastro-intestinales: pancréatite, amylase augmentée, douleurs abdominales.
Affections hépatobiliaires: stéatose hépatique, hépatite, enzymes hépatiques augmentées (en général ASAT, ALAT, gamma-GT).
Affections de la peau et du tissu sous-cutané: rash.
Affections musculosquelettiques et du tissu conjonctif: rhabdomyolyse, ostéomalacie (se manifestant par des douleurs osseuses et pouvant favoriser la survenue de fractures), faiblesse musculaire, myopathie.
Affections du rein et des voies urinaires: défaillance rénale aiguë, défaillance rénale, nécrose tubulaire aiguë, syndrome de Fanconi, tubulopathie rénale proximale, néphrite interstitielle (y compris cas aigus), diabète insipide néphrogénique, insuffisance rénale, élévation de la créatinine, protéinurie, polyurie.
Troubles généraux et anomalies au site d'administration: asthénie.
Les effets indésirables suivants, présentés ci-dessus par classe d'organes, peuvent survenir à la suite d'une tubulopathie rénale proximale: rhabdomyolyse, ostéomalacie, hypokaliémie, faiblesse musculaire, myopathie, hypophosphatémie.
Valeurs de laboratoire anormales
Le tableau 3 présente les pourcentages de patients avec des valeurs de laboratoire anormales séléctionnées (péjorées par rapport aux valeurs initiales) chez les patients traités par doravirine ou DRV+r dans l'étude DRIVE-FORWARD ou par Delstrigo ou EFV/FTC/TDF dans l'étude DRIVE-AHEAD.
Tableau 3: Valeurs de laboratoire anormales séléctionnées chez les adultes sans antécédent de traitement antirétroviral dans les études DRIVE-FORWARD et DRIVE-AHEAD (semaine 96)
DRIVE-FORWARD | DRIVE-AHEAD | |||
Paramètre de laboratoire Terme préféré (unité)/limite | Doravirine | DRV+r | Delstrigo | EFV/FTC/TDF |
Biochimie sanguine | ||||
Bilirubine totale | ||||
1,1 - <1,6 x LSN | 6% | 2% | 5% | 0% |
1,6 - <2,6 x LSN | 2% | <1% | 2% | 0% |
≥2,6 x LSN | <1% | 0% | 1% | <1% |
Créatinine (mg/dl) | ||||
>1,3 - 1,8 x LSN ou élévation à >0,3 mg/dl au-dessus de la valeur initiale | 4% | 6% | 3% | 2% |
>1,8 x LSN ou élévation à un niveau ≥1,5 x supérieur à la valeur initiale | 4% | 4% | 3% | 2% |
Aspartate aminotransférase (UI/l) | ||||
2,5 - <5,0 x LSN | 5% | 4% | 3% | 3% |
≥5,0 x LSN | 2% | 2% | 1% | 4% |
Alanine aminotransférase (UI/l) | ||||
2,5 - <5,0 x LSN | 4% | 2% | 4% | 4% |
≥5,0 x LSN | 2% | 3% | 1% | 3% |
Phosphatase alcaline (UI/l) | ||||
2,5 - <5,0 x LSN | <1% | 1% | <1% | 1% |
≥5,0 x LSN | 0% | <1% | 0% | <1% |
Lipase | ||||
1,5 - <3,0 x LSN | 7% | 6% | 6% | 4% |
≥3,0 x LSN | 3% | 4% | 2% | 3% |
Créatine kinase (UI/l) | ||||
6,0 - <10,0 x LSN | 3% | 3% | 3% | 3% |
≥10,0 x LSN | 5% | 6% | 4% | 6% |
Cholestérol, à jeun (mg/dl) | ||||
≥300 mg/dl | 0% | 1% | 1% | <1% |
Cholestérol-LDL, à jeun (mg/dl) | ||||
≥190 mg/dl | <1% | 4% | <1% | 2% |
Triglycérides, à jeun (mg/dl) | ||||
>500 mg/dl | 1% | 2% | 1% | 3% |
Chaque patient n'est compté qu'une fois pour chaque paramètre affichant le plus haut degré de toxicité. Seuls sont inclus les patients présentant une valeur initiale et au moins une valeur observée en cours de traitement pour un paramètre de laboratoire donné. LSN = limite supérieure de la normale. Note: INTI = FTC/TDF ou ABC/3TC | ||||
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Il n'existe aucun traitement spécifique connu pour les cas de surdosage de Delstrigo. Tout patient victime d'un surdosage doit être surveillé et bénéficier si nécessaire le traitement standard de soutien.
Doravirine: Il n'existe aucun traitement spécifique connu pour les cas de surdosage de la doravirine.
Lamivudine: Une quantité négligeable de lamivudine ayant été éliminée par hémodialyse (de 4 heures), dialyse péritonéale continue ambulatoire et dialyse péritonéale automatique, on ignore si une hémodialyse continue pourrait procurer un bénéfice clinique en cas de surdosage en lamivudine.
Ténofovir DF: Le ténofovir DF est efficacement éliminé par hémodialyse, avec un coefficient d'extraction d'environ 54%. Après administration d'une dose unique de 300 mg de ténofovir-DF, une séance d'hémodialyse de 4 heures a éliminé environ 10% de la dose administrée de ténofovir.
Propriétés/Effets
Code ATC
J05AR24
Mécanisme d'action
Doravirine: La doravirine est un inhibiteur non nucléosidique de la transcriptase inverse de type pyridinone du VIH-1 et inhibe la réplication du VIH-1 par inhibition non compétitive de la transcriptase inverse (TI) du VIH-1. La doravirine n'inhibe ni les ADN polymérases cellulaires humaines α, β ni l'ADN polymérase mitochondriale γ.
Lamivudine: La lamivudine est un analogue nucléosidique synthétique. La lamivudine est phosphorylée au niveau intracellulaire en son métabolite actif 5'-triphosphate , la lamivudine triphosphate (3TC-TP). Le mode d'action principal de la 3TC-TP repose sur l'inhibition de la TI par terminaison de la chaîne d'ADN après incorporation de l'analogue nucléotidique.
Ténofovir DF: Le ténofovir DF est un analogue nucléosidique diester phophonate acyclique de l'adénosine monophosphate. Le ténofovir DF nécessite d'abord une hydrolyse du diester pour la conversion en ténofovir, puis des phosphorylations par des enzymes cellulaires pour former du diphosphate de ténofovir. Le ténofovir diphosphate inhibe l'activité de la TI du VIH-1 en entrant en compétition avec le substrat de la désoxyadenosine 5'-triphosphate naturelle et, après incorporation dans l'ADN, par terminaison de la chaîne d'ADN. Le ténofovir diphosphate est un faible inhibiteur des ADN polymérases des mammifères α et β ainsi que de l'ADN polymérase mitochondriale γ.
Pharmacodynamique
Activité antivirale en culture cellulaire
Doravirine: La doravirine, testée sur des cellules reporters MT4-GFP en présence de 100% de sérum humain normal (SHN), a montré une CE50 de 12,0 ± 4,4 nM contre les souches de laboratoire de type sauvage du VIH-1. La doravirine a montré une activité antivirale contre un large spectre d'isolats primaires du VIH-1 (A, A1, AE, AG, B, BF, C, D, G, H) avec des valeurs de CE50 comprises entre 1,2 nM et 10,0 nM.
Lamivudine: L'activité antivirale de la lamivudine contre le VIH-1 a été évaluéesur un certain nombre de lignées cellulaires, y compris des monocytes et des cellules mononucléées du sang périphérique (CMSP) en utilisant des tests de sensibilité classiques. Les valeurs de CE50 ont été comprises entre 0,003 et 15 μM (1 μM = 0,23 μg/ml). Les valeurs médianes de CE50 de la lamivudine ont été de 60 nM (intervalle: 20 à 70 nM), 35 nM (intervalle: 30 à 40 nM), 30 nM (intervalle: 20 à 90 nM), 20 nM (intervalle: 3 à 40 nM), 30 nM (intervalle: 1 à 60 nM), 30 nM (intervalle: 20 à 70 nM), 30 nM (intervalle: 3 à 70 nM) et 30 nM (intervalle: 20 à 90 nM) respectivement contre les sous-types A à G et les virus du groupe O du VIH-1 (n = 3, sauf n = 2 pour le clade B). La ribavirine (50'000 nM) utilisée dans le traitement de l'infection chronique par le VHC a diminué l'activité anti-VIH-1 de la lamivudine de 3,5 fois dans les cellules MT-4.
Ténofovir DF: L'activité antivirale du ténofovir contre les isolats cliniques et de laboratoire du VIH-1 a été évaluée sur des lignées de cellules lymphoblastoïdes T, sur des cellules monocytes/macrophages primaires et sur des CMSP. Les valeurs de CE50 du ténofovir étaient comprises entre 0,04 et 8,5 μM. Le ténofovir a présenté une activité antivirale en culture cellulaire contre les sous-types A, B, C, D, E, F, G et O du VIH-1 (valeurs de CE50 comprises entre 0,5 et 2,2 μM).
Résistance
En culture cellulaire
Doravirine: Les souches résistantes à la doravirine ont été sélectionnées en culture cellulaire à partir de VIH-1 de type sauvage d'origines et de sous-types différents, ainsi que de VIH-1 résistants aux INNTI. Les substitutions d'acides aminés observées sous traitement qui ont émergé dans la TI incluaient entre autres: V106A, V106I, V106M, V108I, H221Y, F227C, F227L, F227V, M230I, L234I, P236L et Y318F.
Lamivudine: Des variants du VIH-1 résistants à la lamivudine ont été sélectionnés en culture cellulaire et chez des patients traités par la lamivudine. L'analyse génotypique a montré que la résistance était due à une substitution spécifique d'acide aminé dans la TI du VIH-1 au niveau du codon 184, modifiant la méthionine soit en isoleucine soit en valine (M184I/V).
Ténofovir DF: Les isolats du VIH-1 sélectionnés par le ténofovir exprimaient une substitution K65R de la TI du VIH-1 et ont entraîné une réduction d'un facteur 2 à 4 de la sensibilité au ténofovir. Par ailleurs, une substitution K70E de la TI du VIH-1 a été sélectionné par le ténofovir, se traduisant par une diminution de faible niveau de la sensibilité à l'abacavir, à l'emtricitabine, à la lamivudine et au ténofovir.
Dans les études cliniques
Chez les patients adultes sans antécédent de traitement antirétroviral
Doravirine: Dans les bras traités par doravirine des études DRIVE-FORWARD et DRIVE-AHEAD réalisées chez des patients naïfs de traitement (n = 747), de nouvelles substitutions associées à une résistance à la doravirine ont été observées chez 8 patients sur 30 de la sous-population d'analyse de la résistance (patients présentant plus de 400 copies d'ARN du VIH-1 par ml après échec virologique ou arrêt prématuré de l'étude, et pour lesquels on disposait de données de résistance) jusqu'à la semaine 96.
Une ou plusieurs des substitutions suivantes dans la TI comptaient parmi les nouvelles substitutions associées à une résistance à la doravirine: A98G, V106A,V106I, V106M/T, Y188L, H221Y, P225H, F227C, F227C/R et Y318Y/F.
Aucune nouvelle substitution associée à une résistance au darunavir n'a été observée chez les 11 patients de la sous-population d'analyse de la résistance dans le bras de traitement DRV+r de l'étude DRIVE-FORWARD (n = 383). Dans le bras de traitement EFV/FTC/TDF de l'étude DRIVE-AHEAD (n = 364), de nouvelles substitutions associées à une résistance à l'éfavirenz ont été observées chez 15 des 24 patients de la sous-population d'analyse de la résistance.
Lamivudine et ténofovir DF: Dans une analyse poolée de patients naïfs de traitement antirétroviral recevant de la doravirine, de la lamivudine et du ténofovir DF, un génotypage des isolats plasmatiques de VIH-1 a été effectué chez tous les patients présentant >400 copies d'ARN du VIH-1 par ml après un échec virologique confirmé ou au moment de l'arrêt prématuré du médicament à l'étude. 8 patients évaluables, qui ont reçu DOR/3TC/TDF jusqu'à la semaine 96, avaient développé une résistance génotypique. Les substitutions apparues et associées à une résistance étaient RT A62A/V, M41L (n = 1), T69T/A et V75V/I (n = 1); K65R (n = 2) et M184V (n = 5).
Chez les patients adultes virologiquemement contrôlés
Dans l'étude clinique DRIVE-SHIFT, aucun patient sous traitement par Delstrigo n'a développé de résistance génotypique ou phénotypique à la doravirine, à la lamivudine ou au ténofovir DF, ni dans le groupe avec switch immédiat (n=447) ni dans le groupe avec switch retardé (n=209). Un patient a développé une mutation M184M/I de la TI et une résistance phénotypique à la lamivudine et à l'emtricitabine pendant son traitement à l'inclusion. Aucun des 24 patients (11 dans le groupe de switch immédiat [jour 1], 13 dans le groupe de switch retardé [semaine 24]) qui présentaient des mutations associées aux INNTI à l'inclusion (TI K103N, G190A ou Y181C) ne s'est retrouvé en échec virologique à la semaine 48 ou au moment de l'arrêt du traitement.
Résistance croisée
Aucune résistance croisée significative n'a été démontrée entre les variants du VIH-1 résistants à la doravirine et à la lamivudine/emtricitabine ou au ténofovir ou entre les variants résistants à la lamivudine ou au ténofovir et à la doravirine.
Doravirine: Les souches de laboratoire de VIH-1 présentant les mutations fréquentes associées aux INNTI par les substitutions K103N, Y181C ou K103N/Y181C dans la TI montrent une diminution de la sensibilité à la doravirine d'un facteur inférieur à 3 par rapport au virus de type sauvage. La doravirine a été capable de supprimer les substitutions suivantes associées aux INNTI à des concentrations cliniquement pertinentes: K103N, Y181C, G190A et E138K.
Un spectre de 96 différents isolats cliniques présentant des substitutions associées aux INNTI a été soumis à un test de sensibilité à la doravirine. Les isolats cliniques présentant la substitution Y188L seule ou associée à K103N ou à V106I, la substitution V106A associée à G190A et à F227L ou la substitution E138K associée à Y181C et à M230L ont montré une sensibilité plus de 100 fois moins élevée à la doravirine.
Les substitutions associées à une résistance à la doravirine apparues sous traitement peuvent conférer une résistance croisée à l'éfavirenz, à la rilpivirine, à la névirapine et à l'étravirine. Sur les 8 patients ayant développé une résistance phénotypique à la doravirine, tous ont présenté au test Monogram Phenosense une résistance phénotypique à la névirapine, 6 une résistance phénotypique à l'efavirenz, 4 une résistance phénotypique à la rilpivirine et 4 une résistance partielle à l'étravirine.
Lamivudine: Une résistance croisée a été observée entre les INTI. La substitution M184I/V responsable de la résistance à la lamivudine confère une résistance à l'emtricitabine. Les mutants du VIH-1 résistants à la lamivudine ont également montré une résistance croisée à la didanosine. Chez certains patients traités par zidovudine + didanosine, des isolats résistants à de multiples inhibiteurs de la TI, y compris la lamivudine, ont émergé.
Ténofovir-DF: Une résistance croisée a été observée entre les INTI. La substitution K65R de la TI du VIH-1 sélectionnée par le ténofovir est également sélectionnée chez certains patients infectés par le VIH-1 traités par l'abacavir ou la didanosine. Les isolats du VIH-1 porteurs de la substitution K65R ont également montré une réduction de la sensibilité à l'emtricitabine et à la lamivudine. Par conséquent, une résistance croisée entre ces INTI pourrait se développer chez les patients dont le virus contient la substitution K65R. La substitution K70E sélectionnée en clinique par le ténofovir-DF se traduit par une diminution de la sensibilité à l'abacavir, à la didanosine, à l'emtricitabine, à la lamivudine et au ténofovir. Les isolats du VIH-1 provenant de patients (n = 20) dont le VIH-1 exprimait en moyenne 3 substitutions d'acides aminés de la TI associées à la zidovudine (M41L, D67N, K70R, L210W, T215Y/F ou K219Q/E/N) ont montré une diminution d'un facteur 3,1 de la sensibilité au ténofovir. Les patients dont le virus exprimait une substitution de la TI L74V sans substitutions associées à une résistance à la zidovudine (n = 8) ont présenté une diminution de la réponse au ténofovir-DF. On dispose de données limitées pour les patients dont le virus exprimait une substitution Y115F (n = 3), une substitution Q151M (n = 2) ou une insertion T69 (n = 4) de la TI du VIH-1; tous ont présenté une diminution de la réponse dans les études cliniques.
Effets sur l'électrocardiogramme
Administrée à une dose de 1200 mg qui génère des pics de concentration environ 4 fois plus élevés que la dose maximale autorisée, la doravarine n'entraîne pas d'allongement cliniquement significatif de l'intervalle QT.
Efficacité clinique
Patients adultes sans antécédent de traitement antirétroviral
L'efficacité de Delstrigo repose sur les analyses des données sur une période de 96 semaines de deux études de phase III multicentriques, randomisées en double aveugle et contrôlées versus comparateur actif (DRIVE-FORWARD et DRIVE-AHEAD) chez des patients infectés par le VIH-1 naïfs de traitement antirétroviral (n = 1494).
Dans l'étude DRIVE-FORWARD, 766 patients ont été randomisés pour recevoir au moins 1 dose de doravirine 1x par jour ou de DRV+r 800/100 mg 1x par jour, chaque groupe recevant aussi l'association emtricitabine/ténofovir-DF (FTC/TDF) ou l'association abacavir/lamivudine (ABC/3TC) au choix de l'investigateur. A l'inclusion, les patients avaient un âge médian de 33 ans, 16% étaient des femmes, 27% étaient non-caucasiens, 4% étaient co-infectés par le virus de l'hépatite B et/ou C, 10% avaient une anamnèse de SIDA, 20% présentaient un taux d'ARN VIH-1 supérieur à 100'000 copies/ml et 86% avaient un nombre de lymphocytes T CD4+ supérieur à 200 cellules/mm3; 13% étaient traités par ABC/3TC et 87% par FTC/TDF. Ces caractéristiques étaient comparables entre les groupes de traitements.
Dans l'étude DRIVE-AHEAD, 728 participants ont été randomisés pour recevoir soit Delstrigo, soit EFV/FTC/TDF à raison d'au moins une dose par jour. A l'inclusion, les patients avaient un âge médian de 31 ans, 15% étaient des femmes, 52% étaient non-caucasiens, 3% étaient co-infectés par le virus de l'hépatite B et/ou C, 14% avaient une anamnèse de SIDA, 21% présentaient un taux d'ARN VIH-1 supérieur à 100'000 copies/ml et 88% avaient un nombre de lymphocytes T CD4+ supérieur à 200 cellules/mm3. Ces caractéristiques étaient comparables entre les groupes de traitements.
Les résultats aux semaines 48 et 96 pour les études DRIVE-FORWARD et DRIVE-AHEAD sont présentés dans le tableau 4. Leur juxtaposition dans le tableau vise à simplifier la visibilité; des comparaisons directes entre les études ne devraient pas être faites en raison des différences de conception des essais.
Dans l'étude DRIVE-FORWARD, la doravirine a montré une efficacité cohérente par rapport aux facteurs démographiques et aux facteurs pronostiques connus à l'inclusion tels que le sexe, la couleur de la peau, l'origine ethnique, le traitement de fond par INTI, le taux initial d'ARN VIH-1 (≤100'000 ou >100'000 copies/ml), le nombre de lymphocytes T CD4+ et les sous-types viraux. Le nombre moyen de lymphocytes T CD4+ dans le groupe doravirine et le groupe DRV+r a augmenté de 193 et 186 cellules/mm3, respectivement, à la semaine 48, et de 224 et 207 cellules/mm3, respectivement, à la semaine 96 par rapport à l'inclusion.
Dans l'étude DRIVE-AHEAD, Delstrigo a montré une efficacité cohérente par rapport aux facteurs démographiques et aux facteurs pronostiques connus à l'inclusion tels que le sexe, la couleur de la peau, l'origine ethnique, le taux initial d'ARN VIH-1 (≤100'000 ou >100'000 copies/ml), le nombre de lymphocytes T CD4+ et les sous-types viraux. Le nombre moyen de lymphocytes T CD4+ dans le groupe Delstrigo et le groupe EFV/FTC/TDF a augmenté de 198 et 188 cellules/mm3, respectivement, à la semaine 48, et de 238 et 223 cellules/mm3, respectivement, à la semaine 96 par rapport à l'inclusion.
Tableau 4: Réponse thérapeutique (ARN VIH-1 <50 copies/ml, analyse «Snapshot») chez les patients adultes infectés par VIH-1 sans antécédents de traitement antirétroviral
Résultat | DRIVE-FORWARD | DRIVE-AHEAD | |||
Doravirine | DRV+r | Delstrigo | EFV/FTC/TDF | ||
Semaine 48 | 84% (N=383) | 80% (N=383) | 84% (N=364) | 81% (N=364) | |
Différence (IC à 95%)* | 3,9% (-1,6%; 9,4%) | 3,5% (-2,0%; 9,0%) | |||
Semaine 96# | 73% (N=379) | 66% (N=376) | 77% (N=364) | 74% (N=364) | |
Différence (IC à 95%)* | 7,1% (0,5%; 13,7%) | 3,8% (2,4%; 10,0%) | |||
Proportion (%) de participants avec un taux d'ARN VIH-1 <50 copies/ml à la semaine 96 en fonction des facteurs à l'inclusion et démographiques | |||||
Sexe | |||||
homme | 73% (N = 315) | 68% (N = 319) | 78% (N = 305) | 73% (N = 311) | |
femme | 73% (N = 64) | 54% (N = 57) | 75% (N = 59) | 75% (N = 53) | |
Couleur de peau | |||||
caucasienne | 78% (N = 227) | 69% (N = 276) | 80% (N = 176) | 74% (N = 170) | |
non caucasienne | 59% (N = 102) | 59% (N = 99) | 76% (N = 188) | 74% (N = 194) | |
Origine ethnique | |||||
hispanique ou latino-américaine | 78% (N = 91) | 64% (N = 85) | 81% (N = 126) | 77% (N = 119) | |
ni hispanique ni latino-américaine | 72% (N = 283) | 67% (N = 285) | 76% (N = 238) | 72% (N = 239) | |
Traitement de fond par INTI | |||||
FTC/TDF | 72% (N = 329) | 66% (N = 328) | - | - | |
ABC/3TC | 80% (N = 50) | 67% (N = 48) | - | - | |
ARN VIH-1 à l'inclusion (copies/ml) | |||||
≤100'000 copies/ml | 76% (N = 297) | 67% (N = 303) | 80% (N = 291) | 77% (N = 282) | |
>100'000 copies/ml | 62% (N = 82) | 60% (N = 72) | 67% (N = 73) | 62% (N = 82) | |
Nombre de lymphocytes T CD4+ (cellules/mm3) | |||||
≤200 cellules/mm3 | 65% (N = 40) | 52% (N = 65) | 59% (N = 44) | 70% (N = 46) | |
>200 cellules/mm3 | 74% (N = 339) | 69% (N = 311) | 80% (N = 320) | 74% (N = 318) | |
Sous-type viral¶ | |||||
Sous-type B | 72% (N = 262) | 67% (N = 266) | 80% (N = 232) | 72% (N = 253) | |
Sous-type non-B | 75% (N = 117) | 63% (N = 110) | 73% (N = 130) | 77% (N = 111) | |
# Pour la semaine 96, les patients avec un ARN VIH-1 manquant en raison d'un rappel d'agent par le fabricant Abbott ont été exclus de l'analyse. * Les IC à 95% pour les différences entre traitements ont été calculés à l'aide de la méthode de Mantel-Haenszel ajustée de la strate. ¶ Le sous-type viral n'était pas disponible pour deux patients. Note: INTI = FTC/TDF ou ABC/3TC. | |||||
L'étude P007 était une étude de phase IIb chez des patients adultes infectés par le VIH-1 naïfs de traitement antirétroviral (n = 340). Dans la partie I, les patients étaient randomisés pour recevoir l'une des 4 doses de doravirine ou d'EFV, chacune en association avec FTC/TDF. Après la semaine 24, tous les participants assignés au groupe doravirine sont passés (ou ont été maintenus) à la dose de 100 mg de doravirine. Dans la partie II, d'autres patients ont été randomisés pour recevoir soit de la doravirine 100 mg, soit l'EFV, l'un et l'autre en association avec FTC/TDF. Dans les deux parties de l'étude, la doravirine et l'EFV étaient administrés en aveugle, tandis que le traitement par FTC/TDF était administré en ouvert.
À la semaine 48, la proportion de participants avec un taux d'ARN VIH-1 inférieur à 50 copies/ml était de 79% (85/108) pour la doravirine 100 mg et de 82% (89/108) pour l'EFV. À la semaine 96, la proportion de participants avec un taux d'ARN VIH-1 inférieur à 50 copies/ml était de 76% (82/108) pour la doravirine 100 mg et de 76% (82/108) pour l'EFV. À la semaine 48, le nombre moyen de lymphocytes T CD4+ dans le groupe doravirine 100 mg et le groupe EFV avait augmenté de 192 et 195 cellules/mm3, respectivement, par rapport à l'inclusion. À la semaine 96, le nombre moyen de lymphocytes T CD4+ dans le groupe doravirine 100 mg et le groupe EFV avait augmenté de 259 et 264 cellules/mm3, respectivement, par rapport à l'inclusion. L'analyse de sous-groupes P007 est présentée dans le tableau 5 ci-dessous.
Tableau 5: Proportion (%) de patients avec un taux d'ARN VIH-1 <50 copies/ml à la semaine 96 pour le protocole 007 (analyse «Snapshot» de la FDA)
Doravirine 100 mg | Éfavirenz 600 mg | |
ARN VIH-1 à l'inclusion (copies/ml) | ||
≤100'000 copies/ml | 56/73 (77%) | 55/76 (72%) |
>100'000 copies/ml | 26/35 (74%) | 27/32 (84%) |
Nombre de lymphocytes T CD4+ (cellules/mm3) | ||
≤200 cellules/mm3 | 6/7 (86%) | 7/10 (70%) |
>200 cellules/mm3 | 76/101 (75%) | 75/98 (77%) |
Patients adultes virologiquement contrôlés
L'efficacité d'un passage à Delstrigo à partir d'un traitement de base composé de deux inhibiteurs nucléosidiques de la transcriptase inverse en association avec un inhibiteur de la protéase (IP) boosté par le ritonavir ou le cobicistat, ou avec l'elvitégravir boosté par le cobicistat, ou avec un INNTI a été évaluée dans une étude ouverte randomisée (DRIVE-SHIFT) chez des adultes infectés par le VIH-1 virologiquement contrôlés. Les patients devaient être virologiquement contrôlés (ARN VIH-1 <50 copies/ml) par leur traitement de base depuis au moins 6 mois, sans antécédent d'échec virologique, avant leur inclusion dans l'étude. Les patients ont été randomisés soit pour passer à Delstrigo dès l'inclusion (n = 447, groupe de switch immédiat GSI), soit pour maintenir leur traitement de base jusqu'à leur passage à Delstrigo à la semaine 24 (n = 223, groupe de switch retardé GSR). A l'inclusion les patients avaient un âge médian de 43 ans, 16% étaient des femmes et 24% étaient non-caucasiens.
L'étude DRIVE-SHIFT a montré la non-infériorité (jugée au critère de la proportion de patients ayant un taux d'ARN VIH-1 <50 copies/ml) d'un switch immédiat à Delstrigo à la semaine 48 par rapport à la poursuite du traitement de base à la semaine 24. La comparaison des groupes de traitement à la semaine 24 a donné des résultats cohérents dans chaque groupe. Les résultats du traitement sont présentés dans le tableau 6.
Tableau 6: Résultats virologiques chez des patients infectés par le VIH-1 virologiquement contrôlés qui sont passés à Delstrigo dans l'étude DRIVE-SHIFT
| Delstrigo GSI 1x par jour | Traitement de base GSR | |
| Semaine 48 N=447 | Semaine 24 N=223 | |
| ARN VIH-1 <50 copies/ml | 91% | 95% |
| GSI-GSR, différence (IC à 95%)* | 3,8% (-7,9%; 0,3%)* | |
| ARN VIH-1 ≥50 copies/ml† | 2% | 2% |
| Absence de données virologiques dans la fenêtre de la semaine 48 | 8% | 4% |
| Abandon de l'étude pour cause d'EI ou de décès‡ | 3% | 0 |
| Abandon de l'étude pour d'autres raisons§ | 4% | 4% |
| Dans l'étude, mais il manque des données dans la fenêtre | 0 | 0 |
Proportion (%) de patients avec un taux d'ARN VIH-1 <50 copies/ml en fonction des facteurs à l'inclusion et démographiques | ||
Sexe | ||
| homme | 91% (N = 372) | 94% (N = 194) |
| femme | 91% (N = 75) | 100% (N = 29) |
Couleur de peau | ||
| caucasienne | 90% (N = 344) | 95% (N = 168) |
| non caucasienne | 93% (N = 103) | 93% (N = 55) |
Origine ethnique | ||
| hispanique ou latino-américaine | 88% (N = 99) | 91% (N = 45) |
| ni hispanique ni latino-américaine | 91% (N = 341) | 95% (N = 175) |
Nombre de lymphocytes T CD4+ (cellules/mm³) | ||
| <200 cellules/mm³ | 85% (N = 13) | 75% (N = 4) |
| ≥200 cellules/mm³ | 91% (N = 426) | 95% (N = 216) |
* Les IC à 95% pour les différences entre traitements ont été calculés à l'aide de la méthode de Mantel-Haenszel ajustée de la strate. † Inclut les patients ayant arrêté la prise du médicament à l'étude ou leur participation à l'étude avant la semaine 48 (GSI) ou avant la semaine 24 (GSR) à cause d'un manque ou d'une perte d'efficacité, ainsi que les patients avec ≥50 copies/ml d'ARN VIH-1 dans la fenêtre de la semaine 48 (GSI) ou de la semaine 24 (GSR). ‡ Inclut les patients qui ont arrêté l'étude en raison d'un événement indésirable (El) ou d'un décès si cela a entraîné l'absence de données virologiques sur le traitement dans la fenêtre de temps spécifiée. § Autres raisons: perte de vue lors du suivi, non-observance du médicament à l'étude, décision du médecin, écart au protocole, retrait du participant. Traitement de base = IP boosté par ritonavir ou cobicistat (en particulier atazanavir, darunavir ou lopinavir) ou elvitégravir boosté par cobicistat, ou INNTI (en particulier éfavirenz, névirapine ou rilpivirine), chacun administré avec deux INTI. | ||
Pharmacocinétique
L'administration d'un comprimé unique de Delstrigo à des volontaires sains (n = 24) à jeun a produit des expositions à la doravirine, à la lamivudine et au ténofovir comparables à celles obtenues avec l'administration de comprimés de doravirine (100 mg) plus comprimés de lamivudine (300 mg) plus comprimés de ténofovir-DF (300 mg).
La pharmacocinétique de la doravirine a été étudiée chez des volontaires sains et chez des patients infectés par le VIH-1. La pharmacocinétique de la doravirine est similaire chez les volontaires sains et chez les patients infectés par le VIH-1. L'état d'équilibre est généralement atteint au jour 2 d'un traitement administré une fois par jour, avec des ratios d'accumulation compris entre 1,2 et 1,4 pour l'ASC0-24, la Cmax et la C24 à des doses de 30 à 240 mg 1x par jour. Les paramètres pharmacocinétiques de la doravirine à l'état d'équilibre, après administration de 100 mg une fois par jour à des participants infectés par le VIH-1, basés sur une analyse pharmacocinétique de population, sont présentés ci-dessous.
Tableau 7: Paramètres pharmacocinétiques à l'état d'équilibre de la doravirine
Paramètre | ASC0-24 μM·h | Cmax μM | C24 nM |
Doravirine 100 mg 1x par jour | 37,8 (29) | 2,26 (19) | 930 (63) |
MG: moyenne géométrique, %CV: coefficient géométrique de variation | |||
Absorption
Doravirine: Après administration orale, les pics de concentrations plasmatiques sont atteints 2 heures après l'administration. La biodisponibilité absolue de la doravirine a été estimée à environ 64% pour le comprimé à 100 mg sur la base d'analyses de modèles.
Lamivudine: Après administration orale, la lamivudine est bien résorbée au niveau de l'appareil gastro-intestinal. La biodisponibilité absolue est comprise normalement entre 80 et 85% chez l'adulte. Après une prise orale, le temps moyen (tmax) écoulé jusqu'à l'obtention du pic de concentration sérique (Cmax) est d'environ 1 heure. À la dose thérapeutique (4 mg/kg/jour) avec une prise unique toutes les 12 heures, la Cmax est comprise entre 1 et 1,9 µg/ml.
Aucune accumulation de principe actif pouvant avoir de conséquence clinique n'a été constatée lors de prises réitérées.
Ténofovir DF: Après administration orale de ténofovir DF à des patients infectés par le VIH, le ténofovir DF est rapidement absorbé et converti en ténofovir. Après une prise à jeun, les concentrations maximales de ténofovir ont été atteintes en une heure et les valeurs de la Cmax et de l'ASC (moyenne ± ET) (%CV) étaient respectivement de 296 ± 90 ng/ml (30%) et de 2'287 ± 685 ng·h/ml (30%). La biodisponibilité orale du ténofovir provenant du ténofovir DF chez les patients à jeun était approximativement 25%.
Distribution
Doravirine: Sur la base de l'administration IV d'une microdose de 100 µg, le volume de distribution de la doravirine, est de 60,5 l. La doravirine est liée aux protéines plasmatiques à environ 76%.
Lamivudine: Des études sur la lamivudine utilisée par voie intraveineuse ont révélé que le volume moyen de distribution est de 1,3 l/kg. La pharmacocinétique de la lamivudine est linéaire dans la zone thérapeutique, sa liaison à l'albumine, principale protéine du plasma, est limitée (16-36%).
Un nombre restreint de données montre que la lamivudine passe dans le liquide céphalo-rachidien où elle peut être décelée. Le quotient moyen de concentration de la lamivudine dans le liquide céphalo-rachidien et dans le sérum a été d'environ 0,12, 2 à 4 heures après administration orale. On ignore l'importance exacte du passage dans le liquide céphalo-rachidien et s'il existe une corrélation avec un effet clinique.
Ténofovir DF: Après administration intraveineuse, le volume de distribution du ténofovir était approximativement de 800 ml/kg. Après administration orale le ténofovir est largement distribué dans tout l'organisme. La liaison in vitro du ténofovir aux protéines plasmatiques et sériques humaines était inférieure à 0,7% (plasma) et à 7,2% (sérum) dans l'intervalle de concentration du ténofovir de 0,01 à 25 µg/ml.
Métabolisme
Doravirine: Les données in vitro montrent que la doravirine est principalement métabolisée par le CYP3A.
Lamivudine: Dans l'élimination de la lamivudine, la métabolisation joue un rôle secondaire (5 à 10%).
Ténofovir DF: Les études in vitro ont montré que ni le ténofovir DF ni le ténofovir ne sont des substrats pour les enzymes du CYP450.
Élimination
Doravirine: La doravirine a une demi-vie terminale (t1/2) d'environ 15 heures. La doravirine est principalement éliminée par métabolisme oxydatif dépendant du CYP3A4. L'excretion du principe actif sous forme inchangée par voie urinaire est mineure. On ne s'attend pas à une excrétion significative du principe actif sous forme inchangée par voie biliaire.
Dans une étude clinique utilisant de la doravirine marquée au 14C sous la forme galénique d'une capsule à faible biodisponibilité par rapport au comprimé, la majeure partie de la dose du médicament a été retrouvée sous forme non absorbée dans les selles. La doravirine et son métabolite oxydé M9 étaient les principales espèces retrouvées dans le plasma (75% resp. 12,9% des composants totals dérivés du médicament). Dans la partie absorbée de la dose administrée, M9 était la principale espèce dérivée du médicament retrouvée dans les urines (39,4% de la dose absorbée) et dans les selles (15,9% de la dose absorbée). Les métabolites moins courants, représentant chacun 1,2% ou moins des composants dérivés du médicament dans le plasma ou de la dose retrouvée dans les excréments, comprenaient des métabolites N-désalkylés et autres produits du métabolisme oxydatif ainsi que des conjugués de métabolites oxydés. Environ 12,9% de la dose absorbée après administration en capsule a été éliminée sous forme de doravirine dans les urines.
Lamivudine: La demi-vie d'élimination terminale moyenne est de 5 à 7 heures. La clairance systémique moyenne de la lamivudine est d'environ 0,32 l/h/kg, l'élimination rénale étant effectuée essentiellement par le système de transport de cations organiques (>70%). La métabolisation hépatique est inférieure à 10%. Le molécule actif (triphosphate de lamivudine intracellulaire) possède, par rapport à la demi-vie plasmatique de la lamivudine (5 à 7 h), une demi-vie terminale prolongée dans la cellule (16 à 19 h).
Ténofovir DF: Après administration orale, la demi-vie d'élimination du ténofovir est de 12 à 18 heures environ. Le ténofovir est principalement éliminé par voie rénale, à la fois par filtration et par un système de transport tubulaire actif (constitué des protéines de transport d'anions organiques humaines (hOAT) 1 et 3 et de la protéine de multirésistance 4 (MRP4)), environ 70 à 80% de la dose se retrouvant excrétée sous forme inchangée dans l'urine après administration intraveineuse. La clairance apparente du ténofovir s'élève à environ 307 ml/min. La clairance rénale a été estimée à environ 210 ml/min, ce qui est supérieur au débit de la filtration glomérulaire. Ce résultat indique que la sécrétion tubulaire active représente une part importante de l'élimination du ténofovir.
Effet de l'alimentation sur l'absorption orale
L'administration d'un comprimé unique de Delstrigo avec un repas riche en graisses à des volontaires sains a entraîné une augmentation de 26% de la C24 de la doravirine, tandis que l'ASC et la Cmax n'étaient pas affectées de manière significative. La Cmax de la lamivudine a diminué de 19% lors de l'administration avec un repas riche en graisses, tandis que l'ASC n'était pas affectée de manière significative. La Cmax du ténofovir a diminué de 12% et l'ASC a augmenté de 27% lors de l'administration avec un repas riche en graisses. Ces différences pharmacocinétiques ne sont pas jugées cliniquement pertinentes.
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique
Doravirine: La doravirine est principalement métabolisée et éliminée par le foie. Une étude comparant 8 patients présentant une insuffisance hépatique modérée (classe Child-Pugh B) à 8 volontaires sans insuffisance hépatique n'a pas révélé de différence cliniquement pertinente au niveau de la pharmacocinétique de la doravirine. La doravirine n'a pas été étudiée chez les patients présentant une insuffisance hépatique sévère (classe Child-Pugh C) (voir «Posologie/Mode d'emploi»).
Lamivudine: Les propriétés pharmacocinétiques de la lamivudine ont été examinées chez des adultes présentant une insuffisance hépatique. Les paramètres pharmacocinétiques n'ont pas été modifiés par la diminution de la fonction hépatique. La sécurité et l'efficacité de la lamivudine n'ont pas été établies en présence d'une décompensation hépatique.
Ténofovir DF: La pharmacocinétique du ténofovir après administration d'une dose de 300 mg de ténofovir DF a été étudiée chez des volontaires sains présentant une insuffisance hépatique modérée à sévère. Aucune différence cliniquement pertinente de la pharmacocinétique du ténofovir n'a été observée entre les patients avec une insuffisance hépatique et les volontaires sains.
Troubles de la fonction rénale
Doravirine: La doravirine n'est excrétée que dans une faible proportion par les reins: environ 6% de la dose administrée sous forme de comprimé est retrouvée sous forme inchangée dans les urines. Dans une étude comparant 7 patients présentant un DFG de <30 ml/min à 8 volontaires sans insuffisance rénale (DFG ≥90 ml/min), l'exposition à la doravirine après administration d'une dose unique a été plus élevée de 31% chez les patients présentant une insuffisance rénale sévère. Dans une analyse pharmacocinétique de population qui incluait 1102, 188, 9 et 7 patients présentant respectivement un DFG de ≥90 ml/min, 60-89 ml/min, 30-59 ml/min et <30 ml/min, la fonction rénale n'a pas eu d'effet cliniquement pertinent sur la pharmacocinétique de la doravirine. La doravirine n'a pas été étudiée chez les patients présentant une insuffisance rénale terminale ou chez les patients sous dialyse (voir «Posologie/Mode d'emploi»).
Lamivudine: Les propriétés pharmacocinétiques de la lamivudine ont été déterminées dans un petit groupe d'adultes infectés par le VIH-1 avec insuffisance hépatique (tableau 8).
Tableau 8: Paramètres pharmacocinétiques (moyenne ± ET) après administration orale unique de 300 mg de lamivudine dans 3 groupes d'adultes présentant divers degrés d'insuffisance rénale
Critère: clairance de la créatinine | |||
Paramètre | >60 ml/min | 10–30 ml/min | <10 ml/min |
n = 6 | n = 4 | n = 6 | |
Clairance de la créatinine (ml/min) | 111 ± 14 | 28 ± 8 | 6 ± 2 |
Cmax (μg/ml) | 2,6 ± 0,5 | 3,6 ± 0,8 | 5,8 ± 1,2 |
ASC∞ (μg•h/ml) | 11,0 ± 1,7 | 48,0 ± 19 | 157 ± 74 |
Cl/F (ml/min) | 464 ± 76 | 114 ± 34 | 36 ± 11 |
Ténofovir DF: Les paramètres pharmacocinétiques du ténofovir disoproxil 245 mg (sous forme de fumarate) ont été déterminés après administration d'une dose unique à des patients non infectés par le VIH ni par le VHB et présentant divers degrés d'insuffisance rénale. Le degré d'insuffisance rénale était défini en fonction de la valeur initiale de la clairance de la créatinine (ClCr) (fonction rénale normale: ClCr >80 ml/min; insuffisance rénale légère: ClCr = 50-79 ml/min; insuffisance rénale modérée: ClCr = 30-49 ml/min et insuffisance rénale sévère: ClCr = 10-29 ml/min).
L'exposition moyenne (% coefficient de variation [%CV]) au ténofovir a augmenté de 2'185 ng·h/ml (12%) chez les patients ayant une fonction rénale normale à 3'064 ng·h/ml (30%), 6'009 ng·h/ml (42%) et 15'985 ng·h/ml (45%) chez les patients présentant respectivement une insuffisance rénale légère, modérée et sévère.
Chez des patients présentant une insuffisance rénale terminale (IRT) (ClCr <10 ml/min), dialysés, l'exposition au ténofovir a augmenté de façon substantielle entre deux hémodialyses sur 48 heures, atteignant une Cmax moyenne de 1'032 ng/ml et une ASC0-48h moyenne de 42'857 ng·h/ml (+29%).
La pharmacocinétique du ténofovir n'a pas été étudiée chez les patients non dialysés dont la clairance de la créatinine est <10 ml/min, ni en IRT sous dialyse péritonéale ou autres types de dialyse.
Patients âgés
Une étude de phase I et une analyse pharmacocinétique de population n'ont révélé aucune différence cliniquement pertinente au niveau de la pharmacocinétique de la doravirine entre les personnes âgées de 65 ans et plus et les personnes de moins de 65 ans. La pharmacocinétique de la lamivudine et du ténofovir n'a pas été étudiée chez les patients de plus de 65 ans (voir «Posologie/Mode d'emploi»).
Enfants et adolescents
La pharmacocinétique et les recommandations de posologie de Delstrigo n'ont pas été examinées chez les patients de moins de 18 ans (voir «Posologie/Mode d'emploi»).
Origine ethnique
Doravirine: Une analyse pharmacocinétique de population portant sur l'utilisation de la doravirine chez des volontaires sains et des patients infectés par le VIH-1 n'a révélé aucune différence cliniquement pertinente entre différentes ethnies.
Lamivudine: On n'a pas constaté de différences significatives ou cliniquement pertinentes de la pharmacocinétique de la lamivudine entre différentes ethnies.
Ténofovir DF: Le nombre de membres de groupes ethniques non caucasiens examinés n'a pas été suffisant pour déterminer adéquatement des différences pharmacocinétiques potentielles entre ces populations après l'administration de ténofovir DF.
Sexe
Aucune différence cliniquement pertinente au niveau de la pharmacocinétique de la doravirine, de la lamivudine et du ténofovir n'a été identifiée entre les hommes et les femmes.
Données précliniques
Aucune étude chez l'animal n'a été réalisée sur Delstrigo. Les données suivantes se basent sur les résultats d'études séparées portant sur les différents constituants de Delstrigo (doravirine, lamivudine et ténofovir-DF).
Toxicité aiguë
Doravirine: Aucune étude de toxicité aiguë n'a été réalisée sur la doravirine.
Lamivudine: La lamivudine a fait l'objet d'études de toxicité aiguë chez la souris et le rat. Chez la souris, on n'a pas observé de surmortalité ni d'indices de toxicité pour l'organe cible après administration orale en aigu de doses très élevées (deux doses de 2000 mg/kg chacune) de lamivudine. L'administration intraveineuse unique de 2000 mg/kg de lamivudine a été bien tolérée par les souris comme par les rats; seuls des signes cliniques non spécifiques de relativement brève durée ont été observés, qui n'ont pas été mis en relation avec une toxicité pour l'organe cible.
Ténofovir DF: Le niveau de non-effet (NOEL = No-effect-Level) chez les rats ayant reçu une dose unique est de 1500 mg/kg. Chez le chien, les seuls effets observés d'une dose unique (jusqu'à 270 mg/kg) étaient une légère caryomégalie et/ou basophilie des cellules tubulaires rénales. Dans une étude des effets d'une dose unique sur la fonction rénale chez le rat, l'excrétion d'électrolytes par les urines et le volume urinaire étaient augmentés chez les animaux qui avaient reçu 500 mg/kg de ténofovir DF; la dose de 50 mg/kg n'a produit aucun effet. Après administration de ténofovir DF (0, 50 ou 500 mg/kg) à des rats pour l'évaluation des effets d'un repas de charbon activé sur le transit gastro-intestinal, la vidange gastrique était diminuée chez les animaux qui avaient reçu 500 mg/kg/jour; en revanche, la dose de 50 mg/kg/jour n'a produit aucun effet.
Toxicité en cas d'administration répétée
Doravirine: Dans des études de toxicité orale après administration répétée, la doravirine a été très bien tolérée par toutes les espèces d'animaux de laboratoire, y compris aux plus hautes doses testées. Aucun effet indésirable n'a été observé, ni aucun organe cible de toxicité identifié, chez des rats traités par 450 mg/kg/jour sur une période de 6 mois et des chiens qui ont reçu 1000 mg/kg/jour sur une période de 9 mois (ce qui représente respectivement env. 7 fois et 18 fois l'exposition au médicament après administration de la DHR).
Lamivudine: Dans des études de toxicité avec des doses orales répétées, la lamivudine a été très bien tolérée à des doses jusqu'à 2000 mg/kg deux fois par jour sur 6 mois chez le rat et à des doses jusqu'à 1000 mg/kg deux fois par jour sur une durée allant jusqu'à 12 mois chez le chien. Dans une étude de 3 mois menée chez le chien, on a observé des femelles mortes avec une posologie de 1500 mg/kg deux fois par jour. Les effets liés au traitement observés dans les études de toxicité chronique se limitaient à des altérations mineures de l'hématologie (essentiellement des paramètres érythrocytaires), de la chimie clinique et de l'analyse des urines aussi qu'à une hyperplasie muqueuse du cæcum (chez le rat). Les altérations hématologiques incluaient une diminution du nombre d'érythrocytes à tous les niveaux de dose, s'accompagnant d'une hausse des indices MCV et MCH et d'une diminution du nombre total de leucocytes, neutrophiles et de lymphocytes chez les animaux qui avaient reçu des doses élevées; il n'y a cependant pas eu d'effets sur la cytologie de la moelle osseuse. Le niveau de non-effet (pour les effets d'importance toxicologique) était de 450 mg/kg deux fois par jour chez le rat et de 45 mg/kg/jour chez le chien, ce qui correspond respectivement à environ 17 fois et 9 fois le niveau d'exposition d'un être humain à la DHR.
Ténofovir DF: Le ténofovir et le ténofovir DF ont provoqué une toxicité osseuse dans des études toxicologiques chez des rats, des chiens et des singes, dans lesquels des expositions (liées à l'ASC) de ≥6 fois de l'exposition humaine ont été réalisées. Chez les singes, la toxicité osseuse se manifestait par une ostéomalacie. L'ostéomalacie observée chez les singes était apparemment réversible après diminuation de la dose ou arrêt complet de ténofovir. Chez le rat et le chien, la toxicité osseuse se manifestait par une diminution de la densité minérale osseuse. On ignore le ou les mécanismes à l'origine de cette toxicité osseuse.
Une toxicité rénale a été mis en évidence dans les quatre espèces animales étudiées. Les animaux présentaient des niveaux variables d'élévation de la créatinine sérique, de l'azote uréique du sang, de la glucosurie, de la protéinurie, de la phosphaturie et/ou de la calciurie, ainsi que des diminutions des taux de phosphate sérique. Ces effets toxiques ont été observés pour des expositions (liées à l'ASC) de 2 à 20 fois de l'exposition humaine. On ignore dans quelle mesure les anomalies rénales, et notamment la phosphaturie, sont liées à la toxicité osseuse.
Génotoxicité
Doravirine: La doravirine ne s'est pas révélée génotoxique dans une batterie de tests in vitro et in vivo, y compris dans des tests de mutagénicité microbienne, des recherches d'aberrations chromosomiques dans les cellules CHO et des tests in vivo du micronoyau chez le rat.
Lamivudine: La lamivudine a été mutagène dans un essai sur un lymphome de souris L5178Y et clastogène dans un essai cytogénétique utilisant des lymphocytes humains en culture. La lamivudine n'a pas été mutagène dans un essai de mutagénicité microbienne, dans un essai de transformation cellulaire in vitro, dans un test du micronoyau chez le rat, dans un essai cytogénétique sur de la moelle osseuse de rat et dans un essai de synthèse non programmée de l'ADN sur foie de rat.
Ténofovir DF: Le ténofovir DF a été positif dans deux des trois études de génotoxicité in vitro. Le ténofovir DF a été positif dans le test in vitro de lymphome de souris, mais négatif dans le test in vivo du micronoyau.
Carcinogénicité
Doravirine: Des études de cancérogénicité à long terme par voie orale de la doravirine chez des souris et des rats n'ont montré aucun potentiel cancérogène à des expositions allant jusqu'à 6 fois (souris) et 7 fois (rats) l'exposition d'un être humain à la DHR.
Lamivudine: Des études de cancérogénicité à long terme par voie orale de la lamivudine chez des souris et des rats n'ont montré aucun potentiel cancérogène à des expositions allant jusqu'à 12 fois (souris) et 57 fois (rats) l'exposition d'un être humain à la DHR.
Ténofovir DF: Le ténofovir DF n'a montré aucun potentiel carcinogène lors d'une étude de carcinogénicité à long terme par voie orale chez le rat.
Une étude de carcinogénicité à long terme par voie orale chez la souris a révélé une faible incidence de tumeurs duodénales, probablement liées aux concentrations locales élevées de ténofovir DF dans le tractus gastro-intestinal à la posologie de 600 mg/kg/jour. Bien que le mécanisme de développement de ces tumeurs soit incertain, ces résultats ne semblent pas être cliniquement pertinents chez l'homme.
Toxicité sur la reproduction
Doravirine: Aucun impact sur la fertilité, le comportement reproductif ou le développement embryonnaire précoce n'a été observé après administration de doravirine à des rats, y compris à la plus haute dose testée. L'exposition systémique (ASC) à la doravirine équivalait à environ 7 fois l'exposition humaine à la DHR.
Lamivudine: La lamivudine n'a pas affecté la fertilité de rats mâles et femelles à des niveaux d'exposition équivalents à environ 112 fois l'exposition humaine à la DHR.
Ténofovir DF: Après administration de ténofovir DF à une dose correspondant à 10 fois la DHR (rapportée à la surface corporelle) à des rats mâles pendant les 28 jours précédant l'accouplement et à des rats femelles depuis le 15e jour précédant l'accouplement au 7e jour de gestation, aucun effet du ténofovir DF sur la fertilité, le comportement reproductif ou le début du développement embryonnaire n'a pu être observé. Chez les rates, par contre, le cycle estrogénique a été modifié.
Toxicité sur le développement
Doravirine: Des études de reproduction ont été réalisées chez des rats et des lapins avec administration orale de doravirine à des expositions environ 9 fois (rats) et 8 fois (lapins) supérieures à l'exposition humaine à la DHR sans effets sur le développement embryo-fœtal (rats et lapins) ou pré/postnatal (rats). La doravirine a été administrée oralement à des lapines gestantes à des doses jusqu'à 300 mg/kg/jour du 7e au 20e jour de gestation, ainsi qu'à des rates gestantes à des doses jusqu'à 450 mg/kg/jour du 6e au 20e jour de gestation et du 6e jour de gestation au 20e jour d'allaitement/post-partum. Des études chez les rates et les lapines gestantes ont montré un transfert de la doravirine dans la circulation fœtale à travers le placenta, avec des concentrations plasmatiques fœtales jusqu'à 40% (lapins) et 52% (rats) des concentrations maternelles mesurées au 20e jour de gestation.
Un passage de la doravirine dans le lait maternel de rates a été constaté après administration orale (450 mg/kg/jour) du 6e jour de gestation au 14e jour d'allaitement; les concentrations dans le lait correspondaient à env. 1,5 fois celles mesurées dans le plasma maternel 2 heures après l'administration de doravirine au 14e jour d'allaitement.
Lamivudine: Des études de reproduction ont été réalisées chez des rats et des lapins avec administration orale de lamivudine à des doses générant des taux plasmatiques atteignant jusqu'à 32 fois la concentration mesurée chez l'être humain exposé à la DHR. Ces études n'ont pas mis en évidence de tératogénicité imputable à la lamivudine. Une létalité embryonnaire précoce a été observée chez le lapin à des exposition similaires à celles observées chez l'être humain; cet effet n'a pas été constaté chez le rat, même à des taux plasmatiques correspondant à 32 fois la concentration mesurée chez l'être humain. Des études sur des rates gestantes ont montré que la lamivudine passe dans la circulation fœtale à travers le placenta.
Ténofovir DF: Des études de reproduction chez le rat et le lapin qui recevaient des doses de ténofovir DF (rapportées à la surface corporelle) correspondant respectivement à 14 fois et 19 fois la DHR n'ont pas mis en évidence de lésions fœtales.
Remarques particulières
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 30 °C.
Conserver dans le flacon d'origine bien fermé pour protéger le contenu de l'humidité. Ne pas écarter le produit dessiccatif.
Tenir hors de la portée des enfants.
Numéro d’autorisation
67066 (Swissmedic).
Titulaire de l’autorisation
MSD MERCK SHARP & DOHME AG, Lucerne.
Mise à jour de l’information
Novembre 2020.
S-CCDS-MK1439A-T-122018+062020/96week-HA-round1+RCN000013688-CH
Відгуки (0)
Ви переглядали

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.

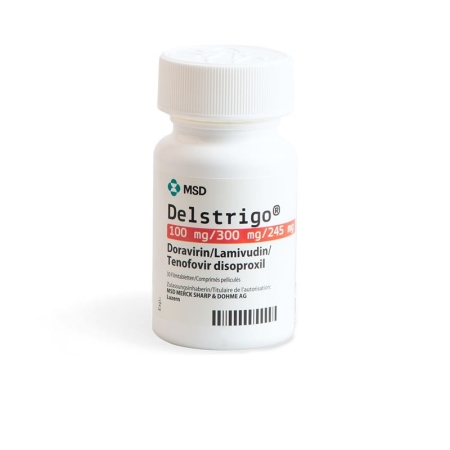


 Deutsch
Deutsch French
French Italian
Italian