Copaxone PEN Inj Lös 40 мг/мл попередньо заповнена ручка 12 х 1 мл
Copaxone PEN Inj Lös 40 mg/ml Fertigpen 12 x 1 ml
-
175752.29 RUB
При оплате криптовалютой:
Ваша прибыль 17575.23 RUB / 199.64 USDT
- Наявність: Немає в наявності
- Виробник: Mepha Schweiz AG
- Модель: 7771215
- ATC-код L03AX13
- EAN 7680674920021
Склад:
Опис
Was ist Copaxone Pen und wann wird es angewendet?
Auf Verschreibung des Arztes oder der Ärztin.
Copaxone Pen ist ein Arzneimittel, das zur Behandlung der schubförmigen multiplen Sklerose (MS) eingesetzt wird. Copaxone Pen wird angewendet, um die Häufigkeit von Schüben bei MS zu vermindern. Für MS-Formen, die nicht oder aufgrund des Fortschreitens der Erkrankung kaum mehr schubförmig oder mit überlagerten Schüben verlaufen, ist keine Wirkung nachgewiesen.
Der Wirkstoff von Copaxone Pen ist Glatiramer Acetat, ein synthetisches Polypeptid (eiweissartige Verbindung), das aus 4 natürlichen Aminosäuren besteht, nämlich L-Glutaminsäure, L-Alanin, L-Tyrosin und L-Lysin.
Copaxone Pen wird vom Patienten selbst subkutan (unter die Haut) injiziert.
Was sollte dazu beachtet werden?
Versichern Sie sich vor Beginn der Behandlung, dass Sie alle Informationen zu Copaxone Pen verstanden haben. Bei Unklarheiten informieren Sie sich bei Ihrem Arzt bzw. Ihrer Ärztin.
Wenden Sie Copaxone Pen erst an, wenn Sie von einer Fachperson genau über die Technik der Selbstinjektion instruiert worden sind.
Copaxone Pen darf ausschliesslich subkutan (unter die Haut) injiziert werden.
Wann darf Copaxone Pen nicht angewendet werden?
Copaxone Pen darf bei bekannter Überempfindlichkeit gegen Glatiramer Acetat oder gegen Mannitol (Hilfsstoff von Copaxone Pen) nicht verwendet werden.
Wann ist bei der Anwendung von Copaxone Pen Vorsicht geboten?
Die einzige empfohlene Verabreichungsart ist die Injektion unter die Haut.
Ihr Arzt bzw. Ihre Ärztin wird Ihnen die Technik der Selbstinjektion zeigen. Er bzw. sie oder eine andere Fachperson wird Sie auch bei der ersten Selbstinjektion und in den darauffolgenden 30 Minuten bei Beginn oder Wiederaufnahme der Behandlung beaufsichtigen.
Innerhalb von Minuten nach der Injektion von Copaxone Pen können Reaktionen mit mindestens einer der folgenden Beschwerden auftreten: Gefässerweiterung, Brustschmerzen, Atemnot, Herzklopfen und beschleunigter Herzschlag. Die meisten dieser Reaktionen gehen innerhalb kurzer Zeit zurück. Sollte eine Reaktion nicht zurückgehen, oder wenn eine andere schwere Nebenwirkung auftritt, müssen Sie unverzüglich Ihren Arzt bzw. Ihre Ärztin oder einen Notfallarzt bzw. eine Notfallärztin benachrichtigen, und die Behandlung mit Copaxone Pen abbrechen.
Sollten bei Ihnen bereits Herz- oder Nierenerkrankungen bestehen, sollten Sie Ihren Arzt bzw. Ihre Ärztin informieren, da Sie in diesen Fällen regelmässige Untersuchungen und Tests benötigen könnten.
Es kann zu ernsthaften Überempfindlichkeitsreaktionen (z.B. Verkrampfung der Muskulatur der Atemwege, schwere allergische Reaktionen oder Nesselsucht) kommen. Über Schüttelkrampf (epileptischer Anfall) wurde ebenfalls berichtet. Bei schwerwiegenden Reaktionen müssen Sie sofort Ihren Arzt bzw. Ihre Ärztin informieren und die Behandlung mit Copaxone Pen abbrechen.
Informieren Sie Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbst gekaufte!) einnehmen oder äusserlich anwenden!
Darf Copaxone Pen während einer Schwangerschaft oder in der Stillzeit angewendet werden?
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie Ihren Arzt um Rat und um Überprüfung der Behandlung mit Copaxone Pen während der Schwangerschaft und/oder Stillzeit.
Es ist nicht bekannt, ob Glatiramer Acetat in die Muttermilch ausgeschieden wird. Es empfiehlt sich daher, während der Behandlung mit diesem Medikament nicht zu stillen.
Wie verwenden Sie Copaxone Pen?
Wenden Sie Copaxone Pen immer genau nach der Anweisung des Arztes an.
Bitte fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht ganz sicher sind.
Die empfohlene Dosierung bei Erwachsenen beträgt 40 mg Copaxone (1 Fertigpen) angewendet als dreimal wöchentliche Injektion unter die Haut im Abstand von mindestens 48 Stunden. Es wird empfohlen, das Arzneimittel stets an den gleichen Wochentagen zu injizieren. Bei Kindern und Jugendlichen unter 18 Jahren sollte Copaxone Pen nicht angewendet werden.
Es ist sehr wichtig, dass Copaxone Pen richtig injiziert wird:
- Ausschliesslich in das Gewebe unter der Haut (Subkutangewebe) (siehe «Anleitung zur Durchführung der Injektion» am Ende dieser Packungsbeilage).
- Im Dosierungsabstand (mindestens 48 Stunden), den der Arzt verordnet hat
- Verwenden Sie jeden Fertigpen nur ein Mal. Nicht verwendetes Arzneimittel oder Abfallmaterial müssen entsorgt werden.
- Der Inhalt eines Fertigpens Copaxone 40 mg/ml darf nicht mit anderen Arzneimitteln oder Substanzen gemischt oder gleichzeitig verabreicht werden.
- Kontrollieren Sie durch das Sichtfenster an der Seite des Fertigpens, wie die Lösung aussieht. Verwenden Sie die Lösung nicht, wenn sie sichtbare Teilchen enthält. Nehmen Sie einen neuen Fertigpen.
Bevor Sie Copaxone Pen zum ersten Mal selbst anwenden, müssen Sie von medizinischem Fachpersonal in die Technik der Selbstinjektion eingewiesen werden. Um sicherzugehen, dass keine Probleme auftreten, führen Sie Ihre erste Injektion unter Aufsicht von medizinischem Fachpersonal durch und bleiben anschliessend etwa 30 Minuten unter Beobachtung.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin. Beenden Sie die Behandlung nie ohne Erlaubnis Ihres Arztes oder Ihrer Ärztin.
Sollten Sie einmal eine Injektion vergessen haben, so holen Sie diese nach, sobald Sie sich daran erinnern, wobei die darauf folgende Injektion erst wieder mindestens 48 Stunden später erfolgen sollte. Machen Sie also keine zusätzlichen Injektionen zwecks Kompensation der vergessenen Dosis. Wenn möglich, sollten Sie in der folgenden Woche wieder zu Ihrem gewohnten Anwendungsschema zurückkehren.
Lesen Sie die am Ende dieser Packungsbeilage aufgeführten Anweisungen sorgfältig durch, bevor Sie Copaxone Pen zum ersten Mal anwenden, und beachten Sie die entsprechenden Abbildungen genau.
Welche Nebenwirkungen kann Copaxone Pen haben?
Als häufigste Nebenwirkung wurden Reaktionen an der Injektionsstelle berichtet. Die häufigsten örtlichen Reaktionen waren: Hautrötung, Schmerz, Quaddelbildung, Juckreiz, Wassereinlagerung im Gewebe, Entzündung und Überempfindlichkeit an der Injektionsstelle.
Es können folgende Reaktionen innerhalb von Minuten nach der Anwendung auftreten: Gefässerweiterung, Brustschmerz, Schwierigkeiten beim Atmen, Herzklopfen oder beschleunigter Herzschlag.
In der Mehrzahl der Fälle sind diese Ereignisse vorübergehender Natur, klingen ohne Behandlung ab und hinterlassen keine Folgen. Diese Nebenwirkungen können sowohl zu Beginn der Behandlung wie auch nach mehreren Monaten auftreten; sie können sowohl einmalig als auch mehrfach auftreten.
Ausserdem können folgende Nebenwirkungen auftreten:
Sehr häufig (betrifft mehr als einen von 10 Anwendern)
- Infektionen, Grippe;
- Kopfschmerzen;
- Angst, Depression;
- Gefässerweiterung;
- erschwerte Atmung;
- Übelkeit;
- Hautausschlag;
- Gelenkschmerzen, Rückenschmerzen;
- Erschöpfung, Brustschmerzen, Reaktionen an der Injektionsstelle, Schmerzen.
Häufig (betrifft 1 bis 10 von 100 Anwendern)
- Bronchitis;
- Funktionsstörungen des Mastdarmes, Verstopfung, Zahnkaries, Verdauungsstörungen, Schluckstörungen, Darminkontinenz, Erbrechen;
- Brechdurchfälle, Herpesbläschen, Mittelohrentzündung, Schnupfen, Zahnabszess, Pilzinfektion der Scheide;
- gutartige Neubildung von Haut, Neubildung von Körpergewebe;
- Überempfindlichkeit;
- Schwellung der Lymphknoten;
- Appetitlosigkeit, Gewichtszunahme;
- Nervosität;
- Geschmacksstörungen, krampfartig erhöhte Muskelspannung, Migräne, Sprachstörungen, Ohnmacht, Zittern;
- Doppeltsehen, Funktionsstörungen der Augen;
- Herzklopfen und Herzrasen;
- Ohrenschmerzen;
- Husten, Heuschnupfen;
- abnormaler Leberfunktionstest;
- kleinflächige Hautblutung, Schwitzen, Juckreiz, Störung der Haut, Nesselsucht;
- Nackenschmerzen;
- Harndrang, häufiges Wasserlassen, Harnverhalten;
- Schüttelfrost, geschwollenes Gesicht, Gewebeschwund an der Injektionsstelle, örtliche Reaktionen, Wassereinlagerungen, Fieber.
Gelegentlich (betrifft 1 bis 10 von 1000 Anwendern)
- Abszess, Zellulitis, Furunkel, Gürtelrose, Nierenbeckenentzündung;
- Hautkrebs;
- Veränderung in Anzahl und Form der weissen Blutkörperchen, Milzvergrösserung, geringe Anzahl an Blutplättchen;
- schwere allergische Reaktion;
- Vergrösserung der Schilddrüse, Schilddrüsenüberfunktion;
- Alkohol-Unverträglichkeit, Gicht, erhöhte Blutfette, Veränderungen im Blut (erhöhter Natriumgehalt, verringerter Eisengehalt);
- ungewöhnliche Träume, Verwirrtheit, gehobene Stimmung, Sinnestäuschung, Feindseligkeit, manische Reaktionen, Persönlichkeitsstörung, Selbstmordversuch;
- Taubheit und Schmerzgefühl in der Hand, Wahrnehmungsstörung, Schüttelkrampf, Schreibstörung, Leseschwäche, Bewegungsstörungen, Muskelzuckung, Nervenentzündung, Muskelsperre, Augenbewegungen, Lähmung, Fallfuss, geistig-körperliche Erstarrung (Stupor), Gesichtsfeldstörungen, Sprechstörungen;
- Trübung der Augenlinse (Katarakt), Hornhautläsionen, trockenes Auge, Augenblutung, Herabhängen des Augenlides, erweiterte Pupillen, Schädigung des Sehnerves;
- Herzrhythmusstörungen (zusätzliche Herzschläge, langsamer oder plötzlich beschleunigter Herzschlag);
- Krampfadern;
- Atemstillstand, Erstickungsgefühl, Nasenbluten, beschleunigte Atmung, Engegefühl im Hals, Funktionsstörung der Lunge, Atmungsstörung;
- Entzündung des Dickdarmes, Entzündung des Dünndarmes, Dickdarmpolypen, Aufstossen, Geschwür der Speiseröhre, Zahnfleischentzündung, Blutung des Mastdarmes, Vergrösserung der Speicheldrüse;
- Gallensteine, Vergrösserung der Leber;
- Schwellung der Haut und/oder der Schleimhäute (Angioödem), Kontaktekzem der Haut, Hautknötchen, Knötchenrose (erythema nodosum);
- Entzündung der Gelenke (Arthritis oder Osteoarthritis), Schleimbeutelentzündung, Flankenschmerzen, verringerte Muskelmasse;
- blutiger Urin und Störungen des Harnapparates, Nierensteine, Harnanomalie;
- Schwangerschaft, Wochenbett und perinatale Beschwerden: Fehlgeburt;
- Brustschwellung, Erektionsstörungen, Beckenvorfall, Dauererektion, anormaler Gebärmutterhalsabstrich, Störungen der äusseren weiblichen Geschlechtsorgane, Störungen der Scheide, der Hoden und der Prostata, Scheidenblutung;
- Zyste, Katergefühl, allgemeine Unterkühlung, unspezifische Entzündungen, Gewebszerstörung (Nekrose) an der Injektionsstelle, Schleimhautstörung;
- Post-Impfungs-Syndrom.
Selten (betrifft 1 bis 10 von 10'000 Anwendern)
- T-Zellen Lymphom;
- akutes Herzversagen.
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin. Dies gilt insbesondere auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Was ist ferner zu beachten?
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Lagerungshinweis
Im Kühlschrank (2-8°C) und vor Licht geschützt lagern.
Wenn die COPAXONE PEN Fertigpens nicht im Kühlschrank gelagert werden können, können sie einmalig bis zu einem Monat außerhalb des Kühlschranks zwischen 15°C und 25°C aufbewahrt werden. Wenn die Fertigpens nicht innerhalb eines Monats angewendet wurden und sich noch in der Originalverpackung befinden, müssen sie wieder im Kühlschrank gelagert werden.
Nicht einfrieren.
Fertigpens, die gefroren waren, müssen vernichtet werden.
Ein Fertigpen darf nur einmal verwendet werden.
Ausser Reichweite von Kindern aufbewahren.
Weitere Auskünfte erteilt Ihnen Ihr Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Copaxone Pen enthalten?
Copaxone Pen Injektionslösung im Fertigpen enthält 1 ml einer sterilen, klaren Lösung.
Wirkstoffe
Glatiramer Acetat (40 mg/ml)
Hilfsstoffe
Mannitol (40 mg), Wasser für Injektionszwecke.
Zulassungsnummer
67492 (Swissmedic).
Wo erhalten Sie Copaxone Pen? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Copaxone Pen ist erhältlich in Packungen mit 3 oder 12 Fertigpens mit 1 ml Injektionslösung.
Zulassungsinhaberin
Teva Pharma AG, Basel.
Diese Packungsbeilage wurde im August 2019 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Interne Versionsnummer: 1.2
Anleitung zur Durchführung der Injektion
Lesen Sie die folgende Anleitung zur Durchführung der Injektion sorgfältig durch, bevor Sie sich COPAXONE PEN injizieren.
Bewahren Sie die Anleitung zur Durchführung der Injektion auf, bis Sie alle Fertigpens dieser Packung aufgebraucht haben.
Der Fertigpen ist ein Einweginjektor und nur zur einmaligen Anwendung bestimmt.
Sobald das Arzneimittel injiziert ist, wird die Nadel automatisch abgedeckt.
WARNHINWEISE UND VORSICHTSMASSNAHMEN
Berühren Sie nach dem Abziehen der Kappe nicht die Nadel, um sie nicht zu verunreinigen.
Versuchen Sie nicht, einen Fertigpen mehrfach zu verwenden, da dies zu Verletzungen oder Verunreinigungen führen kann.
Befüllen Sie den Pen nicht mit anderen Arzneimitteln.
Tauschen Sie keine Bestandteile des Pens aus.
SO SIEHT DER FERTIGPEN VOR DER ANWENDUNG AUS

SO SIEHT DER FERTIGPEN NACH DER ANWENDUNG AUS

Der blaue Kolben schiebt sich bei der Injektion immer weiter in das Sichtfenster; wenn er das Sichtfenster ausfüllt, ist die Injektion abgeschlossen.
Halten Sie den Pen bei der Injektion so, dass Sie das Sichtfenster gut sehen können.
Anmerkung: Wenn der blaue Kolben das Sichtfenster ausfüllt, ist auch der graue Stopfen immer noch zu sehen, so wie hier im Bild gezeigt (schwarzer Pfeil).
1. NEHMEN SIE DEN FERTIGPEN AUS DER PACKUNG
Entnehmen Sie einen Fertigpen aus der Packung.

2. LEGEN SIE DAS MATERIAL BEREIT
Legen Sie die folgenden Materialien auf einer sauberen, ebenen Oberfläche bereit:
- 1 Fertigpen
- 1 Alkoholtupfer (nicht in der Packung enthalten)
- 1 Mullkompresse oder Wattebausch (nicht in der Packung enthalten)
- 1 durchstichsicherer Abfallbehälter für scharfe und spitze Instrumente (nicht in der Packung enthalten)
Wenn Sie noch keinen Spritzen-Abfallbehälter haben, sprechen Sie mit Ihrem Apotheker oder zuständigen Fachperson.
3. ÜBERPRÜFEN SIE DEN FERTIGPEN
Prüfen Sie, dass der Fertigpen keine Beschädigung aufweist (z. B. einen Sprung oder ein Leck).
Prüfen Sie, dass der Fertigpen mit «COPAXONE PEN» beschriftet ist.
Prüfen Sie das Verfallsdatum.
Verwenden Sie den Fertigpen nicht, wenn das Verfallsdatum überschritten oder der Fertigpen beschädigt ist, oder wenn man Ihnen nicht das richtige Arzneimittel gegeben hat.
Verwenden Sie den Fertigpen nicht, wenn die Kappe fehlt oder beschädigt ist.
Dies ist wichtig, da in diesem Fall die Verwendung des Fertigpens und des Arzneimittels möglicherweise nicht sicher ist.
Prüfen Sie, dass die Lösung im Sichtfenster klar aussieht.
Anmerkung: Kleinere Luftblasen können in der Flüssigkeit zu sehen sein; sie sind unbedenklich und können mit injiziert werden. Versuchen Sie nicht, die Luftblasen vor der Injektion aus der Lösung zu entfernen.

Verwenden Sie den Fertigpen nicht, wenn die Lösung sichtbare Teilchen (Partikel) enthält. Verwenden Sie den Fertigpen nicht, wenn die Lösung gefroren ist oder gefroren war.
Dies ist wichtig, da in diesem Fall die Verwendung des Arzneimittels möglicherweise nicht sicher ist.
4. WARTEN SIE 20 MINUTEN
Legen Sie den Fertigpen auf eine saubere, ebene Oberfläche.
Wenn Sie den Fertigpen im Kühlschrank aufbewahrt haben, warten Sie 20 Minuten, damit sich das Arzneimittel auf Raumtemperatur erwärmt.

Anmerkung: Es ist nicht schädlich, das Arzneimittel kalt zu injizieren, aber die Injektion könnte dann unangenehmer sein.
Setzen Sie den Fertigpen nicht direkter Sonneneinstrahlung aus; dies könnte dem Arzneimittel schaden.
Erwärmen Sie den Fertigpen nicht auf andere Weise als beschrieben; dies könnte dem Arzneimittel schaden.
5. WASCHEN SIE DIE HÄNDE
Waschen Sie sich die Hände mit Wasser und Seife und trocknen Sie sie mit einem sauberen Handtuch gründlich ab.
6. WÄHLEN SIE EINE INJEKTIONSSTELLE AUS UND BEREITEN SIE SIE VOR
Wählen Sie eine Injektionsstelle aus einem der in den Abbildungen dargestellten Bereiche. Für die Injektion kommen sieben Körperbereiche infrage:
Bereich 1: Bauchregion rund um den Bauchnabel, ausgenommen ein Bereich von 5 cm um den Bauchnabel herum

Bereich 2 und 3: Oberschenkel (oberhalb der Knie)

Bereich 4, 5, 6 und 7: Rückseite der Oberarme und obere Hüften (unterhalb der Taille)

Innerhalb jedes Injektionsbereichs gibt es verschiedene Injektionsstellen. Wählen Sie für jede Injektion eine andere Stelle. Dadurch wird die Wahrscheinlichkeit für Reizungen oder Schmerzen an der Injektionsstelle geringer. Wechseln Sie die Injektionsbereiche und auch die Injektionsstellen innerhalb eines Bereichs. Stechen Sie nicht immer wieder in dieselbe Stelle.
Hinweis:
Sie sollten in Erwägung ziehen, einen Plan für den Wechsel der Injektionsstellen zu erstellen und dies in einem Tagebuch zu vermerken. An einigen Körperstellen könnte die Selbstinjektion schwierig sein (etwa an der Rückseite der Arme). Wenn Sie in diese Stellen injizieren möchten, benötigen Sie möglicherweise Hilfe.
Reinigen Sie die ausgewählte Injektionsstelle mit einem ungebrauchten Alkoholtupfer.
Warten Sie 10 Sekunden, um die Haut vor der Injektion trocknen zu lassen.
Injizieren Sie COPAXONE PEN nicht in eine Stelle, die schmerzt oder verfärbt ist oder an der Sie verhärtete Knoten oder Beulen spüren.
Injizieren Sie nicht durch die Kleidung hindurch.
Wählen Sie nicht öfter als 1‑mal pro Woche dieselbe Injektionsstelle für den Fertigpen.
7. ZIEHEN SIE DIE SCHUTZKAPPE AB
Halten Sie den Fertigpen fest in der einen Hand.
Greifen Sie mit der anderen Hand die Schutzkappe wie hier gezeigt und ziehen Sie sie gerade vom Pen ab.
Ziehen Sie die Schutzkappe nicht mit dem Mund bzw. den Zähnen ab.
Werfen Sie die Schutzkappe sofort weg.

Versuchen Sie nicht, die Schutzkappe wieder aufzusetzen, da dies zu Verunreinigungen führen könnte.
Berühren Sie nach dem Abziehen der Kappe nicht die Nadel, um sie nicht zu verunreinigen.
Setzen Sie die Schutzkappe nicht wieder auf, auch wenn der Fertigpen noch unbenutzt ist.
8. FÜHREN SIE DIE INJEKTION DURCH
A) Setzen Sie den Fertigpen im rechten Winkel (90°) an der gewählten Injektionsstelle auf die Haut auf.

B) Setzen Sie den Fertigpen so auf, dass Sie das Sichtfenster sehen können. Drücken Sie den Fertigpen herunter und halten Sie ihn etwa 15 Sekunden lang gedrückt. Lassen Sie mit dem Druck nicht nach, bis der folgende Vorgang vollständig abgelaufen ist: | ||
Sie hören ein erstes «Klicken» (die Injektion beginnt; Sie sehen, wie sich der blaue Kolben bewegt) | Sie hören ein zweites «Klicken» (etwa 5–10 Sekunden nach dem ersten Klicken) | Sie warten weitere 5 Sekunden (um sicherzugehen, dass das gesamte Arzneimittel injiziert wird) |
| ||
Anmerkung: Nachdem der Nadelschutzschild vollständig zurückgeschoben wurde, wird die Nadel in die Haut eingestochen. | ||
C) Prüfen Sie, dass der blaue Kolben nun das Sichtfenster ausfüllt, und entfernen Sie dann den Fertigpen von der Haut.

Anmerkung: Wenn der blaue Kolben ganz heruntergedrückt ist, ist immer noch der graue Stopfen zu sehen (siehe Pfeil).
9. ENTSORGUNG
Entsorgen Sie den gebrauchten Fertigpen sofort in einen Spritzen-Abfallbehälter oder in einen durchstichsicheren Abfallbehälter.
Entsorgen Sie gebrauchte Fertigpens nicht im Haushaltsabfall, sondern entsorgen Sie sie ordnungsgemäß in einen Spritzen-Abfallbehälter oder in einen durchstichsicheren Abfallbehälter, so wie Ihr Arzt oder anderes medizinisches Fachpersonal es Ihnen empfohlen hat.
10. VERSORGEN SIE DIE INJEKTIONSSTELLE
Untersuchen Sie die Injektionsstelle.
Wenn Sie einen Blutstropfen sehen, können Sie einen sauberen Wattebausch oder eine saubere Mullkompresse auf die Injektionsstelle drücken.
Wenn Sie möchten, können Sie ein Pflaster auf die Injektionsstelle kleben.
Reiben Sie nicht die Injektionsstelle; dies kann Beschwerden hervorrufen.
DIE INJEKTION IST ABGESCHLOSSEN
Qu’est-ce que Copaxone Pen et quand doit-il être utilisé?
Selon prescription du médecin.
Copaxone Pen est un médicament indiqué pour le traitement des formes récurrentes de la sclérose en plaques (SEP). Copaxone Pen est utilisé pour réduire la fréquence des poussées de SEP.
Aucune efficacité n'a été prouvée sur les formes de SEP qui n'évoluent pas ou peu en poussées - en raison de leur stade avancé - ou qui évoluent avec poussées superposées.
Le principe actif de Copaxone Pen est l'acétate de glatiramère, un polypeptide synthétique (agent protéique) se composant de 4 acides aminés naturels: l'acide L-glutamique, la L-alanine, la L-tyrosine et la L-lysine.
Copaxone Pen est injecté par voie sous-cutanée (sous la peau) par les patients eux-mêmes.
De quoi faut-il tenir compte en dehors du traitement?
Avant le début du traitement, assurez-vous que vous avez compris toutes les informations concernant Copaxone Pen. En cas de doute, demandez à votre médecin.
N'utilisez Copaxone Pen qu'après avoir été exactement informé(e) de la technique d'auto-injection par un professionnel.
Copaxone Pen est destiné exclusivement à une injection sous-cutanée (sous la peau).
Quand Copaxone Pen ne doit-il pas être utilisé?
En cas d'hypersensibilité connue à l'acétate de glatiramère ou au mannitol (excipient dans Copaxone Pen), Copaxone Pen ne doit pas être utilisé.
Quelles sont les précautions à observer lors de l’utilisation de Copaxone Pen?
La seule voie d'administration recommandée est l'injection sous la peau.
Votre médecin vous montrera la technique d'auto-injection. Votre médecin ou un autre professionnel vous surveillera lors de la première auto-injection et pendant les 30 minutes qui suivront au début du traitement ou en cas de reprise du traitement.
Dans les minutes qui suivent l'injection de Copaxone Pen, des réactions comportant au moins l'un des symptômes suivants peuvent survenir: dilatation vasculaire, douleurs dans la poitrine, difficultés respiratoires, palpitations cardiaques ou accélération du rythme cardiaque. La plupart de ces réactions disparaissent rapidement. Si une réaction ne disparait pas ou si un autre effet indésirable grave survient, vous devez consulter immédiatement votre médecin ou un médecin urgentiste et arrêter le traitement par Copaxone Pen.
Si vous souffrez déjà d'une maladie cardiaque ou rénale, vous devez en informer votre médecin, car dans ce cas il demandera probablement de vous soumettre à des examens et à des tests réguliers.
Des réactions d'hypersensibilité sérieuses (par ex. contractions violentes des muscles respiratoires, réactions allergiques sévères ou urticaire) ainsi que des cas de convulsions (crise d'épilepsie) ont également été rapportés. En cas de réaction grave, vous devez en informer immédiatement votre médecin et arrêter le traitement par Copaxone Pen.
Veuillez informer votre médecin ou votre pharmacien si
- vous souffrez d'une autre maladie
- vous êtes allergique
- vous prenez ou utilisez déjà d'autres médicaments en usage interne ou externe (même en automédication!).
Copaxone Pen peut-il être utilisé pendant la grossesse ou l’allaitement?
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin et demandez-lui de contrôler le traitement par Copaxone Pen pendant la grossesse et/ou l'allaitement.
On ne sait pas si l'acétate de glatiramère passe dans le lait maternel. Il est donc recommandé de ne pas allaiter lors de l'utilisation de ce médicament.
Comment utiliser Copaxone Pen?
Lors de l'utilisation de Copaxone Pen, suivez toujours exactement les instructions de votre médecin.
En cas de doute, demandez conseil à votre médecin ou à votre pharmacien.
Chez les adultes, la dose est de 40 mg de Copaxone (1 stylo prérempli) administrée sous forme d'injection sous la peau trois fois par semaine à 48 heures d'intervalle minimum. Il est recommandé d'administrer le médicament les mêmes jours chaque semaine.
Copaxone Pen ne doit pas être utilisé chez les enfants et les adolescents de moins de 18 ans.
Il est très important d'injecter correctement Copaxone Pen:
- Exclusivement dans le tissu sous la peau (tissu sous-cutané) (voir «Instructions pour effectuer l'injection» à la fin de cette notice .
- À l'intervalle posologique (au moins 48 heures) prescrit par le médecin.
- N'utilisez le stylo prérempli qu'une seule fois. Les restes de médicament non utilisé et les déchets doivent être jetés.
- Le contenu d'un stylo prérempli de Copaxone 40 mg/ml ne doit pas être mélangé ou administré simultanément avec d'autres médicaments ou d'autres substances.
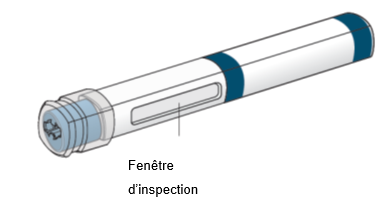
- Contrôlez l'aspect de la solution dans la fenêtre d'inspection latérale du stylo prérempli. N'utilisez pas la solution si elle contient des particules. Utilisez dans ce cas un nouveau stylo prérempli.
Avant d'utiliser vous-même Copaxone Pen pour la première fois, vous devez apprendre la technique d'auto-injection auprès du personnel médical. Afin de garantir l'absence de problème, réalisez votre première injection sous la surveillance du personnel médical et restez ensuite en observation pendant 30 minutes.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte. N'arrêtez jamais le traitement sans l'autorisation de votre médecin.
Si vous oubliez une injection, réalisez-la aussitôt que vous vous apercevez de votre oubli. Ne réalisez l'injection suivante que 48 heures plus tard au minimum. Ne réalisez donc pas d'injection supplémentaire pour compenser la dose oubliée. Si possible reprenez votre schéma d'administration habituel dans la semaine suivante.
Lisez attentivement les instructions à la fin de cette notice avant d'utiliser Copaxone Pen pour la première fois et respectez les figures correspondantes.
Quels effets secondaires Copaxone Pen peut-il provoquer?
Des réactions au site d'injection ont représenté les effets secondaires les plus fréquemment rapportés. Les réactions locales les plus fréquentes ont été les suivantes: rougeur de la peau, douleur, formation de vésicules, démangeaisons, rétention d'eau dans les tissus, inflammation et hypersensibilité au site d'injection.
Les réactions suivantes peuvent apparaitre dans les minutes suivant l'utilisation: dilatation vasculaire, douleur dans la poitrine, difficultés respiratoires, palpitations cardiaques ou accélération du rythme cardiaque.
Dans la plupart des cas, ces événements sont passagers. Ils disparaissent sans traitement et ne laissent pas de séquelles. Ces effets secondaires peuvent apparaître au début du traitement ou après plusieurs mois. Ils peuvent apparaître une ou plusieurs fois.
En outre, les effets secondaires suivants peuvent survenir:
Très fréquent (concerne plus d'un utilisateur sur 10)
- Infections, grippe;
- Maux de tête;
- Angoisse, dépression;
- Dilatation des vaisseaux;
- Difficultés respiratoires;
- Nausées;
- Éruptions cutanées;
- Douleurs articulaires, douleurs dorsales;
- Épuisement, douleurs dans la poitrine, réactions au site d'injection, douleur.
Fréquent (concerne 1 à 10 utilisateurs sur 100)
- Bronchite;
- Troubles fonctionnels du rectum, constipation, caries dentaires, troubles digestifs, troubles de la déglutition, incontinence fécale, vomissements;
- Gastro-entérite, vésicules herpétiques, otite moyenne, rhume, abcès dentaire, infection fongique vaginale;
- Excroissance cutanée bénigne, néoformation tissulaire;
- Hypersensibilité;
- Gonflement des ganglions lymphatiques;
- Manque d'appétit, prise de poids;
- Nervosité;
- Troubles du goût, augmentation de la contraction musculaire de type crampes, migraine, trouble de l'élocution, perte de conscience, tremblements;
- Vision double, troubles fonctionnels oculaires;
- Palpitations cardiaques et augmentation du rythme cardiaque;
- Douleurs dans les oreilles;
- Toux, rhume des foins;
- Résultats anormaux des tests de la fonction hépatique;
- Saignement cutané sur une faible surface, sudation, démangeaisons, troubles cutanés, urticaire;
- Douleurs dans la nuque;
- Miction impérieuse, mictions fréquentes, rétention d'urine;
- Grelottements, gonflement du visage, atrophie tissulaire au site d'injection, réactions locales, rétentions d'eau, fièvre.
Occasionnel (concerne 1 à 10 utilisateurs sur 1000)
- Abcès, cellulite, furoncle, zona, pyélonéphrite;
- Cancer de la peau;
- Modification du nombre et de la forme des globules blancs, augmentation du volume de la rate, diminution du nombre des plaquettes sanguines;
- Réaction allergique sévère;
- Augmentation du volume de la thyroïde, hyperthyroïdie;
- Intolérance à l'alcool, goutte, augmentation des lipides sanguins, modification du sang (augmentation du taux de sodium, diminution du taux de fer);
- Rêves inhabituels, confusion, euphorie, confusion des sens, agressivité, comportement maniaque, troubles de la personnalité, tentative de suicide;
- Engourdissement et sensation douloureuse dans la main, troubles de la perception, convulsions, troubles de l'écriture, troubles de la lecture, troubles des mouvements, tressaillement musculaires, inflammations nerveuses, tétanie musculaire, mouvements oculaires, paralysie, steppage du pied, stupeur, troubles du champ visuel, troubles de l'élocution;
- Opacification du cristallin (cataracte), lésions dans la cornée, sécheresse oculaire, saignement oculaire, affaissement de la paupière, dilatation des pupilles, endommagement du nerf optique;
- Troubles du rythme cardiaque (battements cardiaques supplémentaires, fréquence cardiaque ralentie ou soudainement accélérée);
- Varices;
- Arrêt de la respiration, sensation d'étouffement, saignement de nez, accélération de la respiration, sensation d'étroitesse dans la gorge, troubles fonctionnel des poumons, troubles de la respiration;
- Inflammation du côlon, inflammation de l'intestin grêle, polypes dans le côlon, renvois, ulcère dans l'œsophage, inflammation des gencives, saignement rectal, augmentation du volume des glandes salivaires;
- Calculs biliaires, augmentation du volume du foie;
- Gonflement de la peau et/ou des muqueuses (angio-œdème), eczéma de contact sur la peau, nodules cutanés, érythème noueux;
- Inflammation des articulations (arthrite ou ostéoarthrite), bursite, douleurs abdominales latérales, diminution de la masse musculaire;
- Sang dans les urines et troubles de l'appareil urinaire, calculs rénaux anomalies urinaires;
- Troubles de la grossesse, du post-partum et troubles périnataux: fausse-couche;
- Gonflement des seins, troubles de l'érection, affaissement du plancher pelvien, érection permanente, anomalie du frottis cervical, troubles des organes génitaux féminin externes, troubles vaginaux, troubles des testicules ou de la prostate, saignements vaginaux;
- Kyste, sensation de veisalgie, hypothermie généralisée, inflammations non spécifiques, destruction tissulaire (nécrose) au site d'injection, troubles des muqueuses;
- Syndrome post-vaccinal.
Rare (concerne 1 à 10 utilisateurs sur 10 000)
- Lymphome à cellules T;
- Insuffisance cardiaque aiguë.
Si vous remarquez des effets secondaires, veuillez en informer votre médecin ou votre pharmacien. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d'emballage.
A quoi faut-il encore faire attention?
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
Conserver au réfrigérateur (2-8°C) et à l'abri de la lumière.
Lorsque les stylos préremplis COPAXONE PEN ne peuvent pas être conservés au réfrigérateur, ils peuvent être conservés entre 15°C et 25°C une seule fois jusqu'à un mois à l'extérieur du réfrigérateur. Lorsque les stylos préremplis n'ont pas été utilisés dans le délai d'un mois et qu'ils se trouvent encore dans l'emballage d'origine, ils doivent être à nouveau conservés dans le réfrigérateur.
Ne pas congeler.
Les stylos préremplis qui ont été congelés doivent être détruits.
Un stylo prérempli ne doit être utilisé qu'une seule fois.
Conserver hors de portée des enfants.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Copaxone Pen?
Copaxone Pen solution injectable dans le stylo prérempli contient 1 ml d'une solution stérile et limpide.
Principes actifs
Acétate de glatiramère (40 mg/ml)
Excipients
Mannitol (40 mg), eau pour préparations injectables.
Numéro d’autorisation
67492 (Swissmedic).
Où obtenez-vous Copaxone Pen? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Copaxone Pen est disponible en emballages de 3 ou 12 stylos préremplis de 1 ml de solution injectable.
Titulaire de l’autorisation
Teva Pharma AG, Basel.
Cette notice d'emballage a été vérifiée pour la dernière fois en août 2019 par l'autorité de contrôle des médicaments (Swissmedic).
Numéro de version interne: 1.2
Instructions pour effectuer l’injection
Veuillez lire attentivement les instructions suivantes pour effectuer l’injection avant de procéder à l’injection par COPAXONE PEN.
Conservez ces instructions pour effectuer l’injection jusqu’à ce que tous les stylos préremplis de cet emballage aient été utilisés.
Le stylo prérempli est un injecteur à usage unique et destiné exclusivement à l’usage unique.
Dès que le médicament est injecté, l’aiguille est immédiatement recouverte.
MISES EN GARDE ET PRÉCAUTIONS
Ne touchez pas l’aiguille après avoir enlevé le capuchon afin de ne pas la contaminer.
N’essayez pas d’utiliser plusieurs fois un stylo prérempli, étant donné que ceci peut entraîner des blessures ou des contaminations.
Ne remplissez pas le stylo avec d’autres médicaments.
Ne remplacez aucun élément du stylo.
ASPECT D’UN STYLO PRÉREMPLI AVANT UTILISATION

ASPECT D’UN STYLO PRÉREMPLI APRÈS UTILISATION

Le piston bleu progresse toujours plus loin dans la fenêtre d’inspection après l’injection; lorsqu’il remplit la fenêtre d’inspection, l’injection est terminée.
Lors de l’injection, tenez le stylo de manière à toujours bien voir la fenêtre d’inspection.
Remarque: Lorsque le piston bleu remplit la fenêtre d’inspection, le bouchon gris est également encore visible, comme illustré ici (flèche noire).
1. PRÉLEVEZ LE STYLO PRÉREMPLI DE L’EMBALLAGE
Prélevez un stylo prérempli de l’emballage.

2. PRÉPAREZ LE MATÉRIEL
Rassemblez les éléments nécessaires à l’injection sur une surface propre et plane:
- 1 stylo prérempli
- 1 tampon imbibé d’alcool (non inclus dans l’emballage)
- 1 compresse de gaze ou un tampon de coton (non inclus dans l’emballage)
- 1 récipient résistant à la perforation pour l’élimination d’instruments coupants et pointus (non inclus dans l’emballage)
Si vous ne disposez pas encore d’un récipient pour l’élimination de seringues usagées, adressez-vous à votre pharmacien ou au professionnel de santé compétent.
3. CONTRÔLEZ LE STYLO PRÉREMPLI
Vérifiez que le stylo prérempli ne soit pas endommagé (p.ex. une fente ou une fuite).
Vérifiez que le stylo prérempli porte la mention «COPAXONE PEN».
Vérifiez la date de péremption.
N’utilisez pas le stylo prérempli lorsque la date de péremption est dépassée ou lorsque le stylo prérempli est endommagé ou lorsque l’on ne vous a pas donné le médicament adéquat.
N’utilisez pas le stylo prérempli lorsque le capuchon manque ou est endommagé.
Ceci est important, étant donné que dans ce cas l’utilisation du stylo prérempli et du médicament n’est éventuellement pas sûre.
Vérifiez que la solution dans la fenêtre d’inspection est limpide.
Remarque: Des petites bulles d’air peuvent être visibles dans le liquide; elles sont inoffensives et peuvent être injectées. N’essayez pas d’éliminer les bulles d’air de la solution avant l’injection.
N’utilisez pas le stylo prérempli lorsque la solution contient des particules visibles. N’utilisez pas le stylo prérempli lorsque la solution est congelée ou était congelée.
Ceci est important, étant donné que dans ce cas, l’utilisation du médicament n’est éventuellement pas sûre.
4. ATTENDEZ 20 MINUTES
Déposez le stylo prérempli sur une surface propre et plane.
Si vous avez conservé le stylo prérempli au réfrigérateur, attendez 20 minutes pour laisser le médicament atteindre la température ambiante.

Remarque: Il n’est pas nocif d’injecter le médicament froid, mais l’injection pourrait être alors plus désagréable.
N’exposez pas le stylo prérempli à la lumière directe du soleil; ceci pourrait endommager le médicament.
Ne réchauffez pas le stylo prérempli d’une autre manière que celle décrite; ceci pourrait endommager le médicament.
5. LAVEZ-VOUS LES MAINS
Lavez-vous les mains avec de l’eau et du savon et essuyez-les soigneusement avec une serviette propre.
6. CHOISISSEZ UN SITE D’INJECTION ET PRÉPAREZ-LE
Choisissez un site d’injection parmi les zones présentées sur les illustrations. Sept zones corporelles sont adéquates pour procéder à l’injection:
Zone 1 : la région abdominale autour du nombril, à l’exception de la zone à moins de 5 cm du nombril.

Zones 2 et 3: cuisse (au-dessus du genou).

Zones 4, 5, 6 et 7: arrière du bras et hanche supérieure (en dessous de la taille)

Plusieurs sites d’injection sont possibles dans chaque zone d’injection. Choisissez un autre site pour chaque injection. Ceci diminue la probabilité d’irritations ou de douleurs au site d’injection. Alternez les zones d’injection et également les sites d’injection dans une même zone. N’injectez pas toujours le produit exactement au même endroit.
Remarque: Vous devez envisager un plan d’alternance des sites d’injection et mentionner ceux-ci dans un journal. L’auto-injection pourrait s’avérer difficile dans certaines zones corporelles (comme p. ex. à l’arrière du bras). Si vous désirez procéder à l’injection du produit dans ces zones, vous aurez éventuellement besoin d’aide.
Nettoyez le site d’injection chosi avec un tampon imbibé d’alcool non usagé.
Attendez 10 secondes afin de laisser sécher la peau avant de procéder à l’injection.
N’injectez pas COPAXONE PEN dans une zone douloureuse ou colorée ou présentant des nodules durs ou des bosses.
N’injectez pas le produit à travers les vêtements.
N’utilisez pas le stylo prérempli au même site d’injection plus de 1 fois par semaine.
7. ENLEVEZ LE CAPUCHON DE PROTECTION
Maintenez fermement le stylo prérempli dans une main.
De l’autre main, saisissez le capuchon de protection comme illustré ici et retirez-le tout droit dans l’axe du stylo.
N’enlevez pas le capuchon de protection avec la bouche, resp. avec les dents.
Jetez immédiatement le capuchon de protection.

N’essayez pas de remettre le capuchon de protection en place, étant donné que ceci pourrait entraîner des contaminations.
Après avoir retiré le capuchon de protection, ne touchez pas l’aiguille afin de ne pas la contaminer. Ne remettez pas le capuchon de protection en place, même lorsque le stylo prérempli n’a pas encore été utilisé.
8. EFFECTUEZ L’INJECTION
A) Placez le stylo prérempli à angle droit (90°) sur la peau au site d’injection choisi.

B) Placez le stylo prérempli de manière à pouvoir voir la fenêtre d’inspection. Appuyez le stylo prérempli sur la peau et maintenez-le appuyé environ 15 secondes. Ne lâchez pas la pression aussi longtemps que le processus suivant n’est pas complètement effectué: | ||
Vous entendez un premier «clic» (l’injection commence; vous voyez le piston bleu se déplacer). | Vous entendez un second «clic» (environ 5–10 secondes après le premier clic). | Vous attendez encore 5 secondes (afin de vous assurer que la totalité du médicament a été injectée). |
| ||
C) Vérifiez que le piston bleu remplisse maintenant la fenêtre d’inspection et retirez alors le stylo prérempli de votre peau.

Remarque: Lorsque le piston bleu est complètement enfoncé, le bouchon gris est encore visible (voir flèche).
9. ÉLIMINATION
Éliminez le stylo prérempli usagé immédiatement dans un récipient pour seringues usagées ou dans un récipient pour déchets résistant à la perforation.
N’éliminez pas les stylos préremplis usagés avec les ordures ménagères, mais éliminez-les de manière appropriée dans un récipient pour seringues usagées ou dans un récipient pour déchets résistant à la perforation selon les recommandations de votre médecin ou autre professionnel de santé.
10. SOINS DU SITE D’INJECTION
Examinez le site d’injection.
Si vous voyez une goutte de sang, vous pouvez appuyez un tampon d’ouate propre ou une compresse de gaze propre sur le site d’injection.
Si vous le désirez, vous pouvez appliquer un pansement sur le site d’injection.
Ne frottez pas le site d’injection; ceci peut entraîner des irritations.
L’INJECTION EST TERMINÉE.
Che cos’è Copaxone Pen e quando si usa?
Su prescrizione medica.
Copaxone Pen è un medicamento che viene impiegato nel trattamento della sclerosi multipla (SM) recidivante. Copaxone Pen viene impiegato per ridurre la frequenza delle recidive di SM. Non è stata dimostrata alcuna efficacia nelle forme di SM a decorso non recidivante o non più recidivante a causa della progressione della malattia o caratterizzato da ricadute sovrapposte.
Il principio attivo di Copaxone Pen è glatiramer acetato, un polipeptide sintetico (una sostanza del tipo delle proteine) composto da 4 aminoacidi naturali: acido L-glutammico, L-alanina, L-tirosina e L-lisina.
Copaxone Pen viene iniettato per via sottocutanea (sotto la pelle) dal paziente stesso.
Di che cosa occorre inoltre tener conto durante il trattamento?
Prima dell'inizio del trattamento, si assicuri di aver compreso tutte le informazioni riguardanti Copaxone Pen. In caso di dubbi si rivolga al suo medico.
Inizi a usare Copaxone Pen solo dopo che un operatore sanitario le avrà mostrato la tecnica esatta dell'autoiniezione.
Copaxone Pen deve essere iniettato esclusivamente per via sottocutanea (sotto la pelle).
Quando non si può usare Copaxone Pen?
Copaxone Pen non deve essere utilizzato in caso di ipersensibilità nota al glatiramer acetato o al mannitolo (sostanza ausiliaria di Copaxone Pen).
Quando è richiesta prudenza nell’uso di Copaxone Pen?
L'unico modo di somministrazione consigliato è l'iniezione sotto la pelle.
Il medico le mostrerà la tecnica dell'autoiniezione. All'inizio o alla ripresa del trattamento, sarà sorvegliato da un medico o da un operatore sanitario anche durante la prima autoiniezione e nei 30 minuti successivi.
Entro alcuni minuti dopo l'iniezione di Copaxone Pen possono verificarsi reazioni comprendenti almeno uno dei seguenti disturbi: dilatazione dei vasi sanguigni, dolore al petto, affanno, palpitazioni e battito cardiaco accelerato. La maggior parte di queste reazioni regredisce entro poco tempo. Se una reazione non dovesse regredire o se compare un altro effetto collaterale grave deve informare immediatamente il suo medico o un medico d'urgenza e interrompere il trattamento con Copaxone Pen.
Se soffre di malattie al cuore o ai reni, informi il suo medico poiché in questi casi potrebbe essere necessario sottoporla regolarmente ad accertamenti ed esami.
Possono verificarsi reazioni di ipersensibilità serie (ad es. contrazione dei muscoli delle vie aeree, gravi reazioni allergiche o orticaria). Sono anche state segnalate convulsioni (attacchi epilettici). In caso di reazioni gravi deve informare immediatamente il medico e interrompere il trattamento con Copaxone Pen.
Informi il suo medico o il suo farmacista se
- soffre di altre malattie
- soffre di allergie o
- assume altri medicamenti (anche se acquistati di sua iniziativa) o li applica esternamente
Si può usare Copaxone Pen durante la gravidanza o l’allattamento?
Se è in stato di gravidanza o sta allattando, o se sospetta di essere incinta o prevede di avviare una gravidanza, chieda consiglio al suo medico, cui spetta il compito di monitorare il trattamento con Copaxone Pen durante la gravidanza e/o l'allattamento.
Non è noto se il glatiramer acetato venga escreto nel latte materno. Si raccomanda quindi di non allattare durante il trattamento con questo medicamento.
Come usare Copaxone Pen?
Usi sempre Copaxone Pen seguendo esattamente le istruzioni del medico.
Se ha dubbi, consulti il medico o il farmacista.
La posologia raccomandata negli adulti è di 40 mg di Copaxone (1 penna preriempita), somministrato come iniezione sottocutanea tre volte alla settimana, ad intervalli di almeno 48 ore. Si raccomanda di eseguire l'iniezione sempre negli stessi giorni della settimana. Copaxone Pen non deve essere usato nei bambini e negli adolescenti sotto i 18 anni.
È molto importante iniettare correttamente Copaxone Pen:
- Esclusivamente nei tessuti situati sotto la pelle (tessuto sottocutaneo) (vedere «Istruzioni per l'esecuzione dell'iniezione» alla fine del presente foglietto illustrativo).
- Osservando l'intervallo posologico (di almeno 48 ore) prescritto dal medico.
- Usi ogni penna preriempita una sola volta. Il medicamento non utilizzato e i rifiuti devono essere eliminati.
- Il contenuto di una penna preriempita di Copaxone 40 mg/ml non deve essere miscelato o somministrato contemporaneamente ad altri medicamenti o sostanze.
- Verifichi l'aspetto della soluzione attraverso la finestrella di controllo posta sul lato della penna preriempita.
Non usi la soluzione se contiene particelle visibili. Prenda una nuova penna preriempita.
Prima di utilizzare Copaxone Pen per la prima volta, un operatore sanitario deve mostrarle la tecnica dell'autoiniezione. Per assicurarsi che non insorgano problemi, pratichi la prima autoiniezione sotto la supervisione di un operatore sanitario e resti sotto sorveglianza medica per circa 30 minuti.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista. Non interrompa mai il trattamento senza il consenso del medico.
Se dimentica un'iniezione, la pratichi non appena se ne ricorda e lasci trascorrere nuovamente almeno 48 ore prima dell'iniezione successiva. Non pratichi cioè iniezioni aggiuntive per compensare la dimenticanza della dose. Se possibile, nella settimana successiva dovrebbe riprendere il suo consueto schema posologico.
Legga accuratamente le istruzioni riportate alla fine del presente foglietto illustrativo prima di usare Copaxone Pen per la prima volta e osservi attentamente le figure corrispondenti.
Quali effetti collaterali può avere Copaxone Pen?
Gli effetti collaterali più comuni sono state le reazioni nella sede di iniezione. Le reazioni locali più comuni sono state arrossamento cutaneo, dolore, pomfi, prurito, accumulo di liquidi nei tessuti, infiammazione e ipersensibilità nella sede di iniezione.
Le seguenti reazioni possono comparire entro pochi minuti dopo l'uso: dilatazione dei vasi sanguigni, dolore al petto, difficoltà respiratoria, palpitazioni o battito cardiaco accelerato.
Nella maggior parte dei casi questi eventi sono di natura passeggera, regrediscono senza alcun trattamento e sono privi di conseguenze. Questi effetti collaterali possono manifestarsi sia all'inizio del trattamento, sia dopo diversi mesi, e possono verificarsi una o più volte.
Inoltre possono manifestarsi i seguenti effetti collaterali:
Molto comune (riguarda più di 1 utilizzatore su 10)
- infezioni, influenza;
- mal di testa;
- ansia, depressione;
- dilatazione dei vasi sanguigni;
- respiro affannoso;
- nausea;
- eruzione cutanea;
- dolore alle articolazioni, dolore alla schiena;
- spossatezza, dolore al petto, reazioni nella sede di iniezione, dolore.
Comune (riguarda da 1 a 10 utilizzatori su 100)
- bronchite;
- disfunzione dell'intestino retto, stipsi, carie, disturbi della digestione, disturbi della deglutizione, incontinenza intestinale, vomito;
- diarrea con vomito, vescicole dell'herpes, otite media, raffreddore, ascesso dentale, infezione vaginale da funghi;
- neoformazione benigna della pelle, neoformazione di tessuti dell'organismo;
- ipersensibilità;
- gonfiore dei linfonodi;
- inappetenza, aumento del peso corporeo;
- nervosismo;
- alterazioni del gusto, aumento della tensione muscolare di tipo crampiforme, emicrania, disturbi del linguaggio, perdita di coscienza, tremore;
- visione doppia, disfunzioni dell'occhio;
- palpitazioni e battito cardiaco accelerato;
- mal di orecchie;
- tosse, raffreddore da fieno;
- alterazioni dei test di funzionalità epatica;
- piccole emorragie nella pelle, sudorazione, prurito, alterazioni della pelle, orticaria;
- dolore alla nuca;
- urgenza minzionale, minzione frequente, ritenzione urinaria;
- brividi, gonfiore del viso, atrofia della sede di iniezione, reazioni locali, accumulo di liquidi, febbre.
Non comune (riguarda da 1 a 10 utilizzatori su 1000)
- ascesso, cellulite, foruncoli, herpes zoster, infiammazione della pelvi renale;
- cancro della pelle;
- alterazioni del numero e della forma dei globuli bianchi, aumento di volume della milza, riduzione del numero di piastrine;
- reazioni allergiche gravi;
- aumento di volume della tiroide, iperattività della tiroide;
- intolleranza all'alcol, gotta, aumento dei lipidi nel sangue, alterazioni del sangue (aumento del sodio, riduzione del ferro);
- sogni anomali, confusione mentale, euforia, alterazioni sensoriali, ostilità, reazioni maniacali, disturbi della personalità, tentato suicidio;
- intorpidimento e dolore alla mano, disturbi della percezione, convulsioni, disturbi della scrittura, disturbi della lettura, disturbi della motilità, fascicolazioni muscolari, infiammazione dei nervi, paralisi muscolare, movimenti degli occhi, paralisi, piede cadente, torpore psicofisico, disturbi del campo visivo, disturbi della parola;
- opacità del cristallino (cataratta), lesioni della cornea, occhio secco, emorragia oculare, palpebra cadente, dilatazione delle pupille, lesione del nervo ottico;
- alterazioni del ritmo cardiaco (battiti aggiuntivi, battito rallentato o improvvisamente accelerato);
- vene varicose;
- arresto respiratorio, sensazione di soffocamento, perdite di sangue dal naso, respiro veloce, sensazione di costrizione alla gola, disfunzione polmonare, disturbi della respirazione;
- infiammazione dell'intestino crasso, infiammazione dell'intestino tenue, polipi nell'intestino crasso, eruttazioni, ulcera dell'esofago, infiammazione delle gengive, perdite di sangue nell'intestino retto, aumento di volume delle ghiandole salivari;
- calcoli biliari, aumento di volume del fegato;
- gonfiore della pelle e/o delle mucose (angioedema), eczema da contatto della pelle, noduli cutanei, eritema nodoso;
- infiammazione delle articolazioni (artrite o osteoartrite), infiammazione delle sinovie, dolore al fianco, riduzione della massa muscolare;
- sangue nelle urine e disturbi dell'apparato urinario, calcoli renali, anomalie a carico delle urine;
- disturbi della gravidanza, del puerperio e perinatali; aborto;
- gonfiore al petto, disturbi dell'erezione, prolasso di organi del bacino, erezione continua, anomalie allo striscio del collo dell'utero, disturbi degli organi genitali esterni femminili, disturbi a carico della vagina, dei testicoli e della prostata, perdite di sangue vaginali;
- cisti, sensazione simile ai postumi di un'ubriacatura, ipotermia generalizzata, infiammazioni non specifiche, distruzione dei tessuti (necrosi) della sede di iniezione, alterazioni delle mucose;
- sindrome postvaccinica.
Raro (riguarda da 1 a 10 utilizzatori su 10'000)
- linfoma a cellule T;
- scompenso cardiaco acuto.
Se osserva effetti collaterali, si rivolga al suo medico o al suo farmacista, soprattutto se si tratta di effetti collaterali non descritti in questo foglietto illustrativo.
Di che altro occorre tener conto?
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazione di stoccaggio
Conservare in frigorifero (2-8°C) e al riparo dalla luce.
Qualora non fosse possibile conservarle in frigorifero, le penne preriempite COPAXONE PEN possono essere tenute una sola volta fuori dal frigorifero fino ad un mese a una temperatura compresa tra 15°C e 25°C. Se le penne preriempite non vengono utilizzate entro un mese e si trovano ancora nella confezione originale, devono essere rimesse in frigorifero.
Non congelare.
Le penne preriempite precedentemente congelate devono essere distrutte.
Ogni penna preriempita deve essere utilizzata una sola volta.
Conservare fuori dalla portata dei bambini.
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Copaxone Pen?
Copaxone Pen soluzione iniettabile in penna preriempita contiene 1 ml di soluzione sterile trasparente.
Principi attivi
Glatiramer acetato (40 mg/ml)
Sostanze ausiliarie
Mannitolo (40 mg), acqua per preparazioni iniettabili.
Numero dell’omologazione
67492 (Swissmedic).
Dove è ottenibile Copaxone Pen? Quali confezioni sono disponibili?
In farmacia, dietro presentazione della prescrizione medica.
Copaxone Pen è disponibile in confezioni da 3 o 12 penne preriempite contenenti 1 ml di soluzione iniettabile.
Titolare dell’omologazione
Teva Pharma AG, Basel.
Questo foglietto illustrativo è stato controllato l'ultima volta nell'agosto 2019 dall'autorità competente in materia di medicamenti (Swissmedic).
Numero di versione interno: 1.2
Istruzioni per l'esecuzione dell'iniezione
Legga attentamente le seguenti istruzioni per l'esecuzione dell'iniezione prima di utilizzare COPAXONE PEN.
Conservi le istruzioni per l'esecuzione dell'iniezione fino a quando avrà utilizzato tutte le penne preriempite della confezione.
La penna preriempita è un dispositivo monouso destinato a un unico impiego.
Non appena iniettato il medicamento, l'ago viene automaticamente coperto.
AVVERTENZE E MISURE PRECAUZIONALI
Non tocchi l'ago dopo aver rimosso il cappuccio, in modo da non sporcarlo.
Non cerchi di utilizzare più volte una penna preriempita, per non correre il rischio di subire lesioni o di contaminare il prodotto.
Non riempia la penna con altri medicamenti.
Non sostituisca i componenti della penna.
COME APPARE LA PENNA PRERIEMPITA PRIMA DELL'USO

COME APPARE LA PENNA PRERIEMPITA DOPO L'USO

Durante l'iniezione, lo stantuffo blu avanza all'interno della finestrella di controllo; quando lo stantuffo riempie per intero la finestrella l'iniezione è terminata.
Durante l'iniezione tenga la penna in modo che la finestrella sia ben visibile.
Nota: quando lo stantuffo blu riempie completamente la finestrella, il tampone grigio è comunque visibile, così come appare nella figura (freccia nera).
1. TOGLIERE LA PENNA PRERIEMPITA DALLA CONFEZIONE
Estragga una penna preriempita dalla confezione.

2. PREPARAZIONE DEL MATERIALE
Predisponga i seguenti materiali su una superficie piana e pulita:
- 1 penna preriempita
- 1 tampone imbevuto di alcol (non incluso nella confezione)
- 1 compressa di garza o un batuffolo di cotone (non inclusi nella confezione)
- 1 contenitore non perforabile per lo smaltimento degli strumenti acuminati e appuntiti (non incluso nella confezione)
Se non possiede già un contenitore per la raccolta di siringhe usate, si rivolga al farmacista o all’addetto competente.
3. CONTROLLARE LA PENNA PRERIEMPITA
Verifichi che la penna preriempita non sia danneggiata (ad esempio, che non vi siano incrinature o perdite).
Verifichi che la penna preriempita riporti la dicitura «COPAXONE PEN».
Controlli la data di scadenza.
Non utilizzi la penna preriempita dopo la data di scadenza, se la penna è danneggiata o se non le è stato dato il medicamento corretto.
Non utilizzi la penna preriempita se il cappuccio manca o è danneggiato.
Si tratta di un'avvertenza importante, perché in questo caso l'utilizzo della penna preriempita e del medicamento potrebbe non essere sicuro.
Verifichi che la soluzione nella finestrella sia limpida.
Nota: possono essere visibili piccole bolle d'aria, del tutto innocue, che possono essere iniettate insieme alla soluzione. Non cerchi di eliminare le bolle d'aria dalla soluzione prima di eseguire l'iniezione.

Non utilizzi la penna preriempita se nella soluzione sono visibili particelle in sospensione. Non utilizzi la penna preriempita se la soluzione è o è stata congelata.
Presti attenzione a tale aspetto poiché in questo caso l'impiego del medicamento potrebbe non essere sicuro.
4. ATTENDERE 20 MINUTI
Posi la penna preriempita su una superficie piana e pulita.
Se ha conservato la penna preriempita in frigorifero, attenda 20 minuti in modo che il medicamento raggiunga la temperatura ambiente.

Nota: non è pericoloso iniettare il medicamento freddo, ma l'iniezione potrebbe risultare fastidiosa.
Non esponga la penna preriempita alla luce solare diretta, poiché potrebbe danneggiare il medicamento.
Non scaldi la penna preriempita in modi diversi da quello descritto, per non danneggiare il medicamento.
5. LAVARE LE MANI
Si lavi le mani con acqua e sapone e le asciughi accuratamente con un asciugamano pulito.
6. SCEGLIERE IL SITO DI INIEZIONE E PREPARARSI
Scelga il sito di iniezione tra una delle aree illustrate nelle figure. L'iniezione può essere eseguita in sette aree del corpo distinte:
Area 1: regione addominale attorno all'ombelico, osservando una distanza di 5 cm dall'ombelico stesso

Aree 2 e 3: coscia (sopra il ginocchio)

Aree 4, 5, 6 e 7: parte posteriore delle braccia e parte superiore dei fianchi (sotto la vita)

In ciascuna area vi sono diversi siti di iniezione. Scelga un sito diverso per ogni iniezione. In questo modo è meno probabile che vi si manifestino irritazioni o dolore. Cambi area per l'esecuzione dell'iniezione e anche i siti di iniezione in detta area. Non esegua l'iniezione sempre nello stesso sito.
Nota: Valuti la possibilità di elaborare un piano di variazione del sito di iniezione e ne prenda nota in un diario. In talune parti del corpo può essere difficile eseguire l'autoiniezione (ad esempio sulla parte posteriore del braccio). Se desidera eseguire l'iniezione in tali punti, è probabile che debba chiedere aiuto.
Disinfetti il sito di iniezione prescelto con un tampone nuovo imbevuto d'alcol nuovo.
Attenda 10 secondi in modo che la pelle si asciughi prima di eseguire l'iniezione.
Non esegua l'iniezione attraverso gli indumenti.
Non scelga lo stesso sito di iniezione per la penna preriempita più di una volta alla settimana.
7. RIMUOVERE IL CAPPUCCIO PROTETTIVO
Tenga la penna preriempita saldamente in una mano.
Con l'altra mano, afferri il cappuccio protettivo come illustrato nella figura e lo tolga dalla penna tenendolo ben dritto.
Non tiri il cappuccio protettivo con la bocca o con i denti.
Getti immediatamente il cappuccio protettivo.

Non cerchi di riposizionare il cappuccio protettivo, onde prevenire possibili contaminazioni.
Una volta rimosso il cappuccio, non tocchi l'ago per non contaminarlo.
Non rimetta il cappuccio protettivo, anche nel caso in cui la penna preriempita non sia stata ancora utilizzata.
8. ESEGUIRE L'INIEZIONE
A) Posizioni la penna preriempita perpendicolarmente (a 90°) a contatto con la cute sul sito di iniezione prescelto.

B) Posizioni la penna preriempita in modo da vedere la finestrella di controllo. Prema la penna preriempita verso il basso e la tenga premuta per circa 15 secondi. Non allenti la pressione fino a quando la procedura sotto descritta non è conclusa: | ||
Sentirà un primo «clic» (l'iniezione inizia; vedrà avanzare lo stantuffo blu) | Sentirà un secondo «clic» (all'incirca 5-10 secondi dopo il primo) | Attenda altri 5 secondi (onde assicurarsi che sia iniettato tutto il medicamento) |
| ||
Nota: una volta rientrata completamente la protezione dell'ago, quest'ultimo viene inserito nella cute. | ||
C) Verifichi che lo stantuffo blu riempia completamente la finestrella di controllo e rimuova quindi la penna preriempita dalla cute.

Nota: quando lo stantuffo blu è completamente premuto, il tampone grigio è comunque visibile (v. freccia).
9. SMALTIMENTO
Getti subito la penna preriempita usata in un contenitore per la raccolta delle siringhe usate o in un recipiente per rifiuti non perforabile.
Non smaltisca le penne preriempite usate con i rifiuti domestici ma le getti correttamente in un contenitore per la raccolta delle siringhe usate o in un recipiente per rifiuti non perforabile secondo le istruzioni fornitele dal medico o dal personale sanitario.
10. CONTROLLARE IL SITO DI INIEZIONE
Controlli il sito di iniezione.
Qualora vi sia del sangue, eserciti pressione sul sito di iniezione con un batuffolo di cotone o una compressa di garza puliti.
Se lo desidera può applicare un cerotto sul sito di iniezione.
Non strofini il sito di iniezione per non causare irritazioni.
L'INIEZIONE È TERMINATA
Zusammensetzung
Wirkstoffe
Glatirameracetat
Hilfsstoffe
Mannitol (40 mg), Aqua ad iniectabilia.
Darreichungsform und Wirkstoffmenge pro Einheit
Injektionslösung (s.c.) im Fertigpen (1 ml): à 40 mg
40 mg/ml Glatirameracetat entsprechen 36 mg/ml Glatiramer-Base
Indikationen/Anwendungsmöglichkeiten
Copaxone Pen ist angezeigt zur Behandlung der schubförmigen multiplen Sklerose (MS). Copaxone Pen ist nicht indiziert bei primär oder sekundär progredienter MS (mit und ohne überlagerten Schüben).
Dosierung/Anwendung
Die empfohlene Dosierung bei Erwachsenen beträgt 40 mg Copaxone, entsprechend einem Fertigpen, angewendet als dreimal wöchentliche subkutane Injektion im Abstand von mindestens 48 Stunden.
Beginn und Wiederaufnahme der Behandlung mit Copaxone Pen müssen unter Aufsicht eines Neurologen oder Arztes mit Erfahrung auf dem Gebiet der MS-Behandlung durchgeführt werden. Zum gegenwärtigen Zeitpunkt liegen keine Erkenntnisse über die notwendige Behandlungsdauer des Patienten mit Copaxone Pen vor. Die Entscheidung über eine Langzeitbehandlung ist vom behandelnden Arzt individuell zu treffen.
Die Patienten müssen in der Technik der Selbstinjektion instruiert werden, und bei der ersten Selbstinjektion und den darauf folgenden 30 Minuten von einer Fachperson beaufsichtigt werden.
Patienten mit Nierenfunktionsstörungen
Wirksamkeit und Sicherheit wurde nicht bei Patienten mit eingeschränkter Nierenfunktion untersucht (siehe auch Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Ältere Patienten
Wirksamkeit und Sicherheit wurde nicht bei Patienten über 55 Jahren untersucht.
Kinder und Jugendliche
Wirksamkeit und Sicherheit wurde nicht bei Kindern und Jugendlichen untersucht. Zur Anwendung von Copaxone Pen bei Kindern und Jugendlichen unter 18 Jahren liegen nicht genügend Daten vor, um eine Empfehlung zur Anwendung geben zu können. Daher ist Copaxone Pen bei dieser Patientengruppe nicht anzuwenden.
Art der Anwendung
Verabreichungsstelle
Die subkutane Injektion kann an Oberarmen, Abdomen, Gesäss/Hüfte und Oberschenkeln vorgenommen werden. Es wird empfohlen, die Injektionsstelle bei jeder Injektion zu wechseln, um Reizungen und Schmerzen im Gefolge der Injektion zu vermeiden.
Kontraindikationen
Copaxone Pen ist kontraindiziert bei Patienten mit bekannter Hypersensibilität gegenüber Glatirameracetat oder Mannitol.
Warnhinweise und Vorsichtsmassnahmen
Copaxone Pen ist ausschliesslich subkutan zu injizieren. Copaxone Pen darf weder intravenös noch intramuskulär verabreicht werden.
Die Patienten müssen über die Technik der Selbstinjektion instruiert werden, und bei der ersten Selbstinjektion und den darauf folgenden 30 Minuten bei Beginn oder Wiederaufnahme der Behandlung von einer Fachperson beaufsichtigt werden (siehe auch «Dosierung/Anwendung»).
Innerhalb von Minuten nach einer Injektion von Copaxone Pen können Reaktionen mit mindestens einem der folgenden Symptome auftreten: Gefässerweiterung (Flush), Brustschmerzen, Dyspnoe, Herzklopfen oder Tachykardie (siehe auch «Unerwünschte Wirkungen»). Der Patient ist vom behandelnden Arzt über das mögliche Auftreten solcher Reaktionen aufzuklären. Die meisten dieser Reaktionen sind von kurzer Dauer und gehen spontan ohne weitere Folgen zurück. Bei Auftreten einer schweren unerwünschten Reaktion muss der Patient die Anwendung von Copaxone Pen unverzüglich abbrechen und seinen behandelnden Arzt bzw. einen Notfallarzt benachrichtigen. Über die Einleitung einer symptomatischen Behandlung entscheidet der betreffende Arzt.
Es gibt keine Hinweise dafür, dass für bestimmte Patientengruppen bezüglich dieser Reaktionen ein besonderes Risiko besteht. Trotzdem ist Vorsicht geboten, wenn Copaxone Pen bei Patienten mit bereits bestehenden Herzerkrankungen verabreicht wird. Diese Patienten sollten während der Behandlung regelmässig nachkontrolliert werden.
In seltenen Fällen kann es zu ernsthaften Überempfindlichkeitsreaktionen (z.B. Bronchospasmus, Anaphylaxie oder Urtikaria) kommen. Bei schwerwiegenden Reaktionen ist eine entsprechende Therapie einzuleiten und die Behandlung mit Copaxone Pen abzubrechen.
Über Konvulsionen und/oder anaphylaktoide oder allergische Reaktionen wurde selten berichtet.
Unter der Langzeittherapie mit täglicher Gabe von Copaxone wurden in den Seren der Patienten Antikörper gegen Glatirameracetat gefunden. Der maximale Antikörper-Titer wurde im Mittel nach 3-4 Monaten Therapie gemessen, anschliessend sank der Titer ab und stabilisierte sich auf einem gegenüber dem Basistiter leicht erhöhten Niveau. Die vorliegenden Studien lassen keinen Rückschluss auf eine neutralisierende Wirkung der Antikörper gegen Glatirameracetat, oder eine Beeinflussung der klinischen Wirksamkeit von Copaxone zu.
Bei niereninsuffizienten Patienten sollte während der Behandlung mit Copaxone Pen die Nierenfunktion regelmässig kontrolliert werden. Obwohl es keine Hinweise auf eine Ablagerung von Immunkomplexen in den Glomeruli beim Menschen gibt, kann diese Möglichkeit nicht ausgeschlossen werden.
Interaktionen
Interaktionen zwischen Copaxone Pen und anderen Medikamenten sind nicht systematisch untersucht worden.
Bei gleichzeitiger Behandlung mit Kortikosteroiden wurden Reaktionen an der Injektionsstelle häufiger beobachtet.
In-vitro-Studien
Daten aus in vitro-Studien legen nahe, dass Glatirameracetat stark an Plasmaproteine gebunden wird, aber weder durch Phenytoin oder Carbamazepin verdrängt wird, noch diese verdrängt. Trotzdem muss aufgrund der Tatsache, dass Copaxone theoretisch die Verteilung stark plasmaproteinbindender Moleküle beeinflussen kann, die gleichzeitige Verabreichung solcher Präparate unter strikter Aufsicht vorgenommen werden.
Schwangerschaft/Stillzeit
Schwangerschaft
Tierexperimentelle Studien haben keine Reproduktionstoxizität gezeigt (siehe «Präklinische Daten»). Bisherige Erfahrungen mit Copaxone 20 mg/ml an schwangeren Frauen deuten nicht auf ein Fehlbildungsrisiko oder eine fetale/neonatale Toxizität von Copaxone hin. Daten aus der Anwendung von Copaxone 40 mg/ml an schwangeren Frauen sind übereinstimmend mit diesen Ergebnissen. Bislang liegen keine relevanten epidemiologischen Daten vor. Aus Vorsichtsgründen soll eine Anwendung von Copaxone Pen während der Schwangerschaft vermieden werden, es sei denn, dass der Nutzen für die Mutter das Risiko für den Fetus überwiegt.
Stillzeit
Daten zum Übergang von Glatirameracetat, seiner Metaboliten oder deren Antikörper in die Muttermilch liegen nicht vor. Bei der Gabe von Copaxone Pen an eine stillende Mutter ist Vorsicht geboten. Sowohl für die Mutter als auch für das Kind ist das jeweilige Risiko gegen den Nutzen der Behandlung abzuwägen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt.
Unerwünschte Wirkungen
Die meisten Sicherheitsdaten zu Copaxone wurden im Zusammenhang mit der Anwendung von Copaxone 20 mg/ml als einmal tägliche subkutane Injektion erhoben. Im folgenden Abschnitt werden die gesammelten Sicherheitsdaten aus vier placebo-kontrollierten Studien mit Copaxone 20 mg/ml einmal täglich und einer placebo-kontrollierten Studie mit Copaxone 40 mg/ml dreimal wöchentlich dargestellt.
Es wurde weder eine Studie zum Direktvergleich der Sicherheit zwischen Copaxone 20 mg/ml (täglich angewendet) und 40 mg/ml (dreimal wöchentlich angewendet) noch wurde eine Studie hinsichtlich Wechsel von einer Dosierung auf die andere durchgeführt.
Copaxone 20 mg/ml (einmal täglich angewendet)
Als häufigste unerwünschte Wirkung wurden Reaktionen an der Injektionsstelle, berichtet. (70% Copaxone 20 mg/ml vs. 37% Placebo). Die häufigsten lokalen Reaktionen, waren: Erythem, Schmerz, Quaddelbildung, Pruritus, Ödem, Entzündung und Überempfindlichkeit an der Injektionsstelle.
Unmittelbare Reaktionen innerhalb von Minuten nach der Injektion (Post-Injektions-Reaktion) wurden in folgenden Symptomen beschrieben: Gefässerweiterung, Brustschmerz, Dyspnoe, Herzklopfen oder Tachykardie. Über mindestens ein Symptom der unmittelbaren Post-Injektions-Reaktionen wurde mindestens einmal bei 31% der Patienten, die mit Copaxone 20 mg/ml behandelt wurden, gegenüber 13% der Patienten, die Placebo erhielten, berichtet.
In der Mehrzahl der Fälle waren diese Ereignisse vorübergehender Natur, klangen spontan ab und hinterliessen keine Folgen; sie erforderten keine spezifische Behandlung. Diese Effekte können sowohl zu Beginn der Behandlung als auch nach mehreren Monaten auftreten; sie können sowohl einmalig als auch mehrfach bei demselben Patienten auftreten. Es liegen keine Daten vor, die die Identifikation spezieller Risikogruppen für diese Reaktionen erlauben würden.
Alle unerwünschten Ereignisse, die unter Copaxone 20 mg/ml häufiger aufgetreten sind als unter Placebo (* mehr als 2% höhere Inzidenz unter Copaxone als unter Placebo), sind in der untenstehenden Liste aufgeführt. Diese Daten stammen aus vier pivotalen, doppelblinden, placebo-kontrollierten Studien, in denen insgesamt 512 Patienten mit Copaxone 20 mg/ml und 509 Patienten mit Placebo behandelt wurden (maximale Therapiedauer: 36 Monate). Drei dieser klinischen Studien umfassten insgesamt 269 Patienten mit schubförmig-remittierender MS (RRMS), welche mit Copaxone 20 mg/ml behandelt wurden, und 271 RRMS Patienten, welche mit Placebo behandelt wurden (maximale Therapiedauer: 35 Monate). Die vierte Studie wurde bei Patienten, welche eine erste klinische Episode erlebt hatten und ein hohes Risiko für die Entwicklung einer klinisch definitiven MS aufwiesen, durchgeführt und umfasste 243 Patienten, welche mit Copaxone 20 mg/ml, und 238 Patienten, welche mit Placebo behandelt wurden (maximale Therapiedauer: 36 Monate).
Während der anschliessenden offenen Extension über bis zu fünf Jahren wurde keine Änderung des bereits bekannten Copaxone-Risikoprofils festgestellt.
Die folgenden Häufigkeitsdefinitionen werden verwendet:
«Sehr häufig» (≥1/10), «häufig» (<1/10, ≥1/100), «gelegentlich» (<1/100, ≥1/1000), «selten» (<1/1000, ≥1/10'000), «sehr selten» (<1/10'000), «nicht bekannt» (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Infektionen und parasitäre Erkrankungen
Sehr häufig: Infektion (31.8%), Influenza (15.4%)
Häufig: Bronchitis, Gastroenteritis, Herpes simplex, Otitis media, Rhinitis, Zahnabszess, Candida-Mykose der Vagina*
Gelegentlich: Abszess, Zellulitis, Furunkulose, Herpes zoster, Pyelonephritis
Gutartige, bösartige und unspezifische Neubildungen (einschliesslich Zysten und Polypen)
Häufig: benigne Neoplasien der Haut, Neoplasien
Gelegentlich: Hautkarzinom
Selten: T-Zellen -Lymphom
Erkrankungen des Blut- und Lymph-Systems
Häufig: Lymphadenopathie*
Gelegentlich: Leukozytose, Leukopenie, Splenomegalie, Thrombozytopenie, abnormale Lymphozytenmorphologie
Erkrankungen des Immunsystems
Häufig: Hypersensibilität
Gelegentlich: Anaphylaxie
Endokrine Erkrankungen
Gelegentlich: Struma, Hyperthyreose
Stoffwechsel- und Ernährungsstörungen
Häufig: Anorexie, Gewichtszunahme*
Gelegentlich: Alkohol-Intoleranz, Gicht, Hyperlipidämie, erhöhtes Blutnatrium, reduziertes Serum-Ferritin
Psychiatrische Erkrankungen
Sehr häufig: Angst (11.1%)*, Depression (13.1%)
Häufig: Nervosität
Gelegentlich: abnorme Träume, Verwirrtheit, Euphorie, Halluzinationen, Feindseligkeit, manische Reaktionen, Persönlichkeitsstörung, Suizidversuch
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen (30.9%),
Häufig: Geschmacksstörungen, spastisch erhöhter Muskeltonus, Migräne, Sprachstörungen, Synkope, Tremor*
Gelegentlich: Karpal-Tunnel-Syndrom, kognitive Störung, Konvulsion, Schreibstörung, Dyslexie, Dystonie, motorische Störung, Myoklonus, Neuritis, neuromuskuläre Sperre, Nystagmus, Lähmung, peroneale Nervenlähmung, Stupor, Gesichtsfeldstörungen, Aphasie.
Augenerkrankungen
Häufig: Diplopie, Funktionsstörungen der Augen*
Gelegentlich: Katarakt, Kornealäsionen, trockene Augen, Augenblutung, Ptosis, Mydriasis, Optikusatrophie
Erkrankungen des Ohrs und des Labyrinths
Häufig: Ohrenschmerzen
Herzerkrankungen
Häufig: Herzklopfen*, Tachykardie*
Gelegentlich: Extrasystolen, Sinusbradykardie, paroxysmale Tachykardie
Selten: akutes Herzversagen
Gefässerkrankungen
Sehr häufig: Vasodilatation (18.0%)*
Gelegentlich: Krampfadern
Atmungsorgane
Sehr häufig: Dyspnoe (13.3%)*
Häufig: Husten, saisonale Rhinitis
Gelegentlich: Apnoe, Erstickungsgefühl, Nasenbluten, Hyperventilation, Laryngospasmus, Funktionsstörung der Lunge, Atmungsstörung
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Übelkeit (14.5%)*
Häufig: anorektale Funktionsstörungen, Obstipation , Zahnkaries, Dyspepsie, Dysphagie, Darminkontinenz, Erbrechen*
Gelegentlich: Kolitis, Kolonpolyp, Enterokolitis, Aufstossen, ösophageales Geschwür, Periodontitis, rektale Blutung, Vergrösserung der Speicheldrüse
Leber und Gallenerkrankungen
Häufig: Anormaler Leberfunktionstest
Gelegentlich: Cholelithiasis, Hepatomegalie
Erkrankungen der Haut und des Unterhautzellgewebes
Sehr häufig: Rash (13.7%)*
Häufig: Ekchymose, Schwitzen, Juckreiz, Störung der Haut*, Urtikaria
Gelegentlich: Angioödem, Kontakt-Dermatitis, Erythema nodosum, Hautknötchen
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr häufig: Arthralgien (10.4%) , Rückenschmerzen (13.5%)*
Häufig: Nackenschmerzen
Gelegentlich: Arthritis, Bursitis, Flankenschmerzen, Muskelatrophie, Osteoarthritis
Erkrankungen der Nieren- und Harnwege
Häufig: Harndrang, häufiges Harnlassen, Harnretention
Gelegentlich: Hämaturie, Nephrolithiasis, Störungen des Harnapparates, Harnanomalie
Schwangerschafts-, Wochenbett- und Perinatale Erkrankungen
Gelegentlich: Abort
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gelegentlich: Brustschwellung, erektile Dysfunktion, Beckenprolaps, Priapismus, Funktionsstörungen der Prostata, anormaler Ceravixabstrich, Störung der Testis, Vaginalblutung, Störung der Vulva und der Vagina
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Asthenie (23.8%), Brustschmerzen (12.5%)*, Reaktionen an der Injektionsstelle*§ (69.5%), Schmerzen (19.0%)*
Häufig: Schüttelfrost*, Gesichtsödem*, Atrophie an der Injektionsstelle♣, lokale Reaktionen*, peripheres Ödem, Ödem, Fieber
Gelegentlich: Zyste, Katergefühl, allgemeine Unterkühlung, nicht näher beschriebene Entzündung, Nekrose an der Injektionsstelle, Schleimhautstörung
Verletzungen, Vergiftungen und durch Eingriffe bedingte Komplikationen
Gelegentlich: Post-Impfungs-Syndrom
* Mehr als 2% (>2/100) höhere Inzidenz in der Copaxone-Behandlungsgruppe als in der Placebo-Gruppe. Nebenwirkungen ohne das «*» Symbol stellen ein Unterschied von weniger oder gleich als 2% dar.
§ Der Begriff «Reaktionen an der Injektionsstelle» (verschiedene Arten) umfasst alle unerwünschten Ereignisse an der Injektionsstelle, mit Ausnahme von Atrophie und Nekrose an der Injektionsstelle, die gesondert aufgelistet sind.
♣ Begriffe, welche sich auf lokalisierte Lipodystrophie an den Injektionsstellen beziehen, sind eingeschlossen.
Copaxone 40 mg/ml (dreimal wöchentlich angewendet)
Die Sicherheit von Copaxone 40 mg/ml wurde auf Grundlage einer doppelblinden, placebokontrollierten klinischen Studie an RRMS-Patienten beurteilt, in deren Rahmen insgesamt 943 Patienten mit Copaxone 40 mg/ml dreimal wöchentlich und 461 Patienten mit Placebo über einen Zeitraum von 12 Monaten behandelt wurden.
Im Allgemeinen entsprechen die unerwünschten Wirkungen, die bei Patienten unter Copaxone 40 mg/ml dreimal wöchentlich auftraten, in ihrer Art denjenigen unerwünschten Wirkungen, die bereits für Copaxone 20 mg/ml täglich bekannt waren und in der zugelassenen Arzneimittelinformation aufgeführt sind.
Reaktionen an der Injektionsstelle wurden bei 36% der Patienten unter Copaxone 40 mg/ml gegenüber 5% der Patienten unter Placebo berichtet. Über eine unmittelbare Post-Injektionsreaktion wurde bei 8% der Patienten unter Copaxone 40 mg/ml gegenüber 2% der Patienten unter Placebo berichtet.
Es wurden einige spezifische unerwünschte Wirkungen beobachtet:
Erkrankungen des Immunsystems
Gelegentlich: bei 0,3% der Patienten unter Copaxone 40 mg/ml wurden über anaphylaktische Reaktionen berichtet.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Hauterytheme (2,1%), Schmerzen in den Extremitäten (2,1%). Beides war unter Copaxone 20 mg/ml nicht gemeldet worden.
Leber und Gallenerkrankungen
Gelegentlich: Arzneimittelinduzierte Leberschäden (0,1%), toxische Hepatitis (0,1%). Beides war unter Copaxone 20 mg/ml im Rahmen der Marktüberwachung nur selten verzeichnet worden.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Einige Fälle einer Überdosierung von Copaxone (bis zu 300 mg Glatirameracetat) wurden berichtet. In diesen Fällen kam es zu keinen anderen unerwünschten Wirkungen als die bereits bekannten.
Im Falle von Überdosierung müssen die Patienten überwacht werden und es ist eine geeignete symptomatische oder ergänzende Behandlung einzuleiten.
Eigenschaften/Wirkungen
ATC-Code
L03AX13
Wirkungsmechanismus
Die Wirksubstanz von Copaxone, Glatirameracetat, ist das Salz eines synthetischen Polypeptides, das aus 4 natürlichen Aminosäuren besteht: L-Glutaminsäure, L-Alanin, L-Tyrosin und L-Lysin, mit relativen molaren Anteilen von 0.141, 0.427, 0.093 und 0.337. Das mittlere Molekulargewicht von Glatirameracetat liegt zwischen 5000 und 9000 Dalton.
Der (die) Mechanismus (Mechanismen), durch den (die) Glatirameracetat seine Wirkung bei MS-Patienten entfaltet, ist (sind) nicht vollständig geklärt. Man geht jedoch davon aus, dass Glatirameracetat modifizierend in Immunprozesse eingreift, die für die Pathogenese von MS verantwortlich gemacht werden.
In vorklinischen Studien wurde eine Wirkung von Glatirameracetat bei akuten und remittierenden Formen der experimentellen allergischen Enzephalomyelitis (EAE) bei Maus, Ratte und Meerschweinchen (sowohl bei jungen als auch adulten Tieren), bei Kaninchen und Primaten (Rhesusaffe und Pavian) gezeigt.
Pharmakodynamik
Glatirameracetat induziert über Bindung am Haupthistokompatibilitätskomplex Klasse II Molekül auf den Antigen-präsentierenden Zellen antigen-spezifische T-lymphozyten. Diese erkennen das basische Myelin-Protein (MBP), welches für die Auslösung der EAE verantwortlich ist.
Nach Durchquerung der Blut-Hirn-Schranke werden die T-Lymphozyten durch das MBP im Tiermodell reaktiviert und sezernieren entzündungshemmende Zytokine, welche für therapeutische Effekte im Zentralnervensystem verantwortlich sind.
Es sind keine Daten bekannt, die auf einen generellen immunsuppressiven Effekt von Glatirameracetat hinweisen.
Die Wirkung wurde durch zerebrale MRI-Untersuchungen gezeigt, bei welchen 2 Monate nach Beginn der Copaxone-Behandlung eine Reduktion der Bildung neuer Läsionen beobachtet wurde (sowohl in T1- als auch T2-gewichteten Aufnahmen). Diese Beobachtung wurde mit der Wirkung auf die Aktivität der Krankheit und die Schübe der multiplen Sklerose in Verbindung gebracht.
Klinische Wirksamkeit
Schubförmig-remittierende MS (RRMS):
Die klinische Evidenz für die Wirksamkeit von Copaxone 40 mg/ml als dreimal wöchentliche subkutane Injektion für die Senkung der Schubzahl stammt aus einer 12-monatigen placebo-kontrollierten Studie.
Schubförmig-remittierende multiple Sklerose war in der klinischen Zulassungsstudie gekennzeichnet durch entweder mindestens einen dokumentierten Schub in den letzten 12 Monaten oder mindestens zwei dokumentierte Schübe in den letzten 24 Monaten oder einen dokumentierten Schub innerhalb der letzten 12-24 Monate mit mindestens einer dokumentierten Gadolinium-anreichernden T1-Läsion in der Magnetresonanztomographie, die in den letzten 12 Monaten durchgeführt wurde.
Das primäre Zielkriterium bestand in der Gesamtanzahl bestätigter Schübe. Sekundäre MRT-Zielkriterien umfassten die kumulierte Anzahl neuer/anreichernder T2-Läsionen sowie die kumulierte Anzahl anreichernder Läsionen auf T1-gewichteten Bildern, jeweils beurteilt in den Monaten 6 und 12.
Insgesamt wurden 1404 Patienten per Randomisierung im Verhältnis 2:1 einer Behandlung mit entweder Copaxone 40 mg/ml (n=943) oder Placebo (n=461) zugewiesen. Beide Behandlungsgruppen waren hinsichtlich der demographischen Ausgangsdaten, MS-Krankheitsmerkmale und MRT-Parameter vergleichbar. Die Patienten hatten in den letzten 2 Jahren vor dem Screening im Median 2,0 Schübe.
Im Vergleich zu Placebo zeigten sich bei Patienten, die mit Copaxone 40 mg/ml dreimal wöchentlich behandelt wurden, statistisch signifikante Verminderungen der primären und sekundären Zielparameter, die mit dem Behandlungseffekt von täglich verabreichtem Copaxone 20 mg/ml vergleichbar waren.
Die folgende Tabelle zeigt Werte für die primären und sekundären Zielparameter in der Intention-To-Treat-Population:
Zielparameter | Adjustierte mittlere Schätzwerte | p-Wert | ||
Copaxone (40 mg/ml) | Placebo | |||
Annualisierte Schubrate | 0,331 | 0,505 | p<0,0001 | |
Absoluter Risikounterschied * | -0,174 [-0,2841 bis –0,0639] | |||
Kumulierte Anzahl neuer/anreichernder T2-Läsionen in den Monaten 6 und 12 | 3,650 | 5,592 | p<0,0001 | |
Rate Ratio ** | 0,653 [0,546 bis 0,780] | |||
Kumulierte Anzahl anreichernder Läsionen auf T1-gewichteten Bildern in den Monaten 6 und 12 | 0,905 | 1,639 | p<0,0001 | |
Rate Ratio ** | 0,552 [0,436 bis 0,699] | |||
* Absoluter Risikounterschied definiert als Differenz zwischen der adjustierten mittleren ARR von GA 40 mg (dreimal wöchentlich) und der adjustierten mittleren ARR von Placebo
** Rate Ratio definiert als Quotient der adjustierten mittleren Raten von GA 40 mg (dreimal wöchentlich) und Placebo
Es ist nicht nachgewiesen, dass die Behandlung mit Copaxone die Progression der Behinderung oder die Dauer eines Schubes in dieser 12 monatigen Studie beeinflusste. Der Nutzen von Copaxone bei Patienten mit primär oder sekundär progredienter MS wurde bislang noch nicht nachgewiesen.
Es wurde keine Studie zum Direktvergleich der Wirksamkeit und Sicherheit zwischen Copaxone 20 mg/ml (täglich angewendet) und 40 mg/ml (dreimal wöchentlich angewendet) durchgeführt.
Pharmakokinetik
Absorption
Keine Angaben
Distribution
Keine Angaben
Metabolismus
Keine Angaben
Elimination
Pharmakokinetische Studien beim Menschen sind nicht durchgeführt worden. Man nimmt an, dass Glatirameracetat am Ort der subkutanen Injektion eine immunmodulierende Wirkung entfaltet. Die therapeutische Wirkung wird durch eine systemische Diffusion der lokal aktivierten T-Zellen vermittelt. Deshalb wären Blutspiegel von Glatirameracetat oder seiner Metaboliten, auch wenn sie messbar wären, in keiner Weise zur Vorhersage der therapeutischen Wirksamkeit geeignet.
In vivo- und in vitro-Studien, bei denen mit radioaktivem Iod markiertes Glatirameracetat bei Mäusen, Ratten und Affen verwendet wurde, haben gezeigt, dass die Substanz vollständig resorbiert und rasch zu kleinermolekularen Fragmenten abgebaut wurde, die rasch eliminiert wurden.
Bei wiederholter Verabreichung wurden die nach Gabe einer radioisotopenmarkierten Einzeldosis beobachteten pharmakokinetischen Basisparameter nicht verändert.
Präklinische Daten
Präklinische Daten aus Studien zur pharmakologischen Sicherheit, Toxizität nach wiederholter Gabe, Reproduktionstoxizität, genetischen Toxizität oder Kanzerogenität erbrachten keine besonderen Hinweise auf eine spezielle Gefährdung von Menschen, die nicht bereits in anderen Abschnitten der Fachinformation aufgeführt sind. Aufgrund fehlender pharmakokinetischer Daten für den Menschen können keine Aussagen über die Expositionsmargen zwischen Mensch und Tier getroffen werden.
Bei Ratten und Affen liegen nach sechsmonatiger Behandlung Berichte über Immunkomplex-ablagerungen in den Glomeruli der Nieren vor. In einer 2-Jahres-Studie an Ratten wurden keine Hinweise auf eine glomeruläre Ablagerung von Immunkomplexen gefunden.
Bei sensibilisierten Tieren (Meerschweinchen oder Mäuse) wurde nach Verabreichung von Glatirameracetat über anaphylaktische Reaktionen berichtet. Die Relevanz dieser Ergebnisse für den Menschen ist nicht bekannt.
Nach wiederholter Verabreichung bei Tieren wurden häufig toxische Reaktionen an der Injektionsstelle beobachtet.
Sonstige Hinweise
Inkompatibilitäten
Da keine Verträglichkeitsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2-8°C) und vor Licht geschützt lagern.
Ist eine Lagerung im Kühlschrank nicht möglich, können die Fertigpens einmalig bis zu einem Monat zwischen 15°C und 25°C aufbewahrt werden.
Wenn die Fertigpens nicht innerhalb eines Monats angewendet wurden und sich noch in der Originalverpackung befinden, müssen sie wieder im Kühlschrank gelagert werden (2-8°C).
Nicht einfrieren.
Fertigpens, die gefroren waren, müssen vernichtet werden.
Ein Fertigpen darf nur einmal verwendet werden.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Fertigpens sind ausschliesslich zur einmaligen Verwendung bestimmt.
Zulassungsnummer
67492 (Swissmedic)
Zulassungsinhaberin
Teva Pharma AG, Basel
Stand der Information
August 2019
Interne Versionsnummer: 1.2
Composizione
Principi attivi
Glatiramer acetato
Sostanze ausiliarie
Mannitolo (40 mg), acqua per preparazioni iniettabili (Aqua ad iniectabilia).
Forma farmaceutica e quantità di principio attivo per unità
Soluzione iniettabile (s.c.) in penna preriempita (1 ml): 40 mg
40 mg/ml di glatiramer acetato equivalgono a 36 mg/ml di glatiramer base
Indicazioni/Possibilità d'impiego
Copaxone Pen è indicato per il trattamento della sclerosi multipla (SM) recidivante. Copaxone Pen non è indicato in caso di SM progressiva primaria o secondaria (con e senza ricadute sovrapposte).
Posologia/Impiego
La posologia raccomandata negli adulti è di 40 mg di Copaxone, equivalenti a una penna preriempita, somministrato come iniezione sottocutanea tre volte alla settimana, ad intervalli di almeno 48 ore.
L'inizio e la ripresa del trattamento con Copaxone Pen devono essere supervisionati da un neurologo o da un medico esperto nel trattamento della SM. Attualmente non si sa per quanto tempo il paziente debba essere trattato con Copaxone Pen. Una decisione concernente il trattamento a lungo termine deve essere presa caso per caso dal medico curante.
I pazienti devono essere istruiti sulle tecniche di auto-iniezione e devono essere seguiti da un operatore sanitario la prima volta che si iniettano da soli il prodotto e nei 30 minuti successivi.
Pazienti con disturbi della funzionalità renale
L'efficacia e la sicurezza non sono state studiate nei pazienti con compromissione renale (vedere anche la rubrica «Avvertenze e misure precauzionali»).
Pazienti anziani
L'efficacia e la sicurezza non sono state studiate nei pazienti con più di 55 anni.
Bambini e adolescenti
L'efficacia e la sicurezza non sono state studiate nei bambini e negli adolescenti. Non essendo ci abbastanza informazioni disponibili sull'uso di Copaxone Pen in bambini e adolescenti sotto i 18 anni non è possibile farne alcuna raccomandazione d'uso. Di conseguenza, Copaxone Pen non deve essere utilizzato in questo gruppo di pazienti.
Modo di somministrazione
Sede di somministrazione
L'iniezione sottocutanea può essere praticata su braccia, addome, glutei/fianchi e cosce. Si consiglia di scegliere una diversa sede per ogni iniezione, in modo da ridurre le possibilità di un'eventuale irritazione o di dolore in seguito all'iniezione.
Controindicazioni
Copaxone Pen è controindicato nei pazienti con ipersensibilità nota al glatiramer acetato o al mannitolo.
Avvertenze e misure precauzionali
Copaxone Pen deve essere somministrato esclusivamente con iniezione per via sottocutanea. Copaxone Pen non deve essere somministrato per via endovenosa o intramuscolare.
All'inizio o alla ripresa del trattamento, i pazienti devono essere istruiti sulle tecniche di auto-iniezione e devono essere seguiti da un operatore sanitario la prima volta che si iniettano da soli il prodotto e nei 30 minuti successivi (vedere «Posologia / impiego»).
Entro alcuni minuti dopo l'iniezione con Copaxone Pen, possono verificarsi delle reazioni associate ad almeno uno dei seguenti sintomi: vasodilatazione (vampate di calore), dolore toracico, dispnea, palpitazioni o tachicardia (vedere anche «Effetti indesiderati»). Il paziente deve essere informato dal medico curante in merito alla possibile insorgenza di tali reazioni. La maggior parte di queste reazioni è di breve durata e si risolve spontaneamente senza lasciare alcuna conseguenza. Se si manifesta una reazione indesiderata grave, il paziente deve sospendere immediatamente il trattamento con Copaxone Pen e contattare il medico curante o un medico d'urgenza. Un trattamento sintomatico può essere istituito a discrezione del medico.
Non vi sono evidenze che suggeriscano che qualche particolare gruppo di pazienti sia esposto ad un rischio speciale in seguito a queste reazioni. Tuttavia bisogna prestare cautela quando si somministra Copaxone Pen a pazienti con disturbi cardiaci pre-esistenti. Questi pazienti devono essere seguiti regolarmente durante il trattamento.
Raramente possono verificarsi serie reazioni di ipersensibilità (ad es. broncospasmo, anafilassi od orticaria). Se le reazioni sono gravi, bisogna istituire una terapia appropriata e sospendere il trattamento con Copaxone Pen.
Raramente sono state segnalate convulsioni e/o reazioni anafilattoidi o allergiche.
Anticorpi reattivi contro glatiramer acetato sono stati riconosciuti nel siero di pazienti durante il trattamento cronico giornaliero con Copaxone. I livelli massimi sono stati raggiunti dopo una durata media del trattamento di 3-4 mesi e, successivamente, sono diminuiti e si sono stabilizzati ad un livello leggermente superiore a quello basale. I presenti studi non consentono di trarre conclusioni sull'effetto neutralizzante degli anticorpi reattivi contro glatiramer acetato né sul fatto che la loro formazione influenzi l'efficacia clinica di Copaxone.
In pazienti con insufficienza renale, la funzione renale deve essere regolarmente monitorata durante il trattamento con Copaxone Pen. Sebbene non vi siano prove di un deposito a livello glomerulare di immunocomplessi nei pazienti, non si può escludere tale possibilità.
Interazioni
Le interazioni fra Copaxone Pen e altri medicamenti non sono state studiate sistematicamente.
In caso di trattamento concomitante con corticosteroidi sono state osservate delle reazioni nella sede di iniezione con maggiore frequenza.
Studi in vitro
I dati di studi in vitro suggeriscono che il glatiramer acetato si leghi in misura elevata alle proteine plasmatiche, ma che non venga spostato dalla fenitoina o dalla carbamazepina né che sposti esso stesso la fenitoina o la carbamazepina. Tuttavia, dato che Copaxone ha, teoricamente, la possibilità di alterare la distribuzione delle sostanze fortemente legate alle proteine plasmatiche, deve essere strettamente monitorato l'impiego concomitante di tali prodotti medicinali.
Gravidanza/Allattamento
Gravidanza
Gli studi sugli animali non hanno mostrato una tossicità riproduttiva (vedere «Dati preclinici»). Le esperienze attuali con Copaxone 20 mg/ml nelle donne in gravidanza non indicano rischio di malformazioni o tossicità fetale/neonatale. I dati relativi all'uso di Copaxone 40 mg/ml nelle donne in gravidanza sono in linea con questi risultati. Ad oggi, non sono disponibili dati epidemiologici rilevanti. A scopo precauzionale, l'uso di Copaxone Pen durante la gravidanza deve essere evitato, a meno che il beneficio per la madre superi il rischio per il feto.
Allattamento
Non sono disponibili dati che indichino che il glatiramer acetato, i suoi metaboliti o i relativi anticorpi siano escreti nel latte materno. Si raccomanda prudenza nella somministrazione di Copaxone Pen durante l'allattamento. Il rapporto tra rischi e benefici del trattamento deve essere valutato sia per la madre che per il bambino.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Non sono stati effettuati studi in merito.
Effetti indesiderati
La maggior parte dei dati di sicurezza su Copaxone sono stati acquisiti in relazione all'uso di Copaxone 20 mg/ml somministrato come iniezione sottocutanea una volta al giorno. Nel paragrafo seguente vengono riportati i dati di sicurezza ottenuti da quattro studi controllati con placebo che prevedevano la somministrazione di Copaxone 20 mg/ml una volta al giorno e da uno studio controllato con placebo che prevedeva la somministrazione di Copaxone 40 mg/ml tre volte alla settimana.
Non è stato condotto alcuno studio comparativo diretto sulla sicurezza tra Copaxone 20 mg/ml (somministrato quotidianamente) e 40 mg/ml (somministrato tre volte alla settimana), né è stato eseguito uno studio sul passaggio da una posologia all'altra.
Copaxone 20 mg/ml (somministrato una volta al giorno)
Gli effetti indesiderati più comuni segnalati sono stati reazioni nella sede dell'iniezione (70% Copaxone 20 mg/ml vs. 37% placebo). Le reazioni locali più frequenti includevano: eritema, dolore, esantema, prurito, edema, infiammazione e ipersensibilità nella sede dell'iniezione.
Reazioni immediate entro pochi minuti dopo l'iniezione (reazione post iniezione) sono state descritte con i seguenti sintomi: vasodilatazione, dolore toracico, dispnea, palpitazione o tachicardia. Almeno un sintomo delle reazioni immediate dopo l'iniezione è stato segnalato almeno una volta dal 31% dei pazienti trattati con Copaxone 20 mg/ml rispetto al 13% dei pazienti trattati con placebo.
Nella maggior parte dei casi, questi eventi sono stati di natura passeggera, sono scomparsi spontaneamente senza lasciare conseguenze e non hanno richiesto un trattamento specifico. Questi effetti possono manifestarsi sia all'inizio del trattamento, sia dopo diversi mesi, e possono verificarsi una o più volte nello stesso paziente. Non vi sono dati che consentano di identificare particolari gruppi di rischio per queste reazioni.
Tutti gli effetti indesiderati che si sono verificati più frequentemente durante il trattamento con Copaxone 20 mg/ml rispetto al trattamento con placebo (* incidenza superiore al 2% nel gruppo trattato con Copaxone rispetto al gruppo trattato con placebo) sono riportati nell'elenco sottostante. Questi dati derivano da quattro studi pivotal, in doppio cieco, controllati con placebo, condotti su un totale di 512 pazienti trattati con Copaxone 20 mg/ml e su 509 pazienti trattati con placebo (durata massima della terapia: 36 mesi). Tre di detti studi clinici hanno incluso un totale di 269 pazienti affetti da sclerosi multipla recidivante-remittente (RRMS) trattati con Copaxone 20 mg/ml e 271 pazienti con RRMS trattati con placebo (durata massima della terapia: 35 mesi). Il quarto studio, condotto su pazienti che avevano manifestato un primo episodio clinico e che erano ad alto rischio di sviluppare una SM clinicamente definita, ha incluso 243 pazienti trattati con Copaxone 20 mg/ml e 238 pazienti trattati con placebo (durata massima della terapia: 36 mesi).
Nessun cambiamento nel profilo di rischio noto di Copaxone è stato osservato durante la successiva estensione in aperto fino a 5 anni.
La frequenza è definita come segue:
«molto comune» (≥1/10), «comune» (<1/10, ≥1/100), «non comune» (<1/100, ≥1/1000), «raro» (<1/1000, ≥1/10'000), «molto raro» (<1/10'000), «non nota» (la frequenza non può essere definita sulla base dei dati disponibili).
Infezioni ed infestazioni
Molto comune: infezioni (31,8%), influenza (15,4%)
Comune: bronchite, gastroenterite, Herpes Simplex, otite media, rinite, ascesso dentale, candidiasi vaginale*
Non comune: ascesso, cellulite, foruncolosi, Herpes Zoster, pielonefrite
Tumori benigni, maligni e non specificati (cisti e polipi compresi)
Comune: neoplasie benigne della pelle, neoplasie
Non comune: cancro della pelle
Raro: linfoma a cellule T
Patologie del sistema emolinfopoietico
Comune: linfoadenopatia*
Non comune: leucocitosi, leucopenia, splenomegalia, trombocitopenia, morfologia linfocitaria anormale
Disturbi del sistema immunitario
Comune: ipersensibilità
Non comune: anafilassi
Patologie endocrine
Non comune: gozzo, ipertiroidismo
Disturbi del metabolismo e della nutrizione
Comune: anoressia, aumento di peso*
Non comune: intolleranza all'alcool, gotta, iperlipidemia, aumento dei livelli di sodio nel sangue, diminuzione dei livelli sierici di ferritina
Disturbi psichiatrici
Molto comune: ansia (11,1%)*, depressione (13,1%)
Comune: nervosismo
Non comune: sogni anormali, stato confusionale, euforia, allucinazioni, ostilità, comportamenti maniacali, disturbi della personalità, tentativi di suicidio
Patologie del sistema nervoso
Molto comune: cefalea (30,9%)
Comune: disgeusia, ipertonia spastica, emicrania, disordini della parola, sincope, tremore*
Non comune: sindrome del tunnel carpale, disturbi cognitivi, convulsioni, disgrafia, dislessia, distonia, disfunzione motoria, mioclono, nevriti, blocco neuromuscolare, nistagmo, paralisi, paralisi del nervo peroneale, stupore, difetti del campo visivo, afasia
Patologie dell'occhio
Comune: diplopia, disturbi oculari*
Non comune: cataratta, lesioni corneali, occhi secchi, emorragie oculari, ptosi palpebrale, midriasi, atrofia ottica
Patologie dell'orecchio e del labirinto
Comune: dolori all'orecchio
Patologie cardiache
Comune: palpitazioni*, tachicardia*
Non comune: extrasistole, bradicardia sinusale, tachicardia parossistica
Raro: insufficienza cardiaca acuta
Patologie vascolari
Molto comune: vasodilatazione (18,0%)*
Non comune: vene varicose
Patologie respiratorie, toraciche e mediastiniche
Molto comune: dispnea (13,3%)*
Comune: tosse, rinite stagionale
Non comune: apnea, sensazione di soffocamento, epistassi, iperventilazione, laringospasmo, patologie polmonari, disturbi respiratori
Patologie gastrointestinali
Molto comune: nausea (14,5%)*
Comune: patologie ano-rettali, costipazione, carie dentali, dispepsia, disfagia, incontinenza fecale, vomito*
Non comune: colite, polipi al colon, enterocolite, eruttazione, ulcera esofagea, periodontite, emorragie rettali, ingrossamento delle ghiandole salivari
Patologie epatobiliari
Comune: test di funzionalità epatica anormale
Non comune: colelitiasi, epatomegalia
Patologie della cute e del tessuto sottocutaneo
Molto comune: eruzione cutanea (13,7%)*
Comune: ecchimosi, sudorazione, prurito, patologie della cute*, orticaria
Non comune: angioedema, dermatite da contatto, eritema nodoso, nodulo cutaneo
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Molto comune: artralgia (10,4%), dolore alla schiena (13,5%)*
Comune: dolore al collo
Non comune: artrite, borsite, dolore al fianco, atrofia muscolare, osteoartrite
Patologie renali e urinarie
Comune: urgenza minzionale, pollachiuria, ritenzione urinaria
Non comune: ematuria, nefrolitiasi, patologie del tratto urinario, disturbi urinari
Condizioni di gravidanza, puerperio e perinatali
Non comune: aborto
Patologie dell'apparato riproduttivo e della mammella
Non comune: ingorgo mammario, disfunzione erettile, prolasso pelvico, priapismo, disfunzioni della prostata, striscio cervicale anormale, disturbo testicolare, emorragie vaginali, disturbi vulvovaginali
Patologie sistemiche e condizioni relative alla sede di somministrazione
Molto comune: astenia (23,8%), dolore al petto (12,5%)*, reazioni al sito di iniezione*§ (69,5%), dolore (19,0%)*
Comune: brividi*, edema facciale*, atrofia nella sede dell'iniezione♣, reazioni locali*, edema periferico, edema, piressia
Non comune: cisti, effetti tipo postumi da sbornia, ipotermia generale, infiammazione non ben specificata, necrosi nella sede dell'iniezione, disturbi delle mucose
Traumatismo, avvelenamento e complicazioni da procedura
Non comune: sindrome post-vaccinica
* Incidenza superiore al 2% (>2/100) nel gruppo trattato con Copaxone rispetto al gruppo trattato con placebo. Gli effetti indesiderati senza il simbolo «*» indicano una differenza inferiore o uguale al 2%.
§ Il termine «reazioni nella sede dell'iniezione» (varie tipologie) include tutti gli eventi indesiderati osservati nella sede dell'iniezione, ad eccezione dell'atrofia e della necrosi nella sede dell'iniezione che sono elencati separatamente.
♣ Include i termini correlati alla lipodistrofia localizzata nella sede dell'iniezione.
Copaxone 40 mg/ml (somministrato tre volte alla settimana)
La sicurezza di Copaxone 40 mg/ml è stata valutata in base ad uno studio clinico in doppio cieco, controllato con placebo, condotto su pazienti con RRMS di cui 943 pazienti in totale sono stati trattati con Copaxone 40 mg/ml tre volte alla settimana e 461 pazienti sono stati trattati con placebo per un periodo di 12 mesi.
In generale, gli effetti indesiderati manifestatisi nei pazienti trattati con Copaxone 40 mg/ml tre volte alla settimana corrispondono per tipo agli effetti indesiderati già noti per il trattamento con Copaxone 20 mg/ml al giorno e illustrati nella relativa informazione sul medicamento approvata.
Sono state riportate reazioni nella sede dell'iniezione dal 36% dei pazienti trattati con Copaxone 40 mg/ml rispetto al 5% dei pazienti in trattamento con placebo. È stata segnalata una reazione immediata dopo l'iniezione nell'8% dei pazienti trattati con Copaxone 40 mg/ml rispetto al 2% dei pazienti in trattamento con placebo.
Sono stati osservati alcuni effetti indesiderati specifici:
Disturbi del sistema immunitario
Non comune: sono state riportate reazioni anafilattiche nello 0,3% dei pazienti trattati con Copaxone 40 mg/ml.
Patologie della cute e del tessuto sottocutaneo
Comune: eritema cutaneo (2,1%), dolore alle estremità (2,1%). Entrambi gli effetti indesiderati non erano stati segnalati in associazione al trattamento con Copaxone 20 mg/ml.
Patologie epatobiliari
Non comune: danni epatici indotti da farmaci (0,1%), epatite tossica (0,1%). Entrambi gli effetti indesiderati sono stati registrati solo raramente in associazione al trattamento con Copaxone 20 mg/ml nell'ambito della sorveglianza post-marketing.
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-benefico del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Sono stati segnalati alcuni casi di posologia eccessiva con Copaxone (fino a 300 mg di glatiramer acetato). Questi casi non erano associati ad effetti indesiderati diversi da quelli già noti.
In caso di posologia eccessiva, i pazienti devono essere tenuti sotto controllo e bisogna istituire una terapia sintomatica o di sostegno appropriata.
Proprietà/Effetti
Codice ATC
L03AX13
Meccanismo d'azione
Il principio attivo di Copaxone, glatiramer acetato, è il sale di un polipeptide sintetico contenente 4 amminoacidi naturali: acido L-glutammico, L-alanina, L-tirosina e L-lisina, in frazioni molari relative rispettivamente di 0,141, 0,427, 0,093 e 0,337. Il peso molecolare medio di glatiramer acetato è compreso fra 5000 e 9000 dalton.
Il meccanismo o i meccanismi di azione di glatiramer acetato nei pazienti con sclerosi multipla non sono stati del tutto chiariti. Si presume tuttavia che glatiramer acetato agisca attraverso la modulazione dei processi immunitari, responsabili della patogenesi della SM.
Gli studi preclinici hanno evidenziato un effetto di glatiramer acetato nelle forme acute e recidivanti dell'encefalomielite allergica sperimentale (EAS) nei topi, nei ratti e nelle cavie (sia in esemplari giovani che adulti), nei conigli e nei primati (macaco reso e babbuino).
Farmacodinamica
Glatiramer acetato attiva i linfociti T specifici dell'antigene legandosi alle molecole del complesso maggiore di istocompatibilità di classe II sulle cellule che presentano l'antigene. I linfociti T riconoscono la proteina basica della mielina (MBP), responsabile dell'EAS.
Dopo aver attraversato la barriera emato-encefalica, i linfociti T vengono riattivati dalla MBP nei modelli animali e secernono citochine antinfiammatorie responsabili degli effetti terapeutici nel sistema nervoso centrale.
Non sono noti dati che suggeriscano un effetto immunosoppressivo generale del glatiramer acetato.
L'effetto è stato dimostrato mediante risonanza magnetica all'encefalo, che ha evidenziato una riduzione della formazione di nuove lesioni 2 mesi dopo l'inizio del trattamento con Copaxone (sia nelle immagini pesate in T1 che in T2). Tale osservazione è stata messa in correlazione con l'effetto sull'attività della malattia e sugli attacchi di sclerosi multipla.
Efficacia clinica
SM recidivante-remittente (RRMS):
L'evidenza clinica dell'efficacia del trattamento con Copaxone 40 mg/ml come iniezione sottocutanea tre volte alla settimana per la riduzione del numero di attacchi è stata raccolta in uno studio controllato con placebo di 12 mesi.
Nello studio clinico registrativo, la sclerosi multipla recidivante-remittente era caratterizzata da almeno un attacco documentato negli ultimi 12 mesi o da almeno due attacchi documentati negli ultimi 24 mesi o da un attacco documentato nel corso degli ultimi 12-24 mesi con almeno una lesione captante gadolinio in T1 documentata mediante risonanza magnetica eseguita negli ultimi 12 mesi.
L'endpoint primario era il numero complessivo di attacchi confermati. Gli endpoint secondari documentati mediante RMI includevano il numero complessivo di lesioni in T2 nuove/captanti e il numero complessivo di lesioni captanti evidenziate da immagini pesate in T1, valutate rispettivamente dopo 6 e 12 mesi.
Un totale di 1404 pazienti sono stati randomizzati in rapporto 2:1 al trattamento con Copaxone 40 mg/ml (n=943) o placebo (n=461). I due gruppi di trattamento erano analoghi in termini di composizione demografica, caratteristiche della SM e parametri di RMI. Nei 2 anni precedenti lo screening, i pazienti avevano avuto una mediana di 2,0 attacchi.
Rispetto al placebo, i pazienti trattati con Copaxone 40 mg/ml tre volte alla settimana hanno evidenziato riduzioni statisticamente significative degli endpoint primari e secondari, simile all'effetto ottenuto con la somministrazione di Copaxone 20 mg/ml una volta al giorno.
La tabella sottostante illustra i valori per gli endpoint primari e secondari nella popolazione ITT (Intention-To-Treat):
Parametri di riferimento | Valori medi stimati rettificati | Valore p | ||
Copaxone (40 mg/ml) | Placebo | |||
Tasso di recidiva annualizzato | 0,331 | 0,505 | p<0,0001 | |
Differenza assoluta di rischio * | -0,174 [da -0,2841 a -0,0639] | |||
Numero complessivo di lesioni in T2 nuove/captanti ai mesi 6 e 12 | 3,650 | 5,592 | p<0,0001 | |
Rapporto tra tassi (Rate Ratio)** | 0,653 [da 0,546 a 0,780] | |||
Numero complessivo di lesioni captanti documentate con immagini pesate in T1 nei mesi 6 e 12 | 0,905 | 1,639 | p<0,0001 | |
Rapporto tra tassi (Rate Ratio)** | 0,552 [da 0,436 a 0,699] | |||
* Differenza assoluta di rischio definita come differenza tra ARR medio rettificato di GA 40 mg (tre volte alla settimana) e ARR medio rettificato del placebo
** Rapporto tra tassi (Rate Ratio) definito come quoziente dei tassi medi rettificati di GA 40 mg (tre volte alla settimana) e del placebo
Non è stato dimostrato che il trattamento con Copaxone abbia influito sulla progressione della disabilità o sulla durata degli attacchi in questo studio di 12 mesi. Attualmente non è stata dimostrata l'utilità di Copaxone in pazienti affetti da SM progressiva primaria o secondaria.
Non è stato condotto alcuno studio comparativo diretto sull'efficacia e la sicurezza tra Copaxone 20 mg/ml (somministrato quotidianamente) e Copaxone 40 mg/ml (somministrato tre volte alla settimana).
Farmacocinetica
Assorbimento
Nessuna informazione
Distribuzione
Nessuna informazione
Metabolismo
Nessuna informazione
Eliminazione
Non sono stati condotti studi farmacocinetici sull'uomo. Si presume che glatiramer acetato svolga un'azione immunomodulante nella sede dell'iniezione sottocutanea. L'effetto terapeutico viene ottenuto mediante una diffusione sistemica dei linfociti T attivati localmente. La concentrazione di glatiramer acetato o dei suoi metaboliti nel sangue, ove rilevabile, non sarebbe pertanto assolutamente indicata a predire l'efficacia terapeutica.
Gli studi in vivo e in vitro, nei quali è stato utilizzato glatiramer acetato marcato con iodio radioattivo su topi, ratti e scimmie, hanno evidenziato che la sostanza viene assorbita completamente e degradata rapidamente in frammenti molecolari più piccoli che vengono eliminati velocemente.
Con la somministrazione ripetuta non sono stati rilevati cambiamenti nei parametri farmacocinetici di base osservati dopo la somministrazione di una singola dose di medicamento marcato con isotopi radioattivi.
Dati preclinici
I dati preclinici raccolti da studi su sicurezza farmacologica, tossicità a dosi ripetute, tossicità della riproduzione, tossicità genetica o cancerogenicità non evidenziano rischi particolari per l'uomo rispetto a quelli già indicati nelle altre sezioni dell'informazione professionale. A causa della mancanza di dati farmacocinetici per l'uomo, non è possibile stabilire i margini di esposizione tra uomo e animale.
In ratti e scimmie trattati per sei mesi è stato riferito il deposito di immunocomplessi nei glomeruli renali. Nel corso di uno studio sui ratti durato 2 anni, non è emersa alcuna indicazione di depositi di immunocomplessi nei glomeruli.
In seguito alla somministrazione di glatiramer acetato ad animali sensibilizzati (cavie o ratti), sono state segnalate reazioni anafilattiche. Non si sa se questi dati abbiano rilevanza per l'uomo.
Dopo ripetute somministrazioni agli animali, sono state osservate spesso reazioni tossiche nella sede dell'iniezione.
Altre indicazioni
Incompatibilità
Poiché per questo medicamento non sono stati condotti studi di compatibilità, non lo si deve somministrare in combinazione con altri medicamenti.
Stabilità
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazioni particolari concernenti l'immagazzinamento
Conservare in frigorifero (2-8°C) e al riparo dalla luce.
Qualora non fosse possibile conservarle in frigorifero, le penne preriempite possono essere tenute una sola volta fino ad un mese a una temperatura compresa tra 15°C e 25°C.
Se le penne preriempite non vengono utilizzate entro un mese e si trovano ancora nella confezione originale, devono essere rimesse in frigorifero (2-8°C).
Non congelare.
Le penne preriempite precedentemente congelate devono essere distrutte.
Ogni penna preriempita deve essere utilizzata una sola volta.
Conservare fuori dalla portata dei bambini.
Indicazioni per la manipolazione
Le penne preriempite sono esclusivamente monouso.
Numero dell'omologazione
67492 (Swissmedic).
Titolare dell’omologazione
Teva Pharma AG, Basel.
Stato dell'informazione
Agosto 2019.
Numero di versione interno: 1.2
Composition
Principes actifs
Acétate de glatiramère
Excipients
Mannitol (40 mg), Aqua ad iniectabilia.
Forme pharmaceutique et quantité de principe actif par unité
Solution injectable (SC) en stylo prérempli (1 ml): à 40 mg/ml d'acétate de glatiramère correspondant à 36 mg/ml de glatiramère base.
Indications/Possibilités d’emploi
Copaxone Pen est indiqué pour le traitement des formes récurrentes de la sclérose en plaques (SEP). Copaxone Pen n'est pas indiqué dans la SEP progressive primaire ou secondaire (avec et sans poussées superposées).
Posologie/Mode d’emploi
La posologie recommandée chez l'adulte est de 40 mg de Copaxone (un stylo prérempli), administré en injection sous-cutanée trois fois par semaine à 48 heures d'intervalle minimum.
L'instauration et la reprise du traitement par Copaxone Pen doivent être réalisées sous le contrôle d'un neurologue ou d'un médecin possédant une expérience dans le traitement de la sclérose en plaques.
A l'heure actuelle, on ignore pendant combien de temps le patient doit être traité par Copaxone Pen 40 mg/ml. Une décision concernant un traitement de longue durée doit être prise par le médecin traitant.
Les patients doivent être instruits sur les techniques d'auto-injection et la première auto-injection doit être réalisée sous la surveillance, pendant au moins 30 minutes, d'un professionnel de la santé.
Patients présentant des troubles de la fonction rénale
L'efficacité et la sécurité n'ont pas été étudiées chez les patients ayant une limitation de la fonction rénale (voir aussi rubrique «Mises en garde et précautions»).
Patients âgés
L'efficacité et la sécurité n'ont pas été étudiées chez les patients de plus de 55 ans.
Enfants et adolescents
L'efficacité et la sécurité n'ont pas été étudiées chez les enfants et les adolescents. Les données disponibles sur l'utilisation de Copaxone Pen chez les enfants et les adolescents de moins de 18 ans ne sont pas suffisantes pour recommander son utilisation. Copaxone Pen ne doit donc pas être utilisé chez ce groupe de patients.
Mode d'administration
Site d'injection
Les sites d'injection sous-cutanée incluent les bras, l'abdomen, les fesses/hanches et les cuisses. Il est conseillé de choisir un site différent pour chaque injection afin d'éviter l'apparition d'irritations ou de douleurs consécutives à l'injection.
Contre-indications
Copaxone Pen est contre-indiqué chez les patients avec antécédents d'hypersensibilité à l'acétate de glatiramère ou au mannitol.
Mises en garde et précautions
Copaxone Pen doit être administré uniquement par voie sous-cutanée.
Copaxone Pen ne doit pas être administré par voie intraveineuse ou intramusculaire.
Les patients doivent être instruits sur les techniques d'auto-injection et la première auto-injection doit être réalisée sous la surveillance, pendant au moins 30 minutes au début ou en cas d'une reprise du traitement (voir aussi «Posologie/Mode d'emploi»), d'un professionnel de la santé.
Dans les minutes qui suivent une injection de Copaxone Pen, peuvent survenir des réactions se manifestant par l'un des symptômes suivants au moins: vasodilatation (flush), douleurs thoraciques, dyspnée, palpitations ou tachycardie (voir aussi «Effets indésirables»). Le patient doit être informé par le médecin traitant de la survenue possible de telles réactions, dont la majorité sont de courte durée et disparaissent spontanément sans laisser de séquelles. En cas de réaction indésirable grave, le patient interrompra le traitement de Copaxone Pen sans délai et avertira son médecin traitant ou le médecin de garde. Le médecin décidera s'il y a lieu d'introduire un traitement symptomatique.
On ne dispose d'aucune donnée suggérant l'existence d'un risque accru de telles réactions dans des groupes de patients particuliers. La prudence est malgré tout de mise lorsque Copaxone Pen est administré à des patients souffrant d'une maladie cardiaque préexistante. Ces patients doivent être régulièrement contrôlés tout au long du traitement.
Dans de rares cas, des réactions d'hypersensibilité graves (p.ex. bronchospasme, anaphylaxie ou urticaire) ont été rapportées. Lors de réactions sévères, le traitement adéquat sera instauré et l'administration de Copaxone Pen devra être interrompue.
Rarement, des convulsions et/ou des réactions anaphylactoïdes ou allergiques ont été rapportées.
Des anticorps anti-acétate de glatiramère ont été détectés dans le sérum de patients sous traitement journalier chronique par Copaxone. Le taux maximal d'anticorps a été atteint en moyenne après 3 à 4 mois de traitement, puis ce taux a décru et s'est stabilisé à un niveau légèrement supérieur à sa valeur de base. Il n'y a pas de données suggérant que ces anticorps anti-acétate de glatiramère soient de type neutralisant ou que leur production puisse altérer l'efficacité clinique de Copaxone.
Chez les patients avec insuffisance rénale, il faut contrôler régulièrement la fonction rénale durant le traitement par Copaxone Pen. Bien qu'on ne dispose d'aucune indication pour l'existence chez l'homme de dépôts de complexes immuns dans les glomérules, cette éventualité ne peut être entièrement exclue.
Interactions
Les interactions entre Copaxone Pen et d'autres médicaments n'ont pas été évaluées de façon systématique.
Une augmentation de l'incidence des réactions au site d'injection a été observée chez les patients traités simultanément par des corticostéroïdes.
Études in vitro
In vitro, les données disponibles suggèrent que l'acétate de glatiramère est fortement lié aux protéines plasmatiques, mais n'est pas déplacé par, et ne déplace pas, la phénytoïne ou la carbamazépine. Néanmoins, dans la mesure où Copaxone possède, théoriquement, la capacité d'affecter la distribution des molécules se liant fortement aux protéines plasmatiques, la co-administration de telles substances doit se faire sous stricte surveillance.
Grossesse/Allaitement
Grossesse
Les études menées sur des animaux n'ont mis en évidence aucune toxicité sur la reproduction (voir «Données précliniques»). Les expériences acquises jusqu'à présent avec Copaxone 20 mg/ml chez des femmes enceintes n'indiquent pas de risque de malformation ou de toxicité fœtale/néonatale de Copaxone. Les données disponibles sur l'utilisation de Copaxone 40 mg/ml chez des femmes enceintes sont en accord avec ces résultats. Jusqu'à présent, on ne dispose pas de données épidémiologiques pertinentes. Par mesure de précaution, l'utilisation de Copaxone Pen sera évitée pendant la grossesse, à moins que le bénéfice pour la mère ne surpasse le risque pour le fœtus.
Allaitement
On ne dispose pas de données concernant le passage de l'acétate de glatiramère, de ses métabolites ou de ses anticorps dans le lait maternel. La prudence est de rigueur lors d'une utilisation de Copaxone Pen chez une mère allaitante. Il faut soupeser le risque et le bénéfice relatifs du traitement pour la mère et l'enfant.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude correspondante n'a été effectuée.
Effets indésirables
La plupart des données de sécurité relatives à Copaxone ont été réunies avec Copaxone 20 mg/ml administré en injection sous-cutanée une fois par jour. Le chapitre suivant présente les données de sécurité réunies lors de quatre essais contrôlés contre placebo avec Copaxone 20 mg/ml administré une fois par jour et lors d'un essai contrôlé contre placebo avec Copaxone 40 mg/ml administré trois fois par semaine.
La sécurité de Copaxone 20 mg/ml (administré quotidiennement) et 40 mg/ml (administré trois fois par semaine) n'a pas fait l'objet d'une comparaison directe dans une même étude; de même, le passage d'un dosage à l'autre n'a pas été étudié.
Copaxone 20 mg/ml (administré une fois par jour)
Les réactions au site d'injection ont été les effets indésirables les plus fréquemment rapportés (70% Copaxone 20 mg/ml vs 37% placebo). Les réactions locales les plus fréquentes étaient: érythème, douleur, apparition de plaques prurigineuses, prurit, oedème, inflammation et augmentation de la sensibilité au site d'injection.
Des réactions immédiates survenant dans les minutes qui suivent l'injection (réactions post-injection) ont été décrites sous les symptômes suivants: vasodilatation, douleur thoracique, dyspnée, palpitations ou tachycardie
Au moins une composante de ces réactions post-injection immédiates a été rapportée, au moins une fois, par 31% des patients recevant Copaxone 20 mg/ml comparé à 13% dans le groupe placebo.
Dans la plupart des cas, ces événements étaient de nature transitoire, ils ont disparu spontanément sans laisser de séquelles; ils n'ont pas nécessité de traitement spécifique. Ces effets peuvent survenir au début du traitement comme après plusieurs mois; un patient peut en éprouver un épisode ou plusieurs. Aucune information n'est disponible permettant d'identifier des groupes de patients à risque particulier pour ces réactions.
Tous les événements indésirables qui se sont manifestés avec une incidence plus élevée sous Copaxone 20 mg/ml que sous placebo (* incidence plus élevée de 2% sous Copaxone que sous placebo) sont repris dans la liste ci-dessous. Ces données émanent de quatre études pivotales, menées en double aveugle et contrôlées par placebo, dans lesquelles 512 patients ont été traités par Copaxone 20 mg/ml et 509 patients traités par placebo (durée du traitement maximale: 36 mois). Trois de ces études cliniques comprenaient 269 patients présentant une SEP rémittente-récurrente (SEP-RR) traités par Copaxone 20 mg/ml, et 271 patients présentant une SEP-RR traités par placebo (duré du traitement maximale: 35 mois). La quatrième étude a été effectuée chez des patients ayant vécu un premier épisode clinique et présentant un risque élevé d'une sclérose en plaques définitive, et comprenait 243 patients traités par Copaxone 20 mg/ml et 238 patients traités par placebo (durée maximale du traitement 36 mois).
Pendant l'extension ouverte sur une période de 5 ans il n'y a pas eu de changement du profil de risques connu de Copaxone.
Les fréquences sont définies de la manière suivante:
«très fréquents» (≥1/10), «fréquents» (<1/10, ≥1/100), «occasionnels» (<1/100, ≥1/1000), «rares» (<1/1000, ≥1/10'000), «très rares» (<1/10'000), «inconnus» (la fréquence ne peut être estimée sur la base des données disponibles).
Infections et infestations
Très fréquents: infections (31,8%), grippe (15,4%).
Fréquents: bronchite, gastro-entérite, herpes simplex, otite de l'oreille moyenne, rhinite, abcès dentaire, candidose vaginale*.
Occasionnels: abcès, cellulite, furonculose, herpes zoster, pyélonéphrite.
Tumeurs bénignes, malignes et non précisées (incl. kystes et polypes)
Fréquents: néoplasme cutané bénin, néoplasmes.
Occasionnels: cancer de la peau.
Rares: lymphome à cellules T.
Affections hématologiques et du système lymphatique
Fréquents: lymphadénopathie*.
Occasionnels: leucocytose, leucopénie, splénomégalie, thrombocytopénie, morphologie lymphocytaire anormale.
Affections du système immunitaire
Fréquents: hypersensibilité.
Occasionnels: anaphylaxie.
Affections endocriniennes
Occasionnels: goitre, hyperthyroïdie.
Troubles du métabolisme et de la nutrition
Fréquents: anorexie, prise de poids*.
Occasionnels: intolérance à l'alcool, goutte, hyperlipémie, sodium sanguin élevé, ferritine sérique abaissée.
Affections psychiatriques
Très fréquents: angoisse (11,1%)*, dépression (13,1%).
Fréquents: nervosité.
Occasionnels: rêves anormaux, confusion, euphorie, hallucinations, animosité, réactions maniaques, troubles de la personnalité, tentative de suicide.
Affections du système nerveux
Très fréquents: céphalées (30,9%).
Fréquents: troubles du goût, tonus musculaire élevé spastique, migraine, troubles de la parole, syncope, tremblement*.
Occasionnels: syndrome du tunnel carpien, troubles cognitifs, convulsions, troubles de l'écriture, dyslexie, dystonie, troubles moteurs, myoclonus, névrite, blocage neuromusculaire, nystagmus, paralysie, paralysie du nerf péronier, stupeur, trouble du champ visuel, aphasie.
Affections oculaires
Fréquents: diplopie, troubles fonctionnels des yeux*.
Occasionnels: cataracte, lésions de la cornée, oeil sec, hémorragie ophtalmique, ptose, mydriase, atrophie du nerf optique.
Affections de l'oreille et du labyrinthe
Fréquents: douleurs aux oreilles.
Affections cardiaques
Fréquents: palpitations*, tachycardie*.
Occasionnels: extrasystoles, bradycardie sinusale, tachycardie paroxysmale.
Rares: arrêt cardiaque subit.
Affections vasculaires
Très fréquents: vasodilatation (18,0%)*.
Occasionnels: varices.
Affections respiratoires, thoraciques et médiastinales
Très fréquents: dyspnée (13,3%)*.
Fréquents: toux, rhinite saisonnière.
Occasionnels: apnée, sensation d'étouffement, saignements du nez, hyperventilation, spasme du larynx, troubles fonctionnels des poumons, troubles de la respiration.
Affections gastro-intestinales
Très fréquents: nausée (14,5%)*.
Fréquents: troubles fonctionnels anorectaux, constipation, caries dentaires, dyspepsie, dysphagie, incontinence intestinale, vomissements*.
Occasionnels: colite, polypes du colon, entérocolite, renvois, ulcère oesophagien, périodontite, saignement rectal, augmentation de la glande salivaire.
Affections hépatobiliaires
Fréquents: test de la fonction hépatique anormal.
Occasionnels: cholélithiase, hépatomégalie.
Affections de la peau et du tissu sous-cutané
Très fréquents: rash (13,7%)*.
Fréquents: ecchymose, transpiration, prurit, trouble cutané*, urticaire.
Occasionnels: angio-oedème, dermatite de contact, érythème noueux, nodules cutanés.
Affections musculosquelettiques et du tissu sous-cutané
Très fréquents: arthralgies (10,4%), douleurs dorsales (13,5%)*.
Fréquents: douleurs dans la nuque.
Occasionnels: arthrite, bursite, douleur dans les flancs, atrophie musculaire, ostéoarthrite.
Affections du rein et des voies urinaires
Fréquents: besoin d'uriner, polyurie, rétention d'urine.
Occasionnels: hématurie, néphrolithiase, troubles de l'appareil urinaire, anomalie urinaire.
Affections gravidiques, puerpérales et périnatales
Occasionnels: avortement.
Affections des organes de reproduction et du sein
Occasionnels: gonflement des seins, dysfonction érectile, prolapsus du bassin, priapisme, troubles fonctionnels de la prostate, frottis cervical anormal, troubles testiculaires, hémorragie vaginale, trouble de la vulve et du vagin.
Troubles généraux et anomalies au site d'administration
Très fréquents: asthénie (23,8%), douleurs thoraciques (12,5%)*, réactions au site d'injection*§ (69,5%), douleurs (19,0%)*.
Fréquents: frissons*, oedème au niveau du visage*, atrophie au niveau du site d'injection♣, réactions locales*, oedème périphérique, oedème, fièvre.
Occasionnels: kyste, sensation de gueule de bois, hypothermie, inflammation non détaillée plus précisément, nécrose au site d'injection, troubles des muqueuses.
Lésions, intoxications et complications d'interventions
Occasionnels: syndrome suite à une vaccination.
* Incidence de plus de 2% (>2/100) dans le groupe de traitement Copaxone que dans le groupe placebo. Les effets secondaires sans le symbole «*» ont une différence de moins de ou égale à 2%.
§ Le terme «Réactions au site d'application» (différentes manières) comprend tous les évènements indésirables au site d'injection, à l'exception de l'atrophie et de la nécrose au site d'injection, qui sont mentionnées à part.
♣ Les termes se rapportant à la lipodystrophie localisée au site d'injection sont inclus.
Copaxone 40 mg/ml (administré trois fois par semaine)
La sécurité de Copaxone 40 mg/ml a été évaluée sur la base d'un essai clinique contrôlé contre placebo, en double aveugle, chez des patients atteints de SEP-RR avec un total de 943 patients traités par Copaxone 40 mg/ml trois fois par semaine et 461 patients traités par le placebo pendant 12 mois.
De façon générale, les effets indésirables observés chez les patients traités par Copaxone 40 mg/ml trois fois par semaine ont été de même nature que ceux déjà connus pour Copaxone 20 mg/ml administré quotidiennement et mentionnés dans l'information professionnelle autorisée.
Des réactions au site d'injection ont été rapportées chez 36% des patients sous Copaxone 40 mg/ml contre 5% des patients sous placebo. Des réactions post-injection immédiates ont été rapportées chez 8% des patients sous Copaxone 40 mg/ml contre 2% des patients sous placebo.
Quelques effets indésirables spécifiques ont été observés:
Affections du système immunitaire
Occasionnels: des réactions anaphylactiques ont été rapportées chez 0,3% des patients traités par Copaxone 40 mg/ml.
Affections de la peau et du tissu sous-cutané
Fréquents): érythème cutané (2,1%), douleur dans les extrémités (2,1%). Ces deux effets indésirables n'ont pas été mentionnés pour Copaxone 20 mg/ml.
Affections hépatobiliaires
Occasionnels: lésions hépatiques d'origine médicamenteuse (0.1%), hépatite toxique (0,1%).
Ces deux effets indésirables n'ont été que rarement mentionnés sous Copaxone 20 mg/ml dans le cadre de la surveillance après commercialisation.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Quelques cas de surdosage avec Copaxone (jusqu'à 300 mg d'acétate de glatiramère) ont été rapportés. Ces cas n'ont été associés à aucun effet indésirable autre que ceux déjà connus.
En cas de surdosage, les patients doivent être suivis et un traitement symptomatique ou complémentaire approprié doit être institué.
Propriétés/Effets
Code ATC
L03AX13
Mécanisme d'action
L'acétate de glatiramère, principe actif de Copaxone, est le sel d'un polypeptide synthétique composé de 4 acides aminés naturels, acide L-glutamique, L-alanine, L-tyrosine et L-lysine, avec une fraction molaire moyenne de respectivement de 0,141, 0,427, 0,093 et 0,337. Le poids moléculaire moyen de l'acétate de glatiramère est compris entre 5000–9000 daltons.
Le(s) mécanisme(s) par lequel (lesquels) le glatiramère exerce ses effets chez les patients ayant une SEP n'est (ne sont) pas encore complètement élucidé(s). Néanmoins, on pense que l'acétate de glatiramère agit en modifiant des processus immunologiques actuellement considérés responsables de la pathogenèse de la SEP.
Dans les études précliniques, il a été démontré que l'acétate de glatiramère était efficace en cas de formes aiguës et rémittentes de l'encéphalomyélite allergique expérimentale (EAE) chez la souris, le rat, le cobaye (à la fois chez l'animal jeune et adulte), le lapin et le primate (singe Rhésus et babouin).
Pharmacodynamique
L'acétate de glatiramère induit, par la liaison à la molécule du complexe principal d'histocompatibilité classe II sur les cellules de présentation des antigènes, des lymphocytes T antigènes-spécifiques. Ceux-ci reconnaissent la protéine basique de la myéline (PBM), qui est responsable du déclenchement de l'EAE.
Dès la barrière hémato-encéphalique franchie, les lymphocytes T sont réactivés par la PBM afin de sécréter des cytokines anti-inflammatoires ayant des effets thérapeutiques au niveau du système nerveux central.
Aucune donnée connue sur l'acétate de glatiramère ne suggère qu'il puisse posséder des propriétés immunosuppressives.
Le mécanisme d'action a été corroboré par le suivi de l'IRM cérébrale où l'effet de Copaxone a été observé sur la réduction de la formation de nouvelles lésions (à la fois en séquences pondérées T1 ou T2) deux mois après le début du traitement. Cet effet a été corrélé avec les effets sur l'activité de la maladie et les poussées de sclérose en plaques.
Efficacité clinique
SEP récurrente-rémittente (SEP-RR):
Les données étayant l'efficacité de Copaxone 40 mg/ml en injection sous-cutanée trois fois par semaine pour réduire la fréquence des poussées sont issues d'une étude de 12 mois contrôlée contre placebo.
Dans l'étude clinique pivot, la sclérose en plaques récurrente-rémittente était caractérisée par au moins une poussée documentée au cours des 12 derniers mois ou au moins deux poussées documentées au cours des 24 derniers mois ou une poussée documentée entre les 12 et 24 derniers mois avec au moins une lésion rehaussée par le gadolinium en T1 documentée lors d'une IRM effectuée au cours des 12 derniers mois.
Le critère d'évaluation principal était le nombre total de poussées confirmées. Les critères d'évaluation IRM secondaires incluaient le nombre cumulé de lésions nouvelles/élargies en T2 et le nombre cumulé de lésions rehaussées sur les séquences pondérées en T1, tous deux mesurés aux mois 6 et 12.
Au total, 1404 patients ont été randomisés selon un ratio de 2:1 en vue de recevoir soit Copaxone 40 mg/ml (n = 943) soit le placebo (n = 461). Les deux groupes de traitement étaient comparables en termes de caractéristiques démographiques initiales, caractéristiques de la SEP et paramètres IRM. Les patients avaient présenté un nombre médian de 2,0 poussées au cours des 2 années précédant la sélection.
Par comparaison avec le placebo, les patients traités par Copaxone 40 mg/ml trois fois par semaine ont présenté des réductions statistiquement significatives des paramètres mesurés comme critères d'évaluation primaires et secondaires, ces réductions étant comparables à l'effet du traitement par Copaxone 20 mg/ml administré quotidiennement.
Le tableau suivant présente les résultats de mesure du critère d'évaluation principal et des critères d'évaluation secondaires au sein de la population en intention de traiter:
Paramètre évalué | Estimations moyennes ajustées | Valeur de p | |
Copaxone | Placebo | ||
Taux annualisé de poussées (TAP) | 0,331 | 0,505 | p<0,0001 |
Différence des risques absolus* | -0,174 [-0,2841 à –0,0639] | ||
Nombre cumulé de lésions nouvelles/élargies en T2 aux mois 6 et 12 | 3,650 | 5,592 | p<0,0001 |
Rapport des taux** | 0,653 [0,546 à 0,780] | ||
Nombre cumulé de lésions rehaussées sur les séquences pondérées en T1 aux mois 6 et 12 | 0,905 | 1,639 | p<0,0001 |
Rapport des taux** | 0,552 [0,436 à 0,699] | ||
* La différence des risques absolus est définie comme la différence entre le TAP moyen ajusté sous acétate de glatiramère (AG) 40 mg (3 fois/semaine) et le TAP moyen ajusté sous placebo.
** Le rapport des taux est défini comme le rapport entre les taux moyens ajustés sous AG 40 mg (3 fois/semaine) et sous placebo.
Il n'y a pas de preuve que le traitement par Copaxone ait eu un effet sur la progression du handicap ou la durée des poussées au cours de cette étude de 12 mois.
Le bénéfice thérapeutique de Copaxone chez les patients ayant une SEP progressive primaire ou secondaire n'a pas été démontré jusqu'ici.
L'efficacité et la sécurité de Copaxone 20 mg/ml (administré quotidiennement) et 40 mg/ml (administré trois fois par semaine) n'ont pas fait l'objet d'une comparaison directe dans une même étude.
Pharmacocinétique
Absorption
Aucune donnée
Distribution
Aucune donnée
Métabolisme
Aucune donnée
Élimination
Des études pharmacocinétiques n'ont pas été réalisées chez l'homme. On estime que l'acétate de glatiramère déclenche une action immunomodulatrice au site d'injection sous-cutanée. Les effets thérapeutiques sont alors induits par une diffusion systémique des cellules T activées localement. Ainsi, et même s'ils étaient détectables, les taux sanguins de l'acétate de glatiramère ou de ses métabolites ne seraient d'aucune valeur prédictive de la réponse thérapeutique.
In vivo et in vitro, les études réalisées chez la souris, le rat et le singe, et ayant utilisé l'acétate de glatiramère marqué à l'iode radioactif, ont montré que la substance était complètement absorbée et rapidement dégradée en fragments de poids moléculaire plus petit permettant ainsi une élimination rapide.
Une administration réitérée n'a pas altéré les paramètres pharmacocinétiques de base observés après administration d'une dose unique radiomarquée.
Données précliniques
Les données précliniques d'études de sécurité pharmacologique, de toxicité après exposition récurrente, de toxicité sur la reproduction, de génotoxicité ou de cancérogenèse ne suggèrent aucun risque particulier pour l'homme qui n'est pas déjà énoncé dans d'autres rubriques de l'information professionnelle. En raison du manque de données pharmacocinétiques chez l'homme, aucune déclaration relative aux marges d'exposition entre l'homme et l'animal ne peut être faite .
Lors d'études menées chez les rats et les singes portant sur un traitement de 6 mois, des rapports ont établi la présence de dépôts de complexes immuns dans les glomérules des reins. Dans une étude de 2 ans menée chez les rats, aucun indice de dépôt de complexes immuns dans les glomérules n'a été mis en évidence.
Des réactions anaphylactiques ont été rapportées après administration à des animaux sensibilisés (cobaye et souris). La pertinence de ces résultats pour l'homme est inconnue.
Une toxicité au site d'injection après administration répétée chez l'animal a été fréquemment rapportée.
Remarques particulières
Incompatibilités
Aucune étude de tolérance n'ayant été effectuée, ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8°C) et à l'abri de la lumière.
Si une conservation au réfrigérateur n'est pas possible, les stylos préremplis peuvent être conservés une seule fois jusqu'à un mois (entre 15°C et 25°C).
Si les stylos préremplis n'ont pas été utilisés dans le délai d'un mois et qu'ils sont toujours dans l'emballage d'origine, ils doivent être à nouveau conservés au réfrigérateur (2-8°C).
Ne pas congeler.
Les stylos préremplis qui ont été congelés doivent être détruits.
Un stylo prérempli ne peut être utilisé qu'une seule fois.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Les stylos préremplis sont destinés exclusivement à l'usage unique.
Numéro d’autorisation
67492 (Swissmedic).
Titulaire de l’autorisation
Teva Pharma AG, Basel
Mise à jour de l’information
Août 2019.
Numéro de version interne: 1.2
Відгуки (0)

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.




 Deutsch
Deutsch French
French Italian
Italian




























