Фесго розчин для ін’єкцій 600 мг/600 мг у флаконі 10 мл
PHESGO Inj Lös 600mg/600mg
-
755229.93 RUB
При оплате криптовалютой:
Ваша прибыль 75522.99 RUB / 891.42 USDT
- Наявність: Немає в наявності
- Модель: 7801824
- ATC-код L01XY02
- EAN 7680678280015
Опис
▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, den Verdacht einer neuen oder schwerwiegenden Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Rubrik «Unerwünschte Wirkungen».
Zusammensetzung
Wirkstoffe
Pertuzumabum, Trastuzumabum (gentechnologisch hergestellt unter Verwendung von CHO [Chinese Hamster Ovary]-Zellen).
Hilfsstoffe
Hyaluronidasum humanum (rHuPH20) (gentechnologisch hergestellt unter Verwendung von CHO [Chinese Hamster Ovary]-Zellen), L-histidini hydrochloridum monohydricum, L-histidinum, α,α-trehalosum dihydricum, saccharum, polysorbatum 20*, L-methioninum, aqua ad iniectabilia.
* aus gentechnisch verändertem Mais hergestellt
Darreichungsform und Wirkstoffmenge pro Einheit
Injektionslösung (zur subkutanen Anwendung).
1200 mg Pertuzumab/600 mg Trastuzumab/15 ml Lösung in einer Durchstechflasche.
600 mg Pertuzumab/600 mg Trastuzumab/10 ml Lösung in einer Durchstechflasche.
Phesgo ist eine klare, opaleszente, farblose bis leicht bräunliche Lösung in sterilen, konservierungsmittelfreien, nicht-pyrogenen Durchstechflaschen zur Einmalentnahme.
Indikationen/Anwendungsmöglichkeiten
Metastasierter Brustkrebs
Phesgo ist in Kombination mit Docetaxel zur Behandlung von Patienten mit HER2-positivem metastasierendem oder lokal rezidivierendem nicht resezierbarem Brustkrebs indiziert, die noch keine Chemotherapie gegen ihre metastasierte Erkrankung erhalten haben.
Brustkrebs im Frühstadium
Phesgo ist in Kombination mit Docetaxel für die neoadjuvante Behandlung von Patienten mit HER2-positivem, lokal fortgeschrittenem, entzündlichem Brustkrebs oder Brustkrebs im Frühstadium mit hohem Rezidiv Risiko (entweder Tumorgrösse > 2 cm Durchmesser oder mit Lymphknotenbefall) im Rahmen eines Therapieplanes für Brustkrebs im Frühstadium indiziert.
Phesgo ist in Kombination mit Chemotherapie für die adjuvante Behandlung von Patienten mit HER2-positivem Brustkrebs im Frühstadium mit hohem Rezidivrisiko indiziert (siehe Rubrik «Eigenschaften/Wirkungen», Abschnitt «Klinische Wirksamkeit»).
Dosierung/Anwendung
Eine Therapie mit Phesgo sollte unbedingt unter Aufsicht einer Ärztin oder eines Arztes mit Erfahrung in der Behandlung von Krebspatienten eingeleitet werden.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Patienten, denen derzeit Pertuzumab und Trastuzumab intravenös verabreicht wird, können auf Phesgo umgestellt werden. Der Wechsel von intravenös verabreichtem Pertuzumab und Trastuzumab auf Phesgo (oder umgekehrt) wurde in der Studie MO40628 untersucht (siehe «Unerwünschte Wirkungen» und «Klinische Wirksamkeit»).
Zur Vermeidung von Medikationsfehlern ist es wichtig, das Etikett der Durchstechflasche zu prüfen, um sicherzustellen, dass es sich bei dem zubereiteten und angewendeten Arzneimittel um Phesgo handelt.
Phesgo ist nur für die subkutane (s.c.) Gabe in den Oberschenkel bestimmt. Nicht intravenös verabreichen.
Bei Patienten, die mit Phesgo behandelt werden, sollte der Tumorstatus HER2-positiv sein, definiert als Wert von 3+ in der Immunhistochemie (IHC) oder Verhältnis von ≥2,0 bei der In-situ-Hybridisierung (ISH) bei Beurteilung anhand eines validierten Tests.
Zur Sicherstellung akkurater und reproduzierbarer Ergebnisse müssen die Tests in einem spezialisierten Labor durchgeführt werden, das eine Validierung der Testverfahren gewährleisten kann.
Vollständige Anweisungen zur Leistung und Interpretation des Assays sind den Packungsbeilagen validierter HER2-Testassays zu entnehmen.
Übliche Dosierung
Metastasierender Brustkrebs und Brustkrebs im Frühstadium
Dosisempfehlungen für Phesgo bei Brustkrebs im Frühstadium und metastasierendem Brustkrebs sind Tabelle 1 zu entnehmen.
Tabelle 1: Empfohlene Dosierung und Anwendung von Phesgo
Dosis (unabhängig vom Körpergewicht) | Ungefähre Dauer der subkutanen Injektion | Überwachungszeitraumab | |
Initialdosis | 1200 mg Pertuzumab/600 mg Trastuzumab | 8 Minuten | 30 Minuten |
Erhaltungsdosis (alle 3 Wochen danach) | 600mg Pertuzumab/600mg Trastuzumab | 5 Minuten | 15 Minuten |
a Die Patienten sollten auf injektionsbedingte Reaktionen und Überempfindlichkeitsreaktionen überwacht werden.
b Der Überwachungszeitraum sollte nach Gabe von Phesgo beginnen und vor der nächsten Chemotherapiegabe abgeschlossen worden sein.
Die Injektion sollte ausschliesslich und abwechselnd in den linken und rechten Oberschenkel erfolgen. Neue Injektionen sollten mindestens 2,5 cm von der vorgängigen Stelle entfernt in gesunde Haut und niemals in Bereiche mit Rötung, Prellung, Berührungsempfindlichkeit oder Verhärtung der Haut verabreicht werden. Die Dosis nicht auf zwei Spritzen oder auf zwei Injektionsstellen aufteilen. Während des Behandlungszyklus mit Phesgo sollten andere subkutan anzuwendende Medikamente vorzugsweise an anderen Stellen injiziert werden.
Wechsel von intravenös verabreichtem Pertuzumab und Trastuzumab auf Phesgo
Patienten, denen Pertuzumab und Trastuzumab intravenös verabreicht wird und welche die letzte Dosis vor < 6 Wochen erhalten haben, sollte Phesgo als Erhaltungsdosis aus 600 mg Pertuzumab/600 mg Trastuzumab und danach alle 3 Wochen verabreicht werden. Patienten, denen Pertuzumab und Trastuzumab intravenös verabreicht wird und welche die letzte Dosis vor ≥6 Wochen erhalten haben, sollte Phesgo als Initialdosis aus 1200 mg Pertuzumab/600 mg Trastuzumab und danach alle 3 Wochen als Erhaltungsdosis aus 600 mg Pertuzumab/600 mg Trastuzumab verabreicht werden.
Bei Patienten unter Behandlung mit einem Taxan sollte Phesgo vor dem Taxan gegeben werden. Bei Verabreichung mit Phesgo beträgt die empfohlene Initialdosis von Docetaxel 75 mg/m2.
Bei Patienten, die ein Regime auf Anthracyclin-Basis erhalten, sollte Phesgo erst nach vollständigem Abschluss des Anthracyclin-Regimes gegeben werden.
Therapiedauer
Brustkrebs im Frühstadium (Early Breast Cancer, EBC)
Im neoadjuvanten Setting (vor der Operation) wird empfohlen, die Patienten über drei bis sechs Zyklen (je nachdem, welches Regime in Kombination mit der Chemotherapie gewählt wird) mit Phesgo zu behandeln (siehe «Klinische Wirksamkeit»).
Im adjuvanten Setting (nach der Operation) sollte Phesgo für die Dauer von insgesamt einem Jahr (maximal 18 Zyklen oder bis zum Auftreten eines Rezidivs oder nicht kontrollierbarer Toxizität, je nachdem, welches Ereignis zuerst eintritt) im Rahmen eines vollständigen Regimes für Brustkrebs im Frühstadium, einschliesslich einer Standardchemotherapie auf Anthracyclin- und/oder Taxanbasis, verabreicht werden. Die Behandlung mit Phesgo sollte an Tag 1 des ersten Taxan enthaltenden Zyklus beginnen und auch bei Absetzen der Chemotherapie fortgesetzt werden (siehe «Klinische Wirksamkeit»).
Patienten, bei denen eine Behandlung mit Phesgo im neoadjuvanten Setting begonnen wird, sollten Phesgo weiterhin auch adjuvant erhalten, um insgesamt 1 Jahr lang (maximal 18 Zyklen) behandelt zu werden.
Metastasierender Brustkrebs (Metastatic Breast Cancer, MBC)
Die Gabe von Phesgo sollte in Kombination mit Docetaxel bis zum Fortschreiten der Krankheit oder bis zum Auftreten nicht kontrollierbarer Toxizität erfolgen. Die Behandlung mit Phesgo kann auch bei Absetzen der Behandlung mit Docetaxel fortgesetzt werden.
Dosisanpassung aufgrund unerwünschter Wirkungen/Interaktionen
Eine Dosisreduktion von Phesgo wird nicht empfohlen.
Bezüglich der Anpassung der Dosis der Chemotherapie ist die jeweilige Verschreibungsinformation zu beachten.
Injektionsbedingte Reaktionen
Wenn bei dem Patienten injektionsbedingte Symptome auftreten, sollte die Injektion langsamer durchgeführt oder unterbrochen werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Überempfindlichkeit/Anaphylaxie
Wenn bei dem Patienten eine schwerwiegende Überempfindlichkeitsreaktion (z.B. Anaphylaxie) auftritt, sollte die Injektion sofort und dauerhaft beendet werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Linksventrikuläre Dysfunktion
Siehe «Warnhinweise und Vorsichtsmassnahmen» bezüglich Dosisempfehlungen im Falle einer linksventrikulären Dysfunktion.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Die Sicherheit und Wirksamkeit von Phesgo bei Patienten mit Leberfunktionsstörung wurden nicht untersucht. Es können keine Dosisempfehlungen für Phesgo erteilt werden (siehe «Kinetik spezieller Patientengruppen»).
Patienten mit Nierenfunktionsstörungen
Bei Patienten mit leichter oder mittelstarker Nierenfunktionsstörung sind keine Anpassungen der Dosis von Phesgo erforderlich. Für Patienten mit schwerer Nierenfunktionsstörung können keine Dosisempfehlungen erteilt werden, da die Datenlage zur Pharmakokinetik beschränkt ist (siehe «Kinetik spezieller Patientengruppen»).
Ältere Patienten
Bei Patienten ≥65 Jahren sind keine Dosisanpassungen von Phesgo erforderlich, wobei die diesbezügliche Datenlage auf 26 Patienten beschränkt ist (siehe «Sicherheit und Wirksamkeit bei älteren Patienten» und «Kinetik spezieller Patientengruppen»).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Phesgo bei Kindern und Jugendlichen (< 18 Jahren) wurden nicht untersucht.
Verspätete Dosisgabe
Wenn der Abstand zwischen zwei aufeinanderfolgenden Dosen weniger als 6 Wochen beträgt, sollte die Erhaltungsdosis von Phesgo mit 600 mg Pertuzumab/600 mg Trastuzumab sobald wie möglich gegeben werden. Nicht bis zur nächsten geplanten Dosis warten.
Wenn der Abstand zwischen zwei aufeinanderfolgenden Dosen 6 Wochen oder mehr beträgt, sollte noch einmal die Initialdosis aus 1200 mg Pertuzumab/600 mg Trastuzumab gegeben werden, gefolgt von der Erhaltungsdosis aus 600 mg Pertuzumab/600 mg Trastuzumab alle 3 Wochen.
Kontraindikationen
Phesgo ist bei Patienten mit bekannter Überempfindlichkeit auf Pertuzumab, Trastuzumab oder einen der Hilfsstoffe kontraindiziert.
Warnhinweise und Vorsichtsmassnahmen
Linksventrikuläre Dysfunktion
Bei Wirkstoffen, die die HER2-Aktivität blockieren, einschliesslich Pertuzumab und Trastuzumab, wurde über eine Abnahme der linksventrikulären Ejektionsfraktion (LVEF) berichtet. Die Inzidenz einer symptomatischen linksventrikulären systolischen Dysfunktion (LVD [Stauungsinsuffizienz]) war bei Patienten unter Behandlung mit Pertuzumab in Kombination mit Trastuzumab und Chemotherapie höher als bei solchen unter Behandlung mit Trastuzumab und Chemotherapie. Im adjuvanten Setting traten die meisten Fälle einer symptomatischen Herzinsuffizienz bei Patienten auf, die eine Chemotherapie auf Anthracyclin-Basis erhielten (siehe «Unerwünschte Wirkungen»). Studien mit intravenösem Pertuzumab in Kombination mit Trastuzumab und Chemotherapie zufolge besteht bei Patienten, die vorgängig Anthracycline oder eine Strahlentherapie im Brustbereich erhalten haben, eventuell ein höheres Risiko einer verringerten LVEF.
Phesgo und/oder intravenöses Pertuzumab und Trastuzumab wurden nicht untersucht bei Patienten mit einem LVEF-Wert von < 55 % (EBC) oder < 50 % (MBC) vor der Behandlung, solchen mit Stauungsinsuffizienz in der Vorgeschichte, solchen, bei denen Gegebenheiten vorliegen, welche die linksventrikuläre Funktion beeinträchtigen könnten, beispielsweise unkontrollierter Bluthochdruck, kürzlicher Myokardinfarkt, behandlungspflichtige, schwerwiegende kardiale Arrhythmie, oder solchen mit kumulativer vorgängiger Anthracyclinexposition mit > 360 mg/m2 Doxorubicin oder einer entsprechenden Dosis von dessen Äquivalent. Intravenöses Pertuzumab in Kombination mit Trastuzumab und Chemotherapie wurde nicht bei Patienten untersucht, bei denen es während einer vorgängigen adjuvanten Trastuzumab-Therapie zu einer Verringerung der LVEF auf < 50 % kam.
Die LVEF ist vor Beginn der Anwendung von Phesgo und in regelmässigen Abständen während der Behandlung zu kontrollieren, um sicherzustellen, dass der Wert innerhalb der normalen Grenzen liegt (siehe Tabelle 2 unten). Wenn sich die LVEF wie in Tabelle 2 angegeben verringert und sich bei der nächsten Beurteilung nicht wieder verbessert bzw. sich weiter verschlechtert hat, sollte dringend erwogen werden, Phesgo abzusetzen, es sei denn, die Vorteile für den jeweiligen Patienten werden höher eingeschätzt als die Risiken.
Tabelle 2: Dosisempfehlung bei linksventrikulärer Dysfunktion
LVEF vor der Behandlung: | Kontrolle der LVEF alle: | Die Gabe von Phesgo für mindestens 3 Wochen unterbrechen, wenn sich die LVEF verringert auf: | Die Gabe von Phesgo nach 3 Wochen fortsetzen, wenn sich die LVEF wieder verbessert hat auf: | |||
Metastasierender Brustkrebsa | ≥50 % | ~ 12 Wochen | Entweder | Entweder | ||
< 40 % | 40 %–45 % mit einem Abfall um ≥10 Prozentpunkte unter den Wert vor der Behandlung | > 45 % | 40 %–45 % mit einem Abfall um < 10 Prozentpunkte unter den Wert vor der Behandlung | |||
Brustkrebs im Frühstadium | ≥55 %b | ~ 12 Wochen (einmal im neoadjuvanten Setting) | < 50 % mit einem Abfall um ≥10 Prozentpunkte unter den Wert vor der Behandlung | Entweder | ||
≥50 % | < 10 Prozentpunkte unter den Wert vor der Behandlung | |||||
a Basierend auf Daten zur intravenösen Anwendung von Pertuzumab (CLEOPATRA-Studie).
b Bei Patienten unter Behandlung mit einer Chemotherapie auf Anthracyclin-Basis ist nach Beendigung der Anthracyclintherapie eine LVEF von ≥50 % erforderlich, bevor mit der Anwendung von Phesgo begonnen wird.
Injektions-/Infusionsbedingte Reaktionen (IRRs)
Phesgo wurde mit injektionsbedingten Reaktionen in Zusammenhang gebracht. Injektionsbedingte Reaktionen waren definiert als jegliche systemische Reaktion mit Symptomen wie Fieber, Schüttelfrost, Kopfschmerzen wahrscheinlich aufgrund der Freisetzung von Zytokinen innerhalb von 24 Stunden nach der Gabe von Phesgo. Es wird eine engmaschige Beobachtung des Patienten während und für 30 Minuten nach der Gabe der Initialdosis sowie während und für 15 Minuten nach Gabe der Erhaltungsdosis von Phesgo empfohlen. Wenn eine erhebliche injektionsbedingte Reaktion auftritt, sollte die Injektion langsamer durchgeführt oder unterbrochen werden, und es sollten geeignete medizinische Therapien implementiert werden. Die Patienten sind zu beurteilen und sorgfältig zu überwachen, bis die Anzeichen und Symptome vollständig verschwunden sind. Bei Patienten mit starken injektionsbedingten Reaktionen sollte ein dauerhaftes Absetzen der Behandlung in Betracht gezogen werden. Die entsprechende klinische Beurteilung sollte auf der Grundlage des Schweregrads der vorhergehenden Reaktion und des Ansprechens auf die angewendete Behandlung gegen die unerwünschte Reaktion erfolgen (siehe «Dosierung/Anwendung»). Zwar sind keine Fälle mit tödlichem Ausgang aufgrund von injektionsbedingten Reaktionen nach Gabe von Phesgo beobachtet worden, aber dennoch ist Vorsicht geboten, da mit intravenösem Pertuzumab in Kombination mit intravenösem Trastuzumab und Chemotherapie tödliche infusionsbedingte Reaktionen in Verbindung gebracht wurden.
Überempfindlichkeitsreaktionen/Anaphylaxie
Die Patienten sind engmaschig auf Überempfindlichkeitsreaktionen zu beobachten. Wenngleich bei Patienten unter Behandlung mit Phesgo keine schweren Überempfindlichkeitsreaktionen, einschliesslich Anaphylaxie und Ereignisse mit tödlichem Ausgang, beobachtet wurden, ist dennoch Vorsicht geboten, da intravenöses Pertuzumab in Kombination mit Trastuzumab und Chemotherapie mit solchen Reaktionen in Verbindung gebracht worden ist (siehe «Unerwünschte Wirkungen»). Es sollten Medikamente zur Behandlung solcher Reaktionen sowie eine entsprechende Notfallausrüstung für den sofortigen Einsatz bereitstehen. Phesgo ist bei Patienten mit bekannter Überempfindlichkeit auf Pertuzumab, Trastuzumab oder einen der Hilfsstoffe kontraindiziert (siehe «Kontraindikationen»).
Pulmonale Reaktionen
Über schwerwiegende unerwünschte Wirkungen der Lunge während der Behandlung mit Trastuzumab in der Post-Marketing Phase wurde berichtet (siehe «Unerwünschte Wirkungen»). Manche dieser Fälle hatten einen fatalen Ausgang und können als Teil einer infusionsbedingten Reaktion oder als verspätete Reaktion auftreten. Zusätzlich wurde über interstitielle Lungenerkrankung einschliesslich Lungeninfiltrationen, akutes Atemnot Syndrom, Pneumonie, Pneumonitis, pleurale Effusionen, Atembeschwerden, akute pulmonale Ödeme und Atemversagen berichtet.
Risikofaktoren im Zusammenhang mit interstitiellen Lungenerkrankungen schliessen frühere oder gleichzeitig durchgeführte andere anti-neoplastische Therapien ein, bei denen ein Zusammenhang mit interstitiellen Lungenerkrankungen bekannt ist, wie beispielsweise Taxane, Gemcitabin, Vinorelbin und Strahlentherapie. Bei Patienten, die aufgrund von Komplikationen einer fortgeschrittenen malignen Erkrankung und Komorbiditäten an einer Ruhedyspnoe leiden, kann ein erhöhtes Risiko für pulmonale Ereignisse bestehen. Daher sollten diese Patienten nicht mit Phesgo behandelt werden.
Febrile Neutropenie
Patienten, die mit Pertuzumab, Trastuzumab und Docetaxel behandelt werden, haben im Vergleich zu Patienten, die mit Placebo, Trastuzumab und Docetaxel behandelt werden, vor allem während der ersten 3 Zyklen der Behandlung ein erhöhtes Risiko für eine febrile Neutropenie (siehe «Unerwünschte Wirkungen»); darum ist bei der Anwendung von Phesgo Vorsicht geboten. In der CLEOPATRA Studie bei metastasiertem Brustkrebs war der Nadir der Neutrophilenzahl bei Patienten, die mit Pertuzumab behandelt wurden, und bei Patienten, die mit Placebo behandelt wurden, ähnlich. Bei Patienten, die mit Pertuzumab behandelt wurden, war die höhere Inzidenz febriler Neutropenien mit einer höheren Inzidenz von Mukositis und Diarrhoe assoziiert. Es sollte eine symptomatische Behandlung der Mukositis und der Diarrhoe in Erwägung gezogen werden. Nach Absetzen von Docetaxel wurden keine Ereignisse von febriler Neutropenie berichtet.
Diarrhoe
Phesgo kann schwere Diarrhoe hervorrufen. Diarrhoe tritt am häufigsten während der gleichzeitigen Gabe einer Taxan-Therapie auf. Zur Behandlung einer Diarrhoe nach der Standardpraxis und den Standardleitlinien vorgehen. Es sollte eine frühzeitige Intervention mit Loperamid, Flüssigkeitszufuhr und Elektrolytersatz erwogen werden, insbesondere bei älteren Patienten und im Falle einer schweren oder länger anhaltenden Diarrhoe. Wenn keine Verbesserung des Zustandes erreicht werden kann, sollte eine Unterbrechung der Behandlung mit Phesgo in Erwägung gezogen werden. Wenn die Diarrhoe wirksam behandelt wurde, kann die Behandlung mit Phesgo wiederaufgenommen werden.
Interaktionen
Es wurden keine formalen Arzneimittelinteraktionsstudien durchgeführt.
Intravenöses Pertuzumab
Eine im Rahmen der Pivotstudie CLEOPATRA durchgeführte Teilstudie bei 37 Patienten lieferte keine Hinweise auf eine Arzneimittelwechselwirkung zwischen Pertuzumab und Trastuzumab oder zwischen Pertuzumab und Docetaxel. Darüber hinaus war ausgehend von der Analyse der Populationspharmakokinetik keine klinisch relevante pharmakokinetische Wechselwirkung zwischen gleichzeitig gegebenem Docetaxel oder Trastuzumab und Pertuzumab zu erkennen. Dieses Nichtvorhandensein von Arzneimittelinteraktionen wurde durch pharmakokinetische Daten aus den Studien NEOSPHERE und APHINITY bestätigt.
Fünf Studien untersuchten die Auswirkungen von Pertuzumab auf die Pharmakokinetik von gleichzeitig angewendeten Zytostatika, Docetaxel, Paclitaxel, Gemcitabin, Capecitabin, Carboplatin und Erlotinib. Es gab keine Hinweise auf eine pharmakokinetische Interaktion zwischen Pertuzumab und einem dieser Wirkstoffe. Die Pharmakokinetik von Pertuzumab in diesen Studien war mit der in Einzelwirkstoffstudien beobachteten vergleichbar.
Intravenöses Trastuzumab
Es wurden keine formalen Arzneimittelinteraktionsstudien mit Trastuzumab beim Menschen durchgeführt. Es wurden keine klinisch bedeutsamen Interaktionen zwischen Trastuzumab und den in klinischen Studien eingesetzten Begleitmedikamenten beobachtet.
In Studien, in denen Trastuzumab in Kombination mit Docetaxel, Carboplatin oder Anastrozol verabreicht wurde, war weder die Pharmakokinetik dieser Wirkstoffe noch die Pharmakokinetik von Trastuzumab verändert.
Die Konzentrationen von Paclitaxel und Doxorubicin (und ihren Hauptmetaboliten 6-α-Hydroxylpaclitaxel, POH und Doxorubicinol, DOL) waren bei Vorhandensein von Trastuzumab nicht verändert. Trastuzumab kann jedoch die Gesamtexposition gegenüber einem Doxorubicin-Metaboliten (7-Desoxy-13-dihydro-doxorubicinon, D7D) erhöhen. Die Bioaktivität von D7D und die klinischen Auswirkungen der Erhöhung dieses Metaboliten sind unklar. Es wurden keine Veränderungen der Trastuzumabkonzentrationen bei Vorhandensein von Paclitaxel und Doxorubicin festgestellt.
Die Ergebnisse einer Teilstudie zur Arzneimittelinteraktion, in der die Pharmakokinetik von Capecitabin und Cisplatin bei Anwendung zusammen mit oder ohne Trastuzumab untersucht wurde, liessen den Schluss zu, dass die Exposition gegenüber den bioaktiven Metaboliten (z.B. 5-FU) von Capecitabin durch die gleichzeitige Anwendung von Cisplatin oder durch die gleichzeitige Anwendung von Cisplatin plus Trastuzumab nicht beeinflusst wurde. Für Capecitabin selbst ergaben sich jedoch bei Anwendung in Kombination mit Trastuzumab höhere Konzentrationen und eine längere Halbwertszeit. Die Daten legen auch nahe, dass die Pharmakokinetik von Cisplatin durch gleichzeitige Anwendung oder Capecitabin oder durch gleichzeitige Anwendung von Capecitabin plus Trastuzumab nicht beeinflusst wurden.
Schwangerschaft/Stillzeit
Kontrazeption
Gebärfähige Frauen, einschliesslich der Partnerinnen männlicher Patienten, sollten während der Behandlung mit Phesgo und 7 Monate nach der letzten Dosis von Phesgo eine wirksame Verhütungsmethode anwenden.
Schwangerschaft
Es wurden keine klinischen Studien mit Phesgo bei Schwangeren durchgeführt. Im Rahmen der Anwendungsbeobachtung nach der Markteinführung von Trastuzumab wurden bei schwangeren Frauen Fälle mit Beeinträchtigung des fötalen Nierenwachstums und/oder der fötalen Nierenfunktion in Verbindung mit Oligohydramnion berichtet, von denen einige zu einer tödlichen Lungenhypoplasie des Fötus führten. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt und nachgewiesen, dass Trastuzumab plazentagängig ist (siehe «Präklinische Daten»). Phesgo sollte während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich, da der potentielle Nutzen für die Mutter das mögliche Risiko für den Fötus überwiegt.
Phesgo enthält rekombinante humane Hyaluronidase (rHuPH20). Zum möglichen Einfluss von rHuPH20 auf Reproduktionsparameter und Embryonalentwicklung beim Tier siehe «Präklinische Daten». Der Einfluss neutralisierender Antikörper gegen rHuPH20 oder endogene Hyaluronidase auf Reproduktionsparameter ist unbekannt.
Ausgehend von den Post-Marketing-Daten und tierexperimentellen Studien kann Phesgo das ungeborene Kind schädigen, wenn es bei einer schwangeren Frau angewendet wird. Frauen, die schwanger werden, sollten auf die Möglichkeit einer Schädigung des Fötus hingewiesen werden. Wenn eine schwangere Frau mit Phesgo behandelt wird oder eine Patientin während der Behandlung mit Phesgo oder innerhalb von 7 Monaten nach der letzten Dosis von Phesgo schwanger wird, ist eine engmaschige Überwachung durch ein multidisziplinäres Team ratsam.
Stillzeit
Es ist nicht bekannt, ob Phesgo beim Menschen in die Milch übertritt. Tierexperimentell wurde gezeigt, dass Trastuzumab in die Milch übertritt (siehe «Präklinische Daten») Für Pertuzumab liegen keine Daten vor. Da menschliches IgG in die Muttermilch übergeht und das Potenzial für eine Aufnahme durch den Säugling und eine Schädigung des Säuglings unbekannt ist, sollte Frauen geraten werden, während der Behandlung mit Phesgo und in den 7 Monaten nach der letzten Dosis von Phesgo nicht zu stillen.
Fertilität
Es liegen keine klinischen Daten mit Phesgo zur Fertilität vor. Tierexperimentelle Studien mit Pertuzumab oder Trastuzumab ergaben keinen Hinweis auf eine Beeinträchtigung der Fertilität (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Phesgo hat einen geringen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen. Während der Behandlung mit Phesgo können injektionsbedingte Reaktionen und Schwindel auftreten (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Unerwünschte Wirkungen»).
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Das Sicherheitsprofil von Phesgo beruht auf Daten aus der Phase-III-Studie FEDERICA, in der Patienten mit HER2-positivem Brustkrebs entweder mit Phesgo (n = 248) oder intravenösem Pertuzumab und Trastuzumab (n = 252) in Kombination mit einer Chemotherapie behandelt wurden.
Die häufigsten (≥5 %) unerwünschten Arzneimittelwirkungen (UAW) bei Patienten unter Behandlung mit Phesgo oder intravenösem Pertuzumab in Kombination mit Trastuzumab waren Durchfall, Reaktion an der Injektionsstelle, infusionsbedingte Reaktionen, Asthenie, Müdigkeit, Hautausschlag, verringerte Ejektionsfraktion und Anämie.
Die häufigsten (≥1 %) schwerwiegenden unerwünschten Ereignisse (SUEs) bei Patienten unter Behandlung mit Phesgo oder intravenösem Pertuzumab in Kombination mit Trastuzumab waren febrile Neutropenie, Pyrexie, Neutropenie/verringerte Neutrophilenzahl, neutropenische Sepsis und infusionsbedingte Reaktionen. Die SUEs waren im Behandlungsarm mit Phesgo und im Behandlungsarm mit intravenösem Pertuzumab in Kombination mit Trastuzumab jeweils gleich verteilt. Die folgenden unerwünschten Arzneimittelwirkungen wurden bei Anwendung von Phesgo im Vergleich zu intravenösem Pertuzumab in Kombination mit Trastuzumab häufiger (≥5 %) berichtet: Alopezie 77 % vs. 70,2 %, Dyspnoe 10,1 % vs. 4,4 % und Müdigkeit 27,8 % vs. 22,6 %.
Tabellarische Liste der unerwünschten Arzneimittelwirkungen
Das Sicherheitsprofil von Phesgo stimmte insgesamt mit dem bekannten Sicherheitsprofil von intravenösem Pertuzumab in Kombination mit Trastuzumab und Chemotherapie aus den folgenden Pivotstudien (n = 3344) bei Behandlung mit Pertuzumab und Trastuzumab überein:
- CLEOPATRA, in der Patienten mit MBC Pertuzumab in Kombination mit Trastuzumab und Docetaxel erhielten (n = 453).
- NEOSPHERE (n = 309) und TRYPHAENA (n = 218), in denen Patienten mit lokal fortgeschrittenem, entzündlichem Brustkrebs oder EBC neoadjuvantes Pertuzumab in Kombination mit Trastuzumab und Chemotherapie erhielten.
- APHINITY, in der Patienten mit EBC adjuvantes Pertuzumab in Kombination mit Trastuzumab und einer taxanhaltigen Chemotherapie auf Anthracyclin-Basis oder nicht auf Anthracyclin-Basis erhielten (n = 2364).
Unten sind UAW aufgeführt, die im Zusammenhang mit der Anwendung von Pertuzumab, Trastuzumab und Chemotherapie in den klinischen Pivotstudien und im Rahmen der Anwendungsbeobachtung nach der Markteinführung berichtet wurden.
Da Pertuzumab/Trastuzumab in Kombination mit einer Chemotherapie angewendet wird, ist es schwierig, einen kausalen Zusammenhang zwischen einer unerwünschten Wirkung und einem bestimmten Wirkstoff festzustellen.
In diesem Abschnitt wurden die folgenden Häufigkeitskategorien verwendet: «sehr häufig» (≥1/10), «häufig» (< 1/10 bis ≥1/100), «gelegentlich» (< 1/100 bis ≥1/1000), «selten» (< 1/1000 bis ≥1/10'000), «sehr selten» (< 1/10'000) und nicht bekannt (auf Grundlage der verfügbaren Daten nicht abschätzbar). Innerhalb jeder Häufigkeitsgruppierung sind die unerwünschten Wirkungen nach abnehmendem Schweregrad angeordnet.
Die folgenden unerwünschte Arzneimittelwirkungen, wurden in den Pivotstudien mit Pertuzumab, Trastuzumab und im Rahmen der Anwendungsbeobachtung nach der Markteinführung berichtet a,b,c
Infektionen und parasitäre Erkrankungen
Sehr häufig: Nasopharyngitis (12,8 % (Grad 3-4< 0,1 %)).
Häufig: Infektionen der oberen Atemwege, Paronychie.
Erkrankungen des Blutes und des Lymphsystems
Sehr häufig: Neutropenie (31,4 % (Grad 3-4 24,2 %)), Anämie (24,8 % (Grad 3-4 5,7 %)), febrile Neutropenied (11,9 % (Grad 3-4 11,8 %)), Leukopenie (10,8 % (Grad 3-4 6,1 %)).
Erkrankungen des Immunsystems
Häufig: Überempfindlichkeit, Arzneimittelüberempfindlichkeit.
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Verminderter Appetit (23,1 % (Grad 3-4 0,8 %)).
Nicht bekannt: Tumorlysesyndromg.
Psychiatrische Erkrankungen
Sehr häufig: Schlaflosigkeit (15,9 % (Grad 3-4 0,2 %)).
Erkrankungen des Nervensystems
Sehr häufig: Dysgeusie (22,7 % (Grad 3-4< 0,1 %)), Kopfschmerzen (21,8 % (Grad 3-4 0,4 %)), periphere sensorische Neuropathie (15,7 % (Grad 3-4 0,5 %)), periphere Neuropathie (14,7 % (Grad 3-4 0,7 %)), Schwindel (11,2 % (Grad 3-4 0,1 %)), Parästhesie (10,2 % (Grad 3-4 0,4 %)).
Augenerkrankungen
Sehr häufig: Verstärkter Tränenfluss (12,1 %).
Herzerkrankungen
Häufig: Linksventrikuläre Dysfunktione.
Gelegentlich: Stauungsinsuffizienze.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Sehr häufig: Epistaxis (15,6 % (Grad 3-4< 0,1 %)), Husten (15,5 % (Grad 3-4< 0,1 %)), Dyspnoe (11,5 % (Grad 3-4 0,5 %)).
Gelegentlich: Pleuraerguss.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Diarrhoe (67,9 % (Grad 3-4 8,9 %)), Übelkeit (60,8 % (Grad 3-4 1,9 %)), Erbrechen (30,0 % (Grad 3-4 1,7 %)), Stomatitis (24,9 % (Grad 3-4 1,6 %)), Obstipation (24,5 % (Grad 3-4 0,4 %)), Dyspepsie (13,2 % (Grad 3-4< 0,1 %)), Bauchschmerzen (11,7 % (Grad 3-4 0,4 %)).
Erkrankungen der Haut und des Unterhautzellgewebes
Sehr häufig: Alopezie (63,1 % (Grad 3-4< 0,1 %)), Rash (26,4 % (Grad 3-4 0,5 %)), Störungen der Nägel (12,9 % (Grad 3-4 0,3 %)), Pruritus (12,9 % (Grad 3-4< 0,1 %)), trockene Haut (11,7 % (Grad 3-4< 0,1 %)).
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr häufig: Arthralgie (24,6 % (Grad 3-4 0,7 %)), Myalgie (24,3 % (Grad 3-4 0,8 %)), Extremitätenschmerzen (10,0 % (Grad 3-4 0,2 %)).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Müdigkeit (44,3 % (Grad 3-4 3,3 %)), Entzündungen der Schleimhäute (23,2 % (Grad 3-4 1,5 %)), Asthenie (20,9 % (Grad 3-4 1,5 %)), Fieber (18,9 % (Grad 3-4 0,6 %)), periphere Ödeme (16,2 % (Grad 3-4< 0,1 %)), Reaktion an der Injektionsstelle (12,9%, Grad 3-4: 0%)f.
Gefässerkrankungen
Sehr häufig: Hitzewallungen (15,7 % (Grad 3-4 0,1 %)).
a Gepoolte Daten aus dem gesamten Behandlungszeitraum in der Studie CLEOPATRA; aus dem Zeitraum der neoadjuvanten Behandlung in den Studien NEOSPHERE und TRYPHAENA; und aus dem Behandlungszeitraum in der Studie APHINITY. Darüber hinaus werden UAW gelistet, die für die Art der Anwendung von Phesgo spezifisch sind und in der Studie FEDERICA berichtet wurden.
b In der Studie NEOSPHERE erhielten 108 Patienten nur Pertuzumab + Trastuzumab ohne Docetaxel, und 94 Patienten erhielten Pertuzumab + Docetaxel ohne Trastuzumab.
c In der Studie CLEOPATRA wechselten 45 Patienten, die nach der Randomisierung das Placebo erhalten hatten und zuvor noch nicht mit Pertuzumab behandelt worden waren, zu einer Behandlung mit Pertuzumab und sind in der Zahl von 3344 Patienten unter Behandlung mit Pertuzumab eingeschlossen.
d Dies bezeichnet eine unerwünschte Wirkung, die im Zusammenhang mit einem tödlichen Ausgang gemeldet wurde.
e Die Inzidenz einer linksventrikulären Dysfunktion und Stauungsinsuffizienz spiegelt die in den einzelnen Studien angegebenen bevorzugten Terme gemäss MedDRA wider.
f Wurde nur bei Anwendung von Phesgo festgestellt.
g Wurde im Rahmen der Anwendungsbeobachtung nach der Markteinführung festgestellt.
Beschreibung ausgewählter Nebenwirkungen aus klinischen Studien
Phesgo
Linksventrikuläre Dysfunktion
In der Studie FEDERICA betrug die Inzidenz einer symptomatischen Herzinsuffizienz (NYHA-Klasse III oder IV) mit einer Verringerung der LVEF um mindestens 10 Prozentpunkte gegenüber dem Ausgangswert und auf < 50 % bei mit Phesgo behandelten Patienten 0,4 % vs. 0 % bei Patienten, die intravenöses Pertuzumab und Trastuzumab erhielten. Von den Patienten mit symptomatischer Herzinsuffizienz hatten sich zum Zeitpunkt des Daten-Cutoffs alle mit Phesgo behandelten Patienten wieder erholt (definiert als 2 aufeinanderfolgende LVEF-Messungen über 50 %). Asymptomatische oder leicht symptomatische (NYHA-Klasse II) Verringerungen der LVEF um mindestens 10 Prozentpunkte gegenüber dem Ausgangswert und auf < 50 % (bestätigt durch zweite Messung LVEF) wurden bei 0,4 % der mit Phesgo behandelten Patienten und bei 0,8 % der mit intravenösem Pertuzumab und Trastuzumab behandelten Patienten festgestellt, von denen sich keiner der mit Phesgo behandelten Patienten oder der mit intravenösem Pertuzumab und Trastuzumab behandelten Patienten zum Zeitpunkt des Daten-Cutoffs erholt hatte.
Injektions-/Infusionsbedingte Reaktionen
In der Studie FEDERICA war eine injektions-/infusionsbedingte Reaktion definiert als jede systemische Reaktion, die innerhalb von 24 Stunden nach Gabe von Phesgo oder intravenösem Pertuzumab in Kombination mit der Gabe von Trastuzumab berichtet wurde. Injektionsbedingte Reaktionen wurden bei 1,2 % der mit Phesgo behandelten Patienten und infusionsbedingte Reaktionen bei 10,3 % der mit intravenösem Pertuzumab und Trastuzumab behandelten Patienten berichtet.
Reaktionen an der Injektionsstelle (definiert als jede lokale Reaktion, die innerhalb von 24 Stunden nach Gabe von Phesgo gemeldet wurde) wurden bei 12,9 % der mit Phesgo behandelten Patienten gemeldet, und bei allen handelte es sich um Ereignisse vom Grad 1 oder 2.
Überempfindlichkeitsreaktionen/Anaphylaxie
In der Studie FEDERICA betrug die Gesamthäufigkeit der im Zusammenhang mit einer auf HER2 abzielenden Therapie berichteten Überempfindlichkeits-/Anaphylaxie-Ereignisse sowohl bei den mit Phesgobehandelten Patienten als auch bei den mit intravenösem Pertuzumab und Trastuzumab behandelten Patienten jeweils 1,6 %, und keines dieser Ereignisse war vom NCI-CTCAE (Version 4) Grad 3–4 (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Intravenöses Pertuzumab und Trastuzumab
Linksventrikuläre Dysfunktion
In der Studie CLEOPATRA war die Inzidenz von LVD während der Studienbehandlung in der placebobehandelten Gruppe höher als in der mit Pertuzumab behandelten Gruppe (8,6 % bzw. 6,6 %). Auch die Inzidenz einer symptomatischen LVD war in der mit Pertuzumab behandelten Gruppe niedriger (1,8 % in der Placebogruppe vs. 1,5 % in der mit Pertuzumab behandelten Gruppe) (siehe «Warnhinweise und Vorsichtsmassnahmen»).
In der Studie NEOSPHERE, in der die Patienten vier Zyklen mit Pertuzumab als neoadjuvante Behandlung erhielten, war die LVD-Inzidenz (in der Gesamtbehandlungsphase) in der mit Pertuzumab, Trastuzumab und Docetaxel behandelten Gruppe höher (7,5 %) als in der mit Trastuzumab und Docetaxel behandelten Gruppe (1,9 %). In der mit Pertuzumab und Trastuzumab behandelten Gruppe gab es einen Fall von symptomatischer LVD.
In der Studie TRYPHAENA betrug die LVD-Inzidenz (in der Gesamtbehandlungsphase) in der Gruppe, die zunächst Pertuzumab plus Trastuzumab und 5-Fluoruracil, Epirubicin und Cyclophosphamid (FEC) und anschliessend Pertuzumab plus Trastuzumab und Docetaxel erhalten hatte, 8,3 %, in der Gruppe, die Pertuzumab plus Trastuzumab und Docetaxel nach FEC erhalten hatte, 9,3 % und in der mit Pertuzumab in Kombination mit TCH behandelten Gruppe 6,6 %. Die Inzidenz von symptomatischer LVD (Stauungsinsuffizienz) betrug in der Gruppe, die Pertuzumab plus Trastuzumab und Docetaxel nach FEC erhalten hatte, 1,3 % (ausschliesslich eines Patienten mit symptomatischer LVD während der FEC-Behandlung vor Erhalt von Pertuzumab plus Trastuzumab und Docetaxel) und ebenso 1,3 % in der Gruppe, die Pertuzumab in Kombination mit TCH erhalten hatte. In der Gruppe unter Behandlung mit Pertuzumab plus Trastuzumab und FEC, gefolgt von Pertuzumab plus Trastuzumab und Docetaxel, entwickelte keiner der Patienten eine symptomatische LVD.
In der neoadjuvanten Phase der Studie BERENICE betrug die Inzidenz einer symptomatischen LVD der NYHA-Klasse III/IV (Stauungsinsuffizienz gemäss NCI-CTCAE v.4) in der mit dosisdichtem AC und anschliessend mit Pertuzumab plus Trastuzumab und Paclitaxel behandelten Gruppe 1,5 %, während in der mit FEC und anschliessend mit Pertuzumab in Kombination mit Trastuzumab und Docetaxel behandelten Gruppe keiner der Patienten (0 %) eine symptomatische LVD entwickelte. In der mit dosisdichtem AC und anschliessend mit Pertuzumab plus Trastuzumab und Paclitaxel behandelten Gruppe betrug die Inzidenz einer asymptomatischen LVD (Verringerung der Ejektionsfraktion gemäss preferred term NCI-CTCAE v.4) 7 % und in der mit FEC und anschliessend mit Pertuzumab plus Trastuzumab und Docetaxel behandelten Gruppe 3,5 %.
In der Studie APHINITY betrug die Inzidenz einer symptomatischen Herzinsuffizienz (NYHA-Klasse III oder IV) mit einer Verringerung der LVEF um mindestens 10 Prozentpunkte gegenüber dem Ausgangswert und auf < 50 % < 1 % (0,6 % der mit Pertuzumab behandelten Patienten vs. 0,2 % der Patienten in der Placebogruppe). Von den Patienten mit symptomatischer Herzinsuffizienz hatten sich zum Zeitpunkt des Daten-Cutoffs 46,7 % der mit Pertuzumab behandelten Patienten und 66,7 % der Patienten in der Placebogruppe wieder erholt (definiert als 2 aufeinanderfolgende LVEF-Messungen über 50 %). Die Mehrzahl der Ereignisse wurde bei Patienten unter Behandlung mit Anthracyclin berichtet. Asymptomatische oder leicht symptomatische (NYHA-Klasse II) Verringerungen der LVEF um mindestens 10 Prozentpunkte gegenüber dem Ausgangswert und auf < 50 % wurden bei 2,7 % der mit Pertuzumab behandelten Patienten und bei 2,8 % der Patienten in der Placebogruppe berichtet, wobei sich 79,7 % der mit Pertuzumab behandelten Patienten und 80,6 % der Patienten in der Placebogruppe zum Zeitpunkt des Daten-Cutoffs erholt hatten.
Infusionsbedingte Reaktion
Eine infusionsbedingte Reaktion war in den Pivotstudien als jedes Ereignis definiert, das während einer Infusion oder am selben Tag wie die Infusion als Überempfindlichkeit, anaphylaktische Reaktion, akute Infusionsreaktion oder Zytokinfreisetzungssyndrom gemeldet wurde. In der Studie CLEOPATRA wurde die Initialdosis von Pertuzumab am Tag vor Trastuzumab und Docetaxel gegeben, um die Untersuchung von mit Pertuzumab im Zusammenhang stehenden Reaktionen zu ermöglichen. Am ersten Tag, an dem nur Pertuzumab gegeben wurde, betrug die Gesamthäufigkeit infusionsbedingter Reaktionen in der Placebogruppe 9,8 % und in der mit Pertuzumab behandelten Gruppe 13,2 %, wobei die meisten Reaktionen leicht oder mittelstark waren. Die häufigsten infusionsbedingten Reaktionen (≥1,0 %) in der mit Pertuzumab behandelten Gruppe waren Pyrexie, Schüttelfrost, Müdigkeit, Kopfschmerzen, Asthenie, Überempfindlichkeit und Erbrechen.
Im zweiten Zyklus, in dem alle Wirkstoffe am selben Tag gegeben wurden, waren die häufigsten infusionsbedingten Reaktionen (≥1,0 %) in der mit Pertuzumab behandelten Gruppe Müdigkeit, Arzneimittelüberempfindlichkeit, Dysgeusie, Überempfindlichkeit, Myalgie und Erbrechen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
In den Studien mit Behandlungen im neoadjuvanten und adjuvanten Setting wurde Pertuzumab am selben Tag wie die anderen Studienmedikamente gegeben. Infusionsbedingte Reaktionen traten bei 18,6 % – 25,0 % der Patienten am ersten Tag der Gabe von Pertuzumab (in Kombination mit Trastuzumab und Chemotherapie) auf. Art und Schweregrad der Ereignisse stimmten mit den in der Studie CLEOPATRA beobachteten überein, wobei die meisten Reaktionen leicht oder mittelstark waren.
Überempfindlichkeit/Anaphylaxie
In der Studie CLEOPATRA betrug die Gesamthäufigkeit der als Überempfindlichkeit/Anaphylaxie berichteten Ereignisse bei den Patienten in der Placebogruppe 9,3 % und bei den mit Pertuzumab behandelten Patienten 11,3 %, wobei 2,5 % bzw. 2,0 % dieser Ereignisse vom NCI-CTCAE (Version 3) Grad 3–4 waren. Insgesamt entwickelten 2 Patienten in der Placebogruppe und 4 Patienten in der mit Pertuzumab behandelten Gruppe eine Anaphylaxie (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Insgesamt waren die meisten Überempfindlichkeitsreaktionen leicht oder mittelstark und gingen während der Behandlung zurück. Basierend auf Änderungen der Studienbehandlung wurden die meisten Reaktionen als sekundär zu Docetaxel-Infusionen eingestuft.
Die in den Studien im neoadjuvanten und adjuvanten Setting aufgetretenen Überempfindlichkeits-/Anaphylaxie-Ereignisse waren konsistent mit denen in der Studie CLEOPATRA. In der Studie NEOSPHERE entwickelten zwei Patienten in der mit Pertuzumab und Docetaxel behandelten Gruppe eine Anaphylaxie. Sowohl in der Studie TRYPHAENA als auch in der Studie APHINITY war die Gesamthäufigkeit von Überempfindlichkeit/Anaphylaxie in der mit Pertuzumab und TCH behandelten Gruppe am höchsten (13,2 % bzw. 7,6 %), wobei 2,6 % bzw. 1,3 % der Ereignisse vom NCI-CTCAE Grad 3–4 waren.
Immunogenität
Wie bei allen therapeutischen Proteinen besteht bei Patienten unter Behandlung mit Phesgo die Möglichkeit der Entwicklung einer Immunantwort.
Die Ergebnisse von Immunogenitäts-Assays hängen stark von mehreren Faktoren ab, beispielsweise von der Sensitivität und Spezifität des Assays, der Methode des Assays, der Handhabung der Proben, dem Zeitpunkt der Probennahme, der Begleitmedikation und der Grunderkrankung. Aus diesem Grund kann der Vergleich der Inzidenz von behandlungsbedingten Antikörpern gegen Phesgo mit der Inzidenz von Antikörpern gegen andere Arzneimittel irreführend sein.
In der FEDERICA-Studie betrug die Inzidenz behandlungsbedingter Antikörper gegen Pertuzumab und Trastuzumab bei Patienten unter Behandlung mit intravenösem Pertuzumab und Trastuzumab 3 % (7/237) bzw. 0,4 % (1/237).
Die Inzidenz behandlungsbedingter Antikörper gegen Pertuzumab, Trastuzumab und humaner Hyaluronidase alfa betrug bei Patienten unter Behandlung mit Phesgo 4,8 % (11/231), 0,9 % (2/232) bzw. 0,9 % (2/225). Die klinische Relevanz der Entwicklung von Antikörpern gegen Pertuzumab, Trastuzumab oder humaner Hyaluronidase alfa nach Behandlung mit Phesgo ist nicht bekannt.
Wechsel von intravenös verabreichtem Pertuzumab und Trastuzumab auf Phesgo (oder umgekehrt)
Der Wechsel von intravenös verabreichtem Pertuzumab und Trastuzumab (oder umgekehrt) gab zu keinen neuen oder klinisch relevanten Sicherheitsbedenken Anlass. Die beobachteten unerwünschten Ereignisse standen im Einklang mit jenen, die in der Studie FEDERICA und in früheren Studien mit der intravenösen Darreichungsform von Pertuzumab und Trastuzumab gemeldet wurden (siehe «Klinische Wirksamkeit»).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Es liegen keine Erfahrungen mit einer Überdosierung von Phesgo in klinischen Studien beim Menschen vor. Die höchste geprüfte Dosis von Phesgo beträgt 1200 mg Pertuzumab/600 mg Trastuzumab.
Eigenschaften/Wirkungen
ATC-Code
L01XY02
Wirkungsmechanismus
Pertuzumab und Trastuzumab sind rekombinante, humanisierte monoklonale Antikörper vom Immunglobulin-Subtyp IgG1κ gegen den Rezeptor des humanen epidermalen Wachstumsfaktors 2 (HER2, auch als c-erbB-2 bezeichnet), ein Transmembranglykoprotein mit intrinsischer Tyrosinkinaseaktivität. Pertuzumab und Trastuzumab binden an verschiedene HER2-Epitope, d.h. an die Subdomänen II bzw. IV, ohne zu konkurrieren, und haben komplementäre Mechanismen zur Störung der Signalübertragung über HER2. Daraus ergibt sich eine verstärkte antiproliferative Aktivität in vitro und in vivo, wenn Pertuzumab und Trastuzumab in Kombination angewendet werden.
Darüber hinaus bewirkt der Fc-Teil des IgG1-Gerüsts der beiden Antikörper eine starke Aktivierung der antikörperabhängigen zellvermittelten Zytotoxizität (ADCC). In vitro wirkt die ADCC sowohl von Pertuzumab als auch von Trastuzumab vor allem auf HER2-überexprimierende Krebszellen und weniger auf Krebszellen ohne Überexpression von HER2.
Pharmakodynamik
Klinische Wirksamkeit
In diesem Abschnitt sind die klinischen Erfahrungen bei Anwendung von Phesgo und intravenösem Pertuzumab in Kombination mit Trastuzumab bei Patienten mit HER2-positivem Brustkrebs im Frühstadium und metastasierendem Brustkrebs beschrieben. In allen nachstehend genannten Studien wurde die Überexpression von HER2 in einem Zentrallabor bestimmt und war definiert als IHC-Score von 3+ oder als ISH-Amplifizierungsverhältnis von ≥2,0.
Brustkrebs im Frühstadium
Fixdosiskombination von Pertuzumab und Trastuzumab Phesgo
FEDERICA WO40324
FEDERICA ist eine offene, multizentrische, randomisierte Studie bei 500 Patienten mit HER2-positivem, resezierbarem Mammakarzinom im Frühstadium oder mit lokal fortgeschrittenem (einschliesslich entzündlichem) Mammakarzinom mit einer Tumorgrösse > 2 cm oder nodal-positivem Mammakarzinom im neoadjuvanten und adjuvanten Setting*. Die Patienten wurden randomisiert und erhielten 8 Zyklen einer neoadjuvanten Chemotherapie bei gleichzeitiger Gabe von 4 Zyklen entweder von Phesgo oder von intravenösem Pertuzumab und Trastuzumab während der Zyklen 5 bis 8. Die Prüfärzte wählten für einzelne Patienten eine der zwei folgenden neoadjuvanten Chemotherapie-Regimes aus:
- 4 Zyklen mit Doxorubicin (60 mg/m2) und Cyclophosphamid (600 mg/m2) alle 2 Wochen, gefolgt von Paclitaxel (80 mg/m2) wöchentlich für 12 Wochen.
- 4 Zyklen mit Doxorubicin (60 mg/m2) und Cyclophosphamid (600 mg/m2) alle 3 Wochen, gefolgt von 4 Zyklen mit Docetaxel (75 mg/m2 im ersten Zyklus und dann 100 mg/m2 in den anschliessenden Zyklen nach Ermessen des Prüfarztes) alle 3 Wochen.
* Der Gebrauch von Phesgo bei Patienten mit metastasiertem Brustkrebs beruht auf einer Extrapolation von Daten aus intravenöser Anwendung.
Nach der Operation setzten die Patienten die Therapie mit Phesgo oder intravenösem Pertuzumab und Trastuzumab entsprechend der Behandlung vor der Operation für weitere 14 Zyklen fort, bis insgesamt 18 Zyklen einer auf HER2 abzielenden Therapie erreicht waren. Die Patienten erhielten ausserdem eine adjuvante Strahlentherapie und eine endokrine Therapie entsprechend der vor Ort üblichen Praxis. Im adjuvanten Setting war die Anwendung von intravenösem Trastuzumab anstelle von subkutan gegebenem Trastuzumab nach Ermessen des Prüfarztes zulässig. Die auf HER2 abzielende Therapie wurde, wie in der folgenden Tabelle 3 angegeben, alle 3 Wochen gegeben:
Tabelle 3: Dosierung und Anwendung von Phesgo, intravenösem Pertuzumab, intravenösem Trastuzumab und subkutanem Trastuzumab
Medikament | Verabreichung | Dosis | |
Aufsättigung | Erhaltung | ||
Phesgo | Subkutane Injektion | 1200 mg/600 mg | 600 mg/600 mg |
Pertuzumab | Intravenöse Infusion | 840 mg | 420 mg |
Trastuzumab | Intravenöse Infusion | 8 mg/kg | 6 mg/kg |
Trastuzumab | Subkutane Injektion | 600 mg | |
Die Studie FEDERICA war dazu ausgelegt, die Nichtunterlegenheit der Serum-Talkonzentration (CTal) von Pertuzumab in Phesgo in Zyklus 7 (d.h. vor der Dosisgabe in Zyklus 8) verglichen mit intravenösem Pertuzumab (primärer Endpunkt) aufzuzeigen. Weitere sekundäre Endpunkte schlossen die Nichtunterlegenheit der Serum-Talkonzentration (CTal) von Trastuzumab in Phesgo in Zyklus 7 verglichen mit intravenösem Trastuzumab, die Wirksamkeit [vollständige pathologische Remission insgesamt bzw. total pathological complete response (tpCR)] und Sicherheitsergebnisse ein. Die demografischen Daten waren zwischen den beiden Behandlungsarmen ausgewogen und das mediane Alter der in der Studie behandelten Patienten betrug 51 Jahre. Abgesehen von 2 Patienten waren alle Patienten weiblich. Die meisten Patienten waren nodal-positiv (57,6 %), hatten einen Hormonrezeptor-positiven Tumor (61,2 %) und waren Kaukasier (65,8 %).
Die Nichtunterlegenheit der Exposition gegenüber Pertuzumab und Trastuzumab in Phesgo wurde aufgezeigt (siehe «Pharmakokinetik»). Die Analyse des sekundären Wirksamkeitsendpunktes tpCR, definiert als Nichtvorliegen einer invasiven Erkrankung in Brust und Achsel (ypT0/is, ypN0), ist in Tabelle 4 gezeigt.
Tabelle 4: Zusammenfassung der vollständigen pathologischen Remission insgesamt (tpCR)
Phesgo | Intravenöses Pertuzumab + Trastuzumab | |
tpCR (ypT0/is, ypN0) | 148 (59,7 %) | 150 (59,5 %) |
Exaktes 95%-KI für die tpCR-Rate1 | (53,28; 65,84) | (52,18; 65,64) |
Unterschied bzgl. der tpCR-Rate (s.c. Arm minus i.v. Arm) | 0,15 | |
95%-KI für den Unterschied bzgl. der tpCR-Rate2 | -8,67 bis 8,97 | |
1 Konfidenzintervall für einen Einstichproben-Binomialtest unter Anwendung der Pearson-Clopper-Methode.
2 Bei dieser Berechnung wurde eine Kontinuitätskorrektur nach Hauck-Anderson durchgeführt.
PHranceSCa (MO40628)
In der Studie MO40628 wurde die Sicherheit der Umstellung von intravenös verabreichtem Pertuzumab und Trastuzumab auf Phesgo (und umgekehrt) untersucht, wobei als primärer Endpunkt die Patientenpräferenz für Phesgo bewertet werden sollte. Insgesamt wurden 160 Patienten in diese zweiarmige Cross-over-Studie aufgenommen: 80 von ihnen wurden randomisiert Arm A zugeteilt (3 Zyklen mit intravenösem Pertuzumab und Trastuzumab, danach 3 Zyklen Phesgo), 80 Patienten wurden randomisiert Arm B zugeteilt (3 Zyklen Phesgo, danach 3 Zyklen mit intravenösem Pertuzumab und Trastuzumab). Anschliessend konnten die Patienten wählen, ob sie die Behandlung mit intravenösem Pertuzumab und Trastuzumab oder mit Phesgo fortsetzen, bis insgesamt 18 Zyklen einer auf HER2 abzielenden Therapie erreicht waren.
Gemäss der primären Analyse gaben 136 der 160 Patienten (85 %) an, das subkutan verabreichte Phesgo gegenüber intravenös verabreichtem Pertuzumab und Trastuzumab vorzuziehen. Der häufigste Grund war, dass die Verabreichung einen kürzeren Aufenthalt in der Klinik erfordert. 22 von 160 Patienten (14 %) gaben an, intravenös verabreichtes Pertuzumab und Trastuzumab gegenüber Phesgo vorzuziehen. Der häufigste Grund war, dass die Verabreichung angenehmer wahrgenommen wurde. Zwei von 160 Patienten (1 %) gaben keiner Art der Verabreichung den Vorzug.
Unter den Patienten in Arm A war die Inzidenz unerwünschter Ereignisse nach der Umstellung von intravenösem Pertuzumab und Trastuzumab auf Phesgo ähnlich. In Arm A betrug die Inzidenz unerwünschter Ereignisse während der Zyklen 1 bis 3 (i.v.) 77,5 % und während der Zyklen 4 bis 6 (s.c.) 72,5 %. In Arm B betrug die Inzidenz unerwünschter Ereignisse während der Zyklen 1 bis 3 (s.c.) 77,5 % und während der Zyklen 4 bis 6 (i.v.) 63,8 %. Die Gesamtzahl der Ereignisse war ungeachtet der verabreichten Therapie während der Zyklen 1 bis 3 höher als während der Zyklen 4 bis 6.
Intravenöses Pertuzumab und Trastuzumab
Weitere Angaben und klinische Daten über intravenös verabreichtes Pertuzumab und Trastuzumab sind im Abschnitt «Klinische Wirksamkeit» der Fachinformation von Perjeta zu finden. Dieser enthält auch eine Beschreibung des Designs und der Ergebnisse von Zulassungsstudien, die mit Patienten mit HER2-positivem Brustkrebs im Frühstadium oder metastasierendem Brustkrebs durchgeführt wurden.
Sicherheit und Wirksamkeit bei älteren Patienten
Es wurden insgesamt keine Unterschiede in Bezug auf Wirksamkeit und Sicherheit von Phesgo zwischen Patienten ≥65 (n = 26) und solchen < 65 Jahren (n = 222) festgestellt.
Bei intravenösem Pertuzumab in Kombination mit Trastuzumab war die Inzidenz der folgenden unerwünschten Ereignisse aller Schweregrade bei Patienten ≥65 Jahren (n = 418) jedoch mindestens 5 % höher als bei Patienten < 65 Jahren (n = 2926): verringerter Appetit, Anämie, Gewichtsabnahme, Asthenie, Dysgeusie, periphere Neuropathie, Hypomagnesiämie und Durchfall.
Sicherheit und Wirksamkeit bei pädiatrischen Patienten
Die Sicherheit und Wirksamkeit von Phesgo bei Kindern und Jugendlichen unter 18 Jahren wurden nicht ermittelt.
Pharmakokinetik
In Tabelle 5 ist die Exposition gegenüber Pertuzumab und Trastuzumab nach subkutaner Verabreichung von Phesgo (1200 mg Pertuzumab/600 mg Trastuzumab als Initialdosis, gefolgt von 600 mg Pertuzumab/600 mg Trastuzumab alle 3 Wochen) in der FEDERICA-Studie gezeigt. Die pharmakokinetischen (PK) Ergebnisse für den primären Endpunkt der Talkonzentration (CTal) von Pertuzumab in Zyklus 7 (d.h. vor der Dosisgabe in Zyklus 8) zeigten die Nichtunterlegenheit von Pertuzumab in Phesgo (geometrischer Mittelwert 88,7 µg/ml) verglichen mit intravenösem Pertuzumab (geometrischer Mittelwert 72,4 µg/ml) mit einem Verhältnis der geometrischen Mittelwerte von 1,22 (90%-KI: 1,14–1,31). Die untere Grenze des zweiseitigen 90 %-Konfidenzintervalls für das Verhältnis der geometrischen Mittelwerte von Pertuzumab in Phesgo und intravenösem Pertuzumab betrug 1,14 und war damit höher als die vorab definierte Grenze von 0,8.
Die PK-Ergebnisse für den sekundären Endpunkt der CTal von Trastuzumab in Zyklus 7 (d.h. vor der Dosisgabe in Zyklus 8) zeigten die Nichtunterlegenheit von Trastuzumab in Phesgo (geometrischer Mittelwert 57,5 µg/ml) verglichen mit intravenösem Trastuzumab (geometrischer Mittelwert 43,2 µg/ml) mit einem Verhältnis der geometrischen Mittelwerte von 1,33 (90%-KI: 1,24–1,43).
Unter Heranziehung gepoolter Daten zur PK von Pertuzumab in Phesgo und intravenösem Pertuzumab aus der FEDERICA-Studie wurde ein Populations-PK-Modell von Pertuzumab mit linearer Elimination aus dem zentralen Kompartiment erstellt, um die gemessenen PK-Konzentrationen von Pertuzumab nach subkutaner Gabe von Phesgo und intravenöser Gabe von Pertuzumab zu beschreiben.
Unter Heranziehung gepoolter Daten zur PK von Trastuzumab aus der Phase-III-Studie BO22227 (HannaH) zu subkutanem Trastuzumab vs. intravenösem Trastuzumab wurde ein Populations-PK-Modell mit paralleler linearer und nichtlinearer Elimination aus dem zentralen Kompartiment erstellt, um die gemessenen PK-Konzentrationen nach intravenöser Gabe von Trastuzumab oder subkutaner Gabe von Trastuzumab bei HER2-positiven EBC-Patienten zu beschreiben. Die PK-Analyse unter Verwendung des Populations-PK-Modells aus der Studie HannaH zeigte, dass Pertuzumab in Phesgo keinen Einfluss auf die PK von Trastuzumab in Phesgo hatte, da die PK von Trastuzumab in Phesgo und die PK von subkutanem Trastuzumab einheitlich waren.
Die mittels Populations-PK vorhergesagte Pertuzumab- und Trastuzumab-Exposition ist in der folgenden Tabelle 5 zusammengefasst.
Tabelle 5: Pertuzumab- und Trastuzumab-Exposition (Median mit 5.–95. Perzentil) nach subkutaner Gabe von Phesgo oder intravenöser Gabe von Pertuzumab oder Trastuzumaba
Parameter | Pertuzumab in | Intravenöses Pertuzumab | Trastuzumab in | Intravenöses Trastuzumabb | |
CTal (µg/ml) | Zyklus 5 | 85,1 (48,7 – 122,5) | 74,9 (47,8 – 99,8) | 27,7 | 31,4 |
Zyklus 7 | 88,9 | 78,5 | 57,5 | 44,9 | |
Cmax (µg/ml) | Zyklus 5 | 106,5 | 304,8 | 44,6 | 172,9 |
Zyklus 7 | 149,5 | 225,9 | 117,3 | 169,1 | |
AUC0‑21 Tage (µg/ml•Tag) | Zyklus 5 | 2306,9 | 2519,7 | 1023,8 | 1341,0 |
Zyklus 7 | 2569,3 | 2454,3 | 1838,7 | 1668,6 | |
a Gabe der ersten Dosis von Phesgo intravenösem Pertuzumab und Trastuzumab in Zyklus 5.
bZur Simulation der PK von Trastuzumab wurde das Populations-PK-Modell aus der Studie BO22227 (HannaH) herangezogen.
Absorption
Die mediane maximale Serumkonzentration (Cmax) von Pertuzumab in Phesgo und die Zeit bis zur maximalen Konzentration (Tmax) betrugen 157 µg/ml bzw. 3,82 Tage. Basierend auf der Analyse der Populations-PK betrug die absolute Bioverfügbarkeit 0,712, und die Rate der Absorption erster Ordnung (Ka) beträgt 0,348 (1/Tag).
Die mediane maximale Serumkonzentration (Cmax) von Trastuzumab in Phesgo und die Zeit bis zur maximalen Konzentration (Tmax) betrugen 114 µg/ml bzw. 3,84 Tage. Basierend auf der Analyse der Populations-PK betrug die absolute Bioverfügbarkeit 0,771, und die Rate der Absorption erster Ordnung (Ka) beträgt 0,404 (1/Tag).
Distribution
Basierend auf der Analyse der Populations-PK betrug das Distributionsvolumen von Pertuzumab in Phesgo im zentralen (Vc) Kompartiment bei einem typischen Patienten 2,77 l.
Basierend auf der Analyse der Populations-PK betrug das Distributionsvolumen von subkutan angewendetem Trastuzumab im zentralen (Vc) Kompartiment bei einem typischen Patienten 2,91 l.
Metabolismus
Der Metabolismus von Phesgo wurde nicht direkt untersucht. Antikörper werden prinzipiell durch Katabolismus eliminiert.
Elimination
Basierend auf der Analyse der Populationspharmakokinetik (PK) betrug die Clearance von Pertuzumab in Phesgo 0,163 l/Tag und die Eliminationshalbwertszeit (t1/2) betrug ungefähr 24,3 Tage.
Basierend auf der Analyse der Populationspharmakokinetik (PK) betrug die lineare Clearance von subkutan angewendetem Trastuzumab 0,111 l/Tag. Schätzungen zufolge liegen bei mindestens 95 % der Patienten 7 Monate nach der letzten Dosis Trastuzumab-Konzentrationen < 1 μg/ml vor (ungefähr 3 % der für die Population prognostizierten Cmin,ss bzw. ein Washout von ungefähr 97 %).
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Es wurden keine formale Studie zur Pharmakokinetik von Phesgo bei Patienten mit Leberfunktionsstörung durchgeführt.
Nierenfunktionsstörungen
Es wurden keine formalen Studien zur PK von Phesgo bei Patienten mit Nierenfunktionsstörung durchgeführt.
Die Analyse der Populations-PK von Pertuzumab in Phesgo und intravenösem Pertuzumab ergab, dass eine Nierenfunktionsstörung die Pertuzumab-Exposition nicht beeinflusst, allerdings wurden in die Populations-PK-Analysen nur begrenzte Daten von Patienten mit schwerer Nierenfunktionsstörung einbezogen.
In einer populationspharmakokinetischen Analyse von subkutanem und intravenösem Trastuzumab hatten Nierenfunktionsstörungen keinen Einfluss auf den Verbleib von Trastuzumab.
Ältere Patienten
Es wurden keine Studien zur Untersuchung der Pharmakokinetik von Phesgo bei älteren Patienten durchgeführt.
In Populations-PK-Analysen von Pertuzumab in Phesgo und von intravenösem Pertuzumab hatte das Alter keinen erheblichen Einfluss auf die PK von Pertuzumab.
In Populations-PK-Analysen von subkutan oder intravenös angewendetem Trastuzumab hatte das Alter keinen Einfluss auf den Verbleib von Trastuzumab.
Kinder und Jugendliche
Es wurden keine Studien zur Untersuchung der Pharmakokinetik von Phesgo bei pädiatrischen Patienten durchgeführt.
Präklinische Daten
Mit Phesgo (Kombination aus Pertuzumab, Trastuzumab und humaner Hyaluronidase) wurden keine konventionelle sicherheitspharmakologische und toxikologische Studien durchgeführt. Hingegen sind Studien mit den Einzelsubstanzen vorhanden und es wurde eine Bioverfügbarkeitsstudie in Minipig durchgeführt.
Pertuzumab
Toxizität bei wiederholter Verabreichung
Subkutanes Pertuzumab (250 mg/kg/Woche für 4 Wochen) und intravenöses Pertuzumab (bis zu 150 mg/kg wöchentlich für bis zu 26 Wochen) wurden bei Cynomolgus-Affen (Spezies mit Bindung) mit Ausnahme des Auftretens von Durchfall gut vertragen. Bei intravenösen Pertuzumab-Dosen von 15 mg/kg und mehr wurde im Zusammenhang mit der Behandlung intermittierender leichter Durchfall festgestellt. Bei einer Untergruppe der Affen führte die Langzeitdosierung (26 wöchentliche Dosen) zu Episoden mit durchfallbedingter Dehydrierung, die mit intravenöser Flüssigkeitszufuhr behandelt wurden.
Mutagenität/Karzinogenität
Es wurden keine Studien zur Beurteilung des mutagenen und karzinogenen Potentials von Pertuzumab durchgeführt.
Reproduktionstoxizität
Es wurden Studien zur Reproduktionstoxizität bei Cynomolgus-Affen mit Aufsättigungsdosen von 30 bis 150 mg/kg und Erhaltungsdosen von 10 bis 100 mg/kg durchgeführt, um klinisch relevante Expositionen zu erzielen. Es zeigte sich, dass die intravenöse Verabreichung von Pertuzumab von Gestationstag (GT) 19 bis 50 (Zeitraum der Organogenese) embryotoxisch ist und zu einer dosisabhängigen Zunahme der Fälle mit Absterben des Embryos/Fötus zwischen GT 25 und 70 führt. An GT 100 wurden eine verzögerte Nierenentwicklung und Oligohydramnion identifiziert (Teratogenität).
Es wurden keine spezifischen Fertilitätsstudien bei Tieren zur Beurteilung der Wirkung von Pertuzumab durchgeführt. In bis zu sechsmonatigen Toxizitätsstudien mit wiederholter Gabe an Cynomolgus-Affen wurden keine unerwünschten Wirkungen auf männliche und weibliche Fortpflanzungsorgane beobachtet.
Trastuzumab
Toxizität bei wiederholter Verabreichung
Trastuzumab war bei Mäusen (Spezies ohne Bindung), Kaninchen (Spezies ohne Bindung) und Makaken (Rhesus- und Cynomolgus-Affen) (Spezies mit Bindung) in Studien zur Toxizität bei Anwendung einer Einzeldosis (i.v.) und von mehreren Dosen (s.c. und i.v.) mit einer Dauer von 13 Wochen (25 mg/kg zweimal wöchentlich) bzw. 26 Wochen (25 mg/kg wöchentlich) gut verträglich. Es ergaben sich keine Hinweise auf akute oder chronische Toxizität.
Messbare systemische Konzentrationen von dem rekombinanten humanen Enzym Hyaluronidase (rHuPH20) sind unwahrscheinlich, da sie in klinischen Studien mit subkutan verabreichtem Trastuzumab bei keinem Patienten festgestellt wurden.
Mutagenität/Karzinogenität
Es wurden keine Daten zur Mutagenität berichtet. Es wurden keine Studien zur Einschätzung des karzinogenen Potenzials von Trastuzumab durchgeführt.
Reproduktionstoxizität
Es wurden Reproduktionsstudien bei Cynomolgus-Affen mit Dosen durchgeführt, die bis zu 25 Mal so hoch waren wie die wöchentliche Erhaltungsdosis beim Menschen von 2 mg intravenöses Trastuzumab pro kg, ohne dass sich Hinweise auf eine Schädigung des Fötus ergaben. Während der frühen (Gestationstag 20–50) und späten (Gestationstag 120–150) fötalen Entwicklungsphase wurde ein Transfer von Trastuzumab in die Plazenta beobachtet.
In einer Studie bei Cynomolgus-Affen, denen Trastuzumab in Dosen verabreicht wurde, die 25 Mal so hoch waren wie die wöchentliche Erhaltungsdosis beim Menschen von 2 mg intravenöses Trastuzumab pro kg an den Tagen 120 bis 150 der Schwangerschaft, wurde Trastuzumab nach der Geburt in der Milch ausgeschieden. Die Exposition gegenüber Trastuzumab in utero und das Vorhandensein von Trastuzumab im Serum dieser Säuglingsaffen waren in einem Zeitraum von der Geburt bis zum Alter von einem Monat nicht mit nachteiligen Auswirkungen auf das Wachstum oder die Entwicklung der Jungtiere verbunden.
Es wurden keine tierexperimentellen Studien zum Einfluss von Trastuzumab auf die Fertilität männlicher Tiere durchgeführt.
Weitere Daten (Lokale Toxizität)
Subkutanes Trastuzumab mit humaner Hyaluronidase war in einer Studie zur lokalen Toleranz bei Kaninchen (Spezies ohne Bindung) und in einer 13-wöchigen Toxizitätsstudie mit wiederholter Gabe an Cynomolgus-Affen (Spezies mit Bindung) gut verträglich.
Phesgo (Pertuzumab/Trastuzumab)
Lokale Toxizität
In einer Bioverfügbarkeitsstudie bei Minipig ergab die klinische Beobachtung nach einer subkutanen Einzeldosis von Pertuzumab mit rHuPH20 und Pertuzumab in Kombination mit Trastuzumab und rHuPH20 keine Befunde.
Weitere Daten (Hyaluronidase)
Phesgo enthält als Hilfsstoff das rekombinante humane Enzym Hyaluronidase (rHuPH20), das zur Verbesserung der Verteilung und Absorption gemeinsam subkutan verabreichter Wirkstoffe verwendet wird. Messbare systemische Konzentrationen von rHuPH20 sind nach lokaler subkutaner Verabreichung von Phesgo unwahrscheinlich und wurden bei Patienten in Phesgo klinischen Studien nicht festgestellt.
In einer 39-wöchigen Toxizitätsstudie bei geschlechtsreifen männlichen und weiblichen Affen, die sowohl allgemeine Toxizitätsendpunkte als auch spezielle Fertilitätsendpunkte (Zyklusanalyse, Hormonmessungen, Spermaanalyse und histologische Untersuchung der Fortpflanzungsorgane) umfasste, erwies sich rHuPH20 als gut verträglich. Weder rHuPH20 noch anti-rHuPH20-Antikörper, für welche gezeigt wurde, dass sie endogene Cynomolgus-Hyaluronidase neutralisieren, hatten eine Auswirkung auf Sperma, Hormone, Menstruation oder das histologische Erscheinungsbild der Fortpflanzungsorgane.
In einer weiteren Studie wurden männliche und weibliche Affen mit rekombinanter Cynomolgus-PH20 immunisiert und produzierten signifikante Immunantworten. Die Antikörper erkannten sowohl PH20 als auch akrosomale Hyaluronidase der Affen. In der Gruppe der mit PH20 immunisierten Affen wurden 8 von 14, in der Kontrollgruppe 6 von 14 weiblichen Tieren trächtig. Zwischen der Fertilität und den Antikörpertitern bestand kein Zusammenhang.
In Studien an Kaninchen wurden die Wirkungen von neutralisierenden Antikörpern gegen rHuPH20 und endogener Hyaluronidase auf Reproduktionsparameter und die Embryonalentwicklung untersucht. Im Rahmen detaillierter Beurteilungen der Nachkommen bis ins Erwachsenenalter und der Paarungsergebnisse wurden keine unerwünschten Wirkungen auf die männliche oder weibliche Fertilität und die embryo-fetale Entwicklung festgestellt.
In einer Studie mit rHuPH20 zur embryonalen/fetalen Entwicklung bei Mäusen ergaben sich keine Hinweise auf Teratogenität.
Studien bei Mäusen mit rHuPH20 ergaben Reduzierungen des fetalen Gewichts sowie Erhöhungen der Resorptionsraten. Diese Effekte traten nach Exposition gegenüber rHuPH20 auf, die deutlich höher waren, als nach subkutaner Verabreichung von Phesgo beim Menschen zu erwarten ist. Eine vergleichbare systemische Exposition könnte beim Menschen auftreten, wenn versehentlich eine Bolusdosis von Phesgo verabreicht werden würde.
Die umfassende Beurteilung aller verfügbaren tierexperimentellen Studien zeigte, dass keine Auswirkung von anti-rHuPH20-Antikörper auf die männliche oder weibliche Fertilität sowie die Entwicklung der Nachkommen bestand.
Sonstige Hinweise
Die Lösung mit 1200 mg Pertuzumab/600 mg Trastuzumab und die Lösung mit 600 mg Pertuzumab/600 mg Trastuzumab sind gebrauchsfertige Lösungen zur Injektion und müssen nicht mit anderen Arzneimitteln gemischt oder verdünnt werden.
Phesgo sollte vor der Anwendung einer Sichtprüfung auf Schwebstoffe oder Verfärbung unterzogen werden. Nicht schütteln.
Phesgo Injektionslösung ist nur für den Einmalgebrauch bestimmt und sollte von einer medizinischen Fachperson unter aseptischen Kriterien vorbereitet werden.
Inkompatibilitäten
Es wurden keine Inkompatibilitäten zwischen Phesgo und Polypropylen, Polycarbonat, Polyurethan, Polyethylen, Polyvinylchlorid und fluoriertem Ethylenpolypropylen festgestellt.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Aus hygienischer Sicht sollte das Arzneimittel sofort nach dem Überführen aus der Durchstechflasche in die Spritze angewendet werden, da es kein antimikrobielles Konservierungsmittel enthält. Wenn es nicht sofort angewendet wird, sollte die Zubereitung unter kontrollierten und validierten aseptischen Bedingungen stattfinden. Nach dem Überführen aus der Durchstechflasche in die Spritze ist das Arzneimittel 28 Tage bei 2 °C – 8 °C oder 24 Stunden bei 9 °C – 30 °C physikalisch und chemisch stabil.
Nach dem Überführen der Lösung in die Spritze wird empfohlen, die Transfernadel durch eine Spritzenverschlusskappe zu ersetzen, um ein Austrocknen der Lösung in der Nadel zu vermeiden und die Qualität des Arzneimittels nicht zu beeinträchtigen. Die Spritze zur Kennzeichnung mit dem Abziehetikett versehen. Die Injektionsnadel darf erst unmittelbar vor der Gabe an den Patienten auf die Spritze aufgesetzt werden. Anschliessend ist die Volumenanpassung auf 10 ml (600 mg Pertuzumab/600 mg Trastuzumab) oder 15 ml (1200 mg Pertuzumab/600 mg Trastuzumab) durchzuführen.
Entsorgung von nicht verwendeten/abgelaufenen Medikamenten
Die Freisetzung von Arzneimitteln in die Umwelt sollte minimiert werden. Arzneimittel sollten nicht über das Abwasser entsorgt werden. Eine Entsorgung mit dem Haushaltsabfall sollte vermieden werden.
Die folgenden Punkte sollten strikt in Bezug auf die Verwendung und Entsorgung von Spritzen und anderen medizinischen scharfen Gegenstände eingehalten werden:
- Nadeln und Spritzen sollten niemals wiederverwendet werden.
- Alle verwendeten Nadeln und Spritzen in einen Behälter für spitze Gegenstände (stichverletzungssichere Einwegbehälter) legen.
Nicht verwendetes Arzneimittel und/oder das Abfallmaterial sind entsprechend den nationalen Anforderungen zu entsorgen.
Besondere Lagerungshinweise
Im Kühlschrank (2-8 °C) lagern.
Nicht einfrieren.
Den Behälter im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer
67828 (Swissmedic).
Zulassungsinhaberin
Roche Pharma (Schweiz) AG, Basel.
Stand der Information
April 2021.
▼ Questo medicamento è soggetto a monitoraggio addizionale. Ciò consente una rapida identificazione delle nuove conoscenze in materia di sicurezza. Chi esercita una professione sanitaria è invitato a segnalare un nuovo o serio effetto collaterale sospetto. Per indicazioni a proposito della segnalazione di effetti collaterali, cfr. la rubrica «Effetti indesiderati».
Composizione
Principi attivi
Pertuzumabum, trastuzumabum (prodotto con tecnologia genetica utilizzando cellule CHO [Chinese Hamster Ovary]).
Sostanze ausiliarie
Hyaluronidasum humanum (rHuPH20) (prodotto con tecnologia genetica utilizzando cellule CHO [Chinese Hamster Ovary]), L-histidini hydrochloridum monohydricum, L-histidinum, α,α-trehalosum dihydricum, saccharum, polysorbatum 20*, L-methioninum, aqua ad iniectabilia.
* Prodotto da mais modificato con tecnologia genetica
Forma farmaceutica e quantità di principio attivo per unità
Soluzione iniettabile (per uso sottocutaneo).
1200 mg di pertuzumab/600 mg di trastuzumab/15 ml di soluzione in un flaconcino.
600 mg di pertuzumab/600 mg di trastuzumab/10 ml di soluzione in un flaconcino.
Phesgo è una soluzione limpida, opalescente, da incolore a leggermente marroncina, in flaconcini sterili, senza conservanti e non pirogeni per uso singolo.
Indicazioni/Possibilità d'impiego
Carcinoma mammario metastatico
Phesgo è indicato in combinazione con docetaxel per il trattamento di pazienti con carcinoma mammario HER2-positivo metastatico o localmente recidivante non resecabile che non hanno ancora ricevuto una chemioterapia per la malattia metastatica.
Carcinoma mammario in fase iniziale
Phesgo è indicato in combinazione con docetaxel per il trattamento neoadiuvante di pazienti con carcinoma mammario infiammatorio HER2-positivo localmente avanzato o con carcinoma mammario in fase iniziale (early breast cancer, EBC) ad alto rischio di recidiva (diametro del tumore > 2 cm o coinvolgimento linfonodale), nell'ambito di un piano terapeutico per l'EBC.
Phesgo è indicato in combinazione con la chemioterapia per il trattamento adiuvante di pazienti con carcinoma mammario HER2-positivo in fase iniziale ad alto rischio di recidiva (cfr. la rubrica «Proprietà/effetti», sezione «Efficacia clinica»).
Posologia/Impiego
La terapia con Phesgo deve essere iniziata esclusivamente sotto la supervisione di un medico esperto nel trattamento di pazienti oncologici.
Al fine di garantire la tracciabilità dei medicamenti di produzione biotecnologica, il nome commerciale e il numero di lotto del prodotto somministrato devono essere documentati ad ogni trattamento.
I pazienti che ricevono attualmente pertuzumab e trastuzumab per via endovenosa possono passare a Phesgo. Il passaggio da pertuzumab e trastuzumab somministrati per via endovenosa a Phesgo (o viceversa) è stato valutato nello studio MO40628 (cfr. «Effetti indesiderati» ed «Efficacia clinica»).
Per evitare errori terapeutici è importante controllare l'etichetta del flaconcino per assicurarsi che il medicamento che si sta per preparare e somministrare sia effettivamente Phesgo.
Phesgo è indicato esclusivamente per la somministrazione sottocutanea nella coscia. Non somministrare per via endovenosa.
I pazienti trattati con Phesgo devono avere uno stato tumorale HER2-positivo, definito come punteggio di 3+ all'immunoistochimica (IHC) o rapporto ≥2,0 all'ibridazione in situ (ISH) con utilizzo di un test convalidato.
Per garantire risultati accurati e riproducibili, i test devono essere effettuati in un laboratorio specializzato in grado di garantire la convalida dei metodi di analisi.
Informazioni esaustive sulle prestazioni e l'interpretazione del test sono disponibili nei foglietti illustrativi dei test convalidati per HER2.
Posologia abituale
Carcinoma mammario metastatico e carcinoma mammario in fase iniziale
Le raccomandazioni posologiche per Phesgo nell'EBC e nel carcinoma mammario metastatico (metastatic breast cancer, MBC) sono riportate nella tabella 1.
Tabella 1: Dosaggio e uso raccomandato di Phesgo
Dose (indipendente dal peso corporeo) | Durata approssimativa dell'iniezione sottocutanea | Periodo di osservazioneab | |
Dose iniziale | 1200 mg di pertuzumab/600 mg di trastuzumab | 8 minuti | 30 minuti |
Dose di mantenimento (in seguito, ogni 3 settimane) | 600 mg di pertuzumab/600 mg di trastuzumab | 5 minuti | 15 minuti |
a I pazienti devono essere tenuti sotto stretta osservazione per identificare eventuali reazioni correlate all'iniezione e reazioni di ipersensibilità.
b Il periodo di osservazione deve iniziare dopo la somministrazione di Phesgo e terminare prima della successiva chemioterapia.
L'iniezione deve essere somministrata esclusivamente nella coscia, alternando la destra e la sinistra. Le nuove iniezioni devono essere somministrate ad almeno 2,5 cm dal sito precedente in una zona di cute sana e mai in aree con arrossamento, lividi, indolenzimento o indurimento della pelle. Non suddividere la dose in 2 siringhe o in 2 siti di iniezione. Durante il ciclo di trattamento con Phesgo è preferibile iniettare eventuali altri medicamenti per uso sottocutaneo in altri siti.
Passaggio da pertuzumab e trastuzumab somministrati per via endovenosa a Phesgo
Nei pazienti trattati con pertuzumab e trastuzumab per via endovenosa che hanno ricevuto l'ultima dose da < 6 settimane, Phesgo deve essere somministrato come dose di mantenimento da 600 mg di pertuzumab/600 mg di trastuzumab, e in seguito ogni 3 settimane. Nei pazienti trattati con pertuzumab e trastuzumab per via endovenosa che hanno ricevuto l'ultima dose da ≥6 settimane, Phesgo deve essere somministrato come dose iniziale di 1200 mg di pertuzumab/600 mg di trastuzumab, e in seguito ogni 3 settimane come dose di mantenimento da 600 mg di pertuzumab/600 mg di trastuzumab.
Nei pazienti in trattamento con un taxano, Phesgo deve essere somministrato prima del taxano. La dose iniziale raccomandata di docetaxel in caso di somministrazione insieme a Phesgo è di 75 mg/m2.
Nei pazienti che ricevono un regime a base di antracicline, Phesgo deve essere somministrato solo dopo il completamento del regime con antracicline.
Durata della terapia
Carcinoma mammario in fase iniziale (Early Breast Cancer, EBC)
Nel contesto neoadiuvante (prima dell'intervento), si raccomanda di trattare i pazienti con Phesgo per 3-6 cicli (a seconda di quale regime viene scelto in combinazione con la chemioterapia) (cfr. «Efficacia clinica»).
Nel contesto adiuvante (dopo l'intervento), Phesgo deve essere somministrato complessivamente per 1 anno (per un massimo di 18 cicli o fino all'insorgenza di una recidiva o di tossicità non controllabile, a seconda di quale evento si verifica prima) nell'ambito di un regime completo per l'EBC che includa una chemioterapia standard a base di antracicline e/o taxani. Il trattamento con Phesgo deve essere iniziato nel giorno 1 del primo ciclo contenente taxani e continuato anche in caso di interruzione della chemioterapia (cfr. «Efficacia clinica»).
Nei pazienti in cui si inizia il trattamento con Phesgo in un contesto neoadiuvante, Phesgo deve essere continuato anche durante la terapia adiuvante, per un totale di 1 anno di trattamento (massimo 18 cicli).
Carcinoma mammario metastatico (Metastatic Breast Cancer, MBC)
Phesgo deve essere somministrato in combinazione con docetaxel fino alla progressione della malattia o all'insorgenza di tossicità non controllabile. Il trattamento con Phesgo può essere proseguito anche in caso di interruzione del trattamento con docetaxel.
Adeguamento della dose a causa di effetti indesiderati/interazioni
Si sconsiglia di ridurre la dose di Phesgo.
Per l'adeguamento della dose della chemioterapia, consultare il rispettivo foglietto illustrativo.
Reazioni correlate all'iniezione
Se un paziente sviluppa sintomi correlati all'iniezione, si deve ridurre la velocità di iniezione oppure sospendere l'iniezione (cfr. «Avvertenze e misure precauzionali»).
Ipersensibilità/anafilassi
Se un paziente sviluppa una grave reazione di ipersensibilità (ad es. anafilassi), l'iniezione deve essere interrotta immediatamente e definitivamente (cfr. «Avvertenze e misure precauzionali).
Disfunzione ventricolare sinistra
Consultare «Avvertenze e misure precauzionali» per le raccomandazioni posologiche in caso di disfunzione ventricolare sinistra (LVD).
Istruzioni posologiche speciali
Pazienti con disturbi della funzionalità epatica
La sicurezza e l'efficacia di Phesgo nei pazienti con disturbi della funzionalità epatica non sono state studiate. Non è possibile formulare raccomandazioni posologiche per Phesgo (cfr. «Cinetica di gruppi di pazienti speciali»).
Pazienti con disturbi della funzionalità renale
Nei pazienti con disturbi della funzionalità renale lievi o moderati non sono necessari adeguamenti della dose di Phesgo. Per i pazienti con disturbi della funzionalità renale gravi non è possibile formulare raccomandazioni posologiche, poiché i dati sulla farmacocinetica (PK) sono limitati (cfr. «Cinetica di gruppi di pazienti speciali»).
Pazienti anziani
Nei pazienti di età ≥65 anni non sono necessari aggiustamenti della dose di Phesgo, sebbene i relativi dati siano limitati a 26 pazienti (cfr. «Sicurezza ed efficacia nei pazienti anziani» e «Cinetica di gruppi di pazienti speciali»).
Bambini e adolescenti
La sicurezza e l'efficacia di Phesgo nei bambini e negli adolescenti (< 18 anni) non sono state studiate.
Somministrazione ritardata della dose
Se l'intervallo tra 2 dosi consecutive è inferiore a 6 settimane, deve essere somministrata il prima possibile la dose di mantenimento di Phesgo da 600 mg di pertuzumab/600 mg di trastuzumab, senza aspettare la successiva dose programmata.
Se l'intervallo tra 2 dosi consecutive è pari o superiore a 6 settimane, deve essere somministrata nuovamente la dose iniziale da 1200 mg di pertuzumab/600 mg di trastuzumab, seguita dalla dose di mantenimento da 600 mg di pertuzumab/600 mg di trastuzumab ogni 3 settimane.
Controindicazioni
Phesgo è controindicato nei pazienti con ipersensibilità nota a pertuzumab, trastuzumab o a una delle sostanze ausiliarie.
Avvertenze e misure precauzionali
Disfunzione ventricolare sinistra
Con i principi attivi che bloccano l'attività di HER2, inclusi pertuzumab e trastuzumab, è stata riferita una riduzione della frazione di eiezione ventricolare sinistra (LVEF). L'incidenza di una LVD sistolica (insufficienza cardiaca congestizia) sintomatica era più alta nei pazienti trattati con pertuzumab in combinazione con trastuzumab e chemioterapia che in quelli trattati con trastuzumab e chemioterapia. Nel contesto adiuvante, la maggior parte dei casi di insufficienza cardiaca sintomatica ha coinvolto pazienti che ricevevano una chemioterapia a base di antracicline (cfr. «Effetti indesiderati»). Sulla base di studi con pertuzumab per via endovenosa in combinazione con trastuzumab e chemioterapia, nei pazienti che hanno ricevuto in precedenza una terapia a base di antracicline o una radioterapia nella zona mammaria, il rischio di riduzione della LVEF potrebbe essere più elevato.
Phesgo e/o pertuzumab per via endovenosa e trastuzumab non sono stati studiati nei pazienti con LVEF < 55% (EBC) o < 50% (MBC) prima del trattamento, con insufficienza cardiaca congestizia all'anamnesi, con condizioni che possono compromettere la LVD, ad esempio ipertensione non controllata, recente infarto del miocardio, gravi aritmie cardiache che richiedono un trattamento, o nei pazienti con una precedente esposizione cumulativa ad antracicline superiore a 360 mg/m2 di doxorubicina o alla dose corrispondente di un medicamento equivalente. Pertuzumab per via endovenosa in combinazione con trastuzumab e chemioterapia non è stato studiato nei pazienti in cui durante una precedente terapia adiuvante con trastuzumab si era verificata una riduzione della LVEF a < 50%.
La LVEF deve essere controllata prima dell'inizio dell'impiego di Phesgo e a intervalli regolari durante il trattamento, per verificare che il suo valore sia entro i limiti della norma (cfr. tabella 2 in basso). Se la LVEF si riduce come riportato nella tabella 2 e al controllo successivo non migliora o mostra un'ulteriore riduzione si deve prendere urgentemente in considerazione una sospensione di Phesgo, a meno che non si ritenga che nel singolo paziente i benefici siano superiori ai rischi.
Tabella 2: Raccomandazioni posologiche in caso di disfunzione ventricolare sinistra
LVEF prima del trattamento: | Controllo della LVEF ogni: | Interrompere la somministrazione di Phesgo per almeno 3 settimane se la LVEF si riduce a: | Riprendere la somministrazione di Phesgo dopo 3 settimane se la LVEF è salita nuovamente a: | |||
Carcinoma mammario metastaticoa | ≥50% | ~ 12 settimane | oppure | oppure | ||
< 40% | 40-45% con una riduzione di ≥10 punti percentuali rispetto al valore pre-trattamento | > 45% | 40-45% con una riduzione di < 10 punti percentuali rispetto al valore pre-trattamento | |||
Carcinoma mammario in fase iniziale | ≥55%b | ~ 12 settimane (1 volta nel contesto neoadiuvante) | < 50% con una riduzione di ≥10 punti percentuali rispetto al valore pre-trattamento | oppure | ||
≥50% | < 10 punti percentuali al di sotto del valore pre-trattamento | |||||
a Sulla base dei dati sull'uso endovenoso di pertuzumab (studio CLEOPATRA).
b Nei pazienti trattati con chemioterapia a base di antracicline, dopo l'interruzione della terapia con antracicline è necessaria una LVEF ≥50% prima dell'impiego di Phesgo.
Reazioni correlate all'iniezione/infusione
Phesgo è stato associato a reazioni correlate all'iniezione. Le reazioni correlate all'iniezione erano definite come qualsiasi reazione sistemica con sintomi quali febbre, brividi, cefalea, probabilmente dovuti al rilascio di citochine, insorta entro 24 ore dalla somministrazione di Phesgo. Si raccomanda un attento monitoraggio dei pazienti durante e per 30 minuti dopo la somministrazione della dose iniziale e durante e per 15 minuti dopo la somministrazione della dose di mantenimento di Phesgo. Se insorge una reazione correlata all'iniezione significativa, si deve ridurre la velocità di iniezione o sospendere l'iniezione, e devono essere adottate terapie mediche adeguate. I pazienti devono essere valutati e tenuti sotto stretta osservazione fino alla completa scomparsa dei segni e dei sintomi. Nei pazienti con gravi reazioni correlate all'iniezione si deve valutare l'interruzione definitiva del trattamento. Tale valutazione clinica deve basarsi sulla gravità della reazione precedente e sulla risposta al trattamento utilizzato per la reazione avversa (cfr. «Posologia/impiego»). Sebbene non siano stati osservati casi con esito fatale conseguenti a reazioni correlate all'iniezione dopo la somministrazione di Phesgo, è comunque necessario avere prudenza, in quanto pertuzumab per via endovenosa in combinazione con trastuzumab per via endovenosa e chemioterapia è stato associato a reazioni correlate all'infusione (IRR) fatali.
Reazioni di ipersensibilità/anafilassi
I pazienti devono essere tenuti sotto stretta osservazione per identificare eventuali reazioni di ipersensibilità. Sebbene nei pazienti trattati con Phesgo non siano state osservate reazioni di ipersensibilità gravi, tra cui anafilassi ed eventi fatali, è comunque necessario avere prudenza, in quanto pertuzumab per via endovenosa in combinazione con trastuzumab e chemioterapia è stato associato a tali reazioni (cfr. «Effetti indesiderati»). Devono essere disponibili e pronti per l'uso medicamenti per il trattamento di tali reazioni e un adeguato equipaggiamento di emergenza. Phesgo è controindicato nei pazienti con ipersensibilità nota a pertuzumab, trastuzumab o a una delle sostanze ausiliarie (cfr. «Controindicazioni»).
Reazioni polmonari
Dopo l'introduzione sul mercato sono stati riferiti durante il trattamento con trastuzumab gravi effetti indesiderati polmonari (cfr. «Effetti indesiderati»). Alcuni di questi casi hanno avuto un esito fatale e sono insorti nell'ambito di un'IRR o come reazioni tardive. Inoltre sono stati segnalati pneumopatia interstiziale inclusa infiltrazione polmonare, sindrome da distress respiratorio acuto, infiammazione polmonare, polmonite, effusioni pleuriche, disturbi respiratori, edema polmonare acuto e insufficienza respiratoria.
Tra i fattori di rischio per una pneumopatia interstiziale vi sono altre terapie antineoplastiche somministrate in concomitanza o in precedenza per le quali è nota l'associazione con pneumopatia interstiziale, ad esempio taxani, gemcitabina, vinorelbina e radioterapia. Nei pazienti che presentano una dispnea a riposo dovuta a complicanze della malattia maligna in fase avanzata e a comorbidità può sussistere un rischio più elevato di eventi polmonari. Pertanto, questi pazienti non devono essere trattati con Phesgo.
Neutropenia febbrile
I pazienti trattati con pertuzumab, trastuzumab e docetaxel presentano un rischio più elevato di sviluppare neutropenia febbrile rispetto ai pazienti trattati con placebo, trastuzumab e docetaxel, soprattutto durante i primi 3 cicli di trattamento (cfr. «Effetti indesiderati»); pertanto si raccomanda cautela nell'impiego di Phesgo. Nello studio CLEOPATRA sull'MBC, il numero minimo di neutrofili misurato nei pazienti trattati con pertuzumab e in quelli trattati con placebo è stato simile. Nei pazienti trattati con pertuzumab l'aumento dell'incidenza di neutropenia febbrile è stato associato a una maggiore incidenza di mucosite e diarrea. Si deve prendere in considerazione un trattamento sintomatico della mucosite e della diarrea. Dopo l'interruzione di docetaxel non sono stati riportati eventi di neutropenia febbrile.
Diarrea
Phesgo può causare diarrea grave. La diarrea insorge più comunemente in caso di somministrazione concomitante di una terapia contenente taxani. Per il trattamento della diarrea attenersi alle normali procedure e linee guida standard. Si deve valutare un intervento precoce con loperamide, apporto di liquidi e ripristino degli elettroliti, in particolare nei pazienti anziani e in caso di diarrea grave o persistente. Se non è possibile ottenere un miglioramento delle condizioni del paziente si deve prendere in considerazione l'interruzione del trattamento con Phesgo. Se la diarrea viene trattata efficacemente il trattamento con Phesgo può essere ripreso.
Interazioni
Non sono stati condotti studi formali di interazione farmacologica.
Pertuzumab per via endovenosa
Un sottostudio con 37 pazienti condotto nell'ambito dello studio cardine CLEOPATRA non ha fornito alcuna indicazione di un'interazione farmacologica tra pertuzumab e trastuzumab o tra pertuzumab e docetaxel. Inoltre, sulla base dell'analisi PK di popolazione, non è stata rilevata alcuna interazione PK clinicamente rilevante tra pertuzumab e docetaxel o trastuzumab somministrati in concomitanza. L'assenza di interazioni farmacologiche è stata confermata dai dati PK degli studi NEOSPHERE e APHINITY.
5 studi hanno esaminato gli effetti di pertuzumab sulla PK di citostatici somministrati in concomitanza, docetaxel, paclitaxel, gemcitabina, capecitabina, carboplatino ed erlotinib. Non sono state riscontrate indicazioni di interazioni PK tra pertuzumab e uno di questi principi attivi. La PK di pertuzumab in questi studi è stata paragonabile a quella osservata negli studi in monoterapia.
Trastuzumab per via endovenosa
Non sono stati condotti studi formali di interazione farmacologica con trastuzumab negli esseri umani. Non è stata osservata alcuna interazione clinicamente significativa tra trastuzumab e i medicamenti concomitanti utilizzati negli studi clinici.
Negli studi in cui trastuzumab è stato somministrato in combinazione con docetaxel, carboplatino o anastrozolo, né la PK di questi principi attivi né quella di trastuzumab hanno subito alterazioni.
Le concentrazioni di paclitaxel e doxorubicina (e dei loro principali metaboliti 6-α-idrossil-paclitaxel, POH e doxorubicinolo, DOL) sono rimaste inalterate in presenza di trastuzumab. Tuttavia, trastuzumab può incrementare l'esposizione totale a uno dei metaboliti della doxorubicina (7-deossi-13-diidro-doxorubicinone, D7D). L'attività biologica di D7D e gli effetti clinici dell'aumento di questo metabolita non sono chiari. In presenza di paclitaxel e doxorubicina non sono state riscontrate variazioni delle concentrazioni di trastuzumab.
I risultati di un sottostudio di interazione farmacologica, in cui è stata valutata la PK di capecitabina e cisplatino in caso di impiego con e senza trastuzumab, hanno mostrato che l'esposizione ai metaboliti bioattivi (ad es. 5-FU) della capecitabina non è stata influenzata dalla somministrazione concomitante di cisplatino o dalla somministrazione concomitante di cisplatino più trastuzumab. Per quanto riguarda la capecitabina stessa, però, le concentrazioni sono state più elevate e l'emivita più lunga in caso di impiego in combinazione con trastuzumab. I dati indicano anche che la PK di cisplatino non è influenzata dalla somministrazione concomitante di capecitabina o dalla somministrazione concomitante di capecitabina più trastuzumab.
Gravidanza/Allattamento
Contraccezione
Le donne in età fertile, incluse le partner di pazienti di sesso maschile, devono utilizzare un metodo contraccettivo efficace durante il trattamento con Phesgo e per 7 mesi dopo l'ultima dose di Phesgo.
Gravidanza
Non sono stati effettuati studi clinici con Phesgo in donne in gravidanza. Nell'ambito della sorveglianza post-marketing di trastuzumab, sono stati segnalati in donne in gravidanza casi di compromissione della crescita renale fetale e/o della funzionalità renale del feto associati a oligoidramnios, alcuni dei quali hanno portato a un'ipoplasia polmonare del feto di esito fatale. Gli studi sugli animali hanno evidenziato tossicità per la riproduzione e hanno mostrato che trastuzumab attraversa la placenta (cfr. «Dati preclinici»). Phesgo non deve essere utilizzato in gravidanza, se non in caso di evidente necessità, quando il potenziale beneficio per la madre supera i possibili rischi per il feto.
Phesgo contiene ialuronidasi umana ricombinante (rHuPH20). Per le possibili ripercussioni di rHuPH20 sui parametri riproduttivi e lo sviluppo embrionale negli animali, consultare «Dati preclinici». L'impatto sui parametri riproduttivi degli anticorpi neutralizzanti contro rHuPH20 o la ialuronidasi endogena non è noto.
Sulla base dei dati post-marketing e degli studi sugli animali, Phesgo può nuocere al feto se utilizzato da una donna in gravidanza. Le donne che restano incinte devono essere informate della possibilità di danni al feto. Se una donna in gravidanza viene trattata con Phesgo, o se una paziente resta incinta durante il trattamento con Phesgo o entro 7 mesi dall'ultima dose di Phesgo, è consigliabile un attento monitoraggio da parte di un'equipe multidisciplinare.
Allattamento
Non è noto se Phesgo passi nel latte materno negli esseri umani. Negli studi sugli animali è stato dimostrato che trastuzumab passa nel latte (cfr. «Dati preclinici»). Per pertuzumab non vi sono dati disponibili. Poiché le IgG umane passano nel latte materno e la probabilità che vengano assorbite dal neonato e che lo danneggino non è nota, le donne devono essere invitate a non allattare durante il trattamento con Phesgo e per 7 mesi dopo l'ultima dose di Phesgo.
Fertilità
Non sono disponibili dati clinici sulla fertilità con Phesgo. Negli studi sugli animali con pertuzumab e trastuzumab non sono state riscontrate indicazioni di una compromissione della fertilità (cfr. «Dati preclinici»).
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Phesgo ha effetti trascurabili sulla capacità di guidare veicoli o sulla capacità di utilizzare macchine. Durante il trattamento con Phesgo possono insorgere reazioni correlate all'iniezione e vertigini (cfr. «Avvertenze e misure precauzionali» ed «Effetti indesiderati»).
Effetti indesiderati
Riassunto del profilo di sicurezza
Il profilo di sicurezza di Phesgo si basa sui dati dello studio di fase III FEDERICA, in cui pazienti con carcinoma mammario HER2-positivo sono stati trattati con Phesgo (n = 248) o con pertuzumab per via endovenosa e trastuzumab (n = 252) in combinazione con chemioterapia.
Gli effetti indesiderati (EI) più frequenti (≥5%) nei pazienti in trattamento con Phesgo o con pertuzumab per via endovenosa in combinazione con trastuzumab sono stati diarrea, reazione nel sito di iniezione, IRR, astenia, stanchezza, eruzione cutanea, riduzione della frazione di eiezione e anemia.
Gli eventi indesiderati gravi (EIG) più frequenti (≥1%) nei pazienti in trattamento con Phesgo o con pertuzumab per via endovenosa in combinazione con trastuzumab sono stati neutropenia febbrile, piressia, neutropenia/riduzione del numero di neutrofili, sepsi neutropenica e IRR. Gli EIG erano equamente distribuiti nel braccio di trattamento con Phesgo e nel braccio di trattamento con pertuzumab per via endovenosa in combinazione con trastuzumab. I seguenti effetti indesiderati sono stati segnalati più frequentemente (≥5%) con Phesgo che con pertuzumab per via endovenosa in combinazione con trastuzumab: alopecia 77% vs 70,2%, dispnea 10,1% vs 4,4% e stanchezza 27,8% vs 22,6%.
Elenco tabellare degli effetti indesiderati
In generale, il profilo di sicurezza di Phesgo corrisponde al profilo di sicurezza di pertuzumab per via endovenosa in combinazione con trastuzumab e chemioterapia osservato nei seguenti studi cardine (n = 3344) con trattamento con pertuzumab e trastuzumab:
- CLEOPATRA, in cui pazienti con MBC hanno ricevuto pertuzumab in combinazione con trastuzumab e docetaxel (n = 453);
- NEOSPHERE (n = 309) e TRYPHAENA (n = 218), in cui pazienti con carcinoma mammario infiammatorio localmente avanzato o EBC hanno ricevuto pertuzumab nel contesto neoadiuvante in combinazione con trastuzumab e chemioterapia;
- APHINITY, in cui pazienti con EBC hanno ricevuto pertuzumab nel contesto adiuvante in combinazione con trastuzumab e una chemioterapia contenente taxani a base di antracicline o non a base di antracicline (n = 2364).
Di seguito sono elencati gli EI riportati negli studi clinici cardine e nell'ambito della sorveglianza post-marketing in associazione con l'uso di pertuzumab, trastuzumab e chemioterapia.
Poiché pertuzumab/trastuzumab è utilizzato in combinazione con la chemioterapia, è difficile stabilire una relazione causale tra un EI e un determinato principio attivo.
In questa sezione sono state utilizzate le seguenti categorie di frequenza: «molto comune» (≥1/10), «comune» (< 1/10, ≥1/100), «non comune» (< 1/100, ≥1/1000), «raro» (< 1/1000, ≥1/10'000), «molto raro» (< 1/10'000) e «non nota» (la frequenza non può essere definita sulla base dei dati disponibili). All'interno di ogni gruppo di frequenza, gli EI sono elencati in ordine di gravità decrescente.
I seguenti effetti indesiderati sono stati riportati negli studi cardine con pertuzumab, trastuzumab e nell'ambito della sorveglianza post-marketing a,b,c
Infezioni ed infestazioni
Molto comune: rinofaringite (12,8% [grado 3-4: < 0,1%]).
Comune: infezioni delle vie respiratorie superiori, paronichia.
Patologie del sistema emolinfopoietico
Molto comune: neutropenia (31,4% [grado 3-4: 24,2%]), anemia (24,8% [grado 3-4: 5,7%]), neutropenia febbriled (11,9% [grado 3-4: 11,8%]), leucopenia (10,8% [grado 3-4: 6,1%]).
Disturbi del sistema immunitario
Comune: ipersensibilità, ipersensibilità al medicamento.
Disturbi del metabolismo e della nutrizione
Molto comune: riduzione dell'appetito (23,1% [grado 3-4: 0,8%]).
Non nota: sindrome da lisi tumoraleg.
Disturbi psichiatrici
Molto comune: insonnia (15,9% [grado 3-4: 0,2%]).
Patologie del sistema nervoso
Molto comune: disgeusia (22,7% [grado 3-4: < 0,1%]), cefalea (21,8% [grado 3-4: 0,4%]), neuropatia sensoriale periferica (15,7% [grado 3-4: 0,5%]), neuropatia periferica (14,7% [grado 3-4: 0,7%]), vertigini (11,2% [grado 3-4: 0,1%]), parestesia (10,2% [grado 3-4: 0,4%]).
Patologie dell'occhio
Molto comune: aumento della lacrimazione (12,1%).
Patologie cardiache
Comune: LVDe.
Non comune: insufficienza cardiaca congestiziae.
Patologie respiratorie, toraciche e mediastiniche
Molto comune: epistassi (15,6% [grado 3-4: < 0,1%]), tosse (15,5% [grado 3-4: < 0,1%]), dispnea (11,5% [grado 3-4: 0,5%]).
Non comune: versamento pleurico.
Patologie gastrointestinali
Molto comune: diarrea (67,9% [grado 3-4: 8,9%]), nausea (60,8% [grado 3-4: 1,9%]), vomito (30,0% [grado 3-4: 1,7%]), stomatite (24,9% [grado 3-4: 1,6%]), costipazione (24,5% [grado 3-4: 0,4%]), dispepsia (13,2% [grado 3-4: < 0,1%]), dolore addominale (11,7% [grado 3-4: 0,4%]).
Patologie della cute e del tessuto sottocutaneo
Molto comune: alopecia (63,1% [grado 3-4: < 0,1%]), rash (26,4% [grado 3-4: 0,5%]), disturbi delle unghie (12,9% [grado 3-4: 0,3%]), prurito (12,9% [grado 3-4: < 0,1%]), pelle secca (11,7% [grado 3-4: < 0,1%]).
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Molto comune: artralgia (24,6% [grado 3-4: 0,7%]), mialgia (24,3% [grado 3-4: 0,8%]), dolore alle estremità (10,0% [grado 3-4: 0,2%]).
Patologie sistemiche e condizioni relative alla sede di somministrazione
Molto comune: stanchezza (44,3% [grado 3-4: 3,3%]), mucosite (23,2% [grado 3-4: 1,5%]), astenia (20,9% [grado 3-4: 1,5%]), febbre (18,9% [grado 3-4: 0,6%]), edema periferico (16,2% [grado 3-4: < 0,1%]), reazione nel sito di iniezione (12,9% [grado 3-4: 0%])f.
Patologie vascolari
Molto comune: vampate di calore (15,7% [grado 3-4: 0,1%]).
a Dati aggregati relativi all'intero periodo di trattamento dello studio CLEOPATRA, al periodo con trattamento neoadiuvante degli studi NEOSPHERE e TRYPHAENA e al periodo di trattamento dello studio APHINITY. Inoltre, sono elencati gli EI specifici per il modo di somministrazione di Phesgo che sono stati riportati nello studio FEDERICA.
b Nello studio NEOSPHERE, 108 pazienti hanno ricevuto solo pertuzumab più trastuzumab, senza docetaxel, e 94 pazienti hanno ricevuto pertuzumab più docetaxel senza trastuzumab.
c Nello studio CLEOPATRA, 45 pazienti che hanno ricevuto placebo dopo la randomizzazione e che non erano stati trattati in precedenza con pertuzumab sono passati al trattamento con pertuzumab e sono inclusi nel numero dei 3344 pazienti trattati con pertuzumab.
d Indica un EI riportato in associazione con un esito fatale.
e L'incidenza di LVD e insufficienza cardiaca congestizia rispecchia i termini preferiti secondo MedDRA riportati nei singoli studi.
f Osservato solo con Phesgo.
g Rilevato nell'ambito della sorveglianza post-marketing.
Descrizione di alcuni effetti collaterali osservati negli studi clinici
Phesgo
Disfunzione ventricolare sinistra
Nello studio FEDERICA, l'incidenza di insufficienza cardiaca sintomatica (classe NYHA III o IV) con LVEF < 50% e riduzione di almeno 10 punti percentuali rispetto al valore iniziale è stata dello 0,4% nei pazienti trattati con Phesgo e dello 0% nei pazienti che hanno ricevuto pertuzumab per via endovenosa e trastuzumab. Alla data di valutazione, tutti i pazienti con insufficienza cardiaca sintomatica in trattamento con Phesgo avevano recuperato (recupero definito come 2 misurazioni consecutive della LVEF sopra il 50%). Riduzioni asintomatiche o lievemente sintomatiche (classe NYHA II) della LVEF a valori < 50% e con una diminuzione di almeno 10 punti percentuali rispetto al valore iniziale (confermate mediante una seconda misurazione della LVEF) sono state riscontrate nello 0,4% dei pazienti trattati con Phesgo e nello 0,8% dei pazienti trattati con pertuzumab per via endovenosa e trastuzumab; alla data di valutazione nessuno di questi pazienti in trattamento con Phesgo o con pertuzumab per via endovenosa e trastuzumab aveva recuperato.
Reazioni correlate all'iniezione/infusione
Nello studio FEDERICA, le reazioni correlate all'iniezione/IRR erano definite come qualsiasi reazione sistemica segnalata entro 24 ore dalla somministrazione di Phesgo o di pertuzumab per via endovenosa in combinazione con la somministrazione di trastuzumab. Reazioni correlate all'iniezione sono state riportate nell'1,2% dei pazienti trattati con Phesgo e IRR nel 10,3% dei pazienti trattati con pertuzumab per via endovenosa e trastuzumab.
Reazioni nel sito di iniezione (definite come qualsiasi reazione locale segnalata entro 24 ore dalla somministrazione di Phesgo) sono state segnalate nel 12,9% dei pazienti trattati con Phesgo; tutti gli eventi sono stati di grado 1 o 2.
Reazioni di ipersensibilità/anafilassi
Nello studio FEDERICA, la frequenza complessiva degli eventi di ipersensibilità/anafilassi riportati in associazione con la terapia HER2-specifica è stata dell'1,6% sia nei pazienti trattati con Phesgo sia nei pazienti trattati con pertuzumab per via endovenosa e trastuzumab, e nessuno di questi eventi è stato di grado 3-4 secondo i criteri NCI-CTCAE (versione 4) (cfr. «Avvertenze e misure precauzionali»).
Pertuzumab per via endovenosa e trastuzumab
Disfunzione ventricolare sinistra
Nello studio CLEOPATRA, l'incidenza di LVD nel corso del trattamento sperimentale è stata più elevata nel gruppo trattato con placebo che nel gruppo trattato con pertuzumab (8,6% vs 6,6%). Anche l'incidenza di LVD sintomatica è stata più bassa nel gruppo trattato con pertuzumab (1,8% nel gruppo placebo vs 1,5% nel gruppo trattato con pertuzumab) (cfr. «Avvertenze e misure precauzionali»).
Nello studio NEOSPHERE, in cui i pazienti hanno ricevuto 4 cicli di pertuzumab come trattamento neoadiuvante, l'incidenza di LVD (nell'intera fase di trattamento) è stata più elevata nel gruppo trattato con pertuzumab, trastuzumab e docetaxel (7,5%) che nel gruppo trattato con trastuzumab e docetaxel (1,9%). Nel gruppo trattato con pertuzumab e trastuzumab si è verificato 1 caso di LVD sintomatica.
Nello studio TRYPHAENA, l'incidenza di LVD (nell'intera fase di trattamento) è stata dell'8,3% nel gruppo che aveva ricevuto inizialmente pertuzumab più trastuzumab e 5-fluorouracile, epirubicina e ciclofosfamide (FEC) e poi pertuzumab più trastuzumab e docetaxel, del 9,3% nel gruppo che aveva ricevuto pertuzumab più trastuzumab e docetaxel dopo la FEC e del 6,6% nel gruppo trattato con pertuzumab in combinazione con TCH. L'incidenza di LVD sintomatica (insufficienza cardiaca congestizia) nel gruppo che aveva ricevuto pertuzumab più trastuzumab e docetaxel dopo la FEC è stata dell'1,3% (escludendo un paziente con LVD sintomatica durante la FEC prima del trattamento con pertuzumab più trastuzumab e docetaxel); l'incidenza è stata la stessa (1,3%) anche nel gruppo che aveva ricevuto pertuzumab in combinazione con TCH. Nel gruppo trattato con pertuzumab più trastuzumab e FEC, e poi con pertuzumab più trastuzumab e docetaxel, nessun paziente ha sviluppato una LVD sintomatica.
Nella fase neoadiuvante dello studio BERENICE, l'incidenza di LVD sintomatica di classe NYHA III/IV (insufficienza cardiaca congestizia secondo i criteri NCI-CTCAE v.4) nel gruppo trattato con AC dose-dense e poi con pertuzumab più trastuzumab e paclitaxel è stata dell'1,5%, mentre nel gruppo trattato con FEC e poi con pertuzumab in combinazione con trastuzumab e docetaxel nessuno dei pazienti (0%) ha sviluppato una LVD sintomatica. L'incidenza di LVD asintomatica (riduzione della frazione di eiezione secondo il termine preferito NCI-CTCAE v. 4) è stata del 7% nel gruppo trattato con AC dose-dense e poi con pertuzumab più trastuzumab e paclitaxel e del 3,5% nel gruppo trattato con FEC e poi con pertuzumab più trastuzumab e docetaxel.
Nello studio APHINITY, l'incidenza di insufficienza cardiaca sintomatica (classe NYHA III o IV) con LVEF < 50% e riduzione di almeno 10 punti percentuali rispetto al valore iniziale è stata < 1% (0,6% dei pazienti trattati con pertuzumab e 0,2% dei pazienti del gruppo placebo). La percentuale di pazienti con insufficienza cardiaca sintomatica che alla data di valutazione aveva recuperato (recupero definito come 2 misurazioni consecutive della LVEF sopra il 50%) era del 46,7% nel gruppo pertuzumab e del 66,7% nel gruppo placebo. La maggior parte degli eventi è stata segnalata in pazienti in trattamento con antracicline. Riduzioni asintomatiche o lievemente sintomatiche (classe NYHA II) della LVEF, con valori < 50% e una diminuzione di almeno 10 punti percentuali rispetto al valore iniziale, sono state riferite nel 2,7% dei pazienti trattati con pertuzumab e nel 2,8% dei pazienti del gruppo placebo; alla data di valutazione aveva recuperato il 79,7% dei pazienti trattati con pertuzumab e l'80,6% dei pazienti del gruppo placebo.
Reazione correlata all'infusione
Negli studi cardine, le IRR erano definite come qualsiasi evento segnalato come ipersensibilità, reazione anafilattica, reazione acuta all'infusione o sindrome da rilascio di citochine durante l'infusione o nel giorno dell'infusione. Nello studio CLEOPATRA, la dose iniziale di pertuzumab è stata somministrata il giorno prima di trastuzumab e docetaxel, per consentire lo studio delle reazioni associate a pertuzumab. Nel primo giorno, in cui è stato somministrato solo pertuzumab, la frequenza complessiva delle IRR è stata del 9,8% nel gruppo placebo e del 13,2% nel gruppo trattato con pertuzumab, con la maggior parte delle reazioni di entità lieve o moderata. Le IRR più comuni (≥1,0%) nel gruppo trattato con pertuzumab sono state piressia, brividi, stanchezza, cefalea, astenia, ipersensibilità e vomito.
Nel secondo ciclo, in cui tutti i principi attivi sono stati somministrati nello stesso giorno, le IRR più comuni (≥1,0%) nel gruppo trattato con pertuzumab sono state stanchezza, ipersensibilità al medicamento, disgeusia, ipersensibilità, mialgia e vomito (cfr. «Avvertenze e misure precauzionali»).
Negli studi con trattamenti nel contesto neoadiuvante e adiuvante, pertuzumab è stato somministrato nello stesso giorno degli altri medicamenti sperimentali. Nel primo giorno di somministrazione di pertuzumab (in combinazione con trastuzumab e chemioterapia) sono insorte IRR nel 18,6-25,0% dei pazienti. La tipologia e la gravità degli eventi sono state simili a quelle osservate nello studio CLEOPATRA, con reazioni di entità lieve o moderata nella maggior parte dei casi.
Ipersensibilità/anafilassi
Nello studio CLEOPATRA la frequenza complessiva degli eventi riferiti come ipersensibilità/anafilassi è stata del 9,3% nei pazienti del gruppo placebo e dell'11,3% nei pazienti trattati con pertuzumab, con rispettivamente il 2,5% ovvero il 2,0% di questi eventi di grado 3-4 secondo i criteri NCI-CTCAE (versione 3). In totale, hanno sviluppato anafilassi 2 pazienti nel gruppo placebo e 4 pazienti nel gruppo trattato con pertuzumab (cfr. «Avvertenze e misure precauzionali»).
Nel complesso, la maggior parte delle reazioni di ipersensibilità è stata di entità lieve o moderata ed è regredita durante il trattamento. Sulla base delle variazioni del trattamento sperimentale, la maggior parte delle reazioni è stata classificata come secondaria all'infusione di docetaxel.
Gli eventi di ipersensibilità/anafilassi insorti negli studi nel contesto neoadiuvante e adiuvante sono stati simili a quelli osservati nello studio CLEOPATRA. Nello studio NEOSPHERE, 2 pazienti del gruppo trattato con pertuzumab e docetaxel hanno sviluppato anafilassi. Sia nello studio TRYPHAENA sia nello studio APHINITY, la frequenza complessiva di ipersensibilità/anafilassi è stata più elevata nel gruppo trattato con pertuzumab e TCH (rispettivamente 13,2% e 7,6%); rispettivamente il 2,6% e l'1,3% degli eventi erano di grado 3-4 secondo i criteri NCI-CTCAE.
Immunogenicità
Come con tutte le proteine terapeutiche, anche con Phesgo può verificarsi una reazione immunitaria.
I risultati dei test di immunogenicità dipendono molto da diversi fattori, ad esempio la sensibilità e la specificità del test, la metodologia alla base del test, la manipolazione dei campioni, il momento in cui i campioni vengono prelevati, i medicamenti concomitanti e la patologia di base. Per questo motivo può essere fuorviante fare un confronto tra l'incidenza degli anticorpi correlati al trattamento contro Phesgo e l'incidenza degli anticorpi contro altri medicamenti.
Nello studio FEDERICA, l'incidenza degli anticorpi correlati al trattamento contro pertuzumab e trastuzumab nei pazienti in trattamento con pertuzumab per via endovenosa e trastuzumab è stata rispettivamente del 3% (7/237) ovvero dello 0,4% (1/237).
L'incidenza degli anticorpi correlati al trattamento contro pertuzumab, trastuzumab e la ialuronidasi alfa umana nei pazienti in trattamento con Phesgo è stata rispettivamente del 4,8% (11/231), dello 0,9% (2/232) e dello 0,9% (2/225). La rilevanza clinica dello sviluppo di anticorpi contro pertuzumab, trastuzumab o la ialuronidasi alfa umana dopo il trattamento con Phesgo non è nota.
Passaggio da pertuzumab somministrato per via endovenosa e trastuzumab a Phesgo (o viceversa)
Il passaggio da pertuzumab somministrato per via endovenosa e trastuzumab (o viceversa) non ha sollevato preoccupazioni per la sicurezza nuove o clinicamente rilevanti. Gli eventi indesiderati osservati erano in linea con quelli segnalati nello studio FEDERICA e in studi precedenti con la forma di somministrazione endovenosa di pertuzumab e trastuzumab (cfr. «Efficacia clinica»).
Notifica di effetti collaterali sospetti
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-beneficio del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi effetto indesiderato sospetto, nuovo o serio, attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sono disponibili su www.swissmedic.ch.
Posologia eccessiva
Non sono disponibili esperienze con il sovradosaggio di Phesgo negli studi clinici sull'uomo. La dose massima testata di Phesgo è di 1200 mg di pertuzumab/600 mg di trastuzumab.
Proprietà/Effetti
Codice ATC
L01XY02
Meccanismo d'azione
Pertuzumab e trastuzumab sono anticorpi monoclonali ricombinanti umanizzati del sottotipo IgG1κ, diretti contro il recettore del fattore di crescita dell'epidermide umano 2 (HER2, chiamato anche c-erbB-2), una glicoproteina transmembrana con attività tirosin chinasica intrinseca. Pertuzumab e trastuzumab si legano a epitopi diversi di HER2 – rispettivamente ai sottodomini II e IV – senza competere e hanno meccanismi complementari di interferenza con la trasmissione del segnale mediato da HER2. Per questo l'attività antiproliferativa in vitro e in vivo è maggiore quando pertuzumab e trastuzumab vengono utilizzati in combinazione.
Inoltre, la porzione Fc della struttura IgG1 di entrambi gli anticorpi determina una potente attivazione della citotossicità cellulare anticorpo-dipendente (ADCC). In vitro, l'ADCC sia di pertuzumab sia di trastuzumab agisce principalmente sulle cellule tumorali che sovraesprimono HER2, e in misura minore sulle cellule tumorali senza sovraespressione di HER2.
Farmacodinamica
Efficacia clinica
In questo paragrafo sono descritte le esperienze cliniche con l'uso di Phesgo e di pertuzumab per via endovenosa in combinazione con trastuzumab in pazienti con carcinoma mammario HER2-positivo in fase iniziale o metastatico. In tutti gli studi citati di seguito, la sovraespressione di HER2 è stata determinata in un laboratorio centrale e definita come punteggio IHC di 3+ o rapporto di amplificazione all'ISH ≥2,0.
Carcinoma mammario in fase iniziale
Combinazione a dose fissa di pertuzumab e trastuzumab, Phesgo
FEDERICA WO40324
FEDERICA è uno studio multicentrico, randomizzato, in aperto su 500 pazienti con carcinoma mammario HER2-positivo resecabile in fase iniziale o localmente avanzato (anche infiammatorio), con tumore di dimensioni > 2 cm o linfonodi positivi, nel contesto neoadiuvante e adiuvante.* I pazienti sono stati randomizzati e hanno ricevuto 8 cicli di chemioterapia neoadiuvante, con concomitante somministrazione di 4 cicli di Phesgo o di pertuzumab per via endovenosa e trastuzumab nei cicli 5-8. I medici sperimentatori hanno scelto per i singoli pazienti 1 dei 2 seguenti regimi di chemioterapia neoadiuvante:
- 4 cicli di doxorubicina (60 mg/m2) e ciclofosfamide (600 mg/m2) ogni 2 settimane, seguiti da paclitaxel (80 mg/m2) ogni settimana per 12 settimane.
- 4 cicli di doxorubicina (60 mg/m2) e ciclofosfamide (600 mg/m2) ogni 3 settimane, seguiti da 4 cicli di docetaxel (75 mg/m2 nel primo ciclo e poi 100 mg/m2 nei cicli successivi a discrezione del medico sperimentatore) ogni 3 settimane.
* L'impiego di Phesgo nei pazienti con MBC si basa su un'estrapolazione dei dati sull'uso endovenoso.
Dopo l'intervento, i pazienti hanno proseguito per altri 14 cicli la terapia con Phesgo o con pertuzumab per via endovenosa e trastuzumab (a seconda del trattamento che ricevevano prima dell'intervento), per un totale di 18 cicli di terapia HER2-specifica. I pazienti hanno ricevuto inoltre una radioterapia adiuvante e una terapia endocrina secondo la prassi locale. Nel contesto adiuvante era consentito l'uso di trastuzumab per via endovenosa invece che sottocutanea a discrezione del medico sperimentatore. La terapia HER2-specifica è stata somministrata ogni 3 settimane come indicato nella seguente tabella 3.
Tabella 3: Posologia e somministrazione raccomandata di Phesgo, pertuzumab per via endovenosa, trastuzumab per via endovenosa e trastuzumab per via sottocutanea
Medicamento | Somministrazione | Dose | |
Saturazione | Mantenimento | ||
Phesgo | Iniezione sottocutanea | 1200 mg/600 mg | 600 mg/600 mg |
Pertuzumab | Infusione endovenosa | 840 mg | 420 mg |
Trastuzumab | Infusione endovenosa | 8 mg/kg | 6 mg/kg |
Trastuzumab | Iniezione sottocutanea | 600 mg | |
Lo studio FEDERICA è stato concepito per dimostrare la non inferiorità della concentrazione sierica di valle (Ctrough) di pertuzumab in Phesgo nel ciclo 7 (ossia prima della somministrazione della dose del ciclo 8) rispetto a pertuzumab per via endovenosa (endpoint primario). Altri endpoint secondari comprendevano la non inferiorità della concentrazione sierica di valle (Ctrough) di trastuzumab in Phesgo nel ciclo 7 rispetto a trastuzumab per via endovenosa, l'efficacia (risposta patologica completa totale, total pathological complete response [tpCR]) e i risultati di sicurezza. I dati demografici erano bilanciati tra i 2 bracci di trattamento e l'età mediana dei pazienti trattati nello studio era di 51 anni. Tutti i pazienti tranne 2 erano di sesso femminile. La maggior parte dei pazienti presentava linfonodi positivi (57,6%), aveva un tumore positivo per i recettori ormonali (61,2%) ed era di razza caucasica (65,8%).
È stata dimostrata la non inferiorità dell'esposizione a pertuzumab e trastuzumab in Phesgo (cfr. «Farmacocinetica»). L'analisi dell'endpoint secondario di efficacia tpCR, definito come assenza di malattia invasiva nella mammella e nell'ascella (ypT0/is, ypN0), è riportata nella tabella 4.
Tabella 4: Riepilogo della risposta patologica completa totale
Phesgo | Pertuzumab per via endovenosa più trastuzumab | |
tpCR (ypT0/is, ypN0) | 148 (59,7%) | 150 (59,5%) |
IC esatto al 95% per il tasso di tpCR1 | (53,28; 65,84) | (52,18; 65,64) |
Differenza tra i tassi di tpCR (braccio s.c. meno braccio e.v.) | 0,15 | |
IC al 95% per la differenza tra i tassi di tpCR2 | da -8,67 a 8,97 | |
1 Intervallo di confidenza per un test binomiale a campione singolo con impiego del metodo di Pearson-Clopper.
2 Per questo calcolo è stata utilizzata una correzione di continuità secondo Hauck-Anderson.
PHranceSCa (MO40628)
Nello studio MO40628 è stata valutata la sicurezza del passaggio da pertuzumab e trastuzumab per via endovenosa a Phesgo (e viceversa), con la preferenza dei pazienti per Phesgo valutata come endpoint primario. In questo studio cross-over a 2 bracci sono stati reclutati in totale 160 pazienti: 80 sono stati randomizzati al braccio A (3 cicli di pertuzumab e trastuzumab per via endovenosa, quindi 3 cicli di Phesgo) e 80 al braccio B (3 cicli di Phesgo, quindi 3 cicli di pertuzumab e trastuzumab per via endovenosa). I pazienti potevano poi scegliere se continuare il trattamento con pertuzumab e trastuzumab per via endovenosa o con Phesgo, per arrivare a un totale di 18 cicli di terapia HER2-specifica.
Secondo l'analisi primaria, 136 dei 160 pazienti (85%) hanno riferito di preferire Phesgo somministrato per via sottocutanea a pertuzumab e trastuzumab somministrati per via endovenosa. Il motivo più comune era che la somministrazione richiedeva una permanenza in ospedale più breve. 22 dei 160 pazienti (14%) hanno riferito di preferire pertuzumab e trastuzumab somministrati per via endovenosa a Phesgo. Il motivo più comune era che la somministrazione era più piacevole. 2 dei 160 pazienti (1%) non preferivano nessuna delle 2 vie di somministrazione.
Nei pazienti del braccio A, l'incidenza di eventi avversi dopo il passaggio da pertuzumab e trastuzumab per via endovenosa a Phesgo è rimasta simile. Nel braccio A, l'incidenza di eventi avversi nei cicli da 1 a 3 (e.v.) è stata del 77,5%, nei cicli da 4 a 6 (s.c.) del 72,5%. Nel braccio B, l'incidenza di eventi avversi nei cicli da 1 a 3 (s.c.) è stata del 77,5%, nei cicli da 4 a 6 (e.v.) del 63,8%. Indipendentemente dalla terapia somministrata, il numero complessivo di eventi è stato più alto nei cicli da 1 a 3 che nei cicli da 4 a 6.
Pertuzumab e trastuzumab per via endovenosa
Per ulteriori informazioni e dati clinici su pertuzumab e trastuzumab somministrati per via endovenosa, consultare la sezione «Efficacia clinica» dell'informazione professionale di Perjeta. Questa contiene anche una descrizione del disegno e dei risultati degli studi di omologazione condotti in pazienti con carcinoma mammario HER2-positivo in fase iniziale o metastatico.
Sicurezza ed efficacia nei pazienti anziani
Nel complesso non sono state riscontrate differenze per quanto riguarda l'efficacia e la sicurezza di Phesgo tra i pazienti di età ≥65 anni (n = 26) e quelli di età < 65 anni (n = 222).
Tuttavia, con pertuzumab per via endovenosa in combinazione con trastuzumab, l'incidenza dei seguenti eventi avversi di tutti i gradi nei pazienti di età ≥65 anni (n = 418) è stata più elevata di almeno il 5% rispetto ai pazienti di età < 65 anni (n = 2926): appetito ridotto, anemia, perdita di peso, astenia, disgeusia, neuropatia periferica, ipomagnesiemia e diarrea.
Sicurezza ed efficacia nei pazienti pediatrici
La sicurezza e l'efficacia di Phesgo nei bambini e negli adolescenti sotto i 18 anni di età non sono state esaminate.
Farmacocinetica
Nella tabella 5 è riportata l'esposizione a pertuzumab e trastuzumab dopo la somministrazione sottocutanea di Phesgo (1200 mg di pertuzumab/600 mg di trastuzumab come dose iniziale, seguita da 600 mg di pertuzumab/600 mg di trastuzumab ogni 3 settimane) nello studio FEDERICA. I risultati PK per l'endpoint primario della concentrazione di valle (Ctrough) di pertuzumab nel ciclo 7 (ossia prima della somministrazione della dose del ciclo 8) hanno dimostrato la non inferiorità di pertuzumab in Phesgo (media geometrica 88,7 µg/ml) rispetto a pertuzumab per via endovenosa (media geometrica 72,4 µg/ml) con un rapporto delle medie geometriche di 1,22 (IC al 90%: 1,14-1,31). Il limite inferiore dell'intervallo di confidenza bilaterale al 90% per il rapporto delle medie geometriche di pertuzumab in Phesgo e pertuzumab per via endovenosa era di 1,14, ed era dunque superiore al limite predefinito di 0,8.
I risultati PK per l'endpoint secondario Ctrough di trastuzumab nel ciclo 7 (ossia prima della somministrazione della dose del ciclo 8) hanno dimostrato la non inferiorità di trastuzumab in Phesgo (media geometrica 57,5 µg/ml) rispetto a trastuzumab per via endovenosa (media geometrica 43,2 µg/ml), con un rapporto delle medie geometriche di 1,33 (IC al 90%: 1,24-1,43).
Utilizzando i dati aggregati sulla PK di pertuzumab in Phesgo e di pertuzumab per via endovenosa dello studio FEDERICA, è stato creato un modello PK di popolazione di pertuzumab con eliminazione lineare dal compartimento centrale, per descrivere le concentrazioni PK misurate di pertuzumab dopo la somministrazione sottocutanea di Phesgo e dopo la somministrazione endovenosa di pertuzumab.
Utilizzando i dati aggregati sulla PK di trastuzumab dello studio di fase III BO22227 (HannaH), relativi a trastuzumab per via sottocutanea vs trastuzumab per via endovenosa, è stato creato un modello PK di popolazione con eliminazione parallela lineare e non lineare dal compartimento centrale, per descrivere le concentrazioni PK dopo la somministrazione endovenosa di trastuzumab o la somministrazione sottocutanea di trastuzumab in pazienti con EBC HER2-positivo. L'analisi PK basata sul modello PK di popolazione dello studio HannaH ha mostrato che pertuzumab in Phesgo non ha influenzato la PK di trastuzumab in Phesgo, in quanto la PK di trastuzumab in Phesgo e la PK di trastuzumab per via sottocutanea sono state omogenee.
L'esposizione a pertuzumab e trastuzumab prevista sulla base della PK di popolazione è riassunta nella seguente tabella 5.
Tabella 5: Esposizione a pertuzumab e trastuzumab (mediana con 5o e 95o percentile) dopo la somministrazione sottocutanea di Phesgo o la somministrazione endovenosa di pertuzumab o trastuzumab
Parametro | Pertuzumab in | Pertuzumab per via endovenosa | Trastuzumab in | Trastuzumab per via endovenosab | |
Ctrough (µg/ml) | Ciclo 5 | 85,1 (48,7-122,5) | 74,9 (47,8-99,8) | 27,7 | 31,4 |
Ciclo 7 | 88,9 | 78,5 | 57,5 | 44,9 | |
Cmax (µg/ml) | Ciclo 5 | 106,5 | 304,8 | 44,6 | 172,9 |
Ciclo 7 | 149,5 | 225,9 | 117,3 | 169,1 | |
AUC0‑21 giorni (µg/ml•die) | Ciclo 5 | 2306,9 | 2519,7 | 1023,8 | 1341,0 |
Ciclo 7 | 2569,3 | 2454,3 | 1838,7 | 1668,6 | |
a Somministrazione della prima dose di Phesgo o di pertuzumab e trastuzumab per via endovenosa nel ciclo 5.
b Per simulare la PK di trastuzumab è stato utilizzato il modello PK di popolazione dello studio BO22227 (HannaH).
Assorbimento
La concentrazione sierica massima (Cmax) mediana di pertuzumab in Phesgo e il tempo alla concentrazione massima (Tmax) sono stati rispettivamente di 157 µg/ml e 3,82 giorni. Sulla base dell'analisi della PK di popolazione, la biodisponibilità assoluta era di 0,712 e il tasso di assorbimento di primo ordine (Ka) di 0,348 (1/giorno).
La concentrazione sierica massima (Cmax) mediana di trastuzumab in Phesgo e il tempo alla concentrazione massima (Tmax) sono stati rispettivamente di 114 µg/ml e 3,84 giorni. Sulla base dell'analisi della PK di popolazione, la biodisponibilità assoluta era di 0,771 e il tasso di assorbimento di primo ordine (Ka) di 0,404 (1/giorno).
Distribuzione
Sulla base dell'analisi della PK di popolazione, in un paziente tipico il volume di distribuzione nel compartimento centrale (Vc) di pertuzumab in Phesgo era di 2,77 l.
Sulla base dell'analisi della PK di popolazione, in un paziente tipico il volume di distribuzione nel compartimento centrale (Vc) di trastuzumab somministrato per via sottocutanea era di 2,91 l.
Metabolismo
Il metabolismo di Phesgo non è stato studiato direttamente. Gli anticorpi vengono eliminati principalmente mediante catabolismo.
Eliminazione
Sulla base dell'analisi della PK di popolazione, la clearance di pertuzumab in Phesgo era di 0,163 l/giorno e l'emivita di eliminazione (t1/2) di circa 24,3 giorni.
Sulla base dell'analisi della PK di popolazione, la clearance lineare di trastuzumab somministrato per via sottocutanea era di 0,111 l/giorno. Si stima che in almeno il 95% dei pazienti le concentrazioni di trastuzumab 7 mesi dopo l'ultima dose siano < 1 μg/ml (circa il 3% della Cmin,ss prevista per la popolazione, ovvero un washout di circa il 97%).
Cinetica di gruppi di pazienti speciali
Disturbi della funzionalità epatica
Non sono stati condotti studi formali sulla PK di Phesgo in pazienti con disturbi della funzionalità epatica.
Disfunzioni renali
Non sono stati condotti studi formali sulla PK di Phesgo in pazienti con disfunzioni renali.
L'analisi della PK di popolazione di pertuzumab in Phesgo e pertuzumab per via endovenosa ha mostrato che le disfunzioni renali non influenzano l'esposizione a pertuzumab; tuttavia, l'analisi della PK di popolazione comprendeva solo dati limitati sui pazienti con gravi disfunzioni renali.
In un'analisi della PK di popolazione di trastuzumab per via sottocutanea ed endovenosa, le disfunzioni renali non hanno influito sulla persistenza di trastuzumab.
Pazienti anziani
Non sono stati condotti studi per valutare la PK di Phesgo nei pazienti anziani.
Nelle analisi della PK di popolazione di pertuzumab in Phesgo e di pertuzumab per via endovenosa, l'età non ha avuto alcun impatto significativo sulla PK di pertuzumab.
Nelle analisi della PK di popolazione di trastuzumab somministrato per via sottocutanea o endovenosa, l'età non ha avuto alcuna influenza sulla persistenza di trastuzumab.
Bambini e adolescenti
Non sono stati condotti studi per valutare la PK di Phesgo nei pazienti pediatrici.
Dati preclinici
Con Phesgo (combinazione di pertuzumab, trastuzumab e ialuronidasi umana) non sono stati effettuati studi convenzionali di farmacologia di sicurezza e tossicologia. Sono invece disponibili studi con le singole sostanze ed è stato effettuato uno studio di biodisponibilità nei mini-pig.
Pertuzumab
Tossicità per somministrazione ripetuta
Pertuzumab per via sottocutanea (250 mg/kg/settimana per 4 settimane) e per via endovenosa (fino a 150 mg/kg alla settimana per un massimo di 26 settimane) è stato ben tollerato nelle scimmie cynomolgus (specie con legame), se si esclude l'insorgenza di diarrea. Con dosi endovenose di pertuzumab di 15 mg/kg e superiori è stata riscontrata una lieve diarrea intermittente associata al trattamento. In un sottogruppo di scimmie, la somministrazione a lungo termine (26 dosi settimanali) ha portato a episodi di disidratazione conseguente a diarrea, che sono stati trattati con idratazione endovenosa.
Mutagenicità, cancerogenicità
Non sono stati effettuati studi per valutare il potenziale mutageno e cancerogeno di pertuzumab.
Tossicità per la riproduzione
Sono stati effettuati studi di tossicità per la riproduzione in scimmie cynomolgus, con dosi di saturazione di 30-150 mg/kg e dosi di mantenimento di 10-100 mg/kg che hanno permesso di raggiungere esposizioni clinicamente rilevanti. È stato osservato che la somministrazione endovenosa di pertuzumab dal giorno di gestazione (GD) 19 fino al GD 50 (fase dell'organogenesi) è embriotossica e porta a un aumento dose-dipendente dei casi di morte embrionale/fetale tra il GD 25 e il GD 70. Al GD 100 sono stati riscontrati ritardo nello sviluppo renale e oligoidramnios (teratogenicità).
Non sono stati effettuati studi specifici sulla fertilità negli animali per la valutazione degli effetti di pertuzumab. In studi di tossicità per somministrazione ripetuta della durata massima di 6 mesi sulle scimmie cynomolgus non sono stati osservati effetti indesiderati sugli organi riproduttivi maschili e femminili.
Trastuzumab
Tossicità per somministrazione ripetuta
Trastuzumab è stato ben tollerato nei topi (specie senza legame), nei conigli (specie senza legame) e nei macachi (rhesus e cynomolgus) (specie con legame) in studi di tossicità con dose singola (e.v.) e dosi multiple (s.c. ed e.v.) della durata di 13 settimane (25 mg/kg 2 volte alla settimana) e 26 settimane (25 mg/kg alla settimana). Non sono stati riscontrati segni di tossicità acuta o cronica.
Concentrazioni sistemiche misurabili dell'rHuPH20 sono improbabili, visto che non sono state rilevate in nessun paziente negli studi clinici con trastuzumab somministrato per via sottocutanea.
Mutagenicità, cancerogenicità
Non sono stati riportati dati sulla mutagenicità. Non sono stati effettuati studi per stimare il potenziale cancerogeno di trastuzumab.
Tossicità per la riproduzione
Nelle scimmie cynomolgus sono stati effettuati studi sulla riproduzione con dosi fino a 25 volte più elevate della dose di mantenimento settimanale nell'uomo di 2 mg/kg di trastuzumab per via endovenosa, senza che si evidenziassero segni di danni al feto. Durante lo sviluppo fetale precoce (GD 20-50) e tardivo (GD 120-150) è stato osservato il passaggio di trastuzumab attraverso la placenta. In uno studio sulle scimmie cynomolgus in cui trastuzumab è stato somministrato nei GD da 120 a 150 a dosi fino a 25 volte più elevate della dose di mantenimento settimanale nell'uomo di 2 mg/kg di trastuzumab per via endovenosa, trastuzumab è stato escreto nel latte dopo la nascita. L'esposizione a trastuzumab in utero e la presenza di trastuzumab nel siero di queste scimmie neonate non sono state associate a effetti negativi sulla crescita o lo sviluppo dei piccoli dalla nascita fino a 1 mese di età.
Non sono stati condotti studi sugli animali per valutare l'impatto di trastuzumab sulla fertilità degli animali di sesso maschile.
Altri dati (tossicità locale)
Trastuzumab somministrato per via sottocutanea con ialuronidasi umana è stato ben tollerato in uno studio di tollerabilità locale nei conigli (specie senza legame) e in uno studio di tossicità di 13 settimane con somministrazione ripetuta nelle scimmie cynomolgus (specie con legame).
Phesgo (pertuzumab/trastuzumab)
Tossicità locale
In uno studio di biodisponibilità nei mini-pig, l'osservazione clinica dopo una dose singola sottocutanea di pertuzumab con rHuPH20 o di pertuzumab in combinazione con trastuzumab e rHuPH20 non ha evidenziato anomalie.
Altri dati (Ialuronidasi)
Phesgo contiene come sostanza ausiliare l'rHuPH20, che viene impiegata per migliorare la distribuzione e l'assorbimento di principi attivi somministrati contemporaneamente per via sottocutanea. Concentrazioni sistemiche misurabili di rHuPH20 sono improbabili in seguito a somministrazione sottocutanea locale di Phesgo e non sono stati rilevati nei pazienti durante gli studi clinici su Phesgo.
In uno studio di tossicità di 39 settimane – che comprendeva endpoint di tossicità generali, ma anche particolari endpoint di fertilità (analisi del ciclo mestruale, misurazione degli ormoni, analisi dello sperma ed esame istologico degli organi riproduttivi) – su scimmie di sesso maschile e femminile che avevano raggiunto la maturità sessuale, la rHuPH20 ha dimostrato di essere ben tollerata. Né la rHuPH20 né gli anticorpi contro di essa, per i quali è stato dimostrato che neutralizzano la ialuronidasi endogena di cynomolgus, hanno avuto un effetto sullo sperma, sugli ormoni, sul ciclo mestruale o sul quadro istologico degli organi riproduttivi.
In uno studio successivo, scimmie di sesso maschile e femminile sono state immunizzate con PH20 ricombinante di cynomolgus e hanno prodotto una risposta anticorpale significativa. Gli anticorpi riconoscevano sia PH20 sia la ialuronidasi acrosomale delle scimmie. Nel gruppo di scimmie immunizzate con PH20, 8 delle 14 scimmie di sesso femminile, contro 6 delle 14 scimmie di sesso femminile del gruppo di controllo, sono rimaste incinte. Non sussisteva alcuna correlazione tra fertilità e titolo anticorpale.
In studi sui conigli sono stati esaminati gli effetti degli anticorpi neutralizzanti contro la rHuPH20 e la ialuronidasi endogena sui parametri riproduttivi e lo sviluppo embrionale. Nell'ambito di una valutazione dettagliata della progenie fino all'età adulta e dei risultati degli accoppiamenti non sono stati rilevati effetti indesiderati sulla fertilità maschile o femminile, né sullo sviluppo embrio-fetale.
In uno studio sullo sviluppo embrionale/fetale svolto con rHuPH20 sui topi non sono stati evidenziati segni di teratogenicità.
Studi sui topi con rHuPH20 hanno mostrato una riduzione del peso fetale e un aumento del tasso di riassorbimento. Questi effetti sono subentrati dopo esposizione a livelli di rHuPH20 che erano chiaramente superiori a quelli attendibili in seguito a somministrazione sottocutanea di Phesgo nell'uomo. Un'esposizione sistemica paragonabile si potrebbe verificare nell'uomo se per errore venisse somministrata una dose in bolo di Phesgo.
La valutazione complessiva di tutti gli studi di sperimentazione animale disponibili ha mostrato che gli anticorpi anti-rHuPH20 non avevano alcun impatto sulla fertilità maschile o femminile e nemmeno sullo sviluppo della progenie.
Altre indicazioni
La soluzione con 1200 mg di pertuzumab/600 mg di trastuzumab e la soluzione con 600 mg di pertuzumab/600 mg di trastuzumab sono soluzioni iniettabili pronte all'uso e non devono essere miscelate o diluite con altri medicamenti.
Phesgo deve essere ispezionato visivamente prima dell'uso per verificare che non presenti particelle in sospensione o alterazioni cromatiche. Non agitare.
Phesgo soluzione iniettabile è esclusivamente monouso e deve essere preparato in condizioni asettiche da un operatore sanitario.
Incompatibilità
Non sono state riscontrate incompatibilità tra Phesgo e polipropilene, policarbonato, poliuretano, polietilene, polivinilcloruro ed etilene polipropilene fluorurato.
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Stabilità dopo apertura
Per ragioni igieniche, dopo il trasferimento dal flaconcino alla siringa il medicamento deve essere utilizzato immediatamente, in quanto non contiene conservanti antimicrobici. Se non viene utilizzato immediatamente, la preparazione deve avvenire in condizioni asettiche controllate e convalidate. Dopo il trasferimento dal flaconcino alla siringa, il medicamento è fisicamente e chimicamente stabile per 28 giorni a 2-8 °C o per 24 ore a 9-30 °C.
Dopo il trasferimento della soluzione nella siringa, si raccomanda di sostituire l'ago di trasferimento con un tappo per siringa, per evitare che la soluzione nell'ago si secchi e per non compromettere la qualità del medicamento. Applicare l'etichetta rimovibile sulla siringa per contrassegnarla. L'ago per l'iniezione deve essere applicato alla siringa solo subito prima della somministrazione al paziente. Successivamente, il volume deve essere aggiustato a 10 ml (600 mg di pertuzumab/600 mg di trastuzumab) o 15 ml (1200 mg di pertuzumab/600 mg di trastuzumab).
Smaltimento di medicamenti non usati/scaduti
La dispersione di medicamenti nell'ambiente deve essere ridotta al minimo. I medicamenti non devono essere smaltiti nelle acque di scarico. Lo smaltimento con i rifiuti domestici deve essere evitato.
Per l'impiego e lo smaltimento di siringhe e altri dispositivi medici taglienti bisogna attenersi rigorosamente alle seguenti indicazioni:
- Gli aghi e le siringhe non devono mai essere riutilizzati.
- Gettare tutti gli aghi e le siringhe usati in un contenitore per rifiuti acuminati (contenitore di sicurezza monouso).
Il medicamento non utilizzato e/o i materiali di scarto devono essere smaltiti secondo le prescrizioni nazionali.
Precauzioni particolari per la conservazione
Conservare in frigorifero (2-8 °C).
Non congelare.
Conservare il contenitore nella scatola originale per proteggere il contenuto dalla luce.
Tenere fuori dalla portata dei bambini.
Numero dell'omologazione
67828 (Swissmedic).
Titolare dell’omologazione
Roche Pharma (Svizzera) SA, Basilea.
Stato dell'informazione
Aprile 2021.
▼ Ce médicament fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave. Voir la rubrique «Effets indésirables» pour les modalités de déclaration des effets secondaires.
Composition
Principes actifs
Pertuzumabum, Trastuzumabum (produit par génie génétique à l'aide de cellules CHO [ovaire de hamster chinois]).
Excipients
Hyaluronidasum humanum (rHuPH20) (produite par génie génétique à l'aide de cellules CHO [ovaire de hamster chinois]), L-histidini hydrochloridum monohydricum, L-histidinum, α,α-trehalosum dihydricum, saccharum, polysorbatum 20*, L-methioninum, aqua ad iniectabilia.
* produit à partir de maïs génétiquement modifié
Forme pharmaceutique et quantité de principe actif par unité
Solution injectable (pour administration sous-cutanée).
1200 mg de pertuzumab/600 mg de trastuzumab/15 ml de solution dans un flacon.
600 mg de pertuzumab/600 mg de trastuzumab/10 ml de solution dans un flacon.
Phesgo est une solution limpide, opalescente, incolore à légèrement brunâtre, présentée dans des flacons stériles à usage unique, apyrogènes et sans conservateur.
Indications/Possibilités d’emploi
Cancer du sein métastatique
Phesgo est indiqué en association avec le docétaxel dans le traitement de patients souffrant d'un cancer du sein HER2 positif, métastatique ou localement récurrent, non résécable, et qui n'ont pas été préalablement traités par chimiothérapie pour leur maladie métastatique.
Cancer du sein au stade précoce
Phesgo est indiqué en association avec le docétaxel dans le traitement néoadjuvant de patients souffrant d'un cancer du sein HER2 positif, localement avancé, inflammatoire, ou d'un cancer du sein au stade précoce avec risque élevé de récidive (taille de la tumeur > 2 cm de diamètre ou avec atteinte des ganglions lymphatiques) dans le cadre d'un plan thérapeutique pour cancer du sein au stade précoce.
Phesgo est indiqué en association avec la chimiothérapie dans le traitement adjuvant de patients souffrant d'un cancer du sein HER2 positif au stade précoce avec risque élevé de récidive (voir la rubrique «Propriétés/Effets», paragraphe «Efficacité clinique»).
Posologie/Mode d’emploi
Le traitement par Phesgo ne doit être instauré que sous le contrôle d'un médecin ayant l'expérience du traitement de patients cancéreux.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Les patients traités actuellement par le pertuzumab et le trastuzumab par voie intraveineuse peuvent être passés à Phesgo. Le passage du pertuzumab et du trastuzumab administrés par voie intraveineuse à Phesgo (ou vice versa) a été évalué dans l'étude MO40628 (voir «Effets indésirables» et «Efficacité clinique»).
Afin d'éviter les erreurs médicamenteuses, il est important de vérifier l'étiquette du flacon pour s'assurer que le médicament préparé et administré est bien Phesgo.
Phesgo doit être administré uniquement par injection sous-cutanée (s.c.) dans la cuisse. Ne pas administrer par voie intraveineuse.
Les patients traités par Phesgo doivent présenter un statut tumoral HER2 positif, défini par un score 3+ par immunohistochimie (IHC) ou un ratio ≥2,0 par hybridation in situ (HIS), et déterminé par une méthode de test validée.
Afin d'assurer des résultats exacts et reproductibles, les analyses doivent être effectuées dans un laboratoire spécialisé pouvant garantir la validation des méthodes de test.
Pour les instructions complètes sur la réalisation et l'interprétation du test, se référer aux notices d'emballages des méthodes de test HER2 validées.
Posologie usuelle
Cancer du sein métastatique et cancer du sein au stade précoce
Pour les recommandations posologiques de Phesgo dans le cancer du sein au stade précoce et le cancer du sein métastatique, se référer au tableau 1.
Tableau 1: Posologie et administration recommandées de Phesgo
Dose (indépendamment du poids corporel) | Durée approximative de l'injection sous-cutanée | Période d'observationab | |
Dose initiale | 1200 mg de pertuzumab/600 mg de trastuzumab | 8 minutes | 30 minutes |
Dose d'entretien (toutes les 3 semaines par la suite) | 600 mg de pertuzumab/600 mg de trastuzumab | 5 minutes | 15 minutes |
a Les patients doivent être surveillés afin de déceler les réactions liées à l'injection et les réactions d'hypersensibilité.
b La période d'observation doit débuter après l'administration de Phesgo et s'achever avant l'administration suivante d'une chimiothérapie.
L'injection doit être réalisée exclusivement dans la cuisse, en alternant côté droit et côté gauche. Les nouvelles injections doivent être réalisées à au moins 2,5 cm du site précédent sur une peau saine et jamais à des endroits où existent une rougeur, une contusion, une sensibilité au toucher ou une induration de la peau. La dose ne doit pas être répartie en deux injections ni en deux sites d'administration. Pendant le cycle de traitement par Phesgo, les autres médicaments administrés par voie sous-cutanée doivent de préférence être injectés au niveau de sites différents.
Passage du pertuzumab et du trastuzumab administrés par voie intraveineuse à Phesgo
Chez les patients traités par le pertuzumab et le trastuzumab par voie intraveineuse et qui ont reçu la dernière dose il y a moins de 6 semaines, Phesgo doit être administré à la dose d'entretien de 600 mg de pertuzumab/600 mg de trastuzumab, puis toutes les 3 semaines par la suite. Chez les patients traités par le pertuzumab et le trastuzumab par voie intraveineuse et qui ont reçu la dernière dose il y a 6 semaines ou plus, Phesgo doit être administré à la dose initiale de 1200 mg de pertuzumab/600 mg de trastuzumab, puis à la dose d'entretien de 600 mg de pertuzumab/600 mg de trastuzumab toutes les 3 semaines par la suite.
Chez les patients traités par un taxane, Phesgo doit être administré avant le taxane. La dose initiale recommandée de docétaxel est de 75 mg/m2 en cas d'administration avec Phesgo.
Chez les patients recevant un schéma à base d'anthracyclines, Phesgo doit être administré après la fin du schéma à base d'anthracyclines.
Durée du traitement
Cancer du sein au stade précoce (Early Breast Cancer, EBC)
En situation néoadjuvante (avant la chirurgie), il est recommandé de traiter les patients par Phesgo pendant trois à six cycles (selon le schéma choisi en association avec la chimiothérapie) (voir «Efficacité clinique»).
En situation adjuvante (après la chirurgie), Phesgo doit être administré pendant un an au total (au maximum 18 cycles ou jusqu'à l'apparition d'une récidive ou d'une toxicité incontrôlable, selon ce qui survient en premier) dans le cadre d'un schéma complet pour le cancer du sein au stade précoce, comprenant une chimiothérapie standard à base d'anthracyclines et/ou de taxanes. Le traitement par Phesgo doit commencer au jour 1 du premier cycle de traitement à base de taxanes et doit également être poursuivi à l'arrêt de la chimiothérapie (voir «Efficacité clinique»).
Les patients chez qui le traitement par Phesgo est instauré en situation néoadjuvante doivent continuer de recevoir Phesgo en situation adjuvante, afin d'être traités pendant un an au total (18 cycles au maximum).
Cancer du sein métastatique (Metastatic Breast Cancer, MBC)
Phesgo en association avec le docétaxel doit être administré jusqu'à progression de la maladie ou apparition d'une toxicité incontrôlable. Le traitement par Phesgo peut également être poursuivi à l'arrêt du traitement par le docétaxel.
Ajustement de la posologie du fait d'effets indésirables/d'interactions
Une réduction de la dose de Phesgo n'est pas recommandée.
Pour les ajustements de la dose de la chimiothérapie, consulter l'information professionnelle respective.
Réactions liées à l'injection
En cas de survenue de symptômes liés à l'injection chez un patient, l'injection doit être ralentie ou interrompue (voir «Mises en garde et précautions»).
Hypersensibilité/Anaphylaxie
L'injection doit être immédiatement et définitivement arrêtée si le patient présente une réaction d'hypersensibilité grave (p.ex. anaphylaxie) (voir «Mises en garde et précautions»).
Dysfonction ventriculaire gauche
Voir «Mises en garde et précautions» concernant les recommandations posologiques en cas de dysfonction ventriculaire gauche.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
La sécurité et l'efficacité de Phesgo n'ont pas fait l'objet d'études chez les patients présentant des troubles de la fonction hépatique. Aucune recommandation posologique ne peut être faite pour Phesgo (voir «Cinétique pour certains groupes de patients»).
Patients présentant des troubles de la fonction rénale
Aucun ajustement de la dose de Phesgo n'est nécessaire chez les patients présentant des troubles légers ou modérés de la fonction rénale. Aucune recommandation posologique ne peut être faite chez les patients présentant des troubles sévères de la fonction rénale, les données pharmacocinétiques disponibles étant limitées (voir «Cinétique pour certains groupes de patients»).
Patients âgés
Aucun ajustement de la dose de Phesgo n'est nécessaire chez les patients ≥65 ans, mais les données disponibles à ce sujet sont limitées à 26 patients (voir «Sécurité et efficacité chez les patients âgés» et «Cinétique pour certains groupes de patients»).
Enfants et adolescents
La sécurité et l'efficacité de Phesgo n'ont pas été évaluées chez les enfants et les adolescents (< 18 ans).
Prise retardée
Si le délai entre deux injections consécutives est inférieur à 6 semaines, la dose d'entretien de Phesgo, de 600 mg de pertuzumab/600 mg de trastuzumab, doit être administrée dès que possible. Ne pas attendre jusqu'à la prochaine dose prévue.
Si le délai entre deux injections consécutives est supérieur ou égal à 6 semaines, la dose initiale de 1200 mg de pertuzumab/600 mg de trastuzumab doit être de nouveau administrée, suivie de la dose d'entretien de 600 mg de pertuzumab/600 mg de trastuzumab toutes les 3 semaines.
Contre-indications
Phesgo est contre-indiqué chez les patients présentant une hypersensibilité connue au pertuzumab, au trastuzumab ou à l'un des excipients.
Mises en garde et précautions
Dysfonction ventriculaire gauche
Des baisses de la fraction d'éjection ventriculaire gauche (FEVG) ont été rapportées sous traitement par des principes actifs inhibiteurs de l'activité HER2, y compris le pertuzumab et le trastuzumab. L'incidence de la dysfonction systolique ventriculaire gauche symptomatique (ICC [insuffisance cardiaque congestive]) était plus élevée chez les patients traités par le pertuzumab en association avec le trastuzumab et une chimiothérapie que chez ceux traités par le trastuzumab et une chimiothérapie. La majorité des cas d'insuffisance cardiaque symptomatique, rapportés en situation adjuvante, concernait des patients qui avaient reçu une chimiothérapie à base d'anthracyclines (voir «Effets indésirables»). D'après les études menées avec le pertuzumab intraveineux en association avec le trastuzumab et une chimiothérapie, les patients ayant précédemment reçu des anthracyclines ou une radiothérapie dans la région thoracique peuvent présenter un risque plus important de baisse de la FEVG.
Phesgo et/ou le pertuzumab intraveineux et le trastuzumab n'ont pas été évalués chez les patients avec une FEVG < 55% (EBC) ou < 50% (MBC) avant le traitement, chez ceux ayant des antécédents d'insuffisance cardiaque congestive, chez ceux présentant des affections susceptibles de diminuer la fonction ventriculaire gauche comme une hypertension non contrôlée, un infarctus du myocarde récent, une arythmie cardiaque grave nécessitant un traitement, ou chez ceux ayant été exposés préalablement aux anthracyclines à une dose cumulée > 360 mg/m2 de doxorubicine ou à une dose correspondante de son équivalent. Le pertuzumab intraveineux en association avec le trastuzumab et une chimiothérapie n'a pas été évalué chez les patients ayant présenté une diminution de la FEVG < 50% au cours d'un traitement adjuvant antérieur par le trastuzumab.
La FEVG doit être contrôlée avant l'instauration du traitement par Phesgo et à intervalles réguliers durant le traitement pour s'assurer que la valeur de la FEVG se situe dans les limites normales (voir le tableau 2 ci-dessous). Si la FEVG a diminué comme indiqué dans le tableau 2 et si elle ne s'est pas améliorée ou si elle a encore baissé lors de l'évaluation suivante, l'arrêt du traitement par Phesgo doit être envisagé de toute urgence, à moins que le bénéfice individuel pour le patient soit supérieur aux risques.
Tableau 2: Recommandation posologique en cas de dysfonction ventriculaire gauche
FEVG avant le traitement: | Contrôle de la FEVG toutes les: | Interrompre l'administration de Phesgo pendant au moins 3 semaines en cas de baisse de la FEVG à une valeur de: | Poursuivre l'administration de Phesgo après 3 semaines si la FEVG s'est améliorée, atteignant: | |||
Cancer du sein métastatiquea | ≥50% | ~ 12 semaines | soit | soit | ||
< 40% | 40%–45% avec une baisse ≥10 points de pourcentage par rapport à la valeur avant le traitement | > 45% | 40%–45% avec une baisse < 10 points de pourcentage par rapport à la valeur avant le traitement | |||
Cancer du sein au stade précoce | ≥55%b | ~ 12 semaines (une fois en situation néoadjuvante) | < 50% avec une baisse ≥10 points de pourcentage par rapport à la valeur avant le traitement | soit | ||
≥50% | < 10 points de pourcentage par rapport à la valeur avant le traitement | |||||
a Sur la base de données portant sur l'administration intraveineuse de pertuzumab (étude CLEOPATRA).
b Chez les patients traités par une chimiothérapie à base d'anthracyclines, une FEVG ≥50% est nécessaire à l'issue du traitement par anthracyclines avant de commencer l'administration de Phesgo.
Réactions liées à l'injection/la perfusion (IRR)
Phesgo a été associé à des réactions liées à l'injection. Les réactions liées à l'injection étaient définies comme toute réaction systémique s'accompagnant de symptômes tels que fièvre, frissons et céphalées, réaction probablement due à un relargage de cytokines se produisant dans les 24 heures suivant l'administration de Phesgo. Une surveillance étroite du patient est recommandée pendant l'administration de la dose initiale et les 30 minutes suivantes ainsi que pendant l'administration de la dose d'entretien de Phesgo et les 15 minutes suivantes. Si une réaction importante liée à l'injection survient, l'injection doit être ralentie ou interrompue et des traitements médicaux appropriés doivent être instaurés. Les patients doivent être évalués et étroitement surveillés jusqu'à la disparition complète des signes et symptômes. L'arrêt définitif du traitement doit être envisagé chez les patients présentant des réactions sévères liées à l'injection. L'évaluation clinique doit reposer sur la sévérité de la réaction précédente et sur la réponse au traitement administré pour cette réaction indésirable (voir «Posologie/Mode d'emploi»). Bien qu'aucun cas d'issue fatale résultant de réactions liées à l'injection n'ait été observé après l'administration de Phesgo, la prudence est néanmoins recommandée, car des réactions mortelles liées à la perfusion ont été associées à l'administration de pertuzumab intraveineux en association avec le trastuzumab intraveineux et une chimiothérapie.
Réactions d'hypersensibilité/Anaphylaxie
Les patients doivent être étroitement surveillés afin de déceler des réactions d'hypersensibilité. Bien qu'aucune réaction d'hypersensibilité sévère, y compris d'anaphylaxie et d'événements d'issue fatale, n'ait été observée chez des patients traités par Phesgo, la prudence est néanmoins recommandée, car de telles réactions ont été associées à l'administration de pertuzumab intraveineux en association avec le trastuzumab et une chimiothérapie (voir «Effets indésirables»). Des médicaments pour le traitement de telles réactions doivent être disponibles, ainsi qu'un équipement médical d'urgence prêt à être utilisé immédiatement. Phesgo est contre-indiqué chez les patients présentant une hypersensibilité connue au pertuzumab, au trastuzumab ou à l'un des excipients (voir «Contre-indications»).
Réactions pulmonaires
Après la commercialisation, des effets indésirables sévères ont été signalés au niveau pulmonaire pendant le traitement par le trastuzumab (voir «Effets indésirables») Ces cas ont occasionnellement eu une issue fatale et peuvent être observés lors d'une réaction liée à la perfusion ou dans le cadre d'une réaction retardée. De plus, les manifestations suivantes ont été signalées: pneumopathie interstitielle y compris infiltrats pulmonaires, syndrome de détresse respiratoire aiguë, pneumonie, pneumonite, épanchement pleural, difficultés respiratoires, œdème aigu du poumon et insuffisance respiratoire.
Les facteurs de risque associés aux pneumopathies interstitielles comprennent d'autres traitements antinéoplasiques antérieurs ou simultanés, pour lesquels un rapport avec des pneumopathies interstitielles est connu, comme les taxanes, la gemcitabine, la vinorelbine et la radiothérapie. Les patients souffrant de dyspnée de repos en relation avec des complications d'une maladie maligne avancée et de comorbidités peuvent présenter un risque accru d'événements pulmonaires. En conséquence, ces patients ne doivent pas être traités par Phesgo.
Neutropénie fébrile
Les patients traités par le pertuzumab, le trastuzumab et le docétaxel présentent un risque accru de neutropénie fébrile par rapport aux patients traités par le placebo, le trastuzumab et le docétaxel, en particulier durant les 3 premiers cycles de traitement (voir «Effets indésirables»); par conséquent, la prudence est recommandée lors de l'administration de Phesgo. Dans le cadre de l'étude CLEOPATRA portant sur le cancer du sein métastatique, le nombre le plus faible de neutrophiles (nadir) était similaire chez les patients traités par le pertuzumab et chez les patients ayant reçu le placebo. Chez les patients traités par le pertuzumab, l'incidence accrue de neutropénies fébriles était associée à une incidence accrue de mucite et de diarrhée. Un traitement symptomatique de la mucite et de la diarrhée doit être envisagé. Aucun événement neutropénique fébrile n'a été rapporté après l'arrêt du docétaxel.
Diarrhée
Phesgo peut provoquer des diarrhées sévères. Les diarrhées surviennent le plus souvent pendant l'administration concomitante d'un traitement par des taxanes. Le traitement de la diarrhée doit être effectué selon la pratique et les directives standard. Une prise en charge précoce avec du lopéramide, un apport liquidien et un remplacement des électrolytes doit être envisagée, surtout chez les patients âgés et en cas de diarrhée sévère ou prolongée. Lorsqu'aucune amélioration de l'état du patient n'a pu être obtenue, une interruption du traitement par Phesgo devrait être envisagée. Le traitement par le pertuzumab pourra être repris lorsque la diarrhée aura été efficacement traitée.
Interactions
Aucune étude spécifique d'interactions n'a été réalisée.
Pertuzumab intraveineux
Une sous-étude réalisée chez 37 patients dans le cadre de l'étude pivot CLEOPATRA n'a montré aucun signe d'interaction médicamenteuse entre le pertuzumab et le trastuzumab ou entre le pertuzumab et le docétaxel. Par ailleurs, l'analyse pharmacocinétique de population n'a pas mis en évidence d'interaction pharmacocinétique cliniquement significative entre le pertuzumab et le docétaxel ou entre le pertuzumab et le trastuzumab, administrés simultanément. Cette absence d'interaction médicamenteuse a été confirmée par les données pharmacocinétiques des études cliniques NEOSPHERE et APHINITY.
Cinq études ont évalué les effets du pertuzumab sur la pharmacocinétique des agents cytotoxiques administrés de manière concomitante, le docétaxel, le paclitaxel, la gemcitabine, la capécitabine, le carboplatine et l'erlotinib. Aucun signe d'interaction pharmacocinétique entre le pertuzumab et l'un de ces principes actifs n'a été observé. La pharmacocinétique du pertuzumab dans ces études était comparable à celle observée dans les études en monothérapie.
Trastuzumab intraveineux
Aucune étude d'interaction spécifique n'a été menée chez l'être humain avec le trastuzumab. Aucune interaction cliniquement significative entre le trastuzumab et les médications concomitantes administrées dans le cadre d'essais cliniques n'a été observée.
Au cours d'études dans lesquelles le trastuzumab a été administré en association avec le docétaxel, le carboplatine ou l'anastrozole, ni la pharmacocinétique de ces principes actifs ni celle du trastuzumab n'ont présenté de modifications.
Les concentrations de paclitaxel et de doxorubicine [ainsi que celles de leurs métabolites principaux 6α-hydroxypaclitaxel (POH) et doxorubicinol (DOL)] n'ont pas été modifiées en présence du trastuzumab. Cependant, le trastuzumab peut augmenter l'exposition globale à un métabolite de la doxorubicine [7-déoxy-13 dihydro-doxorubicinone (D7D)]. L'activité biologique du D7D et les effets cliniques d'une élévation de ce métabolite ne sont pas clairs. En présence de paclitaxel et de doxorubicine, aucune modification des concentrations de trastuzumab n'a été observée.
Les résultats d'une sous-étude d'interactions médicamenteuses ayant évalué la pharmacocinétique de la capécitabine et du cisplatine utilisés avec ou sans trastuzumab ont permis de conclure que l'exposition aux métabolites biologiquement actifs de la capécitabine (p.ex. le 5-FU) n'a pas été modifiée par l'utilisation concomitante du cisplatine ou par l'utilisation concomitante du cisplatine et du trastuzumab. Cependant, lorsque la capécitabine était associée au trastuzumab, des concentrations plus élevées et une demi-vie allongée de la capécitabine ont été observées. Les données suggèrent également que la pharmacocinétique du cisplatine n'a pas été affectée par l'utilisation concomitante de la capécitabine ou par l'utilisation concomitante de la capécitabine associée au trastuzumab.
Grossesse/Allaitement
Contraception
Les femmes en âge de procréer, y compris les partenaires de patients de sexe masculin, doivent utiliser une méthode contraceptive fiable pendant le traitement par Phesgo et durant les 7 mois après la dernière dose de Phesgo.
Grossesse
Aucune étude clinique n'a été menée avec Phesgo chez la femme enceinte. Dans le cadre de la surveillance après la mise sur le marché du trastuzumab, des cas d'altérations du développement rénal fœtal et/ou de la fonction rénale fœtale, associés à un oligoamnios, ont été rapportés chez des femmes enceintes et certains d'entre eux ont provoqué une hypoplasie pulmonaire fœtale d'issue fatale. Les études chez l'animal ont montré une toxicité sur la reproduction et mis en évidence un passage transplacentaire du trastuzumab (voir «Données précliniques»). Phesgo ne doit pas être administré pendant la grossesse, sauf en cas de nécessité absolue, car le bénéfice potentiel pour la mère prédomine sur le risque encouru par le fœtus.
Phesgo contient de la hyaluronidase humaine recombinante (rHuPH20). Concernant l'effet potentiel de la rHuPH20 sur les paramètres de la reproduction et le développement embryonnaire chez l'animal, voir «Données précliniques». L'influence des anticorps neutralisants dirigés contre la rHuPH20 ou la hyaluronidase endogène sur les paramètres de la reproduction est inconnue.
Sur la base des données obtenues après la mise sur le marché et des études chez l'animal, Phesgo peut nuire à l'enfant à naître lorsqu'il est administré à une femme enceinte. En cas de survenue d'une grossesse pendant le traitement, les femmes doivent être informées de la possibilité d’effets nocifs sur le fœtus. Si une femme enceinte est traitée par Phesgo ou si une patiente tombe enceinte pendant le traitement par Phesgon ou au cours des 7 mois qui suivent la dernière dose de Phesgo, une surveillance étroite, effectuée par une équipe pluridisciplinaire, est conseillée.
Allaitement
On ignore si Phesgo passe dans le lait maternel chez l'être humain. Des études chez l'animal ont montré que le trastuzumab passe dans le lait (voir «Données précliniques»). Aucune donnée n'est disponible pour le pertuzumab. Comme les IgG humaines sont excrétées dans le lait maternel et que le risque potentiel d'une absorption par le nourrisson et d'atteinte du nourrisson n'est pas connu, il convient de conseiller aux femmes de ne pas allaiter pendant le traitement par Phesgo et au cours des 7 mois suivant la dernière dose de Phesgo.
Fertilité
On ne dispose d'aucune donnée clinique avec Phesgo sur la fertilité. Les études chez l'animal menées avec le pertuzumab ou le trastuzumab n'ont révélé aucune altération de la fertilité (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machines
Phesgo a une légère influence sur l'aptitude à la conduite ou l'utilisation de machines. Des réactions liées à l'injection et des vertiges peuvent survenir pendant le traitement par Phesgo (voir «Mises en garde et précautions» et «Effets indésirables»).
Effets indésirables
Résumé du profil de sécurité
Le profil de sécurité de Phesgo repose sur les données de l'étude de phase III FEDERICA, dans laquelle des patients souffrant de cancer du sein HER2 positif ont été traités par Phesgo (n = 248) ou par le pertuzumab intraveineux et le trastuzumab (n = 252) en association avec une chimiothérapie.
Les effets indésirables (EI) les plus fréquents (≥5%) chez les patients traités par Phesgo ou par le pertuzumab intraveineux en association avec le trastuzumab étaient: diarrhée, réaction liée à l'injection, réactions liées à la perfusion, asthénie, fatigue, éruption cutanée, baisse de la fraction d'éjection et anémie.
Les événements indésirables graves (EIG) les plus fréquents (≥1%) rapportés chez les patients traités par Phesgo ou par le pertuzumab intraveineux en association avec le trastuzumab étaient: neutropénie fébrile, fièvre, neutropénie/diminution du nombre de neutrophiles, sepsis neutropénique et réactions liées à la perfusion. Les EIG étaient aussi fréquents dans le bras traité par Phesgo que dans le bras traité par le pertuzumab intraveineux en association avec le trastuzumab. Les effets indésirables suivants ont été rapportés plus fréquemment (≥5%) au cours du traitement par Phesgo qu'au cours de l'administration du pertuzumab intraveineux en association avec le trastuzumab: alopécie 77% vs 70,2%, dyspnée 10,1% vs 4,4% et fatigue 27,8% vs 22,6%.
Tableau récapitulatif des effets indésirables
Le profil de sécurité de Phesgo était globalement cohérent avec le profil de sécurité connu du pertuzumab intraveineux en association avec le trastuzumab et une chimiothérapie, issu des études pivots suivantes (n = 3344) menées avec le traitement par le pertuzumab et le trastuzumab:
- CLEOPATRA, dans laquelle des patients atteints de MBC ont reçu le pertuzumab en association avec le trastuzumab et le docétaxel (n = 453).
- NEOSPHERE (n = 309) et TRYPHAENA (n = 218), dans lesquelles des patients atteints de cancer du sein inflammatoire localement avancé ou d'EBC ont reçu en traitement néoadjuvant le pertuzumab en association avec le trastuzumab et une chimiothérapie.
- APHINITY, dans laquelle des patients atteints d'EBC ont reçu en traitement adjuvant le pertuzumab en association avec le trastuzumab et une chimiothérapie à base de taxanes, avec ou sans anthracyclines (n = 2364).
Les EI rapportés en association avec l'administration du pertuzumab, du trastuzumab et d'une chimiothérapie au cours des études cliniques pivots et dans le cadre de la surveillance après la mise sur le marché sont énumérés ci-dessous.
Comme le pertuzumab et le trastuzumab ont été utilisés en association avec une chimiothérapie, il est difficile d'établir un lien de causalité entre un effet indésirable et un principe actif particulier.
Les catégories de fréquence utilisées dans cette rubrique sont les suivantes: «très fréquents» (≥1/10), «fréquents» (< 1/10 bis ≥1/100), «occasionnels» (< 1/100 à ≥1/1000), «rares» (< 1/1000 à ≥1/10'000), «très rares» (< 1/10'000) et fréquence inconnue (ne peut être estimée sur la base des données disponibles). Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre de gravité décroissante.
Les effets indésirables suivants ont été rapportés au cours des études pivots menées avec le pertuzumab, le trastuzumab et dans le cadre de la surveillance après la mise sur le marché a,b,c
Infections et infestations
Très fréquents: rhinopharyngite (12,8% [grade 3-4< 0,1%]).
Fréquents: infections des voies respiratoires supérieures, paronychie.
Affections hématologiques et du système lymphatique
Très fréquents: neutropénie (31,4% [grade 3-4 24,2%]), anémie (24,8% [grade 3-4 5,7%]), neutropénie fébriled (11,9% [grade 3-4 11,8%]), leucopénie (10,8% [grade 3-4 6,1%]).
Affections du système immunitaire
Fréquents: hypersensibilité, hypersensibilité au médicament.
Troubles du métabolisme et de la nutrition
Très fréquents: baisse de l'appétit (23,1% [grade 3-4 0,8%]).
Fréquence inconnue: syndrome de lyse tumoraleg.
Affections psychiatriques
Très fréquents: insomnie (15,9% [grade 3-4 0,2%]).
Affections du système nerveux
Très fréquents: dysgueusie (22,7% [grade 3-4< 0,1%]), céphalées (21,8% [grade 3-4 0,4%]), neuropathie sensitive périphérique (15,7% [grade 3-4 0,5%]), neuropathie périphérique (14,7% [grade 3-4 0,7%]), vertiges (11,2% [grade 3-4 0,1%]), paresthésie (10,2% [grade 3-4 0,4%]).
Affections oculaires
Très fréquents: larmoiement accru (12,1%).
Affections cardiaques
Fréquents: dysfonction ventriculaire gauchee.
Occasionnels: insuffisance cardiaque congestivee.
Affections respiratoires, thoraciques et médiastinales
Très fréquents: épistaxis (15,6% [grade 3-4< 0,1%]), toux (15,5% [grade 3-4< 0,1%]), dyspnée (11,5% [grade 3-4 0,5%]).
Occasionnels: épanchement pleural.
Affections gastro-intestinales
Très fréquents: diarrhée (67,9% [grade 3-4 8,9%]), nausées (60,8% [grade 3-4 1,9%]), vomissements (30,0% [grade 3-4 1,7%]), stomatite (24,9% [grade 3-4 1,6%]), constipation (24,5% [grade 3-4 0,4%]), dyspepsie (13,2% [grade 3-4< 0,1%]), douleurs abdominales (11,7% [grade 3-4 0,4%]).
Affections de la peau et du tissu sous-cutané
Très fréquents: alopécie (63,1% [grade 3-4< 0,1%]), rash (26,4% [grade 3-4 0,5%]), troubles des ongles (12,9% [grade 3-4 0,3%]), prurit (12,9% [grade 3-4< 0,1%]), sécheresse cutanée (11,7% [grade 3-4< 0,1%]).
Affections musculosquelettiques et du tissu conjonctif
Très fréquents: arthralgie (24,6% [grade 3-4 0,7%]), myalgie (24,3% [grade 3-4 0,8%]), douleurs des extrémités (10,0% [grade 3-4 0,2%]).
Troubles généraux et anomalies au site d'administration
Très fréquents: fatigue (44,3% [grade 3-4 3,3%]), inflammations des muqueuses (23,2% [grade 3-4 1,5%]), asthénie (20,9% [grade 3-4 1,5%]), fièvre (18,9% [grade 3-4 0,6%]), œdèmes périphériques (16,2% [grade 3-4< 0,1%]), réaction au site d'injection (12,9%, grade 3-4: 0%)f.
Affections vasculaires
Très fréquents: bouffées de chaleur (15,7% [grade 3-4 0,1%]).
a Données regroupées issues de la période totale de traitement dans l'étude CLEOPATRA; de la période du traitement néoadjuvant dans les études NEOSPHERE et TRYPHAENA; et de la période de traitement dans l'étude APHINITY. Par ailleurs, les EI spécifiques du mode d'administration de Phesgo et rapportés dans l'étude FEDERICA sont répertoriés.
b Dans l'étude NEOSPHERE, 108 patients n'ont reçu que pertuzumab + trastuzumab sans docétaxel et 94 patients ont reçu pertuzumab + docétaxel sans trastuzumab.
c Dans l'étude CLEOPATRA, 45 patients ayant reçu le placebo après la randomisation et naïfs de pertuzumab sont passés à un traitement par le pertuzumab et sont inclus dans les 3344 patients traités par le pertuzumab.
d Ceci désigne un effet indésirable signalé en association avec une issue fatale.
e L'incidence de la dysfonction ventriculaire gauche et de l'insuffisance cardiaque congestive reflète les termes préférentiels de la classification MedDRA, indiqués dans les différentes études.
f Observé uniquement lors de l'administration de Phesgo.
g Observé dans le cadre de la surveillance après la mise sur le marché.
Description de certains effets indésirables issus d'études cliniques
Phesgo
Dysfonction ventriculaire gauche
Dans l'étude FEDERICA, l'incidence de l'insuffisance cardiaque symptomatique (classe III ou IV de la NYHA) avec une baisse de la FEVG d'au moins 10 points de pourcentage par rapport à la valeur initiale et < 50% était de 0,4% chez les patients traités par Phesgo vs 0% chez les patients ayant reçu le pertuzumab intraveineux et le trastuzumab. Parmi les patients atteints d'une insuffisance cardiaque symptomatique, tous les patients traités par Phesgo s'étaient rétablis (rétablissement défini comme 2 mesures consécutives de la FEVG supérieures à 50%) à la date de clôture de recueil des données. Des baisses asymptomatiques ou légèrement symptomatiques (classe II de la NYHA) de la FEVG d'au moins 10 points de pourcentage par rapport à la valeur initiale et < 50% (confirmées par la deuxième mesure de la FEVG) ont été rapportées chez 0,4% des patients traités par Phesgo et chez 0,8% des patients traités par le pertuzumab intraveineux et le trastuzumab, parmi lesquels aucun des patients traités par Phesgo ni des patients traités par le pertuzumab intraveineux et le trastuzumab ne s'était rétabli à la date de clôture du recueil des données.
Réactions liées à l'injection/la perfusion
Dans l'étude FEDERICA, une réaction liée à l'injection/la perfusion était définie comme toute réaction systémique rapportée dans les 24 heures après l'administration de Phesgo ou du pertuzumab intraveineux en association avec l'administration de trastuzumab. Des réactions liées à l'injection ont été rapportées chez 1,2% des patients traités par Phesgo et des réactions liées à la perfusion chez 10,3% des patients traités par le pertuzumab intraveineux et le trastuzumab.
Des réactions au site d'injection (définies comme toute réaction locale signalée dans les 24 heures après l'administration de Phesgo) ont été rapportées chez 12,9% des patients traités par Phesgo et tous ces événements étaient de grade 1 ou 2.
Réactions d'hypersensibilité/Anaphylaxie
Dans l'étude FEDERICA, la fréquence globale des événements d'hypersensibilité/anaphylaxie rapportés en lien avec un traitement ciblé anti-HER2 était de 1,6% tant chez les patients traités par Phesgo que chez ceux traités par le pertuzumab intraveineux et le trastuzumab, et aucun de ces événements n'était de grade 3–4 selon la classification NCI-CTCAE (version 4) (voir «Mises en garde et précautions»).
Pertuzumab intraveineux et trastuzumab
Dysfonction ventriculaire gauche
Dans l'étude CLEOPATRA, l'incidence de la DVG pendant le traitement de l'étude était plus élevée dans le groupe placebo que dans le groupe pertuzumab (8,6% vs 6,6%). L'incidence d'une DVG symptomatique était également plus faible dans le groupe pertuzumab (1,8% dans le groupe placebo vs 1,5% dans le groupe pertuzumab) (voir «Mises en garde et précautions»).
Dans l'étude NEOSPHERE, dans laquelle les patients ont reçu quatre cycles de pertuzumab en traitement néoadjuvant, l'incidence de la DVG (durant la période totale de traitement) était plus élevée dans le groupe pertuzumab, trastuzumab et docétaxel (7,5%) que dans le groupe trastuzumab et docétaxel (1,9%). Un cas de DVG symptomatique a été observé dans le groupe pertuzumab et trastuzumab.
Dans l'étude TRYPHAENA, l'incidence de la DVG (durant la période totale de traitement) était de 8,3% dans le groupe ayant reçu tout d'abord pertuzumab plus trastuzumab et 5-fluoruracile, épirubicine et cyclophosphamide (FEC), puis pertuzumab plus trastuzumab et docétaxel, de 9,3% dans le groupe ayant reçu pertuzumab plus trastuzumab et docétaxel après FEC et de 6,6% dans le groupe traité par pertuzumab en association avec TCH. L'incidence de la DVG symptomatique (insuffisance cardiaque congestive) était de 1,3% dans le groupe ayant reçu pertuzumab plus trastuzumab et docétaxel après FEC (à l'exception d'un patient ayant présenté une DVG symptomatique au cours du traitement par FEC avant de recevoir pertuzumab plus trastuzumab et docétaxel) et également de 1,3% dans le groupe traité par pertuzumab en association avec TCH. Dans le groupe traité par pertuzumab plus trastuzumab et FEC, puis par pertuzumab plus trastuzumab et docétaxel, aucun des patients n'a développé de DVG symptomatique.
Dans la phase néoadjuvante de l'étude BERENICE, l'incidence de la DVG symptomatique de classe III/IV de la NYHA (insuffisance cardiaque congestive selon la classification NCI-CTCAE v. 4) a été de 1,5% dans le groupe traité par AC à dose densifiée, puis par pertuzumab plus trastuzumab et paclitaxel, tandis qu'aucun des patients (0%) du groupe traité par FEC, puis par pertuzumab plus trastuzumab et docétaxel n'a développé de DVG symptomatique. L'incidence de la DVG asymptomatique (baisse de la fraction d'éjection selon les termes préférentiels de la classification NCI-CTCAE v.4) était de 7% dans le groupe traité par AC à dose densifiée, puis par pertuzumab plus trastuzumab et paclitaxel et de 3,5% dans le groupe traité par FEC, puis par pertuzumab plus trastuzumab et docétaxel.
Dans l'étude APHINITY, l'incidence de l'insuffisance cardiaque symptomatique (classe III ou IV de la NYHA) avec une baisse de la FEVG d'au moins 10 points de pourcentage par rapport à la valeur initiale et < 50% était < 1% (0,6% chez les patients traités par le pertuzumab vs 0,2% chez les patients du groupe placebo). Parmi les patients atteints d'une insuffisance cardiaque symptomatique, 46,7% des patients traités par le pertuzumab et 66,7% des patients du groupe placebo s'étaient rétablis (rétablissement défini comme 2 mesures consécutives de la FEVG supérieures à 50%) à la date de clôture de recueil des données. La majorité des événements ont été rapportés chez des patients traités par des anthracyclines. Des baisses asymptomatiques ou légèrement symptomatiques (classe II de la NYHA) de la FEVG d'au moins 10 points de pourcentage par rapport à la valeur initiale et < 50% ont été rapportées chez 2,7 % des patients traités par le pertuzumab et chez 2,8% des patients du groupe placebo; 79,7% des patients traités par le pertuzumab et 80,6% des patients du groupe placebo s'étaient rétablis à la date de clôture du recueil des données.
Réaction liée à la perfusion
Une réaction liée à la perfusion était définie dans les études pivots comme tout événement signalé au cours d'une perfusion ou le même jour de la perfusion comme une hypersensibilité, une réaction anaphylactique, une réaction aiguë à la perfusion ou un syndrome de relargage de cytokines. Dans l'étude CLEOPATRA, la dose initiale de pertuzumab a été administrée le jour précédant l'administration du trastuzumab et du docétaxel afin de permettre l'examen des réactions associées au pertuzumab. Le premier jour, au cours duquel seul le pertuzumab a été administré, la fréquence globale des réactions liées à la perfusion était de 9,8% dans le groupe placebo et de 13,2% dans le groupe traité par le pertuzumab, avec une majorité de réactions légères ou modérées. Les réactions liées à la perfusion les plus fréquentes (≥1,0%) dans le groupe traité par le pertuzumab étaient une fièvre, des frissons, une fatigue, des céphalées, une asthénie, une hypersensibilité et des vomissements.
Durant le second cycle au cours duquel tous les principes actifs ont été administrés le même jour, les réactions liées à la perfusion les plus fréquentes (≥1,0%) dans le groupe traité par le pertuzumab étaient une fatigue, une hypersensibilité au médicament, une dysgueusie, une hypersensibilité, des myalgies et des vomissements (voir «Mises en garde et précautions»).
Dans les études cliniques en situation néoadjuvante et adjuvante, le pertuzumab a été administré le même jour que les autres médicaments de l'étude. Chez 18,6% – 25,0% des patients, les réactions liées à la perfusion sont survenues le premier jour de l'administration du pertuzumab (en association avec le trastuzumab et une chimiothérapie). Le type et la gravité des événements étaient cohérents avec ceux observés dans l'étude CLEOPATRA et la majorité des réactions étaient légères ou modérées.
Hypersensibilité/Anaphylaxie
Dans l'étude CLEOPATRA, la fréquence globale des événements rapportés comme une hypersensibilité/anaphylaxie était de 9,3% chez les patients du groupe placebo et de 11,3% chez les patients traités par le pertuzumab, et respectivement 2,5% et 2,0% de ces événements étant de grade 3–4 selon la classification NCI-CTCAE (version 3). Au total, 2 patients du groupe placebo et 4 patients du groupe pertuzumab ont présenté une anaphylaxie (voir «Mises en garde et précautions»).
Globalement, la majorité des réactions d'hypersensibilité étaient légères ou modérées et se sont résolues au cours du traitement. Sur la base des modifications apportées au traitement à l'étude, la plupart des réactions ont été évaluées comme secondaires aux perfusions de docétaxel.
Dans les études cliniques en situation néoadjuvante et adjuvante, les événements d'hypersensibilité/anaphylaxie étaient cohérents avec ceux observés dans l'étude CLEOPATRA. Dans l'étude NEOSPHERE, deux patients du groupe traité par le pertuzumab et le docétaxel ont présenté une anaphylaxie. Dans les études TRYPHAENA et APHINITY, la fréquence globale des réactions d'hypersensibilité/anaphylactiques a été la plus élevée dans le groupe traité par le pertuzumab et TCH (respectivement de 13,2% et 7,6%), et respectivement 2,6% et 1,3% des événements étaient des réactions de grade 3-4 selon la classification NCI-CTCAE.
Immunogénicité
Comme avec toutes les protéines thérapeutiques, le développement d'une réaction immunitaire est possible chez les patients traités par le Phesgo.
Les résultats des tests d'immunogénicité dépendent fortement de plusieurs facteurs, par exemple de la sensibilité et de la spécificité du test, de la méthode du test, de la manipulation des échantillons, du moment du prélèvement des échantillons, du traitement associé et de la maladie sous-jacente. C'est pourquoi la comparaison de l'incidence des anticorps dirigés contre Phesgo avec l'incidence des anticorps dirigés contre d'autres médicaments peut induire en erreur.
Dans l'étude FEDERICA, l'incidence des anticorps anti-pertuzumab et anti-trastuzumab liés au traitement était respectivement de 3% (7/237) et 0,4% (1/237) chez les patients traités par le pertuzumab intraveineux et le trastuzumab.
L'incidence des anticorps anti-pertuzumab, anti-trastuzumab et anti-hyaluronidase alfa humaine, liés au traitement, était respectivement de 4,8% (11/231), 0,9% (2/232) et 0,9% (2/225) chez les patients traités par Phesgo. La pertinence clinique du développement d'anticorps anti-pertuzumab, anti-trastuzumab ou anti-hyaluronidase alfa humaine après traitement par Phesgo n'est pas connue.
Passage du pertuzumab intraveineux et du trastuzumab à Phesgo (ou vice versa)
Le passage du pertuzumab intraveineux et du trastuzumab à Phesgo (ou vice versa) n'a donné lieu à aucun problème de sécurité nouveau ou cliniquement pertinent. Les effets indésirables observés étaient cohérents avec ceux rapportés dans l'étude FEDERICA et dans les études antérieures menées avec la forme galénique intraveineuse de pertuzumab et le trastuzumab (voir «Efficacité clinique»).
Annonce d'effets secondaires présumés
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Il n'existe aucune expérience en matière de surdosage de Phesgo dans les études cliniques chez l'être humain. La dose la plus élevée de Phesgo évaluée est de 1200 mg de pertuzumab/600 mg de trastuzumab.
Propriétés/Effets
Code ATC
L01XY02
Mécanisme d'action
Le pertuzumab et le trastuzumab sont des anticorps monoclonaux humanisés recombinants du sous-type d'immunoglobulines IgG1κ, dirigés contre le récepteur 2 du facteur de croissance épidermique humain (HER2, appelé aussi c-erbB-2), une glycoprotéine transmembranaire à activité tyrosine kinase intrinsèque. Le pertuzumab et le trastuzumab se lient à différents épitopes de HER2, à savoir aux sous-domaines II et IV, sans entrer en compétition, et ont des mécanismes complémentaires d'inhibition de la signalisation induite par HER2. Il en résulte une activité antiproliférative accrue in vitro et in vivo, lorsque le pertuzumab et le trastuzumab sont utilisés en association.
Par ailleurs, le fragment Fc de la structure IgG1 des deux anticorps provoque une forte activation de la cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC). In vitro, l'ADCC induite par le pertuzumab et par le trastuzumab s'exerce avant tout sur les cellules cancéreuses surexprimant HER2, et moins sur les cellules cancéreuses ne surexprimant pas HER2.
Pharmacodynamique
Efficacité clinique
Cette rubrique présente l'expérience clinique acquise avec Phesgo et avec le pertuzumab intraveineux en association avec le trastuzumab chez des patients atteints d'un cancer du sein HER2 positif au stade précoce ou métastatique. Dans toutes les études mentionnées ci-dessous, la surexpression de HER2 a été déterminée dans un laboratoire centralisé et était définie comme un score 3+ par IHC ou comme un rapport d'amplification ≥2,0 par HIS.
Cancer du sein au stade précoce
Phesgo, association à dose fixe de pertuzumab et de trastuzumab
FEDERICA WO40324
FEDERICA est une étude ouverte, multicentrique, randomisée, menée chez 500 patients souffrant de cancer du sein HER2 positif, résécable, au stade précoce, ou de cancer du sein localement avancé (y compris inflammatoire) avec une taille de la tumeur > 2 cm ou une atteinte ganglionnaire, en situation néoadjuvante et adjuvante*. Les patients ont été randomisés et ont reçu 8 cycles d'une chimiothérapie néoadjuvante avec administration concomitante de 4 cycles de Phesgo ou de pertuzumab intraveineux et de trastuzumab au cours des cycles 5 à 8. Pour chaque patient, les investigateurs ont sélectionné l'un des deux schémas de chimiothérapie néoadjuvante suivants:
- 4 cycles de doxorubicine (60 mg/m2) et de cyclophosphamide (600 mg/m2) toutes les 2 semaines, suivis de l'administration de paclitaxel (80 mg/m2) toutes les semaines pendant 12 semaines.
- 4 cycles de doxorubicine (60 mg/m2) et de cyclophosphamide (600 mg/m2) toutes les 3 semaines, suivis de 4 cycles de docétaxel (75 mg/m2 pendant le premier cycle, puis de 100 mg/m2 au cours des cycles suivants à l'appréciation de l'investigateur) toutes les 3 semaines.
* L'utilisation de Phesgo chez les patients atteints de cancer du sein métastatique repose sur une extrapolation des données obtenues avec l'administration intraveineuse.
Après la chirurgie, les patients ont poursuivi le traitement par Phesgo ou par le pertuzumab intraveineux et le trastuzumab qu'ils recevaient avant la chirurgie, pendant 14 cycles supplémentaires, jusqu'à atteindre au total 18 cycles de thérapie ciblée anti-HER2. Les patients ont reçu en outre une radiothérapie adjuvante et un traitement endocrinienune, conformément à la pratique habituelle locale. En situation adjuvante, l'administration du trastuzumab intraveineux à la place du trastuzumab sous-cutané était autorisée à l'appréciation de l'investigateur. La thérapie ciblée anti-HER2 a été administrée toutes les 3 semaines conformément au tableau 3 ci-dessous:
Tableau 3: Posologie et administration de Phesgo, du pertuzumab intraveineux, du trastuzumab intraveineux et du trastuzumab sous-cutané
Médicament | Administration | Dose | |
Saturation | Entretien | ||
Phesgo | Injection sous-cutanée | 1200 mg/600 mg | 600 mg/600 mg |
Pertuzumab | Perfusion intraveineuse | 840 mg | 420 mg |
Trastuzumab | Perfusion intraveineuse | 8 mg/kg | 6 mg/kg |
Trastuzumab | Injection sous-cutanée | 600 mg | |
L'étude FEDERICA était conçue pour démontrer la non-infériorité de la concentration minimale sérique (Cmin) du pertuzumab contenu dans Phesgo par rapport au pertuzumab intraveineux au cours du cycle 7 (c.-à-d. avant l'administration de la dose au cours du cycle 8) (principal critère d'évaluation). Les critères d'évaluation secondaires additionnels comprenaient la non-infériorité de la concentration minimale sérique (Cmin) du trastuzumab contenu dans Phesgo par rapport au trastuzumab intraveineux au cours du cycle 7, l'efficacité [réponse pathologique complète totale ou total pathological complete response (tpCR)] et les résultats de sécurité. Les données démographiques étaient équilibrées entre les deux bras de traitement, et l'âge médian des patients traités dans l'étude était de 51 ans. Tous les patients, sauf deux, étaient des femmes. La majorité des patients présentaient une atteinte ganglionnaire (57,6%), avaient une tumeur avec des récepteurs hormonaux positifs (61,2%) et étaient caucasiens (65,8%).
La non-infériorité de l'exposition au pertuzumab et au trastuzumab contenus dans Phesgo a été démontrée (voir «Pharmacocinétique»). L'analyse du critère d'efficacité secondaire tpCR, défini comme l'absence de maladie invasive dans le sein et la zone axillaire (ypT0/is, ypN0) est présentée dans le tableau 4.
Tableau 4: Résumé de la réponse pathologique complète totale (tpCR)
Phesgo (n = 248) | Pertuzumab intraveineux + trastuzumab (n = 252) | |
tpCR (ypT0/is, ypN0) | 148 (59,7 %) | 150 (59,5 %) |
IC à 95% exact pour le taux de tpCR1 | (53,28; 65,84) | (52,18; 65,64) |
Différence de taux de tpCR (bras s.c. minus bras i.v.) | 0,15 | |
IC à 95% pour la différence de taux de tpCR2 | -8,67 à 8,97 | |
1 Intervalle de confiance pour un échantillon binomial en utilisant la méthode de Pearson-Clopper.
2 Une correction de continuité d'Anderson et Hauck a été utilisée dans ce calcul.
PHranceSCa (MO40628)
L'étude MO40628 a évalué la sécurité du passage du pertuzumab intraveineux et du trastuzumab à Phesgo (et vice versa), la préférence des patients pour Phesgo étant le critère d'évaluation principal. Au total, 160 patients ont été inclus dans cette étude croisée à deux bras: 80 patients ont été randomisés dans le bras A (3 cycles de pertuzumab intraveineux et de trastuzumab, puis 3 cycles de Phesgo) et 80 patients ont été randomisés dans le bras B (3 cycles de Phesgo, puis 3 cycles de pertuzumab et de trastuzumab intraveineux). Les patients pouvaient ensuite choisir de poursuivre le traitement par le pertuzumab intraveineux et le trastuzumab ou par Phesgo, jusqu'à atteindre 18 cycles au total d'un traitement ciblé anti-HER2.
Selon l'analyse primaire, 136 des 160 patients (85%) ont indiqué préférer Phesgo administré par voie sous-cutané au pertuzumab intraveineux et au trastuzumab. La raison principale était que l'administration nécessitait un séjour hospitalier plus court. 22 des 160 patients (14%) ont indiqué préférer le pertuzumab intraveineux et le trastuzumab à Phesgo. La raison principale était que l'administration était perçue comme plus agréable. Deux des 160 patients (1%) n'ont préféré aucun des modes d'administration.
Parmi les patients du bras A, l'incidence des effets indésirables était similaire après le passage du pertuzumab intraveineux et du trastuzumab à Phesgo. Dans le bras A, l'incidence des effets indésirables était de 77,5% au cours des cycles 1 à 3 (i.v.), et de 72,5% au cours des cycles 4 à 6 (s.c.) Dans le bras B, l'incidence des effets indésirables était de 77,5% au cours des cycles 1 à 3 (s.c.), et de 63,8% au cours des cycles 4 à 6 (i.v.) Le nombre total d'événements était plus élevé au cours des cycles 1 à 3 qu'au cours des cycles 4 à 6, quel que soit le traitement administré.
Pertuzumab intraveineux et trastuzumab
D'autres informations et données cliniques portant sur le pertuzumab intraveineux et le trastuzumab figurent à la rubrique «Efficacité clinique» de l'information professionnelle de Perjeta. Celle-ci contient également une description de la conception et des résultats des études d'homologation réalisées chez des patients atteints de cancer du sein HER2 positif au stade précoce ou métastatique.
Sécurité et efficacité chez les patients âgés
Aucune différence d'efficacité et de sécurité de Phesgo n'a été constatée entre les patients ≥65 ans (n = 26) et ceux < 65 ans (n = 222).
Cependant, avec le pertuzumab intraveineux associé au trastuzumab, les effets indésirables observés, tous grades confondus, avec une incidence supérieure d'au moins 5% chez les patients ≥65 ans (n = 418) par rapport à l'incidence chez les patients < 65 ans (n = 2926), ont été les suivants: baisse de l'appétit, anémie, perte de poids, asthénie, dysgueusie, neuropathie périphérique, hypomagnésémie et diarrhée.
Sécurité et efficacité chez les patients pédiatriques
La sécurité et l'efficacité de Phesgo pour les enfants et les adolescents de moins de 18 ans n'ont pas été établies.
Pharmacocinétique
Le tableau 5 présente l'exposition au pertuzumab et au trastuzumab après administration sous-cutanée de Phesgo (1200 mg de pertuzumab/600 mg de trastuzumab en dose initiale, suivis de 600 mg de pertuzumab/600 mg de trastuzumab toutes les 3 semaines) dans l'étude FEDERICA. Les résultats pharmacocinétiques (PC) pour le critère d'évaluation principal, la concentration minimale (Cmin) du pertuzumab pendant le cycle 7 (c.-à-d. avant l'administration de la dose pendant le cycle 8), ont démontré la non-infériorité du pertuzumab contenu dans Phesgo (moyenne géométrique de 88,7 µg/ml) par rapport au pertuzumab intraveineux (moyenne géométrique de 72,4 µg/ml) avec un rapport des moyennes géométriques de 1,22 (IC à 90%: 1,14–1,31). La limite inférieure de l'intervalle de confiance bilatéral à 90% pour le rapport des moyennes géométriques du pertuzumab contenu dans Phesgo et du pertuzumab intraveineux était de 1,14 et était donc supérieure à la limite prédéfinie de 0,8.
Les résultats PC pour le critère d'évaluation secondaire, la Cmin du trastuzumab pendant le cycle 7 (c.-à-d. avant l'administration de la dose pendant le cycle 8), ont démontré la non-infériorité du trastuzumab contenu dans Phesgo (moyenne géométrique de 57,5 µg/ml) par rapport au trastuzumab intraveineux (moyenne géométrique de 43,2 µg/ml) avec un rapport des moyennes géométriques de 1,33 (IC à 90%: 1,24–1,43).
En utilisant les données regroupées de l'étude FEDERICA sur la PC du pertuzumab contenu dans Phesgo et du pertuzumab intraveineux, un modèle PC de population du pertuzumab avec élimination linéaire du compartiment central a été établi pour décrire les concentrations PC mesurées de pertuzumab après administration sous-cutanée de Phesgo et après administration intraveineuse du pertuzumab.
En utilisant les données regroupées de l'étude de phase III BO22227 (HannaH) sur la PC du trastuzumab sous-cutané vs trastuzumab intraveineux, un modèle PC de population avec élimination parallèle linéaire et non linéaire du compartiment central a été établi pour décrire les concentrations PC mesurées après administration intraveineuse de trastuzumab et après administration sous-cutanée de trastuzumab chez des patients atteints d'EBC HER2 positif. L'analyse PC à l'aide du modèle PC de population de l'étude HannaH a montré que le pertuzumab contenu dans Phesgo n'avait aucune influence sur la PC du trastuzumab contenu dans Phesgo, car la PC du trastuzumab contenu dans Phesgo et la PC du trastuzumab sous-cutané étaient équivalentes.
L'exposition au pertuzumab et au trastuzumab prédite au moyen de la PC de population est résumée dans le tableau 5 ci-dessous.
Tableau 5: Exposition au pertuzumab et au trastuzumab (médiane avec 5e–95e percentiles) après administration sous-cutanée de Phesgo ou administration intraveineuse de pertuzumab ou de trastuzumaba
Paramètre | Pertuzumab contenu dans | Pertuzumab intraveineux | Trastuzumab contenu dans | Trastuzumab intraveineuxb | |
Cmin (µg/ml) | Cycle 5 | 85,1 (48,7 – 122,5) | 74,9 (47,8 – 99,8) | 27,7 | 31,4 |
Cycle 7 | 88,9 | 78,5 | 57,5 | 44,9 | |
Cmax (µg/ml) | Cycle 5 | 106,5 | 304,8 | 44,6 | 172,9 |
Cycle 7 | 149,5 | 225,9 | 117,3 | 169,1 | |
AUC0‑21 jours (µg/ml•jour) | Cycle 5 | 2306,9 | 2519,7 | 1023,8 | 1341,0 |
Cycle 7 | 2569,3 | 2454,3 | 1838,7 | 1668,6 | |
a Administration de la première dose de Phesgo, du pertuzumab intraveineux et du trastuzumab intraveineux au cours du cycle 5.
b Le modèle PC de population de l'étude BO22227 (HannaH) a été utilisé pour simuler la PC du trastuzumab.
Absorption
La concentration sérique maximale (Cmax) médiane du pertuzumab contenu dans Phesgo et le temps nécessaire pour atteindre la concentration maximale (Tmax) étaient respectivement de 157 µg/ml et 3,82 jours. Sur la base de l'analyse PC de population, la biodisponibilité absolue était de 0,712, et la vitesse d'absorption de premier ordre (Ka) était de 0,348 (1/jour).
La concentration sérique maximale (Cmax) médiane du trastuzumab contenu dans Phesgo et le temps nécessaire pour atteindre la concentration maximale (Tmax) étaient respectivement de 114 µg/ml et 3,84 jours. Sur la base de l'analyse PC de population, la biodisponibilité absolue était de 0,771, et la vitesse d'absorption de premier ordre (Ka) était de 0,404 (1/jour).
Distribution
Sur la base de l'analyse PC de population, le volume de distribution du compartiment central (Vc) du pertuzumab contenu dans Phesgo chez un patient standard était de 2,77 l.
Sur la base de l'analyse PC de population, le volume de distribution du compartiment central (Vc) du trastuzumab administré par voie sous-cutanée chez un patient standard était de 2,91 l.
Métabolisme
Le métabolisme de Phesgo n'a pas été directement étudié. Les anticorps sont en principe éliminés par catabolisme.
Élimination
Sur la base de l'analyse PC de population, la clairance du pertuzumab contenu dans Phesgo était de 0,163 l/jour et la demi-vie d'élimination (t1/2) était d'environ 24,3 jours.
Sur la base de l'analyse PC de population, la clairance linéaire du trastuzumab administré par voie sous-cutanée était de 0,111 l/jour. Selon des estimations, les concentrations de trastuzumab 7 mois après la dernière dose sont < 1 μg/ml (environ 3% de la Cmin,ss prédite pour la population et élimination complète de 97% environ) chez au moins 95% des patients.
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique
Aucune étude spécifique n'a été réalisée sur la pharmacocinétique de Phesgo chez des patients présentant des troubles de la fonction hépatique.
Troubles de la fonction rénale
Aucune étude spécifique n'a été réalisée sur la PC de Phesgo chez des patients atteints de troubles de la fonction rénale.
L'analyse PC de population du pertuzumab contenu dans Phesgo et du pertuzumab intraveineux a montré que les troubles de la fonction rénale n'influençaient pas l'exposition au pertuzumab; toutefois, seules des données limitées de patients atteints de troubles sévères de la fonction rénale ont été incluses dans les analyses PC de population.
Dans une analyse pharmacocinétique de population du trastuzumab sous-cutané et du trastuzumab intraveineux, les troubles de la fonction rénale n'ont eu aucune influence sur le devenir du trastuzumab.
Patients âgés
Aucune étude n'a été réalisée pour évaluer la pharmacocinétique de Phesgo chez les patients âgés.
Dans les analyses PC de population du pertuzumab contenu dans Phesgo et du pertuzumab intraveineux, l'âge n'a pas eu d'influence majeure sur la PC du pertuzumab.
Dans les analyses PC de population du trastuzumab sous-cutané et du trastuzumab intraveineux, l'âge n'a eu aucune influence sur le devenir du trastuzumab.
Enfants et adolescents
Aucune étude n'a été réalisée pour évaluer la pharmacocinétique de Phesgo chez les patients pédiatriques.
Données précliniques
Aucune étude conventionnelle sur la pharmacologie de sécurité et la toxicité n'a été réalisée avec Phesgo (association de pertuzumab, de trastuzumab et de hyaluronidase humaine). En revanche, des études avec les différentes substances sont disponibles et une étude de biodisponibilité a été réalisée chez le miniporc.
Pertuzumab
Toxicité en cas d'administration répétée
Le pertuzumab sous-cutané (250 mg/kg/semaine pendant 4 semaines) et le pertuzumab intraveineux (jusqu'à 150 mg/kg une fois par semaine pendant jusqu'à 26 semaines) ont été bien tolérés chez le singe cynomolgus (espèce liant l'anticorps) à l'exception de la survenue de diarrhées. À des doses intraveineuses de pertuzumab de 15 mg/kg et plus, de légères diarrhées intermittentes ont été observées en rapport avec le traitement. Dans un sous-groupe de singes, l'administration à long terme (26 doses hebdomadaires) a provoqué des épisodes de déshydratation liée à une diarrhée qui ont été traités par un apport liquidien intraveineux.
Mutagénicité/Carcinogénicité
Aucune étude n'a été réalisée pour évaluer le potentiel mutagène et carcinogène du pertuzumab.
Toxicité sur la reproduction
Des études sur la toxicité de reproduction ont été menées chez des singes cynomolgus avec des doses de charge de 30 à 150 mg/kg et des doses d'entretien de 10 à 100 mg/kg pour atteindre des expositions cliniquement significatives. L'administration intraveineuse de pertuzumab à partir du 19e au 50e jour de gestation [GD] (phase de l'organogenèse) s'est révélée embryotoxique et a entraîné une augmentation dose-dépendante des cas de morts embryofœtales entre GD 25 et GD 70. Un retard de développement des reins et des oligoamnios ont été observés à GD 100.
Aucune étude spécifique sur la fertilité n'a été menée chez l'animal pour évaluer l'effet du pertuzumab. Dans des études de toxicité à doses répétées d'une durée allant jusqu'à six mois chez des singes cynomolgus, aucun effet indésirable sur les organes reproducteurs mâles et femelles n'a été observé.
Trastuzumab
Toxicité en cas d'administration répétée
Le trastuzumab a été bien toléré par des souris (espèce ne liant pas l'anticorps), des lapins (espèce ne liant pas l'anticorps) et des macaques [singes rhésus et singes cynomolgus] (espèce liant l'anticorps) dans des études de toxicité à dose unique (i.v.) et à doses multiples (s.c. et i.v.) d'une durée de 13 semaines (25 mg/kg deux fois par semaine) ou de 26 semaines (25 mg/kg une fois par semaine). Aucun signe de toxicité aiguë ou chronique n'a été observé.
Des concentrations systémiques mesurables de l'enzyme hyaluronidase recombinante humaine (rHuPH20) sont improbables, car elles n'ont été constatées chez aucun patient lors des études cliniques portant sur le trastuzumab administré par voie sous-cutanée.
Mutagénicité/Carcinogénicité
Aucune donnée de mutagénicité n'a été rapportée. Aucune étude n'a été réalisée pour évaluer le potentiel carcinogène du trastuzumab.
Toxicité sur la reproduction
Des études de reproduction réalisées chez des singes cynomolgus avec des doses jusqu'à 25 fois supérieures à la dose d'entretien hebdomadaire de 2 mg/kg de trastuzumab intraveineux, utilisée chez l'être humain, n'ont montré aucun signe d'atteinte fœtale. Un passage transplacentaire du trastuzumab a été observé pendant la phase de développement fœtal précoce (du 20e au 50e jour de gestation) et tardif (du 120e au 150e jour de gestation). Une étude réalisée chez des singes cynomolgus ayant reçu du 120e au 150e jour de gestation des doses de trastuzumab jusqu'à 25 fois supérieures à la dose d'entretien hebdomadaire de 2 mg/kg de trastuzumab intraveineux, utilisée chez l'être humain, le trastuzumab a été excrété dans le lait après la mise bas. L'exposition au trastuzumab in utero et la présence de trastuzumab dans le sérum de ces bébés singes n'ont pas été associées à des effets délétères sur la croissance et le développement des jeunes animaux entre la naissance et l'âge d'un mois.
Aucune étude n'a été réalisée chez l'animal pour évaluer l'influence du trastuzumab sur la fertilité des mâles.
Autres données (toxicité locale)
Le trastuzumab sous-cutané associé à la hyaluronidase humaine a été bien toléré dans une étude sur la toxicité locale chez le lapin (espèce ne liant pas l'anticorps) et dans une étude de toxicité à doses répétées de 13 semaines chez le singe cynomolgus (espèce liant l'anticorps).
Phesgo (pertuzumab/trastuzumab)
Toxicité locale
Dans une étude de biodisponibilité chez le miniporc, l'observation clinique après une dose sous-cutanée unique de pertuzumab associé à la rHuPH20 et de pertuzumab associé au trastuzumab et à la rHuPH20 n'a montré aucune anomalie.
Autres données (hyaluronidase)
Phesgo contient comme excipient de la hyaluronidase humaine recombinante (rHuPH20), une enzyme utilisée pour augmenter la distribution et l'absorption des médicaments co-administrés lors d'une administration par voie sous-cutanée. Des concentrations systémiques mesurables de rHuPH20 sont improbables après administration sous-cutanée locale de Phesgo et n'ont pas été constatées chez les patients lors des études cliniques portant sur Phesgo.
Dans une étude de toxicité de 39 semaines menée chez des singes mâles et femelles ayant atteint la maturité sexuelle, avec aussi bien des critères d'évaluation généraux de la toxicité que des critères d'évaluation spécifiques de la fertilité (analyse du cycle, dosages hormonaux, analyse de sperme et examen histologique des organes reproducteurs), la rHuPH20 a été bien tolérée. Ni la rHuPH20 ni les anticorps anti-rHuPH20, pour lesquels une neutralisation de la hyaluronidase endogène du singe cynomolgus a été démontrée, n'ont un impact sur le sperme, les hormones, la menstruation ou les résultats histologiques des organes reproducteurs.
Dans le cadre d'une autre étude, des singes mâles et femelles ont été immunisés par de la PH20 recombinante de cynomolgus, et des réponses immunitaires significatives sont apparues. Les anticorps ont reconnu autant la PH20 que la hyaluronidase acrosomique des singes. Dans le groupe des singes immunisés par la PH20, une gravidité s'est déclarée chez 8 singes femelles sur 14 et chez 6 singes femelles sur 14 dans le groupe témoin. Aucun lien n'est apparu entre la fertilité et le taux d'anticorps.
Des études réalisées chez le lapin ont examiné les effets des anticorps neutralisants dirigés contre la rHuPH20 et la hyaluronidase endogène sur les paramètres de la reproduction et du développement embryonnaire. Dans le cadre d'évaluations détaillées de la descendance jusqu'à l'âge adulte et des résultats d'accouplement, aucun effet indésirable sur la fertilité mâle ou femelle et sur le développement embryofœtal n'a été observé.
Une étude portant sur le développement embryofœtal menée avec la rHuPH20 chez les souris n'a révélé aucun indice de tératogénicité.
Des études menées avec la rHuPH20 chez des souris ont révélé des réductions du poids fœtal ainsi que des augmentations des taux de résorption. Ces effets sont apparus après une exposition à la rHuPH20 et étaient nettement plus élevés que ceux escomptés chez l'être humain après l'administration sous-cutanée de Phesgo. Une exposition systémique comparable pourrait survenir chez l'être humain si une dose en bolus de Phesgo était administrée par inadvertance.
L'évaluation globale de toutes les études disponibles menées chez l'animal a révélé l'absence d'impact des anticorps anti-rHuPH20 sur la fertilité mâle et femelle ainsi que sur le développement de la descendance.
Remarques particulières
La solution de 1200 mg de pertuzumab/600 mg de trastuzumab et la solution de 600 mg de pertuzumab/600 mg de trastuzumab sont des solutions injectables prêtes à l'emploi et n'ont pas besoin d'être mélangées ou diluées avec d'autres médicaments.
Phesgo doit être inspecté visuellement avant l'administration pour détecter la présence éventuelle de particules en suspension ou une modification de la couleur. Ne pas secouer.
La solution injectable de Phesgo est à usage unique et doit être préparée par un membre du corps médical dans des conditions d'asepsie.
Incompatibilités
Aucune incompatibilité n'a été observée entre Phesgo et le polypropylène, le polycarbonate, le polyuréthane, le polyéthylène, le chlorure de polyvinyle et l'éthylène propylène fluoré.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Stabilité après ouverture
Pour des raisons d'hygiène et comme il ne contient pas de conservateur antimicrobien, le médicament doit être immédiatement utilisé après avoir été transféré du flacon dans la seringue. En cas d'utilisation non immédiate, la préparation doit être réalisée dans des conditions d'asepsie dûment contrôlées et validées. Après le transfert du flacon dans la seringue, la stabilité physico-chimique du médicament est démontrée pendant 28 jours à 2 °C – 8 °C ou pendant 24 heures à 9 °C – 30 °C.
Après le transfert de la solution dans la seringue, il est recommandé de remplacer l'aiguille de transfert par un capuchon de seringue, afin d'éviter la déshydratation de la solution dans l'aiguille et de ne pas compromettre la qualité du médicament. Coller l'étiquette détachable sur la seringue pour l'identifier. L'aiguille d'injection doit être fixée à la seringue immédiatement avant l'administration au patient. Ajuster ensuite le volume à 10 ml (600 mg de pertuzumab/600 mg de trastuzumab) ou à 15 ml (1200 mg de pertuzumab/600 mg de trastuzumab).
Élimination des médicaments non utilisés/périmés
Le rejet de médicaments dans l'environnement doit être réduit au minimum. Les médicaments ne doivent pas être éliminés avec les eaux usées. Éviter toute élimination avec des déchets ménagers.
Les points suivants doivent être strictement respectés en ce qui concerne l'utilisation et l'élimination de seringues et d'autres objets tranchants à usage médical:
- Les aiguilles et les seringues ne doivent en aucun cas être réutilisées.
- Placer toutes les aiguilles et les seringues utilisées dans un récipient pour objets pointus (récipient jetable permettant d'éviter les blessures par piqûre).
Le médicament non utilisé et/ou les déchets doivent être éliminés conformément aux exigences nationales.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8 °C).
Ne pas congeler.
Conserver le récipient dans son carton pour le protéger de la lumière.
Conserver hors de portée des enfants.
Numéro d’autorisation
67828 (Swissmedic).
Titulaire de l’autorisation
Roche Pharma (Suisse) SA, Bâle.
Mise à jour de l’information
Avril 2021.
Відгуки (0)

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.

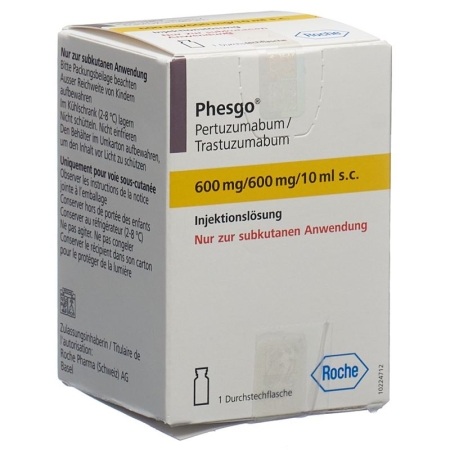


 Deutsch
Deutsch French
French Italian
Italian























