Буденофальк Ректч 2 мг/доза 14 доз
Budenofalk Rektsch 2 mg/Dosis 14 Dos
-
22880.85 RUB
Дата доставки:
25.12.2025 - 08.01.2026
При оплате криптовалютой:
Ваша прибыль 2288.09 RUB / 27.01 USDT
Склад:
Варіанти
Budenofalk Rektsch 2 мг/доза 2 х 14 доз
39280.10 RUB
Опис
Was ist Budenofalk Rektalschaum und wann wird er angewendet?
Budenofalk Rektalschaum enthält den Wirkstoff Budesonid, ein lokal wirksames Cortisonpräparat zur Behandlung von chronisch entzündlichen Darmerkrankungen. Budenofalk Rektalschaum wird zur Behandlung von akuten Schüben einer chronischen Entzündung des Mastdarms und des letzten Abschnitts des Dickdarms (Colitis ulcerosa) auf Verschreibung des Arztes oder der Ärztin angewendet.
Wann darf Budenofalk Rektalschaum nicht angewendet werden?
Budenofalk darf nicht angewendet werden wenn
Sie überempfindlich (allergisch) gegen Budesonid oder einen der sonstigen Bestandteile von Budenofalk Rektalschaum sind;
Sie lokale Infektionen des Darmes (Bakterien, Pilze, Amöben, Viren) haben;
Sie eine schwere Lebererkrankung (Leberzirrhose) haben.
Wann ist bei der Anwendung von Budenofalk Rektalschaum Vorsicht geboten?
Vorsicht ist geboten, wenn Sie unter Tuberkulose, Bluthochdruck, Zuckerkrankheit (Diabetes mellitus), Knochenschwund (Osteoporose), Magen- und Darmgeschwüren oder grünem Star (Glaukom) oder grauem Star (Katarakt) leiden und wenn Diabetes und Glaukom bei Ihren Familienangehörigen vorkommt.
Wenn Sie noch nie Windpocken, Gürtelrose oder Masern durchgemacht haben, sollen Sie jeden Kontakt zu Patienten mit diesen Erkrankungen meiden resp. nach einem Kontakt unverzüglich den Arzt oder die Ärztin konsultieren.
Während der Behandlung mit Budenofalk Rektalschaum sollten Sie sich nicht impfen lassen, ausser auf ausdrückliche ärztliche Empfehlung.
Andere Arznei- oder Lebensmittel beeinflussen die Wirkung von Budenofalk Rektalschaum oder werden selbst in ihrer Wirkung durch Budenofalk Rektalschaum beeinflusst. Dazu zählen z.B. Herzglykoside (Arzneimittel zur Verbesserung der Herztätigkeit), harntreibende Arzneimittel, Blutzucker senkende Arzneimittel, bestimmte blutgerinnungshemmende Arzneimittel, Arzneimittel gegen Entzündungen und Rheuma, Arzneimittel gegen Epilepsie und Arzneimittel gegen Pilzinfektionen, Arzneimittel gegen HIV-Infektion, Antibiotika, Arzneimittel gegen die körpereigene Abwehr und die Pille. Beachten Sie bitte, dass diese Angaben auch für vor kurzem angewandte Arzneimittel gelten können. Vorsichtshalber sollten Sie auch keinen Grapefruitsaft zusammen mit Budenofalk einnehmen.
Bei Operationen oder anderen Stressfaktoren kann es notwendig sein, dass Ihnen Ihr Arzt resp. Ihre Ärztin stärker wirksame Kortikosteroide verschreibt.
Informieren Sie Ihren Arzt, oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie an anderen Krankheiten leiden, Allergien haben oder andere Arzneimittel (auch selbstgekaufte!) einnehmen oder anwenden.
Darf Budenofalk Rektalschaum während einer Schwangerschaft oder in der Stillzeit angewendet werden?
Schwangerschaft
Budenofalk Rektalschaum darf in der Schwangerschaft nur auf ausdrückliche Anweisung des Arztes bzw. der Ärztin eingenommen werden. Frauen im gebärfähigen Alter müssen vor der Behandlung mit Budenofalk Rektalschaum eine mögliche Schwangerschaft ausschliessen und während der Behandlung geeignete Massnahmen zur Schwangerschaftsverhütung treffen.
Stillzeit
Während einer Behandlung mit Budenofalk Rektalschaum soll nicht gestillt werden. Sprechen Sie mit Ihrem Arzt bzw. mit Ihrer Ärztin, wenn Sie schwanger sind, es werden möchten oder stillen.
Wie verwenden Sie Budenofalk Rektalschaum?
Dosierung
Erwachsene: Wenden Sie einmal täglich 1 Sprühstoss zu 2 mg Budesonid an.
Kinder und Jugendliche: Budenofalk Rektalschaum sollte Kindern und Jugendlichen nicht gegeben werden.
Art der Anwendung
Dieses Arzneimittel darf nur rektal (in den Enddarm) angewendet werden. Es ist nicht zur Einnahme bestimmt und darf nicht verschluckt werden. Budenofalk Rektalschaum kann morgens oder abends verabreicht werden. Die besten Ergebnisse werden erreicht, wenn der Darm vor der Anwendung von Budenofalk Rektalschaum entleert wird.
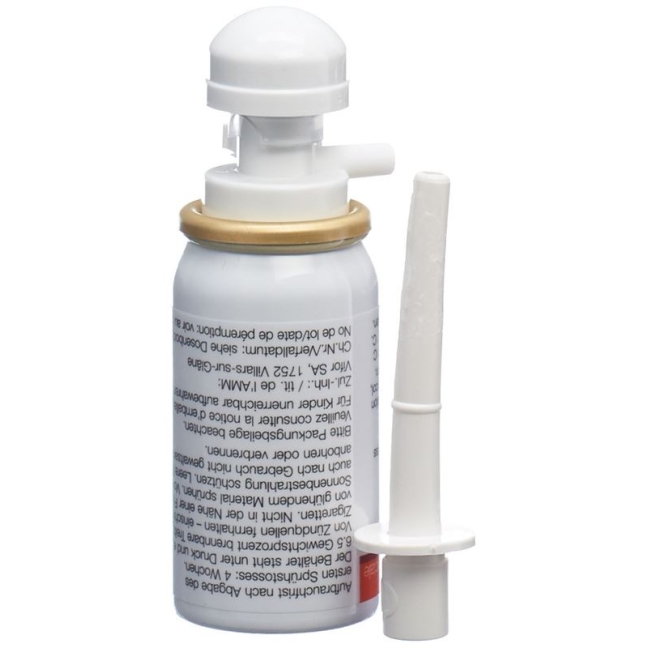
Der Applikator befindet sich in einer speziellen Schiene. Halten Sie bitte die Schiene fest und ziehen den Applikator mit einem Ruck heraus.
Vorbereitungen vor Gebrauch des Schaums


Achten Sie darauf, dass Budenofalk Rektalschaum bei Anwendung Raumtemperatur hat. Drücken Sie den Applikator fest auf das Sprühventil der Dose. Schütteln Sie die Sprühdose kräftig 10 bis 15 Sekunden lang, um den Inhalt zu vermischen.

Entfernen Sie vor dem ersten Gebrauch die unter dem Pumpkopf befindliche Sicherheitssperre (Plastiklasche).

Drehen Sie den oben auf dem Dosenkörper befindlichen Pumpkopf, bis die darunter liegende halbkreisförmige Einkerbung in Richtung des Sprühventils weist. Die Sprühdose ist nun gebrauchsfertig.
Anwendung des Schaums

Legen Sie Ihren Zeigefinger auf die Spitze des Pumpkopfes und drehen Sie die Sprühdose auf den Kopf. Bitte beachten Sie, dass die Sprühdose nur dann einwandfrei funktionieren kann, wenn der Pumpkopf möglichst senkrecht nach unten weist.

Führen Sie den Applikator so weit wie möglich in den After ein. Stellen Sie dazu am besten einen Fuss auf einen Stuhl oder Hocker. Um eine Dosis Budenofalk Rektalschaum zu verabreichen, drücken Sie den Pumpkopf einmal ganz durch und halten ihn für ungefähr 2 Sekunden in dieser Position. Danach lassen Sie ihn sehr langsam wieder los. Der Schaum gelangt nun in den Darm. Warten Sie 10 bis 15 Sekunden, bevor Sie den Applikator aus dem After herausziehen, damit der Schaum vollständig aus dem Applikator entweichen kann. Der Schaum dehnt sich noch etwas aus und würde anderenfalls ungenutzt aus dem Applikator entweichen und daneben laufen.

Entfernen Sie nach Verabreichung des Schaums den Applikator und entsorgen Sie ihn, verpackt in dem mitgelieferten Kunststoffbeutel, mit dem Hauskehricht. Verwenden Sie für jede Anwendung einen neuen Applikator.
Um ein unbeabsichtigtes Austreten von Schaum aus der Sprühdose zwischen den Anwendungen zu vermeiden, drehen Sie den Pumpkopf so, dass die Einkerbung in die der Auslassöffnung entgegengesetzte Richtung zeigt.
Dauer der Anwendung
Die Dauer der Anwendung bestimmt der behandelnde Arzt bzw. die behandelnde Ärztin. Im Allgemeinen klingt der akute Schub, über dessen Ende hinaus Budenofalk Rektalschaum nicht angewendet werden soll, nach 6 bis 8 Wochen ab.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Bislang sind keine Fälle einer Überdosierung mit Budesonid bekannt. Auf Grund der Eigenschaften von Budenofalk Rektalschaum mit dem Wirkstoff Budesonid ist eine Überdosierung mit Folgeschäden unwahrscheinlich.
Sollten Sie einmal zu viel Budenofalk Rektalschaum angewendet haben, wenden Sie beim nächsten Mal die für diesen Zeitpunkt verordnete Dosis an. Wenn Sie zu wenig Budenofalk Rektalschaum angewendet oder eine Anwendung vergessen haben: Verwenden Sie beim nächsten Mal nicht mehr Budenofalk Rektalschaum, sondern setzen Sie die Behandlung mit der verordneten Dosis fort. Wenn Sie frühzeitig bemerken, dass Sie eine Anwendung vergessen haben, können Sie diese sofort nachholen. Wenn Sie schon am nächsten vorgesehenen Anwendungszeitpunkt sind, wenden Sie bitte die für diesen Zeitpunkt verordnete Dosis und nicht die doppelte Dosis an.
Wenn Sie die Behandlung mit Budenofalk Rektalschaum abbrechen wollen: Bevor Sie die Behandlung mit Budenofalk Rektalschaum eigenmächtig – z.B. auf Grund des Auftretens von Nebenwirkungen – unterbrechen oder vorzeitig beenden, sollten Sie auf jeden Fall mit Ihrem Arzt bzw. mit Ihrer Ärztin sprechen!
Welche Nebenwirkungen kann Budenofalk Rektalschaum haben?
Häufig sind Brennen oder Schmerzempfinden im Enddarm.
Folgende Nebenwirkungen wurden gelegentlich beobachtet:
Übelkeit, Bauchschmerzen, Reizmagen, Blähungen, Appetitsteigerung, Gewichtszunahme, Geruchstäuschung, Bluthochdruck, Kopfschmerzen, Schwindel, Schlaflosigkeit, Kraftlosigkeit, Haut-Schleimhaut-Einrisse in der Aftergegend, Hämorrhoiden, Blutungen aus dem Mastdarm, häufiger Stuhldrang, entzündlicher Ausschlag der Mundschleimhaut, Akne, vermehrtes Schwitzen, Harnwegsinfektionen, Veränderungen der Leberfunktionswerte, Blutbildveränderungen.
Folgende Nebenwirkungen wurden v.a. bei längerem Gebrauch und höherer Dosierung auch beobachtet:
Abschwächung der körpereigenen Abwehr, verzögerte Wundheilung, Hautausschlag, Allergien, Vollmondgesicht, Wasseransammlung im Gewebe (Ödeme), Fettleibigkeit, Zuckerkrankheit, Schwund der Nebennierenrinde, Ausbleiben der Regelblutung, männlicher Behaarungstyp bei Frauen, Potenzstörungen, Stimmungsveränderungen wie Depressionen, Gereiztheit und Euphorie, grüner Star, grauer Star, Magengeschwür, Entzündung der Bauchspeicheldrüse, Knochen- und Knorpelschwund, Knochenbrüchigkeit, diffuse Muskelschmerzen und -schwäche, Erhöhung des Thromboserisikos.
Wenn Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind, sollten Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin informieren.
Was ist ferner zu beachten?
Arzneimittel für Kinder unzugänglich aufbewahren.
Das Arzneimittel darf nur bis zu dem auf dem Behälter (Dosenboden) mit «Exp.» bezeichneten Datum verwendet werden.
Nicht über 25 °C lagern.
Nicht im Kühlschrank lagern oder einfrieren!
Der Behälter steht unter Druck und enthält 6,5 Gewichtsprozent brennbare Treibgase. Von Zündquellen fern halten – einschliesslich Zigaretten. Nicht in der Nähe einer Flamme oder von glühendem Material sprühen.
Vor direkter Sonnenbestrahlung schützen. Leere Behälter, auch nach Gebrauch, nicht gewaltsam öffnen, anbohren oder verbrennen. Aufbrauchfrist nach Abgabe des ersten Sprühstosses: 4 Wochen.
Das Arzneimittel darf nicht im Abwasser oder im Haushaltsabfall entsorgt werden. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist. Diese Massnahme hilft die Umwelt zu schützen.
Was ist in Budenofalk Rektalschaum enthalten?
Der Wirkstoff von Budenofalk Rektalschaum ist Budesonid und jeder Sprühstoss enthält 2 mg Budesonid, Propylenglycol, Treibgase sowie weitere Hilfsstoffe.
Zulassungsnummer
59263 (Swissmedic).
Wo erhalten Sie Budenofalk Rektalschaum? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztlich Verschreibung.
Packungen mit 1 Sprühdose und 14 Applikatoren sowie 14 Plastikbeuteln zur hygienischen Entsorgung der Applikatoren.
Packungen mit 2 Sprühdosen und 28 Applikatoren sowie 28 Plastikbeuteln zur hygienischen Entsorgung der Applikatoren.
Zulassungsinhaberin
Dr. Falk Pharma AG, 8152 Opfikon
Diese Packungsbeilage wurde im März 2014 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Qu’est-ce que Budenofalk Mousse rectale et quand est-il utilisé?
Le budésonide, principe actif de Budenofalk Mousse rectale, est un glucocorticoïde à effet local indiqué pour le traitement de maladies inflammatoires chroniques de l’intestin. Budenofalk Mousse rectale est utilisé sur prescription médicale pour le traitement de poussées aiguës d’une inflammation chronique du rectum et du dernier segment du gros intestin (colite ulcéreuse).
Quand Budenofalk Mousse rectale ne doit-il pas être utilisé?
Budenofalk ne doit pas être utilisé
si vous souffrez d’hypersensibilité (allergie) au budésonide ou à l’un des autres composants de Budenofalk Mousse rectale;
si vous souffrez d’infections locales de l’intestin (par des bactéries, champignons, amibes, virus);
si vous avez une maladie hépatique grave (cirrhose du foie).
Quelles sont les précautions à observer lors de l’utilisation de Budenofalk Mousse rectale?
La prudence est recommandée si vous souffrez de tuberculose, hypertension artérielle, diabète, perte de la masse osseuse (ostéoporose), ulcères de l’estomac et du duodénum, cataracte ou glaucome, ainsi que lorsque des membres de votre famille souffrent de diabète ou de glaucome.
Les patients sans antécédents de varicelle, de zona ou de rougeole doivent éviter tout contact avec des patients atteints de ces maladies et doivent immédiatement consulter le médecin en cas de contact avec de telles personnes.
Pendant le traitement par Budenofalk Mousse rectale, vous devez renoncer à toute vaccination, sauf si celle-ci est expressément recommandée par le médecin.
D’autres médicaments ou aliments ont une influence sur l’effet de Budenofalk Mousse rectale ou leur effet peut être influencé par Budenofalk Mousse rectale. Il s’agit p.ex. des glucosides cardiaques (médicaments améliorant l’activité cardiaque), des diurétiques, des antidiabétiques, de certains médicaments qui inhibent la coagulation sanguine, des anti-inflammatoires et antirhumatismaux, de médicaments pour le traitement de l’épilepsie et contre les infections à champignons, de médicaments contre l’infection par le VIH, des antibiotiques, de médicaments contre les défenses de l’organisme et de la pilule. Veuillez garder à l’esprit que ceci peut être également valable pour des médicaments utilisés récemment. Par mesure de précaution, évitez également de prendre Budenofalk Mousse rectale en même temps que du jus de pamplemousse.
En cas d’opérations ou en présence d’autres facteurs de stress, votre médecin peut vous prescrire des corticostéroïdes plus puissants.
Veuillez informer votre médecin ou votre pharmacien si vous souffrez d’une autre maladie, vous êtes allergique ou vous prenez déjà d’autres médicaments (même en automédication!).
Budenofalk Mousse rectale peut-il être utilisé pendant la grossesse ou l’allaitement?
Grossesse
Durant la grossesse, Budenofalk Mousse rectale ne peut être pris que sur prescription expresse du médecin. Les femmes en âge de procréer doivent exclure une éventuelle grossesse avant de commencer le traitement par Budenofalk Mousse rectale et prendre les mesures anticonceptionnelles qui s’imposent pendant le traitement.
Allaitement
Vous ne devez pas allaiter pendant un traitement par Budenofalk Mousse rectale. Informez votre médecin si vous êtes enceinte, si vous envisagez une grossesse ou si vous allaitez.
Comment utiliser Budenofalk Mousse rectale?
Posologie
Adultes: Appliquez 1 dose de 2 mg de budésonide une fois par jour.
Enfants et adolescents: Budenofalk Mousse rectale ne doit pas être administré aux enfants et adolescents.
Mode d’emploi
Ce médicament ne doit être appliqué que par voie rectale (dans le rectum). Il n’est pas destiné à être pris par voie orale et ne doit pas être avalé. Budenofalk Mousse rectale peut être administré le matin ou le soir. Les meilleurs résultats sont obtenus lorsque l’intestin a été vidé avant l’utilisation de Budenofalk Mousse rectale.
L’applicateur se trouve dans un étui spécial. Tenez fermement l’étui et retirez l’applicateur d’un coup.
Préparatifs avant l’utilisation de la mousse


Veillez à ce que Budenofalk Mousse rectale soit à température ambiante lors de son utilisation. Enfilez fermement l’applicateur sur la valve du flacon doseur. Agitez énergiquement le flacon doseur pendant 10 à 15 secondes afin d’en mélanger le contenu.

Avant la première utilisation, retirez le verrou de sécurité qui se trouve sous la tête de la pompe (languette en plastique).

Tournez la tête de la pompe qui se trouve sur la partie supérieure du corps du flacon doseur, jusqu’à ce que l’encoche semi-circulaire située sous la tête se trouve en face de la valve. Le flacon doseur est maintenant prêt à l’emploi.
Utilisation de la mousse

Placez votre index au sommet de la tête de la pompe et renversez le flacon doseur. Veuillez noter que le flacon doseur ne peut fonctionner parfaitement que si la tête de la pompe est orientée aussi verticalement que possible vers le bas.

Introduisez l’applicateur aussi profondément que possible dans l’anus. Pour cela, il est préférable de poser un pied sur une chaise ou un tabouret. Pour administrer une dose de Budenofalk Mousse rectale, pressez une fois à fond sur la tête de la pompe et maintenez-la dans cette position pendant 2 secondes environ. Relâchez ensuite très lentement la tête de la pompe. La mousse parvient maintenant dans l’intestin. Attendez 10 à 15 secondes avant de retirer l’applicateur de l’anus pour que la mousse puisse s’échapper entièrement de l’applicateur. Comme la mousse se dilate encore un peu, si l’applicateur était retiré immédiatement, elle sortirait inutilement de l’applicateur et serait perdue.

Après administration de la mousse, retirez l’applicateur et jetez-le aux ordures ménagères dans le sachet en plastique fourni dans l’emballage. Utilisez à chaque fois un nouvel applicateur.
Afin d’éviter de faire sortir involontairement de la mousse du flacon doseur entre les utilisations, tournez la tête de la pompe de façon à amener l’encoche du côté opposé à celui de l’ouverture de la valve.
Durée d’utilisation
C’est le médecin traitant qui fixe la durée d’utilisation. En général, la fin de la poussée aiguë, au-delà de laquelle Budenofalk Mousse rectale ne doit plus être utilisé, survient après 6 à 8 semaines.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l’efficacité du médicament est trop faible ou au contraire trop forte.
Aucun cas de surdosage de budésonide n’a été signalé jusqu’ici. En raison des propriétés de Budenofalk Mousse rectale, qui contient le budésonide comme principe actif, un surdosage ayant des conséquences préjudiciables est improbable.
S’il vous arrive une fois d’utiliser trop de Budenofalk Mousse rectale, appliquez la fois suivante la dose prescrite pour ce moment. Si vous avez utilisé trop peu de Budenofalk Mousse rectale ou si vous avez oublié de l’utiliser une fois, n’utilisez pas davantage de Budenofalk Mousse rectale la fois suivante, mais poursuivez le traitement avec la dose prescrite. Si vous remarquez assez tôt que vous avez oublié une application, vous pouvez rattraper immédiatement cette omission. Si vous avez déjà atteint le moment de l’administration suivante, utilisez la dose prévue pour ce moment, mais ne doublez pas la dose.
Si vous voulez arrêter le traitement par Budenofalk Mousse rectale: avant d’interrompre ou d’arrêter prématurément de votre propre chef le traitement par Budenofalk Mousse rectale – par exemple à cause de la survenue d’effets secondaires – vous devez dans tous les cas en parler avec votre médecin!
Quels effets secondaires Budenofalk Mousse rectale peut-il provoquer?
Fréquemment des brûlures ou une sensation douloureuse au niveau du rectum peuvent se manifester.
Les effets indésirables suivants se sont manifestés occasionnellement:
Nausée, douleurs abdominales, dyspepsie, flatulences, augmentation d’appétit, augmentation de poids, perception erronée d’odeurs, hypertension artérielle, maux de tête, vertige, insomnie, faiblesse musculaire, fissures anales, hémorroïdes, saignements au niveau du rectum, besoin fréquent de déféquer, éruption inflammatoire sur la muqueuse buccale, acné, transpiration accrue, infections des voies urinaires, modifications des valeurs de la fonction hépatique, modifications de la formule sanguine.
En plus, les effets indésirables suivants ont été observés avant tout lors d’un traitement prolongé et à des doses élevées:
Affaiblissement des défenses de l’organisme, ralentissement de la cicatrisation des plaies, éruption cutanée, allergies, visage lunaire, accumulation d’eau dans les tissus (oedème), obésité, diabète, baisse de la fonction de la glande corticosurrénale, disparition des règles, pilosité du type masculin chez la femme, impuissance, troubles d’humeur telles que dépressions, irritabilité, euphorie, augmentation de la pression intraoculaire (glaucome), opacité du cristallin (cataracte), ulcères de l’estomac, inflammation du pancréas, perte de tissu osseux et cartilagineux, fragilité des os, douleurs et faiblesse musculaire diffuses, augmentation du risque de thrombose.
Informez votre médecin ou votre pharmacien si vous remarquez des effets secondaires qui ne sont pas mentionnés dans cette notice.
A quoi faut-il encore faire attention?
Conserver le médicament hors de la portée des enfants.
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient (sur le fond du flacon).
Ne pas conserver à une température supérieure à 25 °C.
Ne pas conserver au réfrigérateur ou congeler!
Le flacon est sous pression et contient 6,5 pour cent en poids de gaz propulseurs inflammables. Maintenir à distance de sources d’ignition – y compris de cigarettes.
Ne pas vaporiser à proximité d’une flamme ou de matériel incandescent. Protéger d’une exposition directe au rayonnement solaire. Ne pas ouvrir de force, percer ou brûler les flacons, même usagés. Délai d’utilisation après l’application de la première dose: 4 semaines.
Le médicament ne doit pas être jeté au tout à l’égout ou avec les ordures ménagères. Demandez à votre pharmacien comment le médicament doit être éliminé. Cette mesure contribue à protéger l’environnement.
Que contient Budenofalk Mousse rectale?
Le principe actif de Budenofalk Mousse rectale est le budésonide et chaque application contient 2 mg de budésonide, du propylène glycol, du gaz propulseur et d’autres excipients.
Numéro d’autorisation
59263 (Swissmedic).
Où obtenez-vous Budenofalk Mousse rectale? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Emballages avec 1 flacon et 14 applicateurs ainsi que 14 sachets en plastique pour l’élimination hygiénique des applicateurs.
Emballages avec 2 flacons et 28 applicateurs ainsi que 28 sachets en plastique pour l’élimination hygiénique des applicateurs.
Titulaire de l’autorisation
Dr. Falk Pharma AG, 8152 Opfikon
Cette notice d’emballage a été vérifiée pour la dernière fois en mars 2014 par l’autorité de contrôle des médicaments (Swissmedic).
Che cos'è Budenofalk Schiuma rettale e quando si usa?
Budenofalk Schiuma rettale contiene il principio attivo budesonide, un preparato cortisonico ad azione locale per il trattamento delle malattie intestinali infiammatorie croniche. Budenofalk Schiuma rettale é utilizzato su prescrizione medica per il trattamento degli episodi acuti dell’ infiammazione cronica del retto e dell’ultimo tratto del colon (colite ulcerosa).
Quando non si può usare Budenofalk Schiuma rettale?
Non deve usare Budenofalk nei casi seguenti:
Se è ipersensibile (allergico) alla budesonide o ad una qualsiasi delle sostanze ausiliarie di Budenofalk Schiuma rettale.
Se ha infezioni locali dell’intestino (dovute a batteri, funghi, amebe o virus).
Se soffre di una grave malattia del fegato (cirrosi epatica).
Quando è richiesta prudenza nell'uso di Budenofalk Schiuma rettale?
Si raccomanda cautela, nel caso in cui soffra di tubercolosi, ipertensione, diabete mellito, osteoporosi, ulcere gastrointestinali, glaucoma o cataratta, nonché quando dei membri della sua famiglia soffrono di diabete o di glaucoma.
Se non ha ancora avuto varicella, herpes zoster o morbillo, deve evitare qualsiasi contatto con i pazienti che soffrono di queste malattie, e dopo un eventuale contatto deve rivolgersi immediatamente ad un medico.
Durante il trattamento con Budenofalk Schiuma rettale non deve sottoporsi a vaccinazioni, a meno che non le sia stato espressamente raccomandato dal medico.
Altri medicamenti o alimenti possono influenzare l’effetto di Budenofalk Schiuma rettale, o Budenofalk Schiuma rettale stesso può influenzare il loro effetto. Questi medicamenti comprendono p.e. i glicosidi cardiaci (medicamenti che migliorano l’attività cardiaca), i diuretici, gli antidiabetici, alcuni anticoagulanti, gli antinfiammatori e antireumatici, i medicamenti per il trattamento dell’epilessia e i medicamenti contro le infezioni da funghi, i medicamenti contro l’infezione da HIV, gli antibiotici, i medicamenti che inibiscono le difese immunitarie dell’organismo e la pillola anticoncezionale. Nota bene: queste indicazioni possono essere valide anche per i medicamenti usati di recente. A titolo precauzionale, in concomitanza con l’uso di Budenofalk non deve consumare nemmeno il succo di pompelmo.
In caso di interventi chirurgici o altri fattori di stress il vostro medico può prescrivere in aggiunta dei corticosteroidi più potenti.
Informi il suo medico o il suo farmacista nel caso in cui soffra di altre malattie, soffra di allergie o assuma o applichi altri medicamenti (anche se acquistati di sua iniziativa!).
Si può usare Budenofalk Schiuma rettale durante la gravidanza o l'allattamento?
Gravidanza
Budenofalk Schiuma rettale può essere usato durante la gravidanza solo se prescritto espressamente dal medico. Le donne in età fertile devono escludere un’eventuale gravidanza prima di iniziare il trattamento con Budenofalk Schiuma rettale, e nel corso del trattamento devono adottare appropriate misure contraccettive.
Allattamento
Durante il trattamento con Budenofalk Schiuma rettale non si deve allattare al seno. Consulti il medico, se è in gravidanza, se desidera iniziare una gravidanza o se allatta.
Come usare Budenofalk Schiuma rettale?
Posologia
Adulti:Utilizzi 1 dose da 2 mg di budesonide una volta al giorno.
Bambini e adolescenti:Budenofalk Schiuma rettale non deve essere utilizzato nei bambini e negl'adolescenti.
Istruzioni per l'uso
Questo medicamento può essere usato solo per via rettale (applicazione nel retto). Non è concepito per l’uso orale e non deve essere ingerito. Budenofalk Schiuma rettale può essere somministrato al mattino o la sera. I risultati migliori si raggiungono quando si ha evacuato l’intestino prima dell’applicazione di Budenofalk Schiuma rettale.
L’applicatore si trova in un astuccio speciale. Tenga fermo l’astuccio ed estragga l’applicatore tirando in modo deciso.
Preparativi prima dell’applicazione della schiuma


Prima dell’utilizzo, si assicuri che Budenofalk Schiuma rettale abbia raggiunto la temperatura ambiente. Prema saldamente l’applicatore sull’ugello di erogazione del flacone dosatore. Agiti energicamente il flacone dosatore per 10-15 secondi in modo da mescolare il contenuto.

Quando si usa il flacone per la prima volta, si deve rimuovere il blocco di sicurezza (linguetta di plastica) che si trova sotto la testa della pompa.

Ruoti la testa della pompa che si trova sopra il flacone dosatore, in modo da allineare l’ugello di erogazione con l’incavo semicircolare situato alla base della testa della pompa. Il flacone dosatore è ora pronto per l’uso.
Applicazione della schiuma

Appoggi l’indice sulla punta della testa della pompa e capovolga il flacone dosatore. Tenga presente che il flacone dosatore può funzionare perfettamente solo quando viene tenuto il più possibile verticalmente, con la testa dosatrice rivolta verso il basso.

Introduca l’applicatore il più profondamente possibile nell’orifizio anale. Per favorire l’applicazione, appoggi un piede su una sedia o su uno sgabello. Per somministrare una dose di Budenofalk Schiuma rettale, prema fino in fondo la testa della pompa e la mantenga in questa posizione per circa 2 secondi. Rilasci poi la testa della pompa molto lentamente, la schiuma raggiunge così l’intestino. Attenda 10-15 secondi, prima di estrarre l’applicatore dall’ano, per lasciare fuoriuscire completamente la schiuma dall’applicatore. In caso contrario, la schiuma, che si espande ulteriormente, uscirebbe dall’applicatore e andrebbe perduta.

Dopo aver somministrato la schiuma, rimuova l’applicatore, lo introduca nell’apposita busta di plastica acclusa e lo smaltisca nei rifiuti domestici. Per ogni somministrazione utilizzi un nuovo applicatore.
Per evitare che tra le applicazioni fuoriesca accidentalmente della schiuma dal flacone dosatore, ruoti la testa dosatrice in modo che l’incavo sia rivolto in direzione contraria a quella dell’ugello di erogazione.
Durata di utilizzo
La durata dell’utilizzo deve essere determinata dal medico curante. In genere, si osserva la fine dell’episodio acuto dopo 6-8 settimane, oltre cui non si dovrebbe estendere l’utilizzo di Budenofalk Schiuma rettale.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l’azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Finora non sono noti casi di sovradosaggio di budesonide. Considerate le caratteristiche di Budenofalk Schiuma rettale che contiene il principio attivo budesonide, è improbabile che si verifichi un sovradosaggio con conseguenze dannose.
Se ha utilizzato una volta una quantità eccessiva di Budenofalk Schiuma rettale, all’applicazione successiva utilizzi la dose prescritta per questa data. Se ha utilizzato una quantità troppo bassa di Budenofalk Schiuma rettale o se ha dimenticato una somministrazione, all’applicazione successiva non utilizzi una dose superiore di Budenofalk Schiuma rettale, ma prosegua il trattamento con la dose prescritta. Se si accorge in tempo di aver dimenticato un’applicazione, la può somministrare subito. Se è già arrivato l’orario dell’applicazione successiva, utilizzi la dose prescritta per questa data senza raddoppiarla.
Se desidera interrompere il trattamento con Budenofalk Schiuma rettale: prima di interrompere o terminare precocemente di sua iniziativa il trattamento con Budenofalk Schiuma rettale - per es. a causa del manifestarsi di effetti collaterali - deve consultare in ogni caso il suo medico.
Quali effetti collaterali può avere Budenofalk Schiuma rettale?
I bruciori o sensazioni di dolore nel retto sono frequenti.
Gli effetti collaterali seguenti sono stati osservati occasionalmente:
nausea, dolori addominali, dispepsia, meteorismo, aumento dell’appetito, aumento di peso, allucinazioni olfattive, ipertensione arteriosa, mal di testa, vertigini, insonnia, debolezza muscolare, fissure mucocutanee nella regione anale, emorroidi, emorragie rettali, tenesmo rettale frequente, eruzioni infiammatorie della mucosa orale, acne, aumento della sudorazione, infezioni delle vie urinarie, alterazioni dei valori della funzione epatica, alterazioni dei valori del sangue.
Inoltre, i seguenti effetti collaterali sono stati rilevati soprattutto in caso d’uso prolungato e a dosi elevate: indebolimento delle difese corporee, rallentamento nella guarigione delle ferite, eruzioni cutanee, allergie, faccia «a luna piena», accumulazione di liquidi nei tessuti (edema), obesità, diabete, ipofunzione della funzione della ghiandola corticosurrenale, assenza delle mestruazioni, peluria di tipo maschile nelle donne, impotenza, disturbi dell’umore come p.e. depressioni, irritabilità, euforia, aumento della pressione intraoculare (glaucoma), opacizzazione del cristallino (cataratta), ulcera dello stomaco, pancreatite, osteoporosi e condropatia, fragilità ossea, debolezza e dolori muscolari diffusi, aumento del rischio di trombosi.
Informi il suo medico o farmacista se osserva effetti collaterali qui non descritti.
Di che altro occorre tener conto?
Tenere il medicinale fuori dalla portata dei bambini.
Il medicamento non dev’essere utilizzato oltre la data indicata con «EXP» sul recipiente (fondo del flacone).
Non conservare a temperature superiori a 25 ° C.
Non conservare in frigorifero e non congelare!
Il recipiente è sotto pressione e contiene il 6,5% del peso di gas propellente infiammabile. Tenere lontano da fiamme o scintille, comprese le sigarette.
Non spruzzare in vicinanza di una fiamma o di materiale incandescente. Proteggere dalla radiazione solare diretta. Non aprire con violenza, perforare o bruciare i recipienti vuoti neppure dopo l’uso. Tempo di utilizzo dopo l’applicazione della prima dose: 4 settimane.
Il medicamento non deve essere gettato nell’acqua di scarico o nei rifiuti domestici. Chieda al farmacista come eliminare il medicamento che non utilizza più. Questo aiuterà a proteggere l’ambiente.
Cosa contiene Budenofalk Schiuma rettale?
Il principio attivo di Budenofalk Schiuma rettale è la budesonide, e ogni dose contiene 2 mg di budesonide, glicole propilenico, gas propellente e altre sostanze ausiliarie.
Numero dell'omologazione
59263 (Swissmedic).
Dov'è ottenibile Budenofalk Schiuma rettale? Quali confezioni sono disponibili?
In farmacia, su presentazione di una prescrizione medica.
Confezioni con 1 flacone dosatore, 14 applicatori e 14 buste di plastica per lo smaltimento igienico degli applicatori.
Confezioni con 2 flaconi dosatori, 28 applicatori e 28 buste di plastica per lo smaltimento igienico degli applicatori.
Titolare dell’omologazione
Dr. Falk Pharma AG, 8152 Opfikon
Questo foglietto illustrativo è stato controllato l’ultima volta nel marzo 2014 dall’autorità competente in materia di medicamenti (Swissmedic).
Zusammensetzung
Wirkstoff: Budesonid.
Hilfsstoffe: Propylenglykol, Treibgase, Excipiens ad emulsionem.
Galenische Form und Wirkstoffmenge pro Einheit
Rektalschaum.
Aussehen: weisser bis weiss-gräulicher, cremiger, fester Schaum.
1 Sprühstoss enthält 2 mg Budesonid.
Indikationen/Anwendungsmöglichkeiten
Akutbehandlung der Colitis ulcerosa, die auf das Rektum und das Colon sigmoidum beschränkt ist.
Dosierung/Anwendung
Dosierung
Erwachsene: 1× täglich 1 Sprühstoss zu 2 mg Budesonid.
Kinder: Budenofalk Rektalschaum sollte Kindern auf Grund der geringen Erfahrung in dieser Altersgruppe nicht gegeben werden.
Art der Anwendung
Zur rektalen Anwendung.
Budenofalk Rektalschaum kann morgens oder abends verabreicht werden.
Der Behälter wird zuerst mit einem Applikator versehen und anschliessend etwa 15 Sekunden lang kräftig geschüttelt, bevor der Applikator so tief in das Rektum eingeführt wird, wie es dem Patienten bequem möglich ist. Es ist zu beachten, dass die Dosierung nur dann ausreichend genau ist, wenn der Pumpkopf möglichst senkrecht nach unten weist. Um eine Dosis Budenofalk Rektalschaum zu verabreichen, wird der Pumpknopf ganz heruntergedrückt und langsam wieder losgelassen. Nach Verabreichung des Sprühstosses sollte der Applikator 10 bis 15 Sekunden lang in Position gehalten werden, bevor er aus dem Rektum herausgezogen wird.
Die besten Ergebnisse werden erreicht, wenn der Darm vor der Anwendung von Budenofalk Rektalschaum entleert wird.
Die Dauer der Anwendung bestimmt der behandelnde Arzt. Im Allgemeinen klingt der akute Schub, über dessen Ende hinaus Budenofalk Rektalschaum nicht angewendet werden soll, nach 6 bis 8 Wochen ab.
Kontraindikationen
Budenofalk Rektalschaum darf nicht angewendet werden bei
Überempfindlichkeit gegen Budesonid oder einen der sonstigen Bestandteile;
lokalen Infektionen des Darmes (Bakterien, Pilze, Amöben, Viren);
Leberzirrhose und Zeichen einer portalen Hypertension, z.B. im Spätstadium einer primär biliären Zirrhose.
Warnhinweise und Vorsichtsmassnahmen
Eine Behandlung mit Budenofalk Rektalschaum führt zu niedrigeren systemischen Steroidspiegeln als eine orale Steroidtherapie mit systemisch wirkenden Kortikoiden. Die Umstellung von einer anderen Steroidtherapie kann daher zu Symptomen führen, die im Zusammenhang mit dem veränderten systemischen Steroidspiegel stehen.
Eine besondere ärztliche Überwachung ist geboten, wenn der Patient unter einer oder mehreren der nachfolgend genannten Erkrankungen leidet: Tuberkulose, Bluthochdruck, Diabetes mellitus, Osteoporose, peptischem Ulcus (Magen- oder Zwölffingerdarmgeschwür), Glaukom, Katarakt oder bei familiär gehäuft aufgetretenem Diabetes oder Glaukom.
Kinder
Aufgrund nicht ausreichender Erfahrungen sollte Budenofalk Rektalschaum nicht bei Kindern und Jugendlichen angewendet werden.
Infektionen
Die Unterdrückung von Entzündungsreaktionen und des Immunsystems erhöht die Anfälligkeit von Infektionen und deren Schweregrad. Ihre klinische Ausprägung kann atypisch sein. Schwere Infektionen wie Sepsis und Tuberkulose können maskiert werden und ein fortgeschrittenes Stadium erreichen, bevor sie erkannt werden.
Auf eine Infektion mit Windpocken muss besonders geachtet werden, da diese Erkrankung bei immunsupprimierten Patienten einen schweren bis lebensbedrohlichen Verlauf nehmen kann. Patienten, die diese Erkrankung noch nicht durchgemacht haben, sollten dazu angehalten werden, einen engen Kontakt zu Personen mit Windpocken oder Gürtelrose (Herpes zoster) zu vermeiden. Falls sie sich angesteckt haben, sollten sie umgehend einen Arzt aufsuchen. Eine passive Immunisierung mit Varicella-zoster-Immunglobulin ist bei allen nicht immunisierten Patienten, die systemisch wirksame Kortikoide erhalten oder in den letzten 3 Monaten erhalten haben, angezeigt, wenn sie sich mit Windpocken angesteckt haben könnten. Die Immunisierung sollte innerhalb von 10 Tagen nach Exposition durchgeführt werden. Falls Windpocken ausbrechen, bedarf die Erkrankung umgehender, spezieller Behandlung. Entsprechende Vorsichtsmassnahmen müssen auch bei einer möglichen Maserninfektion getroffen werden.
Impfstoffe
Lebendimpfstoffe dürfen nicht an Personen mit verminderter Immunantwort verabreicht werden. Die Antikörperbildung nach Verabreichung anderer Impfstoffe (Totimpfstoffe) kann verringert sein.
Vorsicht ist bei Patienten mit leichter bis mässiger Funktionseinschränkung der Leber geboten.
Bei schweren Leberfunktionsstörungen kommt es unter der Behandlung mit Budenofalk Rektalschaum, ähnlich wie unter der Behandlung mit anderen Glukokortikoiden, zu einer reduzierten Elimination und zu einer Zunahme der systemischen Bioverfügbarkeit; daher sind diese Patienten von einer Behandlung mit Budesonid auszuschliessen (siehe «Kontraindikationen»).
Budenofalk Rektalschaum kann die Ansprechbarkeit der Hypothalamus-Hypophysen-Nebennierenrindenachse auf Stress herabsetzen. Aus diesem Grund sollte bei Operationen oder anderen Stresssituationen die gleichzeitige Gabe eines systemisch wirksamen Glukokortikoids erfolgen.
Eine gleichzeitige Behandlung mit Ketoconazol oder anderen starken CYP3A Inhibitoren sollte vermieden werden, da durch eine Hemmung des oxidativen Budesonidabbaus erhöhte Plasmaspiegel von Budesonid auftreten können (siehe Abschnitt «Interaktionen»).
Ausserdem ist zu beachten, dass bei einer höheren als der angegebenen Dosierung systemische glukokortikoidartige Nebenwirkungen auftreten können (siehe Abschnitt «Unerwünschte Wirkungen»).
Cetylalkohol und Sorbinsäure können örtlich begrenzte Hautreizungen (z.B. Kontaktdermatitis) hervorrufen.
Propylenglycol kann Hautreizungen hervorrufen.
Interaktionen
Pharmakodynamische Interaktionen
Herzglykoside
Die Glykosidwirkung kann durch Kaliummangel verstärkt werden.
Saluretika
Die Kaliumausscheidung kann verstärkt werden.
Pharmakokinetische Interaktionen
Cytochrom P450 3A (CYP3A)
Starke CYP3A-Inhibitoren: Kortikosteroide (einschliesslich Budesonid) werden durch CYP3A4 metabolisiert. Die gleichzeitige Verabreichung mit starken CYP3A4 Inhibitoren (z.B. Ketoconazol, Itraconazol, Clarithromycin, Ritonavir, Produkte welche Cobicistat enthalten) kann zu erhöhter Exposition gegenüber Kortikosteroiden führen und somit zu einem erhöhten Risiko systemischer Nebenwirkungen der Kortikosteroide. Der Nutzen einer gleichzeitigen Verabreichung ist versus dem potentiellen Risiko systemischer Wirkungen der Kortikosteroide sorgfältig zu prüfen, in welchem Falle die Patienten hinsichtlich systemischer Nebenwirkungen der Kortikosteroide überwacht werden sollten. Ausserdem soll auf die gleichzeitige Einnahme von Grapefruitsaft verzichtet werden.
CYP3A-Induktoren wie z.B. Carbamazepin und Rifampicin können sowohl die systemische als auch die lokale Wirkung von Budesonid an der Darmschleimhaut reduzieren. Eine Anpassung der Budesonid-Dosierung kann erforderlich sein.
CYP3A-Substrate wie z.B. Ethinylestradiol stehen in der Metabolisierung in Konkurrenz zu Budesonid. Wenn die Affinität der konkurrierenden Substanz zu CYP3A stärker ist, kann dies zu einer erhöhten Budesonid-Plasmakonzentration führen. Falls Budesonid stärker an CYP3A bindet, kann es zu einem Anstieg des Plasmaspiegels der konkurrierenden Substanz kommen. Eine Anpassung der Dosis von Budesonid oder der konkurrierenden Substanz kann notwendig werden.
Bei Frauen, die gleichzeitig Östrogene oder orale Kontrazeptiva erhalten haben, wurde über erhöhte Plasmaspiegel und eine verstärkte Wirkung von Kortikosteroiden berichtet. Diese Wechselwirkung wurde nicht nach Einnahme von niedrig dosierten Kombinationskontrazeptiva beobachtet.
Schwangerschaft/Stillzeit
Es liegen keine Erfahrungen über die Anwendung von Budenofalk Rektalschaum während der Schwangerschaft vor. Tierstudien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt «Präklinische Daten»). Budenofalk Rektalschaum darf in der Schwangerschaft nicht angewendet werden, es sei denn dies ist eindeutig erforderlich.
Frauen im gebärfähigen Alter sollten vor der Behandlung eine mögliche Schwangerschaft ausschliessen und während der Behandlung geeignete Massnahmen zur Schwangerschaftsverhütung treffen.
Es ist nicht bekannt, ob Budesonid wie andere Glukokortikoide in die Muttermilch übertritt. Daher sollte während einer Behandlung mit Budenofalk Rektalschaum nicht gestillt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt.
Unerwünschte Wirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig: (≥1/10).
Häufig: (≥1/100 bis <1/10).
Gelegentlich: (≥1/1’000 bis <1/100).
Selten: (≥1/10’000 bis <1/1’000).
Sehr selten: (<1/10’000), einschliesslich Einzelfälle.
In klinischen Studien mit Budenofalk Rektalschaum wurden bei 8% der Patienten Nebenwirkungen berichtet. Häufig waren Brennen im Enddarm oder Schmerzempfindung und gelegentlich Übelkeit, Kopfschmerzen, Anstieg der Leberfunktionswerte.
Im Einzelnen wurden folgende Nebenwirkungen im Rahmen klinischer Studien beobachtet:
Infektionen und parasitäre Erkrankungen
Gelegentlich: Harnwegsinfektionen.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Anämie, Anstieg der Blutsenkungsgeschwindigkeit, Leukozytose.
Stoffwechsel- und Ernährungsstörungen
Gelegentlich: Appetitsteigerung.
Psychiatrische Erkrankungen
Gelegentlich: Schlaflosigkeit.
Erkrankungen des Nervensystems
Gelegentlich: Kopfschmerzen, Schwindel, Geruchstäuschung.
Gefässerkrankungen
Gelegentlich: Bluthochdruck.
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Übelkeit, Bauchschmerzen, Dyspepsie, Blähungen, Missempfindungen im Bauchraum, Analfissur, aphtöse Stomatitis, häufiger Stuhldrang, Hämorrhoiden, Rektalblutung.
Leber- und Gallenerkrankungen
Gelegentlich: Anstieg der Transaminasen (GOT, GPT), Anstieg der Cholestaseparameter (GGT, AP).
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Akne, vermehrtes Schwitzen.
Untersuchungen
Gelegentlich: Anstieg der Amylase, Veränderung des Cortisols.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Brennen im Enddarm und Schmerzempfindung.
Gelegentlich: Asthenie, Zunahme des Körpergewichtes.
Bei der Anwendung von Budenofalk Rektalschaum können gelegentlich Nebenwirkungen auftreten, die typisch sind für systemisch wirksame Glukokortikoide. Diese nachfolgend aufgelisteten Nebenwirkungen sind von der Dosis, der Behandlungsdauer, einer gleichzeitig oder vorher durchgeführten Therapie mit anderen Glukokortikoiden und der individuellen Empfindlichkeit abhängig.
Erkrankungen des Immunsystems
Behinderung der Immunvorgänge (z.B. Erhöhung des Infektionsrisikos).
Stoffwechsel- und Ernährungsstörungen
Cushing-Syndrom: Vollmondgesicht, Stammfettsucht, verminderte Glukosetoleranz, Diabetes mellitus, Natriumretention mit Ödembildung, vermehrte Kaliumausscheidung, Inaktivität bzw. Atrophie der Nebennierenrinde, Wachstumsverzögerung bei Kindern, Störung der Sexualhormonsekretion (z.B. Amenorrhö, Hirsutismus, Impotenz).
Psychiatrische Erkrankungen
Depressionen, Gereiztheit, Euphorie.
Augenerkrankungen
Glaukom, Katarakt.
Erkrankungen des Nervensystems
Pseudotumor cerebri, evtl. zusätzlich Papillenödem bei Jugendlichen.
Gefässerkrankungen
Erhöhung des Thromboserisikos, Vaskulitis (Entzugssyndrom nach Langzeittherapie).
Erkrankungen des Gastrointestinaltrakts
Magenbeschwerden, Ulcus ventriculi, Pankreatitis.
Erkrankungen der Haut und des Unterhautzellgewebes
Allergisches Exanthem, Striae rubrae, Petechien, Ekchymosen, verzögerte Wundheilung.
Auf Grund des Gehalts an Sorbinsäure kann es zu lokalen Hautreaktionen, wie z.B. Kontaktdermatitis kommen.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Aseptische Knochennekrosen (Femur- und Humeruskopf), diffuse Muskelschmerzen und -schwäche, Osteoporose.
Einige dieser Nebenwirkungen wurden nur nach Langzeitanwendung von oral verabreichtem Budesonid beobachtet.
Überdosierung
Bisher sind keine Fälle einer Überdosierung mit Budesonid bekannt. Aufgrund der Eigenschaften von Budenofalk Rektalschaum ist eine Überdosierung mit toxischen Folgeschäden unwahrscheinlich.
Eigenschaften/Wirkungen
ATC-Code: A07EA06
Wirkungsmechanismus
Der genaue Wirkungsmechanismus von Budesonid bei der Behandlung der Colitis ulcerosa/Proktosigmoiditis ist noch nicht vollständig geklärt. Ergebnisse aus klinisch-pharmakologischen und anderen kontrollierten Studien geben starke Hinweise darauf, dass Budesonid hauptsächlich über lokale Angriffspunkte im Darm wirksam ist.
Pharmakodynamik
Budesonid ist ein Glukokortikosteroid mit einem hohen lokalen entzündungshemmenden Effekt. Im Vergleich zu klinisch äquivalenten Dosen von systemischen Glucokortikosteroiden erzeugt Budesonid signifikant weniger HPA Axis Suppression und beeinflusst Entzündungsmarker weniger. Budesonid zeigt einen dosisabhängigen Einfluss auf die Cortisol-Plasmaspiegel.
Pharmakokinetik
Generelle Gesichtspunkte zu Budesonid
Resorption
Nach oraler Gabe beträgt die systemische Verfügbarkeit von Budesonid ca. 10%.
Verteilung
Budesonid hat ein hohes Verteilungsvolumen (ca. 3 l/kg). Die Plasmaproteinbindung beträgt durchschnittlich 85–90%.
Biotransformation
Budesonid wird in der Leber intensiv (ca. 90%) zu Metaboliten mit schwacher Glukokortikoidwirkung verstoffwechselt. Verglichen mit Budesonid beträgt die Glukokortikoidwirkung der Hauptmetaboliten 6β-Hydroxybudesonid und 16α-Hydroxyprednisolon, die beide über CYP3A gebildet werden, weniger als 1%.
Ausscheidung
Die durchschnittliche terminale Eliminationshalbwertszeit beträgt nach oraler Gabe ca. 3–4 Stunden. Die mittlere Clearance für Budesonid beträgt ca. 10 l/min.
Spezielle Patientengruppen (Patienten mit eingeschränkter Leberfunktion)
In Abhängigkeit von Art und Schwere der Lebererkrankung kann die Metabolisierung von Budesonid über CYP3A bei diesen Patienten verringert sein.
Spezifische Gesichtspunkte zu Budenofalk Rektalschaum
Resorption
Nach rektaler Verabreichung sind die Flächen unter den Konzentrationszeitkurven etwas höher als nach oraler Gabe (historische Kontrolle). Die Spitzenspiegel werden bei der Verabreichung von Budenofalk Rektalschaum im Mittel nach 2–3 Stunden erreicht. Eine Kumulation nach Mehrfachgabe konnte ausgeschlossen werden.
Ausbreitung
In einer szintigraphischen Untersuchung mit Technetium-markiertem Budenofalk Rektalschaum bei Patienten mit Colitis ulcerosa wurde eine gute Ausbreitung des Schaumes bis Mitte des Sigmoids gezeigt. In der proximalen Hälfte des Sigmoids war die Verteilung des Schaums nur noch bedingt zufriedenstellend.
Präklinische Daten
Die gute lokale Verträglichkeit von Budenofalk Rektalschaum wurde in einer präklinischen Untersuchung an Hunden nachgewiesen.
Nach wiederholter oraler Verabreichung von Budesonid (Dosis vergleichbar beim Menschen) wurden bei Ratten reduzierte Leukozytenzahlen (insbesondere Lymphozyten) und eine Regression der Thymusdrüsen beobachtet. Es gab Hinweise auf Inaktivitätsatrophie der Nebennieren. Am Gesäuge wurde erhöhte Milchgangsproliferation und sekretorische Aktivität festgestellt.
In einer Langzeitstudie (104 Wochen) waren bei weiblichen Ratten Hämatokrit, Hämoglobin und Erythrozytenzahl reduziert. In denselben Dosisgruppen war eine Tendenz zu erhöhter Neutrophilenzahl und zu reduzierten Werten für Lymphozyten, Eosinophile und Normozyten festzustellen. Nur bei männlichen Tieren war die Zahl der Lymphozyten signifikant reduziert (immunsuppressiver Effekt) und die alkalischen Phosphatase leicht erhöht.
Bei Hunden wurden reduzierte Werte des «packed cell volume», erhöhte Konzentration der alkalischen Phosphatase und Alaninaminotransferase, Atrophie der Nebennieren und des lymphatischen Systems, erhöhter Fettgehalt im Myokard und erhöhter Glykogengehalt in der Leber (Lebervergrösserung) festgestellt.
Mutagenität
Budesonid zeigte in einer Reihe von In-vitro- und In-vivo-Tests keine mutagenen Wirkungen.
Kanzerogenität
Männliche Ratten, die mit Budesonid bis zu 104 Wochen lang behandelt wurden, entwickelten leicht erhöhte Inzidenzen basophiler Leberfoci im Vergleich zu Kontrolltieren. Die Inzidenzen der primären hepatozellulären Neoplasien (0,025 und 0,05 mg/kg KG/Tag), der Astrozytome (männliche Ratten, 0,05 mg/kg KG/Tag) und der Mammatumore (weibliche Ratten, 0,05 mg/kg KG/Tag) waren in der Kanzerogenitätsstudie signifikant erhöht. Die Lebertumore entstehen vermutlich durch anabole Effekte und die erhöhte metabolische Belastung der Leber. Die Befunde stellen einen Klasseneffekt dar, an dem wahrscheinlich Glukokortikoidrezeptoren beteiligt sind.
Reproduktionstoxizität
Glukokortikoide induzieren im Tierversuch in verschiedenen Spezies teratogene Effekte (Gaumenspalten, Skelettmissbildungen). Die klinische Relevanz dieser Eigenschaften ist bisher nicht geklärt. Budesonid zeigte bei Nagern nach subkutaner Gabe die schon von anderen Glukokortikoiden bekannten Veränderungen.
Tierstudien haben ebenfalls gezeigt, dass die Gabe von synthetischen Glukokortikoiden während der Trächtigkeit zu einem erhöhten Risiko für eine intrauterine Wachstumsretardierung führen kann und zu Herz-Kreislauf-Erkrankungen und/oder Stoffwechselkrankheiten im Erwachsenenalter sowie einer bleibenden Veränderung der Glukokortikoidrezeptordichte, des Neurotransmitterumsatzes und des Verhaltens beitragen kann.
Sonstige Hinweise
Imkompatibilitäten
Nicht zutreffend.
Beeinflussung diagnostischer Methoden
Nicht zutreffend.
Haltbarkeit
Aufbrauchfrist nach Abgabe des ersten Sprühstosses: 4 Wochen.
Besondere Lagerungshinweise
Nicht über 25 °C lagern. Nicht im Kühlschrank lagern oder einfrieren!
Hinweise für die Handhabung
Der Behälter steht unter Druck und enthält 6,5 Gewichtsprozent brennbare Treibgase. Von Zündquellen fernhalten – einschliesslich Zigaretten. Nicht in der Nähe einer Flamme oder von glühendem Material verwenden. Vor direkter Sonnenbestrahlung schützen. Leere Behälter auch nach Gebrauch nicht gewaltsam öffnen, anbohren oder verbrennen.
Zulassungsnummer
59263 (Swissmedic).
Zulassungsinhaberin
Dr. Falk Pharma AG, 8152 Opfikon
Stand der Information
Oktober 2018.
Composition
Principe actif: Budésonide.
Excipients: Propylène glycol, gaz propulseurs, Excipiens ad emulsionem.
Forme galénique et quantité de principe actif par unité
Mousse rectale.
Aspect: mousse compacte, crémeuse, blanche à blanc-grisâtre.
1 dose contient 2 mg de budésonide.
Indications/Possibilités d’emploi
Traitement aigu de la colite ulcéreuse limitée au rectum et au côlon sigmoïde.
Posologie/Mode d’emploi
Posologie
Adultes: 1× par jour, 1 dose contenant 2 mg de budésonide.
Enfants: Budenofalk Mousse rectale ne devrait pas être administré aux enfants, en raison de l'expérience limitée avec ce groupe d'âge.
Mode d'emploi
Médicament destiné à l'utilisation rectale.
Budenofalk Mousse rectale peut être administré le matin ou le soir.
Munir tout d'abord le flacon d'un applicateur puis agiter vivement pendant environ 15 secondes, avant d'introduire l'applicateur aussi profondément que possible dans le rectum sans que cela devienne inconfortable pour le patient. Il faut prendre garde au fait que le dosage n'est suffisamment précis que si la tête de la pompe est dirigée le plus verticalement possible vers le bas. Pour administrer une dose de Budenofalk Mousse rectale, presser à fond sur la tête de la pompe et la relâcher lentement. Après l'application de la mousse, on laissera l'applicateur en place pendant 10 à 15 secondes avant de le retirer du rectum.
Les meilleurs résultats sont obtenus lorsque l'intestin est vidé avant l'application de Budenofalk Mousse rectale.
C'est le médecin traitant qui détermine la durée du traitement. En général, la poussée aiguë disparaît après 6 à 8 semaines. Budenofalk Mousse rectale ne doit pas être utilisé au-delà de la fin de la poussée aiguë.
Contre-indications
Budenofalk Mousse rectale ne doit pas être utilisé en cas
d'hypersensibilité au budésonide ou à l'un des autres composants;
d'infections locales de l'intestin (bactéries, champignons, amibes, virus);
de cirrhose du foie et de signes d'hypertension portale, par ex. au stade avancé d'une cirrhose biliaire primitive.
Mises en garde et précautions
Un traitement par Budenofalk Mousse rectale mène à des taux systémiques de stéroïdes plus bas qu'un traitement par des corticoïdes à action systémique. De ce fait, le passage d'un autre traitement stéroïdien à Budenofalk Mousse rectale peut provoquer des symptômes liés à la modification du taux systémique de stéroïdes.
Une surveillance médicale particulière est de rigueur si le patient souffre d'une ou de plusieurs des maladies suivantes: tuberculose, hypertension, diabète sucré, ostéoporose, ulcère peptique (ulcère gastrique ou duodénal), glaucome, cataracte ou encore en cas de fréquence familiale accrue de diabète ou de glaucome.
Enfants
Budenofalk Mousse rectale ne devrait pas être utilisé chez l'enfant et l'adolescent, les expériences avec ces groupes d'âge étant insuffisantes.
Infections
L'inhibition des réactions inflammatoires et du système immunitaire augmente la susceptibilité aux infections et leur degré de gravité. Leur manifestation clinique peut être atypique. Des infections graves telles que la septicémie et la tuberculose peuvent être masquées et atteindre un stade avancé avant d'être identifiées.
Il faut prêter une attention particulière à l'éventualité d'une infection par le virus de la varicelle car, chez les patients immunosupprimés, cette affection peut présenter une évolution sévère allant jusqu'à engager le pronostic vital. Il faut instruire les patients qui n'ont pas encore eu cette maladie à éviter tout contact étroit avec des personnes atteintes de varicelle ou de zona (Herpes zoster). En cas de contamination, les patients devront consulter immédiatement un médecin. Il convient de procéder à une immunisation passive par l'immunoglobuline contre la varicelle et le zona chez tous les patients non immunisés qui reçoivent des corticoïdes à action systémique ou en ont reçu au cours des trois derniers mois, dans le cas où ces patients auraient pu être contaminés par le virus de la varicelle. L'immunisation doit se faire dans les dix jours qui suivent l'exposition. En cas d'éruption de la varicelle, la maladie nécessite un traitement spécifique immédiat. Des mesures de précaution doivent également être prises dans le cas d'une possible infection par la rougeole.
Vaccins
Il ne faut pas administrer de vaccins vivants aux personnes dont la réponse immunitaire est diminuée. La formation d'anticorps après l'administration d'autres vaccins (vaccins inactivés) peut être diminuée.
La prudence est de mise chez les patients qui présentent une insuffisance fonctionnelle hépatique légère à modérée.
En cas de troubles fonctionnels hépatiques graves, lors du traitement par Budenofalk Mousse rectale, tout comme lors d'un traitement par d'autres glucocorticoïdes, il y a une réduction de l'élimination du médicament et une augmentation de la biodisponibilité systémique; on exclura donc de traiter ces patients par le budésonide (voir «Contre-indications»).
Budenofalk Mousse rectale peut diminuer la réponse au stress de l'axe hypothalamo-hypophyso-surrénalien. Par conséquent, lors d'opérations ou d'autres situations de stress, il faut administrer simultanément un glucocorticoïde à action systémique.
Il faut éviter un traitement concomitant par le kétoconazole ou par d'autres inhibiteurs puissants du CYP3A car l'inhibition de la dégradation oxydative du budésonide peut s'accompagner d'une élévation des taux plasmatiques du budésonide (voir «Interactions»).
Il faut prendre garde en outre au fait que l'administration d'une dose plus forte que celle de la posologie indiquée peut entraîner l'apparition d'effets indésirables systémiques du type de ceux induits par les glucocorticoïdes (voir «Effets indésirables»).
L'alcool cétylique et l'acide sorbique peuvent provoquer localement des irritations cutanées limitées (p.ex. dermatite de contact).
Le propylène glycol peut provoquer des irritations cutanées.
Interactions
Interactions pharmacodynamiques
Glucosides cardiotoniques
L'effet des glucosides peut être renforcé par une carence en potassium.
Salidiurétiques
L'excrétion de potassium peut être renforcée.
Interactions pharmacocinétiques
Cytochrome P450 3A (CYP3A)
Inhibiteurs puissants du CYP3A: Les corticostéroïdes (y compris le budésonide) sont métabolisés par le CYP3A4. L'administration concomitante d'inhibiteurs puissants du CYP3A4 (par ex. kétoconazole, itraconazole, clarythromycine, ritonavir, produits qui contiennent du cobicistat) peut entraîner une augmentation de l'exposition aux corticostéroïdes et, de ce fait, un risque accru d'effets secondaires systémiques des corticostéroïdes. Le bénéfice d'une administration concomitante doit être soigneusement pesé au regard du risque potentiel d'effets systémiques des corticostéroïdes; le cas échéant, on surveillera les patients pour détecter la survenue d'éventuels effets secondaires systémiques des corticostéroïdes.
En plus il faudrait renoncer à la prise concomitante de jus de pamplemousse.
Inducteurs du CYP3A comme p.ex. la carbamazépine et la rifampicine peuvent réduire l'effet aussi bien systémique que local du budésonide sur la muqueuse intestinale. Une adaptation de la posologie du budésonide peut s'avérer nécessaire.
Substrats du CYP3A comme p.ex. l'éthinylestradiol, entrent en concurrence avec le budésonide pour leur métabolisme. Si l'affinité pour le CYP3A de la substance concurrente est plus forte, cela peut entraîner une augmentation de la concentration plasmatique de budésonide. Si le budésonide se lie plus fortement au CYP3A que la substance concurrente, cela peut entraîner une élévation du taux plasmatique de cette dernière. Une adaptation de la dose de budésonide ou de la substance concurrente peut s'avérer nécessaire.
Chez des femmes qui prenaient simultanément des estrogènes ou des contraceptifs oraux, des taux plasmatiques de corticostéroïdes élevés et un effet plus marqué de corticostéroïdes ont été rapportés. Cette interaction n'a pas été observée dans le cas d'une prise de contraceptifs combinés faiblement dosés.
Grossesse/Allaitement
On ne dispose pas d'expériences sur l'utilisation de Budenofalk Mousse rectale pendant la grossesse. Des études chez l'animal ont montré une toxicité de reproduction (voir «Données précliniques»). Budenofalk Mousse rectale ne doit pas être utilisé pendant la grossesse sauf en cas de nécessité absolue.
Les femmes en âge de procréer doivent exclure une éventuelle grossesse avant le traitement et appliquer des mesures contraceptives appropriées pendant le traitement.
On ignore si, comme d'autres glucocorticoïdes, le budésonide passe dans le lait maternel. Par conséquent, les femmes ne doivent pas allaiter pendant le traitement par Budenofalk Mousse rectale.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude correspondante n'a été effectuée.
Effets indésirables
Dans l'évaluation des effets indésirables, les fréquences sont indiquées comme suit:
Très fréquents: (≥1/10).
Fréquents: (≥1/100 à <1/10).
Occasionnels: (≥1/1000 à <1/100).
Rares: (≥1/10'000 à <1/1000).
Très rares: (<1/10'000), y compris cas isolés.
Des effets indésirables ont été rapportés chez 8% des patients dans les études cliniques menées avec Budenofalk Mousse rectale. Les effets indésirables fréquents ont été des brûlures dans le rectum ou des sensations douloureuses; occasionnellement, des nausées, des céphalées, une élévation des valeurs fonctionnelles hépatiques sont apparues.
Dans le détail, les effets indésirables suivants ont été observés dans le cadre d'études cliniques:
Infections et infestations
Occasionnels: infections des voies urinaires.
Troubles de la circulation sanguine et lymphatique
Occasionnels: anémie, élévation de la vitesse de sédimentation du sang, leucocytose.
Troubles du métabolisme et de la nutrition
Occasionnels: augmentation de l'appétit.
Troubles psychiatriques
Occasionnels: insomnie.
Troubles du système nerveux
Occasionnels: céphalées, vertige, parosmie.
Troubles vasculaires
Occasionnels: hypertension.
Troubles gastro-intestinaux
Occasionnels: nausée, douleurs abdominales, dyspepsie, flatulences, fausses sensations dans la région abdominale, fissure anale, stomatite aphteuse, besoin plus fréquent d'aller à la selle, hémorroïdes, hémorragie rectale.
Troubles hépato-biliaires
Occasionnels: élévation des transaminases (ALAT, ASAT), élévation des paramètres de la cholestase (GGT, AP).
Troubles cutanés et des tissus sous-cutanés
Occasionnels: acné, sueurs profuses.
Investigations
Occasionnels: élévation de l'amylase, variation du cortisol.
Troubles généraux et accidents liés au site d'administration
Fréquents: sensation de brûlure et sensation douloureuse dans le rectum.
Occasionnels: asthénie, augmentation du poids corporel.
Lors de l'utilisation de Budenofalk Mousse rectale, des effets indésirables peuvent se manifester occasionnellement, qui sont typiques des glucocorticoïdes à action systémique. Les effets indésirables ci-après dépendent de la dose, de la durée du traitement, de l'administration concomitante ou antérieure d'un traitement par d'autres glucocorticoïdes et de la sensibilité individuelle du patient.
Troubles du système immunitaire
Inhibition des processus immunitaires (p.ex. augmentation du risque d'infection).
Troubles du métabolisme et de la nutrition
Syndrome de Cushing: visage lunaire, obésité tronculaire, diminution de la tolérance au glucose, diabète sucré, rétention sodée avec formation d'oedèmes, augmentation de l'excrétion de potassium, inactivité ou atrophie du cortex surrénalien, retard de croissance chez l'enfant, troubles de la sécrétion d'hormones sexuelles (p.ex. aménorrhée, hirsutisme, impuissance).
Troubles psychiatriques
Dépressions, irritabilité, euphorie.
Troubles oculaires
Glaucome, cataracte.
Troubles du système nerveux
Pseudotumeur cérébrale, éventuellement oedème papillaire additionnel chez l'adolescent.
Troubles vasculaires
Élévation du risque de thrombose, angéite (syndrome de sevrage après un traitement prolongé).
Troubles gastro-intestinaux
Troubles gastriques, ulcère gastrique, pancréatite.
Troubles cutanés et des tissus sous-cutanés
Exanthème allergique, vergetures, pétéchies, ecchymoses, retards de cicatrisation.
En raison de la teneur en acide sorbique, des réactions cutanées locales telles que dermatites de contact peuvent se produire.
Troubles musculo-squelettiques, du tissu conjonctif et des os
Nécroses osseuses aseptiques (tête du fémur et de l'humérus), myalgies diffuses et faiblesse musculaire, ostéoporose.
Certains de ces effets indésirables n'ont été observés qu'après une utilisation prolongée de budésonide administré par voie orale.
Surdosage
Aucun cas de surdosage au budésonide n'est connu à ce jour. Au vu des propriétés de Budenofalk Mousse rectale, il est improbable qu'un surdosage ait des conséquences toxiques.
Propriétés/Effets
Code ATC: A07EA06
Mécanisme d'action
Le mécanisme d'action précis du budésonide dans le traitement de la colite ulcéreuse/proctosigmoïdite n'est pas encore entièrement élucidé. Des résultats d'études cliniques pharmacologiques et d'autres études contrôlées suggèrent fortement que le budésonide agit principalement sur des points d'impact situés dans l'intestin.
Pharmacodynamie
Le budésonide est un glucocorticoïde qui exerce un puissant effet anti-inflammatoire local. Par rapport à des doses cliniquement équivalentes de glucocorticoïdes systémiques, le budésonide entraîne une suppression significativement plus faible de l'axe hypothalamo-hypophyso-surrénalien et a moins d'influence sur des paramètres inflammatoires. Le budésonide exerce un effet dépendant de la dose sur les taux plasmatiques de cortisol.
Pharmacocinétique
Informations générales sur le budésonide
Absorption
Après administration orale, la disponibilité systémique du budésonide est d'environ 10%.
Distribution
Le budésonide a un grand volume de distribution (environ 3 l/kg). La liaison aux protéines plasmatiques s'élève en moyenne à 85–90%.
Métabolisme
Le budésonide subit un métabolisme hépatique intense (environ 90%) pour donner des métabolites exerçant un faible effet glucocorticoïde. En comparaison avec le budésonide, l'effet glucocorticoïde des principaux métabolites, le 6β-hydroxybudésonide et la 16α-hydroxyprednisolone, formés tous deux par la voie du CYP3A, est inférieur à 1%.
Élimination
La demi-vie moyenne d'élimination terminale après administration orale est d'environ 3 à 4 heures. La clairance moyenne du budésonide est d'environ 10 l/min.
Cinétique pour certains groupes de patients (patients souffrant d'insuffisance hépatique)
En fonction du type et de la gravité de la maladie hépatique, le métabolisme du budésonide par la voie du CYP3A peut être réduit chez ces patients.
Informations spécifiques sur Budenofalk Mousse rectale
Absorption
Après administration rectale, les aires sous la courbe de la concentration en fonction du temps sont un peu plus grandes qu'après administration orale (contrôle historique). En moyenne, les taux maximums sont atteints après 2 à 3 heures lors de l'administration de Budenofalk Mousse rectale. Une accumulation après administrations multiples a pu être exclue.
Distribution
Un examen scintigraphique avec Budenofalk Mousse rectale marqué au technétium a montré une bonne distribution de la mousse jusqu'au milieu du côlon sigmoïde chez des patients souffrant de colite ulcéreuse. Dans la moitié proximale du côlon sigmoïde, la distribution de la mousse n'était que limitée.
Données précliniques
La bonne tolérance locale de Budenofalk Mousse rectale a été démontrée dans une étude préclinique chez le chien.
Après administration répétée de budésonide (à une dose comparable à celle utilisée chez l'humain), une réduction du nombre des leucocytes (en particulier des lymphocytes) et une régression du thymus ont été observées chez le rat. On a relevé des signes d'atrophie par inactivité des glandes surrénales. Au niveau des mamelles, une prolifération accrue des conduits lactifères et une augmentation de l'activité sécrétoire ont été constatées.
Dans une étude à long terme (104 semaines) chez des rates, l'hématocrite, l'hémoglobine et le nombre des érythrocytes ont été réduits. Dans les groupes qui ont reçu les mêmes doses, une tendance à une élévation du nombre des neutrophiles et à une réduction du nombre des lymphocytes, des éosinophiles et des normocytes a été constatée. Le nombre des lymphocytes était réduit de manière significative (effet immunosuppresseur) uniquement chez les rats mâles et la phosphatase alcaline était légèrement augmentée.
Chez le chien, des valeurs diminuées du «packed cell volume», une augmentation de la concentration de la phosphatase alcaline et de l'alanine aminotransférase (ALAT), une atrophie des glandes surrénales et du système lymphatique, une augmentation de la teneur en lipides du myocarde et de la teneur en glycogène du foie (augmentation de la taille du foie) ont été constatées.
Mutagénicité
Dans une série de tests in vitro et in vivo, le budésonide n'a pas montré d'effets mutagènes.
Carcinogénicité
Des rats mâles qui ont été traités pendant 104 semaines avec le budésonide ont présenté des fréquences légèrement augmentées de foyers hépatiques basophiles par rapport aux animaux témoins. Les fréquences de néoplasies hépatocellulaires primaires (0,025 et 0,05 mg/kg de poids corporel par jour), d'astrocytomes (rats mâles, 0,05 mg/kg de poids corporel par jour) et de tumeurs mammaires (rates, 0,05 mg/kg de poids corporel par jour) ont été significativement augmentées dans l'étude de carcinogénicité. Les tumeurs hépatiques sont probablement dues à des effets anabolisants et à la charge métabolique accrue du foie. Ces résultats représentent un effet de classe dans lequel les récepteurs des glucocorticoïdes sont vraisemblablement impliqués.
Toxicité de reproduction
Dans les essais chez l'animal, les glucocorticoïdes induisent des effets tératogènes chez diverses espèces (fente palatine, malformations du squelette). À ce jour, l'importance clinique de ces propriétés n'est pas clarifiée. Chez des rongeurs, le budésonide administré par voie sous-cutanée a induit les altérations déjà connues pour d'autres glucocorticoïdes.
Des études chez l'animal ont également montré que l'administration de glucocorticoïdes de synthèse pendant la gestation peut entraîner un risque accru de retard du développement intra-utérin et des pathologies cardio-vasculaires et/ou métaboliques à l'âge adulte, ainsi que des modifications permanentes de la densité des récepteurs des glucocorticoïdes, du métabolisme de neurotransmetteurs et du comportement.
Remarques particulières
Incompatibilités
Non pertinent.
Influence sur les méthodes de diagnostic
Non pertinent.
Stabilité
Le médicament ne doit pas être utilisé au-delà de 4 semaines après la première administration.
Remarques concernant le stockage
Ne pas conserver au-dessus de 25 °C. Ne pas conserver au réfrigérateur ni congeler.
Remarques concernant la manipulation
Le contenu du flacon est sous pression et contient 6,5 pour cent (poids/poids) de gaz propulseurs inflammables. Tenir à distance de sources d'ignition – y compris de cigarettes. Ne pas utiliser à proximité d'une flamme ou de matériel incandescent. Protéger du rayonnement solaire direct. Ne pas ouvrir de force, percer ou incinérer les flacons vides, même après les avoir utilisés entièrement.
Numéro d’autorisation
59263 (Swissmedic).
Titulaire de l’autorisation
Dr. Falk Pharma AG, 8152 Opfikon
Mise à jour de l’information
Octobre 2018.
Відгуки (0)
Ви переглядали

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.






 Deutsch
Deutsch French
French Italian
Italian