Brilique плівкові таблетки 90 мг 100 шт
Brilique Filmtabl 90 mg 100 Stk
-
33321.86 RUB
При оплате криптовалютой:
Ваша прибыль 3332.19 RUB / 36.82 USDT
- Наявність: Немає в наявності
- Виробник: ASTRAZENECA AG
- Модель: 4957516
- ATC-код B01AC24
- EAN 7680613890026
Склад:
Склад:
Ticagrelor 90 mg .Опис
Was ist BRILIQUE und wann wird es angewendet?
BRILIQUE enthält den Wirkstoff Ticagrelor, der zur Arzneimittelklasse der sogenannten Thrombozytenaggregationshemmer gehört.
Der Arzt bzw. die Ärztin hat Ihnen BRILIQUE verschrieben, weil Sie:
- kürzlich oder vor mehr als einem Jahr einen Herzinfarkt hatten oder
- kürzlich an einer instabilen Angina pectoris (Angina pectoris oder Brustschmerz, die/der nicht hinreichend unter Kontrolle ist) litten.
Patienten, die einen Herzinfarkt hatten und BRILIQUE 60 mg für eine Langzeitbehandlung verschrieben bekommen haben, müssen zusätzlich einen der folgenden kardiovaskulären Risikofaktoren aufweisen:
- mehr als einen vorangegangenen Herzinfarkt
- dokumentierte Mehrgefäss-Koronare Herzkrankheit (d.h. Vorliegen von mehreren Verengungen der Herzkranzgefässe)
- Diabetes mellitus, der eine Medikation erfordert
- 65 Jahre oder älter
- chronische nicht terminale Nierenschwäche.
BRILIQUE wirkt auf die sogenannten «Blutplättchen» (Thrombozyten). Das sind sehr kleine Blutzellen, die für die Blutstillung zuständig sind.
Wenn ein Blutgefäss verletzt wird, verklumpen die Blutplättchen und bilden ein Blutgerinnsel. Dadurch wird die Blutung gestillt.
Blutgerinnsel können sich aber auch innerhalb eines geschädigten Blutgefässes bilden. Dies kann sehr gefährlich werden, da:
- das Gerinnsel die Blutversorgung vollständig abschneiden kann - dies kann einen Herzinfarkt (Myokardinfarkt) oder einen Schlaganfall verursachen.
- das Gerinnsel die Blutgefässe, die das Herz umgeben, teilweise verstopfen kann - dies vermindert die Blutversorgung des Herzens. Dadurch können wiederkehrende Brustschmerzen auftreten (sogenannte «instabile Angina pectoris»).
BRILIQUE wirkt der Verklumpung von Blutplättchen entgegen. Dadurch vermindert sich die Gefahr der Bildung eines Blutgerinnsels, das möglicherweise ein Blutgefäss verstopft. Dies bedeutet, dass BRILIQUE die Gefahr eines weiteren Herzinfarkts oder Schlaganfalls bzw. an einer Herzkreislaufkrankheit zu sterben, vermindert.
Normalerweise werden Sie von Ihrem Arzt bzw. Ihrer Ärztin angewiesen, zusätzlich Acetylsalicylsäure (Aspirin) einzunehmen. Dies ist ein weiteres Arzneimittel, das die Bildung von Blutgerinnseln verhindert.
BRILIQUE ist nur auf Verschreibung des Arztes bzw. der Ärztin einzunehmen.
Wann darf BRILIQUE nicht eingenommen werden?
BRILIQUE darf nicht eingenommen werden,
- wenn Sie überempfindlich (allergisch) gegen Ticagrelor oder einen der Hilfsstoffe von BRILIQUE sind, oder
- wenn Sie Probleme mit Blutungen haben, zum Beispiel Magen- oder Darmblutungen aufgrund eines Geschwürs,
- wenn Sie Blutungen im Gehirn hatten,
- wenn Sie eine schwere Lebererkrankung haben, oder
- wenn Sie eines der folgenden Arzneimittel einnehmen: Ketoconazol (zur Behandlung von Pilzinfektionen), Clarithromycin (zur Behandlung von bakteriellen Infektionen), Nefazodon (ein Antidepressivum), Ritonavir und Atazanavir (zur Behandlung von HIV-Infektionen und AIDS).
Für die Langzeitbehandlung darf BRILIQUE 60 mg nicht eingenommen werden,
- wenn Sie innerhalb der vergangenen 6 Monate eine schwere Magen- oder Darmblutung hatten.
Wenn Sie nicht ganz sicher sind, ob Sie BRILIQUE einnehmen dürfen, fragen Sie bitte bei Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin nach, bevor Sie das Medikament einnehmen.
Wann ist bei der Einnahme von BRILIQUE Vorsicht geboten?
Da unter der Einnahme von BRILIQUE das Blutungsrisiko (einschliesslich Blutungen im Gehirn) erhöht ist, müssen Sie vor der Einnahme von BRILIQUE mit Ihrem Arzt, Apotheker oder Zahnarzt bzw. Ihrer Ärztin, Apothekerin oder Zahnärztin sprechen, wenn
- Sie ein erhöhtes Risiko für Blutungen haben aufgrund:
- einer kürzlich erlittenen schwerwiegenden Verletzung,
- einer Operation, die innerhalb der vergangenen 30 Tage erfolgte (einschliesslich zahnärztlicher Eingriffe),
- einer Operation am Gehirn oder am Rückenmark, die innerhalb der vergangenen 5 Jahre erfolgte,
- einer Erkrankung, die Ihre Blutgerinnung beeinträchtigt,
- einer aktiven oder kürzlich aufgetretenen Magen- oder Darmblutung (wie zum Beispiel bei einem Magengeschwür oder Darmpolypen).
- bei Ihnen während des Zeitraums, in dem Sie BRILIQUE einnehmen, eine Operation durchgeführt werden muss (einschliesslich zahnärztlicher Eingriffe). Dies ist wichtig aufgrund des erhöhten Blutungsrisikos. Ihr Arzt bzw. Ihre Ärztin rät Ihnen möglicherweise, die Behandlung mit BRILIQUE 7 Tage vor der Operation zu unterbrechen.
- Ihr Herzschlag unnormal langsam ist (üblicherweise weniger als 60 Schläge pro Minute) und Sie noch kein Gerät zur Regelung Ihres Herzschlages haben (Herzschrittmacher).
- Sie Asthma oder andere Lungenprobleme oder Atmungsschwierigkeiten haben.
- Sie je Probleme mit Ihrer Leber hatten oder früher an einer Krankheit litten, die Ihre Leber geschädigt hat.
Während der Behandlung mit BRILIQUE können Verletzungen und Unfälle wie z.B. Stürze schwerwiegende Folgen haben, da es zu schweren Blutungen kommen kann. Holen Sie bitte rechtzeitig ärztlichen Rat ein, wenn Sie Bedenken wegen einer Verletzung haben.
Suchen Sie bei folgenden Beschwerden sofort einen Arzt bzw. eine Ärztin auf - eventuell ist eine dringende medizinische Behandlung erforderlich:
- Anzeichen einer Blutung, wie zum Beispiel:
- schwere Blutung, länger andauernde Blutung oder Blutung, die Sie nicht kontrollieren können
- rosafarbener, roter oder brauner Urin
- Erbrechen von rotem Blut oder Erbrochenes, das wie Kaffeesatz aussieht
- roter oder schwarzer Stuhl (sieht wie Teer aus)
- Abhusten von Blut oder Blutgerinnseln
- Blut im Auge
- Zeichen eines Schlaganfalls wie
- plötzliche(s) Taubheitsgefühl oder Schwäche in Arm, Bein oder Gesicht, vor allem wenn dies einseitig auftritt
- plötzliche Verwirrtheit, Schwierigkeiten beim Sprechen oder Probleme, andere zu verstehen
- plötzliche Schwierigkeiten beim Gehen oder Verlust des Gleichgewichts oder der Koordination
- plötzliches Schwindelgefühl oder plötzliche starke Kopfschmerzen ohne bekannte Ursache
Dies sind Zeichen einer bestimmten Art des Schlaganfalls, der durch eine Blutung im Gehirn verursacht wird. Dies tritt bei weniger als 1 von 100 Behandelten auf.
Sprechen Sie mit Ihrem Arzt, Apotheker oder Zahnarzt bzw. Ihrer Ärztin, Apothekerin oder Zahnärztin wenn Sie einen Schlaganfall hatten und BRILIQUE 60 mg einnehmen.
- Kreislaufkollaps (Synkope)
- kurz andauernde Bewusstlosigkeit aufgrund einer plötzlichen Minderdurchblutung des Gehirns (häufig)
- Zeichen einer Blutgerinnungsstörung namens Thrombotisch-thrombozytopenische Purpura (TTP), wie zum Beispiel:
- Fieber und kleinfleckige, punktförmige Blutungen in die Haut oder Mundschleimhaut
- mit oder ohne Gelbfärbung von Haut oder Augenweiss (Gelbsucht),
- unerklärte ausgeprägte Müdigkeit oder Verwirrtheit
TTP wurde sehr selten bei Patienten gemeldet, die mit Ticagrelor behandelt wurden.
Wenn Sie sich nicht ganz sicher sind, ob Sie BRILIQUE einnehmen dürfen, fragen Sie bitte bei Ihrem Arzt, Apotheker oder Zahnarzt bzw. Ihrer Ärztin, Apothekerin oder Zahnärztin nach, bevor Sie das Medikament einnehmen.
BRILIQUE kann die Wirkung von bestimmten Arzneimitteln beeinflussen, und umgekehrt können manche Arzneimittel Auswirkungen auf BRILIQUE besitzen.
Informieren Sie insbesondere Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie folgende Arzneimittel einnehmen, denn diese erhöhen Ihr Blutungsrisiko:
- andere Thrombozytenaggregationshemmer, oft als Blutplättchenhemmer bezeichnet (P2Y12-ADP-Rezeptor-Antagonisten, GPIIb/IIa Inhibitoren), ausser tiefdosierter Acetylsalisylsäure (wie z.B. Aspirin)
- Antikoagulanzien zum Einnehmen, oft als «Blutverdünner» bezeichnet, dazu gehören Vitamin K Antagonisten wie Phenprocoumon (Marcoumar) und Acenocoumarol (Sintrom), direktwirksame Antikoagulanzien wie Rovaroxaban (Xarelto) und chronische Behandlung mit niedermolekularem Heparin wie Enoxaparin natrium (Clexane) und Dalteparinum natricum (Fragmin).
- Nichtsteroidale entzündungshemmende Arzneimittel (abgekürzt als NSARs), sie werden oft als Schmerzmittel, wie z.B. Ibuprofen und Naproxen, eingenommen.
- Selektive Serotonin-Wiederaufnahme-Hemmer (abgekürzt mit SSRI), die als Antidepressiva eingenommen werden wie Paroxetin, Sertralin und Citalopram.
- Andere Arzneimittel wie Ketoconazol (zur Behandlung von Pilzinfektionen, Clarithromycin (zur Behandlung von bakteriellen Infektionen), Nefazadon (Antidepressivum), Ritonavir und Atazanavir (zur Behandlung von HIV-Infektionen und AIDS).
Informieren Sie Ihren Arzt bzw. Ihre Ärztin auch darüber, dass bei Ihnen durch die Einnahme von BRILIQUE ein erhöhtes Blutungsrisiko besteht, wenn Ihr Arzt Ihnen Fibrinolytika verabreicht, die oft als Arzneimittel zur «Auflösung von Blutgerinnseln» bezeichnet werden und zu denen Streptokinase und Alteplase gehören.
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin ebenfalls, wenn Sie eines der folgenden Arzneimittel einnehmen:
- Täglich mehr als 40 mg Simvastatin bzw. Lovastatin (Arzneimittel zur Behandlung von hohen Cholesterinwerten).
- Rifampicin, Erythromycin (Antibiotika), Fluconazol (zur Behandlung von Pilzinfektionen), Phenytoin, Carbamazepin und Phenobarbital (zur Kontrolle von Krampfanfällen), Johanniskraut (Stimmungsaufheller), Digoxin (zur Behandlung von Herzleistungsschwäche), Cyclosporin (zur Dämpfung Ihrer Abwehrkräfte), Chinidin und Diltiazem (zur Behandlung von unnormalen Herzrhythmen), Betablocker und Verapamil (zur Behandung von Bluthochdruck), Cisaprid (zur Behandlung von Sodbrennen), Mutterkornalkaloide (zur Behandlung von Migräne und Kopfschmerzen), Morphin (bei sehr starken Schmerzen).
Brilique kann gewisse Labortests beeinflussen. Informieren Sie deshalb Ihren Arzt bzw. Ihre Ärztin, dass Sie Brilique einnehmen, wenn Labortests durchgeführt werden müssen.
Einnahme von BRILIQUE zusammen mit Nahrungsmitteln und Getränken
Sie können BRILIQUE zusammen mit oder unabhängig von einer Mahlzeit einnehmen. Während der Behandlung mit BRILIQUE sollten Sie keine grösseren Mengen von konzentriertem Grapefruitsaft zu sich nehmen.
BRILIQUE hat wahrscheinlich keinen Einfluss auf die Verkehrstüchtigkeit oder Fähigkeit zum Bedienen von Maschinen. Sie werden derzeit behandelt, weil Sie einen Herzinfarkt oder eine instabile Angina pectoris hatten, und Sie können sich deshalb schwindlig und verwirrt fühlen. Wenn Sie an derartigen Beschwerden leiden, sollten Sie beim Steuern eines Fahrzeugs oder Bedienen von Maschinen Vorsicht walten lassen.
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbstgekaufte) einnehmen oder äusserlich anwenden!
Darf BRILIQUE während einer Schwangerschaft oder in der Stillzeit eingenommen werden?
Sprechen Sie vor der Einnahme von BRILIQUE mit Ihrem Arzt bzw. Ihrer Ärztin, wenn Sie schwanger sind oder schwanger werden könnten. Ihr Arzt bzw. Ihre Ärztin spricht mit Ihnen über Nutzen und Risiken einer Einnahme von BRILIQUE während der Schwangerschaft. Während der Schwangerschaft sollte BRILIQUE nicht angewendet werden, es sei denn es ist klar notwendig. Während der Stillzeit sollte BRILIQUE nicht eingenommen werden.
Wie verwenden Sie BRILIQUE?
Nehmen Sie BRILIQUE immer genau nach Anweisung des Arztes bzw. der Ärztin ein. Bitte fragen Sie bei Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin nach, wenn Sie sich nicht ganz sicher sind.
BRILIQUE muss immer zusammen mit tiefdosierter (75-150 mg) Acetylsalicylsäure (wie z.B. Aspirin) eingenommen werden, ausser es liegen Gründe vor, weshalb Aspirin nicht eingenommen werden darf.
Welche Dosis ist einzunehmen?
BRILIQUE 90 mg: Wenn Sie kürzlich einen Herzinfarkt oder eine instabile Angina pectoris (Angina pectoris oder Brustschmerz, die/der nicht hinreichend unter Kontrolle ist) hatten:
- Die Anfangsdosis beträgt zwei Tabletten mit 90 mg gleichzeitig (Initialdosis mit 180 mg). Diese Dosis wird Ihnen üblicherweise im Krankenhaus gegeben.
- Nach dieser Anfangsdosis ist die übliche Dosis eine Tablette mit 90 mg zweimal täglich über einen Zeitraum von mind. 12 Monaten, sofern Ihr Arzt bzw. Ihre Ärztin Ihnen keine anderen Anweisungen gibt.
- Im Anschluss kann die Behandlung in bestimmten Fällen mit zweimal täglich 60 mg fortgesetzt werden.
BRILIQUE 60 mg: Wenn Sie vor mehr als einem Jahr einen Herzinfarkt hatten:
- Die übliche Dosierung beträgt eine Tablette mit 60 mg zweimal täglich. Nehmen Sie BRILIQUE 60 mg so lange ein, wie es Ihr Arzt oder Ihre Ärztin sagt.
Sie können die Behandlung mit BRILIQUE 60 mg unabhängig davon welche Blutplättchenhemmer Sie vorher einnahmen und unabhängig davon, ob Sie die Therapie mit dem Blutplättchenhemmer zuvor unterbrochen haben, beginnen.
Stoppen Sie die Einnahme des aktuellen Blutplättchenhemmers bevor Sie zum nächsten geplanten Einnahmezeitpunkt mit BRILIQUE 60 mg zusammen mit tiefdosierter (75-150 mg) Acetylsalicylsäure (wie z.B. Aspirin) beginnen.
Wenn Sie vor der Umstellung auf BRILIQUE 60 mg zuvor nicht BRILIQUE 90 mg sondern einen anderen Blutplättchenhemmer eingenommen haben, sollen Sie die erste BRILIQUE-Dosis 24 Stunden nach der Gabe der letzten Dosis einnehmen.
Nehmen Sie BRILIQUE jeden Tag ungefähr zu den gleichen Zeiten ein (z.B. eine Tablette morgens und eine abends).
Ihr Arzt bzw. Ihre Ärztin weist Sie normalerweise auch an, Acetylsalicylsäure (Aspirin) einzunehmen und teilt Ihnen mit, wie viel Sie davon einnehmen sollen (üblicherweise 75-150 mg täglich).
Wie ist BRILIQUE einzunehmen?
Filmtabletten:
Schlucken Sie die Filmtabletten als Ganzes mit einem Glas Wasser.
Sie können überprüfen, wann Sie zuletzt eine Filmtablette BRILIQUE eingenommen haben, indem Sie sich den Blister anschauen. Es sind eine Sonne (für den Morgen) und ein Mond (für den Abend) sowie die Wochentage aufgedruckt. Daran können Sie erkennen, ob Sie Ihre Dosis eingenommen haben.
Wie nehmen Sie BRILIQUE ein, wenn Sie Probleme haben, Tabletten zu schlucken?
Wenn Sie beim Schlucken der Filmtabletten Probleme haben, können Sie diese zerdrücken und wie folgt mit Wasser mischen:
- Zerdrücken Sie die Filmtablette(n) zu einem feinen Pulver.
- Geben Sie das Pulver in ½ Glas Wasser.
- Rühren Sie um, und trinken Sie es sofort.
- Um sicher zu gehen, dass nichts im Glas zurückbleibt, spülen Sie das leere Glas mit einem weiteren halben Glas Wasser und trinken Sie den Inhalt ebenfalls sofort.
Schmelztabletten:
Öffnen Sie den Blister erst, wenn es Zeit für die Einnahme Ihres Medikaments ist.
Reissen Sie die Blisterfolie auf, um die Schmelztablette herauszunehmen. Sie dürfen die Tablette nicht durch die Blisterfolie hindurchdrücken, da die Tablette dabei zerbrochen werden kann.
Legen Sie die Tablette auf Ihre Zunge, wo sie sich schnell im Speichel auflöst. Die aufgelöste Schmelztablette kann dann mit oder ohne Wasser geschluckt werden.
Sie können die Film- resp. Schmelztabletten zusammen mit oder unabhängig von einer Mahlzeit einnehmen.
Wenn Sie im Krankenhaus sind, verabreicht man Ihnen die Tablette möglicherweise aufgelöst in Wasser über einen Schlauch durch die Nase (nasogastrale Sonde).
Wenn Sie eine grössere Menge von BRILIQUE eingenommen haben, als Sie sollten
Wenn Sie eine grössere Menge von BRILIQUE eingenommen haben, als Sie sollten, sprechen Sie sofort mit einem Arzt bzw. einer Ärztin oder suchen Sie ein Spital auf. Nehmen Sie die Arzneimittelpackung mit. Möglicherweise besteht eine erhöhte Blutungsgefahr.
Wenn Sie die Einnahme von BRILIQUE vergessen haben
Wenn Sie die Einnahme einer Dosis vergessen haben, nehmen Sie einfach Ihre nächste Dosis wie gewohnt ein.
Nehmen Sie aber nicht die doppelte Dosis (zwei Tabletten gleichzeitig) ein.
Wenn Sie die Einnahme von BRILIQUE abbrechen
Beenden Sie die Einnahme von BRILIQUE nur nach Rücksprache mit Ihrem Arzt bzw. Ihrer Ärztin. Führen Sie die Einnahme so lange fort, wie der Arzt bzw. die Ärztin es Ihnen verordnet. Wenn Sie die Behandlung beenden möchten, ist es wichtig, dass Sie vorher mit Ihrem Arzt bzw. Ihrer Ärztin sprechen. Der Nutzen von BRILIQUE hängt davon ab, dass Sie es regelmässig einnehmen.
BRILIQUE wird nicht für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren empfohlen.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Welche Nebenwirkungen kann BRILIQUE haben?
BRILIQUE beeinflusst die Blutgerinnung. Deshalb stehen die meisten Nebenwirkungen im Zusammenhang mit Blutungen. Blutungen können in jedem Teil Ihres Körpers auftreten. Einige Blutungen sind häufig (wie blaue Flecken und Nasenbluten). Schwerwiegende Blutungen sind selten, können aber lebensgefährlich sein.
Suchen Sie umgehend einen Arzt bzw. eine Ärztin auf, wenn Sie Anzeichen für einen Schlaganfall oder Blutungen bemerken oder wenn Sie einen Kreislaufkollaps hatten (siehe auch «Wann ist bei der Einnahme von BRILIQUE Vorsicht geboten?»).
Sprechen Sie mit Ihrem Arzt bzw. Ihrer Ärztin, wenn Sie ein Gefühl von Kurzatmigkeit haben - dies ist sehr häufig. Die Kurzatmigkeit kann durch Ihre Herzkrankheit, eine andere Ursache oder als Nebenwirkung von BRILIQUE bedingt sein. Durch BRILIQUE verursachte Kurzatmigkeit ist in der Regel wenig ausgeprägt, gekennzeichnet durch einen plötzlichen, unerwarteten Bedarf an Luft, der gewöhnlich in Ruhe entsteht und während den ersten Behandlungswochen auftreten kann und bei vielen wieder verschwindet. Informieren Sie Ihren Arzt oder Ihre Ärztin, wenn die Kurzatmigkeit schlimmer wird oder eine lange Zeit anhält. Ihr Arzt oder Ihre Ärztin wird entscheiden, ob eine Behandlung oder weitere Untersuchungen nötig sind.
Folgende Nebenwirkungen können bei der Einnahme von BRILIQUE auftreten:
Sehr häufig (bei mehr als 10 von 100 Behandelten) können Blutungen, Kurzatmigkeit und ein erhöhter Harnsäurespiegel (in Tests nachgewiesen) auftreten.
Häufig (bei mehr als 1 bis 10 von 100 Behandelten) können folgende Nebenwirkungen auftreten: Bluterguss, blaue Flecken, Bluthusten, Magen-Darm-Blutung, rektale Blutung, Blut im Urin, Schwindel oder Gefühl, dass sich der Raum dreht, Ohnmacht, Durchfall, Übelkeit, Juckreiz, starke Schmerzen oder Schwellung in Ihren Gelenken (kann ein Zeichen von Gicht sein), Schwindelgefühl, Benommenheit oder verschwommene Sicht (können ein Zeichen für tiefen Blutdruck sein), Nasenbluten, Blutung wegen Blutgerinnungsstörungen, verstärkte Blutung nach einer Operation oder aus Schnitten (z.B. beim Rasieren) und Wunden, Blutung aus Magenschleimhaut (Geschwür), Zahnfleischbluten.
Gelegentlich (bei mehr als 1 bis 10 von 1000 Behandelten) können Verwirrtheit, Blutung in den Augen, Tumorblutungen, Gehirnblutung, Blutung im Ohr, innere Blutung, die Schwindel oder Benommenheit verursachen kann, muskuläre Blutung, Blut im Sperma und Vaginalblutung, die stärker ist oder zu anderen Zeiten auftritt als Ihre normale Monatsblutung, auftreten.
Seit der Markteinführung sind bei einigen Patienten Hautausschlag und allergische Reaktionen wie zum Beispiel Schwellungen im Gesicht, der Lippen, dem Mund, der Zunge oder des Rachens beobachtet worden. Dies kann zu Schluck- oder Atemschwierigkeiten führen.
Ebenfalls wurden sehr selten Zeichen einer Blutgerinnungsstörung namens thrombotisch-thrombozytopenische Purpura (TTP) beobachtet, die mit Fieber und kleinfleckigen, punktförmigen Blutungen in die Haut oder Mundschleimhaut, mit oder ohne Gelbsucht, sowie unerklärter ausgeprägter Müdigkeit oder Verwirrtheit verbunden sein kann. Die TTP ist eine schwerwiegende Erkrankung und erfordert eine sofortige Behandlung.
Informieren Sie bitte Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind. Beenden Sie die Einnahme von BRILIQUE jedoch nicht, ohne zuvor mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin zu sprechen.
Was ist ferner zu beachten?
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Lagerungshinweis
In der Originalverpackung und nicht über 30°C lagern.
Ausser Reichweite von Kindern aufbewahren.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in BRILIQUE enthalten?
Wirkstoffe
1 Filmtablette enthält:
Wirkstoff: 60 mg resp. 90 mg Ticagrelor sowie Tablettenhilfstoffe.
1 Schmelztablette enthält:
Wirkstoff: 90 mg Ticagrelor sowie Tablettenhilfsstoffe.
Zulassungsnummer
61389, 66822 (Swissmedic).
Wo erhalten Sie BRILIQUE? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Filmtablette zu 90 mg: runde, bikonvexe, gelbe Filmtabletten mit der Markierung «90» über «T» auf einer Seite. Die andere Seite ist nicht markiert.
Filmtablette zu 60 mg: runde, bikonvexe, rosafarbene Filmtabletten mit der Markierung «60» über «T» auf einer Seite. Die andere Seite ist nicht markiert.
Schmelztablette zu 90 mg: runde, flache, kantig abgeschrägte, weisse bis blassrosa Schmelztabletten mit der Markierung «90» über «TI» auf einer Seite. Die andere Seite ist nicht markiert.
Filmtabletten:
BRILIQUE 90 mg ist erhältlich in Blisterpackungen (Kalenderpackungen) zu 56 und 168 Filmtabletten.
BRILIQUE 60 mg ist erhältlich in Blisterpackungen (Kalenderpackungen) zu 56 und 168 Filmtabletten.
Schmelztabletten:
Brilique 90 mg ist erhältlich in Blisterpackungen zu 10 Schmelztabletten.
Zulassungsinhaberin
AstraZeneca AG, 6340 Baar.
Diese Packungsbeilage wurde im November 2020 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Qu’est-ce que le BRILIQUE et quand doit-il être utilisé?
BRILIQUE contient le principe actif ticagrelor, appartenant au groupe de médicaments appelé «antiagrégants plaquettaires».
Votre médecin vous a prescrit BRILIQUE parce que vous:
- avez eu un infarctus du myocarde récemment ou il y a plus d'un an, ou
- avez souffert récemment d'angor instable (c'est-à-dire une angine de poitrine ou douleur thoracique insuffisamment contrôlée).
Les patients qui ont eu un infarctus du myocarde et se sont vus prescrire BRILIQUE 60 mg en traitement de longue durée doivent également présenter un des facteurs de risque cardiovasculaire suivants:
- plus d'un antécédent d'infarctus du myocarde
- coronaropathie multi-vaisseaux documentée (c.-à-d. présence de plusieurs rétrécissements des vaisseaux coronaires)
- diabète sucré qui nécessite un traitement médicamenteux
- 65 ans ou plus
- insuffisance rénale chronique non terminale.
BRILIQUE agit sur les plaquettes sanguines (également appelées thrombocytes). Les plaquettes sont de très petites cellules sanguines dont la fonction est de stopper les saignements.
Lorsqu'un vaisseau sanguin est blessé, les plaquettes sanguines s'agrègent et forment ainsi un caillot sanguin qui stoppe l'hémorragie.
Des caillots sanguins peuvent cependant aussi se former à l'intérieur d'un vaisseau sanguin endommagé. Cela peut devenir très dangereux pour les raisons suivantes:
- Le caillot peut complètement bloquer l'apport sanguin, ce qui peut provoquer un infarctus du myocarde (crise cardiaque) ou un accident vasculaire cérébral (attaque cérébrale).
- Le caillot peut partiellement obturer les vaisseaux sanguins qui entourent le cœur, ce qui réduit l'apport de sang au cœur. Cela peut provoquer des douleurs thoraciques récurrentes (angor instable).
BRILIQUE inhibe l'agrégation des plaquettes sanguines et réduit ainsi le risque de formation d'un caillot sanguin susceptible de boucher un vaisseau sanguin. Cela signifie que BRILIQUE réduit le risque de subir un nouvel infarctus du myocarde ou un nouvel accident vasculaire cérébral, et donc aussi le risque de mourir d'une maladie cardiovasculaire.
Normalement, votre médecin vous prescrira également de l'acide acétylsalicylique (Aspirine), qui contribue également à empêcher la formation de caillots sanguins.
BRILIQUE ne doit être pris que sur prescription médicale.
Quand BRILIQUE ne doit-il pas être pris?
Vous ne devez pas prendre BRILIQUE
- si vous présentez une hypersensibilité (allergie) au ticagrelor ou à l'un des excipients contenus dans BRILIQUE
- si vous avez des problèmes de saignements, par exemple des saignements gastriques ou intestinaux dus à un ulcère
- si vous avez eu un saignement dans le cerveau
- si vous souffrez d'une maladie sévère du foie
- si vous prenez l'un des médicaments suivants: kétoconazole (utilisé pour le traitement d'infections fongiques), clarithromycine (utilisée pour le traitement d'infections bactériennes), néfazodone (un antidépresseur), ritonavir et atazanavir (utilisés dans le traitement des infections à VIH et du sida).
La prise de BRILIQUE 60 mg n'est pas indiquée en traitement à long terme
- si vous avez eu un saignement gastrique ou intestinal sévère au cours des six derniers mois.
Si vous ne savez pas avec certitude que vous pouvez prendre BRILIQUE, parlez-en à votre médecin ou à votre pharmacien avant de prendre le médicament.
Quelles sont les précautions à observer lors de la prise de BRILIQUE?
Étant donné que le risque de saignements (saignement dans le cerveau inclus) est accru pendant le traitement par BRILIQUE, vous devez demander l'avis de votre médecin, de votre pharmacien ou de votre dentiste avant de prendre BRILIQUE
- si vous avez un risque accru de saignements pour une des raisons suivantes:
- blessure sérieuse subie récemment
- intervention chirurgicale, ayant eu lieu au cours des 30 derniers jours (y compris dentaire)
- intervention chirurgicale au niveau du cerveau ou de la moelle épinière ayant eu lieu au cours des 5 dernières années
- maladie affectant la coagulation sanguine
- saignement gastrique ou intestinal actif ou survenu récemment (par exemple à cause d'un ulcère de l'estomac ou à cause de polypes intestinaux)
- si vous devez vous soumettre à une intervention chirurgicale (y compris dentaire) au cours de votre traitement par BRILIQUE. Ceci est important à cause du risque accru de saignements. Votre médecin vous recommandera éventuellement une interruption de l'administration de BRILIQUE 7 jours avant l'intervention chirurgicale.
- si votre fréquence cardiaque est anormalement basse (généralement moins de 60 battements par minute) et si vous ne portez pas encore un appareil régulant le rythme cardiaque (stimulateur cardiaque).
- si vous souffrez d'asthme, d'autres problèmes pulmonaires ou de difficultés respiratoires.
- si vous avez eu des problèmes au niveau du foie ou avez souffert par le passé d'une maladie ayant affecté votre foie.
Les blessures et les accidents tels que les chutes survenant pendant le traitement par BRILIQUE peuvent avoir des conséquences graves, car ils peuvent entraîner des saignements sévères. Veuillez demander un avis médical à temps si vous avez des doutes au sujet d'une blessure.
Consultez immédiatement un médecin si les problèmes suivants se manifestent chez vous, car ces situations pourraient éventuellement exiger une intervention médicale immédiate:
- Signes d'un saignement, par exemple:
- Saignement grave de longue durée ou saignement que vous ne parvenez pas à arrêter
- Urine de couleur rose, rouge ou brune
- Vomissement de sang rouge ou vomi ressemblant à du marc de café
- Selles de couleur rouge ou noire (comme du goudron)
- Crachats de sang ou de caillots de sang
- Sang dans les yeux
- Signes d'un accident vasculaire cérébral, par exemple
- Engourdissement ou faiblesse se manifestant soudainement dans un bras, une jambe ou le visage, surtout si ce problème concerne une seule moitié du corps
- Survenue soudaine d'un état confusionnel, de difficultés à parler ou de difficultés à comprendre ce que disent d'autres personnes
- Apparition soudaine de difficultés à marcher ou d'une perte de l'équilibre/de la coordination
- Manifestation soudaine de vertiges ou de maux de tête violents de cause inconnue
Tous ces symptômes sont des signes d'une forme particulière d'accident vasculaire cérébral, due à un saignement dans le cerveau. Ce type d'accident vasculaire cérébral survient chez moins d'une personne traitée sur cent.
Veuillez-vous adresser à votre médecin, à votre pharmacien ou à votre dentiste si vous prenez BRILIQUE 60 mg et que vous avez eu un accident vasculaire cérébral.
- Collapsus cardiovasculaire (syncope)
- brève perte de conscience due à une insuffisance soudaine de l'irrigation du cerveau (fréquent)
- Signes d'un trouble de la coagulation appelé purpura thrombotique thrombocytopénique (PTT), par exemple:
- fièvre et saignements sous forme de petites taches hémorragiques punctiformes cutanées ou muqueuses
- présence ou non d'une coloration jaune de la peau ou du blanc des yeux (jaunisse),
- fatigue prononcée inexpliquée ou confusion
Le PTT a été très rarement signalé chez les patients traités par le ticagrelor.
Si vous ne savez pas avec certitude si vous pouvez prendre BRILIQUE, parlez-en à votre médecin, à votre pharmacien ou à votre dentiste avant de prendre le médicament.
BRILIQUE peut influencer les effets de certains médicaments et être influencé lui-même par d'autres médicaments.
Veuillez informer notamment votre médecin ou votre pharmacien si vous prenez un des médicaments suivants, susceptibles d'accroître votre risque de saignements:
- Autres inhibiteurs de l'agrégation plaquettaire, souvent appelés antiagrégants plaquettaires (antagonistes du récepteur P2Y12-ADP, inhibiteurs du GPIIb/IIa), à l'exception de l'acide acétylsalicylique à faible dose (Aspirine par exemple).
- Anticoagulants oraux (médicaments utilisés pour «fluidifier» le sang), tels que les antagonistes de la vitamine K comme phenprocoumone (Marcoumar) et acénocoumarol (Sintrom), anticoagulants d'action directe comme le rivaroxaban (Xarelto) ou un traitement chronique par une héparine de bas poids moléculaire comme l'énoxaparine sodique (Clexane) et la daltéparine sodique (Fragmin).
- Anti-inflammatoires non stéroïdiens (AINS), des médicaments souvent utilisés pour traiter les douleurs, par exemple ibuprofène ou naproxène.
- Inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), utilisés en tant qu'antidépresseurs, par exemple paroxétine, sertraline ou citalopram.
- Autres médicaments tels que le kétoconazole (utilisé pour le traitement d'infections fongiques), la clarithromycine (utilisée pour le traitement d'infections bactériennes), la néfazodone (antidépresseur), le ritonavir et l'atazanavir (utilisés dans le traitement des infections à VIH et du sida).
Informez également votre médecin que vous avez un risque accru de saignements en raison de votre traitement par BRILIQUE si votre médecin vous donne un fibrinolytique (les fibrinolytiques sont parfois appelés «dissolvants de caillots»), par exemple de la streptokinase ou de l'altéplase.
Vous devez informer également votre médecin ou votre pharmacien si vous prenez l'un des médicaments suivants:
- Plus de 40 mg par jour de simvastatine ou de lovastatine (médicaments utilisés pour traiter un taux excessif de cholestérol).
- Rifampicine, érythromycine (des antibiotiques), fluconazole (utilisé pour traiter des infections fongiques), phénytoïne, carbamazépine ou phénobarbital (utilisés pour contrôler les crises de convulsions), millepertuis (régulateur de l'humeur), digoxine (utilisée pour traiter l'insuffisance cardiaque), ciclosporine (utilisée pour diminuer les défenses de votre corps), quinidine ou diltiazem (utilisés pour traiter des anomalies du rythme cardiaque), bêtabloquants ou vérapamil (utilisés pour traiter l'hypertension), cisapride (utilisé pour traiter les brûlures d'estomac), alcaloïdes de l'ergot de seigle (utilisés pour traiter les migraines et les maux de tête), morphine (en cas de douleurs très fortes).
Brilique peut modifier les résultats de certains examens de laboratoire. Veuillez donc informer votre médecin que vous prenez Brilique lorsque des examens de laboratoire doivent être effectués.
Prise de BRILIQUE avec de la nourriture et des boissons
Vous pouvez prendre BRILIQUE avec ou sans nourriture. Vous ne devez pas consommer de grandes quantités de jus de pamplemousse pendant la durée de votre traitement par BRILIQUE.
BRILIQUE n'a probablement aucune influence sur l'aptitude à conduire ou la capacité à utiliser des machines. Vous recevez actuellement ce traitement parce que vous avez eu un infarctus du myocarde ou un angor instable; il est possible que vous ressentiez un vertige ou une confusion à cause de cela. Si vous souffrez de ce type de symptômes, vous devez user de prudence en conduisant un véhicule ou en utilisant une machine.
Veuillez informer votre médecin ou votre pharmacien si
- vous souffrez d'une autre maladie
- vous êtes allergique ou
- vous prenez ou utilisez en usage externe déjà d'autres médicaments (même en automédication!)
BRILIQUE peut-il être pris pendant la grossesse ou l'allaitement?
Demandez l'avis de votre médecin avant de prendre BRILIQUE si vous êtes une femme enceinte ou susceptible de le devenir. Votre médecin vous expliquera les avantages et les risques d'une prise de BRILIQUE pendant la grossesse. BRILIQUE ne doit pas être utilisé pendant la grossesse, sauf en cas de nécessité absolue. BRILIQUE ne doit pas être pris pendant la période d'allaitement.
Comment utiliser BRILIQUE?
Respectez toujours scrupuleusement les instructions de votre médecin pour la prise de BRILIQUE. En cas de doute, demandez conseil à votre médecin ou votre pharmacien.
BRILIQUE doit toujours être pris avec de l'acide acétylsalicylique à faible dose (75-150 mg) (Aspirine par exemple), sauf s'il y a des raisons contre-indiquant la prise d'Aspirine.
Quelle est la dose à prendre?
BRILIQUE 90 mg: si vous avez souffert récemment d'un infarctus du myocarde ou d'angor instable (angine de poitrine ou douleur thoracique insuffisamment contrôlée):
- La dose initiale est de deux comprimés à 90 mg en une prise (dose initiale de 180 mg). Cette dose vous est normalement administrée à l'hôpital.
- Après cette dose initiale, la dose usuelle est d'un comprimé de 90 mg deux fois par jour pendant une période d'au moins 12 mois, sauf instruction contraire de votre médecin.
- Dans certains cas, le traitement peut être poursuivi avec une dose de 60 mg deux fois par jour.
BRILIQUE 60 mg: si vous avez souffert d'un infarctus du myocarde il y a plus d'un an:
- La posologie habituelle est d'un comprimé à 60 mg deux fois par jour. Poursuivez la prise de BRILIQUE 60 mg aussi longtemps que votre médecin vous le prescrit.
Vous pouvez commencer le traitement par BRILIQUE 60 mg quel que soit l'antiagrégant plaquettaire que vous preniez préalablement, et indépendamment du fait que vous ayez déjà interrompu ce traitement ou non.
Arrêtez de prendre votre antiagrégant plaquettaire habituel au moment de commencer le traitement prévu avec BRILIQUE 60 mg et acide acétylsalicylique (p.ex. Aspirine) à faible dose (75-150 mg).
Si, avant de passer à BRILIQUE 60 mg, vous ne preniez pas BRILIQUE 90 mg mais un autre antiagrégant plaquettaire, vous devez prendre la première dose de BRILIQUE 24 heures après la dernière prise de cet autre antiagrégant.
Prenez BRILIQUE chaque jour à peu près à la même heure (par exemple un comprimé le matin et un comprimé le soir).
Votre médecin vous prescrira sans doute également de l'acide acétylsalicylique (Aspirine) et vous indiquera combien vous devrez en prendre (habituellement 75 à 150 mg par jour).
Comment prendre BRILIQUE?
Comprimés pelliculés:
Avalez les comprimés pelliculés en entier avec un verre d'eau.
Vous pouvez vérifier le moment de votre dernière prise d'un comprimé pelliculé en consultant les indications figurant sur la plaquette thermoformée de BRILIQUE. Un soleil (symbolisant le matin) et une lune (symbolisant le soir) ainsi que les jours de la semaine sont imprimés. Ils vous permettent de savoir si vous avez bien pris votre dose.
Comment prendre BRILIQUE si vous avez des difficultés à avaler les comprimés?
Si vous avez des difficultés à avaler les comprimés pelliculés, vous pouvez les écraser et les mélanger avec de l'eau comme suit:
- Écraser le(s) comprimé(s) pelliculé(s) en une poudre fine
- Verser la poudre dans un demi-verre d'eau
- Remuer et boire immédiatement
- Pour s'assurer qu'il n'y a pas de résidus de médicament, rincer le verre vide avec un autre demi-verre d'eau et le boire aussi immédiatement.
Comprimés orodispersibles:
N'ouvrez la plaquette thermoformée que lorsque vous êtes prêt à prendre votre médicament.
Retirez la pellicule de la plaquette thermoformée pour extraire le comprimé orodispersible. Ne faites pas sortir le comprimé en appuyant sur la plaquette sinon il risque de se casser.
Placez le comprimé sur la langue où il se dissout rapidement dans la salive. Le comprimé orodispersible dissout peut ensuite être avalé avec ou sans eau.
Vous pouvez prendre les comprimés pelliculés ou orodispersibles avec ou en dehors des repas.
Si vous êtes à l'hôpital, il est possible que l'on vous administre le comprimé dissous dans de l'eau en utilisant un tuyau qui passe par le nez (sonde nasogastrique).
Si vous avez pris plus de BRILIQUE que vous n'auriez dû
Si vous avez pris plus de BRILIQUE que vous n'auriez dû, signalez-le immédiatement à un médecin ou rendez-vous à l'hôpital. Emportez la boîte du médicament. Il se peut que vous ayez alors un risque accru de saignement.
Si vous avez oublié de prendre BRILIQUE
Si vous avez omis une prise de BRILIQUE, prenez simplement votre dose suivante comme à l'habitude.
Ne prenez cependant pas une double dose (deux comprimés à la fois)!
Si vous arrêtez la prise de BRILIQUE
N'arrêtez la prise de BRILIQUE qu'après avoir demandé l'avis de votre médecin. Poursuivez la prise aussi longtemps que votre médecin vous le prescrit. Si vous souhaitez terminer le traitement, il est important que vous en parliez d'abord avec votre médecin. L'utilité du traitement par BRILIQUE dépend d'une prise régulière.
BRILIQUE n'est pas recommandé pour le traitement d'enfants et d'adolescents de moins de 18 ans.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Quels effets secondaires BRILIQUE peut-il provoquer?
BRILIQUE influence la coagulation sanguine, la plupart des effets indésirables sont donc en relation avec des saignements. Les saignements peuvent survenir dans n'importe quelle partie du corps. Certains saignements sont fréquents (comme les ecchymoses («bleus») et les saignements de nez). Les saignements sévères sont rares mais peuvent présenter un risque vital.
Consultez immédiatement un médecin si vous observez des signes d'accident vasculaire cérébral ou de saignement ou si vous avez eu une syncope (collapsus circulatoire) (voir aussi: «Quelles sont les précautions à observer lors de la prise de BRILIQUE?»).
Prévenez votre médecin si vous avez une sensation d'essoufflement - un tel effet est très fréquent. L'essoufflement peut être dû à votre maladie cardiaque ou à une autre cause ou être un effet secondaire de BRILIQUE. L'essoufflement lié à BRILIQUE est généralement d'intensité légère, il se caractérise par un besoin d'air soudain et inattendu, survenant habituellement au repos, pouvant apparaître durant les premières semaines de traitement et disparaissant la plupart du temps chez beaucoup de patients. Veuillez informer votre médecin si l'essoufflement s'aggrave ou s'il dure longtemps. Votre médecin décidera si vous avez besoin d'un traitement ou si des examens complémentaires sont nécessaires.
Les effets secondaires suivants peuvent apparaître lors de la prise de BRILIQUE:
Très fréquents (chez plus de 10 patients traités sur 100): saignements, essoufflement et augmentation du taux d'acide urique (démontrée par des analyses).
Fréquents (chez 1 à 10 patients traités sur 100): hématomes, bleus, crachats de sang, saignement gastro-intestinal, saignement rectal, sang dans l'urine, vertiges ou sensation que la pièce tourne, évanouissement, diarrhée, nausées, démangeaisons, douleurs intenses ou gonflement dans les articulations (peut être un signe de goutte), sensation de vertige, étourdissement ou vision trouble (peuvent être un signe d'hypotension), saignements de nez, saignement dû aux troubles de la coagulation, saignement accru après une opération ou dans le cas d'une coupure (par exemple lors du rasage) et d'une plaie, saignement au niveau de la muqueuse de l'estomac (ulcère), saignement des gencives.
Occasionnels (chez 1 à 10 patients traités sur 1000): confusion, saignement dans les yeux, saignement au niveau d'une tumeur, hémorragie cérébrale, saignement dans l'oreille, hémorragie interne qui peut entraîner des vertiges ou un étourdissement, saignement musculaire, sang dans le sperme, saignement vaginal plus abondant ou survenant à un autre moment que les règles normales.
Depuis la mise sur le marché, des éruptions cutanées et des réactions allergiques telles que des gonflements du visage, des lèvres, de la bouche, de la langue ou de la gorge ont été observées chez certains patients. Cela peut entraîner des difficultés à avaler ou à respirer.
Des signes d'un trouble de la coagulation, appelé purpura thrombotique thrombocytopénique (PTT), pouvant être associé à de la fièvre et des saignements sous forme de petites taches hémorragiques punctiformes cutanées ou muqueuses, avec présence ou non d'une jaunisse ainsi qu'une fatigue prononcée inexpliquée ou une confusion ont également été observés très rarement. Le PTT est une maladie grave et nécessite un traitement immédiat.
Veuillez informer votre médecin ou votre pharmacien si l'un des effets secondaires mentionnés vous affecte fortement ou si vous remarquez des effets secondaires qui ne sont pas mentionnés dans cette notice. N'arrêtez cependant pas la prise de BRILIQUE sans en avoir préalablement parlé à votre médecin ou à votre pharmacien.
À quoi faut-il encore faire attention?
Conservation
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
Conserver dans l'emballage d'origine et ne pas conserver au-dessus de 30°C.
Tenir le médicament hors de portée des enfants.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient BRILIQUE?
1 comprimé pelliculé contient:
60 mg resp. 90 mg de ticagrelor en tant que principe actif ainsi que des excipients pour comprimés.
1 comprimé orodispersible contient:
90 mg de ticagrelor en tant que principe actif ainsi que des excipients pour comprimés.
Numéro d'autorisation
61389, 66822 (Swissmedic).
Où obtenez-vous BRILIQUE? Quels sont les emballages à disposition sur le marché?
En pharmacie, seulement sur ordonnance médicale.
Comprimé pelliculé à 90 mg: comprimé rond, biconvexe, jaune, portant la mention «90» au-dessus d'un «T» sur une face. Pas d'inscription sur l'autre face.
Comprimé pelliculé à 60 mg: comprimé rond, biconvexe, rose, portant la mention «60» au-dessus d'un «T» sur une face. Pas d'inscription sur l'autre face.
Comprimé orodispersible à 90 mg: comprimé rond, plat, aux bords biseautés, blanc à rose pâle, portant la mention «90» au-dessus d'un «TI» sur une face. Pas d'inscription sur l'autre face.
Comprimés pelliculés:
BRILIQUE 90 mg est disponible en plaquettes thermoformées calendaires, en boîtes de 56 et de 168 comprimés pelliculés.
BRILIQUE 60 mg est disponible en plaquettes thermoformées calendaires, en boîtes de 56 et de 168 comprimés pelliculés.
Comprimés orodispersibles:
BRILIQUE 90 mg est disponible en plaquettes thermoformées, en boîtes de 10 comprimés orodispersibles.
Titulaire de l’autorisation
AstraZeneca AG, 6340 Baar.
Cette notice d'emballage a été vérifiée pour la dernière fois en novembre 2020 par l'autorité de contrôle des médicaments (Swissmedic).
Che cos'è BRILIQUE e quando si usa?
BRILIQUE contiene ticagrelor, un principio attivo appartenente alla classe farmacologica dei cosiddetti inibitori dell'aggregazione piastrinica.
Il medico le ha prescritto BRILIQUE perché lei:
- ha avuto recentemente o più di un anno fa un infarto cardiaco, o
- ha sofferto recentemente di angina pectoris instabile (angina pectoris o dolore toracico non sufficientemente controllati).
I pazienti che hanno subito un infarto cardiaco e ai quali BRILIQUE 60 mg è stato prescritto per un trattamento a lungo termine devono anche avere uno dei seguenti fattori di rischio cardiovascolari:
- più di un infarto cardiaco precedente;
- malattia coronarica plurivasale accertata (più coronarie presentano un restringimento)
- diabete mellito che richiede trattamento con medicamenti
- età 65 anni e oltre
- insufficienza renale cronica non terminale.
BRILIQUE agisce sulle cosiddette «piastrine» (trombociti), che sono cellule del sangue molto piccole responsabili della coagulazione del sangue.
Quando viene leso un vaso sanguigno, le piastrine si aggregano, formando un coagulo di sangue che arresta il sanguinamento.
I coaguli di sangue si possono però formare anche all'interno di un vaso sanguigno leso. Questa eventualità può essere molto pericolosa perché:
- il coagulo può interrompere completamente l'apporto di sangue, che a sua volta può essere causa di infarto cardiaco (infarto miocardico) o ictus;
- il coagulo può ostruire parzialmente i vasi sanguigni che circondano il cuore, riducendo l'apporto di sangue al cuore e causando così dolori toracici ricorrenti (la cosiddetta «angina pectoris instabile»).
BRILIQUE contrasta l'aggregazione delle piastrine. Questo riduce la possibilità di formazione di un coagulo sanguigno che può occludere un vaso sanguigno. Ciò significa che BRILIQUE riduce il rischio di un altro infarto cardiaco o ictus ovvero il rischio di morire a causa di una malattia cardiocircolatoria.
In genere, il medico le dirà di prendere in aggiunta l'acido acetilsalicilico (Aspirina), che è un altro medicamento che inibisce la formazione di coaguli di sangue.
BRILIQUE dev'essere assunto solo su prescrizione medica.
Quando non si può assumere BRILIQUE?
BRILIQUE non dev'essere assunto nei seguenti casi:
- se ha un'ipersensibilità (allergia) al ticagrelor o ad una qualsiasi delle sostanze ausiliarie di BRILIQUE
- se ha problemi di sanguinamenti, per esempio sanguinamenti gastrici o intestinali dovuti ad ulcere;
- se ha manifestato sanguinamenti cerebrali,
- se soffre di una malattia epatica grave, o
- se assume uno dei medicamenti seguenti: ketoconazolo (per il trattamento delle infezioni fungine), claritromicina (per il trattamento delle infezioni batteriche), nefazodone (un antidepressivo), ritonavir e atazanavir (per il trattamento delle infezioni da HIV e dell'AIDS).
Nel quadro di un trattamento a lungo termine, BRILIQUE 60 mg non deve essere assunto se:
- nel corso dei 6 mesi precedenti ha avuto un grave sanguinamento gastrico o intestinale.
Se non è del tutto sicuro del fatto che possa assumere BRILIQUE, chieda al suo medico o al suo farmacista prima di assumere il medicamento.
Quando è richiesta prudenza nella somministrazione di BRILIQUE?
Poiché con l'assunzione di BRILIQUE aumenta il rischio di sanguinamenti (inclusi sanguinamenti cerebrali), prima di assumere BRILIQUE deve consultare il suo medico, il suo farmacista o il suo dentista nei casi seguenti.
- Se ha un aumentato rischio di sanguinamenti a causa di:
- grave ferita recente;
- intervento chirurgico eseguito negli ultimi 30 giorni (compreso intervento dentistico);
- intervento chirurgico al cervello o al midollo spinale eseguito negli ultimi 5 anni;
- malattia che riduce la coagulazione sanguigna;
- sanguinamento gastrico o intestinale attivo o manifestato di recente (per esempio in caso di ulcera gastrica o polipi intestinali).
- Se nel periodo in cui assume BRILIQUE dev'essere sottoposto a un intervento chirurgico (incluso intervento dentistico). Ciò è importante a causa del rischio elevato di sanguinamento. È possibile che il suo medico le raccomandi di interrompere il trattamento con BRILIQUE sette giorni prima dell'intervento.
- Se il suo battito cardiaco è insolitamente lento (d'abitudine inferiore a 60 battiti al minuto) e lei non ha ancora un apparecchio per il controllo del battito cardiaco (pacemaker).
- Se lei soffre di asma o di altri problemi polmonari o ha difficoltà di respirazione.
- Se ha già avuto problemi di fegato o in precedenza ha sofferto di una malattia che ha provocato danni al fegato.
Durante il trattamento con BRILIQUE, lesioni e incidenti, come ad es. le cadute, possono avere conseguenze gravi, poiché possono comparire gravi sanguinamenti. Si rivolga tempestivamente al medico se ha dubbi riguardo a una ferita.
Se manifesta uno dei disturbi seguenti, consulti immediatamente un medico, perché potrebbe essere necessario un trattamento medico urgente:
- Segni di sanguinamento, per esempio:
- grave sanguinamento, sanguinamento prolungato o sanguinamento che non riesce a controllare
- urina di colore rosa, rosso o marrone
- vomito con sangue rosso o che assomiglia a fondi di caffè.
- feci rosse o nere (somiglianti a catrame)
- espettorazione di sangue o coaguli di sangue
- sangue nell'occhio
- Segni di ictus quali i seguenti
- improvvisa insensibilità o debolezza di braccia, gambe o volto, soprattutto se colpisce un solo lato del corpo;
- improvvisa confusione mentale, difficoltà a parlare o problemi a capire gli altri;
- improvvise difficoltà a camminare o perdita di equilibrio o coordinazione;
- capogiri improvvisi o mal di testa intenso e improvviso senza cause note.
Si tratta di segni di un particolare tipo di ictus causato da sanguinamento cerebrale, che si manifesta in meno di 1 persona trattata su 100.
Consulti il medico, il farmacista o il dentista se ha avuto un ictus cerebrale e assume BRILIQUE 60 mg.
- collasso circolatorio (sincope)
- breve perdita di conoscenza causata da un improvviso calo del flusso di sangue al cervello (frequente)
- Segni di un disturbo della coagulazione del sangue noto come porpora trombotica trombocitopenica (TTP), come per esempio:
- febbre e sanguinamenti puntiformi, a piccole macchie, nella cute o nella mucosa orale
- con o senza ingiallimento della cute o della sclera dell'occhio (ittero)
- stanchezza o confusione marcate, inspiegate
La TTP è stata segnalata molto raramente in pazienti trattati con ticagrelor.
Se non è del tutto sicuro del fatto che possa assumere BRILIQUE, chieda al suo medico, al suo farmacista o al suo dentista prima di assumere il medicamento.
BRILIQUE può influenzare l'azione di alcuni medicamenti e, viceversa, può essere influenzato da alcuni medicamenti.
In particolare, informi il suo medico o il suo farmacista, nel caso in cui assuma i medicamenti seguenti, perché aumentano il rischio di sanguinamento:
- altri inibitori dell'aggregazione piastrinica, spesso chiamati inibitori piastrinici (antagonisti del recettore dell'ADP P2Y12, inibitori del GP IIb/IIIa), ad eccezione dell'acido acetilsalicilico (come l'Aspirina) a basse dosi;
- anticoagulanti da assumere per via orale, spesso chiamati fluidificanti del sangue, tra cui gli antagonisti della vitamina K come il fenprocumone (Marcoumar) e l'acenocumarolo (Sintrom), anticoagulanti ad azione diretta come il rivaroxaban (Xarelto) e il trattamento cronico con eparina a basso peso molecolare come l'enoxaparina sodica (Clexane) e la dalteparina sodica (Fragmin);
- medicamenti antinfiammatori non steroidei (FANS), che vengono assunti spesso come antidolorifici, per es. ibuprofene e naprossene;
- inibitori selettivi della ricaptazione della serotonina (SSRI), che vengono assunti come antidepressivi, per es. paroxetina, sertralina, e citalopram;
- altri medicamenti quali ketoconazolo (per il trattamento delle infezioni fungine), claritromicina (per il trattamento delle infezioni batteriche), nefazodone (antidepressivo), ritonavir e atazanavir (per il trattamento delle infezioni da HIV e dell'AIDS).
Informi il suo medico anche del fatto che presenta un rischio di sanguinamento più elevato a causa dell'assunzione di BRILIQUE, nel caso in cui le prescriva fibrinolitici (tra cui streptochinasi e alteplase), ossia medicamenti che agiscono disgregando i coaguli di sangue.
Informi il suo medico o il suo farmacista anche, se assume uno dei medicamenti seguenti:
- simvastatina o lovastatina (medicamenti per il trattamento dei valori elevati di colesterolo) in dosi giornaliere superiori a 40 mg;
- rifampicina, eritromicina (antibiotici), fluconazolo (usato per trattare le infezioni fungine), fenitoina, carbamazepina e fenobarbitale (per il controllo delle convulsioni), iperico (elevatore del tono dell'umore), digossina (per il trattamento dell'insufficienza cardiaca), ciclosporina (usato per abbassare le difese dell'organismo), chinidina e diltiazem (per il trattamento del ritmo cardiaco anormale), beta-bloccanti e verapamil (per il trattamento dell'ipertensione arteriosa), cisapride (per trattare il bruciore di stomaco), alcaloidi dell'ergot (usati per il trattamento dell'emicrania e del mal di testa), morfina (in caso di dolori molto forti).
Brilique può influenzare determinati esami di laboratorio. Informi pertanto il suo medico che assume Brilique, se devono essere effettuati esami di laboratorio.
Assunzione di BRILIQUE insieme ad alimenti e bevande
BRILIQUE può essere assunto durante o lontano dai pasti. Nel corso del trattamento con BRILIQUE non si devono assumere grandi quantità di succo di pompelmo concentrato.
Probabilmente BRILIQUE non esercita alcun effetto sulla capacità di condurre un veicolo e sulla capacità di utilizzare macchine. Attualmente lei viene trattato perché ha sofferto di un infarto cardiaco o di angina pectoris instabile e per questo può manifestare capogiri e confusione mentale. Se soffre di disturbi di questo tipo, deve usare cautela quando conduce un veicolo o utilizza macchine.
Informi il suo medico o il suo farmacista nel caso in cui:
- soffre di altre malattie
- soffre di allergie o
- assume o applica esternamente altri medicamenti (anche se acquistati di sua iniziativa!).
Si può assumere BRILIQUE durante la gravidanza o l’allattamento?
Se è in gravidanza o se esiste la possibilità che inizi una gravidanza, parli con il suo medico prima di assumere BRILIQUE. Il suo medico le illustrerà i vantaggi e i rischi di un'assunzione di BRILIQUE durante la gravidanza. BRILIQUE non deve essere usato in gravidanza se non nei casi di evidente necessità. BRILIQUE non dev'essere assunto durante l'allattamento.
Come usare BRILIQUE?
Assuma BRILIQUE sempre esattamente secondo le indicazioni del medico. In caso di dubbi consulti il suo medico o il suo farmacista.
BRILIQUE va sempre assunto insieme all'acido acetilsalicilico a basse dosi (75-150 mg) (come l'Aspirina), tranne in presenza di controindicazioni all'uso dell'Aspirina.
Qual è la dose da assumere?
BRILIQUE 90 mg: se ha sofferto recentemente di infarto cardiaco o di angina pectoris instabile (angina pectoris o dolore toracico non sufficientemente controllati):
- La dose iniziale è di due compresse da 90 mg da assumere contemporaneamente (dose iniziale di 180 mg). Questa dose viene somministrata normalmente in ospedale.
- Dopo questa dose iniziale, la dose consueta è di una compressa da 90 mg due volte al giorno per un periodo di almeno 12 mesi, salvo diversa prescrizione medica.
- Successivamente, in determinati casi è possibile proseguire il trattamento con una posologia di 60 mg due volte al giorno.
BRILIQUE 60 mg: se ha avuto un infarto cardiaco più di un anno fa:
- La dose consueta è di una compressa da 60 mg due volte al giorno. Continui ad assumere BRILIQUE 60 mg per tutto il periodo prescritto dal medico.
Il trattamento con BRILIQUE 60 mg può essere iniziato indipendentemente da quale antiaggregante piastrinico sia stato impiegato in precedenza e indipendentemente dal fatto che sia stata interrotta la terapia con tale farmaco.
Sospendere l'assunzione dell'antiaggregante piastrinico attuale prima di iniziare, nel momento previsto, il trattamento con BRILIQUE 60 mg insieme all'acido acetilsalicilico (come ad es. Aspirina) a basse dosi (75-150 mg).
Qualora prima del passaggio a BRILIQUE 60 mg il farmaco utilizzato non fosse BRILIQUE 90 mg bensì un altro antiaggregante piastrinico, l'assunzione della prima dose di BRILIQUE deve avvenire dopo che sono trascorse 24 ore dall'assunzione dell'ultima dose dell'altro medicamento.
Prenda BRILIQUE ogni giorno all'incirca alla stessa ora del giorno (per es. una compressa al mattino e una alla sera).
In genere il medico prescrive anche l'assunzione di acido acetilsalicilico (Aspirina) e ne indica la dose da assumere (normalmente 75-150 mg al giorno).
Come dev'essere assunto BRILIQUE?
Compresse rivestite:
Inghiotta le compresse rivestite intere con un bicchiere d'acqua.
Può controllare quando ha assunto l'ultima compressa rivestita di BRILIQUE osservando il blister che riporta l'immagine di un sole (per il mattino) e di una luna (per la sera), e i giorni della settimana. In tal modo è possibile riconoscere se è stata assunta la dose prevista.
Come assumere BRILIQUE in caso di difficoltà a ingerire le compresse?
Se ha difficoltà a ingerire le compresse rivestite, può schiacciarle e mescolarle all'acqua come descritto:
- schiacci la/le compressa/e rivestita/e riducendola/e in polvere;
- diluisca la polvere ottenuta in ½ bicchiere d'acqua;
- mescoli e beva immediatamente;
- per accertarsi che non vi siano residui di medicamento nel bicchiere, riempia nuovamente a metà il bicchiere con acqua e beva subito anche questa.
Compresse orodispersibili:
Apra il blister solo quando è l'ora di assumere il medicamento.
Rompa la pellicola del blister per estrarre la compressa orodispersibile. Non deve premere la compressa attraverso la pellicola del blister per evitare di romperla.
Metta la compressa sulla lingua dove si scioglie rapidamente con la saliva. Una volta sciolta, la compressa orodispersibile può essere inghiottita con o senza acqua.
Le compresse rivestite o orodispersibili possono essere assunte durante o lontano dai pasti.
Se si trova in ospedale, è possibile che la compressa le venga somministrata sciolta in acqua tramite un tubicino flessibile inserito nel naso (sondino nasogastrico).
Se ha assunto una quantità di BRILIQUE superiore a quella prescritta
Se ha assunto una quantità di BRILIQUE superiore a quella prescritta, consulti immediatamente il suo medico o si rechi in ospedale, portando con sé la confezione del medicamento. È probabile che vi sia un elevato pericolo di sanguinamento.
Se ha dimenticato di assumere BRILIQUE
Se ha dimenticato di assumere una dose, prenda semplicemente la dose successiva come d'abitudine.
Non prenda però una dose doppia (due compresse contemporaneamente).
Se interrompe il trattamento con BRILIQUE
Interrompa l'assunzione di BRILIQUE solo dopo aver consultato il suo medico. Prosegua l'assunzione per tutto il tempo prescrittole dal medico. Se desidera interrompere il trattamento, è importante che ne parli prima con il suo medico. Il beneficio di BRILIQUE dipende dal fatto che venga assunto regolarmente.
L'utilizzo di BRILIQUE nei bambini e negli adolescenti di età inferiore a 18 anni non è raccomandato.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Quali effetti collaterali può avere BRILIQUE?
BRILIQUE influisce sulla coagulazione sanguigna. Pertanto la maggior parte degli effetti collaterali è relativa a sanguinamenti. I sanguinamenti possono manifestarsi in ogni parte del corpo. Alcuni tipi di sanguinamento sono frequenti (come la formazione di lividi o la perdita di sangue dal naso). I sanguinamenti gravi sono rari ma possono mettere in pericolo la vita.
Si rivolga immediatamente a un medico, se presenta segni di ictus o sanguinamento o se ha subito un collasso circolatorio (vedere anche «Quando è richiesta prudenza nella somministrazione di BRILIQUE?»).
Parli con il suo medico se le sembra di avere l'affanno - ciò avviene molto frequentemente. L'affanno respiratorio può essere causato dalla sua malattia cardiaca, da altre cause o rappresentare un effetto collaterale di BRILIQUE. L'affanno causato da BRILIQUE è solitamente lieve ed è caratterizzato da un'improvvisa e inattesa fame d'aria che insorge abitualmente a riposo e può manifestarsi nelle prime settimane di trattamento e poi scomparire in molti pazienti. Informi il medico se l'affanno peggiora o perdura nel tempo. Il medico deciderà se è necessario procedere a un trattamento o a ulteriori accertamenti.
Con l'assunzione di BRILIQUE possono manifestarsi i seguenti effetti collaterali:
Molto frequentemente (in più di 10 pazienti trattati su 100) possono comparire sanguinamenti, affanno respiratorio e un aumento del livello di acido urico nel sangue (rilevato in esami).
Di frequente (in più di 1-10 pazienti trattati su 100) possono comparire i seguenti effetti collaterali: ematomi, lividi, tosse con espettorato sanguinolento, sanguinamento gastrointestinale, perdita di sangue dal retto, sangue nelle urine, vertigini o sensazione come se la stanza girasse, svenimento, diarrea, nausea, prurito, forte dolore o gonfiore delle articolazioni (possibili segni di gotta), sensazione di capogiro, stordimento o annebbiamento della vista (possibili segni di un calo della pressione arteriosa), sangue dal naso, sanguinamento a causa di disturbi della coagulazione, sanguinamento più abbondante in seguito a un intervento chirurgico o a tagli (es. radendosi) e ferite, sanguinamento della mucosa gastrica (ulcera), sanguinamento gengivale.
Occasionalmente (in più di 1-10 pazienti trattati su 1000) possono manifestarsi confusione, sanguinamento negli occhi, sanguinamenti tumorali, sanguinamento cerebrale, sangue nelle orecchie, sanguinamento interno che può causare vertigini o capogiri, sanguinamento muscolare, sangue nello sperma e sanguinamento vaginale più intenso o in momenti diversi rispetto alle normali mestruazioni.
Dopo l'immissione sul mercato sono state osservate in alcuni pazienti eruzioni cutanee e reazioni allergiche quali, ad esempio, gonfiore del viso, delle labbra, della bocca, della lingua o della gola. Ciò può determinare difficoltà respiratorie o di deglutizione.
Parimenti, molto raramente, sono stati osservati segni di un disturbo della coagulazione del sangue noto come porpora trombotica trombocitopenica (TTP), che può essere associata a febbre e sanguinamenti puntiformi, a piccole macchie, nella cute o nella mucosa orale, con o senza ittero, nonché a stanchezza o confusione marcate, inspiegate. La TTP è una malattia grave e richiede un trattamento immediato.
Se uno degli effetti collaterali sopra descritti dovesse crearle problemi notevoli o se osserva effetti collaterali qui non descritti, dovrebbe informare il suo medico o il suo farmacista. Tuttavia, non smetta di assumere BRILIQUE senza aver prima consultato il suo medico o il suo farmacista.
Di che altro occorre tener conto?
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Conservazione
Conservare nella confezione originale e a temperature non superiori a 30°C.
Tenere i medicamenti fuori dalla portata dei bambini.
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene BRILIQUE?
Principi attivi
1 compressa rivestita contiene:
Principio attivo: 60 mg o 90 mg di ticagrelor nonché sostanze ausiliarie per la fabbricazione delle compresse
1 compressa orodispersibile contiene:
Principio attivo: 90 mg di ticagrelor nonché sostanze ausiliarie per la fabbricazione delle compresse
Numero dell’omologazione
61389, 66822 (Swissmedic).
Dove è ottenibile BRILIQUE? Quali confezioni sono disponibili?
In farmacia, dietro presentazione della prescrizione medica.
Compressa rivestita da 90 mg: compresse rivestite rotonde, biconvesse, gialle, con la scritta «90» sopra una «T» su un lato. L'altro lato non reca alcuna scritta.
Compressa rivestita da 60 mg: compresse rivestite rotonde, biconvesse, di colore rosa, con la scritta «60» sopra una «T» su un lato. L'altro lato non reca alcuna scritta.
Compressa orodispersibile da 90 mg: compresse orodispersibili rotonde, piatte, con angoli smussati, di colore da bianco a rosa pallido, con la scritta «90» sopra «TI» su un lato. L'altro lato non reca alcuna scritta.
Compresse rivestite:
BRILIQUE 90 mg è disponibile in confezioni blister (confezioni calendario) da 56 e 168 compresse rivestite.
BRILIQUE 60 mg è disponibile in confezioni blister (confezioni calendario) da 56 e 168 compresse rivestite.
Compresse orodispersibili:
BRILIQUE 90 mg è disponibile in confezioni blister da 10 compresse orodispersibili.
Titolare dell’omologazione
AstraZeneca AG, 6340 Baar.
Questo foglietto illustrativo è stato controllato l'ultima volta nel novembre 2020 dall'autorità competente in materia di medicamenti (Swissmedic).
Zusammensetzung
Wirkstoffe
Ticagrelorum.
Hilfsstoffe
Excipiens pro compresso obducto.
Darreichungsform und Wirkstoffmenge pro Einheit
Filmtabletten
90 mg: Runde, bikonvexe, gelbe Filmtabletten mit der Markierung «90» über «T» auf der einen Seite. Die andere Seite ist nicht markiert. 1 Filmtablette enthält 90 mg Ticagrelor.
60 mg: Runde, bikonvexe, rosa Filmtabletten mit der Markierung «60» über «T» auf der einen Seite. Die andere Seite ist nicht markiert. 1 Filmtablette enthält 60 mg Ticagrelor.
Schmelztabletten
90 mg: Runde, flache, kantig abgeschrägte, weisse bis blass rosa Schmelztabletten mit der Markierung «90» über «TI» auf der einen Seite. Die andere Seite ist nicht markiert.
Indikationen/Anwendungsmöglichkeiten
BRILIQUE 90 mg
BRILIQUE 90 mg wird in Kombination mit Acetylsalicylsäure (ASS) zur Prävention thrombotischer Ereignisse (kardiovaskulärer Tod, Myokardinfarkt und Schlaganfall) bei Patienten mit akutem Koronarsyndrom [ACS] (instabile Angina pectoris [UA], Myokardinfarkt ohne ST- Streckenhebung [NSTEMI] bzw. mit ST-Streckenhebung [STEMI]) angewendet. Hierzu zählen Patienten unter medikamentöser Therapie sowie solche, die mittels perkutaner Koronarintervention (PCI) oder koronarer Bypassoperation (CABG) behandelt werden.
BRILIQUE 60 mg
BRILIQUE 60 mg wird in Kombination mit Acetylsalicylsäure (ASS) zur Prävention thrombotischer Ereignisse (kardiovaskulärer Tod, Myokardinfarkt und Schlaganfall) bei Patienten mit anamnestisch bekanntem Myokardinfarkt, der mindestens 12 Monate zurück liegt angewendet. Zusätzlich müssen diese Patienten mindestens einen weiteren kardiovaskulären Risikofaktor aufweisen (siehe «Klinische Wirksamkeit»).
Dosierung/Anwendung
Dosierung
BRILIQUE 90 mg
Bei Patienten mit einem akuten Koronarsyndrom sollte die Behandlung mit BRILIQUE mit einer Initialdosis von 180 mg (zwei Tabletten zu 90 mg) eingeleitet und danach mit einer Dosis von 90 mg zweimal täglich fortgeführt werden.
Die Behandlung sollte über einen Zeitraum von mindestens 12 Monaten fortgeführt werden, ausser wenn ein Absetzen von BRILIQUE klinisch angezeigt ist (siehe «Eigenschaften/Wirkungen»).
Patienten unter BRILIQUE sollten täglich auch eine tiefe Erhaltungsdosis ASS von 75-150 mg einnehmen (siehe «Eigenschaften/Wirkungen»), ausser dies ist ausdrücklich kontraindiziert. Bei Patienten mit akutem Koronarsyndrom ist eine initiale Aufsättigungsdosis von ASS empfohlen.
Im Anschluss an eine 12-monatige Behandlung ihres akuten Ereignisses mit BRILIQUE 90 mg zweimal täglich können Patienten mit persistent erhöhtem Risiko zur Entwicklung eines thrombotischen Ereignisses die Behandlung mit 60 mg BRILIQUE zweimal täglich fortsetzen. Ein hohes Risiko ist definiert durch das Vorliegen von mindestens einem weiteren kardiovaskulären Risikofaktor (siehe «Klinische Wirksamkeit»).
BRILIQUE 60 mg
Bei Patienten mit anamnestisch bekanntem Myokardinfarkt, der mindestens 12 Monate zurückliegt, ist keine initiale Aufsättigungsdosis von BRILIQUE erforderlich, und die empfohlene Dosis beträgt 60 mg zweimal täglich. Die Datenlage hinsichtlich der Wirksamkeit und Sicherheit einer Dauerbehandlung mit BRILIQUE 60 mg über 3 Jahre hinaus ist begrenzt. Daher sollte das Nutzen-Risiko-Verhältnis dieser Behandlung in regelmässigen Abständen während Routineuntersuchungen individuell bewertet werden, vor allem bei einem Behandlungszeitraum von mehr als 3 Jahren.
Patienten unter BRILIQUE 60 mg sollten täglich auch eine tiefe Erhaltungsdosis ASS von 75-150 mg einnehmen, ausser dies ist ausdrücklich kontraindiziert.
Die Patienten können die Behandlung mit BRILIQUE 60 mg unabhängig von ihrer vorherigen antithrombozytären Therapie und unabhängig davon, ob die Therapie unterbrochen wurde oder nicht, beginnen. Die Patienten sollten ihre aktuelle antithrombozytäre Therapie absetzen, bevor sie zum nächsten geplanten Einnahmezeitpunkt mit BRILIQUE 60 mg, kombiniert mit niedrig dosierter ASS, beginnen.
Art der Anwendung
Filmtabletten:
Für Patienten, welche BRILIQUE nicht als ganze Tabletten schlucken können, ist es möglich, BRILIQUE Tabletten zu feinem Pulver zu zerdrücken, mit einem halben Glas Wasser zu mischen und sofort zu trinken. Das Glas soll mit einem weiteren halben Glas Wasser gespült und der Inhalt sofort getrunken werden. Die aufgelöste Tablette kann ebenfalls via Magensonde (CH8 oder grösser) verabreicht werden. Es ist wichtig, dass die Sonde nach der Verabreichung gut mit Wasser durchgespült wird.
Schmelztabletten:
Die 90-mg Schmelztabletten können als Alternative zu den BRILIQUE 90‑mg‑Filmtabletten bei Patienten verwendet werden, die Schwierigkeiten beim Schlucken der Filmtabletten haben. Die Schmelztablette sollte auf die Zunge gelegt werden, wo sie sich schnell im Speichel auflöst. Die aufgelöste Schmelztablette kann dann mit oder ohne Wasser geschluckt werden (siehe «Pharmakokinetik»). Die Schmelztablette kann auch in Wasser aufgelöst und anschliessend über eine nasogastrale Sonde (CH8 oder grösser) verabreicht werden. Es ist wichtig, dass die nasogastrale Sonde nach der Verabreichung des Gemisches mit Wasser gespült wird. Eine 60-mg-Schmelztablette ist nicht erhältlich.
BRILIQUE Film- oder Schmelztabletten können unabhängig von den Mahlzeiten eingenommen werden.
Ausgelassene Dosis
Unterbrechungen der Therapie sollten vermieden werden. Hat ein Patient die Einnahme von BRILIQUE versäumt, sollte er lediglich die nächste Dosis zum geplanten Zeitpunkt einnehmen.
Umstellung von einer anderen antithrombozytären Therapie auf BRILIQUE
Bei der Umstellung von einer alternativen antithrombozytären Therapie auf BRILIQUE nach einem vorausgehenden ACS-Ereignis sollten die betreffenden Patienten die erste BRILIQUE-Dosis 24 Stunden nach Gabe der letzten Dosis des zuvor eingesetzten Thrombozytenaggregationshemmers einnehmen (siehe «Eigenschaften/Wirkungen»).
Das vorzeitige Absetzen einer antithrombozytären Therapie einschliesslich BRILIQUE könnte angesichts der Grunderkrankung des Patienten mit einem erhöhten Risiko eines kardiovaskulären Todes, Myokardinfarktes oder Schlaganfalls einhergehen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Bei Patienten mit einem akuten Koronarsyndrom sollte die Aufsättigungsdosis von 180 mg so bald wie möglich gegeben werden, unabhängig davon, welche antithrombozytäre Therapie der Patient zuvor erhalten hat.
Spezielle Dosierungsanweisungen:
Patienten mit Leberfunktionsstörungen
Bei Patienten mit leichter Leberfunktionsstörung ist keine Dosisanpassung nötig. BRILIQUE wurde bei Patienten mit schwerer Leberfunktionsstörung nicht untersucht, und für Patienten mit mässiger Leberfunktionsstörung gibt es nur beschränkt Informationen (siehe «Kontraindikationen», «Warnhinweise und Vorsichtsmassnahmen» sowie «Pharmakokinetik»).
Patienten mit Nierenfunktionsstörungen
Bei Patienten mit Nierenfunktionsstörungen ist keine Dosisanpassung nötig (siehe «Pharmakokinetik»).
Ältere Patienten
Bei älteren Patienten ist keine Dosisanpassung nötig (siehe «Pharmakokinetik»).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von BRILIQUE wurden bei Kindern unter 18 Jahren in dem für Erwachsene zugelassenen Anwendungsgebiet nicht nachgewiesen.
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe.
Aktive pathologische Blutung.
Vorgeschichte einer intrakraniellen Blutung (siehe «Unerwünschte Wirkungen»).
Schwere Leberfunktionsstörung (siehe «Dosierung/Anwendung», «Warnhinweise und Vorsichtsmassnahmen» sowie «Pharmakokinetik»).
Langzeitbehandlung bei Patienten mit einer schweren gastrointestinalen Blutung innerhalb der vergangenen 6 Monate.
Gleichzeitige Verabreichung von BRILIQUE mit starken CYP3A4 Inhibitoren (z.B. Ketoconazol, Clarithromycin, Nefazodon, Ritonavir und Atazanavir).
Warnhinweise und Vorsichtsmassnahmen
Blutungsrisiko
Wie bei anderen Thrombozytenaggregationshemmern besteht ein erhöhtes Blutungsrisiko, einschliesslich intrakranieller Blutungen, bei der Behandlung mit BRILIQUE. Bei Patienten mit einem bekannten erhöhten Blutungsrisiko, sollte die Anwendung von BRILIQUE gegen den Nutzen bei der Vorbeugung thrombotischer Ereignisse abgewogen werden. Bei Patienten mit intrakraniellen Blutungen in der Vorgeschichte ist die Anwendung von BRILIQUE kontraindiziert. BRILIQUE sollte ausserdem bei den folgenden Patientengruppen mit Vorsicht eingesetzt werden:
- Patienten mit einer Blutungsneigung (z.B. aufgrund eines kürzlich erlittenen Traumas, einer grösseren Operation innerhalb der vergangenen 30 Tage, einer intrakraniellen oder Rückenmarks-Operation innerhalb der vergangenen 5 Jahre, einer mässigen Leberfunktionsstörung, einer aktiven oder kürzlich aufgetretenen gastrointestinalen Blutung) oder Patienten mit erhöhtem Risiko für traumatische Blutungen inklusive traumatischer intrakranieller Blutungen. Die Anwendung von BRILIQUE ist kontraindiziert bei Patienten mit einer aktiven pathologischen Blutung, bei Patienten mit einer intrakraniellen Blutung in der Vorgeschichte und schwerer Leberfunktionsstörung (siehe «Kontraindikationen»).
- Patienten mit Begleitmedikation, die das Blutungsrisiko erhöht, z.B. andere Thrombozytenaggregationshemmern (P2Y12-ADP-Rezeptor-Antagonisten, GPIIb/IIIa Inhibitoren) nicht-steroidale Antirheumatika (NSAIDS), chronische Behandlung mit niedermolekularem Heparin, orale Antikoagulantien (Vitamin K Antagonisten, neue orale Antikoagulantien) und/oder Fibrinolytika innerhalb von 24 Stunden einer Gabe von BRILIQUE).
Patienten mit vorangegangenem ischämischen Schlaganfall
Patienten mit akutem Koronarsyndrom und vorangegangenem ischämischen Schlaganfall können über einen Zeitraum bis zu 12 Monaten mit BRILIQUE 90 mg behandelt werden (PLATO-Studie). In die PEGASUS-Studie wurden Patienten mit anamnestisch bekanntem Myokardinfarkt in Kombination mit einem vorangegangenen ischämischen Schlaganfall nicht eingeschlossen. Angesichts fehlender Daten wird daher bei der Behandlung über 12 Monate hinaus zu Vorsicht geraten.
Die antithrombotische Wirkung von BRILIQUE konnte in gesunden Probanden durch Thrombozytentransfusion nicht aufgehoben werden. Ein klinischer Nutzen der Thrombozytentransfusion in Patienten mit Blutungen ist unwahrscheinlich.
Da die gleichzeitige Gabe von BRILIQUE und Desmopressin die Blutungszeit («template-bleeding time») nicht verminderte, dürfte Desmopressin beim Management von klinischen Blutungsereignissen nicht wirksam sein.
Eine antifibrinolytische Therapie (Aminocapronsäure oder Tranexamsäure) und/oder Therapie mit rekombinantem Faktor VIIa kann die Hämostase steigern. Die Therapie mit BRILIQUE kann wieder aufgenommen werden, nachdem die Ursache der Blutung ausgemacht und die Blutung unter Kontrolle gebracht wurde.
Operationen
- Wenn bei einem Patienten eine Operation erforderlich ist, sollte der Arzt das individuelle klinische Profil des Patienten sowie Nutzen und Risiken einer weiteren antithrombotischen Therapie berücksichtigen, wenn darüber entschieden wird, wann die Behandlung mit BRILIQUE abgesetzt werden sollte.
- Aufgrund der reversiblen Bindung von Ticagrelor erfolgt die Wiederherstellung der Thrombozytenaggregation unter BRILIQUE rascher als unter Clopidogrel. In der OFFSET Studie fiel die mittlere Inhibition der Thrombozytenaggregation (IPA) unter BRILIQUE 72 Stunden nach Verabreichung vergleichbar aus wie die mittlere IPA unter Clopidogrel 120 Stunden nach Verabreichung. Das schnellere Aussetzen der Wirkung könnte ein geringeres Risiko von Blutungskomplikationen prognostizieren, z.B. in Situationen, in denen die antithrombotische Therapie aufgrund einer Operation oder eines Traumas vorübergehend abgesetzt werden muss (siehe «Eigenschaften/Wirkungen»).
- Bei Patienten der PLATO Studie, die sich einer koronaren Bypassoperation unterzogen haben, fiel die Häufigkeit von Major-Blutungen unter BRILIQUE an allen Tagen nach Beendigung der Therapie ähnlich aus wie unter Clopidogrel, ausser an Tag 1, an dem die Häufigkeit von Major-Blutungen unter BRILIQUE höher lag (siehe «unerwünschte Wirkungen»).
- Wenn bei einem Patienten eine elektive Operation erfolgen soll und eine antithrombotische Wirkung unerwünscht ist, sollte BRILIQUE 7 Tage vor der Operation abgesetzt werden.
Patienten mit mässiger Leberfunktionsstörung
Die Erfahrung mit BRILIQUE bei Patienten mit mässiger Leberfunktionsstörung ist begrenzt. Bei diesen Patienten ist daher Vorsicht angebracht. Die Anwendung von BRILIQUE ist bei Patienten mit schwerer Leberfunktionsstörung kontraindiziert (siehe «Dosierung/Anwendung», «Kontraindikationen» sowie «Pharmakokinetik»).
Patienten mit einem Risiko bradykarder Ereignisse
Die Überwachung mittels Holter-EKG hat während der Behandlung mit Ticagrelor, verglichen mit Clopidogrel, eine erhöhte Häufigkeit von meist asymptomatischen ventrikulären Pausen gezeigt. Patienten mit einem erhöhten Risiko für bradykarde Ereignisse (z.B. Patienten ohne Herzschrittmacher, die Sinusknotensyndrom, AV-Block II. oder III. Grades oder bradykardiebedingte Synkopen aufweisen) wurden von den Hauptstudien ausgeschlossen, in denen die Sicherheit und Wirksamkeit von Ticagrelor bewertet wurden. Daher sollte Ticagrelor aufgrund der begrenzten klinischen Erfahrung bei diesen Patienten mit Vorsicht angewendet werden (siehe «Eigenschaften/Wirkungen»).
Zusätzlich sollte die gleichzeitige Anwendung von BRILIQUE mit Arzneimitteln, die bekanntermassen eine Bradykardie auslösen, mit Vorsicht erfolgen. Allerdings wurden in der PLATO-Studie nach gleichzeitiger Anwendung von einem oder mehreren Arzneimitteln, die bekanntermassen eine Bradykardie auslösen (z.B. 96% Betablocker, 33% Kalziumkanalblocker Diltiazem und Verapamil und 4% Digoxin), keine Hinweise auf klinisch signifikante unerwünschte Wechselwirkungen beobachtet (siehe «Interaktionen»).
Innerhalb der PLATO-Studie wurde eine Holter-Substudie durchgeführt. In dieser hatten unter BRILIQUE mehr Patienten während der akuten Phase ihres Koronarsyndroms (ACS) ventrikuläre Pausen ≥3 Sekunden als unter Clopidogrel. Der durch das Holter-EKG ermittelte Anstieg von ventrikulären Pausen unter BRILIQUE war bei Patienten mit chronischer Herzinsuffizienz während der akuten Phase des Koronarsyndroms höher als in der Gesamtpopulation der Studie. Nach einem Monat Behandlung mit BRILIQUE zeigte sich kein Unterschied mehr zur Gesamtpopulation oder im Vergleich zu Clopidogrel. Bei dieser Patientenpopulation waren mit diesem Ungleichgewicht (einschliesslich Synkope oder Implantation eines Herzschrittmachers) keine nachteiligen klinischen Folgen verbunden (siehe «Eigenschaften/Wirkungen»).
Dyspnoe
Dyspnoe wurde bei mit BRILIQUE behandelten Patienten beobachtet. Die Dyspnoe ist üblicherweise von leichter bis mittelschwerer Intensität und geht oft zurück, ohne dass ein Absetzen der Therapie erforderlich ist. Patienten mit Asthma/COPD haben unter BRILIQUE möglicherweise ein erhöhtes absolutes Risiko, eine Dyspnoe zu erleiden (siehe «Unerwünschte Wirkungen»). BRILIQUE sollte bei Patienten mit Asthma und/oder COPD in der Vorgeschichte mit Vorsicht angewendet werden. Der zugrunde liegende Mechanismus wurde noch nicht geklärt (siehe auch «Eigenschaften/Wirkungen» - Adenosin-Mechanismus). Sollte ein Patient über eine neu aufgetretene Dyspnoe oder eine Verlängerung bzw. Verschlechterung einer bestehenden Dyspnoe berichten, so sollte dies vollständig abgeklärt werden, und falls nicht toleriert, sollte die Behandlung mit BRILIQUE beendet werden.
Thrombotisch-thrombozytopenische Purpura (TTP)
In Zusammenhang mit der Anwendung von BRILIQUE wurde sehr selten über Thrombotisch-thrombozytopenische Purpura berichtet. Die TTP ist eine schwerwiegende Erkrankung und erfordert eine sofortige Behandlung.
Interferenz mit Labortests
Thrombozyten-Funktionstests zur Diagnostizierung einer Heparin-induzierten Thrombozytopenie (HIT)
Bei Patienten, die Ticagrelor erhalten hatten, wurde über falsch-negative Ergebnisse von Thrombozyten-Funktionstest auf Heparin-induzierte Thrombozytopenie (HIT) berichtet. Dies hängt damit zusammen, dass in dem Test eine Hemmung des P2Y12-Rezeptors auf den Thrombozyten gesunder Spender durch Ticagrelor im Serum/Plasma des Patienten erfolgt. Für die Interpretation von Thrombozyten-Funktionstests auf HIT werden Informationen zur gleichzeitigen Behandlung mit Ticagrelor benötigt.
Bevor ein Absetzen von Ticagrelor in Betracht gezogen wird, sollten Nutzen und Risiko einer Fortsetzung der Therapie abgewogen werden, wobei sowohl der prothrombotische Zustand bei HIT als auch das erhöhte Blutungsrisiko bei gleichzeitiger Anwendung von Gerinnungshemmern und Ticagrelor zu berücksichtigen sind.
Sonstiges
Basierend auf der Beziehung, die in der PLATO-Studie zwischen der ASS-Erhaltungsdosis und der relativen Wirksamkeit von BRILIQUE im Vergleich zu Clopidogrel beobachtet wurde, wird eine gleichzeitige Verabreichung von BRILIQUE und hohen ASS-Erhaltungsdosen (>300 mg) nicht empfohlen (siehe «Eigenschaften/Wirkungen»).
Eine gleichzeitige Verabreichung von BRILIQUE mit starken CYP3A4-Inhibitoren (z.B. Ketoconazol, Clarithromycin, Nefazodon, Ritonavir und Atazanavir) ist kontraindiziert, da es im Fall einer gleichzeitigen Anwendung zu einem erheblichen Anstieg der Ticagrelor-Exposition kommen kann (siehe «Interaktionen»).
Von einer gleichzeitigen Verabreichung von BRILIQUE und starken CYP3A4 induzierenden Substanzen (z.B. Rifampicin, Phenytoin, Carbamazepin, Phenobarbital, Johanniskraut) wird abgeraten, da die gleichzeitige Anwendung zu einer Verringerung der Konzentration und Wirksamkeit von Ticagrelor führen könnten (siehe «Interaktionen»).
Eine gleichzeitige Verabreichung von BRILIQUE mit CYP3A4 Substraten mit einer engen therapeutischen Breite (z.B. Cisaprid und Mutterkornalkaloide) wird nicht empfohlen, weil BRILIQUE die Exposition dieser Substanzen erhöhen kann. Die gleichzeitige Einnahme von BRILIQUE mit Dosen von Simvastatin oder Lovastatin grösser als 40 mg wird nicht empfohlen.
Wenn Digoxin oder Medikamente mit Einfluss auf die Hämostase zusammen mit BRILIQUE verabreicht werden, sind engmaschige klinische und laborchemische Kontrollen erforderlich.
Potente P-Glykoprotein (P-gp)-Inhibitoren (z.B. Verapamil, Chinidin, Cyclosporin) erhöhen die Ticagrelor-Konzentration. Wenn diese Kombination unvermeidbar ist, sollte deren gleichzeitige Anwendung mit Vorsicht erfolgen.
Therapieabbruch
Patienten, bei welchen die Behandlung mit BRILIQUE abgebrochen werden muss, tragen ein erhöhtes Risiko von kardialen Ereignissen oder Schlaganfall. Eine vorzeitige Beendigung der Therapie sollte vermieden werden. Wenn BRILIQUE aufgrund einer unerwünschten Wirkung vorübergehend abgesetzt werden muss, sollte die Behandlung so schnell wie möglich wiederaufgenommen werden, wenn der Nutzen der Behandlung das Risiko des unerwünschten Ereignisses überwiegt oder wenn die unerwünschte Wirkung abgeklungen ist (siehe «Dosierung/Anwendung»).
Interaktionen
Ticagrelor ist vor allem ein CYP3A4-Substrat und ein leichter Inhibitor von CYP3A4. Ticagrelor ist ebenfalls ein P-gp-Substrat und ein schwacher P-gp-Inhibitor und erhöht möglicherweise die Konzentration von P-gp-Substraten.
Wirkung anderer Arzneimittel auf Ticagrelor
Über CYP3A4 metabolisierte Arzneimittel
Starke CYP3A4-Inhibitoren: Die gleichzeitige Gabe von Ketoconazol und Ticagrelor bewirkte einen Anstieg der Cmax und AUC von Ticagrelor um das 2.4- bzw. 7.3-fache. Die Cmax und AUC des aktiven Metaboliten waren um 89% bzw. 56% reduziert. Da davon auszugehen ist, dass andere starke CYP3A4-Inhibitoren (Clarithromycin, Nefazodon, Ritonavir und Atazanavir) ähnliche Wirkungen besitzen, ist die gleichzeitige Anwendung mit BRILIQUE kontraindiziert (siehe «Kontraindikationen»).
Moderate CYP3A4-Inhibitoren: Die gleichzeitige Gabe von Diltiazem und Ticagrelor bewirkte einen Anstieg der Cmax und AUC von Ticagrelor um 69% bzw. 174% und verminderte die Cmax des aktiven Metaboliten um 38%, während die AUC des aktiven Metaboliten unverändert war. Eine Einzeldosis von 90 mg Ticagrelor besass keine Auswirkungen auf die Diltiazemspiegel im Plasma. Andere moderate CYP3A4-Inhibitoren (z.B. Amprenavir, Aprepitant, Erythromycin, Fluconazol, Verapamil und Grapefruitsaft) haben vermutlich ähnliche Wirkungen und können ebenfalls zusammen mit BRILIQUE angewendet werden.
Cyclosporin (PgP und CYP3A-Inhibitor)
Die gleichzeitige Verabreichung von Cyclosporin (600 mg) mit Ticagrelor erhöhte Ticagrelor Cmax und AUC um 130% bzw. 183%. Die AUC des aktiven Metaboliten war in Gegenwart von Cyclosporin um 33% erhöht und die Cmax um 15% verringert. Ticagrelor hatte keinen Einfluss auf die Cyclosporin Blutspiegel.
CYP3A4-Induktoren: Die gleichzeitige Gabe von Rifampicin und Ticagrelor ging mit einer Verminderung der Cmax und AUC von Ticagrelor um 73% bzw. 86% einher. Die Cmax des aktiven Metaboliten war unverändert, und die AUC des aktiven Metaboliten war um 46% reduziert. Andere CYP3A4-Induktoren (z.B. Phenytoin, Carbamazepin, Phenobarbital und Johanniskraut) dürften die Ticagrelor-Exposition ebenfalls vermindern und könnten die Wirksamkeit von Ticagrelor einschränken.
Andere
Klinische Studien zu pharmakologischen Wechselwirkungen haben gezeigt, dass die gleichzeitige Anwendung von Ticagrelor und Heparin, Enoxaparin und ASS keinerlei Auswirkungen auf die Plasmaspiegel von Ticagrelor oder seines aktiven Metaboliten hatte. Sofern klinisch indiziert, sollten Arzneimittel, die die Hämostase verändern, in Kombination mit BRILIQUE mit Vorsicht angewendet werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Es liegen keine Daten über die gleichzeitige Anwendung von BRILIQUE und potenten P-gp-Inhibitoren (z.B. Verapamil, Chinidin, Cyclosporin) vor, die die Konzentration von Ticagrelor erhöhen könnten. Sofern klinisch indiziert, sollte die gleichzeitige Anwendung mit Vorsicht erfolgen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Eine verzögerte oder verringerte Exposition gegenüber oralen P2Y12-Inhibitoren, einschliesslich Ticagrelor und seines aktiven Metaboliten, wurde bei mit Morphin behandelten Patienten berichtet (ca. 35% Reduktion bei Ticagrelor). Diese Interaktion kann mit der reduzierten gastrointestinalen Motilität im Zusammenhang stehen und daher auch für andere Opioide gelten. Die klinische Relevanz ist unbekannt.
Wirkung von Ticagrelor auf andere Arzneimittel
Über CYP3A4 metabolisierte Arzneimittel
Ticagrelor ist ein leichter CYP3A4-Inhibitor. Die gleichzeitige Anwendung von BRILIQUE und CYP3A4-Substraten mit engen therapeutischen Indizes (z.B. Cisaprid oder Mutterkornalkaloide) wird nicht empfohlen, da Ticagrelor die Konzentration dieser Arzneimittel erhöhen kann (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Simvastatin: Die gemeinsame Gabe von Ticagrelor und Simvastatin bewirkte einen Anstieg der Cmax und AUC von Simvastatin um 81% bzw. 56% und erhöhte die Cmax und AUC von Simvastatinsäure um 64% bzw. 52%, wobei einzelne Anstiege um das 2- bis 3-fache verzeichnet wurden.
Die gleichzeitige Anwendung von Ticagrelor mit Simvastatindosen von mehr als 40 mg täglich könnte Nebenwirkungen von Simvastatin verursachen und sollte gegenüber dem möglichen Nutzen abgewogen werden. Eine Einzeldosis von 80 mg Simvastatin hatte keinen Effekt auf die Plasmaspiegel von Ticagrelor. Ticagrelor hat möglicherweise ähnliche Wirkungen auf Lovastatin. Die gleichzeitige Anwendung von BRILIQUE und Dosen von Simvastatin oder Lovastatin, die grösser sind als 40 mg wird nicht empfohlen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Atorvastatin: Die gleichzeitige Gabe von Atorvastatin und Ticagrelor bewirkte einen Anstieg der Cmax und AUC von Atorvastatinsäure um 23% bzw. 36%. Ähnliche Anstiege von AUC und Cmax wurden bei allen Atorvastatinsäure-Metaboliten beobachtet. Diese Anstiege gelten nicht als klinisch bedeutsam.
Ein ähnlicher Effekt auf andere Statine, die über CYP3A4 verstoffwechselt werden, kann nicht ausgeschlossen werden. 93% der Patienten der PLATO-Studie nahmen verschiedene Statine ein. Es kamen in dieser Kohorte keine Bedenken über die Sicherheit im Zusammenhang mit der Einnahme mit Statinen auf.
Über CYP2C9 metabolisierte Arzneimittel
Tolbutamid
Die kombinierte Anwendung von Ticagrelor und Tolbutamid führte zu keiner Veränderung der Plasmaspiegel. Eine Einzeldosis von 500 mg Tolbutamid hatte keinen Einfluss auf die Plasmaspiegel von Ticagrelor. Dies deutet darauf hin, dass es sich bei Ticagrelor nicht um einen CYP2C9-Inhibitor handelt und eine Veränderung der CYP2C9-vermittelten Metabolisierung von Arzneimitteln wie Warfarin und Tolbutamid unwahrscheinlich ist.
Pharmakodynamische Interaktionen mit Vitamin K Antagonisten können jedoch nicht ausgeschlossen werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Orale Kontrazeptiva
Bei gleichzeitiger Gabe von Ticagrelor und Levonorgestrel und Ethinylestradiol erhöhte sich die Exposition gegenüber Ethinylestradiol um ungefähr 20%, während die Pharmakokinetik von Levonorgestrel unverändert blieb. Es wird keine klinisch relevante Wirkung auf die Wirksamkeit von oralen Kontrazeptiva erwartet, wenn Levonorgestrel und Ethinylestradiol gemeinsam mit BRILIQUE angewendet werden.
Über CYP2D6-metabolisierte Arzneimittel – Venlafaxin
Bei der gleichzeitigen Verabreichung von Ticagrelor und Venlafaxin resultieren keine Veränderungen in der AUC und Cmax von O-Desmethylvenlafaxine bzw. der AUC von Venlafaxin. Die Cmax von Venlafaxin war nach Gabe einer Einzeldosis von Ticagrelor um 22% erhöht. Venlafaxin hatte keinen Einfluss auf die Ticagrelor-Plasmaspiegel. Diese Resultate deuten darauf hin, dass Ticagrelor kein CYP2D6-Inhibitor ist, und es unwahrscheinlich ist, dass Ticagrelor den über CYP2D6 vermittelten Metabolismus von Arzneimitteln wie Venlafaxin oder Metoprolol beeinflusst.
P-glykoprotein(P-gp)-Substrate
Die gleichzeitige Anwendung von Ticagrelor führte zu einem Anstieg der Cmax von Digoxin um 75% und der AUC um 28%. Die mittlere Cmin von Digoxin wurde bei gleichzeitiger Anwendung von Ticagrelor um 30% erhöht, wobei es in Einzelfällen zu einer maximalen Erhöhung auf das 2-fache kam. In Gegenwart von Digoxin wurden die Cmax und die AUC von Ticagrelor und seinem aktiven Metaboliten nicht beeinflusst. Daher wird eine geeignete klinische Überwachung und/oder Kontrolle der Laborwerte empfohlen, wenn PgP-abhängige Wirkstoffe mit einem engen therapeutischen Index, z.B. Digoxin oder Cyclosporin, gemeinsam mit BRILIQUE angewendet werden.
Andere Begleittherapien
Aufgrund der Beobachtung meist asymptomatischer ventrikulärer Pausen und Bradykardie sollte die gleichzeitige Anwendung von BRILIQUE zusammen mit Arzneimitteln, die bekanntermassen eine Bradykardie auslösen, mit Vorsicht erfolgen (siehe «Warnhinweise und Vorsichtsmassnahmen»). Allerdings wurden in der PLATO Studie nach gleichzeitiger Anwendung von einem oder mehreren Arzneimitteln, die bekanntermassen eine Bradykardie auslösen (z.B. 96% Betablocker, 33% Kalziumkanalblocker Diltiazem und Verapamil und 4% Digoxin), keine Hinweise auf klinisch signifikante Nebenwirkungen beobachtet.
In klinischen Studien wurde BRILIQUE je nach Bedarf aufgrund von Begleiterkrankungen häufig langfristig zusammen mit ASS, Protonenpumpenhemmern, Statinen, Betablockern, Angiotensin- Converting-Enzyme-Hemmern und Angiotensin-Rezeptorblockern und kurzfristig auch mit Heparin, niedermolekularem Heparin und intravenösen GP-IIb/IIIa-Inhibitoren angewendet. Es wurden keine Anzeichen für klinisch signifikante unerwünschte Wechselwirkungen mit diesen Arzneimitteln beobachtet.
Wegen potenzieller pharmakodynamischer Wechselwirkungen sollte eine gleichzeitige Anwendung von BRILIQUE und Arzneimitteln, die bekanntermassen die Hämostase verändern, mit Vorsicht erfolgen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Aufgrund von Berichten über abnormale kutane Blutungen mit SSRI (z.B. Paroxetin, Sertralin und Citalopram) wird bei gleichzeitiger Anwendung von SSRI mit BRILIQUE zur Vorsicht geraten, da dieses das Blutungsrisiko erhöhen kann.
Schwangerschaft/Stillzeit
Es wurden keine klinischen Studien mit schwangeren oder stillenden Frauen durchgeführt.
Schwangerschaft
Es liegen keine bzw. nur begrenzte Daten zur Anwendung von BRILIQUE bei Schwangeren vor. In Tierstudien zeigte sich Reproduktionstoxizität (siehe «Präklinische Daten»). BRILIQUE sollte nicht während der Schwangerschaft angewendet werden, es sei denn es ist klar notwendig.
Stillzeit
Es ist nicht bekannt, ob Ticagrelor beim Menschen in die Muttermilch übergeht. Studien an Ratten haben gezeigt, dass Ticagrelor und der aktive Metabolit in die Muttermilch ausgeschieden werden. BRILIQUE sollte nicht während der Stillzeit angewendet werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen von BRILIQUE auf die Fahrtüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Es wird angenommen, dass BRILIQUE keinen oder einen nur vernachlässigbaren Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen hat. Während der Behandlung mit BRILIQUE wurde über Schwindel und Verwirrtheit berichtet. Patienten, bei denen diese Symptome auftreten, sollten daher beim Steuern eines Fahrzeugs oder Bedienen von Maschinen vorsichtig sein.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Die Sicherheit von BRILIQUE wurde in zwei grossen Phase-III-Endpunktstudien (PLATO und PEGASUS) mit insgesamt mehr als 39'000 Patienten untersucht (siehe «Eigenschaften/Wirkungen»). Die relevanten unerwünschten Arzneimittelwirkungen, die in diesen Studien beobachtet wurden, werden unten diskutiert.
Die Sicherheit von BRILIQUE 90 mg bei Patienten mit akutem Koronarsyndrom (UA, NSTEMI und STEMI) wurde in der PLATO-Studie beurteilt. In dieser Studie wurden Patienten unter Behandlung mit BRILIQUE 90 mg zweimal täglich mit Patienten unter Clopidogrel 75 mg einmal täglich, jeweils in Kombination mit ASS und anderen Standardtherapien, verglichen.
In der PLATO-Studie lag die mediane Dauer der Behandlung mit BRILIQUE 90 mg bei 277 Tagen. Die mit BRILIQUE 90 mg behandelten Patienten hatten eine höhere Inzidenz von Therapieabbrüchen aufgrund von Nebenwirkungen als mit Clopidogrel behandelte Patienten (7.4% vs. 5.4%).
Die Sicherheit von BRILIQUE bei Patienten mit anamnestisch bekanntem Myokardinfarkt, welcher mindestens 12 Monate zurück liegt, und einem hohen Risiko zur Entwicklung thrombotischer Ereignisse wurde in der PEGASUS-Studie untersucht, in der Patienten unter Behandlung mit BRILIQUE 60 mg zweimal täglich oder 90 mg zweimal täglich kombiniert mit ASS mit Patienten unter einer alleinigen ASS-Therapie und anderen Standardtherapien verglichen wurden. Die mediane Behandlungsdauer für BRILIQUE 60 mg betrug 29.4 Monate. In der PEGASUS-Studie zeigte sich bei Patienten unter BRILIQUE eine höhere Inzidenz von Therapieabbrüchen wegen unerwünschter Ereignisse als bei Patienten unter einer alleinigen ASS-Therapie (16.1% für BRILIQUE 60 mg mit ASS vs. 8.5% für eine alleinige ASS-Therapie).
Die bei Patienten unter Ticagrelor am häufigsten gemeldeten, unerwünschten Ereignisse waren Blutungen und Dyspnoe.
Die folgenden unerwünschten Arzneimittelwirkungen wurden in den klinischen Phase-III-Studien PEGASUS und PLATO festgestellt.
Die unerwünschten Arzneimittelwirkungen wurden nach MedDRA-Organklasse und Häufigkeit klassifiziert. Die Häufigkeitskategorien sind wie folgt definiert: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1000, <1/100), selten (≥1/10'000, <1/1000).
Gutartige, bösartige und unspezifische Neubildungen (einschl. Zysten und Polypen)
Gelegentlich: Tumorblutungen (z.B. Blutung von Blasenkarzinom, Magenkarzinom, Dickdarmkarzinom).
Erkrankungen des Blutes und des Lymphsystems
Sehr häufig: Blutungen aufgrund gestörter Hämostase (z.B. erhöhte Neigung zu Blutergüssen, spontane Hämatome, hämorrhagische Diathese) (10.3%).
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: erhöhter Harnsäurespiegela (22.1%).
Häufig: Gicht.
Psychiatrische Erkrankungen
Gelegentlich: Verwirrtheit.
Erkrankungen des Nervensystems
Häufig: Schwindel, Synkope.
Gelegentlich: Intrakranielle Blutung (d.h. spontane, eingriffsbedingte oder traumatische intrakranielle Blutungen).
Augenerkrankungen
Gelegentlich: Augenblutungen (z.B. intraokular, konjunktival, retinal).
Erkrankungen des Ohrs und des Labyrinths
Häufig: Vertigo.
Gelegentlich: Blutungen im Ohr.
Gefässerkrankungen
Häufig: Hypotonie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Sehr häufig: Dyspnoe (15.7%).
Häufig: Blutungen der Atemwege (z.B. Epistaxis, Hämoptyse).
Erkrankungen des Gastrointestinaltrakts
Häufig: Gastrointestinale Blutung (z.B. Zahnfleischblutung, rektale Blutung, Blutung aus Magengeschwür), Durchfall, Übelkeit.
Gelegentlich: Retroperitoneale Blutung.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Subkutane oder dermale Blutung (z.B. Ekchymose, Hautblutung, Petechien), Pruritus.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Muskuläre Blutung (z.B. Hämarthrose, Muskelblutung).
Erkrankungen der Nieren und Harnwege
Häufig: Blutung im Harntrakt (z.B. Hämaturie, hämorrhagische Zystitis).
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gelegentlich: Blutungen des Reproduktionssystems (z.B. vaginale Blutung, Hämatospermie, postmenopausale Blutung).
Untersuchungen
Häufig: Anstieg der Kreatininwerte im Bluta.
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen
Häufig: Blutungen nach Eingriffen, traumatische Blutung (z.B. Kontusion, traumatisches Hämatom, traumatische hämorrhagische Blutung).
aHäufigkeiten wurden von Laboruntersuchungen abgeleitet (Harnsäure bis >ULN vom Ausgangswert unterhalb oder innerhalb des Referenzbereichs. Anstieg des Kreatins um >50% vom Ausgangswert) und nicht von der Rohinzidenz von Berichten von unerwünschten Ereignissen.)
Unerwünschte Wirkungen nach Markteinführung
Die folgenden unerwünschten Wirkungen wurden nach Markteinführung von BRILIQUE beobachtet. Da diese Daten auf freiwilliger Meldung basieren und von einer unbekannten Populationsgrösse stammen, ist es nicht immer möglich, die Häufigkeit verlässlich zu schätzen.
Erkrankungen des Immunsystems
Überempfindlichkeitsreaktionen, einschliesslich Angioödem (siehe «Kontraindikationen»).
Erkrankungen der Haut und des Unterhautzellgewebes
Ausschlag.
Erkrankungen des Blutes:
Thrombotisch-thrombozytopenische Purpura (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Beschreibung ausgewählter Nebenwirkungen
Ergebnisse zu Blutungsereignissen aus PLATO
Hauptausschlusskriterien waren ein erhöhtes Risiko für Blutungen, klinisch bedeutsame Thrombozytopenie oder Anämie, intrakranielle Blutungen in der Vorgeschichte, gastrointestinale Blutung innerhalb der vergangenen 6 Monate oder eine grössere Operation innerhalb der vergangenen 30 Tage. Das Gesamtresultat zu Blutungsereignissen in der PLATO-Studie ist in Tabelle 1 dargestellt.
Tabelle 1: Analyse der allgemeinen Blutungsereignisse, Kaplan-Meier-Schätzung der Blutungsraten nach Behandlung in Monat 12 (PLATO)
Sicherheits-Endpunkte | BRILIQUE 90 mg zweimal täglich | Clopidogrel 75 mg einmal täglich | p-Wert | |
KM % | Hazard Ratio | |||
Blutungen nach PLATO-Definition | ||||
Gesamt Major-Blutungen | 11.6 | 1.04 (0.95, 1.13) | 11.2 | 0.4336 |
Tödliche/lebensbedrohliche Blutungen | 5.8 | 1.03 (0.90, 1.16) | 5.8 | 0.6988 |
Gesamt Major- + Minor-Blutungen kombiniert | 16.1 | 1.11 (1.03, 1.20) | 14.6 | 0.0084 |
Nicht-CABG-Major-Blutungen | 4.5 | 1.19 (1.02, 1.38) | 3.8 | 0.0264 |
Nicht-eingriffsbedingte Major-Blutungen | 3.1 | 1.31 (1.08, 1.60) | 2.3 | 0.0058 |
Nicht-eingriffsbedingte Major- + Minor-Blutungen | 5.9 | 1.39 (1.21, 1.60) | 4.3 | <0.0001 |
TIMI-definierte Blutungskategorie | ||||
Major-Blutungen | 7.9 | 1.03 (0.93, 1.15) | 7.7 | 0.5669 |
Major- + Minor-Blutungen | 11.4 | 1.05 (0.96, 1.15) | 10.9 | 0.3272 |
In der PLATO-Studie wurden die folgenden Definitionen für Blutungen verwendet:
«Tödliche/lebensbedrohliche Major-Blutung»: tödliche, jegliche intrakranielle oder intraperikardiale Blutung mit Herztamponade; oder mit hypovolämischem Schock oder schwere Hypotonie bei Notwendigkeit einer Gabe von Vasopressoren/inotrop wirkende Arzneimittel bzw. Operation; oder klinisch manifeste mit einem Hämoglobinabfall ≥5 g/dl; oder Transfusion von 4 oder mehr Einheiten
«Sonstige Major-Blutung»: Mit erheblicher Behinderung oder klinisch manifest mit einem Hämoglobinabfall von 3 bis 5 g/dl; oder Transfusion von 2-3 Einheiten (Vollblut oder Erythrozytenkonzentrat) wegen einer Blutung.
«Minor-Blutung»: Erfordert medizinischen Eingriff zum Stoppen oder zur Behandlung der Blutung.
«TIMI Major»: lebensbedrohende Blutung oder jegliche intrakranielle Blutung, oder klinisch manifeste Zeichen einer Blutung im Zusammenhang mit einem Hämoglobinabfall von ≥5 g/dl, oder, falls Hämoglobin nicht verfügbar ist, mit einer Abnahme des Hämatokrits um 15%.
«TIMI Minor»: Klinisch manifeste Blutung mit einem Hämoglobinabfall um 3-5 g/dl.
In PLATO unterschied sich die Zeitspanne bis zur ersten PLATO-definierten «Gesamt-Major»-Blutung unter BRILIQUE nicht signifikant von der entsprechenden Zeit unter Clopidogrel. In der Studie traten nur wenige tödliche Blutungsereignisse auf: 20 (0.2%) unter BRILIQUE 90 mg zweimal täglich und 23 (0.3%) unter Clopidogrel 75 mg einmal täglich. Wenn Minor-Blutungen mitberücksichtigt wurden, war die Inzidenz von PLATO-definierten Major- und Minor-Blutungsereignissen unter BRILIQUE signifikant höher als unter Clopidogrel. Die allgemeinen Auftrittsraten von TIMI-definierten Blutungsereignissen unterschieden sich zwischen BRILIQUE und Clopidogrel nicht signifikant.
CABG-bedingte Blutung: In PLATO trat bei 42% der 1584 Patienten (12% der Kohorte) mit einer CABG-Operation eine «Tödliche/lebensbedrohliche Major-Blutung» nach PLATO-Definition auf. Es gab keinen Unterschied zwischen den Behandlungsgruppen. Tödliche CABG-Blutungen traten bei 6 Patienten in jeder Behandlungsgruppe auf (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Nicht-CABG-bedingte Blutung und nicht-Eingriffs-bedingte Blutung: BRILIQUE und Clopidogrel unterschieden sich nicht im Hinblick auf Nicht-CABG-bedingte, PLATO-definierte, tödliche/lebensbedrohliche Major-Blutungen. Allerdings kam es unter BRILIQUE häufiger zu PLATO-definierten «Gesamt-Major»-, TIMI-Major- und TIMI-Major- + Minor-Blutungen. Gleichermassen traten, wenn alle durch einen Eingriff bedingten Blutungen herausgerechnet wurden, unter BRILIQUE mehr Blutungen auf als unter Clopidogrel (Tabelle 1). Ein Absetzen der Therapie aufgrund von nicht durch einen Eingriff bedingten Blutungen war unter BRILIQUE häufiger (2.9%) als unter Clopidogrel (1.2%; p <0.001).
Weder Alter, Geschlecht, Gewicht, ethnische Abstammung, geographische Region, Begleiterkrankungen, Begleittherapien noch medizinische Vorgeschichte, einschliesslich Schlaganfall oder transitorische ischämische Attacke in der Vorgeschichte, liessen auf eine allgemeine oder nicht-eingriffsbedingte PLATO-definierte Major-Blutung schliessen. Es wurde keine besondere Gruppe mit erhöhtem Risiko für Blutungen ausgemacht.
Intrakranielle Blutung: Es gab unter BRILIQUE mehr intrakranielle, nicht durch einen Eingriff bedingte Blutungen (n= 27 Blutungen bei 26 Patienten, 0.3%) als unter Clopidogrel (n= 14 Blutungen, 0.2%), wobei 11 Blutungen unter BRILIQUE und 1 unter Clopidogrel tödlich waren. Es gab keinen Unterschied bei den tödlichen Blutungen insgesamt. Die Inzidenz intrakranieller Blutungen war angesichts der signifikanten Komorbiditäten und kardiovaskulären Risikofaktoren im untersuchten Patientenkollektiv in beiden Behandlungsgruppen niedrig.
Ergebnisse zu Blutungsereignissen in PEGASUS
Hauptausschlusskriterien waren der geplante Gebrauch von Arzneimitteln, die zu einem erhöhten Blutungsrisiko führen können; Blutungsstörungen oder eine Vorgeschichte von Schlaganfall oder intrakraniellen Blutungen; Zentralnervensystemtumor; intrakranielle Gefässanomalie; gastrointestinale Blutung innerhalb der vergangenen 6 Monate, intrakranielle oder Rückenmarks-Operation innerhalb der vergangenen 5 Jahre oder eine grössere Operation innerhalb der vergangenen 30 Tage.
Das Gesamtresultat zu Blutungsereignissen in der PEGASUS-Studie ist in Tabelle 2 dargestellt.
Tabelle 2 – Analyse der allgemeinen Blutungsereignisse, Kaplan-Meier-Schätzung der Blutungsraten nach Behandlung in Monat 36 (PEGASUS)
BRILIQUE 60 mg zweimal täglich + ASS | ASS alleine | |||
Sicherheits-Endpunkte | KM % | Hazard Ratio | KM % | p-Wert |
TIMI-definierte Blutungskategorien | ||||
Major | 2.3 | 2.32 (1.68, 3.21) | 1.1 | <0.0001 |
Tödlich | 0.3 | 1.00 (0.44, 2.27) | 0.3 | 1.0000 |
Intrakranielle Blutungen | 0.6 | 1.33 (0.77, 2.31) | 0.5 | 0.3130 |
Andere Major | 1.6 | 3.61 (2.31, 5.65) | 0.5 | <0.0001 |
Major oder Minor | 3.4 | 2.54 (1.93, 3.35) | 1.4 | <0.0001 |
Major oder Minor oder ärztliche Behandlung erfordernd | 16.6 | 2.64 (2.35, 2.97) | 7.0 | <0.0001 |
PLATO-definierte Blutungskategorien | ||||
Major | 3.5 | 2.57 (1.95, 3.37) | 1.4 | <0.0001 |
Tödlich/Lebensbedrohlich | 2.4 | 2.38 (1.73, 3.26) | 1.1 | <0.0001 |
Andere Major | 1.1 | 3.37 (1.95, 5.83) | 0.3 | <0.0001 |
Major oder Minor | 15.2 | 2.71 (2.40, 3.08) | 6.2 | <0.0001 |
Definition der Blutungskategorien:
TIMI Major: Tödliche Blutung, ODER jegliche intrakranielle Blutung, ODER klinisch manifeste Blutungszeichen in Verbindung mit einem Abfall des Hämoglobins (Hb) um ≥5 g/dl oder, falls kein Hb-Wert zur Verfügung steht, mit einem Abfall des Hämatokrits (Hct) um ≥15%.
Tödlich: Ein Blutungsereignis, das direkt zum Tod innerhalb von 7 Tagen führte.
Andere TIMI Major: Nichttödliche, nicht-intrakranielle TIMI-Major-Blutung.
TIMI Minor: Klinisch manifeste Blutung mit einem Abfall des Hämoglobins um 3-5 g/dl.
TIMI Ärztliche Behandlung erfordernd: Eine Intervention erfordernd, ODER eine Hospitalisierung erfordernd ODER eine Untersuchung erfordernd.
PLATO Major Tödlich/Lebensbedrohlich: Tödliche Blutung, ODER jegliche intrakranielle Blutung, ODER intraperikardiale Blutung mit Herztamponade, ODER mit hypovolämischem Schock oder schwerer Hypotonie, die eine Behandlung mit Pressoren/Inotropika oder einen chirurgischen Eingriff erfordert ODER klinisch manifest mit einem Abfall des Hämoglobins um >50 g/L ODER ≥4 transfundierte Erythrozyteneinheiten.
Andere PLATO Major: Eine erhebliche Behinderung verursachend, ODER klinisch manifest mit einem Abfall des Hämoglobins um 3-5 g/dl, ODER 2-3 transfundierte Erythrozyteneinheiten.
PLATO Minor: Medizinische Intervention erforderlich, um Blutung zu stoppen oder zu behandeln.
In der PEGASUS-Studie traten TIMI-Major-Blutungen unter BRILIQUE 60 mg zweimal täglich häufiger auf als unter ASS allein. Im Vergleich zu einer alleinigen ASS-Therapie wurde im Hinblick auf tödliche Blutungen kein erhöhtes Blutungsrisiko verzeichnet, und es wurde nur ein leichter Anstieg intrakranieller Blutungen beobachtet. In der Studie kam es nur zu wenigen tödlichen Blutungsereignissen: 11 (0.3%) unter BRILIQUE 60 mg und 12 (0.3%) unter alleiniger ASS-Therapie. Das unter BRILIQUE 60 mg beobachtete höhere Risiko von TIMI-Major-Blutungen beruhte in erster Linie auf einer grösseren Häufigkeit von Blutungen der Kategorie «Andere TIMI Major», die wiederum durch Ereignisse im Gastrointestinaltrakt bedingt waren.
Ähnliche Muster von erhöhten Blutungsereignissen wie im Fall von TIMI-Major-Blutungen wurden auch für die Blutungskategorien «TIMI Major oder Minor» sowie «PLATO Major» und «PLATO Major oder Minor» dokumentiert (siehe Tabelle 2). Zu Therapieabbrüchen wegen Blutungen kam es unter BRILIQUE 60 mg häufiger als unter alleiniger ASS-Therapie (6.2% bzw. 1.5%). Diese Blutungen waren überwiegend weniger schwerwiegend (klassifiziert als «TIMI Ärztliche Behandlung erfordernd»), z.B. Epistaxis, Blutergüsse und Hämatome.
Das Blutungsprofil von BRILIQUE 60 mg fiel in den zahlreichen vorab definierten Subgruppen (z.B. Alter, Geschlecht, Gewicht, Rasse, geographische Region, Begleiterkrankungen, Begleitmedikationen und medizinische Anamnese) für Blutungsereignisse der Kategorien «TIMI Major», «TIMI Major oder Minor» und «PLATO Major» einheitlich aus.
Intrakranielle Blutung: Spontane intrakranielle Blutungen wurden unter BRILIQUE 60 mg und einer alleinigen ASS-Therapie mit ähnlicher Häufigkeit berichtet (n=13, 0.2% in beiden Behandlungsgruppen). Traumatische und eingriffsbedingte intrakranielle Blutungen traten unter Behandlung mit BRILIQUE 60 mg etwas häufiger auf (n=15, 0.2%) als unter alleiniger ASS-Therapie (n=10, 0.1%). Insgesamt kam es zu 6 tödlichen intrakraniellen Blutungen unter BRILIQUE 60 mg und zu 5 tödlichen intrakraniellen Blutungen unter alleiniger ASS-Therapie. Die Inzidenz intrakranieller Blutungen war angesichts der signifikanten Komorbiditäten und kardiovaskulären Risikofaktoren im untersuchten Patientenkollektiv in beiden Behandlungsgruppen niedrig.
Dyspnoe
In PLATO wurde bei 13.8% der mit BRILIQUE 90 mg zweimal täglich, und bei 7.8% der mit 75 mg Clopidogrel behandelten Patienten über Dyspnoe als Nebenwirkung berichtet. Dyspnoesymptome waren meist von leichter bis mittelschwerer Intensität und besserten häufig, ohne dass ein Therapieabbruch nötig war. Dyspnoe trat meist zu Beginn der Behandlung auf; 87% der Patienten mit Dyspnoe hatten nur eine einzige Episode.
Dyspnoe als schwerwiegende Nebenwirkung wurde bei 0.7% der mit BRILIQUE behandelten Patienten und bei 0.4% bei mit Clopidogrel behandelten Patienten festgestellt. Patienten, die über Dyspnoe berichteten, waren in der Regel älter und hatten schon vor Behandlungsbeginn häufiger Dyspnoe, Herzinsuffizienz, COPD oder Asthma. Die Resultate von PLATO lassen nicht darauf schliessen, dass die höhere Häufigkeit unter BRILIQUE auf eine neue oder sich verschlechternde Herz- oder Lungenkrankheit zurückzuführen ist (siehe «Eigenschaften/Wirkungen» - Adenosin-Mechanismus). Es gab keine Hinweise auf eine nachteilige Wirkung von BRILIQUE auf die Lungenfunktion (siehe «Warnhinweise und Vorsichtsmassnahmen»).
In der PEGASUS-Studie wurde bei 14,2% der Patienten unter BRILIQUE 60 mg zweimal täglich und bei 5,5% der Patienten unter alleiniger ASS-Therapie über Dyspnoe berichtet. Wie in der PLATO-Studie war die Dyspnoe in den meisten Fällen von leichter bis mittelschwerer Intensität (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Gegenwärtig ist kein Antidot bekannt, das Wirkungen von Ticagrelor rückgängig macht, und Ticagrelor dürfte nicht dialysierbar sein (siehe «Warnhinweise und Vorsichtsmassnahmen»). Die Behandlung einer Überdosierung sollte nach der medizinischen Standardpraxis vor Ort erfolgen. Die zu erwartende Wirkung einer starken Überdosierung von Ticagrelor ist die mit der Thrombozytenaggregationshemmung verbundene verlängerte Dauer des Blutungsrisikos. Falls es zu Blutungen kommt, sollten geeignete unterstützende Massnahmen ergriffen werden. Ticagrelor wird in Einzeldosen bis zu 900 mg gut vertragen. In einer Studie mit ansteigenden Einzeldosen erwies sich eine gastrointestinale Toxizität als dosislimitierend. Andere klinisch bedeutsame Nebenwirkungen, die bei einer Überdosierung auftreten können, sind Dyspnoe und ventrikuläre Pausen (siehe «Unerwünschte Wirkungen»).
Im Fall einer Überdosierung sollte auf diese möglichen Nebenwirkungen geachtet sowie eine EKG-Überwachung in Betracht gezogen werden.
Eigenschaften/Wirkungen
ATC-Code
B01AC24
Wirkungsmechanismus
BRILIQUE enthält als Wirkstoff Ticagrelor, einen Stoff der chemischen Klasse der Cyclopentyl-Triazolopyrimidine (CPTP). Es handelt sich um einen oralen, direkt wirkenden, selektiven und reversibel bindenden P2Y12-Rezeptor- Antagonisten, der in der Lage ist, die Adenosindiphospat (ADP)-vermittelte P2Y12-abhängige Thrombozytenaktivierung und -aggregation zu verhindern. Ticagrelor verhindert dabei nicht die Bindung des Rezeptors mit ADP, sondern verhindert mit seiner Bindung an den P2Y12–Rezeptor die ADP-induzierte Signalübertragung.
Da Thrombozyten an der Auslösung und/oder Entwicklung thrombotischer Komplikationen bei Atherosklerose beteiligt sind, kann eine Hemmung der Thrombozytenfunktion das Risiko kardiovaskulärer Ereignisse wie Herz-Tod, Myokardinfarkt oder Schlaganfall vermindern.
Ticagrelor verfügt über einen weiteren Wirkmechanismus, indem es über eine Hemmung des equilibrativen Nukleosidtransporters-1 (ENT-1) einen Anstieg der lokalen endogenen Adenosinspiegel herbeiführt. Adenosin wird bei vorhandener Hypoxie und Gewebeschädigung durch Abbau von freigesetztem Adenosintriphosphat und -diphosphat (ATP und ADP) lokal synthetisiert. Da der Abbau von Adenosin im Wesentlichen auf den Intrazellularraum beschränkt ist, führt die Hemmung von ENT-1 durch Ticagrelor zu einer Verlängerung der Halbwertszeit von Adenosin. Ticagrelor besitzt keine klinisch bedeutsame unmittelbare Wirkung auf Adenosinrezeptoren (A1, A2A, A2B, A3) und wird nicht zu Adenosin verstoffwechselt. Es wurden zahlreiche Adenosinwirkungen dokumentiert, hierzu zählen: Vasodilatation, Thrombozytenhemmung, Modulation von Entzündung und Induktion von Dyspnoe, welche zum klinischen Profil von Ticagrelor beitragen dürften.
Pharmakodynamik
Einsetzen der Wirkung
Die Hemmung der Thrombozytenaggregation (IPA = Inhibition of Platelet Aggregation) durch Ticagrelor und Clopidogrel wurde in einer 6-wöchigen Studie untersucht, in der bei Patienten mit stabiler koronarer Herzkrankheit (KHK) unter ASS sowohl akute als auch chronische thrombozytenhemmende Effekte in Reaktion auf 20 µM ADP als Agonist der Thrombozytenaggregation beurteilt wurden. Das Einsetzen der Wirkung wurde nach einer Aufsättigungsdosis von 180 mg Ticagrelor oder 600 mg Clopidogrel bewertet.
Ticagrelor zeigt ein rasches Einsetzen der pharmakologischen Wirkung, was sich 0.5 Stunden nach einer Initialdosis von 180 mg in einer mittleren Hemmung der Thrombozytenaggregation für Ticagrelor von ca. 41% zeigte, mit einem maximalen IPA-Effekt von 89%, der bis zu 2-4 Stunden nach Dosierung erreicht wurde und zwischen 2-8 Stunden anhielt. Bei 90% der Patienten betrug 2 Stunden nach Dosierung das endgültige Ausmass der IPA >70%.
Aussetzen der Wirkung
Wenn eine CABG geplant ist, ist das Blutungsrisiko durch Ticagrelor verglichen mit Clopidogrel erhöht, wenn es weniger als 96 Stunden vor dem Eingriff abgesetzt wird.
Daten zur Therapieumstellung
Die Umstellung von Clopidogrel 75 mg einmal täglich auf BRILIQUE 90 mg zweimal täglich führt zu einem absoluten IPA-Anstieg um 26.4%, umgekehrt geht eine Umstellung von BRILIQUE auf Clopidogrel mit einer absoluten IPA-Reduktion um 24.5% einher. Die Therapie kann von Clopidogrel auf BRILIQUE umgestellt werden, ohne dass die Thrombozyten hemmende Wirkung unterbrochen wird (siehe «Dosierung/Anwendung»).
Adenosin-Mechanismus (ENT-1)
Ticagrelor führte bei ACS-Patienten zu einem Anstieg der Adenosinkonzentration im Plasma und bewirkte eine Verstärkung verschiedener physiologischer Reaktionen auf Adenosin. Adenosin ist ein Vasodilatator; es wurde gezeigt, dass Ticagrelor bei gesunden Freiwilligen und ACS-Patienten die adenosininduzierte Steigerung des koronaren Blutflusses erhöht. Adenosin ist ein endogener Thrombozytenhemmer; es wurde nachgewiesen, dass Ticagrelor die adenosinvermittelte Hemmung der Thrombozytenaggregation verstärkt, und zwar zusätzlich zur Thrombozytenhemmung über seinen P2Y12-Antagonismus. Ebenso induziert Adenosin Dyspnoe; es wurde nachgewiesen, dass Ticagrelor bei gesunden Freiwilligen eine adenosininduzierte Dyspnoe verstärkt. Daher ist nicht auszuschliessen, dass die bei manchen Patienten unter Ticagrelor zu beobachtende Dyspnoe (siehe «Unerwünschte Wirkungen») teilweise adenosinvermittelt ist.
Klinische Wirksamkeit
Die klinische Evidenz für die Wirksamkeit von BRILIQUE stammt aus zwei Phase-III-Studien:
- Aus der PLATO-Studie [PLATO = PLATelet Inhibition and Patient Outcomes], ein Vergleich von BRILIQUE mit Clopidogrel, jeweils verabreicht in Kombination mit ASS und anderen Standardtherapien. (Akutes Koronarsyndrom)
- Aus der Studie PEGASUS TIMI-54 [PEGASUS = PrEvention with TicaGrelor of SecondAry Thrombotic Events in High-RiSk AcUte Coronary Syndrome Patients], ein Vergleich von BRILIQUE in Kombination mit ASS mit einer alleinigen ASS-Therapie. (Langzeitbehandlung bei anamnestisch bekanntem Myokardinfarkt und Vorliegen weiterer kardiovaskulären Risikofaktoren)
PLATO-Studie (Akutes Koronarsyndrom)
Die PLATO Studie untersuchte 18'624 Patienten, bei denen innerhalb von 24 Stunden Symptome einer instabilen Angina pectoris (IA), eines Myokardinfarktes ohne ST-Strecken-Hebung (NSTEMI) oder eines Myokardinfarktes mit ST-Strecken-Hebung (STEMI) auftraten und die bereits medizinisch behandelt wurden, oder bei denen eine perkutane Koronarintervention (PCI) oder eine aortokoronare Bypass-Operation (CABG) durchgeführt wurde (siehe «Indikationen/Anwendungsmöglichkeiten»).
Vor dem Hintergrund einer täglichen ASS-Einnahme zeigte BRILIQUE 90 mg bei zweimal täglicher Einnahme eine Überlegenheit gegenüber Clopidogrel 75 mg täglich, im Hinblick auf die Prävention des kombinierten Endpunkts kardiovaskulärer (CV)-Tod, Myokardinfarkt (MI), oder Schlaganfall, wobei die Differenz hauptsächlich auf CV-Tod und MI zurückzuführen war. Die Patienten erhielten eine 300-mg-Initialdosis von Clopidogrel (600 mg möglich im Falle von PCI) oder 180 mg BRILIQUE.
Das Ergebnis zeichnete sich früh ab (absolute Risikoreduktion [ARR] 0,6% und relative Risikoreduktion [RRR] von 12% nach 30 Tagen), und ergab aufgrund einer konstanten Wirkung der Therapie während des gesamten Zeitraums von 12 Monaten eine ARR von 1,9% pro Jahr mit einer RRR von 16%. Dies deutet darauf hin, dass es angebracht ist, die Patienten bis zu 12 Monate lang mit BRILIQUE zu behandeln (siehe «Dosierung/Anwendung»). Wenn 54 Patienten mit akutem Koronarsyndrom mit BRILIQUE anstelle von Clopidogrel behandelt werden, so verhindert dies 1 atherothrombotisches Ereignis; die Behandlung von 91 Patienten verhindert 1 CV-Tod (siehe Abbildung 1 und Tabelle 3).
Die Wirkung der Behandlung mit BRILIQUE verglichen mit Clopidogrel zeigt sich durchgängig in vielen Subgruppen, wie z.B. Gewicht; Geschlecht; medizinische Vorgeschichte von Diabetes mellitus, transitorischer ischämischer Attacke oder nicht-hämorrhagischem Schlaganfall oder Revaskularisierung; Begleittherapien einschliesslich Heparin, GP-IIb/IIIa-Hemmern und Protonenpumpenhemmern (siehe «Interaktionen»); abschliessende Diagnose des Indexereignisses (STEMI, NSTEMI oder instabile Angina pectoris) und geplante Behandlungsmethode bei der Randomisierung (invasiv oder medikamentös).
Eine leicht signifikante Interaktion zwischen der Therapie und der Region wurde beobachtet. Die Hazard Ratio zum primären Endpunkt war in Nordamerika, was ungefähr 10% der gesamten untersuchten Studienpopulation darstellt, für Clopidogrel günstiger, während weltweit in allen anderen Regionen BRILIQUE günstiger war (p-Wert für die Interaktion = 0.045). Explorative Analysen deuten auf einen möglichen Zusammenhang mit der ASS-Dosis hin, da eine reduzierte Wirksamkeit bei BRILIQUE mit erhöhten ASS-Dosen beobachtet wurde. Dauerhafte, BRILIQUE begleitende ASS-Tagesdosen sollten 75-150 mg betragen (siehe «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
Abbildung 1 zeigt das geschätzte Risiko für die Zeit bis zum ersten Auftreten eines Ereignisses des zusammengesetzten Wirksamkeitsendpunkts.
Abbildung 1: Zeit bis zum ersten Auftreten von kardiovaskulärem (CV) Tod, Myokardinfarkt und Schlaganfall (PLATO)

BRILIQUE verminderte sowohl in der instabilen Angina pectoris/NSTEMI als auch in der STEMI-Population das Auftreten des zusammengesetzten primären Endpunkts im Vergleich zu Clopidogrel.
Tabelle 3: Analyse der Primären und sekundären Wirksamkeits-Endpunkte in PLATO
Primärer Endpunkt (EP) | Patienten mit Ereignissen | ||||
BRILIQUE 90 mg zweimal täglich | Clopidogrel einmal täglich 75 mg | Reduktion des Relativen Risikosa | Hazard Ratio | p-Wert | |
Zusammengesetzter EP aus CV-Tod/MI (ausser stummer MI)/Schlaganfall | 9.3 | 10.9 | 16 | 0.84(0.77,0.92) | p=0.0003 |
CV-Tod | 3.8 | 4.8 | 21 | 0.79(0.69,0.91) | p=0.0013 |
MI (ausser stummer MI) | 5.4 | 6.4 | 16 | 0.84(0.75,0.95) | p=0.0045 |
Schlaganfall | 1.3 | 1.1 | -17 | 1.17(0.91,1.52) | p=0.2249 |
Sekundäre Endpunkte | |||||
Zusammengesetzter EP aus CV-Tod/MI (ausser stummer MI)/Schlaganfall – geplante invasive Behandlung | 8.5 | 10.0 | 16 | 0.84(0.75,0.94) | p=0.0025 |
Zusammengesetzter EP aus Gesamtmortalität/MI (ausser stummer MI)/Schlaganfall | 9.7 | 11.5 | 16 | 0.84(0.77,0.92) | p=0.0001 |
Zusammengesetzter EP aus CV-Tod/allen MI/Schlaganfall/SRIb/RIc/TIAd/Andere ATEe | 13.8 | 15.7 | 12 | 0.88(0.81,0.95) | p=0.0006 |
Gesamtmortalität | 4.3 | 5.4 | 22 | 0.78(0.69,0.89) | p=0.0003** |
a RRR= (1-Hazard Ratio) × 100%. Negative Werte für die Reduktion des relativen Risikos entsprechen einem Anstieg des relativen Risikos
** nominaler p-Wert, nicht formal statistisch signifikant durch ein vorher festgelegtes hierarchisches Testverfahren
b SRI= Severe Recurrent Cardiac Ischaemia
c RI= Recurrent Cardiac Ischaemia
d TIA= Transitional Ischaemic Attack
e ATE= Arterial Thrombotic Events
Holter-Substudie
Um das Auftreten ventrikulärer Pausen und anderer arrhythmischer Episoden während PLATO zu untersuchen, führten die Prüfärzte ein Holter-Monitoring in einer Untergruppe von annähernd 3'000 Patienten durch. Bei ca. 2'000 dieser Patienten wurde ein EKG sowohl während der akuten Phase des ACS als auch nach einem Monat durchgeführt. Die primär interessierende Variable war das Auftreten ventrikulärer Pausen ≥3 Sekunden. In der akuten Phase hatten unter BRILIQUE mehr Patienten ventrikuläre Pausen (6,0%) als unter Clopidogrel (3,5%); nach einem Monat traf dies für 2,2% bzw. 1,6% zu (siehe «Warnhinweise und Vorsichtsmassnahmen»). Der Anstieg von ventrikulären Pausen in der akuten Phase eines ACS war ausgeprägter bei BRILIQUE-Patienten mit chronischer Herzinsuffizienz in der Vorgeschichte (9,2% versus 5,4% bei Patienten ohne chronische Herzinsuffizienz in der Vorgeschichte; bei Clopidogrel-Patienten 4,0% bei denen mit versus 3,6% bei denen ohne chronische Herzinsuffizienz in der Vorgeschichte). Dieses Ungleichgewicht trat nicht nach einem Monat auf: 2,0% versus 2,1% für BRILIQUE-Patienten mit bzw. ohne chronische Herzinsuffizienz in der Vorgeschichte; und 3,8% versus 1,4% bei Clopidogrel. Bei dieser Patientengruppe waren mit diesem Ungleichgewicht keine negativen klinischen Folgen verbunden (einschliesslich Implantation eines Schrittmachers).
PLATO genetische Substudie
Die CYP 2C19- und ABCB1-Genotypisierung von 10'285 Patienten in PLATO ergab Zusammenhänge zwischen Genotypgruppen und PLATO-Outcomes. Die Überlegenheit von BRILIQUE gegenüber Clopidogrel im Hinblick auf die Verringerung schwerwiegender kardiovaskulärer Ereignisse wurde durch den CYP 2C19- oder ABCB1-Genotyp der Patienten nicht signifikant beeinflusst. Ähnlich wie in der PLATO-Studie insgesamt gab es im Hinblick auf PLATO gesamt schwerwiegende Blutungen, unabhängig vom CYP2C19- oder ABCB1-Genotyp, keine Unterschiede zwischen BRILIQUE und Clopidogrel. Nicht-CABG-bedingte PLATO schwerwiegende Blutungen traten bei Patienten mit einem oder mehreren «Loss of function» Allelen für CYP2C19 unter BRILIQUE verglichen mit Clopidogrel häufiger auf, aber vergleichbar zu Clopidogrel-Patienten mit keinem «Loss of Function» Allel.
Zusammengesetzter kombinierter Wirksamkeits-/Sicherheits-Endpunkt
Ein zusammengesetzter kombinierter Wirksamkeits-/Sicherheits-Endpunkt (CV-Tod, MI, Schlaganfall oder PLATO-definierte «Gesamt-Major-Blutung») untermauert den klinischen Nutzen von BRILIQUE gegenüber Clopidogrel (RRR 8%, ARR 1.4%, HR 0.92; p=0.0257) über 12 Monate nach einem ACS-Ereignis.
PEGASUS-Studie (Langzeitbehandlung bei anamnestisch bekanntem Myokardinfarkt und Vorliegen weiterer kardiovaskulären Risikofaktoren)
Bei der Studie PEGASUS TIMI-54 handelt es sich um eine ereignisgesteuerte, randomisierte, doppelblinde, Placebo-kontrollierte, internationale, multizentrische Parallelgruppenstudie an 21'162 Patienten, in der die Prävention thrombotischer Ereignisse mit BRILIQUE in 2 Dosierungen (entweder 90 mg zweimal täglich oder 60 mg zweimal täglich) in Kombination mit niedrig dosierter ASS (75-150 mg) im Vergleich mit einer alleinigen ASS-Therapie bei Patienten mit anamnestisch bekanntem Myokardinfarkt und zusätzlichen Risikofaktoren für eine Atherothrombose untersucht wurde.
Risikofaktoren
Die Patienten waren für eine Studienteilnahme geeignet, wenn sie mindestens 50 Jahre alt waren, einen Myokardinfarkt in der Vorgeschichte hatten (1 bis 3 Jahre vor der Randomisierung) und mindestens einen der folgenden kardiovaskulären Risikofaktoren aufwiesen:
- einen zweiten vorangegangenen Myokardinfarkt
- dokumentierte Mehrgefäss-KHK
- Diabetes mellitus, der eine Medikation erfordert
- Alter ≥65 Jahre
- chronische nichtterminale Niereninsuffizienz.
Abbildung 2 - Kaplan-Meier-Plot und Analyse des primären klinischen kombinierten Endpunkts aus kardiovaskulärem Tod, Myokardinfarkt und Schlaganfall in PEGASUS

Tabelle 4 - Analyse der primären und der sekundären Wirksamkeitsendpunkte in PEGASUS
BRILIQUE 60 mg zweimal täglich + ASS | ASS allein | p-Wert | |||||||
|---|---|---|---|---|---|---|---|---|---|
Merkmal | Patienten mit Ereignissen | KM % | HR | Patienten mit Ereignissen | KM % | ||||
Primärer Endpunkt | |||||||||
Kombination aus kardiovaskulärem Tod/MI/Schlaganfall | 487 | 7.8% | 0.84 | 578 | 9.0% | 0.0043 (s) | |||
Kardiovaskulärer Tod | 174 | 2.9% | 0.83 | 210 | 3.4% | 0.0676 | |||
MI | 285 | 4.5% | 0.84 | 338 | 5.2% | 0.0314 | |||
Schlaganfall | 91 | 1.5% | 0.75 | 122 | 1.9% | 0.0337 | |||
Sekundärer Endpunkt | |||||||||
Kardiovaskulärer Tod | 174 | 2.9% | 0.83 | 210 | 3.4% | - | |||
Gesamtmortalität | 289 | 4.7% | 0.89 | 326 | 5.2% | - | |||
Hazard Ratio und p-Werte für BRILIQUE vs. ASS allein separat berechnet anhand eines Cox-Proportional-Hazards-Modells mit Behandlungsgruppe als einzige explanatorische Variable.
Kaplan-Meier-Prozentanteil berechnet nach 36 Monaten.
Hinweis: Die Anzahl von Erstereignissen der Komponenten kardiovaskulärer Tod, MI und Schlaganfall stellen die tatsächliche Anzahl von Erstereignissen für die jeweilige Komponente dar und werden nicht zur Anzahl der Ereignisse des kombinierten Endpunkts hinzuaddiert.
(s) Zeigt statistische Signifikanz an.
KI = Konfidenzintervall; HR = Hazard Ratio; KM= Kaplan-Meier; MI = Myokardinfarkt; N = Anzahl Patienten.
Sowohl das 60-mg- als auch das 90-mg-zweimal-täglich-BRILIQUE-Regime hat sich, jeweils in Kombination mit ASS, bei der Prävention thrombotischer Ereignisse (kombinierter Endpunkt: kardiovaskulärer Tod, Myokardinfarkt und Schlaganfall) gegenüber einer alleinigen ASS-Therapie als überlegen erwiesen. Dabei wurde während des gesamten Studienzeitraums ein konsistenter Behandlungseffekt beobachtet, der zu einer 16%igen RRR und 1.27%igen ARR im Fall von BRILIQUE 60 mg bzw. zu einer 15%igen RRR und 1.19%igen ARR im Fall von BRILIQUE 90 mg führte.
Obwohl das Wirksamkeitsprofil von BRILIQUE 90 mg und 60 mg ähnlich ausfiel, scheint die niedrigere Dosierung ein besseres Verträglichkeits- und Sicherheitsprofil im Hinblick auf das Risiko von Blutungen und Dyspnoe zu besitzen. Daher wird für die Prävention thrombotischer Ereignisse (kardiovaskulärer Tod, Myokardinfarkt und Schlaganfall) bei Patienten mit anamnestisch bekanntem Myokardinfarkt, der mindestens 12 Monate zurück liegt, und einem hohen Risiko zur Entwicklung eines thrombotischen Ereignisses eine Dosis von 60 mg BRILIQUE zweimal täglich in Kombination mit ASS empfohlen.
Im Vergleich zu ASS allein reduzierte BRILIQUE 60 mg zweimal täglich signifikant den primären kombinierten Endpunkt aus kardiovaskulärem Tod, Myokardinfarkt und Schlaganfall. Zur Reduktion des primären kombinierten Endpunkts trug jede der einzelnen Komponenten bei (kardiovaskulärer Tod 17% RRR, Myokardinfarkt 16% RRR, Schlaganfall 25% RRR).
Um ein Ereignis des primären kombinierten Endpunkts zu verhindern, ist eine Behandlung von 79 Patienten über bis zu 36 Monate mit BRILIQUE 60 mg zweimal täglich in Kombination mit ASS anstelle einer alleinigen ASS-Therapie erforderlich.
Der Nutzen von BRILIQUE hinsichtlich des primären kombinierten Endpunkts zeigte sich auch bei den beiden sekundären Endpunkten, und zwar in Form eines numerischen Rückgangs sowohl von kardiovaskulären Todesfällen als auch der Gesamtmortalität unter BRILIQUE 60 mg in Kombination mit ASS gegenüber einer alleinigen ASS-Therapie, allerdings wurde hier keine statistische Signifikanz erreicht (siehe Tabelle 4).
Die RRR für den kombinierten Endpunkt von Tag 1 bis 360 (17% RRR) und von Tag 361 und danach (16% RRR) war ähnlich. Dieser Effekt war während der gesamten Studie konsistent, mit einer Dauer von bis zu 48 Monaten (Median 33 Monate). Die Konsistenz der RRR über die Zeit deutet darauf hin, dass eine Fortführung der Behandlung mit BRILIQUE so lange angemessen ist, wie der Patient ein hohes Risiko zur Entwicklung thrombotischer Ereignisse aufweist (siehe «Dosierung/Anwendung»).
Der Behandlungseffekt von BRILIQUE 60 mg zweimal täglich gegenüber einer alleinigen ASS-Therapie war konsistent über mehrere Patienten-Subgruppen, die auf demographischen Merkmalen einschliesslich Gewicht, Geschlecht, medizinischer Anamnese und Region beruhten.
Die mit BRILIQUE verbundenen Vorteile waren zudem unabhängig von der Anwendung anderer kardiovaskulärer Therapien, darunter Lipidsenker, Betablocker, ACE-Hemmer, Angiotensin-II-Rezeptorantagonisten, Calciumkanalblocker, Nitrate und Protonenpumpenhemmer (siehe «Interaktionen»).
Pharmakokinetik
Absorption
Die Resorption von Ticagrelor erfolgt rasch, die mediane tmax beläuft sich auf rund 1.5 Stunden. Der wichtigste zirkulierende Metabolit AR-C124910XX (ebenfalls aktiv) wird mit einer medianen tmax von ungefähr 2.5 Stunden schnell gebildet. Nach oraler Anwendung von Ticagrelor 90 mg im nüchternen Zustand beträgt die Cmax 529 ng/ml und die AUC 3451 ng*h/ml. Das Verhältnis Metabolit zu Muttersubstanz beträgt 0.28 für die Cmax und 0.42 für die AUC.
Die mittlere absolute Bioverfügbarkeit von Ticagrelor wurde auf 36% geschätzt (Spannweite 25.4% bis 64.0%). Der Verzehr einer fettreichen Mahlzeit blieb ohne Einfluss auf die Cmax von Ticagrelor oder die AUC des aktiven Metaboliten, führte aber zu einem Anstieg der AUC von Ticagrelor um 21% und einer Verminderung der Cmax des aktiven Metaboliten um 22%. Die klinische Bedeutung dieser leichten Veränderungen wird als minimal betrachtet, weshalb Ticagrelor mit oder ohne Nahrung eingenommen werden kann. Sowohl Ticagrelor als auch sein aktiver Metabolit sind P-gp-Substrate.
Filmtabletten:
Ticagrelor in Form von zerstossenen und mit Wasser vermischten Tabletten, die entweder oral eingenommen oder über eine nasogastrale Sonde direkt in den Magen verabreicht werden, ist bioäquivalent mit Ticagrelor in Form von ganzen (unzerstossenen) Tabletten (AUC und Cmax innerhalb von 80-125% für Ticagrelor und den aktiven Metaboliten). Die initiale Exposition (0.5 und 1 Stunde nach Gabe) war höher bei den zerstossenen und mit Wasser vermischten Tabletten als bei den ganzen (unzerstossenen) Tabletten. Nach 2 bis 48 Stunden war das Konzentrationsprofil jedoch im Allgemeinen identisch.
Schmelztabletten:
Ticagrelor Schmelztabletten, aufgelöst im Speichel und ohne Wasser geschluckt oder in Wasser suspendiert und durch eine nasogastrale Sonde in den Magen verabreicht, waren bioäquivalent zu den geschluckten Filmtabletten (AUC und Cmax innerhalb von 80–125% der Werte für Ticagrelor und den aktiven Metaboliten). Wenn die Schmelztablette in Speichel aufgelöst und mit Wasser geschluckt wurde, war die AUC für Ticagrelor ähnlich, wobei die Cmax etwa 15% geringer war als bei der Filmtablette. Es ist unwahrscheinlich, dass die beobachtete Differenz der Cmax eine klinische Relevanz hat.
Distribution
Das Steady-State-Distributionsvolumen von Ticagrelor beträgt 87.5 l. Ticagrelor und der aktive Metabolit werden beim Menschen stark an Plasmaproteine gebunden (>99%).
Metabolismus
CYP3A ist das wichtigste Enzym für die Metabolisierung von Ticagrelor und die Bildung des aktiven Metaboliten. Die Interaktionen von Ticagrelor und seines aktiven Metaboliten mit anderen CYP3A-Substraten reichen von Aktivierung bis Hemmung. Ticagrelor und der aktive Metabolit sind schwache P-Glycoprotein-Inhibitoren.
Der wichtigste Metabolit von Ticagrelor ist AR-C124910XX. Entsprechend seiner in vitro-Bindung an den ADP-Rezeptor P2Y12 auf den Thrombozyten ist dieser Metabolit ebenfalls aktiv. Die systemische Exposition gegenüber dem aktiven Metaboliten liegt bei etwa 30-40% der Exposition gegenüber Ticagrelor.
Elimination
Ticagrelor wird in erster Linie über Metabolisierung in der Leber eliminiert. Nach Gabe von radioaktiv markiertem Ticagrelor werden im Mittel rund 84% der Radioaktivität wiedergefunden (57.8% in den Fäzes, 26.5% im Urin). Die Wiederfindungsrate von Ticagrelor und des aktiven Metaboliten im Urin liegt bei jeweils weniger als 1% der Dosis. Der aktive Metabolit wird wahrscheinlich primär biliär ausgeschieden. Die mittlere t½ lag bei etwa 6.9 Stunden (Spannweite 4.5‑12.8 Stunden) für Ticagrelor bzw. 8.6 Stunden (Spannweite 6.5-12.8 Stunden) für den aktiven Metaboliten.
Linearität/Nicht Linearität
Ticagrelor verfügt über eine lineare Pharmakokinetik über die Zeit, und die Exposition gegenüber Ticagrelor und dem aktiven Metaboliten (AR‑C124910XX) verhält sich im therapeutischen Dosisbereich nahezu dosisproportional.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Bei Patienten mit leichter Leberfunktionsstörung fielen die Cmax und AUC für Ticagrelor 12% bzw. 23% höher aus als bei entsprechenden gesunden Probanden. Bei Patienten mit leichter Leberfunktionsstörung ist keine Dosisanpassung nötig (siehe «Dosierung/Anwendung»). Ticagrelor wurde bei Patienten mit schwerer Leberfunktionsstörung nicht untersucht, und es gibt keine pharmakokinetischen Informationen von Patienten mit mässiger Leberinsuffizienz (siehe «Dosierung/Anwendung», «Kontraindikationen» bzw. «Warnhinweise und Vorsichtsmassnahmen»).
Nierenfunktionsstörungen
Die Exposition gegenüber Ticagrelor lag bei Patienten mit schwerer Nierenfunktionsstörung ungefähr 20% niedriger und gegenüber dem aktiven Metaboliten ungefähr 17% höher als bei nierengesunden Probanden. Bei Patienten mit Nierenfunktionsstörung ist keine Dosisanpassung nötig (siehe «Dosierung/Anwendung»).
Bei Patienten mit terminaler Niereninsuffizienz, die sich einer Hämodialyse unterzogen, lagen die Werte für AUC und Cmax nach Verabreichung von 90 mg Brilique an einem dialysefreien Tag um 38% bzw. 51% höher als bei Patienten mit normaler Nierenfunktion. Eine ähnliche Erhöhung der Exposition wurde beobachtet, wenn Brilique unmittelbar vor der Dialyse verabreicht wurde (49% bzw. 61%), was zeigt, dass BRILIQUE nicht dialysierbar ist. Die Exposition des aktiven Metaboliten erhöhte sich in geringerem Mass (AUC 13–14% und Cmax 17–36%). Der IPA-Effekt von Brilique war bei Patienten mit terminaler Niereninsuffizienz unabhängig von der Dialyse und ähnlich wie bei Patienten mit normaler Nierenfunktion.
Ältere Patienten
Bei älteren (≥65 Jahre) Probanden wurden im Vergleich zu jüngeren Probanden höhere Expositionen gegenüber Ticagrelor (63% für Cmax und 52% für AUC) und dem aktiven Metaboliten (ungefähr 60% für Cmaxund 48% für AUC) beobachtet. Diese Unterschiede werden nicht als klinisch bedeutsam betrachtet (siehe «Dosierung/Anwendung»).
Kinder und Jugendliche
Ticagrelor wurde in der pädiatrischen Population nicht untersucht (siehe «Dosierung/Anwendung»).
Ethnizität
Bei Patienten asiatischer Abstammung fällt die Bioverfügbarkeit im Mittel 39% höher aus als bei kaukasischen Patienten. Patienten, die sich selbst als Farbige bezeichneten, wiesen eine um 18% niedrigere Bioverfügbarkeit von Ticagrelor auf als kaukasische Patienten. In klinischen pharmakologischen Studien war die Exposition (Cmax und AUC) gegenüber Ticagrelor bei japanischen Probanden etwa 40% (20% nach Adjustierung für das Körpergewicht) höher als bei Kaukasiern. Die Exposition bei Patienten, welche sich selber als Hispanics oder Latino bezeichneten, war gleich wie diejenige bei Kaukasiern.
Geschlecht
Bei Frauen wurden im Vergleich zu Männern höhere Expositionen gegenüber Ticagrelor und dem aktiven Metaboliten verzeichnet. Die Unterschiede werden nicht als klinisch bedeutsam betrachtet.
Präklinische Daten
Basierend auf konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei einmaliger und wiederholter Gabe und zur Genotoxizität lassen die präklinischen Daten zu Ticagrelor und seinem Hauptmetaboliten (AR-C124910XX) kein unvertretbares Risiko von unerwünschten Wirkungen beim Menschen erkennen.
Die folgenden unerwünschten Reaktionen wurden nicht in klinischen Studien beobachtet, waren aber im Tiermodell bei Expositionen zu verzeichnen, die ähnlich oder höher ausfielen als bei der klinischen Prüfung, und könnten daher für die klinische Anwendung relevant sein: gastrointestinale Toxizität und gastrointestinale Reizungen.
In einer 2-jährigen Studie an Mäusen, die orale Dosen von bis zu 250 mg/kg/Tag (>18-faches der maximalen therapeutischen Humanexposition) erhalten hatten, wurden keine arzneimittelinduzierten Tumoren beobachtet. Bei männlichen Ratten kam es unter oralen Dosen von bis zu 120 mg/kg/Tag (>15-faches der maximalen therapeutischen Humanexposition) nicht zu einer Zunahme von Tumoren. Bei weiblichen Ratten war nur unter hohen Dosen (>25-faches der maximalen therapeutischen Humanexposition) ein Anstieg von uterinen Adenokarzinomen und hepatozellulären Adenomen und Adenokarzinomen sowie eine Verminderung von Hypophysenadenomen und mammären Fibroadenomen zu beobachten. Bei Applikation einer Dosis von 60 mg/kg/Tag (8-facher Unterschied zur maximalen therapeutischen Humanexposition) wurde keine Veränderung der Inzidenz von Tumoren verzeichnet. Die nur bei Ratten beobachteten uterinen Tumoren erwiesen sich als Ergebnis eines nicht-genotoxischen endokrinen Effekts einer Störung des Hormonhaushalts nach Applikation von hoch dosiertem Ticagrelor. Die gutartigen Lebertumoren werden als Folge der Reaktion der Leber auf die metabolische Belastung durch die hohen Dosen von Ticagrelor betrachtet. Die Relevanz dieser Ergebnisse für den Menschen ist zurzeit nicht abschliessend geklärt.
Ticagrelor wurde in einer Reihe von in vitro- und in vivo-Tests untersucht und hat sich dabei nicht als genotoxisch erwiesen.
Ticagrelor führte bei weiblichen Ratten zu Zyklusunregelmässigkeiten (meistens verlängerte Zyklen), hatte aber keine Auswirkungen auf die Fertilität von männlichen und weiblichen Ratten insgesamt.
Es hat sich gezeigt, dass Ticagrelor bei weiblichen Ratten unter oralen Dosen von bis zu 200 mg/kg pro Tag (ungefähr 20-faches der maximalen therapeutischen Humanexposition) und bei männlichen Ratten unter Dosen von bis zu 180 mg/kg/Tag (15.7-faches der maximalen therapeutischen Humanexposition) keinen Einfluss auf die Fertilität besitzt.
Studien mit Ratten und Kaninchen haben Reproduktionstoxizität gezeigt, bei leicht reduzierter Zunahme des Körpergewichts der Mutter und reduzierter Lebensfähigkeit und verringertem Geburtsgewicht der Neugeborenen sowie verzögertem Wachstum.
Ticagrelor besass unter oralen Dosen von bis zu 100 mg/kg pro Tag bei Ratten (5.1-faches der maximalen therapeutischen Humanexposition) bzw. bis zu 42 mg/kg pro Tag bei Kaninchen (entspricht der maximalen therapeutischen Humanexposition) keine Wirkung auf die fetale Entwicklung. Zudem blieb Ticagrelor bei Ratten unter Dosen von bis zu 60 mg/kg/Tag (4.6-faches der maximalen therapeutischen Humanexposition) ohne Auswirkungen auf die Geburt oder postnatale Entwicklung. Bei höheren Dosen mit maternaler Toxizität wurden unspezifische Effekte bei den Nachkommen beobachtet.
Sonstige Hinweise
Inkompatibilitäten
Nicht zutreffend.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
In der Originalverpackung und nicht über 30°C lagern.
Ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer
61389, 66822 (Swissmedic).
Zulassungsinhaberin
AstraZeneca AG, 6340 Baar.
Stand der Information
November 2020.
Composizione
Principi attivi
Ticagrelorum.
Sostanze ausiliarie
Excipiens pro compresso obducto.
Forma farmaceutica e quantità di principio attivo per unità
Compresse rivestite con film
90 mg: compresse rivestite con film rotonde, biconvesse, di colore giallo, con impresso «90» sopra una «T» su un lato, e lisce sull'altro lato. 1 compressa rivestita con film contiene 90 mg di ticagrelor.
60 mg: compresse rivestite con film rotonde, biconvesse, di colore rosa, con impresso «60» sopra una «T» su un lato, e lisce sull'altro lato. 1 compressa rivestita con film contiene 60 mg di ticagrelor.
Compresse orodispersibili
90 mg: compresse orodispersibili rotonde, piatte, con il bordo smussato, da bianche a rosa pallido con impresso «90» sopra una «TI» su un lato, e lisce sull'altro lato.
Indicazioni/Possibilità d'impiego
BRILIQUE 90 mg
BRILIQUE 90 mg, in associazione con acido acetilsalicilico (ASA), è indicato per la prevenzione di eventi trombotici (morte cardiovascolare, infarto miocardico e ictus) in pazienti con sindrome coronarica acuta [SCA] (angina pectoris instabile [UA], infarto miocardico senza sopraslivellamento del tratto ST [NSTEMI] o con sopraslivellamento del tratto ST [STEMI]), inclusi i pazienti in terapia con medicamenti e i pazienti trattati con intervento coronarico percutaneo (PCI) o bypass coronarico (CABG).
BRILIQUE 60 mg
BRILIQUE 60 mg, in associazione con acido acetilsalicilico (ASA), è indicato per la prevenzione di eventi trombotici (morte cardiovascolare, infarto miocardico e ictus) in pazienti con storia di infarto miocardico di almeno 12 mesi. Inoltre, i pazienti devono presentare almeno un ulteriore fattore di rischio cardiovascolare (cfr. «Efficacia clinica»).
Posologia/Impiego
Posologia
BRILIQUE 90 mg
Nei pazienti con sindrome coronarica acuta, il trattamento con BRILIQUE deve essere iniziato con una dose da carico da 180 mg (due compresse da 90 mg) e proseguito successivamente con una dose da 90 mg due volte al giorno.
Si raccomanda di proseguire il trattamento almeno per 12 mesi, a meno che l'interruzione della terapia con BRILIQUE sia clinicamente indicata (cfr. «Proprietà/effetti»).
I pazienti in trattamento con BRILIQUE devono anche assumere quotidianamente una bassa dose di mantenimento di ASA compresa tra 75 e 150 mg (cfr. «Proprietà/effetti»), a meno che non sia specificatamente controindicato. Nei pazienti con sindrome coronarica acuta, si raccomanda una dose da carico iniziale di ASA.
Dopo 12 mesi di trattamento dell'evento acuto con BRILIQUE 90 mg due volte al giorno, i pazienti che continuano a essere a rischio elevato di sviluppare un evento trombotico possono continuare il trattamento con BRILIQUE 60 mg due volte al giorno. Il rischio elevato è definito dalla presenza di almeno un altro fattore di rischio cardiovascolare (cfr. «Efficacia clinica»).
BRILIQUE 60 mg
Nei pazienti con storia di infarto miocardico di almeno 12 mesi, non è richiesta una dose da carico iniziale di BRILIQUE e la dose raccomandata è di 60 mg due volte al giorno. I dati sull'efficacia e la sicurezza dell'uso di BRILIQUE 60 mg oltre i 3 anni di trattamento prolungato sono limitati. Il rapporto rischi/benefici di tale trattamento deve quindi essere valutato regolarmente e individualmente in occasione dei controlli di routine, soprattutto se il trattamento viene continuato per più di 3 anni.
I pazienti in trattamento con BRILIQUE 60 mg devono anche assumere quotidianamente una bassa dose di mantenimento di ASA compresa tra 75 e 150 mg, a meno che non sia specificatamente controindicato.
I pazienti possono iniziare il trattamento con BRILIQUE 60 mg indipendentemente dalla loro precedente terapia antipiastrinica e dall'interruzione o meno della terapia. I pazienti devono interrompere la loro attuale terapia antipiastrinica prima di iniziare il trattamento con BRILIQUE 60 mg in associazione ad ASA a basso dosaggio al momento previsto per l'assunzione della dose successiva.
Modo di somministrazione
Compresse rivestite con film:
Per i pazienti che non sono in grado di deglutirle intere, le compresse di BRILIQUE possono essere frantumate in una polvere fine, mescolate in mezzo bicchiere d'acqua e bevute immediatamente. Il bicchiere deve essere sciacquato con un ulteriore mezzo bicchiere d'acqua e il contenuto bevuto immediatamente. La compressa disciolta può inoltre essere somministrata attraverso un sondino gastrico (CH8 o più grande). Dopo la somministrazione è importante irrigare il sondino con acqua.
Compresse orodispersibili:
Le compresse orodispersibili da 90 mg possono essere usate come alternativa a BRILIQUE 90 mg compresse rivestite con film per i pazienti che hanno difficoltà a deglutire le compresse rivestite con film. La compressa orodispersibile deve essere posta sulla lingua, dove sarà rapidamente dispersa nella saliva. La compressa orodispersibile può poi essere deglutita con o senza acqua (cfr. «Farmacocinetica»). La compressa orodispersibile può anche essere dispersa in acqua e quindi somministrata attraverso un sondino naso-gastrico (CH8 o più grande). Dopo la somministrazione della miscela è importante irrigare il sondino naso-gastrico con acqua. Non è disponibile una compressa orodispersibile da 60 mg.
Le compresse rivestite con film o orodispersibili di BRILIQUE possono essere somministrate durante i pasti o lontano dai pasti.
Dose dimenticata
Devono essere evitate interruzioni nella continuità del trattamento. Il paziente che salta una dose di BRILIQUE deve assumere solo la dose successiva all'orario stabilito.
Passaggio da un'altra terapia antipiastrinica a BRILIQUE
Quando passano da un'altra terapia antipiastrinica a BRILIQUE dopo un precedente evento di SCA, i pazienti devono assumere la prima dose di BRILIQUE 24 ore dopo l'ultima dose dell'altro antiaggregante piastrinico (cfr. «Proprietà/effetti»).
L'interruzione prematura di qualunque terapia antipiastrinica, compresa quella con BRILIQUE, potrebbe causare un maggiore rischio di morte per cause cardiovascolari, di infarto miocardico o ictus dovuti alla malattia di base del paziente (cfr. «Avvertenze e misure precauzionali»).
Nei pazienti con sindrome coronarica acuta, la dose da carico da 180 mg deve essere somministrata il più presto possibile, indipendentemente dalla terapia antipiastrinica che il paziente ha ricevuto in precedenza.
Istruzioni posologiche speciali:
Pazienti con disturbi della funzionalità epatica
Non è necessario alcun aggiustamento della dose nei pazienti con funzionalità epatica lievemente compromessa. BRILIQUE non è stato studiato nei pazienti con grave compromissione epatica mentre le informazioni disponibili per i pazienti con moderata compromissione epatica sono limitate (cfr. «Controindicazioni», «Avvertenze e misure precauzionali» e «Farmacocinetica»).
Pazienti con disturbi della funzionalità renale
Non è necessario alcun aggiustamento della dose nei pazienti con compromissione renale (cfr. «Farmacocinetica»).
Pazienti anziani
Non è necessario alcun aggiustamento della dose nei pazienti anziani (cfr. «Farmacocinetica»).
Bambini e adolescenti
La sicurezza e l'efficacia di BRILIQUE nei bambini di età inferiore ai 18 anni non sono state dimostrate per l'indicazione autorizzata negli adulti.
Controindicazioni
Ipersensibilità al principio attivo o a una qualsiasi delle sostanze ausiliarie.
Sanguinamento patologico in atto.
Storia clinica di emorragia intracranica (cfr. «Effetti indesiderati»).
Grave disturbo della funzionalità epatica (cfr. «Posologia/impiego», «Avvertenze e misure precauzionali» e «Farmacocinetica»).
Trattamento a lungo termine in pazienti con grave sanguinamento gastrointestinale negli ultimi 6 mesi.
Co-somministrazione di BRILIQUE con potenti inibitori del CYP3A4 (per es. ketoconazolo, claritromicina, nefazodone, ritonavir e atazanavir).
Avvertenze e misure precauzionali
Rischio di sanguinamento
Come per altri agenti antiaggreganti piastrinici, il trattamento con BRILIQUE comporta un aumento del rischio di emorragie, anche intracraniche. L'utilizzo di BRILIQUE in pazienti con noto aumento del rischio emorragico deve essere valutato rispetto al beneficio in termini di prevenzione degli eventi trombotici. L'uso di BRILIQUE è controindicato nei pazienti con anamnesi di emorragia intracranica. BRILIQUE deve essere inoltre usato con cautela nei seguenti gruppi di pazienti:
- pazienti con predisposizione al sanguinamento (per es., dovuto a trauma recente, intervento chirurgico importante negli ultimi 30 giorni, intervento chirurgico intracranico o al midollo spinale negli ultimi 5 anni, moderati disturbi della funzionalità epatica, sanguinamento gastrointestinale in fase attiva o recente) o pazienti a rischio elevato di emorragie traumatiche, comprese le emorragie intracraniche traumatiche. L'uso di BRILIQUE è controindicato in pazienti con sanguinamento patologico attivo, in quelli con anamnesi di emorragia intracranica ed in pazienti con gravi disturbi della funzionalità epatica (cfr. «Controindicazioni»).
- pazienti in trattamento concomitante con medicamenti che aumentano il rischio di emorragie, ad esempio altri agenti antiaggreganti piastrinici (antagonisti del recettore P2Y12 dell'ADP, inibitori GPIIb/IIIa), antinfiammatori non steroidei (FANS), trattamento cronico con eparina a basso peso molecolare, anticoagulanti orali (antagonisti della vitamina K, nuovi anticoagulanti orali) e/o fibrinolitici entro 24 ore dalla somministrazione di BRILIQUE).
Pazienti con precedente ictus ischemico
I pazienti con sindrome coronarica acuta e precedente ictus ischemico possono essere trattati con BRILIQUE 90 mg per un periodo fino a 12 mesi (studio PLATO). Nello studio PEGASUS, i pazienti con storia di infarto miocardico con precedente ictus ischemico non sono stati inclusi. Pertanto, in assenza di dati, si consiglia cautela in caso di trattamenti per più di 12 mesi.
La trasfusione piastrinica non ha consentito di neutralizzare l'effetto antitrombotico di BRILIQUE nei soggetti sani. È improbabile che la trasfusione piastrinica arrechi un beneficio clinico ai pazienti con emorragie.
Poiché la co-somministrazione di BRILIQUE e desmopressina non ha diminuito il tempo di sanguinamento («template-bleeding time»), è improbabile che la desmopressina possa essere efficace nel trattamento clinico degli eventi emorragici.
La terapia antifibrinolitica (acido aminocaproico o acido tranexamico) e/o la terapia con il fattore VIIa ricombinante possono aumentare l'emostasi. La terapia con BRILIQUE può essere ripresa una volta che la causa del sanguinamento sia stata identificata e il sanguinamento controllato.
Interventi chirurgici
- Se un paziente deve essere sottoposto a intervento chirurgico, il medico deve considerare il profilo clinico individuale del paziente e soppesare i benefici e i rischi associati alla continuazione della terapia antitrombotica prima di decidere quando interrompere il trattamento con BRILIQUE.
- In virtù del legame reversibile di ticagrelor, il recupero dell'aggregazione piastrinica è più veloce nei pazienti trattati con BRILIQUE che in quelli trattati con clopidogrel. Nello studio OFFSET, l'inibizione media dell'aggregazione piastrinica (IPA) ottenuta con BRILIQUE 72 ore dopo la somministrazione era paragonabile all'IPA media ottenuta con clopidogrel 120 ore dopo la somministrazione. La regressione più rapida degli effetti potrebbe indicare un rischio inferiore di complicanze emorragiche, ad esempio in situazioni che richiedono la sospensione temporanea della terapia antitrombotica a causa di un intervento chirurgico o trauma (cfr. «Proprietà/effetti»).
- Fra i pazienti dello studio PLATO sottoposti ad intervento di impianto di bypass coronarico, l'incidenza di sanguinamenti maggiori sotto BRILIQUE era simile a quella sotto clopidogrel per tutti i giorni dopo l'interruzione della terapia, tranne il giorno 1 in cui l'incidenza di sanguinamenti maggiori sotto BRILIQUE è risultata maggiore (cfr. «Effetti indesiderati»).
- Se un paziente deve essere sottoposto ad intervento chirurgico elettivo e non è auspicabile un effetto antitrombotico, BRILIQUE deve essere interrotto 7 giorni prima dell'intervento.
Pazienti con moderati disturbi della funzionalità epatica
L'esperienza con l'uso di BRILIQUE nei pazienti con moderata compromissione epatica è limitata. Si richiede pertanto cautela in questi pazienti. L'uso di BRILIQUE è controindicato in pazienti con compromissione epatica severa (cfr. «Posologia/impiego», «Controindicazioni» e «Farmacocinetica»).
Pazienti a rischio di eventi bradicardici
Il monitoraggio Holter dell'ECG ha mostrato un aumento della frequenza di pause ventricolari per lo più asintomatiche durante il trattamento con ticagrelor rispetto a clopidogrel. I pazienti ad aumentato rischio di eventi bradicardici (per es. pazienti senza un pacemaker portatori di sindrome del nodo del seno, blocco AV di II o III grado o sincope correlata a bradicardia) sono stati esclusi dai principali studi che hanno valutato la sicurezza e l'efficacia di ticagrelor. Pertanto, data la limitata esperienza clinica, ticagrelor deve essere usato con cautela in questi pazienti (cfr. «Proprietà/effetti»).
Inoltre deve essere usata cautela quando si somministra BRILIQUE in concomitanza a medicamenti noti per indurre bradicardia. Comunque non è stata osservata alcuna evidenza clinicamente rilevante di interazioni avverse nello studio PLATO in seguito a somministrazione concomitante con uno o più medicamenti noti per indurre bradicardia (per es., 96% beta bloccanti, 33% calcio antagonisti diltiazem e verapamil, e 4% digossina) (cfr. «Interazioni»).
Durante il sottostudio con monitoraggio Holter nello studio PLATO, un numero maggiore di pazienti ha riportato pause ventricolari ≥3 secondi con BRILIQUE rispetto a clopidogrel durante la fase acuta della sindrome coronarica (SCA). L'aumento delle pause ventricolari osservato con monitoraggio Holter è stato maggiore con BRILIQUE in pazienti con insufficienza cardiaca cronica rispetto alla popolazione totale dello studio durante la fase acuta della sindrome coronarica. Dopo un mese di trattamento con BRILIQUE non è stata osservata più alcuna differenza rispetto alla popolazione totale o nel confronto con clopidogrel. Non ci sono state conseguenze cliniche negative associate a questo squilibrio (inclusi sincope o impianto di pacemaker) in questa popolazione di pazienti (cfr. «Proprietà/effetti»).
Dispnea
Nei pazienti trattati con BRILIQUE sono stati riportati episodi di dispnea. La dispnea è di solito di intensità da lieve a moderata e spesso si risolve senza richiedere l'interruzione del trattamento. I pazienti con asma/BPCO possono presentare un aumentato rischio assoluto di insorgenza di dispnea con BRILIQUE (cfr. «Effetti indesiderati»). BRILIQUE deve essere usato con cautela nei pazienti con storia di asma e/o BPCO. Il meccanismo di base non è stato chiarito (cfr. anche «Proprietà/effetti» - Meccanismo dell'adenosina). Se un paziente sviluppa dispnea di nuova insorgenza o riferisce un prolungamento o peggioramento della dispnea in atto, questa deve essere approfonditamente studiata e, se non tollerato, il trattamento con BRILIQUE deve essere interrotto.
Porpora trombotica trombocitopenica (PTT)
Porpora trombotica trombocitopenica è stata riportata molto raramente con l'uso di BRILIQUE. La PTT è una malattia grave che richiede un trattamento immediato.
Interferenza con i test di laboratorio
Test di funzionalità piastrinica per diagnosticare la trombocitopenia indotta da eparina (HIT)
Sono stati riportati risultati falsi negativi in un test di funzionalità piastrinica per trombocitopenia indotta da eparina (HIT) in pazienti a cui è stato somministrato ticagrelor. Questo è correlato all'inibizione del recettore P2Y12 sulle piastrine del donatore sano nel test da parte di ticagrelor nel siero/plasma del paziente. Sono necessarie informazioni sul trattamento concomitante con ticagrelor per l'interpretazione dei test di funzionalità piastrinica per HIT.
Prima di prendere in considerazione l'interruzione del trattamento con ticagrelor, deve essere valutato il rapporto rischi/benefici del trattamento continuato, prendendo in considerazione sia lo stato protrombotico di HIT sia il rischio aumentato di sanguinamento con concomitante trattamento anticoagulante e ticagrelor.
Altro
Sulla base della relazione osservata nello studio PLATO tra dose di mantenimento dell'ASA ed efficacia relativa di BRILIQUE rispetto al clopidogrel, la co-somministrazione di BRILIQUE ed elevate dosi di mantenimento di ASA (> 300 mg) non è raccomandata (cfr. «Proprietà/effetti»).
La co-somministrazione di BRILIQUE con potenti inibitori del CYP3A4 (per es., ketoconazolo, claritromicina, nefazodone, ritonavir e atazanavir) è controindicata, perché la co-somministrazione può portare ad un incremento sostanziale dell'esposizione a ticagrelor (cfr. «Interazioni»).
La co-somministrazione di BRILIQUE con potenti induttori del CYP3A4 (per es. rifampicina, fenitoina, carbamazepina, fenobarbitale, iberico) non è consigliata, dato che la co-somministrazione può portare ad una diminuzione della concentrazione e dell'efficacia di ticagrelor (cfr. «Interazioni»).
La co-somministrazione di BRILIQUE con substrati del CYP3A4 a basso indice terapeutico (cioè cisapride o alcaloidi dell'ergot) non è raccomandata, poiché BRILIQUE può aumentare l'esposizione a queste sostanze. L'uso concomitante di BRILIQUE con dosi di simvastatina o lovastatina superiori a 40 mg non è raccomandato.
È necessario un attento monitoraggio clinico e dei parametri di laboratorio quando la digossina o medicamenti che influenzano l'emostasi sono somministrati in concomitanza con BRILIQUE.
I potenti inibitori della glicoproteina P (P-gp) (ad es. verapamil, chinidina, ciclosporina) aumentano la concentrazione di ticagrelor. Se tale associazione non può essere evitata, il loro uso concomitante deve essere effettuato con cautela.
Interruzione della terapia
I pazienti che devono interrompere il trattamento con BRILIQUE sono soggetti a un rischio maggiore di eventi cardiaci o ictus. L'interruzione anticipata del trattamento deve essere evitata. Se la somministrazione di BRILIQUE deve essere temporaneamente sospesa a causa di un effetto indesiderato, il trattamento deve essere ripreso il più presto possibile se i benefici del trattamento superano il rischio di subire l'effetto indesiderato o se l'effetto indesiderato è scomparso (cfr. «Posologia/impiego»).
Interazioni
Ticagrelor è principalmente un substrato del CYP3A4 ed un lieve inibitore del CYP3A4. Ticagrelor è anche un substrato della P-gp ed un debole inibitore della P-gp e può aumentare la concentrazione dei substrati della P-gp.
Effetti di altri medicamenti su ticagrelor
Medicamenti metabolizzati dal CYP3A4
Potenti inibitori del CYP3A4: la co-somministrazione di ketoconazolo e ticagrelor ha aumentato la Cmax e l'AUC di ticagrelor rispettivamente di 2,4 e 7,3 volte. Cmax e AUC del metabolita attivo sono risultate ridotte rispettivamente dell'89% e del 56%. Altri potenti inibitori del CYP3A4 (claritromicina, nefazodone, ritonavir e atazanavir) possono produrre effetti simili, e pertanto il loro uso concomitante con BRILIQUE è controindicato (cfr. «Controindicazioni»).
Inibitori moderati del CYP3A4: la co-somministrazione di diltiazem e ticagrelor ha aumentato la Cmax e l'AUC di ticagrelor rispettivamente del 69% e del 174% e ha diminuito la Cmax del metabolita attivo del 38%, mentre l'AUC del metabolita attivo è rimasta invariata. Una singola dose di 90 mg di ticagrelor non ha prodotto alcun effetto sui livelli plasmatici di diltiazem. Altri inibitori moderati del CYP3A4 (ad es. amprenavir, aprepitant, eritromicina, fluconazolo, verapamil e succo di pompelmo) hanno probabilmente un effetto simile e possono altresì essere somministrati insieme a BRILIQUE.
Ciclosporina (inibitore della P-gp e del CYP3A)
La co-somministrazione di ciclosporina (600 mg) e ticagrelor ha aumentato la Cmax e l'AUC di ticagrelor rispettivamente del 130% e 183%. L'AUC del metabolita attivo è aumentata del 33% e la Cmax è diminuita del 15% in presenza di ciclosporina. Ticagrelor non ha avuto alcun effetto sulla concentrazione plasmatica della ciclosporina.
Induttori del CYP3A4: la co-somministrazione di rifampicina e ticagrelor ha diminuito la Cmax e l'AUC di ticagrelor rispettivamente del 73% e dell'86%. La Cmax del metabolita attivo è rimasta invariata mentre l'AUC si è ridotta del 46%. Anche altri induttori del CYP3A4 (per es. fenitoina, carbamazepina, fenobarbitale e iperico) dovrebbero ridurre l'esposizione a ticagrelor e potrebbero quindi limitarne l'efficacia.
Altri
Studi clinici di interazione farmacologica hanno mostrato che la co-somministrazione di ticagrelor con eparina, enoxaparina ed ASA non ha avuto effetti sui livelli plasmatici di ticagrelor o del suo metabolita attivo. Se clinicamente indicati, i medicamenti che alterano l'emostasi devono essere utilizzati con cautela in associazione con BRILIQUE (cfr. «Avvertenze e misure precauzionali»).
Non sono disponibili dati sull'uso concomitante di BRILIQUE e potenti inibitori della P-gp (per es. verapamil, chinidina, ciclosporina) che possono aumentare l'esposizione a ticagrelor. Se clinicamente indicato, il loro uso concomitante deve essere effettuato con cautela (cfr. «Avvertenze e misure precauzionali»).
In pazienti trattati con morfina è stata osservata un'esposizione ritardata o ridotta agli inibitori orali del recettore P2Y12, incluso ticagrelor e il suo metabolita attivo (riduzione del 35% circa per ticagrelor). Questa interazione può essere correlata alla ridotta motilità gastrointestinale e valere quindi anche per altri oppioidi. La rilevanza clinica non è nota.
Effetti di ticagrelor su altri medicamenti
Medicamenti metabolizzati dal CYP3A4
Ticagrelor è un inibitore lieve del CYP3A4. La co-somministrazione di BRILIQUE e substrati del CYP3A4 con bassi indici terapeutici (cioè cisapride o alcaloidi dell'ergot) non è raccomandata, poiché ticagrelor può aumentare la concentrazione di questi medicamenti (cfr. «Avvertenze e misure precauzionali»).
Simvastatina: la co-somministrazione di ticagrelor e simvastatina ha aumentato la Cmax della simvastatina dell'81% e l'AUC del 56%, e ha prodotto un incremento della Cmax dell'acido simvastatinico del 64% e dell'AUC del 52%, con alcuni incrementi individuali superiori di 2-3 volte.
La co-somministrazione di ticagrelor e dosi di simvastatina superiori a 40 mg al giorno potrebbe causare effetti collaterali dovuti alla simvastatina, e deve essere valutata rispetto ai potenziali benefici. Una singola dose di 80 mg di simvastatina non ha prodotto alcun effetto sui livelli plasmatici di ticagrelor. Ticagrelor potrebbe indurre effetti simili sulla lovastatina. L'uso concomitante di BRILIQUE con dosi di simvastatina o lovastatina superiori a 40 mg non è raccomandato (cfr. «Avvertenze e misure precauzionali»).
Atorvastatina: la co-somministrazione di atorvastatina e ticagrelor ha aumentato la Cmax dell'acido atorvastatinico del 23% e l'AUC del 36%. Simili incrementi di AUC e Cmax sono stati osservati per tutti i metaboliti dell'acido atorvastatinico. Tali incrementi non sono considerati clinicamente significativi.
Un effetto simile su altre statine metabolizzate dal CYP3A4 non può essere escluso. Il 93% dei pazienti dello studio PLATO assumeva svariati tipi di statine, senza alcun problema in questa coorte relativamente alla sicurezza dell'assunzione di statine.
Medicamenti metabolizzati dal CYP2C9
Tolbutamide
La somministrazione concomitante di ticagrelor con tolbutamide non ha determinato alcuna variazione dei livelli plasmatici. Una singola dose di 500 mg di tolbutamide non ha prodotto alcun effetto sui livelli plasmatici di ticagrelor. Ciò sta ad indicare che ticagrelor non è un inibitore del CYP2C9 ed è improbabile che possa alterare il metabolismo mediato dal CYP2C9 di medicamenti come warfarin e tolbutamide.
Non si possono tuttavia escludere interazioni farmacodinamiche con gli antagonisti della vitamina K (cfr. «Avvertenze e misure precauzionali»).
Contraccettivi orali
La co-somministrazione di ticagrelor e levonorgestrel ed etinilestradiolo ha aumentato l'esposizione all'etinilestradiolo di circa il 20%, ma non ha alterato il profilo farmacocinetico del levonorgestrel. Non è atteso un effetto clinicamente rilevante sull'efficacia dei contraccettivi orali in seguito ad assunzione concomitante di levonorgestrel ed etinilestradiolo con BRILIQUE.
Medicamenti metabolizzati dal CYP2D6 – venlafaxina
La co-somministrazione di ticagrelor e venlafaxina non ha determinato variazioni dell'AUC e della Cmax di O-desmetilvenlafaxina o dell'AUC di venlafaxina. La Cmax della venlafaxina era aumentata del 22% dopo la somministrazione di una singola dose di ticagrelor. La venlafaxina non ha avuto alcuna influenza sui livelli plasmatici di ticagrelor. Questi risultati indicano che ticagrelor non è un inibitore del CYP2D6 ed è improbabile che possa alterare il metabolismo mediato dal CYP2D6 di medicamenti come venlafaxina o metoprololo.
Substrati della glicoproteina P (P-gp)
La co-somministrazione di ticagrelor ha aumentato la Cmax della digossina del 75% e l'AUC del 28%. La Cmin media della digossina è stata aumentata del 30% con la co-somministrazione di ticagrelor, con aumenti individuali massimi di 2 volte. In presenza di digossina, Cmax e AUC di ticagrelor e del suo metabolita attivo non sono state modificate. Pertanto, si raccomanda un appropriato monitoraggio clinico e/o un controllo dei parametri di laboratorio quando si somministrano medicamenti con un indice terapeutico ristretto dipendenti dalla P-gp, come la digossina o la ciclosporina, in concomitanza con BRILIQUE.
Altre terapie concomitanti
In seguito all'osservazione di pause ventricolari per lo più asintomatiche e bradicardia, si deve prestare cautela quando si somministra BRILIQUE in concomitanza ad altri medicamenti noti per indurre bradicardia (cfr. «Avvertenze e misure precauzionali»). Comunque nello studio PLATO non sono state osservate evidenze di effetti collaterali clinicamente significativi in seguito alla somministrazione concomitante con uno o più medicamenti noti per indurre bradicardia (per es., 96% beta bloccanti, 33% calcio antagonisti diltiazem e verapamil, e 4% digossina).
Negli studi clinici BRILIQUE è stato comunemente somministrato con ASA, inibitori della pompa protonica, statine, beta-bloccanti, inibitori dell'enzima di conversione dell'angiotensina e antagonisti dei recettori dell'angiotensina, così come richiesto da condizioni cliniche concomitanti, a lungo termine ed anche con eparina, eparina a basso peso molecolare ed inibitori GP-IIb/IIIa per via endovenosa a breve termine. Nessuna evidenza di interazioni avverse clinicamente rilevanti è stata osservata con questi medicamenti.
A causa delle potenziali interazioni farmacodinamiche, occorre usare cautela nel caso di somministrazione concomitante di BRILIQUE con medicamenti noti per alterare l'emostasi (cfr. «Avvertenze e misure precauzionali»).
A seguito di segnalazioni di anormalità nei sanguinamenti cutanei con SSRI (per es., paroxetina, sertralina e citalopram) deve essere posta cautela quando si somministrano SSRI con BRILIQUE dato che questo può causare un aumento del rischio di sanguinamento.
Gravidanza/Allattamento
Non sono stati condotti studi clinici con donne in gravidanza o in allattamento.
Gravidanza
Non sono disponibili o sono presenti dati limitati sull'uso di BRILIQUE nelle donne in gravidanza. Gli studi sugli animali hanno mostrato una tossicità per la riproduzione (cfr. «Dati preclinici»). BRILIQUE non deve essere usato durante la gravidanza a meno che non ne sia evidente la necessità.
Allattamento
Non è noto se nell'essere umano ticagrelor venga escreto nel latte materno. Gli studi sui ratti hanno evidenziato che ticagrelor e il metabolita attivo passano nel latte materno. BRILIQUE non deve essere utilizzato durante l'allattamento.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Non sono stati condotti studi sugli effetti di BRILIQUE relativi alla capacità di guidare veicoli e utilizzare macchinari. Si presume che BRILIQUE non abbia effetti o abbia effetti trascurabili sulla capacità di guidare veicoli o sulla capacità di utilizzare macchine. Durante il trattamento con BRILIQUE sono stati riportati capogiri e confusione. Pertanto, i pazienti che manifestano questi sintomi devono prestare attenzione mentre guidano o usano macchinari.
Effetti indesiderati
Riassunto del profilo di sicurezza
La sicurezza di BRILIQUE è stata valutata in due ampi studi di fase III su endpoint (PLATO e PEGASUS) che hanno incluso in totale più di 39'000 pazienti (cfr. «Proprietà/effetti»). Le reazioni avverse significative osservate in questi studi sono illustrate di seguito.
La sicurezza di BRILIQUE 90 mg in pazienti con sindrome coronarica acuta (UA, NSTEMI e STEMI) è stata valutata nello studio PLATO. In questo studio, i pazienti trattati con BRILIQUE 90 mg due volte al giorno sono stati confrontati con i pazienti trattati con clopidogrel 75 mg una volta al giorno ed entrambi i gruppi sono stati trattati in associazione ad ASA e altre terapie standard.
Nello studio PLATO la durata media del trattamento con BRILIQUE 90 mg è stata di 277 giorni. I pazienti in trattamento con BRILIQUE 90 mg hanno mostrato una più alta incidenza di interruzione della terapia a causa di effetti collaterali rispetto ai pazienti trattati con clopidogrel (7,4% vs 5,4%).
La sicurezza di BRILIQUE in pazienti con una storia di infarto miocardico di almeno 12 mesi e ad alto rischio di un evento trombotico è stata esaminata nello studio PEGASUS, che ha confrontato pazienti trattati con BRILIQUE 60 mg due volte al giorno o 90 mg due volte al giorno in associazione ad ASA con pazienti in terapia con solo ASA e che seguivano altre terapie standard. La durata mediana del trattamento con BRILIQUE 60 mg è stata di 29,4 mesi. Nello studio PEGASUS, i pazienti in trattamento con BRILIQUE hanno mostrato una più alta incidenza di interruzione della terapia a causa di eventi avversi rispetto ai pazienti in terapia con solo ASA (16,1% per BRILIQUE 60 mg con ASA vs 8,5% per la terapia con solo ASA).
Le reazioni avverse più comunemente riportate nei pazienti trattati con ticagrelor erano sanguinamento e dispnea.
Le seguenti reazioni avverse ai medicamenti sono state identificate nel quadro degli studi clinici di fase III PEGASUS e PLATO.
Le reazioni avverse ai medicamenti sono elencate in base alla classificazione MedDRA per classi di organi e grado di frequenza. Le categorie di frequenza sono definite come segue: molto comune (≥1/10), comune (≥1/100, <1/10), non comune (≥1/1000, <1/100), raro (≥1/10'000, <1/1000).
Tumori benigni, maligni e non specificati (cisti e polipi compresi)
Non comune: sanguinamento da tumore (per es. sanguinamento per carcinoma vescicale, carcinoma gastrico e carcinoma del colon).
Patologie del sistema emolinfopoietico
Molto comune: sanguinamento per alterazione dell'emostasi (per es. maggiore tendenza alla contusione, ematoma spontaneo, diatesi emorragica) (10,3%).
Disturbi del metabolismo e della nutrizione
Molto comune: iperuricemiaa (22,1%).
Comune: gotta.
Disturbi psichiatrici
Non comune: confusione.
Patologie del sistema nervoso
Comune: capogiro, sincope.
Non comune: emorragia intracranica (ovvero emorragia intracranica spontanea, dovuta a intervento chirurgico o trauma).
Patologie dell'occhio
Non comune: emorragia oculare (per es. intraoculare, congiuntivale, retinica).
Patologie dell'orecchio e del labirinto
Comune: vertigini.
Non comune: otorragia.
Patologie vascolari
Comune: ipotensione.
Patologie respiratorie, toraciche e mediastiniche
Molto comune: dispnea (15,7%).
Comune: emorragie delle vie respiratorie (per es. epistassi, emottisi).
Patologie gastrointestinali
Comune: emorragia gastrointestinale (per es. sanguinamento gengivale, emorragia rettale, emorragia da ulcera gastrica), diarrea, nausea.
Non comune: emorragia retroperitoneale.
Patologie della cute e del tessuto sottocutaneo
Comune: sanguinamento sottocutaneo o cutaneo (per es. ecchimosi, emorragia cutanea, petecchie), prurito.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Non comune: emorragia muscolare (per es. emartrosi, emorragia muscolare).
Patologie renali e urinarie
Comune: emorragia del tratto urinario (per es. ematuria, cistite emorragica).
Patologie dell'apparato riproduttivo e della mammella
Non comune: emorragie dell'apparato riproduttivo (per es. emorragia vaginale, ematospermia, emorragia postmenopausa).
Esami diagnostici
Comune: creatinina ematica aumentataa.
Traumatismo, avvelenamento e complicazioni da procedura
Comune: emorragia post procedurale, sanguinamento traumatico (per es. contusione, ematoma traumatico, emorragia traumatica).
aFrequenza derivata da osservazioni di laboratorio (l'acido urico aumenta oltre il limite superiore normale rispetto al basale al di sotto o entro il range di riferimento. La creatinina aumenta oltre il 50% rispetto al basale) e non dalla segnalazione dell'evento avverso.
Effetti indesiderati dopo l'introduzione sul mercato
Dopo l'introduzione sul mercato di BRILIQUE sono stati osservati i seguenti effetti indesiderati. Poiché questi dati si basano sulla segnalazione spontanea e originano da una popolazione di dimensioni non note, una stima affidabile della frequenza non è sempre possibile.
Disturbi del sistema immunitario
Reazioni di ipersensibilità, incluso angioedema (cfr. «Controindicazioni»).
Patologie della cute e del tessuto sottocutaneo
Eruzione cutanea.
Patologie ematologiche:
Porpora trombotica trombocitopenica (cfr. «Avvertenze e misure precauzionali»).
Descrizione di alcuni effetti collaterali
Risultati di eventi di sanguinamento nello studio PLATO.
I criteri di esclusione principali comprendevano un aumentato rischio di sanguinamento, trombocitopenia o anemia clinicamente rilevante, precedente sanguinamento intracranico, sanguinamento gastrointestinale nei 6 mesi precedenti o chirurgia maggiore nei 30 giorni precedenti. Gli esiti globali degli eventi di sanguinamento dello studio PLATO sono riportati nella Tabella 1.
Tabella 1: Analisi degli eventi di sanguinamento generali, valutazione secondo Kaplan-Meier dei tassi di sanguinamento post trattamento riportati a 12 mesi (PLATO)
Endpoint di sicurezza | BRILIQUE 90 mg due volte al giorno | Clopidogrel 75 mg una volta al giorno | Valore di p | |
KM % | Hazard Ratio | |||
Sanguinamenti secondo la definizione PLATO | ||||
Sanguinamenti totali maggiori | 11.6 | 1.04 (0,95; 1,13) | 11.2 | 0.4336 |
Sanguinamenti fatali/pericolosi per la vita | 5.8 | 1.03 (0,90; 1,16) | 5.8 | 0.6988 |
Sanguinamenti totali maggiori + minori combinati | 16.1 | 1.11 (1,03; 1,20) | 14.6 | 0.0084 |
Sanguinamenti maggiori non correlati a CABG | 4.5 | 1.19 (1,02; 1,38) | 3.8 | 0.0264 |
Sanguinamenti maggiori non correlati alla procedura | 3.1 | 1.31 (1,08; 1,60) | 2.3 | 0.0058 |
Sanguinamenti maggiori + minori non correlati alla procedura | 5.9 | 1.39 (1,21; 1,60) | 4.3 | <0,0001 |
Categoria di sanguinamento secondo i criteri TIMI | ||||
Sanguinamenti maggiori | 7.9 | 1.03 (0,93; 1,15) | 7.7 | 0.5669 |
Sanguinamenti maggiori + minori | 11.4 | 1.05 (0,96; 1,15) | 10.9 | 0.3272 |
Nello studio PLATO sono state utilizzate le seguenti definizioni per i sanguinamenti:
«Sanguinamento maggiore fatale/pericoloso per la vita»: sanguinamento fatale, qualsiasi sanguinamento intracranico o intrapericardico con tamponamento cardiaco; o con shock ipovolemico o grave ipotensione che richiede trattamento ipertensivo/inotropo o intervento chirurgico; o clinicamente manifesto con diminuzione di emoglobina ≥5 g/dl; o trasfusione ≥4 unità.
«Altro sanguinamento maggiore»: significativamente disabilitante o clinicamente manifesto con diminuzione di emoglobina di 3 - 5 g/dl; o trasfusione di 2-3 unità (di sangue intero o concentrato eritrocitario) a causa di emorragia.
«Sanguinamento minore»: richiede l'intervento medico per l'arresto o il trattamento dell'emorragia.
«Sanguinamento maggiore secondo la scala TIMI»: sanguinamento pericoloso per la vita o qualsiasi sanguinamento intracranico, o segni clinicamente manifesti di sanguinamento associati a diminuzione di emoglobina ≥5 g/dl, o se l'emoglobina non è disponibile, a diminuzione del 15% dell'ematocrito.
«Sanguinamento minore secondo la scala TIMI»: sanguinamento clinicamente manifesto con diminuzione di emoglobina di 3 - 5 g/dl.
Nello studio PLATO, l'intervallo al primo evento del gruppo «sanguinamenti totali maggiori» secondo la definizione PLATO non era significativamente diverso tra BRILIQUE e clopidogrel. Si sono verificati solo pochi eventi emorragici fatali nello studio: 20 (0,2%) con BRILIQUE 90 mg due volte al giorno e 23 (0,3%) con clopidogrel 75 mg una volta al giorno. Considerando anche i sanguinamenti minori, l'incidenza degli eventi di sanguinamento maggiori e minori definiti secondo i criteri PLATO era significativamente più elevata con BRILIQUE rispetto al clopidogrel. L'incidenza generale degli eventi di sanguinamento secondo la definizione di TIMI non era significativamente diversa tra BRILIQUE e clopidogrel.
Sanguinamento correlato a CABG: nello studio PLATO, il 42% dei 1584 pazienti (12% della coorte) sottoposti ad intervento di CABG ha avuto un 'sanguinamento maggiore fatale/pericoloso per la vita', secondo la definizione PLATO, senza differenze tra i gruppi di trattamento. Un sanguinamento fatale correlato a CABG si è verificato in 6 pazienti in ogni gruppo di trattamento (cfr. «Avvertenze e misure precauzionali»).
Sanguinamento non correlato a CABG e sanguinamento non correlato alla procedura: BRILIQUE e clopidogrel non differiscono per i sanguinamenti maggiori non correlati a CABG, fatali/pericolosi per la vita, definiti secondo i criteri PLATO mentre i sanguinamenti «totali maggiori» secondo la definizione PLATO, maggiori secondo la scala TIMI e maggiori + minori secondo la scala TIMI, sono stati più comuni con BRILIQUE. Similmente, quando si eliminano i sanguinamenti correlati alle procedure, si sono osservati più sanguinamenti con BRILIQUE che con clopidogrel (Tabella 1). L'interruzione del trattamento a causa di sanguinamento non-procedurale è risultata più comune per BRILIQUE (2,9%) che per clopidogrel (1,2%; p< 0,001).
Fattori quali età, sesso, peso, etnia, regione geografica, comorbilità, terapia concomitante e storia clinica, compresi precedenti ictus o attacco ischemico transitorio, non sono risultati predittivi né di sanguinamenti totali, né di sanguinamenti maggiori non correlati alla procedura, definiti secondo i criteri PLATO. Nessun gruppo particolare è stato identificato come a rischio elevato per sanguinamento.
Sanguinamento intracranico: si è verificato un numero maggiore di sanguinamenti intracranici non-procedurali con BRILIQUE (n = 27 sanguinamenti in 26 pazienti, 0,3%) che con clopidogrel (n = 14 sanguinamenti, 0,2%), di cui 11 sanguinamenti con BRILIQUE ed 1 con clopidogrel hanno avuto esito fatale. Non ci sono state differenze nei sanguinamenti fatali globali. L'incidenza dei sanguinamenti intracranici è risultata bassa in entrambi i gruppi di trattamento considerate le significative comorbilità e i fattori di rischio cardiovascolari della popolazione in studio.
Risultati di eventi di sanguinamento nello studio PEGASUS
I principali criteri di esclusione erano l'uso previsto di medicamenti che possono determinare un aumento del rischio di sanguinamento; disturbi emorragici o una storia di ictus o di sanguinamento intracranico; tumore del sistema nervoso centrale; anomalia vascolare intracranica; sanguinamento gastrointestinale negli ultimi 6 mesi, intervento chirurgico intracranico o al midollo spinale negli ultimi 5 anni o intervento chirurgico importante negli ultimi 30 giorni.
Gli esiti globali degli eventi di sanguinamento dello studio PEGASUS sono riportati nella Tabella 2.
Tabella 2 – Analisi degli eventi di sanguinamento generali, valutazione secondo Kaplan-Meier dei tassi di sanguinamento post trattamento riportati a 36 mesi (PEGASUS)
BRILIQUE 60 mg due volte al giorno + ASA | Solo ASA | |||
Endpoint di sicurezza | KM% | Hazard Ratio | KM % | Valore di p |
Categorie di sanguinamento secondo i criteri TIMI | ||||
Maggiori | 2.3 | 2.32 (1,68; 3,21) | 1.1 | <0.0001 |
Fatali | 0.3 | 1.00 (0,44; 2,27) | 0.3 | 1.0000 |
Emorragie intracraniche | 0,6 | 1.33 (0,77; 2,31) | 0,5 | 0.3130 |
Maggiori - Altro | 1.6 | 3.61 (2,31; 5,65) | 0,5 | <0.0001 |
Maggiori o Minori | 3.4 | 2.54 (1,93; 3,35) | 1.4 | <0.0001 |
Maggiori o Minori o che richiedono trattamento medico | 16.6 | 2.64 (2,35; 2,97) | 7.0 | <0.0001 |
Categorie di sanguinamento secondo i criteri PLATO | ||||
Maggiori | 3.5 | 2.57 (1,95; 3,37) | 1.4 | <0.0001 |
Fatali/pericolosi per la vita | 2.4 | 2.38 (1,73; 3,26) | 1.1 | <0.0001 |
Maggiori - Altro | 1.1 | 3.37 (1,95; 5,83) | 0.3 | <0.0001 |
Maggiori o Minori | 15.2 | 2.71 (2,40; 3,08) | 6.2 | <0.0001 |
Definizioni delle categorie dei sanguinamenti:
Sanguinamento maggiore secondo la scala TIMI: sanguinamento fatale, O qualsiasi sanguinamento intracranico, O segni di emorragia clinicamente manifesta associata ad una diminuzione di emoglobina (Hb) ≥5 g/dl, o quando Hb non è disponibile, a una riduzione dell'ematocrito (Hct) ≥15%.
Fatali: un evento di sanguinamento che conduce direttamente alla morte in 7 giorni.
TIMI Maggiori - Altro: sanguinamenti non-fatali non-intracranici maggiori secondo la scala TIMI.
TIMI Minori: sanguinamento clinicamente manifesto con diminuzione di emoglobina di 3 - 5 g/dl.
TIMI che richiedono trattamento medico: richiedono un intervento, O conducono all'ospedalizzazione, O richiedono una valutazione.
Sanguinamento maggiore fatale/pericoloso per la vita secondo i criteri PLATO: sanguinamento fatale, O qualsiasi sanguinamento intracranico, O sanguinamento intrapericardico con tamponamento cardiaco, O con shock ipovolemico o grave ipotensione che richiede trattamento ipertensivo/inotropo o intervento chirurgico, O clinicamente manifesto con diminuzione di emoglobina >50 g/l O trasfusione ≥4 unità di globuli rossi.
PLATO Maggiori - Altro: significativamente disabilitante, O clinicamente manifesto con diminuzione di emoglobina di 3-5 g/dl, O trasfusione di 2-3 unità di globuli rossi.
PLATO Minori: richiede l'intervento medico per l'arresto o il trattamento del sanguinamento.
Nello studio PEGASUS, i sanguinamenti Maggiori secondo il criterio TIMI con BRILIQUE 60 mg due volte al giorno erano più frequenti rispetto al solo ASA. Non sono stati rilevati aumenti nel rischio di sanguinamenti fatali e solo un aumento minore è stato osservato nell'emorragia intracranica rispetto alla terapia con solo ASA. C'è stato un basso numero di sanguinamenti fatali nello studio: 11 (0,3%) con BRILIQUE 60 mg e 12 (0,3%) con la terapia con solo ASA. L'aumentato rischio di sanguinamenti maggiori secondo il criterio TIMI osservato con BRILIQUE 60 mg era soprattutto dovuto ad una più alta frequenza di Altri Sanguinamenti maggiori secondo il criterio TIMI dovuti ad eventi gastrointestinali.
Un sanguinamento aumentato con caratteristiche simili ai sanguinamenti TIMI Maggiori è stato osservato per le categorie di sanguinamento TIMI Maggiori o Minori, PLATO Maggiori e PLATO Maggiori o Minori (cfr. Tabella 2). L'interruzione del trattamento dovuta al sanguinamento è risultata più comune con BRILIQUE 60 mg rispetto alla terapia con solo ASA (6,2% e 1,5%, rispettivamente). La maggior parte di questi sanguinamenti è stata di gravità minore (classificata come TIMI che richiedono trattamento medico), per es. epistassi, ecchimosi ed ematomi.
Il profilo di sanguinamento di BRILIQUE 60 mg è risultato coerente fra i molteplici sottogruppi predefiniti (per es. secondo età, sesso, peso, razza, regione geografica, comorbilità, terapia concomitante e storia clinica) per gli eventi di sanguinamento TIMI Maggiori, TIMI Maggiori o Minori e PLATO Maggiori.
Sanguinamento intracranico: le emorragie intracraniche (ICH) spontanee sono state riportate con frequenza simile per BRILIQUE 60 mg e per la terapia con solo ASA (n=13, 0,2% in entrambi i gruppi di trattamento). ICH traumatiche e procedurali hanno mostrato un'incidenza lievemente superiore nei pazienti trattati con BRILIQUE 60 mg (n=15, 0,2%) rispetto a quelli trattati con solo ASA (n=10, 0,1%). Sono state riportate 6 ICH fatali con BRILIQUE 60 mg e 5 ICH fatali con solo ASA. L'incidenza dei sanguinamenti intracranici è risultata bassa in entrambi i gruppi di trattamento considerate le significative comorbilità e i fattori di rischio cardiovascolari della popolazione in studio.
Dispnea
Nello studio PLATO gli effetti collaterali di tipo dispnoico sono stati riportati dal 13,8% dei pazienti trattati con BRILIQUE 90 mg due volte al giorno e dal 7,8% dei pazienti trattati con 75 mg di clopidogrel. I sintomi di dispnea erano perlopiù di intensità da lieve a moderata e spesso miglioravano senza dover interrompere la terapia. La dispnea si è manifestata perlopiù all'inizio del trattamento; l'87% dei pazienti con dispnea ha avuto un solo episodio.
La dispnea come grave effetto collaterale è stata riscontrata nello 0,7% dei pazienti trattati con BRILIQUE e nello 0,4% dei pazienti trattati con clopidogrel. I pazienti che hanno riferito dispnea erano solitamente più anziani ed avevano già al basale più frequentemente dispnea, insufficienza cardiaca, BPCO o asma. I risultati dello studio PLATO non suggeriscono che la maggiore incidenza di dispnea osservata con BRILIQUE sia dovuta all'insorgenza o ad un peggioramento della cardiopatia o della pneumopatia (cfr. «Proprietà/effetti» - Meccanismo dell'adenosina). Non è stato evidenziato alcuno effetto negativo di BRILIQUE sulla funzionalità polmonare (cfr. «Avvertenze e misure precauzionali»).
Nello studio PEGASUS la dispnea è stata riportata nel 14,2% dei pazienti trattati con BRILIQUE 60 mg due volte al giorno e nel 5,5% dei pazienti trattati con solo ASA. Come nello studio PLATO gli eventi di dispnea sono stati prevalentemente di intensità da lieve a moderata (cfr. «Avvertenze e misure precauzionali»).
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-beneficio del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Non esiste ad oggi un antidoto noto per contrastare gli effetti di ticagrelor e si presume che ticagrelor non sia dializzabile (cfr. «Avvertenze e misure precauzionali»). Il trattamento del sovradosaggio deve seguire gli standard della pratica medica locale. L'effetto atteso di un dosaggio eccessivo di ticagrelor è il prolungamento del rischio di sanguinamento associato all'inibizione dell'aggregazione piastrinica. Se si verifica sanguinamento, devono essere istituite appropriate misure di supporto. Ticagrelor è ben tollerato in dosi singole fino a 900 mg. La tossicità gastrointestinale è stata dose-limitante in un singolo studio con aumento progressivo della dose singola. Altri effetti collaterali clinicamente rilevanti che possono verificarsi a seguito di sovradosaggio comprendono dispnea e pause ventricolari (cfr. «Effetti indesiderati»).
In caso di sovradosaggio, prestare attenzione a questi potenziali effetti collaterali e considerare il monitoraggio dell'ECG.
Proprietà/Effetti
Codice ATC
B01AC24
Meccanismo d'azione
BRILIQUE contiene il principio attivo ticagrelor, una sostanza appartenente alla classe chimica delle ciclopentiltriazolopirimidine (CPTP), che è un antagonista orale, diretto, selettivo e a legame reversibile del recettore P2Y12 in grado di prevenire l'attivazione e l'aggregazione piastrinica P2Y12 dipendente ADP mediata. Ticagrelor non impedisce il legame del recettore con l'ADP, ma quando si lega al recettore P2Y12 impedisce la trasduzione del segnale indotta dall'ADP.
Poiché le piastrine hanno un ruolo nell'esordio e/o evoluzione delle complicanze trombotiche della malattia aterosclerotica, l'inibizione della funzione delle piastrine può ridurre il rischio di eventi cardiovascolari come morte cardiaca, infarto miocardico o ictus.
Ticagrelor presenta un ulteriore meccanismo d'azione che consiste nell'aumento dei livelli endogeni locali di adenosina attraverso l'inibizione del trasportatore nucleosidico equilibrativo-1 (ENT-1). L'adenosina è sintetizzata localmente in presenza di ipossia e danno tissutale per degradazione dell'adenosina trifosfato e difosfato (ATP e ADP) rilasciata. Poiché la degradazione dell'adenosina è essenzialmente limitata allo spazio intracellulare, l'inibizione dell'ENT-1 da parte di ticagrelor determina un prolungamento dell'emivita dell'adenosina. Ticagrelor non ha un effetto diretto clinicamente significativo sui recettori dell'adenosina (A1, A2A, A2B, A3) e non viene metabolizzato ad adenosina. Sono stati documentati numerosi effetti dell'adenosina, tra cui vasodilatazione, inibizione piastrinica, modulazione della risposta infiammatoria e induzione della dispnea, che dovrebbero contribuire al profilo clinico del ticagrelor.
Farmacodinamica
Insorgenza dell'azione (Onset)
L'inibizione dell'aggregazione piastrinica (IPA = Inhibition of Platelet Aggregation) da parte di ticagrelor e clopidogrel è stata esaminata nell'ambito di uno studio di 6 settimane in cui sono stati valutati sia gli effetti antipiastrinici acuti che cronici in risposta a 20 µM di ADP come agonista dell'aggregazione piastrinica in pazienti con coronaropatia stabile (CAD) trattati con ASA. L'inizio dell'effetto è stato valutato dopo una dose da carico di 180 mg di ticagrelor o 600 mg di clopidogrel.
Ticagrelor induce una rapida insorgenza dell'effetto farmacologico, come dimostrato da un'inibizione dell'aggregazione piastrinica media per ticagrelor, 0,5 ore dopo una dose da carico di 180 mg, di circa il 41% con un effetto massimo sull'IPA dell'89% entro 2-4 ore successive dalla dose, e mantenuto tra 2 e 8 ore. Il 90% dei pazienti presentava un'IPA finale >70% 2 ore dopo la dose.
Reversibilità dell'azione (Offset)
Se viene pianificata una procedura CABG, il rischio di sanguinamento con ticagrelor è aumentato rispetto a clopidogrel quando interrotto meno di 96 ore prima dell'intervento.
Dati relativi al cambio di terapia
Il passaggio da clopidogrel 75 mg una volta al giorno a BRILIQUE 90 mg due volte al giorno risulta in un aumento assoluto dell'IPA del 26,4%, mentre il passaggio da BRILIQUE a clopidogrel risulta in una diminuzione assoluta dell'IPA pari al 24,5%. I pazienti possono passare dalla terapia con clopidogrel a quella con BRILIQUE senza interruzione dell'effetto antipiastrinico (cfr. «Posologia/impiego»).
Meccanismo dell'adenosina (ENT-1)
Ticagrelor ha determinato un aumento della concentrazione plasmatica di adenosina nei pazienti con SCA e potenziato varie risposte fisiologiche all'adenosina. L'adenosina è un vasodilatatore; ticagrelor ha dimostrato di incrementare l'aumento del flusso sanguigno coronarico indotto dall'adenosina nei volontari sani e nei pazienti affetti da SCA. L'adenosina è un antiaggregante piastrinico endogeno; ticagrelor ha dimostrato di potenziare l'inibizione dell'aggregazione piastrinica mediata dall'adenosina, oltre a svolgere un'azione antipiastrinica per antagonismo a livello del recettore P2Y12. L'adenosina induce anche dispnea; è stato dimostrato che ticagrelor aumenta la dispnea indotta dall'adenosina nei volontari sani. Pertanto, non si può escludere che la dispnea osservata in alcuni pazienti trattati con ticagrelor (cfr. «Effetti indesiderati») sia parzialmente mediata dall'adenosina.
Efficacia clinica
L'evidenza clinica dell'efficacia di BRILIQUE deriva da due studi di fase III:
- lo studio PLATO [PLATO = PLATelet Inhibition and Patient Outcomes] che ha confrontato BRILIQUE con clopidogrel, entrambi somministrati in associazione con ASA e altre terapie standard (sindrome coronarica acuta);
- lo studio PEGASUS TIMI-54 [PEGASUS = PrEvention with TicaGrelor of SecondAry Thrombotic Events in High-RiSk AcUte Coronary Syndrome Patients] che ha confrontato BRILIQUE in associazione con ASA e ASA da solo (trattamento a lungo termine in caso di storia di infarto del miocardio e presenza di altri fattori di rischio cardiovascolare).
Studio PLATO (sindrome coronarica acuta)
Lo studio PLATO ha incluso 18'624 pazienti che si presentavano entro 24 ore dall'insorgenza dei sintomi di angina instabile (UA), infarto miocardico senza innalzamento del tratto ST (NSTEMI) o infarto miocardico con innalzamento del tratto ST (STEMI), ed erano stati inizialmente trattati farmacologicamente o con intervento coronarico percutaneo (PCI) o con impianto di bypass aorto-coronarico (CABG) (cfr. «Indicazioni/possibilità d'impiego»).
Con assunzione giornaliera di ASA, BRILIQUE 90 mg due volte al giorno è risultato superiore a clopidogrel 75 mg/die nella prevenzione dell'endpoint composito di morte per cause cardiovascolari (CV), infarto miocardico (IM) o ictus, con la differenza guidata dalla riduzione di morti CV e IM. I pazienti ricevevano una dose da carico di clopidogrel da 300 mg (era possibile una dose da 600 mg in caso di PCI) oppure di BRILIQUE da 180 mg.
Il risultato è stato raggiunto precocemente (riduzione del rischio assoluto [ARR] 0,6% e riduzione del rischio relativo [RRR] del 12% a 30 giorni), con un effetto del trattamento che si è mantenuto costante per l'intero periodo di 12 mesi, ottenendo un'ARR dell'1,9% all'anno ed una RRR del 16%. Questi dati suggeriscono che è opportuno trattare i pazienti con BRILIQUE fino a 12 mesi (cfr. «Posologia/impiego»). Il trattamento di 54 pazienti affetti da SCA con BRILIQUE invece che con clopidogrel eviterebbe l'insorgenza di 1 evento aterotrombotico; il trattamento di 91 pazienti eviterebbe 1 morte CV (cfr. Figura 1 e Tabella 3).
L'effetto del trattamento con BRILIQUE rispetto a clopidogrel risulta coerente in molti sottogruppi di pazienti suddivisi per caratteristiche comprendenti peso, sesso, storia clinica di diabete mellito, attacco ischemico transitorio o ictus non emorragico, rivascolarizzazione, terapie concomitanti comprendenti eparine, inibitori GP-IIb/IIIa ed inibitori della pompa protonica (cfr. «Interazioni»), diagnosi finale dell'evento indice (STEMI, NSTEMI o UA) e percorso di trattamento assegnato alla randomizzazione (invasivo o farmacologico).
È stata osservata un'interazione debolmente significativa fra il trattamento e la regione geografica, per cui l'Hazard Ratio (HR) per l'endpoint primario favorisce BRILIQUE nel resto del mondo, mentre favorisce clopidogrel in Nord America, che rappresenta approssimativamente il 10% della popolazione globale studiata (valore di p dell'interazione = 0,045). Analisi esplorative suggeriscono una possibile associazione con la dose di ASA, dal momento che è stata osservata un'efficacia ridotta con BRILIQUE associata a dosi crescenti di ASA. La dose cronica giornaliera di ASA, somministrato insieme a BRILIQUE, deve essere compresa tra 75 e 150 mg (cfr. «Posologia/impiego» e «Avvertenze e misure precauzionali»).
La Figura 1 mostra la stima del rischio per il tempo alla prima insorgenza di qualsiasi evento valutato nell'endpoint composito di efficacia.
Figura 1: Tempo alla prima insorgenza di morte cardiovascolare (CV), infarto miocardico e ictus (PLATO)

BRILIQUE ha ridotto l'insorgenza dell'endpoint composito primario rispetto a clopidogrel in entrambe le popolazioni UA/NSTEMI e STEMI.
Tabella 3: Analisi degli endpoint di efficacia primari e secondari (PLATO)
Endpoint primario (EP) | Pazienti con eventi | ||||
BRILIQUE 90 mg due volte al giorno | Clopidogrel una volta al giorno N=9291 | Riduzione del rischio relativoa | Hazard Ratio | Valore di p | |
EP composto da morte CV/IM (escluso IM silente)/ictus | 9.3 | 10.9 | 16 | 0,84 (0,77; 0,92) | p = 0,0003 |
Morte CV | 3.8 | 4.8 | 21 | 0,79 (0,69; 0,91) | p = 0,0013 |
IM (escluso IM silente) | 5.4 | 6.4 | 16 | 0,84 (0,75; 0,95) | p = 0,0045 |
Ictus | 1.3 | 1.1 | -17 | 1,17 (0,91; 1,52) | p = 0,2249 |
Endpoint secondari | |||||
EP composto da morte CV/IM (escluso IM silente)/ictus – intenzione di trattamento invasivo | 8.5 | 10.0 | 16 | 0,84 (0,75; 0,94) | p = 0,0025 |
EP composto da mortalità globale /IM (escluso IM silente)/ictus | 9.7 | 11.5 | 16 | 0,84 (0,77; 0,92) | p = 0,0001 |
EP composto da morte CV/IM totale/ictus/SRIb/RIc/TIAd/altri ATEe | 13.8 | 15.7 | 12 | 0,88 (0,81; 0,95) | p = 0,0006 |
Mortalità globale | 4.3 | 5.4 | 22 | 0,78 (0,69; 0,89) | p= 0,0003** |
a RRR= (1-Hazard Ratio) x 100%. I valori con una riduzione del rischio relativo negativa indicano un aumento del rischio relativo.
** Valore nominale di p, non formalmente statisticamente significativo in base a test gerarchico predefinito
b SRI= Severe Recurrent Cardiac Ischaemia
c RI= Recurrent Cardiac Ischaemia
d TIA= Transitional Ischaemic Attack
e ATE= Arterial Thrombotic Events
Sottostudio Holter
Al fine di studiare l'insorgenza di pause ventricolari ed altri episodi di aritmia durante lo studio PLATO, gli sperimentatori hanno eseguito un monitoraggio Holter in un sottogruppo di quasi 3'000 pazienti, dei quali circa 2'000 disponevano di ECG relativo sia alla fase acuta della SCA, sia dopo un mese. La variabile primaria di interesse era rappresentata dall'insorgenza di pause ventricolari ≥3 secondi. Nella fase acuta più pazienti trattati con BRILIQUE (6,0%) hanno avuto pause ventricolari rispetto a quelli trattati con clopidogrel (3,5%); dopo 1 mese il 2,2% e l'1,6%, rispettivamente (cfr. «Avvertenze e misure precauzionali»). L'aumento delle pause ventricolari nella fase acuta della SCA è stato più pronunciato nei pazienti trattati con BRILIQUE con storia clinica di insufficienza cardiaca cronica (ICC) (9,2% verso 5,4% nei pazienti senza storia clinica di ICC; per i pazienti trattati con clopidogrel, il 4,0% nei pazienti con storia clinica di ICC verso 3,6% in quelli senza storia clinica di ICC). Questa differenza non è stata osservata dopo un mese: 2,0% verso 2,1% per i pazienti trattati con BRILIQUE con e senza storia clinica di ICC rispettivamente; e 3,8% verso 1,4% con clopidogrel. In questo gruppo di pazienti non sono state rilevate conseguenze cliniche negative associate a questa differenza (compreso l'impianto di pacemaker).
Sottostudio di genetica dello studio PLATO
La genotipizzazione di CYP2C19 e ABCB1 di 10'285 pazienti dello studio PLATO ha permesso di associare i risultati clinici dello studio con la distribuzione genotipica. La superiorità di BRILIQUE nei confronti del clopidogrel nel ridurre gli eventi cardiovascolari maggiori non ha subìto un'influenza significativa del genotipo CYP2C19 o ABCB1 del paziente. Similmente ai dati complessivi dello studio PLATO, l'incidenza dei sanguinamenti Maggiori Totali secondo i criteri PLATO non differisce tra BRILIQUE e clopidogrel, a prescindere dal genotipo CYP2C19 o ABCB1. L'incidenza dei sanguinamenti Maggiori Non correlati a CABG secondo PLATO era aumentata con BRILIQUE rispetto a clopidogrel nei pazienti con uno o più alleli del CYP2C19 a funzione ridotta, ma simile a clopidogrel nei pazienti senza alleli a funzione ridotta.
Endpoint composito di efficacia e sicurezza
L'endpoint composito di efficacia e sicurezza (morte CV, IM, ictus o sanguinamenti Totali Maggiori secondo i criteri PLATO) conferma il beneficio clinico di BRILIQUE rispetto a clopidogrel (RRR 8%, ARR 1,4%, HR 0,92; p = 0,0257) nei 12 mesi successivi a un evento di SCA.
Studio PEGASUS (trattamento a lungo termine in caso di storia di infarto del miocardio e presenza di altri fattori di rischio cardiovascolare)
Lo studio PEGASUS TIMI-54 è uno studio di 21'162 pazienti, randomizzato, in doppio cieco, controllato con placebo, guidato dagli eventi, a gruppi paralleli, internazionale e multicentrico disegnato per valutare la prevenzione di eventi trombotici con BRILIQUE somministrato in 2 dosi (90 mg due volte al giorno o 60 mg due volte al giorno) associato ad una bassa dose di ASA (75-150 mg), rispetto alla terapia con solo ASA in pazienti con storia clinica di infarto miocardico e fattori di rischio addizionali per l'aterotrombosi.
Fattori di rischio
I pazienti erano idonei a partecipare allo studio se avevano almeno 50 anni, una storia clinica di infarto miocardico (da 1 a 3 anni prima della randomizzazione) e presentavano almeno uno dei seguenti fattori di rischio cardiovascolari:
- un ulteriore precedente infarto miocardico
- evidenza di malattia multivasale CAD
- diabete mellito che richiede trattamento
- età ≥65 anni
- insufficienza renale cronica non terminale.
Figura 2 – Curva di Kaplan-Meier e analisi dell'endpoint composito clinico primario di morte cardiovascolare, infarto miocardico e ictus nello studio PEGASUS

Tabella 4 – Analisi degli endpoint di efficacia primari e secondari nello studio PEGASUS
BRILIQUE 60 mg due volte al giorno + ASA | Solo ASA | Valore di p | |||||||
|---|---|---|---|---|---|---|---|---|---|
Caratteristiche | Pazienti con eventi | KM% | HR | Pazienti con eventi | KM% | ||||
Endpoint primario | |||||||||
Composito di morte cardiovascolare/IM/ictus | 487 (6.9%) | 7.8% | 0,84 | 578 (8.2%) | 9.0% | 0,0043 (s) | |||
Morte cardiovascolare | 174 (2.5%) | 2.9% | 0,83 | 210 (3.0%) | 3.4% | 0.0676 | |||
IM | 285 (4.0%) | 4.5% | 0,84 | 338 (4.8%) | 5.2% | 0.0314 | |||
Ictus | 91 (1.3%) | 1.5% | 0,75 | 122 (1.7%) | 1.9% | 0.0337 | |||
Endpoint secondario | |||||||||
Morte cardiovascolare | 174 (2.5%) | 2.9% | 0,83 | 210 (3.0%) | 3.4% | - | |||
Mortalità globale | 289 (4.1%) | 4.7% | 0.89 (0,76; 1,04) | 326 (4.6%) | 5.2% | - | |||
Gli hazard ratio e i valori di p sono calcolati separatamente per BRILIQUE vs la terapia con solo ASA sulla base del modello dei rischi proporzionali di Cox (Cox proportional hazard model) con il gruppo di trattamento come unica variabile esplicativa.
Percentuale secondo Kaplan-Meier calcolata a 36 mesi.
Nota: il numero di primi eventi per le componenti morte cardiovascolare, IM e ictus rappresenta il numero attuale di primi eventi per ogni componente e non viene aggiunto al numero di eventi nell'endpoint composito.
(s) indica significatività statistica.
IC = intervallo di confidenza; HR = Hazard Ratio; KM = Kaplan-Meier; IM = infarto miocardico; N = numero di pazienti.
Sia il trattamento con BRILIQUE 60 mg due volte al giorno che con BRILIQUE 90 mg due volte al giorno in associazione ad ASA è risultato superiore alla terapia con solo ASA nella prevenzione degli eventi trombotici (endpoint composito: morte cardiovascolare, infarto miocardico e ictus), con un effetto consistente per l'intero periodo di studio, raggiungendo una RRR del 16% e una ARR dell'1,27% per BRILIQUE 60 mg e una RRR del 15% e una ARR dell'1,19% per BRILIQUE 90 mg.
Nonostante i profili di efficacia di BRILIQUE 90 mg e 60 mg siano risultati simili, la dose più bassa sembra avere un migliore profilo di tollerabilità e sicurezza in relazione al rischio di sanguinamento e dispnea. Pertanto, BRILIQUE 60 mg due volte al giorno co-somministrato con ASA è raccomandato per la prevenzione degli eventi trombotici (morte cardiovascolare, infarto miocardico e ictus) in pazienti con una storia di infarto miocardico di almeno 12 mesi e ad alto rischio di sviluppare un evento trombotico.
Rispetto a solo ASA, BRILIQUE 60 mg due volte al giorno ha ridotto significativamente l'endpoint composito primario di morte cardiovascolare, infarto miocardico e ictus. Ognuno dei singoli componenti ha contribuito alla riduzione dell'endpoint composito primario (RRR del 17% per morte cardiovascolare, RRR del 16% per infarto miocardico e RRR del 25% per ictus).
Per prevenire un evento dell'endpoint composito primario, è necessario il trattamento di 79 pazienti fino a 36 mesi con BRILIQUE 60 mg due volte al giorno in associazione ad ASA invece della terapia con solo ASA.
Il beneficio di BRILIQUE in termini di endpoint composito primario è stato dimostrato anche per entrambi gli endpoint secondari, in quanto sia i decessi per cause cardiovascolari che la mortalità globale sono stati inferiori con BRILIQUE 60 mg in associazione ad ASA rispetto alla terapia con solo ASA, sebbene non sia stata raggiunta una significatività statistica (cfr. Tabella 4).
La RRR per l'endpoint composito da 1 a 360 giorni (RRR del 17%) e da 361 giorni in poi (RRR del 16%) è risultata simile. Questo effetto è stato coerente per tutto lo studio, con una durata fino a 48 mesi (mediana 33 mesi). La consistenza della RRR nel tempo suggerisce che la continuazione del trattamento con BRILIQUE è indicata fintanto che il paziente è ad alto rischio di sviluppare un evento trombotico (cfr. «Posologia/impiego»).
L'effetto terapeutico di BRILIQUE 60 mg due volte al giorno rispetto alla terapia con solo ASA è stato coerente in diversi sottogruppi di pazienti sulla base delle caratteristiche demografiche come il peso, il sesso, l'anamnesi e la regione geografica.
I benefici del trattamento con BRILIQUE sono risultati inoltre indipendenti dall'uso di altre terapie cardiovascolari, tra cui agenti ipolipemizzanti, beta bloccanti, ACE-inibitori, antagonisti del recettore dell'angiotensina II, calcio antagonisti, nitrati e inibitori della pompa protonica (cfr. «Interazioni»).
Farmacocinetica
Assorbimento
L'assorbimento di ticagrelor è rapido, con un tmax mediano di circa 1,5 ore. La formazione del principale metabolita circolante, AR-C124910XX (anch'esso attivo) è rapida, con un tmax mediano di circa 2,5 ore. A seguito di somministrazione orale di 90 mg di ticagrelor in condizioni di digiuno, la Cmax è pari a 529 ng/ml e l'AUC a 3451 ng*h/ml. Il rapporto metabolita precursore è di 0,28 per la Cmax e 0,42 per l'AUC.
La biodisponibilità assoluta media di ticagrelor è stata stimata essere del 36% (intervallo dal 25,4% al 64,0%). Il consumo di un pasto ad alto contenuto di grassi non ha prodotto effetti sulla Cmax di ticagrelor né sull'AUC del metabolita attivo, ma ha causato un incremento del 21% dell'AUC di ticagrelor ed una riduzione del 22% della Cmax del metabolita attivo. Queste lievi variazioni sono considerate di minima rilevanza clinica; pertanto, ticagrelor può essere somministrato sia durante che lontano dai pasti. Ticagrelor e il suo metabolita attivo sono substrati della P-gp.
Compresse rivestite con film:
Ticagrelor come compresse frantumate miscelate in acqua, somministrate oralmente o attraverso un sondino naso-gastrico direttamente nello stomaco, è bioequivalente a ticagrelor sotto forma di compresse intere (non frantumate) (AUC e Cmax entro l'80-125% per ticagrelor e il metabolita attivo). L'esposizione iniziale (0,5 e 1 ora dopo la dose) alle compresse frantumate di ticagrelor mescolate in acqua è risultata più elevata rispetto alle compresse intere (non frantumate), con un profilo di concentrazione dopo 2-48 ore generalmente identico.
Compresse orodispersibili:
Le compresse orodispersibili di ticagrelor, disperse nella saliva e deglutite senza acqua o sospese in acqua e somministrate attraverso un sondino naso-gastrico nello stomaco, sono risultate bioequivalenti alle compresse rivestite con film deglutite (AUC e Cmax entro l'80-125% dei valori di ticagrelor e del metabolita attivo). Quando la compressa orodispersibile era dispersa nella saliva e deglutita con acqua, la AUC di ticagrelor era simile mentre la Cmax era di circa il 15% inferiore rispetto alla compressa rivestita con film. È improbabile che la differenza osservata nella Cmax sia di rilevanza clinica.
Distribuzione
Il volume di distribuzione di ticagrelor allo stato stazionario è di 87,5 l. Nell'uomo, ticagrelor ed il metabolita attivo sono largamente legati alle proteine plasmatiche (>99%).
Metabolismo
Il CYP3A è il principale enzima responsabile del metabolismo di ticagrelor e della formazione del metabolita attivo e le loro interazioni con altri substrati del CYP3A variano dall'attivazione all'inibizione. Ticagrelor e il metabolita attivo sono deboli inibitori della glicoproteina P.
Il metabolita principale di ticagrelor è l'AR-C124910XX, dotato anch'esso di attività farmacologica, come dimostrato in vitro dal legame con il recettore piastrinico P2Y12 dell'ADP. L'esposizione sistemica al metabolita attivo è pari a circa il 30-40% di quella osservata con ticagrelor.
Eliminazione
La via primaria di eliminazione di ticagrelor è rappresentata dal metabolismo epatico. Dopo somministrazione di ticagrelor radiomarcato, il recupero medio di radioattività è di circa l'84% (di cui il 57,8% nelle feci e il 26,5% nelle urine). Le quote recuperate sia di ticagrelor, sia del metabolita attivo, presenti nelle urine, erano inferiori all'1% della dose. La via primaria di eliminazione del metabolita attivo è verosimilmente la secrezione biliare. Il t1/2 medio era circa 6,9 ore (intervallo 4,5‑12,8 ore) per ticagrelor e 8,6 ore (intervallo 6,5-12,8 ore) per il metabolita attivo.
Linearità/non linearità
Ticagrelor mostra una farmacocinetica lineare nel tempo e l'esposizione al ticagrelor e al metabolita attivo (AR‑C124910XX) è approssimativamente proporzionale alla dose nell'intervallo di dosi terapeutiche.
Cinetica di gruppi di pazienti speciali
Disturbi della funzionalità epatica
Cmax e AUC di ticagrelor sono risultate del 12% e del 23% maggiori nei pazienti con lieve compromissione della funzionalità epatica rispetto a un campione paragonabile di soggetti sani. Non è necessario alcun aggiustamento della dose nei pazienti con compromissione epatica lieve (cfr. «Posologia/impiego»). Ticagrelor non è stato studiato nei pazienti con compromissione della funzionalità epatica severa e non sono disponibili informazioni farmacocinetiche per i pazienti con compromissione epatica moderata (cfr. «Posologia/impiego», «Controindicazioni» e «Avvertenze e misure precauzionali»).
Disturbi della funzionalità renale
L'esposizione a ticagrelor era inferiore di circa il 20% e l'esposizione al metabolita attivo era superiore di circa il 17% nei pazienti con danno renale severo rispetto ai soggetti con normale funzionalità renale. Non è necessario alcun aggiustamento della dose nei pazienti con funzionalità renale compromessa (cfr. «Posologia/impiego»).
Nei pazienti con insufficienza renale allo stadio terminale in emodialisi, l'AUC e la Cmax di BRILIQUE 90 mg somministrati in un giorno senza dialisi erano del 38% e del 51% più alti rispetto ai soggetti con funzionalità renale normale. Un simile aumento dell'esposizione è stato osservato quando BRILIQUE è stato somministrato immediatamente prima della dialisi (49% e 61% rispettivamente), dimostrando che BRILIQUE non è dializzabile. L'esposizione al metabolita attivo è aumentata in misura minore (AUC 13 - 14% e Cmax 17 - 36%). L'inibizione dell'aggregazione piastrinica (IPA) di BRILIQUE era indipendente dalla dialisi in pazienti con insufficienza renale allo stadio terminale e simile a quella di soggetti con funzionalità renale normale.
Pazienti anziani
Esposizioni più elevate a ticagrelor (63% per Cmax e 52% per AUC) e al metabolita attivo (circa il 60% per Cmax e il 48% per AUC) sono state osservate nei soggetti anziani (≥65 anni) rispetto ai soggetti più giovani. Queste differenze non sono considerate clinicamente significative (cfr. «Posologia/impiego»).
Bambini e adolescenti
Ticagrelor non è stato studiato nella popolazione pediatrica (cfr. «Posologia/impiego»).
Etnia
I pazienti di discendenza asiatica mostrano una biodisponibilità media superiore del 39% rispetto ai pazienti caucasici. I pazienti autoidentificatisi come neri hanno mostrato una biodisponibilità di ticagrelor inferiore del 18% rispetto ai pazienti caucasici. Negli studi di farmacologia clinica, l'esposizione (Cmax e AUC) a ticagrelor nei pazienti giapponesi è risultata superiore di circa il 40% (20% dopo l'aggiustamento in funzione del peso corporeo) rispetto ai pazienti caucasici. L'esposizione nei pazienti che si sono identificati come ispanici o latini è risultata simile a quella della popolazione caucasica.
Sesso
Esposizioni più elevate a ticagrelor e al metabolita attivo sono state osservate nelle donne rispetto agli uomini. Queste differenze non sono considerate clinicamente significative.
Dati preclinici
I dati preclinici di ticagrelor e del suo principale metabolita (AR-C124910XX) non hanno dimostrato un rischio inaccettabile di effetti indesiderati per l'uomo sulla base di studi convenzionali di sicurezza farmacologica, tossicità a dose singola o a dosi ripetute e genotossicità.
Le seguenti reazioni avverse non sono state osservate in studi clinici, ma negli studi sugli animali con esposizioni simili o superiori a quelle esaminate negli studi clinici e potrebbero quindi essere rilevanti per l'uso clinico: tossicità gastrointestinale e irritazione gastrointestinale.
In uno studio di 2 anni su topi che hanno ricevuto dosi orali fino a 250 mg/kg/die (>18 volte l'esposizione terapeutica massima nell'uomo), non sono stati osservati tumori indotti da medicamenti. Nei ratti maschi, dosi orali fino a 120 mg/kg/die (>15 volte l'esposizione terapeutica massima nell'uomo) non hanno indotto un aumento dei tumori. Nei ratti femmina, solo dosi elevate (>25 l'esposizione terapeutica massima nell'uomo) sono state associate ad un aumento di adenocarcinomi uterini, adenomi epatocellulari e adenocarcinomi, e a una diminuzione degli adenomi ipofisari e dei fibroadenomi mammari. L'incidenza dei tumori è rimasta invariata dopo la somministrazione di una dose di 60 mg/kg/die (8 volte l'esposizione terapeutica massima nell'uomo). I tumori uterini osservati soltanto nel ratto sono risultati essere dovuti ad effetti endocrini non genotossici correlati ad uno squilibrio ormonale dopo la somministrazione di ticagrelor ad alte dosi. I tumori benigni del fegato sono considerati una conseguenza della risposta del fegato alle elevate esigenze metaboliche di alte dosi di ticagrelor. Il significato di questi risultati per l'uomo non è stato ancora definitivamente chiarito.
Ticagrelor è stato esaminato in una serie di test in vitro e in vivo e non ha mostrato genotossicità.
Ticagrelor ha causato cicli irregolari (prevalentemente cicli più prolungati) nei ratti femmina, ma non ha provocato effetti sulla fertilità generale nei ratti maschio e femmina.
È stato dimostrato che ticagrelor somministrato a ratti femmina a dosi orali fino a 200 mg/kg/die (circa 20 volte l'esposizione terapeutica massima nell'uomo) e somministrato a ratti maschi a dosi fino a 180 mg/kg/die (15,7 volte l'esposizione terapeutica massima nell'uomo) non ha alcun effetto sulla fertilità.
Studi nei ratti e nei conigli hanno mostrato tossicità per la riproduzione, con lieve riduzione dell'aumento di peso corporeo della madre, ridotta vitalità neonatale e diminuzione del peso alla nascita, con ritardo nella crescita.
A dosi orali fino a 100 mg/kg/die nei ratti (5,1 volte l'esposizione terapeutica massima nell'uomo) e a dosi fino a 42 mg/kg/die nei conigli (corrispondenti all'esposizione terapeutica massima nell'uomo), ticagrelor non ha avuto alcun effetto sullo sviluppo fetale. Inoltre, ticagrelor somministrato a ratti a dosi fino a 60 mg/kg/die (4,6 volte l'esposizione terapeutica massima nell'uomo) non ha avuto alcun effetto sul parto o sullo sviluppo postnatale. A dosi più elevate con tossicità materna, sono stati osservati effetti non specifici nella prole.
Altre indicazioni
Incompatibilità
Non applicabile.
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sulla confezione.
Indicazioni particolari concernenti l'immagazzinamento
Conservare nella confezione originale. Non conservare a temperature superiori a 30°C.
Conservare fuori dalla portata dei bambini.
Numero dell'omologazione
61389, 66822 (Swissmedic).
Titolare dell’omologazione
AstraZeneca AG, 6340 Baar.
Stato dell'informazione
Novembre 2020.
Composition
Principes actifs
Ticagrelorum.
Excipients
Excipiens pro compresso obducto.
Forme pharmaceutique et quantité de principe actif par unité
Comprimé pelliculé
90 mg: Comprimé pelliculé rond, biconvexe, jaune, portant la mention «90» au-dessus d'un «T» sur une face. L'autre face est lisse.
1 comprimé pelliculé contient 90 mg de ticagrelor.
60 mg: Comprimé pelliculé rond, biconvexe, rose, portant la mention «60» au-dessus d'un «T» sur une face. L'autre face est lisse.
1 comprimé pelliculé contient 60 mg de ticagrelor.
Comprimé orodispersible
90 mg: comprimé orodispersible rond, plat, à bords biseautés, blanc à rose pâle, portant la mention «90» au-dessus d'un «TI» sur une face. L'autre face est lisse.
Indications/Possibilités d’emploi
BRILIQUE 90 mg
BRILIQUE 90 mg, en association avec l'acide acétylsalicylique (AAS), est indiqué dans la prévention des événements athérothrombotiques (décès d'origine cardio-vasculaire, infarctus du myocarde, accident vasculaire cérébral) chez les patients ayant un syndrome coronarien aigu [SCA] (angor instable [AI], infarctus du myocarde sans sus-décalage du segment ST [NSTEMI] ou infarctus du myocarde avec sus-décalage du segment ST [STEMI]), incluant les patients traités médicalement et ceux traités par une intervention coronaire percutanée (ICP) ou un pontage aorto-coronarien (PAC).
BRILIQUE 60 mg
BRILIQUE 60 mg, en association avec l'acide acétylsalicylique (AAS), est indiqué dans la prévention des événements athérothrombotiques (décès d'origine cardiovasculaire, infarctus du myocarde, accident vasculaire cérébral) chez les patients ayant des antécédents d'infarctus du myocarde datant d'au moins 12 mois. De plus, ces patients doivent présenter au moins un autre facteur de risque cardiovasculaire (voir «Efficacité clinique»).
Posologie/Mode d’emploi
Posologie
BRILIQUE 90 mg
Chez les patients ayant un syndrome coronarien aigu, le traitement par BRILIQUE doit être instauré avec une dose initiale de 180 mg (2 comprimés à 90 mg) puis poursuivi avec une dose de 90 mg deux fois par jour. Le traitement est recommandé pendant au moins 12 mois, à moins que l'arrêt de BRILIQUE soit cliniquement indiqué (voir «Propriétés/Effets»).
Les patients sous BRILIQUE doivent également prendre une faible dose quotidienne d'AAS (75 à 150 mg) en traitement d'entretien, sauf contre-indication spécifique. Chez les patients ayant un syndrome coronarien aigu, une dose de charge initiale d'AAS est recommandée (voir «Propriétés/Effets»).
Les patients qui, après 12 mois de traitement par BRILIQUE 90 mg deux fois par jour suite à un événement athérothrombotique aigu, restent exposés à un risque élevé de développement d'un événement athérothrombotique peuvent poursuivre le traitement sans interruption par BRILIQUE 60 mg deux fois par jour. Un risque élevé est défini par la présence d'au moins un autre facteur de risque cardiovasculaire (voir «Efficacité clinique»).
BRILIQUE 60 mg
Une dose de charge initiale de BRILIQUE n'est pas nécessaire chez les patients ayant des antécédents d'infarctus du myocarde datant d'au moins 12 mois; la dose recommandée est de 60 mg deux fois par jour. Les données sur l'efficacité et la sécurité d'emploi de BRILIQUE au-delà d'une prolongation du traitement de 3 ans sont limitées. Il convient d'évaluer régulièrement et individuellement lors des examens de routine le bénéfice et le risque liés au traitement par BRILIQUE, en particulier si le traitement se poursuit au-delà de 3 ans.
Les patients sous BRILIQUE 60 mg doivent également prendre une faible dose quotidienne d'AAS (75 à 150 mg) en traitement d'entretien, sauf contre-indication spécifique.
Les patients peuvent initier le traitement par BRILIQUE 60 mg indépendamment de leur traitement antiagrégant plaquettaire antérieur et indépendamment de l'interruption ou non du traitement. Les patients doivent arrêter leur traitement antiagrégant actuel avant d'initier le traitement par BRILIQUE 60 mg deux fois par jour en association avec l'AAS à faible dose au moment de prise prévu.
Mode d'administration
Comprimés pelliculés:
Pour les patients qui ne sont pas capables d'avaler le(s) comprimé(s) en entier, les comprimés de BRILIQUE peuvent être écrasés en une poudre fine et mélangés dans un demi-verre d'eau et bus immédiatement. Le verre doit être rincé avec un autre demi-verre d'eau et le contenu doit être bu immédiatement. Le mélange peut également être administré via une sonde naso-gastrique (CH8 ou plus). Il est important de nettoyer la sonde naso-gastrique en y faisant passer de l'eau après administration du mélange.
Comprimés orodispersibles:
Les comprimés orodispersibles de 90 mg peuvent être utilisés comme alternative à BRILIQUE 90 mg, comprimés pelliculés chez les patients ayant des difficultés à avaler les comprimés pelliculés en entier. Le comprimé orodispersible doit être placé sur la langue, où il sera rapidement dispersé dans la salive. Il peut ensuite être avalé avec ou sans eau (voir «Pharmacocinétique»). Le comprimé orodispersible peut aussi être dispersé dans de l'eau et administré via une sonde naso-gastrique (CH8 ou plus). Il est important de rincer la sonde naso-gastrique en y faisant passer de l'eau après administration du mélange. Le comprimé orodispersible de 60 mg n'est pas disponible.
Les comprimés pelliculés ou les comprimés orodispersibles BRILIQUE peuvent être pris indépendamment des repas.
Omission d'une dose
Il est recommandé de ne pas interrompre le traitement. En cas d'oubli de prise de BRILIQUE, le patient ne prendra que la prochaine dose à l'heure de sa prise habituelle suivante.
Passage d'un autre traitement antiagrégant plaquettaire à BRILIQUE
Lors du passage d'un autre traitement antiagrégant plaquettaire à BRILIQUE après un SCA antérieur, les patients doivent prendre la première dose de BRILIQUE 24 heures après l'administration de la dernière dose de l'antiagrégant plaquettaire utilisé jusque-là (voir «Propriétés/Effets»).
L'arrêt prématuré de tout traitement antiagrégant plaquettaire, y compris de BRILIQUE, pourrait augmenter le risque de décès d'origine cardiovasculaire, d'infarctus du myocarde ou d'accident vasculaire cérébral lié à la pathologie sous-jacente du patient (voir «Mises en garde et précautions»).
Chez les patients présentant un syndrome coronarien aigu, la dose de charge de 180 mg doit être administrée aussi rapidement que possible, quel que soit le traitement antiagrégant plaquettaire que le patient a reçu auparavant.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
Aucun ajustement de la posologie n'est nécessaire chez les patients présentant de troubles légers de la fonction hépatique. BRILIQUE n'a pas été étudié chez les patients présentant des troubles sévères de la fonction hépatique et seules des informations limitées sont disponibles concernant les patients présentant des troubles modérés de la fonction hépatique (voir «Contre-indications», «Mises en garde et précautions» ainsi que «Pharmacocinétique»).
Patients présentant des troubles de la fonction rénale
Aucun ajustement posologique n'est nécessaire chez les patients présentant des troubles de la fonction rénale (voir «Pharmacocinétique»).
Patients âgés
Aucune adaptation de la posologie n'est nécessaire chez les patients âgés (voir «Pharmacocinétique»).
Enfants et adolescents
La sécurité d'emploi et l'efficacité de BRILIQUE chez les enfants âgés de moins de 18 ans n'ont pas été établies pour l'indication approuvée chez l'adulte.
Contre-indications
Hypersensibilité au principe actif ou à l'un des excipients.
Saignement pathologique en cours.
Antécédent d'hémorragie intracrânienne (voir «Effets indésirables»).
Insuffisance hépatique sévère (voir «Posologie/Mode d'emploi», «Mises en garde et précautions» ainsi que «Pharmacocinétique».
Traitement prolongé chez les patients avec un saignement gastro-intestinal sévère au cours des 6 derniers mois.
Administration concomitante de BRILIQUE avec de puissants inhibiteurs du CYP3A4 (par exemple kétoconazole, clarithromycine, néfazodone, ritonavir et atazanavir).
Mises en garde et précautions
Risque de saignement
Comme pour d'autres antiagrégants plaquettaires, le traitement par BRILIQUE comprend un risque hémorragique accru, saignement intracrânien y compris. Chez les patients ayant un risque hémorragique accru connu, l'utilisation de BRILIQUE doit être évaluée au vu du rapport entre ces risques et les bénéfices en termes de prévention d'événements athérothrombotiques. L'utilisation de BRILIQUE est contre-indiquée chez les patients ayant un antécédent d'hémorragie intracrânienne. BRILIQUE doit être utilisé avec prudence chez les types de patients suivants:
- Patients à risque accru de saignement (en raison, par exemple, d'un traumatisme récent, d'une intervention chirurgicale importante au cours des 30 derniers jours, d'une intervention chirurgicale intracrânienne ou de la moelle épinière au cours des 5 dernières années, d'un trouble de la fonction hépatique modéré, d'un saignement gastro-intestinal actuel ou récent) ou patients présentant un risque accru d'hémorragie traumatique, y compris les hémorragies intracrâniennes traumatiques. L'utilisation de BRILIQUE est contre-indiquée chez les patients ayant un saignement pathologique en cours, les patients ayant un antécédent d'hémorragie intracrânienne et les patients ayant une insuffisance hépatique sévère (voir «Contre-indications»).
- Patients recevant de manière concomitante des médicaments susceptibles d'augmenter le risque de saignement, par exemple, d'autres antiagrégants plaquettaires (antagonistes du récepteur P2Y12 de l'ADP, inhibiteurs de la GPIIb/IIIa), anti-inflammatoires non stéroïdiens (AINS), traitement chronique par de l'héparine de bas poids moléculaire, anticoagulants oraux (antagonistes de la vitamine K, nouveaux anticoagulants oraux) et/ou fibrinolytiques dans les 24 heures autour de l'administration de BRILIQUE.
Patients ayant des antécédents d'accident vasculaire cérébral ischémique
Les patients ayant présenté un SCA et ayant des antécédents d'accident vasculaire cérébral ischémique peuvent être traités par BRILIQUE 90 mg pendant une durée allant jusqu'à 12 mois (étude PLATO). Dans l'étude PEGASUS, aucun patient ayant des antécédents d'infarctus du myocarde avec accident vasculaire cérébral ischémique antérieur n'a été inclus. Par conséquent, en l'absence de données, la prolongation du traitement au-delà de 12 mois n'est pas recommandée chez ces patients.
La transfusion plaquettaire n'a pas permis la réversion de l'effet antithrombotique de BRILIQUE chez les volontaires sains. Il est peu probable qu'une transfusion plaquettaire présente un bénéfice clinique chez les patients qui présentent un saignement.
L'administration concomitante de BRILIQUE et de desmopressine ne diminuant pas le temps de saignement («template-bleeding time»), il est peu probable que la desmopressine soit efficace dans la prise en charge thérapeutique des événements hémorragiques.
Un traitement antifibrinolytique (acide aminocaproïque ou acide tranexamique) et/ou un traitement par le facteur VIIa recombinant peuvent améliorer l'hémostase. Le traitement par BRILIQUE peut être repris après l'identification de la cause des saignements et leur contrôle.
Chirurgie
- Si une opération est nécessaire chez un patient, le médecin doit tenir compte du profil clinique individuel du patient et peser les avantages et les risques d'une anticoagulation poursuivie avant de décider quand le traitement par BRILIQUE doit être arrêté.
- En raison de la liaison réversible de ticagrelor, le rétablissement de l'agrégation plaquettaire est plus rapide chez les patients traités par BRILIQUE que chez ceux traités au clopidogrel. Dans l'étude OFFSET, l'inhibition de l'agrégation plaquettaire (IAP) atteinte en moyenne sous BRILIQUE 72 heures après l'administration était comparable à l'IAP moyenne sous clopidogrel 120 heures après l'administration. La régression plus rapide des effets pourrait indiquer un plus faible risque de complications hémorragiques, par exemple dans les situations exigeant une suspension du traitement antithrombotique à cause d'une opération ou d'un traumatisme (voir «Propriétés/Effets»).
- Dans l'étude PLATO, chez les patients ayant eu un pontage aorto-coronarien (PAC), la fréquence de saignements majeurs sous BRILIQUE a été comparable à celle sous clopidogrel pour tous les jours après la fin du traitement, sauf pour le jour 1, pour lequel BRILIQUE a été associé à une fréquence supérieure de saignements majeurs (voir «Effets indésirables»).
- Si un patient doit avoir une intervention chirurgicale planifiée et que l'effet antiplaquettaire n'est pas souhaité, BRILIQUE doit être arrêté 7 jours avant la chirurgie.
Patients ayant des troubles modérés de la fonction hépatique
L'expérience avec BRILIQUE est limitée chez les patients avec des troubles modérés de la fonction hépatique. La prudence est donc de rigueur chez ces patients. L'utilisation de BRILIQUE est contre-indiquée chez les patients présentant une insuffisance hépatique sévère (voir «Posologie/Mode d'emploi», «Contre-indications» ainsi que «Pharmacocinétique»).
Patients présentant un risque d'événements bradycardiques
Comparé au clopidogrel, la surveillance par Holter-ECG lors du traitement par le ticagrelor a mis en évidence une fréquence élevée de pauses ventriculaires essentiellement asymptomatiques. Les patients avec un risque accru d'événements bradycardiques (par exemple, patients sans stimulateur cardiaque ayant un syndrome de dysfonctionnement sinusal, un bloc auriculo-ventriculaire du 2e ou du 3e degré ou une syncope liée à une bradycardie) ont été exclus des études principales évaluant la tolérance et l'efficacité et du ticagrelor. Par conséquent, la prudence s'impose chez ces patients en raison de l'expérience clinique limitée (voir «Propriétés/Effets»).
De plus, BRILIQUE doit être administré avec précaution en cas d'association à des médicaments connus pour induire des bradycardies. Cependant, aucune manifestation d'un effet indésirable cliniquement significatif n'a été observée dans l'étude PLATO après l'administration concomitante de médicaments connus comme pouvant induire une bradycardie (par exemple 96% de patients traités aux bêtabloquants, 33% traités aux inhibiteurs calciques diltiazem et vérapamil, 4% traités à la digoxine) (voir «Interactions»).
Une sous-étude Holter a été réalisée dans le cadre de l'étude PLATO. Dans cette sous-étude, un plus grand nombre de patients présentait des pauses ventriculaires ≥3 secondes avec BRILIQUE qu'avec le clopidogrel pendant la phase aiguë du syndrome coronarien aigu (SCA). L'augmentation du nombre de pauses ventriculaires détectées dans Holter sous BRILIQUE était plus importante chez les patients ayant une insuffisance cardiaque chronique que dans la population générale de l'étude durant la phase aiguë du SCA. Au bout d'un mois de traitement par BRILIQUE, il n'y avait plus de différence par rapport à la population générale ou les patients sous clopidogrel. Il n'y a pas eu d'effets indésirables cliniques associés à ce trouble (incluant des syncopes ou la pose d'un stimulateur cardiaque) dans cette population de patients (voir «Propriétés/Effets»).
Dyspnée
Une dyspnée a été observée chez des patients traités par BRILIQUE. La dyspnée est généralement légère à modérée et disparaît souvent sans qu'il soit nécessaire d'arrêter le traitement. Les patients présentant un asthme/une BPCO peuvent avoir une augmentation du risque absolu de présenter une dyspnée sous BRILIQUE (voir «Effets indésirables»). BRILIQUE doit être utilisé avec précaution chez les patients avec un antécédent d'asthme et/ou de BPCO. Le mécanisme n'a pas été élucidé (voir aussi «Propriétés/Effets» – Mécanisme lié à l'adénosine). Si un patient développe une dyspnée nouvelle, prolongée ou aggravée, une exploration complète est nécessaire, et si elle n'est pas tolérée, le traitement par BRILIQUE doit être interrompu.
Purpura thrombotique thrombocytopénique (PTT)
Un purpura thrombotique thrombocytopénique a été observé très rarement en lien avec l'utilisation de BRILIQUE. Le PTT est une maladie grave et nécessite un traitement immédiat.
Interférence avec les tests de laboratoire
Tests de la fonction plaquettaire visant au diagnostic de la thrombocytopénie induite par l'héparine (TIH)
Des résultats faux négatifs au test de la fonction plaquettaire à la recherche d'une thrombocytopénie induite par l'héparine (TIH) ont été rapportés chez des patients qui avaient reçu du ticagrelor. Ceci est dû au fait qu'au cours du test, le ticagrelor induit dans le sérum/plasma du patient une inhibition du récepteur P2Y12 sur les thrombocytes de donneurs sains. Des informations concernant le traitement concomitant avec le ticagrelor sont nécessaires afin de pouvoir interpréter les tests de la fonction plaquettaire à la recherche d'une TIH.
Le rapport bénéfice-risque de la poursuite du traitement doit être évalué avant d'envisager un arrêt du traitement par le ticagrelor en tenant compte de l'état prothrombotique en présence d'une TIH, mais aussi du risque hémorragique accru de l'utilisation concomitante d'anticoagulants et de ticagrelor.
Autres
En se basant sur la relation observée dans PLATO entre la dose d'entretien d'AAS et l'efficacité relative de BRILIQUE comparé au clopidogrel, l'administration concomitante de BRILIQUE et d'une forte dose d'entretien d'AAS (>300 mg) n'est pas recommandée (voir «Propriétés/Effets»).
L'administration concomitante de BRILIQUE avec des inhibiteurs puissants du CYP3A4 (par exemple, kétoconazole, clarithromycine, néfazodone, ritonavir et atazanavir) est contre-indiquée, car elle peut conduire à une augmentation importante de l'exposition au ticagrelor (voir «Interactions»).
L'administration concomitante de ticagrelor avec des inducteurs puissants du CYP3A4 (par exemple rifampicine, phénytoïne, carbamazépine, phénobarbital et millepertuis) doit être évitée, car l'administration concomitante peut entraîner une diminution de la concentration et de l'efficacité du ticagrelor (voir «Interactions»).
L'administration concomitante de BRILIQUE et de substrats du CYP3A4 à marge thérapeutique étroite (par exemple cisapride et des alcaloïdes de l'ergot de seigle) n'est pas recommandée, étant donné que BRILIQUE peut augmenter l'exposition à ces médicaments. L'administration concomitante de BRILIQUE et de simvastatine ou de lovastatine à plus de 40 mg n'est pas recommandée.
Une étroite surveillance clinique et des analyses de laboratoire régulières sont recommandées quand la digoxine ou d'autres médicaments susceptibles d'influencer l'hémostase sont administrés de manière concomitante avec BRILIQUE.
Les inhibiteurs puissants de la glycoprotéine P (PGP) (par exemple vérapamil, quinidine, ciclosporine) augmentent l'exposition au ticagrelor. Si l'association ne peut pas être évitée, elle doit être utilisée avec prudence.
Arrêt du traitement
Les patients chez lesquels le traitement par BRILIQUE doit être arrêté sont exposés à un risque accru d'événements cardiaques ou d'accident vasculaire cérébral. Il est recommandé de ne pas interrompre le traitement prématurément. Si l'administration de BRILIQUE doit être suspendue en raison d'un effet indésirable, le traitement doit être repris dès que possible si les avantages du traitement l'emportent sur le risque de subir l'effet indésirable ou si ce dernier a régressé (voir «Posologie/Mode d'emploi»).
Interactions
Le ticagrelor est essentiellement un substrat du cytochrome CYP3A4 et un inhibiteur faible du CYP3A4. Le ticagrelor est aussi un substrat et un inhibiteur faible de la PGP et il peut augmenter l'exposition aux substrats de la PGP.
Effets d'autres médicaments sur le ticagrelor
Médicaments métabolisés par le CYP3A4
Inhibiteurs puissants du CYP3A4: L'administration concomitante de kétoconazole et de ticagrelor a multiplié par 2,4 la Cmax du ticagrelor et par 7,3 son aire sous la courbe (AUC). La Cmax et l'AUC du métabolite actif ont été diminuées de respectivement 89% et 56%. Les autres inhibiteurs puissants du CYP3A4 (clarithromycine, néfazodone, ritonavir et atazanavir) ont probablement des effets similaires, et leur administration concomitante avec BRILIQUE est contre-indiquée (voir «Contre-indications»).
Inhibiteurs modérés du CYP3A4: L'administration concomitante de diltiazem avec le ticagrelor a augmenté de 69% la Cmax du ticagrelor et de 174% son AUC, et a diminué la Cmax du métabolite actif de 38%, alors que son AUC est restée inchangée. Une dose unique de 90 mg de ticagrelor n'a eu aucun effet sur les concentrations plasmatiques du diltiazem. Les autres inhibiteurs modérés du CYP3A4 (par exemple amprénavir, aprépitant, érythromycine, fluconazole, vérapamil et jus de pamplemousse) auraient probablement des effets similaires et peuvent donc également être co-administrés avec BRILIQUE.
Ciclosporine (inhibiteur de la PGP et du CYP3A)
L'administration concomitante de ciclosporine (600 mg) avec le ticagrelor a augmenté de 130% la Cmax du ticagrelor et de 183% son AUC. L'AUC du métabolite actif était augmentée de 33% en présence de ciclosporine et la Cmax diminuée de 15%. Le ticagrelor n'avait aucune influence sur la concentration plasmatique de la ciclosporine.
Inducteurs du CYP3A4: L'administration concomitante de rifampicine avec le ticagrelor a diminué de 73% la Cmax du ticagrelor et de 86% son AUC. La Cmax du métabolite actif est restée inchangée et son AUC a diminué de 46%. Les autres inducteurs du CYP3A4 (par exemple phénytoïne, carbamazépine, phénobarbital et millepertuis) pourraient également diminuer l'exposition au ticagrelor et limiter ainsi son efficacité.
Autres
Les études d'interactions pharmacologiques ont montré que l'administration concomitante du ticagrelor avec l'héparine, l'énoxaparine et l'AAS n'a aucun effet sur les taux plasmatiques du ticagrelor ou de son métabolite actif. Si cliniquement indiqué, les médicaments altérant l'hémostase doivent être administrés avec prudence en association avec BRILIQUE (voir «Mises en garde et précautions»).
Aucune donnée n'est disponible concernant l'administration concomitante de BRILIQUE avec des inhibiteurs puissants de la PGP (par exemple vérapamil, quinidine, ciclosporine) qui pourraient augmenter l'exposition au ticagrelor. Si cliniquement indiquée, leur administration concomitante doit être réalisée avec prudence (voir «Mises en garde et précautions»).
Une exposition retardée ou réduite aux inhibiteurs du P2Y12 par voie orale, y compris le ticagrelor et son métabolite actif, a été rapportée chez des patients traités par la morphine (environ 35% de réduction avec le ticagrelor). Cette interaction peut être liée à une diminution de la motilité gastro-intestinale et donc s'appliquer à d'autres opioïdes. La pertinence clinique de cette interaction est inconnue.
Effets du ticagrelor sur d'autres médicaments
Médicaments métabolisés par le CYP3A4
Le ticagrelor est un inhibiteur faible du CYP3A4. Une administration concomitante de BRILIQUE et de substrats du CYP3A4 à marge thérapeutique étroite (par exemple cisapride ou alcaloïdes de l'ergot de seigle) n'est pas recommandée, puisque le ticagrelor peut augmenter l'exposition à ces médicaments (voir «Mises en garde et précautions»).
Simvastatine: l'administration concomitante du ticagrelor avec la simvastatine a augmenté de 81% la Cmax de la simvastatine et de 56% son AUC, et elle a augmenté de 64% la Cmax de la simvastatine acide et de 52% son AUC, les valeurs individuelles étant multipliées par 2 à 3 dans certains cas.
L'administration concomitante de ticagrelor avec des doses de simvastatine dépassant 40 mg par jour pourrait causer des effets indésirables de la simvastatine qu'il convient d'évaluer par rapport aux bénéfices potentiels. La simvastatine en dose unique de 80 mg n'a pas eu d'effet sur les concentrations plasmatiques du ticagrelor. Il est possible que le ticagrelor ait des effets similaires sur la lovastatine. L'administration concomitante de BRILIQUE avec des doses de simvastatine ou de lovastatine supérieures à 40 mg n'est pas recommandée (voir «Mises en garde et précautions»).
Atorvastatine: l'administration concomitante d'atorvastatine et de ticagrelor a augmenté de 23% la Cmax de l'atorvastatine acide et de 36% son AUC. Des augmentations comparables de l'AUC et de la Cmax ont été observées pour tous les métabolites de l'atorvastatine acide. Ces augmentations ne sont pas considérées comme cliniquement significatives.
Un effet similaire sur les autres statines métabolisées par CYP3A4 ne peut pas être exclu. 93% des patients traités au ticagrelor dans le cadre de l'étude PLATO prenaient différentes statines sans que cette association ait donné lieu à des réserves de sécurité concernant la prise de statines chez cette cohorte.
Médicaments métabolisés par le CYP2C9
Tolbutamide
L'administration concomitante de ticagrelor avec le tolbutamide n'a pas modifié les concentrations plasmatiques respectives de ces médicaments. Une dose unique de 500 mg de tolbutamide n'a pas eu d'influence sur le taux plasmatique de ticagrelor, ce qui suggère que le ticagrelor n'est pas un inhibiteur du CYP2C9 et qu'une interférence avec les médicaments métabolisés par le CYP2C9 comme la warfarine et le tolbutamide est peu probable.
Des interactions pharmacodynamiques avec des antagonistes de la vitamine K ne peuvent cependant pas être exclues (voir «Mises en garde et précautions»).
Contraceptifs oraux
L'administration concomitante de BRILIQUE, de lévonorgestrel et d'éthinylestradiol a augmenté l'exposition à l'éthinylestradiol d'environ 20%, mais n'a pas modifié la pharmacocinétique du lévonorgestrel. Aucun effet cliniquement significatif n'est attendu sur l'efficacité contraceptive du lévonorgestrel et de l'éthinylestradiol lors d'une administration concomitante de BRILIQUE.
Médicaments métabolisés par le CYP2D6 – venlafaxine
L'administration concomitante de ticagrelor et de venlafaxine n'a influencé ni l'AUC ni la Cmax de l'O-desméthylvenlafaxine ni l'AUC de la venlafaxine. La Cmax de la venlafaxine était augmentée de 22% après l'administration d'une dose unique de ticagrelor. La venlafaxine n'avait aucune influence sur la concentration plasmatique du ticagrelor. Ces résultats indiquent que le ticagrelor n'est pas un inhibiteur du CYP2D6 et qu'il est improbable que le ticagrelor influence le métabolisme de médicaments métabolisés par le CYP2D6 comme la venlafaxine ou le métoprolol.
Substrats de la glycoprotéine P (PGP)
L'administration concomitante de BRILIQUE a augmenté de 75% la Cmax de la digoxine et de 28% son AUC. La Cmin moyenne de la digoxine a été augmentée d'environ 30% – et chez certains patients multipliée par deux – lors de l'administration concomitante de ticagrelor. En présence de digoxine, la Cmax et l'AUC du ticagrelor et de son métabolite actif n'ont pas été modifiées. Une surveillance clinique et/ou biologique appropriée est donc recommandée lors de l'administration concomitante de BRILIQUE avec des médicaments substrats de la PGP à marge thérapeutique étroite, comme la digoxine ou la ciclosporine.
Autres traitements concomitants
En raison d'observations de pauses ventriculaires et de bradycardies le plus souvent asymptomatiques, BRILIQUE doit être administré avec précaution en cas d'association avec des médicaments connus pour induire des bradycardies (voir «Mises en garde et précautions»). Cependant, aucune manifestation d'un effet indésirable cliniquement significatif n'a été observée dans l'étude PLATO après l'administration concomitante de médicaments connus comme pouvant induire une bradycardie (par exemple 96% de patients traités aux bêtabloquants, 33% traités aux inhibiteurs calciques diltiazem et vérapamil, 4% traités à la digoxine).
Dans des études cliniques, BRILIQUE a été fréquemment administré à long terme en même temps que les médicaments suivants selon les besoins et les maladies concomitantes: AAS, inhibiteurs de la pompe à protons, statines, bêtabloquants, inhibiteurs de l'enzyme de conversion de l'angiotensine et antagonistes des récepteurs de l'angiotensine. BRILIQUE a été administré pour de courtes périodes en association avec de l'héparine, de l'héparine de bas poids moléculaire et des inhibiteurs de la GpIIb/IIIa. On n'a pas observé de signes d'effets indésirables cliniquement significatifs avec ces divers médicaments.
En raison d'interactions pharmacodynamiques potentielles, toute administration concomitante de BRILIQUE avec des médicaments connus pour altérer l'hémostase doit être réalisée avec prudence (voir «Mises en garde et précautions»).
En raison de rapports de saignements cutanés anormaux sous ISRS (par exemple paroxétine, sertraline et citalopram), BRILIQUE doit être administré avec précaution en cas d'association avec les ISRS car cela peut augmenter le risque de saignement.
Grossesse/Allaitement
Aucune étude clinique n'a été effectuée avec des femmes enceintes ou allaitant.
Grossesse
Les données sur l'utilisation du ticagrelor chez la femme enceinte sont absentes ou limitées. Les études chez l'animal ont montré une toxicité sur la reproduction (voir «Données précliniques»). BRILIQUE ne doit pas être utilisé pendant la grossesse, sauf nécessité absolue.
Allaitement
On ignore si le ticagrelor passe dans le lait maternel. Des études sur des rats ont montré que le ticagrelor et son métabolite actif passent dans le lait. BRILIQUE ne doit pas être utilisé pendant la période d'allaitement.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude n'a été réalisée sur les effets de BRILIQUE sur l'aptitude à conduire des véhicules et à utiliser des machines. Il est attendu que BRILIQUE n'a aucun ou qu'un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines. Des états de vertige et de confusion ont été rapportés pendant le traitement par BRILIQUE. Les patients chez lesquels ces symptômes se manifestent doivent donc être prudents pour la conduite d'un véhicule ou la manipulation de machines.
Effets indésirables
Résumé du profil de sécurité d'emploi
La sécurité d'emploi de BRILIQUE a été évaluée dans deux grandes études de phase III (PLATO et PEGASUS) ayant inclus plus de 39 000 patients (voir «Propriétés/Effets»). Les effets indésirables médicamenteux importants observés lors de ces études sont discutés ci-dessous.
La sécurité d'emploi de BRILIQUE 90 mg chez les patients présentant des syndromes coronariens aigus (angor instable, NSTEMI et STEMI) a été évaluée dans l'étude PLATO. Dans cette étude les patients traités par BRILIQUE 90 mg deux fois par jour ont été comparés à des patients traités par clopidogrel 75 mg une fois par jour, les deux groupes recevant en association de l'AAS ou d'autres traitements standard.
Dans l'étude PLATO, la durée médiane de traitement par BRILIQUE 90 mg était de 277 jours. L'incidence des arrêts dus à des événements indésirables a été plus élevée chez les patients traités par BRILIQUE 90 mg que sous clopidogrel (7,4% vs 5,4%).
Dans l'étude PEGASUS, la sécurité de BRILIQUE a été évaluée chez des patients ayant des antécédents connus d'infarctus du myocarde datant d'au moins 12 mois et un risque élevé de développer des événements athérothrombotiques; l'étude a comparé des patients traités par BRILIQUE 60 mg deux fois par jour ou 90 mg deux fois par jour en association avec l'AAS à des patients sous AAS en monothérapie et suivant d'autres traitements standard. La durée médiane de traitement par BRILIQUE 60 mg était de 29,4 mois. Dans l'étude PEGASUS, l'incidence des arrêts dus à des événements indésirables était plus élevée chez les patients sous BRILIQUE que chez ceux sous AAS en monothérapie (16,1% pour BRILIQUE 60 mg avec AAS vs 8,5% pour AAS en monothérapie). Les effets indésirables les plus fréquemment rapportés sous ticagrelor étaient les saignements et la dyspnée.
Les effets indésirables suivants ont été identifiés dans les études cliniques de phase III PEGASUS et PLATO.
Ces effets indésirables sont classés en fonction de leur classe de systèmes d'organes MedDRA et de leur fréquence. Les catégories de fréquence sont définies selon les conventions suivantes: très fréquent (≥1/10), fréquent (≥1/100 à <1/10), occasionnel (≥1/1000 à <1/100), rare (≥1/10'000 à <1/1000).
Tumeurs bénignes, malignes et non précisées (incl. kystes et polypes)
Occasionnel: saignements d'une tumeur (par exemple saignement dû à un cancer de la vessie, de l'estomac ou du côlon).
Affections hématologiques et du système lymphatique
Très fréquent: saignements dus à des troubles hématologiques (par exemple augmentation de la tendance aux ecchymoses, hématomes spontanés, diathèse hémorragique) (10,3%).
Troubles du métabolisme et de la nutrition
Très fréquent: hyperuricémiea (22,1%).
Fréquent: goutte.
Affections psychiatriques
Occasionnel: état confusionnel.
Affections du système nerveux
Fréquent: vertiges, syncope.
Occasionnel: hémorragie intracrânienne (c'est-à-dire une hémorragie intracrânienne spontanée, causée par une intervention ou par un traumatisme).
Affections oculaires
Occasionnel: hémorragie oculaire (par exemple intra-oculaire, conjonctivale, rétinienne).
Affections de l'oreille et du conduit auditif
Fréquent: vertiges.
Occasionnel: hémorragie de l'oreille.
Affections vasculaires
Fréquent: hypotension.
Affections respiratoires, thoraciques et médiastinales
Très fréquent: dyspnée (15.7%).
Occasionnel: saignement des voies respiratoires (par exemple épistaxis, hémoptysie).
Affections gastro-intestinales
Fréquent: hémorragie gastro-intestinale (par exemple saignement gingival, saignement rectal, hémorragie d'un ulcère gastrique), diarrhée, nausée.
Occasionnel: hémorragie rétropéritonéale.
Affections de la peau et des tissus sous-cutanés
Fréquent: saignement sous-cutané ou dermique (par exemple ecchymoses, hémorragie cutanée, pétéchies), prurit.
Affections musculosquelettiques
Occasionnel: saignement musculaire (par exemple hémarthrose, hémorragie musculaire).
Affections du rein et des voies urinaires
Fréquent: saignement des voies urinaires (par exemple hématurie, cystite hémorragique).
Affections des organes de reproduction et des seins
Occasionnel: saignement des organes de reproduction (par exemple saignement vaginal, hémospermie, hémorragie post-ménopausique).
Investigations
Fréquent: augmentation du taux sanguin de créatininea.
Lésions, intoxications et complications liées aux procédures
Fréquent: hémorragies après une intervention, saignement traumatique (par exemple contusion, hématome traumatique, saignement hémorragique traumatique).
a fréquences provenant de résultats d'analyses (augmentation de l'acide urique >limite supérieure de la normale à partir d'une valeur initiale inférieure à l'intervalle de référence ou dans celui-ci. Augmentation de la créatinine >50% de la valeur initiale) et non pas fréquence brute des notifications de l'événement indésirable
Effets indésirables après commercialisation
Les effets indésirables suivants ont été observés après la mise sur le marché de BRILIQUE. Etant donné que ces données proviennent d'annonces spontanées issues d'une population de taille inconnue, il n'est pas toujours possible d'en estimer la fréquence de manière fiable.
Affections du système immunitaire
Réactions d'hypersensibilité, y compris angio-œdème (voir «Contre-indications»).
Affections de la peau et du tissu sous-cutané
Eruption cutanée.
Affections hématologiques
Purpura thrombotique thrombocytopénique (voir «Mises en garde et précaution»).
Description de certains effets indésirables
Résultats concernant les événements hémorragiques dans l'étude PLATO
Les principaux critères d'exclusion étaient un risque accru de saignements, une thrombopénie cliniquement importante ou une anémie, des antécédents de saignements intracrâniens, un saignement gastro-intestinal au cours des 6 derniers mois ou une intervention chirurgicale importante au cours des 30 derniers jours.
Le tableau 1 présente les résultats généraux concernant les événements hémorragiques dans l'étude PLATO.
Tableau 1: Analyse des événements hémorragiques généraux, estimation de Kaplan-Meier des taux d'hémorragies après traitement à 12 mois (PLATO)
Critères de sécurité | BRILIQUE 90 mg deux fois par jour | Clopidogrel 75 mg une fois par jour | Valeur p | |
KM % | Hazard Ration (95% IC) | |||
Définition des catégories d'hémorragies dans l'étude PLATO | ||||
Hémorragies majeures au total | 11,6 | 1,04 (0,95, 1,13) | 11,2 | 0,4336 |
Hémorragies fatales/engageant le pronostic vital | 5,8 | 1.03 (0,90, 1,16) | 5,8 | 0,6988 |
Toutes les hémorragies majeures et mineures confondues | 16,1 | 1,11 (1,03, 1,20) | 14,6 | 0,0084 |
Hémorragies majeures non associées à un PAC | 4,5 | 1,19 (1,02, 1,38) | 3,8 | 0,0264 |
Hémorragies majeures non dues à une intervention | 3,1 | 1,31 (1.08, 1.60) | 2,3 | 0,0058 |
Hémorragies majeures et mineures non dues à une intervention | 5,9 | 1,39 (1,21, 1,60) | 4,3 | <0,0001 |
Catégorie d'hémorragies selon l'échelle TIMI | ||||
Hémorragies majeures | 7,9 | 1,03 (0,93, 1,15) | 7,7 | 0,5669 |
Hémorragies majeures et mineures | 11,4 | 1,05 (0,96, 1,15) | 10,9 | 0,3272 |
L'étude PLATO a utilisé les définitions suivantes pour les hémorragies:
«Hémorragies mortelles/engageant le pronostic vital»: hémorragies mortelles, toute hémorragie intracrânienne ou intrapéricardique avec tamponnade cardiaque; ou avec hypovolémique choc ou hypotension sévère, nécessitant des vasopresseurs/médicaments à effet inotrope ou une intervention chirurgicale; ou hémorragie cliniquement évidente avec une perte d'hémoglobine de plus de ≥5 g/dl; ou transfusion de 4 unités ou davantage.
«Autres hémorragies majeures»: hémorragie associée à une invalidation notable ou cliniquement évidente avec une perte d'hémoglobine de 3 à 5 g/dl; ou transfusion de 2 à 3 unités (sang entier ou concentré d'érythrocytes) à cause d'une hémorragie.
«Hémorragies mineures»: exigeant une intervention médicale pour stopper ou traiter l'hémorragie
«Hémorragie TIMI majeure»: hémorragie engageant le pronostic vital ou toute hémorragie intracrânienne, ou signes d'hémorragie cliniquement manifeste associée à une réduction du taux d'hémoglobine supérieure à 5 g/dl, ou, si Hb non disponible, diminution de l'hématocrite de 15%.
«Hémorragie TIMI mineure»: hémorragie cliniquement manifeste associée à une réduction du taux d'hémoglobine de 3 à 5 g/dl.
Dans l'étude PLATO, l'intervalle jusqu'au premier événement du groupe «hémorragies majeures au total» n'a pas été significativement différent entre BRILIQUE et le clopidogrel. Les hémorragies mortelles ont été rares dans cette étude: 20 (0,2%) sous BRILIQUE 90 mg deux fois par jour et 23 (0,3%) sous clopidogrel 75 mg une fois par jour. En incluant les hémorragies mineures, l'incidence des hémorragies majeures + mineures a été significativement supérieure sous BRILIQUE versus clopidogrel dans l'étude PLATO. Les incidences d'hémorragies selon la définition TIMI n'étaient pas significativement différentes entre BRILIQUE et le clopidogrel.
Hémorragies liées à un pontage aorto-coronarien:
Dans l'étude PLATO, 1584 patients (12% de la cohorte) ont eu un PAC et 42% d'entre eux ont eu un saignement majeur fatal ou engageant le pronostic vital selon le critère PLATO, sans différence entre les groupes de traitement. Des saignements fatals liés à un PAC sont survenus chez 6 patients dans chaque groupe de traitement (voir «Mises en garde et précautions»).
Saignements non liés à un pontage aorto-coronarien: BRILIQUE et clopidogrel ne se distinguent pas l'un de l'autre en ce qui concerne les hémorragies majeures fatales/engageant le pronostic vital (définition PLATO) qui n'étaient pas dues à un PAC. Cependant les hémorragies définies comme «hémorragies majeures au total» (définition PLATO), TIMI majeures et TIMI majeures + mineures étaient plus fréquentes avec BRILIQUE. De même, lorsqu'on exclut tous les saignements liés à une intervention, davantage de saignements sont survenus sous BRILIQUE que sous clopidogrel (tableau 1). Les arrêts de traitement liés à des saignements non liés à une intervention ont été plus fréquents sous BRILIQUE (2,9%) que sous clopidogrel (1,2%; p <0,001).
Aucun des facteurs suivants, âge, sexe, poids, origine ethnique, origine géographique, maladies associées, traitements associés, antécédents médicaux incluant les accidents vasculaires cérébraux et les accidents ischémiques transitoires, n'a permis de prédire les saignements globaux ou les saignements majeurs (définition PLATO) non liés à une intervention. Il n'y a donc pas de sous-groupe identifié comme à risque de quelque forme de saignement que ce soit.
Saignement intracrânien: il y a eu plus de saignements intracrâniens non liés à une intervention dans le groupe BRILIQUE (n=27 saignements chez 26 patients, 0,3%) que dans le groupe clopidogrel (n=14 saignements, 0,2%), avec 11 saignements fatals sous BRILIQUE et un sous clopidogrel. Il n'y a pas eu de différence sur la totalité des hémorragies fatales. Considérant les comorbidités significatives et les facteurs de risque cardiovasculaire dans la population de patients examinée, l'incidence des saignements intracrâniens était basse dans les deux groupes de traitement.
Résultats concernant les événements hémorragiques dans l'étude PEGASUS
Les principaux critères d'exclusion étaient l'utilisation prévue de médicaments pouvant entraîner un risque accru de saignements, des troubles hémorragiques ou des antécédents d'AVC ou de saignement intracrânien, une tumeur du système nerveux central, une anomalie vasculaire intracrânienne, un saignement gastro-intestinal au cours des 6 derniers mois, une intervention chirurgicale intracrânienne ou de la moelle épinière au cours des 5 derniers mois ou une intervention chirurgicale importante au cours des 30 derniers jours.
Le tableau 2 présente les résultats généraux concernant les événements hémorragiques dans l'étude PEGASUS.
Tableau 2 – Analyse des événements hémorragiques généraux, estimation de Kaplan-Meier des taux d'hémorragies après traitement à 36 mois (PEGASUS)
BRILIQUE 60 mg deux fois par jour + AAS | AAS en monothérapie | |||
Critères de sécurité | KM % | Hazard Ratio | KM % | Valeur de p |
Catégories de saignements, définitions TIMI | ||||
Majeurs | 2,3 | 2,32 (1,68, 3,21) | 1,1 | <0,0001 |
Fatals | 0,3 | 1,00 (0,44, 2,27) | 0,3 | 1,0000 |
Saignements intracrâniens | 0,6 | 1,33 (0,77, 2,31) | 0,5 | 0,3130 |
Autres majeurs | 1,6 | 3,61 (2,31, 5,65) | 0,5 | <0,0001 |
Majeurs ou mineurs | 3,4 | 2,54 (1,93, 3,35) | 1,4 | <0,0001 |
Majeurs ou mineurs ou nécessitant un traitement médical | 16,6 | 2,64 (2,35, 2,97) | 7,0 | <0,0001 |
Catégories de saignements, définitions PLATO | ||||
Majeurs | 3,5 | 2,57 (1,95, 3,37) | 1,4 | <0,0001 |
Fatals/engageant le pronostic vital | 2,4 | 2,38 (1,73, 3,26) | 1,1 | <0,0001 |
Autres majeurs | 1,1 | 3,37 (1,95, 5,83) | 0,3 | <0,0001 |
Majeurs ou mineurs | 15,2 | 2,71 (2,40, 3,08) | 6,2 | <0,0001 |
Définitions des catégories de saignements:
Majeurs TIMI: saignement fatal OU tout saignement intracrânien, OU signes cliniquement évidents d'hémorragie avec une diminution de l'hémoglobinémie (Hb) ≥5 g/dl, ou, si Hb non disponible, diminution de l'hématocrite (Hct) >15%.
Fatal: événement hémorragique aboutissant directement au décès dans les 7 jours.
Autres majeurs, définition TIMI: saignements majeurs non fatals, non intracrâniens, définition TIMI.
Mineurs, définition TIMI: cliniquement évidents avec une diminution de 3 à 5 g/dl de l'hémoglobine.
Nécessitant un traitement médical, définition TIMI: nécessitant une intervention OU entraînant une hospitalisation OU nécessitant une évaluation.
Majeurs fatals/engageant le pronostic vital, définition PLATO: saignements fatals OU tout saignement intracrânien OU saignement intrapéricardique avec tamponnade cardiaque OU avec choc hypovolémique ou hypotension sévère nécessitant le recours à des vasopresseurs/inotropes ou une intervention chirurgicale OU cliniquement évidents avec une diminution >5 g/dl de l'hémoglobinémie OU la transfusion de ≥4 culots globulaires.
Autres majeurs, définition PLATO: entraînant un handicap significatif OU cliniquement évidents avec une diminution de 3 à 5 g/dl de l'hémoglobine OU la transfusion de 2 à 3 culots globulaires.
Mineurs, définition PLATO: nécessitant une intervention médicale pour arrêter ou traiter le saignement.
Dans l'étude PEGASUS, les saignements majeurs (définition TIMI) ont été plus fréquents sous BRILIQUE 60 mg administré deux fois par jour que sous AAS en monothérapie. Aucune augmentation du risque hémorragique n'a été observée pour les saignements fatals, et seule une augmentation mineure a été observée pour les hémorragies intracrâniennes comparativement à l'AAS en monothérapie. Quelques événements hémorragiques fatals sont survenus au cours de l'étude, 11 (0,3%) pour BRILIQUE 60 mg et 12 (0,3%) pour l'AAS en monothérapie. L'augmentation observée du risque de saignements majeurs TIMI sous BRILIQUE 60 mg a été principalement due à une fréquence plus élevée des autres saignements majeurs TIMI, liés à des événements gastro-intestinaux.
Des augmentations des profils de saignements similaires aux saignements majeurs TIMI ont été observées pour les catégories de saignements majeurs ou mineurs TIMI, majeurs PLATO et majeurs ou mineurs PLATO (voir tableau 2). L'arrêt du traitement en raison de saignements a été plus fréquent sous BRILIQUE 60 mg qu'avec l'AAS en monothérapie (respectivement 6,2% et 1,5%). La majorité de ces saignements a été de moindre sévérité (nécessitant un traitement médical selon la définition TIMI), par exemple épistaxis, ecchymose et hématomes.
Le profil des saignements sous BRILIQUE 60 mg a été uniforme dans plusieurs sous-groupes prédéfinis (par exemple par âge, sexe, poids, origine ethnique, région géographique, pathologies concomitantes, traitement concomitant et antécédents médicaux) pour les saignements majeurs TIMI, majeurs ou mineurs TIMI et majeurs PLATO.
Saignements intracrâniens: des saignements intracrâniens spontanés ont été rapportés à des taux similaires sous BRILIQUE 60 mg et sous AAS en monothérapie (n=13, 0,2% dans les deux groupes de traitement). La fréquence des saignements intracrâniens d'origine traumatique ou dus à une procédure a été légèrement plus élevée sous BRILIQUE 60 mg (n=15, 0,2%) que sous AAS en monothérapie (n=10, 0,1%). Six saignements intracrâniens fatals sont survenus sous BRILIQUE 60 mg et 5 sous AAS en monothérapie. L'incidence des saignements intracrâniens a été faible dans les deux groupes de traitement, étant donné les comorbidités significatives et les facteurs de risque cardiovasculaire dans la population étudiée.
Dyspnée
Dans l'étude PLATO, des effets secondaires de type dyspnée ont été rapportés chez 13,8% des patients traités par BRILIQUE 90 mg deux fois par jour et chez 7,8% des patients traités par 75 mg de clopidogrel. La plupart des événements indésirables de type dyspnée étaient d'intensité légère à modérée et s'amélioraient souvent sans qu'il soit nécessaire d'arrêter le traitement. La dyspnée se présentait la plupart du temps sous forme d'épisodes uniques (chez 87% des patients) survenant peu de temps après le début du traitement.
La dyspnée en tant qu'effet secondaire sévère a été observée chez 0,7% des patients traités par BRILIQUE et chez 0,4% des patients traités par clopidogrel. Les patients ayant rapporté une dyspnée avaient tendance à être plus âgés et avaient plus fréquemment présenté une dyspnée, une insuffisance cardiaque, une BPCO ou un asthme avant le début du traitement. Les résultats de PLATO ne permettent pas de conclure que la fréquence accrue sous BRILIQUE soit due à une affection cardiaque ou pulmonaire nouvelle ou s'aggravant (voir «Propriétés/Effets» - Mécanisme de l'adénosine). BRILIQUE ne modifie pas les explorations fonctionnelles respiratoires (voir «Mises en garde et précautions»).
Dans l'étude PEGASUS, des dyspnées ont été rapportées chez 14,2% des patients traités par BRILIQUE 60 mg deux fois par jour et chez 5,5% de patients traités par AAS en monothérapie. Comme dans l'étude PLATO, les cas de dyspnée rapportés ont été le plus souvent d'intensité légère à modérée (voir «Mises en garde et précautions»).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Il n'existe actuellement aucun antidote connu pour neutraliser les effets de ticagrelor, et il n'est pas attendu que le ticagrelor soit dialysable (voir «Mises en garde et précautions»). Le traitement du surdosage doit suivre la pratique médicale standard locale. L'effet pharmacologique attendu en cas de surdosage de ticagrelor est une prolongation de la durée du risque de saignements liés à l'inhibition de l'agrégation plaquettaire. Des mesures de soutien appropriées devront être prises si des saignements se produisent. Le ticagrelor est bien toléré jusqu'à des doses uniques de 900 mg. Une toxicité gastro-intestinale a été l'événement limitant dans une étude d'escalade de doses uniques. Les autres effets indésirables significatifs au plan clinique pouvant survenir en cas de surdosage sont la dyspnée et les pauses ventriculaires (voir «Effets indésirables»).
En cas de surdosage, il faudra rechercher ces effets indésirables potentiels et considérer une surveillance électrocardiographique continue.
Propriétés/Effets
Code ATC
B01AC24
Mécanisme d'action
BRILIQUE contient le principe actif ticagrelor, une substance appartenant à la classe chimique des cyclopentyltriazolopyrimidines (CPTP). Il s'agit d'un antagoniste oral, à action directe, sélectif et réversible du récepteur P2Y12 qui empêche l'activation et l'agrégation plaquettaires déclenchées par l'adénosine diphosphate (ADP) et dépendantes du P2Y12. Le ticagrelor n'empêche pas la liaison entre le récepteur et l'ADP, mais la transduction du signal médiée par l'ADP par sa liaison avec le récepteur P2Y12.
Comme les plaquettes sont impliquées dans le déclenchement et/ou le développement des complications thrombotiques observées dans l'athérosclérose, une inhibition de la fonction plaquettaire est en mesure d'atténuer le risque d'événements cardiovasculaires tels que décès par arrêt cardiaque, infarctus du myocarde ou accident vasculaire cérébral.
Le ticagrelor dispose d'un autre mécanisme d'action qui consiste en une augmentation du niveau endogène local d'adénosine par une inhibition du transporteur équilibrant type 1 de nucléosides (ENT-1). En présence d'hypoxie et de lésion tissulaire, l'adénosine est synthétisée localement par la dégradation de l'adénosine triphosphate et de l'adénosine diphosphate (ATP et ADP) libérées. Comme la dégradation de l'adénosine a lieu essentiellement dans l'espace intracellulaire, l'inhibition de l'ENT-1 par le ticagrelor entraîne un allongement de la demi-vie de l'adénosine. Le ticagrelor ne déploie pas d'action directe cliniquement importante sur les récepteurs de l'adénosine (A1, A2A, A2B, A3) et n'est pas métabolisé en adénosine. De nombreux effets sont documentés pour l'adénosine, parmi lesquels: vasodilatation, inhibition de l'agrégation plaquettaire, modulation de la réaction inflammatoire et induction d'une dyspnée, ces effets pouvant contribuer au profil clinique du ticagrelor.
Pharmacodynamie
Apparition de l'effet
L'inhibition de l'agrégation plaquettaire (IPA = inhibition of platelet aggregation) par le ticagrelor et le clopidogrel a été examinée dans le cadre d'une étude de 6 semaines au cours de laquelle l'effet antiagrégant aigu et chronique a été évalué en réaction à 20 µM d'ADP agissant comme agoniste de l'agrégation thrombocytaire chez des patients ayant une cardiopathie coronarienne stable et traités par de l'AAS. L'apparition de l'effet a été évaluée après une dose de charge de 180 mg de ticagrelor ou 600 mg de clopidogrel. Le ticagrelor démontre une rapidité de son effet pharmacologique, comme le montre l'inhibition moyenne de l'agrégation plaquettaire, qui est d'environ 41%, 0,5 heure après une dose de charge de 180 mg de ticagrelor. L'inhibition maximale de l'agrégation plaquettaire, atteinte 2 à 4 heures après l'administration, est de 89%. Elle se maintient pendant 2 à 8 heures. L'inhibition finale de l'agrégation plaquettaire est supérieure à 70% 2 heures après l'administration du traitement chez 90% des patients.
Disparition de l'effet
Si un pontage aorto-coronarien est prévu, le risque de saignement avec le ticagrelor est augmenté comparativement au clopidogrel quand il est arrêté moins de 96 heures avant l'intervention.
Données concernant le remplacement du traitement
Le remplacement du clopidogrel 75 mg une fois par jour par BRILIQUE 90 mg deux fois par jour conduit à une augmentation absolue de l'inhibition de l'agrégation plaquettaire de 26,4%, et le remplacement de BRILIQUE par le clopidogrel entraîne une diminution absolue de l'IAP de 24,5%. Les patients peuvent passer du clopidogrel au BRILIQUE sans interruption de l'effet antiagrégant plaquettaire (voir «Posologie/Mode d'emploi»).
Mécanisme de l'adénosine (ENT-1)
Le ticagrelor a entraîné une augmentation de la concentration plasmatique d'adénosine chez les patients ayant un SCA et a renforcé diverses réactions physiologiques à l'adénosine. L'adénosine est un vasodilatateur; il a été établi que le ticagrelor accroît l'augmentation induite par l'adénosine du débit sanguin coronaire chez des volontaires sains comme chez des patients ayant un SCA. L'adénosine est un antiagrégant plaquettaire endogène; il a été démontré que le ticagrelor renforce l'inhibition de l'agrégation plaquettaire liée à l'adénosine, en plus de son action anti-plaquettaire par antagonisme au niveau du récepteur P2Y12. De même, l'adénosine induit une dyspnée; il a été prouvé que le ticagrelor renforce la dyspnée induite par l'adénosine chez des volontaires sains. Il n'est donc pas exclu que la dyspnée observée chez certains patients sous ticagrelor soit partiellement médiée par l'adénosine (voir «Effets indésirables»).
Efficacité clinique
Les preuves cliniques de l'efficacité de BRILIQUE proviennent de deux études de phase III:
- L'étude PLATO [PLATO = PLATelet Inhibition and Patient Outcomes] qui a comparé BRILIQUE au clopidogrel, tous deux administrés en association avec l'AAS et d'autres traitements standard (syndrome coronarien aigu).
- L'étude PEGASUS TIMI-54 [PEGASUS = PrEvention with TicaGrelor of SecondAry Thrombotic Events in High-RiSk AcUte Coronary Syndrome Patients] qui a comparé BRILIQUE en association avec l'AAS et l'AAS en monothérapie (traitement prolongé avec antécédents d'infarctus du myocarde et la présence d'autres facteurs de risque cardiovasculaire).
Etude PLATO (syndrome coronarien aigu)
L'étude PLATO a inclus 18'624 patients ayant un syndrome coronarien aigu (angor instable [AI], infarctus du myocarde sans sus-décalage du segment ST [NSTEMI] ou infarctus du myocarde avec sus-décalage du segment ST [STEMI]) avec apparition des symptômes depuis moins de 24 heures et traités initialement soit médicalement, soit par intervention coronaire percutanée (ICP) ou par pontage aorto-coronarien (PAC) (voir «Indications/Possibilités d'emploi»).
Sur la base d'une administration quotidienne d'AAS, BRILIQUE à la dose de 90 mg administré 2 fois par jour s'est montré supérieur au clopidogrel à la dose de 75 mg administré une fois par jour, quant à la prévention du critère composite primaire de décès cardiovasculaire (CV), d'infarctus du myocarde (IM) ou d'accident vasculaire cérébral (AVC), avec une différence due essentiellement à une réduction des décès CV et des IM. Les patients ont reçu une dose de charge de 300 mg de clopidogrel (possibilité d'administrer 600 mg en cas d'ICP) ou 180 mg de BRILIQUE.
Ce résultat est apparu rapidement (avec une réduction du risque absolu [RRA] de 0,6% et une réduction du risque relatif [RRR] de 12% à trente jours), avec un effet constant du traitement pendant toute la période de 12 mois de l'étude, aboutissant à un RRA de 1,9% et un RRR de 16% à un an. Cela suggère qu'il est approprié de traiter les patients par BRILIQUE jusqu'à 12 mois (voir «Posologie/Mode d'emploi»). Traiter 54 patients avec syndrome coronarien aigu par BRILIQUE à la place du clopidogrel évitera 1 événement athérothrombotique. Traiter 91 patients évitera 1 décès cardiovasculaire (voir Figure 1 et Tableau 3).
L'effet du traitement par BRILIQUE versus clopidogrel apparaît de façon cohérente dans de nombreux sous-groupes, incluant poids; sexe; antécédents médicaux de diabète, d'accident ischémique transitoire, d'accident vasculaire cérébral non hémorragique ou de revascularisation; traitements concomitants incluant les héparines, les anti-GPIIb/IIIa et les inhibiteurs de la pompe à proton (voir «Interactions»); diagnostic final (STEMI, NSTEMI ou angor instable); et stratégie thérapeutique initialement envisagée lors de la randomisation (interventionnelle ou pharmacologique).
Une interaction faiblement significative a été observée en fonction des régions; le Hazard Ratio du critère principal d'évaluation est en faveur du clopidogrel en Amérique du Nord, région ou près de 10% des patients de l'étude avaient été inclus, tandis qu'il est en faveur de BRILIQUE dans le reste monde (valeur p pour l'interaction = 0,045). Des analyses exploratoires suggèrent une association possible avec la dose d'AAS: une diminution de l'efficacité a été observée avec BRILIQUE en augmentant les doses d'AAS. Les doses d'AAS à long terme administrées parallèlement à BRILIQUE devraient être de 75 à 150 mg (voir «Posologie/Mode d'emploi» et «Mises en garde et précautions»).
La Figure 1 présente l'estimation du risque de première apparition d'un des événements du critère primaire composite.
Figure 1: Temps écoulé avant la première survenue d'un décès d'origine CV, d'un IM ou d'un AVC (PLATO)

Aussi bien dans la population atteinte d'angor instable/NSTEMI que dans la population avec STEMI, BRILIQUE a diminué la survenue du critère principal composite d'évaluation comparativement au clopidogrel.
Tableau 3: Analyse des critères primaires et secondaires d'efficacité de l'étude PLATO
Critère primaire (CP) | Patients avec événements | ||||
BRILIQUE 90 mg deux fois par jour | Clopidogrel 75 mg une fois par jour | Réduction du risque relatifa | Hazard ratio | Valeur p | |
Critère composite: décès CV/IM (sauf IM silencieux)/AVC | 9,3 | 10,9 | 16 | 0,84 | p = 0,0003 |
Décès CV | 3,8 | 4,8 | 21 | 0,79 | p = 0,0013 |
IM (hors IM silencieux) | 5,4 | 6,4 | 16 | 0,84 | p = 0,0045 |
Accident vasculaire cérébral (AVC) | 1,3 | 1,1 | -17 | 1,17 | p= 0,2249 |
Critères secondaires | |||||
Critère composite: décès CV/IM (sauf IM silencieux)/AVC et traitement invasif prévu | 8,5 | 10,0 | 16 | 0,84 | p = 0,0025 |
Critère composite: mortalité totale/IM (hors IM silencieux)/AVC | 9,7 | 11,5 | 16 | 0,84 | p = 0,0001 |
Critère composite: décès CV/tous les IM/AVC/IRGb/IRc/AITd/autres EATe | 13,8 | 15,7 | 12 | 0,88 | p = 0,0006 |
Mortalité totale | 4,3 | 5,4 | 22 | 0,78 | p = 0,0003** |
a RRR= réduction du risque relatif = (1-Hazard Ratio) × 100%. Les valeurs avec une diminution relative négative du risque indiquent une augmentation relative du risque.
** Valeur nominale de p; toutes les autres valeurs sont formellement statistiquement significatives selon une analyse hiérarchisée prédéfinie.
b IRG = ischémie récurrente grave
c IR = ischémie récurrente
d AIT = accident ischémique transitoire
e EAT = événement athérothrombotique
Sous-étude Holter
Pour étudier la survenue de pauses ventriculaires et d'autres épisodes arythmiques pendant l'étude PLATO, les investigateurs ont pratiqué un enregistrement Holter chez une sous-population de près de 3'000 patients, dont environ 2'000 ont bénéficié d'enregistrements en phase aiguë de syndrome coronarien aigu et à un mois. La variable principale d'intérêt était la survenue de pauses ventriculaires ≥3 secondes. Le nombre de patients présentant des pauses ventriculaires était plus important sous BRILIQUE (6,0%) que sous clopidogrel (3,5%) pendant la phase aiguë, et atteignait respectivement 2,2% et 1,6% à un mois (voir «Mises en garde et précautions»). L'augmentation du nombre de pauses ventriculaires pendant la phase aiguë du syndrome coronarien aigu était plus prononcée chez les patients sous BRILIQUE ayant des antécédents d'insuffisance cardiaque chronique (9,2% versus 5,4% des patients sans antécédent d'insuffisance cardiaque chronique; pour les patients sous clopidogrel: 4,0% de ceux ayant des antécédents d'insuffisance cardiaque chronique versus 3,6% de ceux n'ayant pas d'antécédent d'ICC). Ce déséquilibre ne s'est pas produit à un mois: 2,0% versus 2,1% pour les patients sous BRILIQUE avec et sans antécédents d'insuffisance cardiaque chronique et 3,8% versus 1,4% sous clopidogrel. Il n'y a eu aucune conséquence clinique associée à ce déséquilibre (y compris la pose de stimulateurs cardiaques) dans cette population de patients.
Sous-étude génétique de PLATO
Le génotypage de 10'285 patients de l'étude PLATO pour les polymorphismes du CYP2C19 et de ABCB1 a permis d'obtenir des corrélations entre ces polymorphismes et les résultats de l'étude PLATO. La supériorité de BRILIQUE par rapport au clopidogrel en termes de réduction des événements cardiovasculaires majeurs n'est pas significativement modifiée par le génotype des patients pour CYP2C19 et ABCB1. Comme dans la totalité de l'étude PLATO, la fréquence des saignements majeurs suivant la définition PLATO n'est pas différente entre BRILIQUE et le clopidogrel, indépendamment du génotype pour CYP2C19 ou ABCB1. Les saignements majeurs suivant la définition PLATO survenant chez des patients n'ayant pas eu de PAC est plus élevée dans le groupe BRILIQUE que dans le groupe clopidogrel chez les patients ayant un ou deux allèles de perte de fonction du CYP2C19, mais similaire à celle du clopidogrel pour les patients n'ayant pas d'allèle de perte de fonction.
Critère composite d'efficacité et de sécurité
Un critère composite d'efficacité et de sécurité (décès CV, IM, AVC, ou événement du type «hémorragies majeures au total» selon la définition PLATO) confirme le bénéfice clinique de BRILIQUE versus clopidogrel (RRR 8%, RAR 1,4%, HR 0,92; p = 0,0257) pendant une période de 12 mois après un syndrome coronarien aigu.
Etude PEGASUS (traitement prolongé avec antécédents d'infarctus du myocarde et la présence d'autres facteurs de risque cardiovasculaire)
L'étude PEGASUS TIMI-54 est une étude événementielle, randomisée, en double aveugle, contrôlée versus placebo, en groupes parallèles, internationale et multicentrique menée chez 21'162 patients dans le but d'évaluer la prévention des événements athérothrombotiques par BRILIQUE administré en deux doses (90 mg deux fois par jour ou 60 mg deux fois par jour) en association avec de faibles doses d'AAS (75 à 150 mg) comparativement à l'AAS en monothérapie chez des patients ayant des antécédents d'infarctus du myocarde et présentant des facteurs additionnels de risque d'athérothrombose.
Facteurs de risque
Les patients étaient éligibles pour participer s'ils étaient âgés de 50 ans ou plus, avaient un antécédent d'infarctus du myocarde (1 à 3 ans avant la randomisation) et présentaient au moins un des facteurs de risque cardiovasculaire suivants:
- un second infarctus du myocarde dans les antécédents
- une coronaropathie multitronculaire documentée
- un diabète nécessitant un traitement
- âge ≥65 ans
- insuffisance rénale chronique non au stade terminal.
Figure 2 – Courbe de Kaplan-Meier et analyse du critère clinique composite principal de décès d'origine CV, d'infarctus du myocarde ou d'AVC dans PEGASUS

Tableau 4 – Analyse du critère principal et des critères secondaires d'efficacité dans PEGASUS
BRILIQUE 60 mg deux fois par jour + | AAS en monothérapie | Valeur de p | |||||||
|---|---|---|---|---|---|---|---|---|---|
Caractéristique | Patients avec événements | KM % | HR (IC à 95%) | Patients avec événements | KM % | ||||
Critère principal | |||||||||
Critère composite décès CV/IM/AVC | 487 | 7.8% | 0,84 | 578 | 9,0% | 0,0043 | |||
Décès CV | 174 | 2.9% | 0,83 | 210 | 3,4% | 0,0676 | |||
IM | 285 | 4.5% | 0,84 | 338 | 5,2% | 0,0314 | |||
AVC | 91 | 1,5% | 0,75 | 122 | 1,9% | 0,0337 | |||
Critère secondaire | |||||||||
Décès CV | 174 | 2,9% | 0,83 | 210 | 3,4% | - | |||
Mortalité toutes causes | 289 | 4,7% | 0,89 | 326 | 5,2% | - | |||
Hazard ratio et valeurs de p pour BRILIQUE vs AAS en monothérapie calculés séparément à partir d'un modèle à risques proportionnels de Cox avec le groupe de traitement à titre de seule variable explicative.
Pourcentage selon Kaplan-Meier calculé à 36 mois.
Remarque: le nombre des premiers événements pour les composantes décès CV, infarctus du myocarde et AVC est le nombre réel des premiers événements pour chaque composante et ne s'ajoute pas au nombre d'événements dans le critère composite.
(s) Indique la significativité statistique.
IC = intervalle de confiance; HR = hazard ratio; KM = Kaplan-Meier; IM = infarctus du myocarde; N = nombre de patients.
Aux deux posologies de 60 mg deux fois par jour et de 90 mg deux fois par jour, BRILIQUE en association avec l'AAS a été supérieur à l'AAS en monothérapie dans la prévention des événements athérothrombotiques (critère composite: décès d'origine cardiovasculaire, infarctus du myocarde et AVC), avec un effet constant du traitement sur la totalité de la période d'étude, donnant une RRR de 16% et une RRA de 1,27% pour BRILIQUE 60 mg, et une RRR de 15% et une RRA de 1,19% pour BRILIQUE 90 mg.
Bien que les profils d'efficacité de BRILIQUE 90 mg et 60 mg soient similaires, des données indiquent que le profil de tolérance et de sécurité de la plus faible dose est meilleur au regard du risque de saignements et de dyspnée. Par conséquent, BRILIQUE 60 mg administré deux fois par jour en association avec l'AAS est recommandé pour la prévention des événements athérothrombotiques (décès d'origine cardiovasculaire, infarctus du myocarde et AVC) chez les patients ayant des antécédents d'infarctus du myocarde datant d'au moins 12 mois et à haut risque de développer un événement athérothrombotique.
Comparativement à l'AAS en monothérapie, l'administration de BRILIQUE 60 mg deux fois par jour a significativement réduit le critère composite principal de décès d'origine cardiovasculaire, d'infarctus du myocarde et d'AVC. Chacune des composantes a contribué à la réduction du critère composite principal (décès d'origine cardiovasculaire RRR 17%, infarctus du myocarde RRR 16% et AVC RRR 25%).
Pour empêcher un événement du critère composite, il faut traiter 79 patients pendant 36 mois par BRILIQUE 60 mg deux fois par jour en association avec de l'AAS à la place de l'AAS en monothérapie.
L'utilité de BRILIQUE au niveau du critère composite principal est aussi apparue pour les deux critères d'évaluation secondaires, en l'occurrence sous la forme d'un recul du nombre autant des décès d'origine cardiovasculaire que de la mortalité globale sous BRILIQUE 60 mg en association avec l'AAS par rapport à l'AAS en monothérapie, la significativité statistique n'ayant toutefois pas été atteinte (voir tableau 4).
Les RRR pour le critère composite de 1 à 360 jours (RRR 17%) et à partir de 361 jours (RRR 16%) ont été similaires avec un effet constant du traitement pendant toute l'étude qui a duré jusqu'à 48 mois (médiane 33 mois). La constance du RRR sur toute la durée suggère que la prolongation du traitement par BRILIQUE est indiquée aussi longtemps que le patient présente un risque élevé de développer un événement athérothrombotique (voir «Posologie/Mode d'emploi»).
L'effet du traitement par BRILIQUE 60 mg deux fois par jour par rapport à l'AAS en monothérapie est apparu de façon cohérente dans de nombreux sous-groupes de patients formés selon des données démographiques telles que poids, sexe, antécédents médicaux et région géographique.
Les bénéfices liés au traitement par BRILIQUE étaient par ailleurs indépendants de l'utilisation d'autres traitements cardiovasculaires, parmi lesquels hypolipémiants, bêtabloquants, inhibiteurs de l'ECA, antagonistes des récepteurs de l'angiotensine, inhibiteurs calciques, dérivés nitrés et inhibiteurs de la pompe à protons (voir «Interactions»).
Pharmacocinétique
Absorption
L'absorption du ticagrelor est rapide, avec un tmax médian d'environ 1,5 heure. La formation du métabolite principal, l'AR-C124910XX (également actif), à partir du ticagrelor est rapide, avec un tmax médian d'environ 2,5 heures. Après administration orale du ticagrelor 90 mg à jeun, la Cmax est de 529 ng/ml et l'AUC de 3451 ng*h/ml. Les rapports métabolite/substance mère sont de 0,28 pour Cmax et de 0,42 pour l'AUC.
La biodisponibilité absolue moyenne du ticagrelor a été estimée à 36% (spectre de 25,4% à 64,0%). L'ingestion d'un repas riche en lipides a conduit à une augmentation de 21% de l'AUC du ticagrelor et à une diminution de 22% de la Cmax du métabolite actif, mais n'a eu d'effet ni sur la Cmax du ticagrelor, ni sur l'AUC du métabolite actif. Ces faibles modifications sont considérées comme ayant une signification clinique minime. Ainsi, le ticagrelor peut être administré avec ou sans aliments. Le ticagrelor et son métabolite actif sont des substrats de la PGP.
Comprimés pelliculés:
Les comprimés de ticagrelor, lorsqu'ils sont écrasés et mélangés dans de l'eau, administrés par voie orale ou par une sonde naso-gastrique dans l'estomac, présentent une biodisponibilité comparable à celle des comprimés entiers (AUC et Cmax entre 80 et 125% pour le ticagrelor et le métabolite actif). L'exposition initiale (0,5 et 1 heure après la prise) de comprimés de ticagrelor écrasés et mélangés dans de l'eau est augmentée par rapport aux comprimés entiers. Cependant en général, après 2 à 48 heures, le profil général de concentration est identique.
Comprimés orodispersibles:
Les comprimés orodispersibles de ticagrelor, dispersés dans la salive et avalés sans eau ou mis en suspension dans de l'eau et administrés par une sonde naso-gastrique dans l'estomac, sont bioéquivalents aux comprimés pelliculés avalés (AUC et Cmax compris entre 80 et 125% pour le ticagrelor et son métabolite actif). Lorsque le comprimé orodispersible est dispersé dans la salive et avalé avec de l'eau, l'AUC du ticagrelor est similaire, alors que la Cmax est diminuée d'environ 15% par rapport au comprimé pelliculé. Il est peu probable que la différence observée pour la Cmax soit cliniquement pertinente.
Distribution
Le volume de distribution du ticagrelor à l'état l'équilibre est de 87,5 l. Le ticagrelor et son métabolite actif se lient fortement aux protéines plasmatiques humaines (>99%).
Métabolisme
Le CYP3A4 est la principale isoenzyme responsable du métabolisme du ticagrelor et de la formation du métabolite actif. Les interactions du ticagrelor et de son métabolite actif avec les autres substrats du CYP3A vont de l'activation à l'inhibition. Le ticagrelor et son métabolite actif sont de faibles inhibiteurs de la glycoprotéine P.
Le métabolite principal du ticagrelor est l'AR-C124910XX. Il est également actif, comme le montre la fixation in vitro sur le P2Y12, récepteur plaquettaire à l'ADP. L'exposition systémique au métabolite actif atteint environ 30 à 40% de celle du ticagrelor.
Élimination
La voie d'élimination principale du ticagrelor est le métabolisme hépatique. Après administration de ticagrelor radiomarqué, la récupération moyenne de la radioactivité est d'environ 84% (57,8% dans les fèces, 26,5% dans l'urine). Les quantités de ticagrelor et de métabolite actif retrouvées dans l'urine ont été inférieures à 1% de la dose administrée. La voie d'élimination principale du métabolite actif est probablement la sécrétion biliaire. La t½ moyenne a été d'environ 6,9 heures (fourchette de 4,5 à 12,8 heures) pour le ticagrelor et de 8,5 heures (fourchette de 6,5 à 12,8 heures) pour le métabolite actif.
Linéarité/non-linéarité
Le ticagrelor a une pharmacocinétique linéaire et l'exposition au ticagrelor et à son métabolite actif (AR-C124910XX) est approximativement proportionnelle à la dose dans le domaine des doses thérapeutiques.
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique
La Cmax et l'AUC du ticagrelor ont été supérieures de respectivement 12% et 23% chez les patients présentant des troubles légers de la fonction hépatique comparativement aux sujets sains correspondants. Aucun ajustement de la posologie n'est nécessaire chez les patients présentant des troubles légers de la fonction hépatique (voir «Posologie/Mode d'emploi»). Le ticagrelor n'a pas été étudié chez les patients présentant des troubles sévères de la fonction hépatique et il n'y a pas d'informations pharmacocinétiques disponibles sur les patients présentant des troubles modérés de la fonction hépatique (voir «Posologie/Mode d'emploi», «Contre-indications» et «Mises en garde et précautions»).
Troubles de la fonction rénale
L'exposition au ticagrelor a été inférieure d'environ 20% et à son métabolite actif supérieure d'environ 17% chez les patients présentant des troubles sévères de la fonction rénale comparativement aux sujets ayant une fonction rénale normale. Un ajustement de la posologie n'est pas nécessaire chez les patients présentant des troubles de la fonction rénale (voir «Posologie/Mode d'emploi»).
Chez les patients sous hémodialyse présentant une insuffisance rénale terminale, l'AUC et la Cmax après administration de 90 mg de Brilique sur une journée sans dialyse étaient respectivement de 38% et 51% plus élevées par rapport aux patients ayant une fonction rénale normale. Une augmentation similaire de l'exposition était observée lorsque Brilique était administré immédiatement avant la dialyse (respectivement 49% et 61%), ce qui montre que BRILIQUE n'est pas dialysable. L'exposition du métabolite actif a augmenté dans une moindre mesure (AUC 13–14% et Cmax 17–36%). L'effet IPA de Brilique était indépendant de la dialyse chez les patients présentant une insuffisance rénale terminale et était similaire à celui des patients présentant une fonction rénale normale.
Patients âgés
Une exposition plus élevée au ticagrelor (environ 63% pour la Cmax et 52% pour l'AUC) et au métabolite actif (environ 60% pour la Cmax et 48% pour l'AUC) a été observée chez les patients âgés (≥65 ans) en comparaison avec aux patients plus jeunes. Ces différences ne sont pas considérées comme cliniquement significatives (voir «Posologie/Mode d'emploi»).
Enfants et adolescents
Le ticagrelor n'a pas été évalué dans la population pédiatrique (voir «Posologie/Mode d'emploi»).
Origine ethnique
Les patients d'origine asiatique ont une biodisponibilité supérieure de 39% par rapport aux patients caucasiens. Les patients auto-identifiés comme Noirs ont une biodisponibilité de BRILIQUE de 18% plus faible lorsque comparé aux patients caucasiens. Dans les études de pharmacologie clinique, l'exposition (Cmax et AUC) à BRILIQUE chez les sujets japonais a été supérieure d'environ 40% (20% après ajustement en fonction du poids corporel) à celle des Caucasiens. L'exposition a été similaire entre des patients auto-identifiés comme hispaniques ou latinos et des patients caucasiens.
Sexe
Une exposition plus élevée au ticagrelor et au métabolite actif a été observée chez la femme par rapport à l'homme. Les différences ne sont pas considérées comme cliniquement significatives.
Données précliniques
D'après les études conventionnelles sur la pharmacologie de sécurité, sur la toxicité après une administration unique et répétée et sur la génotoxicité potentielle, les données précliniques sur le ticagrelor et son métabolite principal (AR-C124910XX) n'ont pas démontré de risque inacceptable d'effets indésirables chez l'homme.
Les réactions indésirables suivantes n'ont pas été observées dans des études cliniques, mais dans des expérimentations animales avec des expositions similaires ou supérieures à celles examinées dans les études cliniques. Elles pourraient donc être significatives pour l'utilisation clinique: toxicité gastro-intestinale et irritations gastro-intestinales.
Dans une étude de 2 ans sur des souris, avec administration de doses orales allant jusqu'à 250 mg/kg/jour (>18 fois l'exposition thérapeutique maximale chez l'homme), aucune tumeur induite par le médicament n'a été observée. Chez des rats mâles, des doses orales allant jusqu'à 120 mg/kg/jour (>15 fois l'exposition thérapeutique maximale chez l'homme) n'ont pas provoqué une augmentation des tumeurs. Chez des rats femelles, seules de fortes doses (>25 fois l'exposition thérapeutique maximale chez l'homme) ont été associées à une augmentation des adénocarcinomes utérins, des adénocarcinomes et adénomes hépatocellulaires, ainsi qu'à une réduction des adénomes hypophysaires et des fibro-adénomes mammaires. L'incidence de tumeurs est restée inchangée après l'administration de doses de 60 mg/kg/jour (8 fois l'exposition thérapeutique maximale chez l'homme). Il est apparu que les tumeurs utérines observées chez les rates sont dues à des effets endocriniens non génotoxiques, provenant d'un dérèglement hormonal après l'administration de ticagrelor fortement dosé. Les tumeurs bénignes du foie sont considérées comme une conséquence de la réaction du foie aux grandes exigences métaboliques dues aux doses élevées de ticagrelor. La signification de ces résultats pour l'homme n'est pas encore définitivement éclaircie à ce jour.
Le ticagrelor a été examiné dans une série de tests in vitro et in vivo. Aucune génotoxicité n'a été mise en évidence.
Le ticagrelor provoque des cycles irréguliers (surtout allongés) chez les rats femelles mais n'affecte pas la fertilité globale des rats mâles et femelles.
Il a été montré que le ticagrelor administré à des rates à des doses orales allant jusqu'à 200 mg/kg/jour (environ 20 fois l'exposition thérapeutique maximale chez l'homme) et administré à des rats mâles à des doses allant jusqu'à 180 mg/kg/jour (15,7 fois l'exposition thérapeutique maximale chez l'homme) n'influence pas la fertilité.
Les études chez le rat et le lapin ont montré une toxicité sur la reproduction, avec une prise de poids maternelle légère, une viabilité néonatale retardée et un faible poids de naissance avec un retard de croissance.
Aux doses orales inférieures à 100 mg/kg/jour chez le rat (5,1 fois l'exposition thérapeutique maximale chez l'homme) et à des doses allant jusqu'à 42 mg/kg/jour chez le lapin (correspond à l'exposition thérapeutique maximale chez l'homme), le ticagrelor n'a eu aucun effet sur le développement fœtal. À part cela, le ticagrelor administré à des rats à des doses allant jusqu'à 60 mg/kg/jour (4,6 fois l'exposition thérapeutique maximale chez l'homme) n'a eu aucun effet sur la mise bas ou le développement postnatal des petits. Aux doses supérieures présentant une toxicité pour la mère, des effets non spécifiques ont été observés chez la progéniture.
Remarques particulières
Incompatibilités
Non applicable.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver dans l'emballage d'origine et ne pas conserver au-dessus de 30 °C.
Tenir le médicament hors de portée des enfants.
Numéro d’autorisation
61389, 66822 (Swissmedic).
Titulaire de l’autorisation
AstraZeneca AG, 6340 Baar.
Mise à jour de l’information
Novembre 2020.
Відгуки (0)

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.




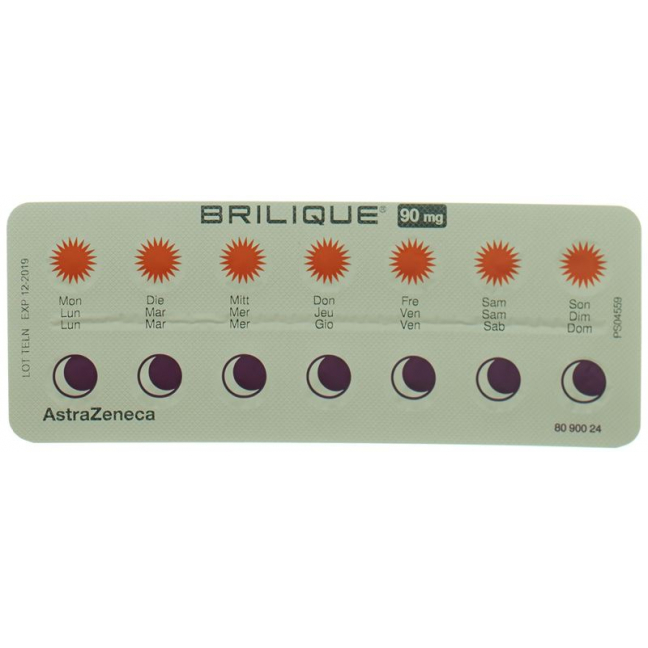


 Deutsch
Deutsch French
French Italian
Italian