Rexulti плівка таблетки 1 мг 28 шт
Rexulti Filmtabl 1 mg 28 Stk
-
21560.61 RUB
При оплате криптовалютой:
Ваша прибыль 2156.06 RUB / 23.73 USDT
- Наявність: Немає в наявності
- Виробник: LUNDBECK (SCHWEIZ) AG
- Модель: 7435327
- ATC-код N05AX16
- EAN 7680664750034
Варіанти
Rexulti плівка таблетки 1 мг 10 шт
11418.61 RUB
Опис
Was ist REXULTI und wann wird es angewendet?
REXULTI Filmtabletten enthalten den Wirkstoff Brexpiprazol.
REXULTI ist ein Arzneimittel zur Behandlung der Symptome einer Schizophrenie bei Erwachsenen ab 18 Jahren.
Auch wenn Sie sich besser fühlen, kann Ihnen Ihr Arzt/Ihre Ärztin REXULTI weiter verschreiben, um ein erneutes Auftreten der Symptome zu verhindern.
Auf Verschreibung des Arztes oder der Ärztin.
Wann darf REXULTI nicht eingenommen werden?
REXULTI darf nicht eingenommen werden, wenn Sie allergisch sind gegen Brexpiprazol oder einen anderen Bestandteil dieses Arzneimittels (siehe unter «Was ist in REXULTI enthalten?»).
Kinder und Jugendliche
Dieses Arzneimittel ist nicht zur Anwendung bei Kindern und Jugendlichen unter 18 Jahren bestimmt. Die Sicherheit und Wirksamkeit bei diesen Patienten wurden nicht untersucht.
Wann ist bei der Einnahme von REXULTI Vorsicht geboten?
Informieren Sie vor der Einnahme von REXULTI Ihren Arzt/Ihre Ärztin, wenn Sie:
- eine ältere Person sind und an Demenz leiden (Verlust des Gedächtnisses und anderer geistiger Fähigkeiten);
- selber oder in der Familiengeschichte Diabetes oder hohen Blutzucker haben;
- hohe Cholesterin-, Triglyzerid-, oder LDL-Cholesterinwerte oder niedrige HDL-Cholesterinwerte haben (Blutfettwerte);
- Probleme mit der Leber oder Niere haben;
- wenn Sie
- Krampfanfälle (Konvulsionen)
- tiefen oder hohen Blutdruck
- Herzprobleme oder einen Schlaganfall
- zu wenig weisse Blutkörperchen haben oder hatten;
- jemals an Spielsucht oder Impulskontrollstörungen gelitten haben (ein unangemessener Drang zu spielen, Geld auszugeben, zu essen oder andere unangepasste Verlangen).
Während der Einnahme von REXULTI,
- informieren Sie Ihren Arzt/Ihre Ärztin, wenn
- eines dieser Symptome von hohem Blutzucker bei Ihnen auftritt: starkes Durstgefühl, Übelkeit, ungewohnt häufiger Harndrang, starkes Hungergefühl, Schwäche oder Müdigkeit, Verwirrung oder fruchtiger Geruch des Atems;
- Sie an Muskelsteife oder Unbeweglichkeit verbunden mit hohem Fieber, Schwitzen, Bewusstseinsstörungen oder sehr schnellem oder unregelmässigem Herzschlag leiden;
- Sie unwillkürliche, unregelmässige Muskelbewegungen, besonders im Gesicht (z.B. an Zunge und Lippen), bemerken;
- Sie Gedanken oder Gefühle entwickeln, sich selbst zu verletzen. Während einer antipsychotischen Behandlung können Selbstmordgedanken und Selbstmordhandlungen auftreten.
- vermeiden Sie Überhitzung oder Austrocknung (Flüssigkeitsmangel). Vermeiden Sie übermässige körperliche Anstrengung und trinken Sie viel Wasser.
Einnahme von REXULTI zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie andere Arzneimittel einnehmen, kürzlich eingenommen haben oder einzunehmen beabsichtigen, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt. Ihr Arzt/Ihre Ärztin kann entscheiden, ob Sie REXULTI zusammen mit diesen anderen Arzneimitteln einnehmen dürfen. Während der Einnahme von REXULTI sollten Sie die Einnahme anderer Arzneimittel weder beginnen noch abbrechen, ohne vorher mit Ihrem Arzt/Ihre Ärztin zu sprechen.
Bei der Einnahme von REXULTI Tabletten zusammen mit anderen Arzneimitteln kann eine Anpassung Ihrer REXULTI Dosierung erforderlich sein. Sie müssen Ihren Arzt/Ihre Ärztin vor allem über die Einnahme folgender Medikamente informieren:
- Blutdrucksenkende Arzneimittel
- Arzneimittel zur Behandlung von Herzrhythmusstörungen (z.B. Chinidin)
- Antidepressiva (z.B. Paroxetin, Fluoxetin) oder pflanzliche Arzneimittel zur Behandlung von Depressionen (z.B. Johanniskraut (Hypericum perforatum))
- Arzneimittel zur Behandlung von Pilzinfektionen (z.B. Ketoconazol)
- Antibiotika (z.B. Rifampicin, Clarithromycin)
- bestimmte Arzneimittel zur Behandlung einer HIV-Infektion (z.B. Ritonavir)
- Arzneimittel zur Behandlung von Epilepsie (z.B. Carbamazepin).
Diese Arzneimittel können das Risiko für Nebenwirkungen erhöhen. Wenn Sie während der Einnahme eines dieser Arzneimittel zusammen mit REXULTI Tabletten ungewöhnliche Symptome bei sich bemerken, müssen Sie Ihren Arzt/Ihre Ärztin aufsuchen.
Laktose
Die REXULTI Filmabletten enthalten Laktose.
Bitte nehmen Sie REXULTI erst nach Rücksprache mit Ihrem Arzt bzw. Ihrer Ärztin ein, wenn Ihnen bekannt ist, dass Sie unter einer Zuckerunverträglichkeit leiden.
Einnahme von REXULTI zusammen mit Alkohol
Das Trinken von Alkohol ist zu vermeiden.
Dieses Arzneimittel beeinträchtigt die Reaktionsfähigkeit, die Fahrtüchtigkeit und die Fähigkeit, Werkzeuge oder Maschinen zu bedienen! Sie dürfen diesen Aktivitäten nicht nachgehen, bis Sie Ihre Reaktion auf auf REXULTI kennen. REXULTI kann Sie schläfrig machen.
Informieren Sie Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbst gekaufte!) einnehmen oder äusserlich anwenden!
Darf REXULTI während einer Schwangerschaft oder in der Stillzeit eingenommen werden?
Wenn Sie schwanger sind oder stillen, oder eine Schwangerschaft vermuten oder beabsichtigen, fragen Sie vor der Einnahme dieses Arzneimittels Ihren Arzt/Ihre Ärztin um Rat.
Die Auswirkungen von REXULTI auf Ihr ungeborenes Kind sind nicht bekannt. Bei Anwendung von REXULTI während des letzten Drittels der Schwangerschaft können bei Ihrem Neugeborenen Störungen der Muskelbewegungen und/oder Arzneimittel-Entzugserscheinungen auftreten.
Es ist nicht bekannt, ob Brexpiprazol in die Muttermilch übertritt. Ihr Arzt/Ihre Ärztin wird gemeinsam mit Ihnen entscheiden, ob Sie REXULTI während der Stillzeit einnehmen sollen.
Wie verwenden Sie REXULTI?
Nehmen Sie dieses Arzneimittel genau nach Vorschrift Ihres Arztes/Ihrer Ärztin ein. Fragen Sie bei Ihrem Arzt/Ihrer Ärztin nach, wenn Sie sich nicht sicher sind.
Die empfohlene Dosierung bei Schizophrenie ist 2‑4 mg einmal täglich. Um das Risiko für Nebenwirkungen zu senken, wird die Dosis schrittweise bis zur empfohlenen Dosis erhöht.
Die übliche Anfangsdosis beträgt 1 mg einmal täglich während den ersten vier Tagen. Ab Tag 5 bis Tag 7 wird sie auf 2 mg erhöht. Ab Tag 8 kann die Dosis bis auf 4 mg einmal täglich gesteigert werden.
Die maximal empfohlene Tagesdosis ist 4 mg.
Die empfohlene Erhaltungsdosis zur Verhinderung eines Wiederauftretens der Symptome ist 2‑4 mg einmal täglich.
Wenn Sie an einer Leber- oder Nierenerkrankung leiden, so ist die empfohlene Tagesdosierung 3 mg. Wenn Sie älter als 65 Jahre sind, wird REXULTI mit Vorsicht dosiert, aber im gleichen Dosierungsbereich wie bei Erwachsenen unter 65 Jahren.
Ihr Arzt/Ihre Ärztin wird die beste Dosis für Sie bestimmen.
Nehmen Sie Ihre REXULTI Tabletten möglichst immer zur gleichen Tageszeit ein. Schlucken Sie Ihre Tabletten ganz mit Wasser. Teilen, zerkauen oder zerkleinern Sie die Tabletten nicht.
REXULTI kann mit oder ohne Nahrung eingenommen werden.
Dieses Arzneimittel ist nicht zur Anwendung bei Kindern und Jugendlichen unter 18 Jahren bestimmt.
Die Anwendung und Sicherheit von REXULTI bei Kindern und Jugendlichen unter 18 ist bisher nicht geprüft worden.
Wenn Sie mehr als die verschriebene Dosis von REXULTI eingenommen haben
Wenn Sie zu viele REXULTI Tabletten eingenommen haben, kontaktieren Sie umgehend Ihren Arzt/Ihre Ärztin, auch wenn Sie keine Beschwerden haben. Wenn Sie Ihren Arzt/Ihre Ärztin nicht erreichen können, nehmen Sie Ihre Packung mit und suchen das nächste Krankenhaus auf.
Wenn Sie die Einnahme von REXULTI vergessen haben
Nehmen Sie die verpasste Dosis ein, sobald Sie es bemerken. Wenn es schon fast Zeit für Ihre nächste Einnahme ist, überspringen Sie die verpasste Dosis und nehmen die nächste Dosis zur gewohnten Zeit. Verdoppeln Sie die Dosis nicht, um eine verpasste Einnahme nachzuholen.
Wenn Sie die Einnahme von REXULTI abbrechen
Ihre Symptome können zurückkehren, wenn Sie die Einnahme von REXULTI abbrechen. Sie sollten sich vor einem Abbruch der Einnahme mit Ihrem Arzt/Ihrer Ärztin absprechen.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Wenn Sie weitere Fragen zur Anwendung von REXULTI haben, wenden Sie sich an Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin.
Welche Nebenwirkungen kann REXULTI haben?
Wie bei allen Arzneimitteln, können Nebenwirkungen auftreten, die sich aber nicht bei jeder Person zeigen müssen.
Die beobachteten Nebenwirkungen waren im Allgemeinen leicht bis mittelschwer ausgeprägt und führten in der Regel nicht zu einem Behandlungsabbruch.
Die unten aufgeführten Nebenwirkungen wurden mit den folgenden Häufigkeiten berichtet:
Häufig (betrifft 1 bis 10 von 100 Anwendern)
- Unruhe, Unfähigkeit still zu sitzen, Zittern, Sedierung, Schwindel, Durchfall, trockener Mund, Bauchschmerzen, Hautausschlag, Rückenschmerzen, Schmerzen in den Extremitäten, Gewichtszunahme, Erhöhung der Kreatinphosphokinase (ein Enzym, das in ihrem Blut gemessen wird).
Gelegentlich (betrifft 1 bis 10 von 1000 Anwendern)
- Parkinson-ähnliche Symptome, Husten, Blähungen, Muskel-schmerzen.
Andere Nebenwirkungen wurden ebenfalls berichtet: Verstopfung, Verdauungsstörungen, Müdigkeit, gesteigerter Appetit, Schläfrigkeit, Agitation, Angst, Schlaflosigkeit, eine Kombination aus Fieber, schnellerer Atmung, Schwitzen, Muskelsteifheit und Schläfrigkeit oder Müdigkeit, die ein Anzeichen für einen Zustand sein kann, der als malignes neuroleptisches Syndrom bezeichnet wird, Überempfindlichkeit und erhöhte Prolaktinwerte (ein Hormon, das im Blut gemessen wird).
REXULTI kann weitere Nebenwirkungen haben. Wenden Sie sich an Ihren Arzt/Ihre Ärztin oder Apotheker/Apothekerin für weitere Informationen.
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin. Dies gilt insbesondere auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Was ist ferner zu beachten?
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Lagerungshinweis
Nicht über 30°C lagern.
In der Originalverpackung aufbewahren.
Ausser Reichweite von Kindern aufbewahren.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in REXULTI enthalten?
Aussehen der Filmtabletten:
Alle Filmtabletten sind rund, flach-konvex, mit abgeschrägter Kante.
0.5 mg: hellorange, mit Prägung «BRX» und «0.5» auf einer Seite
1 mg: hellgelb, mit Prägung «BRX» und «1» auf einer Seite
2 mg: hellgrün, mit Prägung «BRX» und «2» auf einer Seite
3 mg: hellviolett, mit Prägung «BRX» und «3» auf einer Seite
4 mg: weiss, mit Prägung «BRX» und «4» auf einer Seite
Wirkstoffe
Jede Filmtablette enthält 0,5 mg, 1 mg, 2 mg, 3 mg oder 4 mg Brexpiprazol.
Hilfsstoffe
Laktose-Monohydrat, Maisstärke, mikrokristalline Cellulose, Hydroxypropylcellulose, niedrig substituierte Hydroxypropylcellulose, Magnesiumstearat, Hypromellose, Talkum, Titandioxid, rotes Eisenoxid (0,5 mg, 3 mg), gelbes Eisenoxid (0,5 mg, 1 mg, 2 mg), schwarzes Eisenoxid (2 mg, 3 mg),
Zulassungsnummer
66475 (Swissmedic)
Wo erhalten Sie REXULTI? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Filmtabletten 0,5 mg: 7
Filmtabletten 1 mg: 10 und 28
Filmtabletten 2 mg: 28
Filmtabletten 3 mg: 28
Filmtabletten 4 mg: 28
Zulassungsinhaberin
Lundbeck (Schweiz) AG, Opfikon
Diese Packungsbeilage wurde im August 2020 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
30102020PI
Qu'est-ce que le REXULTI et quand doit-il être utilisé?
REXULTI comprimés pelliculés contiennent le principe actif brexpiprazole.
REXULTI est un médicament utilisé pour traiter les symptômes de la schizophrénie chez l'adulte à partir de 18 ans.
Même si vous vous sentez mieux, votre médecin peut continuer à vous prescrire REXULTI pour éviter une récidive des symptômes.
REXULTI ne peut être utilisé que sur prescription du médecin.
Quand REXULTI ne doit-il pas être pris?
Ne prenez pas REXULTI si vous êtes allergique au brexpiprazole ou à l'un des autres composants de ce médicament (voir la rubrique «Que contient REXULTI?»).
Enfants et adolescents
Ce médicament n'est pas indiqué dans le traitement des enfants ou des adolescents de moins de 18 ans. L'efficacité et la sécurité n'ont pas été étudiées chez ces patients.
- si vous êtes une personne âgée et souffrez de démence (perte de mémoire et d'autres facultés);
- si vous êtes atteint ou avez des antécédents familiaux de diabète ou d'une glycémie élevée;
- si vous présentez des taux élevés de cholestérol, de triglycérides ou de taux de LDL cholestérol ou des taux faibles de cholestérol HDL (valeurs de lipides sanguins);
- si vous souffrez de troubles hépatiques ou rénaux;
- si vous
- avez des convulsions ou en avez déjà eues
- avez ou avez déjà eu une pression sanguine basse ou élevée
- avez ou avez déjà eu des problèmes cardiaques ou un accident vasculaire cérébral
- avez ou avez déjà eu un faible taux de globules blancs;
- si vous avez ou avez eu une dépendance au jeu ou des problèmes du contrôle des impulsions (une impulsion incontrôlable poussant à jouer, dépenser de l'argent, de manger ou d'autres envies inappropriées).
Lorsque vous être traité par REXULTI,
- informez votre médecin
- si vous présentez un symptôme évocateur d’une hyperglycémie: une sensation de soif accrue, nausées, besoin plus fréquent d’uriner, augmentation de la faim, faiblesse ou fatigue, confusion ou haleine dégageant une odeur de fruit;
- si vous souffrez de raideur musculaire ou d’immobilité accompagnée d'une forte fièvre, de sueur, d’une altération de la conscience ou de battements de cœur rapides ou irréguliers;
- si vous présentez des mouvements musculaires irréguliers et involontaires, particulièrement au niveau du visage (par ex. au niveau de la langue ou des lèvres);
- si vous avez des idées d’automutilation. Il se peut qu’une personne sous traitement antipsychotique développe des pensées suicidaires et des actes suicidaires peuvent se produire.
- évitez toute exposition à la chaleur excessive et toute déshydratation (manque de liquide). Évitez de faire des efforts physiques excessifs et buvez beaucoup d'eau.
Prise de REXULTI avec d'autres médicaments
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, même s'il s'agit de médicaments non soumis à ordonnance médicale. Votre médecin décidera si vous pouvez prendre REXULTI en même temps que ces médicaments. Lorsque vous êtes traité par REXULTI, vous ne devriez ni débuter ni arrêter tout traitement par d'autres médicaments sans en avoir auparavant parlé avec votre médecin.
La prise concomitante de REXULTI comprimés et d'autres médicaments peut obliger à ajuster votre dosage de REXULTI. Vous devez notamment informer votre médecin si vous prenez les médicaments suivants:
- médicaments hypotenseurs
- médicaments pour traiter des troubles du rythme cardiaque (par ex. quinidine)
- antidépresseurs (par ex. paroxétine, fluoxétine) ou produits à base de plantes tels que millepertuis (Hypericum perforatum) pour traiter les dépressions
- médicaments pour traiter des mycoses (par ex. kétoconazole)
- antibiotiques (par ex. rifampicine, clarithromycine)
- certains médicaments indiqués dans le traitement d'une infection par le VIH (par ex. ritonavir)
- médicaments pour traiter l'épilepsie (par ex. carbamazépine).
Ces médicaments sont susceptibles d'accroître le risque de survenue d'effets indésirables. Consultez votre médecin si vous ressentez des symptômes inhabituels lors de la prise d'un de ces médicaments en même temps que REXULTI comprimés.
Lactose
REXULTI comprimés contiennent du lactose. Si votre médecin vous a informé(e) d'une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
Prise de REXULTI avec de l'alcool
La consommation d'alcool n'est pas recommandée.
Ce médicament peut affecter les réactions, l'aptitude à conduire et la capacité à utiliser des outils ou des machines ! Assurez-vous de savoir comment vous réagissez à REXULTI avant de conduire un véhicule, d'utiliser des outils, des machines ou d'effectuer toutes autres activités à risque. REXULTI peut entraîner de la somnolence.
Veuillez informer votre médecin ou pharmacien si
- vous souffrez d'une autre maladie
- vous êtes allergique
- vous prenez déjà d'autres médicaments (même en automédication!).
REXULTI peut-il être pris/utilisé pendant la grossesse ou l'allaitement?
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Il n'existe aucune donnée sur les effets de REXULTI sur votre bébé à naître. L'administration de REXULTI lors du dernier trimestre de la grossesse peut provoquer des troubles des mouvements des muscles et/ou des symptômes de sevrage médicamenteux.
On ne sait pas si le brexpiprazole passe dans le lait maternel. Votre médecin décidera avec vous si vous devez prendre REXULTI pendant l'allaitement.
Comment utiliser REXULTI?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin. En cas de doute, consultez votre médecin.
La dose recommandée pour le traitement de la schizophrénie est de 2 à 4 mg par jour. Pour minimiser le risque des effets secondaires, il est conseillé d'augmenter la dose progressivement jusqu'à la dose recommandée.
La dose initiale est habituellement de 1 mg par jour pendant les quatre premiers jours. Elle sera augmentée à 2 mg du 5ème au 7ème jour. À partir du 8ème jour, la dose peut être augmentée à 4 mg par jour en une seule prise.
La dose journalière maximale recommandée est de 4 mg.
La dose d'entretien recommandée pour empêcher la récidive des symptômes est de 2 à 4 mg par jour.
Si vous souffrez de troubles hépatiques ou rénaux, la dose journalière recommandée est de 3 mg. La prudence est de mise pour le dosage de REXULTI si vous êtes âgé de 65 ans ou plus, mais celui-ci reste toutefois dans la même fourchette que chez les adultes de moins de 65 ans.
Votre médecin déterminera la dose optimale pour vous.
Prenez REXULTI de préférence toujours à la même heure. Avalez les comprimés en entier avec de l'eau. Vous ne devez pas diviser, mâcher ou écraser les comprimés.
REXULTI peut se prendre pendant ou en-dehors des repas.
Ce médicament n'est pas indiqué pour le traitement des enfants ou des adolescents de moins de 18 ans. L'utilisation et la sécurité de REXULTI n'ont pas été établies à ce jour pour les enfants et les adolescents de moins de 18 ans.
Si vous avez pris plus de REXULTI que vous n'auriez dû
Si vous avez pris plus que la dose de REXULTI comprimés prescrite, contactez immédiatement votre médecin, même si vous ne ressentez aucun trouble. Si votre médecin n'est pas joignable, rendez-vous au service des urgences de l'hôpital et emportez l'emballage du médicament.
Si vous oublié de prendre REXULTI
Prenez la dose oubliée dès que vous vous en êtes rendu compte. Si l'heure de la prise suivante est déjà proche, ne prenez pas la dose oubliée et prenez la prochaine dose à l'heure habituelle. Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre REXULTI
En cas d'arrêt de la prise de REXULTI, vous risquez le retour de vos symptômes. Vous devriez toujours discuter avec votre médecin avant d'arrêter le traitement par ce médicament.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Si vous avez d'autres questions sur l'utilisation de REXULTI, adressez-vous à votre médecin ou à votre pharmacien.
Quels effets secondaires REXULTI peut-il provoquer?
Comme tous les médicaments, ce médicament peut provoquer des effets secondaires, mais ils ne surviennent pas systématiquement chez tout le monde.
Les effets secondaires observés étaient généralement d'intensité légère ou modérée et n'ont, en règle générale, pas conduit à l'arrêt du traitement.
Les effets secondaires mentionnés ci-dessous ont été rapportés aux fréquences suivantes:
Fréquent (concerne 1 à 10 utilisateurs sur 100)
- agitation, incapacité de rester immobile, tremblements, sédation, vertiges, diarrhée, sécheresse de la bouche, douleurs abdominales, éruptions cutanées, douleurs dorsales, douleurs dans les extrémités, prise de poids, augmentation de la créatinine-phosphokinase (une enzyme mesurée dans votre sang).
Occasionnel (concerne 1 à 10 utilisateurs sur 1000)
- symptômes analogues à la maladie de Parkinson, toux, flatulences, douleurs musculaires.
Autres effets secondaires ayant été rapportés: constipation, troubles de la digestion, fatigue, appétit accrue, somnolence, agitation, crises d'angoisse, insomnie, à la fois de la fièvre, des sueurs, une respiration plus rapide, une raideur musculaire et une sensation d'endormissement ou de somnolence (peut être un signe de syndrome malin des neuroleptiques), hypersensibilité et taux élevés de prolactine (une hormone mesurée dans le sang).
REXULTI peut présenter d'autres effets secondaires. Consultez votre médecin ou à votre pharmacien pour plus d'informations.
Si vous remarquez des effets secondaires, veuillez en informer votre médecin, votre pharmacien. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d'emballage.
À quoi faut-il encore faire attention?
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention <EXP> sur l'emballage.
Remarques concernant le stockage
Ne pas conserver au-dessus de 30°C.
Conserver dans l'emballage d'origine.
Tenir hors de la portée des enfants.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient REXULTI?
Aspect des comprimés:
Tous les comprimés pelliculés sont ronds, légèrement convexe et à bords biseautés
0.5 mg: orange pâle, gravé «BRX» et «0.5» sur une face
1 mg: jaune pâle, gravé «BRX» et «1» sur une face
2 mg: vert pâle, gravé «BRX» et «2» sur une face
3 mg: violet pâle, gravé «BRX» et «3» sur une face
4 mg: blanc, gravé «BRX» et «4» sur une face
Principes actifs
Chaque comprimé pelliculés contient 0.5 mg, 1 mg, 2 mg, 3 mg ou 4 mg de brexpiprazole.
Excipients
Lactose monohydraté, amidon de maïs, cellulose microcristalline, hydroxypropylcellulose, hydroxypropylcellulose à faible substitution, stéarate de magnésium, hypromellose, talc, dioxyde de titane, oxyde fer rouge (0.5 mg, 3 mg), oxyde fer jaune (0.5 mg, 1 mg, 2 mg), oxyde fer noir (2 mg, 3 mg).
Numéro d'autorisation
66475 (Swissmedic).
Où obtenez-vous REXULTI? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Comprimés pelliculés 0,5 mg: 7
Comprimés pelliculés 1 mg: 10 et 28
Comprimés pelliculés 2 mg: 28
Comprimés pelliculés 3 mg: 28
Comprimés pelliculés 4 mg: 28
Titulaire de l'autorisation
Lundbeck (Schweiz) AG, Opfikon.
Cette notice d'emballage a été vérifiée pour la dernière fois en août 2020 par l'autorité de contrôle des médicaments (Swissmedic).
30102020PI
Che cos'è REXULTI e quando si usa?
Le compresse rivestite di REXULTI contengono il principio attivo brexpiprazolo.
REXULTI è un medicamento utilizzato per il trattamento dei sintomi della schizofrenia nei pazienti adulti a partire dai 18 anni di età.
Anche se si sente meglio, il medico può continuare a prescriverle REXULTI per evitare che i sintomi si ripresentino.
Su prescrizione medica.
Quando non si può assumere REXULTI?
Non prenda REXULTI se è allergico al brexpiprazolo o a uno degli altri componenti di questo medicamento (vedere «Cosa contiene REXULTI?»).
Bambini e adolescenti
Questo medicamento non deve essere utilizzato da bambini e adolescenti di età inferiore a 18 anni. La sicurezza e l'efficacia non sono state esaminate in questi pazienti.
Quando è richiesta prudenza nella somministrazione REXULTI?
Consulti il medico prima di prendere REXULTI:
- se lei è un anziano con demenza (perdita di memoria e di altre capacità mentali);
- se soffre o ha una storia familiare di diabete o di elevati livelli di zucchero nel sangue;
- se ha livelli elevati di colesterolo, trigliceridi o colesterolo LDL o bassi livelli di colesterolo HDL (livelli dei grassi nel sangue);
- se ha problemi al fegato o ai reni;
- se soffre o ha sofferto di
- crisi convulsive (convulsioni)
- pressione sanguigna alta o bassa
- problemi al cuore o ictus
- livelli troppo bassi di globuli bianchi;
- se ha mai sofferto di dipendenza da gioco d'azzardo o di disturbi del controllo degli impulsi (un impulso spropositato a giocare d'azzardo, spendere denaro, mangiare o qualche altro desiderio esagerato).
Mentre prende REXULTI,
- informi il suo medico se
- si presenta uno dei seguenti sintomi indicativi di livelli elevati di zucchero nel sangue: sete eccessiva, nausea, stimolo a urinare insolitamente frequente, forte aumento dell’appetito, debolezza o stanchezza, sensazione di confusione o alito di odore fruttato;
- si soffre di rigidità muscolare o immobilità accompagnati da febbre elevata, sudorazione, turbamenti della coscienza o battito cardiaco accelerato o irregolare;
- osserva movimenti muscolari involontari, irregolari, soprattutto del viso (ad es. della lingua e delle labbra);
- ha pensieri o sensazioni autolesioniste. Durante il trattamento con antipsicotici sono stati segnalati pensieri e comportamenti suicidari.
- eviti il surriscaldamento o la disidratazione (carenza di liquidi). Eviti l'affaticamento fisico eccessivo e beva molta acqua.
Assunzione di REXULTI con altri medicamenti
Informi il medico o il farmacista se sta prendendo, ha preso recentemente o pensa di prendere altri medicamenti, compresi i medicamenti ottenuti senza prescrizione medica. Il suo medico può decidere se può prendere REXULTI insieme a questi altri medicamenti. Mentre prende REXULTI, non deve iniziare o interrompere l'assunzione di altri medicamenti senza parlarne prima con il suo medico.
Qualora REXULTI compresse venga preso con altri medicamenti, potrebbe essere necessario aggiustare la dose di REXULTI. Deve informare il medico soprattutto in caso di assunzione dei seguenti medicamenti:
- medicamenti che abbassano la pressione sanguigna
- medicamenti per il trattamento dell'aritmia (ad esempio chinidina)
- antidepressivi (ad es. paroxetina, fluoxetina) o medicamenti a base di erbe usati per trattare la depressione [ad es. erba di San Giovanni (Hypericum perforatum)]
- medicamenti per il trattamento delle infezioni da funghi (ad es. ketoconazolo)
- antibiotici (ad es. rifampicina, claritromicina)
- determinati medicamenti per il trattamento dell'infezione da HIV (ad es. ritonavir)
- medicamenti per il trattamento dell'epilessia (ad es. carbamazepina).
Questi medicamenti possono aumentare il rischio di effetti collaterali. Consulti il medico se accusa qualsiasi sintomo insolito mentre sta prendendo uno di questi medicamenti insieme a REXULTI compresse.
Lattosio
REXULTI compresse contiene lattosio. Se il medico le ha diagnosticato una intolleranza ad alcuni zuccheri, lo contatti prima di prendere questo medicamento..
Assunzione di REXULTI con alcool
L'alcol deve essere evitato.
Questo medicamento può ridurre la capacità di reazione, la capacità di condurre un veicolo e la capacità di utilizzare attrezzi o macchine! Non guidi, non utilizzi macchinari e non svolga altre attività pericolose fino a quando non capisce che effetto ha REXULTI su di lei. REXULTI può causare sonnolenza.
Informi il suo medico o il suo farmacista nel caso in cui
- soffre di altre malattie
- soffre di allergie o
- assume altri medicamenti (anche se acquistati di sua iniziativa!).
Si può assumere REXULTI durante la gravidanza o l'allattamento?
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con latte materno, chieda consiglio al medico prima di prendere questo medicamento.
Gli effetti di REXULTI sul feto non sono noti. I neonati che hanno ricevuto REXULTI nell'ultimo trimestre di gravidanza possono presentare movimenti muscolari anormali e/o crisi di astinenza dal medicamento.
Non è noto se brexpiprazolo passa nel latte materno. Il medico deciderà insieme a lei se è opportuno prendere REXULTI durante l'allattamento.
Come usare REXULTI?
Prenda sempre questo medicamento seguendo esattamente le istruzioni del suo medico. Se ha dubbi consulti il suo medico.
La dose raccomandata per la schizofrenia è di 2-4 mg una volta al giorno. Per ridurre il rischio di effetti collaterali, la dose viene aumentata gradualmente fino a raggiungere la dose raccomandata.
La dose iniziale abituale è pari a 1 mg una volta al giorno durante i primi quattro giorni. Dal 5° fino al 7° la dose viene aumentata a 2 mg. Dall'8° giorno la dose può essere aumentata fino a 4 mg una volta al giorno.
La dose massima giornaliera raccomandata è di 4 mg.
La dose di mantenimento raccomandata per prevenire il ripresentarsi dei sintomi è di 2-4 mg una volta al giorno.
Se soffre di malattia epatica o malattia renale, la dose giornaliera raccomandata è di 3 mg. Se lei ha più di 65 anni, la dose di REXULTI deve essere stabilita con attenzione, ma dello stesso intervallo posologico valido per un adulto di meno di 65 anni.
Il suo medico stabilirà qual è la dose migliore per lei.
Prenda preferibilmente le compresse di REXULTI sempre alla stessa ora del giorno. Ingoiare le compresse intere con acqua. Non dividere, masticare, né frantumare le compresse.
REXULTI può essere assunto con o senza cibo.
Questo medicamento non deve essere utilizzato da bambini e adolescenti di età inferiore a 18 anni. L'uso e la sicurezza di REXULTI nei bambini e negli adolescenti sotto i 18 anni finora non sono stati esaminati.
Se prende una dose di REXULTI superiore a quella prescritta
Se assume più compresse di REXULTI di quante prescritte, contatti immediatamente il medico, anche se non ha disturbi. Se non potesse raggiungere il medico, vada al più vicino ospedale e porti con sé la confezione.
Se dimentica di prendere REXULTI
Prenda la dose dimenticata non appena se ne ricorda. Se è quasi ora di prendere la compressa successiva, tralasci la dose dimenticata e prenda quella successiva all'ora abituale. Non prenda una dose doppia per compensare la dimenticanza di una dose.
Se interrompe il trattamento con REXULTI
Se smette di prendere REXULTI, i sintomi potrebbero ripresentarsi. Consulti il medico prima di interrompere l'assunzione del medicamento.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Se ha ulteriori domande sull'uso di REXULTI, si rivolga al medico o al farmacista.
Quali effetti collaterali può avere REXULTI?
Come tutti i medicamenti, anche questo può causare effetti collaterali sebbene non tutte le persone li manifestino.
Gli effetti collaterali osservati sono stati in generale da lievi a mediamente gravi e di norma non hanno comportato l'interruzione del trattamento.
Gli effetti collaterali riportati più sotto sono stati segnalati con le frequenze indicate:
Comune (riguarda da 1 a 10 utilizzatori su 100)
- irrequietezza, difficoltà a rimanere seduti, tremori, sedazione, capogiri, diarrea, bocca secca, dolore addominale, eruzione cutanea, mal di schiena, dolore alle estremità, aumento di peso, aumento della creatinfosfochinasi (un enzima che viene misurato nel sangue).
Non comune (riguarda da 1 a 10 utilizzatori su 1000)
- sintomi Parkinson-simili, tosse, flatulenza, dolori muscolari.
Sono stati inoltre osservati altri effetti collaterali: stitichezza, disturbi digestivi, stanchezza, aumento dell'appetito, sonnolenza, agitazione, paura, insonnia, una combinazione di febbre, sudorazione, respiro accelerato, rigidità muscolare e torpore o sonnolenza (possono essere segni della sindrome neurolettica maligna) ipersensibilità e aumento dei valori di prolattina (un ormone che viene misurato nel sangue).
REXULTI può avere altri effetti collaterali. Si rivolga al medico o al farmacista per ulteriori informazioni.
Se osserva effetti collaterali, si rivolga al suo medico o farmacista, soprattutto se si tratta di effetti collaterali non descritti in questo foglietto illustrativo.
Di che altro occorre tener conto?
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore
Indicazione di stoccaggio
Non conservare a temperature superiori a 30 °C.
Conservare nella confezione originale.
Tenere fuori dalla portata dei bambini.
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene REXULTI?
Aspetto delle compresse rivestite:
Tutte le compresse rivestite sono di forma rotonda, piatte da un lato e convesse dall'altro, con bordi smussati.
0,5 mg: arancione chiaro con impresso «BRX» e «0,5» su un lato
1 mg: giallo chiaro con impresso «BRX» e «1» su un lato
2 mg: verde chiaro con impresso «BRX» e «2» su un lato
3 mg: viola chiaro con impresso «BRX» e «3» su un lato
4 mg: bianca con impresso «BRX» e «4» su un lato
Principi attivi
Ogni compressa contiene 0,5 mg, 1 mg, 2 mg, 3 mg o 4 mg.
Sostanze ausiliarie
Gli eccipienti sono lattosio monoidrato, amido di mais, cellulosa microcristallina, idrossipropilcellulosa, idrossipropilcellulosa a basso grado di sostituzione, magnesio stearato, ipromellosa, talco, biossido di titanio, ossido di ferro rosso (0,5 mg, 3 mg), ossido di ferro giallo (0,5 mg, 1 mg, 2 mg), ossido di ferro nero (2 mg, 3 mg).
Numero dell'omologazione
66475 (Swissmedic).
Dove è ottenibile REXULTI? Quali confezioni sono disponibili?
In farmacia, dietro presentazione della prescrizione medica.
Compresse rivestite con film da 0,5 mg: 7
Compresse rivestite con film da 1 mg: 10 e 28
Compresse rivestite con film da 2 mg: 28
Compresse rivestite con film da 3 mg: 28
Compresse rivestite con film da 4 mg: 28
Titolare dell'omologazione
Lundbeck (Svizzera) AG, Opfikon.
Questo foglietto illustrativo è stato controllato l'ultima volta nel agosto 2020 dall'autorità competente in materia di medicamenti (Swissmedic).
30102020PI
Zusammensetzung
Wirkstoffe
Brexpiprazol.
Hilfsstoffe
Tablettenkern:
0,5 mg: Laktose-Monohydrat 47,9 mg, Maisstärke, mikrokristalline Cellulose, Hydroxypropylcellulose, niedrig substituierte Hydroxypropylcellulose, Magnesiumstearat.
1 mg: Laktose-Monohydrat 47,4 mg, Maisstärke, mikrokristalline Cellulose, Hydroxypropylcellulose, niedrig substituierte Hydroxypropylcellulose, Magnesiumstearat.
2 mg: Laktose-Monohydrat 46,4 mg, Maisstärke, mikrokristalline Cellulose, Hydroxypropylcellulose, niedrig substituierte Hydroxypropylcellulose, Magnesiumstearat.
3 mg: Laktose-Monohydrat 45,4 mg, Maisstärke, mikrokristalline Cellulose, Hydroxypropylcellulose, niedrig substituierte Hydroxypropylcellulose, Magnesiumstearat.
4 mg: Laktose-Monohydrat 44,4 mg, Maisstärke, mikrokristalline Cellulose, Hydroxypropylcellulose, niedrig substituierte Hydroxypropylcellulose, Magnesiumstearat.
Tablettenüberzug:
0,5 mg: Hypromellose, Talkum, Farbstoff: Titandioxid (E171), gelbes und rotes Eisenoxid (E172).
1 mg: Hypromellose, Talkum, Farbstoff: Titandioxid (E171), gelbes Eisenoxid (E172).
2 mg: Hypromellose, Talkum, Farbstoff: Titandioxid (E171), gelbes und schwarzes Eisenoxid (E172).
3 mg: Hypromellose, Talkum, Farbstoff: Titandioxid (E171), rotes und schwarzes Eisenoxid (E172).
4 mg: Hypromellose, Talkum, Titandioxid (E171).
Darreichungsform und Wirkstoffmenge pro Einheit
0,5 mg Filmtablette: 0,5 mg Brexpiprazol.
1 mg Filmtablette: 1 mg Brexpiprazol.
2 mg Filmtablette: 2 mg Brexpiprazol.
3 mg Filmtablette: 3 mg Brexpiprazol.
4 mg Filmtablette: 4 mg Brexpiprazol.
Aussehen der Filmtabletten
Alle Tabletten sind rund, flach-konvex, mit abgeschrägter Kante.
0,5 mg: hellorange, mit Prägung «BRX» und «0.5» auf einer Seite.
1 mg: hellgelb, mit Prägung «BRX» und «1» auf einer Seite.
2 mg: hellgrün, mit Prägung «BRX» und «2» auf einer Seite.
3 mg: hellviolett, mit Prägung «BRX» und «3» auf einer Seite.
4 mg: weiss, mit Prägung «BRX» und «4» auf einer Seite.
Indikationen/Anwendungsmöglichkeiten
REXULTI ist indiziert zur Behandlung der Schizophrenie bei erwachsenen Patienten.
Dosierung/Anwendung
Die empfohlene Anfangsdosierung von REXULTI zur Behandlung von Patienten mit Schizophrenie ist 1 mg einmal täglich für Tag 1 bis 4.
Der empfohlene Zieldosierungsbereich beträgt 2-4 mg einmal täglich.
Am Tag 5 wird auf 2 mg titriert, anschliessend am Tag 8 auf 4 mg, je nach Verträglichkeit und klinischem Ansprechen des Patienten. Die empfohlene maximale Tagesdosis beträgt 4 mg.
Erhaltungstherapie
Der empfohlene Dosierungsbereich beträgt 2-4 mg/Tag. Die Erforderlichkeit der Erhaltungstherapie sowie die angemessene Dosierung müssen regelmässig überprüft werden.
REXULTI kann mit oder ohne Nahrung eingenommen werden.
Spezielle Dosierungsanweisungen
Ältere Patienten
Die Sicherheit und Wirksamkeit von REXULTI zur Behandlung der Schizophrenie ist bei älteren Probanden (älter als 65 Jahre) nicht belegt.
Eine ähnliche Brexpiprazol Exposition wurde beobachtet, wenn REXULTI an gesunde ältere Probanden (älter als 65 Jahre) und an erwachsene Probanden (18–45 Jahre) verabreicht wurde (siehe Pharmakokinetik). Generell sollte die Dosierung für ältere Patienten vorsichtig und am unteren Ende des Dosierungsbereichs gewählt werden, um den häufigeren Einschränkungen der Leber-, Nieren- und Herzfunktionen, den Begleiterkrankungen sowie anderen medikamentösen Therapien Rechnung zu tragen.
Patienten mit Leberfunktionsstörungen
Bei schizophrenen Patienten mit mässigen bis schweren Leberfunktionsstörungen (Child-Pugh-Score ≥7) beträgt die maximal empfohlene Dosis 3 mg einmal täglich.
Patienten mit Nierenfunktionsstörungen
Bei schizophrenen Patienten mit mässiger, schwerer oder terminaler Nierenfunktionsstörung (Kreatinin-Clearance CLcr < 60 ml/min) beträgt die maximal empfohlene Dosis 3 mg einmal täglich.
Weitere besondere Patientengruppen
Eine Dosisanpassung von REXULTI aufgrund des Geschlechts, der ethnischen Zugehörigkeit oder von Tabakkonsum ist nicht erforderlich (siehe Pharmakokinetik).
Dosisanpassungen für langsame CYP2D6 Metabolisierer und bei gleichzeitiger Anwendung von CYP Hemmern oder Induktoren
Angepasste Dosis | |
Langsame CYP2D6 Metabolisierer | |
Bekannte langsame CYP2D6 Metabolisierer | Gabe der halben üblichen Dosis |
Bekannte langsame CYP2D6 Metabolisierer, die mässige/starke CYP3A4 Hemmer einnehmen | Gabe eines Viertels der üblichen Dosis |
Patienten, die CYP2D6 Hemmer und/oder CYP3A4 Hemmer einnehmen | |
Starke CYP2D6 Hemmer | Gabe der halben üblichen Dosis |
Starke CYP3A4 Hemmer | |
Starke/mässige CYP2D6 Hemmer mit starken/mässigen CYP3A4 Hemmern | Gabe eines Viertels der üblichen Dosis |
Patienten, die CYP3A4 Induktoren einnehmen | |
Starke CYP3A4 Induktoren* | Verdoppelung der üblichen Dosis über 1–2 Wochen |
* Wird der gleichzeitig verabreichte CYP3A4 Induktor abgesetzt, muss die Dosierung über 1‑2 Wochen auf das ursprüngliche Niveau reduziert werden.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von REXULTI bei Kindern und Jugendlichen unter 18 Jahren wurde nicht untersucht (siehe Warnhinweise und Vorsichtsmassnahmen).
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und Vorsichtsmassnahmen
Erhöhte Mortalität bei älteren Patienten mit demenzbedingter Psychose
Ältere Patienten mit demenzbedingter Psychose unter einer Behandlung mit Antipsychotika, weisen ein höheres Sterberisiko auf als unter Placebo.
Die Analysen von 17 Placebo-kontrollierten Studien (modale Dauer von 10 Wochen), überwiegend mit Patienten unter atypischen Antipsychotika, zeigten bei den medikamentös behandelten Patienten ein 1,6–1,7‑fach erhöhtes Sterberisiko im Vergleich zu Patienten unter Placebo. Im Verlauf einer typischen kontrollierten 10‑Wochen Studie betrug die Todesrate bei den medikamentös behandelten Patienten etwa 4,5%, verglichen zu 2,6% bei Patienten unter Placebo. REXULTI ist nicht zur Behandlung von demenzbedingten Psychosen zugelassen.
Unerwünschte zerebrovaskuläre Wirkungen
In Placebo-kontrollierten Studien mit verschiedenen Antipsychotika bei älteren Patienten mit Demenz, zeigte sich im Vergleich zu Placebo eine höhere Inzidenz von unerwünschten zerebrovaskulären Ereignissen (Schlaganfälle und vorübergehende Durchblutungsstörungen), einschliesslich Todesfällen.
Suizidrisiko
Psychotische Erkrankungen erhöhen das Risiko von Suizidversuchen. Hochrisikopatienten sollten während der medikamentösen Therapie eng überwacht und klinisch angemessen begleitet werden.
Venöse Thromboembolie
Unter Antipsychotika sind Fälle von venösen Thromboembolien (VTE) gemeldet worden. Patienten, die mit Antipsychotika behandelt werden, zeigen oftmals erworbene Risikofaktoren für VTE. Mögliche Risikofaktoren für VTE sollten deshalb vor und während der Behandlung mit REXULTI gründlich abgeklärt und Vorsichtsmassnahmen ergriffen werden.
Malignes Neuroleptisches Syndrom (MNS)
Das MNS ist ein potenziell tödlicher Symptomkomplex, der in Zusammenhang mit der Einnahme von Antipsychotika, einschliesslich Brexpiprazol, auftreten kann. Klinische Manifestationen eines MNS sind: sehr hohes Fieber, Muskelrigidität, veränderte Bewusstseinslage und Anzeichen autonomer Instabilität (unregelmässiger Puls oder Blutdruck, Tachykardie, Schwitzen und Herzrhythmusstörungen). Weitere Anzeichen können ein Anstieg der Kreatinphosphokinase, Myoglobinurie (Rhabdomyolyse) und akutes Nierenversagen sein. Sollte ein Patient Anzeichen und Symptome entwickeln, die auf ein MNS hinweisen, oder hohes Fieber unklarer Genese ohne weitere klinische Manifestationen von MNS zeigen, müssen alle Antipsychotika, einschliesslich REXULTI, abgesetzt werden. Benötigt ein Patient nach der Genesung von MNS eine Antipsychotika Behandlung, muss die mögliche Wiederaufnahme der medikamentösen Therapie sorgfältig geprüft werden. Der Patient sollte sorgfältig überwacht werden, da über Rezidive von NMS berichtet wurde.
Spätdyskinesien
Unter einer Antipsychotika Behandlung kann sich ein Syndrom aus möglicherweise irreversiblen, unwillkürlichen dyskinetischen Bewegungen entwickeln. Die höchste Prävalenz dieses Syndroms scheint bei älteren Patienten, vor allem bei älteren Frauen, zu liegen. Aufgrund von Prävalenzschätzungen kann allerdings zu Beginn einer Antipsychotika Behandlung nicht vorausgesagt werden, welche Patienten zur Entwicklung dieses Syndroms neigen.
Falls unter der Behandlung mit REXULTI Anzeichen und Symptome von Spätdyskinesien auftreten, muss eine Dosisreduktion oder das Absetzen des Arzneimittels in Erwägung gezogen werden. Die Symptome können sich vorübergehend noch verschlechtern oder selbst nach Absetzen der Behandlung auftreten.
Hyperglykämie und Diabetes mellitus
Bei Patienten unter Behandlung mit Antipsychotika wurde über Hyperglykämie berichtet, die in einigen Fällen sehr ausgeprägt war und mit Ketoazidose oder hyperosmolarem Koma oder Tod einherging.
Patienten, die mit Antipsychotika behandelt werden, sollten auf Anzeichen und Symptome von Hyperglykämie überwacht werden (wie etwa Polydipsie, Polyurie, Polyphagie und Schwäche). Patienten mit Diabetes mellitus oder Risikofaktoren für Diabetes mellitus (wie etwa Fettleibigkeit oder Diabetes in der Familiengeschichte) sollten regelmässig auf eine Verschlechterung der Glukosewerte kontrolliert werden. Bei Patienten mit erheblicher therapiebedingter Hyperglykämie sollte das Absetzen von REXULTI in Betracht gezogen werden.
In klinischen Studien mit REXULTI (Studien 1 und 2) bei Patienten mit Schizophrenie waren die Schwankungen der Nüchtern-Glukose vergleichbar unter REXULTI und unter Placebo.
In der Langzeit-Studie zur Erhaltungstherapie (Studie 3), waren die mittleren Abweichungen vom Ausgangswert bis zur letzten Visite in den Serumglukosewerten klein, sowohl unter REXULTI (2,11 mg/dl) als auch unter Placebo (1,62 mg/dl), und wurden nicht als klinisch relevant erachtet.
In den offenen Langzeitstudien betrug die mittlere Abweichung vom Ausgangswert bis zur letzten Visite im Nüchtern-Serumglukosewert 2,31 mg/dl (N=1120).
Gewichtszunahme und Dyslipidämie
Unter Antipsychotika Behandlung traten Stoffwechselveränderungen wie etwa Gewichtszunahme und Dyslipidämie auf. Die klinische Überwachung des Körpergewichts wird empfohlen (siehe Unerwünschte Wirkungen).
Orthostatische Hypotonie und Synkope
In den Placebo-kontrollierten klinischen Kurzzeitstudien mit REXULTI bei Patienten mit Schizophrenie wurde folgende Inzidenz von unerwünschten, durch orthostatische Hypotonie bedingten Ereignissen unter REXULTI versus Placebo beobachtet: Schwindel (2,3% versus 1,4%), orthostatische Hypotonie (0,4% versus 0,2%) und Synkope (0,1% versus 0%).
Orthostatische Hypotonie kann mit unerwünschten Wirkungen wie Schwindel, Benommenheit und Tachykardie einhergehen. Das höchste Risiko besteht im Allgemeinen zu Behandlungsbeginn und während einer Dosiserhöhung. Patienten mit erhöhtem Risiko für diese unerwünschten Wirkungen oder für das Auftreten von Komplikationen aufgrund von Hypotonie sind Patienten mit Dehydratation, Hypovolämie, Antihypertensiva Therapie, Herz-Kreislauf-Erkrankungen in der Anamnese (z.B. Herzinsuffizienz, Myokardinfarkt, Ischämie oder Überleitungsstörungen), zerebrovaskulären Erkrankungen in der Anamnese sowie Patienten mit erstmaliger Antipsychotika Behandlung. Eine tiefere Anfangsdosierung und eine langsamere Titration sollte bei diesen Patienten in Betracht gezogen und die orthostatischen Vitalparameter überwacht werden.
Krampfanfälle
Wie andere Antipsychotika, sollte REXULTI bei Patienten mit Krampfanfällen in der Anamnese oder bei Krankheitsbildern mit potenziell herabgesetzter Anfallsschwelle mit Vorsicht angewendet werden.
Thermoregulation
Antipsychotika können die Fähigkeit des Körpers zur Senkung der Körperkerntemperatur beeinträchtigen. Bei Patienten, die dem Risiko einer Erhöhung der Körperkerntemperatur ausgesetzt sind, z.B. durch anstrengende körperliche Betätigung, extreme Hitze, gleichzeitige Behandlung mit anticholinergen Arzneimitteln oder Dehydratation, sollte REXULTI mit der entsprechenden Sorgfalt verschrieben werden.
Dysphagie
Motilitätsstörungen der Speiseröhre und Aspiration wurden unter Antipsychotika Therapie beobachtet. REXULTI und andere Antipsychotika sollten bei Patienten mit einem Risiko für Aspirationspneumonie mit Vorsicht angewendet werden.
Leukopenie, Neutropenie und Agranulozytose
Unter Behandlung mit Antipsychotika wurde von Leukopenie/Neutropenie berichtet. Für andere Wirkstoffe dieser Klasse wurden Agranulozytosen (einschliesslich Todesfälle) beobachtet.
Mögliche Risikofaktoren für eine Leukopenie/Neutropenie sind unter anderem vorbestehende tiefe Leukozytenwerte sowie eine medikamenteninduzierte Leukopenie/Neutropenie in der Anamnese. Bei Patienten mit diesen Risikofaktoren sollte in den ersten Monaten der Therapie das vollständige Blutbild häufig kontrolliert werden. In Abwesenheit anderer ursächlicher Faktoren sollte REXULTI bei den ersten Anzeichen eines absinkenden Leukozytenwerts abgesetzt werden.
Patienten mit Neutropenie sollten sorgfältig auf Fieber oder andere Symptome oder auf Anzeichen für Infektionen überwacht und bei Auftreten solcher Symptome unverzüglich behandelt werden. Bei Patienten mit schwerer Neutropenie (absoluter Neutrophilenwert < 1'000/mm3) sollte REXULTI abgesetzt und die Leukozytenwerte bis zur Genesung kontrolliert werden.
Impulskontrollstörungen
Bei Patienten unter Brexpiprazol wurden Fälle von Impulskontrollstörungen, inklusive Spielsucht, berichtet. Patienten mit Impulskontrollstörungen in der Anamnese weisen möglicherweise ein erhöhtes Risiko auf und müssen sorgfältig überwacht werden. Es ist zu beachten, dass Symptome einer Impulskontroll-Störung mit der zugrundeliegenden Erkrankung in Zusammenhang stehen können.
Laktose
REXULTI Filmtabletten enthalten Laktose. Patienten mit der seltenen hereditären Galaktose-Intoleranz, völligem Laktase-mangel oder Glukose-Galaktose-Malabsorption sollten dieses Arzneimittel nicht anwenden.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von REXULTI bei Patienten unter 18 Jahren wurden nicht untersucht.
Ältere Menschen
Klinische Studien mit REXULTI umfassten eine begrenzte Zahl von Probanden ab 65 Jahren, um eine möglicherweise unterschiedliche Reaktion zu jüngeren Probanden zu ermitteln. Ältere Probanden (> 65 Jahre) zeigten eine vergleichbare systemische Brexpiprazol Exposition wie erwachsene Probanden (18–45 Jahre) (siehe Pharmakokinetik und Dosierung/Anwendung). Ältere Patienten mit demenzbedingter Psychose unter Behandlung mit Antipsychotika, weisen ein höheres Sterberisiko auf als unter Placebo (siehe oben: Erhöhte Mortalität bei älteren Patienten mit demenzbedingter Psychose).
Leberfunktionsstörungen
Bei Patienten mit Leberfunktionsstörungen muss die Dosierung angepasst werden (siehe Pharmakokinetik und Dosierung/Anwendung).
Nierenfunktionsstörungen
Bei Patienten mit Nierenfunktionsstörungen muss die Dosierung angepasst werden (siehe Pharmakokinetik und Dosierung/Anwendung).
Interaktionen
REXULTI wird in erster Linie von CYP3A4 und CYP2D6 metabolisiert. Aufgrund der Ergebnisse aus Arzneimittel-Interaktionsstudien wird bei Personen, die starke CYP2D6 oder CYP3A4 Hemmer erhalten, eine Dosisanpassung auf die Hälfte der Erhaltungsdosis empfohlen. Basierend auf Schätzungen aus den Analysen der Populations-Pharmakokinetik, dürften extensive CYP2D6 Metabolisierer, die sowohl CYP3A4 als auch CYP2D6 Hemmer erhalten, oder langsame CYP2D6 Metabolisierer, die starke CYP3A4 Hemmer erhalten, einen etwa 4–5‑fachen Anstieg der Brexpiprazol Konzentrationen aufweisen. Daher sollte die Dosierung von REXULTI in diesen Fällen auf einen Viertel der empfohlenen Dosis reduziert werden (siehe Dosierung/Anwendung).
Wird REXULTI gleichzeitig mit einem starken CYP3A4 Induktor (z.B. Rifampicin) angewendet, muss die Dosis um das 2‑fache erhöht und gemäss dem klinischen Ansprechen weiter angepasst werden (siehe Dosierung/Anwendung).
Enzyminduktoren
Rifampicin und andere CYP3A4 Induktoren
Bei gleichzeitiger Anwendung von Rifampicin (600 mg zweimal täglich über 12 Tage), einem starken CYP3A4 Induktor, mit einer oralen Einzeldosis von 4 mg REXULTI, sank die Cmax von Brexpiprazol um ca. 31% und die AUC um ca. 73%.
Enzyminhibitoren
Starke CYP2D6 Hemmer
Bei gleichzeitiger Anwendung einer oralen Einzeldosis von 2 mg REXULTI mit Chinidin (324 mg/Tag über 7 Tage), einem starken CYP2D6 Hemmer (in der Schweiz nicht zugelassen), stieg die area under the curve (AUC) von Brexpiprazol um 94%.
Ketoconazol und andere starke CYP3A4 Hemmer
Bei gleichzeitiger Anwendung von Ketoconazol (200 mg zweimal täglich über 7 Tage), einem starken CYP3A4 Hemmer, mit einer oralen Einzeldosis von 2 mg REXULTI stieg die AUC von Brexpiprazol um 97%.
CYP2B6 Hemmer
Die gleichzeitige Anwendung einer oralen Einzeldosis von 2 mg REXULTI mit Ticlopidin (250 mg zweimal täglich über 7 Tage), einem CYP2B6 Hemmer (in der Schweiz nicht zugelassen), hatte keinen Effekt auf die Pharmakokinetik von Brexpiprazol.
Andere Interaktionen
Magensäure pH-Modifikatoren
Die gleichzeitige Anwendung von Omeprazol (40 mg einmal täglich über 5 Tage), einem weit verbreiteten Protonenpumpenhemmer (PPI), mit einer oralen Einzeldosis von 4 mg REXULTI, hatte keine Wirkung auf die Absorption von Brexpiprazol.
Wirkung von REXULTI auf andere Arzneimittel
In-vitro Daten zeigten eine geringe bis gar keine Hemmung der CYP450 Isoenzyme durch Brexpiprazol. Die potenzielle in-vitro Hemmung der MDR1 (P-gp), OAT1, OAT3, OCT2, Multidrogen und Toxin Extrusion Transporter (MATE1), MATE2-K, OATP1B1, OATP1B3 und OCT1 durch Brexpiprazol wurde ebenfalls untersucht. Brexpiprazol oder sein Hauptmetabolit wurden lediglich als potenzieller Hemmer des BCRP-Efflux-Transporters von BCRP, OATP1B1, MATE1 und MATE2-K identifiziert, jedoch nicht als Hemmer der anderen getesteten Transporter.
Klinische Studien zeigen, dass orales REXULTI (2 mg/Tag, über 5 Tage) keinen Effekt hat auf die Pharmakokinetik von Dextromethorphan (ein CYP2D6-Substrat), Lovastatin (ein CYP3A4-Substrat, in der Schweiz nicht zugelassen), Bupropion (ein CYP2B6-Substrat) oder Fexofenadin (ein P-gp-Transporter-Substrat). REXULTI (6 mg Einzeldosis) hatte keinen Einfluss auf die Absorption von Rosuvastatin (ein BCRP und OATP Transporter-Substrat).
Schwangerschaft/Stillzeit
Schwangerschaft
Die sichere Anwendung von REXULTI während der Schwangerschaft oder Stillzeit wurde nicht untersucht. REXULTI sollte während der Schwangerschaft, bei stillenden Müttern oder bei Frauen im gebärfähigen Alter nicht angewendet werden, es sei denn es ist klar notwendig.
In tierexperimentellen Reproduktionsstudien wurde keine Teratogenität beobachtet jedoch wurde eine erhöhte Anzahl der perinatalen Todesfälle beobachtet (siehe Präklinische Daten).
Adäquate, ausreichend kontrollierte Studien an schwangeren Frauen zur Ermittlung der Arzneimittelrisiken bei Anwendung von REXULTI wurden bisher nicht durchgeführt. Bei Neugeborenen, deren Mütter während des dritten Trimenons der Schwangerschaft Antipsychotika wie REXULTI einnahmen, besteht nach der Geburt das Risiko für extrapyramidale und/oder Entzugssymptome. Es gab Berichte von Agitation, ungewöhnlich erhöhtem oder vermindertem Muskeltonus, Tremor, Schläfrigkeit, Schwierigkeiten beim Atmen oder Probleme beim Füttern. Diese Komplikationen wiesen unterschiedliche Schweregrade auf. Die Symptome waren in einigen Fällen selbstlimitierend, in anderen Fällen waren die Behandlung auf der Intensivstation oder ein längerer Klinikaufenthalt erforderlich.
Die Wirkung von REXULTI auf Wehen und Geburtsvorgang beim Menschen ist nicht bekannt.
Stillzeit
Es ist nicht bekannt, ob Brexpiprazol oder seine Metaboliten beim Menschen in die Muttermilch übergehen. Brexpiprazol wurde in die Milch von Ratten ausgeschieden. Aufgrund der möglicherweise schwerwiegenden unerwünschten Wirkungen auf den Säugling, muss entschieden werden, ob entweder das Stillen abgebrochen oder die Behandlung beendet werden soll, wobei das Risiko eines Therapieabbruchs für die Mutter berücksichtigt werden soll.
Fertilität
In tierexperimentellen Fertilitätsstudien wurde eine Beeinträchtigung der Fertilität bei weiblichen Ratten (Estrus Zyklus Unregelmässigkeiten und verringerte Fruchtbarkeit) beobachtet, nicht jedoch bei Männchen (siehe Präklinische Daten).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Wie bei anderen Antipsychotika, die potenziell das Urteilsvermögen sowie die Denk- und motorischen Fähigkeiten beeinträchtigen können, sollten Patienten zur Vorsicht beim Lenken von Fahrzeugen oder Bedienen von gefährlichen Maschinen angehalten werden, bis sichergestellt ist, dass sie durch die REXULTI Behandlung nicht beeinträchtigt sind.
In den placebokontrollierten Kurzzeitstudien an Schizophrenie-Patienten wurde bei 5% der mit REXULTI behandelten Patienten und 4% der mit Placebo behandelten Patienten Schläfrigkeit (einschliesslich Sedierung und vermehrtem Schlafbedürfnis) angegeben. In den unverblindeten Langzeitstudien betrug die Inzidenz von Schläfrigkeit und ähnlichen Wirkungen 3%.
Unerwünschte Wirkungen
In den doppel-blinden, Placebo-kontrollierten Phase 2 und 3 Studien wurden innerhalb des empfohlenen Dosierungsbereichs (2‑4 mg täglich) folgende unerwünschte Reaktionen (adverse drug reactions, ADRs) am häufigsten berichtet: Akathisie (6%) und Gewichtszunahme (5%). Die unerwünschten Reaktionen waren meist leicht bis mittelschwer und führten in der Regel nicht zu einem Studienabbruch.
Zusammenstellung der unerwünschten Wirkungen
Die unerwünschten Reaktionen (ADRs), die in den klinischen Studien unter Brexpiprazol im Dosierungsbereich 2-4mg berichtet wurden, sind nachfolgend nach Organklasse und Häufigkeit geordnet dargestellt: sehr häufig (≥1/10); häufig (≥1/100, <1/10); gelegentlich (≥1/1000, <1/100); selten (≥1/10'000, <1/1000); sehr selten (<1/10'000); nicht bekannt (Häufigkeit aufgrund der verfügbaren Daten nicht abschätzbar). Die unerwünschten Wirkungen sind innerhalb der Häufigkeitskategorien nach abnehmendem Schweregrad geordnet.
Psychiatrische Erkrankungen:
Häufig: Unruhe*.
* Unruhe kann mit der pharmakologischen Wirkung von Brexpiprazol zusammenhängen und ist aufgeführt, obwohl die Differenz zu Placebo kleiner war als 0.5%.
Erkrankungen des Nervensystems:
Häufig: Akathisie, Tremor, Sedierung, Schwindel.
Gelegentlich: Parkinsonismus.
Erkrankungen der Atemwege, des Brustraums und Mediastinums:
Gelegentlich: Husten.
Erkrankungen des Gastrointestinaltrakts:
Häufig: Durchfall, Mundtrockenheit, Bauchschmerzen.
Gelegentlich: Blähungen.
Erkrankungen der Haut und des Unterhautzellgewebes:
Häufig: Hautausschlag.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen:
Häufig: Rückenschmerzen, Schmerzen in den Extremitäten.
Gelegentlich: Myalgie.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Häufig: Schmerzen.
Untersuchungen:
Häufig: Gewichtszunahme, Erhöhung der Kreatinphosphokinase.
Als weitere unerwünschte Wirkungen wurden Konstipation, Dyspepsie, Müdigkeit, gesteigerter Appetit, Schläfrigkeit, Agitation, Angst, Schlaflosigkeit, Überempfindlichkeit sowie erhöhte Prolaktinspiegel berichtet.
Akathisie und extrapyramidale Symptome (EPS)
In den Studien 1 und 2 betrug die Häufigkeit von EPS-verwandten Ereignissen (ohne Akathisie Ereignisse) 5,1% bei Patienten unter REXULTI versus 3,5% unter Placebo. Die Häufigkeit von Akathisie Ereignissen betrug 5.4% bei Patienten unter REXULTI versus 4,9% unter Placebo. Neu auftretende Fälle von Akathisie wurden in allen Behandlungsarmen häufiger während der ersten 3 Wochen nach Behandlungsbeginn berichtet und waren leicht bis mittelschwer.
In den Studien 1 und 2 wurden die objektiven Skalen Simpson Angus Scale (SAS) für extrapyramidale Symptome, die Barnes Akathisia Rating Scale (BARS) für Akathisie und die Abnormal Involuntary Movement Scale (AIMS) für Dyskinesie eingesetzt. Die mittleren Abweichungen vom Ausgangswert bei der Schlussvisite bei Patienten unter REXULTI auf der SAS, BARS und AIMS (‑0,10; 0,02 und ‑0,08) waren vergleichbar mit denen bei Patienten unter Placebo (0,00; 0,01 und ‑0,07).
Auch in Studie 3 waren die mittleren Abweichungen vom Ausgangswert bei der Schluss Visite auf der SAS, BARS und AIMS vergleichbar bei Patienten unter REXULTI und unter Placebo.
Dystonie
Klasseneffekt: Während der ersten Tage der Behandlung können bei empfindlichen Personen Dystoniesymptome, lang anhaltende abnormale Kontraktionen von Muskelgruppen, auftreten. Zu den Dystoniesymptomen zählen Spasmen der Nackenmuskulatur, die sich manchmal zu einem Engegefühl der Kehle, Schluckbeschwerden, Kurzatmigkeit und/oder einer Protrusion der Zunge verstärken können. Obwohl diese Symptome bereits bei tiefen Dosen auftreten können, treten sie häufiger und mit grösserer Intensität bei antipsychotischen Medikamenten der ersten Generation mit hoher Potenz und in höheren Dosen auf. Bei männlichen und jüngeren Patienten wird ein erhöhtes Risiko für akute Dystonie beobachtet.
Gewichtszunahme
In den Kurzzeitstudien 1 und 2 war der Anteil der Patienten mit einer potenziell klinisch relevanten Gewichtszunahme (≥7% des Körpergewichts) 10.5% unter REXULTI 2 mg/Tag und 10,2% unter REXULTI 4 mg/Tag, verglichen mit 4,1% unter Placebo. Die mittlere Gewichtszunahme bei der letzten Visite betrug 1,2 kg in beiden REXULTI Gruppen und 0,2 kg in der Placebo Gruppe.
In der Studie 3 betrug der Anteil der Patienten mit einer Gewichtszunahme von ≥7% bei der letzten Visite 3,1% in der REXULTI Gruppe verglichen mit 1,0% in der Placebo Gruppe.
In den offenen Schizophrenie Langzeit-Studien betrug die mittlere Abweichung des Körpergewichts vom Ausgangswert bis zur letzten Visite 1,1 kg. Der Prozentsatz von Patienten mit potentiell klinisch relevanter Gewichtszunahme (≥7%) betrug 18% und 0,4% der Probanden brachen die Behandlung aufgrund der Gewichtszunahme ab.
Dyslipidämie
Bei Personen unter einer Behandlung mit atypischen Antipsychotika können unerwünschte Veränderungen der Lipide auftreten.
In den Studien 1 und 2 waren die Veränderungen des Nüchtern-Gesamtcholesterins, des LDL-Cholesterins und des HDL-Cholesterins vergleichbar bei Patienten unter REXULTI und unter Placebo. Tabelle 1 zeigt den Anteil der Patienten mit Veränderungen der Nüchtern-Triglyzeride.
Tabelle 1: Veränderung der Nüchtern-Triglyzeride in Studien 1 und 2
Anteil der Probanden mit Abweichungen von Baseline bis Post-Baseline | ||||
Placebo | 1 mg/Tag | 2 mg/Tag | 4 mg/Tag | |
Triglyzeride | ||||
Normal bis hoch (<150 bis ≥200 mg/dl und <500 mg/dl) | 6% (15/253)* | 10% (7/72)* | 8% (19/232)* | 10% (22/226)* |
Normal/grenzwertig bis sehr hoch (<200 bis ≥500 mg/dl) | 0% (0/303)* | 0% (0/94)* | 0% (0/283)* | 0.4% (1/283)* |
* Bezeichnet n/N, wobei N=Gesamtzahl der Patienten mit einer Baseline und mindestens einer Post-Baseline Messung; n=Zahl der Patienten mit einer Abweichung.
In Studie 3 wurden keine klinisch bedeutsamen Unterschiede zwischen den Behandlungsgruppen in der Häufigkeit von potenziell klinisch relevanten Stoffwechselwerten festgestellt.
In den offenen Langzeitstudien betrug die mittlere Abweichung der Nüchtern-Triglyzeride vom Ausgangswert bis zur letzten Visite ‑2,14 mg/dl (N=1123).
Hämatologie und klinische Chemie
In den klinischen Studien mit REXULTI wurden keine klinisch relevanten mittleren Abweichungen vom Ausgangswert in der Serumchemie, Hämatologie, Urinanalyse oder anderen Labortests (Insulin, Nüchtern-Insulin und Prolaktin) beobachtet.
Unerwünschte Wirkungen nach Markteinführung
Die folgenden Nebenwirkungen mit Brexpiprazol wurden während des Zeitraums nach Markteinführung berichtet. Die Häufigkeit der gemeldeten Nebenwirkung ist unbekannt.
Erkrankungen des Nervensystems
Unbekannt: Malignes neuroleptisches Syndrom.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Behandlung
Zur Behandlung einer Überdosierung mit REXULTI sind keine konkreten Informationen verfügbar. Eine Magenspülung und Behandlung mit einem Emetikum können unmittelbar nach einer Überdosierung hilfreich sein. Ein EKG sollte durchgeführt und bei einer Verlängerung des QT-Intervalls eine Herzüberwachung installiert werden. Im Übrigen sollte sich die Behandlung einer Überdosierung auf unterstützende Massnahmen, Freihalten der Atemwege, Sauerstoffzufuhr, Beatmung und Symptombehandlung fokussieren. Eine enge medizinische Überwachung und Kontrolle bis zur Genesung sind erforderlich.
Orale Verabreichung von Aktivkohle und Sorbit (50 g/240 ml) eine Stunde nach Einnahme von REXULTI senkte die Cmax von Brexpiprazol um ca. 5% bis 23% und die AUC um 31% bis 46%. Die verfügbare Information zum therapeutischen Potenzial von Aktivkohle zur Behandlung einer REXULTI Überdosierung ist jedoch ungenügend. Obwohl keine Informationen zur Wirkung einer Hämodialyse vorliegen, dürfte eine Hämodialyse bei der Behandlung einer REXULTI Überdosierung wenig hilfreich sein, aufgrund der hohen Bindung von Brexpiprazol an Plasmaproteine.
Eigenschaften/Wirkungen
ATC-Code
N05AX16
Wirkungsmechanismus
REXULTI ist ein neuartiger, atypischer, antipsychotischer Wirkstoff, dessen pharmakologische Aktivität auf der Modulation der Serotonin-Dopamin Aktivität beruht. Obwohl der genaue Wirkmechanismus von Brexpiprazol in der Schizophrenie Behandlung nicht vollständig geklärt ist, beruht die Pharmakologie von Brexpiprazol vermutlich auf einer Kombination von hoher Bindungsaffinität und funktioneller Aktivität an multiplen monoaminergen Rezeptoren. Seine modulatorische Wirkung auf die Serotonin- und Dopamin-Systeme, beruht auf einer Kombination von partiell agonistischer Aktivität an den serotonergen 5‑HT1A und den dopaminergen D2 Rezeptoren mit einer antagonistischen Aktivität an den serotonergen 5‑HT2A Rezeptoren, wobei die Affinitäten an all diesen Rezeptoren ähnlich hoch sind (Ki: 0,1–0,5 nM).
Brexpiprazol zeigt ausserdem eine antagonistische Aktivität an den noradrenergen α1B/2C Rezeptoren im gleichen sub-nanomolaren Ki‑Bereich (Ki: 0,2–0,6 nM). Die partiell agonistische Aktivität am 5HT1A/D2 Rezeptor in Kombination mit der antagonistischen Aktivität an den 5‑HT2A und α1B/2C Rezeptoren trägt möglicherweise zur antipsychotischen Wirkung von Brexpiprazol bei.
Pharmakodynamik
Brexpiprazol hat eine hohe Affinität (Ki <5 nM) zu multiplen monoaminergen Rezeptoren, darunter Serotonin 5‑HT1A, 5‑HT2A, 5‑HT2B und 5‑HT7, Dopamin D2 und D3 sowie noradrenerge α1A, α1B, α1D und α2C Rezeptoren. Brexpiprazol wirkt als Partialagonist an den 5‑HT1A, D2 und D3 Rezeptoren und als Antagonist an den 5‑HT2A, 5‑HT2B, 5‑HT7, α1A, α1B, α1D und α2C Rezeptoren.
An den dopaminergen D2 Rezeptoren besitzt Brexpiprazol eine schwache intrinsiche Aktivität. Brexpiprazol hat eine mässige Affinität zu Histamin H1 Rezeptoren (19 nM) und eine sehr schwache Affinität zu muscarinischen M1 Rezeptoren (67% Inhibition bei 10 µM). Die Dosis-Wirkungs-Okkupanz sowie das Verhältnis der Gehirn/Plasma Exposition wurden in präklinischen Studien in‑vivo oder ex‑vivo für die D2/D3, 5‑HT2A, 5‑HT1A, 5‑HT6 und 5‑HT7 Rezeptoren sowie für den 5‑HT-Transporter bestimmt. Die Resultate stimmen mit den relativen in‑vitro Bindungsaffinitäten überein und zeigen die Aktivität von Brexpiprazol an mehreren Angriffspunkten im zentralen Nervensystem bei relevanter Plasma Exposition.
In einer umfassenden QTc-Studie bei Patienten mit Schizophrenie oder schizoaffektiver Störung, bewirkte REXULTI nach 12 Tagen therapeutischer (4 mg/Tag) oder supra-therapeutischer (12 mg/Tag) Dosierung keine QTcF Verlängerung. Es wurde keine Korrelation zwischen den Brexpiprazol Konzentrationen und QTcF Verlängerung beobachtet.
Klinische Wirksamkeit
Die Wirksamkeit von REXULTI bei der Behandlung von erwachsenen Patienten mit Schizophrenie gemäss DSM‑IV‑TR Kriterien, wurde in zwei randomisierten, doppel-blinden, Placebo-kontrollierten 6‑Wochen Studien mit fixer Dosierung (Studien 1 und 2) und einer Langzeitstudie zur Erhaltungstherapie (Studie 3) gezeigt.
Für in Frage kommende Patienten wurde eine Spitalaufnahme oder eine Verlängerung des Spitalaufenthalts zur Behandlung eines akuten Rückfalls von Schizophrenie als vorteilhaft befunden. Sie mussten im Voraus eine angemessene ambulante Behandlung mit Antipsychotika erhalten und innerhalb der letzten 12 Monate vor Studienbeginn gut auf diese Behandlung (ausser Clozapin) angesprochen haben.
In den Studien 1 und 2 wurden die Patienten auf Tagesdosen von REXULTI 2 mg oder 4 mg oder Placebo randomisiert. Patienten in den REXULTI Gruppen begannen die Behandlung mit 1 mg einmal täglich am Tag 1. Am Tag 5 wurde die REXULTI Dosis auf 2 mg einmal täglich erhöht. Am Tag 8 wurde die Dosis, abhängig vom Behandlungsarm, für die restlichen 5 Studienwochen entweder bei 2 mg belassen oder auf 4 mg einmal täglich erhöht.
Die Studien 1 und 2 umfassten auch zwei Behandlungsarme mit tiefer REXULTI Dosierung von 0.25 mg/Tag und 1 mg/Tag. Diese wurden jedoch nicht in die primäre Analyse aufgenommen.
Der primäre Wirksamkeits-Endpunkt für beide Studien war die Veränderung des Gesamtscores der Positive and Negative Syndrome Scale (PANSS) vom Ausgangswert bis Woche 6. Die PANSS umfasst 30 Items und misst die positiven (7 Items) und negativen (7 Items) Symptome der Schizophrenie sowie die allgemeine Psychopathologie (16 Items). Jedes Item wird auf einer Skala von 1 (nicht vorhanden) bis 7 (extrem) bewertet. Der PANSS Gesamt-score reicht von 30 (bestes Ergebnis) bis 210 (schlechtestes Ergebnis). Der wichtigste sekundäre Endpunkt der Studien war die Veränderung auf der Clinical Global Impression – Severity of Illness Scale (CGI S) vom Ausgangswert bis Woche 6. Die CGI S ist eine validierte, vom Arzt bewertete Skala, die den aktuellen klinischen Zustand des Patienten in Bezug auf die Symptom-schwere bewertet. Weitere sekundäre Endpunkte waren unter anderen die Personal and Social Performance Scale (PSP), eine validierte, vom Arzt bewertete Skala, welche die persönliche und soziale Funktionsfähigkeit misst.
In Studie 1 war REXULTI in beiden Dosierungen, 2 mg/Tag und 4 mg/Tag, bezüglich des PANSS-Gesamtscores gegenüber Placebo überlegen (Tabelle 2). In Studie 2 war REXULTI in einer Dosis von 4 mg/Tag im Hinblick auf den PANSS-Gesamtscore gegenüber Placebo überlegen (Tabelle 2). Für die Dosis 2 mg/Tag wurde nur in Studie 1 eine statistisch signifikante Wirksamkeit gezeigt. Aus der Untersuchung der Populationsuntergruppen auf Basis von Alter, Geschlecht und ethnischer Zugehörigkeit ergaben sich keine Hinweise auf Unterschiede bei der Ansprechempfindlichkeit.
Tabelle 2 zeigt die Ergebnisse für den primären Wirksamkeitsendpunkt für die Studien 1 und 2.
Tabelle 2: Primäre Wirksamkeitsresultate für die 6-Wochen Studien in Schizophrenie (Studien 1 und 2)
Primärer Wirksamkeitsparameter: PANSS | ||||||
Studie | Behandlungs-gruppe | N | Mittlerer Ausgangswert (SD) | LS mittlere Abweichung vom Ausgangswert (SE) | LS mittlere Differenza (95% KI) | p-Wert |
1 | REXULTI (2 mg/Tag)* | 180 | 95,85 (13,75) | -20,73 (1,55) | -8,7 (‑13,1; ‑4,4) | <0,0001 |
REXULTI (4 mg/Tag)* | 178 | 94,70 (12,06) | -19,65 (1,54) | -7,6 (‑12,0; ‑3,1) | 0,0006 | |
Placebo | 178 | 95,69 (11,46) | -12,01 (1,60) | -- | - | |
2 | REXULTI (2 mg/Tag) | 179 | 96,30 (12,91) | -16,61 (1,49) | -3,1 (‑7,2; 1,1) | 0,1448 |
REXULTI (4 mg/Tag)* | 181 | 94,99 (12,38) | -20,00 (1,48) | -6,5 (‑10,6; ‑2,4) | 0,0022 | |
Placebo | 180 | 94,63 (12,84) | -13,53 (1,52) | -- | - | |
SD: standard deviation (Standardabweichung); SE: standard error (Standardfehler); LS: Least-Square, KI: unadjusted confidence interval (unbereinigtes Konfidenzintervall).
* REXULTI dem Placebo statistisch signifikant überlegen
a Differenz (REXULTI minus Placebo) der Least-Square mittleren Veränderung vom Ausgangswert bis Woche 6
REXULTI war in den Dosierungen 2 mg/Tag und 4 mg/Tag in den sekundären Endpunkten, CGI-S-Score und PSP-Gesamtscore, Placebo überlegen. Somit bestätigen die Ergebnisse für den CGI-S- und den PSP-Score sekundäre Endpunkte die Überlegenheit und klinisch relevante Wirkung von REXULTI im Vergleich zu Placebo.
Ein vorher festgelegte Interimsanalyse zeigte bei den in die REXULTI Gruppe (1–4 mg/Tag) randomisierten Patienten eine statistisch signifikant längere Zeit bis zum drohenden Rückfall als bei den in die Placebo Gruppe randomisierten Patienten (p = 0,0008, Log-Rank Test). Die Schlussanalyse bestätigte die statistisch signifikant längere Zeit bis zum drohenden Rückfall für Patienten in der REXULTI Gruppe gegenüber der Placebo Gruppe (p < 0,0001, Log-Rank Test). Die Kaplan-Meier Kurven des kumulativen Anteils der Patienten im finalen Analyse Set, die während der doppel-blinden Behandlungsphase in den REXULTI und Placebo Gruppen einen Rückfall erlitten, sind in Abbildung 1 dargestellt. Bei der Schlussanalyse betrug die Hazard-Ratio aus dem Cox Proportional Hazard Model für den Vergleich von Placebo und REXULTI 3,42 (95% KI: 1,82; 6,41, Rückfallrate 13,54% vs. 38,46%). Somit hatten Patienten in der Placebo Gruppe ein 3,42-fach erhöhtes Risiko für einen drohenden Rückfall als Patienten in der REXULTI Gruppe.
Abbildung 1: Kaplan-Meier Kurven für die Zeit bis zum drohenden Rückfall (doppel-blinde Erhaltungsphase, Wirksamkeits-Stichprobe) – Schlussanalyse, Studie 3

Langzeitdaten
Die Langzeitstudie (Studie 3) war eine randomisierte Placebo-kontrollierte doppelblinde Studie zur Messung der Wirksamkeit, Sicherheit und Verträglichkeit von REXULTI 1–4 mg/Tag als Erhaltungstherapie bei Erwachsenen mit Schizophrenie. Die Brexpiprazol-Dosierung konnte in dieser Studie nach Ermessen des Prüfers angepasst werden. Die häufigste Modaldosis für stabilisierte Patienten, die randomisiert Brexpiprazol zugeordnet waren, betrug 4 mg/Tag (64 Patienten, 66%), gefolgt von 3 mg/Tag (25 Patienten, 25,8%), 2 mg/Tag (7 Patienten, 7,2%) und 1 Patient (1%) erhielt eine Modaldosis von 1 mg/Tag.
Pharmakokinetik
Absorption
Nach Verabreichung von REXULTI Tabletten wird Brexpiprazol gut absorbiert, mit Spitzen-Plasmakonzentrationen innerhalb von 4,0 bis 8 Stunden nach Verabreichung einer Einzeldosis. Die absolute orale Bioverfügbarkeit der Tablettenformulierung beträgt 95,1%. Die Steady-State Konzentration von Brexpiprazol wird nach 10–12 Tagen Verabreichung erreicht und sind etwa 4-fach höher als nach der ersten Dosis. REXULTI kann mit oder ohne Nahrung eingenommen werden. Die Einnahme einer Tablette REXULTI 4 mg zusammen mit einer fettreichen Standardmahlzeit hatte keinen signifikanten Effekt auf die Cmax oder AUC von Brexpiprazol. Nach Einzel- und Mehrfach-Dosen von bis zu 8 mg einmal täglich erhöhte sich die Brexpiprazol Exposition (Cmax und AUC) proportional zur verabreichten Dosis. In-vitro Studien gaben keinen Hinweis darauf, dass Brexpiprazol ein Substrat für Efflux-Transporter wie MDR1 (P-gp) und BCRP ist.
Distribution
Das Distributionsvolumen von Brexpiprazol nach intravenöser Verabreichung ist hoch (1,56 ± 0,418 l/kg), was auf eine extravaskuläre Distribution hinweist. Brexpiprazol zeigt im Plasma eine starke Proteinbindung an Serumalbumin (über 99%) und saures α1-Glykoprotein. Seine Proteinbindung wird durch Nieren- oder Leberfunktionsstörungen nicht beeinflusst. Resultate aus in-vitro Studien zeigen keine Beeinflussung der Proteinbindung von Brexpiprazol durch Warfarin, Diazepam oder Digoxin.
Metabolismus
TEX In-vitro Metabolismus Studien mit Brexpiprazol unter Verwendung von rekombinantem humanem Cytochrom P450 (CYP1A1, 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 und 3A4) zeigen, dass Brexpiprazol hauptsächlich durch CYP3A4 und CYP2D6 metabolisiert wird.
In-vivo wird Brexpiprazol in erster Linie von den Enzymen CYP3A4 und CYP2D6 metabolisiert. Nach ein- und mehrmaliger Anwendung, sind Brexpiprazol und ein Hauptmetabolit, DM-3411, die vorherrschenden Arzneimittelanteile im systemischen Kreislauf. DM-3411 macht im Steady State 23,1–47,7% der Brexpiprazol Exposition (AUC) im Plasma aus. Allerdings zeigten präklinische in-vivo Studien, dass bei klinisch relevanten Plasmaexpositionen von Brexpiprazol die Exposition von DM-3411 im Hirn unter der Nachweisgrenze lag. Daher trägt DM-3411 wahrscheinlich nicht zur therapeutischen Wirkung von Brexpiprazol bei.
Elimination
Nach einer oralen Einzeldosis von [14C]-markiertem Brexpiprazol wurden etwa 24,6% der verabreichten Radioaktivität im Urin und 46% in den Fäzes nachgewiesen. Weniger als 1% unverändertes Brexpiprazol wurde im Urin ausgeschieden und etwa 14% der oralen Dosis wurden unverändert in den Fäzes nachgewiesen. Die scheinbare orale Clearance von Brexpiprazol nach Verabreichung einer Tablette täglich beträgt 19,8 (±11,4) ml/h/kg. Nach mehrmaliger Verabreichung von REXULTI einmal täglich beträgt die terminale Eliminationshalbwertszeit von Brexpiprazol 91,4 Stunden und vom Hauptme-taboliten DM-3411 85,7 Stunden.
Kinetik spezieller Patientengruppen
Alter/Geschlecht
Nach Verabreichung einer Einzeldosis REXULTI (2 mg) zeigten gesunde ältere Probanden (über 65 Jahre) eine ähnliche systemische Brexpiprazol Exposition (Cmax und AUC) wie erwachsene Probanden (18–45 Jahre). Weibliche Probanden zeigten eine um etwa 40–50% höhere systemische Brexpiprazol Exposition (Cmax und AUC) als männliche Probanden. Bei der Populationspharmakokinetischen Untersuchung wurden Alter und weibliches Geschlecht als statistisch signifikante Kovariaten ermittelt, die die Pharmakokinetik von Brexpiprazol beeinflussen, aber nicht als klinisch relevant beurteilt werden.
Ethnische Zugehörigkeit
Obwohl keine spezielle pharmakokinetische Studie zur Auswirkung der ethnischen Zugehörigkeit auf die Disposition von Brexpiprazol durchgeführt wurde, ergab die Populations-pharmakokinetische Beurteilung keinen Hinweis auf klinisch signifikante Unterschiede aufgrund ethnischer Zugehörigkeit in der Pharmakokinetik von Brexpiprazol.
Langsame CYP2D6 Metabolisierer
Etwa bei 8% der Kaukasier und bei 3–8% der Schwarzen/Afroamerikaner fehlt die Fähigkeit, CYP2D6 Substrate zu metabolisieren. Sie werden als langsame Metabolisierer (poor metabolisers, PM) klassifiziert, im Gegensatz zu den extensiven Metabolisierern (extensive metabolisers, EM). Die Brexiprazol Exposition ist bei CYP2D6 PMs etwa 1,8-fach höher als bei EMs. (siehe Dosierung/Anwendung).
Rauchen
In-vitro-Studien mit humanen Leberenzymen zeigen, dass Brexpiprazol kein Substrat für CYP1A2 ist. Rauchen sollte sich somit nicht auf die Pharmakokinetik von Brexpiprazol auswirken.
Leberfunktionsstörungen
Patienten mit mässigen bis schweren Leberfunktionsstörungen (Child-Pugh-Klassifikation ≥7) wiesen in der Regel eine höhere Brexpiprazol Exposition auf als Patienten mit normaler Leberfunktion. Daher sollte die maximal empfohlene Dosis reduziert werden. Bei Probanden mit Leberfunktionsstörungen unterschiedlicher Grade (Child-Pugh-Klassen A, B und C), stieg die AUC von oralem Brexpiprazol (2 mg Einzeldosis) im Vergleich zu entsprechenden gesunden Probanden um 24% bei leichter und um 60% bei mässiger Leberfunktionsstörung, während sie bei schwerer Leberfunktionsstörung unverändert blieb.
Nierenfunktionsstörungen
Patienten mit Nierenfunktionsstörung (CLcr < 60 ml/min) wiesen eine höhere Brexpiprazol Exposition auf als Patienten mit normaler Nierenfunktion. Daher sollte die maximal empfohlene Dosis reduziert werden. Bei Probanden mit schwerer Nierenfunktionsstörung (CLcr < 30 ml/min) stieg die AUC von oralem Brexpiprazol (2 mg Einzeldosis) im Vergleich zu entsprechenden gesunden Probanden um 69%, während die Cmax unverändert blieb.
Präklinische Daten
Basierend auf konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Genotoxizität, Reproduktions- und Entwicklungstoxizität und zum kanzerogenen Potenzial lassen präklinischen Daten keine speziellen Gefahren für den Menschen erkennen.
Sicherheitspharmakologie
Bei Ratten induzierte Brexpiprazol in hohen Dosen (ED50 = 20 mg/kg) eine Katalepsie (Tiermodell für das Risiko eines extrapyramidalen Syndroms [EPS]). Dies zeigt, dass Brexpiprazol unter klinischen Bedingungen ein geringes Potenzial zur Auslösung eines EPS aufweist.
Beim Hund und beim Affen wurden ein erniedrigter Blutdruck und eine Verlängerung des QT- und des QTc-Intervalls festgestellt. Die Wirkung auf den Blutdruck wurde auf eine Blockade der α1-Adrenorezeptoren in den peripheren Gefässen zurückgeführt, was mit dem pharmakologischen Profil von Brexpiprazol entspricht. Die QT- und die QTc-Verlängerung hängen möglicherweise mit der pharmakologisch vermittelten Senkung der Körpertemperatur zusammen; allerdings hemmte Brexpiprazol auch den Ionentransport durch den hERG-Kanal (mit einem IC50-Wert von 0,117 µM).
Die wichtigsten klinischen Zeichen zur Festlegung des NOAEL (No-Observed-Adverse-Effect-Level, Dosis ohne beobachtete schädliche Wirkung) in den Studien zur Toxizität bei wiederholter Gabe an Ratten und Affen wurden auf die pharmakologisch bedingte Aktivitätsminderung des Zentralnervensystem (Verminderung der Bewegungen, Tremor, Schläfrigkeit, geschlossene Augen, Hypothermie) zurückgeführt. Sonstige klinische Zeichen wie zum Beispiel bei der Ratte beobachtete klonische Krampfanfälle, Hyperaktivität und Aggressivität waren nur von kurzer Dauer.
Wie bei anderen Antipsychotika ist die therapeutische Breite, gemessen anhand der AUC bei Ratten und Affen sowie der Exposition des Menschen bei der maximal empfohlenen Dosis von 4 mg/Tag, relativ gering (Männer/Frauen: 0,1/0,8 und 0,4/0,4 bei Ratten bzw. Affen).
Generell wurden die bei juvenilen Ratten und Hunden beobachteten Wirkungen nach der Gabe von Brexpiprazol auch bei erwachsenen Tieren festgestellt; es reagierten also nicht nur Jungtiere empfindlich auf Brexpiprazol.
Mutagenität
Das mutagene Potenzial von Brexpiprazol wurde im in-vitro Rückmutationstest an Bakterien, im in-vitro Vorwärts-Genmutationstest an Lymphomzellen der Maus, im in-vitro Chromosomen Aberrationstest mit Ovarialzellen des chinesischen Hamsters (CHO), im in-vivo Mikronukleus Test an Ratten sowie im unplanmässigen DNA-Synthese Test an Ratten untersucht. Bei in-vitro-Tests mit Säugetierzellen war Brexpiprazol mutagen und klastogen, aber nur in Dosen, die Zytotoxizität induzierten. In anderen Studien wurde keine Mutagenität oder Genotoxizität beobachtet. Aufgrund der Beweislage wird Brexpiprazol nicht als genotoxisches Risiko für den Menschen beurteilt.
Karzinogenität
Das lebenslange karzinogene Potenzial von Brexpiprazol wurde in einer zwei-Jahres Studie an ICR Mäusen und Sprague-Dawley Ratten untersucht. Den Mäusen wurde Brexpiprazol während zwei Jahren oral verabreicht (Schlundsonde) in einer Dosierung von 0,75, 2 und 5 mg/kg/Tag (mit der 0,3-3,1-fachen (Männchen) und 0,2-1,1-fachen (Weibchen) Plasma AUC verglichen mit der klinischen Exposition bei der maximal empfohlenen oralen Dosis von 4 mg beim Menschen [MRHD]). Bei den männlichen Tieren nahm die Häufigkeit von Tumoren in keiner Dosisgruppe zu. Bei weiblichen Mäusen stieg die Häufigkeit von Adenokarzinomen der Brustdrüsen, von adenosquamösen Karzinomen sowie von pars-distalis Adenomen der Hypophyse. Den Ratten wurde Brexpiprazol während zwei Jahren oral verabreicht (Schlundsonde) in einer Dosierung von 1, 3 und 10 mg/kg/Tag an männliche Ratten und von 3, 10 und 30 mg/kg/Tag an weibliche Ratten (mit Plasma AUC-Expositionen bis zu 1,0-fach (Männchen) und 4,4-fach (Weibchen) erhöht im Vergleich zur Exposition bei der 4 mg/Tag MRHD). Bei Ratten war Brexpiprazol nicht karzinogen.
Fertilitätsstörungen
Die Auswirkungen von Brexpiprazol auf die Fertilität wurden an weiblichen und männlichen Ratten untersucht. Brexpiprazol wurde weiblichen Ratten vor der Paarung mit unbehandelten Männchen bis zur Empfängnis und Einnistung der Eizelle einmal täglich oral per Schlundsonde verabreicht in Dosen von 0; 0,3; 3 oder 30 mg/kg/Tag mit einer Exposition (Plasma-AUC) bis zum 4,1-fachen der klinischen Exposition bei Anwendung der MRHD). Bei 3 und 30 mg/kg/Tag wurden ein verlängerter Diöstrus und verringerte Fertilität beobachtet, wobei die Exposition (Plasma) um das ≥0,2-fache über der klinischen Exposition bei der MRHD lag. Bei 30 mg/kg/Tag (AUC-Exposition 4,1-fache höher als bei der klinischen Exposition mit MHRD) wurden eine geringfügige Verlängerung der Paarungsphase sowie eine signifikante Zunahme der Verluste vor Einnisten der Eizelle beobachtet. Der no observed adverse effect level für Brexpiprazol war 0,3 mg/kg/Tag (das 0,7-fache der oralen MRHD von 4 mg für einen 60 kg Patienten, berechnet anhand eines Vergleichs der Körperoberfläche).
An männliche Ratten wurde Brexpiprazol einmal täglich oral per Schlundsonde verabreicht in Dosierungen von 0, 3, 10 oder 100 mg/kg/Tag mit einer bis zu 11,6-fach erhöhten Exposition (Plasma AUC) verglichen mit der klinischen Exposition bei der MRHD. Nach 63 Tagen Verabreichung wurden die behandelten Männchen für maximal 14 Tage mit unbehandelten Weibchen zusammengebracht. Es wurden keine erkennbaren Unterschiede in der Paarungs-dauer oder den Fertilitätsindizes in irgendeiner der mit Brexpiprazol behandelten Gruppen festgestellt.
Entwicklungstoxizität und Laktation
In Studien zur Entwicklungstoxizität war Brexpiprazol nicht teratogen und hatte keine unerwünschten Wirkungen auf die Entwicklung. In diesen Studien erhielten trächtige Ratten und Kaninchen während der Phase der Organogenese Brexpiprazol in Dosen von bis zu 30 mg/kg/Tag wobei die Exposition (Plasma AUC), 4,1-fach bzw. 5,9-fach über der klinischen Exposition bei MRHD betrugen).
In der Embryo-fötalen Entwicklungsstudie an Kaninchen, mit einer zu materneller Toxizität führenden oralen Dosis (150 mg/kg/Tag, 16,5-fache AUC Exposition verglichen zur klinischen Exposition) wurden bei den Föten verringertes Körpergewicht, verzögerte Knochenbildung und gehäuftes Auftreten von Anomalien der Eingeweide und des Skeletts beobachtet.
Wurde Brexpiprazol an trächtige Ratten während der Periode von Organogenese bis zur Laktation verabreicht, erhöhte sich die Zahl der perinatalen Todesfälle der Jungen bei 30 mg/kg/Tag (4,1-fach erhörte Plasma AUC-Exposition verglichen zur klinischen Exposition bei der 4 mg MRHD); die No-Effect-Dosis lag bei 10 mg/kg/Tag (0,8-fache Exposition verglichen zur klinischen Exposition).
Wirkung auf das Serum-Prolaktin
Nach chronischer Verabreichung von Antipsychotika an Nager wurden proliferative und/oder neoplastische Veränderungen der Brustdrüsen und der Hypophyse beobachtet, welche wahrscheinlich durch Prolaktin vermittelt werden. Brexpiprazol zeigte sowohl bei Mäusen wie auch bei Ratten ein Potenzial zur Erhöhung der Serum-Prolaktinspiegel. Die Relevanz dieser Daten zu Prolaktin-vermittelten endokrinen Tumoren bei Nagern für das Risiko beim Menschen ist nicht bekannt.
Missbrauchspotenzial
Brexpiprazol zeigte weder ein Potenzial zur Erzeugung physischer Abhängigkeit bei Ratten noch eine verstärkende Wirkung bei Rhesusaffen. In einer Studie zum Medikamenten Missbrauchspotenzial bei Ratten, wurden keine Entzugserscheinungen, die eine physische Abhängigkeit nahelegen, nachgewiesen. Brexpiprazol wird kein Potenzial zur Erzeugung physischer Abhängigkeit zugeschrieben.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Ausser Reichweite von Kindern aufbewahren.
Nicht über 30°C lagern.
In der Originalverpackung aufbewahren.
Zulassungsnummer
66475 (Swissmedic)
Zulassungsinhaberin
Lundbeck (Schweiz) AG, Opfikon.
Stand der Information
August 2020.
30102020FI
Composition
Principes actifs
Brexpiprazole.
Excipients
Noyau du comprimé:
0,5 mg: lactose monohydraté 47,9 mg, amidon de maïs, cellulose microcristalline, hydroxypropylcellulose, hydroxypropylcellulose à faible substitution, stéarate de magnésium.
1 mg: lactose monohydraté 47,4 mg, amidon de maïs, cellulose microcristalline, hydroxypropylcellulose, hydroxypropylcellulose à faible substitution, stéarate de magnésium.
2 mg: lactose monohydraté 46,4 mg, amidon de maïs, cellulose microcristalline, hydroxypropylcellulose, hydroxypropylcellulose à faible substitution, stéarate de magnésium.
3 mg: lactose monohydraté 45,4 mg, amidon de maïs, cellulose microcristalline, hydroxypropylcellulose, hydroxypropylcellulose à faible substitution, stéarate de magnésium.
4 mg: lactose monohydraté 44,4 mg, amidon de maïs, cellulose microcristalline, hydroxypropylcellulose, hydroxypropylcellulose à faible substitution, stéarate de magnésium.
Pelliculage du comprimé:
0,5 mg: hypromellose, talc, colorant: dioxyde de titane (E171), oxyde de fer jaune et rouge (E172),
1 mg: hypromellose, talc, colorant: dioxyde de titane (E171), oxyde de fer jaune (E172),
2 mg: hypromellose, talc, colorant: dioxyde de titane (E171), oxyde de fer jaune et noir (E172),
3 mg: hypromellose, talc, colorant: dioxyde de titane (E171), oxyde de fer rouge et noir (E172),
4 mg: hypromellose, talc, colorant: dioxyde de titane (E171).
Forme pharmaceutique et quantité de principe actif par unité
0,5 mg comprimé pelliculé: 0,5 mg brexpiprazole.
1 mg comprimé pelliculé: 1 mg brexpiprazole.
2 mg comprimé pelliculé: 2 mg brexpiprazole.
3 mg comprimé pelliculé: 3 mg brexpiprazole.
4 mg comprimé pelliculé: 4 mg brexpiprazole.
Comment se présentent les comprimés pelliculés
Tous les comprimés sont ronds, légèrement convexes et à bords biseautés
0.5 mg: orange pâle, gravé «BRX» et «0.5» d'un côté.
1 mg: jaune pâle, gravé «BRX» et «1» d'un côté.
2 mg: vert pâle, gravé «BRX» et «2» d'un côté.
3 mg: violet pâle, gravé «BRX» et «3» d'un côté.
4 mg: blanc, gravé «BRX» et «4» d'un côté.
Indications/Possibilités d’emploi
REXULTI est indiqué pour le traitement de la schizophrénie chez l'adulte.
Posologie/Mode d’emploi
La posologie initiale recommandée de REXULTI pour le traitement de patients atteints de schizophrénie est de 1 mg une fois par jour du 1er au 4e jour.
La fourchette posologique recommandée est de 2-4 mg une fois par jour.
Le jour 5, la prise du médicament est augmentée à 2 mg, puis à 4 mg le jour 8 selon la tolérance et la réponse clinique du patient. La dose quotidienne maximale recommandée est de 4 mg.
Traitement d'entretien
La fourchette posologique recommandée est de 2-4 mg/jour. La nécessité du traitement d'entretien et la posologie appropriée doivent être contrôlées régulièrement.
REXULTI peut se prendre pendant ou en dehors des repas.
Instructions posologiques particulières
Patients âgés
La sécurité et l'efficacité de REXULTI pour le traitement de la schizophrénie chez le sujet âgé (plus de 65 ans) n'ont pas été établies. L'exposition au brexpiprazole observée était similaire lors de l'administration de REXULTI à des sujets âgés en bonne santé (plus de 65 ans) et à des sujets adultes (18-45 ans) (voir la rubrique Pharmacocinétique). La posologie doit être définie avec prudence et à l'extrémité inférieure de la fourchette posologique pour les patients âgés afin de tenir compte des atteintes plus fréquentes des fonctions hépatiques, rénales et cardiaques, ainsi que des comorbidités et des autres traitements médicamenteux.
Patients présentant des troubles de la fonction hépatique
Chez les patients atteints de schizophrénie qui présentent une insuffisance hépatique modérée à sévère (score de Child-Pugh ≥7), la dose maximale recommandée est de 3 mg, une fois par jour.
Patients présentant des troubles de la fonction rénale
Chez les patients atteints de schizophrénie qui présentent une insuffisance rénale modérée, sévère ou terminale (clairance de la créatinine CLcr < 60 ml/min), la dose maximale recommandée est de 3 mg, une fois par jour.
Autres groupes de patients particuliers
Aucun ajustement de la dose de REXULTI n'est nécessaire en raison du sexe, de l'origine ethnique ou du tabagisme (voir la rubrique Pharmacocinétique).
Ajustements posologiques chez les métaboliseurs lents du CYP2D6 et lors de l'utilisation concomitante d'inhibiteurs ou d'inducteurs du CYP
Posologie ajustée | |
Métaboliseurs lents du CYP2D6 | |
Métaboliseurs lents du CYP2D6 connus | Administration de la moitié de la dose habituelle |
Métaboliseurs lents du CYP2D6 connus, qui prennent un inhibiteur modéré/puissant du CYP3A4 | Administration d'un quart de la dose habituelle |
Patients prenant un inhibiteur du CYP2D6 et/ou un inhibiteur du CYP3A4 | |
Inhibiteur puissant du CYP2D6 | Administration de la moitié de la dose habituelle |
Inhibiteur puissant du CYP3A4 | |
Inhibiteur puissant/modéré du CYP2D6 avec inhibiteurs puissants/modérés du CYP3A4 | Administration d'un quart de la dose habituelle |
Patients prenant des inducteurs du CYP3A4 | |
Inducteurs puissants du CYP3A4* | Doublement de la dose habituelle pendant 1 à 2 semaines |
* Si l'inducteur du CYP3A4 pris simultanément est arrêté, la posologie doit être réduite au niveau initial pendant 1‑2 semaines.
Enfants et adolescents
La sécurité et l'efficacité de REXULTI n'ont pas été étudiées chez l'enfant et l'adolescent de moins de 18 ans (voir la rubrique Mises en garde et précautions).
Contre-indications
Hypersensibilité au principe actif ou à l'un des excipients mentionnés sous Composition.
Mises en garde et précautions
Mortalité accrue chez les patients âgés atteints de psychose démentielle
Les patients âgés atteints de psychose démentielle sous traitement antipsychotique présentent un risque de décès plus élevé que ceux recevant un placebo.
Les analyses de 17 études contrôlées par placebo (durée modale de 10 semaines), portant principalement sur des patients sous antipsychotiques atypiques, ont démontré que les patients traités par médicaments présentaient un risque de mortalité 1.6 à 1.7 fois plus élevé que les patients sous placebo. Au cours d'une étude contrôlée type sur 10 semaines, le taux de mortalité des patients traités par médicaments a été de 4.5% environ contre 2.6% chez les patients sous placebo. REXULTI n'est pas approuvé pour le traitement de la psychose démentielle.
Effets indésirables sur le système cérébrovasculaire
Dans des études contrôlées par placebo portant sur plusieurs antipsychotiques administrés à des patients âgés atteints de démence, on a observé une fréquence plus élevée d'événements indésirables cérébrovasculaires (AVC et hémorragies temporaires), y compris les cas de décès, comparativement aux sujets recevant le placebo.
Risque de suicide
Les maladies psychotiques augmentent le risque de tentative de suicide. Les patients à haut risque doivent être étroitement surveillés pendant le traitement médicamenteux et bénéficier d'un suivi clinique approprié.
Thromboembolie veineuse
Des cas de thromboembolie veineuse (TEV) ont été rapportés sous antipsychotiques. Les patients traités par antipsychotiques présentent souvent des facteurs de risque acquis de TEV. Les facteurs de risque de TEV possibles doivent donc être testés scrupuleusement avant et pendant le traitement par REXULTI et des précautions doivent être prises.
Syndrome malin des neuroleptiques (SMN)
Le SMN est un ensemble potentiellement mortel de symptômes qui a été observé avec l'emploi d'antipsychotiques, y compris brexpiprazole. Les manifestations cliniques d'un SMN sont: hyperthermie, raideur musculaire, altération de la conscience et signes d'instabilité autonome (pouls ou tension artérielle irréguliers, tachycardie, diaphorèse, troubles du rythme cardiaque). Les autres signes peuvent être: taux élevé de créatine phosphokinase, myoglobinurie (rhabdomyolyse) et insuffisance rénale aiguë. Si un patient développe des signes et symptômes faisant penser à un SMN ou présente une forte fièvre inexpliquée sans autres manifestations cliniques du SMN, tous les antipsychotiques, y compris REXULTI, doivent être arrêtés. Si un patient a besoin d'un traitement antipsychotique après avoir guéri d'un SMN, la reprise éventuelle d'un traitement médicamenteux doit être évaluée soigneusement. Le paient doit être surveillé étroitement, car des récidives de SMN ont été rapportées.
Dyskinésie tardive
Les patients sous traitement antipsychotique peuvent développer un syndrome se manifestant par des mouvements dyskinétiques involontaires, et qui peut être potentiellement irréversible. La prévalence maximale de ce syndrome semble concerner les patients âgés, plus particulièrement les femmes âgées. Malgré les estimations de prévalence, il n'est pas possible de prévoir en début de traitement antipsychotique quels patients risquent de présenter ce syndrome.
Si des signes et symptômes de dyskinésie tardive surviennent pendant le traitement par REXULTI, une réduction de la dose ou l'arrêt du médicament doivent être envisagés. Les symptômes peuvent s'aggraver temporairement ou apparaître spontanément après l'arrêt du traitement.
Hyperglycémie et diabète
Une hyperglycémie parfois très marquée, accompagnée d'une acidocétose ou d'un coma hyperosmolaire, voire un décès, a été rapportée chez les patients sous traitement par antipsychotiques.
Chez les patients traités par antipsychotiques, les signes et symptômes de l'hyperglycémie (par ex. polydipsie, polyurie, polyphagie et faiblesse) doivent être surveillés. Les patients diabétiques ou présentant des facteurs de risque de diabète (par ex. obésité ou antécédents familiaux de diabète) doivent être contrôlés régulièrement pour détecter toute détérioration des valeurs de glucose. Chez les patients présentant une hyperglycémie liée au traitement significative, l'arrêt de REXULTI doit être envisagé.
Dans des études cliniques sur REXULTI (études 1 et 2) portant sur des patients atteints de schizophrénie, les fluctuations du glucose à jeun étaient comparables sous REXULTI et sous placebo.
Dans l'étude à long terme sur le traitement d'entretien (étude 3), les fluctuations moyennes des valeurs de glucose sérique étaient faibles entre le départ et la dernière visite, aussi bien sous REXULTI (2.11 mg/dl) que sous placebo (1.62 mg/dl), et n'ont pas été considérées comme cliniquement significatives.
Dans les études ouvertes à long terme, l'écart moyen entre les valeurs de glucose sérique à jeun de départ et à la dernière visite était de 2.31 mg/dl (N=1'120).
Prise de poids et dyslipidémie
Des modifications du métabolisme, comme une prise de poids et une dyslipidémie, se sont produites sous traitement antipsychotique. Une surveillance clinique du poids corporel est recommandée (voir la rubrique Effets indésirables).
Hypotension orthostatique et syncope
Dans les études cliniques à court terme contrôlées par placebo avec REXULTI administré à des patients atteints de schizophrénie, l'incidence des événements indésirables liés à l'hypotension orthostatique observée sous REXULTI par rapport au placebo a été la suivante: vertiges (2.3% contre 1.4%), hypotonie orthostatique (0.4% contre 0.2%) et syncope (0.1% contre 0%).
L'hypotension orthostatique peut être associée à des effets indésirables, comme des vertiges, des étourdissements et une tachycardie. Le risque est généralement maximal en début de traitement et pendant la phase d'augmentation de la dose. Les patients déshydratés, hypovolémiques, sous traitement antihypertenseur, ayant des antécédents de maladies cardiovasculaires (par ex. insuffisance cardiaque, infarctus du myocarde, ischémie ou troubles de la conduction) ou cérébrovasculaires, ainsi que les patients prenant un traitement antipsychotique pour la première fois, présentent un risque accru de subir ces effets indésirables ou des complications dues à l'hypotension. Une dose initiale moins forte et une augmentation progressive plus lente doivent être envisagées chez ces patients, dont les paramètres vitaux orthostatiques doivent être surveillés.
Convulsions
Comme les autres antipsychotiques, REXULTI doit être utilisé avec prudence chez les patients ayant des antécédents de convulsions ou dont le tableau clinique indique des seuils de déclenchement potentiellement réduits.
Thermorégulation
Les antipsychotiques peuvent compromettre la capacité du corps à abaisser la température interne. Chez les patients présentant un risque d'élévation de la température interne, par ex. en raison d'une activité physique intense, d'une chaleur extrême, d'un traitement concomitant par médicaments anticholinergiques ou d'une déshydratation, REXULTI doit être prescrit avec la diligence appropriée.
Dysphagie
Des troubles de la motilité de l'œsophage et de l'aspiration ont été observés sous traitement antipsychotique. REXULTI et les autres antipsychotiques doivent être utilisés avec prudence chez les patients présentant un risque de pneumonie d'aspiration.
Leucopénie, neutropénie et agranulocytose
Une leucopénie/neutropénie a été rapportée sous traitement par antipsychotiques. Pour les autres principes actifs de cette classe, des agranulocytoses (y compris des cas de décès) ont été observées.
Les facteurs de risque possibles de la leucopénie/neutropénie sont, entre autres, la préexistence d'une numération leucocytaire basse, ainsi que des antécédents de leucopénie/neutropénie induite par les médicaments. Chez les patients présentant ces facteurs de risque, un hémogramme complet doit être effectué fréquemment au cours des premiers mois de traitement. En l'absence d'autres facteurs déclencheurs, REXULTI doit être arrêté dès les premiers signes de chute des valeurs leucocytaires.
Chez les patients présentant une neutropénie, toute fièvre ou tout autre signe ou symptôme d'infection doivent être surveillés attentivement et, en cas de manifestation de ces symptômes, un traitement doit être instauré immédiatement. Chez les patients présentant une neutropénie sévère (numération des neutrophiles absolue < 1'000/mm3), REXULTI doit être arrêté et la numération des leucocytes doit être contrôlée jusqu'à la guérison.
Troubles du contrôle des impulsions
Chez les patients sous brexpiprazole, des cas de troubles du contrôle des impulsions, y compris une addiction aux jeux, ont été rapportés. Les patients ayant des antécédents de troubles du contrôle des impulsions sont susceptibles de présenter un risque accru et doivent être étroitement suivis. A noter que les symptômes d'un trouble du contrôle des impulsions peuvent être liés à la maladie sous-jacente.
Lactose
REXULTI comprimés contient du lactose. Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Enfants et adolescents
La sécurité et l'efficacité de REXULTI n'ont pas été étudiées chez les patients ayant moins de 18 ans.
Personnes âgées
Des études cliniques sur REXULTI ont été menées sur un nombre limité de sujets ayant 65 ans ou plus pour déterminer la possibilité qu'ils réagissent différemment des sujets plus jeunes. Les sujets âgés (> 65 ans) ont présenté une exposition systémique au brexpiprazole comparable à celle des sujets adultes (18-45 ans) (voir les rubriques Pharmacocinétique et Posologie/Mode d'emploi). Les patients âgés atteints de psychose démentielle sous traitement antipsychotique présentent un risque de décès plus élevé que sous placebo (voir ci-dessus: Mortalité accrue chez les patients âgés atteints de psychose démentielle).
Insuffisance hépatique
La posologie doit être ajustée pour les patients insuffisants hépatiques (voir les rubriques Pharmacocinétique et Posologie/Mode d'emploi).
Insuffisance rénale
La posologie doit être ajustée pour les patients insuffisants rénaux (voir les rubriques Pharmacocinétique et Posologie/Mode d'emploi).
Interactions
REXULTI est principalement métabolisé par les cytochromes CYP3A4 et CYP2D6. Sur la base des résultats d'études d'interaction du médicament chez les personnes recevant de puissants inhibiteurs du CYP2D6 et du CYP3A4, il est recommandé d'ajuster la dose d'entretien en la réduisant de moitié. D'après les estimations effectuées dans le cadre d'analyses de la pharmacocinétique au sein de la population, les métaboliseurs rapides du CYP2D6 qui reçoivent un inhibiteur du CYP3A4 et du CYP2D6 ou les métaboliseurs lents du CYP2D6 qui reçoivent un puissant inhibiteur du CYP3A4 devraient présenter des concentrations en brexpiprazole 4 ou 5 fois supérieures. Dans ce cas, la prise de REXULTI doit donc être réduite à un quart de la dose recommandée (voir la rubrique Posologie/Mode d'emploi).
Si REXULTI est utilisé conjointement à un puissant inducteur du CYP3A4 (par ex. rifampicine), la dose doit être multipliée par 2, puis adaptée en fonction de la réponse clinique (voir la rubrique Posologie/Mode d'emploi).
Inducteurs enzymatiques
Rifampicine et autres inducteurs du CYP3A4
En cas d'utilisation concomitante de rifampicine (600 mg deux fois par jour pendant 12 jours), un puissant inducteur du CYP3A4, et de REXULTI 4 mg en dose unique par voie orale, la valeur Cmax du brexpiprazole a chuté d'environ 31% et l'AUC, d'environ 73%.
Inhibiteurs enzymatiques
Inhibiteur puissant du CYP2D6
En cas d'utilisation concomitante de REXULTI 2 mg en dose unique par voie orale et de quinidine (324 mg/jour pendant 7 jours), un puissant inhibiteur du CYP2D6 (non autorisé en Suisse), l'aire sous la courbe (area under the curve [AUC]) du brexpiprazole a augmenté de 94%.
Kétoconazole et autres puissants inhibiteurs du CYP3A4
En cas d'utilisation concomitante de kétoconazole (200 mg deux fois par jour pendant 7 jours), un puissant inhibiteur du CYP3A4 et de REXULTI 2 mg en dose unique par voie orale, l'AUC du brexpiprazole a augmenté de 97%.
Inhibiteurs du CYP2B6
L'utilisation concomitante de REXULTI 2 mg en dose unique par voie orale et de ticlopidine (250 mg deux fois par jour pendant 7 jours), un inhibiteur du CYP2B6 (non autorisé en Suisse), n'a aucun effet sur la pharmacocinétique du brexpiprazole.
Autres interactions
Modificateurs de pH de l'acide gastrique
L'utilisation concomitante d'oméprazole (40 mg une fois par jour pendant 5 jours), un inhibiteur de la pompe à protons (IPP) largement utilisé, et de REXULTI 4 mg en dose unique par voie orale n'a aucun effet sur l'absorption du brexpiprazole.
Effet de REXULTI sur d'autres médicaments
Les données in vitro ont montré une inhibition faible, voire nulle, de l'isoenzyme CYP450 par le brexpiprazole. L'inhibition potentielle in vitro des transporteurs de MDR1 (P-gp), OAT1, OAT3, OCT2, d'extrusion de multiples médicaments et toxines (MATE1), MATE2-K, OATP1B1, OATP1B3 et OCT1 par le brexpiprazole a également été étudiée. Le brexpiprazole ou son métabolite principal ont seulement été identifiés comme des inhibiteurs potentiels du transporteur d'efflux-BCRP de BCRP, OATP1B1, MATE1 et MATE2-K, mais pas comme des inhibiteurs des autres transporteurs testés.
Des études cliniques montrent que REXULTI par voie orale (2 mg/jour pendant 5 jours) n'a aucun effet sur la pharmacocinétique du dextrométhorphane (substrat du CYP2D6), de la lovastatine (substrat du CYP3A4 non autorisé en Suisse), du bupropion (substrat du CYP2B6) ou de la fexofénadine (substrat du transporteur de P-gp). REXULTI (6 mg en dose unique) n'a eu aucun effet sur l'absorption de la rosuvastatine (substrat des transporteurs de BCRP et OATP).
Grossesse/Allaitement
Grossesse
L'utilisation sûre de REXULTI pendant la grossesse ou l'allaitement n'a pas été étudiée. REXULTI ne doit pas être utilisé pendant la grossesse ni chez la mère allaitante, ni chez les femmes en âge de procréer, sauf si cela est absolument nécessaire.
Les expérimentations animales sur la reproduction n'ont révélé aucune tératogénicité, mais une augmentation des cas de mortalité périnatale a été constatée (voir la rubrique Données précliniques).
Pour l'instant, aucune étude suffisamment contrôlée et adéquate n'a été menée sur la femme enceinte pour déterminer les risques liés à l'utilisation de REXULTI. Chez les nouveau-nés dont la mère a pris des antipsychotiques comme REXULTI au cours du troisième trimestre de grossesse, il existe un risque de syndrome extrapyramidal et/ou de manque après la naissance. Des cas d'agitation, de tonus musculaire anormalement élevé ou faible, de tremblements, de somnolence, de difficultés à respirer ou de problèmes pour s'alimenter ont été rapportés. Ces complications présentent différents niveaux de gravité. Dans certains cas, les symptômes étaient auto-limitatifs, tandis que dans d'autres cas, un traitement en soins intensifs ou une hospitalisation plus longue ont été nécessaires.
L'effet de REXULTI sur l'accouchement et la naissance n'est pas connu chez l'humain.
Allaitement
On ne sait pas si le brexpiprazole ou ses métabolites passent dans le lait maternel chez l'humain. Le brexpiprazole est excrété dans le lait de rats. Compte-tenu des effets indésirables potentiels graves sur le nourrisson, il convient de décider si l'allaitement doit être interrompu ou si le traitement doit être arrêté en tenant compte du risque lié à l'arrêt du traitement pour la mère.
Fertilité
Dans des expérimentations animales sur la fertilité, une baisse de la fertilité a été observée chez les rates (irrégularités du cycle d'œstrus et baisse de la fécondité), mais pas chez les mâles (voir la rubrique Données précliniques).
Effet sur l’aptitude à la conduite et l’utilisation de machines
Comme avec les autres antipsychotiques susceptibles d'altérer le jugement et les capacités de réflexion et motrice, les patients doivent s'abstenir de conduire des véhicules ou d'utiliser des machines dangereuses par mesure de précaution jusqu'à ce qu'il soit sûr que le traitement par REXULTI ne les affecte pas.
Dans les études à court terme contrôlées par placebo menées sur des patients schizophrènes, 5% des patients traités par REXULTI et 4% des patients sous placebo ont rapporté une somnolence (y compris sédation et besoin de sommeil accru). Dans les études ouvertes à long terme, l'incidence de la somnolence et des effets similaires était de 3%.
Effets indésirables
Dans les études de phases 2 et 3 en double aveugle contrôlées par placebo, les effets indésirables (EI) les plus fréquemment rapportés dans la fourchette posologique recommandée (2-4 mg par jour) ont été les suivants: acathisie (6%) et prise de poids (5%). Les événements indésirables étaient pour la plupart légers à modérés et ont généralement conduit à une interruption de l'étude.
Résumé des effets indésirables
Les effets indésirables (EI) rapportés dans les études cliniques sur le brexpiprazole dans la fourchette posologique de 2-4 mg sont classés par classe d'organe et par fréquence ci-dessous: très fréquents (≥1/10), fréquents (≥1/100 à <1/10), occasionnels (≥1/1'000 à <1/100), rares (≥1/10'000 à <1/1'000), très rares (<1/10'000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque catégorie de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Affections psychiatriques:
Fréquent: agitation*.
* L'agitation peut être associée à l'effet pharmacologique du brexpiprazole. Elle est citée, bien que la différence par rapport au placebo soit inférieure à 0.5%.
Affections du système nerveux:
Fréquent: acathisie, tremblements, sédation, vertiges.
Occasionnels: parkinsonisme.
Affections respiratoires, thoraciques et médiastinales:
Occasionnels: toux.
Affections gastro-intestinales:
Fréquent: diarrhée, sècheresse buccale, douleurs abdominales.
Occasionnels: aérophagie.
Affections de la peau et du tissu sous-cutané:
Fréquent: éruption cutanée.
Affections musculo-squelettiques et systémiques:
Fréquent: maux de dos, douleurs dans les membres.
Occasionnels: myalgie.
Troubles généraux et anomalies au site d'administration:
Fréquent: douleurs.
Investigations:
Fréquent: prise de poids, augmentation de la créatinine-phosphokinase.
Les autres effets indésirables rapportés étaient la constipation, la dyspepsie, la fatigue, l'augmentation de l'appétit, la somnolence, l'agitation, l'angoisse, l'insomnie, l'hypersensibilité et l'augmentation du taux de prolactine.
Acathisie et syndrome extrapyramidal (SEP)
Dans les études 1 et 2, la fréquence des événements connexes au SEP (sans acathisie) a été de 5.1% chez les patients sous REXULTI contre 3.5% sous placebo. La fréquence des événements d'acathisie a été de 5.4% chez les patients sous REXULTI contre 4.9% sous placebo. Dans tous les groupes de traitement, les nouveaux cas d'acathisie ont été rapportés au cours des 3 premières semaines suivant le début du traitement et ont été légers à modérés.
Les échelles objectives SAS (Simpson Angus Scale) pour le syndrome extrapyramidal, BARS (Barnes Akathisia Rating Scale) pour l'acathisie et AIMS (Abnormal Involuntary Movement Scale) pour la dyskinésie ont été utilisées dans les études 1 et 2. Sur les échelles SAS, BARS et AIMS (-0.10, 0.02 et ‑0.08), les écarts moyens entre la valeur de départ et celle de la visite de clôture observés chez les patients sous REXULTI étaient comparables à ceux constatés avec le placebo (0.00, 0.01 et ‑0.07).
Dans l'étude 3 également, les écarts moyens entre la valeur de départ et celle de la visite de clôture étaient comparables entre les patients sous REXULTI et sous placebo sur les échelles SAS, BARS et AIMS.
Dystonie
Effet lié à la classe: pendant les premiers jours du traitement, les personnes sensibles peuvent ressentir des symptômes de dystonie, c'est-à-dire des contractions anormales et constantes de certains groupes musculaires. Les symptômes de la dystonie se manifestent notamment par des spasmes de la musculature du cou susceptibles de provoquer une sensation d'oppression au niveau de la gorge, des troubles de la déglutition, un essoufflement et/ou une protrusion de la langue. Bien que ces symptômes soient susceptibles d'apparaître à des faibles doses, ils se manifestent plus souvent et plus intensément avec les médicaments antipsychotiques de première génération qui sont plus puissants et plus forts. Un risque accru de dystonie aiguë a été observé chez les patients jeunes et de sexe masculin.
Prise de poids
Dans les études à court terme 1 et 2, 10.5% des patients présentaient un risque de prise de poids cliniquement significative (≥7% du poids corporel) sous REXULTI 2 mg/jour et 10.2% sous REXULTI 4 mg/jour, contre 4.1% sous placebo. La prise de poids moyenne lors de la dernière visite était de 1.2 kg dans les deux groupes REXULTI contre 0.2 kg dans le groupe placebo.
Dans l'étude 3, 3.1% des patients ont affiché une prise de poids ≥7% lors de la dernière visite dans le groupe REXULTI contre 1.0% dans le groupe placebo.
Dans les études ouvertes à long terme sur la schizophrénie, l'écart moyen de poids corporel entre le départ et la dernière visite était de 1.1 kg. 18% des patients ont été susceptibles d'afficher une prise de poids cliniquement significative (≥7%) et 0.4% des sujets ont interrompu le traitement en raison de la prise de poids.
Dyslipidémie
Chez les personnes sous traitement par antipsychotiques atypiques, des modifications indésirables de la lipidémie peuvent survenir.
Dans les études 1 et 2, les modifications du cholestérol total, du cholestérol LDL et du cholestérol HDL à jeun étaient comparables chez les patients sous REXULTI et sous placebo. Le tableau 1 récapitule le nombre de patients présentant des modifications des triglycérides à jeun en pourcentage.
Tableau 1: Modification des triglycérides à jeun dans les études 1 et 2
Proportion de sujets présentant des différences entre le départ et après | ||||
Placebo | 1 mg/jour | 2 mg/jour | 4 mg/jour | |
Triglycérides | ||||
Normale à élevée (<150 à ≥200 mg/dl et <500 mg/dl) | 6% (15/253)* | 10% (7/72)* | 8% (19/232)* | 10% (22/226)* |
Normale/De la limite de la normale à très élevée (<200 à ≥500 mg/dl) | 0% (0/303)* | 0% (0/94)* | 0% (0/283)* | 0.4% (1/283)* |
* Désigne n/N, où N=nombre total de patients ayant une mesure de départ et au moins une mesure après le départ; n=nombre de patients présentant un écart.
Dans l'étude 3, aucune différence cliniquement significative n'a été observée entre les groupes de traitement en termes de fréquence d'atteinte de valeurs de métabolisme potentiellement cliniquement pertinentes.
Dans les études ouvertes à long terme, l'écart moyen entre les triglycérides à jeune de départ et à la dernière visite était de ‑2.14 mg/dl (N=1123).
Hématologie et chimie clinique
Dans les études cliniques sur REXULTI, aucun écart moyen cliniquement significatif n'a été observé par rapport à la valeur de départ concernant la chimie sérique, l'hématologie, l'analyse d'urine et les autres tests de laboratoire (insuline, insuline à jeun et prolactine).
Effets indésirables après commercialisation
Les effets indésirables suivants avec le brexpiprazole ont été rapportés après la commercialisation. La fréquence de l'effet indésirable signalé est inconnue.
Affections du système nerveux
Inconnue: syndrome malin des neuroleptiques.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Traitement
Il n'existe pas d'informations concrètes sur le traitement du surdosage par REXULTI. Un lavage gastrique et un traitement émétique peuvent être utiles juste après un surdosage. Un ECG doit être effectué et, en cas d'allongement de l'intervalle QT, une surveillance du cœur doit être instaurée. Globalement, le traitement d'un surdosage doit se concentrer sur des mesures de soutien, le dégagement des voies aériennes, l'apport d'oxygène, la respiration et le traitement symptomatique. Une étroite surveillance médicale et un contrôle jusqu'à la guérison sont nécessaires.
L'administration de charbon actif et de sorbitol par voie orale (50 g/240 ml) une heure après la prise de REXULTI a abaissé la valeur Cmax du brexpiprazole d'environ 5% à 23% et l'AUC de 31% à 46%. Les informations disponibles sur le potentiel thérapeutique du charbon actif pour le traitement d'un surdosage par REXULTI ne sont toutefois pas suffisantes. Bien qu'il n'existe pas d'informations sur l'effet d'une hémodialyse, celle méthode devrait être peu utile pour le traitement d'un surdosage par REXULTI compte-tenu de la liaison élevée du brexpiprazole aux protéines plasmatiques.
Propriétés/Effets
Code ATC
N05AX16
Mécanisme d'action
REXULTI est un nouveau principe actif antipsychotique atypique, dont l'activité pharmacologique repose sur la modulation de l'activité sérotonine-dopamine. Bien que le mécanisme d'action précis du brexpiprazole dans le traitement de la schizophrénie ne soit pas totalement connu, la pharmacologie du brexpiprazole repose principalement sur l'association d'une haute affinité de liaison et d'une activité fonctionnelle sur plusieurs récepteurs monoaminergiques. Son effet modulateur sur le système sérotonine-dopamine repose sur l'association d'une activité partiellement agoniste sur les récepteurs sérotoninergiques 5-HT1A et les récepteurs dopaminergiques D2 et d'une activité antagoniste sur les récepteurs sérotoninergiques 5-HT2A, les affinités pour tous ces récepteurs étant similaires et élevées (Ki: 0,1–0,5 nM).
Le brexpiprazole affiche en outre une activité antagoniste sur les récepteurs noradrénergiques α1B/2C dans la même zone Ki sous-nanomolaire (Ki: 0,2–0,6 nM). L'activité partiellement agoniste sur le récepteur 5HT1A/D2 combinée à l'activité antagoniste sur les récepteurs 5-HT2A et α1B/2C est susceptible de contribuer à l'effet antipsychotique du brexpiprazole.
Pharmacodynamique
Le brexpiprazole a une affinité élevée (Ki < 5 nM) pour plusieurs récepteurs monoarminergiques, notamment les récepteurs sérotoninergiques 5-HT1A, 5-HT2A, 5-HT2B et 5-HT7, les récepteurs dopaminergiques D2 et D3, ainsi que les récepteurs noradrénergiques α1A, α1B, α1D et α2C. Le brexpiprazole est un agoniste partiel des récepteurs 5-HT1A, D2 et D3 et un antagoniste des récepteurs 5-HT2A, 5-HT2B, 5-HT7, α1A, α1B, α1D et α2C.
Le brexpiprazole possède une faible activité intrinsèque sur les récepteurs dopaminergiques D2. Le brexpiprazole a une affinité modérée pour les récepteurs histaminiques H1 (19 nM) et une affinité très faible pour les récepteurs muscariniques M1 (inhibition de 67% à 10 µM). Le rapport dose/efficacité et le ratio d'exposition cerveau/plasma ont été déterminés dans des études précliniques in vivo ou ex vivo sur les récepteurs D2/D3, 5-HT2A, 5-HT1A, 5-HT6 et 5-HT7 ainsi que sur le transporteur de 5-HT. Les résultats concordent avec les affinités de liaison relatives in vivo et démontrent l'activité du brexpiprazole sur plusieurs points d'ancrage du système nerveux central en cas d'exposition plasmatique significative.
Dans une étude complète sur l'intervalle QTc menée auprès de patients atteints de schizophrénie ou d'un trouble schizo-affectif, REXULTI n'a pas provoqué d'allongement de l'intervalle QTcF après 12 jours à une dose thérapeutique (4 mg/jour) ou extra-thérapeutique (12 mg/jour). Aucune corrélation n'a été observée entre les concentrations en brexpiprazole et l'allongement de l'intervalle QTcF.
Efficacité clinique
L'efficacité de REXULTI dans le traitement de patients adultes atteints de schizophrénie selon les critères DSM-IV-TR a été démontrée dans deux études randomisées en double aveugle contrôlées par placebo sur 6 semaines à dose fixe (études 1 et 2) et dans une étude à long terme sur le traitement d'entretien (étude 3).
Pour les patients concernés, une hospitalisation ou un allongement de la durée d'hospitalisation pour le traitement d'une rechute aiguë de la schizophrénie s'est avérée bénéfique. Ils ont dû au préalable recevoir un traitement ambulatoire approprié par antipsychotiques et ont bien répondu à ce traitement (sauf à la clozapine) au cours des 12 derniers mois ayant précédé le début de l'étude.
Dans les études 1 et 2, les patients ont été randomisés aux doses journalières de REXULTI 2 mg ou 4 mg ou au placebo. Les patients des groupes REXULTI ont commencé le traitement à 1 mg une fois par jour le jour 1. Le jour 5, la dose de REXULTI a été augmentée à 2 mg une fois par jour. Le jour 8, la dose a été soit maintenue à 2 mg pendant les 5 semaines restantes de l'étude, soit augmentée à 4 mg une fois par jour selon le groupe de traitement.
Les études 1 et 2 comprenaient également deux groupes de traitement recevant une dose de REXULTI plus faible de 0.25 mg/jour et 1 mg/jour. Celles-ci n'ont toutefois pas été reprises dans l'analyse principale.
Le principal critère d'évaluation de l'efficacité des deux études était la modification du score global sur l'échelle PANSS (Positive and Negative Syndrome Scale) entre le départ et la semaine 6. L'échelle PANSS comporte 30 items et mesure les symptômes positifs (7 items) et négatifs (7 items) de la schizophrénie, ainsi que la physiopathologie générale (16 items). Chaque item est évalué sur une échelle de 1 (inexistant) à 7 (extrême). Le score global sur l'échelle PANSS s'étend de 30 (meilleur résultat) à 210 (pire résultat). Le principal critère d'évaluation secondaire des études était la modification de la valeur entre le départ et la semaine 6 sur l'échelle CGI-S (Clinical Global Impression – Severity of Illness Scale). CGI-S est une échelle validée, évaluée par le médecin, qui détermine l'état clinique actuel du patient en termes de gravité des symptômes. Les autres critères d'évaluation secondaires étaient entre autres l'échelle PSP (Personal and Social Performance Scale) validée et évaluée par le médecin, qui mesure les compétences personnelle et sociale.
Dans l'étude 1, REXULTI a été étudié aux deux posologies (2 mg/jour et 4 mg/jour) par rapport au placebo à l'aide du score global sur l'échelle PANSS (tableau 2). Dans l'étude 2, REXULTI a été étudié à la posologie de 4 mg/jour par rapport au placebo à l'aide du score global sur l'échelle PANSS (tableau 2). Pour la posologie de 2 mg/jour, seule l'étude 1 a démontré une efficacité statistiquement significative. L'analyse des groupes de population par âge, sexe et origine ethnique n'a pas démontré de différences de sensibilité de la réponse.
Le tableau 2 récapitule les résultats concernant le critère d'évaluation principal de l'efficacité pour les études 1 et 2.
Tableau 2: Principaux résultats d'efficacité pour les études sur 6 semaines concernant la schizophrénie (études 1 et 2)
Paramètre d'efficacité principal: PANSS | ||||||
Etude | Groupe de traitement | N | Valeur de départ moyenne (SD) | Ecart moyen LS par rapport à la valeur de départ (SE) | Différence LS moyennea (IC à 95%) | Valeur P |
1 | REXULTI (2 mg/jour)* | 180 | 95,85 (13,75) | -20,73 (1,55) | -8,7 (-13,1; ‑4,4) | <0,0001 |
REXULTI (4 mg/jour)* | 178 | 94,70 (1,06) | -19,65 (1,54) | -7,6 (-12,0; ‑3,1) | -0,0006 | |
Placebo | 178 | 95,69 (11,46) | -12,01 (1,60) | -- | - | |
2 | REXULTI (2 mg/jour) | 179 | 96,30 (12,91) | -16,61 (1,49) | -3,1 (-7,2; 1,1) | 0,1448 |
REXULTI (4 mg/jour)* | 181 | 94,99 (12,38) | -20,00 (1,48) | -6,5 (-10,6; ‑2,4) | -0,0022 | |
Placebo | 180 | 94,63 (12,84) | -13,53 (1,52) | -- | - | |
SD: écart type; SE: erreur standard; LS: moindres carrés; IC: intervalle de confiance non ajusté.
* Supériorité statistiquement significative de REXULTI par rapport au placebo
a Différence (REXULTI moins placebo) de modification moyenne des moindres carrés entre la valeur de départ et à la semaine 6
REXULTI a été supérieur au placebo aux posologies de 2 mg/jour et 4 mg/jour concernant les critères d'évaluation secondaires (score CGI-S et score global sur l'échelle PSP). Les résultats des critères d'évaluation secondaires (scores CGI-S et PSP) confirment donc la supériorité de REXULTI par rapport au placebo et son effet cliniquement significatif.
Une analyse intermédiaire établie précédemment a démontré que la durée avant rechute imminente était statistiquement significativement plus longue chez les patients randomisés dans le groupe REXULTI (1-4 mg/jour) que chez patients randomisés dans le groupe placebo (p = 0,0008, test Log-Rank). L'analyse finale a confirmé la durée statistiquement significativement plus longue avant rechute imminente pour les patients du groupe REXULTI par rapport au groupe placebo (p = 0,0001, Log-Rank Test). Les courbes de Kaplan-Meier du nombre cumulé de patients du dernier groupe d'analyse, ayant subi une rechute durant la phase de traitement en double aveugle dans les groupes REXULTI et placebo sont représentés dans l'illustration 1. Lors de l'analyse finale, le rapport de risque déduit du modèle de risque proportionnel de Cox était de 3,42 pour la comparaison entre le placebo et REXULTI (IC à 95%: 1,82; 6,41, taux de rechute 13,54% contre 38,46%). Les patients du groupe placebo présentaient donc un risque 3.42 fois plus élevé de rechute imminente que ceux du groupe REXULTI.
Illustration 1: Courbes de Kaplan-Meier concernant le temps avant rechute imminente (phase d'entretien en double aveugle - échantillon aléatoire d'efficacité) – analyse finale, étude 3

Données à long terme
L'étude à long terme (étude 3) était une étude randomisée en double aveugle contrôlée par placebo de mesure de l'efficacité, la sécurité et la tolérabilité de REXULTI 1-4 mg/jour comme traitement d'entretien chez l'adulte atteint de schizophrénie. Dans cette étude, la posologie du brexpiprazole a pu être ajustée à la discrétion de l'investigateur. La dose modale la plus fréquente pour les patients stabilisés randomisés dans le groupe du brexpiprazole était de 4 mg/jour (64 patients, 66%), suivie de 3 mg/jour (25 patients, 25,8%), 2 mg/jour (7 patients, 7,2%) et 1 patient (1%) a reçu une dose modale de 1 mg/jour.
Pharmacocinétique
Absorption
Suite à l'administration de doses uniques de REXULTI en comprimés, le brexpiprazole est bien absorbé, les concentrations plasmatiques maximales étant atteintes sous 4,0 à 8 heures. La biodisponibilité orale absolue de la formulation en comprimés est de 95.1%. La concentration de brexpiprazole à l'état d'équilibre est atteinte 10 à 12 jours après l'administration et est environ 4 fois supérieure à celle de la première dose. REXULTI peut se prendre pendant ou en-dehors des repas. La prise d'un comprimé de REXULTI 4 mg pendant un repas ordinaire riche en lipides n'a pas eu d'effet significatif sur la valeur Cmax ni sur l'AUC du brexpiprazole. Après l'administration de doses uniques ou multiples atteignant 8 mg une fois par jour, l'exposition au brexpiprazole (Cmax et AUC) a augmenté proportionnellement à la dose administrée. Les études in vitro n'ont pas démontré que le brexpiprazole était un substrat pour les transporteurs d'efflux comme MDR1 (P-gp) et BCRP.
Distribution
Le volume de distribution du brexpiprazole après administration par voie intraveineuse est élevé (1,56 ± 0,418 l/kg), ce qui suggère une distribution extravasculaire. Dans le plasma, le brexpiprazole affiche une forte liaison protéique à la sérum-albumine (supérieure à 99%) et à l'α1 glycoprotéine acide. Sa liaison protéique n'est pas influencée par l'insuffisance rénale ou hépatique. Les résultats des études in vitro ne démontrent aucune influence de la warfarine, du diazépam ou de la digoxine sur la liaison protéique du brexpiprazole.
Métabolisme
Les études in vitro du métabolisme du brexpiprazole utilisant le cytochrome recombinant humain P450 (CYP1A1, 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 et 3A4) démontrent que le brexpiprazole est principalement métabolisé par le CYP3A4 et le CYP2D6.
In vivo, le brexpiprazole est principalement métabolisé par les enzymes CYP3A4 et CYP2D6. Après une ou plusieurs utilisations, le brexpiprazole et un métabolite principal, DM-3411, sont les principaux constituants du médicament présents dans le circuit systémique. A l'état stable, DM-3411 représente entre 23,1 et 47,7% de l'exposition plasmatique (AUC) au brexpiprazole (AUC). Toutefois, des études précliniques in vivo démontrent qu'en cas d'expositions plasmatiques cliniquement significatives du brexpiprazole, l'exposition du DM-3411 dans le cerveau est inférieure à la limite de détection. DM-3411 ne contribue donc vraisemblablement pas à l'effet thérapeutique du brexpiprazole.
Élimination
Après une dose unique par voie orale de brexpiprazole marqué au [14C], environ 24,6% de la radioactivité administrée a été excrétée dans l'urine et 46%, dans les fèces. Moins de 1% du brexpiprazole inchangé a été excrété dans l'urine et environ 14% de la dose orale ont été excrétés sous une forme inchangée dans les fèces. La clairance orale apparente du brexpiprazole après administration d'un comprimé une fois par jour était de 19,8 (±11,4) ml/h/kg. Après l'administration répétée de REXULTI une fois par jour, la demi-vie d'élimination terminale du brexpiprazole est de 91,4 heures et de 85,7 heures pour le métabolite principal, DM-3411.
Cinétique pour certains groupes de patients
Âge/Sexe
Après administration d'une dose unique de REXULTI (2 mg), les sujets âgés (plus de 65 ans) en bonne santé ont présenté une exposition systémique au brexpiprazole similaire (Cmax et AUC) à celle des sujets adultes (18–45 ans). Les sujets de sexe féminin ont affiché une exposition systémique au brexpiprazole environ 40-50% supérieure (Cmax et AUC) à celle des sujets de sexe masculin. Lors de l'analyse de la pharmacocinétique au sein de la population, l'âge et le sexe féminin ont été définis comme des co-variables statistiquement significatives ayant un effet sur la pharmacocinétique du brexpiprazole, mais non cliniquement significatives.
Origine ethnique
Bien qu'aucune étude pharmacocinétique spéciale n'ait été menée concernant l'effet de l'origine ethnique sur la disposition du brexpiprazole, l'évaluation pharmacocinétique au sein de la population n'a pas démontré de différences cliniquement significatives liées à l'origine ethnique dans la pharmacocinétique du brexpiprazole.
Métaboliseurs lents du CYP2D6
Environ 8% des personnes caucasiennes et 3-8% des personnes de couleur/afro-américaines n'ont pas la capacité de métaboliser le substrat du CYP2D6. Elles sont classées dans la catégorie des métaboliseurs lents (PM), par opposition aux métaboliseurs rapides (EM). L'exposition au brexpiprazole est environ 1.8 fois plus élevée chez les PM du CYP2D6 que chez les EM (voir la rubrique Posologie/Mode d'emploi).
Tabagisme
Des études in vitro menées sur des enzymes hépatiques humaines démontrent que le brexpiprazole n'est pas un substrat du CYP1A2. Le tabagisme ne devrait donc pas avoir d'effet sur la pharmacocinétique du brexpiprazole.
Troubles de la fonction hépatique
Les patients atteints d'insuffisance hépatique modérée à sévère (classification de Child-Pugh ≥7) sont en général davantage exposés au brexpiprazole que les patients dont la fonction hépatique est normale. La dose maximale recommandée doit donc être réduite. Chez les sujets atteints d'insuffisance hépatique de divers grades (classes Child-Pugh A, B et C), l'AUC du brexpiprazole par voie orale (2 mg en dose unique) a augmenté d'environ 24% en cas d'insuffisance hépatique légère et de 60% en cas d'insuffisance hépatique modérée par rapport aux sujets sains, tandis qu'en cas d'insuffisance hépatique sévère, elle est restée inchangée.
Troubles de la fonction rénale
Les patients atteints d'insuffisance rénale (CLcr < 60 ml/min) ont été plus exposés au brexpiprazole que les patients dont la fonction rénale était normale. La dose maximale recommandée doit donc être réduite. Chez les sujets atteints d'insuffisance rénale sévère (CLcr < 30 ml/min), l'AUC du brexpiprazole par voie orale (2 mg en dose unique) a augmenté de 69% par rapport aux sujets sains et la valeur Cmax est restée inchangée.
Données précliniques
Sur la base des études conventionnelles de pharmacologie de sécurité, de toxicité en cas d'administration répétée, de génotoxicité, de toxicité sur le système reproducteur et au stade du développement et de potentiel carcinogène, les données précliniques n'indiquent aucun risque particulier pour l'humain.
Pharmacologie de sécurité
Chez le rat, le brexpiprazole à hautes doses (ED50 = 20 mg/kg) a induit une catalepsie (modèle animal pour le risque de syndrome extrapyramidal [SEP]). Cela démontre que le brexpiprazole présente un faible risque de déclencher un SEP dans des conditions cliniques.
Chez le chien et le singe, une baisse de la tension artérielle et un allongement des intervalles QT et QTC ont été constatés. L'effet sur la tension artérielle a été imputé à un blocage des récepteurs adrénergiques α1 dans les vaisseaux périphériques, ce qui concorde avec le profil pharmacologique du brexpiprazole. L'allongement des intervalles QT et QTc est susceptible de dépendre de la diminution de la température interne induite pharmacologiquement, mais le brexpiprazole a également inhibé le transport des ions par le canal hERG (avec une valeur IC50 de 0,117 µM).
Les principaux signes cliniques permettant de définir la dose sans effet observable (NOAEL) dans les études de toxicité en cas d'administration répétée à des rats et des singes étaient liés à la diminution induite pharmacologiquement de l'activité du système nerveux central (réduction des mouvements, tremblements, somnolence, yeux fermés, hypothermie). Certains signes cliniques, comme par exemple les convulsions cloniques, l'hyperactivité et l'agressivité, observés chez le rat ont été de courte durée seulement.
Comme les autres antipsychotiques, l'index thérapeutique, mesuré à l'aide de l'AUC chez les rats et les singes, ainsi que de l'exposition de l'humain à la dose maximale recommandée de 4 mg/jour, est relativement faible (hommes/femmes: 0,1/0,8 et 0,4/0,4 chez les rats et les singes).
Globalement, les effets observés chez les ratons et les chiots après administration de brexpiprazole ont également été constatés chez les animaux adultes; les jeunes animaux ne sont donc pas les seuls à avoir eu une réaction sensible au brexpiprazole.
Mutagénicité
Le potentiel mutagène du brexpiprazole a été analysé dans le cadre de tests in vitro de rétro-mutation sur des bactéries, de tests in vitro de mutation génétique sur les ganglions lymphatiques de la souris, de tests in vitro d'aberration chromosomique sur les cellules ovariennes du hamster de Chine (CHO), de tests micronucléiques in vivo sur le rat, ainsi que de tests de la synthèse de l'ADN imprévue sur le rat. Dans les tests in vitro sur les cellules de mammifères, le brexpiprazole était mutagène et clastogène, mais seulement aux doses induisant une cytotoxicité. Dans d'autres études, aucune mutagénicité et aucune génotoxicité n'ont été observées. Sur la base des éléments factuels, le brexpiprazole n'est pas considéré comme présentant un risque génotoxique pour l'humain.
Effet sur la prolactine sérique
Suite à l'administration chronique d'antipsychotiques à des rongeurs, des modifications prolifératives et/ou néoplasiques des glandes mammaires et de l'hypophyse vraisemblablement provoquées par la prolactine ont été observées. Le brexpiprazole a démontré un potentiel d'augmentation du taux de prolactine sérique, aussi bien chez la souris que chez le rat. La pertinence de ces données concernant les tumeurs endocrines médiées par la prolactine chez les rongeurs n'est pas connue en termes de risque chez l'humain.
Carcinogénicité
Le potentiel carcinogène tout au long de la vie du brexpiprazole a été analysé dans une étude de deux ans sur des souris ICR et des rats Sprague-Dawley. Le brexpiprazole a été administré aux souris pendant deux ans par voie orale (sonde œsophagienne) à une posologie de 0,75; 2 et 5 mg/kg/jour (AUC plasmatique 0,3-3,1 fois supérieure (mâles) et 0,2-1,1 fois supérieure (femelles) à l'exposition clinique de 4 mg par voie orale, soit la dose maximale recommandée chez l'homme [MRHD]). Chez les animaux mâles, la fréquence des tumeurs n'a augmenté dans aucun groupe de dose. Chez les souris femelles, la fréquence des adénocarcinomes mammaires, des carcinomes adénosquameux et des adénomes dans la partie distale de l'hypophyse a augmenté. Le brexpiprazole a été administré aux rats pendant deux ans par voie orale (sonde œsophagienne) à une posologie de 1, 3 et 10 mg/kg/jour pour les rats et de 3, 10 et 30 mg/kg/jour pour les rates (AUC plasmatique d'exposition jusqu'à 1,0 fois supérieure (mâles) et 4,4 fois supérieure (femelles) à l'exposition à la MRHD de 4 mg/jour). Chez le rat, le brexpiprazole n'a pas été carcinogène.
Troubles de la fertilité
Les effets du brexpiprazole sur la fertilité ont été analysés sur des rates et des rats. Le brexpiprazole a été administré aux rates avant l'accouplement et aux rats après la conception et l'implantation des ovules une fois par jour par voie orale par sonde œsophagienne à des doses de 0; 0,3; 3 ou 30 mg/kg/jour avec une exposition (AUC plasmatique) jusqu'à 4,1 fois supérieure à l'exposition clinique à la MRHD). À 3 et 30 mg/kg/jour, un allongement de l'œstrus et une diminution de la fertilité ont été observés, l'exposition (plasma) étant ≥0.2 fois supérieure à l'exposition clinique à la MRHD. À 30 mg/kg/jour (AUC d'exposition 4.1 fois supérieure à l'exposition clinique à la MHRD), un léger allongement de la phase d'accouplement, ainsi qu'une hausse significative des pertes avant implantation des ovules ont été observés. La dose sans effet observable du brexpiprazole était de 0,3 mg/kg/jour (0,7 fois la MRHD par voie orale de 4 mg pour un patient de 60 kg, calculée à l'aide d'une surface corporelle comparative).
Le brexpiprazole a été administré aux rats une fois par jour par voie orale par sonde œsophagienne à des posologies de 0, 3 et 10 ou 100 mg/kg/jour, l'exposition (AUC plasmatique) étant jusqu'à 11,6 fois supérieure à l'exposition clinique à la MRHD. Après 63 jours d'administration, les mâles traités pendant 14 jours maximum et les femelles non traitées ont été réunis. Il n'y a pas eu de différence détectable avec les groupes traités par brexpiprazole concernant la durée d'accouplement ou les indices de fertilité.
Toxicité au stade du développement et lactation
Dans les études de toxicité au stade du développement, le brexpiprazole n'a pas été tératogène et n'a pas eu d'effet indésirable sur le développement. Dans ces études, les rates et les lapines en gestation ont reçu des doses de brexpiprazole allant jusqu'à 30 mg/kg/jour pendant la phase d'organogenèse, l'exposition (AUC plasmatique) étant 4,1 et 5,9 fois supérieure à l'exposition clinique à la MRHD.
Dans les études sur le développement embryon-fœtal menées sur le lapin, il a été observé qu'à une dose orale entraînant une toxicité maternelle (150 mg/kg/jour, AUC d'exposition 16,5 fois supérieure à l'exposition clinique), les fœtus avaient un poids corporel plus faible, une formation osseuse tardive et plus souvent des anomalies des viscères et du squelette.
Lorsque le brexpiprazole a été administré à des rates en gestation de la période d'organogenèse jusqu'à la lactation, le nombre de décès périnataux des portées a augmenté à 30 mg/kg/jour (AUC plasmatique 4,1 fois supérieure à l'exposition clinique à la MRHD de 4 mg); la dose sans effet observable était de 10 mg/kg/jour (exposition 0.8 fois supérieure à l'exposition clinique).
Potentiel addictif
Le brexpiprazole n'a pas démontré de potentiel à induire une dépendance physique chez le rat, ni d'effet de renforcement chez le singe rhésus. Dans une étude sur le potentiel addictif du médicament chez le rat, aucun syndrome de manque suggérant une dépendance physique n'a été démontré. Le brexpiprazole n'a pas le potentiel d'induire une dépendance physique.
Remarques particulières
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Tenir hors de portée des enfants.
Conserver dans l'emballage d'origine.
Ne pas conserver au-dessus de 30°C.
Numéro d’autorisation
66475 (Swissmedic).
Titulaire de l’autorisation
Lundbeck (Schweiz) AG, Opfikon.
Mise à jour de l’information
Août 2020.
30102020FI
Відгуки (0)

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.




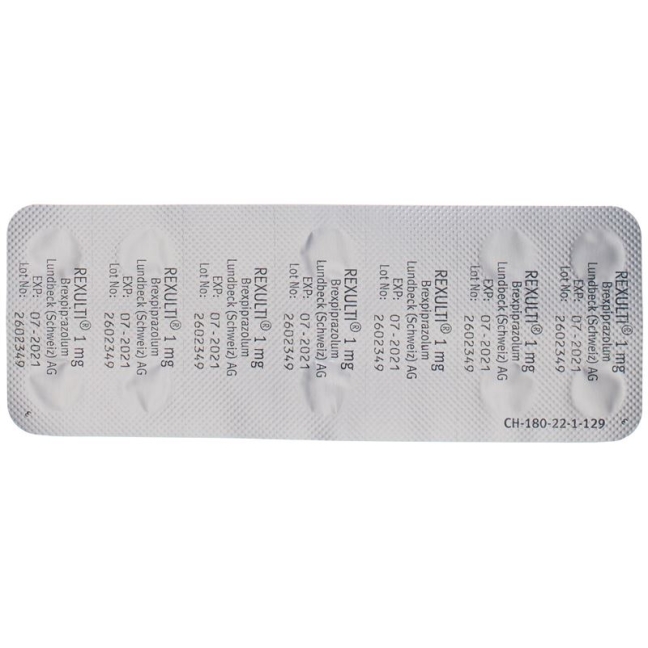


 Deutsch
Deutsch French
French Italian
Italian