Ezetimibe Simva Spirig HC таблетки 10/20 мг 100 шт
Ezetimib Simva Spirig HC Tabl 10/20 mg 100 Stk
-
16827.51 RUB
Дата доставки:
25.12.2025 - 08.01.2026
При оплате криптовалютой:
Ваша прибыль 1682.75 RUB / 19.86 USDT
- Наявність: В наявності
- Виробник: Spirig Healthcare AG
- Модель: 7749430
- ATC-код C10BA02
- EAN 7680662330122
Варіанти
Опис
Was ist Ezetimib Simva Spirig HC und wann wird es angewendet?
Ezetimib Simva Spirig HC enthält die beiden Wirkstoffe Simvastatin und Ezetimib. Es senkt erhöhtes Gesamtcholesterin, LDL-Cholesterin (schlechtes Cholesterin) und Triglyceride (fettartige Substanzen) und erhöht HDL-Cholesterin (gutes Cholesterin) im Blut. Es ist für Patienten geeignet, deren Cholesterinwerte zu hoch sind und bei denen eine Diät allein diese Werte nicht genügend senken konnte.
In Ezetimib Simva Spirig HC ergänzen sich die Wirkmechanismen der beiden Wirkstoffe in ihrer cholesterinsenkenden Wirkung. Ezetimib Simva Spirig HC vermindert die Aufnahme von Cholesterin aus dem Dünndarm und hemmt die körpereigene Cholesterinproduktion in der Leber.
Ihr Arzt oder Ihre Ärztin hat Ihnen Ezetimib Simva Spirig HC zur Senkung erhöhter Cholesterinwerte und Triglyceridwerte im Blut verschrieben. Cholesterin ist eine von mehreren Fettsubstanzen, welche im Blutkreislauf vorkommen. Ihr Gesamtcholesterin besteht hauptsächlich aus LDL- und HDL-Cholesterin.
Ezetimib Simva Spirig HC soll nur auf Verschreibung des Arztes oder der Ärztin angewendet werden.
Was sollte dazu beachtet werden?
Vor der Behandlung mit Ezetimib Simva Spirig HC soll eine cholesterinsenkende Diät durchgeführt und das vorhandene Übergewicht abgebaut werden. Die fett- und cholesterinarme Diät ist auch während der Behandlung mit Ezetimib Simva Spirig HC weiterzuführen.
Wann darf Ezetimib Simva Spirig HC nicht eingenommen werden?
Nehmen Sie Ezetimib Simva Spirig HC nicht ein, wenn Sie auf Ezetimib, Simvastatin oder irgendeinen der Inhaltsstoffe überempfindlich (allergisch) reagieren. Patienten und Patientinnen, die an einer Lebererkrankung leiden oder bei denen aus nicht bekannten Gründen die Blutwerte der Leberenzyme erhöht sind, dürfen Ezetimib Simva Spirig HC nicht anwenden.
Ferner darf Ezetimib Simva Spirig HC während der Schwangerschaft oder Stillzeit nicht eingenommen werden. Ezetimib Simva Spirig HC darf bei Kindern und Jugendlichen unter 18 Jahren nicht angewendet werden, da in dieser Altersgruppe noch keine Erfahrungen mit dem Arzneimittel vorliegen.
Ezetimib Simva Spirig HC darf nicht eingenommen werden, wenn Sie eines oder mehrere der nachfolgenden Arzneimittel einnehmen: Arzneimittel gegen Pilze, z.B. Itraconazol (Sporanox®), Ketoconazol (Nizoral®), Posaconazol (Noxafil®) oder Voriconazol (Vfend®), HIV-Proteasehemmer, z.B. Indinavir (Crixivan®), Nelfinavir (Viracept®), Ritonavir (Norvir®), Saquinavir (Invirase®, Fortovase®), Arzneimittel zur Behandlung von Hepatitis-C-Virusinfektionen, z.B. Boceprevir (Victrelis®) oder Telaprevir (Incivo®), Antibiotika, z.B. Erythromycin (Erythrocin®), Clarithromycin (Klacid®), Telithromycin, systemische Fusidinsäure (Fucidin® Filmtabletten) und bestimmte Antidepressiva, z.B. Nefazodon (Nefadar®), Arzneimittel, die Cobicistat enthalten (Stribild®), Gemfibrozil (Gevilon®) eine cholesterinsenkende Fibrinsäure, Cyclosporin (Sandimmun®) und Danazol (Danatrol®).
Fragen Sie Ihren Arzt oder Ihre Ärztin wenn Sie nicht sicher sind, ob Ihr Arzneimittel, das Sie einnehmen, oben aufgelistet ist.
Wann ist bei der Einnahme von Ezetimib Simva Spirig HC Vorsicht geboten?
Informieren Sie Ihren Arzt oder Ihre Ärztin über alle medizinischen Probleme, die Sie haben oder früher gehabt haben, insbesondere über Leberprobleme und –krankheiten oder Allergien.
Bei der Einnahme von Ezetimib Simva Spirig HC sind selten erhöhte Werte bestimmter Lebertests (ohne Krankheitszeichen) aufgetreten. Ihr Arzt bzw. Ihre Ärztin wird deshalb diese Laborwerte periodisch kontrollieren. Bei Patienten und Patientinnen, die übermässig Alkohol konsumieren oder Lebererkrankungen in der Vorgeschichte aufweisen, wird der Arzt oder die Ärztin dieses Arzneimittel nur mit besonderen Vorsichtsmassnahmen verordnen. Informieren Sie deshalb Ihren Arzt bzw. Ihre Ärztin wenn Sie grössere Mengen Alkohol konsumieren oder früher eine Lebererkrankung gehabt haben.
Ihr Arzt bzw. Ihre Ärztin wird Sie während der Einnahme dieses Arzneimittels engmaschig auf Diabetes, respektive auf das Risiko zur Entwicklung von Diabetes untersuchen. Wenn Sie hohe Zucker- und Fettwerte im Blut haben, übergewichtig sind und einen hohen Blutdruck haben, besteht bei Ihnen wahrscheinlich ein Risiko zur Entwicklung von Diabetes.
Konsultieren Sie Ihren Arzt bzw. Ihre Ärztin sofort, wenn Sie unerklärliche Muskelschmerzen, -empfindlichkeit oder –schwäche verspüren. In seltenen Fällen können Muskelprobleme schwerwiegend sein, einschliesslich Muskelabbau, der Nierenschäden und im Weiteren den Tod zur Folge haben kann. Das Risiko eines Muskelabbaus ist grösser bei Patienten und Patientinnen, die höhere Ezetimib Simva Spirig HC-Dosierungen einnehmen, besonders bei einer Dosierung von 10/80 mg, bei älteren Patienten und Patientinnen (65 Jahre und älter), beim weiblichen Geschlecht und im Falle von vorbestehenden Nierenschäden oder Schilddrüsenproblemen.
Da sich das Risiko von Muskelproblemen erhöhen kann, wenn Sie gleichzeitig mit Ezetimib Simva Spirig HC eines der folgenden Arzneimittel oder Substanzen einnehmen (siehe Welche Nebenwirkungen kann Ezetimib Simva Spirig HC haben?), ist es besonders wichtig, dass Sie Ihren Arzt bzw. Ihre Ärztin informieren, wenn Sie eines der folgenden Arzneimittel oder Substanzen einnehmen: das Immunsupressivum Cyclosporin (Sandimmun Neoral®); Danazol (Danatrol®); Mittel gegen Pilzinfektionen, wie Itraconazol (Sporanox®) oder Ketoconazol (Nizoral®), Posaconazol (Noxafil®) oder Voriconazol (Vfend®); Fibrate wie z.B. Gemfibrozil (Gevilon®), Ciprofibrat (Hyperlipen®), Bezafibrat (Cedur®) oder Fenofibrat (Lipanthyl®); die Antibiotika Erythromycin (Erythrocin®), Clarithromycin (Klacid®), Telithromycin und Fusidinsäure (Fucidin®); HIV-Proteasehemmer wie z.B. Indinavir (Crixivan®), Nelfinavir (Viracept®), Ritonavir (Norvir®) und Saquinavir (Invirase®, Fortovase®); antivirale Arzneimittel gegen Hepatitis C wie z.B. Boceprevir (Victrelis®), Telaprevir (Incivo®), Elbasvir oder Grazoprevir (die Wirkstoffe von Zepatier®); das Antidepressivum Nefazodon (Nefadar®); Arzneimittel, die Cobicistat enthalten (Stribild®); Amiodaron (Cordarone®), ein Arzneimittel zur Behandlung des unregelmässigen Herzschlags; Arzneimittel zur Behandlung von Bluthochdruck oder Herzengegefühl oder anderen Herzerkrankungen wie z.B. Verapamil (Isoptin®), Diltiazem (Dilzem®) oder Amlodipin (Norvasc®); Lomitapid (ein Arzneimittel zur Behandlung einer schwerwiegenden und seltenen genetischen Cholesterinerkrankung); Daptomycin (ein Arzneimittel zur Behandlung komplizierter Haut- und Hautstrukturinfektionen und Bakteriämie); Grapefruitsaft (sollte während der Einnahme von Ezetimib Simva Spirig HC vermieden werden).
Es ist wichtig, dass Sie Ihren Arzt bzw. Ihre Ärztin informieren, wenn Sie Blutverdünnungsmittel wie Phenprocoumon (Marcoumar®) oder Acenocoumarol (Sintrom®) einnehmen, sowie Colchicin (Arzneimittel gegen Gicht), Niacin oder Digoxin.
Einige dieser Arzneimittel sind bereits oben im Kapitel Wann darf Ezetimib Simva Spirig HC nicht eingenommen werden? erwähnt.
Aufgrund der möglichen unerwünschten Wirkungen kann dieses Arzneimittel die Reaktionsfähigkeit, die Fahrtüchtigkeit und die Fähigkeit, Werkzeuge oder Maschinen zu bedienen, beeinträchtigen.
Informieren Sie Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbst gekaufte!) einnehmen oder äusserlich anwenden, oder asiatischer Abstammung sind!
Informieren Sie auch Ihren Arzt bzw. Ihre Ärztin, der/die Ihnen ein neues Arzneimittel verschreibt, dass Sie Ezetimib Simva Spirig HC einnehmen.
Darf Ezetimib Simva Spirig HC während einer Schwangerschaft oder in der Stillzeit eingenommen werden?
Ezetimib Simva Spirig HC darf während einer Schwangerschaft oder in der Stillzeit nicht eingenommen werden. Nehmen Sie Ezetimib Simva Spirig HC auch nicht ein, wenn Sie eine Schwangerschaft planen oder vermuten, dass Sie schwanger sein könnten. Wenn Sie während der Behandlung mit Ezetimib Simva Spirig HC schwanger werden, beenden Sie die Behandlung und setzen Sie sich sofort mit Ihrem Arzt bzw. Ihrer Ärztin in Verbindung.
Wie verwenden Sie Ezetimib Simva Spirig HC?
Vor Beginn der Behandlung mit Ezetimib Simva Spirig HC sollte eine geeignete cholesterinsenkende Diät begonnen werden, die auch während der Behandlung fortgesetzt werden sollte.
- Die übliche Dosis zu Therapiebeginn beträgt 1 Tablette Ezetimib Simva Spirig HC 10/10 einmal täglich am Abend. Je nach Situation und Ansprechen wird der Arzt oder die Ärztin die Dosis langsam auf 1 Tablette Ezetimib Simva Spirig HC 10/20, Ezetimib Simva Spirig HC 10/40 oder Ezetimib Simva Spirig HC 10/80 erhöhen.
- Wegen des erhöhten Risikos von Muskelproblemen, ist die 10/80 mg Dosis von Ezetimib Simva Spirig HC nur für Patienten und Patientinnen, welche chronisch die 10/80 mg Dosis ohne schwerwiegende Muskelprobleme eingenommen haben. Nebenwirkungen treten bei einer Dosierung von 10/80 mg häufiger auf.
- Ezetimib Simva Spirig HC kann unabhängig von den Mahlzeiten eingenommen werden.
- Wenn Ihnen Ihr Arzt oder Ihre Ärztin Ezetimib Simva Spirig HC zusammen mit einem Anionenaustauscher wie z.B. Colestyramin (Quantalan®) oder Colestipol (Colestid®) verordnet hat, nehmen Sie Ezetimib Simva Spirig HC mindestens 2 Stunden vor oder mindestens 4 Stunden nach der Einnahme des Anionentauschers ein.
- Ezetimib Simva Spirig HC sollte wie von Ihrem Arzt bzw. Ihrer Ärztin verschrieben eingenommen werden. Fahren Sie mit der Einnahme der anderen cholesterinsenkenden Arzneimittel fort, bis Ihr Arzt oder Ihre Ärztin Ihnen mitteilt, diese abzusetzen.
Es ist wichtig, dass Sie Ezetimib Simva Spirig HC täglich, genau wie von Ihrem Arzt oder Ihrer Ärztin verschrieben, einnehmen.
Selbst wenn Sie Arzneimittel zur Senkung der Cholesterinwerte einnehmen, ist es wichtig, Ihre Cholesterinwerte regelmässig bestimmen zu lassen. Sie sollten Ihre Cholesterinwerte und auch die Zielwerte kennen, die Sie erreichen und beibehalten wollen.
Was ist zu tun, wenn Sie zu viele Tabletten eingenommen haben?
Wenn Sie mehr Ezetimib Simva Spirig HC Tabletten eingenommen haben als verordnet, wenden Sie sich bitte an Ihren Arzt oder Apotheker bzw. an Ihre Ärztin oder Apothekerin.
Was ist zu tun, wenn Sie eine Dosis vergessen haben?
Versuchen Sie, Ezetimib Simva Spirig HC wie verordnet einzunehmen. Sollten Sie jedoch einmal die Einnahme vergessen, so holen Sie die Einnahme nicht mit einer Extradosis nach, sondern fahren Sie am folgenden Tag wie gewohnt mit der Einnahme fort.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Welche Nebenwirkungen kann Ezetimib Simva Spirig HC haben?
Die folgenden unerwünschten Wirkungen wurden bei der Einnahme von Ezetimib Simva Spirig HC häufig gemeldet: Muskelschmerzen (siehe Wann ist bei der Einnahme von Ezetimib Simva Spirig HC Vorsicht geboten?).
Gelegentlich (betrifft 1 bis 10 von 1000 Anwendern)
Die folgenden unerwünschten Wirkungen wurden gelegentlich gemeldet: Gewichtsabnahme, Schwindel, Kopfschmerzen, Kribbeln, Bauchschmerzen, Verdauungsstörungen, Blähungen, Übelkeit, Erbrechen, geblähter Bauch, Durchfall, Mundtrockenheit, Sodbrennen, Ausschlag, Juckreiz, Nesselsucht, Gelenkschmerzen, Muskelschmerzen, Empfindlichkeit und Schwäche der Muskulatur, Muskelverkrampfungen, Nackenschmerzen, Schmerzen in den Armen und Beinen, Rückenschmerzen, ungewöhnliche Müdigkeit oder Schwäche, Kraftlosigkeit, Brustschmerzen, Schwellungen, besonders der Hände, Füsse und Gesicht, Schlafstörungen, Schlaflosigkeit.
Selten (betrifft 1 bis 10 von 10'000 Anwendern)
Die folgenden unerwünschten Wirkungen wurden selten gemeldet:
Entzündung des Nasen-Rachen-Raumes, Überempfindlichkeit, Appetitlosigkeit, verminderter Appetit, Angst, Depression, verminderte Libido, Energielosigkeit, anfallsweises Erröten mit Hitzegefühl, erhöhter Blutdruck, Atembeschwerden einschliesslich hartnäckigem Husten und/oder Atemnot oder Fieber, Nasenbluten, Magenschleimhautentzündung, Akne, Haarverlust im Bereich der Kopfhaut, übermässiges Schwitzen, Schuppenflechte, Flankenschmerz, Gelenkschwellung, Muskelschmerzen, Empfindlichkeit und Schwäche der Muskulatur, häufiger Harndrang, Erektionsstörung, Durst.
Zusätzlich wurde über die folgenden unerwünschten Wirkungen bei der Anwendung von Ezetimib (Ezetrol® Tabletten) oder Simvastatin (Zocor® Filmtabletten) berichtet (Präparate, die einen der Wirkstoffe von Ezetimib Simva Spirig HC enthalten): Leberprobleme (manchmal schwerwiegend), Verstopfung, saures Aufstossen, allergische Reaktionen, einschliesslich Schwellung des Gesichts, Lippen, Zunge und/oder Rachens, die Atem- oder Schluckbeschwerden verursachen können (die eine sofortige Behandlung erfordern), Hautausschlag und Nesselausschlag, Hautausschlag mit roten Erhebungen, manchmal scheibenförmig mit zentral gelegenen Läsionen, Muskelschmerzen, Muskelempfindlichkeit oder -schwäche (die in sehr seltenen Fällen auch nach Absetzen von Ezetimib Simva Spirig HC nicht verschwinden), Entzündung der Bauchspeicheldrüse, Gallensteine, Gallenblasenentzündung, Gedächtnisprobleme, Gedächtnisverlust, Verwirrtheit. Es wurde über einzelne Beschwerden der Achillessehne, selten verbunden mit Achillessehnenriss, berichtet.
Diabetes kann auftreten – dies ist wahrscheinlicher, wenn Sie hohe Zucker- und Fettwerte im Blut haben, übergewichtig sind und einen hohen Blutdruck haben. Ihr Arzt bzw. Ihre Ärztin wird Sie während der Einnahme dieses Arzneimittels diesbezüglich überwachen.
Wenn Ihnen Ezetimib Simva Spirig HC verschrieben wurde, möchte Ihr Arzt oder Ihre Ärztin allenfalls Bluttests zur Überprüfung Ihrer Leber durchführen bevor Sie Ezetimib Simva Spirig HC zum ersten Mal einnehmen und falls während der Behandlung mit Ezetimib Simva Spirig HC Symptome von Leberproblemen auftreten. Kontaktieren Sie Ihren Arzt oder Ihre Ärztin sofort, falls bei Ihnen die folgenden Symptome von Leberproblemen auftreten: Müdigkeit oder Schwäche, Appetitlosigkeit, Schmerzen im Oberbauch, Dunkler Urin, Gelbfärbung der Haut oder des Augenweiss
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, falls Sie irgendeines dieser Symptome oder andere Beschwerden im Zusammenhang mit der Einnahme von Ezetimib Simva Spirig HC bemerken.
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin. Dies gilt insbesondere auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Was ist ferner zu beachten?
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Lagerungshinweis
Bewahren Sie Ezetimib Simva Spirig HC in der Originalverpackung bei einer Temperatur nicht über 25ºC auf.
Bewahren Sie Ezetimib Simva Spirig HC wie alle Arzneimittel ausserhalb der Reichweite von Kindern auf.
Weitere Auskünfte erteilt Ihnen Ihr Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Ezetimib Simva Spirig HC enthalten?
Wirkstoffe
Jede Tablette Ezetimib Simva Spirig HC enthält 10 mg Ezetimib sowie jeweils 10 mg (Ezetimib Simva Spirig HC 10/10, einseitige Prägung «511»), 20 mg (Ezetimib Simva Spirig HC 10/20, einseitige Prägung «512»), 40 mg (Ezetimib Simva Spirig HC 10/40, einseitige Prägung «513») oder 80 mg (Ezetimib Simva Spirig HC 10/80 einseitige Prägung «515») Simvastatin als aktive Inhaltsstoffe.
Hilfsstoffe
Ascorbinsäure, Citronensäure, Croscarmellose-Natrium, Hypromellose, Lactose-Monohydrat, Magnesiumstearat, mikrokristalline Cellulose, Antioxidanzien Propylgallat (E310) und Butylhydroxyanisol (E320) und Eisenoxid (E172).
Zulassungsnummer
66233 (Swissmedic).
Wo erhalten Sie Ezetimib Simva Spirig HC? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Ezetimib Simva Spirig HC 10/10: Blisterpackungen zu 30 und 100 Tabletten.
Ezetimib Simva Spirig HC 10/20: Blisterpackungen zu 30 und 100 Tabletten.
Ezetimib Simva Spirig HC 10/40: Blisterpackungen zu 30 und 100 Tabletten.
Ezetimib Simva Spirig HC 10/80: Blisterpackungen zu 30 und 100 Tabletten.
Zulassungsinhaberin
Spirig HealthCare AG, Egerkingen.
Diese Packungsbeilage wurde im April 2019 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Qu’est-ce que Ezétimibe Simva Spirig HC et quand doit-il être utilisé?
Ezétimibe Simva Spirig HC contient deux principes actifs, la simvastatine et l'ézétimibe. Il provoque une baisse du cholestérol total trop élevé, du cholestérol LDL (mauvais cholestérol) et des triglycérides (substances apparentées aux lipides) et il élève le cholestérol HDL (bon cholestérol) dans le sang. Il est destiné aux patients dont les taux de cholestérol sont trop élevés et chez lesquels un régime seul ne provoque pas de réduction suffisante de ces valeurs.
Ezétimibe Simva Spirig HC associe les mécanismes d'action complémentaires des deux principes actifs entraînant une baisse du cholestérol. Ezétimibe Simva Spirig HC diminue l'absorption de cholestérol à partir de l'intestin grêle et inhibe la production endogène de cholestérol par le foie.
Votre médecin vous a prescrit Ezétimibe Simva Spirig HC afin de diminuer vos taux sanguins trop élevés de cholestérol et de triglycérides. Le cholestérol est l'un des nombreux lipides que l'on trouve dans la circulation sanguine. Votre cholestérol total est constitué principalement de cholestérol LDL et de cholestérol HDL.
Ezétimibe Simva Spirig HC ne doit être utilisé que sur prescription médicale.
De quoi faut-il tenir compte en dehors du traitement?
Avant d'instaurer le traitement par Ezétimibe Simva Spirig HC, il faut suivre un régime hypocholestérolémiant et diminuer l'excès pondéral. Le régime pauvre en graisses et en cholestérol doit également être poursuivi durant le traitement par Ezétimibe Simva Spirig HC.
Quand Ezétimibe Simva Spirig HC ne doit-il pas être pris?
Ne prenez pas Ezétimibe Simva Spirig HC si vous présentez une hypersensibilité (allergie) à l'ézétimibe, à la simvastatine ou à l'un des composants du médicament. Les patients souffrant d'une maladie du foie ou ceux qui, pour des raisons inconnues, présentent des taux sanguins trop élevés d'enzymes hépatiques, ne doivent pas utiliser Ezétimibe Simva Spirig HC.
En outre, Ezétimibe Simva Spirig HC ne doit pas être pris durant la grossesse ou en période d'allaitement. Il ne faut pas administrer Ezétimibe Simva Spirig HC aux enfants et aux adolescents de moins de 18 ans, étant donné que l'on ne dispose pas encore d'expériences pour cette classe d'âge.
Ezétimibe Simva Spirig HC ne doit pas être pris si vous utilisez un ou plusieurs des médicaments suivants: contre les mycoses, p.ex. itraconazole (Sporanox®), kétoconazole (Nizoral®), posaconazole (Noxafil®) ou voriconazole (Vfend®); inhibiteurs de la protéase du VIH, p.ex. indinavir (Crixivan®), nelfinavir (Viracept®), ritonavir (Norvir®), saquinavir (Invirase®, Fortovase®); médicaments pour le traitement des infections par le virus de l'hépatite C, p.ex. bocéprévir (Victrelis®) ou télaprévir (Incivo®); antibiotiques, p.ex. érythromycine (Erythrocin®), clarithromycine (Klacid®), télithromycine; acide fusidique systémique (Fucidin® comprimés pelliculés); certains antidépresseurs, p.ex. néfazodone (Nefadar®); médicaments contenant du cobicistat (Stribild®); gemfibrozil (Gevilon®), un fibrate hypocholestérolémiant; ciclosporine (Sandimmun®); danazol (Danatrol®).
Demandez l'avis de votre médecin si vous ne savez pas avec certitude si un médicament que vous prenez fait partie de la liste ci-dessus.
Quelles sont les précautions à observer lors de la prise de Ezétimibe Simva Spirig HC?
Veuillez informer votre médecin de tous les problèmes médicaux que vous présentez actuellement ou que vous avez présentés dans le passé, en particulier des problèmes et affections hépatiques ou des allergies.
Pendant la prise d'Ezétimibe Simva Spirig HC, des valeurs élevées sont apparues dans de rares cas pour certains tests hépatiques (sans signes pathologique). C'est pourquoi le médecin contrôlera périodiquement ces données de laboratoire au cours du traitement. Pour les patients ayant une consommation excessive d'alcool ou ceux dont les antécédents font état d'une maladie du foie, le médecin ne prescrira ce médicament qu'en observant des précautions particulières. Veuillez donc informer votre médecin si vous consommez de grandes quantités d'alcool ou si vous avez souffert d'une maladie du foie dans le passé.
Votre médecin vous surveillera étroitement au cours de votre traitement avec ce médicament afin de détecter le développement éventuel d'un diabète ou d'un risque de diabète. Si vous avez des taux sanguins accrus de glucose et de lipides et si vous présentez un excès de poids et une hypertension, vous êtes probablement à risque de développer un diabète.
Veuillez consulter immédiatement votre médecin sans attendre si vous ressentez des douleurs, une sensibilité ou une faiblesse au niveau des muscles qui sont inexpliquables. Dans de rares cas, les problèmes musculaires peuvent être graves; y compris une dégradation musculaire qui peut entraîner des dommages rénaux et en outre la mort. Le risque d'une dégradation de muscles est plus élevé chez des patient(e)s qui prennent de doses d'Ezétimibe Simva Spirig HC plus fortes, surtout avec un dosage de 10/80 mg, chez les patient(e)s âgé(e)s (65 ans ou plus), chez la femme et lors de lésions rénales préexistantes ou de problèmes de la glande thyroïde.
Etant donné que le risque de problèmes musculaires peut être plus marqué si vous prenez l'un des médicaments ou substances ci-après en même temps qu'Ezétimibe Simva Spirig HC (voir sous «Quels effets secondaires Ezétimibe Simva Spirig HC peut-il provoquer?»), il est particulièrement important que vous informiez votre médecin si vous prenez l'un des médicaments ou substances suivants: l'immunosuppresseur ciclosporine (Sandimmun Néoral®); le danazol (Danatrol®); des médicaments contre les mycoses, p.ex. l'itraconazole (Sporanox®), le kétoconazole (Nizoral®), le posaconazole (Noxafil®) ou le voriconazole (Vfend®); des fibrates, p.ex. le gemfibrozil (Gevilon®), le ciprofibrate (Hyperlipen®), le bézafibrate (Cedur®) ou le fénofibrate (Lipanthyl®); des antibiotiques comme l'érythromycine (Erythrocin®), la clarithromycine (Klacid®), la télithromycine et l'acide fusidique (Fucidin®); des inhibiteurs de la protéase du VIH, par ex. l'indinavir (Crixivan®), le nelfinavir (Viracept®), le ritonavir (Norvir®) et le saquinavir (Invirase®, Fortovase®); médicaments antivirales contre l'hépatite C, p.ex. le bocéprévir (Victrelis®), le télaprévir (Incivo®), elbasvir ou grazoprevir (les principes actifs de Zepatier®); l'antidépresseur néfazodone (Nefadar®); médicaments contenant du cobicistat (Stribild®); l'amiodarone (Cordarone®), un médicament destiné au traitement des arythmies cardiaques; des médicaments destinés au traitement de l'hypertension artérielle, de l'angine de poitrine ou d'autres affections cardiaques, par ex. le vérapamil (Isoptin®), le diltiazem (Dilzem®) ou l'amlodipine (Norvasc®); le lomitapide (un médicament utilisé pour le traitement d'une maladie génétique rare et sévère caractérisée par des taux de cholestérol anormaux); la daptomycine (un médicament utilisé pour le traitement des infections compliquées de la peau et de la structure de la peau et de la bactériémie); le jus de pamplemousse (à éviter pendant la prise d'Ezétimibe Simva Spirig HC).
Il est important que vous informiez votre médecin si vous prenez des anticoagulants (médicaments utilisés pour fluidifier le sang) comme la phenprocoumone (Marcoumar®) ou l'acénocoumarol (Sintrom®), de la colchicine (médicament pour traiter la goutte), ou si vous prenez de la niacine ou de la digoxine.
Certains de ces médicaments ont déjà été mentionnés ci-dessus dans le chapitre «Quand Ezétimibe Simva Spirig HC ne doit-il pas être pris?».
En raison des effets indésirables possibles, ce médicament peut affecter l'aptitude à la conduite et les capacités à utiliser des outils ou des machines.
Veuillez informer votre médecin ou votre pharmacien si vous souffrez d'une autre maladie, vous êtes allergique, vous prenez ou utilisez déjà d'autres médicaments (même en automédication!) en usage interne ou externe, ou vous êtes d'origine asiatique.
Veuillez aussi informer votre médecin qui vous prescrit un nouveau médicament que vous prenez Ezétimibe Simva Spirig HC.
Ezétimibe Simva Spirig HC peut-il être pris pendant la grossesse ou l’allaitement?
Ezétimibe Simva Spirig HC ne doit pas être pris pendant la grossesse ou l'allaitement. Vous ne devrez pas non plus prendre Ezétimibe Simva Spirig HC si vous prévoyez une grossesse ou si vous pensez que vous pourriez être enceinte. Si vous deviez tout de même tomber enceinte durant le traitement à Ezétimibe Simva Spirig HC, arrêtez le traitement et prenez immédiatement contact avec votre médecin.
Comment utiliser Ezétimibe Simva Spirig HC?
Avant d'instaurer le traitement à Ezétimibe Simva Spirig HC, il faut suivre un régime hypocholestérolémiant approprié, qui devra être poursuivi durant le traitement.
- La dose usuelle au début du traitement se monte à 1 comprimé d'Ezétimibe Simva Spirig HC 10/10 une fois par jour, le soir. En fonction de la situation et de la réponse au traitement, le médecin augmentera lentement la dose à 1 comprimé d'Ezétimibe Simva Spirig HC 10/20, d'Ezétimibe Simva Spirig HC 10/40 ou d'Ezétimibe Simva Spirig HC 10/80.
- En raison d'un risque accru de problèmes musculaires, la dose de 10/80 mg d'Ezétimibe Simva Spirig HC ne convient qu'aux patients ayant utilisé cette dose de façon chronique sans problèmes musculaires sérieux. Avec un dosage de 10/80 mg, les effets secondaires sont plus fréquents.
- Ezétimibe Simva Spirig HC peut être pris indépendamment des repas.
- Si votre médecin vous a prescrit de prendre en même temps qu'Ezétimibe Simva Spirig HC également un échangeur d'anions, par ex. la colestyramine (Quantalan®) ou le colestipol (Colestid®), prenez Ezétimibe Simva Spirig HC au moins 2 heures avant ou au moins 4 heures après l'échangeur d'anions.
- Ezétimibe Simva Spirig HC doit être pris conformément aux prescriptions de votre médecin. Poursuivez la prise des autres médicaments hypocholestérolémiants jusqu'à ce que votre médecin vous ordonne de les arrêter.
Il est important de prendre Ezétimibe Simva Spirig HC tous les jours, exactement comme prescrit par votre médecin.
Même si vous prenez des médicaments destinés à abaisser vos taux de cholestérol, il est important de faire contrôler régulièrement vos taux de cholestérol. Vous devriez connaître vos taux de cholestérol ainsi que les valeurs que vous souhaitez atteindre et maintenir.
Que faut-il faire si vous prenez trop de médicaments?
Si vous avez pris plus de comprimés d'Ezétimibe Simva Spirig HC que le nombre prescrit, veuillez vous adresser à votre médecin ou pharmacien.
Que faut-il faire si vous avez oublié une dose?
Essayez de prendre Ezétimibe Simva Spirig HC en vous conformant aux prescriptions. Si toutefois vous deviez oublier une prise, ne prenez pas de dose supplémentaire, mais poursuivez la prise le lendemain, comme d'habitude.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Quels effets secondaires Ezétimibe Simva Spirig HC peut-il provoquer?
Les effets indésirables ci-après ont été rapportés fréquemment lors de la prise d'Ezétimibe Simva Spirig HC: douleurs musculaires (voir sous «Quelles sont les précautions à observer lors de la prise d'Ezétimibe Simva Spirig HC?»).
Occasionnel (concerne 1 à 10 utilisateurs sur 1000)
Les effets indésirables ci-après ont été rapportés occasionnellement:Perte de poids, vertiges, maux de tête, picotements, douleurs abdominales, problèmes digestifs, ballonnements, nausées, vomissements, ventre gonflé, diarrhée, sécheresse buccale, brûlures d'estomac, éruption cutanée, démangeaisons, urticaire, douleurs articulaires, douleurs musculaires, sensibilité ou faiblesse musculaire, crispations musculaires, douleurs au niveau de la nuque, douleurs des extrémités supérieures et inférieures, douleurs dorsales, fatigue ou faiblesse inhabituelles, manque de forces, douleurs dans la poitrine, gonflements affectant en particulier les mains, les pieds et le visage, troubles du sommeil, insomnie.
Rare (concerne 1 à 10 utilisateurs sur 10 000)
Les effets indésirables ci-après ont été rapportés rarement: inflammations rhino-pharyngées, hypersensibilité, manque d'appétit, réduction de l'appétit, anxiété, dépression, libido réduite, manque d'énergie, accès de rougissement avec sensation de chaleur, tension artérielle accrue, problèmes respiratoires (y compris toux tenace et/ou détresse respiratoire ou fièvre), saignements du nez, gastrite, acné, chute des cheveux, transpiration excessive, psoriasis, douleur de flanc, articulations gonflées, douleurs musculaires, sensibilité et faiblesse de la musculature, besoin fréquent d'uriner, trouble érectile, sensation de soif.
En outre, les effets indésirables ci-après ont été constatés lors de l'emploi de comprimés d'ézétimibe (comprimés Ezetrol®) ou de simvastatine (comprimés pelliculés Zocor®) (des comprimés qui contiennent l'un des principes actifs d'Ezétimibe Simva Spirig HC): problèmes de foie (parfois sérieux), constipation, renvois acides, réactions allergiques, y compris gonflement du visage, des lèvres, de la langue et/ou du pharynx, susceptibles de provoquer des difficultés respiratoires ou des problèmes de déglutition (nécessitant un traitement immédiat); éruptions cutanées, urticaire, éruptions de plaques rouges en relief (éventuellement de forme discoïde à lésion centrale); douleurs musculaires, sensibilité ou faiblesse musculaire (qui, dans de très rares cas, ne disparaissent pas après l'arrêt d'administration d'Ezétimibe Simva Spirig HC); pancréatite, calculs biliaires, cholécystite, problèmes de mémoire, perte de mémoire, confusion. On a rapporté dans des cas isolés des problèmes concernant le tendon d'Achille, rarement associés à une rupture du tendon d'Achille.
Le développement d'un diabète est possible, surtout si vous avez des taux sanguins élevés de glucose et de lipides, si vous présentez un excès de poids et si votre tension artérielle est élevée. Votre médecin vous surveillera pour détecter les signes éventuels correspondants au cours de votre traitement avec ce médicament.
Si votre médecin vous a prescrit Ezétimibe Simva Spirig HC, il souhaitera peut-être faire des tests sanguins pour vérifier la santé de votre foie avant que vous preniez Ezétimibe Simva Spirig HC pour la première fois et dans le cas où des problèmes hépatiques surviennent pendant le traitement avec Ezétimibe Simva Spirig HC. Contactez immédiatement votre médecin si vous développez les symptômes suivants de problèmes de foie: Fatigue et faiblesse, Manque d'appétit, Douleurs dans l'abdomen supérieur, Urines foncées, Teinte jaune de la peau ou du blanc des yeux
Informez votre médecin ou votre pharmacien si vous remarquez l'un ou l'autre de ces symptômes ou si vous remarquez d'autres symptômes en rapport avec la prise d'Ezétimibe Simva Spirig HC.
À quoi faut-il encore faire attention?
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Stockage
Conservez Ezétimibe Simva Spirig HC dans l'emballage d'origine, à une température ne dépassant pas 25 °C. Comme tous les médicaments, Ezétimibe Simva Spirig HC doit être tenu hors de portée des enfants.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Ezétimibe Simva Spirig HC?
Principes actifs
Chaque comprimé d'Ezétimibe Simva Spirig HC contient 10 mg d'ézétimibe et 10 mg (Ezétimibe Simva Spirig HC 10/10, avec l'inscription «511» sur une face), 20 mg (Ezétimibe Simva Spirig HC 10/20, avec l'inscription «512» sur une face), 40 mg (Ezétimibe Simva Spirig HC 10/40, avec l'inscription «513» sur une face) ou 80 mg (Ezétimibe Simva Spirig HC 10/80, avec l'inscription «515» sur une face) de simvastatine comme principes actifs.
Excipients
Ascorbique acide, citrique acide, Croscarmellose sodique, hydroxypropylméthyl-cellulose, lactose monohydraté, magnésium stéarate de, cellulose microcristalline, antioxydants gallate de propyle (E310), butylhydroxyanisole (E320), oxyde de fer (E172) et d'autres excipients pour la fabrication des comprimés.
Numéro d’autorisation
66233 (Swissmedic).
Où obtenez-vous Ezétimibe Simva Spirig HC? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Ezétimibe Simva Spirig HC 10/10: blister de 30 et de 100 comprimés.
Ezétimibe Simva Spirig HC 10/20: blister de 30 et de 100 comprimés.
Ezétimibe Simva Spirig HC 10/40: blister de 30 et de 100 comprimés.
Ezétimibe Simva Spirig HC 10/80: blister de 30 et de 100 comprimés.
Titulaire de l’autorisation
Spirig HealthCare SA, 4622 Egerkingen.
Cette notice d'emballage a été vérifiée pour la dernière fois en avril 2019 par l'autorité de contrôle des médicaments (Swissmedic).
Che cos’è Ezetimibe Simva Spirig HC e quando si usa?
Ezetimibe Simva Spirig HC contiene i due principi attivi simvastatina ed ezetimibe. Questo medicamento abbassa i valori troppo elevati di colesterolo totale, colesterolo LDL (colesterolo cattivo) e trigliceridi (sostanze lipidiche) nel sangue e aumenta il colesterolo HDL (colesterolo buono) nel sangue. È indicato per quei pazienti che presentano valori di colesterolo troppo elevati che non hanno potuto essere ridotti a sufficienza con la sola dieta.
In Ezetimibe Simva Spirig HC i due principi attivi si completano nella loro azione ipocolesterolemizzante. Ezetimibe Simva Spirig HC impedisce l'assorbimento del colesterolo attraverso l'intestino tenue e inibisce la produzione naturale di colesterolo da parte del fegato.
Il suo medico le ha prescritto Ezetimibe Simva Spirig HC per ridurre gli alti valori di colesterolo e trigliceridi nel sangue. Il colesterolo è una delle molteplici sostanze lipidiche presenti nella circolazione sanguigna. Il colesterolo totale è composto in prevalenza da colesterolo LDL e HDL.
Ezetimibe Simva Spirig HC deve essere usato solo su prescrizione medica.
Di che cosa occorre inoltre tener conto durante il trattamento?
Prima della terapia con Ezetimibe Simva Spirig HC si deve seguire una dieta mirata per abbassare i valori di colesterolo e per ridurre il sovrappeso corporeo. La dieta povera di grassi e colesterolo deve essere proseguita anche durante il trattamento con Ezetimibe Simva Spirig HC.
Quando non si può assumere/usare Ezetimibe Simva Spirig HC?
Non assuma Ezetimibe Simva Spirig HC se presenta reazioni di ipersensibilità (allergia) all'ezetimibe, alla simvastatina oppure ad uno dei componenti. I pazienti che soffrono di una malattia epatica oppure che per motivi sconosciuti presentano alti valori di enzimi epatici nel sangue non devono utilizzare Ezetimibe Simva Spirig HC.
Inoltre, Ezetimibe Simva Spirig HC non deve essere utilizzato in gravidanza e durante l'allattamento. Ezetimibe Simva Spirig HC non deve essere usato in bambini e adolescenti di età inferiore a 18 anni, dato che non si dispone ancora di conoscenze sull'uso del medicamento in questa fascia di età.
Ezetimibe Simva Spirig HC non deve essere assunto, se prende uno o più dei seguenti medicamenti: antimicotici, per es. itraconazolo (Sporanox®), ketoconazolo (Nizoral®), posaconazolo (Noxafil®) o voriconazolo (Vfend®); inibitori della proteasi dell'HIV, per es. indinavir (Crixivan®), nelfinavir (Viracept®), ritonavir (Norvir®), saquinavir (Invirase®, Fortovase®); medicamenti per il trattamento delle infezioni da virus dell'epatite C, per es. boceprevir (Victrelis®) o telaprevir (Incivo®); antibiotici, per es. eritromicina (Erythrocin®), claritromicina (Klacid®), telitromicina; acido fusidico sistemico (Fucidin® compresse rivestite), determinati antidepressivi, per es. nefazodone (Nefadar®); medicamenti contenenti cobicistat (Stribild®), gemfibrozil (Gevilon®), un derivato dell'acido fibrico usato per la riduzione del colesterolo; ciclosporina (Sandimmun®) e danazolo (Danatrol®).
In caso di incertezza consulti il medico per accertare se il medicamento che prende è compreso nella lista riportata sopra.
Quando è richiesta prudenza nella somministrazione/nell’uso di Ezetimibe Simva Spirig HC HC?
Informi il suo medico di tutti i problemi di salute di cui soffre o di cui ha sofferto, con particolare riguardo per problemi e malattie epatiche oppure allergie.
Raramente, durante la terapia con Ezetimibe Simva Spirig HC, sono stati osservati valori elevati in alcuni test del fegato (senza segni di malattia). Perciò, il suo medico effettuerà dei controlli periodici di questi valori di laboratorio. Ai pazienti che fanno uso eccessivo di alcolici o che hanno sofferto in passato di malattie del fegato il medico prescriverà questo farmaco soltanto con misure precauzionali particolari. Informi perciò il suo medico se assume elevate quantità di alcool oppure se in precedenza ha sofferto di malattie epatiche.
Durante l'assunzione di questo medicamento il suo medico la terrà sotto stretto controllo per escludere la presenza di diabete o il rischio di insorgenza di diabete. Se presenta valori elevati di zucchero e grassi nel sangue, è sovrappeso e soffre di ipertensione, è probabile che sussista il rischio che lei possa sviluppare il diabete.
Consulti immediatamente il suo medico, se dovesse avvertire dolori muscolari, sensibilità o debolezza muscolare inspiegabile. In casi rari i problemi muscolari possono essere gravi e portare ad una degenerazione muscolare, che può causare lesioni renali e, in casi più avanzati, anche la morte. Il rischio di degenerazione muscolare è maggiore in pazienti che assumono un dosaggio elevato di Ezetimibe Simva Spirig HC, in particolare con dosi pari a 10/80 mg, in pazienti anziani (di età pari o superiore a 65 anni), nelle donne e qualora vi siano lesioni renali preesistenti o disturbi alla tiroide.
Poiché la somministrazione di Ezetimibe Simva Spirig HC in concomitanza con l'assunzione di uno dei seguenti medicamenti o sostanze può aumentare il rischio di disturbi muscolari (vedere «Quali effetti collaterali può avere Ezetimibe Simva Spirig HC?»), è molto importante informare il medico se dovesse assumere uno dei medicamenti o delle sostanze seguenti: l'immunosoppressivo ciclosporina (Sandimmun Neoral®); danazolo (Danatrol®); medicamenti antimicotici come itraconazolo (Sporanox®) o ketoconazolo (Nizoral®), posaconazolo (Noxafil®) o voriconazolo (Vfend®); fibrati come per es. gemfibrozil (Gevilon®), ciprofibrato (Hyperlipen®), bezafibrato (Cedur®) o fenofibrato (Lipanthyl®); gli antibiotici eritromicina (Erythrocin®), claritromicina (Klacid®), telitromicina e acido fusidico (Fucidin®); inibitori della proteasi dell'HIV, per es. indinavir (Crixivan®), nelfinavir (Viracept®), ritonavir (Norvir®) e saquinavir (Invirase®, Fortovase®); medicamenti antivirali per il trattamento dell'epatite C, per es. boceprevir (Victrelis®), telaprevir (Incivo®) elbasvir o grazoprevir (i principi attivi di Zepatier®); l'antidepressivo nefazodone (Nefadar®); medicamenti contenenti cobicistat (Stribild®); amiodarone (Cordarone®), un medicamento per il trattamento dell'aritmia cardiaca; medicamenti per il trattamento dell'ipertensione arteriosa, dell'angina pectoris o di altre malattie cardiache come verapamil (Isoptin®), diltiazem (Dilzem®) o amlodipina (Norvasc®); lomitapide (un medicamento per il trattamento di una rara e grave forma di malattia genetica di colesterolo); daptomicina (un medicamento per il trattamento di infezioni complicate della pelle e della struttura della pelle e della batteriemia); succo di pompelmo (il consumo è da evitare durante l'assunzione di Ezetimibe Simva Spirig HC).
È importante informare il suo medico se assume anticoagulanti (medicamenti per fluidificare il sangue) come il fenprocumone (Marcoumar®) oppure l'acenocumarolo (Sintrom®) ed anche la colchicina (un medicamento contro la gotta), la niacina o la digossina.
Alcuni di questi medicamenti sono già citati nella sezione «Quando non si può usare Ezetimibe Simva Spirig HC».
A causa dei possibili effetti collaterali questo medicamento può ridurre la capacità di reazione, la capacità di condurre un veicolo e la capacità di utilizzare attrezzi e macchine.
Informi il suo medico o il suo farmacista nel caso in cui soffre di altre malattie, soffre di allergie o assume o applica esternamente altri medicamenti (anche se acquistati di sua iniziativa!), o se è di origine asiatica.
Comunichi anche al medico che le prescrive un nuovo medicamento che sta prendendo Ezetimibe Simva Spirig HC.
Si può assumere/usare Ezetimibe Simva Spirig HC durante la gravidanza o l’allattamento?
Ezetimibe Simva Spirig HC non deve essere utilizzato durante la gravidanza o l'allattamento. Non utilizzi Ezetimibe Simva Spirig HC neanche se pianifica o sospetta una gravidanza. Se dovesse restare incinta durante il trattamento con Ezetimibe Simva Spirig HC, interrompa l'assunzione del medicamento e si metta immediatamente in contatto con il suo medico.
Come usare Ezetimibe Simva Spirig HC?
Prima di iniziare il trattamento con Ezetimibe Simva Spirig HC bisogna seguire un'adeguata dieta per ridurre i valori di colesterolo, la quale dovrà essere proseguita anche durante il trattamento.
- La dose usuale all'inizio della terapia è di 1 compressa di Ezetimibe Simva Spirig HC 10/10 alla sera. A seconda della situazione e della risposta, il medico potrà aumentare gradualmente la dose a 1 compressa di Ezetimibe Simva Spirig HC 10/20, Ezetimibe Simva Spirig HC 10/40 o Ezetimibe Simva Spirig HC 10/80.
- A causa dell'aumento del rischio di problemi muscolari, la dose di Ezetimibe Simva Spirig HC 10/80 mg è destinata esclusivamente a pazienti che hanno assunto continuativamente la dose 10/80 mg senza problemi muscolari gravi. Con il dosaggio 10/80 mg gli effetti collaterali insorgono con maggiore frequenza.
- Ezetimibe Simva Spirig HC può essere assunto indipendentemente dai pasti.
- Se il suo medico le ha prescritto Ezetimibe Simva Spirig HC in combinazione con una resina a scambio anionico come la colestiramina (Quantalan®) o il colestipolo (Colestid®), Ezetimibe Simva Spirig HC deve essere assunto almeno 2 ore prima oppure almeno 4 ore dopo la somministrazione della resina a scambio anionico.
- Assuma Ezetimibe Simva Spirig HC secondo le indicazioni del suo medico. Prosegua l'assunzione degli altri medicamenti ipocolesterolemizzanti fino a quando il suo medico non le dirà di sospenderla.
È importante che lei assuma giornalmente Ezetimibe Simva Spirig HC esattamente come le è stato prescritto dal suo medico.
Anche quando assume medicamenti per ridurre i valori del colesterolo è importante che questi vengano controllati regolarmente. Deve essere a conoscenza dei suoi attuali valori di colesterolo e anche dei valori che vuole raggiungere e mantenere.
Cosa fare se ha assunto troppe compresse?
Se dovesse aver preso più compresse di quelle prescritte, si rivolga al medico o al farmacista.
Cosa fare se ha dimenticato di assumere una dose?
Cerchi di assumere Ezetimibe Simva Spirig HC come le è stato prescritto dal medico. Se dovesse aver dimenticato una dose, non la recuperi prendendo una dose extra, bensì prosegua il giorno successivo con la normale assunzione.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte, ne parli al suo medico o al suo farmacista.
Quali effetti collaterali può avere Ezetimibe Simva Spirig HC?
I seguenti effetti collaterali sono stati spesso segnalati durante l'assunzione di Ezetimibe Simva Spirig HC: dolori muscolari (vedi «Quando è richiesta prudenza nella somministrazione di Ezetimibe Simva Spirig HC?»).
Non comune (riguarda da 1 a 10 utilizzatori su 1000)
Occasionalmente sono stati riportati gli effetti collaterali seguenti: perdita di peso corporeo, capogiro, mal di testa, formicolii, dolori addominali, disturbi della digestione, meteorismo, nausea, vomito, gonfiore addominale, diarrea, secchezza della bocca, bruciore di stomaco, eruzione cutanea, prurito, orticaria, dolori articolari, dolori muscolari, sensibilità e debolezza della muscolatura, crampi muscolari, dolori alla nuca, dolori alle braccia e alle gambe, mal di schiena, stanchezza o debolezza insolite, astenia, dolori toracici, gonfiori (soprattutto alle mani, ai piedi e al viso), disturbi del sonno, insonnia.
Raro (riguarda da 1 a 10 utilizzatori su 10'000)
In casi rari sono stati riportati gli effetti collaterali seguenti: infiammazione del cavo orofaringeo, ipersensibilità, mancanza di appetito, riduzione dell'appetito, ansia, depressione, riduzione della libido, mancanza di energia, accessi di rossore con vampate di calore, ipertensione sanguigna, disturbi della respirazione compresa tosse ostinata e/o affanno respiratorio o febbre, sangue dal naso, infiammazione della mucosa gastrica, acne, perdita dei capelli, sudorazione eccessiva, psoriasi, dolore al fianco, gonfiore delle articolazioni, dolori muscolari, sensibilità o debolezza muscolare, frequente stimolo a urinare, disturbi dell'erezione, sete.
Inoltre, sono stati riportati i seguenti effetti indesiderati durante l'assunzione di ezetimibe (Ezetrol® compresse) o simvastatina (Zocor® compresse rivestite) (preparati che contengono uno dei principi attivi di Ezetimibe Simva Spirig HC): problemi di fegato (talvolta seri), stipsi, rigurgito acido, reazioni allergiche, inclusi gonfiori al viso, alle labbra, alla lingua e/o alla faringe che possono causare difficoltà respiratorie o di deglutizione (che necessitano di un intervento immediato), eruzioni cutanee e orticaria, eruzioni cutanee con gonfiori arrossati (talvolta di forma circolare con lesioni centrali), dolori muscolari, sensibilità o debolezza muscolare (che in casi molto rari non scompaiono anche dopo la sospensione di Ezetimibe Simva Spirig HC), pancreatite, calcoli biliari, infiammazione alla cistifellea, problemi di memoria, amnesia, confusione. Sono stati osservati singoli casi di disturbi al tendine d'Achille, raramente associati alla rottura del tendine d'Achille.
Si può verificare l'insorgenza di diabete – la probabilità è maggiore se presenta livelli elevati di zucchero e grassi nel sangue, se è sovrappeso e soffre di ipertensione arteriosa. Il suo medico la terrà sotto controllo a questo riguardo durante il trattamento con questo medicamento.
Se le è stato prescritto Ezetimibe Simva Spirig HC, il suo medico potrebbe eventualmente effettuare analisi del sangue per accertare lo stato del fegato, prima che lei inizi con l'assunzione di Ezetimibe Simva Spirig HC e nel caso che insorgano sintomi di problemi epatici durante l'assunzione di Ezetimibe Simva Spirig HC. Si rivolga immediatamente al suo medico se manifesta i seguenti sintomi di problemi epatici: stanchezza o debolezza, inappetenza, dolore alla parte superiore dell'addome, urina di colore scuro, ingiallimento della pelle o del bianco degli occhi.
Informi il suo medico o il suo farmacista se osserva uno qualsiasi di questi sintomi o altri disturbi in relazione all'assunzione di Ezetimibe Simva Spirig HC.
Di che altro occorre tener conto?
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazione di stoccaggio
Conservi Ezetimibe Simva Spirig HC nell'imballaggio originale ad una temperatura inferiore a 25 °C. Conservare Ezetimibe Simva Spirig HC, come tutti i medicamenti, fuori della portata dei bambini.
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Ezetimibe Simva Spirig HC?
Principi attivi
Ogni compressa di Ezetimibe Simva Spirig HC contiene 10 mg di ezetimibe e 10 mg (Ezetimibe Simva Spirig HC 10/10, su un lato è impressa la scritta «511»), 20 mg (Ezetimibe Simva Spirig HC 10/20, su un lato è impressa la scritta «512»), 40 mg (Ezetimibe Simva Spirig HC 10/40, su un lato è impressa la scritta «513») oppure 80 mg (Ezetimibe Simva Spirig HC 10/80, su un lato è impressa la scritta «515») di simvastatina come principi attivi.
Sostanze ausiliarie
Acido ascorbico, acido citrico, croscaramelose sodica, ipromellosa, lattosio monoidrato, magnesio stearato, cellulosa microcristallina, antiossidanti gallato di propile (E310), e butilidrossianisolo (E320) e ossido di ferro (E172).
Numero dell’omologazione
66233 (Swissmedic).
Dove è ottenibile Ezetimibe Simva Spirig HC? Quali confezioni sono disponibili?
In farmacia, dietro presentazione della prescrizione medica.
Ezetimibe Simva Spirig HC 10/10: blister da 30 e 100 compresse.
Ezetimibe Simva Spirig HC 10/20: blister da 30 e 100 compresse.
Ezetimibe Simva Spirig HC 10/40: blister da 30 e 100 compresse.
Ezetimibe Simva Spirig HC 10/80: blister da 30 e 100 compresse.
Titolare dell’omologazione
Spirig HealthCare SA, 4622 Egerkingen.
Questo foglietto illustrativo è stato controllato l'ultima volta nell'aprile 2019 dall'autorità competente in materia di medicamenti (Swissmedic).
Zusammensetzung
Wirkstoffe
Ezetimibum, Simvastatinum.
Hilfsstoffe
Ascorbinsäure, Citronensäure, Croscarmellose-Natrium, Hydroxypropylmethylcellulose, Lactose-Monohydrat, Magnesium-stearat, mikrokristalline Cellulose, Antioxidantien: Propylgallat (E310), Butylhydroxyanisol (E320), Eisenoxid (E172).
Darreichungsform und Wirkstoffmenge pro Einheit
Ezetimib Simva Spirig HC 10/10: Tabletten zu 10 mg Ezetimib und 10 mg Simvastatin, mit Prägung «511» auf einer Seite.
Ezetimib Simva Spirig HC 10/20: Tabletten zu 10 mg Ezetimib und 20 mg Simvastatin, mit Prägung «512» auf einer Seite.
Ezetimib Simva Spirig HC 10/40: Tabletten zu 10 mg Ezetimib und 40 mg Simvastatin, mit Prägung «513» auf einer Seite.
Ezetimib Simva Spirig HC 10/80: Tabletten zu 10 mg Ezetimib und 80 mg Simvastatin, mit Prägung «515» auf einer Seite.
Indikationen/Anwendungsmöglichkeiten
Primäre Hypercholesterinämie
Ezetimib Simva Spirig HC senkt begleitend zu einer Diät erhöhte Werte von Gesamtcholesterin, LDL-Cholesterin, Apo-Lipoprotein B, Triglyzeriden sowie non-HDL-Cholesterin und erhöht HDL-Cholesterin bei Patienten mit primärer (heterozygoter familiärer und nicht familiärer) Hypercholesterinämie oder gemischter Hyperlipidämie.
Homozygote familiäre Hypercholesterinämie
Ezetimib Simva Spirig HC senkt erhöhte Werte von Gesamtcholesterin und LDL-Cholesterin bei Patienten mit homozygoter familiärer Hypercholesterinämie. Die Patienten können weitere begleitende Therapien (wie z.B. LDL-Apherese) erhalten.
Dosierung/Anwendung
Der Patient sollte eine geeignete lipidsenkende Diät einhalten, bevor mit der Behandlung mit Ezetimib Simva Spirig HC begonnen wird, die auch während der Therapie mit Ezetimib Simva Spirig HC fortgesetzt werden sollte.
Dosierung bei Patienten mit primärer Hypercholesterinämie
Die Dosierung sollte aufgrund der Basis-LDL-Cholesterinwerte, der empfohlenen Therapieziele und dem Ansprechen des Patienten auf die Therapie individuell bestimmt werden.
Ezetimib Simva Spirig HC sollte als Einzeldosis abends unabhängig von der Nahrungsaufnahme eingenommen werden.
Der Dosierungsbereich liegt zwischen 10/10 mg täglich bis 10/80 mg täglich. Die empfohlene Dosis bei Therapiebeginn beträgt 10/10 mg täglich. Nach Therapiebeginn oder erfolgter Titration von Ezetimib Simva Spirig HC sollen die Lipidwerte nach 2 bis 4 Wochen kontrolliert und die Dosis kann ggf. bei Neueinstellungen auf höchstens 10/40 mg pro Tag angepasst werden. Die 10/80 mg Dosierung bleibt wegen des erhöhten Risikos von Myopathien einschliesslich Rhabdomyolyse den Patienten vorbehalten, welche chronisch die Dosierung von Ezetimib Simva Spirig HC 10/80 mg ohne Zeichen von Muskeltoxizität einnehmen.
Wegen dieses Risikos sollten Patienten, bei denen eine ausreichende Senkung des LDL-Cholesterins mit 10/40 mg nicht erreicht wird, nicht auf Ezetimib Simva Spirig HC 10/80 mg, sondern auf eine alternative LDL-Cholesterin-senkende Therapie umgestellt werden, welche eine stärkere Senkung des LDL-Cholesterinwertes bewirkt. Das Myopathie-Risiko ist prinzipiell ein bekannter dosisabhängiger Klasseneffekt aller Statine (siehe «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse).
Dosierung bei Patienten mit homozygoter familiärer Hypercholesterinämie
Die empfohlene Dosis für Patienten mit homozygoter familiärer Hypercholesterinämie beträgt Ezetimib Simva Spirig HC 10/40 mg pro Tag. Ezetimib Simva Spirig HC sollte als Ergänzung zu anderen lipidsenkenden Behandlungen (z.B. LDL-Apherese) bei diesen Patienten angewendet werden oder wenn diese Behandlungen nicht verfügbar sind.
Bei Patienten, die gleichzeitig Lomitapid und Ezetimib Simva Spirig HC einnehmen, sollte die Dosis von Ezetimib Simva Spirig HC 10/40 mg pro Tag nicht überschritten werden (siehe «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse und «Interaktionen»).
Patienten mit Leberfunktionsstörungen
Für Patienten mit leichter Leberinsuffizienz (Child-Pugh-Score 5 oder 6) ist keine Dosisanpassung erforderlich. Für Patienten mit mässiger (Child-Pugh-Score 7-9) oder schwerer (Child-Pugh-Score >9) Leberinsuffizienz ist die Behandlung mit Ezetimib Simva Spirig HC nicht angezeigt (siehe «Kontraindikationen», «Warnhinweise und Vorsichtsmassnahmen» und «Pharmakokinetik», Kinetik spezieller Patientengruppen).
Patienten mit Nierenfunktionsstörungen
Für Patienten mit mässigen Nierenfunktionsstörungen ist keine Dosisanpassung erforderlich. Falls eine Behandlung von Patienten mit schweren Nierenfunktionsstörungen (Kreatinin-Clearance ≤30 ml/min) als notwendig erachtet wird, sollten Dosierungen über 10/10 mg pro Tag mit Vorsicht verordnet werden (siehe «Pharmakokinetik», Kinetik spezieller Patientengruppen).
Ältere Patienten
Da fortgeschrittenes Alter (≥65 Jahre) ein prädisponierender Faktor für Myopathie darstellt, sollte Ezetimib Simva Spirig HC bei älteren Patienten mit Vorsicht angewendet werden. In einer klinischen Studie, bei welcher Patienten mit 80 mg Simvastatin pro Tag behandelt wurden, wiesen Patienten im Alter von ≥65 Jahren ein erhöhtes Risiko betreffend Myopathie auf im Vergleich zu Patienten <65 Jahre.
Kinder und Jugendliche
Die Anwendung von Ezetimib Simva Spirig HC bei Kindern und Jugendlichen unter 18 Jahren wird nicht empfohlen.
Gemeinsame Gabe mit anderen Arzneimitteln
Die Einnahme von Ezetimib Simva Spirig HC sollte mindestens 2 Stunden vor oder mindestens 4 Stunden nach der Einnahme eines Anionenaustauschers erfolgen (siehe Interaktionen, Colestyramin).
Bei gleichzeitiger Verabreichung von Ezetimib Simva Spirig HC mit Verapamil oder Diltiazem darf eine Dosis von Ezetimib Simva Spirig HC 10/10 mg pro Tag nicht überschritten werden.
Bei gleichzeitiger Verabreichung von Ezetimib Simva Spirig HC mit Amiodaron, Amlodipin oder Ranolazin, sollte die Dosis von Ezetimib Simva Spirig HC 10/20 mg pro Tag nicht überschritten werden (siehe «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse und «Interaktionen»).
Die Verträglichkeit und Wirksamkeit von Ezetimib in Kombination mit Fibraten wurde nicht untersucht (ausser mit Fenofibrat). Die gleichzeitige Anwendung von Ezetimib Simva Spirig HC und Fibraten wird daher nicht empfohlen (siehe «Kontraindikationen», «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse und «Interaktionen»).
Die Verträglichkeit und Wirksamkeit von Ezetimib in Kombination mit Arzneimitteln, die Elbasvir oder Grazoprevir enthalten wurde nicht untersucht; allerdings kann die gleichzeitige Anwendung zu erhöhten Plasmakonzentrationen von Simvastatin führen. Die gleichzeitige Anwendung wird daher nicht empfohlen (siehe «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse und «Interaktionen»).
Kontraindikationen
- Überempfindlichkeit gegenüber einem der Wirkstoffe oder einem der Hilfsstoffe.
- Aktive Lebererkrankung oder ungeklärte und persistierende Erhöhung der Serum-Transaminasen.
- Schwangerschaft und Stillzeit (siehe «Schwangerschaft/Stillzeit»).
- Gleichzeitige Anwendung von potenten CYP3A4-Inhibitoren (z.B. Itraconazol, Ketoconazol, Posaconazol, Voriconazol, HIV-Protease-Inhibitoren, Boceprevir, Telaprevir, Erythromycin, Clarithromycin, Telithromycin, Nefazodon und Arzneimitteln, die Cobicistat enthalten) (siehe «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse und «Interaktionen»).
- Gleichzeitige Anwendung von Gemfibrozil, Cyclosporin oder Danazol (siehe «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse und «Interaktionen»).
Warnhinweise und Vorsichtsmassnahmen
Myopathie/Rhabdomyolyse
Wie andere HMG-CoA-Reduktase-Hemmer verursacht Simvastatin gelegentlich eine Myopathie, welche sich in Form von Muskelschmerz, -schwäche oder –empfindlichkeit zusammen mit erhöhter Kreatinkinase (CK, auf das Zehnfache der oberen Normgrenze) äussert.
Myopathie kann manchmal als Rhabdomyolyse mit oder ohne akutem Nierenversagen aufgrund von Myoglobinurie auftreten, selten mit tödlichem Ausgang. Das Risiko einer Myopathie ist bei hoher HMG-CoA-Reduktase-Inhibitoraktivität im Plasma erhöht (d.h. bei erhöhten Plasmakonzentrationen von Simvastatin und Simvastatinsäure), was möglicherweise zum Teil durch interagierende Arzneimittel, welche mit dem Simvastatin-Metabolismus und/oder mit Transporter-Signalwegen interferieren, herbeigeführt werden kann (siehe «Interaktionen»).
In einer randomisierten klinischen Studie, in der mehr als 9000 Patienten mit chronischer Nierenkrankheit Ezetimib/Simvastatin 10/20 mg täglich (n = 4650) oder Placebo (n = 4620) erhielten (mediane Beobachtungsdauer: 4,9 Jahre), lag die Inzidenz von Myopathie/Rhabdomyolyse unter Ezetimib/Simvastatin bei 0,2% und unter Placebo bei 0,1%.
Die Ärzte sollten Arzneimittel, die Statine enthalten, mit Vorsicht bei Patienten mit prädisponierenden Faktoren für eine Rhabdomyolyse verschreiben. Ein Kreatinkinase-Wert sollte vor Beginn einer Behandlung mit Arzneimitteln, die Statine enthalten, in den folgenden Situationen bestimmt werden:
- Einschränkung der Nierenfunktion
- Nicht-Kontrollierte Hypothyreose
- Persönliche oder familiäre Vorgeschichte von erblichen Muskelerkrankungen
- Vorgeschichte von Muskeltoxizität mit einem Statin oder Fibrat
- Alkoholabhängigkeit
- Ältere Personen (≥65 Jahre): die Notwendigkeit einer solchen Messung sollte bei Vorhandensein von anderen prädisponierenden Faktoren für eine Rhabdomyolyse in Betracht gezogen werden.
- Weibliches Geschlecht
In solchen Situationen sollte das Risiko einer Behandlung in Relation zum möglichen Nutzen betrachtet werden und eine klinische Überwachung wird empfohlen.
Wenn die CK-Ausgangswerte signifikant erhöht sind (>5 mal die obere Normgrenze, ULN), darf die Behandlung nicht eingeleitet werden.
Alle Patienten, welche eine Behandlung mit Ezetimib Simva Spirig HC beginnen oder bei denen die Dosis von Ezetimib Simva Spirig HC erhöht werden soll, sollten über das Myopathierisiko aufgeklärt und angehalten werden, allfällige auftretende Zeichen wie unklarer Muskelschmerz, Empfindlichkeit der Muskulatur oder Muskelschwäche unverzüglich zu melden.
Die Therapie mit Ezetimib Simva Spirig HC sollte unverzüglich abgebrochen werden, wenn eine Myopathie diagnostiziert oder vermutet wird. Diese Symptome und ein CK-Wert >10ULN ist ein Hinweis auf eine Myopathie. Bei sofortigem Absetzen der Therapie sind Muskelsymptome und CK-Werte in den meisten Fällen rückläufig (siehe «Unerwünschte Wirkungen»).
Periodische CK-Bestimmungen sind bei Patienten, welche eine Behandlung mit Ezetimib Simva Spirig HC beginnen oder bei denen die Dosis erhöht werden soll, in Betracht zu ziehen. Periodische CK-Bestimmungen werden bei Patienten mit Titration auf die 10/80 mg Dosierung empfohlen. Es gibt allerdings keine Sicherheit, dass dadurch das Auftreten einer Myopathie verhindert werden kann.
Kreatinkinase (CK) sollte nicht nach körperlicher Anstrengung oder in Gegenwart irgendeiner anderen plausiblen Ursache für eine CK-Erhöhung gemessen werden, da dies die Interpretation der Messresultate erschwert. Wenn die CK-Ausgangswerte signifikant erhöht sind (>5× ULN), sollte die Messung innerhalb 5 bis 7 Tage später zur Bestätigung der Resultate wiederholt werden.
Wenn bei Patienten während der Behandlung mit Ezetimib Simva Spirig HC Muskelschmerzen, -schwäche oder –krämpfe vorkommen, sollten ihre CK-Werte bestimmt werden. Wenn diese Werte signifikant erhöht sind (>5× ULN), sollte die Behandlung abgebrochen werden.
Wenn die Muskelsymptome schwerwiegend sind und täglich Unannehmlichkeiten verursachen, selbst wenn die CK-Werte im Bereich ≤5× ULN erhöht sind, sollte ein Abbruch der Behandlung in Betracht gezogen werden.
Wenn die Symptome vollständig abklingen und die CK-Werte sich normalisieren, dann kann eine Wiederaufnahme der Behandlung mit Ezetimib Simva Spirig HC oder eine Behandlung mit einem anderen Arzneimittel das ein Statin enthält bei der tiefsten Dosis mit enger Überwachung des Patienten in Betracht gezogen werden.
Viele der Patienten, die unter Simvastatin-Therapie eine Rhabdomyolyse entwickelt haben, hatten erschwerende Befunde in der Anamnese einschliesslich Niereninsuffizienz, meist als Folge eines langdauernden Diabetes mellitus. Diese Patienten erfordern eine engmaschigere Überwachung. Die Behandlung mit Ezetimib Simva Spirig HC sollte vorübergehend einige Tage vor einem grösseren chirurgischen Wahleingriff abgesetzt werden, ebenso wenn ein bedeutendes medizinisches oder chirurgisches Leiden auftritt.
Wie bei anderen HMG-CoA-Reduktase-Hemmern ist das Risiko einer Myopathie/Rhabdomyolyse dosisabhängig.
In einer klinischen Studien-Datenbasis, bei der 41'413 Patienten mit Simvastatin behandelt wurden, wobei 24'747 der Patienten (ungefähr 60%) in Studien mit einem medianen Follow-up von mindestens 4 Jahren eingeschlossen worden sind, lag die Myopathieinzidenz bei ungefähr 0,03% bei 20 mg/Tag, 0,08% bei 40 mg/Tag und 0,61% bei 80 mg/Tag. Die Patienten in diesen Studien wurden sorgfältig überwacht und einige interagierende Arzneimittel wurden ausgeschlossen.
In einer klinischen Studie, bei welcher Patienten mit einer Vorgeschichte eines Myokardinfarktes mit Simvastatin 80 mg pro Tag (mittlerer Follow-up 6,7 Jahre) behandelt wurden, lag die Inzidenz einer Myopathie bei ungefähr 1,0% im Vergleich zu 0,02% bei Patienten mit 20 mg pro Tag. Ungefähr die Hälfte der Fälle mit Myopathie traten während des ersten Behandlungsjahres auf. Die Inzidenz einer Myopathie während jedem folgenden Behandlungsjahr betrug ungefähr 0,1%.
Bei Patienten unter 80 mg Simvastatin ist das Risiko einer Myopathie grösser im Vergleich zu anderen Statin-basierenden Therapien, welche eine ähnliche LDL-C senkende Wirksamkeit aufweisen. Die 10/80 mg Dosierung von Ezetimib Simva Spirig HC sollte daher nur bei Patienten angewendet werden, welche chronisch Ezetimib Simva Spirig HC 10/80 mg ohne Zeichen von Muskeltoxizität einnehmen. Eine alternative Statin-Ezetimib basierende Behandlung mit weniger potenziellen Arzneimittelinteraktionen, sollte bei Patienten mit Ezetimib Simva Spirig HC 10/80 mg angewendet werden, bei denen ein interagierender Wirkstoff verwendet werden muss (siehe unten, «Dosierung/Anwendung», «Kontraindikationen»).
In einer klinischen Studie, in welcher Patienten mit einem hohen Risiko einer kardiovaskulären Erkrankung mit Simvastatin 40 mg pro Tag behandelt wurden (mittlerer Follow-up 3,9 Jahre), lag die Inzidenz einer Myopathie bei ungefähr 0,05% bei nicht chinesischen Patienten (n=7367) im Vergleich zu 0,24% bei chinesischen Patienten (n=5468). Da in dieser klinischen Studie die Chinesen die einzige asiatische Population waren, die eingeschlossen wurde, sollte Ezetimib Simva Spirig HC bei asiatischen Patienten mit Vorsicht verschrieben und die niedrigste notwendige Dosis angewendet werden.
lmmunvermittelte nekrotisierende Myopathie (IMNM)
In sehr seltenen Fällen wurde während oder nach der Behandlung mit einigen Statinen über eine immunvermittelte nekrotisierende Myopathie (immune-mediated necrotizing myopathy; IMNM) berichtet. Die klinischen Charakteristika einer IMNM sind persistierende proximale Muskelschwäche und erhöhte Serum-Kreatinkinase-Werte, die trotz Absetzen der Behandlung mit Statinen fortbestehen.
Reduzierte Funktion von Transportproteinen
Die verminderte Funktion des hepatischen OATP-Transportproteins kann die systemische Exposition von Simvastatinsäure, sowie das Risiko für Myopathie und Rhabdomyolyse erhöhen. Die verminderte Funktion kann als Ergebnis einer Hemmung durch interagierende Arzneimittel (z.B. Ciclosporin) entstehen oder bei Patienten auftreten, die Träger des SLCO1B1 c.521T>C Genotyps sind.
Patienten, die das Allel c.521T>C des SLCO1B1 Gens tragen, das ein weniger aktives OATP1B1 Protein kodiert, haben eine erhöhte systemische Exposition von Simvastatinsäure, sowie ein erhöhtes Myopathierisiko. Das Risiko einer durch hochdosiertes Simvastatin (80 mg) bedingten Myopathie liegt ohne Gentest im Allgemeinen bei 1%. Basierend auf den Ergebnissen der SEARCH-Studie haben mit 80 mg behandelte Träger des homozygoten C-Allels (auch CC genannt) ein 15%iges Risiko für eine Myopathie innerhalb eines Jahres, während das Risiko bei Trägern des heterozygoten C-Allels (CT) bei 1,5% liegt. Patienten mit dem häufigsten Genotyp (TT) haben diesbezüglich ein Risiko von 0,3% (siehe «Pharmakokinetik»). Sofern verfügbar, sollten eine Genotypisierung bezüglich des Vorliegens des C-Allels als Teil der Nutzen-Risiko-Bewertung bei einzelnen Patienten vor einer Verordnung von Simvastatin 80 mg in Betracht gezogen, sowie hohe Dosen bei identifizierten Trägern des CC-Genotyps vermieden werden. Die Abwesenheit dieses Gens bei der Genotypisierung schliesst allerdings nicht aus, dass eine Myopathie auftreten kann.
Arzneimittelinteraktionen
Da Ezetimib Simva Spirig HC Simvastatin enthält, kann das Risiko einer Myopathie/Rhabdomyolyse bei gleichzeitiger Behandlung mit folgenden Arzneimitteln erhöht sein (siehe «Interaktionen»):
Kontraindizierte Arzneimittel
Potente Hemmer von CYP3A4: Die gleichzeitige Anwendung von Arzneimitteln, die einen potenten Hemmungseffekt auf CYP3A4 bei therapeutischen Dosen haben, ist kontraindiziert (z.B. Itraconazol, Ketoconazol, Posaconazol, Voriconazol, Erythromycin, Clarithromycin, Telithromycin, HIV-Proteasehemmer, Boceprevir, Telaprevir, Nefazodon oder Arzneimittel, die Cobicistat enthalten). Wenn die kurzfristige Behandlung mit potenten CYP3A4 Inhibitoren unvermeidlich ist, sollte die Therapie mit Ezetimib Simva Spirig HC während der Zeit der Behandlung unterbrochen werden (siehe «Kontraindikationen», «Interaktionen», «Pharmakokinetik»).
Gemfibrozil, Cyclosporin oder Danazol: Die gleichzeitige Anwendung von Ezetimib Simva Spirig HC mit diesen Arzneimitteln ist kontraindiziert (siehe «Kontraindikationen», «Interaktionen», «Pharmakokinetik»).
Andere Arzneimittel:
Fusidinsäure: HMG-CoA-Reduktasehemmer (Statine), einschliesslich Ezetimib Simva Spirig HC dürfen nicht zusammen mit systemischen Fusidinsäurepräparaten angewendet werden. Es wurde über Rhabdomyolyse (einschliesslich einiger Todesfälle) bei Patienten berichtet, die systemische Fusidinsäurepräparate in Kombination mit Statinen erhielten (siehe «Interaktionen»). Die Behandlung mit Ezetimib Simva Spirig HC ist während einer unverzichtbaren systemischen Fusidinsäuretherapie abzusetzen. Die Patienten sollten darüber informiert werden, umgehend ärztlichen Rat einzuholen, wenn sie Anzeichen von Muskelschwäche, -schmerzen oder -empfindlichkeit bemerken. Die Statintherapie kann 7 Tage nach der letzten Dosis Fusidinsäure fortgesetzt werden. In Ausnahmesituationen, wenn eine anhaltende systemische Fusidinsäure-Behandlung erforderlich ist, sollte die gleichzeitige Anwendung von Ezetimib Simva Spirig HC und Fusidinsäure nur von Fall zu Fall und unter engmaschiger medizinischer Überwachung in Betracht gezogen werden.
Fibrate: Die Sicherheit und Wirksamkeit der Anwendung von Ezetimib/Simvastatin mit Fibraten (ausser Fenofibrat) wurde nicht geprüft. Deshalb wird die gleichzeitige Anwendung von Ezetimib Simva Spirig HC mit Fibraten nicht empfohlen. Die gleichzeitige Anwendung von Gemfibrozil ist kontraindiziert (siehe «Kontraindikationen»).
Amiodaron: Bei 6% der Patienten, die 80 mg Simvastatin und Amiodaron in einer klinischen Studie erhalten haben, wurde über Myopathie berichtet (siehe «Interaktionen»). Bei gleichzeitiger Anwendung mit Amiodaron sollte eine Dosis von 10/20 mg Ezetimib Simva Spirig HC pro Tag nicht überschritten werden.
Kalziumkanalblocker:
Verapamil oder Diltiazem: Bei Patienten, die 80 mg Simvastatin und Diltiazem in einer klinischen Studie erhalten haben, bestand ein erhöhtes Risiko für Myopathie. Bei Patienten mit gleichzeitiger Verabreichung von Verapamil oder Diltiazem sollte die Dosierung von Ezetimib Simva Spirig HC 10/10 mg pro Tag nicht überschreiten (siehe «Interaktionen», Weitere Interaktionen).
Amlodipin: In einer klinischen Studie hatten Patienten unter Behandlung mit Amlodipin und Simvastatin 80 mg ein leicht erhöhtes Risiko einer Myopathie (siehe «Interaktionen», Weitere Interaktionen). Bei Patienten mit gleichzeitiger Verabreichung von Amlodipin sollte die Dosierung von Ezetimib Simva Spirig HC 10/20 mg pro Tag nicht überschreiten.
Lomitapid: Bei Patienten mit homozygoter familiärer Hypercholesterinämie und gleichzeitiger Verabreichung von Arzneimitteln mit Lomitapid, sollte die Dosierung von Ezetimib Simva Spirig HC 10/40 mg pro Tag nicht überschreiten (siehe «Interaktionen»).
Moderate CYP3A4 Inhibitoren: Patienten mit gleichzeitiger Verabreichung von Arzneimitteln, die einen moderaten Hemmungseffekt auf CYP3A4 haben und Ezetimib Simva Spirig HC, im Besonderen bei höheren Dosierungen von Ezetimib Simva Spirig HC, haben möglicherweise ein erhöhtes Risiko für Myopathie. Eine Dosisanpassung von Ezetimib Simva Spirig HC könnte bei gleichzeitiger Anwendung von Ezetimib Simva Spirig HC mit einem moderaten CYP3A4 Inhibitor notwendig sein.
Inhibitoren des Breast Cancer Resistance Proteins (BCRP): Die gleichzeitige Verabreichung von Arzneimitteln, die Inhibitoren von BCRP sind (z.B. Elbasvir und Grazoprevir), kann zu erhöhten Plasmakonzentrationen von Simvastatin und einem erhöhten Myopathie-Risiko führen. Die gleichzeitige Verabreichung von Elbasvir und Grazoprevir mit Simvastatin wurde nicht untersucht; daher ist die gleichzeitige Anwendung von Ezetimib Simva Spirig HC mit Elbasvir oder Grazoprevir enthaltenden Arzneimitteln nicht empfohlen (siehe «Interaktionen», Weitere Interaktionen).
Antikoagulantien: Bei gleichzeitiger Behandlung mit Warfarin oder anderen Vitamin K-Antagonisten (wie z.B. Marcoumar, Sintrom) sollen der Quickwert bzw. die INR engmaschig bestimmt werden (siehe «Interaktionen»).
Niacin (≥1 g/Tag): Fälle von Myopathie/Rhabdomyolyse wurden bei gemeinsamer Anwendung von Simvastatin mit Lipid-modifizierenden Dosierungen (≥1 g/Tag) von Niacin beobachtet. In einer klinischen Studie (mittlerer Follow-up 3,9 Jahre) wurden Patienten mit einem hohen Risiko für eine kardiovaskuläre Erkrankung eingeschlossen, die einen gut kontrollierten LDL-C Spiegel unter Simvastatin 40 mg pro Tag mit oder ohne Ezetimib 10 mg erreichten. Die Zugabe von lipid-modifizierenden Dosierungen (≥1 g/Tag) von Niacin hatte keinen zusätzlichen Nutzen in Bezug auf kardiovaskuläre Ereignisse. Der Nutzen einer kombinierten Verabreichung von Simvastatin mit Niacin sollte deshalb im Vergleich zum Risiko einer Kombination vorsichtig abgewogen werden. Zusätzlich lag die Inzidenz einer Myopathie in dieser Studie bei ungefähr 0,24% bei chinesischen Patienten unter Simvastatin 40 mg oder Ezetimib/Simvastatin 10/40 mg im Vergleich zu 1,24% bei chinesischen Patienten unter Simvastatin 40 mg oder Ezetimib/Simvastatin 10/40 mg mit gleichzeitiger Verabreichung von Niacin/Laropiprant 2 g/40 mg mit verzögerter Wirkstofffreisetzung. Da in dieser klinischen Studie die Chinesen die einzige asiatische Population waren, die eingeschlossen wurde und das Risiko einer Myopathie bei Chinesen im Vergleich zu nicht-chinesischen Patienten höher ist, ist die gleichzeitige Verabreichung von Ezetimib Simva Spirig HC mit lipid-modifizierenden Dosierungen (≥1 g/Tag) von Niacin bei asiatischen Patienten nicht empfohlen (siehe «Interaktionen», Weitere Interaktionen).
Daptomycin: Fälle von Myopathie und/oder Rhabdomyolyse wurden bei gleichzeitiger Verabreichung von HMG-CoA-Reduktase-Inhibitoren mit Daptomycin beobachtet. Bei der Verschreibung von HMG-CoA-Reduktase-Inhibitoren mit Daptomycin ist Vorsicht geboten, da beide Arzneimittel bei alleiniger Verabreichung eine Myopathie und/oder Rhabdomyolyse verursachen können. Es wird generell empfohlen, Ezetimib Simva Spirig HC bei Patienten, die mit Daptomycin behandelt werden, vorübergehend abzusetzen (siehe «Interaktionen», Weitere Interaktionen).
Grapefruitsaft
Patienten sollten instruiert werden wegen möglicher Interaktionen keinen Grapefruitsaft zu trinken (CYP3A4-Inhibition) (siehe «Interaktionen», Weitere Interaktionen).
Leberenzyme
In kontrollierten Studien wurden nach Kombination von Ezetimib mit einem Statin Erhöhungen der Transaminasen (≥3× ULN) beobachtet.
In einer randomisierten kontrollierten klinischen Studie, in der mehr als 9000 Patienten mit chronischer Nierenkrankheit Ezetimib/Simvastatin 10/20 mg täglich (n = 4650) oder Placebo (n = 4620) erhielten (mediane Beobachtungsdauer: 4,9 Jahre), lag die Inzidenz von aufeinanderfolgenden erhöhten Transaminase-Werten (>3× obere Normbereichsgrenze) unter Ezetimib/Simvastatin bei 0,7% und unter Placebo bei 0,6%.
Leberfunktionsprüfungen werden vor Beginn der Behandlung und danach immer, wenn klinisch angezeigt, empfohlen. Bei Patienten, die auf eine Dosis von 10/80 mg eingestellt werden, sollte eine zusätzliche Bestimmung vor und 3 Monate nach Dosiserhöhung auf 10/80 mg und danach in regelmässigen Abständen (z.B. halbjährlich) im ersten Behandlungsjahr erfolgen. Bei Patienten, die erhöhte Transaminasenwerte im Serum entwickeln, sollte die Bestimmung sofort und anschliessend in kurzen Abständen wiederholt werden. Sollten Transaminasenerhöhungen fortschreiten, insbesondere wenn sie auf Werte bis zum Dreifachen der oberen Normgrenze ansteigen und persistieren, sollte das Arzneimittel abgesetzt werden. Es sollte beachtet werden, dass ALT aus dem Muskel stammen kann, weshalb eine Erhöhung der ALT zusammen mit der CK auf eine Myopathie hinweisen kann (siehe «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse).
Nach Markteinführung wurde selten über letales und nicht-letales Leberversagen bei Patienten unter Statin einschliesslich Simvastatin berichtet. Die Therapie mit Ezetimib Simva Spirig HC soll umgehend unterbrochen werden, wenn während der Behandlung mit Ezetimib Simva Spirig HC schwerwiegende Leberschäden mit klinischen Symptomen und/oder Hyperbilirubinämie oder Gelbsucht auftreten. Die Therapie mit Ezetimib Simva Spirig HC soll nicht wieder begonnen werden, wenn keine anderweitige Krankheitsursache festgestellt wird.
Ezetimib Simva Spirig HC sollte mit Vorsicht bei denjenigen Patienten eingesetzt werden, die im erheblichen Masse Alkohol zu sich nehmen und/oder eine Lebererkrankungen in der Anamnese haben. Akute Lebererkrankungen oder ungeklärte persistierende Transaminasenerhöhungen sind Kontraindikationen.
Leberinsuffizienz
Aufgrund fehlender Daten zu Auswirkungen einer erhöhten Exposition von Ezetimib bei Patienten mit mässiger oder schwerer Leberinsuffizienz, wird Ezetimib Simva Spirig HC für diese Patienten nicht empfohlen (siehe «Pharmakokinetik», sowie «Kontraindikationen»).
Diabetes mellitus
Es gibt einige Hinweise, dass Statine als Klasseneffekt den Blutzuckerspiegel erhöhen. Bei einigen Patienten, die ein hohes Risiko für einen zukünftigen Diabetes aufweisen, kann dies zu einem Grad an Hyperglykämie führen, der eine angemessene Diabetesbehandlung erforderlich macht. Dies sollte jedoch kein Grund sein die Behandlung mit Statinen zu beenden, da die Reduktion des vaskulären Risikos unter Statinen das Risiko für Diabetes überwiegt. Risikopatienten (Nüchternglucosewert 5,6 bis 6,9 mmol/l, BMI >30 kg/m², erhöhte Triglyceride, Hypertonie) sollten klinisch als auch biochemisch überwacht werden (siehe «Unerwünschte Wirkungen»).
Augen
Ohne jegliche Arzneimitteltherapie muss mit der Zeit, als Folge des Alterungsprozesses, eine erhöhte Prävalenz von Linsentrübungen erwartet werden. Gegenwärtige Daten aus kontrollierten klinischen Langzeituntersuchungen mit Simvastatin geben keinen Hinweis auf eine nachteilige Wirkung von Simvastatin auf die menschliche Linse.
Interaktionen
Mehrere Mechanismen können zu potentiellen Interaktionen mit HMG Co-A Reduktase Inhibitoren beitragen. Arzneimittel oder pflanzliche Mittel welche gewisse Enzyme (z.B. CYP3A4) und/oder Transporter-Signalwege (z.B. OATP1B) inhibieren, können die Simvastatin- und Simvastatinsäure-Plasmakonzentrationen erhöhen und können so zu einem erhöhten Risiko von Myopathie/Rhabdomyolyse führen.
Beachten Sie die Arzneimittelinformationen aller Begleitmedikamente um mehr Informationen über ihre potentiellen Interaktionen mit Simvastatin und/oder potenziellen Veränderungen der Enzyme oder Transporter sowie über mögliche Dosis- und Regime-Anpassungen zu erhalten.
Kontraindizierte Arzneimittel:
Die gleichzeitige Verabreichung der nachfolgenden Arzneimittel ist kontraindiziert:
Potente Hemmer von CYP3A4
Simvastatin wird über CYP3A4 metabolisiert, hat aber keinen inhibitorischen Effekt auf CYP3A4. Deshalb wird auch nicht erwartet, dass es die Plasmaspiegel anderer Arzneimittel, die über CYP3A4 metabolisiert werden, beeinflusst. Die folgenden starken Inhibitoren von CYP3A4 können das Risiko für eine Myopathie wegen einer reduzierten Elimination des Simvastatin-Anteils von Ezetimib Simva Spirig HC erhöhen: Die gleichzeitige Verabreichung von Arzneimitteln, die einen potenten Hemmungseffekt auf CYP3A4 bei therapeutischen Dosen haben, ist kontraindiziert (z.B. Itraconazol, Ketoconazol, Posaconazol, Voriconazol, Erythromycin, Clarithromycin, Telithromycin, HIV-Protease-Inhibitoren, Boceprevir, Telaprevir, Nefazodon, Arzneimittel, die Cobicistat enthalten) (siehe «Kontraindikationen», «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse, «Pharmakokinetik»).
Gemfibrozil, Cyclosporin oder Danazol: siehe «Kontraindikationen», «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse, «Pharmakokinetik».
Pharmakokinetische Wechselwirkungen
Verordnungsempfehlungen zu interagierenden Arzneimitteln sind in der untenstehenden Tabelle zusammengefasst (weitere Details sind im Text erläutert, siehe «Dosierung/Anwendung», «Kontraindikationen» und «Warnhinweise und Vorsichtsmassnahmen»).
Mit einem erhöhten Risiko für Myopathie/Rhabdomyolyse assoziierte Arzneimittelwechselwirkungen
Interagierende Stoffe | Verordnungsempfehlungen |
Potente CYP-3A4-Inhibitoren, z.B.: Itraconazol Ketoconazol Posaconazol Voriconazol Erythromycin Clarithromycin Telithromycin HIV-Protease-Inhibitoren Boceprevir Telaprevir Nefazodon Cobicistat Cyclosporin Danazol Gemfibrozil | Gleichzeitige Anwendung mit Ezetimib Simva Spirig HC ist kontraindiziert |
Andere Fibrate | Nicht empfohlen zusammen mit Ezetimib Simva Spirig HC |
Elbasvir Grazoprevir | Nicht empfohlen zusammen mit Ezetimib Simva Spirig HC |
Fusidinsäure | Nicht empfohlen zusammen mit Ezetimib Simva Spirig HC |
Niacin (≥1 g/Tag) | Bei asiatischen Patienten nicht empfohlen zusammen mit Ezetimib Simva Spirig HC |
Verapamil Diltiazem | Eine Dosis von 10/10 mg Ezetimib Simva Spirig HC pro Tag nicht überschreiten |
Amiodaron Amlodipin | Eine Dosis von 10/20 mg Ezetimib Simva Spirig HC pro Tag nicht überschreiten |
Lomitapid | Bei Patienten mit homozygoter familiärer Hypercholesterinämie eine Dosis von 10/40 mg Ezetimib Simva Spirig HC pro Tag nicht überschreiten |
Daptomycin | Nicht empfohlen zusammen mit Ezetimib Simva Spirig HC |
Grapefruitsaft | Während der Behandlung mit Ezetimib Simva Spirig HC Grapefruitsaft vermeiden |
Andere Interaktionen
Fibrate (siehe auch Kontraindizierte Arzneimittel in dieser Rubrik):
Die gleichzeitige Anwendung von Fenofibrat erhöhte die Konzentration von Gesamt-Ezetimib auf das ca. 1,5-Fache. Die Sicherheit und Wirksamkeit von Ezetimib/Simvastatin bei gleichzeitiger Anwendung mit Fibraten wurde nicht untersucht. Die gemeinsame Gabe von Ezetimib Simva Spirig HC mit Fibraten wird nicht empfohlen.
Systemische Fusidinsäurepräparate:
Es wurde über Rhabdomyolyse (einschliesslich einiger Todesfälle) bei Patienten berichtet, die systemische Fusidinsäurepräparate in Kombination mit Statinen, einschliesslich Ezetimib Simva Spirig HC erhielten (siehe «Warnhinweise und Vorsichtsmassnahmen»). Der Mechanismus dieser Interaktion ist nicht bekannt. Die Behandlung mit Ezetimib Simva Spirig HC ist während einer unverzichtbaren systemischen Fusidinsäuretherapie abzusetzen. Die Behandlung mit Ezetimib Simva Spirig HC kann sieben Tage nach Erhalt der letzten Fusidinsäuredosis wieder aufgenommen werden.
Amiodaron:
Das Risiko einer Myopathie/Rhabdomyolyse ist bei gemeinsamer Therapie von Amiodaron mit Ezetimib Simva Spirig HC erhöht (siehe «Dosierung/Anwendung», «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse). In einer klinischen Studie wurde bei 6% der Patienten, die 80 mg Simvastatin und Amiodaron einnahmen, über eine Myopathie berichtet. Die Dosis von Ezetimib Simva Spirig HC sollte daher 10/20 mg pro Tag bei Kombination mit Amiodaron nicht überschreiten.
Kalziumkanalblocker:
Verapamil: Das Risiko einer Myopathie/Rhabdomyolyse ist erhöht bei gleichzeitiger Anwendung von Verapamil mit Ezetimib Simva Spirig HC 10/40 mg oder 10/80 mg (siehe «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse). In einer pharmakokinetischen Studie führte eine gleichzeitige Anwendung von Simvastatin und Verapamil zu einer 2,3fachen Erhöhung der Exposition mit der Simvastatinsäure, was vermutlich teilweise auf eine CYP3A4-Hemmung zurückzuführen ist. Die Dosis von Ezetimib Simva Spirig HC sollte daher 10/10 mg pro Tag bei Kombination mit Verapamil nicht überschreiten.
Diltiazem: Das Risiko einer Myopathie/Rhabdomyolyse ist erhöht bei gleichzeitiger Anwendung von Diltiazem mit Ezetimib Simva Spirig HC 10/80 (siehe «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse). In einer pharmakokinetischen Studie führte die gleichzeitige Anwendung von Simvastatin und Diltiazem zu einer 2,7fachen Erhöhung der Exposition mit der Simvastatinsäure, was vermutlich teilweise auf eine CYP3A4-Hemmung zurückzuführen ist. Die Dosis von Ezetimib Simva Spirig HC sollte daher 10/10 mg pro Tag bei Kombination mit Diltiazem nicht überschreiten.
Amlodipin: Patienten, welche gleichzeitig mit Amlodipin und Ezetimib Simva Spirig HC 10/80 behandelt werden, haben ein erhöhtes Myopathierisiko (siehe «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse). Das Risiko einer Myopathie war bei Patienten unter 40 mg Simvastatin durch die gleichzeitige Einnahme von Amlodipin nicht erhöht. In einer pharmakokinetischen Studie führte eine gleichzeitige Anwendung mit Amlodipin zu einer 1,6fachen Erhöhung der Exposition mit der Simvastatinsäure. Die Dosis von Ezetimib Simva Spirig HC sollte daher 10/20 mg pro Tag bei Kombination mit Amlodipin nicht überschreiten.
Lomitapid: Das Risiko einer Myopathie/Rhabdomyolyse kann durch die gleichzeitige Anwendung von Lomitapid möglicherweise erhöht sein (siehe «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse).
Moderate CYP3A4-Inhibitoren: Patienten mit gleichzeitiger Verabreichung von Arzneimitteln, die einen moderaten Hemmungseffekt auf CYP3A4 haben und Ezetimib Simva Spirig HC, im Besonderen bei höheren Dosierungen von Ezetimib Simva Spirig HC, haben möglicherweise ein erhöhtes Risiko für Myopathie (siehe «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse).
Inhibitoren des Transportproteins OATP1B1: Simvastatinsäure ist ein Substrat des Transportproteins OATP1B1. Die gleichzeitige Anwendung von Arzneimitteln, die Inhibitoren des Transportproteins OATP1B1 sind (z.B. Ciclosporin), kann möglicherweise zu erhöhten Plasmakonzentrationen von Simvastatinsäure und zu einem möglicherweise erhöhten Risiko für Myopathie und Rhabdomyolyse führen (siehe «Kontraindikationen», «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse).
Inhibitoren des Breast Cancer Resistance Protein (BCRP): Simvastatin ist ein Substrat des Effluxtransporters BCRP. Die gleichzeitige Verabreichung von Arzneimitteln, die Inhibitoren von BCRP sind (z.B. Elbasvir und Grazoprevir), kann zu erhöhten Plasmakonzentrationen von Simvastatin und einem erhöhten Myopathie-Risiko führen. Die gleichzeitige Anwendung von Ezetimib Simva Spirig HC mit Produkten, die Elbasvir oder Grazoprevir enthalten, ist nicht empfohlen (siehe «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse).
Colestyramin:
Die gleichzeitige Anwendung von Colestyramin verkleinerte die mittlere Fläche unter der Kurve (AUC) von Gesamt-Ezetimibe (Ezetimibe und glukuronidiertes Ezetimibe) um ca. 55% (siehe «Dosierung/Anwendung»).
Colchicin:
Bei Patienten mit einer Niereninsuffizienz bei gleichzeitiger Anwendung von Colchicin und Simvastatin, wurde über Myopathie und Rhabdomyolyse berichtet. Es wird eine engmaschige Überwachung dieser Patienten empfohlen, die die Kombination Colchicin und Simvastatin einnehmen.
Grapefruitsaft:
Grapefruitsaft hemmt CYP3A4. Der Genuss grosser Mengen von Grapefruitsaft (über 1 Liter pro Tag) bei gleichzeitiger Anwendung von Simvastatin führte zu einer 7fachen Erhöhung der Exposition mit Simvastatinsäure. Der Genuss von 240 ml Grapefruitsaft am Morgen und die Einnahme von Simvastatin am Abend führte ebenso zu einer 1,9fachen Erhöhung. Der Genuss von Grapefruitsaft sollte deshalb während der Therapie mit Ezetimib Simva Spirig HC vermieden werden.
Niacin (Nicotinsäure):
In einer Studie mit 15 gesunden Erwachsenen ergab die gleichzeitige Anwendung von Ezetimib/Simvastatin (10/20 mg täglich während 7 Tagen) und retardiertem Niacin (1000 mg für 2 Tage und 2000 mg für 5 Tage, jeweils gefolgt von einem kalorienreduzierten Frühstück) eine geringe Vergrösserung der mittleren Fläche unter der Kurve (AUC) von Niacin (22%) und Nicotinursäure (19%). In derselben Studie ergab die gleichzeitige Anwendung von Niacin eine leicht vergrösserte mittlere Fläche unter der Kurve (AUC) von Ezetimib (9%), Gesamt-Ezetimib (26%), Simvastatin (20%) und Simvastatinsäure (35%). Fälle von Myopathie/Rhabdomyolyse wurden bei gleichzeitiger Verabreichung von Simvastatin mit lipid-modifizierenden Dosierungen (≥1 g/Tag) von Niacin beobachtet (Siehe «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse).
Daptomycin:
Das Risiko einer Myopathie und/oder Rhabdomyolyse kann durch die gleichzeitige Verabreichung von HMG-CoA-Reduktase-Inhibitoren und Daptomycin erhöht werden (siehe «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse).
Cumarin-Derivate:
Bei gleichzeitiger Gabe von Simvastatin mit Cumarinantikoagulantien in klinischen Studien war die INR leicht erhöht. Die gleichzeitige Anwendung von Ezetimib (10 mg täglich) hatte in einer Studie mit 12 erwachsenen männlichen Probanden keine signifikante Wirkung auf die Bioverfügbarkeit von Warfarin und die Prothrombinzeit. Hingegen gab es Postmarketing Berichte über erhöhte INR bei Patienten, die Ezetimib und Warfarin erhielten. Daher sollte bei Patienten, die Cumarin-Derivate einnehmen, die Prothrombinzeit zu Beginn einer Therapie mit Ezetimib Simva Spirig HC und danach in häufigen Abständen bestimmt werden, um signifikante Veränderungen der Prothrombinzeit zu erfassen. Nach Stabilisierung der Werte wird die Bestimmung der Prothrombinzeit anschliessend in den Zeitabständen empfohlen, wie sie für Patienten unter Therapie mit Cumarin-Derivaten üblich sind. Wird die Dosis von Ezetimib Simva Spirig HC geändert oder Ezetimib Simva Spirig HC abgesetzt, sollte dieselbe Vorgehensweise eingehalten werden. Bei nicht-antikoagulierten Patienten ist die Behandlung mit Simvastatin nicht mit Blutungen oder Veränderungen der Prothrombinzeit in Verbindung gebracht worden.
Antazida:
Die gleichzeitige Anwendung von Antazida verminderte die Resorptionsrate von Ezetimib, beeinflusste aber nicht die Bioverfügbarkeit von Ezetimib. Der verminderten Resorptionsrate wird keine klinische Bedeutung beigemessen.
Digoxin:
Die gleichzeitige Anwendung von Simvastatin und Digoxin bei gesunden Freiwilligen resultierte in einer geringen Erhöhung des Digoxin-Spiegels (weniger als 0,3 ng/ml, gemessen im Radio-Immuno-Assay), während dies bei gleichzeitiger Anwendung von Placebo und Digoxin nicht beobachtet wurde.
Schwangerschaft/Stillzeit
Schwangerschaft
Ezetimib Simva Spirig HC ist während der Schwangerschaft kontraindiziert. Ezetimib Simva Spirig HC darf daher nicht von Frauen eingenommen werden, die schwanger sind, eine Schwangerschaft planen oder vermuten schwanger zu sein. Die Behandlung mit Ezetimib Simva Spirig HC muss unterbrochen werden, bis die Schwangerschaft beendet oder definitiv ausgeschlossen ist (siehe «Kontraindikationen»).
Bei gleichzeitiger Anwendung von Ezetimib mit Simvastatin wurden keine teratogenen Wirkungen im Rahmen von Studien zur embryonalen/fetalen Entwicklung bei trächtigen Ratten beobachtet. Bei trächtigen Kaninchen wurde eine geringe Anzahl von Skelettmissbildungen beobachtet (siehe «Präklinische Daten»).
Es liegen seltene Berichte über kongenitale Anomalien nach intrauteriner Exposition mit HMG-CoA-Reduktase-Inhibitoren vor. Eine Analyse bisheriger Erfahrungen mit ca. 200 Frauen, die Simvastatin oder einen strukturverwandten HMG-CoA-Reduktase-Inhibitor im ersten Trimenon der Schwangerschaft eingenommen hatten, zeigte gegenüber der Gesamtpopulation kein erhöhtes Risiko für kongenitale Anomalien.
Stillzeit
Ezetimib Simva Spirig HC ist während der Stillzeit kontraindiziert. Studien an Ratten haben gezeigt, dass Ezetimib in die Muttermilch übergeht. Es ist nicht bekannt, ob die Wirkstoffe von Ezetimib Simva Spirig HC in die menschliche Muttermilch übergehen; deshalb dürfen stillende Frauen Ezetimib Simva Spirig HC nicht einnehmen (siehe «Kontraindikationen»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt. Aufgrund der möglichen unerwünschten Wirkungen kann die Reaktionsfähigkeit, die Fahrtüchtigkeit und die Fähigkeit, Werkzeuge und Maschinen zu bedienen, beeinträchtigt sein.
Unerwünschte Wirkungen
Die folgenden arzneimittelbedingten unerwünschten Ereignisse wurden häufig (≥1/100, <1/10), gelegentlich (≥1/1000, <1/100), selten (≥1/10'000, <1/1000) oder sehr selten (<1/10'000) unter Ezetimib/Simvastatin (n=2404) und mit einer höheren Inzidenz als unter Placebo (n=1340) beobachtet, und/oder unter Ezetimib/Simvastatin (n=9595) und mit einer höheren Inzidenz als unter Statinen alleine (n=8883) beobachtet:
Organsystemklasse | Unerwünschte Reaktion | Häufigkeit |
|---|---|---|
Infektionen und parasitäre Erkrankungen | Nasopharyngitis | selten |
Erkrankungen des Immunsystems | Hypersensitivität | selten |
Stoffwechsel und Ernährungsstörungen | Anorexie, verminderter Appetit | selten |
Psychiatrische Erkrankungen | Schlafstörungen, Insomnie | gelegentlich |
Angst, Depression, verminderte Libido | selten | |
Erkrankungen des Nervensystems | Schwindel, Kopfschmerzen, Parästhesie | gelegentlich |
Lethargie | selten | |
Herzerkrankungen und Gefässerkrankungen | Flushing, erhöhter Blutdruck | selten |
Erkrankungen der Atemwege, des Brustraums und Mediastinums | Dyspnoe, Nasenbluten | selten |
Erkrankungen des Gastrointestinaltrakts | Abdominale Schmerzen, abdominale Beschwerden, Dyspepsie, Flatulenz, Nausea, Erbrechen, geblähtes Abdomen, Diarrhoe, Mundtrockenheit, gastroösophageale Refluxkrankheit | gelegentlich |
Gastritis | selten | |
Erkrankungen der Haut und des Unterhautgewebes | Pruritus, Ausschlag, Urticaria | gelegentlich |
Akne, Alopezie, Hyperhidrosis, Psoriasis | selten | |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | Myalgie | häufig |
Arthralgie, Muskelspasmen, Muskelschwäche, muskuloskelettale Beschwerden, Nackenschmerzen, Schmerzen in den Extremitäten, Rückenschmerzen, muskuloskelettale Schmerzen | gelegentlich | |
Flankenschmerz, Gelenkschwellung, Myopathie | selten | |
Erkrankungen der Nieren und Harnwege | Pollakisurie | selten |
Erkrankungen der Geschlechtsorgane und der Brustdrüse | Erektile Dysfunktion | selten |
Allgemeine Erkrankungen | Asthenie, Müdigkeit, Malaise, Ödeme (inkl. periphere Ödeme und Gesichtsödeme), Schmerzen (inkl. Thoraxschmerzen) | gelegentlich |
Durst | selten | |
Untersuchungen | Erhöhte ALT und/oder AST, CK im Blut erhöht | häufig |
Bilirubin im Blut erhöht, Harnsäure im Blut erhöht, Gamma-Glutamyltransferase erhöht, INR erhöht, Vorhandensein von Protein im Urin, Gewichtsabnahme, alkalische Phosphatase im Blut erhöht | gelegentlich | |
Kreatinin im Blut erhöht, Harnstoff im Blut erhöht, Hämoglobin vermindert | selten |
Laborwerte:
In Koadministrationsstudien betrug die Inzidenz klinisch bedeutender Erhöhungen der Serum-Transaminasen (ALT und/oder AST ≥3× ULN in Folge) 1,7% unter Ezetimib/Simvastatin. Diese Erhöhungen waren im Allgemeinen asymptomatisch, standen nicht im Zusammenhang mit einer Cholestase und kehrten nach Absetzen der Therapie oder im Laufe der Behandlung auf den Ausgangswert zurück (siehe Warnhinweise und Vorsichtsmassnahmen). Klinisch bedeutende Erhöhungen der CK (≥10×ULN) wurden bei 0,2% der mit Ezetimib/Simvastatin behandelten Patienten beobachtet.
Diabetes mellitus: Die Häufigkeit ist abhängig von den bestehenden oder nicht bestehenden Risikofaktoren (Nüchternblutzucker ≥5.6 mmol/l, BMI >30 kg/m², erhöhte Triglyceride, Hypertonie in der Vorgeschichte) (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Postmarketing Erfahrung:
Die unerwünschten Wirkungen unter Ezetimib/Simvastatin entsprechen bisher den bereits bekannten unter Ezetimib und/oder Simvastatin.
Weitere Informationen zu den einzelnen Wirkstoffen: Ausser den oben genannten Nebenwirkungen des Kombinationsproduktes können andere, bereits in klinischen Studien und/oder nach Markteinführung berichtete Nebenwirkungen der einzelnen Bestandteile auch unter Ezetimib/Simvastatin auftreten.
Ezetimib
Erkrankungen des Blutes und des Lymphsystems:
Sehr selten: Thrombozytopenie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums:
Unbekannt: Husten.
Erkrankungen des Gastrointestinaltrakts:
Sehr selten: Pankreatitis.
Unbekannt: Obstipation.
Leber- und Gallenerkrankungen:
Selten: Hepatitis.
Sehr selten: Cholelithiasis, Cholezystitis, Ikterus.
Erkrankungen der Haut und des Unterhautgewebes:
Selten: Überempfindlichkeitsreaktionen einschliesslich Hautausschlag, Urtikaria und sehr selten Anaphylaxie und Angioödem.
Sehr selten: Erythema multiforme.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen:
Sehr selten: Rhabdomyolyse, Myositis.
Gefässerkrankungen:
Gelegentlich: Hitzewallungen.
Simvastatin
Erkrankungen des Blutes und des Lymphsystems:
Selten: Anämie.
Erkrankungen des Immunsystems:
Selten wurde über ein offensichtliches Hypersensitivitätssyndrom berichtet, das mit einem oder mehreren der folgenden Symptome einherging: angioneurotisches Ödem, Lupus-ähnliches Syndrom, Polymyalgia rheumatica, Dermatomyositis, Vaskulitis, Thrombozytopenie, Eosinophilie, Beschleunigung der Blutsenkungsgeschwindigkeit, Arthritis und Arthralgie, Urtikaria, Photosensitivität, Fieber, Gesichtsrötung, Dyspnoe und allgemeines Krankheitsgefühl.
Erkrankungen des Nervensystems:
Selten: periphere Neuropathie.
Sehr selten: Einschränkung des Erinnerungsvermögens.
Erkrankungen der Atemwege, des Brustraums und Mediastinums:
Einzelfälle: interstitielle Lungenerkrankung.
Erkrankungen des Gastrointestinaltrakts:
Selten: Obstipation, Pankreatitis.
Leber- und Gallenerkrankungen:
Selten: Hepatitis/Ikterus.
Sehr selten: letales und nicht-letales Leberversagen.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen:
Selten: Rhabdomyolyse.
Isolierte Fälle von Beschwerden der Achillessehne, selten verbunden mit Achillessehnenruptur.
Unbekannt: lmmunvermittelte nekrotisierende Myopathie (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Unerwünschte Wirkungen mit Statinen:
Es wurde sehr selten über immunvermittelte, nekrotisierende Myopathie (IMNM), eine autoimmune Myopathie, unter Therapie mit Statinen berichtet. Die IMNM ist durch proximale Muskelschwäche und erhöhte Serumkreatinkinasespiegel charakterisiert, die trotz Absetzen des Statins bestehen bleiben. Muskeluntersuchungen zeigen eine nekrotisierende Myopathie ohne signifikante Entzündung und immunsuppressive Arzneimittel führen zu einer Verbesserung (siehe «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse).
Nach Markteinführung wurde selten über kognitive Beeinträchtigung (z.B. Gedächtnisverlust, Vergesslichkeit, Amnesie, Einschränkung des Erinnerungsvermögens, Verwirrtheit) unter Therapie mit Statinen, berichtet. Es wurde bei allen Statinen über diese kognitiven Beeinträchtigungen berichtet. Die Berichte sind im Allgemeinen nicht schwerwiegend und reversibel nach Absetzen des Statins, wobei die Zeitspanne in Bezug auf Beginn (1 Tag bis Jahre) und Ende (Median von 3 Wochen) der Symptome unterschiedlich ist.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Es gibt keine besondere Behandlungsempfehlung bei einer Überdosierung mit Ezetimib Simva Spirig HC. Im Fall einer Überdosierung sollten symptomatische und unterstützende Massnahmen ergriffen werden.
Eigenschaften/Wirkungen
ATC-Code
C10BA02
Wirkungsmechanismus
Ezetimib Simva Spirig HC
Das Cholesterin im Plasma stammt aus der intestinalen Resorption und der endogenen Synthese. Ezetimib Simva Spirig HC enthält Ezetimib und Simvastatin, zwei lipidsenkende Stoffe mit komplementären Wirkmechanismen. Ezetimib Simva Spirig HC senkt erhöhte Werte von Gesamtcholesterin, LDL-Cholesterin, Apolipoprotein B, Triglyzeriden, non-HDL-Cholesterin und erhöht den HDL-Cholesterinwert durch die duale Hemmung der Cholesterinresorption und -synthese.
Ezetimib
Ezetimib hemmt die intestinale Cholesterinresorption. Ezetimib ist nach oraler Einnahme wirksam; seine Wirkungsweise unterscheidet sich von den anderen Klassen von cholesterinsenkenden Stoffen (z.B. Statine, Anionenaustauscher [Harze], Fibrinsäurederivate und Phytosterine). Ezetimib bindet an das Steroltransportprotein, Niemann-Pick C1-Like 1 (NPC1L1), das für die Aufnahme von Cholesterin und Phytosterolen im Dünndarm verantwortlich ist.
Ezetimib lagert sich am Bürstensaum des Dünndarms an und hemmt die Cholesterinresorption, was zu einem verminderten Transport von Cholesterin aus dem Darm in die Leber führt. Statine reduzieren die Cholesterinsynthese in der Leber, und gemeinsam führen diese unterschiedlichen Wirkungsmechanismen zu einer komplementären Cholesterinsenkung.
Simvastatin
Nach oraler Aufnahme wird Simvastatin, ein inaktives Lacton, in der Leber zur entsprechenden aktiven Betahydroxysäure hydrolysiert, welche die 3-Hydroxy-3-methylglutaryl-Coenzym A(HMG-CoA)-Reduktase hemmt. Dieses Enzym katalysiert die Umwandlung von HMG-CoA zu Mevalonat, einem frühen und geschwindigkeitsbestimmenden Schritt in der Biosynthese des Cholesterins.
Pharmakodynamik
Siehe «Wirkungsmechanismus».
Klinische Wirksamkeit
In kontrollierten klinischen Studien führte Ezetimib/Simvastatin zu einer signifikanten Reduktion der Werte von Gesamtcholesterin, LDL-Cholesterin, Apolipoprotein B, Triglyzeriden und Non-HDL-Cholesterin und einer Erhöhung von HDL-Cholesterin bei Patienten mit Hypercholesterinämie.
Primäre Hypercholesterinämie
In einer doppelblinden, placebokontrollierten Studie erreichten bei Studienende unter Ezetimib mit Simvastatin signifikant mehr hypercholesterinämische Patienten den NCEP (National Cholesterol Education Program) LDL-Cholesterin-Zielwert (2,6 -4,1 mmol/l) (76%) im Vergleich zu den Patienten unter Placebo mit Simvastatin (21,5%). Die Unterschiede in den entsprechenden Senkungen des LDL-Cholesterins waren signifikant (27% vs. 3%). Ausserdem senkte Ezetimib zusätzlich zu einer laufenden Statin-Therapie im Vergleich zu Placebo signifikant die Werte von Gesamtcholesterin, Apolipoprotein B, Triglyzeriden.
In einer multizentrischen, doppelblinden Studie wurden Patienten mit Typ-2-Diabetes mellitus eingeschlossen; sie wurden mit Thiazolidindionen für mindestens 3 Monate und mit 20 mg Simvastatin mindestens 6 Wochen behandelt und ihr LDL-Cholesterinwert lag im Mittel bei 93 mg/dl. Ezetimib/Simvastatin 10/20 war signifikant wirksamer als die Verdopplung der Simvastatindosis auf 40 mg bei der weiteren Senkung der Werte von LDL-Cholesterin (-21% vs. 0), Gesamtcholesterin (-14% vs. -1%), Apolipoprotein B (-14% vs. –2%) und non-HDL-Cholesterin (-20% vs. –2%) über die bereits mit 20 mg Simvastatin erreichten Senkungen hinaus. Die Ergebnisse hinsichtlich der Werte von HDL-Cholesterin und Triglyzeriden unterschieden sich nicht signifikant zwischen beiden Behandlungsgruppen. Die Ergebnisse wurden nicht durch die Wahl des Thiazolidindions beeinflusst.
In einer multizentrischen, doppelblinden, kontrollierten Studie wurden Patienten mit bekannter KHK oder entsprechenden KHK-Risiken sowie einem LDL-Cholesterinwert ≥130 mg/dl untersucht. Nach 5 Wochen waren die Senkungen der Werte von LDL-Cholesterin unter Ezetimib/Simvastatin 10/10 (-47%), 10/20 (-53%) oder 10/40 (-59%) signifikant grösser als unter 20 mg Simvastatin (-38%). Ausserdem erreichten nach 5 Wochen signifikant mehr Patienten unter Ezetimib/Simvastatin 10/10 (75%), 10/20 (83%) oder 10/40 (88%) den angestrebten LDL-Cholesterin-Zielwert als unter 20 mg Simvastatin (46%). Die Ergebnisse am Ende der Studie (Woche 23) entsprachen denen nach 5 Wochen hinsichtlich der Senkung des LDL-Cholesterinwerts und dem Anteil an Patienten, die den angestrebten LDL-Cholesterin-Zielwert erreichten.
In einer multizentrischen, doppelblinden, placebokontrollierten Studie erhielten hypercholesterinämische Patienten Ezetimib/Simvastatin (10/10, 10/20, 10/40 und 10/80) oder Simvastatin (10 mg, 20 mg, 40 mg oder 80 mg). Ezetimib/Simvastatin senkte im Vergleich zu Simvastatin folgende Werte signifikant stärker (gepoolten Daten aller Ezetimib/Simvastatin-Dosen vs. aller Simvastatin-Dosen): Gesamtcholesterin (-38% vs. –26%), LDL-Cholesterin (-53% vs. –38%), Apolipoprotein B (-42% vs. –29%), Triglyzeride (-28% vs. –15%), non-HDL-Cholesterin (-49% vs. –34%) und C-reaktives Protein (-33% vs. –9%). Die Wirkungen von Ezetimib/Simvastatin auf die Werte von HDL-Cholesterin waren mit den unter Simvastatin beobachteten Werten vergleichbar (+8,2% vs. +7,6%). Eine weitere Analyse zeigte, dass Ezetimib/Simvastatin die Werte von HDL-Cholesterin im Vergleich zu Placebo signifikant erhöhte.
In zwei doppelblinden, randomisierten, placebokontrollierten zwölfwöchigen Studien wurden 1719 Patienten mit primärer Hypercholesterinämie untersucht. Ezetimib 10 mg senkte im Vergleich zu Placebo signifikant die Werte von Gesamtcholesterin (-13%), LDL-Cholesterin (-19%), Apolipoprotein B (-14%) und Triglyzeriden (-8%) und erhöhte die Werte von HDL-Cholesterin (+3%). Ausserdem hatte Ezetimib keinen Einfluss auf die Plasmakonzentrationen der fettlöslichen Vitamine A, D und E, keinen Einfluss auf die Prothrombinzeit, und hatte wie andere lipidsenkende Arzneimittel keine Beeinträchtigung der Produktion von Kortikosteroiden in der Nebennierenrinde zur Folge.
In zwei grossen, plazeobokontrollierten klinischen Studien wurde die Wirkung von Simvastatin bei kardiovaskulären Risiko-Patienten (KHK, Diabetes, peripheren Gefässerkrankungen oder Anamnese von Schlaganfall oder einem anderen zerebrovaskulären Ereignis) untersucht. Simvastatin führte nachweislich zu einer Reduktion des Gesamtmortalitätsrisikos aufgrund der Reduktion KHK bedingter Todesfälle; nicht letaler Myokardinfarkte und Schlaganfälle; sowie der Notwendigkeit koronarer und nicht koronarer revaskularisierender Eingriffe.
Studien zum Nachweis der Wirksamkeit von Ezetimib/Simvastatin bei der Prävention von Komplikationen einer Atherosklerose laufen derzeit noch.
Homozygote familiäre Hypercholesterinämie
In einer doppelblinden, randomisierten Studie wurden Patienten mit klinischer und/oder genotypischer Diagnose einer homozygoten familiären Hypercholesterinämie untersucht. Daten einer Subgruppe mit Patienten (N=14), die zu Studienbeginn 40 mg Simvastatin erhielten, wurden analysiert. Eine Dosiserhöhung von 40 mg auf 80 mg Simvastatin (N=5) führte zu einer Senkung des LDL-Cholesterinwerts um 13% im Vergleich zum Ausgangswert unter 40 mg Simvastatin. Eine Koadministration von Ezetimib und Simvastatin entsprechend Ezetimib/Simvastatin (10/40 und 10/80 gepoolt, N=9) führte zu einer Senkung des LDL-Cholesterinwerts um 23% im Vergleich zum Ausgangswert unter 40 mg Simvastatin. Bei jenen Patienten, die Ezetimib und Simvastatin entsprechend Ezetimib/Simvastatin (10/80, N=5) erhielten, führte dies zu einer Senkung des LDL-Cholesterinwerts um 29% im Vergleich zum Ausgangswert unter 40 mg Simvastatin.
Pharmakokinetik
Absorption
Ezetimib
Nach oraler Gabe wird Ezetimib rasch resorbiert und weitgehend zu einem pharmakologisch aktiven Phenol-Glukuronid (Ezetimib-Glukuronid) konjugiert. Die mittlere Plasmaspitzenkonzentration (Cmax) wird nach 1-2 Stunden für Ezetimib-Glukuronid und nach 4-12 Stunden für Ezetimib erreicht. Die absolute Bioverfügbarkeit von Ezetimib kann nicht bestimmt werden, da die Substanz in wässrigen Lösungen, welche zur Injektion geeignet sind, praktisch unlöslich ist.
Eine gleichzeitige Nahrungsaufnahme (Mahlzeiten mit hohem Fettgehalt oder fettfreie Mahlzeiten) hatte keinen Einfluss auf die orale Bioverfügbarkeit von Ezetimib, wenn es in der Form von 10-mg-Tabletten angewendet wurde.
Simvastatin
Weniger als 5% der verabreichten Dosis ist als Betahydroxysäure (Metabolit) nach oraler Gabe systemisch verfügbar, was mit dem ausgeprägten First-Pass-Effekt in der Leber übereinstimmt. Im menschlichen Plasma sind der Betahydroxysäure-Metabolit und 4 weitere aktive Metaboliten als Hauptmetaboliten von Simvastatin zu finden.
Die Ergebnisse pharmakokinetischer Studien bei einmaliger und multipler Gabe von Simvastatin zeigten, dass die wiederholte Verabreichung des Arzneimittels nicht zu einer Akkumulation führt. In den genannten pharmakokinetischen Studien traten die maximalen Inhibitorkonzentrationen im Plasma zwischen 1,3 und 2,4 Stunden nach der Einnahme auf.
Das Plasmaprofil der aktiven als auch gesamten Inhibitoren wurde im Vergleich zum Nüchternzustand nicht beeinflusst, wenn Simvastatin unmittelbar vor einer Testmahlzeit eingenommen wurde.
Distribution
Ezetimib
Ezetimib ist beim Menschen zu 99,7%, Ezetimib-Glukuronid zu 88-92% an Plasmaproteine gebunden.
Simvastatin
Simvastatin und die Betahydroxysäure sind beim Menschen an Plasmaproteine gebunden (95%).
Metabolismus
Ezetimib
Ezetimib wird vor allem im Dünndarm und der Leber über Glukuronidkonjugation (eine Phase-II-Reaktion) metabolisiert und anschliessend über die Galle ausgeschieden. In allen untersuchten Spezies wurde ein minimaler oxidativer Metabolismus (eine Phase-I-Reaktion) beobachtet. Ezetimib und Ezetimib-Glukuronid sind die hauptsächlich im Plasma nachgewiesenen Substanzen, wobei Ezetimib ca. 10-20% und Ezetimib-Glukuronid ca. 80-90% der Gesamtkonzentration im Plasma ausmachen.
Ezetimib und Ezetimib-Glukuronid werden langsam aus dem Plasma eliminiert mit Hinweis auf einen signifikanten enterohepatischen Kreislauf. Die Halbwertszeit von Ezetimib und Ezetimib-Glukuronid beträgt ca. 22 Stunden.
Simvastatin
Simvastatin wird über CYP3A4 metabolisiert, hat aber keine inhibitorische CYP3A4-Aktivität. Deshalb ist nicht zu erwarten, dass Plasmaspiegel anderer Arzneimittel, die durch CYP3A4 metabolisiert werden, beeinflusst werden. Potente Inhibitoren von CYP3A4 können das Myopathierisiko durch Verminderung der Elimination von Simvastatin erhöhen.
Simvastatin ist ein inaktives Lacton, das in vivo schnell zur entsprechenden Betahydroxysäure, einem wirksamen Inhibitor der HMG-CoA-Reduktase, hydrolysiert wird.
Elimination
Ezetimib
Nach oraler Gabe einer radioaktiv markierten Dosis von 20 mg [14C]Ezetimib an Probanden finden sich ca. 93% der gesamten Radioaktivität im Plasma als Gesamt-Ezetimib. Über einen Beobachtungszeitraum von 10 Tagen wurden ca. 78% der verabreichten radioaktiven Dosis in den Fäzes und 11% im Urin wiedergefunden. Nach 48 Stunden war keine Radioaktivität mehr im Plasma nachweisbar.
Simvastatin
Nach oraler Gabe radioaktiv markierten Simvastatins an Probanden wurden innerhalb von 96 Stunden 13% der Radioaktivität im Urin und 60% in den Fäzes wiedergefunden. Letztere Menge steht sowohl für resorbierte Anteile, die über die Galle ausgeschieden werden, als auch für nicht resorbierte Substanz. Nur durchschnittlich 0,3% einer i.v. Dosis wurden nach intravenöser Injektion des Betahydroxysäure-Metaboliten im Urin als Inhibitoren ausgeschieden. Die Halbwertszeit des Betahydroxysäure-Metaboliten beträgt nach intravenöser Injektion durchschnittlich 1,9 Stunden.
Simvastatinsäure wird durch den Transporter OATP1B1 aktiv in die Hepatozyten aufgenommen.
Kinetik spezieller Patientengruppen
Pädiatrische Patienten
Ezetimib
Resorption und Metabolismus von Ezetimib sind bei Kindern und Jugendlichen (10-18 Jahre) ähnlich wie bei Erwachsenen. Die Pharmakokinetik des Gesamt-Ezetimibes bei Jugendlichen und Erwachsenen unterscheidet sich nicht. Pharmakokinetische Daten für Kinder unter 10 Jahren liegen nicht vor. Klinische Erfahrungen zur Behandlung von Kindern und Jugendlichen (9-17 Jahre) sind auf Patienten mit homozygoter familiärer Hypercholesterinämie oder Sitosterinämie begrenzt.
Simvastatin
Es liegen keine klinischen Daten bei Kindern unter 10 Jahren vor.
Ältere Patienten
Ezetimib
Die Plasmakonzentrationen von Gesamt-Ezetimib sind bei älteren Patienten (ab 65 Jahren) etwa doppelt so hoch wie bei jüngeren Patienten (18-45 Jahre). Die Senkung des LDL-Cholesterinwertes und das Sicherheitsprofil sind jedoch bei älteren und jüngeren mit Ezetimib behandelten Probanden vergleichbar. Deshalb ist keine Dosisanpassung für ältere Patienten erforderlich, allerdings wurden keine spezifischen Studien bei älteren Patienten mit Leber– oder Niereninsuffizienz durchgeführt.
Simvastatin
Eine pharmakokinetische Studie zeigte bei älteren Patienten (70-78 Jahre) ca. 45% höhere mittlere Plasmaspiegel der Statinaktivität verglichen mit 18-30 Jahre alten Patienten.
Leberinsuffizienz
Ezetimib
Nach einer Einzeldosis von 10 mg Ezetimib bei Patienten mit leichter Leberinsuffizienz (Child-Pugh-Score 5 oder 6) war die AUC für Gesamt-Ezetimib ca. 1,7mal grösser als jene für gesunde Probanden. In einer 14-tägigen Studie mit Mehrfachdosierungen (10 mg pro Tag) bei Patienten mit mässiger Leberinsuffizienz (Child-Pugh-Score 7-9) war die mittlere AUC für Gesamt-Ezetimib am 1. und am 14. Tag ca. 4mal grösser als die von gesunden Probanden. Für Patienten mit leichter Leberinsuffizienz ist normalerweise keine Dosisanpassung erforderlich. Da die Folgen einer erhöhten Exposition mit Gesamt-Ezetimib bei Patienten mit mässiger oder mit schwerer Leberinsuffizienz (Child-Pugh-Score >9) nicht bekannt sind, wird Ezetimib für diese Patienten nicht empfohlen (siehe Warnhinweise und Vorsichtsmassnahmen).
Simvastatin
Es gibt keine pharmakokinetische Information zu Simvastatin bei Patienten mit Leberinsuffizienz.
Niereninsuffizienz
Ezetimib
Nach einer Einzeldosis von 10 mg Ezetimib bei Patienten (N = 8) mit schwerer Niereninsuffizienz (mittlere Kreatinin-Clearance ≤30 ml/min) war die durchschnittliche AUC für Gesamt-Ezetimib im Vergleich zu der bei gesunden Probanden (N = 9) um das ca. 1,5fache vergrössert.
Ein Patient in dieser Studie (nach Nierentransplantation, unter multipler Arzneimitteltherapie u.a. Ciclosporin) hatte eine 12fach höhere Exposition mit Gesamt-Ezetimib.
Simvastatin
In einer klinischen Studie zeigte sich bei Patienten mit schwerer Niereninsuffizienz (Kreatinin-Clearance <30 ml/min), dass nach Einmalgabe eines verwandten HMG-CoA-Reduktase-Inhibitors die Plasmaspiegel der Gesamtinhibitoren etwa zweimal höher waren als bei gesunden Probanden.
Geschlecht
Ezetimib
Die Plasmakonzentration von Gesamt-Ezetimib ist bei Frauen etwas höher (<20%) als bei Männern. Unter Therapie mit Ezetimib sind sowohl die Senkung des LDL-Cholesterinwerts als auch das Sicherheitsprofil bei Männern und Frauen vergleichbar. Daher ist keine geschlechtsabhängige Dosisanpassung erforderlich.
Rasse
Ezetimib
Die Metaanalyse der pharmakokinetischen Studien ergab keine pharmakokinetischen Unterschiede zwischen Schwarzen und Kaukasiern.
SLCO1B1 Polymorphismus
Simvastatin
Träger des c.521T>C Allels des SLCO1B1-Gens haben eine niedrigere OATP1B1-Aktivität. Die durchschnittliche Bioverfügbarkeit (AUC) des wichtigsten aktiven Metaboliten, Simvastatinsäure, beträgt 120% bei heterozygoten Trägern (CT) des C-Allels und 221% bei homozygoten Trägern (CC), bezogen auf die von Patienten mit dem häufigsten Genotyp (TT). Das C-Allel hat eine Häufigkeit von 18% in der europäischen Bevölkerung. Bei Patienten mit SLCO1B1 Polymorphismus besteht ein Risiko für eine verstärkte Exposition von Simvastatinsäure, welche zu einem erhöhten Rhabdomyolyserisiko führen kann (siehe «Warnhinweise und Vorsichtsmassnahmen», Myopathie/Rhabdomyolyse).
Präklinische Daten
In Koadministrationsstudien mit Ezetimib und Simvastatin wurden im Wesentlichen die toxischen Effekte beobachtet, die für die Behandlung mit Statinen typisch sind. Manche toxischen Effekte waren stärker ausgeprägt als bei Monotherapie mit Statinen. Dieses wird auf pharmakokinetische und/oder pharmakodynamische Interaktionen bei Koadministrationsbehandlung zurückgeführt. Derartige Interaktionen traten in den klinischen Studien nicht auf.
Myopathien traten bei Ratten nur bei Exposition mit Dosen auf, die um ein Vielfaches über der humantherapeutischen Dosis lagen (ca. 20fache AUC-Konzentration für Simvastatin und 1800fache AUC-Konzentration für den aktiven Metaboliten). Es fanden sich keine Hinweise auf einen Einfluss der gemeinsamen Gabe von Ezetimib auf das myotoxische Potenzial von Simvastatin.
Die gleichzeitige Gabe von Ezetimib und Simvastatin war bei Ratten nicht teratogen. Bei trächtigen Kaninchen wurde eine geringe Anzahl von Skelettmissbildungen (fusionierte Sternebrae, Blockwirbelbildung im Bereich der Schwanzwirbel, verminderte Anzahl an Schwanzwirbeln) beobachtet. Diese erhielten Ezetimib (1000 mg/kg; ≥146fache humantherapeutische Exposition bei 10 mg/Tag basierend auf der AUC0-24 h für Gesamt-Ezetimib) mit Simvastatin (5 mg/kg und 10 mg/kg).
In einer Reihe von in-vivo- und in-vitro-Assays zeigte Ezetimib allein oder zusammen mit Simvastatin kein genotoxisches Potenzial.
Ezetimib
Ezetimib wurde von Mäusen, Ratten und Hunden gut vertragen. In Langzeitstudien wurde keine gezielte Organtoxizität gefunden. Ezetimib zeigte kein teratogenes, genotoxisches oder kanzerogenes Potential in einer Reihe von in-vivo und in-vitro Untersuchungen.
Simvastatin
Basierend auf konventionellen Tierstudien bezüglich Pharmakodynamik, Toxikologie bei Mehrfachdosierungen, Genotoxizität und Karzinogenität wurden für die Patienten keine weiteren Risiken beobachtet, ausser denjenigen, die aufgrund der pharmakologischen Mechanismen erwartet wurden. Bei den verträglichen Maximaldosen in Ratten und Kaninchen führte Simvastatin zu keinen fetalen Missbildungen und hatte keinen Effekt auf die Fruchtbarkeit, Fortpflanzung oder neonatale Entwicklung.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
In der Originalverpackung nicht über 25 °C und ausserhalb der Reichweite von Kindern aufzubewahren.
Zulassungsnummer
66233 (Swissmedic).
Zulassungsinhaberin
Spirig HealthCare AG, Egerkingen.
Stand der Information
April 2019.
Composition
Principes actifs
Ezetimibum et simvastatinum.
Excipients
Acide ascorbique, acide citrique, croscarmellose de sodium, hydroxypropylméthyl-cellulose, monohydrate de lactose, stéarate de magnésium, cellulose microcristalline, antioxydants: gallate de propyle (E310), butylhydroxyanisole (E320), oxyde de fer (E172).
Forme pharmaceutique et quantité de principe actif par unité
Ezétimibe Simva Spirig HC 10/10: Comprimés à 10 mg d'ézétimibe et 10 mg de simvastatine avec l'inscription «511» sur une face.
Ezétimibe Simva Spirig HC 10/20: Comprimés à 10 mg d'ézétimibe et 20 mg de simvastatine avec l'inscription «512» sur une face.
Ezétimibe Simva Spirig HC 10/40: Comprimés à 10 mg d'ézétimibe et 40 mg de simvastatine avec l'inscription «513» sur une face.
Ezétimibe Simva Spirig HC 10/80: Comprimés à 10 mg d'ézétimibe et 80 mg de simvastatine avec l'inscription «515» sur une face».
Indications/Possibilités d’emploi
Hypercholestérolémie primaire
Ezétimibe Simva Spirig HC diminue, lorsqu'il est utilisé en accompagnement d'un régime, les valeurs trop élevées de cholestérol total, de cholestérol LDL, d'apolipoprotéine B, de triglycérides ainsi que de cholestérol non HDL et augmente le cholestérol HDL chez les patients atteints d'hypercholestérolémie primaire (familiale hétérozygote et non familiale) ou d'hyperlipidémie mixte.
Hypercholestérolémie familiale homozygote
Ezétimibe Simva Spirig HC diminue les valeurs trop élevées de cholestérol total et de cholestérol LDL chez les patients atteints d'hypercholestérolémie familiale homozygote. Les patients peuvent bénéficier d'autres traitements concomitants (comme par exemple une aphérèse LDL).
Posologie/Mode d’emploi
Avant de commencer le traitement avec Ezétimibe Simva Spirig HC, le patient devrait suivre un régime hypolipémiant approprié, lequel devrait être poursuivi pendant le traitement avec Ezétimibe Simva Spirig HC.
Posologie chez les patients atteints d'hypercholestérolémie primaire
La posologie doit être déterminée individuellement pour chaque patient en fonction des taux initiaux de cholestérol LDL, des objectifs thérapeutiques recommandés et de la réponse du patient au traitement.
Ezétimibe Simva Spirig HC doit être pris en une seule fois, le soir, indépendamment des repas.
La fourchette des doses se situe entre 10/10 mg par jour et 10/80 mg par jour. La dose recommandée au début du traitement est de 10/10 mg par jour. Après le début du traitement ou le titrage d'Ezétimibe Simva Spirig HC, les taux lipidiques doivent être contrôlés après 2 à 4 semaines, et la dose peut éventuellement être adaptée sans dépasser 10/40 mg par jour lors de l'instauration d'un nouveau traitement. En raison du risque accru de myopathies, y compris de rhabdomyolyse, la posologie de 10/80 mg doit rester réservée aux patients prenant 10/80 mg d'Ezétimibe Simva Spirig HC de façon chronique sans signes de toxicité musculaire.
À cause de ce risque, les patients chez lesquels une réduction suffisante du taux de cholestérol LDL n'est pas atteinte avec 10/40 mg ne doivent pas passer à 10/80 mg d'Ezétimibe Simva Spirig HC, mais à un traitement pour baisser le taux de cholestérol LDL alternatif permettant une réduction plus prononcée du taux de cholestérol LDL. Le risque de myopathie est en principe un effet de classe connu dépendant de la dose pour toutes les statines (voir «Mises en garde et précautions», Myopathie/Rhabdomyolyse).
Posologie chez les patients atteints d'hypercholestérolémie familiale homozygote
La dose recommandée pour les patients atteints d'hypercholestérolémie familiale homozygote est de 10/40 mg d'Ezétimibe Simva Spirig HC par jour. Chez ces patients, Ezétimibe Simva Spirig HC doit être pris en complément à d'autres traitements hypolipémiants (par ex. l'aphérèse LDL) ou lorsque ces traitements ne sont pas disponibles.
Chez des patients sous traitement concomitante d'Ezétimibe Simva Spirig HC et de lomitapide, la dose d'Ezétimibe Simva Spirig HC ne devrait pas dépasser 10/40 mg par jour (voir «Mises en garde et précautions», Myopathie/rhabdomyolyse et «Interactions»).
Emploi en cas d'insuffisance hépatique
Chez les patients atteints d'une insuffisance hépatique légère (score de Child Pugh 5-6), aucune adaptation posologique n'est nécessaire.
Chez les patients atteints d'une insuffisance hépatique modérée (score de Child Pugh 7-9) ou sévère (score de Child Pugh >9), un traitement avec Ezétimibe Simva Spirig HC n'est pas indiqué (voir «Contre-indications», «Mises en garde et précautions» et «Pharmacocinétique», Cinétique pour certains groupes de patients).
Emploi en cas de troubles de la fonction rénale
Aucune adaptation posologique n'est nécessaire chez les patients atteints d'insuffisance rénale modérée. Lorsque le traitement de patients atteints de troubles sévères de la fonction rénale (clairance de la créatinine ≤30 ml/min) est considéré comme nécessaire, la prescription de doses supérieures à 10/10 mg par jour requiert une prudence particulière (voir «Pharmacocinétique», Cinétique pour certains groupes de patients).
Emploi chez des patients âgés
Un âge avancé (≥65 ans) étant un facteur de prédisposition aux myopathies, la prudence est de rigueur lors d'une utilisation d'Ezétimibe Simva Spirig HC chez le patient âgé. Dans une étude clinique au cours de laquelle les patients ont reçu 80 mg de simvastatine par jour, les patients âgés de ≥65 ans ont présenté un risque accru de myopathie en comparaison avec les patients âgés de moins de 65 ans.
Emploi chez les enfants et les adolescents
L'emploi d'Ezétimibe Simva Spirig HC chez les enfants et les adolescents de moins de 18 ans n'est pas recommandé.
Administration simultanée avec d'autres médicaments
La prise d'Ezétimibe Simva Spirig HC devra se faire au moins 2 heures avant ou au moins 4 heures après l'utilisation d'un échangeur d'anions (voir «Interactions», Cholestyramine).
Lors de l'administration concomitante d'Ezétimibe Simva Spirig HC et de vérapamil ou de diltiazem, la dose de 10/10 mg par jour d'Ezétimibe Simva Spirig HC ne doit pas être dépassée.
Lors d'une administration concomitante d'Ezétimibe Simva Spirig HC et d'amiodarone, d'amlodipine ou de ranolazine, la dose d'Ezétimibe Simva Spirig HC de 10/20 mg par jour ne doit pas être dépassée (voir «Mises en garde et précautions», Myopathie/Rhabdomyolyse, et «Interactions»).
La tolérance et l'efficacité de l'ézétimibe en association avec des fibrates n'ont pas été étudiées (sauf avec le fénofibrate). L'emploi d'Ezétimibe Simva Spirig HC avec des fibrates n'est donc pas recommandé (voir «Contre-indications», «Mises en garde et précautions», Myopathie/Rhabdomyolyse, et sous «Interactions»).
La tolérance et l'efficacité l'ézétimibe en association avec des médicaments contenant de l'elbasvir ou du grazoprévir n'ont pas été étudiées; cependant, l'utilisation concomitante peut entraîner une augmentation des concentrations plasmatiques de la simvastatine. L'utilisation concomitante n'est donc pas recommandée (voir «Mises en garde et précautions», Myopathie/Rhabdomyolyse et «Interactions»).
Contre-indications
- Hypersensibilité vis-à-vis de l'un des principes actifs ou de l'un des excipients.
- Affection hépatique active ou élévation persistante et inexpliquée des transaminases sériques.
- Grossesse et allaitement (voir «Grossesse/Allaitement»).
- Utilisation concomitante d'inhibiteurs puissants du CYP3A4 (par exemple itraconazole, kétoconazole, posaconazole, voriconazole, inhibiteurs de la protéase du VIH, bocéprévir, télaprévir, érythromycine, clarithromycine, télithromycine, néfazodone et médicaments contenant du cobicistat) (voir «Mises en garde et précautions», Myopathie/Rhabdomyolyse et «Interactions»)
- Utilisation concomitante de gemfibrozil, de ciclosporine ou de danazol (voir «Mises en garde et précautions», Myopathie/Rhabdomyolyse et «Interactions»).
Mises en garde et précautions
Myopathie/Rhabdomyolyse
Comme d'autres inhibiteurs de la HMG-CoA-réductase, la simvastatine provoque occasionnellement une myopathie se manifestant sous la forme de douleurs musculaires, de faiblesse musculaire ou de sensibilité musculaire, en présence d'un taux accru (10 fois la limite supérieure de la norme) de créatine kinase (CK).
Une myopathie peut parfois survenir sous forme de rhabdomyolyse avec ou sans insuffisance rénale aiguë due à une myoglobinurie, rarement avec une issue fatale. Le risque de myopathie augmente en cas d'activité inhibitrice plasmatique élevée de la HMG-CoA-réductase (c'est-à-dire en cas de concentrations plasmatiques élevées de simvastatine et de simvastatine acide), qui peut être provoquée en partie par des interactions avec des médicaments qui interfèrent avec le métabolisme de la simvastatine et/ou les voies de signalisation de transporteurs (voir «Interactions»).
Dans une étude clinique randomisée et contrôlée, avec une durée d'observation médiane de 4,9 ans, plus de 9000 patients souffrant d'une affection rénale chronique ont reçu ézétimibe/simvastatine 10/20 mg par jour (n = 4650) ou un placebo (n = 4620). L'incidence de myopathie/rhabdomyolyse a été de 0,2% sous ézétimibe/simvastatine et de 0,1% sous placebo.
La prescription de médicaments contenant des statines à des patients présentant des facteurs prédisposant à une rhabdomyolyse requiert une prudence particulière. Une détermination du taux de créatine kinase devrait être réalisée avant le début du traitement avec des médicaments qui contiennent des statines dans les situations suivantes:
- Insuffisance rénale
- Hypothyroïdie non contrôlée
- Antécédents personnels ou familiaux de troubles musculaires héréditaires
- Antécédents de toxicité musculaire avec une statine ou un fibrate
- Dépendance à l'alcool
- Chez les personnes âgées (≥65 ans), la nécessité d'une telle mesure devrait être envisagée en fonction de la présence d'autres facteurs prédisposant à une rhabdomyolyse
- Sexe féminin
Dans ces situations, le risque d'un traitement devrait être considéré dans l'optique du bénéfice escompté et une surveillance clinique est recommandée.
Le traitement ne doit pas être instauré en présence de valeurs initiales de CK significativement élevées (>5 fois la limite supérieure de la norme, LSN).
Tous les patients qui commencent un traitement avec Ezétimibe Simva Spirig HC ou chez lesquels la dose d'Ezétimibe Simva Spirig HC doit être augmentée doivent être informés du risque de myopathie et incités à annoncer immédiatement toute manifestation éventuelle de signes comme une myalgie inexpliquée, une sensibilité de la musculature ou une faiblesse musculaire.
En cas de diagnostic ou de suspicion de myopathie, le traitement d'Ezétimibe Simva Spirig HC doit être interrompu immédiatement. L'apparition de ces symptômes et un taux de CK >10× LSN sont des indices de myopathie. Dans la plupart des cas, les symptômes musculaires et les taux de CK régressent si le traitement est interrompu immédiatement (voir «Effets indésirables»).
Des contrôles périodiques de la CK doivent être envisagés chez les patients qui débutent un traitement avec Ezétimibe Simva Spirig HC ou chez lesquels la dose doit être augmentée. Des dosages périodiques de la CK sont recommandés chez les patients avec titrage de la dose à 10/80 mg. Ces examens ne sont toutefois pas à même de garantir que l'apparition d'une myopathie puisse être évitée.
La créatine kinase (CK) ne devrait pas être mesurée après un effort physique ou en présence d'une autre cause plausible d'une hausse de la CK, car ces circonstances rendent plus difficile l'interprétation des résultats des mesures. Si les valeurs initiales de CK sont significativement augmentées (>5× LSN), la mesure devra être répétée en l'espace de 5 à 7 jours afin de confirmer les résultats.
En cas de myalgies, de faiblesse musculaire ou de crampes musculaires apparaissant chez un patient traité avec Ezétimibe Simva Spirig HC, il faut mesurer le taux de CK. Si ces valeurs sont significativement augmentées (>5× LSN), le traitement doit être interrompu.
Si les symptômes musculaires sont sévères et occasionnent des troubles quotidiens, une interruption du traitement devra être envisagée même si les taux de CK se situent dans la fourchette des valeurs ≤5× LSN.
Si les symptômes régressent complètement et si les taux de CK reviennent à la normale, une reprise du traitement par Ezétimibe Simva Spirig HC ou un traitement par un autre médicament contenant une statine à la dose la plus faible possible peuvent être envisagés sous une surveillance étroite du patient.
Parmi les patients ayant développé une rhabdomyolyse sous une thérapie de simvastatine, un grand nombre présentait des facteurs aggravants dans les antécédents, y compris une insuffisance rénale, généralement comme conséquence d'un diabète sucré prolongé. Ces patients requièrent une surveillance plus étroite. Le traitement par Ezétimibe Simva Spirig HC devrait être suspendu temporairement quelques jours avant une intervention chirurgicale élective majeure, ainsi que lors de l'apparition d'un problème médical ou chirurgical significatif.
Comme pour les autres inhibiteurs de la HMG-CoA-réductase, le risque de myopathie/rhabdomyolyse est dépendant de la dose.
Dans une base de données d'études cliniques incluant 41413 patients traités à la simvastatine, dont 24747 patients (environ 60%) inclus dans des études avec une durée de suivi médiane d'au moins 4 ans, l'incidence de myopathies était d'environ 0,03% avec la dose de 20 mg par jour, de 0,08% avec 40 mg par jour et de 0,61% avec 80 mg par jour. Les patients inclus dans ces études étaient surveillés soigneusement et certains médicaments susceptibles d'interagir avec le traitement étaient exclus.
Dans une étude clinique dans laquelle des patients ayant des antécédents d'infarctus du myocarde ont reçu 80 mg de simvastatine par jour (suivi d'une durée moyenne de 6,7 ans), l'incidence de myopathies était d'environ 1,0%, par rapport à 0,02% chez les patients traités avec la dose de 20 mg par jour. Environ la moitié des cas de myopathie ont été observés au cours de la première année de traitement. Dans chacune des années suivantes du traitement, l'incidence de myopathies a été d'environ 0,1%.
Chez les patients traités avec 80 mg de simvastatine, le risque de développer une myopathie est plus élevé qu'avec d'autres traitements à base de statines offrant une efficacité similaire pour baisser le taux de cholestérol LDL. La dose de 10/80 mg d'Ezétimibe Simva Spirig HC ne doit donc être utilisée que chez les patients prenant 10/80 mg d'Ezétimibe Simva Spirig HC de façon chronique sans signes de toxicité musculaire. Un traitement alternatif à base de statines-ézétimibe, présentant un faible potentiel d'interactions médicamenteuses, doit être utilisé chez les patients sous 10/80 mg d'Ezétimibe Simva Spirig HC chez lesquels il devient nécessaire d'utiliser une substance ayant un potentiel d'interactions (voir ci-dessous, sous «Posologie/Mode d'emploi» et «Contre-indications»).
Dans une étude clinique avec traitement de patients à risque cardio-vasculaire élevé par 40 mg de simvastatine par jour (durée moyenne de suivi: 3,9 ans), l'incidence de myopathie était d'environ 0,05% chez les patients d'origine non chinoise (n = 7367), par rapport à 0,24% chez les patients d'origine chinoise (n = 5468). Les Chinois étant la seule population asiatique incluse dans cette étude clinique, l'Ezétimibe Simva Spirig HC doit être prescrit avec prudence et à la plus faible dose nécessaire chez les patients asiatiques.
Myopathie nécrosante immuno-médiée (IMNM)
De très rares cas de myopathie nécrosante immuno-médiée (immune-mediated necrotizing myopathy; IMNM) ont été rapportés pendant ou après le traitement par certaines statines. Les caractéristiques cliniques d'une IMNM sont une faiblesse musculaire proximale persistante et des taux sériques élevés de créatine-kinase qui persistent malgré l'arrêt du traitement par statines.
Fonction réduite des protéines de transport
En cas de fonction réduite de la protéine de transport hépatique OATP, l'exposition systémique à la simvastatine acide ainsi que le risque de myopathie et de rhabdomyolyse peuvent être augmentés. Une fonction réduite peut être due à une inhibition liée à une interaction médicamenteuse (par exemple avec la ciclosporine) ou chez les patients porteurs du génotype SLCO1B1 c.521T>C.
Les patients porteurs de l'allèle c.521T>C du gène SLCO1B1 codant une protéine OATP1B1 moins active présentent une exposition systémique accrue à la simvastatine acide et un plus grand risque de myopathie. Le risque de myopathie liée à une forte dose de simvastatine (80 mg) est d'environ 1% en général, sans test génétique. Selon les résultats de l'essai SEARCH, les porteurs homozygotes de l'allèle C (également appelés CC) traités avec une dose de 80 mg présentent un risque de myopathie de 15% sur un an, contre un risque de 1,5% chez les porteurs hétérozygotes de l'allèle C (CT). Le risque correspondant est de 0,3% chez les patients présentant le génotype le plus courant (TT) (voir «Pharmacocinétique»). S'il est connu, le génotype correspondant à la présence de l'allèle C devrait être pris en considération lors de l'évaluation du bénéfice/risque du patient avant de prescrire une dose de 80 mg de simvastatine et les doses élevées devraient être évitées chez les porteurs du génotype CC. Cependant, l'absence de ce gène, une fois le génotype établi, n'exclut pas la survenue d'une myopathie.
Interactions médicamenteuses
Étant donné qu'Ezétimibe Simva Spirig HC contient de la simvastatine, le risque d'une myopathie/rhabdomyolyse peut augmenter lors d'un emploi simultané d'Ezétimibe Simva Spirig HC et des médicaments suivants (voir «Interactions»):
Médicaments contre-indiqués
Inhibiteurs puissants du CYP3A4: l'utilisation concomitante de médicaments qui sont de puissants inhibiteurs du CYP3A4 aux doses thérapeutiques (p.ex. itraconazole, kétoconazole, posaconazole, voriconazole, érythromycine, clarithromycine, télithromycine, inhibiteurs de la protéase du VIH, bocéprévir, télaprévir, néfazodone ou médicaments contenant du cobicistat) est contre-indiquée. Si le traitement de courte durée par des inhibiteurs puissants du CYP3A4 est inévitable, le traitement par Ezétimibe Simva Spirig HC doit être suspendu pendant la durée de ces traitements (voir «Contre-indications», «Interactions» et «Pharmacocinétique»).
Gemfibrozil, ciclosporine ou danazol: l'utilisation concomitante d'Ezétimibe Simva Spirig HC et de ces médicaments est contre-indiquée (voir «Contre-indications», «Interactions» et «Pharmacocinétique»).
Autres médicaments:
Acide fusidique: les inhibiteurs de la HMG-CoA-réductase (statines), y compris Ezétimibe Simva Spirig HC, ne doivent pas être associés à des préparations systémiques à base d'acide fusidique. Des cas de rhabdomyolyse (y compris quelques décès) ont été rapportés chez des patients ayant reçu des préparations systémiques à base d'acide fusidique associées à des statines (voir «Interactions»). Le traitement par Ezétimibe Simva Spirig HC doit être interrompu pendant un traitement systémique par acide fusidique jugé indispensable. Il doit être indiqué aux patients de consulter immédiatement un médecin s'ils notent des signes de faiblesse, douleur ou sensibilité dans les muscles. Le traitement par statines peut être poursuivi 7 jours après la dernière dose d'acide fusidique. Dans des situations exceptionnelles, si un traitement systémique ininterrompu à l'acide fusidique est nécessaire, l'utilisation concomitante d'Ezétimibe Simva Spirig HC et de l'acide fusidique ne doit être envisagée qu'au cas par cas et sous surveillance médicale étroite.
Fibrates: la sécurité et l'efficacité de l'emploi d'ézétimibe/simvastatine en même temps que des fibrates (à l'exception du fénofibrate) n'ont pas fait l'objet d'études. L'emploi simultané d'Ezétimibe Simva Spirig HC avec des fibrates n'est donc pas recommandé. L'utilisation concomitante de gemfibrozil est contre-indiquée (voir «Contre-indications»).
Amiodarone: dans une étude clinique, une myopathie a été rapportée chez 6% des patients ayant reçu 80 mg de simvastatine en association avec de l'amiodarone (voir «Interactions»). Lors de l'emploi simultané d'amiodarone, la dose de 10/20 mg d'Ezétimibe Simva Spirig HC par jour ne devra pas être dépassée.
Bloqueurs des canaux calciques:
Vérapamil ou diltiazem: dans une étude clinique, un risque accru de myopathie a été observé chez les patients ayant reçu 80 mg de simvastatine en association avec le diltiazem. Chez les patients recevant simultanément du vérapamil ou du diltiazem, la dose de 10/10 mg d'Ezétimibe Simva Spirig HC par jour ne devra pas être dépassée (voir «Interactions», Autres interactions).
Amlodipine: dans une étude clinique, les patients traités simultanément à l'amlodipine et à la simvastatine 80 mg ont présenté un risque légèrement accru de myopathie (voir «Interactions», Autres interactions). Chez les patients prenant en même temps de l'amlodipine, la dose d'Ezétimibe Simva Spirig HC ne devrait pas dépasser 10/20 mg par jour.
Lomitapide: chez les patients présentant une hypercholestérolémie familiale homozygote et avec administration concomitante de lomitapide, la dose d'Ezétimibe Simva Spirig HC ne devrait pas dépasser 10/40 mg par jour (voir «Interactions», Autres interactions).
Inhibiteurs modérés du CYP3A4: les patients recevant simultanément Ezétimibe Simva Spirig HC et des médicaments exerçant un effet modérément inhibiteur sur le CYP3A4 peuvent présenter un risque accru de myopathie, surtout si la dose d'Ezétimibe Simva Spirig HC est élevée. Un ajustement de la posologie d'Ezétimibe Simva Spirig HC peut éventuellement être nécessaire lors d'une utilisation concomitante d'Ezétimibe Simva Spirig HC et d'un inhibiteur modéré du CYP3A4.
Inhibiteurs de la Breast Cancer Resistance Protein (BCRP): l'administration concomitante de médicaments qui sont des inhibiteurs de la BCRP (p.ex. l'elbasvir et le grazoprévir) peut entraîner des concentrations plasmatiques élevées de simvastatine et un risque accru de myopathie. L'association d'elbasvir et de grazoprévir à la simvastatine n'a pas été étudiée; par conséquent, l'administration simultanée d'Ezétimibe Simva Spirig HC avec des médicaments contenant de l'elbasvir ou du grazoprévir n'est pas recommandée (voir «Interactions», Autres interactions).
Anticoagulants: lors d'un traitement simultané à la warfarine ou à d'autres antagonistes de la vitamine K (tels que Marcoumar, Sintrom), le temps de Quick ou l'INR devraient être déterminés à intervalles rapprochés (voir «Interactions»).
Niacine (≥1 g par jour): des cas de myopathie/rhabdomyolyse ont été observés lors d'une utilisation concomitante de simvastatine et de doses de niacine (≥1 g par jour) modifiant les lipides. Dans une étude clinique (avec une durée de suivi moyenne de 3,9 ans) des patients à risque cardio-vasculaire élevé ont été inclus qui avaient atteint un bon contrôle du taux de LDL-C sous un traitement par 40 mg de simvastatine par jour avec ou sans ajout de 10 mg d'ézétimibe. L'ajout de doses de niacine (≥1 g par jour) modifiant les lipides n'a apporté aucun bénéfice supplémentaire concernant les événements cardio-vasculaires. Le bénéfice d'une administration concomitante de simvastatine et de niacine doit donc être soupesé soigneusement face au risque d'une telle association médicamenteuse. De plus, l'incidence de myopathie dans cette étude était d'environ 0,24% chez les patients chinois sous simvastatine 40 mg ou ézétimibe/simvastatine 10/40 mg, par rapport à une incidence de 1,24% chez les patients chinois sous simvastatine 40 mg ou ézétimibe/simvastatine 10/40 mg qui recevaient en même temps une association de niacine/laropiprant 2 g/40 mg à libération prolongée. Les Chinois étant la seule population asiatique dans cette étude et le risque de myopathie étant plus élevé chez les patients chinois que chez les patients non chinois, l'utilisation concomitante d'Ezétimibe Simva Spirig HC et de doses de niacine (≥1 g/jour) modifiant les lipides n'est pas recommandée chez les patients asiatiques (voir «Interactions», Autres interactions).
Daptomycine: des cas de myopathie et/ou de rhabdomyolyse ont été observés lors de l'administration simultanée d'inhibiteurs de la HMG-CoA-réductase et de daptomycine. La prudence est de mise lors de la prescription d'inhibiteurs de la HMG-CoA-réductase avec de la daptomycine, car chacun de ces deux médicaments administré seul peut provoquer une myopathie et/ou une rhabdomyolyse. Il est généralement recommandé d'arrêter temporairement Ezétimibe Simva Spirig HC chez les patients traités par la daptomycine (voir «Interactions», Autres interactions).
Jus de pamplemousse
Vu les interactions possibles (inhibition du CYP3A4), les patients doivent être instruits de ne pas boire de jus de pamplemousse (voir «Interactions», Autres interactions).
Enzymes hépatiques
Des augmentations des transaminases (≥3× LSN) ont été observées dans le cadre d'études contrôlées sur l'association d'ézétimibe avec une statine.
Dans une étude clinique randomisée et contrôlée, avec une durée d'observation médiane de 4,9 ans, plus de 9000 patients souffrant d'une affection rénale chronique ont reçu ézétimibe/simvastatine 10/20 mg par jour (n = 4650) ou un placebo (n = 4620). L'incidence de valeurs de transaminases augmentées de façon répétée (à >3× la LSN) a été de 0,7% sous ézétimibe/simvastatine et de 0,6% sous placebo.
Des contrôles de la fonction hépatique sont recommandés avant le début du traitement ainsi que chaque fois qu'il existe une indication clinique. Chez les patients qui passent à la dose de 10/80 mg, des déterminations supplémentaires avant le passage à la dose de 10/80 mg, 3 mois après l'augmentation de la dose et, par la suite, à des intervalles réguliers (par exemple tous les six mois) sont indiquées durant la première année de traitement. Chez les patients qui, durant le traitement, développent des augmentations des transaminases sériques, les déterminations doivent être répétées immédiatement, puis à intervalles rapprochés. Dans les cas où les augmentations des transaminases progressent, en particulier si elles atteignent des valeurs égales au triple de la limite supérieure de la norme et s'y maintiennent, le médicament doit être arrêté. Il faut tenir compte du fait que l'ALAT peut provenir du muscle et que des valeurs d'ALAT et de CK augmentées simultanément peuvent indiquer une myopathie (voir «Mises en garde et précautions», Myopathie/Rhabdomyolyse).
Après l'introduction sur le marché, on a rapporté dans de rares cas une défaillance hépatique mortelle ou non mortelle chez des patients sous statines, y compris sous simvastatine. Le traitement par Ezétimibe Simva Spirig HC doit être interrompu immédiatement si des atteintes hépatiques sévères accompagnées de symptômes cliniques et/ou d'hyperbilirubinémie ou d'ictère se développent au cours du traitement par Ezétimibe Simva Spirig HC. Le traitement par Ezétimibe Simva Spirig HC ne doit pas être repris si aucune autre cause de la maladie n'est constatée.
L'emploi d'Ezétimibe Simva Spirig HC requiert une prudence particulière chez les patients qui consomment de grandes quantités d'alcool et/ou dont l'anamnèse fait état d'une affection hépatique. Les affections hépatiques aiguës ou les augmentations persistantes inexpliquées des transaminases constituent des contre-indications.
Insuffisance hépatique
En raison de l'absence de données sur les effets d'une exposition accrue à l'ézétimibe chez des patients atteints d'insuffisance hépatique modérée à sévère, Ezétimibe Simva Spirig HC n'est pas recommandé chez ces patients (voir «Pharmacocinétique» et «Contre-indications»).
Diabète sucré
Il existe certains indices suggérant un effet de classe des statines dans le sens d'une augmentation de la glycémie. Chez certains patients qui présentent un risque élevé de développer un diabète à l'avenir, cet effet peut provoquer un degré d'hyperglycémie exigeant un traitement antidiabétique adéquat. Cela ne doit toutefois pas conduire à l'arrêt d'utilisation des statines, étant donné que la réduction du risque vasculaire grâce aux statines l'emporte sur le risque de diabète. Les patients à risque de diabète (glycémie à jeun de 5,6 à 6,9 mmol/l, IMC >30 kg/m², taux accru de triglycérides, hypertension artérielle) doivent être surveillés quant aux manifestations cliniques et aux paramètres biochimiques (voir «Effets indésirables»).
Yeux
En l'absence de tout traitement médicamenteux, on doit s'attendre – suite au processus de vieillissement des yeux – à une prévalence accrue d'opacifications du cristallin. Les données actuellement disponibles d'études cliniques contrôlées à long terme sur la simvastatine ne fournissent aucun indice d'effets défavorables de la simvastatine sur le cristallin chez l'homme.
Interactions
Plusieurs mécanismes peuvent contribuer à des interactions potentielles avec des inhibiteurs de la HMG-CoA-réductase. Les médicaments ou les produits à base de plantes qui inhibent certaines enzymes (par ex. le CYP3A4) et/ou des voies de signalisation de transporteurs (par ex. OATP1B) peuvent augmenter les concentrations plasmatiques de simvastatine et de simvastatine acide, et entraîner de ce fait une élévation du risque de myopathie/rhabdomyolyse.
Veuillez tenir compte des informations professionnelles de tous les médicaments co-administrés, afin d'obtenir plus d'informations sur leurs interactions potentielles avec la simvastatine et/ou sur des modifications potentielles des enzymes ou des transporteurs, ainsi que sur d'éventuels ajustements de la posologie et du régime.
Médicaments contre-indiqués:
L'administration concomitante des médicaments suivants est contre-indiquée:
Inhibiteurs puissants du CYP3A4
La simvastatine est métabolisée par le CYP3A4 mais n'exerce pas d'effet inhibiteur sur le CYP3A4. C'est pourquoi on ne s'attend pas à observer une influence sur les taux plasmatiques d'autres médicaments métabolisés par le CYP3A4. Les inhibiteurs puissants ci-après du CYP3A4 peuvent augmenter le risque de myopathie en raison d'une élimination réduite de la composante simvastatine d'Ezétimibe Simva Spirig HC: l'administration concomitante de médicaments qui sont des inhibiteurs puissants du CYP3A4 aux doses thérapeutiques (p.ex. itraconazole, kétoconazole, posaconazole, voriconazole, érythromycine, clarithromycine, télithromycine, inhibiteurs de la protéase du VIH, bocéprévir, télaprévir, néfazodone, médicaments contenant du cobicistat) est contre-indiquée (voir «Contre-indications», «Mises en garde et précautions», Myopathie/Rhabdomyolyse et «Pharmacocinétique»).
Gemfibrozil, ciclosporine ou danazol: voir «Contre-indications», «Mises en garde et précautions», Myopathie/Rhabdomyolyse et «Pharmacocinétique»).
Interactions pharmacocinétiques
Le tableau ci-dessous donne un aperçu des recommandations concernant la prescription des médicaments présentant un risque d'interaction (pour plus de détails dans le texte, voir «Posologie/Mode d'emploi», «Contre-indications» et «Mises en garde et précautions»).
Interactions médicamenteuses associées à un risque accru de myopathie/rhabdomyolyse
Agents capables d'interagir | Recommandations concernant la prescription |
Inhibiteurs puissants du CYP3A4, p.ex.: Itraconazole Kétoconazole Posaconazole Voriconazole Érythromycine Clarithromycine Télithromycine Inhibiteurs de la protéase du VIH Bocéprévir Télaprévir Néfazodone Cobicistat Ciclosporine Danazol Gemfibrozil | Association avec Ezétimibe Simva Spirig HC contre-indiquée |
Autres fibrates | Déconseillés avec Ezétimibe Simva Spirig HC |
Elbasvir Grazoprévir | Déconseillés avec Ezétimibe Simva Spirig HC |
Acide fusidique | Déconseillé avec Ezétimibe Simva Spirig HC |
Niacine (≥1 g/jour) | Chez les patients asiatiques déconseillé avec Ezétimibe Simva Spirig HC |
Vérapamil Diltiazem | Ne pas dépasser une dose de 10/10 mg d'Ezétimibe Simva Spirig HC par jour |
Amiodarone Amlodipine | Ne pas dépasser une dose de 10/20 mg d'Ezétimibe Simva Spirig HC par jour |
Lomitapide | Ne pas dépasser une dose de 10/40 mg d'Ezétimibe Simva Spirig HC par jour chez les patients présentant une hypercholestérolémie familiale homozygote |
Daptomycine | Déconseillée avec Ezétimibe Simva Spirig HC |
Jus de pamplemousse | Éviter le jus de pamplemousse pendant le traitement par Ezétimibe Simva Spirig HC |
Autres interactions
Fibrates (voir Médicaments contre-indiqués dans cette rubrique):
L'administration simultanée de fénofibrate augmente les concentrations totales d'ézétimibe d'environ 1,5 fois. La sécurité et l'efficacité d'emploi d'ézétimibe/simvastatine administré en association avec des fibrates n'ont pas été étudiées. Ainsi, l'administration simultanée d'Ezétimibe Simva Spirig HC et de fibrates n'est pas recommandée.
Préparations systémiques à base d'acide fusidique:
Des cas de rhabdomyolyse (y compris quelques décès) ont été rapportés chez des patients qui recevaient des préparations systémiques à base d'acide fusidique associées à des statines, y compris Ezétimibe Simva Spirig HC (voir «Mises en garde et précautions»). Le mécanisme de cette interaction n'est pas connu. Le traitement par Ezétimibe Simva Spirig HC doit être interrompu pendant un traitement systémique par acide fusidique jugé indispensable. Le traitement par Ezétimibe Simva Spirig HC peut être repris sept jours après l'administration de la dernière dose d'acide fusidique.
Amiodarone:
Le risque de myopathie/rhabdomyolyse augmente lors d'un traitement d'Ezétimibe Simva Spirig HC en association avec l'amiodarone (voir «Posologie/Mode d'emploi», «Mises en garde et précautions», Myopathie/Rhabdomyolyse). Dans une étude clinique, une myopathie a été rapportée chez 6% des patients traités avec 80 mg de simvastatine en association avec l'amiodarone. La dose d'Ezétimibe Simva Spirig HC ne doit par conséquent pas dépasser 10/20 mg par jour lors d'une association avec l'amiodarone.
Bloqueurs des canaux calciques:
Vérapamil: le risque de myopathie/rhabdomyolyse est accru lors d'une utilisation concomitante de 10/40 mg ou de 10/80 mg d'Ezétimibe Simva Spirig HC et de vérapamil (voir «Mises en garde et précautions», Myopathie/Rhabdomyolyse). Dans une étude pharmacocinétique, une administration de simvastatine en association avec le vérapamil a conduit à une multiplication par 2,3 de l'exposition à la simvastatine acide. Cet effet était probablement dû en partie à une inhibition du CYP3A4. La dose d'Ezétimibe Simva Spirig HC ne doit par conséquent pas dépasser 10/10 mg par jour lors d'une association avec le vérapamil.
Diltiazem: le risque de myopathie/rhabdomyolyse est accru lors d'une utilisation concomitante de diltiazem et d'Ezétimibe Simva Spirig HC 10/80 (voir «Mises en garde et précautions», Myopathie/Rhabdomyolyse). Dans une étude pharmacocinétique, une administration de simvastatine en association avec le diltiazem a conduit à une multiplication par 2,7 de l'exposition à la simvastatine acide. Cet effet était probablement dû en partie à une inhibition du CYP3A4. La dose d'Ezétimibe Simva Spirig HC ne doit par conséquent pas dépasser 10/10 mg par jour lors d'une association avec le diltiazem.
Amlodipine: les patients traités simultanément par l'amlodipine et Ezétimibe Simva Spirig HC 10/80 présentent un risque de myopathie accru (voir «Mises en garde et précautions», Myopathie/Rhabdomyolyse). Avec des doses de simvastatine de 40 mg, le risque de myopathie n'était pas accru lors d'une administration concomitante d'amlodipine. Dans une étude pharmacocinétique, l'association avec l'amlodipine a provoqué une multiplication par 1,6 de l'exposition à la simvastatine acide. La dose d'Ezétimibe Simva Spirig HC ne doit par conséquent pas dépasser 10/20 mg par jour lors d'une association avec l'amlodipine.
Lomitapide: le risque de myopathie/rhabdomyolyse peut être éventuellement accru par une utilisation concomitante de lomitapide (voir «Posologie/Mode d'emploi» et «Mises en garde et précautions», Myopathie/Rhabdomyolyse).
Inhibiteurs modérés du CYP3A4: Les patients recevant simultanément Ezétimibe Simva Spirig HC et des médicaments exerçant un effet modérément inhibiteur sur le CYP3A4 peuvent présenter un risque accru de myopathie, surtout si la dose d'Ezétimibe Simva Spirig HC est élevée (voir «Mises en garde et précautions», Myopathie/Rhabdomyolyse).
Inhibiteurs de la protéine de transport OATP1B1: La simvastatine acide est un substrat de la protéine de transport OATP1B1. L'administration concomitante d'inhibiteurs de la protéine de transport OATP1B1 (par exemple la ciclosporine) pourrait conduire à des concentrations plasmatiques augmentées de simvastatine acide et à un risque accru de myopathie et de rhabdomyolyse (voir «Contre-indications», «Mises en garde et précautions», Myopathie/Rhabdomyolyse).
Inhibiteurs de la Breast Cancer Resistance Protein (BCRP): la simvastatine est un substrat de la BCRP, un transporteur d'efflux. L'administration concomitante de médicaments qui sont des inhibiteurs de la BCRP (p.ex. l'elbasvir et le grazoprévir) peut entraîner des concentrations plasmatiques élevées de simvastatine et un risque accru de myopathie. L'administration concomitante d'Ezétimibe Simva Spirig HC avec des produits qui contiennent l'elbasvir ou le grazoprévir n'est pas recommandée (voir «Posologie/mode d'emploi» et «Mises en garde et précautions», Myopathie/Rhabdomyolyse.
Cholestyramine:
L'utilisation simultanée de cholestyramine a diminué la surface sous la courbe de la concentration plasmatique en fonction du temps (AUC) de l'ézétimibe total (ézétimibe et glucuronide d'ézétimibe) d'environ 55% (voir «Posologie/Mode d'emploi»).
Colchicine:
Des cas de myopathie et de rhabdomyolyse ont été rapportés chez des patients atteints d'insuffisance rénale et traités simultanément à la colchicine et à la simvastatine. Une surveillance étroite de ces patients est recommandée lorsqu'ils reçoivent un traitement simultané de colchicine et de simvastatine.
Jus de pamplemousse:
Le jus de pamplemousse inhibe le CYP3A4. La consommation de grandes quantités de jus de pamplemousse (>1 litre par jour) pendant un traitement à la simvastatine a multiplié l'exposition à la simvastatine acide par 7. La consommation de 240 ml de jus de pamplemousse le matin en association avec une prise de simvastatine le soir a également entraîné une multiplication par 1,9. La consommation de jus de pamplemousse doit donc être évitée pendant le traitement par Ezétimibe Simva Spirig HC.
Niacine (acide nicotinique):
Dans une étude menée auprès de 15 adultes sains, l'administration concomitante d'ézétimibe/simvastatine (10/20 mg par jour pendant 7 jours) et de niacine à libération retardée (1000 mg pendant 2 jours et 2000 mg pendant 5 jours, la dose étant toujours suivie d'un petit-déjeuner à calories réduites), on a observé une faible augmentation de l'aire sous la courbe (AUC) moyenne de la niacine (22%) et de l'acide nicotinurique (19%). Dans la même étude, l'administration concomitante de niacine a entraîné une légère augmentation de l'aire moyenne sous la courbe (AUC) de l'ézétimibe (9%), de l'ézétimibe total (26%), de la simvastatine (20%) et de la simvastatine acide (35%). Des cas de myopathie/rhabdomyolyse ont été observés lors d'une utilisation concomitante de simvastatine et de doses de niacine (≥1 g par jour) modifiant les lipides (voir «Mises en garde et précautions», Myopathie/Rhabdomyolyse).
Daptomycine:
Le risque de myopathie et/ou de rhabdomyolyse peut être augmenté par l'administration simultanée d'inhibiteurs de la HMG-CoA-réductase et de daptomycine (voir «Mises en garde et précautions», Myopathie/Rhabdomyolyse).
Dérivés coumariniques:
Lors de l'administration simultanée de simvastatine et d'anticoagulants coumariniques au cours d'études cliniques, l'INR était légèrement augmenté. L'emploi simultané d'ézétimibe (10 mg par jour) au cours d'une étude ayant fait appel à 12 volontaires adultes du sexe masculin n'a pas eu d'effet significatif sur la biodisponibilité de la warfarine et sur le temps de prothrombine. Il existe toutefois des rapports de post-marketing signalant un INR augmenté chez des patients qui recevaient de l'ézétimibe et de la warfarine. C'est pourquoi le temps de prothrombine doit être déterminé au début d'un traitement à Ezétimibe Simva Spirig HC ainsi qu'ensuite à intervalles rapprochés chez les patients qui prennent des dérivés de la coumarine, afin d'identifier des variations significatives du temps de prothrombine. Après stabilisation des valeurs, on recommande la détermination du temps de prothrombine à des intervalles de temps tels qu'ils sont habituels pour les patients sous dérivés coumariniques. Si la dose d'Ezétimibe Simva Spirig HC est modifiée ou qu'Ezétimibe Simva Spirig HC est arrêté, il est recommandé de poursuivre la détermination du temps de prothrombine selon la même procédure. Le traitement à la simvastatine n'a pas été associé à l'apparition de saignements ou de modifications du temps de prothrombine chez des patients n'ayant pas pris d'anticoagulants.
Antiacides:
L'utilisation simultanée d'antiacides a diminué le taux d'absorption de l'ézétimibe sans toutefois modifier sa biodisponibilité. Aucune importance clinique n'est accordée à cette diminution du taux d'absorption.
Digoxine:
L'administration concomitante de simvastatine et de digoxine chez des volontaires sains a provoqué une légère augmentation du taux de digoxine (moins de 0,3 ng/ml au test radio-immunologique), tandis que ce n'était pas le cas lors d'une administration concomitante d'un placebo et de digoxine.
Grossesse/Allaitement
Grossesse:
Ezétimibe Simva Spirig HC est contre-indiqué au cours de la grossesse. C'est pourquoi Ezétimibe Simva Spirig HC ne doit pas être pris par des femmes enceintes, qui planifient une grossesse ou qui pensent être enceintes. Le traitement à Ezétimibe Simva Spirig HC doit être interrompu jusqu'à la fin de la grossesse ou jusqu'à ce que l'éventualité d'une grossesse ait été exclue (voir «Contre-indications»).
L'utilisation simultanée d'ézétimibe et de simvastatine dans le cadre d'études sur le développement embryonnaire/fœtal chez des rates gravides n'a pas montré d'effets tératogènes. Chez des lapines gravides, un faible nombre de malformations squelettiques a été observé (voir «Données précliniques»).
Il existe quelques rares rapports faisant état d'anomalies congénitales apparues après une exposition intra-utérine à des inhibiteurs de la HMG-CoA-réductase. Une analyse des expériences réalisées jusqu'ici avec près de 200 femmes ayant pris la simvastatine ou un inhibiteur de la HMG-CoA-réductase de structure apparentée au cours du premier trimestre de la grossesse n'a pas montré, par rapport à la population générale, d'augmentation du risque d'anomalies congénitales.
Allaitement:
Ezétimibe Simva Spirig HC est contre-indiqué en période d'allaitement. Des études chez des rates ont montré que l'ézétimibe passe dans le lait maternel. On ignore si les principes actifs d'Ezétimibe Simva Spirig HC passent dans le lait maternel chez la femme. Par conséquent, les femmes qui allaitent ne doivent pas prendre Ezétimibe Simva Spirig HC (voir «Contre-indications»).
Effet sur l’aptitude à la conduite et l’utilisation de machines
Des études concernant les effets sur l'aptitude à conduire et à utiliser des machines n'ont pas été menées. En raison des effets indésirables possibles, la capacité de réaction, l'aptitude à conduire et à utiliser des outils et des machines peuvent être altérées.
Effets indésirables
Les effets indésirables médicamenteux suivants ont été observés fréquemment (≥1/100, <1/10), occasionnellement (≥1/1000, <1/100), rarement (≥1/10'000, <1/1000) ou très rarement (<1/10'000), avec une incidence plus élevée sous ézétimibe/simvastatine (n = 2404) que sous placebo (n = 1340) et/ou avec une incidence plus élevée sous ézétimibe/simvastatine (n = 9595) que sous une statine seule (n = 8883):
Classes de systèmes d'organes | Effet indésirable | Fréquence |
Infections et infestations | Rhinopharyngite | Rare |
Affections du système immunitaire | Hypersensibilité | Rare |
Troubles du métabolisme et de la nutrition | Anorexie, appétit réduit | Rares |
Affections psychiatriques | Troubles du sommeil, insomnies | Occasionnels |
Anxiété, dépression, libido réduite | Rares | |
Affections du système nerveux | Vertiges, céphalées, paresthésies | Occasionnels |
Léthargie | Rare | |
Affections cardiaques et affections vasculaires | Bouffées vasomotrices, hypertension | Rares |
Affections respiratoires, thoraciques et médiastinales | Dyspnée, épistaxis | Rares |
Affections gastro-intestinales | Douleurs abdominales, gêne abdominale, dyspepsie, flatulences, nausées, vomissements, ballonnement, diarrhée, sécheresse buccale, reflux gastro-œsopaghien | Occasionnels |
Gastrite | Rare | |
Affections de la peau et du tissu sous-cutané | Prurit, éruption cutanée, urticaire | Occasionnels |
Acné, alopécie, hyperhidrose, psoriasis | Rares | |
Affections musculo-squelettiques et du tissu conjonctif | Myalgie | Fréquente |
Arthralgie, spasmes musculaires, faiblesse musculaire, troubles musculosquelettiques, douleurs au niveau de la nuque, douleurs dans les extrémités, douleurs dorsales, douleurs musculosquelettiques | Occasionnels | |
Douleur de flanc, articulations gonflées, myopathie | Rares | |
Affections du rein et des voies urinaires | Pollakiurie | Rare |
Affections des organes de reproduction et du sein | Dysfonction érectile | Rare |
Troubles généraux | Asthénie, fatigue, malaise, œdèmes (y compris œdèmes périphériques et faciaux), douleurs (y compris thoraciques) | Occasionnels |
Soif | Rare | |
Investigations | Taux accrus d'ALAT et/ou d'ASAT, taux accrus de CK dans le sang | Fréquents |
Taux sanguins accrus de bilirubine, d'acide urique, taux accru de gamma-glutamyl transférase; INR accru, protéinurie, perte de poids, taux sanguin accru de phosphatase alcaline | Occasionnels | |
Taux sanguin accru de créatinine, taux sanguin accru d'urée, taux réduit d'hémoglobine | Rares |
Valeurs de laboratoire:
Au cours d'études sur des administrations simultanées, l'incidence d'augmentations cliniquement significatives des transaminases sériques (ALAT et/ou ASAT ≥3× LSN de façon répétée) était de 1,7% sous ézétimibe/simvastatine. Ces augmentations étaient en général asymptomatiques, n'étaient pas associées à une cholestase et revenaient aux valeurs initiales soit à l'arrêt du traitement, soit au cours de celui-ci (voir «Mises en garde et précautions»).
Des augmentations cliniquement significatives de la CK (≥10× LSN) ont été observées chez 0,2% des patients traités par ézétimibe/simvastatine.
Diabète sucré: la fréquence dépend de la présence ou de l'absence de facteurs de risque (glycémie à jeun ≥5,6 mmol/l, IMC >30 kg/m², taux accru de triglycérides, antécédents d'hypertension artérielle) (voir «Mises en garde et précautions»).
Expériences de post-marketing:
Les effets indésirables apparus sous ézétimibe/simvastatine correspondent à ce jour aux effets déjà connus observés sous l'ézétimibe et/ou la simvastatine.
Informations supplémentaires relatives aux principes actifs: à côté des effets secondaires du produit combiné mentionnés plus haut, d'autres effets secondaires, déjà rapportés pour les composants isolés au cours d'études cliniques et/ou après l'introduction sur le marché, peuvent également apparaître sous ézétimibe/simvastatine.
Ézétimibe
Affections hématologiques et du système lymphatique
Très rare: thrombocytopénie.
Affections respiratoires, thoraciques et médiastinales
Fréquence inconnue: toux.
Affections gastro-intestinales
Très rare: pancréatite.
Fréquence inconnue: constipation.
Affections hépato-biliaires
Rare: hépatite.
Très rares: cholélithiase, cholécystite, ictère.
Affections de la peau et du tissu sous-cutané
Rares: réactions d'hypersensibilité, y compris éruption cutanée, urticaire et très rarement anaphylaxie ou angio-œdème.
Très rare: érythème polymorphe.
Affections musculo-squelettiques et du tissu conjonctif et des os
Très rares: rhabdomyolyse, myosite.
Affections vasculaires
Occasionnels: bouffées de chaleur.
Simvastatine
Affections hématologiques et du système lymphatique
Rare: anémie.
Affections du système immunitaire
Dans de rares cas, un syndrome d'hypersensibilité manifeste a été rapporté, associé à l'un ou à plusieurs des symptômes suivants: œdème angioneurotique, syndrome pseudo-lupus, polymyalgie rhumatismale, dermatomyosite, vasculite, thrombocytopénie, éosinophilie, accélération de la vitesse de sédimentation du sang, arthrite et arthralgie, urticaire, photosensibilité, fièvre, rougeur du visage, dyspnée et sensation générale de malaise.
Affections du système nerveux
Rare: neuropathie périphérique.
Très rare: atteinte de la mémoire.
Affections respiratoires, thoraciques et médiastinales
Cas isolés: maladie pulmonaire interstitielle.
Affections gastro-intestinales
Rares: constipation, pancréatite.
Affections hépato-biliaires
Rare: hépatite/ictère.
Très rare: défaillance hépatique létale et non létale.
Affections musculo-squelettiques et du tissu conjonctif
Rare: rhabdomyolyse.
Cas isolés de problèmes concernant le tendon d'Achille, rarement associés à une rupture du tendon d'Achille.
Fréquence inconnue: myopathie nécrosante immuno-médiée (voir «Mises en garde et précautions»).
Effets indésirables des statines
De très rares cas de myopathie nécrosante immune (immune-mediated necrotizing myopathy, IMNM) ont été rapportés sous statines. L'IMNM est caractérisée par une faiblesse musculaire proximale et des taux sériques accrus de créatine kinase, persistants malgré l'arrêt d'administration de la statine. Des examens de la musculature révèlent une myopathie nécrosante sans inflammation significative. Les médicaments immunosuppresseurs permettent une amélioration (voir «Mises en garde et précautions», Myopathie/Rhabdomyolyse).
Après l'introduction sur le marché, on a rapporté dans de rares cas des altérations cognitives (p.ex. perte de mémoire, oubli de mémoire, amnésie, atteinte de la mémoire, confusion) sous statines. Ces altérations cognitives ont été rapportées sous toutes les statines. Les rapports décrivent généralement des symptômes sans grande sévérité qui sont réversibles après l'arrêt de prise de la statine, avec des délais variables jusqu'à la survenue des symptômes (entre 1 jour et plusieurs années) et jusqu'à leur disparition (temps médian de 3 semaines).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Il n'existe pas de recommandation thérapeutique particulière valable en cas de surdosage d'Ezétimibe Simva Spirig HC. Lors d'un surdosage, des mesures symptomatiques et de soutien devraient être prises.
Propriétés/Effets
Code ATC
C10BA02
Mécanisme d'action
Ezétimibe Simva Spirig HC
Le cholestérol présent dans le plasma provient de l'absorption intestinale et de la synthèse endogène. Ezétimibe Simva Spirig HC contient l'ézétimibe et la simvastatine, deux substances hypolipémiantes dont les mécanismes d'action sont complémentaires. Ezétimibe Simva Spirig HC diminue les valeurs augmentées de cholestérol total, de cholestérol LDL, d'apolipoprotéine B, de triglycérides, de cholestérol non HDL et augmente le taux de cholestérol HDL par la double inhibition de l'absorption et de la synthèse du cholestérol.
Ézétimibe
L'ézétimibe inhibe l'absorption intestinale de cholestérol. L'ézétimibe est efficace après prise orale; son mécanisme d'action se différencie de celui d'autres classes de médicaments hypocholestérolémiants (p.ex. les statines, les échangeurs d'anions [résines], les dérivés de l'acide fibrique et les phytostérols). L'ézétimibe se lie à la protéine de transport des stérols, Niemann-Pick C1-Like 1 (NPC1L1), responsable de l'absorption de cholestérol et de phytostérols dans l'intestin grêle.
L'ézétimibe se dépose sur la bordure en brosse de l'intestin grêle et inhibe l'absorption de cholestérol, ce qui conduit à une diminution du transport de cholestérol depuis l'intestin vers le foie. Les statines réduisent la synthèse de cholestérol dans le foie, et les deux mécanismes d'action distincts se conjuguent pour induire une diminution complémentaire du cholestérol.
Simvastatine
Après administration par voie orale, la simvastatine, une lactone inactive, est hydrolysée dans le foie en son bêta-hydroxyacide actif correspondant, qui inhibe la 3-hydroxy-3-méthylglutaryl-coenzyme A (HMG-CoA)-réductase. Cette enzyme catalyse la transformation du HMG-CoA en mévalonate, une étape précoce et limitante dans la biosynthèse du cholestérol.
Pharmacodynamique
Voir «Mécanisme d'action».
Efficacité clinique
Au cours d'études cliniques contrôlées, ézétimibe/simvastatine a permis une réduction significative des taux de cholestérol total, de cholestérol LDL, d'apolipoprotéine B, de triglycérides et de cholestérol non-HDL ainsi qu'une augmentation du cholestérol HDL chez des patients atteints d'hypercholestérolémie.
Hypercholestérolémie primaire
Au cours d'une étude contrôlée par placebo, réalisée en double aveugle, le nombre de patients atteints d'hypercholestérolémie ayant atteint le taux de cholestérol LDL visé (2,6 –4,1 mmol/l) (76%) conformément au NCEP (National Cholesterol Education Program) sous ézétimibe associé à la simvastatine était significativement plus élevé que celui des patients sous placebo associé à la simvastatine (21,5%) à la fin de l'étude. Les différences en termes de diminutions du cholestérol LDL étaient significatives (27% par rapport à 3%). En outre, l'ézétimibe utilisé en complément à un traitement aux statines en cours a permis, par rapport au placebo, une baisse significative des taux de cholestérol total, d'apolipoprotéine B et des triglycérides.
Au cours d'une étude multicentrique, réalisée en double aveugle, des patients atteints de diabète sucré de type 2 ont été inclus; ils ont été traités pendant au moins 3 mois avec des thiazolidinediones et 20 mg de simvastatine pendant au moins 6 semaines, et leur taux de cholestérol LDL se situait autour de 93 mg/dl en moyenne. Ezétimibe/simvastatine 10/20 a été significativement plus efficace que le doublement de la dose de simvastatine, portée ainsi à 40 mg, et a permis d'obtenir une diminution supplémentaire du taux de cholestérol LDL (-21% par rapport à 0), du cholestérol total (-14% par rapport à -1%), de l'apolipoprotéine B (-14% par rapport à -2%) et du cholestérol non HDL (-20% par rapport à -2%) en comparaison avec les diminutions déjà obtenues avec 20 mg de simvastatine. Les résultats concernant les taux de cholestérol HDL et de triglycérides ne présentaient pas de différence significative entre les deux groupes de traitement. Les résultats n'ont pas été influencés par le choix de la thiazolidinedione.
Au cours d'une étude contrôlée, multicentrique, réalisée en double aveugle, des patients atteints d'une cardiopathie coronarienne connue ou présentant des facteurs de risque connus de cardiopathie coronarienne ainsi qu'un taux de cholestérol LDL ≥130 mg/dl ont été examinés. Après 5 semaines, les diminutions des taux de cholestérol LDL sous ézétimibe/simvastatine 10/10 (-47%), 10/20 (-53%) ou 10/40 (-59%) étaient significativement plus élevées que sous 20 mg de simvastatine (-38%). En outre, après 5 semaines, un nombre significativement plus élevé de patients ont atteint les taux de cholestérol LDL visés sous ézétimibe/simvastatine 10/10 (75%), 10/20 (83%) ou 10/40 (88%) que sous 20 mg de simvastatine (46%). Les résultats à la fin de l'étude (semaine 23) correspondaient aux résultats après 5 semaines du point de vue de la diminution du taux de cholestérol LDL et de la proportion de patients ayant atteint les taux de cholestérol LDL visés.
Au cours d'une étude multicentrique, réalisée en double aveugle, contrôlée par placebo, des patients atteints d'hypercholestérolémie ont reçu ézétimibe/simvastatine (10/10, 10/20, 10/40 et 10/80) ou la simvastatine (10 mg, 20 mg, 40 mg ou 80 mg). Ezétimibe/simvastatine a permis en comparaison avec la simvastatine une diminution significativement plus forte des valeurs suivantes (données groupées de toutes les doses d'ézétimibe/simvastatine par rapport à toutes les doses de simvastatine): cholestérol total (-38% par rapport à -26%), cholestérol LDL (-53% par rapport à -38%), apolipoprotéine B (-42% par rapport à -29%), triglycérides (-28% par rapport à -15%), cholestérol non HDL (-49% par rapport à -34%) et protéine C-réactive (-33% par rapport à -9%). Les effets d'ézétimibe/simvastatine sur les taux de cholestérol HDL étaient comparables aux valeurs observées sous la simvastatine (+8,2% par rapport à +7,6%). Une analyse supplémentaire a montré qu'ézétimibe/simvastatine a entraîné une élévation significative des taux de cholestérol HDL par rapport au placebo.
Au cours de deux études menées en double aveugle, randomisées et contrôlées par placebo, de 12 semaines, 1719 patients atteints d'hypercholestérolémie primaire ont été examinés. L'ézétimibe à la dose de 10 mg a entraîné, par rapport au placebo, une diminution significative des taux de cholestérol total (-13%), de cholestérol LDL (-19%), d'apolipoprotéine B (-14%) et des triglycérides (-8%), et une élévation des taux de cholestérol HDL (+3%). En outre, l'ézétimibe n'a pas eu d'influence sur la concentration plasmatique des vitamines liposolubles A, D et E, ni sur le temps de prothrombine et, comme d'autres médicaments hypolipémiants, il n'a pas altéré la production de corticostéroïdes dans la corticosurrénale.
Deux études cliniques de grande envergure, contrôlées par placebo, ont examiné les effets de la simvastatine chez les patients exposés à un risque cardio-vasculaire (cardiopathie coronarienne, diabète, affection vasculaire périphérique ou antécédent d'accident vasculaire cérébral ou d'un autre événement cérébrovasculaire). Il a été démontré que la simvastatine permet une réduction du risque total de mortalité grâce à la réduction des décès dus à une cardiopathie coronarienne, des infarctus du myocarde non létaux et des accidents vasculaires cérébraux; de même, la nécessité d'interventions coronaires et non coronaires de revascularisation a été réduite.
Des études destinées à prouver l'efficacité d'ézétimibe/simvastatine dans la prévention des complications d'une athérosclérose sont actuellement en cours.
Hypercholestérolémie familiale homozygote
Au cours d'une étude randomisée réalisée en double aveugle, des patients présentant un diagnostic clinique et/ou génotypique d'hypercholestérolémie familiale homozygote ont été examinés. Les données issues d'un sous-groupe incluant des patients (N=14) qui avaient reçu, au début de l'étude, 40 mg de simvastatine, ont été analysées. Une augmentation de la dose de 40 mg à 80 mg de simvastatine (N=5) a entraîné une baisse de 13% du taux de cholestérol LDL par rapport à la valeur initiale mesurée sous 40 mg de simvastatine. L'administration simultanée d'ézétimibe et de simvastatine, à des doses correspondant à celles d'ézétimibe/simvastatine (10/40 et 10/80 groupés, N=9) a entraîné une diminution du taux de cholestérol LDL de 23% par rapport à la valeur initiale sous 40 mg de simvastatine. Chez les patients ayant reçu l'ézétimibe et la simvastatine à des doses correspondant à ézétimibe/simvastatine (10/80, N=5), une diminution de 29% du taux de cholestérol LDL a été observée par rapport à la valeur initiale sous 40 mg de simvastatine.
Pharmacocinétique
Absorption
Ézétimibe
Après administration orale, l'ézétimibe est rapidement absorbé et principalement conjugué en un phényl-glucuronide (glucuronide d'ézétimibe) pharmacologiquement actif. La concentration plasmatique maximale moyenne (Cmax) est atteinte après 1-2 heures pour le glucuronide d'ézétimibe et après 4-12 heures pour l'ézétimibe. La biodisponibilité absolue de l'ézétimibe ne peut être déterminée car la substance est pratiquement insoluble dans les solutions aqueuses appropriées pour les injections.
Une prise simultanée de nourriture (repas à haute teneur en graisses ou repas sans graisses) n'a eu aucune influence sur la biodisponibilité orale de l'ézétimibe, utilisé sous forme de comprimés de 10 mg.
Simvastatine
Après administration par voie orale, moins de 5% de la dose est disponible au niveau systémique sous forme de bêta-hydroxyacide (métabolite), ce qui concorde avec l'effet de premier passage marqué dans le foie. Les principaux métabolites de la simvastatine pouvant être détectés dans le plasma humain sont le métabolite béta-hydroxyacide et 4 autres métabolites actifs.
Les résultats d'études pharmacocinétiques avec administration d'une dose unique et de doses multiples de simvastatine ont montré que l'administration répétée du médicament n'entraîne pas d'accumulation. Dans ces études pharmacocinétiques, les concentrations plasmatiques maximales des inhibiteurs ont été atteintes 1,3 à 2,4 heures après l'administration de la dose.
Le profil plasmatique des inhibiteurs actifs ainsi que de l'ensemble des inhibiteurs n'a pas été influencé par la prise de simvastatine immédiatement avant un repas test par rapport à la prise à jeun.
Distribution
Ézétimibe
Chez l'homme, l'ézétimibe est lié à hauteur de 99,7% aux protéines plasmatiques, le glucuronide d'ézétimibe à hauteur de 88-92%.
Simvastatine
La simvastatine et le bêta-hydroxyacide se lient aux protéines plasmatiques chez l'homme (95%).
Métabolisme
Ézétimibe
L'ézétimibe est principalement métabolisé dans l'intestin grêle et au niveau du foie par glucuroconjugaison (une réaction de phase II) puis éliminé par la bile. Dans toutes les espèces étudiées, un métabolisme oxydatif minime a été observé (une réaction de phase I). L'ézétimibe et le glucuronide d'ézétimibe sont les deux substances principales identifiées dans le plasma, l'ézétimibe représentant env. 10-20% et le glucuronide d'ézétimibe env. 80-90% de la concentration plasmatique totale. L'ézétimibe et le glucuronide d'ézétimibe sont éliminés lentement du plasma, ce qui est un signe clair en faveur d'un cycle entéro-hépatique significatif. La demi-vie de l'ézétimibe et du glucuronide d'ézétimibe est d'environ 22 heures.
Simvastatine
La simvastatine est métabolisée par le CYP3A4, mais n'exerce pas d'activité inhibitrice sur le CYP3A4. C'est pourquoi aucune influence sur les taux plasmatiques d'autres médicaments métabolisés par le CYP3A4 n'est attendue. Les inhibiteurs puissants du CYP3A4 peuvent augmenter le risque de myopathie en diminuant l'élimination de la simvastatine.
La simvastatine est une lactone inactive qui est rapidement hydrolysée in vivo en bêta-hydroxyacide correspondant, un puissant inhibiteur de la HMG-CoA réductase.
Élimination
Ézétimibe
Après administration orale d'une dose radiomarquée de 20 mg de [14C]-ézétimibe à des volontaires, environ 93% de la radioactivité totale est retrouvée dans le plasma sous forme d'ézétimibe total. Sur une période d'observation de 10 jours, environ 78% de la dose radioactive administrée ont été retrouvés dans les fèces et 11% dans l'urine. Après 48 heures, la radioactivité avait disparu du plasma.
Simvastatine
Après l'administration par voie orale de simvastatine radiomarquée à des volontaires, 13% de la radioactivité ont été retrouvés dans les urines et 60% dans les fèces en l'espace de 96 heures. Cette dernière quantité concerne aussi bien la fraction absorbée, éliminée par voie biliaire, que la fraction non absorbée. Seuls 0,3% en moyenne d'une dose i.v. ont été éliminés dans l'urine sous forme d'inhibiteurs après l'injection intraveineuse du métabolite bêta-hydroxyacide. La demi-vie du métabolite bêta-hydroxyacide après injection intraveineuse est de 1,9 heure en moyenne.
La simvastatine acide est activement absorbée dans les hépatocytes via la protéine de transport OATP1B1.
Cinétique pour certains groupes de patients
Patients pédiatriques
Ezétimibe
L'absorption et le métabolisme de l'ézétimibe chez les enfants et les adolescents (10-18 ans) sont similaires à ceux de l'adulte. Il n'existe pas de différence entre les adolescents et les adultes en ce qui concerne la pharmacocinétique de l'ézétimibe total. Il n'existe pas de données concernant la pharmacocinétique chez les enfants de moins de 10 ans. L'expérience clinique concernant le traitement des enfants et adolescents (9-17 ans) se limite aux cas de patients atteints d'hypercholestérolémie familiale homozygote ou de sitostérolémie.
Simvastatine
On ne dispose pas de données cliniques sur les enfants âgés de moins de 10 ans.
Patients âgés
Ézétimibe
Les concentrations plasmatiques d'ézétimibe total sont environ deux fois plus élevées chez les patients âgés (≥65 ans) que chez les patients plus jeunes (18-45 ans). La baisse de la valeur du cholestérol LDL et le profil de sécurité de l'ézétimibe sont toutefois similaires chez les volontaires âgés ou plus jeunes. C'est pourquoi aucune adaptation posologique n'est nécessaire chez les patients plus âgés, mais aucune étude clinique spécifique n'a été réalisée chez des patients plus âgés atteints d'insuffisance hépatique ou rénale.
Simvastatine
Une étude pharmacocinétique a constaté chez des patients âgés (70 à 78 ans) un niveau accru d'environ 45% de l'activité plasmatique moyenne de la statine par rapport aux patients âgés de 18 à 30 ans.
Insuffisance hépatique
Ézétimibe
Après administration d'une dose unique de 10 mg d'ézétimibe à des patients atteints d'insuffisance hépatique légère (score de Child Pugh 5 ou 6), l'AUC pour l'ézétimibe total était environ 1,7 fois plus élevée que chez les volontaires sains. Dans une étude d'une durée de 14 jours avec administrations multiples (10 mg par jour) chez des patients atteints d'une insuffisance hépatique modérée (score de Child Pugh 7-9), l'AUC moyenne pour l'ézétimibe total au premier et au quatorzième jour était environ 4 fois plus élevée que celle de volontaires sains. Pour les patients atteints d'insuffisance hépatique légère, aucune adaptation posologique n'est normalement nécessaire. Étant donné que les suites d'une exposition accrue à l'ézétimibe total des patients présentant une insuffisance hépatique modérée ou sévère (score de Child Pugh >9) ne sont pas connues, l'ézétimibe n'est pas recommandé chez ces patients (voir «Mises en garde et précautions»).
Simvastatine
On ne dispose d'aucune information pharmacocinétique sur la simvastatine chez les patients atteints d'insuffisance hépatique.
Insuffisance rénale
Ézétimibe
Après administration d'une dose unique de 10 mg d'ézétimibe à des patients (N=8) atteints d'insuffisance rénale sévère (clairance moyenne de la créatinine ≤30 ml/min), l'AUC moyenne pour l'ézétimibe total était augmentée d'environ 1,5 fois en comparaison avec celle des volontaires sains (n = 9).
Au cours de cette étude, un patient (après transplantation rénale, sous traitements médicamenteux multiples dont la ciclosporine) a présenté une exposition 12 fois supérieure à l'ézétimibe total.
Simvastatine
Au cours d'une étude clinique, des patients atteints d'insuffisance rénale sévère (clairance de la créatinine <30 ml/min) présentaient, après une administration d'une dose unique d'un inhibiteur apparenté de la HMG-CoA réductase, des taux plasmatiques des inhibiteurs totaux approximativement deux fois plus élevés que ceux mesurés chez les volontaires sains.
Sexe
Ézétimibe
La concentration plasmatique d'ézétimibe total est légèrement plus élevée (<20%) chez les femmes que chez les hommes. La diminution de la valeur du cholestérol LDL et le profil de sécurité sous le traitement d'ézétimibe sont similaires chez les hommes et les femmes. C'est pourquoi aucune adaptation posologique n'est nécessaire en fonction du sexe.
Groupe ethnique
Ézétimibe
La méta-analyse des études de pharmacocinétique n'a pas montré de différences en termes de pharmacocinétique entre les Noirs et les Caucasiens.
Polymorphisme SLCO1B1
Simvastatine
Les porteurs de l'allèle c.521T>C du gène SLCO1B1 présentent une activité OATP1B1 réduite. L'exposition moyenne (AUC) au principal métabolite actif, la simvastatine acide, est de 120% chez les porteurs hétérozygotes de l'allèle C (CT) et de 221% chez les porteurs homozygotes (CC) par rapport à celle des patients présentant le génotype le plus courant (TT). L'allèle C est présent chez 18% de la population européenne. Chez les patients présentant un polymorphisme SLCO1B1, il existe un risque d'exposition accrue à la simvastatine acide, pouvant entraîner une augmentation du risque de rhabdomyolyse (voir «Mises en garde et précautions», Myopathie/Rhabdomyolyse).
Données précliniques
Au cours d'études sur l'administration simultanée d'ézétimibe et de simvastatine, les effets toxiques observés étaient pour l'essentiel ceux typiques du traitement par les statines. Certains effets toxiques étaient plus marqués que ceux observés lors d'une monothérapie par les statines. Cette différence est attribuée à des interactions pharmacocinétiques et/ou pharmacodynamiques lors du traitement combiné. Des interactions de ce genre ne sont pas apparues au cours d'études cliniques.
Des myopathies sont apparues chez les rats uniquement lors d'une exposition à des doses de plusieurs fois supérieures aux doses thérapeutiques préconisées chez l'homme (environ 20 fois la concentration AUC pour la simvastatine et 1800 fois la concentration AUC pour le métabolite actif). Aucun indice laissant supposer une éventuelle influence de l'administration simultanée d'ézétimibe sur le potentiel myotoxique de la simvastatine n'a été constaté.
L'administration simultanée d'ézétimibe et de simvastatine n'était pas tératogène chez les rats. Chez des lapines gravides, un faible nombre de malformations squelettiques (sternèbres fusionnées, vertèbres soudées au niveau caudal, diminution du nombre de vertèbres caudales) a été observé. Ces lapines ont été traitées à l'ézétimibe (1000 mg/kg; ≥146 fois l'exposition humaine thérapeutique avec 10 mg/jour, sur la base de l'AUC0-24 h pour l'ézétimibe total) et à la simvastatine (5 mg/kg et 10 mg/kg).
Dans une série d'essais in vivo et in vitro, l'ézétimibe seul ou en association avec la simvastatine n'a pas montré de potentiel génotoxique.
Ézétimibe
L'ézétimibe a été bien toléré par les souris, les rats et les chiens. Au cours d'études à long terme, aucune toxicité spécifique d'un organe n'a été trouvée. L'ézétimibe n'a montré aucun potentiel tératogène, génotoxique ou cancérigène dans une série d'études menées in vivo et in vitro.
Simvastatine
Lors d'études conventionnelles d'expérimentation animale concernant la pharmacodynamie, la toxicologie lors de doses multiples, la génotoxicité et la cancérogénicité, aucun risque supplémentaire n'a été observé pour les patients, à l'exception de ceux attendus au vu des mécanismes pharmacologiques. Sous les doses maximales tolérées chez le rat et le lapin, la simvastatine n'a pas provoqué de malformation fœtale et n'a eu aucun effet sur la fertilité, la reproduction ou le développement néonatal.
Remarques particulières
Stabilité
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Conserver à une température ne dépassant pas 25 °C, dans l'emballage d'origine.
Conserver le médicament hors de portée des enfants.
Numéro d’autorisation
66233 (Swissmedic).
Titulaire de l’autorisation
Spirig HealthCare SA, 4622 Egerkingen.
Mise à jour de l’information
Avril 2019.
Відгуки (0)
Ви переглядали

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.

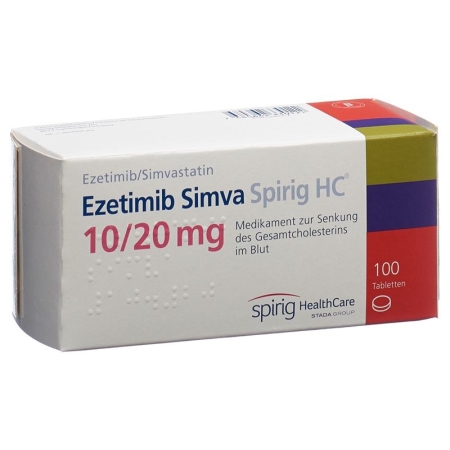

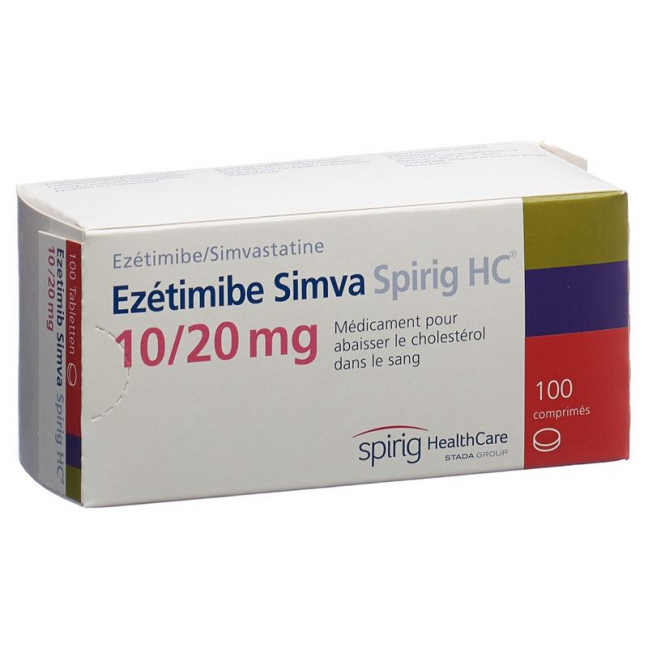


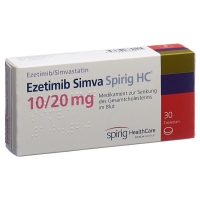
 Deutsch
Deutsch French
French Italian
Italian

























