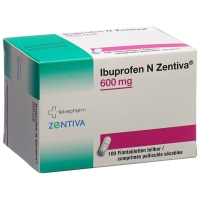
Losartan HCT Zentiva Filmtable 100/12,5 мг 98 шт
Losartan HCT Zentiva Filmtabl 100/12.5 mg 98 Stk
-
15237.79 RUB
Дата доставки:
25.12.2025 - 08.01.2026
При оплате криптовалютой:
Ваша прибыль 1523.78 RUB / 17.99 USDT
- Наявність: В наявності
- Виробник: HELVEPHARM AG
- Модель: 7769729
- ATC-код C09DA01
- EAN 7680613140107
Склад:
Варіанти
Losartan HCT Zentiva Filmtable 100/12,5 мг 28 шт
8262.84 RUB
Опис
Was ist Losartan HCT Zentiva und wann wird es angewendet?
Losartan HCT Zentiva ist ein Kombinationspräparat bestehend aus einem Hemmer der Angiotensin II Rezeptoren (Losartan) und einem Diuretikum (Hydrochlorothiazid), welches nur auf Verschreibung Ihres Arztes bzw. Ihrer Ärztin verwendet werden darf. Losartan und Hydrochlorothiazid wirken zusammen zur Senkung des hohen Blutdrucks.
Die in Losartan HCT Zentiva enthaltene Substanz Losartan senkt den Blutdruck durch spezifische Blockierung des sogenannten Angiotensin II. Angiotensin II verengt normalerweise die Blutgefässe. Das in Losartan HCT Zentiva enthaltene Losartan führt zu einer Erweiterung der Blutgefässe. Die in Losartan HCT Zentiva enthaltene Substanz Hydrochlorothiazid erhöht die Ausscheidung von Wasser und Salz durch Ihre Nieren. Zusammen senken Losartan und Hydrochlorothiazid Ihren hohen Blutdruck. Obwohl Ihr Arzt bzw. Ihre Ärztin durch Messung des Blutdrucks die Wirksamkeit des Arzneimittels nachweisen kann, werden Sie in Ihrem Wohlbefinden wahrscheinlich keinen Unterschied spüren, wenn Sie Losartan HCT Zentiva einnehmen.
Ihr Arzt bzw. Ihre Ärztin hat Ihnen Losartan HCT Zentiva verschrieben, weil Sie an zu hohem Blutdruck, auch Hypertonie genannt, leiden. Falls Sie hohen Blutdruck und eine Linksherzvergrösserung (eine Vergrösserung der zum Pumpen wichtigsten Herzkammer) haben, hat Ihnen Ihr Arzt bzw. Ihre Ärztin Losartan HCT Zentiva verschrieben, um das Risiko eines kardiovaskulären Ereignisses wie z. Bsp. einem Schlaganfall, zu reduzieren.
Was sollte dazu beachtet werden?
Wieso sollte ein hoher Blutdruck (Hypertonie) behandelt werden?
Wenn ein hoher Blutdruck nicht behandelt wird, können lebenswichtige Organe, wie das Herz und die Nieren geschädigt werden. Sie können sich wohlauf fühlen und keine Symptome haben, aber die unbehandelte Hypertonie kann eventuell einen Hirnschlag, einen Herzinfarkt, eine Herzschwäche, eine Nierenfunktionsstörung oder Erblinden verursachen.
Wann darf Losartan HCT Zentiva nicht eingenommen/angewendet werden?
Nehmen Sie Losartan HCT Zentiva nicht ein, wenn Sie
- auf irgendeinen Bestandteil von Losartan HCT Zentiva allergisch reagieren;
- auf Arzneimittel allergisch sind, welche von Sulfonamiden abstammen (fragen Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Ihnen unklar ist, welche Arzneimittel von Sulfonamiden abstammen);
- keinen Urin ausscheiden;
- eine eingeschränkte Leber- oder Nierenfunktion haben;
- Diabetes oder eine eingeschränkte Nierenfunktion haben und das Arzneimittel Aliskiren (z.B. Rasilez®) zur Senkung des Blutdrucks einnehmen;
- schwanger sind oder eine Schwangerschaft planen (Siehe «Wann ist bei der Einnahme von Losartan HCT Zentiva Vorsicht geboten» und «Darf Losartan HCT Zentiva während einer Schwangerschaft oder in der Stillzeit eingenommen/angewendet werden»).
- Falls früher anlässlich der Einnahme eines blutdrucksenkenden Arzneimittels Schwellungen im Gesicht, an Lippen, Zunge oder im Rachen (Schluck- oder Atembeschwerden) auftraten, dürfen Sie Losartan HCT Zentiva nicht einnehmen.
Wenn Sie nicht sicher sind, ob Sie Losartan HCT Zentiva einnehmen dürfen, wenden Sie sich an Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin.
Wann ist bei der Einnahme/Anwendung von Losartan HCT Zentiva Vorsicht geboten?
Teilen Sie Ihrem Arzt/Ihrer Ärztin mit, wenn Sie vermuten, schwanger zu sein (oder schwanger werden könnten). Die Einnahme von Losartan HCT Zentiva in der frühen Phase der Schwangerschaft wird nicht empfohlen, und Losartan HCT Zentiva darf nicht mehr nach dem dritten Schwangerschaftsmonat eingenommen werden, da die Einnahme von Losartan HCT Zentiva in diesem Stadium zu schweren Schädigungen Ihres ungeborenen Kindes führen kann (siehe «Wann darf Losartan HCT Zentiva nicht eingenommen werden» und «Darf Losartan HCT Zentiva während einer Schwangerschaft oder in der Stillzeit eingenommen/angewendet werden»).
Ihr Arzt bzw. Ihre Ärztin sollte unbedingt informiert werden, wenn Sie an Leber- oder Nierenkrankheit, Gicht, Zuckerkrankheit (Diabetes) oder Lupus erythematodes leiden. Wichtig ist auch eine allfällige Behandlung mit Diuretika (harntreibende Mittel). In diesen Fällen kann Ihr Arzt bzw. Ihre Ärztin eine Anpassung der Dosis als notwendig erachten.
Vor einer Operation oder Anästhesie (auch beim Zahnarzt) sollten Sie Ihren Arzt oder Zahnarzt bzw. Ihre Ärztin oder Zahnärztin über die Einnahme von Losartan HCT Zentiva informieren, da während der Anästhesie ein plötzlicher Abfall des Blutdrucks auftreten kann.
Teilen Sie Ihrem Arzt bzw. Ihrer Ärztin mit, falls Sie schon einmal Hautkrebs hatten oder falls Sie während der Behandlung eine unerwartete Hautveränderung bemerken. Die Behandlung mit Hydrochlorothiazid (einem der Wirkstoffe vonLosartan HCT Zentiva), insbesondere über längere Zeit und in höherer Dosierung, kann zu einem erhöhten Risiko für bestimmte Arten von Haut- und Lippenkrebs (nicht-melanozytärer, Hautkrebs) führen. Schützen Sie Ihre Haut vor Sonnenlicht und UV-Strahlen, solange Sie Losartan HCT Zentiva anwenden, und kontrollieren Sie Ihre Haut regelmässig, um Ihrem Arzt bzw. Ihrer Ärztin unerwartete Veränderungen zeigen zu können.
Über die Einnahme von Losartan HCT Zentiva bei Kindern liegen keine Erfahrungen vor. Losartan HCT Zentiva sollte deshalb nicht an Kinder verabreicht werden.
Die Wirksamkeit und Verträglichkeit von Losartan HCT Zentiva bei älteren und jüngeren Patienten ist im Allgemeinen gleich gut. Die meisten älteren Patienten benötigen die gleiche Dosis wie die jüngeren Patienten.
Für Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin ist es besonders wichtig, über die Einnahme von folgenden Arzneimitteln informiert zu sein: Kaliumzusätze, kaliumsparende Mittel, Kalium enthaltende Diätsalze oder andere Arzneimittel, die das Serumkalium erhöhen können (z.B. Trimethoprim-haltige Antibiotika), Substanzen zur Senkung des Blutdrucks, Diuretika (harntreibende Mittel), Arzneimittel zur Senkung des Cholesterins, Medikamente zur Behandlung der Zuckerkrankheit (Diabetes) einschliesslich Insulin, Muskelrelaxantien, Substanzen zur Erhöhung des Blutdrucks wie Adrenalin, blutverdünnende Arzneimittel, Cortisonpräparate, gewisse Arzneimittel gegen Schmerzen und Gelenkentzündung sowie Lithium (ein Arzneimittel, welches zur Behandlung von Depressionen verwendet wird). Weil Schlafmittel, Beruhigungsmittel, Narkotika, Alkohol und Schmerzmittel die Blutdrucksenkung von Losartan HCT Zentiva verstärken können, sollten Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin informieren, wenn Sie eines dieser Arzneimittel einnehmen.
Aufgrund der möglichen Nebenwirkungen ist beim Lenken von Fahrzeugen und Bedienen von Maschinen Vorsicht geboten.
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie an anderen Krankheiten leiden, Allergien haben oder andere Arzneimittel (auch selbstgekaufte!) einnehmen, an übermässigem Durchfall/Erbrechen leiden.
Darf Losartan HCT Zentiva während einer Schwangerschaft oder in der Stillzeit eingenommen/angewendet werden?
Schwangerschaft
Teilen Sie Ihrem Arzt/Ihrer Ärztin mit, wenn Sie vermuten, schwanger zu sein (oder schwanger werden könnten). Ihr Arzt/Ihre Ärztin wird Ihnen empfehlen, Losartan HCT Zentiva vor einer Schwangerschaft abzusetzen, und er/sie wird Ihnen ein anderes Arzneimittel anstelle von Losartan HCT Zentiva empfehlen. Losartan HCT Zentiva darf während der Schwangerschaft nicht eingenommen werden, da die Einnahme von Losartan HCT Zentiva zu schweren Schädigungen oder zum Tod des ungeborenen Kindes führen kann.
Falls Sie während der Behandlung mit Losartan HCT Zentiva schwanger werden, müssen Sie umgehend Ihren Arzt oder Ihre Ärztin davon in Kenntnis setzen, damit Ihre Therapie angepasst werden kann.
Stillzeit
Sie dürfen Ihr Kind nicht stillen, wenn Sie Losartan HCT Zentiva einnehmen.
Wie verwenden Sie Losartan HCT Zentiva?
Nehmen Sie Losartan HCT Zentiva täglich ein, genau wie von Ihrem Arzt bzw. Ihrer Ärztin verordnet. Es ist wichtig, dass Sie die Einnahme von Losartan HCT Zentiva solange fortsetzen, wie Ihr Arzt bzw. Ihre Ärztin es verschrieben hat. Nur so erreichen Sie eine zuverlässige Kontrolle Ihres Blutdrucks.
Losartan HCT Zentiva kann mit oder ohne Mahlzeiten eingenommen werden. Die Einnahme ist am einfachsten und geht auch am wenigsten vergessen, wenn Sie Losartan HCT Zentiva immer zur gleichen Tageszeit einnehmen.
Patienten mit hohem Blutdruck: Die übliche Dosis beträgt 1 Tablette Losartan HCT Zentiva 50 mg/12,5 mg pro Tag. Damit kann bei den meisten Patienten der Blutdruck über 24 Stunden kontrolliert werden.
Patienten mit hohem Blutdruck und Linksherzvergrösserung: Die übliche Dosis beträgt 50 mg Losartan einmal täglich. Falls die erzielte Blutdruck-Senkung nicht erreicht wird mit Losartan 50 mg, so kann Ihr Arzt bzw. Ihre Ärztin eine Kombination von Losartan mit einer tiefen Dosierung von Hydrochlorothiazid (12,5 mg) verschreiben. Ihr Arzt bzw. Ihre Ärztin wird die Dosierung von Losartan und Hydrochlorothiazid schrittweise erhöhen, bis die für Sie richtige Dosierung erreicht ist.
Sollten Sie jedoch einmal die Einnahme vergessen, so nehmen Sie keine Extradosis ein, sondern fahren Sie am folgenden Tag wie gewohnt mit der Einnahme fort.
Bei einer Überdosierung sollten Sie sofort mit Ihrem Arzt bzw. Ihrer Ärztin Kontakt aufnehmen, sodass eine medizinische Behandlung rechtzeitig erfolgen kann.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin.
Welche Nebenwirkungen kann Losartan HCT Zentiva haben?
Jedes Arzneimittel kann unbeabsichtigte oder unerwünschte Wirkungen, sogenannte Nebenwirkungen, haben.
Die folgenden Nebenwirkungen wurden für die Kombination von Losartan-Kalium/Hydrochlorothiazid (Losartan HCT Zentiva) und/oder eine der einzelnen Wirksubstanzen (Losartan-Kalium und/oder Hydrochlorothiazid) beobachtet:
Sehr häufig: Kopfschmerzen;
Häufig: Schwindel, Drehschwindel, Schwächegefühl, Müdigkeit, Infektionen der oberen Atemwege, Schlaflosigkeit, Ruhelosigkeit, Herzklopfen, schneller Herzschlag, zu tiefer Blutdruck, Husten, Rachenentzündung, Nasenverstopfung, Nebenhöhlenerkrankungen, Übelkeit, Erbrechen, Bauchschmerzen, Verdauungsstörungen, Rückenschmerzen, Muskelkrämpfe, Muskelschmerzen, Gelenkschmerzen, Flüssigkeitsansammlung in den Geweben (Ödeme)/Schwellungen, Brustschmerzen, Unwohlsein, Erhöhung oder Senkung des Kaliumblutspiegels, erhöhte Leberenzyme, abnormale Menge Protein im Urin, Leberfunktionsstörungen.
Gelegentlich: Orthostatische Hypotonie (Blutdruckabfall beim Aufstehen, welche durch Alkohol, Anästhetika oder Beruhigungsmittel verstärkt werden kann), Erhöhung der Blutharnsäurespiegel, Senkung der Natrium- und Magnesiumspiegel im Blut, Appetitverlust,Nesselsucht und andere Hautausschläge.
Selten: Hautausschlag, Hautblutungen, Leberentzündung, Ansammlung von Gallenflüssigkeit oder Gelbsucht, Depression, Herzrhytmusstörungen, Erhöhung der Kalziumblutspiegel, Erhöhung der Blutzuckerspiegel, Verschlechterung des diabetischen Stoffwechsels, Zucker im Urin, Bewusstseinsstörung, Kribbelgefühl, Verstopfung, gastrointestinale Beschwerden, Entzündungsreaktionen der Blutgefässe (die mit einem Hautausschlag oder Bluterguss verbunden sein können), Impotenz, Migräne.
Sehr selten: Entzündung der Bauchspeicheldrüse, Abnahme der roten Blutzellen, weissen Blutzellen und der Blutplättchen, Lupus erythematodes (Immunstörung mit Beteiligung der Haut).
Über Überempfindlichkeitsreaktionen, hypochlorämische Alkalose (Ungleichgewicht von Säure und Base im Blut), Entzündung der Blutgefässwände, Atemwegsbeschwerden einschliesslich entzündliche Lungenerkrankung und Lungenödem, Durchfall, Sehstörungen (insbesondere in den ersten Wochen der Behandlung), Juckreiz, Lichtempfindlichkeit der Haut, schwere Hautreaktionen, Haut- und Lippenkrebs (nicht-melanozytärer Hautkrebs) wurde ebenfalls berichtet.
Für die vollständige Liste der Nebenwirkungen fragen Sie bitte Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin.
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin sofort, wenn Sie solche oder andere ungewöhnliche Symptome beobachten.
Wenn Sie eine allergische Reaktion mit Schwellung des Gesichts, der Lippen, des Rachens und/oder der Zunge (mit Schluck- oder Atembeschwerden) verspüren, unterbrechen Sie die Einnahme von Losartan HCT Zentiva und setzen Sie sich sofort mit Ihrem Arzt oder Ihrer Ärztin in Verbindung.
Wenn Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind, sollten Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin informieren.
Darüber hinaus sollten Sie Ihrem Arzt bzw. Ihrer Ärztin umgehend jegliche unerwarteten Veränderungen der Haut zeigen, die Sie während der Behandlung mit Losartan HCT Zentiva beobachten.
Was ist ferner zu beachten?
Bewahren Sie dieses Arzneimittel ausserhalb der Reichweite von Kindern auf.
Bewahren Sie Losartan HCT Zentiva vor Feuchtigkeit geschützt in der Originalverpackung nicht oberhalb von 30 °C auf.
Das Arzneimittel darf nur bis zu dem auf der Verpackung mit «EXP» bezeichneten Datum verwendet werden.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, der/die über die ausführliche Fachinformation verfügt.
Was ist in Losartan HCT Zentiva enthalten?
Losartan HCT Zentiva 50/12,5 mg: gelbe Filmtablette von ovaler Form, mit 50 mg Losartan-Kalium und 12,5 mg Hydrochlorothiazid als Wirkstoffe, dem Farbstoff Chinolingelb (E 104) sowie Hilfsstoffen (mit Bruchrille).
Losartan HCT Zentiva 100/12,5 mg: weisse Filmtablette von ovaler Form, mit 100 mg Losartan-Kalium und 12,5 mg Hydrochlorothiazid als Wirkstoffe sowie Hilfsstoffen.
Losartan HCT Zentiva 100/25 mg: gelbe Filmtablette von ovaler Form, mit 100 mg Losartan-Kalium und 25 mg Hydrochlorothiazid als Wirkstoffe, dem Farbstoff Chinolingelb (E 104) sowie Hilfsstoffen.
Wenn auch Losartan HCT Zentiva eine sehr geringe Menge Kalium enthält, kann es Kaliumzusätze nicht ersetzen. Falls Ihnen vom Arzt oder Ärztin Kaliumzusätze verordnet wurden, halten Sie sich weiter an seine/ihre Anweisungen.
Zulassungsnummer
61314 (Swissmedic).
Wo erhalten Sie Losartan HCT Zentiva? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliches Rezept.
Losartan HCT Zentiva 50 mg/12,5 mg: Packungen zu 28 und 98 Filmtabletten (mit Bruchrille).
Losartan HCT Zentiva 100 mg/12,5 mg: Packungen zu 28 und 98 Filmtabletten.
Losartan HCT Zentiva 100 mg/25 mg: Packungen zu 28 und 98 Filmtabletten.
Zulassungsinhaberin
Helvepharm AG, Frauenfeld.
Diese Packungsbeilage wurde im Juni 2019 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Qu’est-ce que le Losartan HCT Zentiva et quand doit-il être utilisé?
Losartan HCT Zentiva est une association médicamenteuse composée d'un inhibiteur des récepteurs de l'angiotensine II (losartan) et d'un diurétique (hydrochlorothiazide), qui ne doit être utilisée que sur prescription de votre médecin. Le losartan et l'hydrochlorothiazide agissent ensemble pour abaisser la tension artérielle élevée.
Le losartan, substance contenue dans Losartan HCT Zentiva, abaisse la tension artérielle en bloquant spécifiquement un facteur appelé angiotensine II. L'angiotensine II a normalement pour effet de contracter les vaisseaux sanguins. Le losartan contenu dans Losartan HCT Zentiva entraîne une dilatation des vaisseaux sanguins. L'hydrochlorothiazide contenu dans Losartan HCT Zentiva augmente l'élimination par vos reins de l'eau et du sel. Ensemble, le losartan et l'hydrochlorothiazide diminuent votre tension artérielle élevée. Bien que si votre médecin puisse vérifier l'efficacité du médicament en mesurant votre tension artérielle, vous ne ressentirez probablement aucune différence au niveau de votre bien-être lorsque vous prenez Losartan HCT Zentiva.
Votre médecin vous a prescrit Losartan HCT Zentiva parce que vous souffrez d'une tension artérielle trop élevée, qu'on appelle aussi hypertension. Si vous souffrez d'hypertension artérielle et présentez une hypertrophie ventriculaire gauche (un agrandissement du ventricule cardiaque le plus important pour le pompage), votre médecin vous a prescrit Losartan HCT Zentiva afin de réduire le risque d'un événement cardiovasculaire, p.ex. un accident vasculaire cérébral.
De quoi faut-il tenir compte en dehors du traitement?
Pourquoi faut-il traiter une tension artérielle élevée (hypertension)?
Si l'on ne traite pas une tension artérielle élevée, des organes vitaux tels que le cœur et les reins peuvent être endommagés. Même si vous vous sentez bien et n'avez aucun symptôme, une hypertension non traitée peut toutefois entraîner une attaque cérébrale, un infarctus cardiaque, une insuffisance cardiaque, un trouble de la fonction rénale ou une cécité.
Quand Losartan HCT Zentiva ne doit-il pas être pris/utilisé?
Vous ne devez pas prendre Losartan HCT Zentiva si vous:
- présentez une réaction allergique à l'un des composants de Losartan HCT Zentiva;
- êtes allergique aux médicaments dérivés des sulfamides (si vous ignorez quels sont les médicaments dérivés des sulfamides, interrogez votre médecin ou votre pharmacien);
- n'éliminez pas d'urine;
- souffrez d'une insuffisance hépatique ou rénale;
- souffrez de diabète ou d'une insuffisance rénale et suivez un traitement par l'aliskirène, (p.ex. Rasilez®) pour faire baisser votre tension artérielle;
- êtes enceinte ou envisagez une grossesse (voir sous «Quelles sont les précautions à observer lors de la prise/de l'utilisation de Losartan HCT Zentiva?» et «Losartan HCT Zentiva peut-il être pris/utilisé pendant la grossesse ou l'allaitement?»);
- Si vous avez pris d'autres antihypertenseurs par le passé et que ces traitements ont provoqué chez vous un gonflement du visage, des lèvres, de la langue ou du pharynx (troubles de la déglutition ou de la respiration), ne prenez pas Losartan HCT Zentiva.
Si vous n'êtes pas sûr(e) de pouvoir prendre Losartan HCT Zentiva, demandez l'avis de votre médecin ou pharmacien.
Quelles sont les précautions à observer lors de la prise/de l’utilisation de Losartan HCT Zentiva?
Vous devez informer votre médecin si vous pensez être (ou êtes susceptible de devenir) enceinte. L'utilisation de Losartan HCT Zentiva est déconseillée en début de grossesse et elle est contre-indiquée après le troisième mois de la grossesse, car elle pourrait être nuire gravement à l'enfant à naître à ce stade de la grossesse (voir sous «Quand Losartan HCT Zentiva ne doit-il pas être pris/utilisé?» et «Losartan HCT Zentiva peut-il être pris/utilisé pendant la grossesse ou l'allaitement?»).
Vous devez absolument informer votre médecin si vous souffrez d'une maladie du foie ou des reins, de goutte, de diabète ou d'un lupus érythémateux. Il importe également de lui signaler un éventuel traitement avec des diurétiques (produits qui stimulent l'excrétion urinaire). Dans ces cas, votre médecin peut considérer qu'un ajustement de la dose s'avère nécessaire.
Avant une intervention chirurgicale ou une anesthésie (même chez le dentiste), vous devez informer votre médecin ou votre dentiste de ce que vous prenez Losartan HCT Zentiva, étant donné qu'une brusque chute de tension peut survenir au cours de l'anesthésie.
Informez votre médecin si vous avez déjà eu un cancer de la peau ou si vous constatez une modification inattendue de votre peau pendant le traitement. Le traitement par l'hydrochlorothiazide (l'un des principes actifs de Losartan HCT Zentiva), en particulier à long terme et à fortes doses, est susceptible d'augmenter le risque de certains types de cancer de la peau et des lèvres (cancer de la peau non mélanocytaire). Protégez votre peau des rayonnements solaires et UV aussi longtemps que vous prenez Losartan HCT Zentiva et contrôlez régulièrement l'état de votre peau afin de pouvoir montrer à votre médecin toute modification inattendue.
On ne dispose d'aucune expérience concernant l'utilisation de Losartan HCT Zentiva chez les enfants. Par conséquent, Losartan HCT Zentiva ne doit pas être administré aux enfants.
De manière générale, l'efficacité et la tolérance de Losartan HCT Zentiva sont pareillement bonnes chez les patients âgés ou jeunes. La plupart des patients âgés requièrent la même posologie que les jeunes patients.
Pour votre médecin ou votre pharmacien, il est particulièrement important d'être informé de la prise des médicaments suivants: suppléments de potassium, substances d'épargne potassique, sels de régime contenant du potassium ou autres médicaments susceptibles d'augmenter le potassium sérique (p.ex. les antibiotiques contenant du triméthoprime), substances qui abaissent la tension artérielle, diurétiques (qui favorisent l'excrétion urinaire), médicaments diminuant le taux de cholestérol, médicaments pour le traitement du diabète, y compris l'insuline, myorelaxants, substances élevant la tension artérielle telles que l'adrénaline, médicaments qui diluent le sang, préparations de cortisone, certains médicaments destinés au traitement des douleurs et de l'arthrite, ainsi que le lithium (un médicament utilisé dans le traitement des dépressions). Etant donné que les somnifères, les tranquillisants, les narcotiques, l'alcool et les analgésiques peuvent renforcer l'effet antihypertenseur de Losartan HCT Zentiva, vous devriez informer votre médecin ou votre pharmacien si vous prenez l'un des médicaments cités.
En raison des effets secondaires possibles, une prudence particulière est de mise lors de la conduite de véhicules et l'utilisation de machines.
Veuillez informer votre médecin ou votre pharmacien si vous souffrez d'une autre maladie, vous êtes allergique ou vous prenez déjà d'autres médicaments (même en auto-médication!), si vous souffrez de diarrhées/de vomissements intenses.
Losartan HCT Zentiva peut-il être pris/utilisé pendant la grossesse ou l'allaitement?
Grossesse
Vous devez informer votre médecin si vous pensez être (ou êtes susceptible de devenir) enceinte. Votre médecin vous recommandera d'arrêter la prise de Losartan HCT Zentiva avant de devenir enceinte et vous recommandera un autre médicament à la place de Losartan HCT Zentiva. Losartan HCT Zentiva ne doit pas être pris pendant la grossesse, étant donné que la prise de Losartan HCT Zentiva peut nuire gravement à l'enfant à naître ou même causer sa mort.
Si vous devenez enceinte au cours de votre traitement par Losartan HCT Zentiva, vous devez immédiatement prévenir votre médecin afin qu'il puisse adapter votre traitement.
Allaitement
Vous ne devez pas allaiter si vous prenez Losartan HCT Zentiva.
Comment utiliser Losartan HCT Zentiva?
Vous devez prendre Losartan HCT Zentiva tous les jours, en suivant exactement les prescriptions de votre médecin. Il est essentiel que vous preniez Losartan HCT Zentiva aussi longtemps que votre médecin vous l'a prescrit. C'est la seule manière de parvenir à contrôler votre tension artérielle avec fiabilité.
Losartan HCT Zentiva peut être pris au cours des repas ou en dehors de ceux-ci. Le plus simple est de prendre Losartan HCT Zentiva chaque jour à la même heure, et les oublis sont alors moins fréquents.
Patients atteints d'hypertension artérielle: la dose usuelle est de 1 comprimé de Losartan HCT Zentiva 50 mg/ 12,5 mg par jour. Celle-ci permet, chez la plupart des patients, de contrôler la tension artérielle pendant 24 heures.
Patients atteints d'hypertension artérielle et présentant une hypertrophie ventriculaire gauche: la dose usuelle est de 50 mg de losartan une fois par jour. Lorsque la diminution souhaitée de la tension artérielle n'est pas obtenue avec losartan 50 mg, votre médecin peut prescrire une association de losartan et d'une faible dose d'hydrochlorothiazide (12,5 mg). Votre médecin augmentera progressivement la posologie du losartan et de l'hydrochlorothiazide, jusqu'à l'obtention de la dose adéquate.
Si vous deviez néanmoins oublier un jour de prendre le médicament, ne prenez pas de dose supplémentaire, mais continuez la prise dès le jour suivant selon le plan habituel.
En cas de surdosage, contactez immédiatement votre médecin afin qu'il puisse prendre les mesures nécessaires.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Quels effets secondaires Losartan HCT Zentiva peut-il provoquer?
Tout médicament peut avoir des effets non intentionnels ou indésirables, appelés effets secondaires.
Les effets secondaires ci-après ont été observés sous l'association de losartan potassium/hydrochlorothiazide (Losartan HCT Zentiva) et/ou l'un des principes actifs pris seuls (losartan potassium et/ou hydrochlorothiazide):
Très fréquents: maux de tête;
Fréquents: étourdissements, vertiges rotatoires, sensation de faiblesse, fatigue, infections des voies respiratoires supérieures, insomnie, agitation, palpitations cardiaques, accélération du rythme cardiaque, tension artérielle trop basse, toux, pharyngite, nez bouché, affections des sinus, nausées, vomissements, douleurs abdominales, troubles digestifs, douleurs dorsales, crampes musculaires, douleurs musculaires, douleurs articulaires, accumulation de liquide dans les tissus (œdèmes)/gonflements, douleurs thoraciques, sensation générale de malaise, augmentation ou baisse du taux de potassium dans le sang, élévation des enzymes hépatiques, quantité anormale de protéines dans les urines, troubles de la fonction hépatique;
Occasionnels: hypotension orthostatique (chute de tension en passant en position debout, laquelle peut être renforcée sous l'effet de l'alcool, de produits anesthésiques ou de tranquilisants), augmentation du taux d'acide urique dans le sang, baisse des taux de sodium et de magnésium dans le sang, perte de l'appétit, urticaire et autres éruptions cutanées;
Rares: éruption cutanée, saignements cutanés, hépatite (inflammation du foie), accumulation de bile ou jaunisse, dépression, troubles du rythme cardiaque, augmentation du taux de calcium dans le sang, augmentation de la glycémie (taux de sucre dans le sang), aggravation du trouble métabolique lié au diabète, présence de sucre dans les urines, trouble de la conscience, sensation de picotement, altération du goût, maux de ventre, constipation, troubles gastro-intestinaux, réactions inflammatoires des vaisseaux sanguins (qui peuvent être associées à une éruption cutanée ou un hématome), impuissance, migraine;
Très rares: inflammation du pancréas, réduction du nombre de globules rouges, de globules blancs et de plaquettes sanguines, lupus érythémateux (une maladie du système immunitaire qui affecte aussi la peau).
Des réactions d'hypersensibilité, une alcalose hypochlorémique (déséquilibre acido-basique dans le sang), une inflammation des parois vasculaires, des troubles respiratoires dont une maladie pulmonaire inflammatoire et un œdème pulmonaire, des diarrhées, des troubles visuels (en particulier au cours des premières semaines du traitement), des démangeaisons, une sensibilité de la peau à la lumière, des réactions cutanées sévères et un cancer de la peau et des lèvres (cancer de la peau non mélanocytaire) ont également été rapportés.
Pour avoir la liste complète des effets secondaires, renseignez-vous auprès de votre médecin ou pharmacien.
Informez immédiatement votre médecin ou votre pharmacien si vous observez ces symptômes ou d'autres symptômes inhabituels.
Si vous ressentez une réaction allergique avec gonflement du visage, des lèvres, de la gorge et/ou de la langue (difficultés à avaler ou respirer), arrêtez de prendre Losartan HCT Zentiva et contactez immédiatement votre médecin.
Si vous remarquez des effets secondaires qui ne sont pas mentionnés dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
Par ailleurs, vous devriez immédiatement montrer à votre médecin toute modification inattendue de votre peau que vous observez pendant le traitement avec Losartan HCT Zentiva.
A quoi faut-il encore faire attention?
Veuillez conserver ce médicament hors de la portée des enfants.
Veuillez conserver Losartan HCT Zentiva à l'abri de l'humidité dans l'emballage original, pas au-dessus de 30 °C.
Ce médicament ne doit pas être utilisé au-delà de la date imprimée sur l'emballage avec la mention «EXP».
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Losartan HCT Zentiva?
Losartan HCT Zentiva 50/12,5 mg: comprimé pelliculé jaune et ovale, contenant 50 mg de losartan potassium et 12,5 mg d'hydrochlorothiazide comme principes actifs, le colorant jaune quinoléine (E 104) et des excipients (avec entaille du rupture).
Losartan HCT Zentiva 100/12,5 mg: comprimé pelliculé blanc et ovale, contenant 100 mg de losartan potassium et 12,5 mg d'hydrochlorothiazide comme principes actifs et des excipients.
Losartan HCT Zentiva 100/25: comprimé pelliculé jaune et ovale, contenant 100 mg de losartan potassium et 25 mg d'hydrochlorothiazide comme principes actifs, le colorant jaune quinoléine (E 104) et des excipients.
Même si Losartan HCT Zentiva contient une quantité minime de potassium, il ne peut pas remplacer des suppléments potassiques. Si votre médecin vous a prescrit des suppléments potassiques, continuez à suivre sa prescription.
Numéro d'autorisation
61314 (Swissmedic).
Où obtenez-vous Losartan HCT Zentiva? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Losartan HCT Zentiva 50 mg/12,5 mg: emballages de 28 et 98 comprimés pelliculés (avec entaille du rupture).
Losartan HCT Zentiva 100 mg/12,5 mg: emballages de 28 et 98 comprimés pelliculés.
Losartan HCT Zentiva 100 mg/25 mg: emballages de 28 et 98 comprimés pelliculés.
Titulaire de l’autorisation
Helvepharm AG, Frauenfeld.
Cette notice d'emballage a été vérifiée pour la dernière fois en juin 2019 par l'autorité de contrôle des médicaments (Swissmedic).
Che cos'è Losartan HCT Zentiva e quando si usa?
Losartan HCT Zentiva è un preparato combinato composto da un inibitore dei recettori dell'angiotensina II (losartan) e un diuretico (idroclorotiazide), il quale deve essere utilizzato solo su prescrizione del suo medico. Losartan e idroclorotiazide agiscono sinergicamente per la riduzione dell'ipertensione.
Il losartan, la sostanza contenuta in Losartan HCT Zentiva, riduce la pressione arteriosa attraverso una specifica inibizione dell'angiotensina II. Normalmente l'angiotensina II causa una vasocostrizione. Il losartan contenuto in Losartan HCT Zentiva provoca una dilatazione dei vasi sanguigni. L'idroclorotiazide contenuta in Losartan HCT Zentiva aumenta l'eliminazione di acqua e sale attraverso i reni. Losartan e idroclorotiazide insieme diminuiscono l'ipertensione. Sebbene il suo medico possa verificare l'efficacia del medicamento misurando la pressione arteriosa, è probabile che durante il trattamento con Losartan HCT Zentiva Lei non percepisca nessuna differenza nel suo stato di salute.
Il medico le ha prescritto Losartan HCT Zentiva perché soffre di pressione alta, detta anche ipertensione. Se soffre di ipertensione e ipertrofia ventricolare sinistra (ingrossamento del ventricolo cardiaco sinistro, la parte del cuore più importante per il pompaggio), il suo medico le ha prescritto Losartan HCT Zentiva per ridurre il rischio di problemi cardiovascolari come ad es. un colpo apoplettico.
Di che cosa occorre tener conto durante il trattamento?
Perché l'ipertensione arteriosa deve essere trattata?
Se l'ipertensione arteriosa non viene trattata, possono venir danneggiati organi vitali, quali il cuore e i reni. Lei può anche sentirsi in forma e non avere sintomi, ma un'ipertensione arteriosa non trattata può eventualmente essere causa di un colpo apoplettico, un infarto cardiaco, un'insufficienza cardiaca, una disfunzione renale o la perdita della vista.
Quando non si può assumere/usare Losartan HCT Zentiva?
Non assuma Losartan HCT Zentiva se
- è allergico ad uno dei componenti di Losartan HCT Zentiva;
- è allergico ai medicamenti che derivano dai sulfamidici (se non le è chiaro, chieda al suo medico o al suo farmacista quali medicamenti derivano dai sulfamidici);
- non urina;
- ha una ridotta funzione epatica o renale;
- soffre di diabete o ridotta funzionalità renale e assume aliskiren (per es. Rasilez®) per ridurre la pressione arteriosa;
- è incinta o progetta una gravidanza (vedere «Quando è richiesta prudenza nella somministrazione/nell'uso di Losartan HCT Zentiva?» e «Si può assumere/usare Losartan HCT Zentiva durante la gravidanza o l'allattamento?»).
- Se in passato, dopo aver preso un farmaco contro l'ipertensione, si sono manifestati gonfiori al volto, alle labbra, alla lingua o in gola (difficoltà a deglutire o a respirare) non deve prendere Losartan HCT Zentiva.
Se non è sicuro di poter assumere Losartan HCT Zentiva si rivolga al suo medico o al suo farmacista.
Quando è richiesta prudenza nella somministrazione/nell’uso di Losartan HCT Zentiva?
Informi il suo medico se sospetta di essere incinta (o di poter rimanere incinta). L'assunzione di Losartan HCT Zentiva nella prima fase della gravidanza non è raccomandata e Losartan HCT Zentiva non deve essere più preso dopo il terzo mese di gravidanza, dato che l'assunzione di Losartan HCT Zentiva in questo stadio può portare a gravi danni per il nascituro (vedere «Quando non si può assumere Losartan HCT Zentiva» e «Si può assumere/usare Losartan HCT Zentiva durante la gravidanza o l'allattamento?»).
Se soffre di malattie epatiche o renali, di gotta, diabete o lupus eritematoso, il suo medico ne deve essere assolutamente informato. È importante sapere anche se ha seguito un trattamento con diuretici (medicamenti per eliminare urina). In questo caso il suo medico potrà ritenere necessario un adattamento della dose.
Prima di un intervento chirurgico o di un'anestesia (anche dal dentista) dovrà informare il suo medico o il dentista che fa uso di Losartan HCT Zentiva, in quanto durante l'anestesia può manifestarsi un improvviso calo della pressione.
Informi il suo medico se ha già avuto una volta un cancro della pelle o se durante il trattamento nota un cambiamento inaspettato della pelle. Il trattamento con idroclorotiazide (uno dei principi attivi di Losartan HCT Zentiva), in particolare per lunghi periodi di tempo e ad alto dosaggio, può far aumentare il rischio di determinati cancri della pelle e delle labbra (cancro cutaneo non melanoma). Protegga la pelle dalla luce solare e dai raggi UV durante l'uso di Losartan HCT Zentiva e controlli regolarmente la pelle per poter mostrare al suo medico cambiamenti inaspettati.
Non sono disponibili esperienze circa il trattamento di bambini con Losartan HCT Zentiva. Losartan HCT Zentiva non deve essere perciò somministrato ai bambini.
L'efficacia e la tollerabilità di Losartan HCT Zentiva in pazienti anziani e giovani sono generalmente buone per entrambi. La maggior parte dei pazienti anziani necessita della stessa dose dei pazienti più giovani.
È particolarmente importante che il medico o il farmacista siano informati se assume i seguenti medicamenti: integratori di potassio, medicamenti risparmiatori di potassio, sali dietetici contenenti potassio o altri medicamenti che possono aumentare il potassio nel siero (es. antibiotici contenenti trimetoprim), sostanze che riducono la pressione arteriosa, diuretici (medicamenti per eliminare urina), medicamenti che riducono il colesterolo, medicamenti per il trattamento del diabete (compresa l'insulina), miorilassanti, sostanze che aumentano la pressione sanguigna come l'adrenalina, diluenti del sangue, preparati cortisonici, determinati medicamenti contro il dolore e le infiammazioni articolari, litio (medicamento utilizzato per il trattamento della depressione). Sonniferi, tranquillanti, narcotici, alcool e analgesici possono aumentare l'effetto antiipertensivo di Losartan HCT Zentiva, e perciò il medico o il suo farmacista deve essere informato se assume questi medicamenti.
A causa dei possibili effetti collaterali si raccomanda cautela nella guida di veicoli e nell'utilizzazione di macchine.
Informi il suo medico o il suo farmacista nel caso in cui soffra di altre malattie, soffra di allergie o assuma altri medicamenti (anche se acquistati di sua iniziativa!) o soffra di diarrea / vomito eccessivi.
Si può assumere/usare Losartan HCT Zentiva durante la gravidanza o l’allattamento?
Gravidanza
Informi il suo medico se sospetta di essere incinta (o di poter rimanere incinta). Il medico le raccomanderà di sospendere l'assunzione di Losartan HCT Zentiva durante la gravidanza, consigliandole un altro medicamento al posto di Losartan HCT Zentiva. Non si deve prendere Losartan HCT Zentiva durante la gravidanza, dato che l'assunzione di Losartan HCT Zentiva può arrecare gravi danni al nascituro o causarne la morte.
Se rimane incinta durante l'assunzione di Losartan HCT Zentiva deve informare immediatamente il suo medico, in modo che la sua terapia possa essere modificata di conseguenza.
Allattamento
Se prende Losartan HCT Zentiva non può allattare il suo bambino.
Come usare Losartan HCT Zentiva?
Assuma Losartan HCT Zentiva giornalmente, esattamente come le è stato prescritto dal suo medico. È importante che prosegua il trattamento con Losartan HCT Zentiva per tutto il periodo prescritto dal suo medico. Solo in questo modo potrà raggiungere un controllo affidabile della pressione arteriosa.
Losartan HCT Zentiva può essere assunto insieme ai pasti o indipendentemente dai pasti. L'assunzione è più semplice e viene più difficilmente dimenticata se avviene sempre alla stessa ora del giorno.
Pazienti con ipertensione: la dose usuale è di 1 compressa di Losartan HCT Zentiva 50 mg/12,5 mg al giorno. In questo modo la pressione arteriosa della maggioranza dei pazienti può essere tenuta sotto controllo per 24 ore.
Pazienti con ipertensione e ipertrofia ventricolare sinistra (ingrossamento del ventricolo cardiaco sinistro): la dose usuale è 50 mg di losartan una volta al giorno. Se con losartan 50 mg non si ottiene l'abbassamento di pressione desiderato, il suo medico le potrà prescrivere una combinazione di losartan con un basso dosaggio di idroclorotiazide (12,5 mg). Il suo medico aumenterà il dosaggio di losartan e idroclorotiazide gradualmente fino a raggiungere la dose adatta a lei.
Se una volta dovesse dimenticare di assumere la compressa, non prenda una dose extra, bensì prosegua l'assunzione il giorno seguente come d'abitudine.
In caso di sovradosaggio prenda immediatamente contatto con il suo medico, in modo che si possa iniziare tempestivamente un trattamento.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte, ne parli al suo medico o al suo farmacista.
Quali effetti collaterali può avere Losartan HCT Zentiva?
Ogni medicamento può avere degli effetti imprevisti o indesiderati, i cosiddetti effetti
collaterali.
I seguenti effetti collaterali sono stati osservati per la combinazione losartan potassico / idroclorotiazide (Losartan HCT Zentiva) e/o per uno dei singoli principi attivi (losartan potassico e/o idroclorotiazide).
Molto comune: cefalea.
Comune: capogiri, vertigini rotatorie, debolezza, stanchezza, infezione delle vie respiratorie superiori, insonnia, irrequietezza, palpitazioni, tachicardia, ipotensione arteriosa, tosse, infiammazione della gola, occlusione nasale, malattie dei seni paranasali, nausea, vomito, dolori addominali, disturbi della digestione, dolori alla schiena, crampi muscolari, dolori muscolari, dolori articolari, edemi (accumulo di liquidi nei tessuti) / gonfiori, dolori al petto, malessere, aumento o riduzione dei livelli di potassio nel sangue, aumento degli enzimi epatici, anormale quantità di proteine nelle urine, disfunzioni epatiche.
Non comune: ipotensione ortostatica (caduta della pressione arteriosa nell'alzarsi in piedi, che può essere accentuata dall'alcool, dagli anestetici o dai tranquillanti), aumento dei livelli di acido urico nel sangue, riduzione dei livelli di sodio e magnesio nel sangue, perdita dell'appetito, orticaria e altre eruzioni cutanee.
Raro: eruzione cutanea, sanguinamenti cutanei, infiammazione del fegato, accumulo di bile o ittero, depressione, aritmie cardiache, aumento dei livelli di calcio nel sangue, aumento del livello glicemico, peggioramento del metabolismo diabetico, zucchero nelle urine, disturbi della coscienza, formicolio, compromissione del gusto, disturbi addominali, stipsi, disturbi gastrointestinali, reazioni infiammatorie dei vasi sanguigni (che possono essere collegate a un'eruzione cutanea o a un ematoma), impotenza, emicrania.
Molto raro: pancreatite, riduzione del numero di globuli rossi, globuli bianchi e piastrine, lupus eritematoso (disturbo immunitario con interessamento della cute).
Sono stati segnalati anche reazioni di ipersensibilità, alcalosi ipocloremica (disturbo dell'equilibrio acido/base nel sangue), infiammazione delle pareti vasali, disturbi delle vie respiratorie (compresi polmonite ed edema polmonare), diarrea, disturbi della vista (soprattutto le prime settimane di trattamento), prurito, fotosensibilità cutanea, reazioni cutanee gravi, cancro della pelle e delle labbra (cancro cutaneo non melanoma).
Per la lista completa degli effetti collaterali si rivolga al suo medico o al suo farmacista.
Informi immediatamente il suo medico o il suo farmacista se dovessero manifestarsi questi o altri sintomi insoliti.
Se presenta una reazione allergica con gonfiore del viso, delle labbra, della gola e/o della lingua (con difficoltà di deglutizione o di respirazione), interrompa l'assunzione di Losartan HCT Zentiva e si metta immediatamente in contatto con il suo medico.
Se osserva effetti collaterali qui non descritti dovrebbe informare il suo medico o il suo farmacista.
Inoltre, dovrebbe mostrare immediatamente al suo medico qualsiasi cambiamento inaspettato della pelle che osserva durante il trattamento con Losartan HCT Zentiva.
Di che altro occorre tener conto?
Conservi questo medicamento fuori dalla portata dei bambini.
Conservi Losartan HCT Zentiva al riparo da umidità nell'imballaggio originale non maggiore di 30 °C.
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Losartan HCT Zentiva?
Losartan HCT Zentiva 50/12,5 mg: compressa rivestita di colore giallo e di forma ovale, con 50 mg di losartan potassico e 12,5 mg di idroclorotiazide come sostanze attive, colorante giallo chinolina (E 104), nonché sostanze ausiliarie (divisibile).
Losartan HCT Zentiva 100/12,5 mg: compressa rivestita di colore bianco e di forma ovale, con 100 mg di losartan potassico e 12,5 mg di idroclorotiazide come sostanze attive, nonché sostanze ausiliarie.
Losartan HCT Zentiva 100/25 mg: compressa rivestita di colore giallo e di forma ovale, con 100 mg di losartan potassico e 25 mg di idroclorotiazide come sostanze attive, colorante giallo chinolina (E 104), nonché sostanze ausiliarie.
Anche se Losartan HCT Zentiva contiene una quantità di potassio molto piccola, non può rimpiazzare gli integratori di potassio. Se il suo medico le ha prescritto una terapia con integratori di potassio, si attenga alle sue indicazioni.
Numero dell’omologazione
61314 (Swissmedic).
Dov’è ottenibile Losartan HCT Zentiva? Quali confezioni sono disponibili?
In farmacia, dietro presentazione della prescrizione medica.
Losartan HCT Zentiva 50/12,5 mg: confezioni da 28 e 98 compresse rivestite (co canalatura).
Losartan HCT Zentiva 100/12,5 mg: confezioni da 28 e 98 compresse rivestite.
Losartan HCT Zentiva 100/25 mg: confezioni da 28 e 98 compresse rivestite.
Titolare dell’omologazione
Helvepharm AG, Frauenfeld.
Questo foglietto illustrativo è stato controllato l'ultima volta nel giugno 2019 dall'autorità competente in materia di medicamenti (Swissmedic).
Zusammensetzung
Wirkstoffe: Losartan-Kalium und Hydrochlorothiazid.
Hilfsstoffe
Losartan HCT Zentiva 50/12,5 mg: Color: E 104, Excipiens pro compresso obducto.
Losartan HCT Zentiva 100/12,5 mg: Excipiens pro compresso obducto.
Losartan HCT Zentiva 100/25 mg: Color: E 104, Excipiens pro compresso obducto.
Darreichungsform und Wirkstoffmenge pro Einheit
Losartan HCT Zentiva 50/12,5 mg: Filmtablette zu 50 mg Losartan-Kalium und 12,5 mg Hydrochlorothiazid (mit Bruchrille).
Losartan HCT Zentiva 100/12,5 mg: Filmtablette zu 100 mg Losartan-Kalium und 12,5 mg Hydrochlorothiazid.
Losartan HCT Zentiva 100/25 mg: Filmtablette zu 100 mg Losartan-Kalium und 25 mg Hydrochlorothiazid.
Kaliumgehalt der Filmtabletten: Losartan HCT Zentiva 50/12,5 mg: 4,24 mg (0,108 mAeq) K, Losartan HCT Zentiva 100/12,5 mg und 100/25 mg: 8,48 mg (0,216 mAeq) K.
Indikationen/Anwendungsmöglichkeiten
Hypertonie
Losartan HCT Zentiva ist indiziert zur Behandlung von Patienten mit Hypertonie, bei denen eine Kombinationsbehandlung angemessen ist.
Hypertonie mit linksventrikulärer Hypertrophie
Reduktion des Schlaganfallrisikos bei Hypertonikern mit linksventrikulärer Hypertrophie (siehe «Eigenschaften/Wirkungen», «LIFE Studie, Patienten mit schwarzer Hautfarbe»).
Dosierung/Anwendung
Hypertonie
Die übliche Anfangs- und Erhaltungsdosis beträgt 1 Filmtablette Losartan HCT Zentiva 50 mg/12,5 mg pro Tag. Für Patienten, welche ungenügend auf Losartan HCT Zentiva 50 mg/12,5 mg ansprechen, kann die Dosis auf 1 Filmtablette Losartan HCT Zentiva 100 mg/25 mg einmal täglich oder auf 2 Filmtabletten Losartan HCT Zentiva 50 mg/12,5 mg einmal täglich erhöht werden. Die maximale Dosierung beträgt 1 Filmtablette Losartan HCT Zentiva 100 mg/25 mg einmal täglich oder 2 Filmtabletten Losartan HCT Zentiva 50 mg/12,5 mg einmal täglich. Die antihypertensive Wirkung wird im Allgemeinen innerhalb von 3 Wochen nach Therapiebeginn erreicht. Losartan HCT Zentiva 100 mg/12,5 mg ist für Patienten vorgesehen, die bereits auf Losartan Zentiva 100 mg eingestellt sind und eine zusätzliche Kontrolle des Blutdruckes benötigen.
Hypertonie mit linksventrikulärer Hypertrophie
Die normale Anfangsdosierung ist 50 mg Losartan einmal täglich. Falls die Ziel-Blutdruckwerte mit Losartan 50 mg nicht erreicht werden, dann sollte die Behandlung durch das Kombinieren von Losartan mit einer tiefen Dosierung von Hydrochlorothiazid (12,5 mg) angepasst werden. Falls nötig, kann die Dosierung dann auf 100 mg Losartan/12,5 mg Hydrochlorothiazid einmal täglich, oder auf 100 mg Losartan/25 mg Hydrochlorothiazid einmal täglich erhöht werden. Losartan HCT Zentiva ist eine angemessene alternative Formulierung für Patienten, die ansonsten mit Losartan und gleichzeitigem Hyrochlorothiazid behandelt würden.
Spezielle Dosierungsanweisungen
Volumenmangel
Losartan HCT Zentiva sollte bei Patienten mit intravaskulärer Volumendepletion nicht angewendet werden (z.B. Patienten unter Behandlung mit hohen Dosen von Diuretika).
Ältere Patienten/Nieren- und Leberfunktionsstörungen
Bei Patienten mit schwerer Einschränkung der Leberfunktion und der Nierenfunktion (Kreatininclearance ≤30 ml/min) wird die Anwendung von Losartan HCT Zentiva nicht empfohlen.
Für ältere Patienten ist keine initiale Dosisanpassung von Losartan HCT Zentiva 50 mg/12,5 mg erforderlich. Losartan HCT Zentiva 100 mg/12,5 mg und Losartan HCT Zentiva 100 mg/25 mg sollten nicht als Initialtherapie bei älteren Patienten verwendet werden.
Kinder und Jugendliche
Losartan HCT Zentiva sollte bei Kindern und Jugendlichen nicht angewendet werden, da die Sicherheit und Wirksamkeit bei Kindern und Jugendlichen nicht untersucht wurde.
Losartan HCT Zentiva kann auch mit anderen Antihypertonika kombiniert werden.
Losartan HCT Zentiva kann vor, während oder nach einer Mahlzeit eingenommen werden.
Kontraindikationen
Losartan HCT Zentiva ist kontraindiziert:
- bei Patienten, welche eine Überempfindlichkeit auf die Wirksubstanzen oder einen anderen Inhaltsstoff des Produkts aufweisen;
- bei Patienten mit Anurie;
- bei Patienten, welche eine Überempfindlichkeit gegenüber anderen Sulfonamidderivaten aufweisen;
- in der Schwangerschaft (siehe «Schwangerschaft/Stillzeit»);
- bei Patienten mit schwerer Einschränkung der Leber- oder Nierenfunktion (Kreatininclearance ≤30 ml/min);
- Losartan HCT Zentiva ist ferner kontraindiziert bei Patienten mit hereditärem Angioödem oder bei denen sich unter einer früheren Behandlung mit einem ACE-Hemmer oder Angiotensin-II-Rezeptor-Antagonisten ein angioneurotisches Ödem entwickelt hatte.
Die gleichzeitige Anwendung von Losartan HCT Zentiva mit Aliskiren-haltigen Arzneimitteln ist bei Patienten mit Diabetes mellitus oder eingeschränkter Nierenfunktion (GFR <60 ml/min/1,73 m2) kontraindiziert.
Warnhinweise und Vorsichtsmassnahmen
Losartan Hydrochlorothiazid
Fetale Toxizität
Die Anwendung von Arzneimitteln wie zum Beispiel Losartan HCT Zentiva, das auf das Renin-Angiotensin-System wirkt, im zweiten und dritten Trimester einer Schwangerschaft reduziert die fetale Nierenfunktion und erhöht die fetale und neonatale Morbidität und Mortalität. Ein daraus resultierendes Oligohydramnion kann mit einer fetalen Lungenhypoplasie und einer Deformation des Skeletts assoziiert sein. Potenzielle neonatale unerwünschte Wirkungen beinhalten Schädelhypoplasie, Anurie, Hypotonie, Nierenversagen und Tod. Sobald eine Schwangerschaft festgestellt wird, muss Losartan HCT Zentiva sobald wie möglich abgesetzt werden (siehe «Schwangerschaft/Stillzeit»).
Überempfindlichkeit
Angioödem – siehe «Unerwünschte Wirkungen».
Potentielle Interaktionen von Losartan HCT Zentiva mit oralen Antikoagulantien sind nicht untersucht worden.
Losartan
Einschränkung der Nierenfunktion
Als Folge der Hemmung des Renin-Angiotensin-Systems wurde bei einzelnen Personen über Veränderungen der Nierenfunktion einschliesslich Nierenversagen berichtet; diese Veränderungen der Nierenfunktion können nach Absetzen der Therapie reversibel sein.
Bei Nierenarterien-Stenosen kann das Arzneimittel möglicherweise zu einer massiven Hypotonie führen.
Andere das Renin-Angiotensin-System beeinflussende Arzneimittel können bei Patienten mit bilateraler Nierenarterienstenose oder einer Stenose der Arterie einer Einzelniere die Blutharnstoff- und Serumkreatininwerte erhöhen. Ähnliche Effekte wurden mit Losartan gemeldet; diese Veränderungen der Nierenfunktion können nach Absetzen der Therapie reversibel sein.
Bei Patienten mit Hypovolämie (z.B. nach hochdosierter Diuretikabehandlung) muss mit symptomatischem Blutdruckabfall gerechnet werden. Losartan HCT Zentiva sollte bei Patienten mit intravaskulärer Volumendepletion nicht angewendet werden.
Erhöhung des Serumkaliums
Die gleichzeitige Anwendung von anderen Arzneimitteln, die das Serumkalium erhöhen können, kann zu einer Hyperkaliämie führen (siehe «Interaktionen»).
Einschränkung der Leberfunktion
Aufgrund pharmakokinetischer Daten konnte bei zirrhotischen Patienten eine signifikante Erhöhung der Plasmakonzentrationen von Losartan gezeigt werden. Daher sollte bei Patienten mit Leberfunktionsstörungen in der Anamnese eine niedrigere Anfangsdosis in Betracht gezogen werden (siehe «Dosierung/Anwendung» und «Pharmakokinetik»).
«Duale Blockade» des Renin-Angiotensin-Aldosteron-Systems
Siehe «Interaktionen».
Hydrochlorothiazid
Hypotonie und Störungen des Elektrolyt- und Flüssigkeitsgleichgewichts
Wie mit jeder anderen antihypertensiven Therapie kann bei einigen Patienten eine symptomatische Hypotonie auftreten. Während diese Nebenwirkung bei Patienten mit unkomplizierter Hypertonie nur selten beobachtet wurde, ist sie bei gestörter Flüssigkeits- und Elektrolytbalance wahrscheinlicher. Die Patienten sollten auf klinische Anzeichen von Flüssigkeits- oder Elektrolytgleichgewichtsstörungen überwacht werden, z.B. Volumenmangel, Hyponatriämie, hypochlorämische Alkalose, Hypomagnesiämie oder Hypokaliämie, welche während hinzutretendem Durchfall oder Erbrechen auftreten können. Bei Patienten unter diuretischer Behandlung sollten deshalb periodisch Bestimmungen der Serumelektrolyte durchgeführt werden.
Metabolische und endokrine Effekte
Thiazide können die Glucosetoleranz verschlechtern. Eine Anpassung der antidiabetischen Behandlung, inkl. Insulin, kann deshalb notwendig sein (siehe «Interaktionen»).
Thiazide können die renale Ausscheidung von Kalzium vermindern und zu vorübergehender und leichter Erhöhung von Serumkalzium führen. Eine ausgeprägte Hypercalcämie kann auf einen verborgenen Hyperparathyreoidismus hinweisen. Thiazide sollten deshalb vor Funktionsprüfungen der Nebenschilddrüsen abgesetzt werden.
Die diuretische Behandlung mit Thiaziden kann zu erhöhten Werten für Cholesterin und Triglyceride führen.
Thiazide können bei prädisponierten Patienten zu Hyperurikämie und/oder Gicht führen. Weil Losartan die Harnsäure senkt, vermindert die Kombination von Hydrochlorothiazid mit Losartan das Risiko einer Diuretika-induzierten Hyperurikämie.
Andere
Unter Behandlung mit Thiaziden können bei Patienten mit oder ohne Anamnese einer Allergie oder eines Asthma bronchiale Überempfindlichkeitsreaktionen auftreten. Eine Exacerbation oder das Auftreten eines systemischen Lupus erythematodes wurde unter Behandlung mit Thiaziden beobachtet.
Nicht-melanozytäre Malignome der Haut
In zwei epidemiologischen Studien auf Basis des dänischen nationalen Krebsregisters wurde ein erhöhtes Risiko für nicht-melanozytäre Malignome der Haut in Form von Basalzellkarzinom (BCC) und Plattenepithelkarzinomen (SCC) unter zunehmender kumulativer Hydrochlorothiazid-Exposition beobachtet. Die photosensibilisierende Wirkung von Hydrochlorothiazid könnte als potentieller Mechanismus an der Entwicklung von nicht-melanozytären Malignomen der Haut beteiligt sein.
Patienten, die Hydrochlorothiazid anwenden, sind über das Risiko für nicht-melanozytäre Malignome der Haut aufzuklären und anzuweisen, ihre Haut regelmässig auf neue Läsionen zu kontrollieren und jegliche verdächtige Hautveränderungen umgehend zu melden. Den Patienten sind Präventivmassnahmen wie eine begrenzte Sonnenlicht-/UV-Exposition und ein angemessener Sonnenschutz bei Exposition zu empfehlen, um das Hautkrebsrisiko zu minimieren. Verdächtige Hautveränderungen sind umgehend zu untersuchen, gegebenenfalls mittels histologischer Analyse von Biopsien. Bei Patienten mit nicht-melanozytären Malignomen der Haut in der Vorgeschichte ist die Anwendung von Hydrochlorothiazid möglicherweise zu überdenken (siehe auch Abschnitt «Unerwünschte Wirkungen»).
Kinder und Jugendliche
Die Wirksamkeit und Sicherheit der Behandlung bei Kindern und Jugendlichen wurden nicht überprüft.
Neugeborene mit einer Anamnese einer in utero Exposition durch Losartan HCT Zentiva
Wenn eine Oligurie oder eine Hypotonie auftritt, soll die Aufmerksamkeit der Unterstützung des Blutdrucks und der Nierendurchblutung zugewandt werden. Eine Austauschtransfusion oder eine Dialyse kann notwendig sein, um eine Hypotonie rückgängig zu machen und/oder eine Nierenfunktionsstörung zu substituieren.
Anwendung bei älteren Patienten
In klinischen Versuchen ergaben sich keine altersabhängigen Unterschiede bezüglich der Wirksamkeit oder Sicherheit einer Behandlung mit Losartan Kalium/Hydrochlorothiazid.
Interaktionen
Losartan
In klinischen pharmakokinetischen Studien wurden keine klinisch bedeutsamen Interaktionen mit folgenden Substanzen beobachtet: Hydrochlorothiazid, Digoxin, Warfarin, [siehe unten: Hydrochlorothiazid, Alkohol, Barbiturate oder Narkotika], Ketoconazol und Erythromycin. Phenobarbital als Enzyminduktor führte zu einer ca. 20%-igen Abnahme der AUC von Losartan und seines aktiven Metaboliten. Cimetidin als Enzymhemmer führte zu einer 18%-igen Zunahme der AUC von Losartan, nicht aber seines aktiven Metaboliten. Diese Effekte werden nicht als klinisch signifikant erachtet. Bei Rifampicin und Fluconazol wurde über reduzierte Spiegel des aktiven Metaboliten berichtet. Die klinischen Folgen dieser Interaktionen wurden nicht evaluiert.
Wie bei anderen Arzneimittel, welche Angiotensin II oder seine Wirkungen blockieren, kann die gleichzeitige Anwendung von kaliumsparenden Diuretika (z.B. Spironolakton, Triamteren, Amilorid), Kaliumzusätzen, kaliumhaltigen Diätsalzen oder andere Arzneimittel, die das Serumkalium erhöhen können (z.B. Trimethoprim-haltige Arzneimittel), zu Erhöhung der Serumkaliumspiegel führen.
Wie bei anderen Arzneimitteln, die die Ausscheidung von Natrium beeinflussen, kann die Ausscheidung von Lithium vermindert sein. Deshalb sollten die Serum-Lithiumwerte sorgfältig überwacht werden, falls Lithiumsalze zusammen mit Angiotensin-II-Rezeptor-Antagonisten verabreicht werden.
Potentielle Interaktionen von Losartan HCT Zentiva mit oralen Antikoagulantien wurden nicht untersucht.
Studien mit Losartan HCT Zentiva und Acenocoumarol und Phenprocoumon wurden nicht durchgeführt.
Nicht-steroidale entzündungshemmende Arzneimittel (NSAIDs) inklusive selektive Cyclooxygenase-2-Inhibitoren (COX-2-Inhibitoren) können den Effekt von Diuretika und anderen blutdrucksenkenden Arzneimitteln abschwächen. Aus diesem Grund kann die blutdrucksenkende Wirkung von Angiotensin-II-Rezeptor-Antagonisten oder ACE-Hemmern durch NSAIDs inklusive selektive COX-2-Inhibitoren vermindert werden.
Bei Patienten mit eingeschränkter Nierenfunktion (z.B. älteren Patienten oder Patienten mit Volumenmangel, inkl. solchen unter Diuretikatherapie), die mit nicht-steroidalen entzündungshemmenden Arzneimitteln inklusive selektiven Cyclooxygenase-2-Inhibitoren behandelt werden, kann die gleichzeitige Verabreichung von Angiotensin-II-Rezeptor-Antagonisten oder ACE-Hemmern zu einer weiteren Verschlechterung der Nierenfunktion führen, inkl. möglichem akutem Nierenversagen. Diese Effekte sind normalerweise reversibel. Deshalb sollte die Kombination bei Patienten mit eingeschränkter Nierenfunktion mit Vorsicht angewendet werden.
Duale Blockade des Renin-Angiotensin-Aldosteron-Systems (RAAS)
Es gibt Belege dafür, dass die gleichzeitige Anwendung von ACE-Hemmern, Angiotensin-II-Rezeptor-Antagonisten oder Aliskiren das Risiko für Hypotonie, Hyperkaliämie und eine Abnahme der Nierenfunktion (einschliesslich eines akuten Nierenversagens) erhöht. Eine duale Blockade des RAAS durch die gleichzeitige Anwendung von ACE-Hemmern, Angiotensin-II-Rezeptor-Antagonisten oder Aliskiren wird deshalb nicht empfohlen.
Wenn die Therapie mit einer dualen Blockade als absolut notwendig erachtet wird, sollte dies nur unter Aufsicht eines Spezialisten und unter Durchführung engmaschiger Kontrollen von Nierenfunktion, Elektrolytwerten und Blutdruck erfolgen.
ACE-Hemmer und Angiotensin-II-Rezeptor-Antagonisten sollten bei Patienten mit diabetischer Nephropathie nicht gleichzeitig angewendet werden.
Hydrochlorothiazid
Die folgenden Substanzen können bei gleichzeitiger Verabreichung zu Interaktionen führen:
Alkohol, Barbiturate, Narkotika: Verstärkung der orthostatischen Hypotension.
Antidiabetika: (orale Substanzen und Insulin): Dosisanpassung der antidiabetischen Medikation kann notwendig sein.
Andere Antihypertonika: additiver Effekt.
Cholestyramin und Colestipol Ionenaustauscherharze: Die Absorption von Hydrochlorothiazid wird durch Anionenaustauschharze verschlechtert. Einzeldosen von Cholestyramin bzw. Colestipol binden Hydrochlorothiazid und reduzieren die gastrointestinale Absorption um bis zu 85 bzw. 43%.
Corticosteroide, ACTH, oder Glycyrrhizin (in Lakritze vorhanden), Amphotericin, Carbenoxolon: Verstärkung eines Elektrolytmangels, insbesondere Hypokaliämie.
Katecholamine (z.B. Adrenalin): Eine Reduktion der Wirkung von Vasopressoren ist möglich, was deren Anwendung aber nicht verbietet.
Nicht-depolarisierende Muskelrelaxantien (z.B. Tubocurarin): Verstärkte Wirkung der Muskelrelaxantien ist möglich.
Lithium: Diuretika reduzieren die renale Ausscheidung von Lithium und erhöhen das Risiko einer Lithium-Intoxikation. Eine gleichzeitige Behandlung wird deshalb nicht empfohlen. Packungsbeilagen von Lithiumpräparaten sind vor deren Gebrauch zu konsultieren.
Nichtsteroidale Antirheumatika inklusive Cyclooxygenase-2 Inhibitoren: Die Verabreichung von nichtsteroidalen Antirheumatika inklusive selektiven Cyclooxygenase-2-Inhibitoren kann die diuretische, natriuretische und antihypertensive Wirkung der Diuretika vermindern.
Bei Patienten mit eingeschränkter Nierenfunktion (z.B. ältere Patienten oder Patienten mit Volumenmangel, inkl. solchen unter Diuretikatherapie), die mit nicht-steroidalen entzündungshemmenden Arzneimitteln, inklusive selektiven Cyclooxygenase-2-Inhibitoren behandelt werden, kann die gleichzeitige Verabreichung von Angiotensin-II-Rezeptor-Antagonisten oder ACE-Hemmern zu einer weiteren Verschlechterung der Nierenfunktion führen, inkl. möglichem akutem Nierenversagen. Diese Effekte sind normalerweise reversibel. Deshalb sollte die Kombination bei Patienten mit eingeschränkter Nierenfunktion mit Vorsicht angewendet werden.
Allopurinol: Erhöhung der Häufigkeit von Überempfindlichkeitsreaktionen auf Allopurinol.
Antineoplastika (z.B. Methotrexat, Cyclophosphamid): Verminderung der renalen Ausscheidung von Antineoplastika.
Amantadin: Erhöhung des Risikos unerwünschter Wirkungen von Amantadin.
Anticholinergika (z.B. Atropin, Biperiden): Erhöhung der Bioverfügbarkeit thiazidartiger Diuretika.
Vitamin D: Verstärkung des Anstiegs von Serumkalzium.
Cyclosporin: Erhöhung des Risikos einer Hyperurikämie und gichtartiger Komplikationen.
Kalziumsalze: Thiazidartige Diuretika können durch Erhöhung der tubulären Rückresorption von Kalzium zu einer Hyperkalzämie führen.
Diazoxid: Verstärkung des hyperglykämischen Effekts von Diazoxid.
Interaktionen mit Arzneimittel/Laboruntersuchungen
Aufgrund ihrer Wirkungen auf den Calziumstoffwechsel können Thiazide die Untersuchungsmethoden für die Nebenschilddrüsen beeinflussen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Schwangerschaft/Stillzeit
Schwangerschaft
Losartan HCT Zentiva ist während der Schwangerschaft kontraindiziert (siehe «Kontraindikationen»). Sobald eine Schwangerschaft festgestellt wird, muss Losartan HCT Zentiva sobald wie möglich abgesetzt werden.
Es liegen keine endgültigen epidemiologischen Daten hinsichtlich eines teratogenen Risikos nach Anwendung von ACE-Hemmern während des ersten Schwangerschaftstrimesters vor; ein geringfügig erhöhtes Risiko kann jedoch nicht ausgeschlossen werden. Auch wenn keine kontrollierten epidemiologischen Daten zum Risiko von Angiotensin-II-Rezeptor-Antagonisten (AIIRAs) vorliegen, so bestehen möglicherweise für diese Arzneimittelklasse vergleichbare Risiken. Sofern ein Fortsetzen der AIIRA-Therapie nicht als notwendig erachtet wird, sollten Patientinnen, die planen, schwanger zu werden, auf eine alternative antihypertensive Therapie mit geeignetem Sicherheitsprofil für Schwangere umgestellt werden. Wird eine Schwangerschaft festgestellt, ist eine Behandlung mit AIIRAs unverzüglich zu beenden und, wenn erforderlich, eine alternative Therapie zu beginnen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Kinder mit einer Anamnese einer in utero Exposition durch Losartan HCT Zentiva, sollten engmaschig auf Hypotonie, Oligurie und Hyperkaliämie untersucht werden.
Es ist bekannt, dass eine Therapie mit AIIRAs während des zweiten und dritten Schwangerschaftstrimesters fetotoxische Effekte (verminderte Nierenfunktion, Oligohydramnion, verzögerte Schädelossifikation) und neonatal-toxische Effekte (Nierenversagen, Hypotonie, Hyperkaliämie) hat (siehe «Präklinische Daten»).
Im Falle einer Exposition mit Losartan HCT Zentiva ab dem zweiten Schwangerschaftstrimester werden Ultraschalluntersuchungen der Nierenfunktion und des Schädels dringend empfohlen.
Normalerweise sind diese unerwünschten Wirkungen mit der Anwendung dieser Arzneimittel während des zweiten und dritten Trimesters assoziiert. Die meisten epidemiologischen Studien, in denen fetale Abnormalitäten nach antihypertensiver Therapie im ersten Trimester untersucht wurden, zeigten keine Unterschiede zwischen Antihypertensiva die das Renin-Angiotensin-System beeinflussen, und anderen Antihypertensiva. Das angemessene Management einer Hypertonie bei der Mutter ist während der Schwangerschaft wichtig, um die Folgen sowohl für Mutter als auch Foetus zu optimieren.
Hydrochlorothiazid ist plazentagängig. Aufgrund des pharmakologischen Wirkmechanismus von Hydrochlorothiazid kann es zu einer Störung der fetoplazentaren Perfusion und zu fetalen und neonatalen Auswirkungen wie Ikterus, Störung des Elektrolythaushalts und Thrombozytopenien kommen.
Aufgrund des Risikos eines verringerten Plasmavolumens und einer plazentaren Hypoperfusion, ohne den Krankheitsverlauf günstig zu beeinflussen, sollte Hydrochlorothiazid bei Schwangerschaftsödemen, Schwangerschaftshypertonie oder einer Präeklampsie nicht zur Anwendung kommen.
Stillzeit
Da keine Erkenntnisse zur Anwendung von Losartan HCT Zentiva in der Stillzeit vorliegen und Hydrochlorothiazid in die menschliche Muttermilch übergeht, wird Losartan HCT Zentiva nicht empfohlen. Eine alternative antihypertensive Therapie mit einem besser geeigneten Sicherheitsprofil bei Anwendung in der Stillzeit ist vorzuziehen, insbesondere, wenn Neugeborene oder Frühgeborene gestillt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Bei Teilnahme am Strassenverkehr und beim Bedienen von Maschinen ist Vorsicht geboten.
Unerwünschte Wirkungen
In klinischen Studien wurden unter der Kombinationsbehandlung mit Losartan Kalium und Hydrochlorothiazid keine neuen unerwünschten Wirkungen beobachtet. Die unerwünschten Wirkungen waren beschränkt auf Effekte, welche schon aus früheren Studien mit Losartan und/oder Hydrochlorothiazid festgestellt wurden. Die Häufigkeit von unerwünschten Wirkungen unter Kombinationsbehandlung war vergleichbar mit der Placebobehandlung. Ebenso war der Prozentsatz des Behandlungsabbruchs vergleichbar mit Placebo. Unerwünschte Wirkungen waren meistens leicht und vorübergehend; ein Abbruch der Therapie war nicht notwendig.
Unerwünschte Wirkungen sind nach Organklassen aufgeteilt und mit abnehmender Häufigkeit erwähnt: Sehr häufig (≥1/10), Häufig (≥1/100, <1/10), Gelegentlich (≥1/1'000, <1/100), Selten (≥1/10'000, <1/1'000), Sehr selten (<1/10'000, einschliesslich gemeldeter Einzelfälle.
In klinischen Studien mit Losartan Kalium/Hydrochlorothiazid bei Patienten mit essentieller Hypertonie und Hypertonie mit linksventrikulärer Hypertrophie wurden die folgenden unerwünschten Ereignisse beobachtet:
Störungen des Nervensystems
Häufig: Schwindel.
Funktionsstörungen des Ohrs und des Innenohrs
Häufig: Vertigo.
Funktionsstörungen der Haut und des Unterhautzellgewebes
Selten: Hautausschlag.
Allgemeine Störungen und Reaktionen an der Applikationsstelle
Häufig: Schwächegefühl, Müdigkeit.
Die weiteren folgenden unerwünschten Wirkungen wurden für Losartan Kalium/Hydrochlorothiazid nach Markteinführung und/oder in klinischen Studien oder nach Markteinführung für beide Komponenten unabhängig beobachtet (es kann keine Häufigkeit für Berichte nach Markteinführung angegeben werden):
Infektionen und Infestationen
Häufig: obere Atemwegsinfektionen.
Gutartige, bösartige und unspezifische Neubildungen (einschl. Zysten und Polypen)
Nicht-melanozytäre Malignome der Haut [NMSC] (Basalzellkarzinom [BCC] und Plattenepithelkarzinom [SCC]).
Störungen des Blut- und Lymphsystems
Selten: Purpura.
Sehr selten einschliesslich Einzelfälle: Agranulozytose, Knochenmarkdepression und hämolytische Anämie, Leukopenie.
Anämie, Thrombozytopenie.
Störungen des Immunsystems
Sehr selten einschliesslich Einzelfälle: Überempfindlichkeitsreaktionen.
Anaphylaktische Reaktionen, Angioödem einschliesslich Schwellung von Larynx und Glottis (Ursache für Atemwegsobstruktion) und/oder Schwellung des Gesichts, der Lippen, des Rachens und/oder Zunge wurde selten bei Patienten unter Behandlung mit Losartan berichtet; einige dieser Patienten hatten früher mit anderen Arzneimittel einschliesslich ACE-Hemmern ein Angioödem durchgemacht.
Stoffwechsel- und Ernährungsstörungen
Häufig: Hyperkaliämie, Hypokaliämie.
Gelegentlich: Appetitverlust, Hyperurikämie, Hyponatriämie, Hypomagnesiämie.
Selten: Hyperkalzämie, Hyperglykämie, Verschlechterung einer diabetischen Stoffwechsellage.
Sehr selten einschliesslich Einzelfälle: Hypochlorämische Alkalose.
Psychiatrische Störungen
Häufig: Schlaflosigkeit, Ruhelosigkeit.
Selten: Depressionen.
Störungen des Nervensystems
Sehr häufig: Kopfschmerzen.
Selten: Schwindel oder Benommenheit, Parästhesien.
Dysgeusie, Migräne.
In doppel-blinden, kontrollierten Studien bei Patienten mit essentieller Hypertension wurden Kopfschmerzen bei 14,1% der mit Losartan behandelten Patienten beobachtet im Vergleich zu 17,2% in der Plazebo-Gruppe.
Augenleiden
Sehstörungen, besonders in den ersten Behandlungswochen.
Funktionsstörungen des Herzens
Häufig: Hypotension, Palpitationen, Tachykardie.
Gelegentlich: dosisabhängige orthostatische Probleme, orthostatische Hypotonie, die durch Alkohol, Anästhetika oder Sedativa verstärkt werden kann.
Selten: Herzrhythmusstörungen.
Funktionsstörungen der Gefässe
Selten: Vaskulitis, einschliesslich Henoch-Schoenlein.
Sehr selten einschliesslich Einzelfälle: Nekrotisierende Vaskulitis.
Respiratorische, thorakale und mediastinale Funktionsstörungen
Häufig: Nasenverstopfung, Husten, Pharyngitis, Sinus-Störungen.
Sehr selten einschliesslich Einzelfälle: respiratorische Beschwerden einschliesslich Pneumonitis und Lungenödem.
Gastrointestinale Beschwerden
Häufig: Bauchschmerzen, Dyspesie, Nausea, Erbrechen.
Selten: Abdominalbeschwerden, Verstopfung, gastrointestinale Beschwerden.
Sehr selten einschliesslich Einzelfälle: Pankreatitis.
Diarrhoe.
Funktionsstörungen der Leber und der Galle
Selten: Hepatitis, intrahepatische Cholestase oder Ikterus.
Funktionsstörungen der Haut und des Unterhautzellgewebes
Gelegentlich: Urtikaria, andere Hautausschläge.
Sehr selten einschliesslich Einzelfälle: Epidermolysis acuta toxica, Lupus-erythematodes-ähnliche Reaktionen und Reaktivierung eines Lupus erythematodes.
Erythrodermie, Photosensibilität, Pruritus.
Funktionsstörungen des Bewegungsapparates, des Bindegewebes und der Knochen
Häufig: Rückenschmerzen, Muskelkrämpfe.
Arthralgie, Myalgie.
Funktionsstörungen der Nieren und ableitenden Harnwege
Selten: Glykosurie.
Funktionsstörungen des Reproduktionssystems und der Brust
Selten: Impotenz.
Erektile Dysfunktion.
Allgemeine Störungen und Reaktionen an der Applikationsstelle
Häufig: Brustschmerzen, Ödeme/Schwellung.
Malaise.
Untersuchungen
Häufig: Anstieg der ALT, Proteinurie.
Leberfunktionsstörungen.
Beschreibung ausgewählter unerwünschter Wirkungen
Nicht-melanozytäre Malignome der Haut (BCC und SCC): Basierend auf den verfügbaren Daten aus epidemiologischen Studien wurde ein von der kumulativen Dosis abhängiger Zusammenhang zwischen Hydrochlorothiazid-Exposition und nicht-melanozytären Malignomen der Haut beobachtet (siehe auch Abschnitte «Warnhinweise und Vorsichtsmassnahmen» und «Eigenschaften/Wirkungen»).
Überdosierung
Es gibt keine spezifischen Informationen zur Behandlung einer Überdosierung mit Losartan HCT Zentiva. Die Therapie mit Losartan HCT Zentiva sollte abgebrochen werden und der Patient genau beobachtet werden. Falls die Einnahme kürzlich stattgefunden hat, soll eine Emesis erwirkt werden und Flüssigkeitsverlust, Elektrolytstörungen, Leberkoma und Hypotonie durch geeignete Massnahmen korrigiert werden.
Losartan
Beim Menschen sind nur beschränkte Angaben zur Überdosierung bekannt. Das wahrscheinlichste Anzeichen von Überdosierung müssten Blutdruckabfall und Tachykardie sein. Bradykardie könnte infolge parasympathischer (vagaler) Stimulation auftreten. Bei symptomatischem Blutdruckabfall müsste eine entsprechende, kreislaufstützende Behandlung erfolgen.
Weder Losartan noch sein aktiver Metabolit können durch Hämodialyse eliminiert werden.
Hydrochlorothiazid
Die wichtigsten Symptome und Befunde, welche auf eine Überdosierung hinweisen, sind Elektrolytstörungen (Hypokaliämie, Hypochlorämie, Hyponatriämie) und Dehydration als Folge einer exzessiven Diurese. Wenn gleichzeitig Digitalis eingenommen wird, kann die Hypokaliämie kardiale Rhythmusstörungen verstärken.
Es ist nicht bekannt, in welchem Ausmass Hydrochlorothiazid durch Hämodialyse entfernt wird.
Eigenschaften/Wirkungen
ATC-Code: C09DA01
Losartan
Losartan ist ein oraler Angiotensin-II-Rezeptor-Antagonist (Typ AT1). Angiotensin II bindet sich an den AT1-Rezeptor, welcher in vielen Körpergeweben zu finden ist (z.B. glatte Gefässmuskulatur, Nebennieren, Nieren und Herz), wo es verschiedene wichtige biologische Wirkungen einschliesslich Gefässverengung und Freigabe von Aldosteron auslöst. Angiotensin II stimuliert auch die Proliferation glatter Muskelzellen. Gemäss pharmakologischen und biologischen Versuchen bindet es sich selektiv an den AT1-Rezeptor. Sowohl in vitro wie in vivo blockieren Losartan und sein pharmakologisch aktiver Carboxylsäure-Metabolit (E-3174) alle physiologisch bedeutsamen Wirkungen von Angiotensin II, unabhängig von dessen Herkunft oder Syntheseweg.
Während der Verabreichung von Losartan führt die Unterdrückung der negativen Rückkopplung von Angiotensin II auf die Reninsekretion zu einer erhöhten Renin-Aktivität im Plasma. Die Zunahme der Plasmareninaktivität führt zu einem Anstieg des Angiotensin II im Plasma. Trotz dieser Zunahme bleibt die blutdrucksenkende Wirkung und Verminderung der Aldosteron-Konzentration im Plasma erhalten, was auf eine wirkungsvolle Blockade der Angiotensin-II-Rezeptoren hinweist.
Losartan bindet sich selektiv an die AT1-Rezeptoren, es bindet oder blockiert jedoch keine anderen Hormonrezeptoren oder Ionenkanäle, welche für die Herz-Kreislauf-Steuerung von Bedeutung sind. Das Enzym ACE (Kininase II), welches Bradykinin abbaut, wird durch Losartan nicht gehemmt. Demzufolge sind Wirkungen, welche nicht direkt auf der AT1-Rezeptoren-Blockade beruhen, wie die Erhöhung der Bradykininwirkungen oder Ödembildung (Losartan 1,7%, Placebo 1,9%) nicht auf Losartan zurückzuführen.
Klinische Wirksamkeit
In klinischen Studien bewirkte eine einmal tägliche Verabreichung von Losartan bei Patienten mit leichter bis mässiger essentieller Hypertonie eine statistisch signifikante Senkung des systolischen und diastolischen Blutdrucks. Diese blutdrucksenkende Wirkung blieb in klinischen Versuchen bis zu einem Jahr erhalten. Messungen des Blutdrucks am Ende des Dosierungsintervalls (24 Stunden nach Einnahme) zeigten, verglichen mit der maximalen Wirkung (nach 5-6 Stunden), gleichmässige Blutdruckkontrolle über 24 Stunden. Die antihypertensive Wirkung entsprach dem natürlichen Tagesrhythmus. Die Blutdrucksenkung nach Ende des Dosierungsintervalls entsprach noch 70-80% der Wirkung nach 5-6 Stunden. Ein Absetzen der Behandlung mit Losartan hatte keinen abrupten Wiederanstieg des Blutdrucks zur Folge. Trotz der erheblichen Blutdrucksenkung hatte Losartan keine klinisch bedeutsame Auswirkung auf die Herzfrequenz.
Bei nicht-diabetischen Patienten mit Bluthochdruck und Proteinurie, vermindert Losartan statistisch signifikant die Proteinurie, die fraktionale Ausscheidung von Albumin und IgG. Losartan erhält die glomeruläre Filtration aufrecht und reduziert die Filtrationsfraktion. Losartan bewirkte eine leichte Senkung der Harnsäurespiegel, auch während der Langzeittherapie.
Bei Patienten mit Links-Herzinsuffizienz bewirkten Dosen von 25 bis 50 mg Losartan positive haemodynamische und neurohormonale Reaktionen, wie die Erhöhung des Herzindex und die Verminderung des pulmonalen Kapillardrucks, des systemischen Gefässwiderstandes, des durchschnittlichen arteriellen Drucks, der Herzfrequenz und der Blutspiegel von Aldosteron bzw. Noradrenalin. Bei diesen herzinsuffizienten Patienten war das Auftreten einer Hypotonie dosisabhängig.
Losartan ist bei Männern und Frauen und bei jüngeren (bis 65-jährigen) und älteren (über 65-jährigen) Hypertonikern gleich wirksam. Bei Schwarzen jedoch war Losartan weniger wirksam als bei Kaukasiern.
Die Erfahrung mit Losartan HCT Zentiva bei Patienten mit anderen kardiovaskulären Erkrankungen (z.B. Herzinsuffizienz und koronare Herzkrankheit) ist begrenzt.
Wird Losartan HCT Zentiva zusammen mit Diuretika vom Thiazidtyp verabreicht, so kann eine additive Wirkung auf die Blutdrucksenkung erwartet werden.
Hydrochlorothiazid
Der Mechanismus der antihypertensiven Wirkung der Thiazide ist nicht bekannt. Bei normalen Blutdruckwerten führen Thiazide nicht zu einer Blutdrucksenkung.
Hydrochlorothiazid ist ein Diuretikum und Antihypertonikum. Es wirkt auf die Reabsorption der Elektrolyte im distalen Nierentubulus. Hydrochlorothiazid erhöht die Ausscheidung von Natrium und Chlorid in etwa gleichem Ausmass. Die Natriurese kann von einem leichten Kalium- und Bikarbonatverlust begleitet sein.
Die Diurese beginnt innerhalb von 2 Stunden nach oraler Einnahme, zeigt ein Maximum nach etwa 4 Stunden und dauert ca. 6-12 Stunden an.
Nicht-melanozytäre Malignome der Haut (NMSC): Basierend auf den verfügbaren Daten aus epidemiologischen Studien wurde ein von der kumulativen Dosis abhängiger Zusammenhang zwischen Hydrochlorothiazid (HCTZ)-Exposition und NMSC-Entwicklung beobachtet. Eine Studie schloss eine Population aus 71'553 BCC-Fällen und 8'629 SCC-Fällen sowie 1'430'883 bzw. 172'462 entsprechenden Kontrollen ein. Eine starke HCTZ-Exposition (kumulative Dosis ≥50'000 mg) war mit einer bereinigten Odds Ratio (OR) von 1,29 (95%-KI: 1,23–1,35) für BCC bzw. 3,98 (95%-KI: 3,68–4,31) für SCC assoziiert. Eine eindeutige kumulative Dosis-Wirkungs-Beziehung wurde sowohl für BCC als auch für SCC beobachtet. Eine weitere Studie ergab einen möglichen Zusammenhang zwischen HCTZ-Exposition und Lippenkarzinom (SCC): 633 Fälle von Lippenkarzinomen wurden mit 63'067 entsprechenden Kontrollen mittels der «Risk Set Sampling»-Strategie verglichen. Eine kumulative Dosis-Wirkungs-Beziehung wurde mit einem Anstieg der bereinigten OR von 2,1 (95%-KI: 1,7–2,6) auf 3,9 (95%-KI: 3,0–4,9) bei hoher kumulativer Dosis (≥25'000 mg) und auf 7,7 (95%-KI: 5,7–10,5) bei der höchsten kumulativen Dosis gezeigt (≥100'000 mg). (Siehe auch Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
Losartan-Hydrochlorothiazid
Die beiden Komponenten von Losartan HCT Zentiva haben einen additiven Effekt auf die Blutdrucksenkung, welche grösser ist als jene einer einzelnen Komponente. Es wird vermutet, dass dieser Effekt das Resultat einer komplementären Wirkung der beiden Substanzen ist. Als Folge des diuretischen Effektes erhöht Hydrochlorothiazid die Aktivität von Plasma-Renin, die Sekretion von Aldosteron sowie die Plasmaspiegel von Angiotensin II und senkt das Serumkalium. Durch Verabreichung von Losartan werden alle physiologisch relevanten Wirkungen von Angiotensin II blockiert. Zusätzlich könnte der Diuretika-induzierte Kaliumverlust durch Hemmung von Aldosteron vermindert werden.
Es wurde gezeigt, dass Losartan einen leichten und vorübergehenden urikosurischen Effekt hat. Unter Hydrochlorothiazid wurde ein mässiger Anstieg der Harnsäure beobachtet. Die Kombination von Losartan und Hydrochlorothiazid vermindert tendenziell die Diuretika-induzierte Hyperurikämie.
Die antihypertensive Wirkung von Losartan HCT Zentiva bleibt während 24 Stunden erhalten. In klinischen Studien über mindestens ein Jahr blieb die antihypertensive Wirkung erhalten. Trotz einer signifikanten Senkung des Blutdrucks führte die Behandlung mit Losartan HCT Zentiva nicht zu klinisch fassbaren Effekten auf die Herzfrequenz. In klinischen Studien wurde nach zwölfwöchiger Therapie mit Losartan 50 mg/Hydrochlorothiazid 12,5 mg, am Ende des Dosierungsintervalls, eine Senkung des im Sitzen gemessenen diastolischen Blutdrucks um durchschnittlich bis zu 13,2 mm Hg nachgewiesen.
In einer Studie, in welcher die Kombination von Losartan 50 mg/Hydrochlorothiazid 12,5 mg mit der Kombination von Captopril 50 mg/Hydrochlorothiazid 25 mg bei jüngeren (<65 Jahre) und älteren (≥65 Jahre) Patienten mit Hypertonie untersucht wurde, konnte kein Unterschied zwischen den beiden Behandlungs- und Altersgruppen nachgewiesen werden.
LIFE Studie
Die Losartan Interventionsstudie zur Endpunktreduktion bei Hypertonie (Losartan Intervention for Endpoint Reduction in Hypertension, LIFE) war eine grosse, multinationale, randomisierte, dreifach-blinde und aktiv-kontrollierte Studie mit 9193 Hypertonikern zwischen 55 und 80 Jahren (Mittelwert 67 Jahre) mit EKG-dokumentierter linksventrikulärer Hypertrophie. Von den zu Studienbeginn aufgenommenen Patienten hatten 1195 (13%) einen Diabetes mellitus, 1326 (14%) eine isolierte systolische Hypertonie, 1468 (17%) eine koronare Herzkrankheit und 728 (8%) eine zerebrovaskuläre Erkrankung.
Ziel dieser Studie war es, einen über die Blutdrucksenkung hinausgehenden kardiovaskulär protektiven Effekt von Losartan im Vergleich zu Atenolol nachzuweisen. Der Blutdruck wurde 24 h nach Verabreichung der letzten Dosis gemessen. Dazu sollte gemäss Studiendesign eine vergleichbare Blutdrucksenkung in beiden Behandlungsgruppen erreicht werden. Die Patienten erhielten randomisiert entweder Losartan 50 mg oder Atenolol 50 mg einmal täglich. Wenn der Zielblutdruck (<140/90 mm Hg) nicht erreicht wurde, wurde zusätzlich Hydrochlorothiazid (12,5 mg) zugegeben und dann gegebenenfalls die Losartan oder Atenolol Dosis auf 100 mg einmal täglich erhöht. Falls notwendig, wurden andere Antihypertensiva (z.B. Dosiserhöhung von Hydrochlorothiazid auf 25 mg oder Zugabe anderer Diuretika, Calciumantagonisten, alpha-Blocker, zentral wirksame Antihypertensiva, jedoch nicht ACE-Hemmer, Angiotensin-II-Antagonisten oder beta-Blocker) zusätzlich gegeben, um den Zielblutdruck zu erreichen. Mit dem Ziel, den Blutdruck zu kontrollieren, erhielten die Patienten in beiden Armen der LIFE-Studie zusätzlich Hydrochlorothiazid während der meisten Zeit, in der sie auch mit Studienmedikation behandelt wurden (73,9% bzw. 72,4% der Tage in der Losartan bzw. Atenolol-Gruppe).
In beiden Behandlungsgruppen wurde der Blutdruck signifikant auf vergleichbare Werte gesenkt und ein vergleichbar grosser Anteil der Patienten erreichte den Zielblutdruck. Die mittlere Beobachtungsdauer betrug 4,8 Jahre.
Der primäre Endpunkt war die Kombination von kardiovaskulärer Morbidität und Mortalität gemessen als Reduktion der kombinierten Ereignisse kardiovaskulärer Tod, Schlaganfall und Myokardinfarkt. Die Ergebnisse zeigten, dass die Behandlung mit Losartan im Vergleich zu Atenolol zu einer Risikoreduktion von 13% (p=0,021) in Bezug auf den primären zusammengesetzten Endpunkte führte (siehe Graphik 1).
Die statistische Signifikanz wurde in der Reduktion des Schlaganfalls gezeigt, während die kardiovaskuläre Mortalität und Myokard-Infarkt-Endpunkte keine statistische Signifikanz hatten.

Graphik 1) Kaplan-Meier-Kurven des primären kombinierten Endpunkts kardiovaskulärer Tod, Schlaganfall oder Myokardinfarkt in den mit Losartan und mit Atenolol behandelten Gruppen, adjustiert auf den «Framingham Baseline Risk Score» und den Grad der EKG-dokumentierten Linkherzhypertrophie.
Die Behandlung mit Losartan reduzierte das Risiko eines Schlaganfalls im Vergleich zu Atenolol um 25% (p=0,001). Die Rate der Ereignisse kardiovaskulärer Mortalität und Myokardinfarkt war nicht signifkant unterschiedlich zwischen den Behandlungsgruppen. Die Wirkung von Losartan auf den primären kombinierten Endpunkt schien über den Vorteil der alleinigen Blutdrucksenkung hinauszugehen (siehe Tabelle unten).
Life Studien Endpunkte
Ergebnis | Losartan | Rate* | Atenolol | Rate* | Risikoreduktion** | p-Wert |
|---|---|---|---|---|---|---|
Primärer kombinierter Endpunkt | 508 (11%) | 23,8 | 588 (13%) | 27,9 | 13% | 0,021 |
Komponenten des primären kombinierten Endpunkts | ||||||
Kardiovaskuläre Mortalität | 204 (4%) | 9,2 | 234 (5%) | 10,6 | 11% | 0,206 |
Schlaganfall | 232 (5%) | 10,8 | 309 (7%) | 14,5 | 25% | 0,001 |
Myokardinfarkt | 198 (4%) | 9,2 | 188 (4%) | 8,7 | -7% | 0,491 |
* Pro 1000 Patientenjahre Weiterbeobachtung.
** Adjustiert auf den «Framingham Baseline Risk Score» und auf EKG-dokumentierten Messungen der LVH.
Andere klinische Endpunkte der LIFE Studie waren: Gesamtmortalität, Hospitalisierung wegen Herzinsuffizienz oder Angina pectoris, koronare oder periphere Revaskularisierungsmassnahmen, sowie Reanimation nach Herzstillstand. Es traten keine signifikanten Unterschiede in der Häufigkeit dieser Endpunkte zwischen den Behandlungsgruppen auf. Mit Losartan behandelte Patienten zeigten im Vergleich zu mit Atenolol behandelten Patienten eine signifikant grössere Reduktion der LVH-Werte im EKG.
Die Wirkung von Losartan im Vergleich zu Atenolol auf kardiovaskuläre Morbidität und Mortalität wurde in Subgruppen bei Patienten mit Diabetes mellitus (n=1195) und mit isolierter systolischer Hypertonie (ISH) (n=1326) in der Vorgeschichte untersucht. Im Hinblick auf den primären kombinierten Endpunkt entsprachen die Ergebnisse dieser Subgruppen dem vorteilhaften Ergebnis der Losartan-Behandlung der Studien-Gesamtpopulation: bei Diabetikern wurde eine 24% Risikoreduktion (p=0,03) und bei Patienten mit isolierter systolischer Hypertonie (ISH) wurde eine 25% Risikoreduktion (p=0,06) beobachtet. Bei Bluthochdruck-Patienten mit linksventrikulärer Hypertrophie ist Losartan HCT Zentiva eine angemessene alternative Formulierung für Patienten, die ansonsten gleichzeitig mit Losartan und Hydrochlorothiazid einmal täglich behandelt würden zur Reduktion der kardiovaskulären Morbidität und Mortalität.
Unterschiede betreffend Hautfarbe
Die in der LIFE Studie beobachteten vorteilhaften Ergebnisse von Losartan im Vergleich zu Atenolol auf die kardiovaskuläre Morbidität und Mortalität gelten nicht für Patienten mit schwarzer Hautfarbe, die an Bluthochdruck und linksventrikulärer Hypertrophie leiden, obwohl beide Therapeutika den Blutdruck bei Patienten mit schwarzer Hautfarbe effektiv senkten.
Dagegen senkte Losartan in der LIFE Studie im Vergleich zu Atenolol das Risiko kardiovaskulärer Morbidität und Mortalität bei nicht-schwarzen Hypertonikern mit linksventrikulärer Hypertrophie (n=8660) signifikant (p=0,003) in Bezug auf den primären kombinierten Endpunkt kardiovaskulärer Tod, Schlaganfall und Myokardinfarkt.
Es zeigte sich, dass mit Atenolol behandelte Patienten schwarzer Hautfarbe ein geringeres Risiko den kombinierten primären Endpunkt zu erreichen hatten als mit Losartan behandelte Patienten (p=0,03) schwarzer Hautfarbe. In der Subgruppe der Patienten mit schwarzer Hautfarbe (n=533; 6% der Patienten der LIFE Studie) gab es 29 primäre Endpunkte unter den 263 mit Atenolol behandelten Patienten (11%, 25,9 pro 1000 Patientenjahre) und 46 primäre Endpunkte unter den 270 mit Losartan behandelten Patienten (17%, 41,8 pro 1000 Patientenjahre).
In der LIFE Studie war eine signifikant geringere Häufigkeit der Therapieabbrüche auf Grund von unerwünschten Nebenwirkungen unter Losartan im Vergleich zu Atenolol nachweisbar.
Pharmakokinetik
Absorption
Losartan
Nach oraler Einnahme wird Losartan gut absorbiert und unterliegt einem first-pass Effekt, wobei ein aktiver Carboxylsäure-Metabolit und weitere inaktive Metaboliten gebildet werden. Die Bioverfügbarkeit von Losartan-Tabletten beträgt ungefähr 33%. Durchschnittliche Spitzenkonzentrationen von Losartan werden nach 1 Stunde, die des aktiven Metaboliten nach 3 bis 4 Stunden erreicht. Bei gleichzeitiger Einnahme mit einer normalen Mahlzeit wurden im Plasmakonzentrationsprofil von Losartan keine klinisch signifikanten Veränderungen beobachtet.
Hydrochlorothiazid
Die Bioverfügbarkeit von Hydrochlorothiazid-Tabletten beträgt ungefähr 70%. Nach oraler Einnahme einer Einzeldosis von 12,5, 25, 50 und 75 mg werden mittlere Maximalkonzentrationen im Plasma von 70, 142, 260 und 376 ng/ml durchschnittlich nach 2 Stunden erreicht. Innerhalb des therapeutischen Dosierungsbereichs ist die systemische Verfügbarkeit von Hydrochlorothiazid proportional zur Dosis.
Distribution
Losartan
Sowohl Losartan und sein aktiver Metabolit sind zu mindestens 99% an Plasmaproteine, vor allem Albumin gebunden. Das Verteilungsvolumen von Losartan beträgt 34 Liter. Versuche an Ratten zeigten, dass Losartan die Blut-Liquorschranke kaum durchdringt.
Hydrochlorothiazid
Hydrochlorothiazid passiert die Plazenta, aber nicht die Blut/Hirn-Schranke und wird in der Muttermilch ausgeschieden.
Hydrochlorothiazid ist zu etwa 40-70% an Plasmaproteine gebunden. Das apparente Verteilungsvolumen wird auf 5-6 l/kg geschätzt.
Metabolismus
Losartan
Ungefähr 14% einer peroral verabreichten Losartan-Dosis werden zum aktiven Metaboliten umgewandelt. In vitro Studien zeigen, dass Cytochrom P450 2C9 und 3A4 an der Umwandlung von Losartan in seine Metaboliten beteiligt sind. Bei 1% der Patienten wurde aufgrund einer genetisch bestimmten Enzympolymorphie eine geringere Umwandlung beobachtet (weniger als 1% der Dosis im Vergleich zu 14% der Dosis bei normalen Patienten). Nach oraler Gabe von 14C-markiertem Losartan ist die im Plasma zirkulierende Radioaktivität hauptsächlich auf Losartan und seinen aktiven Metaboliten zurückzuführen.
Neben dem aktiven Metaboliten werden inaktive Metaboliten gebildet, so zwei Hauptmetaboliten durch Hydroxylierung der Butylseitenkette und ein weiterer Metabolit, ein N-2 Tetrazole Glucuronid.
Elimination
Losartan
Die Plasma-Clearance von Losartan beträgt 600 ml/min, beim aktiven Metaboliten 50 ml/min. Die renale Clearance von Losartan ist 74 ml/min, resp. beim aktiven Metaboliten 26 ml/min. Bei oraler Verabreichung werden ungefähr 4% der Dosis unverändert, ungefähr 6% der Dosis als aktiver Metabolit im Urin ausgeschieden. Die Pharmakokinetik von Losartan und seinem aktiven Metaboliten verlaufen bis zu Dosen von 200 mg Losartan linear.
Nach oraler Einnahme nehmen die Plasmakonzentrationen von Losartan und seinem aktiven Metaboliten polyexponentiell ab mit einer Halbwertszeit von ca. 2 bzw. 6-9 Stunden. Bei einmaliger Tagesdosierung mit 100 mg kommt es weder bei Losartan noch beim aktiven Metaboliten zu einer signifikanten Kumulation im Plasma.
Sowohl biliäre wie renale Ausscheidung tragen zur Elimination von Losartan und dessen Metaboliten bei. Nach oraler Einnahme von 14C-markiertem Losartan werden beim Menschen 35% der Radioaktivität im Urin und 58% im Stuhl wiedergefunden.
Hydrochlorothiazid
In Studien mit Bestimmung der Plasmaspiegel über mindestens 24 Stunden wurden Plasma-Halbwertszeiten zwischen 5,6 und 14,8 Stunden gemessen. Mindestens 61% einer oralen Dosis wird innerhalb von 24 Stunden über die Nieren ausgeschieden, 95% davon in unveränderter Form und etwa 4% als Hydrolysat des 2-Amino-4-chlor-m-benzoldisulfonamids. Bis zu 24% einer oralen Dosis können in den Fäzes gefunden und eine unbedeutende Menge über die Galle ausgeschieden werden.
Kinetik in besonderen klinischen Situationen
Losartan-Hydrochlorothiazid
Die AUC für Losartan (aber nicht für den aktiven Metaboliten von Losartan) und Hydrochlorothiazid ist bei älteren Patienten im Vergleich zu jüngeren Patienten erhöht.
Losartan
Bei Patienten mit leichter bis mässiger alkoholischer Leberzirrhose waren nach peroraler Einnahme die Plasmakonzentrationen von Losartan und seinem aktiven Metaboliten im Vergleich zu jungen, gesunden Männern 5-, bzw. 1,7-fach erhöht.
Weder Losartan noch sein aktiver Metabolit können durch Hämodialyse eliminiert werden.
Hydrochlorothiazid
Im Vergleich zu jungen ist bei älteren Patienten die Hydrochlorothiazid-Plasmakonzentration im Steady-state höher und die systemische Clearance beträchtlich langsamer.
Bei Nierenfunktionsstörungen sind die mittleren Maximalkonzentrationen im Plasma und die AUC-Werte von Hydrochlorothiazid erhöht. Bei Patienten mit Niereninsuffizienz (Kreatinin-Clearance zwischen 30 und 70 ml/min) ist die mittlere Halbwertszeit der Elimination fast verdoppelt.
Präklinische Daten
Die präklinischen Studien einschliesslich konventioneller Studien zur allgemeinen Pharmakologie, zur Genotoxizität und zum kanzerogenen Potenzial lassen keine besonderen Gefahren für den Menschen erkennen. Das toxische Potenzial einer Kombination von Losartan/Hydrochlorothiazid nach oraler Gabe wurde in Studien zur chronischen Toxizität mit bis zu sechsmonatiger Dauer mit Ratten und Hunden bewertet. Die in diesen Studien mit der Kombination beobachteten Veränderungen wurden hauptsächlich durch den Bestandteil Losartan bewirkt. Die Verabreichung der Losartan/Hydrochlorothiazid-Kombination führte zu einer Abnahme der roten Blutzellparameter (Erythrozyten, Hämoglobin, Hämatokrit), einem Anstieg des Harnstoff-Stickstoffs im Serum, einer Abnahme im Herzgewicht (ohne histologisches Korrelat) und gastrointestinalen Veränderungen (Schleimhautläsionen, Ulzera, Erosionen, Hämorrhagien).
Kein Hinweis auf Teratogenität ergab sich bei Ratten oder Kaninchen bei Gabe von Losartan/Hydrochlorothiazid. Bei Ratten wurde fetale Toxizität, erkennbar an einem leichten Anstieg überzähliger Rippen in der F1-Generation, beobachtet, wenn weibliche Tiere vor und während der Gestation therapiert wurden. Wie auch in Studien mit Losartan allein festgestellt, kam es zu unerwünschten Wirkungen an Feten und Neonaten, wie renaler Toxizität oder Tod der Feten, wenn trächtigen Ratten während der späten Gestation und/oder Laktation Losartan-Hydrochlorothiazid verabreicht wurde.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Losartan HCT Zentiva nicht oberhalb von 30 °C und vor Feuchtigkeit geschützt in der Originalpackung aufbewahren.
Für Kinder unerreichbar aufbewahren.
Zulassungsnummer
61314 (Swissmedic).
Zulassungsinhaberin
Helvepharm AG, Frauenfeld.
Stand der Information
Dezember 2018.
Composition
Principes actifs: Losartan potassique et hydrochlorothiazide.
Excipients
Losartan HCT Zentiva 50/12,5 mg: Color: E104, Excipiens pro compresso obducto.
Losartan HCT Zentiva 100/12,5 mg: Excipiens pro compresso obducto.
Losartan HCT Zentiva 100/25 mg: Color: E104, Excipiens pro compresso obducto.
Forme galénique et quantité de principe actif par unité
Losartan HCT Zentiva 50/12,5 mg: comprimé pelliculé, contient 50 mg de losartan potassique et 12,5 mg d'hydrochlorothiazide (avec rainure).
Losartan HCT Zentiva 100/12,5 mg: comprimé pelliculé, contient 100 mg de losartan potassique et 12,5 mg d'hydrochlorothiazide.
Losartan HCT Zentiva 100/25 mg: comprimé pelliculé, contient 100 mg de losartan potassique et 25 mg d'hydrochlorothiazide.
Teneur en potassium des comprimés pelliculé: Losartan HCT Zentiva 50/12,5 mg: 4,24 mg (0,108 mEq), Losartan HCT Zentiva 100/12,5 mg et 100/25 mg: 8,48 mg (0,216 mEq).
Indications/Possibilités d’emploi
Hypertension artérielle
Losartan HCT Zentiva est indiqué chez les patients hypertendus dont le cas nécessite un traitement par association médicamenteuse.
Hypertension artérielle avec hypertrophie ventriculaire gauche
Réduction du risque d'accident vasculaire cérébral chez les patients hypertendus atteints d'hypertrophie ventriculaire gauche (voir sous «Propriétés/Effets, Etude LIFE, Patients de peau noire»).
Posologie/Mode d’emploi
Hypertension artérielle
La dose initiale et d'entretien habituelle est de 1 comprimé pelliculé de Losartan HCT Zentiva 50 mg/12,5 mg par jour. Pour les patients ne répondant pas de manière suffisante à Losartan HCT Zentiva 50 mg/12,5 mg, la dose peut être portée à 1 comprimé pelliculé de Losartan HCT Zentiva 100 mg/25 mg une fois par jour ou à 2 comprimés pelliculés de Losartan HCT Zentiva 50 mg/12,5 mg une fois par jour. La posologie maximale est de 1 comprimé pelliculé de Losartan HCT Zentiva 100 mg/25 mg une fois par jour ou de 2 comprimés pelliculés de Losartan HCT Zentiva 50 mg/12,5 mg une fois par jour. L'effet antihypertenseur est généralement atteint en l'espace de 3 semaines après le début du traitement. Losartan HCT Zentiva 100 mg/12,5 mg est destiné aux patients dont le traitement est déjà ajusté avec Losartan Zentiva 100 mg et qui nécessitent un contrôle supplémentaire de la pression artérielle.
Hypertension artérielle avec hypertrophie ventriculaire gauche
La posologie initiale normale est de 50 mg de losartan une fois par jour. Lorsque la pression artérielle visée ne peut pas être atteinte avec losartan 50 mg, le traitement devrait être adapté par l'association de losartan avec une dose faible d'hydrochlorothiazide (12,5 mg). Si nécessaire, la dose peut ensuite être portée à 100 mg de losartan/12,5 mg d'hydrochlorothiazide une fois par jour, ou à 100 mg de losartan/25 mg d'hydrochlorothiazide une fois par jour. Losartan HCT Zentiva est une formulation alternative adaptée aux patients qui seraient sinon traités au losartan et à l'hydrochlorothiazide en même temps.
Instructions spéciales pour la posologie
Hypovolémie
Losartan HCT Zentiva ne devrait pas être utilisé chez les patients présentant une déplétion du volume intravasculaire (p.ex. les patients traités avec des hautes doses de diurétiques).
Patients âgés/Troubles rénaux et hépatiques
L'utilisation de Losartan HCT Zentiva est déconseillée chez les patients souffrant d'une insuffisance grave de la fonction hépatique ou rénale (clairance de la créatinine ≤30 ml/min).
Chez les patients âgés, aucune adaptation initiale de la dose de Losartan HCT Zentiva 50/12,5 mg n'est nécessaire. Losartan HCT Zentiva 100/12,5 mg et Losartan HCT Zentiva 100/25 mg ne devraient pas être utilisés pour le traitement initial chez les patients âgés.
Enfants et adolescents
Losartan HCT Zentiva ne devrait pas être utilisé chez les enfants et les adolescents, car la sécurité et l'efficacité chez les enfants et les adolescents n'ont pas été étudiées.
Losartan HCT Zentiva peut être également pris en association avec d'autres antihypertenseurs.
Losartan HCT Zentiva peut être pris avant, pendant ou après un repas.
Contre-indications
Losartan HCT Zentiva est contre-indiqué:
- chez les patients présentant une hypersensibilité à l'un des principes actifs ou à l'un des composants de la préparation;
- chez les patients souffrant d'anurie;
- chez les patients présentant une hypersensibilité à d'autres dérivés de sulfonamides;
- pendant la grossesse (voir sous «Grossesse/Allaitement»);
- chez les patients souffrant d'une grave insuffisance hépatique ou rénale (clairance de la créatinine ≤30 ml/min);
- Losartan HCT Zentiva est en outre contre-indiqué chez les patients présentant un angio-œdème héréditaire ou chez ceux ayant développé un œdème de Quincke lors d'un traitement antérieur par un inhibiteur de l'ECA ou par un antagoniste du récepteur de l'angiotensine II.
L'utilisation concomitante de Losartan HCT Zentiva et de médicaments contenant de l'aliskirène est contre-indiquée chez les patients souffrant de diabète ou d'insuffisance rénale (DFG <60 ml/min/1,73 m2).
Mises en garde et précautions
Losartan-hydrochlorothiazide
Toxicité fœtale
Au cours du deuxième et du troisième trimestre de la grossesse, l'utilisation de médicaments agissant sur le système rénine-angiotensine tels que par exemple Losartan HCT Zentiva est associée à une réduction de la fonction rénale du fœtus et à une augmentation de la morbi-mortalité fœtale et néonatale. Un oligohydramnios dû au médicament peut être associé à une hypoplasie pulmonaire fœtale et à une déformation du squelette. Les effets indésirables potentiels chez le nouveau-né englobent une hypoplasie crânienne, une anurie, une hypotension, une défaillance rénale et la mort. L'administration de Losartan HCT Zentiva doit donc être arrêtée le plus rapidement possible dès qu'une grossesse est constatée (voir «Grossesse/Allaitement»).
Hypersensibilité
Angio-œdème – voir sous «Effets indésirables».
Les interactions potentielles de Losartan HCT Zentiva avec des anticoagulants oraux n'ont pas été étudiées.
Losartan
Insuffisance rénale
Chez quelques rares patients, on a rapporté des modifications de la fonction rénale, y compris des défaillances rénales, consécutives à l'inhibition du système rénine-angiotensine; ces changements peuvent être réversibles après arrêt du médicament.
Lors de sténose de l'artère rénale, il est possible que l'usage du médicament ait pour conséquence une baisse massive de la pression artérielle.
D'autres médicaments agissant sur le système rénine-angiotensine peuvent augmenter les valeurs d'urémie et de créatinine sérique chez les patients atteints d'une sténose de l'artère rénale, bilatérale ou sur un seul rein. Des effets semblables ont été rapportés pour le losartan; ces altérations de la fonction rénale peuvent être réversibles après arrêt du médicament.
Chez les patients présentant une hypovolémie (p.ex. après un traitement par des hautes doses de diurétiques), il faut s'attendre à une chute symptomatique de la pression artérielle. Losartan HCT Zentiva ne doit pas être utilisé chez les patients présentant une déplétion du volume intravasculaire.
Elévation du potassium sérique
L'emploi simultané d'autres médicaments susceptibles d'augmenter le potassium sérique peut entraîner une hyperkaliémie (voir «Interactions»).
Insuffisance hépatique
Des données pharmacocinétiques ont montré une augmentation significative des concentrations plasmatiques de losartan chez les patients cirrhotiques. C'est pourquoi il convient d'envisager une posologie initiale réduite chez les patients dont l'anamnèse révèle des troubles de la fonction hépatique (voir sous «Posologie/Mode d'emploi» et «Pharmacocinétique»).
«Double blocage» du système rénine-angiotensine-aldostérone
Voir sous «Interactions».
Hydrochlorothiazide
Hypotension et troubles de l'équilibre hydro-électrolytique
Comme pour tout autre traitement antihypertenseur, une hypotension symptomatique peut survenir. Cet effet secondaire, rarement observé chez les patients hypertendus ne présentant pas de complication, est en revanche plus probable en cas de déséquilibre hydrique et électrolytique. L'apparition d'éventuels signes cliniques de troubles de l'équilibre hydro-électrolytique, p.ex. un déficit volumique, une hyponatrémie, une alcalose hypochlorémique, une hypomagnésiémie ou une hypokaliémie, pouvant apparaître durant une diarrhée ou des vomissements, doit être surveillée. C'est pourquoi des déterminations périodiques des électrolytes sériques devraient être réalisées chez les patients sous traitement diurétique.
Effets métaboliques et endocriniens
Les thiazides peuvent diminuer la tolérance au glucose. Une adaptation du traitement antidiabétique, y compris par l'insuline, peut donc être nécessaire (voir sous «Interactions»).
Les thiazides peuvent diminuer l'excrétion rénale du calcium et entraîner une augmentation légère et passagère du calcium sérique. Une hypercalcémie prononcée peut être le signe d'une hyperparathyroïdie cachée. Les thiazides doivent donc être arrêtés avant des tests de la fonction parathyroïdienne.
Un traitement diurétique avec des thiazides peut conduire à une augmentation des valeurs de cholestérol et de triglycérides.
Les thiazides peuvent provoquer une hyperuricémie et/ou un accès de goutte chez les patients prédisposés. Etant donné que le losartan fait baisser le taux d'acide urique, l'association losartan-hydrochlorothiazide diminue le risque d'une hyperuricémie induite par le diurétique.
Autres
Des patients avec ou sans anamnèse d'allergie ou d'asthme bronchique peuvent manifester des réactions d'hypersensibilité lors d'un traitement avec des thiazides. Une exacerbation ou l'apparition d'un lupus érythémateux systémique a été observée sous traitement avec des thiazides.
Cancers de la peau de type non mélanocytaire
Dans le cadre de deux études épidémiologiques fondée sur le registre national danois du cancer, un risque accru de cancers de la peau de type non mélanocytaire sous forme de carcinome basocellulaire (CBC) et de carcinome épidermoïde (CE) a été observé lors de l'exposition à des doses cumulées croissantes d'hydrochlorothiazide. L'effet photosensibilisant de l'hydrochlorothiazide pourrait constituer un mécanisme potentiel impliqué dans le développement du cancer de la peau non mélanocytaire.
Les patients qui prennent de l'hydrochlorothiazide doivent être informés du risque de cancer de la peau non mélanocytaire, et de la nécessité de contrôler régulièrement leur peau à la recherche de nouvelles lésions et de signaler immédiatement toute modification cutanée suspecte. Afin de minimiser le risque de cancer de la peau, il sera conseillé aux patients, à titre préventif, de limiter l'exposition au soleil et aux rayons UV et d'utiliser une protection solaire adéquate en cas d'exposition. Les modifications cutanées suspectes doivent être examinées rapidement, si nécessaire au moyen d'un examen histologique de biopsies Chez les patients ayant des antécédents de cancer de la peau non mélanocytaire, il peut être nécessaire de reconsidérer l'utilisation d'hydrochlorothiazide (voir aussi la rubrique «Effets indésirables»).
Enfants et adolescents
L'efficacité et la sécurité du médicament n'ont pas été étudiées chez les enfants et les adolescents.
Nouveau-nés ayant une anamnèse d'exposition à Losartan HCT Zentiva in utero
En présence d'une oligurie ou d'une hypotension, il faut veiller au soutien de la tension artérielle et de la circulation rénale. Une exsanguino-transfusion ou une dialyse peut être nécessaire pour corriger une hypotension et/ou substituer la fonction rénale insuffisante.
Utilisation chez les patients âgés
Des études cliniques ont montré l'absence d'effets liés à l'âge en ce qui concerne l'efficacité ou de la sécurité d'un traitement avec losartan potassique/hydrochlorothiazide.
Interactions
Losartan
Dans le cadre d'études pharmacocinétiques cliniques, aucune interaction cliniquement significative avec les substances ci-après n'a été observée: hydrochlorothiazide, digoxine, warfarine, (voir plus bas: hydrochlorothiazide, alcool, barbituriques ou narcotiques), kétoconazole et érythromycine. Le phénobarbital a, en tant qu'inducteur enzymatique, entraîné une diminution d'env. 20% de l'AUC du losartan et de son métabolite actif. La cimétidine, un inhibiteur enzymatique, a conduit à une augmentation de 18% de l'AUC du losartan, mais non de son métabolite actif. Ces effets n'ont pas été considérés comme cliniquement significatifs. Pour la rifampicine et le fluconazole, des réductions du taux du métabolite actif ont été rapportées. Les conséquences cliniques de ces interactions n'ont pas été évaluées.
Comme d'autres médicaments qui bloquent l'angiotensine II ou ses effets, l'emploi simultané de diurétiques d'épargne potassique (p.ex. la spironolactone, le triamtérène, l'amiloride), de suppléments potassiques, de sels de régime contenant du potassium ou d'autres médicaments susceptibles d'augmenter le potassium sérique (tels que les médicaments contenant du triméthoprime) peuvent provoquer une hausse des taux sériques de potassium.
Comme d'autres médicaments qui influencent l'excrétion de sodium, l'excrétion du lithium peut diminuer. C'est pourquoi les taux sériques de lithium doivent faire l'objet d'une surveillance étroite lorsque des sels de lithium sont administrés en même temps que des antagonistes du récepteur de l'angiotensine II.
Les interactions potentielles du Losartan HCT Zentiva avec des anticoagulants oraux n'ont pas été étudiées.
Des études d'interaction entre Losartan HCT Zentiva et l'acénocoumarol et la phenprocoumone n'ont pas été effectuées.
Les anti-inflammatoires non stéroïdiens (AINS), y compris les inhibiteurs sélectifs de la cyclo-oxygénase-2 (inhibiteurs de la COX-2), peuvent diminuer l'effet des diurétiques et d'autres médicaments antihypertenseurs. C'est pourquoi l'effet hypotenseur des antagonistes du récepteur de l'angiotensine II ou des inhibiteurs de l'ECA peut diminuer sous l'effet des AINS, y compris des inhibiteurs sélectifs de la COX-2.
Chez les patients présentant une fonction rénale diminuée (par exemple patients âgés ou hypovolémiques, y compris patients sous diurétiques) et traités aux anti-inflammatoires non stéroïdiens, y compris des inhibiteurs sélectifs de la cyclo-oxygénase 2, l'administration simultanée d'antagonistes du récepteur de l'angiotensine II ou d'inhibiteurs de l'ECA peut provoquer une aggravation supplémentaire de la fonction rénale pouvant aller jusqu'à une éventuelle défaillance rénale aiguë. Ces effets sont habituellement réversibles. Par conséquent, ces associations seront administrées avec prudence chez des patients présentant une fonction rénale diminuée.
Double blocage du système rénine-angiotensine-aldostérone (SRAA)
Il existe des données indiquant que l'utilisation concomitante d'inhibiteurs de l'ECA, d'antagonistes des récepteurs de l'angiotensine II ou de l'aliskirène augmente le risque d'hypotension, d'hyperkaliémie et de diminution de la fonction rénale (y compris une défaillance rénale aiguë). C'est pour cette raison qu'un double blocage du SRAA par l'utilisation concomitante d'inhibiteurs de l'ECA, d'antagonistes des récepteurs de l'angiotensine II ou de l'aliskirène n'est pas recommandé.
Si le traitement par double blocage est considéré comme absolument nécessaire, celui-ci doit avoir lieu exclusivement sous la supervision d'un spécialiste et sous contrôle étroit de la fonction rénale, des valeurs électrolytiques et de la pression artérielle.
Les inhibiteurs de l'ECA et les antagonistes des récepteurs de l'angiotensine II ne doivent pas être utilisés simultanément chez des patients souffrant de néphropathie diabétique.
Hydrochlorothiazide
Les substances suivantes peuvent conduire à des interactions si elles sont administrées simultanément:
Alcool, barbituriques, narcotiques: renforcement de l'hypotension orthostatique.
Antidiabétiques: (substances orales et insuline): une adaptation de la dose des médicaments antidiabétiques peut être nécessaire.
Autres antihypertenseurs: effet additif.
Colestyramine et colestipol, résines échangeuses d'ions: l'absorption de l'hydrochlorothiazide est diminuée par les résines échangeuses d'anions. Des doses isolées de cholestyramine et de colestipol lient l'hydrochlorothiazide et réduisent son absorption gastro-intestinale dans des proportions pouvant atteindre respectivement 85% et 43%.
Corticostéroïdes, ACTH, ou glycyrrhizine (une substance contenue dans la réglisse), amphotéricine, carbénoxolone: renforcent la carence électrolytique, en particulier l'hypokaliémie.
Catécholamines (p.ex. adrénaline): une diminution de l'action des vasopresseurs est possible, ce qui n'interdit cependant pas leur utilisation.
Myorelaxants non dépolarisants (p.ex. tubocurarine): un renforcement de l'action de ces myorelaxants est possible.
Lithium: les diurétiques diminuent l'excrétion rénale du lithium et augmentent le risque d'une intoxication au lithium. Un traitement simultané est donc déconseillé. Les notices d'emballage accompagnant les préparations de lithium doivent être consultées avant l'utilisation de celles-ci.
Antirhumatismaux non stéroïdiens, y compris inhibiteurs de la cyclo-oxygénase 2: l'administration d'antirhumatismaux non-stéroïdiens, y compris d'inhibiteurs sélectifs de la cyclo-oxygénase 2, peut diminuer l'effet diurétique, natriurétique et antihypertenseur des diurétiques.
Chez les patients présentant une fonction rénale diminuée (par exemple patients âgés ou hypovolémiques, y compris patients sous diurétiques) et traités avec des anti-inflammatoires non stéroïdiens, y compris des inhibiteurs sélectifs de la cyclo-oxygénase 2, l'administration simultanée d'antagonistes du récepteur de l'angiotensine II ou d'inhibiteurs de l'ECA peut provoquer une aggravation supplémentaire de la fonction rénale pouvant aller jusqu'à une éventuelle défaillance rénale aiguë. Ces effets sont habituellement réversibles. Par conséquent, ces traitements seront associés avec prudence chez des patients présentant une fonction rénale diminuée.
Allopurinol: augmentation de la fréquence des réactions d'hypersensibilité à l'allopurinol.
Cytostatiques (p.ex. méthotrexate, cyclophosphamide): diminution de l'excrétion rénale des cytostatiques.
Amantadine: augmentation du risque d'effets indésirables de l'amantadine.
Anticholinergiques (p.ex. atropine, bipéridène): augmentation de la biodisponibilité des diurétiques de type thiazide.
Vitamine D: renforcement de l'augmentation du calcium sérique.
Ciclosporine: augmentation du risque d'une hyperuricémie et de ses complications (goutte).
Sels calciques: les diurétiques de type thiazide peuvent provoquer une hypercalcémie par augmentation de la réabsorption tubulaire du calcium.
Diazoxide: renforcement de l'effet hyperglycémique du diazoxide.
Interactions médicamenteuses/Examens de laboratoire
En raison de leur action sur le métabolisme calcique, les thiazides peuvent influer sur les méthodes d'analyse de la fonction des glandes parathyroïdes (voir sous «Mises en garde et précautions»).
Grossesse/Allaitement
Grossesse
Losartan HCT Zentiva est contre-indiqué pendant la grossesse (voir sous «Contre-indications»). L'administration de Losartan HCT Zentiva doit être arrêtée le plus rapidement possible dès qu'une grossesse est constatée.
On ne dispose pas de données épidémiologiques définitives concernant le risque tératogène après une exposition aux inhibiteurs de l'ECA au cours du premier trimestre de la grossesse; une légère augmentation du risque ne peut cependant pas être exclue. Bien qu'il n'existe pas de données épidémiologiques contrôlées sur le risque associé aux antagonistes des récepteurs de l'angiotensine II (ARA II), un risque comparable pourrait exister avec cette classe de médicaments. A moins que le traitement par ARA II soit considéré comme nécessaire, les patientes qui envisagent une grossesse doivent passer à un traitement antihypertenseur alternatif offrant un profil de sécurité approprié pour la femme enceinte. Si une grossesse est constatée, il faut immédiatement arrêter le traitement par ARA II et commencer au besoin un traitement alternatif (voir «Mises en garde et précautions»).
Les enfants ayant une anamnèse d'exposition à Losartan HCT Zentiva in utero doivent être surveillés étroitement à la recherche d'une hypotension, d'une oligurie et d'une hyperkaliémie.
On sait qu'un traitement aux ARA II pendant les deuxième et troisième trimestres de la grossesse entraîne des effets fœtotoxiques (diminution de la fonction rénale, oligohydramnios, retard d'ossification des os du crâne) et une toxicité chez le nouveau-né (défaillance rénale, hypotension, hyperkaliémie) (voir «Données précliniques»).
En cas d'exposition à Losartan HCT Zentiva à partir du deuxième trimestre de la grossesse, il est vivement recommandé de contrôler la fonction rénale et le crâne par des examens échographiques.
Ces effets indésirables sont normalement associés à l'utilisation de ce type de médicaments au cours du deuxième et du troisième trimestre de la grossesse. La plupart des études épidémiologiques ayant examiné les anomalies fœtales à la suite d'un traitement antihypertenseur administré pendant le premier trimestre de la grossesse n'ont révélé aucune différence entre les antihypertenseurs agissant sur le système rénine-angiotensine et les autres types d'antihypertenseurs. Le traitement approprié d'une hypertension chez la femme enceinte est important pour optimiser les résultats aussi bien chez la mère que chez le fœtus.
L'hydrochlorothiazide traverse la barrière placentaire. Le mécanisme d'action pharmacologique de l'hydrochlorothiazide peut provoquer une perturbation de la circulation fœto-placentaire et entraîner chez le nouveau-né des effets indésirables tels qu'un ictère, un dérèglement de l'équilibre électrolytique et une thrombocytopénie.
Compte tenu des risques d'un volume plasmatique réduit et d'une ischémie placentaire sans effets bénéfiques sur l'évolution de la maladie, l'administration d'hydrochlorothiazide doit être évitée en cas d'œdèmes gestationnels, d'hypertension gestationnelle ou de pré-éclampsie.
Allaitement
Vu l'absence d'informations disponibles sur l'utilisation de Losartan HCT Zentiva dans la période d'allaitement et le fait que l'hydrochlorothiazide passe dans le lait maternel, Losartan HCT Zentiva est déconseillé. Il est préférable d'utiliser un traitement antihypertenseur alternatif offrant un profil de sécurité approprié pour la femme qui allaite, surtout dans le cas d'un enfant nouveau-né ou prématuré.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Lorsque le patient prend part au trafic routier ou conduit des machines, la prudence est de rigueur.
Effets indésirables
Les études cliniques sur le traitement avec le losartan potassique en association avec l'hydrochlorothiazide n'ont révélé aucun effet indésirable nouveau. Les effets indésirables ont été limités à ceux déjà constatés au cours des études précédentes sur le losartan et/ou l'hydrochlorothiazide. La fréquence des événements indésirables sous association des deux médicaments a été comparable à celle enregistrée sous placebo. De même, le pourcentage des arrêts de traitement a été comparable à celui observé pour le placebo. Dans la plupart des cas, les effets indésirables ont été légers et passagers et n'ont pas nécessité l'arrêt du traitement.
Les effets indésirables sont répartis en fonction de classes d'organes et mentionnés dans l'ordre décroissant des fréquences: très fréquents (≥1/10), fréquents (≥1/100, <1/10), occasionnels (≥1/1'000, <1/100), rares (≥1/10'000, <1/1'000) et très rares (<1/10'000), y compris des cas isolés rapportés.
Au cours d'études cliniques avec le losartan potassique/hydrochlorothiazide chez des patients atteints d'hypertension essentielle et d'hypertension avec hypertrophie du ventricule gauche, les effets indésirables ci-après ont été observés:
Affections du système nerveux
Fréquents: étourdissements.
Affections de l'oreille et du labyrinthe
Fréquents: vertiges rotatoires.
Affections de la peau et du tissu sous-cutané
Rares: éruption cutanée.
Troubles généraux et anomalies au site d'administration
Fréquents: sensation de faiblesse, fatigue.
Les autres effets indésirables ci-après ont été observés pour Losartan HCT Zentiva après l'introduction sur le marché et/ou dans des études cliniques, ou observés pour les monosubstances indépendamment l'une de l'autre après l'introduction sur le marché (les catégories de fréquence ne peuvent pas être indiquées pour les rapports post-commercialisation):
Infections et infestations
Fréquents: infections des voies respiratoires supérieures.
Tumeurs bénignes, malignes et non spécifiques (y compris kystes et polypes)
Cancers de la peau de type non mélanocytaire [CPNM] (carcinome basocellulaire [CBC] et carcinome épidermoïde [CE]).
Troubles de la circulation sanguine et lymphatique
Rares: purpura.
Très rares, y compris les cas isolés: agranulocytose, myélodépression et anémie hémolytique, leucopénie.
Anémie, thrombocytopénie.
Affections du système immunitaire
Très rares, y compris les cas isolés: réactions d'hypersensibilité.
De rares cas de réactions anaphylactiques, d'angio-œdèmes y compris de gonflements du larynx et de la glotte (à l'origine d'une obstruction des voies respiratoires) et/ou des gonflements du visage, des lèvres, du pharynx et/ou de la langue ont été rapportés chez des patients sous traitement de losartan; quelques-uns de ces patients avaient présenté dans le passé un angio-œdème sous d'autres médicaments, y compris des inhibiteurs de l'ECA.
Troubles du métabolisme et de la nutrition
Fréquents: hyperkaliémie, hypokaliémie.
Occasionnels: perte d'appétit, hyperuricémie, hyponatrémie, hypomagnésiémie.
Rares: hypercalcémie, hyperglycémie, aggravation d'un état métabolique diabétique.
Très rares, y compris les cas isolés: alcalose hypochlorémique.
Affections psychiatriques
Fréquents: insomnie, agitation.
Rares: dépressions.
Affections du système nerveux
Très fréquents: céphalées.
Rares: vertiges ou étourdissements, paresthésies.
Dysgueusie, migraine.
Au cours d'études contrôlées, menées en double aveugle chez des patients atteints d'hypertension artérielle essentielle, des céphalées ont été observés chez 14,1% des patients traités avec le losartan, par rapport à 17,2% des patients dans le groupe sous placebo.
Affections oculaires
Troubles de la vision, surtout dans les premières semaines du traitement.
Affections cardiaques
Fréquents: hypotension artérielle, palpitations, tachycardie.
Occasionnels: problèmes orthostatiques dépendants de la dose, hypotension orthostatique, pouvant être renforcée par l'alcool, les anesthésiques ou les sédatifs.
Rares: arythmies cardiaques.
Affections vasculaires
Rares: vascularite y compris de Henoch-Schoenlein.
Très rares, y compris les cas isolés: vascularite nécrosante.
Affections respiratoires, thoraciques et médiastinales
Fréquents: nez bouché, toux, pharyngite, troubles du sinus.
Très rares, y compris les cas isolés: troubles respiratoires y compris pneumonie et œdème pulmonaire.
Affections gastro-intestinales
Fréquents: douleurs abdominales, dyspepsie, nausées, vomissements.
Rares: troubles abdominaux, constipation, troubles gastro-intestinaux.
Très rares, y compris les cas isolés: pancréatite.
Diarrhée.
Affections hépatobiliaires
Rares: hépatite, cholestase intra-hépatique ou ictère.
Troubles cutanés et des tissus sous-cutanés
Occasionnels: urticaire, autres éruptions cutanées.
Très rares, y compris les cas isolés: épidermolyse aiguë toxique, réactions rappelant un lupus érythémateux et réactivation d'un lupus érythémateux.
Erythrodermie, photosensibilité, prurit.
Affections musculosquelettiques et du tissu conjonctif
Fréquents: douleurs dorsales, crampes musculaires.
Arthralgie, myalgie.
Affections du rein et des voies urinaires
Rares: glycosurie.
Affections des organes de reproduction et du sein
Rares: impuissance.
Dysfonction érectile.
Troubles généraux et anomalies au site d'administration
Fréquents: douleurs thoraciques, œdèmes/tuméfaction.
Malaise.
Investigations
Fréquents: augmentation du taux d'ALAT, protéinurie.
Insuffisance hépatique.
Description d'effets indésirables sélectionnés
Cancers de la peau de type non mélanocytaire (CBC et CE): sur la base des données disponibles provenant d'études épidémiologiques, une relation cumulative dose-dépendante entre l'exposition à l'hydrochlorothiazide et des cancers de la peau de type non mélanocytaire a été observée (voir aussi les rubriques «Mises en garde et précautions» et «Propriétés/Effets»).
Surdosage
Il n'existe pas d'informations spécifiques concernant le traitement d'un surdosage de Losartan HCT Zentiva. Le traitement avec Losartan HCT Zentiva doit être arrêté et le patient devra être attentivement surveillé. Au cas où la dose excessive a été prise depuis peu, induire le vomissement et corriger pertes de liquide, déséquilibres électrolytiques, coma hépatique et hypotension par des mesures appropriées.
Losartan
Les données dont on dispose sur le surdosage du losartan chez l'être humain sont limitées. Les signes les plus probables d'un surdosage devraient être une chute de la pression artérielle et une tachycardie. Une bradycardie pourrait survenir consécutivement à une stimulation du système parasympathique (stimulation vagale). En cas d'hypotension symptomatique, un traitement de soutien approprié pour stimuler la circulation devrait être administré.
Ni le losartan ni son métabolite actif ne peuvent être éliminés par hémodialyse.
Hydrochlorothiazide
Les principaux symptômes et les résultats d'analyse qui permettent de conclure à un surdosage sont des déséquilibres électrolytiques (hypokaliémie, hypochlorémie, hyponatrémie) et une déshydratation, consécutifs à une diurèse excessive. S'il y a prise simultanée de digitaliques, l'hypokaliémie peut renforcer les arythmies cardiaques.
On ignore dans quelle mesure l'hydrochlorothiazide est éliminé par hémodialyse.
Propriétés/Effets
Code ATC: C09DA01
Losartan
Le losartan est un antagoniste oral du récepteur de l'angiotensine-II (type AT1). L'angiotensine II se lie au récepteur AT1 que l'on trouve dans de nombreux tissus du corps humains (par ex. la musculature lisse des vaisseaux, les glandes surrénales, les reins et le cœur) où elle produit divers effets biologiques importants comprenant la vasoconstriction et la sécrétion d'aldostérone. L'angiotensine II stimule également la prolifération des cellules musculaires lisses. Des expérimentations biologiques et pharmacologiques ont montré que le losartan se lie sélectivement au récepteur AT1. Le losartan et son métabolite pharmacologiquement actif sous forme d'acide carboxylique (E-3174) bloquent aussi bien in vivo qu'in vitro tous les effets physiologiques significatifs de l'angiotensine II, indépendamment de son origine ou de son mode de synthèse.
Lors de l'administration du losartan, l'inhibition du rétrocontrôle négatif de l'angiotensine II sur la sécrétion de rénine conduit à une augmentation de l'activité de la rénine dans le plasma. L'accroissement de l'activité de la rénine plasmatique entraîne une augmentation de l'angiotensine II dans le plasma. En dépit de cette augmentation, l'effet hypotenseur et la diminution de la concentration d'aldostérone dans le plasma sont conservés, ce qui témoigne d'un blocage effectif des récepteurs de l'angiotensine-II.
Le losartan se lie sélectivement aux récepteurs AT1; il ne se lie ni ne bloque aucun autre récepteur hormonal ou canal ionique intervenant dans le contrôle des mécanismes cardiovasculaires. L'enzyme de conversion de l'angiotensine (kinase II) qui dégrade la bradykinine n'est pas inhibée par le losartan. Par conséquent les effets qui ne reposent pas sur le blocage des récepteurs AT1, tels que l'augmentation des effets dus à la bradykinine ou la formation d'œdèmes (losartan 1,7%, placebo 1,9%) ne doivent pas être attribués au losartan.
Efficacité clinique
Dans les études cliniques, l'administration d'une dose journalière unique de losartan à des patients présentant une hypertension essentielle légère à modérée, a induit une baisse statistiquement significative de la pression artérielle systolique et diastolique. Dans des études cliniques, cet effet hypotenseur a pu être maintenu durant une période se prolongeant jusqu'à un an. Les mesures de la pression artérielle au terme de l'intervalle posologique (24 heures après la prise) ont montré, comparativement à l'effet maximum (après 5-6 heures), un contrôle stable de la pression au cours des 24 heures. L'effet antihypertenseur correspondait au rythme journalier naturel. L'abaissement de la pression au terme de l'intervalle posologique se maintenait encore à des valeurs correspondant à 70 -80% de la baisse obtenue après 5 - 6 heures. Une interruption du traitement avec le losartan n'a pas entraîné de montée brutale de la pression artérielle. En dépit d'une baisse notable de la pression artérielle, le losartan n'a pas exercé d'effet cliniquement significatif sur la fréquence cardiaque.
Chez des patients non diabétiques présentant une hypertension avec protéinurie, le losartan diminue de façon statistiquement significative la protéinurie et l'excrétion fractionnelle d'albumine et d'IgG. Le losartan maintient la filtration glomérulaire et réduit la fraction filtrée. Le losartan a entraîné une légère diminution des taux d'urémie, même pendant les traitements prolongés.
Chez des patients présentant une insuffisance cardiaque gauche, des doses de 25 à 50 mg de losartan ont provoqué des réactions hémodynamiques et neuro-hormonales positives, telles que l'élévation de l'index cardiaque et l'abaissement de la pression pulmonaire capillaire, de la résistance vasculaire systémique, de la pression artérielle moyenne, de la fréquence cardiaque et des taux sanguins d'aldostérone et de noradrénaline. Chez ces patients insuffisants cardiaques, la survenue d'une hypotension était dépendante de la dose administrée de losartan.
Le losartan présente une efficacité comparable chez l'homme et la femme, ainsi que chez les hypertendus jeunes (moins de 65 ans) et âgés (plus de 65 ans). L'efficacité du losartan était cependant plus faible chez les patients de couleur noire que chez les Caucasiens.
L'expérience dont on dispose dans l'utilisation de Losartan HCT Zentiva chez les patients atteints d'autres affections cardiovasculaires (p.ex. insuffisance cardiaque, coronaropathie) est limitée.
Lorsque Losartan HCT Zentiva est administré en association avec des diurétiques du type thiazide, on peut s'attendre à un effet additif sur la baisse de la pression artérielle.
Hydrochlorothiazide
Le mécanisme de l'effet antihypertenseur des thiazides n'est pas connu. Chez les sujets normotendus, les thiazides n'entraînent pas de diminution de la pression artérielle.
L'hydrochlorothiazide est un diurétique et un antihypertenseur. Il agit sur la réabsorption des électrolytes au niveau du tube contourné distal du rein. L'hydrochlorothiazide augmente l'excrétion du sodium et du chlorure environ dans les mêmes proportions. La natriurèse peut être accompagnée d'une légère perte en potassium et en bicarbonates.
La diurèse débute dans les 2 heures qui suivent la prise par voie orale, atteint un maximum après 4 heures environ, puis persiste durant 6 - 12 heures environ.
Cancers de la peau de type non mélanocytaire (CPNM): sur la base des données disponibles provenant d'études épidémiologiques, une relation cumulative dose-dépendante entre l'exposition à l'hydrochlorothiazide (HCTZ) et le développement de CPNM a été observée. Une des études a inclus une population composée de 71'553 cas de CBC et de 8'629 cas de CE, appariés respectivement à 1'430'883 et 172'462 cas témoins. Une forte exposition à l'HCTZ (dose cumulative ≥50'000 mg) a été associée à un rapport de cotes (RC) ajusté de 1,29 (IC à 95%: 1,23-1,35) pour le CBC et de 3,98 (IC à 95%: 3,68-4,31) pour le CE. Une relation dose-effet cumulative claire a été observée à la fois pour le CBC et pour le CE. Une autre étude a montré le lien possible entre l'exposition à l'HCTZ et le carcinome des lèvres (CE): 633 cas de carcinome des lèvres ont été comparés avec 63'067 cas témoins, à l'aide d'une stratégie d'échantillonnage axée sur les risques «(risk set sampling»). Une relation dose-effet cumulative a été démontrée avec une augmentation du RC ajusté de 2,1 (IC à 95%: 1,7-2,6) à 3,9 (IC à 95%: 3,0-4,9) à la dose cumulative élevée (≥25'000 mg) et à 7,7 (IC à 95%: 5,7-10,5) à la dose cumulative la plus élevée (≥100'000 mg). (Voir également la rubrique «Mises en garde et précautions»).
Losartan-hydrochlorothiazide
Les deux composants de Losartan HCT Zentiva ont un effet additif qui est supérieur à celui de chaque composant individuel sur la diminution de la pression artérielle. On présume que cet effet additif résulte d'une action complémentaire des deux substances. En conséquence de l'effet diurétique, l'hydrochlorothiazide augmente l'activité de la rénine plasmatique, la sécrétion d'aldostérone et les taux plasmatiques d'angiotensine II, et diminue le potassium sérique. L'administration de losartan bloque toutes les actions de l'angiotensine II importantes du point de vue physiologique. En outre, la déplétion potassique induite par les diurétiques pourrait être diminuée par un blocage de l'aldostérone.
On a montré que le losartan présente un effet uricosurique léger et passager. Une augmentation modérée de l'acide urique a été observée sous hydrochlorothiazide. L'association de losartan et d'hydrochlorothiazide tend à diminuer l'hyperuricémie induite par les diurétiques.
L'effet antihypertenseur de Losartan HCT Zentiva est maintenu pendant 24 heures. Cet effet antihypertenseur a persisté dans des études cliniques s'étendant sur une année au moins. En dépit d'une diminution significative de la pression artérielle, le traitement avec Losartan HCT Zentiva n'a pas entraîné d'effets cliniques mesurables sur la fréquence cardiaque. Dans des études cliniques, on a observé à la fin de l'intervalle de prise une diminution pouvant atteindre en moyenne 13,2 mmHg de la pression diastolique mesurée en position assise, au terme d'un traitement de douze semaines avec losartan 50 mg/hydrochlorothiazide 12,5 mg.
Dans une étude où l'on a testé en parallèle les deux associations losartan 50 mg/hydrochlorothiazide 12,5 mg et captopril 50 mg/hydrochlorothiazide 25 mg chez des patients hypertendus jeunes (<65 ans) et âgés (≥65 ans), on n'a pu mettre en évidence une différence entre les deux groupes de traitement ou les deux groupes d'âge.
Etude LIFE
L'étude interventionnelle avec le losartan sur la réduction des critères d'évaluation lors d'hypertension artérielle (Losartan Intervention for Endpoint Reduction in Hypertension, LIFE), était une vaste étude multicentrique, multinationale, randomisée, menée en triple aveugle et contrôlée activement, incluant 9'193 patients hypertendus âgés entre 55 et 80 ans (moyenne: 67 ans) présentant une hypertrophie ventriculaire gauche documentée par ECG. Parmi les patients inclus au début de l'étude, 1'195 (13%) présentaient un diabète sucré, 1'326 (14%) une hypertension systolique isolée, 1'468 (17%) une cardiopathie coronarienne et 728 (8%) une affection cérébrovasculaire.
L'objectif de l'étude était de démontrer l'existence d'un effet protecteur cardiovasculaire du losartan par rapport à l'aténolol, dépassant l'effet protecteur obtenu grâce à la baisse de la pression artérielle. La pression artérielle a été mesurée 24 heures après l'administration de la dernière dose. Selon la conception de l'étude, une réduction comparable de la pression artérielle devait être obtenue à cette fin dans les deux groupes de traitement. Les patients ont reçu, de manière randomisée, soit le losartan 50 mg, soit l'aténolol 50 mg une fois par jour. Lorsque la pression artérielle visée (<140/90 mm Hg) n'avait pas été atteinte, de l'hydrochlorothiazide (12,5 mg) était ajouté en premier, puis, le cas échéant, la dose de losartan ou d'aténolol était portée à 100 mg une fois par jour. Si nécessaire, d'autres antihypertenseurs (p.ex. augmentation de la dose d'hydrochlorothiazide à 25 mg ou adjonction d'autres diurétiques, d'antagonistes du calcium, d'alphabloquants, d'antihypertenseurs à action centrale, mais non d'inhibiteurs de l'ECA, d'antagonistes de l'angiotensine II ou de β-bloquants) ont été administrés en plus afin d'atteindre la pression artérielle visée. L'objectif étant de contrôler la pression artérielle, les patients des deux bras de l'étude LIFE ont reçu en plus de l'hydrochlorothiazide durant la majeure partie de la période pendant laquelle ils ont également été traités avec la médication d'étude (73,9% ou 72,4% des jours dans le groupe losartan ou aténolol).
Dans les deux groupes de traitement, la pression artérielle a été réduite de manière significative jusqu'à des valeurs comparables, et une fraction comparativement importante de patients a atteint la pression artérielle visée. La durée moyenne d'observation était de 4,8 ans.
Le critère d'évaluation principal était la combinaison des cas de morbidité et de mortalité cardiovasculaire et il était mesuré en termes de réduction des événements cardiovasculaires combinés de décès cardiovasculaire, d'accident vasculaire cérébral et d'infarctus du myocarde. Les résultats ont montré que le traitement par le losartan a permis, par rapport à l'aténolol, une réduction du risque de 13% (p=0,021) des critères d'évaluation principaux combinés (voir le graphique 1).
La significativité statistique a été démontrée pour la réduction du nombre d'accidents vasculaires cérébraux, alors que les critères d'évaluation associés à la mortalité cardiovasculaire et aux infarctus du myocarde n'étaient pas statistiquement significatifs.

Graphique 1) Courbes de Kaplan-Meier décrivant le critère d'évaluation principal combiné (décès cardiovasculaire, accident vasculaire cérébral ou infarctus) du myocarde dans les groupes traités par le losartan et l'aténolol, ajustées au «Framingham Baseline Risk Score» et au degré de l'hypertrophie cardiaque gauche documentée par ECG.
Le traitement par le losartan a réduit le risque d'accident vasculaire cérébral par rapport à l'aténolol de 25% (p= 0,001). Le taux des événements de mortalité cardiovasculaire et des infarctus du myocarde n'était pas significativement différent entre les groupes de traitement. L'effet du losartan sur le critère d'évaluation combiné principal semblait dépasser l'avantage obtenu grâce à la seule baisse de la pression artérielle (voir le tableau ci-dessous).
Critères d'évaluation de l'étude LIFE
Résultat | Losartan (N=4605) | Taux* | Aténolol (N=4588) | Taux * | Réduction du risque** | Valeur p |
|---|---|---|---|---|---|---|
Critère d'évaluation combiné principal | 508 (11%) | 23,8 | 588 (13%) | 27,9 | 13% | 0,021 |
Composantes du critère d'évaluation combiné principal | ||||||
Mortalité cardiovasculaire | 204 (4%) | 9,2 | 234 (5%) | 10,6 | 11% | 0,206 |
Accident vasculaire cérébral | 232 (5%) | 10,8 | 309 (7%) | 14,5 | 25% | 0,001 |
Infarctus du myocarde | 198 (4%) | 9,2 | 188 (4%) | 8,7 | -7% | 0,491 |
* Par 1000 années-patients de suivi.
** Ajusté au «Framingham Baseline Risk Score» et aux mesures de l'HVG documentées par ECG.
D'autres critères d'évaluation cliniques de l'étude LIFE étaient: la mortalité totale, les hospitalisations en raison d'une insuffisance cardiaque ou d'une angine de poitrine, des mesures de revascularisation coronarienne ou périphérique ainsi qu'une réanimation après un arrêt cardiaque. Aucune différence significative en termes de fréquences de ces critères d'évaluation entre les groupes de traitement n'a été observée. Les patients traités par le losartan ont montré, par rapport aux patients traités par l'aténolol, une réduction significativement plus élevée des valeurs de l'HVG dans l'ECG.
L'effet du losartan par rapport à l'aténolol sur la morbidité et la mortalité cardiovasculaires a été étudié dans des sous-groupes chez des patients atteints de diabète sucré (n=1195) et présentant une hypertension systolique isolée (HSI) (n=1326) dans leurs antécédents. En ce qui concerne le principal critère d'évaluation combiné, les résultats de ces sous-groupes correspondaient au résultat favorable du traitement par le losartan de l'ensemble de la population étudiée: chez les diabétiques, une réduction de 24% du risque (p=0,03) et, chez les patients présentant une hypertension systolique isolée (HSI), une réduction de 25% du risque (p=0,06) ont été observées. Chez les patients atteints d'hypertension artérielle, avec hypertrophie ventriculaire gauche, Losartan HCT Zentiva est une formulation alternative adaptée aux patients qui seraient sinon traités en même temps avec le losartan et l'hydrochlorothiazide une fois par jour, afin de réduire la morbidité et la mortalité cardiovasculaires.
Différences concernant la couleur de peau
Les résultats favorables sur la morbidité et la mortalité cardiovasculaires du losartan par rapport à l'aténolol, observés au cours de l'étude LIFE, ne sont pas valables pour les patients de couleur de peau noire qui souffrent d'hypertension artérielle et d'hypertrophie ventriculaire gauche, bien que les deux traitements permettent des baisses efficaces de la pression artérielle chez les patients de couleur de peau noire.
En revanche, au cours de l'étude LIFE, le losartan a abaissé, par rapport à l'aténolol, le risque de morbidité et de mortalité cardiovasculaires chez les patients hypertendus non noirs souffrant d'hypertrophie ventriculaire gauche (n=8660) de manière significative (p=0,003) en ce qui concerne le critère d'évaluation principal composite (décès d'origine cardiovasculaire, accidents vasculaires cérébraux et infarctus du myocarde).
Il s'est avéré que les patients noirs traités par l'aténolol étaient exposés à un risque plus faible d'atteindre le critère d'évaluation principal combiné que les patients noirs traités par le losartan (p=0,03). Dans le sous-groupe de patients de couleur de peau noire (n= 533; 6% des patients de l'étude LIFE), 29 événements du critère d'évaluation principal ont été observés parmi les 263 patients traités par l'aténolol (11%, 25,9 par 1000 années-patients) contre 46 parmi les 270 patients traités par le losartan (17%, 41,8 par 1000 années-patients).
Au cours de l'étude LIFE, une fréquence significativement plus faible des interruptions du traitement en raison d'effets indésirables a été observée sous le losartan, par rapport à l'aténolol.
Pharmacocinétique
Absorption
Losartan
Après administration orale, le losartan est bien absorbé et subit un effet de premier passage, au cours duquel se forment un métabolite actif sous forme d'acide carboxylique et d'autres métabolites inactifs. La biodisponibilité des comprimés de losartan se situe aux environs de 33%. Les pics de concentration moyens du losartan sont atteints après 1 heure, ceux du métabolite actif après 3 - 4 heures. Lors de l'absorption simultanée d'un repas normal, on n'a pas constaté de variation cliniquement significative du profil des concentrations plasmatiques.
Hydrochlorothiazide
La biodisponibilité des comprimés d'hydrochlorothiazide est de 70% environ. Après absorption par voie orale d'une dose unique de 12,5, 25, 50 et 75 mg, des concentrations plasmatiques maximales moyennes de 70, 142, 260 et 376 ng/ml sont atteintes en moyenne au bout de deux heures. A l'intérieur de la fourchette des doses thérapeutiques, la disponibilité systémique de l'hydrochlorothiazide est proportionnelle à la dose.
Distribution
Losartan
Le losartan comme son métabolite actif sont liés aux protéines plasmatiques dans une proportion de 99% au moins, principalement à l'albumine. Le volume de distribution du losartan est de 34 litres. Des études chez le rat ont montré que le losartan ne traverse pratiquement pas la barrière hémato-encéphalique.
Hydrochlorothiazide
L'hydrochlorothiazide traverse le placenta, mais ne traverse pas la barrière hémato-encéphalique; il passe dans le lait maternel.
L'hydrochlorothiazide est lié pour environ 40-70% aux protéines du plasma. Le volume de distribution apparent est estimé à 5-6 l/kg.
Métabolisme
Losartan
Environ 14% d'une dose de losartan administrée per os sont transformés en métabolite actif. Des études in vitro montrent que les cytochromes P450 2C9 et 3A4 contribuent à la transformation du losartan en ses métabolites. Chez 1% des patients, cette transformation a été moins importante du fait d'un polymorphisme génétique concernant une enzyme particulière (moins de 1% de la dose en comparaison de 14% de la dose pour des patients normaux). Après administration orale de losartan marqué au 14C, la radioactivité circulant dans le plasma est due principalement au losartan et à son métabolite actif.
Outre le métabolite actif, des métabolites inactifs sont également formés, parmi lesquels deux principaux par hydroxylation de la chaîne latérale butyle et un autre métabolite, un glucuronide N-2 tétrazole.
Elimination
Losartan
La clairance plasmatique du losartan est de 600 ml/min, celle du métabolite actif de 50 ml/min. La clairance rénale du losartan est de 74 ml/min, respectivement de 26 ml/min pour le métabolite actif. Lors d'administration orale, 4% environ de la dose restent inchangés, environ 6% de la dose sont éliminés dans l'urine sous forme de métabolite actif. La pharmacocinétique du losartan et de son métabolite actif suit une évolution linéaire jusqu'à des doses de 200 mg.
Après administration orale, les concentrations plasmatiques de losartan et de son métabolite actif diminuent de manière polyexponentielle avec une demi-vie respective d'environ 2 et 6-9 heures. Avec une posologie journalière unique de 100 mg, on n'a pas observé de phénomène significatif d'accumulation du losartan ni de son métabolite actif dans le plasma.
L'élimination du losartan et de ses métabolites est assurée par les voies biliaire et rénale. Après administration orale de losartan marqué au 14C, on retrouve chez l'homme 35% de la radioactivité dans l'urine et 58% dans les selles.
Hydrochlorothiazide
Des études comprenant la mesure des taux plasmatiques sur au moins 24 heures ont révélé des demi-vies plasmatiques se situant entre 5,6 et 14,8 heures. Sur une dose administrée oralement, une part d'au moins 61% est éliminée dans les 24 heures par les reins, dont 95% sous forme inchangée et 4% sous forme d'hydrolysat d'amino-2-chloro-4-m-benzènedisulfonamide. Jusqu'à 24% d'une dose orale peuvent être retrouvés dans les selles et une quantité insignifiante est excrétée par voie biliaire.
Cinétique dans les situations cliniques particulières
Losartan-hydrochlorothiazide
Pour le losartan (mais non pour le métabolite actif du losartan) et pour l'hydrochlorothiazide, l'aire sous la courbe (AUC) est plus élevée chez les patients âgés que chez les patients jeunes.
Losartan
Chez les patients atteints d'une cirrhose alcoolique légère à modérée, les concentrations plasmatiques de losartan et de son métabolite actif après prise per os se sont révélées respectivement 5 et 1,7 fois plus élevées que celles mesurées chez des hommes jeunes et sains.
Ni le losartan ni son métabolite actif ne peuvent être éliminés par hémodialyse.
Hydrochlorothiazide
Chez les patients âgés, la concentration plasmatique à l'état d'équilibre de l'hydrochlorothiazide est plus élevée et la clairance systémique considérablement ralentie par rapport aux patients jeunes.
En cas de troubles de la fonction rénale, les pics plasmatiques moyens et les valeurs d'AUC de l'hydrochlorothiazide sont augmentés. Chez les patients atteints d'insuffisance rénale (clairance de la créatinine comprise entre 30 et 70 ml/min), la demi-vie moyenne d'élimination est presque doublée.
Données précliniques
Les études précliniques – y compris les études conventionnelles concernant la pharmacologie générale, la génotoxicité et le potentiel cancérigène – n'ont révélé aucun risque particulier pour l'homme. Le potentiel toxique d'une association de losartan et d'hydrochlorothiazide en administration orale a été évalué chez des rats et des chiens dans des études de toxicité chronique d'une durée allant jusqu'à six mois. Les altérations observées sous l'association losartan-hydrochlorothiazide dans le cadre de ces études étaient dues essentiellement au losartan. L'administration de l'association losartan-hydrochlorothiazide a induit une réduction des paramètres érythrocytaires (taux de globules rouges, hémoglobine, hématocrite), une augmentation du taux sérique d'azote uréique, une réduction de la masse cardiaque (sans corrélat histologique) et des altérations gastro-intestinales (lésions des muqueuses, ulcères, érosions, hémorragies).
Aucun indice de tératogénicité n'a été trouvé chez le rat ou le lapin après l'administration de losartan-hydrochlorothiazide. Chez le rat, une toxicité fœtale se manifestant par une fréquence légèrement accrue de côtes surnuméraires dans la génération F1 a été observée lorsque les femelles étaient traitées avant et pendant la gestation. Ainsi qu'on l'a également constaté dans des études sur le losartan seul, une administration de losartan-hydrochlorothiazide à des rates en phase tardive de gestation et/ou allaitantes a été associée à des effets indésirables chez les fœtus et les animaux nouveau-nés, notamment une toxicité rénale ou la mort du fœtus.
Remarques particulières
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques concernant le stockage
Conserver Losartan HCT Zentiva pas au-dessus de 30 °C et à l'abri de l'humidité dans l'emballage original.
Tenir hors de la portée des enfants.
Numéro d’autorisation
61314 (Swissmedic).
Titulaire de l’autorisation
Helvepharm AG, Frauenfeld.
Mise à jour de l’information
Décembre 2018.
Відгуки (0)
Ви переглядали

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.





 Deutsch
Deutsch French
French Italian
Italian