Methotrexate Accord Inj Lös 12,5 mg/0,25 ml Fertspr 0,25 ml
Methotrexat Accord Inj Lös 12.5 mg/0.25ml Fertigspritze 0.25 ml
-
9176.39 RUB
Дата доставки:
25.12.2025 - 08.01.2026
При оплате криптовалютой:
Ваша прибыль 917.64 RUB / 10.83 USDT
- Наявність: В наявності
- Виробник: ACCORD HEALTHCARE AG
- Модель: 7572656
- ATC-код L04AX03
- EAN 7680667800095
Склад:
Опис
Was ist Methotrexat Accord und wann wird es angewendet?
Der arzneilich wirksame Bestandteil in Methotrexat Accord ist Methotrexat.
1 ml Injektionslösung enthält 50 mg Methotrexat (als Methotrexat-Dinatrium).
Der Wirkstoff Methotrexat ist ein Folsäureanalogon mit folgenden Eigenschaften:
- es hemmt als Antimetabolit die Vermehrung sich schnell teilender Zellen,
- es unterdrückt bzw. schwächt als Immunsuppressivum unerwünschte körpereigene Abwehrreaktionen ab,
- es hat als Antiphlogistikum entzündungshemmende Wirkungen.
Methotrexat Accord wird auf Verschreibung des Arztes oder der Ärztin angewendet bei:
- aktiver chronischer Polyarthritis (rheumatoider Arthritis) bei Erwachsenen,
- polyarthritischen Formen der schweren, aktiven juvenilen Arthritis bei mangelndem Ansprechen auf nicht-steroidale Antirheumatika (NSAR),
- schwerer, hartnäckiger und beeinträchtigender Psoriasis vulgaris, die nicht genügend auf andere Therapieformen wie Phototherapie, PUVA und Retinoide anspricht, sowie schwerer Psoriasis arthropathica bei Erwachsenen.
- leichtem bis mittelschwerem Morbus Crohn bei erwachsenen Patienten, wenn eine entsprechende Behandlung mit anderen Arzneimitteln nicht möglich ist.
Rheumatoide Arthritis ist eine chronische Erkrankung des Bindegewebes, die durch Entzündung des Synovialgewebes (Gelenkauskleidung) charakterisiert ist. Dieses Gewebe produziert eine Flüssigkeit, die als Gleitmittel für viele Gelenke wirkt. Die Entzündung des Synovialgewebes führt zur Verdickung dieser Haut und zum Anschwellen des Gelenks.
Juvenile Arthritis betrifft Kinder und Jugendliche, die jünger als 16 Jahre sind. Von polyarthritischen Formen wird gesprochen, wenn fünf oder mehr Gelenke innerhalb der ersten sechs Monate der Erkrankung betroffen sind.
Psoriasis vulgaris (Schuppenflechte) ist eine chronische Erkrankung der Haut, die sich durch das Auftreten von roten und weissen schuppenartigen Hauterscheinungen äussert.
Psoriasis arthropathica tritt im Rahmen einer Schuppenflechte auf. Sie zeichnet sich durch psoriatische Läsionen der Haut und der Nägel aus. Weiterhin sind insbesondere die Finger- und Zehengelenke betroffen.
Methotrexat Accord greift in den Krankheitsprozess ein und verlangsamt das Fortschreiten der Krankheit.
Morbus Crohn ist eine bestimmte Form der entzündlichen Darmerkrankung, die alle Bereiche des Magen-Darm-Trakts betrifft und zu Symptomen wie Bauchschmerzen, Durchfall, Erbrechen oder Gewichtsverlust führen kann.
Es ist unbedingt zu beachten, dass bei der Therapie der rheumatoiden Arthritis, der Psoriasis (Schuppenflechte) und von Morbus Crohn die empfohlene Dosis 1x wöchentlich angewendet wird, und dass eine versehentliche tägliche Anwendung der empfohlenen Dosis zu schweren Vergiftungen mit zum Teil tödlichem Ausgang führen kann.
Wann darf Methotrexat Accord nicht angewendet werden?
- wenn Sie überempfindlich (allergisch) gegen Methotrexat oder einen der sonstigen Bestandteile von Methotrexat Accord sind,
- wenn Sie an Leber- oder Nierenerkrankungen leiden (siehe auch Abschnitt «Wie verwenden Sie Methotrexat Accord?»),
- wenn Sie an Erkrankungen des blutbildenden Systems leiden,
- wenn Sie viel Alkohol trinken,
- wenn Sie schwere Infektionen haben, wie zum Beispiel Tuberkulose, HIV oder andere Immundefizienzsyndrome,
- wenn Sie Geschwüre im Mund oder Magen-Darm-Bereich haben,
- wenn Sie schwanger sind oder es werden möchten,
- wenn Sie stillen,
- wenn Sie gleichzeitig eine Impfung mit Lebendimpfstoffen (z.B. Masern, Mumps, Röteln, Poliomyelitis, Varizella) erhalten müssen,
- nach einer bestimmten Art von Narkose (Lachgas-Anästhesie).
Wann ist bei der Anwendung von Methotrexat Accord Vorsicht geboten?
Dieses Arzneimittel kann die Reaktionsfähigkeit, die Fahrtüchtigkeit und die Fähigkeit, Werkzeuge oder Maschinen zu bedienen, beeinträchtigen.
Bei der Anwendung von Methotrexat Accord ist Vorsicht geboten, wenn Sie eine Operation unter Narkose (Lachgas-Anästhesie) benötigen sollten.
Gewisse Arten von Narkosemitteln haben Einfluss auf die Wirkung von Methotrexat und können zu schwerwiegenden Nebenwirkungen mit tödlichem Ausgang führen. Informieren Sie Ihren Arzt bzw. Ihre Ärztin, wenn Sie eine Operation unter Narkose (Lachgas-Anästhesie) benötigen sollten.
Besondere Vorsichtsmassnahmen für die Behandlung mit Methotrexat Accord
Methotrexat beeinträchtigt vorübergehend die Produktion von Spermien und Eizellen, was in den meisten Fällen umkehrbar ist. Methotrexat kann Fehlgeburten und schwere Geburtsfehler verursachen. Sie müssen während der Behandlung mit Methotrexat und für mindestens sechs Monate nach Beendigung der Behandlung eine Schwangerschaft vermeiden (siehe auch Abschnitt «Darf Methotrexat Accord während einer Schwangerschaft oder in der Stillzeit angewendet werden?»).
Auch wenn Methotrexat Accord in niedrigen Dosen angewendet wird, können schwerwiegende Nebenwirkungen auftreten. Um diese rechtzeitig zu erkennen, müssen Vorsichtsmassnahmen ergriffen und regelmässig Nachuntersuchungen durch den Arzt bzw. die Ärztin durchgeführt werden.
Empfohlene Nachuntersuchungen und Vorsichtsmassnahmen:
Vor Beginn der Behandlung:
Es werden Blutuntersuchungen durchgeführt, um zu kontrollieren, ob Sie ausreichend viele Blutkörperchen haben, Tests zur Kontrolle der Leberenzyme, des Bilirubins (Abbauprodukt des roten Blutfarbstoffs), des Serumalbumins (ein Protein im Blut) und der Nierenfunktion. Ihr Arzt bzw. Ihre Ärztin wird ebenfalls kontrollieren, ob Sie an Tuberkulose oder an Hepatitis leiden und Ihren Brustkorb röntgen.
Während der Behandlung:
Es werden Untersuchungen (während der ersten sechs Monate mindestens monatlich und danach mindestens vierteljährlich) durchgeführt:
- Untersuchung des Mundes und des Rachens auf Schleimhautveränderungen
- Blutuntersuchungen
- Kontrolle der Leberfunktion und der Leberenzyme im Serum: Im Fall von stetigem Anstieg der Leberenzyme sollte eine Reduzierung der Dosis oder ein Abbrechen der Therapie in Erwägung gezogen werden. Während der Behandlung mit Methotrexat sollten Sie keine anderen Arzneimittel anwenden, die die Leber oder das blutbildende System schädigen können. Wenn die Einnahme erforderlich ist, sollte eine engmaschigere Kontrolle vorgenommen werden. Sie sollten keinen Alkohol trinken.
- Kontrolle der Nierenfunktion: Da Methotrexat über die Nieren ausgeschieden wird, können schwerwiegende Nebenwirkungen auftreten, wenn Ihre Nieren nicht richtig funktionieren (besonders bei älteren Patientinnen und Patienten). In solchen Fällen sollte eine sorgfältigere Überwachung durch den Arzt bzw. Ärztin erfolgen.
- Kontrolle des Atmungssystems und falls notwendig Lungenfunktionstest: Abhängig vom Testergebnis muss Methotrexat eventuell abgesetzt werden.
Methotrexat kann Ihr Immunsystem, Impfergebnisse und immunologische Testergebnisse beeinflussen. Inaktive, chronische Infektionen (z.B. Herpes Zoster (Gürtelrose), Tuberkulose, Hepatitis B oder C) können wieder aufflammen. Während der Behandlung mit Methotrexat Accord dürfen Sie nicht mit Lebendimpfstoffen geimpft werden.
Entzündliche Reaktionen der Haut (Dermatitis) oder Sonnenbrand, die durch Bestrahlung verursacht wurden, können unter der Behandlung mit Methotrexat wieder auftreten (Recall-Reaktion). Durch Schuppenflechte bedingte Hautveränderungen (psoriatische Läsionen) können sich bei Bestrahlung mit UV-Licht und gleichzeitiger Gabe von Methotrexat verschlimmern.
Durchfall kann eine Nebenwirkung von Methotrexat Accord sein. In diesem Fall muss die Behandlung unterbrochen werden. Bitte sprechen Sie mit Ihrem Arzt oder Ihrer Ärztin, wenn Sie an Durchfall leiden.
Das Auftreten von Lymphknotenvergrösserungen (Lymphomen) kann ein Absetzen der Therapie erforderlich machen. Sollten sich die Lymphome nicht spontan zurückbilden, muss eine entsprechende Therapie eingeleitet werden.
Enzephalopathie (krankhafte Veränderungen des Gehirns) / Leukenzephalopathie (krankhafte Veränderung der weissen Hirnsubstanz) wurden bei Krebspatienten, die eine Methotrexat-Therapie erhalten haben, beobachtet und können für andere Erkrankungen bei einer Methotrexat-Therapie nicht ausgeschlossen werden.
Bei älteren Menschen können die Leber- sowie Nierenfunktion eingeschränkt und die Folsäurereserven gering sein (siehe Abschnitt «Wie verwenden Sie Methotrexat Accord?»). Wenn Sie gleichzeitig regelmässig Alkohol trinken oder andere Arzneimittel anwenden, die die Leber oder das Blutbild schädigen (z.B. Leflunomid), besteht ein erhöhtes Risiko, dass Methotrexat Ihre Leber schädigt. In solchen Fällen sollten Sie sorgfältig überwacht werden. Dies sollte ebenfalls berücksichtigt werden, wenn Sie gleichzeitig hämatotoxische (die Blutbildung schädigende) Arzneimittel (z.B. Leflunomid) einnehmen.
Wenn Leflunomid mit Methotrexat kombiniert wird, kann eine Panzytopenie (verminderte Anzahl an Blutkörperchen und Blutplättchen) und Hepatotoxizität (Schädigung der Leber) vermehrt auftreten.
Antibiotika, wie z.B. Penicilline, Glykopeptide, Sulfonamide, Ciprofloxazin und Cefalotin, können in Einzelfällen die Ausscheidung von Methotrexat über die Niere reduzieren, was die Methotrexatkonzentration im Blut erhöhen kann und zu hämatologischer (die Blutbildung betreffend) und gastrointestinaler (den Magen-Darm-Trakt betreffend) Toxizität führen kann.
Probenecid und schwache organische Säuren wie Schleifendiuretika und Pyrazole (Phenylbutazon) können ebenfalls den Methotrexat-Blutspiegel erhöhen. Nichtsteroidale entzündungshemmende Arzneimittel oder Salicylate können das Risiko einer eingeschränkten Nierenfunktion erhöhen.
Wenn Sie Arzneimittel nehmen, die die Ausscheidung von Methotrexat beeinträchtigen, Nierenschäden verursachen oder die potentiell die Blutbildung beeinträchtigen, werden Sie häufiger überwacht.
Wenn Sie gleichzeitig Arzneimittel einnehmen, die mögliche Nebenwirkungen auf das Knochenmark haben (z.B. Sulfonamide, Trimethoprim-Sulfametoxazol, Chloramphenicol, Pyrimethamine) kann es zu einer verstärkten Störung der Blutbildung kommen.
Wenn Sie Arzneimittel einnehmen, die einen Folsäuremangel verursachen (z.B. Sulfonamide, Trimethoprim-Sulfamethoxazol), kann die Methotrexat-Toxizität erhöht sein. Besondere Vorsicht ist daher geboten, wenn bei Ihnen bereits ein Folsäuremangel besteht. Ihr Arzt bzw. Ihre Ärztin wird über eine Folsäuresupplementierung sorgfältig entscheiden.
Ein Anstieg der toxischen Wirkung von Methotrexat ist nicht zu erwarten, wenn Methotrexat Accord gleichzeitig mit anderen Basistherapeutika (z.B. Goldverbindungen, Penicillamin, Hydroxychloroquin, Sulfasalazin, Azathioprin, Cyclosporin) gegeben wird. Die Kombination von Methotrexat und Sulfasalazin kann zu einer Wirkungsverstärkung von Methotrexat führen. Da sowohl Methotrexat als auch Sulfasalazin die Folsäurebildung hemmen, können vermehrt Nebenwirkungen auftreten. Dieses ist jedoch bisher nur in seltenen Fällen beobachtet worden.
Wenn Protonenpumpenblocker gleichzeitig gegeben werden, kann es zu Wechselwirkungen kommen. Wenn der Protonenpumpenblocker Omeprazol gegeben wird, kann die Ausscheidung von Methotrexat über die Nieren verzögert werden. In Kombination mit Pantoprazol wird die Ausscheidung des Metaboliten 7-Hydroxymethotrexat gehemmt, was in einem Fall zu Myalgie (Muskelschmerzen und Unwohlsein) und Schüttelfrost führte.
Akute Blutungen aus der Lunge bei Patienten mit zugrunde liegender rheumatologischer Erkrankung wurden mit Methotrexat berichtet. Sollten Sie Symptome wie blutigen Auswurf oder Husten beobachten, kontaktieren Sie unverzüglich Ihren Arzt oder Ihre Ärztin.
Wechselwirkungen mit anderen Arzneimitteln und Alkohol
Während der Anwendung von Methotrexat Accord sollten Sie möglichst keinen Alkohol trinken. Vermeiden Sie übermässigen Konsum koffein- oder theophyllin-haltiger Getränke (Kaffee, koffeinhaltige Kaltgetränke, schwarzer Tee).
Wechselwirkungen können insbesondere bei stickoxid-basiertem Narkosemittel (Lachgas) auftreten; sprechen Sie mit Ihrem Arzt bzw. Ihrer Ärztin, wenn bei Ihnen eine Operation ansteht.
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbstgekaufte) einnehmen oder äusserlich anwenden!
Darf Methotrexat Accord während einer Schwangerschaft oder in der Stillzeit eingenommen werden?
Schwangerschaft
Wenden Sie Methotrexat Accord während der Schwangerschaft oder wenn Sie versuchen, schwanger zu werden, nicht an. Methotrexat kann zu Geburtsfehlern führen, ungeborene Kinder schädigen oder Fehlgeburten auslösen. Es ist mit Fehlbildungen von Schädel, Gesicht, Herz und Blutgefässen, Gehirn und Gliedmassen verbunden. Daher ist es sehr wichtig, dass Methotrexat nicht an schwangere Patientinnen oder an Patientinnen, die planen schwanger zu werden, gegeben wird. Frauen im gebärfähigen Alter müssen jede Möglichkeit einer Schwangerschaft mit angemessenen Massnahmen (Schwangerschaftstest) ausschliessen, bevor mit der Behandlung begonnen wird.
Während der Behandlung mit Methotrexat und 6 Monate nach dem Ende der Behandlung müssen Sie eine Schwangerschaft vermeiden. Deshalb müssen Sie während dieses gesamten Zeitabschnitts eine zuverlässige Verhütung sicherstellen.
Falls Sie während der Behandlung schwanger werden oder vermuten, schwanger zu sein, sprechen Sie so bald wie möglich mit Ihrem Arzt/Ihrer Ärztin. Es sollte Ihnen eine Beratung über das Risiko schädigender Wirkungen der Behandlung auf das Kind angeboten werden. Wenn Sie schwanger werden möchten, sollten Sie vor dem geplanten Behandlungsbeginn Ihren Arzt/Ihre Ärztin aufsuchen, der/die Sie zur Beratung eventuell an einen Spezialisten überweisen wird.
Stillzeit
Stillen Sie nicht während der Behandlung, da Methotrexat in die Muttermilch übertritt. Sollte Ihr behandelnder Arzt/Ihre behandelnde Ärztin die Behandlung mit Methotrexat während der Stillzeit für unabdingbar halten, müssen Sie mit dem Stillen aufhören.
Fruchtbarkeit des Mannes
Die verfügbaren Fakten deuten nicht darauf hin, dass ein erhöhtes Risiko für Fehlbildungen oder Fehlgeburten besteht, wenn der Vater Methotrexat in einer Dosis von weniger als 30 mg/Woche erhält. Aber das Risiko kann nicht vollständig ausgeschlossen werden. Methotrexat kann erbgutschädigend sein und die Spermaproduktion beeinträchtigen, verbunden mit der Möglichkeit von Geburtsschäden. Während der Behandlung mit Methotrexat und 6 Monate nach der Behandlung sollten Sie die Zeugung von Kinder oder Samenspenden vermeiden.
Wie verwenden Sie Methotrexat Accord?
Wenden Sie Methotrexat Accord immer genau nach der Anweisung des Arztes bzw. der Ärztin an. Bitte fragen Sie bei Ihrem Arzt oder Apotheker, bzw. bei Ihrer Ärztin oder Apothekerin nach, wenn Sie sich nicht ganz sicher sind.
Der Arzt bzw. die Ärztin, der/die Ihnen Methotrexat Accord verschreibt, sollte mit diesem Arzneimittel und seiner Wirkweise vertraut sein.
Methotrexat Accord wird nur einmal wöchentlich angewendet. Es empfiehlt sich, einen für Sie besonders geeigneten Wochentag (Methotrexat Accord-Tag) für die Injektion zu wählen und diesen möglichst über die gesamte Therapiedauer beizubehalten.
Dosierung bei erwachsenen Patientinnen und Patienten mit rheumatoider Arthritis:
Die empfohlene Anfangsdosis beträgt 7,5 mg Methotrexat einmal wöchentlich als Einzelinjektion. Diese Dosis kann schrittweise um 2,5 mg/Woche erhöht werden bis ein optimales Ergebnis erreicht wird.
Eine Wochendosis von 25 mg sollte im Allgemeinen nicht überschritten werden.
Dosierung bei erwachsenen Patientinnen und Patienten mit Psoriasis vulgaris und Psoriasis arthropathica:
Eine Woche vor Therapiebeginn erhalten Sie möglicherweise eine Testdosis von 5-10 mg, um die Verträglichkeit zu überprüfen. Die empfohlene Anfangsdosis beträgt 7,5 mg Methotrexat einmal wöchentlich als Einzelinjektion. Die Dosis kann schrittweise erhöht werden, bis ein optimales Ergebnis erreicht wird.
Im Allgemeinen sollte eine maximale Wochendosis von 25 mg Methotrexat nicht überschritten werden. In Ausnahmefällen kann der Arzt bzw. die Ärztin eine Wochendosis von 30 mg verschreiben.
Dosierung bei erwachsenen Patienten mit Morbus Crohn
Die empfohlene Anfangsdosis beträgt 25 mg Methotrexat pro Woche. Es kann 8 bis 12 Wochen dauern bis ein Behandlungserfolg einsetzt. Während der Erhaltungsbehandlung werden in der Regel 15 mg Methotrexat pro Woche angewendet.
Patientinnen und Patienten mit eingeschränkter Nierenfunktion:
Patientinnen und Patienten mit leicht eingeschränkter Nierenfunktion (Kreatinin-Clearance 20-50 ml/min) sollten 50% der Normaldosis erhalten. Ist die Nierenfunktion stark eingeschränkt (Kreatinin-Clearance <20 ml/min), darf Methotrexat nicht angewendet werden.
Patientinnen und Patienten mit eingeschränkter Leberfunktion:
Patientinnen und Patienten mit eingeschränkter Leberfunktion sollten Methotrexat Accord nur mit Vorsicht anwenden. Sollte der Bilirubinwert >5 mg/dl betragen, darf Methotrexat nicht angewendet werden.
Anwendung bei älteren Patientinnen und Patienten:
Bei älteren Patientinnen und Patienten kann der Arzt bzw. die Ärztin eine Reduzierung der Dosis in Betracht ziehen.
Anwendung bei Kindern und Jugendlichen:
Die empfohlene Dosis beträgt 10-15 mg/m² Körperoberfläche (KOF) pro Woche. Bei nicht ausreichender Wirkung kann die wöchentliche Dosis auf bis zu 20 mg/m² KOF erhöht werden. Bei eingeschränkter Nierenfunktion (Kreatinin-Clearance <80 ml/min) ist die Behandlung mit Methotrexat Accord nicht angebracht.
Methotrexat Accord wird subkutan (in das Unterhautgewebe) injiziert.
Wenn Methotrexat versehentlich mit Ihrer oberen Hautschicht oder Schleimhäuten in Kontakt kommt, sollten Sie die betroffene Stelle sofort mit viel Wasser abwaschen.
Die Fertigspritzen sind nur zur einmaligen Anwendung. Jegliche nicht verbrauchte Lösung muss verworfen werden und ist zu entsorgen.
Wenn Sie vergessen haben, Methotrexat Accord anzuwenden, nehmen Sie keine doppelte Dosis, sondern fragen Sie unverzüglich Ihren Arzt bzw. Ihre Ärztin um Rat.
Wenn der Verdacht einer Überdosierung mit Methotrexat Accord besteht, informieren Sie bitte sofort Ihren Arzt bzw. Ärztin. Er wird über die notwendigen Behandlungsmassnahmen entsprechend der Schwere der Beschwerden entscheiden.
Ihr Arzt bzw. Ihre Ärztin entscheidet über die Dauer der Behandlung. Bei rheumatoider Arthritis kann mit einem Ansprechen auf die Behandlung ungefähr nach 4 bis 8 Wochen gerechnet werden. Sobald der gewünschte Behandlungserfolg erreicht ist, wird Ihr Arzt bzw. Ihre Ärztin die Dosis schrittweise auf die niedrigste wirksame Erhaltungsdosis reduzieren.
Bei Psoriasis vulgaris und Psoriasis arthropathica kann mit einem Ansprechen auf die Behandlung ungefähr nach 2 bis 6 Wochen gerechnet werden. Sobald der gewünschte Behandlungserfolg erreicht ist, wird Ihr Arzt bzw. Ihre Ärztin die Dosis schrittweise auf die niedrigste wirksame Erhaltungsdosis reduzieren.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Welche Nebenwirkungen kann Methotrexat Accord haben?
Das Auftreten und der Schweregrad der Nebenwirkungen hängt von der Dosierung und der Häufigkeit der Anwendung ab. Da auch bei niedriger Dosierung schwerwiegende Nebenwirkungen auftreten können, ist es unerlässlich, dass Ihr Arzt bzw. Ihre Ärztin Sie regelmässig in kurzen Zeitabständen überwacht.
Folgende Nebenwirkungen können bei der Anwendung von Methotrexat Accord auftreten:
Die häufigsten Nebenwirkungen sind Beeinträchtigungen des blutbildenden (hämatopoetischen) Systems und Magen-Darm-Beschwerden.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zu Grunde gelegt:
Sehr häufig: bei mehr als 1 von 10 Behandelten
Häufig: bei mehr als 1 von 100 Behandelten
Gelegentlich: bei mehr als 1 von 1'000 Behandelten
Selten: bei mehr als 1 von 10'000 Behandelten
Sehr selten: bei 1 oder weniger von 10'000 Behandelten einschliesslich Einzelfälle
Unbekannt: kann von den bisher vorhandenen Daten nicht geschätzt werden
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Entzündung des Mundes (Stomatitis), Verdauungsbeschwerden, Übelkeit, Appetitlosigkeit.
Häufig: Geschwüre im Mund- und Rachenraum, Durchfall.
Gelegentlich: Entzündung im Rachenbereich, Darmentzündung, Entzündung der Bauchspeicheldrüse, Erbrechen.
Selten: Geschwüre des Magen-Darm-Trakts.
Sehr selten: Bluterbrechen, starke Blutungen.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Hautausschlag (Exanthem), Hautrötung (Erythem), Juckreiz (Pruritus).
Gelegentlich: erhöhte Empfindlichkeit der Haut bei Sonneneinstrahlung (Photosensibilität), Haarausfall, Zunahme von Rheumaknoten, Gürtelrose (Herpes zoster), Entzündung der Blutgefässe (Vaskulitis), Herpesähnlicher Hautausschlag, juckender Hautausschlag (Urticaria).
Selten: verstärkte Pigmentierung der Haut.
Sehr selten: lebensbedrohliche allergische Hautreaktion, die von Fieber und Blasen begleitet werden kann (Stevens-Johnson-Syndrom), toxische epidermale Nekrolyse (blasige Ablösungen der Oberhaut, Lyell Syndrom), verstärkte Pigmentierung der Nägel, Nagelumlauf (akute Paronychie).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Selten: Überempfindlichkeitsreaktionen (allergische Reaktionen), allergischer (anaphylaktischer) Schock; allergisch bedingte Gefässentzündung (Vaskulitis), Fieber, rote Augen (Konjunktivitis), Infektionen, Blutvergiftung (Sepsis), eingeschränkte Wundheilung, Flüssigkeitsansammlung um die Lungen (Pleuraerguss), Flüssigkeitsansammlung zwischen den Herzbeutelblättern (Perikarderguss), Behinderung der Füllung der Herzkammern (Perikardtamponade), Verringerung der Antikörper im Blut (Hypogammaglobulinämie).
Bei intramuskulärer Anwendung kann es zu Nebenwirkungen an der Injektionsstelle (brennendes Gefühl) oder Gewebeschäden (sterile Abszessbildung, Untergang von Fettgewebe) kommen.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen, Müdigkeit, Benommenheit.
Gelegentlich: Schwindel, Verwirrtheit, Depression (starkes Gefühl von Traurigkeit).
Sehr selten: Sehstörungen, Schmerzen, Muskelschwäche oder Missempfindungen wie Kribbeln in Armen und Beinen, metallischer Geschmack im Mund, Krampfanfälle, Zeichen einer Hirnhautentzündung ohne Entzündung, Lähmung (Verlust der Muskelfunktion).
Unbekannt: Enzephalopathie / Leukenzephalopathie
Leber- und Gallenerkrankungen
Sehr häufig: Anstieg der Leberenzyme (Transaminasen).
Gelegentlich: Leberzirrhose (bindegewebige bzw. narbig-bindegewebige Umwandlung von Lebergewebe), Leberfibrose (Vernarbung), Leberverfettung.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Allergisch bedingte Entzündung des Lungengerüstes und der Lungenbläschen (interstitielle Pneumonitis/ Alveolitis). Erste Anzeichen sind: trockener Reizhusten, Kurzatmigkeit bis hin zur Luftnot und Fieber.
Selten: Lungenfibrose (Vernarbung), Lungenentzündung, die durch den Erreger Pneumocystis-carinii verursacht wird; Luftnot, Kurzatmigkeit bis hin zur Luftnot und Bronchialasthma.
Unbekannt: Blutung aus der Lunge.
Erkrankungen des Blutes und des Lymphsystems
Häufig: Störungen der Blutzellbildung mit einer krankhaften Verminderung der weissen und/oder roten Blutkörperchen und/oder der Blutplättchen (Leukopenie, Anämie, Thrombozytopenie).
Gelegentlich: starker Abfall aller Blutkörperchen und Blutplättchen (Panzytopenie).
Sehr selten: starker Abfall der weissen Blutzellen (Agranulocytose), schwere Knochenmarkdepression.
Erkrankungen der Nieren und Harnwege
Gelegentlich: Entzündungen und Geschwüre im Bereich von Harnblase, eingeschränkte Nierenfunktion, Blasenentleerungsstörungen.
Selten: Nierenversagen, verminderte oder stark verminderte Harnausscheidung, Elektrolytschwankungen.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gelegentlich: Entzündungen und Geschwüre im Bereich von Scheide.
Sehr selten: Verlust des sexuellen Interesses, Impotenz, Störungen der Entwicklung der Spermien (männliche Samenzellen) mit Verminderung der Spermienzahl, Störungen des weiblichen Zyklus und der Monatsblutung, Ausfluss.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Gelenkschmerzen, Muskelschmerzen, Verminderung der Knochenmasse (Osteoporose).
Gutartige, bösartige und nicht spezifizierte Neubildungen (einschl. Zysten und Polypen)
Sehr selten: In Einzelfällen wurde über das Auftreten von Lymphknotenvergrösserungen (Lymphomen) berichtet, die sich in einigen Fällen nach Absetzen der Therapie mit Methotrexat zurückgebildet haben. Ein vermehrtes Auftreten von Lymphomen unter einer Behandlung mit Methotrexat konnte bisher nicht bestätigt werden.
Wenn Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind, sollten Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin informieren.
Was ist ferner zu beachten?
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Methotrexat Accord bei Raumtemperatur unter 30 °C aufbewahren. Den Behälter im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Methotrexat Accord ist vor Kindern geschützt aufzubewahren.
Medizinisches Fachpersonal, das schwanger ist, sollte nicht mit Methotrexat Accord umgehen oder es verabreichen.
Methotrexat sollte nicht mit der Haut oder Schleimhäuten in Berührung kommen. Im Falle einer Kontamination müssen die betroffenen Areale sofort mit einer ausreichenden Menge Wasser abgespült werden.
Nur zur einmaligen Anwendung. Jegliche nicht verbrauchte Lösung ist zu verwerfen.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Methotrexat Accord enthalten?
1 ml Methotrexat Accord enthält als Wirkstoff 50 mg Methotrexat (als Methotrexat-Dinatrium) sowie als Hilfsstoffe Natriumchlorid, Natriumhydroxid und Wasser für Injektionszwecke.
Zulassungsnummer
66780 (Swissmedic)
Wo erhalten Sie Methotrexat Accord? Welche Packungen sind erhältlich?
In Apotheken gegen ärztliche Verschreibung, die nur zum einmaligen Bezug berechtigt.
Fertigspritzen mit integrierter s.c.-Injektionsnadel mit Nadelschutz zu 7,5 mg (0,15 ml), 10 mg (0,2 ml), 12.5 mg (0,25 ml),15 mg (0,3 ml), 17,5 mg (0,35 ml), 20 mg (0,4 ml), 22,5 mg (0,45 ml), 25 mg (0,5 ml), 27,5 mg (0,55 ml) und 30 mg (0,6 ml).
In jeder Arzneimittelpackung sind bereits Alkoholtupfer enthalten.
Erhältlich in Packungen zu 1 Fertigspritze.
Zur subkutanen Anwendung.
Zulassungsinhaberin
Accord Healthcare AG, 4103 Bottmingen
Diese Packungsbeilage wurde im Juli 2019 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Hinweise zur Anwendung
Lesen Sie die Anweisungen sorgfältig durch, bevor Sie mit der Injektion beginnen. Wenden Sie die Injektionstechnik immer genau so an, wie es Ihnen vom Arzt, Apotheker oder medizinischen Fachpersonal gezeigt worden ist.
Wenn Sie Fragen oder Probleme mit der Anwendung haben, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal.
Vorbereitung
Wählen Sie eine saubere, gut beleuchtete und glatte Arbeitsfläche.
Legen Sie vor der Anwendung die notwendigen Utensilien bereit:
- 1 Methotrexat Accord Fertigspritze
- 1 Alkoholtupfer
Waschen Sie sich sorgfältig die Hände. Prüfen Sie vor der Anwendung die Methotrexat Accord-Spritze auf sichtbare Beschädigungen (oder Risse).
Injektionsstelle
Für die Injektion eignen sich die folgenden Stellen am besten:
- oberer Bereich der Oberschenkel
- Bauch mit Ausnahme des Nabelbereichs.

Falls Ihnen eine andere Person bei der Injektion hilft, kann sie Ihnen die Injektion auch in die Rückseite eines Arms, direkt unterhalb der Schulter geben.
Wählen Sie für jede Injektion eine andere Injektionsstelle. So verringern Sie das Risiko, dass an der Injektionsstelle Reizungen auftreten.
Wählen Sie für die Injektion niemals Hautstellen, die empfindlich, blutunterlaufen, gerötet, verhärtet oder narbig sind oder Dehnungsstreifen aufweisen. Falls Sie an Psoriasis leiden, sollten Sie versuchen, möglichst nicht direkt in Hauterhebungen, verdickte, gerötete oder schuppige Hautpartien oder Verletzungsstellen zu injizieren.
Injizieren der Lösung
1. Nehmen Sie die Methotrexat-Fertigspritze aus der Verpackung und lesen Sie die Packungsbeilage sorgfältig durch. Die Fertigspritze muss bei Raumtemperatur aus der Verpackung genommen werden.
2. Desinfektion

Wählen Sie eine Injektionsstelle und säubern Sie diese mit einem mit Desinfektionsmittel getränkten Tupfer. Warten Sie mindestens 60 Sekunden, bis das Desinfektionsmittel getrocknet ist.
3. Entfernen Sie die Plastikschutzkappe.

Entfernen Sie vorsichtig die Plastikschutzkappe, indem Sie sie gerade von der Spritze abziehen. Wenn die Kappe sehr fest sitzt, entfernen Sie sie mit einer leicht drehenden Ziehbewegung. Wichtig: Niemals die Nadel der Fertigspritze berühren!
4. Einführen der Kanüle

Drücken Sie die Haut mit zwei Fingern zu einer Hautfalte zusammen und stechen Sie die Nadel in einem 90-Grad-Winkel schnell in die Haut ein.
5. Injektion


Führen Sie die Nadel vollständig in die Hautfalte ein. Drücken Sie den Kolben langsam herunter und injizieren Sie die Flüssigkeit unter die Haut. Halten Sie die Haut zusammengedrückt, bis die Injektion beendet ist.
6. Nadelschutz

Nachdem der Kolben vollständig heruntergedrückt ist, wird das Nadelschutzsystem aktiviert:
- Halten Sie die Spritze still und nehmen Sie Ihren Daumen langsam vom Kopfende des Kolbens;
- Der Kolben bewegt sich mit Ihrem Daumen nach oben und die Feder zieht die Nadel aus der Injektionsstelle zurück in den Nadelschutz.
Methotrexat darf nicht mit der Oberfläche der Haut oder der Schleimhaut in Berührung kommen. Falls dies doch geschehen sein sollte, muss der betroffene Bereich sofort mit reichlich Wasser gespült werden.
Falls Sie oder eine andere Person sich an der Nadel verletzt, wenden Sie sich unverzüglich an Ihren Arzt. Die betreffende Fertigspritze darf in dem Fall nicht verwendet werden.
Beseitigung und sonstige Handhabung
Bei der Handhabung und Entsorgung des Arzneimittels und der Fertigspritze müssen die geltenden nationalen Vorschriften beachtet werden. Mitarbeiterinnen des medizinischen Fachpersonals, die schwanger sind, dürfen Methotrexat Accord nicht handhaben und/oder verabreichen.
Qu'est-ce que Methotrexat Accord et quand doit-il être utilisé?
Le principe actif de Methotrexat Accord est le méthotrexate.
1 ml de solution injectable contient 50 mg de méthotrexate (sous la forme de méthotrexate disodique).
Le méthotrexate est un analogue de l'acide folique avec les propriétés suivantes:
- en tant qu'anti-métabolite il bloque la division des cellules qui se divisent rapidement,
- en tant qu'immunosuppresseur il inhibe, respectivement affaiblit, les réactions de défense indésirables de l'organisme,
- en tant qu'antiphlogistique il possède des propriétés anti-inflammatoires.
Methotrexat Accord est utilisé sur prescription médicale lors de:
- polyarthrite active chronique (arthrite rhumatoïde) chez l'adulte,
- formes poly-arthritiques de l'arthrite juvénile active sévère, en l'absence de réponse aux anti-inflammatoires non stéroïdiens (AINS),
- psoriasis vulgaire sévère, tenace et invalidant, en cas de réponse insuffisante à d'autres formes thérapeutiques telles que photothérapie, PUVA et rétinoïdes, ainsi qu'arthrite psoriasique sévère chez l'adulte,
- formes légères à modérées de la maladie de Crohn chez les patients adultes lorsqu'un traitement adéquat par d'autres médicaments n'est pas possible.
L'arthrite rhumatoïde est une maladie inflammatoire chronique du tissu conjonctif, caractérisée par une inflammation du tissu synovial (revêtement interne des articulations). Ce tissu sécrète un liquide qui sert de lubrifiant à de nombreuses articulations. L'inflammation du tissu synovial est responsable d'un épaississement de ce tissu et de la tuméfaction consécutive des articulations concernées.
L'arthrite juvénile touche les enfants et les adolescents en dessous de 16 ans. On parle de polyarthrite lorsque cinq articulations ou plus sont touchées au cours des six premiers mois de la maladie.
Le psoriasis vulgaire est une maladie chronique de la peau, qui se caractérise par l'apparition de placards squameux rougeâtres et blanchâtres.
Le psoriasis arthropathique se manifeste dans le cadre d'un psoriasis. Il se manifeste par des lésions psoriasiformes de la peau et des ongles. Ce sont essentiellement les articulations des doigts et des orteils qui sont concernées.
Methotrexat Accord interfère avec le processus évolutif de la maladie et ralentit ce dernier.
La maladie de Crohn est un type de maladie inflammatoire des intestins qui peut affecter n'importe quelle région du tractus gastro-intestinal et provoquer des symptômes tels que des douleurs abdominales, de la diarrhée, des vomissements ou une perte de poids.
Pour le traitement de la polyarthrite rhumatoïde, du psoriasis et de la maladie de Crohn, il faut absolument veiller à utiliser la dose recommandée 1x par semaine; si la dose recommandée est prise une fois par jour par inadvertance, cela peut entraîner des intoxications sévères dont l'évolution est parfois fatale.
Quand Methotrexat Accord ne doit-il pas être utilisé?
- lorsque vous êtes hypersensible (allergique) au méthotrexate ou à l'un des composants de Methotrexat Accord,
- lorsque vous souffrez d'affections hépatiques ou rénales (voir également le paragraphe «Comment utiliser Methotrexat Accord?»),
- lorsque vous souffrez de maladies du système hématopoïétique (formation du sang),
- lorsque vous consommez beaucoup d'alcool,
- lorsque vous souffrez d'infections graves, telles que notamment la tuberculose, le VIH ou autres syndromes de l'immunodéficience,
- lorsque vous avez des ulcères dans la région de la bouche, de l'estomac ou de l'intestin,
- lorsque vous êtes enceinte ou désirez l'être,
- lorsque vous allaitez,
- lorsque vous devez être vacciné simultanément avec des vaccins vivants (p.ex. rougeole, oreillons, rubéole, poliomyélite ou varicelle),
- après un certain type d'anesthésie (anesthésie au gaz hilarant).
Quelles sont les précautions à observer lors de l'utilisation de Methotrexat Accord?
Ce médicament peut affecter les réactions, l'aptitude à la conduite et l'aptitude à utiliser des outils ou des machines!
Certains types d'anesthésiants ont une influence sur l'effet du méthotrexate et peuvent entraîner des effets secondaires graves d'issue fatale. Informez votre médecin si vous deviez avoir besoin d'une opération sous anesthésie (anesthésie au gaz hilarant).
Mesures de précaution spéciales pour le traitement par Methotrexat Accord:
Le méthotrexate affecte temporairement la production du sperme et des ovules, ces effets étant réversibles dans la plupart des cas. Le méthotrexate peut provoquer des fausses couches et de graves malformations congénitales. Vous devez éviter de tomber enceinte si vous prenez du méthotrexate et pendant au moins six mois après l'arrêt du traitement.
Même lorsque Methotrexat Accord est utilisé à de faibles doses, des effets indésirables graves peuvent survenir. Afin de reconnaître ces effets à temps, des mesures de précaution doivent être prises et des contrôles réguliers doivent être effectués par le médecin après le début du traitement.
Contrôles de suivi et précautions recommandés:
Avant le début du traitement:
Des examens sanguins doivent être effectués afin de contrôler si vous avez suffisamment de globules sanguins, de procéder à des tests hépatiques en vue de contrôler les enzymes du foie, la bilirubine (métabolite des pigments du sang), la sérumalbumine (une protéine du sang) et la fonction rénale. Le médecin contrôlera également si vous souffrez de tuberculose ou d'hépatite et procédera à une radiographie du thorax.
Pendant le traitement:
Des contrôles sont effectués (au moins chaque mois pendant les six premiers mois et au moins trimestriellement par la suite):
- Recherche de modifications des muqueuses dans la cavité buccale et le pharynx.
- Examen sanguin.
- Contrôle de la fonction hépatique (foie) et des enzymes hépatiques dans le sérum. En cas d'une augmentation persistante des enzymes hépatiques, une réduction du dosage, voire l'interruption du traitement devront être envisagés. Pendant le traitement par méthotrexate, aucun autre médicament pouvant altérer les fonctions du foie ou le système hématopoïétique (formation du sang) ne doit être utilisé. Si un tel traitement s'avérait néanmoins nécessaire, des contrôles rapprochés devront être effectués. Vous ne devez pas consommer d'alcool pendant le traitement.
- Contrôle de la fonction rénale: Le méthotrexate étant éliminé par les reins, des effets graves au niveau rénal peuvent survenir si la fonction rénale est altérée (en particulier chez les patients âgés). Dans de tels cas, une surveillance médicale particulièrement vigilante est indiquée.
- Contrôle de la fonction respiratoire et le cas échéant test fonctionnel pulmonaire. En fonction du résultat de ce test, le traitement par méthotrexate devra éventuellement être suspendu.
Le méthotrexate peut avoir une influence sur votre système immunitaire ainsi que sur les résultats de vos vaccinations et tests immunologiques. Des infections chroniques inactives (notamment zona, tuberculose, hépatite B ou C) pourront notamment être réactivées. Vous ne devez pas être vacciné par des vaccins vivants pendant le traitement par Methotrexat Accord.
Des réactions inflammatoires de la peau (dermatite) ou un coup de soleil, provoqués par une irradiation, peuvent réapparaître au cours du traitement par le méthotrexate (réaction de réactivation). Des modifications de la peau causées par un psoriasis (lésions psoriasiques) peuvent s'aggraver lors d'une exposition aux rayons UV et de l'administration simultanée de méthotrexate.
Methotrexat Accord peut avoir comme effet secondaire une diarrhée. Dans ce cas, le traitement doit être interrompu. Veuillez contacter votre médecin si vous souffrez d'une diarrhée.
La tuméfaction des ganglions lymphatiques (lymphomes) peut rendre nécessaire l'arrêt du traitement. Si les lymphomes ne régressent pas spontanément, un traitement approprié devra être instauré.
Une encéphalopathie (modifications pathologiques du cerveau) / leucoencéphalopathie (modification pathologique de la substance blanche du cerveau) a été observée chez des patients cancéreux traités par le méthotrexate et ne peut pas être exclue lors d'un traitement par le méthotrexate pour d'autres maladies.
Chez les personnes âgées, la fonction rénale et/ou hépatique peut être diminuée et les réserves d'acide folique peuvent être réduites (voir paragraphe «Comment utiliser Methotrexat Accord?»). Si vous consommez régulièrement et concomitamment de l'alcool, ou si vous avez recours à d'autres médicaments pouvant altérer la fonction hépatique ou la formule sanguine (notamment le léflunomide), le risque de toxicité hépatique sera accru sous méthotrexate. Dans de tels cas, vous devez être soumis à des contrôles médicaux vigilants. Ceci est également à prendre en considération si vous utilisez en même temps à des médicaments hématotoxiques (qui altèrent la formation du sang) (p.ex. le léflunomide). Lorsque le léflunomide et le méthotrexate sont associés, le risque d'apparition d'une pancytopénie (réduction du nombre de cellules sanguines et des plaquettes) et d'une hépatotoxicité (altération du foie) est accru.
Les antibiotiques tels que la pénicilline, les glycopeptides, les sulfonamides, la ciprofloxacine et la céfalotine, peuvent dans des cas isolés réduire l'excrétion rénale du méthotrexate. Ceci a pour conséquence une augmentation des concentrations sanguines du méthotrexate et peut conduire à une toxicité hématologique (concernant la formation du sang) et gastro-intestinale (concentrant l'estomac et l'intestin).
Le probénécide et les acides organiques faibles tels que les diurétiques de l'anse et les pyrazolés (phénylbutazone) peuvent augmenter les concentrations sanguines du méthotrexate. Les anti-inflammatoires non stéroïdiens (AINS) et l'acide salicylique peuvent augmenter le risque d'une insuffisance rénale.
Si vous prenez des médicaments qui réduisent l'excrétion du méthotrexate, qui sont responsables d'une insuffisance rénale, ou qui réduisent potentiellement la formation du sang, vous serez soumis à des contrôles médicaux plus stricts.
Si vous prenez en même temps des médicaments ayant des effets secondaires possibles sur la moelle épinière (p.ex. sulfonamides, triméthoprime-sulfaméthoxazole, chloramphénicol, pyriméthamine), on peut observer une perturbation accrue de la formation sanguine.
Si vous prenez des médicaments responsables d'une carence en folate (p. ex sulfonamides, triméthoprime-sulfaméthoxazole), la toxicité du méthotrexate pourra être augmentée. Il faut donc être particulièrement vigilant s'il existe chez vous une carence connue en acide folique. Votre médecin décidera alors de la nécessité d'une administration supplémentaire d'acide folique.
Une toxicité accrue du méthotrexate n'est pas attendue lors de l'administration de Methotrexat Accord avec d'autres traitements de fond antirhumatismaux (p.ex. sels d'or, pénicillamine, hydroxychloroquine, sulfasalazine, azathioprine, cyclosporine). L'association du méthotrexate et de la sulfasalazine peut conduire au renforcement de l'action du méthotrexate. Dès lors que le méthotrexate et la sulfasalazine sont des inhibiteurs de la synthèse de l'acide folique des effets secondaires peuvent survenir. Ceci n'a toutefois été décrit que rarement jusqu'ici.
Si des inhibiteurs de la pompe à protons sont administrés concomitamment, on peut observer des interactions médicamenteuses. Lorsque l'inhibiteur de la pompe à protons oméprazole est administré, l'élimination rénale du méthotrexate peut être retardée. En association avec le pantoprazole, c'est l'élimination du métabolite 7-hydroxyméthotrexate qui est retardée, ce qui a conduit dans un cas à des myalgies (douleurs musculaires et malaise) et à des frissons.
Des saignements aigus des poumons chez des patients atteints d'une maladie rhumatismale sous-jacente ont été rapportés avec le méthotrexate. Contactez immédiatement votre médecin si vous observez des symptômes tels que des expectorations sanguinolentes ou une toux avec expectorations de sang.
Interactions avec d'autres médicaments et avec l'alcool
Pendant votre traitement par Methotrexat Accord, il faut dans la mesure du possible ne pas boire d'alcool. Evitez la consommation excessive de boissons riches en caféine ou en théophylline (café, boissons fraîches contenant de la caféine, thé).
Des interactions peuvent particulièrement exister avec les anesthésiants à l'oxyde azoteux (gaz hilarant). Si une opération est prévue, parlez-en à votre médecin.
Veuillez informer votre médecin ou votre pharmacien si:
- vous souffrez d'une autre maladie,
- vous êtes allergique,
- vous prenez déjà d'autres médicaments en usage interne ou externe (même en automédication)!
Methotrexat Accord peut-il être utilisé pendant la grossesse ou l'allaitement?
Grossesse
N'utilisez pas Methotrexat Accord pendant la grossesse ou si vous essayez de tomber enceinte. Le méthotrexate peut provoquer des malformations congénitales, avoir des effets nocifs sur l'enfant à naître ou provoquer des fausses couches. Il est associé à des malformations du crâne, du visage, du cœur et des vaisseaux sanguins, du cerveau et des membres. Il est dès lors très important de ne pas administrer de méthotrexate aux patientes enceintes ou à celles qui envisagent de le devenir. Chez les femmes en âge de procréer, toute possibilité de grossesse doit être exclue en prenant des mesures appropriées (test de grossesse) avant le début du traitement.
Vous devez éviter de tomber enceinte pendant la prise de méthotrexate et pendant au moins 6 mois après l'arrêt du traitement en utilisant une contraception fiable durant toute cette période.
Si vous tombez enceinte au cours du traitement ou si vous pensez l'être, consultez votre médecin dès que possible. Une information médicale sur les risques d'effets nocifs du traitement sur l'enfant doit vous être fournie. Si vous souhaitez tomber enceinte, vous devez consulter votre médecin, qui pourra vous adresser à un spécialiste avant le début planifié du traitement.
Allaitement
N'allaitez pas pendant le traitement, car le méthotrexate passe dans le lait maternel. Si votre médecin considère qu'un traitement par le méthotrexate est absolument nécessaire pendant la période d'allaitement, vous devez arrêter d'allaiter.
Fertilité masculine
Les éléments de preuve disponibles n'indiquent pas une augmentation du risque de malformations ou de fausse couche si le père prend du méthotrexate à une dose inférieure à 30 mg/semaine. Il n'est néanmoins pas possible d'exclure totalement ce risque. Le méthotrexate peut être génotoxique et peut affecter la production des spermatozoïdes avec la possibilité de provoquer des anomalies congénitales. Vous devez éviter de concevoir un enfant ou de donner du sperme pendant le traitement par le méthotrexate et pendant 6 mois après l'arrêt du traitement.
Comment utiliser Methotrexat Accord?
Veuillez vous conformer exactement aux indications de votre médecin lors de l'utilisation de Methotrexat Accord. Veuillez vous adresser à votre médecin ou à votre pharmacien en cas doute.
Le médecin qui vous prescrit Methotrexat Accord doit être familiarisé avec l'activité du médicament et avec ses effets secondaires.
Methotrexat Accord n'est utilisé qu'une fois par semaine. Il est recommandé de réserver un jour spécifique et approprié pour l'injection (jour Methotrexat Accord) et de maintenir ce même jour si possible pendant toute la durée du traitement.
Posologie chez l'adulte avec une arthrite rhumatoïde:
La dose initiale recommandée est de 7,5 mg de méthotrexate une fois par semaine en une seule injection Cette dose peut être augmentée par paliers de 2,5 mg/semaine, jusqu'à l'obtention d'un résultat optimal. De manière générale, ne pas dépasser une dose hebdomadaire de 25 mg.
Posologie chez les patients avec un psoriasis vulgaire et un psoriasis arthropathique:
Une semaine avant le début du traitement vous allez recevoir une dose test de 5-10 mg, afin d'éprouver votre tolérance. La dose initiale recommandée est de 7,5 mg de méthotrexate une fois par semaine en une seule injection. Cette dose peut être augmentée progressivement jusqu'à l'obtention d'un résultat optimal. Toutefois, une dose maximale de 25 mg de méthotrexate par une semaine ne devrait pas être dépassée. Dans des cas exceptionnels, le médecin peut prescrire une dose hebdomadaire de 30 mg.
Posologie chez les patients adultes atteints d'une maladie de Crohn:
La dose initiale recommandée est de 25 mg de méthotrexate une fois par semaine. Une période de 8 à 12 semaines peut s'écouler avant d'observer une réponse indiquant le succès du traitement. Pendant le traitement d'entretien, la dose généralement utilisée est de 15 mg de méthotrexate une fois par semaine.
Patients avec une insuffisance rénale:
Les patients avec une légère insuffisance rénale (clairance de la créatinine de 20-50 ml/min) devraient recevoir 50% de la dose normale. Lors d'insuffisance rénale grave (clairance de la créatinine <20 ml/min), le méthotrexate ne doit pas être utilisé.
Patients avec une insuffisance hépatique:
Les patients avec une insuffisance hépatique ne doivent utiliser Methotrexat Accord qu'avec la plus grande prudence. Si le taux de bilirubine est >5 mg/dl, le méthotrexate ne doit pas être utilisé.
Utilisation chez le patient âgé:
Chez les patients âgés, le médecin peut envisager une réduction du dosage.
Utilisation chez les enfants et les adolescents:
La dose recommandée est de 10-15 mg/m² de surface corporelle par semaine. Lors d'inefficacité du traitement, la dose peut être augmentée jusqu'à 20 mg/m² de surface corporelle. Avec une insuffisance rénale (clairance de la créatinine <80 ml/min), Methotrexat Accord ne doit pas être utilisé.
Methotrexat Accord est injecté par voie sous-cutanée (dans le tissu sous-cutané).
Lorsque le méthotrexate entre accidentellement en contact avec votre peau ou avec vos muqueuses, les zones concernées seront immédiatement lavées à grande eau.
Les seringues prêtes à l'emploi sont destinées à un usage unique. Toute solution entamée sera jetée.
Lorsque vous avez oublié d'utiliser Methotrexat Accord, ne doublez pas la dose, mais demandez conseil à votre médecin sans délai.
Lorsqu'il existe un doute de surdosage avec Methotrexat Accord, veuillez en informer immédiatement votre médecin. En fonction de la gravité de vos symptômes, il décidera des mesures nécessaires.
Votre médecin décide de la durée de votre traitement. Lors d'arthrite rhumatoïde, la réponse au traitement pourra prendre environ 4 à 8 semaines. Dès que l'efficacité thérapeutique est atteinte, votre médecin réduira votre traitement progressivement à la dose d'entretien minimale efficace.
Lors de psoriasis vulgaire et de psoriasis arthropathique, il faudra compter avec une réponse au traitement après un délai d'environ 2 à 6 semaines. Dès que l'efficacité thérapeutique est atteinte, votre médecin réduira votre traitement progressivement à la dose d'entretien minimale efficace.
Ne changez pas le dosage prescrit de votre propre chef. Adressez-vous à votre médecin ou à votre pharmacien lorsque vous estimez que l'efficacité de votre médicament est trop faible ou au contraire trop forte.
Quels effets secondaires Methotrexat Accord peut-il provoquer?
La survenue et la gravité des effets secondaires dépendent du dosage et de la fréquence d'utilisation. Des effets secondaires graves peuvent survenir même lors de dosages faibles, il est donc indispensable que votre médecin procède chez vous à des contrôles réguliers à intervalles rapprochés.
L'utilisation de Methotrexat Accord peut provoquer les effets secondaires suivants:
Les effets secondaires apparaissant le plus fréquemment sont des troubles de système sanguin (ou système hématopoïétique) et des troubles gastro-intestinaux.
Lors de l'évaluation des effets secondaires, les paramètres de fréquence suivants sont utilisés:
Très fréquents: chez plus de 1 sur 10 patients traités
Fréquents: chez plus de 1 sur 100 patients traités
Occasionnels: chez plus de 1 sur 1'000 patients traités
Rares: chez plus de 1 sur 10'000 patients traités
Très rares: chez 1 ou moins sur 10'000 patients traités y compris cas isolés
Fréquence inconnue: ne peut être estimée sur la base des données disponibles.
Affections gastro-intestinales
Très fréquents: inflammation de la bouche (stomatite), troubles digestifs, nausées, perte d'appétit.
Fréquents: ulcères dans la région de la bouche et du pharynx, diarrhées.
Occasionnels: inflammation dans le région pharyngée, inflammation intestinale, pancréatite, vomissements.
Rares: ulcères du tractus gastro-intestinal.
Très rares: vomissements de sang (hématémèse), saignements importants.
Affections de la peau et du tissu sous-cutané
Fréquents: éruption cutanée (exanthème), rougeur de la peau (érythème), démangeaisons (prurit).
Occasionnels: sensibilité accrue de la peau à l'exposition solaire (photosensibilité), chute de cheveux, augmentation des nodules rhumatismaux, zona (herpes zoster), inflammation des vaisseaux sanguins (vascularite), éruption cutanée herpétiforme, éruption cutanée prurigineuse (urticaire).
Rares: pigmentation accrue de la peau.
Très rares: réaction cutanée allergique à risque létal, accompagnée de fièvre et de vésicules (syndrome de Stevens-Johnson), nécrolyse épidermique toxique (décollement bulleux de l'épiderme, syndrome de Lyell), pigmentation accrue des ongles, panaris (paronychie aiguë).
Troubles généraux et anomalies au site d'administration
Rares: réactions d'hypersensibilité (réactions allergiques), choc allergique (anaphylactique), inflammation vasculaire de type allergique (vascularite), fière, yeux rouges (conjonctivite), infections, infection du sang (septicémie), guérison retardée des plaies, accumulation de liquide autour des poumons (épanchement pleural), accumulation de liquide entre les feuillets du coeur (épanchement péricardique), entrave au remplissage des chambres cardiaques (tamponnade péricardique), diminution des anticorps dans le sang (hypogammaglobulinémie).
Lors d'injection intramusculaire, il est possible d'observer des effets indésirables au niveau du site d'injection (sensation de brûlure) ou des troubles tissulaires (formation d'abcès stériles, atrophie du tissu graisseux).
Affections du système nerveux
Fréquents: maux de tête, fatigue, somnolence.
Occasionnels: vertiges, confusion, dépression (fort sentiment de tristesse).
Très rares: troubles de la vue, douleurs, faiblesse musculaire ou sensation de fourmillement dans les bras et les jambes, goût métallique dans la bouche, crampes, signes de méningite sans inflammation, paralysie (perte de la fonction musculaire).
Fréquence inconnue: encéphalopathie / leucoencéphalopathie
Affections hépatobiliaires
Très fréquents: augmentation du taux sanguin des enzymes hépatiques (transaminases).
Occasionnels: cirrhose du foie (dégénération conjonctive, respectivement fibreuse du tissu du foie), fibrose hépatique (transformation cicatricielle), dégénérescence graisseuse du foie.
Affections respiratoires, thoraciques et médiastinales
Fréquents: inflammation de type allergique du squelette et des alvéoles (pneumonie interstitielle/alvéolite). Les premiers signes sont: une toux sèche irritative, un essoufflement (dyspnée) jusqu'à l'étouffement et de la fièvre.
Rares: fibrose pulmonaire (transformation cicatricielle des poumons), inflammation pulmonaire causée par des agents infectieux tels que Pneumocystis-Carinii, dyspnée, essoufflement (dyspnée) jusqu'à l'étouffement et asthme bronchique.
Inconnue: saignement des poumons.
Affections hématologiques et du système lymphatique
Fréquents: altération de la formation des cellules sanguines avec une diminution pathologique des globules blancs et/ou rouges et/ou des plaquettes sanguines (leucopénie, anémie, thrombocytopénie).
Occasionnels: chute massive des globules et des plaquettes sanguines (pancytopénie).
Très rares: chute massive des globules blancs (agranulocytose), insuffisance médullaire grave.
Affections du rein et des voies urinaires
Occasionnels: Inflammations et ulcères dans la région vésicale, insuffisance rénale, troubles mictionnels.
Rares: Insuffisance rénale, diminution ou réduction massive de l'excrétion urinaire, troubles électrolytiques.
Affections des organes de reproduction et du sein
Occasionnels: Inflammations et ulcères dans la région vaginale.
Très rares: perte de l'appétit sexuel, impuissance, troubles de la formation du sperme (cellules germinales masculines), troubles du cycle menstruel et des règles, écoulement vaginal.
Affections musculosquelettiques et du tissu conjonctif
Occasionnels: douleurs articulaires, douleurs musculaires, diminution de la masse osseuse (ostéoporose).
Tumeurs bénignes, malignes et non précisées (incl kystes et polypes)
Très rares: dans de rares cas, une tuméfaction des ganglions lymphatiques a été signalée (lymphomes). Cette tuméfaction a régressé spontanément après l'arrêt du traitement par méthotrexate dans quelques cas. Une augmentation des lymphomes sous méthotrexate n'a à l'heure actuelle pas été confirmée.
Si vous observez des effets secondaires qui ne sont pas décrits ici, veuillez en informer votre médecin ou votre pharmacien.
A quoi faut-il encore faire attention?
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Methotrexat Accord doit être conservé à température ambiante (à moins de 30 °C). Conserver le produit dans son emballage d'origine à l'abri de la lumière.
Methotrexat Accord est à conserver hors de la portée des enfants.
Les femmes enceintes du personnel médical ne doivent ni manipuler ni administrer Methotrexat Accord.
Le méthotrexate ne doit pas entrer en contact avec votre peau ou vos muqueuses. En cas de contamination, les zones concernées seront immédiatement lavées à grande eau.
Médicament à usage unique. Toute solution entamée sera jetée.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien qui dispose d'une information détaillée destinée aux professionnels.
Que contient Methotrexat Accord?
1 ml de Methotrexat Accord contient 50 mg de principe actif méthotrexate (sous la forme de méthotrexate disodique) ainsi que les excipients chlorure de sodium, hydroxyde de sodium et de l'eau pour préparations injectables.
Numéro d'autorisation
66780 (Swissmedic)
Où obtenez-vous Methotrexat Accord? Quels sont les emballages à disposition sur le marché?
En pharmacie, seulement sur ordonnance médicale non renouvelable.
Seringues prêtes à l'emploi avec aiguille d'injection s.c. intégrée avec système de sécurité de protection de l'aiguille, à 7,5 mg (0,15 ml), 10 mg (0,2 ml), 12.5 mg (0,25 ml),15 mg (0,3 ml), 17,5 mg (0,35 ml), 20 mg (0,4 ml), 22,5 mg (0,45 ml), 25 mg (0,5 ml), 27,5 mg (0,55 ml) et 30 mg (0,6 ml).
Chaque boîte contient déjà des tampons imprégnés d'alcool.
Disponible dans des emballages à 1 seringue prête à l'emploi.
À usage sous-cutané.
Titulaire de l'autorisation
Accord Healthcare AG, 4103 Bottmingen.
Cette notice d'emballage a été vérifiée pour la dernière fois en juillet 2019 par l'autorité de contrôle des médicaments (Swissmedic).
Remarques concertant l'utilisation
Lisez attentivement les instructions avant de commencer l'injection. Utilisez toujours exactement la technique d'injection que votre médecin, votre pharmacien ou le personnel médical vous a montrée.
Si vous avez des problèmes ou des questions concernant l'utilisation, adressez-vous à votre médecin, votre pharmacien ou au personnel médical.
Préparation
Choisissez un plan de travail plat, propre et bien éclairé.
Préparez avant l'utilisation les ustensiles nécessaires:
- 1 seringue prête à l'emploi de Methotrexat Accord
- 1 tampon imbibé d'alcool
Lavez-vous soigneusement les mains. Avant l'utilisation, vérifiez que la seringue de Methotrexat Accord ne présente pas de dommages visibles (ou de fissures).
Site d'injection
Les sites d'injection les plus appropriés sont les suivants:
- la partie supérieure des cuisses,
- le ventre, à l'exception de la région autour du nombril.

Si une autre personne vous aide à faire l'injection, celle-ci peut également effectuer l'injection sur la face arrière d'un bras, juste en dessous de l'épaule.
Changez de site lors de chaque injection. Vous réduisez ainsi le risque de survenue d'irritations au niveau du site d'injection.
Ne choisissez jamais des endroits de la peau présentant une sensibilité, une ecchymose, une rougeur, une induration, une cicatrice ou des vergetures. Si vous souffrez de psoriasis, vous devez essayer, dans la mesure du possible, de ne pas réaliser l'injection directement dans des lésions cutanées surélevées, épaisses, rouges ou squameuses ou des blessures.
Injection de la solution
1. Sortez la seringue prête à l'emploi de méthotrexate de son emballage et lisez attentivement la notice d'emballage. La seringue prête à l'emploi doit être
sortie de l'emballage à température ambiante.
2. Désinfection

Choisissez un site d'injection et désinfectez-le avec un tampon imbibé de désinfectant. Attendez au moins 60 secondes jusqu'à ce que le désinfectant soit sec.
3. Retirer le capuchon protecteur en plastique

Retirez avec précaution le capuchon protecteur en plastique de la seringue en tirant droit. Si le capuchon est très solidement fixé, tournez-le légèrement tout en tirant. Important: ne touchez jamais l'aiguille de la seringue prête à l'emploi!
4. Insertion de l'aiguille

Pincez la peau entre deux doigts pour former un pli cutané et d'un mouvement rapide, piquez l'aiguille dans la peau suivant un angle de 90 degrés.
5. Injection


Insérez complètement l'aiguille dans le pli de la peau. Appuyez lentement sur le piston et injectez le liquide sous la peau. Pincez la peau jusqu'à ce que l'injection soit terminée.
6. Système de sécurité de protection de l'aiguille

Lorsque le piston de la seringue est complètement enfoncé, le système de protection de l'aiguille s'active:
- Tenez la seringue immobile et retirez lentement le pouce de la tête du piston.
- Le piston remonte avec le pouce et le ressort ôter automatiquement l'aiguille du site d'injection pour la placer dans le système de sécurité.
Le méthotrexate ne doit pas entrer en contact avec la surface de la peau ou les muqueuses. En cas de contact, rincer abondamment à l'eau la zone concernée.
Si vous-même ou une autre personne vous blessez avec l'aiguille, consultez immédiatement votre médecin. Cette seringue prête à l'emploi ne doit pas être utilisée dans ce cas.
Élimination et autre manipulation
Les prescriptions nationales en vigueur doivent être respectées lors de la manipulation et de l'élimination du médicament et de la seringue prête à l'emploi.
Les femmes enceintes appartenant au personnel médical ne doivent pas manipuler et/ou administrer Methotrexat Accord.
Che cos'è Methotrexat Accord e quando si usa?
La componente farmacologicamente attiva del Methotrexat Accord è il metotressato.
1 ml di soluzione iniettabile contiene 50 mg di metotressato (sotto forma di sale disodico del metotressato).
Il principio attivo metotressato è un analogo dell'acido folico con le seguenti caratteristiche:
- è un antimetabolita che inibisce la moltiplicazione delle cellule che si dividono rapidamente,
- è un immunosoppressore che sopprime oppure indebolisce le reazioni di difesa indesiderate proprie dell'organismo,
- è un antiflogistico con attività antiinfiammatoria.
Il Methotrexat Accord si usa su prescrizione medica in caso di:
- poliartrite cronica attiva (artrite reumatoide) negli adulti,
- forme poliartritiche dell'artrite giovanile attiva grave con risposta carente agli antireumatici non steroidei (FANS),
- psoriasi volgare grave, tenace e invalidante, che non risponde sufficientemente ad altre forme di terapia come fototerapia, PUVA e retinoidi, e psoriasi artropatica grave negli adulti,
- morbo di Crohn di gravità da lieve a moderata in pazienti adulti, quando non è possibile un trattamento appropriato con altri medicamenti.
L'artrite reumatoide è una malattia cronica del tessuto connettivo, caratterizzata da infiammazione del tessuto sinoviale (rivestimento delle articolazioni). Questo tessuto produce un liquido che agisce da lubrificante per molte articolazioni. L'infiammazione del tessuto sinoviale dà origine ad un ispessimento di questo rivestimento e al rigonfiamento dell'articolazione.
L'artrite giovanile colpisce bambini ed adolescenti di età inferiore ai 16 anni. Si parla di forme poliartritiche quando sono interessate cinque o più articolazioni nei primi sei mesi della malattia.
La psoriasi volgare è una malattia cronica della cute che si manifesta con la comparsa di desquamazioni cutanee rosse e bianche.
L'artrite psoriasica compare nel contesto di una psoriasi. Si distingue per la presenza di lesioni psoriasiche della cute e delle unghie. Sono colpite in particolare le articolazioni delle dita delle mani e dei piedi.
Il Methotrexat Accord interviene nel processo patologico e rallenta la progressione della malattia.
Il morbo di Crohn è una determinata forma di malattia infiammatoria intestinale, che riguarda tutti i settori del tratto gastrointestinale e che può determinare sintomi come dolori addominali, diarrea, vomito o perdita di peso.
Occorre assolutamente accertarsi che nella terapia della artrite reumatoide, della psoriasi e del morbo di Crohn la dose raccomandata sia somministrata una volta alla settimana, poiché la somministrazione giornaliera accidentale della dose raccomandata può determinare gravi intossicazioni, talora con esito letale.
Quando non si può usare il Methotrexat Accord?
- se è presente un'ipersensibilità (allergia) contro il metotressato oppure contro una delle altre componenti di Methotrexat Accord,
- se si soffre di una malattia epatica o renale (veda anche la sezione: «Come usare il Methotrexat Accord?»),
- se si soffre di malattie del sistema di formazione del sangue,
- se si beve molto alcool,
- se si soffre di gravi infezioni come per esempio tubercolosi, HIV o altre sindromi di immunodeficienza,
- se si soffre di ulcere del cavo orale o del tratto gastrointestinale,
- se si è incinta o se si desidera una gravidanza,
- se si sta allattando,
- se contemporaneamente si deve ricevere una vaccinazione con un vaccino vivo (per esempio: morbillo, parotite, rosolia, poliomielite, varicella),
- dopo un certo tipo di anestesia (anestesia con gas esilarante).
Quando è richiesta prudenza nell'uso di Methotrexat Accord?
Questo medicamento può ridurre la capacità di reazione, la capacità di condurre un veicolo e la capacità di utilizzare attrezzi o macchine!
Sia particolarmente prudente con l'assunzione di Methotrexat Accord e informi immediatamente il Suo medico qualora debba sottoporsi a un intervento chirurgico in anestesia (anestesia con gas esilarante).
Misure precauzionali particolari per il trattamento con Methotrexat Accord:
Il metotrexato influisce temporaneamente sulla produzione dello sperma e degli ovuli, effetto che nella maggior parte dei casi è reversibile. Il metotrexato può causare aborto spontaneo e gravi difetti alla nascita. Durante il trattamento con metotrexato e per almeno sei mesi dopo la fine del trattamento deve evitare una gravidanza. Durante il trattamento con Methotrexat Accord, ed e anche per un certo periodo dopo il suo completamento, la fertilità sia maschile sia femminile può essere compromessa; ciò può comportare nelle donne la comparsa di disturbi del ciclo mestruale o l'assenza totale di mestruazioni (fare riferimento anche al paragrafo «Si può usare Methotrexat Accord durante la gravidanza o l'allattamento?»).
Anche con l'uso del Methotrexat Accord a basse dosi possono comparire gravi effetti collaterali. Per riconoscerli tempestivamente occorre mettere in atto delle misure precauzionali ed eseguire regolarmente delle visite mediche di controllo.
Controlli clinici raccomandati e misure precauzionali:
Prima di iniziare il trattamento:
Vengono eseguiti esami del sangue per verificare che il livello dei globuli rossi sia sufficientemente alto, test per il controllo degli enzimi epatici, della bilirubina (prodotto di degradazione dell'emoglobina), dell'albumina sierica (una proteina del sangue), e della funzione renale. Il suo medico controllerà anche se soffre di tubercolosi o epatite e farà eseguire una radiografia del torace.
Durante il trattamento:
Vengono eseguiti degli esami (durante i primi sei mesi almeno una volta al mese, successivamente almeno ogni tre mesi):
- Controllo del cavo orale e della faringe per alterazioni delle mucose
- Esami del sangue
- Controllo della funzione epatica e degli enzimi epatici nel siero. Nel caso d'incremento progressivo degli enzimi epatici, occorre prendere in considerazione una riduzione del dosaggio o una sospensione della terapia. Durante il trattamento con metotressato non deve assumere altri medicamenti che possono danneggiare il fegato o il sistema di formazione del sangue. Se l'assunzione è indispensabile, i controlli devono avvenire ad intervalli più ravvicinati. Non deve bere alcolici.
- Controllo della funzione renale: Il metotressato viene escreto attraverso i reni, pertanto possono comparire gravi effetti collaterali se i suoi reni non funzionano bene (in particolare nelle persone anziane). In questo caso occorre una sorveglianza più accurata da parte del medico.
- Controllo del sistema respiratorio e, se necessario, test di funzionalità respiratoria: In base ai risultati del test, può rendersi necessaria la sospensione del metotressato.
Il metotressato può interferire con il sistema immunitario, con i risultati delle vaccinazioni e con i risultati dei test immunologici. Eventuali infezioni croniche inattive (per esempio herpes zoster (fuoco di S. Antonio), tubercolosi, epatite B o C) possono riattivarsi. Durante il trattamento con Methotrexat Accord non deve sottoporsi a vaccinazioni con vaccini vivi.
Reazioni infiammatorie della pelle (dermatiti) o scottature solari, causate da irradiazione, possono manifestarsi nuovamente durante la terapia con metotressato (recall reaction). Le alterazioni cutanee dovute alla psoriasi (lesioni psoriasiche) possono aggravarsi in seguito all'irradiazione con raggi UV e con una somministrazione concomitante di metotressato.
Uno degli effetti collaterali di Methotrexat Accord può essere la diarrea. In questo caso il trattamento va interrotto. Consulti il suo medico se soffre di diarrea.
La comparsa di linfonodi ingrossati (linfomi) può rendere necessaria la sospensione della terapia. Se i linfomi non dovessero andare incontro a regressione spontanea occorre iniziare una terapia specifica.
In pazienti affetti da tumori maligni, che sono stati trattati con metotressato, sono state osservate encefalopatia (alterazione patologica del cervello) / leucoencefalopatia (alterazione patologica della sostanza bianca del cervello) che non possono essere escluse anche per altre malattie trattate con metotressato.
Nelle persone anziane può essere presente una riduzione della funzione epatica e renale e le riserve di acido folico possono essere scarse (veda sezione «Come usare il Methotrexat Accord?»). Se contemporaneamente beve regolarmente alcolici o se assume altri medicamenti che danneggiano il fegato o alterano la composizione del sangue (per esempio la leflunomide), sussiste un rischio elevato che il metotressato danneggi il fegato. In questi casi occorre un'accurata sorveglianza. Lo stesso vale anche quando assume contemporaneamente dei medicamenti ematotossici (che danneggiano la formazione del sangue, come la leflunomide).
Quando si associa la leflunomide con il metotressato, può comparire, con maggiore frequenza, una pancitopenia (diminuzione del numero dei globuli e delle piastrine) oppure un'epatotossicità (danneggiamento del fegato).
Antibiotici come per esempio penicilline, glicopeptidi, sulfamidici, ciprofloxacina e cefalotina possono, in casi isolati, causare una diminuzione dell'escrezione renale del metotressato e portare ad un aumento della concentrazione di metotressato nel sangue, con conseguente tossicità ematologica (riguardante la formazione del sangue) e gastrointestinale.
Anche il probenecid e gli acidi organici deboli come i diuretici dell'ansa ed i pirazoli (fenilbutazone) possono incrementare il livello ematico del metotressato. Gli antinfiammatori non steroidei oppure i salicilati possono aumentare il rischio di una riduzione della funzione renale.
Se assume dei medicamenti che diminuiscono l'escrezione del metotressato, che causano danno renale o che potenzialmente danneggiano la formazione del sangue, sarà sottoposto a controlli più frequenti.
Se contemporaneamente assume medicamenti che hanno possibili effetti collaterali sul midollo osseo (per esempio sulfamidici, trimetoprim-sulfametossazolo, cloramfenicolo, pirimetamina) si può verificare una più marcata alterazione della formazione del sangue.
Se assume medicamenti che danno origine ad una carenza di acido folico (per esempio sulfamidici, trimetoprim-sulfametossazolo), la tossicità del metotressato può essere maggiore. Pertanto, è richiesta maggiore prudenza se le è già stata riscontrata una carenza di acido folico. Il suo medico deciderà sull'opportunità di una supplementazione con acido folico.
Non bisogna attendersi un aumento dell'attività tossica del metotressato, quando il Methotrexat Accord viene somministrato insieme ad altri farmaci di fondo (per esempio composti dell'oro, penicillamina, idrossiclorochina, sulfasalazina, azatioprina, ciclosporina). L'associazione tra metotressato e sulfasalazina può portare ad un rafforzamento dell'attività del metotressato. Sia il metotressato, sia la sulfasalazina inibiscono la formazione di acido folico, pertanto può verificarsi un aumento degli effetti collaterali. Tuttavia, ciò finora è stato osservato soltanto in rari casi.
Quando vengono somministrati contemporaneamente degli inibitori della pompa protonica, si possono verificare delle interazioni. Quando viene somministrato l'inibitore della pompa protonica omeprazolo, si può verificare un ritardo dell'escrezione renale del metotressato. In associazione con pantoprazolo, l'escrezione del metabolita 7-idrossimetotressato viene inibita, e ciò, in un caso, ha causato mialgie (dolori muscolari e malessere) e brividi.
Nei pazienti con malattie reumatiche di base sono state segnalate emorragie polmonari acute con metotrexato. Se dovesse manifestare sintomi come tosse o espettorato con sangue, contatti immediatamente il suo medico.
Interazioni con altri medicamenti e con l'alcool
Durante la terapia con Methotrexat Accord non dovrebbe, se possibile, bere alcolici. Eviti l'eccessivo consumo di bevande contenenti caffeina o teofillina (caffè, bibite contenenti caffeina, tè nero).
Possono verificarsi interazioni in particolare con I anestetici a base di protossido di azoto (gas esilarante). Parli con il Suo medico se ha in programma di sottoporsi a un intervento chirurgico.
Informi il suo medico o il suo farmacista nel caso in cui:
- soffre di altre malattie,
- soffre di allergie o
- assume o applica esternamente altri medicamenti (anche se acquistati di sua iniziativa)!
Si può usare il Methotrexat Accord durante la gravidanza o l'allattamento?
Gravidanza
Non usi Methotrexat Accord durante la gravidanza o se sta cercando di rimanere incinta. Il metotrexato può causare difetti alla nascita, nuocere al feto o provocare aborto spontaneo. È associato a malformazioni del cranio, viso, cuore e vasi sanguigni, cervello e arti. Pertanto, è molto importante che le pazienti in stato di gravidanza o che stanno pianificando una gravidanza non vengano trattate con metotrexato. Nelle donne in età fertile deve essere esclusa ogni possibilità di una gravidanza tramite l'impiego di misure adeguate (test di gravidanza) prima dell'inizio del trattamento.
Durante l'assunzione di metotrexato e per almeno 6 mesi dopo la fine del trattamento dovrà evitare una gravidanza utilizzando metodi contraccettivi affidabili nel corso dell'intero periodo. Pertanto, dovrà utilizzare un metodo contraccettivo affidabile nel corso dell'intero periodo.
Se rimane incinta durante il trattamento o sospetta di essere incinta, si rivolga al medico il prima possibile. Riceverà un consulto in merito al rischio di effetti dannosi sul bambino a causa del trattamento. Se desidera una gravidanza dovrà consultare il medico, che la invierà da uno specialista prima dell'inizio previsto del trattamento.
Allattamento
Durante il trattamento con metotrexato non deve allattare, perché il metotrexato passa nel latte materno. Se il suo medico curante dovesse ritenere indispensabile il trattamento con metotrexato durante il periodo di allattamento, dovrà interrompere l'allattamento.
Fertilità maschile
I dati disponibili non indicano un aumento del rischio di malformazioni o aborto se il padre assume metotrexato a una dose inferiore a 30 mg/settimana. Tuttavia, non è possibile escludere completamente il rischio. Il metotrexato può essere nocivo per i geni e influire sulla produzione di sperma con possibilità di causare difetti alla nascita. Durante il trattamento con metotrexato e per 6 mesi dopo il trattamento deve evitare di procreare o donare sperma.
Come usare il Methotrexat Accord?
Assuma il Methotrexat Accord sempre esattamente secondo le indicazioni del suo medico. Consulti il suo medico o il suo farmacista se non è completamente sicuro.
Il medico che le prescrive il Methotrexat Accord deve essere esperto nell'uso di questo medicamento e del suo meccanismo d'azione.
Il Methotrexat Accord viene somministrato soltanto una volta alla settimana. È consigliabile che lei scelga un giorno della settimana particolarmente adatto per l'iniezione (giorno del Methotrexat Accord) e che lo mantenga, possibilmente, per tutta la durata della terapia.
Dosaggio nei pazienti adulti con artrite reumatoide:
La dose iniziale raccomandata è di 7,5 mg di metotressato, una volta alla settimana, come iniezione singola. Questa dose può essere aumentata gradualmente di 2,5 mg/settimana finché si sarà ottenuto il risultato ottimale. In generale, non si dovrebbe superare la dose settimanale di 25 mg.
Dosaggio nei pazienti adulti con psoriasi volgare ed artrite psoriasica:
Una settimana prima dell'inizio della terapia, può eventualmente ricevere una dose di prova di 5-10 mg, per verificarne la tollerabilità. La dose iniziale raccomandata è di 7,5 mg di metotressato, una volta alla settimana come singola iniezione. La dose può essere gradualmente incrementata fino ad ottenere un risultato ottimale.
In generale, non dovrebbe essere superata la dose settimanale massima di 25 mg di metotressato. In casi eccezionali, il medico può prescrivere una dose settimanale di 30 mg.
Dosaggio nei pazienti adulti affetti da morbo di Crohn:
La dose iniziale raccomandata è di 25 mg di metotressato alla settimana. Possono occorrere da 8 a 12 settimane perché inizi a manifestarsi un successo del trattamento. Durante il primo trattamento, di regola si impiegano 15 mg di metotressato alla settimana.
Pazienti con riduzione della funzione renale:
Pazienti con lieve riduzione della funzione renale (clearance della creatinina 20-50 ml/min) devono ricevere il 50% della dose normale. Se la funzione renale è molto ridotta (clearance della creatinina <20 ml/min), non si deve somministrare metotressato.
Pazienti con riduzione della funzione epatica:
I pazienti con riduzione della funzione epatica devono usare il Methotrexat Accord soltanto con prudenza. Se il valore della bilirubina supera i 5 mg/dl, non si deve usare metotressato.
Somministrazione nei pazienti anziani:
Nei pazienti anziani, il medico può prendere in considerazione una riduzione del dosaggio.
Somministrazione nei bambini e negli adolescenti:
La dose raccomandata è di 10-15 mg/m2 di superficie corporea a settimana. Nel caso di insufficiente efficacia, la dose settimanale può essere incrementata fino a 20 mg/m2 di superficie corporea. Con riduzione della funzione renale (clearance della creatinina <80 ml/min), non si deve somministrare Methotrexat Accord.
Il Methotrexat Accord va iniettato per via sottocutanea (nel tessuto sotto la pelle).
Se si verifica un contatto accidentale del metotressato con lo strato superficiale della cute o con le mucose, occorre subito irrigare abbondantemente la sede interessata con acqua.
Le siringhe pronte all'uso sono destinate ad essere usate solo una volta. Tutta la soluzione non utilizzata deve essere scartata ed eliminata.
Se ha dimenticato di assumere il Methotrexat Accord, non assuma una doppia dose, ma consulti immediatamente il suo medico.
Se sospetta di aver preso una dose eccessiva di Methotrexat Accord, informi subito il suo medico che deciderà le necessarie misure di trattamento, in base alla gravità dei disturbi.
Il suo medico deciderà la durata della terapia. Per l'artrite reumatoide, ci si può attendere una risposta al trattamento dopo circa 4-8 settimane. Appena è stato raggiunto il desiderato successo terapeutico, il suo medico ridurrà la dose gradualmente fino alla dose minima efficace di mantenimento.
Per la psoriasi volgare e per l'artrite psoriasica, ci si può attendere una risposta al trattamento dopo circa 2-6 settimane. Appena è stato raggiunto il desiderato successo terapeutico, il suo medico ridurrà la dose gradualmente fino alla dose minima efficace di mantenimento.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Quali effetti collaterali può avere il Methotrexat Accord?
La comparsa e la gravità degli effetti collaterali dipendono dal dosaggio e dalla frequenza delle somministrazioni. Anche con l'uso di Methotrexat Accord a basse dosi possono comparire gravi effetti collaterali. Pertanto è indispensabile che il suo medico la segua con regolari visite di controllo a intervalli ravvicinati.
Con l'assunzione del Methotrexat Accord possono manifestarsi i seguenti effetti collaterali:
i più frequenti consistono in un effetto nocivo sul sistema che forma il sangue (emopoietico) ed in disturbi gastrointestinali.
La valutazione degli effetti collaterali si basa sulle seguenti indicazioni di frequenza:
Molto frequenti: in più di 1 su 10 persone trattate
Frequenti: in più di 1 su 100 persone trattate
Occasionali: in più di 1 su 1'000 persone trattate
Rari: in più di 1 su 10'000 persone trattate
Molto rari: in 1 o meno su 10'000 persone trattate, compresi casi singoli
Non noti: non possono essere stimati in base ai dati attualmente disponibili.
Patologie gastrointestinali
Molto frequenti: infiammazioni del cavo orale (stomatite), disturbi digestivi, nausea, mancanza d'appetito.
Frequenti: ulcere nel cavo orale e nella faringe, diarrea.
Occasionali: infiammazioni della faringe, infiammazioni intestinali, pancreatite, vomito.
Rari: ulcere del tratto gastroenterico.
Molto rari: vomito di sangue, gravi emorragie.
Patologie della cute e del tessuto sottocutaneo
Frequenti: eruzione cutanea (esantema), arrossamento cutaneo (eritema), prurito.
Occasionali: aumento della sensibilità della cute ai raggi solari (fotosensibilità), caduta dei capelli, aumento dei noduli reumatici, fuoco di S. Antonio (herpes zoster), infiammazioni dei vasi sanguigni (vasculiti), eruzione cutanea simile all'herpes, eruzione cutanea pruriginosa (orticaria).
Rari: iperpigmentazione cutanea.
Molto rari: reazione allergica cutanea pericolosa per la vita, eventualmente accompagnata da febbre e formazione di vescicole (sindrome di Stevens-Johnson), necrolisi epidermica tossica (formazione di bolle e distacco dell'epidermide, sindrome di Lyell), iperpigmentazione delle unghie, patereccio (paronichia acuta).
Patologie generali e condizioni relative alla sede di somministrazione
Rari: reazioni di ipersensibilità (reazioni allergiche); shock allergico (shock anafilattico); infiammazione di tipo allergico dei vasi (vasculite); febbre, arrossamento degli occhi (congiuntivite), infezioni, sepsi, lenta guarigione delle ferite, raccolta di liquido intorno ai polmoni (versamento pleurico), raccolta di liquido tra i foglietti del pericardio (versamento pericardico), ostacolo al riempimento delle camere cardiache (tamponamento pericardico), diminuzione degli anticorpi nel sangue (ipogammaglobulinemia).
Dopo somministrazione intramuscolare possono verificarsi degli effetti collaterali nella sede dell'iniezione (sensazione di bruciore) o dei danni al tessuto circostante (formazione di ascessi sterili, necrosi del tessuto adiposo).
Patologie del sistema nervoso
Frequenti: mal di testa, stanchezza, stordimento.
Occasionali: vertigini, disorientamento, depressione (intenso sentimento di tristezza).
Molto rari: disturbi della vista, dolori, debolezza muscolare o alterazioni della percezione come formicolio agli arti superiori o inferiori, gusto metallico in bocca, convulsioni, segni di meningismo senza meningite, paralisi (perdita della funzione muscolare).
Non noti: encefalopatia / leucoencefalopatia
Patologie epatobiliari
Molto frequenti: aumento degli enzimi epatici (transaminasi).
Occasionali: cirrosi epatica (trasformazione connettivale o connettivo-cicatriziale del tessuto epatico), fibrosi epatica (cicatrizzazione), steatosi epatica (fegato grasso).
Patologie respiratorie, toraciche e mediastiniche
Frequenti: infiammazione di tipo allergico dell'interstizio polmonare e degli alveoli polmonari (polmonite interstiziale/alveolite). I primi sintomi sono: tosse secca, stizzosa, fiato corto fino a fame d'aria e febbre.
Rari: fibrosi polmonare (cicatrizzazione), polmonite da Pneumocystis carinii; fiato corto fino a fame d'aria e asma bronchiale.
Non noti: emorragia polmonare.
Patologie del sistema emolinfopoietico
Frequenti: alterazioni della formazione delle cellule del sangue, con diminuzione patologica dei globuli bianchi e/o rossi e/o delle piastrine (leucopenia, anemia, trombocitopenia).
Occasionali: grave diminuzione di tutte le cellule del sangue e delle piastrine (pancitopenia).
Molto rari: grave diminuzione dei globuli bianchi (agranulocitosi), grave depressione del midollo osseo.
Patologie renali e urinarie
Occasionali: infiammazioni ed ulcere della vescica, riduzione della funzione renale, disturbi dello svuotamento della vescica.
Rari: insufficienza renale, escrezione urinaria ridotta o gravemente ridotta, alterazioni elettrolitiche.
Patologie dell'apparato riproduttivo e della mammella
Occasionali: Infiammazioni ed ulcere della vagina
Molto rari: perdita dell'interesse sessuale, impotenza, alterazioni dello sviluppo spermatico con diminuzione del numero degli spermatozoi (cellule seminali maschili), alterazioni del ciclo femminile e delle mestruazioni, secrezioni vaginali.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Occasionali: dolori articolari, dolori muscolari, diminuzione della massa ossea (osteoporosi).
Tumori benigni, maligni e non specificati (incl cisti e polipi)
Molto rari: in casi isolati è stata descritta la comparsa di linfonodi ingrossati (linfomi), che in alcuni casi, dopo sospensione della terapia con metotressato, sono regrediti. Non è stato possibile, finora, confermare un aumento della comparsa di linfomi durante il trattamento con metotressato.
Se osserva effetti collaterali qui non descritti dovrebbe informare il suo medico o il suo farmacista.
Di che altro occorre tener conto?
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Conservare il Methotrexat Accord a temperatura ambiente (al di sotto di 30 °C). Custodire il contenitore nella confezione di cartone, per proteggere il contenuto dalla luce.
Il Methotrexat Accord deve essere conservato fuori della portata dei bambini.
Le donne del personale sanitario specializzato in stato di gravidanza non devono maneggiare né somministrare il Methotrexat Accord.
Il metotressato non deve entrare in contatto con la cute o con le mucose. Nel caso di contaminazione, le sedi interessate devono essere subito irrigate abbondantemente con acqua.
Solo per somministrazione unica. Tutta la soluzione non utilizzata deve essere eliminata.
Il medico o il farmacista, che sono in possesso di documentazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene il Methotrexat Accord?
1 ml di Methotrexat Accord contiene come principio attivo 50 mg di metotressato (sotto forma di sale disodico del metotressato), nonché le sostanze ausiliarie cloruro di sodio, idrossido di sodio e acqua per soluzioni iniettabili.
Numero dell'omologazione
66780 (Swissmedic)
Dove è ottenibile il Methotrexat Accord? Quali confezioni sono disponibili?
In farmacia dietro presentazione della prescrizione medica non rinnovabile.
Sono disponibili siringhe pronte all'uso con ago integrato con sistema di sicurezza dell'ago per iniezione s.c. da 7,5 mg (0,15 ml), 10 mg (0,2 ml), 12,5 mg (0,25 ml),15 mg (0,3 ml), 17,5 mg (0,35 ml), 20 mg (0,4 ml), 22,5 mg (0,45 ml), 25 mg (0,5 ml), 27,5 mg (0,55 ml) e 30 mg (0,6 ml) di soluzione.
Confezioni singole da 1 siringa preriempita.
Tutte le confezioni del medicamento contengono già i tamponi imbevuti d'alcool.
Per uso sottocutaneo.
Titolare dell'omologazione
Accord Healthcare AG, 4103 Bottmingen.
Questo foglietto illustrativo è stato controllato l'ultima volta nel luglio 2019 dall'autorità competente in materia di medicamenti (Swissmedic).
Avvertenze sull'uso
Legga attentamente queste avvertenze prima di iniziare con l'iniezione. Esegua la tecnica di iniezione seguendo sempre precisamente le istruzioni date dal medico, dal farmacista o dall'infermiere.
Se ha domande sull'uso, si rivolga al suo medico, farmacista o personale medico specializzato.
Preparazione
Scelga una superfice di lavoro pulita, ben illuminata e liscia.
Prima dell'applicazione, prepari l'occorrente:
- 1 Methotrexat Accord siringa pronta all'uso
- 1 tampone imbevuto d'alcool
Si lavi accuratamente le mani. Prima dell'uso controlli che la siringa di Methotrexat Accord non presenti danni visibili (o incrinature).
Sito d'iniezione
Le sedi più adatte per effettuare l'iniezione sono le seguenti:
- regione superiore della coscia
- addome con eccezione della regione ombelicale

Se per eseguire l'iniezione riceve l'aiuto di un'altra persona, quest'ultima può effettuare l'iniezione anche nel lato posteriore di un braccio direttamente sotto la spalla.
Scelga un sito d'iniezione diverso per ogni iniezione. In questo modo riduce il rischio di irritazioni nel sito d'iniezione.
Per l'iniezione non scelga mai zone cutanee sensibili, nelle quali si è verificato uno stravaso di sangue, che sono arrossate, indurite o cicatriziali o che presentino smagliature. Se soffre di psoriasi, cerchi di non effettuare l'iniezione direttamente nei rilievi cutanei, nelle parti cutanee ispessite, arrossate o squamose o nelle parti ferite.
Iniezione della soluzione
1. Prelevi la siringa pronta all'uso contenente metotressato dalla confezione e legga attentamente il foglietto illustrativo. La siringa pronta all'uso va prelevata dalla confezione a temperatura ambiente.
2. Disinfezione

Scelga un sito d'iniezione e lo pulisca con un tampone imbevuto di un disinfettante. Attenda almeno 60 secondi fino a che il disinfettante si sia asciugato.
3. Rimuova il cappuccio di protezione di plastica

Rimuova cautamente il cappuccio di plastica, estraendolo e tenendolo in linea con la siringa. Se il cappuccio è inserito saldamente, lo rimuova con un movimento di trazione e di lieve rotazione. Importante: non toccare mai l'ago della siringa pronta all'uso!
4. Introduzione dell'ago

Con due dita formi una piega nella pelle e lasci penetrare l'ago rapidamente e perpendicolarmente nella pelle.
5. Iniezione


Quando l'ago è penetrato completamente nella pelle, spinga lentamente verso il basso lo stantuffo e inietti il liquido sotto la pelle. Tenga la pelle premuta fino al termine dell'iniezione.
6. Sistema di sicurezza dell'ago

Il sistema di sicurezza si attiverà una volta che lo stantuffo è completamente premuto:
- Tenere ancora la siringa e sollevare lentamente il pollice dalla testa del pistone;
- L'asta del pistone si sposta con il pollice e la molla ritrae l'ago dal sito, nella custodia di sicurezza dell'ago.
Il metotressato non deve venire in contatto con la superficie della pelle o delle mucose. Se tuttavia ciò dovesse accadere, la zona colpita va immediatamente sciacquata con abbondante quantità d'acqua.
Qualora lei o un'altra persona dovesse ferirsi con l'ago, si rivolga immediatamente al suo medico. In questo caso la siringa pronta all'uso non dovrà essere usata.
Smaltimento e manipolazione
Nella manipolazione e nello smaltimento del medicamento e della siringa pronta all'uso devono essere osservate le direttive nazionali vigenti. Le collaboratrici del personale medico specializzato in stato di gravidanza non devono manipolare né somministrare Methotrexat Accord.
Zusammensetzung
Wirkstoff: Methotrexat als Methotrexat-Dinatrium.
Hilfsstoffe: Natriumchlorid, Natriumhydroxid (zur pH-Wert Einstellung), Wasser für Injektionszwecke.
Galenische Form und Wirkstoffmenge pro Einheit
1 ml Injektionslösung enthält 50 mg Methotrexat (als Methotrexat-Dinatrium).
1 Fertigspritze zu 0,15 ml enthält 7,5 mg Methotrexat.
1 Fertigspritze zu 0,2 ml enthält 10 mg Methotrexat.
1 Fertigspritze zu 0,25 ml enthält 12,5 mg Methotrexat.
1 Fertigspritze zu 0,3 ml enthält 15 mg Methotrexat.
1 Fertigspritze zu 0,35 ml enthält 17,5 mg Methotrexat.
1 Fertigspritze zu 0,4 ml enthält 20 mg Methotrexat.
1 Fertigspritze zu 0,45 ml enthält 22,5 mg Methotrexat.
1 Fertigspritze zu 0,5 ml enthält 25 mg Methotrexat.
1 Fertigspritze zu 0,55 ml enthält 27,5 mg Methotrexat.
1 Fertigspritze zu 0,6 ml enthält 30 mg Methotrexat.
Indikationen/Anwendungsmöglichkeiten
Aktive rheumatoide Arthritis bei erwachsenen Patienten.
Polyarthritische Formen der schweren, aktiven juvenilen idiopathischen Arthritis bei mangelndem Ansprechen auf nicht-steroidale Antirheumatika (NSAR).
Schwere, hartnäckige und beeinträchtigende Psoriasis vulgaris, die nicht genügend auf andere Therapieformen wie Phototherapie, PUVA und Retinoide anspricht, sowie schwere Psoriasis arthropathica bei erwachsenen Patienten.
Leichter bis mittelschwerer Morbus Crohn, entweder allein oder in Kombination mit Kortikosteroiden bei erwachsenen Patienten, die auf Thiopurine nicht ansprechen oder diese nicht vertragen.
Dosierung/Anwendung
Methotrexat Accord ist nur für nicht-onkologische Anwendungsgebiete zugelassen.
- Dieses Arzneimittel darf nur 1x wöchentlich verabreicht werden.
- Der Verordner sollte den Wochentag der Verabreichung auf der Verordnung vermerken.
Methotrexat Accord sollte nur von Ärzten verschrieben werden, die Erfahrungen mit den verschiedenen Eigenschaften des Arzneimittels und seiner Wirkweise haben.
Methotrexat Accord darf nur einmal wöchentlich injiziert werden. Der Patient muss explizit auf den ungewöhnlichen Umstand hingewiesen werden, dass Methotrexat Accord nur einmal wöchentlich angewendet wird. Es wird empfohlen, einen geeigneten festen Wochentag für die Injektion zu vereinbaren. Der Verordner sollte den Wochentag der Injektion auf der Verordnung vermerken.
Die Elimination von Methotrexat ist bei Patienten mit einem dritten Verteilungsraum (Aszites, Pleuraerguss) eingeschränkt. Diese Patienten müssen besonders sorgfältig auf Toxizitäten überwacht werden. Ausserdem ist eine Dosisreduktion oder, in einigen Fällen, ein Abbruch der Behandlung mit Methotrexat erforderlich (siehe Rubriken «Warnhinweise und Vorsichtsmassnahmen», sowie «Pharmakokinetik»).
Dosierung bei erwachsenen Patienten mit rheumatoider Arthritis
Die empfohlene Initialdosis beträgt 7,5 mg Methotrexat einmal wöchentlich als subkutane Applikation. Je nach individueller Krankheitsaktivität und Verträglichkeit für den Patienten kann die Initialdosis schrittweise um 2,5 mg pro Woche gesteigert werden. Eine wöchentliche Dosis von 25 mg sollte im Allgemeinen nicht überschritten werden. Jedoch sind Dosierungen über 20 mg /Woche mit einem signifikanten Anstieg der Toxizität verbunden, insbesondere mit Knochenmarksuppression.
Mit einem Wirkungseintritt kann nach etwa 4-8 Wochen gerechnet werden. Nach Erreichen des gewünschten therapeutischen Ergebnisses sollte die Dosierung schrittweise auf die niedrigste noch wirksame Erhaltungsdosis reduziert werden.
Dosierung bei Kindern und Jugendlichen unter 16 Jahren mit polyarthritischen Formen der juvenilen idiopathischen Arthritis (JIA)
Die empfohlene Dosierung beträgt 10-15 mg/m² Körperoberfläche (KOF) einmal wöchentlich. Bei therapierefraktären Fällen kann die Dosierung auf bis zu 20 mg/m² Körperoberfläche einmal wöchentlich erhöht werden. Wenn die Dosierung erhöht wird, ist jedoch die Frequenz von Kontrolluntersuchungen zu erhöhen. Aufgrund der begrenzten Verfügbarkeit von Daten zur intravenösen Anwendung bei Kindern und Jugendlichen ist die parenterale Gabe auf die subkutane Injektion beschränkt. Patienten mit JIA sollten stets an ein rheumatologisches Zentrum verwiesen werden, das auf die Behandlung von Kindern und Jugendlichen spezialisiert ist.
Bei einer Kreatinin-Clearance <80 ml/min ist die Behandlung mit Methotrexat Accord nicht indiziert.
Methotrexat Accord wird für die Anwendung bei Kindern unter 3 Jahren nicht empfohlen, da für diese Patientengruppe keine ausreichenden Daten zur Wirksamkeit und Unbedenklichkeit vorliegen (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Dosierung bei erwachsenen Patienten mit Psoriasis vulgaris und Psoriasis arthropathica
Es wird empfohlen, eine Testdosis von 5-10 mg parenteral eine Woche vor Therapiebeginn zu applizieren, um idiosynkratische Nebenwirkungen aufzuspüren. Die empfohlene Initialdosis beträgt 7,5 mg Methotrexat einmal wöchentlich als subkutane Applikation. Die Dosierung wird schrittweise gesteigert, soll jedoch im Allgemeinen eine Wochendosis von 25 mg Methotrexat nicht überschreiten. Dosierungen über 20 mg /Woche können mit einem signifikanten Anstieg der Toxizität verbunden sein, insbesondere mit Knochenmarksuppression. In einigen Ausnahmefällen kann eine höhere Dosis klinisch begründet sein. Sie sollte jedoch eine wöchentliche Höchstdosis von 30 mg Methotrexat nicht überschreiten, da sich dann die Toxizität deutlich erhöht.
Mit einem Wirkungseintritt kann im Allgemeinen nach etwa 2-6 Wochen gerechnet werden. Nach Erreichen des gewünschten therapeutischen Ergebnisses sollte die Dosierung schrittweise auf die niedrigste noch wirksame Erhaltungsdosis reduziert werden.
Dosierung bei Patienten mit Morbus Crohn:
Einleitung der Behandlung:
25 mg/Woche subkutan angewendet. Ein Ansprechen auf die Behandlung kann nach etwa 8 bis 12 Wochen erwartet werden.
Erhaltungsbehandlung:
15 mg/Woche subkutan angewendet.
Aufgrund mangelnder Erfahrung bei Kindern und Jugendlichen wird Methotrexat zur Behandlung von Morbus Crohn bei dieser Patientengruppe nicht empfohlen.
Patienten mit eingeschränkter Nierenfunktion
Methotrexat Accord sollte bei Patienten mit eingeschränkter Nierenfunktion mit Vorsicht angewendet werden. Die Dosierung sollte wie folgt angepasst werden:
Kreatinin-Clearance (ml/min): Dosierung
>50: 100%
20-50: 50%
<20: Methotrexat Accord darf nicht angewendet werden.
Siehe Rubrik «Kontraindikationen».
Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit signifikanter bestehender oder vorheriger Lebererkrankung, vor allem falls diese durch Alkohol verursacht ist, sollte Methotrexat, wenn überhaupt, nur mit grosser Vorsicht angewendet werden. Ist der Bilirubin-Wert >5 mg/dl (85,5 µmol/l), ist Methotrexat kontraindiziert.
Anwendung bei älteren Patienten
Bei älteren Patienten sollte aufgrund eingeschränkter Leber- und Nierenfunktionen sowie geringerer Folat-Reserven, die mit steigendem Alter auftreten, eine Dosisreduktion in Betracht gezogen werden.
Anwendung bei Patienten mit einem dritten Verteilungsraum (Pleuraerguss, Aszites):
Da die Halbwertzeit bei Patienten mit einem dritten Verteilungsraum bis um das Vierfache verlängert sein kann, kann eine Dosisreduktion oder, in einigen Fällen, ein Abbruch der Behandlung mit Methotrexat erforderlich sein (siehe Rubriken «Warnhinweise und Vorsichtsmassnahmen», sowie «Pharmakokinetik»).
Dauer und Art der Anwendung
Dieses Arzneimittel ist nur zur einmaligen Anwendung bestimmt. Methotrexat Accord Injektionslösung wird subkutan injiziert. Über die Gesamtdauer der Behandlung entscheidet der Arzt.
Eine Anleitung zur Anwendung von Methotrexat Accord Injektionslösung in einer Fertigspritze mit integrierter Injektionsnadel wird im Abschnitt «Hinweise für die Handhabung» gegeben.
Bitte beachten Sie, dass der gesamte Inhalt angewendet werden muss.
Anmerkung
Bei einem Wechsel von oraler Verabreichung zu parenteraler Anwendung kann eine Dosisreduktion erforderlich werden, die durch die schwankende Bioverfügbarkeit von Methotrexat nach oraler Verabreichung bedingt ist.
Eine Folsäuresupplementierung kann gemäss aktuellen Behandlungsleitlinien erwogen werden.
Kontraindikationen
Methotrexat Accord darf in folgenden Fällen nicht angewendet werden:
Überempfindlichkeit gegenüber Methotrexat oder einem der Hilfsstoffe,
Leberinsuffizienz (siehe auch Abschnitt «Dosierung/Anwendung»),
Alkoholabusus,
Niereninsuffizienz (Kreatinin-Clearance <20 ml/min, siehe auch Abschnitt «Dosierung/Anwendung»),
vorbestehende Blutdyskrasie wie Knochenmarkhypoplasie, Leukopenie, Thrombozytopenie oder signifikante Anämie,
schwere, akute oder chronische Infektionen wie Tuberkulose und HIV, oder andere Immundefizienzsyndrome,
Ulzera der Mundhöhle und bekannte Ulzera des Magen-Darm-Traktes,
Schwangerschaft, Stillzeit (siehe auch Abschnitt «Schwangerschaft/Stillzeit»),
gleichzeitige Impfung mit Lebendimpfstoffen.
Verabreichung von Methotrexat nach Lachgas-Anästhesie.
Warnhinweise und Vorsichtsmassnahmen
Patienten müssen deutlich darauf hingewiesen werden, dass die Therapie einmal in der Woche angewendet werden muss, nicht jeden Tag.
Es wurden besonders bei älteren Patienten nach der versehentlichen täglichen Anwendung der Wochendosis über Todesfälle berichtet.
Patienten, die eine Therapie erhalten, sollten angemessen überwacht werden, damit Anzeichen möglicher toxischer Effekte oder Nebenwirkungen erkannt werden und ohne Verzögerung beurteilt werden können. Daher sollte Methotrexat nur von, oder unter der Aufsicht von Ärzten angewendet werden, deren Erfahrungen und Kenntnisse die Anwendung einer Therapie mit Antimetaboliten einschliesst. Auf Grund des Risikos schwerer oder sogar fataler toxischer Reaktionen, sollte der Patient komplett über die Risiken und die empfohlenen Schutzmassnahmen informiert werden.
Maligne Lymphome können bei Patienten auftreten, die niedrig dosiertes Methotrexat erhalten, so dass Methotrexat abgesetzt werden muss. Sollten sich die Lymphome nicht spontan zurückbilden, ist die Einleitung einer zytotoxischen Therapie erforderlich. Es wurde berichtet, dass die gleichzeitige Gabe von Folatantagonisten wie Trimethoprim/Sulfametoxazol in seltenen Fällen eine akute megaloblastische Panzytopenie verursachen kann.
Durch Bestrahlung verursachte/r Dermatitis oder Sonnenbrand können unter der Behandlung mit Methotrexat wieder auftreten (Recall-Reaktion). Psoriatrische Läsionen können sich bei Bestrahlung mit UV-Licht und gleichzeitiger Gabe von Methotrexat verschlimmern.
Bei Patienten mit pathologischen Flüssigkeitsansammlungen wie Aszites oder Pleuraerguss («third distribution space») ist die Elimination von Methotrexat eingeschränkt. Diese Patienten müssen besonders sorgfältig auf Toxizitäten überwacht werden. Ausserdem ist eine Dosisreduktion oder, in einigen Fällen, ein Abbruch der Behandlung mit Methotrexat erforderlich. Pleuraergüsse und Aszites müssen vor dem Beginn der Methotrexat-Behandlung drainiert werden.
Diarrhö und Stomatitis ulcerosa können toxische Wirkungen sein und erfordern eine Unterbrechung der Therapie. Andernfalls können hämorrhagische Enteritis oder Tod durch Darmperforation die Folge sein.
Vitaminpräparate oder andere Produkte, die Folsäure, Folinsäure oder deren Derivate enthalten, können die Wirkung von Methotrexat vermindern.
Bei der Behandlung von Psoriasis sollte Methotrexat auf schwere therapieresistente beeinträchtigende Psoriasis beschränkt bleiben, die nicht ausreichend auf andere Therapieformen anspricht, jedoch nur, wenn die Diagnose mittels einer Biopsie und/oder durch einen Dermatologen gestellt wurde.
Enzephalopathie/Leukenzephalopathie wurde bei onkologischen Patienten, die eine Methotrexat-Therapie erhalten haben, beobachtet und kann bei einer Methotrexat-Therapie bei nicht-onkologischen Indikationen nicht ausgeschlossen werden.
Ausserdem wurde von pulmonaler alveolärer Blutung bei der Anwendung von Methotrexat bei rheumatologischen und ähnlichen Indikationen berichtet. Dieses Ereignis kann auch mit Vaskulitis und anderen Komorbiditäten in Verbindung stehen. Es sollte eine sofortige Untersuchung in Betracht gezogen werden, wenn Verdacht auf eine pulmonale alveoläre Blutung besteht, um die Diagnose zu bestätigen.
Eine Schwangerschaft ist vor der Behandlung mit Methotrexat Accord 50 mg/ml auszuschliessen. Methotrexat ist embryotoxisch und verursacht Abort und fötale Defekte bei Menschen. Während Methotrexat angewendet wird, beeinflusst es die Spermatogenese und Oogenese, was zur Beeinträchtigung der Fertilität führen kann. Diese Wirkungen scheinen nach Absetzen der Therapie reversibel zu sein. Männer und Frauen müssen während und mindestens sechs Monate nach der Behandlung eine zuverlässige Verhütungsmethode anwenden. Die möglichen Risiken von Auswirkungen auf die Fortpflanzung sollten mit Patientinnen im gebärfähigen Alter besprochen und ihre Partner sollten entsprechend beraten werden.
Die Anwendung bei Kindern unter 3 Jahren wird Aufgrund ungenügender Daten über die Wirkung und Sicherheit nicht empfohlen.
Lachgas-Anästhesie
Die Verabreichung von Methotrexat nach Lachgas-Anästhesie ist kontraindiziert. Die Verwendung von Distickstoffmonoxid-Anästhetika verstärkt den Effekt von Methotrexat auf den Folat-Stoffwechsel, was zu einer erhöhten Toxizität wie schwerwiegende unvorhersehbare Myelosuppression, Stomatitis und Neurotoxizität führt (siehe «Kontraindikationen»).
Schwerwiegende Neurotoxizität mit fatalem Ausgang wurde insbesondere bei intrathekaler Anwendung von Methotrexat nach Lachgas-Anästhesie beobachtet. Dieser Effekt kann durch Folat-Supplementation reduziert werden (siehe «Dosierung/Anwendung»).
Schwerwiegende unerwünschte Wirkungen sind bei Verabreichung von Methotrexat 36 Stunden nach erfolgter Lachgas-Anästhesie aufgetreten. Schwerwiegende unerwünschte Wirkungen sind auch nach diesem Intervall noch möglich.
Fertilität und Fortpflanzung
Fertilität
Es gibt Berichte darüber, dass Methotrexat beim Menschen während der Therapie und für kurze Zeit nach deren Absetzen zu Oligospermie, Menstruationsstörung und Amenorrhö führt.
Ausserdem kann es zur Beeinträchtigung der Fertilität führen, wobei Spermatogenese und Oogenese während der Dauer der Anwendung betroffen sind- diese Effekte scheinen nach Beendigung der Therapie reversibel zu sein.
Teratogenität - Fortpflanzungsrisiko
Methotrexat führt beim Menschen zu Embryotoxizität, Fehlgeburten und fetalen Fehlbildungen. Daher sind die möglichen Auswirkungen auf die Fortpflanzungsfähigkeit, Spontanaborte und kongenitale Fehlbildungen mit Patientinnen im gebärfähigen Alter zu besprechen (siehe Abschnitt Schwangerschaft/Stillzeit). Vor der Anwendung von Methotrexat Accord muss bestätigt werden, dass keine Schwangerschaft vorliegt. Wenn Frauen im gebärfähigen Alter behandelt werden, müssen sie während der Therapie und für mindestens sechs Monate danach eine effektive Methode zur Empfängnisverhütung anwenden.
Für Hinweise zur Empfängnisverhütung bei Männern siehe Abschnitt Schwangerschaft/Stillzeit.
Folgende Kontrolluntersuchungen werden empfohlen:
Vor Therapiebeginn oder nach Wiederaufnahme der Therapie nach einer Therapiepause
Grosses Blutbild mit Differenzialblutbild und Thrombozyten, Leberenzymen, Bilirubin, Serumalbumin, Röntgen des Brustkorbs und Nierenfunktionstests. Falls klinisch indiziert Ausschluss von Tuberkulose und Hepatitis.
Während der Therapie (während der ersten 6 Monate mindestens monatlich und danach mindestens vierteljährlich. Eine höhere Kontrollfrequenz sollte auch bei Erhöhung der Dosis in Betracht gezogen werden)
1. Inspektionen der Mundhöhle und des Rachens auf Schleimhautveränderungen.
2. Grosses Blutbild mit Differenzialblutbild und Thrombozyten. Hämatopoetische Suppression ausgelöst durch Methotrexat kann abrupt und bei augenscheinlich sicheren Dosen auftreten. Jeder deutliche Abfall der Leukozyten oder der Thrombozyten bedeutet den sofortigen Therapieabbruch und entsprechende supportive Therapie. Patienten sollen dazu aufgefordert werden, alle Anzeichen und Symptome verdächtiger Infektionen mitzuteilen. Bei Patienten, die gleichzeitig hämatotoxische Arzneimittel einnehmen (z.B. Leflunomid), sollten Blutbild und Thrombozyten engmaschiger überwacht werden.
3. Leberfunktionstests: Besondere Aufmerksamkeit sollte auf das Auftreten von Leberschäden gelegt werden. Die Behandlung sollte nicht begonnen bzw. unterbrochen werden, wenn Abweichungen von der Norm bei Leberfunktionstests oder Leberbiopsien vorhanden sind oder sich während der Therapie entwickeln. Diese Abweichungen sollten sich innerhalb von zwei Wochen, nach denen die Therapie nach Ermessen des Arztes weitergeführt werden kann, normalisieren. Bei rheumatologischen Indikationen gibt es keine Hinweise, die die Durchführung von Leberbiopsien zur Verfolgung der Lebertoxizität unterstützen. Bei Psoriasis-Patienten sollte die Notwendigkeit der Durchführung von Leberbiopsien vor und während der Anwendung gemäss neuesten wissenschaftlichen Erkenntnissen erwogen werden. Die Abwägung sollte zwischen Patienten ohne Risikofaktoren und Patienten mit Risikofaktoren, wie vorherigem exzessiven Alkoholgenuss, persistierender Erhöhung der Leberenzyme, Anamnese mit Lebererkrankungen, Familienanamnese mit erblichen Lebererkrankungen, Übergewicht, und zurückliegendem Kontakt mit hepatotoxischen Arzneimitteln oder Chemikalien unterscheiden.
Untersuchung der leberbezogenen Enzyme im Serum: Über einen temporären Anstieg der Transaminasen auf das zwei- oder dreifache des oberen Normwerts ist mit einer Häufigkeit von 13-20% berichtet worden. Im Falle eines konstanten Anstiegs der leberbezogenen Enzyme ist eine Dosisreduktion oder Therapieabbruch in Erwägung zu ziehen.
Auf Grund des potentiell toxischen Effekts auf die Leber sollten zusätzlich keine hepatotoxischen Arzneimittel während der Behandlung mit Methotrexat gegeben werden, ausser wenn unbedingt erforderlich, und die Aufnahme von Alkohol sollte vermieden oder stark reduziert werden (siehe Abschnitt «Interaktionen»). Eine engmaschigere Kontrolle der Leberenzyme sollte bei Patienten, die gleichzeitig andere hepatotoxische Arzneimittel (z.B. Leflunomid) einnehmen, durchgeführt werden. Dasselbe sollte beachtet werden, wenn simultan hämatotoxische Arzneimittel angewendet werden (z.B. Leflunomid).
4. Die Nierenfunktion sollte mit Nierenfunktionsprüfungen und Urinanalyse kontrolliert werden.
Da Methotrexat überwiegend renal ausgeschieden wird, können im Falle einer renalen Insuffizienz erhöhte Konzentrationen erwartet werden, die schwere Nebenwirkungen auslösen können.
Bei möglicherweise eingeschränkter Nierenfunktion (z.B. bei älteren Patienten) sollte die Überwachung engmaschiger erfolgen. Dies gilt insbesondere wenn zusätzlich Arzneimittel gegeben werden, die die Ausscheidung von Methotrexat beeinträchtigen, Nierenschädigungen verursachen (z.B. nicht steroidale Antirheumatika) oder potentiell zu Blutbildungsstörungen führen können. Dehydratation kann ebenfalls die Toxizität von Methotrexat steigern.
5. Untersuchung des respiratorischen Systems:
Aufmerksam auf Symptome einer beeinträchtigten Lungenfunktion achten und, falls erforderlich, Lungenfunktionstest. Eine Affektion der Lunge erfordert eine schnelle Diagnose und Absetzen von Methotrexat. Pulmonale Symptome (vor allem trockener Reizhusten) oder unspezifische Lungenentzündung, die während der Methotrexat-Therapie auftreten, können auf eine potenziell gefährliche Schädigung hinweisen und machen eine Unterbrechung der Therapie sowie eine sorgfältige Untersuchung erforderlich. Auch wenn das klinische Bild variiert, zeigt der typische Patient mit Methotrexat-induzierter Lungenerkrankung Fieber, Husten mit Atemnot, Hypoxämie und ein Infiltrat auf dem Röntgenbild des Brustkorbs; Infektionen müssen ausgeschlossen werden. Diese Läsion kann bei allen Dosierungen auftreten.
6. Methotrexat kann auf Grund seiner Wirkung auf das Immunsystem das Ansprechen auf Impfungen beeinträchtigen und das Ergebnis immunologischer Tests beeinflussen. Besondere Vorsicht ist bei Bestehen inaktiver chronischer Infektionen (z.B. Herpes zoster, Tuberkulose, Hepatitis B oder C) geboten, da diese eventuell aktiviert werden können. Impfungen mit Lebendimpfstoffen dürfen nicht gleichzeitig durchgeführt werden.
Interaktionen
Alkohol, hepatotoxische, hämatotoxische Arzneimittel
Die Wahrscheinlichkeit, dass Methotrexat hepatotoxische Effekte auslöst, wird durch regelmässigen Alkoholkonsum und die gleichzeitige Einnahme weiterer hepatotoxischer Arzneimittel erhöht. Patienten, die gleichzeitig weitere hepatotoxische Mittel (z.B. Leflunomid) einnehmen, sollten mit besonderer Vorsicht überwacht werden. Dies sollte auch berücksichtigt werden, wenn gleichzeitig hämatotoxische Arzneimittel (z.B. Leflunomid) eingenommen werden. Die Inzidenz von Panzytopenie und Hepatotoxizität kann erhöht sein, wenn Leflunomid mit Methotrexat kombiniert wird.
Die kombinierte Behandlung mit Methotrexat und Retinoiden wie Acitretin oder Etretinat erhöht das Hepatotoxizitätsrisiko.
Orale Antibiotika
Orale Antibiotika wie Tetrazykline, Chloramphenicol und nicht absorbierbare Breitbandantibiotika können den enterohepatischen Kreislauf durch Hemmung der Darmflora oder Hemmung der bakteriellen Metabolisierung beeinflussen.
Antibiotika
Antibiotika, wie Penicilline, Glykopeptide, Sulfonamide, Ciprofloxazin und Cefalotin können, in einzelnen Fällen, die renale Clearance von Methotrexat reduzieren, so dass erhöhte Serumkonzentrationen von Methotrexat mit gleichzeitiger hämatologischer und gastrointestinaler Toxizität auftreten könnten.
Probenecid, schwache organische Säuren, Pyrazole und nicht-steroidale Antiphlogistika
Probenecid, schwache organische Säuren wie Schleifendiuretika und Pyrazole (Phenylbutazon) können die Ausscheidung von Methotrexat herabsetzen und es kann angenommen werden, dass höhere Serumkonzentrationen entstehen und zu hämatologischer Toxizität führen. Das Risiko erhöhter Toxizität besteht auch, wenn niedrig dosiertes Methotrexat mit nicht-steroidalen Antiphlogistika oder Salicylaten kombiniert wird.
Arzneimittel mit unerwünschten Wirkungen auf das Knochenmark
Bei Behandlung mit Arzneimitteln, die mögliche Nebenwirkungen auf das Knochenmark aufweisen (z.B. Sulfonamide, Trimethoprim-Sulfamethoxazol, Chloramphenicol, Pyrimethamin) ist die Möglichkeit ausgeprägter Störungen der Blutbildung zu beachten.
Arzneimittel die Folatmangel verursachen
Die gleichzeitige Verabreichung von Arzneimitteln, die Folatmangel verursachen (z.B. Sulfonamide, Trimethoprim-Sulfamethoxazol) kann zu erhöhter Methotrexat- Toxizität führen. Besondere Vorsicht ist deshalb auch bei einem bereits bestehenden Folsäuremangel geboten.
Andere Antirheumatika
Ein Anstieg der Toxizität von Methotrexat ist im Allgemeinen nicht zu erwarten, wenn Methotrexat Accord gleichzeitig mit anderen Basistherapeutika (z.B. Goldverbindungen, Penicillamin, Hydroxychloroquin, Sulfasalazin, Azathioprin, Cyclosporin) angewendet wird.
Sulfasalazin
Obwohl die Kombination von Methotrexat und Sulfasalazin wegen der Hemmung der Folsäure-Synthese durch Sulfasalazin eine Wirkungsverstärkung von Methotrexat und damit vermehrt Nebenwirkungen verursachen kann, wurden solche Nebenwirkungen in mehreren Untersuchungen nur in seltenen Fällen beobachtet.
Protonenpumpeninhibitoren
Die gleichzeitige Gabe von Protonenpumpenhemmern wie Omeprazol und Pantoprazol kann zu Interaktionen führen: Gleichzeitige Gabe von Methotrexat und Omeprazol führte zu einer Verzögerung der renalen Elimination von Methotrexat. In Kombination mit Pantoprazol wurde über einen Fall von Hemmung der renalen Elimination des Metaboliten 7-Hydroxymethotrexat mit Myalgie und Schüttelfrost berichtet.
Koffein- oder Theophyllin-haltige Getränke
Übermässiger Genuss Koffein- oder Theophyllin-haltiger Getränke (Kaffee, Koffein-haltige Softdrinks, schwarzer Tee) sollte während der Methotrexat-Therapie vermieden werden.
Mercaptopurin
Methotrexat erhöht die Mercaptopurin-Plasmaspiegel. Die Kombination von Methotrexat und Mercaptopurin kann daher eine Dosisanpassung erforderlich machen.
Arzneimittel mit hoher Plasmaproteinbindung
Methotrexat ist plasmaproteingebunden und kann durch andere proteingebundene Arzneimittel wie Salicylate, Hypoglykämika, Diuretika, Sulfonamide, Diphenylhydantoine, Tetrazykline, Chloramphenicol und p-Aminobenzoesäure sowie saure antiinflammatorische Substanzen verdrängt werden, was bei gleichzeitiger Anwendung zu erhöhter Toxizität führen kann.
Lachgas-Anästhesie
Die Verabreichung von Methotrexat nach Lachgas-Anästhesie ist kontraindiziert. Die Verwendung von Distickstoffmonoxid-Anästhetika verstärkt den Effekt von Methotrexat auf den Folat-Stoffwechsel, was zu einer erhöhten Toxizität wie schwerwiegende unvorhersehbare Myelosuppression, Stomatitis und Neurotoxizität führt (siehe «Warnhinweise und Vorsichtsmassnahmen»). Dieser Effekt kann durch Folat-Supplementation reduziert werden (siehe «Dosierung/Anwendung»).
Schwangerschaft/Stillzeit
Frauen im gebärfähigen Alter/Empfängnisverhütung bei Frauen
Frauen dürfen während der Methotrexat-Therapie nicht schwanger werden und müssen während und mindestens 6 Monate nach Abschluss der Therapie mit Methotrexat eine effektive Verhütungsmethode anwenden (siehe Abschnitt Warnhinweise und Vorsichtsmassnahmen). Vor Behandlungsbeginn müssen gebärfähige Frauen über das Fehlbildungsrisiko durch Methotrexat aufgeklärt werden. Ausserdem muss eine bestehende Schwangerschaft durch geeignete Massnahmen wie einen Schwangerschaftstest mit Sicherheit ausgeschlossen werden. Während der Behandlung sollten Schwangerschaftstests nach klinischem Bedarf vorgenommen werden (z.B. nach nicht erfolgter Empfängnisverhütung). Gebärfähige Patientinnen müssen über Schwangerschaftsprävention und -planung beraten werden.
Empfängnisverhütung bei Männern
Es ist nicht bekannt, ob Methotrexat sich im Samen anreichert. In tierexperimentellen Studien hat sich Methotrexat als genotoxisch erwiesen, sodass das Risiko genotoxischer Auswirkungen auf das Sperma nicht vollständig ausgeschlossen werden kann. Begrenzte klinische Evidenz deutet nicht darauf hin, dass ein erhöhtes Risiko für Fehlbildungen oder Fehlgeburten besteht, wenn der Vater Methotrexat in geringen Dosen erhalten hat (weniger als 30 mg/Woche). Für höhere Dosen liegen keine ausreichenden Daten vor, um das Risiko für Fehlbildungen oder Fehlgeburten nach väterlicher Exposition einzuschätzen.
Als Vorsichtsmassnahme sollten sexuell aktive männliche Patienten oder ihre weiblichen Partner während und mindestens 6 Monate nach Abschluss der Therapie mit Methotrexat zuverlässige Empfängnisverhütungsmassnahmen anwenden. In diesem Zeitraum sollten Männer auch keinen Samen spenden.
Schwangerschaft
Methotrexat Accord ist während der Schwangerschaft kontraindiziert (siehe auch Abschnitt «Kontraindikationen»). In Studien an Tieren hat Methotrexat Reproduktionstoxizität gezeigt, vor allem im ersten Trimenon (siehe auch Abschnitt «Präklinische Daten»). Es wurde gezeigt, dass Methotrexat beim Menschen teratogen wirkt; es wurde berichtet, dass es den Tod des Fötus und/oder kongenitale Anomalien verursacht. Die Exposition einer begrenzten Anzahl schwangerer Frauen (42) resultierte in einer erhöhten Inzidenz (1:14) von Missbildungen (kranial, kardiovaskulär und die Extremitäten betreffend). Im Falle des Absetzens von Methotrexat vor der Konzeption wurde über normale Schwangerschaften berichtet. Frauen dürfen während der Methotrexat-Therapie nicht schwanger werden. Falls während der Therapie eine Schwangerschaft eintritt, sollte eine medizinische Beratung zum Risiko unerwünschter Wirkungen für das Kind im Zusammenhang mit einer Methotrexatbehandlung in Anspruch genommen werden. Daher müssen Patienten im geschlechtsreifen Alter (Frauen und Männer) einen wirksamen Empfängnisschutz während der Behandlung mit Methotrexat Accord sowie noch mindestens sechs Monate danach praktizieren (siehe auch Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
Methotrexat ist bei nicht-onkologischen Indikationen während der Schwangerschaft kontraindiziert (siehe Abschnitt Kontraindikationen). Wenn während der Behandlung mit Methotrexat und bis zu 6 Monate danach eine Schwangerschaft eintritt, muss eine medizinische Beratung über das Risiko schädlicher, im Zusammenhang mit der Therapie stehender Wirkungen auf das Kind erfolgen. Ausserdem sollten Ultraschalluntersuchungen durchgeführt werden, um die normale Entwicklung des Fötus zu bestätigen.
Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt, besonders im ersten Trimenon (siehe Abschnitt Präklinische Daten). Methotrexat erwies sich beim Menschen als teratogen; es wurde beobachtet, dass es den Tod des Fötus, Fehlgeburten und/oder fetale Fehlbildungen verursacht (wie kraniofazial, kardiovaskulär, das Zentralnervensystem und die Extremitäten betreffend).
Methotrexat ist ein starkes humanes Teratogen, das bei einer Exposition während der Schwangerschaft das Risiko für Spontanaborte, intrauterine Wachstumsstörungen und kongenitale Fehlbildungen erhöht.
- Spontanaborte wurden bei 42,5% der Schwangeren unter Methotrexat in niedriger Dosierung (weniger als 30 mg/Woche) beobachtet. Bei Patientinnen mit vergleichbarer Erkrankung, die mit anderen Arzneimitteln als Methotrexat behandelt wurden, betrug die Rate gemeldeter Aborte 22,5%.
- Schwerwiegende Geburtsfehler traten bei 6,6% der Lebendgeburten von Frauen auf, die während der Schwangerschaft Methotrexat in niedriger Dosierung (weniger als 30 mg/Woche) erhalten hatten. Bei Patientinnen mit vergleichbarer Erkrankung, die mit anderen Arzneimitteln als Methotrexat behandelt wurden, waren etwa 4% der Lebendgeburten betroffen.
Für die Exposition gegenüber Methotrexat-Dosen höher als 30 mg/Woche während der Schwangerschaft liegen keine ausreichenden Daten vor, aber es sind höhere Raten von Spontanaborten und kongenitaler Fehlbildungen zu erwarten.
War Methotrexat vor der Empfängnis abgesetzt worden, wurde über normale Schwangerschaften berichtet.
Stillzeit
Methotrexat wird in derartigen Konzentrationen in der Milch ausgeschieden, dass ein Risiko für den Säugling besteht. Somit muss vor der Behandlung abgestillt und während der Behandlung darf nicht gestillt werden.
Fertilität
Methotrexat beeinträchtigt die Spermatogenese und Oogenese und kann die Fertilität verringern. Es gibt Berichte, dass Methotrexat beim Menschen Oligospermie, Menstruationsstörungen und Amenorrhö auslöst. Diese Effekte scheinen nach Beendigung der Therapie reversibel zu sein.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Während der Behandlung können Symptome des zentralen Nervensystems wie Müdigkeit und Verwirrtheit auftreten. Methotrexat Accord hat einen geringen oder mässigen Einfluss auf die Verkehrstüchtigkeit oder das Bedienen von Maschinen.
Unerwünschte Wirkungen
Die häufigsten Nebenwirkungen sind gastro-intestinale Beschwerden, eine Beeinträchtigung der Leberfunktion und des hämatopoetischen Systems.
Das Auftreten und der Schweregrad von unerwünschten Arzneimittelwirkungen hängen von der Höhe der Dosierung und der Häufigkeit der Anwendung von Methotrexat Accord ab. Da es jedoch auch bei niedriger Dosierung zu schwerwiegenden Nebenwirkungen kommen kann, ist eine regelmässige Überwachung durch den Arzt in kurzen zeitlichen Abständen unerlässlich.
Die folgenden Angaben werden zur Einteilung der Häufigkeitsangaben der Nebenwirkungen verwendet: Sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1000, <1/100), selten (≥1/10000, <1/1000), und sehr selten (<1/10000), unbekannt (kann von den bisher vorhandenen Daten nicht geschätzt werden).
Gutartige, bösartige und nicht spezifizierte Neubildungen (einschl. Zysten und Polypen)
Sehr selten: Es wurde über das Auftreten von Lymphomen berichtet, die sich in einigen Fällen nach dem Absetzen der Therapie mit Methotrexat zurückgebildet haben. Eine erhöhte Inzidenz für das Auftreten von Lymphomen bei einer Methotrexatbehandlung konnte in einer neueren Untersuchung nicht festgestellt werden.
Erkrankungen des Blutes und des Lymphsystems
Häufig: Leukozytopenie, Anämie, Thrombozytopenie.
Gelegentlich: Panzytopenie.
Sehr selten: Agranulozytose, schwere Verläufe von Knochenmarkdepression.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen, Müdigkeit, Benommenheit.
Gelegentlich: Schwindel, Verwirrtheit, Depressionen.
Sehr selten: Sehstörungen, Schmerzen, Muskelschwäche oder Parästhesien in den Extremitäten, Geschmacksveränderungen (metallischer Geschmack), Krampfanfälle, Meningismus, Lähmungen.
Unbekannt: Enzephalopathie/Leukenzephalopathie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Interstitielle Alveolitis/Pneumonitis. Symptome, die auf potentiell schwere Lungenschädigungen (interstitielle Pneumonitis) hinweisen sind: trockener Reizhusten, Kurzatmigkeit und Fieber.
Selten: Lungenfibrose, Pneumocystis-carinii Pneumonitis, Kurzatmigkeit und Asthma bronchiale.
Unbekannt: Pulmonale Alveolarblutung.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Stomatitis (20–30%), Dyspepsie (bis 60%), Übelkeit (60–70%), Appetitlosigkeit (60–70%).
Häufig: Ulzerationen der Mundschleimhaut, Diarrhoe.
Gelegentlich: Pharyngitis, Enteritis, Pankreatitis, Erbrechen.
Selten: Ulzerationen des Magen-Darm-Traktes.
Sehr selten: Hämatemesis, Hämatorrhoe.
Leber- und Gallenerkrankungen
Sehr häufig: Anstieg der Transaminasen (bis 70%).
Gelegentlich: Leberzirrhose, Leberfibrose, Leberverfettung.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Exantheme, Erytheme, Pruritus.
Gelegentlich: Photosensibilität, Haarausfall, Zunahme von Rheumaknoten, Herpes zoster, Vaskulitis, herpetiforme Hauteruptionen, Urtikaria.
Selten: Verstärkte Pigmentierung.
Sehr selten: Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse (Lyell-Syndrom), verstärkte Pigmentierung der Nägel, akute Paronychie.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Arthralgie, Myalgie und Osteoporose.
Erkrankungen der Nieren und Harnwege
Gelegentlich: Entzündungen und Ulzerationen im Bereich von Harnblase, Störung der Nierenfunktion, Blasenentleerungsstörungen.
Selten: Niereninsuffizienz, Oligurie, Anurie, Elektrolytstörungen.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gelegentlich: Entzündungen und Ulzerationen im Bereich von Vagina.
Sehr selten: Libidoverlust, Impotenz, Oligospemie, Menstruationsstörungen, vaginaler Ausfluss.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Selten: Allergische Reaktionen, anaphylaktischer Schock, allergische Vaskulitis, Fieber, Konjunktivitis, Infektion, Sepsis, Wundheilungsstörungen, Pleuraerguss, Perikarderguss, Perikardtamponade, Hypogammaglobulinämie.
Bei intramuskulärer Anwendung von Methotrexat kann es an der Injektionsstelle zu lokalen Nebenwirkungen (brennendes Gefühl) oder Schäden (sterile Abszessbildung, Untergang von Fettgewebe) kommen.
Überdosierung
a) Symptome einer Überdosierung
Toxische Nebenwirkungen von Methotrexat betreffen hauptsächlich das hämatopoetische System.
b) Therapiemassnahmen bei Überdosierung
Als spezifisches Antidot zur Neutralisation toxischer Nebenwirkungen von Methotrexat steht Calciumfolinat zur Verfügung.
Im Falle einer versehentlichen Überdosierung sollte eine der schädlichen Methotrexatdosis identische oder höhere Dosis Calciumfolinat intravenös oder intramuskulär innerhalb von 1 Stunde gegeben werden und es sollte weiter dosiert werden, bis die Methotrexat-Serumspiegel unter 10-7 mol/l liegen.
Im Falle einer massiven Überdosierung sollte versucht werden, mittels Hydrierung sowie Alkalisierung des Urins die Präzipitation von Methotrexat und/oder seiner Metaboliten in den renalen Tubuli zu minimieren. Weder für Hämodialyse noch für Peritonealdialyse konnte der Nachweis erbracht werden, dass die Methotrexat-Elimination verbessert wurde. Eine effektive Methotrexat-Clearance ist für akute, intermittierende Hämodialyse mit einem High-Flux-Dialysiergerät berichtet worden.
Eigenschaften/Wirkungen
ATC-Code: L04AX03
Wirkungsmechanismus
Methotrexat ist ein Folsäureantagonist, der als Antimetabolit zur Gruppe der zytotoxischen Substanzen gehört. Er wirkt über die kompetitive Hemmung des Enzyms Dihydrofolat-Reduktase und inhibiert somit die DNS-Synthese. Bisher ist nicht geklärt, ob die Wirksamkeit von Methotrexat bei der Behandlung der Psoriasis, Psoriasis-Arthritis und chronischen Polyarthritis und des Morbus Crohn auf einem anti-inflammatorischen oder immunsuppressiven Effekt beruht und in welchem Ausmass extrazelluläre Adenosin-Konzentrationen zu den Effekten beitragen.
Die Nebenwirkungen, die in den Morbus Crohn-Studien mit Methotrexat bei kumulativen Dosen beobachtet wurden, zeigen im Vergleich zum bereits bekannten Profil kein verändertes Sicherheitsprofil für Methotrexat. Daher muss Methotrexat bei der Behandlung von Morbus Crohn genauso vorsichtig angewendet werden wie bei anderen rheumatischen und nichtrheumatischen Indikationen von Methotrexat (siehe Abschnitte «Warnhinweise und Vorsichtsmassnahmen» und «Schwangerschaft/Stillzeit»).
Pharmakokinetik
Distribution
Die Plasmaeiweissbindung von Methotrexat beträgt ca. 50%. Bei der Verteilung erfolgt eine Anreicherung vor allem in Leber, Niere und Milz in Form von Polyglutamaten, die zum Teil wochen- bis monatelang retiniert werden können. Methotrexat tritt in niedriger Dosierung in minimalen Mengen in den Liquor über.
Die terminale Halbwertszeit beträgt im Mittel 6-7 Stunden und weist eine erhebliche Schwankungsbreite (3-17 Stunden) auf.
Bei Patienten mit einem dritten Verteilungsraum (Pleuraerguss, Aszites) kann die Halbwertszeit bis um das Vierfache verlängert sein.
Metabolismus
Ca. 10% der angewendeten Methotrexat-Dosis werden intrahepatisch metabolisiert. Der Hauptmetabolit ist 7-Hydroxymethotrexat.
Elimination
Die Ausscheidung erfolgt überwiegend unverändert renal durch glomeruläre Filtration und aktive Sekretion im proximalen Tubulus.
Ca. 5-20% Methotrexat und 1-5% 7-Hydroxymethotrexat werden biliär eliminiert. Es besteht ein ausgeprägter enterohepatischer Kreislauf.
Kinetik spezieller Patientengruppen
Die Elimination verläuft bei eingeschränkter Nierenfunktion deutlich verzögert. Einschränkungen der Ausscheidung bei eingeschränkter Leberfunktion sind derzeit nicht bekannt.
Präklinische Daten
Da konventionelle Karzinogenitätsstudien nicht durchgeführt wurden und die Daten aus chronischen Toxizitätsstudien an Nagetieren inkonsistent sind, gilt Methotrexat in Bezug auf seine Karzinogenität für den Menschen als nicht klassifizierbar.
Sonstige Hinweise
Inkompatibilitäten
Die Kompatibilität mit anderen parenteralen Produkten ist nicht untersucht worden. Es wird empfohlen, dieses Arzneimittel nicht mit anderen Arzneimitteln oder Verdünnungsmitteln zu mischen.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» angegebenen Datum verwendet werden.
Besondere Lagerungshinweise
Bei Raumtemperatur unter 30 °C lagern. Den Behälter im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Hinweise für die Handhabung
Die Art der Handhabung und Entsorgung muss der Handhabung und Entsorgung anderer zytotoxischer Zubereitungen entsprechen. Medizinisches Fachpersonal, das schwanger ist, sollte nicht mit Methotrexat Accord umgehen oder es verabreichen.
Methotrexat sollte nicht mit der Haut oder Mukosa in Berührung kommen. Im Falle einer Kontamination müssen die betroffenen Areale sofort mit einer ausreichenden Menge Wasser abgespült werden.
Nur zur einmaligen Anwendung. Jegliche nicht verbrauchte Lösung ist zu verwerfen.
Hinweise zur subkutanen Anwendung der Methotrexat Accord Injektionlösung in einer Fertigspritze mit Nadelschutz:
- Für die Injektion eignen sich die folgenden Stellen am besten:
- oberer Bereich des Oberschenkels,
- Bauch mit Ausnahme des Nabelbereichs.
- Den Bereich der gewählten Injektionsstelle säubern.
- Die Plastikschutzkappe gerade von der Spritze abziehen.
- Durch leichtes Zusammendrücken der Haut an der Injektionsstelle eine Hautfalte bilden.
- Die Haut muss bis zum Herausziehen der Spritze nach erfolgter Injektion zusammengedrückt bleiben.
- Die Nadel in einem 90-Grad-Winkel ganz in die Haut einstechen.
- Den Kolben langsam herunterdrücken und die Flüssigkeit unter die Haut injizieren.
- Nachdem der Spritzenkolben vollständig heruntergedrückt ist, wird das Nadelschutzsystem aktiviert.
- Die Spritze still halten und den Daumen langsam vom Kopfende des Kolbens nehmen.
- Der Kolben bewegt sich mit Ihrem Daumen nach oben und die Feder zieht die Nadel aus der Injektionsstelle zurück in den Nadelschutz.
Zulassungsnummer
66780 (Swissmedic).
Zulassungsinhaberin
Accord Healthcare AG, 4103 Bottmingen.
Stand der Information
Juli 2019.
Composition
Principe actif: Méthotrexate (sous forme de méthotrexate disodique).
Excipients: Chlorure de sodium, hydroxyde de sodium (pour équilibrer le pH), eau pour préparations injectables.
Forme galénique et quantité de principe actif par unité
1 ml de solution injectable contient 50 mg de méthotrexate (sous forme de méthotrexate disodique).
1 seringue prête à l'emploi de 0,15 ml contient 7,5 mg de méthotrexate.
1 seringue prête à l'emploi de 0,2 ml contient 10 mg de méthotrexate.
1 seringue prête à l'emploi de 0,25 ml contient 12,5 mg de méthotrexate.
1 seringue prête à l'emploi de 0,3 ml contient 15 mg de méthotrexate.
1 seringue prête à l'emploi de 0,35 ml contient 17,5 mg de méthotrexate.
1 seringue prête à l'emploi de 0,4 ml contient 20 mg de méthotrexate.
1 seringue prête à l'emploi de 0,45 ml contient 22,5 mg de méthotrexate.
1 seringue prête à l'emploi de 0,5 ml contient 25 mg de méthotrexate.
1 seringue prête à l'emploi de 0,55 ml contient 27,5 mg de méthotrexate.
1 seringue prête à l'emploi de 0,6 ml contient 30 mg de méthotrexate.
Indications/Possibilités d’emploi
Polyarthrite rhumatoïde active chez les patients adultes.
Formes polyarthritiques de l'arthrite juvénile active idiopathique sévère en l'absence de réponse aux anti-inflammatoires non stéroïdiens (AINS).
Psoriasis vulgaire sévère et tenace qui altère la qualité de vie et qui ne répond pas suffisamment à d'autres formes thérapeutiques comme la photothérapie, le traitement par psoralènes et rayons UVA (puvathérapie) ou les rétinoïdes, ainsi que psoriasis arthropathique sévère chez les patients adultes.
Formes légères à modérées de la maladie de Crohn, seul ou en association avec des corticostéroïdes, chez les patients adultes ne répondant pas aux thiopurines ou ne les tolérant pas.
Posologie/Mode d’emploi
Methotrexat Accord est seulement approuvé pour les indications non-oncologiques.
- Ce médicament doit uniquement être administré 1x par semaine.
- Le prescripteur doit préciser le jour de prise sur l'ordonnance.
Methotrexat Accord ne doit être prescrit que par des médecins ayant l'expérience des différentes propriétés du médicament et de son mode d'action.
Methotrexat Accord ne doit être injecté qu'une fois par semaine. Il faut explicitement rendre le patient attentif au fait inhabituel que Methotrexat Accord n'est administré qu'une fois par semaine. Il est recommandé de convenir d'un jour de la semaine fixe et approprié pour l'injection. Le prescripteur doit préciser le jour de la semaine de l'injection sur l'ordonnance.
L'élimination du méthotrexate chez les patients disposant d'un troisième espace de distribution (ascite, épanchement pleural) est limitée. Ces patients doivent faire l'objet d'une surveillance étroite en ce qui concerne une éventuelle toxicité. Le cas échéant, une réduction posologique ou, dans certains cas, une interruption du traitement par le méthotrexate peuvent être nécessaires (voir les rubriques «Mises en garde et précautions» ainsi que «Pharmacocinétique»).
Posologie chez les patients adultes atteints de polyarthrite rhumatoïde
La dose initiale recommandée est de 7,5 mg de méthotrexate une fois par semaine en injection sous-cutanée. Selon l'activité individuelle de la maladie et la tolérance du patient, la dose initiale peut être augmentée par paliers progressifs de 2,5 mg par semaine. En général, il ne faut pas dépasser une dose hebdomadaire de 25 mg. Toutefois, des doses supérieures à 20 mg par semaine sont associées à une hausse significative de la toxicité, en particulier pour la moelle osseuse.
Il faut s'attendre à un délai d'action d'environ 4-8 semaines. Une fois le résultat thérapeutique souhaité obtenu, réduire progressivement la posologie à la plus faible dose d'entretien encore efficace.
Posologie chez les enfants et les adolescents de moins de 16 ans atteints de formes polyarthritiques d'arthrite juvénile idiopathique (AJI)
La posologie recommandée est de 10-15 mg/m² de surface corporelle (SC) une fois par semaine. Dans les cas réfractaires au traitement, la posologie peut être augmentée jusqu'à 20 mg/m² de surface corporelle une fois par semaine. Toutefois, lorsque la posologie est augmentée, il faut augmenter la fréquence des examens de contrôle. En raison des données limitées disponibles au sujet de l'administration intraveineuse chez les enfants et les adolescents, l'administration par voie parentérale doit se limiter à l'injection sous-cutanée. Les patients atteints d'AJI doivent dans tous les cas être adressés à un centre de rhumatologie spécialisé dans le traitement des enfants et des adolescents.
Le traitement par Methotrexat Accord n'est pas indiqué si la clairance de la créatine est inférieure à 80 ml/min.
Methotrexat Accord n'est pas recommandé chez les enfants de moins de 3 ans car on ne dispose pas de suffisamment de données concernant l'efficacité et la sécurité chez ce groupe de patients (voir sous «Mises en garde et précautions»).
Posologie chez les patients adultes atteints de psoriasis vulgaire et de psoriasis arthropathique
Il est recommandé d'administrer une dose test parentérale de 5 à 10 mg une semaine avant le début du traitement afin de dépister les effets indésirables idiosyncrasiques. La dose initiale recommandée est de 7,5 mg de méthotrexate une fois par semaine en injection sous-cutanée. Augmenter la posologie progressivement et ne pas dépasser d'une manière générale une dose hebdomadaire de 25 mg de méthotrexate. Les doses dépassant 20 mg/semaine peuvent être associées à une hausse significative de la toxicité, en particulier à des effets myélotoxiques. Dans certains cas exceptionnels, une posologie plus élevée peut être cliniquement justifiée. Elle ne doit toutefois pas dépasser la dose maximale hebdomadaire de 30 mg de méthotrexate car la toxicité augmenterait alors nettement.
Il faut en général s'attendre un délai d'action d'environ 2 à 6 semaines. Une fois le résultat thérapeutique souhaité obtenu, réduire progressivement la posologie à la plus faible dose d'entretien encore efficace.
Posologie chez les patients atteints de la maladie de Crohn
Instauration du traitement:
25 mg/semaine par voie sous-cutanée. La réponse au traitement peut être attendue après 8 à 12 semaines environ.
Traitement d'entretien:
15 mg/semaine par voie sous-cutanée.
L'expérience chez l'enfant et l'adolescent n'est pas suffisante pour que Methotrexat Accord puisse être recommandé pour le traitement de la maladie de Crohn chez cette population de patients.
Patients insuffisants rénaux
Methotrexat Accord doit être utilisé avec prudence chez les patients insuffisants rénaux. La posologie doit être ajustée comme suit:
Clairance de la créatinine (ml/min): Posologie
>50: 100%
20-50: 50%
<20: Methotrexat Accord ne doit pas être utilisé.
Voir la rubrique «Contre-indications».
Patients insuffisants hépatiques
Chez les patients présentant une affection hépatique significative existante ou antérieure, surtout si elle est ou si elle a été provoquée par l'alcool, Methotrexat Accord ne doit être administré qu'avec une grande prudence et seulement si cela est vraiment nécessaire. Le méthotrexate est contre-indiqué si le taux de bilirubine dépasse 5 mg/dl (85,5 µmol/l).
Utilisation chez les patients âgés
Chez les patients âgés, une réduction posologique doit être envisagée en raison de la diminution des fonctions hépatique et rénale et des réserves de folates réduites qui apparaissent avec l'âge.
Utilisation chez les patients présentant un troisième espace de distribution (épanchement pleural, ascite):
Comme la demi-vie peut être jusqu'à quatre fois plus longue chez les patients présentant un troisième espace de distribution, une réduction posologique, voire, dans certains cas, une interruption du traitement par le méthotrexate peut s'avérer nécessaire (voir les rubriques «Mises en garde et précautions» ainsi que «Pharmacocinétique»).
Durée et mode d'administration
Ce médicament est destiné à un usage unique. La solution injectable Methotrexat Accord est injectée par voie sous-cutanée. La durée totale du traitement est décidée par le médecin.
Des instructions sur l'administration de la solution injectable Methotrexat Accord en seringue prête à l'emploi avec aiguille d'injection intégrée figurent au paragraphe Remarques concernant la manipulation.
Veuillez noter que tout le contenu de la seringue doit être administré.
Remarque
Lorsque l'on passe d'une administration orale à une utilisation parentérale, une réduction posologique peut s'avérer nécessaire en raison de la biodisponibilité fluctuante du méthotrexate après administration orale.
Selon les directives thérapeutiques actuelles, une supplémentation en acide folique peut être envisagée.
Contre-indications
Methotrexat Accord ne doit pas être utilisé dans les cas suivants:
Hypersensibilité au méthotrexate ou à l'un des excipients,
insuffisance hépatique (voir «Posologie/Mode d'emploi»),
abus d'alcool,
insuffisance rénale (clairance de la créatinine <20 ml/min, voir «Posologie/Mode d'emploi»),
dyscrasie sanguine préexistante telle que hypoplasie médullaire, leucopénie, thrombocytopénie ou anémie significative,
infections sévères, aiguës ou chroniques, telles que tuberculose et VIH ou autres syndromes d'immunodéficience,
ulcérations de la cavité buccale et ulcères gastro-intestinaux connus,
grossesse, allaitement (voir «Grossesse/Allaitement»),
vaccination simultanée avec des vaccins vivants,
administration de méthotrexate après une anesthésie au protoxyde d'azote.
Mises en garde et précautions
Il faut clairement informer les patients que le traitement doit être utilisé une fois par semaine et non tous les jours.
Des cas de décès ont notamment été rapportés en particulier chez les patients âgés, après une utilisation quotidienne accidentelle de la dose hebdomadaire.
Les patients sous traitement doivent être surveillés convenablement afin de déceler tout signe d'éventuels effets toxiques ou indésirables et de pouvoir évaluer ceux-ci sans retard. C'est pourquoi le méthotrexate ne doit être utilisé que sous la surveillance de médecins expérimentés et disposant de connaissances dans l'utilisation d'un traitement par antimétabolites. Etant donné le risque de réactions toxiques sévères et même fatales, le patient doit être complètement informé des risques et des mesures de protection recommandées.
Des lymphomes malins peuvent survenir chez les patients recevant de faibles doses de méthotrexate, ce qui impose l'arrêt de ce principe actif. Si les lymphomes ne régressent pas spontanément, il est alors nécessaire d'instaurer un traitement cytotoxique. Il a été rapporté que l'administration simultanée d'antagonistes des folates comme le triméthoprime ou le sulfamétoxazole peut dans de rares cas provoquer une pancytopénie mégaloblastique aiguë.
Une dermatite provoquée par un rayonnement ou un coup de soleil peuvent réapparaître sous un traitement par le méthotrexate (réaction de rappel). Les lésions psoriasiques peuvent s'aggraver lors d'une exposition à un rayonnement UV et de l'administration simultanée de méthotrexate.
Chez les patients présentant une accumulation pathologique de liquide comme une ascite ou des épanchements pleuraux («troisième espace de distribution»), l'élimination du méthotrexate est limitée. Ces patients doivent faire l'objet d'une surveillance particulièrement étroite en ce qui concerne d'éventuelles toxicités. En outre, une réduction posologique, voire même dans certains cas une interruption du traitement par le méthotrexate est nécessaire. Les épanchements pleuraux et l'ascite doivent être drainés avant le début d'un traitement par le méthotrexate.
Une diarrhée ou une stomatite ulcéreuse peuvent représenter des effets toxiques et ils imposent donc une interruption du traitement, sans quoi ces effets pourraient conduire à une entérite hémorragique ou à un décès suite à une perforation intestinale.
Des préparations vitaminées ou d'autres produits contenant de l'acide folique, de l'acide folinique ou leurs dérivés peuvent diminuer l'effet du méthotrexate.
Lors du traitement du psoriasis, l'utilisation du méthotrexate doit rester limitée aux psoriasis sévères résistant au traitement qui ne répondent pas suffisamment à d'autres formes thérapeutiques, et uniquement lorsque le diagnostic a été posé sur la base d'une biopsie et/ou par un dermatologue.
Une encéphalopathie/leucoencéphalopathie a été observée chez des patients oncologiques traités par le méthotrexate et ne peut pas être exclue lors d'un traitement par le méthotrexate dans des indications non oncologiques.
Par ailleurs, une hémorragie alvéolaire pulmonaire a été rapportée lors de l'utilisation de méthotrexate lors d'indications rhumatologiques et d'indications similaires. Cet événement peut également être associé à une vascularite ou à d'autres comorbidités. Lorsqu'une hémorragie alvéolaire pulmonaire est suspectée, un examen immédiat doit être envisagé afin de confirmer le diagnostic.
La présence d'une grossesse doit être exclue avant l'utilisation de Methotrexat Accord 50 mg/ml. Le méthotrexate est embryotoxique et provoque des avortements et des anomalies fœtales chez l'être humain. Le méthotrexate influence la spermatogenèse et l'ovogenèse pendant son utilisation, ce qui peut entraîner une diminution de la fertilité. Ces effets semblent être réversibles à l'arrêt du traitement. Une contraception efficace doit être pratiquée par les hommes et les femmes pendant le traitement puis encore au moins pendant les six mois qui suivent. Les possibles risques des conséquences sur la reproduction doivent être discutés avec les patientes en âge de procréer et leurs partenaires.
L'emploi chez les enfants de moins de 3 ans n'est pas recommandé en raison de l'insuffisance des données concernant l'efficacité et la sécurité.
Anesthésie au protoxyde d'azote
L'administration de méthotrexate après une anesthésie au protoxyde d'azote est contre-indiquée. L'utilisation d'anesthésiants à l'oxyde azoteux renforce l'effet du méthotrexate sur le métabolisme du folate, ce qui peut entraîner une augmentation de la toxicité, notamment une myélosuppression plus complexe et imprévisible, une stomatite et une neurotoxicité (voir «Contre-indications»).
Une neurotoxicité grave d'issue fatale a été observée en particulier dans le cadre d'une utilisation intrathécale de méthotrexate après une anesthésie au protoxyde d'azote. Cet effet peut être réduit par la supplémentation de folate (voir «Posologie/Mode d'emploi»).
Des effets indésirables graves sont survenus lors de l'administration de méthotrexate 36 heures après une anesthésie au protoxyde d'azote. Des effets indésirables graves sont également possibles après cet intervalle.
Fertilité et reproduction
Fertilité
Il a été rapporté que le méthotrexate administré chez l'humain provoquait une oligospermie, des troubles menstruels et une aménorrhée au cours du traitement et pendant une courte durée après son interruption. De plus, le méthotrexate peut altérer la fertilité en influençant la spermatogenèse et l'ovogenèse pendant la durée du traitement. Ces effets semblent réversibles après l'arrêt du traitement.
Tératogénicité - risque pour la reproduction
Le méthotrexate entraîne chez l'être humain une embryotoxicité, des fausses couches et des malformations fœtales. Les conséquences possibles sur la fertilité, les avortements spontanés et les malformations congénitales doivent donc être abordées avec les patientes en âge de procréer (voir «Grossesse/Allaitement»). Avant l'utilisation de Methotrexat Accord, l'absence de grossesse doit être confirmée. Lorsque des femmes en âge de procréer sont traitées, elles doivent utiliser une méthode de contraception fiable pendant toute la durée du traitement et au moins six mois après.
Pour les informations concernant la contraception chez les hommes, voir la section «Grossesse/Allaitement».
Les examens de contrôle suivants sont recommandés:
Avant le début du traitement ou après la reprise du traitement après une pause thérapeutique
Hémogramme complet avec formule sanguine et thrombocytes, enzymes hépatiques, bilirubine, albumine sérique, radiographie thoracique et tests évaluant la fonction rénale. S'il y a une indication clinique, exclure une tuberculose et une hépatite.
Pendant le traitement (au moins tous les mois pendant les 6 premiers mois, puis au moins tous les trois mois; une plus grande fréquence des contrôles doit aussi être envisagée lors d'une augmentation posologique)
1. Inspection de la cavité buccale et du pharynx afin de déceler des modifications de la muqueuse.
2. Hémogramme complet avec formule sanguine et thrombocytes. Une suppression hématopoïétique induite par le méthotrexate peut survenir brutalement et à des doses manifestement sûres. Toute chute nette des leucocytes ou des thrombocytes implique l'arrêt immédiat du traitement et un traitement de soutien approprié. Il faut enjoindre les patients de signaler tous les signes et symptômes d'infections suspectes. Chez les patients prenant simultanément des médicaments hématotoxiques (par ex. léflunomide), la formule sanguine et les thrombocytes doivent être étroitement surveillés.
3. Paramètres hépatiques: une attention particulière doit être portée à la survenue d'atteintes hépatiques. Le traitement ne doit pas être commencé ou doit être interrompu si des anomalies des paramètres hépatiques ou des biopsies hépatiques existent ou se développent pendant le traitement. Ces anomalies doivent se normaliser en l'espace de deux semaines, après quoi le traitement peut être poursuivi selon l'appréciation du médecin. Dans les indications rhumatologiques, rien n'indique que la réalisation de biopsies hépatiques aide au suivi de la toxicité hépatique. Chez les patients psoriasiques, il convient d'évaluer la nécessité de réaliser des biopsies hépatiques avant et pendant l'utilisation, conformément aux connaissances scientifiques les plus récentes. L'évaluation doit différencier les patients sans facteurs de risque, des patients avec des facteurs de risque, tels qu'une consommation excessive antérieure d'alcool, une élévation persistante des enzymes hépatiques, des antécédents d'affections hépatiques, des antécédents familiaux d'affections hépatiques héréditaires, un surpoids et un contact antérieur avec des médicaments ou des produits chimiques hépatotoxiques.
Dosage des enzymes hépatiques dans le sérum: une augmentation temporaire des transaminases (deux à trois fois la valeur normale) a été rapportée avec une fréquence de 13-20%. En cas d'augmentation constante des enzymes hépatiques, il faut envisager une réduction de la dose ou un arrêt du traitement.
Etant donné l'effet hépatotoxique potentiel, il ne faut pas, sauf nécessité absolue, donner de médicaments hépatotoxiques supplémentaires pendant le traitement par le méthotrexate et il faut éviter l'absorption d'alcool ou réduire celle-ci fortement (voir «Interactions»). Un contrôle étroit des enzymes hépatiques doit être effectué chez les patients prenant simultanément d'autres médicaments hépatotoxiques (par ex. léflunomide). Il en est de même en cas d'utilisation concomitante de médicaments hématotoxiques (par ex. léflunomide).
4. La fonction rénale doit être contrôlée par les paramètres rénaux et une analyse d'urine.
Le méthotrexate étant éliminé essentiellement par voie rénale, il y a lieu de s'attendre, en cas d'insuffisance rénale, à des concentrations élevées risquant de provoquer des effets indésirables sévères.
En cas de possible insuffisance rénale (par ex. chez les patients âgés), la surveillance doit être étroite. Cela s'applique en particulier lors d'une administration simultanée d'autres médicaments qui diminuent l'excrétion du méthotrexate, provoquent des lésions rénales (par ex. anti-inflammatoires non stéroïdiens) ou peuvent potentiellement induire des troubles de l'hématopoïèse. Une déshydratation peut également augmenter la toxicité du méthotrexate.
5. Examen du système respiratoire:
Veiller attentivement à déceler tout symptôme d'insuffisance respiratoire et, si nécessaire, à faire une épreuve fonctionnelle pulmonaire. Une affection pulmonaire nécessite un diagnostic rapide et l'arrêt du méthotrexate. L'apparition des symptômes pulmonaires (surtout une toux irritative sèche) ou d'une pneumonie aspécifique pendant le traitement par le méthotrexate, peut être l'indice d'une atteinte potentiellement dangereuse et impose l'interruption du traitement ainsi qu'une surveillance soigneuse. Même si le tableau clinique varie, les patients atteints d'une affection pulmonaire induite par le méthotrexate présentent typiquement une fièvre, une toux avec détresse respiratoire, une hypoxémie et un infiltrat sur la radiographie thoracique; il faut exclure des infections. Cette lésion peut survenir à tous les dosages.
6. En raison de son action sur le système immunitaire, le méthotrexate peut diminuer la réponse aux vaccinations et influencer le résultat de tests immunologiques. Une prudence particulière est de rigueur en présence d'infections chroniques inactives (par ex. zona, tuberculose, hépatite B ou C) car celles-ci peuvent éventuellement être réactivées. Ne pas effectuer simultanément de vaccinations avec des vaccins vivants.
Interactions
Alcool, médicaments hépatotoxiques, hématotoxiques
Une consommation régulière d'alcool et la prise simultanée d'autres médicaments hépatotoxiques augmente la probabilité que le méthotrexate provoque des effets hépatotoxiques. Les patients prenant simultanément d'autres produits hépatotoxiques (par ex. léflunomide) doivent être surveillés avec une prudence particulière. Ceci doit être aussi pris en considération lorsque des médicaments hématotoxiques (par ex. léflunomide) sont pris simultanément. L'incidence d'une pancytopénie et d'une hépatotoxicité peut être augmentée quand le léflunomide est associé au méthotrexate.
Un traitement combiné avec du méthotrexate et des rétinoïdes comme l'acitrétine ou l'étrétinate augmente le risque d'hépatotoxicité.
Antibiotiques oraux
Les antibiotiques oraux, tels que les tétracyclines, le chloramphénicol et les antibiotiques à large spectre non absorbables, peuvent influencer le cycle entéro-hépatique par inhibition de la flore intestinale ou inhibition de la métabolisation bactérienne.
Antibiotiques
Les antibiotiques, tels que les pénicillines, les glycopeptides, les sulfonamides, la ciprofloxacine et la céfalotine, peuvent, dans des cas isolés, réduire la clairance rénale du méthotrexate à tel point qu'une augmentation des concentrations sériques de méthotrexate s'accompagnant d'une toxicité hématologique et gastro-intestinale peut survenir.
Probénécide, acides organiques faibles, pyrazolés et anti-inflammatoires non stéroïdiens
Le probénécide, les acides organiques faibles, tels que les diurétiques de l'anse et les pyrazolés (phénylbutazone), peuvent diminuer l'excrétion du méthotrexate et on peut présumer que des concentrations sériques plus élevées apparaissent et entraînent une toxicité hématologique. Le risque d'une toxicité accrue existe aussi lorsque de faibles doses de méthotrexate sont associées à des anti-inflammatoires non stéroïdiens ou à des salicylates.
Médicaments ayant des effets indésirables sur la moelle osseuse
Lors d'un traitement par des médicaments entraînant d'éventuels effets indésirables sur la moelle osseuse (par ex. sulfonamides, triméthoprime-sulfaméthoxazole, chloramphénicol, pyriméthamine), il faut tenir compte de la possibilité de troubles marqués de l'hématopoïèse.
Médicaments induisant une carence en folates
L'administration simultanée de médicaments provoquant une carence en folates (par ex. sulfonamides, triméthoprime-sulfaméthoxazole) peut entraîner une toxicité accrue du méthotrexate. Une prudence particulière est donc aussi de rigueur en cas de carence en folates déjà présente.
Autres antirhumatismaux
Il n'y a pas lieu de redouter une augmentation de la toxicité du méthotrexate quand Methotrexat Accord est utilisé simultanément à d'autres traitements de fond (par ex. sels d'or, pénicillamine, hydroxychloroquine, sulfasalazine, azathioprine, ciclosporine).
Sulfasalazine
Bien que l'association de méthotrexate et de sulfasalazine puisse provoquer une accentuation de l'action du méthotrexate et donc des effets indésirables accrus car la sulfasalazine induit une inhibition de la synthèse de l'acide folique, de tels effets indésirables n'ont été observés que dans de rares cas dans plusieurs études.
Inhibiteurs de la pompe à protons
L'administration simultanée d'inhibiteurs de la pompe à protons tels que l'oméprazole et le pantoprazole peut entraîner des interactions: l'administration simultanée de méthotrexate et d'oméprazole a provoqué un retard de l'élimination rénale du méthotrexate. Lors de l'association avec le pantoprazole, une inhibition de l'élimination rénale du métabolite 7-hydroxyméthotrexate a été rapportée dans un cas, avec des myalgies et des frissons.
Boissons contenant de la caféine ou de la théophylline
Une consommation excessive de boissons contenant de la caféine ou de la théophylline (café, softdrinks contenant de la caféine, thé noir) doit être évitée pendant le traitement par le méthotrexate.
Mercaptopurine
Le méthotrexate augmente les taux plasmatiques de mercaptopurine. L'association de méthotrexate et de mercaptopurine peut donc imposer une adaptation de la dose.
Médicaments présentant une forte liaison aux protéines plasmatiques
Le méthotrexate se lie aux protéines plasmatiques et peut être déplacé par d'autres médicaments se liant aux protéines comme les salicylates, les hypoglycémiants, les diurétiques, les sulfonamides, la diphénylhydantoïne, les tétracyclines, le chloramphénicol et l'acide p-aminobenzoïque ainsi que les anti-inflammatoires acides, ce qui peut entraîner une augmentation de la toxicité lors d'une utilisation simultanée.
Anesthésie au protoxyde d'azote
L'administration de méthotrexate après une anesthésie au protoxyde d'azote est contre-indiquée. L'utilisation d'anesthésiants à l'oxyde azoteux renforce l'effet du méthotrexate sur le métabolisme du folate, ce qui peut entraîner une augmentation de la toxicité, notamment une myélosuppression plus complexe et imprévisible, une stomatite et une neurotoxicité (voir «Mises en garde et précautions»). Cet effet peut être réduit par la supplémentation de folate («Posologie/Mode d'emploi»).
Grossesse/Allaitement
Femmes en âge de procréer/contraception chez les femmes
Les femmes ne doivent pas tomber enceintes pendant le traitement par le méthotrexate et doivent utiliser une méthode de contraception fiable pendant au moins 6 mois après la fin du traitement par le méthotrexate (voir section «Mises en garde et précautions»). Avant le début du traitement, les femmes en âge de procréer doivent être informées du risque de malformation lié au méthotrexate. En outre, la présence d'une grossesse doit être exclue avec certitude par des examens appropriés tels qu'un test de grossesse. Pendant le traitement, des tests de grossesse devraient être réalisés selon les besoins cliniques (p.ex. après un défaut de contraception). Les patientes en âge de procréer doivent être conseillées en matière de prévention et de planification des grossesses.
Contraception chez les hommes
On ignore si le méthotrexate s'accumule dans le sperme. Dans des expérimentations animales, le méthotrexate s'est révélé génotoxique, si bien que le risque de répercussions génotoxiques sur le sperme ne peut pas être totalement exclu. Les preuves cliniques limitées ne suggèrent pas qu'il existe un risque accru de malformations ou de fausses couches lorsque le père a reçu du méthotrexate à de faibles doses (moins de 30 mg/semaine). Concernant les doses plus élevées, les données ne sont pas suffisantes pour estimer le risque de malformations ou de fausses couches après l'exposition paternelle.
Par mesure de précaution, les patients masculins sexuellement actifs ou leurs partenaires féminines devraient utiliser des méthodes de contraception fiables pendant toute la durée du traitement par le méthotrexate et au moins 6 mois après la fin du traitement. Pendant cette période, les hommes ne devraient pas non plus faire don de leur sperme.
Grossesse:
Methotrexat Accord est contre-indiqué pendant la grossesse (voir «Contre-indications»). Dans les expérimentations animales, le méthotrexate a présenté une toxicité de la reproduction, surtout pendant le premier trimestre (voir «Données précliniques»). On a montré que le méthotrexate a des effets tératogènes chez l'être humain; des rapports signalent qu'il provoque la mort du fœtus et/ou des anomalies congénitales. L'exposition d'un nombre limité de femmes enceintes (42) a montré une incidence accrue (1:14) de malformations (crâniennes, cardiovasculaires et touchant les extrémités). Des grossesses normales ont été rapportées lorsque le médicament a été arrêté avant la conception. Les femmes ne doivent pas tomber enceintes pendant le traitement par le méthotrexate. Si une grossesse survient pendant le traitement, il faut recourir à une consultation médicale pour évaluer le risque d'effets indésirables pour l'enfant, en rapport avec le traitement par le méthotrexate. C'est pourquoi les patients en âge de procréer (femmes et hommes) doivent pratiquer une contraception efficace pendant le traitement par Methotrexat Accord ainsi que pendant encore au moins six mois ultérieurs (voir «Mises en garde et précautions»).
Le méthotrexate est contre-indiqué pendant la grossesse pour les indications non oncologiques (voir «Contre-indications»). Si une grossesse survient au cours du traitement par le méthotrexate et jusqu'à 6 mois après, une consultation médicale sur le risque d'effets délétères pour l'enfant, en rapport avec le traitement, doit avoir lieu. En outre, des examens échographiques devraient être pratiqués afin de confirmer l'évolution normale du fœtus.
Des expérimentations animales ont montré une toxicité sur la reproduction, en particulier au premier trimestre (voir «Données précliniques»). Le méthotrexate s'est avéré tératogène chez l'humain; on a observé qu'il provoquait la mort du fœtus, des fausses couches et/ou des malformations fœtales (notamment cranio-faciales, cardiovasculaires et touchant le système nerveux central et les extremités).
Le méthotrexate est un puissant tératogène humain qui augmente le risque d'avortements spontanés, de troubles de la croissance intra-utérine et de malformations congénitales en cas d'exposition pendant la grossesse.
- Des avortements spontanés ont été observés chez 42.5% des femmes enceintes sous méthotrexate à de faibles doses (moins de 30 mg/semaine). Chez les patientes présentant une pathologie similaire et traitées par d'autres médicaments que le méthotrexate, le taux d'avortements rapportés était de 22.5%.
- Des malformations congénitales graves sont survenues pour 6.6% des naissances vivantes issues de femmes qui avaient reçu du méthotrexate à faible dose (moins de 30 mg/semaine) pendant la grossesse. Chez les patientes présentant une pathologie similaire et traitées par d'autres médicaments que le méthotrexate, environ 4% des naissances vivantes ont été touchées.
Il n'existe pas suffisamment de données concernant l'exposition à des doses plus élevées de méthotrexate (doses supérieures à 30 mg/semaine) pendant la grossesse, mais il faut s'attendre à des taux supérieurs d'avortements spontanés et de malformations congénitales. Lorsque le méthotrexate avait été arrêté avant la conception, des grossesses normales ont été rapportées.
Allaitement:
Le méthotrexate est excrété dans le lait à de telles concentrations qu'il y a un risque pour le nourrisson. Il faut donc arrêter l'allaitement avant le traitement et ne pas allaiter pendant le traitement.
Fertilité
Le méthotrexate altère la spermatogenèse et l'ovogenèse, et peut diminuer la fertilité. Il a été rapporté que le méthotrexate administré chez l'humain provoquait une oligospermie, des troubles menstruels et une aménorrhée. Ces effets semblent réversibles après l'arrêt du traitement.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Des symptômes du système nerveux central tels que fatigue et confusion peuvent survenir pendant le traitement. Methotrexat Accord a une influence faible ou modérée sur l'aptitude à la conduite ou l'utilisation de machines.
Effets indésirables
Les effets indésirables les plus fréquents sont des symptômes gastro-intestinaux, une atteinte de la fonction hépatique et du système hématopoïétique.
La survenue et le degré de sévérité des effets indésirables dépendent de la posologie et de la fréquence d'utilisation de Methotrexat Accord. Mais comme des effets indésirables sévères peuvent aussi survenir à une faible posologie, une surveillance médicale régulière à de brefs intervalles est indispensable.
Les indications suivantes sont utilisées pour classifier les indications de fréquence des effets indésirables: très fréquents (≥1/10), fréquents (≥1/100, <1/10), occasionnels (≥1/1000, <1/100), rares (≥1/10'000, <1/1000) et très rares (<1/10'000), fréquence inconnue (ne peut être estimée sur la base des données disponibles).
Tumeurs bénignes, malignes et non précisées (kystes et polypes inclus)
Très rares: des rapports font état de la survenue de lymphomes ayant régressé dans certains cas après l'arrêt du traitement par le méthotrexate. Une étude récente n'a pas révélé d'incidence accrue de lymphomes lors d'un traitement par le méthotrexate.
Affections hématologiques et du système lymphatique
Fréquents: leucocytopénie, anémie, thrombocytopénie.
Occasionnels: pancytopénie.
Très rares: agranulocytose, évolutions sévères de dépression médullaire.
Affections du système nerveux
Fréquents: céphalées, fatigue, obnubilation.
Occasionnels: vertiges, confusion, dépressions.
Très rares: troubles visuels, douleurs, faiblesse musculaire ou paresthésies dans les extrémités, modifications du goût (goût métallique), convulsions, méningisme, paralysies.
Fréquence inconnue: encéphalopathie/leucoencéphalopathie.
Affections respiratoires, thoraciques et médiastinales
Fréquents: alvéolite/pneumonie interstitielles. Les symptômes évoquant des atteintes pulmonaires potentiellement sévères (pneumonie interstitielle) sont: toux irritative sèche, essoufflement et fièvre.
Rares: fibrose pulmonaire, pneumonie à Pneumocystis-carinii, essoufflement et asthme bronchique.
Fréquence inconnue: hémorragie alvéolaire pulmonaire.
Affections gastro-intestinales
Très fréquents: stomatite (20-30%), dyspepsie (jusqu'à 60%), nausées (60-70%), inappétence (60-70%).
Fréquents: ulcérations de la muqueuse buccale, diarrhée.
Occasionnels: pharyngite, entérite, pancréatite, vomissements.
Rares: ulcères gastro-intestinaux.
Très rares: hématémèse, hématorrhée.
Affections hépatobiliaires
Très fréquents: élévation des transaminases (jusqu'à 70%).
Occasionnels: cirrhose hépatique, fibrose hépatique, stéatose hépatique.
Affections de la peau et du tissu sous-cutané
Fréquents: exanthèmes, érythèmes, prurit.
Occasionnels: photosensibilité, chute des cheveux, augmentation des nodules rhumatoïdes, zona, vascularite, éruptions cutanées herpétiformes, urticaire.
Rares: pigmentation accrue.
Très rares: syndrome de Stevens-Johnson, nécrolyse toxique épidermique (syndrome de Lyell), pigmentation accrue des ongles, paronychie aiguë.
Affections musculosquelettiques et du tissu conjonctif
Occasionnels: arthralgies, myalgies et ostéoporose.
Affections du rein et des voies urinaires
Occasionnels: inflammations et ulcérations au niveau de la vessie, trouble de la fonction rénale, troubles de la vidange vésicale.
Rares: insuffisance rénale, oligurie, anurie, troubles électrolytiques.
Affections des organes de reproduction et du sein
Occasionnels: inflammations et ulcérations au niveau du vagin.
Très rares: perte de la libido, impuissance, oligospermie, troubles menstruels, pertes vaginales.
Troubles généraux et anomalies au site d'administration
Rares: réactions allergiques, choc anaphylactique, vascularite allergique, fièvre, conjonctivite, infection, septicémie, troubles de la cicatrisation des plaies, épanchement pleural, épanchement péricardique, tamponnade péricardique, hypogammaglobulinémie.
En cas d'utilisation intramusculaire du méthotrexate, des effets secondaires locaux (sensation de brûlures) ou des lésions (formation d'abcès stérile, perte de tissu adipeux) peuvent se produire au niveau du site d'injection.
Surdosage
a) Symptômes d'un surdosage
Les effets secondaires toxiques du méthotrexate touchent essentiellement le système hématopoïétique.
b) Mesures thérapeutiques en cas de surdosage
On dispose du folinate de calcium comme antidote spécifique pour neutraliser les effets secondaires toxiques du méthotrexate.
En cas de surdosage accidentel, donner dans l'heure qui suit une dose de folinate de calcium, identique ou supérieure à la dose de méthotrexate nocive, par voie intraveineuse ou intramusculaire et répéter la dose jusqu'à ce que la concentration sérique de méthotrexate soit inférieure à 10-7 mol/l.
En cas de surdosage massif, essayer de minimiser la précipitation du méthotrexate et/ou de ses métabolites dans les tubules rénaux, par une hydratation et une alcalinisation des urines. Aucune preuve n'a été apportée que l'hémodialyse ou la dialyse péritonéale améliorent l'élimination du méthotrexate. Une clairance effective du méthotrexate a été rapportée avec une hémodialyse intermittente aiguë avec un appareil de dialyse à haut débit.
Propriétés/Effets
Code ATC: L04AX03
Mécanisme d'action
Le méthotrexate, un antagoniste de l'acide folique, appartient à la classe de substances cytotoxiques appelées antimétabolites. Il agit par inhibition compétitive de l'enzyme dihydrofolate réductase et inhibe ainsi la synthèse de l'ADN. À ce jour, on ne sait pas si l'efficacité du méthotrexate dans le traitement du psoriasis, de l'arthrite psoriasique, de la polyarthrite rhumatoïde et de la maladie de Crohn repose sur un effet anti-inflammatoire ou sur un effet immunosuppresseur, nidans quelle mesure les concentrations extracellulaires d'adénosine contribuent à ces effets.
Les effets indésirables observés dans le cadre des études portant sur la maladie de Crohn et l'utilisation du méthotrexate à des doses cumulatives ne présentent pas de modification du profil de sécurité par rapport au profil déjà connu pour le méthotrexate. C'est pourquoi, dans le cas de la maladie de Crohn, le méthotrexate doit être utilisé avec la même prudence que dans le cas d'autres indications rhumatismales et non rhumatismales du méthotrexate (voir les rubriques «Mises en garde et précautions» ainsi que «Grossesse/Allaitement»).
Pharmacocinétique
Distribution
La liaison aux protéines plasmatiques du méthotrexate est d'environ 50%. Lors de la distribution, il se produit une accumulation surtout dans le foie, les reins et la rate sous forme de polyglutamates qui peuvent être retenus en partie pendant des semaines voire des mois. Le méthotrexate passe en faibles quantités dans le liquide céphalo-rachidien. La demi-vie terminale s'élève en moyenne à 6-7 heures et présente une grande fourchette de fluctuation (3-17 heures). Chez les patients présentant un troisième espace de distribution (épanchement pleural, ascite), la demi-vie peut être jusqu'à quatre fois plus élevée.
Métabolisme
Environ 10% de la dose de méthotrexate utilisée sont métabolisés dans le foie. Le métabolite principal est le 7-hydroxyméthotrexate.
Elimination
L'excrétion est essentiellement rénale et se fait sous forme inchangée par filtration glomérulaire et sécrétion active dans le tubule proximal.
Environ 5-20% du méthotrexate et 1-5% du 7-hydroxyméthotrexate sont éliminés par voie biliaire. Il existe un cycle entéro-hépatique marqué.
Cinétique pour certains groupes de patients
L'élimination est nettement retardée en cas de diminution de la fonction rénale. Une diminution de l'excrétion n'est actuellement pas connue en cas d'insuffisance hépatique.
Données précliniques
Comme aucune étude conventionnelle portant sur la carcinogénicité n'a été réalisée et que les données issues des études sur la toxicité chronique qui ont été conduites avec des rongeurs sont incohérentes, le méthotrexate est considéré comme non classifiable en ce qui concerne sa carcinogénicité pour l'être humain.
Remarques particulières
Incompatibilités
La compatibilité avec d'autres produits parentéraux n'a pas été étudiée. Il est recommandé de ne pas mélanger ce médicament avec d'autres médicaments ou solvants.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
Conserver à température ambiante (<30 °C). Conserver le récipient dans son carton d'origine, à l'abri de la lumière.
Remarques concernant la manipulation
Le mode de manipulation et d'élimination doit correspondre à la manipulation et à l'élimination des autres préparations cytotoxiques. Pendant la grossesse, le personnel médical spécialisé féminin ne doit pas manipuler ou administrer Methotrexat Accord.
Le méthotrexate ne doit pas être mis au contact de la peau ou des muqueuses. En cas de contamination, les zones touchées doivent être immédiatement rincées avec une quantité suffisante d'eau.
A usage unique exclusivement. Jeter toute solution non utilisée.
Remarques concernant l'administration sous-cutanée de la solution injectable Methotrexat Accord en seringue prête à l'emploi avec système de sécurité de protection de l'aiguille:
- Les sites d'injection les plus appropriés sont les suivants:
- la partie supérieure de la cuisse,
- l'abdomen, à l'exception de la région autour du nombril.
- Nettoyer la région du site d'injection choisi.
- Retirer le capuchon protecteur en plastique de la seringue en tirant droit.
- Former un pli cutané en pinçant légèrement la peau au niveau du site d'injection.
- La peau doit rester pincée jusqu'au retrait de la seringue après l'injection.
- Insérer complètement l'aiguille dans la peau suivant un angle de 90 degrés.
- Appuyer lentement sur le piston et injecter le liquide sous la peau.
- Lorsque le piston de la seringue est complètement enfoncé, le système de protection de l'aiguille s'active.
- Tenez la seringue immobile et retirez lentement le pouce de la tête du piston.
- Le piston remonte avec le pouce et le ressort ôter automatiquement l'aiguille du site d'injection pour la placer dans le système de sécurité.
Numéro d’autorisation
66780 (Swissmedic).
Titulaire de l’autorisation
Accord Healthcare AG, 4103 Bottmingen.
Mise à jour de l’information
Juillet 2019.
Відгуки (0)

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.



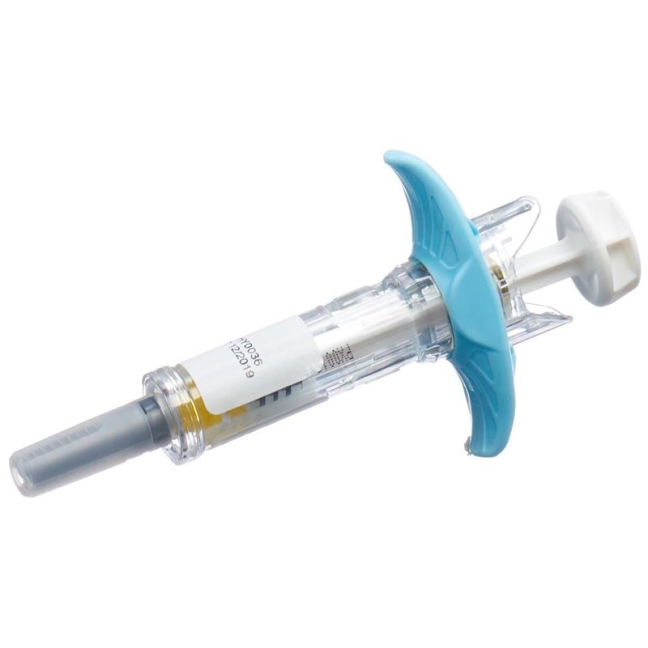


 Deutsch
Deutsch French
French Italian
Italian























