Правастатин Зентіва таблетки 40 мг 30 шт
Pravastatin Zentiva Tabl 40 mg 30 Stk
-
7526.55 RUB
При оплате криптовалютой:
Ваша прибыль 752.65 RUB / 8.88 USDT
- Наявність: Немає в наявності
- Виробник: HELVEPHARM AG
- Модель: 7769721
- ATC-код C10AA03
- EAN 7680575350095
Опис
Was ist Pravastatin Zentiva und wann wird es angewendet?
Pravastatin Zentiva mit dem Wirkstoff Pravastatin ist ein Arzneimittel, welches zur Klasse der Statine (auch HMG-CoA-Reduktaseinhibitoren genannt) gehört.
Pravastatin Zentiva wird angewendet:
Bei Erwachsenen
- Zur Behandlung erhöhter Blutfettwerte (Cholesterin, Triglyzeride), von Apolipoprotein B und deren Risiken auf das Herz-Kreislauf-System.
- Zur Verminderung des Risikos gefährlicher Herz-Kreislaufereignisse, eines Hirnschlages und der Notwendigkeit einer Hospitalisierung bei Patienten mit durchschnittlichen Serumcholesterinwerten nach durchgemachtem Herzinfarkt oder vorangegangener Hospitalisation aufgrund von instabiler Angina pectoris.
Bei Kindern (8–13 Jahre) und Jugendlichen (14–18 Jahre)
- Zur Behandlung der heterozygoten familiären Hypercholesterinämie (einer Form von erblich bedingtem erhöhtem Cholesteringehalt im Blut).
Die Wirkung von Pravastatin Zentiva beruht in erster Linie auf der Hemmung der Cholesterinbildung im Körper.
Pravastatin Zentiva ist in zwei Dosierungsstärken (Tabletten zu 20 mg und 40 mg) erhältlich und darf nur auf Verschreibung des Arztes oder der Ärztin angewendet werden.
Was sollte dazu beachtet werden?
Vor einer Therapie mit Pravastatin Zentiva Tabletten sollten die Blutfettwerte bestimmt und andere Krankheiten bzw. Funktionsstörungen (z.B. Schilddrüsenunterfunktion), die ebenfalls zu einer Beeinträchtigung des Fettstoffwechsels führen können, als Ursache ausgeschlossen werden.
Die Behandlung mit Pravastatin Zentiva soll durch eine cholesterinarme Diät unterstützt werden.
Da sich bei gewissen Patienten die Leberwerte unter Pravastatin Zentiva veränderten oder auch Muskelschmerzen auftraten, wird Ihr Arzt oder Ihre Ärztin diese Werte in bestimmten Abständen durch ein Labor bestimmen lassen (siehe auch «Wann ist bei der Einnahme von Pravastatin Zentiva Vorsicht geboten?»).
Wann darf Pravastatin Zentiva nicht eingenommen werden?
Bei Überempfindlichkeit gegenüber einem der Bestandteile der Tabletten, bei aktiven Lebererkrankungen und bei erhöhten Leberenzymwerten, deren Ursache nicht genau bekannt ist, bei Gallestauungen und Muskelerkrankungen (Myopathien), in der Schwangerschaft und Stillzeit darf Pravastatin Zentiva nicht angewendet werden.
Kinder unter 8 Jahren sollen Pravastatin Zentiva nicht einnehmen.
Wann ist bei der Einnahme von Pravastatin Zentiva Vorsicht geboten?
Dieses Arzneimittel kann die Reaktionsfähigkeit, die Fahrtüchtigkeit und die Fähigkeit, Werkzeuge oder Maschinen zu bedienen, beeinträchtigen.
Pravastatin Zentiva sollte im Allgemeinen bei Lebererkrankungen in der Vorgeschichte und bei Patienten mit hohem Alkoholkonsum nur mit Vorsicht eingesetzt werden.
Mit Arzneimitteln aus der Klasse der Statine wurden zum Teil schwerwiegende Nebenwirkungen im Bereich der Muskeln (Myopathien, Rhabdomyolysen) beobachtet.
Bei der Rhabdomyolyse handelt es sich um eine schwerwiegende, möglicherweise lebensbedrohliche Nebenwirkung. Patienten mit speziellen Risikofaktoren dürfen ein Medikament aus der Klasse der Statine nur mit ärztlicher Zustimmung anwenden, da in diesem Fall vor Behandlungsbeginn ev. spezielle ärztliche Massnahmen erforderlich sind.
Informieren Sie vor der Behandlung mit Pravastatin Zentiva Ihren Arzt bzw. Ihre Ärztin, wenn Sie:
- eine eingeschränkte Nieren- oder Schilddrüsenfunktion haben.
- eine bestehende Muskelerkrankung haben oder bereits einmal hatten (z.B. erblich bedingt oder unter früherer Behandlung mit Statinen bzw. anderen Arzneimitteln) oder wenn in Ihrer Familiengeschichte Muskelerkrankungen bekannt sind.
- viel Alkohol konsumieren.
- älter als 65 Jahre sind.
Unter Behandlung mit Pravastatin wurden Muskelverspannungen- und Einrisse einschliesslich Muskelrissen berichtet.
Falls während der Behandlung mit Pravastatin Zentiva unerklärliche Muskelbeschwerden wie z.B. Muskelschmerzen, -schwäche oder- krämpfe auftreten, ist sofort Ihr Arzt bzw. Ihre Ärztin zu informieren. Das Risiko solcher Nebenwirkungen kann erhöht sein, wenn der Patient Begleiterkrankungen hat (insbesondere bei Infektionskrankheiten oder bei hohem Alkoholkonsum) oder wenn Pravastatin Zentiva zusammen mit bestimmten anderen Arzneimitteln (z.B. Statinen oder Fibraten) eingenommen wird.
Bei der seltenen sogenannten homozygoten (reinerbigen) familiären Hypercholesterinämie ist eine geringere Wirkung von Arzneimitteln dieser Stoffklasse zu erwarten. Entsprechende klinische Erfahrungen mit Pravastatin Zentiva liegen bisher nicht vor.
Falls Sie sich einer Transplantation unterziehen mussten oder wenn Sie unter einer Autoimmunkrankheit leiden und deshalb mit dem Wirkstoff Ciclosporin behandelt werden, sollten Sie dies umgehend Ihrem Arzt oder Ihrer Ärztin mitteilen.
Bei einigen Arzneimitteln aus dieser Klasse, einschliesslich Pravastatin Zentiva, wurde in Einzelfällen, insbesondere bei Langzeitbehandlung, über eine Lungenerkrankung berichtet, welche durch Atemnot, trockenen Husten und eine Verschlechterung der allgemeinen Gesundheit (Müdigkeit/Erschöpfung, Gewichtsverlust und Fieber) gekennzeichnet ist. Wenn Sie diese Symptome bemerken, so wenden Sie Sich unverzüglich an Ihren Arzt bzw. Ihre Ärztin.
Da unter Behandlung mit Arzneimitteln, die das Blutfett senken, einzelne Fälle von lebensbedrohlichen Wechselwirkungen mit anderen Arzneimitteln aufgetreten sind, darf Pravastatin Zentiva nicht gleichzeitig mit innerlich angewendeten Fusidinsäure-Präparaten eingenommen werden.
Dieses Arzneimittel enthält Lactose (Milchzucker). Bitte nehmen Sie Pravastatin Zentiva erst nach Rücksprache mit Ihrem Artz ein, wenn Ihnen bekannt ist, dass Sie unter einer Zuckerunverträglichkeit leiden.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Tablette, d.h. es ist nahezu «natriumfrei».
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbstgekaufte!) einnehmen oder äusserlich anwenden.
Darf Pravastatin Zentiva während einer Schwangerschaft oder in der Stillzeit eingenommen werden?
Pravastatin Zentiva darf während einer Schwangerschaft oder in der Stillzeit nicht eingenommen werden.
Bei gebärfähigen Patientinnen ist während der Pravastatin Zentiva-Behandlung eine zuverlässige Schwangerschaftsverhütung erforderlich.
Patientinnen sollen über mögliche Risiken und geeignete Verhütungsmassnahmen aufgeklärt werden.
Falls Sie dennoch schwanger werden, müssen Sie die Behandlung mit Pravastatin Zentiva sofort abbrechen und die Situation mit Ihrem Arzt oder Ihrer Ärztin besprechen.
Wie verwenden Sie Pravastatin Zentiva?
Dosierung bei Erwachsenen
Die Dosierung von Pravastatin Zentiva Tabletten wird vom Arzt oder der Ärztin bestimmt. Die Anfangs- und Erhaltungsdosis liegt üblicherweise zwischen 10 und 40 mg pro Tag. Pravastatin Zentiva wird abends vor dem Schlafengehen als Einzeldosis, unabhängig von einer Mahlzeit, angewendet. Die Tabletten sollen unzerkaut mit Flüssigkeit eingenommen werden.
Nach 4 Wochen wird der Arzt oder die Ärztin, abhängig von den Blutfettwerten, die Dosierung unter Umständen ändern.
Zur Verminderung des Risikos gefährlicher Herz-Kreislaufereignisse nach durchgemachtem Herzinfarkt beträgt die Dosierung zu Beginn meist 40 mg täglich. Abhängig von den Blutfettwerten wird Ihr Arzt oder Ihre Ärztin die Dosierung unter Umständen ändern.
Dosierung bei Kindern
Über die Dosierung bei Kindern ab 8 Jahren entscheidet der Arzt oder die Ärztin.
Hinweis
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Medikament wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Anwendungshinweise
Die Behandlungsdauer mit Pravastatin Zentiva richtet sich nach den Bedürfnissen des Patienten und ist von der Verträglichkeit des Arzneimittels abhängig.
In bestimmten Fällen kann der Arzt oder die Ärztin zusätzlich ein gallensäurebindendes Arzneimittel (Colestid, Quantalan, Ipocol) verordnen. Bei einer solchen Kombination soll Pravastatin Zentiva 1 Stunde vor oder mehr als 4 Stunden nach dem anderen Präparat eingenommen werden.
Wenn Sie ein Arzneimittel gegen überschüssige Magensäure (Antazidum) benötigen, sollte dies 1 Stunde vor der Einnahme von Pravastatin Zentiva erfolgen.
Welche Nebenwirkungen kann Pravastatin Zentiva haben?
Folgende Nebenwirkungen können bei der Einnahme von Pravastatin Zentiva auftreten:
Magen-Darmbeschwerden, Muskelverspannungen- und Einrisse einschliesslich Muskelrissen, Muskelschmerzen, -krämpfe oder -schwäche, trockene Haut, Hautausschlag (meist leichter Natur) und -jucken, Veränderungen im Bereich der Kopfhaut und Haare (inkl. Haarausfall), Gelenkschmerzen, Sensibilitätsstörungen (Kribbeln, Schmerzen, Taubheitsgefühl in Händen und Füssen), Schwindel, Benommenheit, Schlafstörungen, Schmerzen in der Brust- und Herzgegend, Störungen beim Harnlassen, Sehstörungen, Müdigkeit, sexuelle Funktionsstörungen.
In Einzelfällen können Nebenwirkungen wie z.B. Schwellungen (Angioödeme), Lichtempfindlichkeitsreaktion, Hautveränderungen im Gesichts- und Halsbereich (Rötungen und Schwellungen), Blutdruckabfall, rötliche flechtenartige Papeln im Bereich des Gesichts oder der Gelenke, Gelbsucht/Hepatitis, Leberprobleme, Abweichungen der Leberfunktionstests, Albträume, Lungenerkrankung gekennzeichnet durch Atemnot (Dyspnoe), trockenen Husten und eine Verschlechterung der allgemeinen Gesundheit (Müdigkeit/Erschöpfung, Gewichtsverlust und Fieber), Entzündung der Bauchspeicheldrüse (Pankreatitis) und Beschwerden im Sehnenbereich, insbesondere Sehnenentzündung und Sehnenriss, sowie Muskelerkrankungen und Verminderung der Plättchenzahl im Blut auftreten.
Wenn Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind, sollten Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin informieren.
Was ist ferner zu beachten?
Haltbarkeit/Aufbewahrung
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
In der Originalverpackung, bei Raumtemperatur (15−25 °C), vor Licht und Feuchtigkeit geschützt und ausser Reichweite von Kindern lagern.
Allfällige nach Ende der Behandlung verbleibende Tabletten oder Tabletten mit abgelaufenem Verfalldatum bitte zur fachgerechten Entsorgung Ihrer Verkaufsstelle (Arzt oder Apotheker bzw. Ärztin oder Apothekerin) übergeben.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Pravastatin Zentiva enthalten?
Eine Tablette Pravastatin Zentiva (mit Bruchrille, teilbar) enthält:
Wirkstoffe
20 mg bzw. 40 mg Pravastatin-Natrium.
Hilfsstoffe
Microcrystalline Cellulose, Lactose Monohydrat, Natriummonohydrogenphopshat, Croscarmelose-Natrium, Natriumdodectylsulfat, Povidon, Eisenoxide, hochdisperses Siliciumoxid, Magnesiumstereat.
Zulassungsnummer
57535 (Swissmedic)
Wo erhalten Sie Pravastatin Zentiva? Welche Packungen sind erhältlich?
In Apotheken, nur gegen ärztliche Verschreibung.
Packungen
Pravastatin Zentiva 20 mg: 30 und 100 Tabletten (mit Bruchrille, teilbar).
Pravastatin Zentiva 40 mg: 30 und 100 Tabletten (mit Bruchrille, teilbar).
Zulassungsinhaberin
Helvepharm AG, Frauenfeld
Diese Packungsbeilage wurde im März 2020 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Qu’est-ce que Pravastatin Zentiva et quand doit-il être utilisé?
Pravastatin Zentiva, un médicament contenant comme principe actif la pravastatine, appartient à la classe des statines (aussi appelées inhibiteurs de la HMG-CoA réductase).
Pravastatin Zentiva s'utilise:
Chez les adultes
- Dans le traitement d'un excès de lipides sanguins (cholestérol, triglycérides), d'apolipoprotéine B et de leurs risques sur le système cardiovasculaire.
- Pour la diminution du risque d'événements cardiovasculaires dangereux, du risque d'un accident cérébral vasculaire ainsi que de la nécessité d'une hospitalisation chez les patients qui présentent des valeurs moyennes de cholestérol après avoir subi un infarctus du myocarde ou après une hospitalisation suite à l'angor instable.
Chez les enfants (8 à 13 ans) et les adolescents (14 à 18 ans)
- Dans le traitement de l'hypercholestérolémie hétérozygote familiale (une forme héréditaire d'élévation de la teneur en cholestérol du sang).
L'effet de Pravastatin Zentiva est dû principalement à l'inhibition de la formation du cholestérol dans le corps.
Pravastatin Zentiva est disponible en deux dosages (comprimés de 20 mg et de 40 mg) et ne doit être utilisé que sur prescription du médecin.
De quoi faut-il tenir compte en dehors du traitement?
Avant le traitement par les comprimés Pravastatin Zentiva le médecin déterminera les taux de lipides sanguins du patient et vérifiera l'absence d'autres maladies ou dysfonctionnements (p.ex. une sécrétion thyroïdienne insuffisante) qui pourraient également affecter le métabolisme lipidique.
Un régime pauvre en cholestérol favorisera le traitement par Pravastatin Zentiva.
Le traitement par Pravastatin Zentiva pouvant entraîner chez certains patients une modification des valeurs hépatiques ou provoquer des douleurs musculaires, votre médecin fera contrôler ces valeurs périodiquement par un laboratoire (voir aussi «Quelles sont les précautions à observer lors de la prise de Pravastatin Zentiva?»).
Quand Pravastatin Zentiva ne doit-il pas être pris?
Pravastatin Zentiva ne doit pas être utilisé lors d'hypersensibilité à l'un des composants des comprimés, lors d'une maladie hépatique active ou de taux élevés d'enzymes hépatiques dont la cause n'est pas exactement connue, lors de congestion de la vésicule biliaire, de maladies musculaires (myopathies), durant la grossesse et la période d'allaitement.
Les enfants âgés de moins de 8 ans ne devraient pas prendre Pravastatin Zentiva.
Quelles sont les précautions à observer lors de la prise de Pravastatin Zentiva?
Ce médicament pourrait affecter les réactions, l'aptitude à la conduite et l'aptitude à utiliser des outils ou des machines.
En général, Pravastatin Zentiva sera administré prudemment aux patients avec des antécédents de maladie hépatique et aux personnes qui consomment beaucoup d'alcool.
Avec des médicaments de la classe des statines on a observé des effets indésirables, parfois sévères, au niveau des muscles (myopathies, rhabdomyolyses).
La rhabdomyolyse est un effet indésirable sévère qui pourrait éventuellement mettre la vie du patient en danger. Les patients présentant des facteurs de risque particuliers ne devraient prendre un médicament de la classe des statines qu'avec l'assentiment du médecin parce que des mesures médicales spécifiques pourraient être nécessaires avant le début du traitement.
Veuillez informer votre médecin avant le traitement par Pravastatin Zentiva si vous:
- souffrez d'une insuffisance rénale ou thyroïdienne.
- souffrez ou avez déjà une fois souffert d'une maladie musculaire (p.ex. par disposition héréditaire ou par prétraitement avec une statine ou un autre médicament) ou si des maladies musculaires sont connues dans l'histoire de votre famille.
- consommez beaucoup d'alcool.
- êtes âgés de plus de 65 ans.
Des contractures et des fissurations musculaires, y compris des déchirures musculaires, ont été signalées sous traitement par pravastatine.
Si vous observez des troubles musculaires inexplicables comme p.ex. des douleurs musculaires, une faiblesse musculaire ou des crampes musculaires durant le traitement par Pravastatin Zentiva, veuillez en informer immédiatement votre médecin. Le risque de tels effets indésirables pourrait être accru lorsque le patient présente des maladies concomitantes (particulièrement lors d'une infection ou lors de forte consommation d'alcool) ou lorsque le patient prend Pravastatin Zentiva simultanément avec certains autres médicaments (p.ex. statines ou fibrates).
Aux rares cas où le patient présenterait une hypercholestérolémie familiale homozygote (taux élevé de cholestérol dans le sang), le traitement par un médicament de cette classe serait probablement moins efficace; à ce jour il n'y a pas de données cliniques correspondantes avec Pravastatin Zentiva.
Si vous avez subi une transplantation ou si vous souffrez d'une maladie auto-immune pour laquelle vous êtes sous traitement par un médicament contenant comme principe actif la ciclosporine, veuillez en informer immédiatement votre médecin.
Avec certains médicaments de cette catégorie, dont Pravastatin Zentiva, des cas isolés d'affections pulmonaires ont été signalés, en particulier en cas de traitement de longue durée, lesquels se caractérisent par une insuffisance respiratoire, une toux sèche et une détérioration de l'état de santé général (fatigue/épuisement, perte de poids et fièvre). Si vous remarquez de tels symptômes, consultez immédiatement votre médecin.
Etant donné que des interactions potentiellement fatales ont été observées dans des cas isolés de traitement par des médicaments qui abaissent le taux de cholestérol, Pravastatin Zentiva ne doit pas être administré en même temps que des préparations à base d'acide fusidique à usage interne.
Ce médicament contiennent du lactose. Si votre médecin vous a informé(e) d'une intolérance à certains sucres, contactez-le avant de prendre Pravastatin Zentiva.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé, c.-à-d. qu'il est essentiellement «sans sodium».
Veuillez informer votre médecin ou votre pharmacien si
- vous souffrez d'une autre maladie,
- vous êtes allergique ou
- vous prenez déjà d'autres médicaments en usage interne ou externe (même en automédication!).
Pravastatin Zentiva peut-il être pris pendant la grossesse ou l’allaitement?
Pravastatin Zentiva ne doit pas être utilisé durant la grossesse ou l'allaitement.
Les femmes en âge de procréer doivent prendre des mesures de contraception fiables durant le traitement par Pravastatin Zentiva.
Les patientes doivent être informées des risques possibles et des mesures de contraception adéquates.
En cas de grossesse accidentelle, il sera nécessaire d'arrêter immédiatement le traitement par Pravastatin Zentiva et de demander l'avis de votre médecin.
Comment utiliser Pravastatin Zentiva?
Posologie chez les adultes
La posologie des comprimés Pravastatin Zentiva est déterminée par votre médecin. La posologie initiale et la posologie de maintien sont en général de 10 à 40 mg par jour. Pravastatin Zentiva est appliqué en une seule prise le soir avant le coucher et indépendamment d'un repas. Les comprimés sont avalés, sans les mâcher, avec du liquide.
Après 4 semaines, le médecin pourrait modifier la posologie en fonction des taux de lipides dans le sang.
Afin de diminuer le risque d'événements cardiovasculaires dangereux après un infarctus du myocarde, la posologie initiale du traitement sera le plus souvent de 40 mg par jour. Votre médecin pourrait modifier la posologie en fonction des taux de lipides sanguins.
Posologie chez les enfants
La posologie chez les enfants âgés de 8 ans et plus sera déterminée par le médecin.
Remarque
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou pharmacien si vous estimez que l'effet du médicament est trop faible ou au contraire trop fort.
Mode d'emploi
La durée du traitement par Pravastatin Zentiva dépend des besoins individuels du patient et de la tolérance du médicament par le patient.
Dans certains cas le médecin prescrira en complément un médicament qui lie les acides biliaires (Colestid, Quantalan, Ipocol). Lors d'une telle association, Pravastatin Zentiva sera administré 1 heure avant ou plus de 4 heures après l'application de l'autre médicament.
Si vous êtes sous traitement par un médicament contre l'hyperacidité gastrique (antacide), prenez-le une heure avant l'administration de Pravastatin Zentiva.
Quels effets secondaires Pravastatin Zentiva peut-il provoquer?
La prise de Pravastatin Zentiva peut provoquer les effets secondaires suivants:
troubles gastro-intestinaux, contractures et fissurations musculaires, y compris des déchirures musculaires, douleurs et crampes musculaires ou faiblesse musculaire, sécheresse de la peau, éruptions cutanées (le plus souvent légères) et prurit, altérations au niveau du cuir chevelu et des cheveux (y compris chute des cheveux), arthralgie, troubles de la sensibilité (fourmillements, douleurs, engourdissement au niveau des pieds ou des mains), vertige, obnubilation, troubles du sommeil, douleurs dans la cage thoracique et dans la région du cœur, troubles de la miction, affection de l'acuité visuelle, fatigue, troubles de la fonction sexuelle.
Dans des cas isolés pourraient survenir des effets indésirables comme p.ex. gonflements (œdème angioneurotique), sensibilité à la lumière, modifications cutanées au niveau du visage et du cou (rougeurs et gonflements), chute de la pression sanguine, papules lichénoïdes rouges au niveau du visage ou des articulations, jaunisse/hépatite, troubles hépatiques, anomalies dans les tests de la fonction hépatique, cauchemars, affections pulmonaires caractérisées par une insuffisance respiratoire (dyspnée), toux sèche et une détérioration de l'état de santé général (fatigue/épuisement, perte de poids et fièvre), inflammation du pancréas (pancréatite) et problèmes du tendon, en particulier tendinite et rupture de tendon, maladies musculaires et abaissement de la numération des plaquettes sanguines.
Si vous remarquez d'autres effets secondaires qui ne sont pas mentionnés dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
À quoi faut-il encore faire attention?
Conservation/Stockage
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Conserver dans l'emballage original, à température ambiante (15–25 °C), à l'abri de la lumière et de l'humidité et hors de la portée des enfants.
Rapportez à votre point de vente (médecin ou pharmacien) tous comprimés restants à la fin du traitement ou tous comprimés périmés, afin que ceux-ci puissent être éliminés de façon appropriée.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Pravastatin Zentiva?
1 comprimé Pravastatin Zentiva (avec sillon de sécabilité, sécable) contient:
Principes actifs
20 mg resp. 40 mg de pravastatine sodium.
Excipients
Cellulose microcristalline, lactose monohydraté, phosphate disodique, croscarmellose sodique, sodium (laurisulfate de), povidone, oxyde de fer, silice colloïdale, magnésium (stéarate de).
Numéro d’autorisation
57535 (Swissmedic)
Où obtenez-vous Pravastatin Zentiva? Quels sont les emballages à disposition sur le marché?
En pharmacie, seulement sur ordonnance médicale.
Présentations
Pravastatin Zentiva 20 mg: 30 et 100 comprimés (avec sillon de sécabilité, sécables).
Pravastatin Zentiva 40 mg: 30 et 100 comprimés (avec sillon de sécabilité, sécables).
Titulaire de l’autorisation
Helvepharm AG, Frauenfeld
Cette notice d'emballage a été vérifiée pour la dernière fois en mars 2020 par l'autorité de contrôle des médicaments (Swissmedic).
Che cos’è Pravastatin Zentiva e quando si usa?
Pravastatin Zentiva contiene il principio attivo pravastatina ed è un medicamento appartenente alla classe delle statine (chiamate anche inibitori della HMG-CoA riduttasi).
Pravastatin Zentiva viene usato:
Negli adulti
- Per abbassare valori elevati di lipidi (colesterolo e trigliceridi) e di apolipoproteina B nel sangue, nonché per ridurre i conseguenti rischi per il sistema cardiovascolare.
- Per ridurre il rischio di eventi cardiovascolari pericolosi, ictus cerebrale e necessità di ospedalizzazione in pazienti con valori di colesterolo sierico nella media che hanno subito in precedenza un infarto cardiaco o un'ospedalizzazione a causa di angina pectoris instabile.
In bambini (8−13 anni) e adolescenti (14−18 anni)
- Per il trattamento dell'ipercolesterolemia familiare eterozigote (una forma di aumentato livello di colesterolo nel sangue di origine ereditaria).
L'effetto di Pravastatin Zentiva si basa soprattutto sull'inibizione della formazione di colesterolo nel corpo.
Pravastatin Zentiva è disponibile in due dosaggi (compresse da 20 mg e 40 mg) e può essere impiegato solo su prescrizione medica.
Di che cosa occorre inoltre tener conto durante il trattamento?
Prima di iniziare una terapia con Pravastatin Zentiva compresse, si devono determinare i valori dei lipidi nel sangue ed escludere altre malattie o disturbi della funzione di organi o apparati (per es. ipotiroidismo) che possono causare anch'essi un'alterazione del metabolismo lipidico.
Il trattamento con Pravastatin Zentiva deve essere coadiuvato da una dieta povera di colesterolo.
Dal momento che alcuni pazienti trattati con Pravastatin Zentiva hanno presentato un'alterazione dei valori epatici o dolori muscolari, il suo medico farà rilevare periodicamente da un laboratorio questi valori (vedere anche il paragrafo «Quando è richiesta prudenza nella somministrazione di Pravastatin Zentiva?»).
Quando non si può assumere Pravastatin Zentiva?
Pravastatin Zentiva non deve essere usato in caso di ipersensibilità verso uno dei componenti delle compresse, epatopatia in fase attiva e aumento dei valori degli enzimi epatici di origine non chiara, colestasi e malattie muscolari (miopatie), nonché durante la gravidanza e l'allattamento.
I bambini di età inferiore a 8 anni non devono assumere Pravastatin Zentiva.
Quando è richiesta prudenza nella somministrazione di Pravastatin Zentiva?
Questo medicamento può ridurre la capacità di reazione, la capacità di condurre un veicolo e la capacità di utilizzare attrezzi o macchine.
Pravastatin Zentiva deve essere somministrato in generale con particolare cautela nei pazienti con storia di malattie epatiche e in caso di eccessivo consumo di alcol.
Durante il trattamento con medicamenti della classe delle statine sono stati osservati effetti collaterali anche gravi a carico dei muscoli (miopatie e rabdomiolisi).
La rabdomiolisi rappresenta un effetto collaterale serio che può comportare pericolo per la vita. I pazienti con fattori di rischio particolari possono utilizzare un medicamento della classe delle statine solo dopo parere favorevole del medico, poiché in questo caso sono eventualmente necessarie particolari misure mediche prima dell'inizio del trattamento.
Prima del trattamento con Pravastatin Zentiva informi il suo medico nel caso in cui:
- presenta una compromessa funzionalità renale o tiroidea.
- manifesta o ha manifestato una malattia muscolare (per es. di natura congenita o durante un precedente trattamento con statine o con altri medicamenti) o in caso di malattie muscolari nella sua storia familiare oppure.
- consuma ingenti quantità di alcool.
- abbia un'età superiore a 65 anni.
Durante il trattamento con pravastatina sono stati segnalati tensione muscolare e strappi muscolari.
Se durante il trattamento con Pravastatin Zentiva dovessero manifestarsi inspiegabili disturbi muscolari (per es. dolori muscolari, debolezza muscolare o crampi muscolari), dovrà informarne senza indugio il medico. Il rischio di tali effetti collaterali può essere aumentato in caso di malattie concomitanti (soprattutto in caso di malattie infettive o elevato consumo di alcol) o qualora Pravastatin Zentiva venga assunto in concomitanza con determinati medicamenti (per es. statine o fibrati).
In caso di ipercolesterolemia familiare omozigote i medicamenti di questa classe possono esercitare solo un effetto ridotto. Al riguardo non sono disponibili esperienze cliniche con l'uso di Pravastatin Zentiva.
Se ha dovuto sottoporsi a un trapianto o soffre di una malattia autoimmune e quindi deve essere trattato con ciclosporina, dovrà informarne immediatamente il medico.
Per alcuni medicamenti di questa categoria, incluso Pravastatin Zentiva, in casi singoli, soprattutto nel caso di trattamenti prolungati, si riferisce di malattie polmonari caratterizzate da difficoltà respiratorie, tosse secca e un peggioramento dello stato di salute generale (stanchezza/esaurimento, perdita di peso e febbre). Se nota questi sintomi, consulti immediatamente il suo medico.
Poiché, nel trattamento con medicamenti che abbassano il livello di grassi nel sangue, si sono manifestati casi singoli di interazioni potenzialmente letali con altri medicamenti, Pravastatin Zentiva non deve essere assunto contemporaneamente a medicamenti a base di acido fusidico per uso interno.
Questo medicamento contengono lattosio. Se il medico le ha diagnosticato una intolleranza ad alcuni zuccheri, lo contatti prima di prendere Pravastatin Zentiva.
Questo medicamento contiene meno di 1 mmol (23 mg) di sodio per compressa, cioè essenzialmente «senza sodio».
Informi il suo medico o il suo farmacista nel caso in cui
- soffre di altre malattie,
- soffre di allergie o
- assume altri medicamenti (anche se acquistati di sua iniziativa!) o li applica esternamente.
Si può assumere Pravastatin Zentiva durante la gravidanza o l’allattamento?
Durante la gravidanza o l'allattamento non si deve assumere Pravastatin Zentiva.
Le donne in età fertile possono prendere Pravastatin Zentiva solo se usano un sistema anticoncezionale efficace.
È necessario informare le pazienti sui possibili rischi e sull'uso di metodi contraccettivi efficaci.
Se tuttavia dovesse iniziare una gravidanza, dovrà interrompere immediatamente il trattamento con Pravastatin Zentiva e discutere la situazione con il suo medico.
Come usare Pravastatin Zentiva?
Posologia per gli adulti
Il medico stabilisce la posologia di Pravastatin Zentiva compresse. La dose iniziale e quella di mantenimento sono comprese fra 10 mg e 40 mg al giorno. Pravastatin Zentiva viene somministrato in un'unica dose alla sera, prima di coricarsi, indipendentemente dai pasti. Le compresse devono essere ingerite senza essere masticate, con del liquido.
Dopo 4 settimane, se sarà necessario, il medico modificherà la posologia a seconda dei valori dei lipidi nel sangue.
Per diminuire il rischio di pericolosi eventi cardiovascolari nei pazienti con pregresso infarto cardiaco, la posologia iniziale è per lo più di 40 mg al giorno. Il suo medico modificherà la dose a seconda dei valori dei lipidi nel sangue.
Posologia per i bambini
Il medico stabilisce la posologia per i bambini di età pari o superiore a 8 anni.
Avvertenza
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Indicazione per l'impiego
La durata del trattamento con Pravastatin Zentiva dipende dai bisogni del paziente e dalla tollerabilità del medicamento.
In determinati casi il medico può prescrivere, in aggiunta a Pravastatin Zentiva, un altro medicamento che si lega agli acidi biliari (Colestid, Quantalan, Ipocol). Se viene somministrato in aggiunta a un medicamento di questo tipo, Pravastatin Zentiva deve essere assunto 1 ora prima o più di 4 ore dopo l'altro medicamento.
Se deve usare un medicamento contro l'eccesso di acidi gastrici (antiacido), dovrà assumerlo 1 ora prima di prendere Pravastatin Zentiva.
Quali effetti collaterali può avere Pravastatin Zentiva?
Con l'assunzione di Pravastatin Zentiva possono manifestarsi i seguenti effetti collaterali:
disturbi gastrointestinali, tensione muscolare e strappi muscolari, dolori muscolari, crampi muscolari o debolezza muscolare, pelle secca, eruzioni cutanee (per lo più di lieve intensità) e prurito cutaneo, alterazioni a livello della cute del capo e dei capelli (incl. perdita di capelli), dolori articolari, disturbi della sensibilità (formicolii, dolori e intorpidimento alle mani e ai piedi), vertigini, obnubilamento, disturbi del sonno, dolori al petto e nella regione del cuore, disturbi della minzione, disturbi della vista, stanchezza e disturbi della funzione sessuale.
In singoli casi si possono manifestare effetti collaterali quali gonfiori (angioedemi), reazione di fotosensibilità, alterazioni cutanee del viso e del collo (arrossamento e gonfiori), ipotensione, papule rossastre lichenificate a livello del viso o delle articolazioni, ittero ed epatite, problemi epatici, anomalie della funzionalità epatica, incubi, malattie polmonari caratterizzate da difficoltà respiratorie (dispnea), tosse secca e un peggioramento dello stato di salute generale (stanchezza/esaurimento, perdita di peso e febbre), infiammazione del pancreas (pancreatite) e disturbo del tendine, in particolare, infiammazioni e rotture tendinee, così come malattie muscolari e diminuzione del numero di piastrine nel sangue.
Se osserva effetti collaterali qui non descritti dovrebbe informare il suo medico o il suo farmacista.
Di che altro occorre tener conto?
Validità/Conservazione
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sulla confezione.
Conservare nella confezione originale, a temperatura ambiente (15−25 °C), al riparo dalla luce e dall'umidità e fuori dalla portata dei bambini.
La preghiamo di consegnare le compresse rimaste dopo aver terminato il trattamento e le compresse scadute là dove sono state vendute (dal medico o in farmacia), affinché vengano eliminate in modo adeguato.
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Pravastatin Zentiva?
1 compressa di Pravastatin Zentiva (con linea di frattura, divisibile) contiene:
Principi attivi
20 mg risp. 40 mg di pravastatina sodio.
Sostanze ausiliarie
Cellulosa microcristallina, lattosio monoidrato, sodio fosfato dibasico, croscarmellosa sodica, sodio laurilsulfato, povidone, ossido di ferro, silice colloidale, magnesio stearato.
Numero dell’omologazione
57535 (Swissmedic)
Dove è ottenibile Pravastatin Zentiva? Quali confezioni sono disponibili?
In farmacia dietro presentazione della prescrizione medica.
Confezioni
Pravastatin Zentiva 20 mg: 30 e 100 compresse (con linea di frattura, divisibili).
Pravastatin Zentiva 40 mg: 30 e 100 compresse (con linea di frattura, divisibili).
Titolare dell’omologazione
Helvepharm AG, Frauenfeld
Questo foglietto illustrativo è stato controllato l'ultima volta nel marzo 2020 dall'autorità competente in materia di medicamenti (Swissmedic).
Zusammensetzung
Wirkstoffe
Pravastatinum natricum.
Hilfsstoffe
Cellulosum microcristallinum, lactosum monohydricum 10 mg (20 mg Tabletten) bzw. 20 mg (40 mg Tabletten), dinatrii phosphas, carmellosum natricum conexum, natrii laurilsulfas, povidonum, ferri oxidum (E172), silicea colloidalis anhydrica, magnesii stearas.
Gesamtnatriumgehalt 8,923 mg (20 mg Tabletten) und 17,845 mg (40 mg Tabletten).
Darreichungsform und Wirkstoffmenge pro Einheit
Tabletten (teilbar) zu 20 mg und 40 mg Pravastatin-Natrium.
Indikationen/Anwendungsmöglichkeiten
Sekundärprophylaxe bei Status nach Myokardinfarkt bzw. Status nach Hospitalisation wegen instabiler Angina pectoris bei Patienten mit normalen bzw. leicht erhöhten Serumcholesterinspiegeln (siehe unter «Eigenschaften/Wirkungen» die Ergebnisse der klinischen Studien hinsichtlich der Wirkung von Pravastatin Zentiva auf die Mortalität, Morbidität usw.).
Koronare Herzkrankheit bei Hypercholesterinämie, die durch diätetische Massnahmen nicht ausreichend beeinflusst werden kann.
Bei Patienten mit primärer Hypercholesterinämie sowie kombinierter Hyperlipidämie (Fredrickson-Typ IIa, IIb und III), zur Reduktion von erhöhtem Gesamt- und LDL-Cholesterin, Apolipoprotein B und Triglyzeriden.
Dosierung/Anwendung
Vor Beginn der Therapie sollen die Patienten auf eine cholesterinarme Diät gesetzt werden, die während der Behandlung fortgesetzt werden sollte.
Zudem sollten andere Grundkrankheiten bzw. Störungen (z.B. Fettleibigkeit/Fettsucht, ungenügend kontrollierter Diabetes mellitus, Hypothyroidismus, nephrotisches Syndrom, Dysproteinämie, obstruktive Lebererkrankungen, Begleittherapien, Alkoholismus), die ebenfalls zu Fettstoffwechselstörungen führen, ausgeschlossen werden und ein Lipidprofil erstellt werden.
Übliche Dosierung
Die Anfangs- und Erhaltungsdosis beträgt im Allgemeinen zwischen 10 und 40 mg pro Tag als Einzeldosis und wird unzerkaut mit Flüssigkeit eingenommen. Pravastatin Zentiva Tabletten werden abends, unabhängig von einer allfälligen Mahlzeit, eingenommen. Eine Einzeldosis vor dem Schlafengehen ist ebenso wirksam wie die 2× tägliche Verabreichung und zeigt eine geringfügig stärkere Wirkung als eine morgendliche Gabe (möglicherweise, weil Cholesterin hauptsächlich in der Nacht synthetisiert wird; siehe auch «Pharmakokinetik: Absorption»).
Eine Dosisanpassung soll individuell - frühestens nach 4 Wochen (Maximalwirkung) und abhängig von den Lipidwerten - vorgenommen werden.
Dosierung für die Indikation «Sekundärprophylaxe nach Myokardinfarkt»: 40 mg pro Tag. Falls eine LDL-Konzentration von ca. 3,2 mmol/l erreicht wird, können evtl. auch Dosen unter 40 mg eine Reduktion des Risikos für Koronarereignisse bewirken (siehe auch «Eigenschaften/Wirkungen: Resultate der CARE-Studie»).
Spezielle Dosierungsanweisungen
Kinder und Jugendliche bei heterozygoter familiärer Hypercholesterinämie
Bei Jugendlichen im Alter von 14–18 Jahren beträgt die empfohlene Dosierung 10–40 mg Pravastatin Zentiva 1× täglich. Dosen über 40 mg wurden nicht untersucht. Bei Kindern im Alter von 8–13 Jahren ist die maximale empfohlene Dosierung 20 mg 1× täglich (Dosierungen >20 mg wurden bei dieser Population nicht untersucht). Die Anwendung von Pravastatin Zentiva wird bei Kindern unter 8 Jahren nicht empfohlen, da keine Erfahrungen vorliegen.
Patienten unter Ciclosporin-Behandlung
Bei Patienten, die mit Ciclosporin allein oder in Kombination behandelt werden, sollte wie üblich mit einer Dosierung von 10 mg Pravastatin Zentiva täglich begonnen werden. Die Titration zu höheren Dosen sollte vorsichtig erfolgen. Die meisten Patienten, die mit einer Kombination von Ciclosporin und Pravastatin Zentiva behandelt wurden, erhielten eine maximale Dosierung von 20 mg täglich; siehe auch «Interaktionen».
Ältere Patienten und Patienten mit Niereninsuffizienz
Aufgrund limitierter Daten empfiehlt es sich, bei älteren Patienten (>65 Jahre) und Patienten mit Niereninsuffizienz eine niedrigere Dosierung anzuwenden.
Patienten mit Lebererkrankung
Siehe «Kontraindikationen», «Warnhinweise und Vorsichtsmassnahmen» und «Unerwünschte Wirkungen».
Kombinationstherapie mit Nikotinsäure, Probucol und Ionenaustauscherharzen
Pharmakokinetische Interaktionsstudien, in welchen Pravastatin in Kombination mit Nikotinsäure und Probucol verabreicht wurde, zeigten keine Veränderungen in Bezug auf die Bioverfügbarkeit von Pravastatin; siehe auch «Interaktionen».
Pravastatin Zentiva kann zur Wirkungsverstärkung (Senkung des Gesamtcholesterins und des LDL-C) mit einem gallensäurebindenden Ionenaustauscherharz (Colestyramin, Colestipol) kombiniert werden. Bei Kombination mit einem Ionenaustauscherharz soll Pravastatin Zentiva mindestens 1 Stunde vor oder mehr als 4 Stunden nach diesem eingenommen werden; siehe auch «Interaktionen».
Kontraindikationen
Bekannte Überempfindlichkeit gegenüber einem der Bestandteile der Tabletten.
Aktive Lebererkrankung und nicht abgeklärte persistierende, erhöhte Transaminasenwerte (SGOT [AST], SGPT [ALT]; > das 3-fache der oberen Normalwerte) und Cholestase (siehe auch «Warnhinweise und Vorsichtsmassnahmen» und «Unerwünschte Wirkungen: Leber- und Gallenerkrankungen»).
Schwangerschaft, Stillzeit (siehe auch «Schwangerschaft/Stillzeit»).
Warnhinweise und Vorsichtsmassnahmen
Leber
Pravastatin Zentiva sollte bei anamnestisch bekannter Lebererkrankung oder hohem Alkoholkonsum nur mit Vorsicht eingesetzt werden (siehe auch «Unerwünschte Wirkungen: Leber- und Gallenerkrankungen»).
Wie bei der Behandlung mit anderen Lipidsenkern sollten während der Einnahme von Pravastatin Zentiva regelmässig die Leberfunktionswerte (Transaminasen) kontrolliert werden. Besondere Aufmerksamkeit sollte denjenigen Patienten gelten, die während der Therapie Transaminasenanstiege entwickeln; bei diesen Patienten sollten die Bestimmungen umgehend wiederholt und häufiger durchgeführt werden. Sollten die Erhöhungen der Alanin- (ALT, SGPT) und Aspartat-Aminotransferase (AST, SGOT) bis über das 3-fache des Normalwertes fortschreiten oder persistieren, sollte das Arzneimittel abgesetzt werden.
Siehe auch «Kontraindikationen» und «Unerwünschte Wirkungen: Leber- und Gallenerkrankungen».
Diabetes mellitus
Es gibt einige Hinweise, dass die Substanzklasse der Statine die Blutglukosewerte ansteigen lässt. Bei einigen Patienten, bei denen ein hohes Risiko für die Entwicklung eines zukünftigen Diabetes besteht, kann eine Hyperglykämie solche Ausmasse annehmen, dass eine angemessene Diabetesbehandlung notwendig ist. Diesem Risiko steht jedoch die Reduktion des vaskulären Risikos durch Statine entgegen und sollte daher kein Grund für die Beendigung der Statin-Therapie sein. Patienten, bei denen ein Risiko besteht (Nüchternglukose 5,6 bis 6,9 mmol/l, BMI >30 kg/m2, erhöhte Triglyzeridwerte, Hypertonie) sollten entsprechend der nationalen Richtlinien klinisch und biochemisch überwacht werden.
Homozygote familiäre Hypercholesterinämie
Bei der seltenen homozygoten familiären Hypercholesterinämie fehlen zelluläre LDL-Rezeptoren, daher ist die Wirkung eines Statins geringer. Entsprechende klinische Erfahrungen mit Pravastatin Zentiva liegen nicht vor.
Ältere Patienten und Patienten mit Niereninsuffizienz
Siehe «Dosierung/Anwendung: Spezielle Dosierungsanweisungen».
Skelettmuskel
Myopathie/Rhabdomyolyse
Das Risiko einer Myopathie und Rhabdomyolyse bei gleichzeitiger Behandlung mit Hemmern des CYP-450-Enzymsystems (insb. des CYP3A4 Isoenzyms) sowie bei gleichzeitiger Behandlung mit Fibraten oder Cyclosporin kann erhöht sein (siehe auch «Interaktionen»).
Unter Behandlung mit Pravastatin wurden Muskelverspannungen- und Einrisse einschliesslich Muskelrupturen berichtet.
Patienten, bei denen während der Therapie unerklärliche Muskelschmerzen, -schwäche oder -krämpfe auftreten, sollte geraten werden sofort den behandelnden Arzt oder die behandelnde Ärztin konsultieren, damit in diesem Fall die entsprechenden Massnahmen getroffen werden können; siehe nachstehend «Messung und Interpretation der Kreatinkinase-Werte».
Messung und Interpretation der Kreatinkinase-Werte
Eine routinemässige Überwachung der Kreatinkinase (CK) oder anderer Muskelenzymspiegel wird bei asymptomatischen Patienten unter Statin-Therapie nicht empfohlen. Die Messung des CK-Spiegels wird jedoch bei Patienten mit besonderen prädisponierenden Faktoren vor Beginn einer Statin-Therapie und bei Patienten mit muskulären Symptomen unter Statin-Therapie (wie unten beschrieben) empfohlen. Wenn die CK-Ausgangswerte signifikant erhöht sind (>5× ULN), sollte die Kreatinkinase ca. 5 bis 7 Tage später noch einmal gemessen werden, um die Ergebnisse zu bestätigen. Die Interpretation der gemessenen CK-Spiegel sollte im Kontext anderer potentieller Faktoren erfolgen, die vorübergehende Muskelstörungen verursachen können, wie z.B. anstrengende körperliche Betätigung oder Muskeltrauma.
- Vor Behandlungsbeginn: Vorsicht bei Patienten mit prädisponierenden Faktoren (z.B. fortgeschrittenes Alter (>65), Niereninsuffizienz, unkontrollierte Schilddrüsenunterfunktion (Hypothyreose), anamnestisch bekannte Muskeltoxizität unter Behandlung mit Statinen oder Fibraten, erbliche Muskelerkrankung des Patienten oder in seiner Familienanamnese, Alkoholmissbrauch). In diesen Fällen sollten die CK-Spiegel vor Therapiebeginn gemessen werden. Eine Messung der CK-Spiegel vor Therapiebeginn sollte auch bei Personen über 70 Jahren in Betracht gezogen werden, besonders bei anderen prädisponierenden Faktoren in dieser Patientengruppe. Wenn die CK-Spiegel signifikant erhöht sind (Ausgangswerte >5× ULN), sollte die Behandlung nicht initiiert und die Ergebnisse sollten nach 5−7 Tagen überprüft werden. Die Ausgangswerte der CK-Spiegel können auch im Fall eines späteren Anstiegs während der Statin-Therapie als Referenzwerte nützlich sein.
- Während der Behandlung: Die Patienten sollten angewiesen werden, Ihren Arzt umgehend über alle Muskelschmerzen, -spannungen, -schwächen oder -krämpfe unbekannter Ursache zu informieren. In diesen Fällen sollten die CK-Spiegel gemessen werden. Falls ein deutlich erhöhter (>5× ULN) CK-Spiegel festgestellt wird, muss die Statin-Therapie abgebrochen werden. Ein Therapieunterbruch sollte auch in Betracht gezogen werden, wenn die muskulären Symptome schwerwiegend sind und tägliches Unbehagen verursachen, selbst bei einem CK-Wert ≤5× ULN. Wenn die Symptome nachlassen und sich die CK-Spiegel normalisieren, kann die Wiederaufnahme der Statin-Therapie mit der niedrigsten Dosierung und unter engmaschiger Überwachung in Betracht gezogen werden. Wenn bei einem solchen Patienten eine erbliche Muskelkrankheit vermutet wird, empfiehlt sich die Wiederaufnahme der Statin-Therapie nicht.
In sehr seltenen Fällen wurde während oder nach der Behandlung mit einigen Statinen, einschliesslich Pravastatin, über eine immunvermittelte nekrotisierende Myopathie (immune-mediated necrotizing myopathy, IMNM) berichtet. Die klinischen Charakteristika einer IMNM sind persistierende proximale Muskelschwäche und erhöhte Serumkreatinkinase-Werte, die trotz Absetzen der Behandlung mit Statinen fortbestehen.
HMG-CoA-Reduktasehemmer (Statine), inkl. Pravastatin Zentiva, dürfen nicht zusammen mit systemischen Fusidinsäurepräparaten angewendet werden.
Es wurde über Rhabdomyolyse (einschliesslich einiger Todesfälle) bei Patienten berichtet, die systemische Fusidinsäurepräparate in Kombination mit Statinen erhielten (siehe «lnteraktionen»).
Die Behandlung mit Pravastatin Zentiva ist während einer unverzichtbaren systemischen Fusidinsäuretherapie abzusetzen. Die Patienten sollten darüber informiert werden, umgehend ärztlichen Rat einzuholen, wenn sie Anzeichen von Muskelschwäche, -schmerzen oder -empfindlichkeit bemerken.
Die Statintherapie kann 7 Tage nach der letzten Dosis Fusidinsäure fortgesetzt werden.
In Ausnahmesituationen, wenn eine anhaltende systemische Fusidinsäure-Behandlung erforderlich ist, sollte die gleichzeitige Anwendung von Pravastatin Zentiva und Fusidinsäure nur von Fall zu Fall und unter engmaschiger medizinischer Überwachung in Betracht gezogen werden.
Interstitielle Lungenerkrankung
Bei einigen Statinen, einschliesslich Pravastatin, wurde in Einzelfällen über eine interstitielle Lungenerkrankung berichtet, insbesondere bei Langzeitbehandlung (siehe «Unerwünschte Wirkungen, Anwendungsbeobachtung nach Markteinführung»). Die Symptome können Atemnot (Dyspnoe), trockenen Husten und eine Verschlechterung der allgemeinen Gesundheit (Fatigue, Gewichtsverlust und Fieber) umfassen. Wenn der Verdacht besteht, dass bei dem Patienten eine interstitielle Lungenerkrankung aufgetreten ist, muss die Statintherapie abgesetzt werden.
Kinder unter 8 Jahren
Die Anwendung von Pravastatin Zentiva wird bei Kindern unter 8 Jahren nicht empfohlen, da keine Erfahrungen vorliegen.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Tablette, d.h. es ist nahezu «natriumfrei».
Pravastatin Zentiva Tabletten enthalten Lactose. Patienten mit den seltenen hereditären Störungen Galactoseintoleranz, völligem Lactasemangel oder Glucose-Galactose-Malabsorptionsollten dieses Arzneimittel nicht anwenden.
Interaktionen
Inhibitoren des Cytochrom-P450-Isoenzyms 3A4 (wie Itraconazol, Diltiazem, Ciclosporin)
In vitro-Studien haben gezeigt, dass Pravastatin nur eine schwache Affinität zum Cytochrom-P450 3A4 hat. Deshalb spielt der Cytochrom-P450-3A4-abhängige Metabolismus nur eine untergeordnete Rolle bei der Metabolisierung von Pravastatin (siehe auch «Pharmakokinetik: Metabolismus»).
Bei gesunden Probanden wurde keine signifikante Interaktion zwischen Pravastatin und Itraconazol oder Diltiazem beobachtet.
In einer Interaktionsstudie mit Ciclosporin wurde eine 2,3-fache Erhöhung der AUC und eine 2,6-fache Erhöhung der Cmax von Pravastatin festgestellt. Die Werte von Ciclosporin wurden nicht bestimmt.
Hingegen wurden in je einer Studie mit Nieren- bzw. Herztransplantations-Patienten erhöhte Pravastatinwerte (Erhöhung AUC Pravastatin um das 5-fache) gemessen. Myopathien wurden aber in keiner der klinischen Studien an 100 Transplantations-Patienten (76 Herz- und 24 Nierentransplantationen) beobachtet, die bis zu 2 Jahre mit Pravastatin (10-40 mg pro Tag) und Ciclosporin, gewisse gar zusätzlich mit weiteren Immunsuppressiva, behandelt wurden (siehe auch «Unerwünschte Wirkungen: Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen»).
Antipyrine (Phenytoin, Chinidin usw.)
Die Antipyrin-Clearance, die über das Cytochrom-P450-System erfolgt, wurde bei gleichzeitiger Verabreichung von Pravastatin nicht verändert. Ferner scheint Pravastatin keinen Induktionseffekt auf die metabolisierenden Leberenzyme aufzuweisen. Deshalb sind keine Interaktionen mit anderen über das Cytochrom-P450-System metabolisierten Substanzen zu erwarten.
Gallensäurebindende Ionenaustauscherharze (Colestyramin, Colestipol)
Wenn Pravastatin mindestens 1 Stunde vor, bzw. 4 Stunden nach Colestyramin, bzw. 1 Stunde vor Colestipol und einer Standardmahlzeit eingenommen wurde, konnte keine klinisch signifikante Reduktion der Bioverfügbarkeit oder der klinischen Wirkung festgestellt werden (siehe auch «Dosierung/Anwendung: Spezielle Dosierungsanweisungen»). Bei gleichzeitiger Verabreichung ist die Bioverfügbarkeit von Pravastatin verringert (AUC um 40−50% geringer).
Cumarinderivate (Warfarin)
In einer Studie mit normalen älteren Probanden, die auf Warfarin eingestellt waren, führte die gleichzeitige Gabe von Pravastatin 40 mg täglich zu keinem klinisch signifikanten Effekt auf die Prothrombinzeit.
Nikotinsäure
Bei der kombinierten Anwendung mit Nikotinsäure an einer beschränkten Patientenzahl wurden keine Myopathien beobachtet.
Acetylsalicylsäure und Antacida (1 Stunde vor der Pravastatin-Verabreichung), Cimetidin, Nikotinsäure oder Probucol
Keine Beeinflussung der Bioverfügbarkeit von Pravastatin.
Makrolide
Makrolide können die Statinexposition erhöhen, wenn sie in Kombination angewendet werden.
In einer Interaktionsstudie mit Erythromycin wurde eine statistisch signifikante Erhöhung der AUC (70%) und der Cmax (121%) von Pravastatin festgestellt, während in einer Studie mit Clarithromycin diese Pravastatin-Parameter um 110% (AUC) bzw. 127% (Cmax) statistisch signifikant erhöht wurden. T½ wurde dabei jedoch nicht erhöht.
Obwohl diese Veränderungen der Pravastatin-Bioverfügbarkeit moderat waren, sollte Pravastatin aufgrund des möglichen erhöhten Risikos von Myopathien nur mit Vorsicht in Kombination mit Makrolidantibiotika angewendet werden.
Fibrate
Die Anwendung von Fibraten allein ist gelegentlich mit einer Myopathie assoziiert. Ein erhöhtes Risiko von unerwünschten muskuloskeletalen Ereignissen, einschliesslich Rhabdomyolyse, wurde berichtet, wenn Fibrate mit anderen Statinen verabreicht wurden. Diese unerwünschten Ereignisse mit Pravastatin können nicht ausgeschlossen werden, daher sollte die Kombination von Pravastatin und Fibraten (z.B. Gemfibrozil, Fenofibrat) generell vermieden werden. Wenn diese Kombination als notwendig erachtet wird, ist eine sorgfältige klinische und Serum-Kreatin-Phosphokinase (CPK) Überwachung notwendig.
In einer klinischen Studie an einer limitierten Anzahl Patienten, in der die Kombination von Pravastatin (40 mg/Tag) und Gemfibrozil (1200 mg/Tag) untersucht wurde, wurden keine Fälle von Myopathie beobachtet, obwohl ein Hinweis auf eine Erhöhung der CPK-Aktivität und von muskuloskeletalen Symptomen (z.B. Muskelschmerzen) festgestellt wurde.
Antifungale Azolderivate
Statine und antifungale Azolderivate hemmen die Biosynthese von Cholesterin auf verschiedenen Stufen. Bei Patienten unter Ciclosporin sollte Pravastatin vorübergehend abgesetzt werden, wenn eine systemische Behandlung gegen Pilze mit einem Wirkstoff der Azol-Gruppe notwendig wird. Patienten ohne Ciclosporin sollten bei systemischer Behandlung gegen Pilze mit Wirkstoffen der Azol-Gruppe sorgfältig überwacht werden.
Systemische Fusidinsäurepräparate
Die Kombination von Statinen, inkl. Pravastatin Zentiva, mit Fusidinsäure kann zu möglicherweise letal verlaufenden Rhabdomyolysen führen. Es wurde über Rhabdomyolyse (einschliesslich einiger Todesfälle) bei Patienten berichtet, die systemische Fusidinsäurepräparate in Kombination mit Statinen erhielten (siehe «Warnhinweise und Vorsichtsmassnahmen»). Der Mechanismus dieser lnteraktion ist nicht bekannt.
Die Behandlung mit Pravastatin Zentiva ist während einer unverzichtbaren systemischen Fusidinsäuretherapie abzusetzen.
Die Behandlung mit Pravastatin Zentiva kann sieben Tage nach Erhalt der letzten Fusidinsäuredosis wieder aufgenommen werden.
Andere Therapeutika
Es wurden keine Hinweise auf klinisch signifikante Interaktionen zwischen Pravastatin und den folgenden Therapeutika festgestellt: Diuretika, Antihypertensiva, Digitalisglykoside, ACE-Hemmer, Calciumantagonisten, Betablocker oder Nitroglyzerin.
Schwangerschaft/Stillzeit
Schwangerschaft
Pravastatin Zentiva ist in der Schwangerschaft kontraindiziert (siehe auch «Kontraindikationen»).
Atherosklerose ist ein chronischer Prozess, und ein Unterbruch der lipidsenkenden Behandlung während der Schwangerschaft hat einen geringen Einfluss auf das Langzeitergebnis der primären Hypercholesterinämie. Cholesterin und dem Cholesterin verwandte Substanzen sind essentiell für die Entwicklung des Föten (inkl. die Synthese von Steroiden und Zellmembranen). Da Statine möglicherweise auch die Synthese anderer biologisch aktiver Cholesterin-Abkömmlinge hemmen, kann eine Schädigung des Fötus bei Verabreichung der Wirkstoffe während der Schwangerschaft nicht ausgeschlossen werden.
Einige Berichte über kongenitale Missbildungen bei Säuglingen, deren Mütter während der Schwangerschaft ein Statin erhalten hatten, liegen vor.
Aus diesen Gründen ist bei gebärfähigen Patientinnen während der Pravastatin Zentiva-Behandlung eine zuverlässige Kontrazeption erforderlich.
Patientinnen sollen auf die erwähnten Risiken und auf die Wichtigkeit einer geeigneten Kontrazeption hingewiesen werden.
Wird eine Patientin während der Behandlung mit Pravastatin Zentiva schwanger, so muss das Medikament abgesetzt und die Patientin auf das bestehende Risiko für den Föten hingewiesen werden.
Stillzeit
Obwohl nur geringe Mengen an Pravastatin in die Muttermilch übertreten, soll aufgrund potentieller unerwünschter Wirkungen auf den Säugling während der Behandlung nicht gestillt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Aufgrund der möglichen unerwünschten Wirkungen kann die Reaktionsfähigkeit, die Fahrtüchtigkeit und die Fähigkeit, Werkzeuge und Maschinen zu bedienen, beeinträchtigt sein.
Unerwünschte Wirkungen
Im Rahmen kontrollierter, offener klinischer Prüfungen wurde Pravastatin bei rund 2% der Patienten wegen Nebenwirkungen, die im Zusammenhang mit der Behandlung standen, abgesetzt.
Über Myalgie, Myopathie, Rhabdomyolyse, Polyneuropathie und Arthralgien wurde unter der Anwendung von Statinen berichtet (siehe auch nachstehend unter «Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen» sowie im Kapitel «Warnhinweise und Vorsichtsmassnahmen»).
Leber- und Gallenerkrankungen
Über Einzelfälle von Hepatitis wurde berichtet.
Statine wurden mit erhöhten Leberenzymspiegeln in Verbindung gebracht. Unter Pravastatin wurde gelegentlich ein Anstieg der Serumtransaminasen auf weniger als das 3-fache des oberen Normalwertes beobachtet. Die klinische Bedeutung dieser Erhöhung, die üblicherweise in den ersten Behandlungsmonaten auftritt, ist bisher nicht bekannt. Bei 0,5% (6 von 1139) der Patienten kam es im Rahmen von klinischen Prüfungen zu deutlichen (mehr als das 3-fache des oberen Normalwertes), persistierenden Enzymanstiegen, wobei keine klinischen Symptome einer Lebererkrankung manifest wurden und sich die erhöhten Werte, mit Ausnahme von 2 Patienten, nach Absetzen der Therapie normalisierten. Siehe auch «Kontraindikationen» und «Warnhinweise und Vorsichtsmassnahmen: Leber».
Erkrankungen des Gastrointestinaltrakts
Im Zusammenhang mit Pravastatin wurden Einzelfälle von Pankreatitis beobachtet, wobei ein kausaler Zusammenhang mit dem Wirkstoff nicht gesichert ist.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Unkomplizierte Myalgien wurden unter Pravastatin beobachtet (gleiche Inzidenz wie Placebo). Unter Pravastatin traten Myopathien, definiert als Muskelschmerz oder Muskelschwäche in Verbindung mit einer Erhöhung der Serum-Kreatin-Phosphokinase (CPK) um das 10-fache des oberen Normalwertes, möglicherweise mit Pravastatin korreliert, im Rahmen von klinischen Prüfungen bei weniger als 0,1% der Patienten auf.
Über Rhabdomyolyse mit gestörter Nierenfunktion, als Folge einer Myoglobinurie, wurde sehr selten unter Pravastatin berichtet.
Die Rhabdomyolyse ist eine lebensbedrohliche unerwünschte Wirkung.
Das Risiko einer Myopathie ist erhöht, wenn gewisse Statine gleichzeitig mit Fibraten, Immunsuppressiva (inkl. Ciclosporin), Erythromycin oder Niacin (Nikotinsäure) verabreicht werden.
Augenerkrankungen
Bei 820 bis zu 1 Jahr und mehr mit Pravastatin behandelten Patienten konnte kein Hinweis auf eine Kataraktbildung festgestellt werden.
In einer placebo-kontrollierten Studie bei ca. 300 Patienten wurde die Linsentrübung nach 6 bzw. 12 Monaten beurteilt.
Pravastatin Anzahl Patienten (%) | Placebo/Kontrolle Anzahl Patienten (%) | |
|---|---|---|
Verbessert | 29 (14%) | 13 (14%) |
Unverändert | 142 (70%) | 63 (68%) |
Verschlechtert | 31 (15%) | 16 (17%) |
Total | 202 | 92 |
Der Unterschied zwischen der Pravastatin- und der Placebogruppe war statistisch nicht signifikant.
Erkrankungen der Haut und des Unterhautgewebes
Unter Pravastatin wurden Hautausschlag und Pruritus beobachtet.
Der Hautausschlag war meist leichter Natur. Eine Abhängigkeit von der verabreichten Dosis und der Dauer der Behandlung konnte nicht festgestellt werden.
Erkrankungen des Immunsystems
In Einzelfällen kann es unter der Behandlung mit Pravastatin zu Überempfindlichkeitsreaktionen kommen, die mit einem oder mehreren der folgenden Symptome einhergehen können: Angioödem, anaphylaktoide Reaktionen (Blutdruckabfall), Dermatomyositis.
Untersuchungen
Transaminasen- und CPK-Erhöhungen: siehe «Leber- und Gallenerkrankungen» und «Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen».
Unerwünschte Begleiterscheinungen in placebo-kontrollierten Langzeitstudien
In 7 randomisierten doppelblinden placebo-kontrollierten Morbiditäts- und Mortalitäts-Studien mit insgesamt über 21'400 Patienten, die mit Pravastatin (n= 10'764) oder Placebo (n= 10'719) behandelt wurden, war die Verträglichkeit und die Sicherheit in der Pravastatin- und der Placebogruppe vergleichbar. Mehr als 19'000 Patienten wurden während einer medianen Dauer von 4,8−5,9 Jahren therapiert, während die restlichen Patienten über 2 oder mehr Jahre behandelt wurden.
Tabellarische Aufstellung der unerwünschten Wirkungen, die bei ≥1% der Patienten aufgetreten sind (Kausalität wahrscheinlich, möglich oder ungewiss)
Systemorganklasse | Pravastatin | Placebo |
|---|---|---|
Erkrankungen des Gastrointestinaltrakts | ||
Dyspepsie/Sodbrennen | 3,5 | 3,7 |
Abdominale Schmerzen | 2,4 | 2,5 |
Nausea/Erbrechen | 1,6 | 1,6 |
Flatulenz | 1,2 | 1,1 |
Verstopfung | 1,2 | 1,3 |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | ||
Muskel-/Skelettschmerzen (inkl. Arthralgie) | 6,0 | 5,8 |
Muskelkrämpfe | 2,0 | 1,8 |
Myalgie | 1,4 | 1,4 |
Erkrankungen der Atemwege, des Brustraums und des Mediastinums | ||
Dyspnoe | 1,6 | 1,6 |
Infektion des oberen Respirationstraktes | 1,3 | 1,3 |
Husten | 1,0 | 1,0 |
Erkrankungen des Nervensystems | ||
Benommenheit | 2,2 | 2,1 |
Kopfschmerzen | 1,9 | 1,8 |
Schlafstörungen | 1,0 | 0,9 |
Depression | 1,0 | 1,0 |
Angst/Nervosität | 1,0 | 1,2 |
Erkrankungen der Haut und des Unterhautzellgewebes | ||
Ausschlag (Rash) | 2,1 | 2,2 |
Herzerkrankungen | ||
Angina pectoris | 3,1 | 3,4 |
Erkrankungen der Nieren und Harnwege | ||
Miktionsstörungen (inkl. Dysurie, Nocturie) | 1,0 | 0,8 |
Augenerkrankungen | ||
Sehstörungen (inkl. verschwommenes Sehen, Diplopie) | 1,6 | 1,3 |
Allgemeine Erkrankungen | ||
Müdigkeit | 3,4 | 3,3 |
Brustschmerz | 2,6 | 2,6 |
Tabellarische Aufstellung der unerwünschten Wirkungen, die bei <1,0% (Gesamtinzidenz) der Patienten aufgetreten sind; diese unerwünschten Wirkungen wurden auch mit anderen Statinen und in der Postmarketing-Phase beobachtet
Systemorganklasse | Pravastatin | Placebo |
|---|---|---|
Erkrankungen des Gastrointestinaltrakts | ||
Verminderter Appetit | 0,3 | 0,3 |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | ||
Muskelschwäche | 0,1 | <0,1 |
Erkrankungen des Nervensystems | ||
Parästhesien | 0,9 | 0,9 |
Schwindel | 0,4 | 0,4 |
Schlaflosigkeit | 0,3 | 0,2 |
Gedächtnisstörungen | 0,3 | 0,3 |
Tremor | 0,1 | 0,1 |
Neuropathie (inkl. periphere Neuropathie) | 0,1 | 0,1 |
Erkrankungen der Haut und des Unterhautzellgewebes | ||
Pruritus | 0,9 | 1,0 |
Dermatitis | 0,4 | 0,5 |
Trockene Haut | 0,2 | 0,1 |
Veränderungen im Bereich der Kopfhaut und Haare (inkl. Alopezie) | 0,1 | 0,1 |
Urtikaria | 0,1 | 0,1 |
Augenerkrankungen | ||
Linsentrübung | 0,5 | 0,4 |
Erkrankungen des Immunsystems | ||
Allergie | 0,1 | 0,1 |
Oedeme im Kopf- und Halsbereich | 0,1 | 0,1 |
Endokrine Erkrankungen | ||
Sexuelle Dysfunktion | 0,7 | 0,7 |
Veränderte Libido | 0,3 | 0,3 |
Allgemeine Erkrankungen | ||
Geschmacksstörungen | 0,1 | 0,1 |
Fieber | 0,2 | 0,2 |
Flushing | 0,1 | 0,1 |
Anwendungsbeobachtung nach Markteinführung
Zusätzlich zu den oben aufgeführten Ereignissen wurden die folgenden unerwünschten Wirkungen berichtet:
Erkrankungen der Haut und des Unterhautzellgewebes
Angioödem, Lichtempfindlichkeitsreaktion, Dermatomyositis.
Leber- und Gallenerkrankungen
Gelbsucht, cholestatischer Ikterus, Hepatitis, fulminante Lebernekrose, Anomalien der Leberfunktionstests.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Lupus erythematodes-ähnliches Syndrom, Sehnenerkrankung (insbesondere Tendinitis und Sehnenriss), Muskelverspannungen- und Einrisse sowie Muskelrupturen, Polymyositis und immunvermittelte nekrotisierende Myopathie.
Erkrankungen des Gastrointestinaltrakts
Pankreatitis.
Erkrankungen des Blut- und Lymphsystems
Thrombozytopenie.
Psychiatrische Erkrankungen
Albträume.
Erkrankungen der Atemwege, des Brustraums und des Mediastinums
Interstitielle Lungenerkrankung.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Bisher liegen beschränkte Erfahrungen hinsichtlich Überdosierung mit Pravastatin vor.
Bei einer Überdosierung empfiehlt sich eine symptomatische Therapie mit Überwachung der Laborparameter sowie gegebenenfalls zusätzliche unterstützende Massnahmen.
Eigenschaften/Wirkungen
ATC-Code
C10AA03
HMG-CoA-Reduktasehemmer (Statin)
Wirkungsmechanismus
Pravastatin Zentiva mit dem Wirkstoff Pravastatin ist ein HMG-CoA-Reduktasehemmer (Statin) und hemmt kompetitiv das Enzym HMG-CoA-Reduktase, welches den geschwindigkeits-bestimmenden Schritt der Cholesterin-Biosynthese katalysiert. Pravastatin führt aufgrund zweier Mechanismen zu einer Lipidsenkung: Die Hemmung der HMG-CoA-Reduktase führt via eines mässigen Rückgangs des intrazellulären Cholesterin-Pools zu einer kompensatorischen Zunahme von LDL-Rezeptoren auf den Zelloberflächen, und die Clearance sowie der Katabolismus von zirkulierendem LDL wird gefördert. Zudem hemmt Pravastatin die LDL-Neusynthese, indem es die Synthese von VLDL, einer Vorstufe von LDL, in der Leber hemmt. In-vitro Versuche und Tierversuche zeigten, dass das hydrophile Pravastatin eine hohe Gewebeselektivität zu Leber und Ileum aufweist, d.h. zu denjenigen Geweben mit der höchsten Cholesterin-Synthese im Körper. Im Gegensatz zu anderen Statinen wird in den übrigen Geweben (z.B. Linse, Testes, Muskeln) nur eine geringe oder keine Aktivität beobachtet.
Im Tierversuch war Pravastatin in der Zerebrospinalflüssigkeit nicht nachweisbar.
Pravastatin beeinflusst die Plasmaspiegel von Lipoprotein (a) und Fibrinogen, welche bekannte unabhängige biochemische Risiko-Marker für koronare Herzkrankheit sind, nicht nachteilig.
Pharmakodynamik
Keine Angaben.
Klinische Wirksamkeit
Klinische Studie zur primären Hypercholesterinämie bei Erwachsenen
Dosis-/Wirkungsbeziehung von Pravastatin*, Verabreichung 1× täglich vor dem Schlafengehen
Dosis | Gesamtcholesterin | LDL-C | HDL-C | TG |
|---|---|---|---|---|
10 mg | -16% | -22% | +7% | -15% |
20 mg | -24% | -32% | +2% | -11% |
40 mg | -25% | -34% | +12% | -24% |
* Abweichung vom Basiswert nach 8-wöchiger Behandlung
Eine therapeutische Wirkung ist innerhalb von 1 Woche erkennbar. Die maximale Wirkung tritt oft bereits nach 4 Wochen Therapie auf und wird über ausgedehnte Behandlungszeiträume aufrechterhalten. Zusätzlich vermindert Pravastatin die Plasmakonzentration von Apolipoprotein B.
Weitere klinische Studien
Pravastatin reduzierte bei Patienten mit mässiger Hypercholesterinämie und atherosklerose-bedingter kardiovaskulärer Erkrankung und bei Patienten nach Myokardinfarkt mit durchschnittlichem (normalem) Cholesterin sowohl die Atherosklerose-Progression als auch die kardiovaskulären Ereignisse. Zudem reduziert Pravastatin das Risiko für Gesamtmortalität, Tod durch koronare Herzkrankheit (KHK), wiederholte koronare Ereignisse (inkl. Myokardinfarkt) sowie die Häufigkeit eines Hirnschlags oder transienter ischämischer Attacken (TIA), die Notwendigkeit für myokardiale Revaskularisationsinterventionen (Bypass, PTCA) und die Notwendigkeit einer Hospitalisation infolge instabiler Angina pectoris bei Patienten mit vorangegangenem Myokardinfarkt oder instabiler Angina pectoris.
In der WOSCOP-Studie (West of Scotland Coronary Prevention Study) wurden 6595 männliche Patienten (45-64 Jahre) mit mittelschwerer bis schwerer Hypercholesterinämie (Gesamtcholesterin 7,0 ± 0,6 mmol/l) ohne vorangegangenem Myokardinfarkt untersucht.
Die Patienten erhielten zusätzlich zur Standardbehandlung (inkl. Diätempfehlungen) entweder Pravastatin (n= 3302) 1× täglich 40 mg oder Placebo (n= 3293) während einer medianen Zeitdauer von 4,8 Jahren.
Resultate der WOSCOP-Studie
Reduktion | p-Wert | |
|---|---|---|
Primärer Endpunkt: Tod wegen koronarer Herzkrankheit oder nicht-tödlicher Myokardinfarkt | -31% | <0,001 |
Kardiovaskuläre Mortalität (inkl. Hirnschlag) | -32% | 0,03 |
Gesamtmortalität* | -24% | 0,04 |
Bypass oder PTCA | -37% | 0,009 |
Koronarangiographie | -31% | 0,007 |
Nicht-kardiovaskuläre Mortalität | -11% | p = 0,54 (nicht signifikant) |
* Korrigiert nach Risikofaktoren
Der Effekt trat bereits innerhalb der ersten 6 Behandlungsmonate auf. Pravastatin reduzierte das Risiko für schwere koronare Ereignisse in ähnlichem Ausmass über den gesamten Bereich der Ausgangswerte von LDL-Cholesterin und unabhängig von den untersuchten Altersgruppen.
PLAC-I (Pravastatin Limitation of Atherosclerosis in the Coronary Arteries) und PLAC-II (Pravastatin Limitation of Atherosclerosis in the Carotid Arteries) sind randomisierte, doppelblinde, placebo-kontrollierte Regressionsstudien bei Patienten mit Hypercholesterinämie.
Resultate der PLAC-I und PLAC-II-Studien
PLAC-I | PLAC-II | |
|---|---|---|
Koronare Herzkrankheit, Angiographie | Status nach Myokardinfarkt oder angiographische koronare Herzkrankheit und Karotis-Sklerose | |
Patientenzahl | 408 | 151 |
Dosierung | 40 mg | 10-40 mg |
Myokardinfarkt* | Placebo: 10,5% Pravastatin: 2,7% p = 0,006 | Placebo: 13,3% Pravastatin: 2,7% p = 0,018 |
Nicht-tödlicher Myokardinfarkt und Gesamtmortalität | Placebo: 11,6% Pravastatin: 4,4% p = 0,02 | Placebo: 17,1% Pravastatin: 6,7% p = 0,049 |
* 3-Jahres-Rate nach Kaplan-Meier
In der CARE-Studie (Cholesterol and Recurrent Events) wurden 4159 Männer und Frauen, die nach einem Myokardinfarkt einen Gesamtcholesterinspiegel unter 6,2 mmol/l hatten (d.h. mit einer nach einem Myokardinfarkt üblichen Cholesterinkonzentration) während durchschnittlich 4,9 Jahren mit Pravastatin 1× 40 mg täglich behandelt. Der durchschnittliche Gesamtcholesterin-Ausgangswert lag bei 5,4 mmol/l. Die Risikoreduktion für diesen Endpunkt war sowohl bei den Frauen als auch bei den Männern signifikant.
Resultate der CARE-Studie
Reduktion | p-Wert | |
|---|---|---|
Primärer Endpunkt: Tod wegen koronarer Herzkrankheit oder nicht-tödlicher Myokardinfarkt | -24% | 0,003 |
Bypass oder PTCA | -27% | <0,001 |
Hirnschlag | -31% | 0,03 |
Eine Multivarianz-Analyse der CARE-Daten zeigte, dass die erreichte LDL-Konzentration (Senkung auf ca. 3,2 mmol/l) ein signifikanter, aber nicht linearer Indikator für die Rate von Koronarereignissen ist. Unter der Voraussetzung, dass eine LDL-Konzentration von ca. 3,2 mmol/l erreicht wird (in CARE bei über 90% der Patienten unter Pravastatin erreicht), können evtl. auch Dosen von unter 40 mg Pravastatin eine Reduktion des Risikos für Koronarereignisse bewirken.
In der LIPID-Studie (Long Term Intervention with Pravastatin in Ischemic Disease) wurde der Effekt von Pravastatin an 9014 Männern und Frauen mit normalem bis erhöhtem Serumcholesterinwert (Ausgangswert des Gesamt-Cholesterins = 4,0−7,0 mmol/l oder 155-271 mg/dl; durchschnittliches Gesamt-Cholesterin = 5,6 mmol/l oder 218 mg/dl) untersucht, welche während der vorangegangenen 3-36 Monate entweder einen Myokardinfarkt erlitten hatten oder wegen instabiler Angina pectoris hospitalisiert wurden. Patienten mit einem weiten Bereich an Triglycerid-Ausgangswerten wurden eingeschlossen (<5,0 mmol/l [445 mg/dl]), und die Aufnahme wurde nicht durch die HDL-Cholesterin-Ausgangswerte eingeschränkt. Bei Studienbeginn nahmen 82% der Patienten Aspirin, 47% einen β-Blocker, 35% einen Kalzium-Antagonisten und 16% einen ACE-Hemmer ein. Die Patienten dieser multizentrischen, doppelblinden, placebo-kontrollierten Studie nahmen durchschnittlich 5,6 Jahre (Median = 5,9 Jahre) an der Studie teil.
Resultate der LIPID-Studie
Reduktion | p-Wert | |
|---|---|---|
Primärer Endpunkt: Tod wegen koronarer Herzkrankheit | -24% | <0,001 |
Koronare Ereignisse (Tod wegen koronarer Herzkrankheit oder nicht-tödlicher Myokardinfarkt) | -24% | <0,001 |
Tödlicher oder nicht-tödlicher Myokardinfarkt | -29% | <0,001 |
Kardiovaskuläre Mortalität | -25% | <0,001 |
Gesamtmortalität | -23% | <0,0001 |
Myokardiale Revaskularisationsinterventionen (Bypass oder PTCA) | -20% | <0,001 |
Hirnschlag | -19% | <0,05 |
Hospitalisation | -15% | <0,001 |
Gesamtmortalität bei Patienten mit vorangegangenem Myokardinfarkt | -21% | <0,01 |
Tödlicher oder nicht-tödlicher Myokardinfarkt bei Patienten mit vorangegangenem Myokardinfarkt | -25% | <0,001 |
Gesamtmortalität bei Patienten mit vorangegangener Hospitalisation infolge instabiler Angina pectoris | -26% | <0,01 |
Tödlicher oder nicht-tödlicher Myokardinfarkt bei Patienten mit vorangegangener Hospitalisation infolge instabiler Angina pectoris | -37% | <0,001 |
Die Reduktion von KHK-Ereignissen durch Pravastatin in gewissen Subgruppen von LIPID (Alter, Geschlecht oder diabetischer Status) war konsistent, aber aufgrund der kleinen Patientenzahlen nicht signifikant.
Klinische Studien bei Kindern und Jugendlichen
In einer placebokontrollierten Doppelblindstudie wurden 214 pädiatrische Patienten ab 8 Jahren mit heterozygoter familiärer Hypercholesterinämie während 2 Jahren untersucht.
Diese Studie zeigte sowohl bei Kindern (ab 8 Jahren) als auch bei Jugendlichen eine signifikante durchschnittliche Reduktion des LDL-C um 22,9% und des Gesamt-Cholesterins um 17,2% und eine Reduktion von Apolipoprotein B.
Es zeigte sich keine Beeinflussung der untersuchten endokrinen Parameter [ACTH, Hydrocortison, DHEAS, FSH, LH, TSH, Östradiol (weibliche Population) oder Testosteron (männliche Population)]. Es fanden sich keine Unterschiede in der Entwicklung, der Testes (Grösse) oder in der Klassifizierung nach Tanner (Tanner's Score).
Pharmakokinetik
Absorption
Pravastatin ist die aktive Wirkstoff-Form. Nach oraler Verabreichung wird Pravastatinsalz rasch absorbiert, wobei maximale Blutspiegel 1-1,5 Stunden nach Applikation erreicht werden. Basierend auf der Wiederfindungsrate von radioaktiv markiertem Wirkstoff im Urin wurde ermittelt, dass durchschnittlich 34% des oral verabreichten Pravastatins absorbiert werden; die absolute Bioverfügbarkeit beträgt ca. 17%.
Die Senkung erhöhter Blutfettwerte durch Pravastatin ist unabhängig von der An- resp. Abwesenheit von Nahrung im Gastrointestinaltrakt. Daher ist der pharmakokinetische Befund, dass Nahrung im Gastrointestinaltrakt die Bioverfügbarkeit von Pravastatin verringert, ohne klinische Bedeutung.
Die Serumkonzentration von Pravastatin (AUC = area under the curve), maximale Serumkonzentration (Cmax) und minimale Steady-State-Konzentration (Cmin), sind direkt proportional zur verabreichten Dosis.
Pravastatin, 1× täglich vor dem Schlafengehen verabreicht, zeigt eine marginal bessere Wirksamkeit als eine morgendliche Gabe, trotz einer geringeren systemischen Bioverfügbarkeit.
Distribution
Das Verteilungsvolumen von Pravastatin im Steady-State beträgt 0,5 l/kg (VDss). Aufgrund der extensiven Aufnahme von Pravastatin in die Leber sowie seines Metabolismus besitzen Plasmakonzentrationswerte nur beschränkte Aussagekraft hinsichtlich lipidsenkender Wirkung.
Die Plasmaproteinbindung beträgt ca. 50%, ein kleiner Anteil der oralen Dosis tritt in die Muttermilch über.
In vitro-Studien zeigten ferner, dass Pravastatin deutlich mehr in Hepatozyten aufgenommen wird als in andere Zellen.
Metabolismus
In der Leber unterliegt Pravastatin einem extensiven First-Pass-Effekt von ca. 66% der absorbierten oralen Dosis.
Der Hauptmetabolit von Pravastatin ist das 3-Alpha-hydroxyisomer. Dieser Metabolit zeigt 1/10-1/40 der HMG-CoA-Reduktase-Hemmwirkung von Pravastatin.
Pravastatin wird nicht signifikant über das CYP-P450-System metabolisiert und ist kein Substrat oder Hemmer von P-Glykoprotein.
Elimination
Die Plasma-Eliminationshalbwertszeit (T½β) von Pravastatin nach oraler Verabreichung beträgt 1,5 bis 2 Stunden, wobei ungefähr 20% der radioaktiv markierten Substanz über den Urin und 70% über die Faeces ausgeschieden werden. Nach intravenöser Applikation von radioaktiv markiertem Wirkstoff an gesunden Freiwilligen teilte sich die totale Körperclearance folgendermassen auf: 47% renale Exkretion, 53% nicht-renale Eliminationswege (z.B. biliäre Exkretion und Biotransformation).
Eine Kumulierung der Substanz im Blut konnte bei 1 oder 2× täglicher Verabreichung nicht festgestellt werden.
Kinetik spezieller Patientengruppen
Bei Nieren- oder Leberinsuffizienz kann es zu einer Wirkstoffkumulation kommen, obwohl es aufgrund der zwei Eliminationswege von Pravastatin möglich erscheint, dass ein kompensatorischer Mechanismus eine ausreichende Ausscheidung ermöglicht.
Patienten mit einer alkoholisch bedingten Leberzirrhose wiesen eine verminderte hepatische Clearance mit einer grösseren AUC und höheren Spiegeln der Metaboliten von Pravastatin auf; kompensatorisch resultierte ein Anstieg der renalen Exkretion.
Bei älteren Patienten (>65 Jahre) wurde ebenfalls eine grössere AUC festgestellt.
Für Patienten mit eingeschränkter Nierenfunktion liegen nur limitierte Daten vor. In einer Pharmakokinetik-Studie mässiggradiger (n= 8) und schwerer (n= 6) Niereninsuffizienz waren AUC und Cmax mehr als 2-fach erhöht.
Präklinische Daten
Studien an Mäusen mit Pravastatin-Dosierungen von 10 bis 100 mg/kg/tägl. zeigten kein karzinogenes Potential, während Dosierungen von 250 und 500 mg/kg/tägl. (ca. 310× die maximale Humandosis in mg/kg) eine statistisch signifikante Zunahme hepatozellulärer Karzinome bei Weibchen und Männchen zeigte. Zudem war bei den letztgenannten Dosierungen die Inzidenz von Lungenadenomen bei den Weibchen signifikant erhöht.
Bei männlichen Ratten zeigten Pravastatin-Dosierungen von 100 mg/kg/tägl. (ca. 125× die maximale Humandosis in mg/kg) eine statistisch signifikante Zunahme von hepatozellulären Karzinomen. Solche Veränderungen wurden weder bei männlichen Ratten mit Pravastatin-Dosierungen von ≤40 mg/kg/tägl. (50× die maximale Humandosis in mg/kg) noch bei weiblichen Ratten in irgendeiner Dosierung festgestellt.
Gentoxikologische Studien mit Pravastatin ergaben keine Hinweise auf ein mutagenes Potential.
In einer Studie bei Ratten wurden mit Pravastatin-Dosierungen bis zu 500 mg/kg täglich (625× die maximale Humandosis in mg/kg) keine Nebenwirkungen auf die Fertilität oder die Reproduktion nachgewiesen.
Eine Studie mit trächtigen Ratten, denen während der Tage 7 bis 17 der Gestation täglich eine Dosierung bis zu 1000 mg/kg (1250× die maximale Humandosis in mg/kg) verabreicht wurde, ergab keine Hinweise auf eine embryofoetale Toxizität oder Teratogenität.
Eine Studie mit trächtigen Kaninchen, denen während der Tage 6 bis 18 der Gestation täglich eine Dosierung bis zu 50 mg/kg (ca. 60× die maximale Humandosis in mg/kg) verabreicht wurde, ergab keine Hinweise auf eine embryofoetale Toxizität oder Teratogenität.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
In der Originalverpackung, bei Raumtemperatur (15−25 °C), vor Licht und Feuchtigkeit geschützt und ausser Reichweite von Kindern lagern.
Zulassungsnummer
57535 (Swissmedic).
Zulassungsinhaberin
Helvepharm AG, Frauenfeld.
Stand der Information
März 2020.
Composition
Principes actifs
Pravastatinum natricum.
Excipients
Cellulosum microcristallinum, lactosum monohydricum 10 mg (20 mg comprimés) ou 20 mg (40 mg comprimés), dinatrii phosphas, carmellosum natricum conexum, natrii laurilsulfas, povidonum, ferri oxidum (E172), silicea colloidalis anhydrica, magnesii stearas.
Teneur total en sodium 8,923 mg (20 mg comprimés) et 17,845 mg (40 mg comprimés).
Forme pharmaceutique et quantité de principe actif par unité
Comprimés (sécables) de 20 mg et 40 mg pravastatine sodique.
Indications/Possibilités d’emploi
Prophylaxie secondaire après infarctus du myocarde ou après hospitalisation due à l'angor instable chez les patients avec des taux de cholestérol normaux ou légèrement élevés (voir «Propriétés/Effets»: résultats des études cliniques concernant l'effet de Pravastatin Zentiva sur la mortalité, la morbidité etc.).
Coronaropathie lors d'hypercholestérolémie, lorsqu'un régime diététique s'est prouvé insuffisant.
Réduction des taux élevés de cholestérol total, de cholestérol LDL, d'apolipoprotéine B et de triglycérides chez les patients souffrant d'hypercholestérolémie primaire et d'hyperlipidémie combinée (de type IIa, IIb et III selon Fredrickson).
Posologie/Mode d’emploi
Avant le traitement par Pravastatin Zentiva, le patient sera mis sous un régime pauvre en cholestérol qui devrait être poursuivi durant la thérapie.
Avant l'instauration du traitement par Pravastatin Zentiva, il faudrait de plus exclure toute autre maladie de base ou affection qui pourrait provoquer des troubles du métabolisme lipidique (p.ex. obésité, diabète sucré insuffisamment contrôlé, hypothyroïdie, syndrome néphrotique, dysprotéinémie, maladies obstructives du foie, traitements concomitants, alcoolisme); de plus, un profil lipidique sera établi.
Posologie usuelle
La posologie initiale et de maintien est en général de 10 à 40 mg en une seule prise par jour. Les comprimés Pravastatin Zentiva sont avalés sans les mâcher, avec du liquide; ils sont pris le soir et indépendamment d'un repas. Une seule application avant le coucher est aussi efficace que deux applications pendant la journée et est légèrement plus efficace que la prise matinale (peut-être parce que la synthèse du cholestérol se fait principalement durant la nuit; voir aussi «Pharmacocinétique: Absorption»).
Une adaptation de la posologie devrait être effectuée individuellement - au plus tôt après 4 semaines (effet maximal) et selon les taux des lipides.
Posologie pour le traitement de la prophylaxie secondaire après infarctus du myocarde: 40 mg par jour. Si l'on atteint un taux des LDL d'environ 3,2 mmol/l, on pourrait considérer une posologie inférieure à 40 mg pour réduire le risque d'effets coronaires (voir aussi «Propriétés/Effets: Résultats obtenus de l'étude CARE»).
Instructions posologiques spéciales
Enfants et adolescents souffrant d'hypercholestérolémie hétérozygote familiale
Chez les patients âgés de 14 à 18 ans, la dose recommandée est de 10 à 40 mg de Pravastatin Zentiva une fois par jour. Il n'existe pas de données sur des doses supérieures à 40 mg. Chez les enfants âgés de 8 à 13 ans, la dose maximale est de 20 mg une fois par jour (les doses supérieures à 20 mg n'ont pas été étudiées chez cette population). L'administration de Pravastatin Zentiva n'est pas recommandée chez les enfants de moins de 8 ans, en raison du manque d'expérience.
Personnes sous ciclosporine
Chez les sujets traités à la ciclosporine seule ou en association, on devrait commencer le traitement par une dose initiale quotidienne de 10 mg de Pravastatin Zentiva. L'augmentation de la posologie devrait se faire avec prudence. La plupart des personnes traitées par une association ciclosporine/Pravastatin Zentiva ont reçu une posologie maximale de 20 mg par jour; voir aussi «Interactions».
Personnes âgées et patients avec insuffisance rénale
Parce que les données disponibles sont limitées, on recommande d'administrer des doses plus faibles aux sujets âgés (>65 ans) et aux patients avec insuffisance rénale.
Patients avec maladie hépatique
Voir «Contre-indications», «Mises en garde et précautions» et «Effets indésirables».
Traitement associé à l'acide nicotinique, au probucol et aux résines échangeuses d'ions
Les études pharmacocinétiques portant sur les interactions pharmacocinétiques associant pravastatine à l'acide nicotinique et au probucol n'ont révélé aucune affection de la biodisponibilité de la pravastatine; voir aussi «Interactions».
L'effet de Pravastatin Zentiva (abaissement du taux de cholestérol total et du LDL cholestérol) peut être potentialisé par l'administration concomitante d'une résine échangeuse d'ions qui lie les acides biliaires (colestyramine, colestipol). Dans ce cas, Pravastatin Zentiva devrait être administré au moins une heure avant ou plus de quatre heures après la résine; voir aussi «Interactions».
Contre-indications
Hypersensibilité connue à l'un des constituants des comprimés.
Maladie hépatique active et élévation persistante inconnue des transaminases (SGOT [ASAT], SGPT [ALAT] >3 fois la valeur normale supérieure) et cholestase (voir aussi «Mises en garde et précautions» et «Effets indésirables: Affections hépatobiliaires»).
Grossesse, allaitement (voir aussi «Grossesse/Allaitement»).
Mises en garde et précautions
Foie
Pravastatin Zentiva devrait être utilisé avec prudence lorsque l'anamnèse révèle une maladie hépatique ou une forte consommation d'alcool (voir «Effets indésirables: Affections hépatobiliaires»).
Comme avec d'autres agents hypolipémiants, il faudrait contrôler régulièrement les valeurs hépatiques (transaminases) durant le traitement par Pravastatin Zentiva. On surveillera particulièrement attentivement les sujets dont les transaminases s'élèvent au cours du traitement; chez ces patients, il faudrait immédiatement répéter les analyses et les effectuer plus fréquemment. Au cas où l'alanine aminotransférase (ALAT, SGPT) et l'aspartate aminotransférase (ASAT, SGOT) progresseraient à plus de 3 fois la valeur normale ou persisteraient, on devrait arrêter le traitement. Voir aussi «Contre-Indications» et «Effet indésirables: Affections hépatobiliaires».
Diabète sucré
Certains indices suggèrent que la classe des statines provoque une augmentation de la glycémie. Chez certains patients présentant un risque accru de développer un diabète, cet effet peut conduire à un degré d'hyperglycémie nécessitant un traitement antidiabétique approprié. Ce phénomène n'est toutefois pas une raison d'arrêter le traitement aux statines, étant donné que la réduction du risque vasculaire obtenue sous statines l'emporte sur le risque de diabète. Les patients à risque (glycémie à jeun de 5,6 à 6,9 mmol/l, IMC >30 kg/m², taux accrus de triglycérides, hypertension) doivent être surveillés aussi bien cliniquement que biochimiquement selon les recommandations nationales.
Hypercholestérolémie familiale homozygote
Lors d'hypercholestérolémie familiale homozygote qui survient rarement, il manque aux sujets des récepteurs cellulaires des LDL, d'où l'effet plus faible d'un inhibiteur de la HMG-CoA réductase. On ne dispose pour ces cas d'aucune expérience clinique avec Pravastatin Zentiva.
Personnes âgées et personnes avec insuffisance rénale
Voir aussi «Posologie/Mode d'emploi: Instructions posologiques spéciales».
Muscles du squelette
Myopathie/Rhabdomyolyse
Le risque d'une myopathie et d'une rhabdomyolyse pourrait être accru lors du traitement associé aux inhibiteurs du cytochrome P-450 (en particulier l'isoenzyme 3A4) ou lors du traitement associé aux fibrates ou à la ciclosporine (voir aussi «Interactions»).
Des contractures et des fissurations musculaires, y compris des déchirures musculaires ont été signalées pendant le traitement par pravastatine.
Il convient de conseiller aux patients qui subissent des troubles musculaires (douleurs, crampes ou faiblesse) inexplicables au cours du traitement de consulter immédiatement leur médecin afin qu'il puisse prendre les mesures nécessaires; voir aussi le chapitre suivant «Contrôle et interprétation du taux de la créatine kinase».
Contrôle et interprétation du taux de la créatine kinase
Il n'est pas recommandé de faire des contrôles de routine du taux de la créatine kinase (CK) ou d'autres enzymes musculaires chez les patients asymptomatiques recevant une thérapie par une statine. Cependant, avant l'administration d'une statine, on recommande de mesurer la CK chez les personnes particulièrement prédisposées et les patients qui ont subi des symptômes musculaires sous le traitement par une statine (voir description ci-dessous). Au cas où la valeur initiale de la CK serait significativement élevée (>5 fois la limite supérieure de la norme), on recommande de mesurer la créatine kinase encore une fois environ 5 à 7 jours plus tard afin de confirmer les résultats. Le taux mesuré sera évalué en relation avec d'autres facteurs potentiels qui pourraient provoquer des troubles musculaires passagers (p.ex. efforts physiques intenses, traumatisme musculaire).
- Avant le traitement: La prudence s'impose chez les patients avec une prédisposition (p.ex. âge avancé (>65), insuffisance rénale, hypothyroïdie non contrôlée (hypothyréose), antécédents de toxicité musculaire sous traitement par des statines ou par des fibrates, maladie musculaire héréditaire ou prédisposition pour une maladie musculaire en raison d'anamnèse familiale, abus d'alcool). Dans ces cas, on devrait mesurer la CK avant l'instauration du traitement. Un contrôle de la CK avant la thérapie sera aussi envisagé chez les patients âgés de plus de 70 ans, particulièrement lorsqu'ils ont d'autres prédispositions. Au cas où la CK serait significativement élevée (valeur initiale >5 fois la limite supérieure de la norme) on renoncera au traitement et on mesurera la CK encore une fois 5 à 7 jours plus tard. La valeur initiale de la créatine kinase pourrait être utile comme référence au cas où le taux augmenterait plus tard durant la thérapie par la statine.
- Durant le traitement: Les patients devraient être avisés d'informer leur médecin immédiatement de tous les troubles musculaires (douleurs, tensions, faiblesses, crampes) d'étiologie inconnue. Dans ces cas, on procédera au contrôle de la CK. Si celle-ci est significativement élevée (>5 fois la limite supérieure de la norme), il faudrait arrêter le traitement par la statine. L'arrêt du traitement sera également envisagé si les symptômes musculaires sont sévères et posent une gêne quotidienne pour le patient, même au cas où la CK serait ≤5 fois de la norme. Si les symptômes régressent et le taux de la CK se normalise, on pourrait envisager la réintroduction du traitement par la statine, tout en utilisant la dose la plus basse et en surveillant le patient de près. Si l'on suspecte le patient d'avoir une maladie musculaire héréditaire, on ne recommandera pas la réintroduction du traitement par la statine.
Dans de très rares cas, une myopathie nécrosante immuno-médiée (immune-mediated necrotizing myopathy, IMNM) a été signalée pendant ou après le traitement par certaines statines, en ce compris la pravastatine. Les caractéristiques cliniques d'une IMNM sont une faiblesse musculaire proximale persistante et des valeurs accrues de créatine kinase sérique, qui demeurent importantes malgré l'arrêt du traitement aux statines.
Les inhibiteurs de la HMG-CoA réductase (statines), Pravastatin Zentiva y compris, ne doivent pas être utilisés conjointement à des préparations systémiques à base d'acide fusidique.
Des cas de rhabdomyolyse (avec décès dans quelques cas) ont été signalés chez des patients qui recevaient des préparations systémiques à base d'acide fusidique en association à des statines (voir «Interactions»).
Le traitement par Pravastatin Zentiva doit être arrêté pendant une thérapie systémique à base d'acide fusidique qui s'avère indispensable. Les patients doivent être informés qu'ils doivent solliciter un avis médical immédiatement s'ils remarquent des signes de faiblesse, de douleurs ou de sensibilité musculaires.
Le traitement aux statines peut reprendre 7 jours après la dernière dose d'acide fusidique.
Dans des situations exceptionnelles, si un traitement systémique continu par acide fusidique est nécessaire, l'utilisation concomitante de Pravastatin Zentiva et d'acide fusidique ne doit être envisagée qu'au cas par cas et sous étroite surveillance médicale.
Pneumopathie interstitielle
Avec certaines statines, dont la pravastatine, des cas isolés de pneumopathie interstitielle ont été signalés, en particulier en cas de traitement à long terme (voir «Effets indésirables, Étude observationnelle postmarketing»). Les symptômes peuvent comprendre: détresse respiratoire (dyspnée), toux sèche et détérioration de la santé globale (fatigue, perte de poids et fièvre). Si l'on suspecte que le patient a contracté une pneumopathie interstitielle, le traitement aux statines doit être arrêté.
Enfants de moins de 8 ans
L'administration de Pravastatin Zentiva n'est pas recommandée chez les enfants de moins de 8 ans, en raison du manque d'expérience.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé, c.-à-d. qu'il est essentiellement «sans sodium».
Pravastatin Zentiva comprimés contiennent du lactose. Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne devraient pas prendre ce médicament.
Interactions
Inhibiteurs des isoenzymes 3A4 du cytochrome P-450 (p.ex. itraconazole, diltiazem, ciclosporine)
Des études in vitro ont démontré que la pravastatine ne présente qu'une faible affinité pour le cytochrome P-450 3A4. Donc, le métabolisme par l'isoenzyme 3A4 du cytochrome P-450 ne joue aucun rôle important (voir aussi «Pharmacocinétique: Métabolisme»).
Chez des volontaires sains, on n'a pas trouvé d'interactions significatives entre pravastatine et l'itraconazole ou le diltiazem.
Une étude d'interaction avec la ciclosporine a montré une élévation des taux de pravastatine (AUC = 2,3 fois et Cmax = 2,6 fois). Les taux de ciclosporine n'ont pas été mesurés.
Par contre, deux études portées sur des transplantés cardiaques et rénaux ont révélé des taux élevés de pravastatine (5 fois supérieurs à la valeur AUC). Aucun cas de myopathie n'a été observé dans les études cliniques incluant 100 sujets transplantés (76 transplantations du cœur et 24 transplantations du rein) sous traitement par l'association pravastatine (10-40 mg par jour) et ciclosporine sur une période de 2 années au maximum; certains patients ont même reçu un immunosuppresseur additionnel (voir aussi «Effets indésirables: Affections musculosquelettiques et du tissu conjonctif»).
Antipyrines (phénytoïne, quinidine, etc.)
La clairance des antipyrines, qui se fait par le système du cytochrome P-450, n'a pas été modifiée par l'administration simultanée de pravastatine. D'autre part, pravastatine ne semble pas entraîner une induction des enzymes hépatiques intervenant dans le métabolisme de ces substances. Par conséquent, des interactions avec d'autres substances métabolisées par le système du cytochrome P-450 sont improbables.
Résines échangeuses d'ions liant les acides biliaires (colestyramine, colestipol)
Lorsque pravastatine a été administré au moins 1 heure avant ou 4 heures après la colestyramine, ou 1 heure avant le colestipol et un repas standard, on n'a observé aucune réduction cliniquement significative de la biodisponibilité ou de l'effet clinique du médicament (voir «Posologie/Mode d'emploi: Instructions posologiques spéciales»). La biodisponibilité de la pravastatine se trouve diminuée lors de l'administration simultanée (diminution de l'AUC: 40−50%).
Dérivés coumariniques (warfarine)
Lors d'une étude portée sur des volontaires âgés sous traitement par la warfarine, l'administration concomitante de pravastatine (40 mg par jour) n'a entraîné aucun effet cliniquement significatif sur le temps de prothrombine.
Acide nicotinique
Les observations faites sur un nombre restreint de patients sous le traitement associant pravastatine et l'acide nicotinique n'ont révélé aucun cas de myopathie.
Acide acétylsalicylique et antacides (1 heure avant l'administration de pravastatine), cimétidine, acide nicotinique ou probucol
Aucune influence sur la biodisponibilité de la pravastatine.
Macrolides
Les macrolides peuvent augmenter l'exposition aux statines s'ils sont utilisés en association.
Dans une étude d'interaction avec l'érythromycine, une augmentation statistiquement significative de l'AUC (70%) et de la Cmax (121%) a été observée pour la pravastatine; dans une étude avec la clarithromycine, ces paramètres de la pravastatine ont été significativement augmentés sur le plan statistique (AUC = 110% et Cmax = 127%). Aucune élévation de la demi-vie (T½) n'a été observée.
Même si ces variations de la biodisponibilité de la pravastatine étaient modérées, la pravastatine ne doit être utilisée qu'avec prudence lorsqu'elle est associée à des antibiotiques macrolides en raison du risque potentiel accru de myopathies.
Fibrates
L'utilisation de fibrates seuls a occasionnellement été associé à une myopathie. Un risque accru d'événements indésirables musculosquelettiques, y compris la rhabdomyolyse, a été signalé lorsque les fibrates étaient administrés avec d'autres statines. Ces événements indésirables ne pouvant pas être exclus avec la pravastatine, il faut généralement éviter l'association de pravastatine et de fibrates (p.ex. gemfibrozil, fénofibrate). Lorsque cette association est considérée comme nécessaire, une surveillance clinique étroite s'impose, couplée à une surveillance de la créatine phosphokinase (CPK) sérique.
Une étude réalisée avec un nombre limité de patients sous traitement associant pravastatine (40 mg par jour) et le gemfibrozil (1200 mg par jour) n'a révélé aucun cas de myopathie, bien qu'on ait observé parfois des élévations de la CK et des symptômes musculosquelettiques (p.ex. douleurs musculaires).
Antifongiques de la classe des dérivés azolés
Les statines et les antifongiques de la classe des dérivés azolés inhibent la biosynthèse du cholestérol à différents niveaux. Chez les patients recevant de la ciclosporine et nécessitant un traitement antifongique systémique par un agent azolé, il faudrait interrompre l'administration de pravastatine temporairement. Les patients qui ne reçoivent pas de ciclosporine devraient être surveillés attentivement lorsqu'ils sont mis sous traitement systémique par un antifongique azolé.
Préparations systémiques à base d'acide fusidique
L'association de statines, Pravastatin Zentiva y compris, et d'acide fusidique peut entraîner des rhabdomyolyses potentiellement mortelles. Des cas de rhabdomyolyse (dont certains ont entraîné le décès) ont été signalés chez des patients qui recevaient des préparations systémiques à base d'acide fusidique en association à des statines (voir «Mises en garde et précautions»). Le mécanisme régissant cette interaction n'est pas connu.
Le traitement par Pravastatin Zentiva doit être arrêté pendant une thérapie systémique à base d'acide fusidique qui s'avère indispensable.
Le traitement par Pravastatin Zentiva peut reprendre sept jours après l'administration de la dernière dose d'acide fusidique.
Autres thérapeutiques
On ne connaît aucune interaction cliniquement significative entre pravastatine et les agents thérapeutiques suivants: diurétiques, antihypertenseurs, glucosides digitaliques, inhibiteurs de l'ECA, antagonistes de calcium, bêta-bloquants ou nitroglycérine.
Grossesse/Allaitement
Grossesse
Pravastatin Zentiva est contre-indiqué pendant la grossesse (voir aussi «Contre-indications»).
L'athérosclérose est un processus chronique, et une interruption du traitement hypolipémiant chez la femme enceinte n'a qu'une légère influence, à long terme, sur l'hypercholestérolémie primaire. Le cholestérol et ses dérivés sont essentiels pour le développement du fœtus (y compris la synthèse des stéroïdes et des membranes cellulaires). Comme les statines pourraient également inhiber la synthèse d'autres dérivés bioactifs du cholestérol, on ne peut pas exclure une affection du fœtus lors du traitement par ces agents durant la grossesse.
On connaît quelques cas de malformations congénitales chez des nourrissons dont les mères, lorsqu'elles étaient enceintes, avaient pris une statine.
Durant la thérapie par Pravastatin Zentiva, des mesures anticonceptionnelles fiables s'imposent chez les femmes en âge de procréer.
Les patientes doivent être avisées des risques signalés et de l'importance d'une contraception appropriée.
Lorsqu'une patiente tombe enceinte au cours de la thérapie par Pravastatin Zentiva, il faut arrêter le traitement et informer la patiente sur le risque pour le fœtus.
Allaitement
Bien que seules de petites quantités de pravastatine passent dans le lait maternel, il faudrait renoncer à l'allaitement de l'enfant au cours du traitement par Pravastatin Zentiva, en raison d'effets indésirables potentiels pour le nourrisson.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Au cas où des effets indésirables surviendraient, ceux-ci pourraient influencer la capacité de réaction, les aptitudes à conduire un véhicule, à utiliser des outils et des machines.
Effets indésirables
Dans le cadre d'études cliniques contrôlées ouvertes, le traitement par pravastatine a été arrêté chez environ 2% des patients, en raison d'effets indésirables associés au médicament.
Des myalgies, myopathies, rhabdomyolyses, polyneuropathies et arthralgies ont été rapportées lors du traitement par des statines (voir aussi ci-dessous «Affections musculosquelettiques et du tissu conjonctif» et chapitre «Mises en garde et précautions»).
Affections hépatobiliaires
Des cas isolés d'hépatite ont été rapportés.
Les statines ont été mises en rapport avec une élévation des taux sériques des enzymes hépatiques. On a occasionnellement observé chez les patients traités par pravastatine une élévation des transaminases sériques à moins de 3 fois la valeur normale supérieure. La signification clinique de cette élévation, qui survient généralement durant les premiers mois du traitement, n'est pas connue à ce jour. Dans le cadre d'études cliniques, on a observé chez 0,5% (6 sur 1139) des patients une élévation marquée (plus de 3 fois la valeur normale supérieure) et persistante des taux enzymatiques; aucun symptôme clinique d'une maladie hépatique ne s'est manifesté et les valeurs élevées se sont normalisées après l'arrêt du traitement (à l'exception de deux patients). Voir aussi «Contre-indications» et «Mises en garde et précautions: Affections hépatobiliaires».
Affections gastro-intestinales
On a observé des cas isolés de pancréatite lors du traitement par pravastatine. Aucun lien de cause à effet avec le principe actif n'a été mis en évidence.
Affections musculosquelettiques et du tissu conjonctif
Des myalgies non compliquées ont été observées lors du traitement par pravastatine (même incidence que lors du traitement par placebo). Dans le cadre d'études cliniques, on a observé chez moins de 0,1% des patients des myopathies (définition: douleur ou faiblesse musculaire accompagnée d'une élévation de la créatine kinase à 10 fois la valeur normale supérieure) qui ont été en corrélation possible avec pravastatine.
Une rhabdomyolyse accompagnée d'une dysfonction rénale, suite à une myoglobinurie, a été observée très rarement sous le traitement par pravastatine.
La rhabdomyolyse est un effet indésirable potentiellement fatal.
Le risque de myopathie est accru lorsque certaines statines sont co-administrées avec des fibrates, des immunosuppresseurs (y compris la ciclosporine), l'érythromycine ou la niacine (acide nicotinique).
Affections oculaires
Chez 820 patients sous traitement par pravastatine (durée du traitement jusqu'à un an ou plus) on n'a observé aucun signe d'opacification du cristallin.
Dans une étude contrôlée par placebo et menée sur env. 300 patients, l'opacification du cristallin a été évaluée après 6 et 12 mois.
Pravastatine Nombre de patients (%) | Placebo/contrôle Nombre de patients (%) | |
|---|---|---|
Amélioration | 29 (14%) | 13 (14%) |
Aucun changement | 142 (70%) | 63 (68%) |
Aggravation | 31 (15%) | 16 (17%) |
Total | 202 | 92 |
La différence entre les patients du groupe pravastatine et du groupe placebo ne s'est pas révélée statistiquement significative.
Affections de la peau et du tissu sous-cutané
Le traitement par pravastatine s'est accompagné d'éruptions cutanées (peu intenses dans la plupart des cas) et de prurit. La posologie et la durée du traitement n'ont pas pu être mises en relation avec ces effets indésirables.
Affections du système immunitaire
Sous le traitement par pravastatine, on peut observer des cas isolés de réactions d'hypersensibilité accompagnées de l'un ou plusieurs des symptômes suivants: œdème de Quincke, réactions anaphylactoïdes (chute de la pression sanguine), dermatomyosite.
Investigations
Elévation des taux des transaminases et du taux de la créatine kinase: voir «Affections hépatobiliares» et «Affections musculosquelettiques et du tissu conjonctif».
Effets indésirables observés au cours des études à long terme, contrôlées par placebo
Dans les 7 études de morbidité et de mortalité en double aveugle, randomisées et contrôlées par placebo, incluant plus de 21'400 patients traités par la pravastatine (n= 10'764) ou placebo (n= 10'719), la tolérance et l'innocuité de pravastatine ont été comparables par rapport au placebo. Plus de 19'000 patients ont été traités pendant 4,8 à 5,9 ans (durée médiane); les autres patients ont été traités durant une période de 2 ans ou plus.
Tableau des effets indésirables observés chez ≥1% des patients (causalité probable, possible ou incertaine)
Discipline médicale | Pravastatine | Placebo |
|---|---|---|
Affections gastro-intestinales | ||
Dyspepsie/aigreurs | 3,5 | 3,7 |
Douleurs abdominales | 2,4 | 2,5 |
Nausées/vomissements | 1,6 | 1,6 |
Flatulence | 1,2 | 1,1 |
Constipation | 1,2 | 1,3 |
Affections musculo-squelettiques et du tissu conjonctif | ||
Douleurs musculo-squelettiques (y compris arthralgie) | 6,0 | 5,8 |
Crampes musculaires | 2,0 | 1,8 |
Myalgie | 1,4 | 1,4 |
Affections respiratoires, thoraciques et médiastinales | ||
Dyspnée | 1,6 | 1,6 |
Infections des voies respiratoires supérieures | 1,3 | 1,3 |
Toux | 1,0 | 1,0 |
Affections du système nerveux | ||
Obnubilation | 2,2 | 2,1 |
Maux de tête | 1,9 | 1,8 |
Troubles du sommeil | 1,0 | 0,9 |
Dépression | 1,0 | 1,0 |
Angoisse/nervosité | 1,0 | 1,2 |
Affections de la peau et du tissu sous-cutané | ||
Eruptions cutanées (rash) | 2,1 | 2,2 |
Affections cardiaques | ||
Angine de poitrine | 3,1 | 3,4 |
Affections du rein et des voies urinaires | ||
Troubles de la miction (y compris dysurie, nocturie) | 1,0 | 0,8 |
Affections oculaires | ||
Troubles visuelles (y compris vision floue, diplopie) | 1,6 | 1,3 |
Troubles généraux | ||
Fatigue | 3,4 | 3,3 |
Douleur thoracique | 2,6 | 2,6 |
Tableau des effets indésirables observés chez <1,0% (incidence totale) des patients; ces effets ont également été observés lors du traitement par d'autres statines et dans l'expérience postmarketing
Discipline médicale | Pravastatine | Placebo |
|---|---|---|
Affections gastro-intestinales | ||
Diminution de l'appétit | 0,3 | 0,3 |
Affections musculo-squelettiques et du tissu conjonctif | ||
Faiblesse musculaire | 0,1 | <0,1 |
Affections du système nerveux | ||
Paresthésies | 0,9 | 0,9 |
Vertige | 0,4 | 0,4 |
Insomnie | 0,3 | 0,2 |
Troubles de mémoire | 0,3 | 0,3 |
Tremblement | 0,1 | 0,1 |
Neuropathie (y compris neuropathie périphérique) | 0,1 | 0,1 |
Affections de la peau et du tissu sous-cutané | ||
Prurit | 0,9 | 1,0 |
Dermatite | 0,4 | 0,5 |
Sécheresse de la peau | 0,2 | 0,1 |
Altérations au niveau du cuir chevelu et des cheveux (y compris alopécie) | 0,1 | 0,1 |
Urticaire | 0,1 | 0,1 |
Affections oculaires | ||
Opacité du cristallin | 0,5 | 0,4 |
Affections du système immunitaire | ||
Allergie | 0,1 | 0,1 |
Oedèmes au niveau de la tête et de la gorge | 0,1 | 0,1 |
Affections endocriniennes | ||
Dysfonction sexuelle | 0,7 | 0,7 |
Troubles de la libido | 0,3 | 0,3 |
Troubles généraux | ||
Troubles de la gustation | 0,1 | 0,1 |
Fièvre | 0,2 | 0,2 |
Flushing | 0,1 | 0,1 |
Etude observationnelle postmarketing
En plus des événements susmentionnés, les effets indésirables suivants ont également été signalés:
Affections de la peau et du tissu sous-cutané
Angio-œdème, réaction de photosensibilité, dermatomyosite.
Affections hépatobiliaires
Jaunisse, ictère cholestatique, hépatite, nécrose hépatique fulminante, anomalies au test de la fonction hépatique.
Affections musculo-squelettiques et du tissu conjonctif
Syndrome de type lupus érythémateux, tendinopathie (en particulier tendinite et rupture de tendons), contractures et fissurations musculaires ainsi que déchirures musculaires, polymyosite et myopathie nécrosante immuno-médiée.
Affections gastro-intestinales
Pancréatite.
Affections hématologiques et du système lymphatique
Thrombopénie.
Affections psychiatriques
Cauchemars.
Affections respiratoires, thoraciques et médiastinales
Pneumopathie interstitielle.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Il n'y a que de données limitées en ce qui concerne les effets d'un surdosage.
En cas de surdosage, on recommande d'initier une thérapie symptomatique tout en surveillant les paramètres de laboratoire et, si nécessaire, de prendre des mesures de soutien supplémentaires.
Propriétés/Effets
Code ATC
C10AA03
Inhibiteur de la HMG-CoA réductase (statine)
Mécanisme d'action
La pravastatine est un principe actif appartenant à la famille des inhibiteurs de la HMG-CoA réductase (statine). Pravastatine inhibe de manière compétitive la HMG-CoA réductase, l'enzyme qui catalyse l'étape déterminant la vitesse de la biosynthèse du cholestérol. L'effet hypolipémiant repose sur deux mécanismes: d'une part, l'inhibition de la HMG-CoA réductase entraîne une diminution modérée du pool intracellulaire de cholestérol (d'où l'augmentation compensatoire des récepteurs des LDL à la surface des cellules) et une stimulation de la clairance et du catabolisme des LDL circulants; d'autre part, la pravastatine entrave la néosynthèse des LDL par une inhibition de la synthèse hépatique des VLDL, précurseurs des LDL. Les essais in vitro et l'expérimentation animale ont montré que la pravastatine hydrophile agit très sélectivement sur les tissus hépatique et iléal, c'est-à-dire les tissus où la synthèse du cholestérol est la plus prononcée. Contrairement à d'autres statines, la pravastatine ne manifeste qu'une activité faible, voire nulle, dans les autres tissus (p.ex. le cristallin, les testicules, les muscles).
Chez les animaux on n'a pas trouvé de pravastatine dans le liquide cérébrospinal.
Pravastatine n'a aucun effet négatif sur les taux plasmatiques de lipoprotéine (a) et de fibrinogène, deux marqueurs de risque biochimiques indépendants bien connus de la maladie coronarienne.
Pharmacodynamique
Aucune information.
Efficacité clinique
Etude clinique sur l'hypercholestérolémie primaire chez les adultes
Relation dose-effet de pravastatine*, administration une fois par jour avant le coucher
Posologie | Cholestérol total | LDL-C | HDL-C | TG |
|---|---|---|---|---|
10 mg | -16% | -22% | +7% | -15% |
20 mg | -24% | -32% | +2% | -11% |
40 mg | -25% | -34% | +12% | -24% |
* Ecart de la valeur de base au bout de 8 semaines de traitement.
Un effet thérapeutique peut être constaté en l'espace d'une semaine, l'effet maximal étant souvent atteint au bout de 4 semaines de traitement et maintenu pendant des traitements prolongés. En outre, pravastatine réduit le taux plasmatique d'apolipoprotéine B.
Autres études cliniques
Chez les patients souffrant d'hypercholestérolémie modérée et d'une maladie cardiovasculaire induite par l'athérosclérose et chez les patients ayant subi un infarctus du myocarde et présentant un taux de cholestérol moyen (normal), pravastatine a inhibé la progression de l'athérosclérose tout en réduisant la fréquence des accidents cardiovasculaires. En outre, pravastatine réduit le risque de mortalité totale et de mort due à la cardiopathie coronarienne, la fréquence d'événements coronariens répétés (y compris infarctus du myocarde), la fréquence d'accidents vasculaires cérébraux ou d'attaques ischémiques transitoires (AIT), la fréquence des revascularisations du myocarde (by-pass, angioplastie coronarienne transluminale percutanée) et les hospitalisations nécessaires à cause de l'angor instable chez les patients avec des antécédents d'infarctus du myocarde ou d'angor instable.
Lors de l'étude WOSCOP (West of Scotland Coronary Prevention Study), on a étudié 6595 patients masculins (45 à 64 ans) atteints d'hypercholestérolémie moyenne à sévère (cholestérol total de 7,0 ± 0,6 mmol/l) et sans antécédents d'infarctus du myocarde.
Outre un traitement standard et des conseils diététiques, les patients ont reçu pendant une durée médiane de 4,8 ans, soit pravastatine (n= 3302) à raison de 40 mg une fois par jour, soit un placebo (n= 3293).
Résultats obtenus de l'étude WOSCOP
Réduction | Valeur p | |
|---|---|---|
Paramètre d'évaluation primaire: Mort due à une coronaropathie ou infarctus du myocarde non mortel | -31% | <0,001 |
Mortalité cardiovasculaire (y compris accident vasculaire cérébral) | -32% | 0,03 |
Mortalité totale* | -24% | 0,04 |
By-pass ou angioplastie coronarienne transluminale percutanée | -37% | 0,009 |
Coronarographie | -31% | 0,007 |
Mortalité non cardiovasculaire | -11% | p = 0,54 (non significatif) |
* Compte tenu des facteurs de risque
L'effet s'est manifesté déjà durant les premiers 6 mois du traitement. Pravastatine a réduit le risque d'effets coronariens sévères dans une mesure similaire, sur tout le spectre des valeurs initiales du LDL cholestérol et indépendamment des groupes d'âge étudiés.
PLAC-I (Pravastatin Limitation of Atherosclerosis in the Coronary Arteries) et PLAC II (Pravastatin Limitation of Atherosclerosis in the Carotid Arteries) sont des études randomisées, en double aveugle, et contrôlées par placebo, qui ont été menées chez des sujets hypercholestérolémiques.
Résultats obtenus des études PLAC-I et PLAC-II
PLAC-I | PLAC-II | |
|---|---|---|
Coronaropathie, angiographie | Etat après infarctus du myocarde ou coronaropathie angiographique et sclérose carotidienne | |
Nombre de patients | 408 | 151 |
Posologie | 40 mg | 10-40 mg |
Infarctus du myocarde* | Placebo: 10,5% Pravastatine: 2,7% p = 0,006 | Placebo: 13,3% Pravastatine: 2,7% p = 0,018 |
Infarctus du myocarde non mortel et mortalité totale | Placebo: 11,6% Pravastatine: 4,4% p = 0,02 | Placebo: 17,1% Pravastatine: 6,7% p = 0,049 |
* Fréquence sur 3 ans, d'après la méthode de Kaplan-Meier
Lors de l'étude CARE (Cholesterol and Recurrent Events), on a traité pendant une durée moyenne de 4,9 ans, avec 1× 40 mg de pravastatine par jour, 4159 hommes et femmes qui, après un infarctus du myocarde, ont présenté un taux de cholestérol total inférieur à 6,2 mmol/l (c'est-à-dire un taux de cholestérol normal après un infarctus du myocarde). Le taux initial moyen du cholestérol total était de 5,4 mmol/l. Il en résultait donc, pour les femmes que pour les hommes, une réduction significative du risque de ce paramètre d'évaluation.
Résultats obtenus de l'étude CARE
Réduction | Valeur p | |
|---|---|---|
Paramètre d'évaluation primaire: Mort due à une coronaropathie ou infarctus du myocarde non mortel | -24% | 0,003 |
By-pass ou angioplastie coronarienne transluminale percutanée | -27% | <0,001 |
Accident vasculaire cérébral | -31% | 0,03 |
Une analyse multivariée des résultats de l'étude CARE a révélé que le taux des LDL (réduction au niveau d'environ 3,2 mmol/l) est un indicateur significatif mais non linéaire pour la fréquence d'événements coronariens. A condition qu'un taux des LDL d'environ 3,2 mmol/l est atteint (observé chez plus de 90% des patients traités par pravastatine dans l'étude CARE), des doses inférieures à 40 mg de pravastatine par jour pourraient éventuellement réduire le risque d'effets coronariens.
Dans l'étude clinique LIPID (Long Term Intervention with Pravastatin in Ischemic Disease), on a étudié l'effet de pravastatine sur 9014 hommes et femmes avec des taux de cholestérol normaux ou élevés (valeur initiale du cholestérol total = 4,0 à 7,0 mmol/l ou 155 à 271 mg/dl; cholestérol total moyen = 5,6 mmol/l ou 218 mg/dl) et qui, dans les 3 à 36 mois précédents, ont subi un infarctus du myocarde ou une hospitalisation à cause d'angor instable. On a inclus des patients avec des larges spectres de valeurs initiales des triglycérides (<5,0 mmol/l [445 mg/dl]), et l'inclusion n'a pas été limitée par les valeurs initiales de HDL cholestérol. En début de l'étude, 82% des patients ont pris de l'aspirine, 47% un bêta-bloquant, 35% un antagoniste de calcium et 16% un inhibiteur de l'enzyme de conversion de l'angiotensine. Les patients ont participé pendant une durée moyenne de 5,6 ans (médiane: 5,9 ans) à cette étude multicentrique, pratiquée en double aveugle et contrôlée par placebo.
Résultats de l'étude LIPID
Réduction | Valeur p | |
|---|---|---|
Paramètre d'évaluation primaire: Mort due à la coronaropathie | -24% | <0,001 |
Evénements coronariens (mort due à la coronaropathie ou infarctus du myocarde non-mortel) | -24% | <0,001 |
Infarctus du myocarde mortel ou non-mortel | -29% | <0,001 |
Mortalité cardiovasculaire | -25% | <0,001 |
Mortalité totale | -23% | <0,0001 |
Revascularisations du myocarde (by-pass ou angioplastie coronarienne transluminale percutanée) | -20% | <0,001 |
Accident vasculaire cérébral | -19% | <0,05 |
Hospitalisation | -15% | <0,001 |
Mortalité totale chez les patients avec antécédents d'infarctus du myocarde | -21% | <0,01 |
Infarctus du myocarde mortel ou non-mortel chez les patients avec antécédents d'infarctus du myocarde | -25% | <0,001 |
Mortalité totale chez les patients avec hospitalisation précédente due à l'angor instable | -26% | <0,01 |
Infarctus du myocarde mortel ou non-mortel chez les patients avec hospitalisation précédente due à l'angor instable | -37% | <0,001 |
La réduction des événements coronariens par pravastatine dans certains sous-groupes (âge, sexe, état diabétique) était consistante, mais pas significative (due au petit nombre de patients).
Etude clinique chez les enfants et les adolescents
Dans une étude en double-aveugle contrôlée par placebo on a traité durant 2 ans 214 patients pédiatriques âgés d'au moins 8 ans et souffrant d'hypercholestérolémie hétérozygote familiale.
L'étude a démontré chez les enfants (âgés d'au moins 8 ans) et chez les adolescents une réduction moyenne significative du taux LDL-C de 22,9% et du taux de choléstérol total de 17,2% ainsi qu'une réduction du taux de l'apolipoprotéine B.
On n'a pas observé d'influence des paramètres endocriniens [ACTH, hydrocortisone, DHEAS, FSH, LH, TSH, estradiol (population féminine) ou testostérone (population masculine)]. On n'a observé aucune différence dans le développement, dans les testicules (grosseur) ou au niveau de la classification selon Tanner (Tanner's score).
Pharmacocinétique
Absorption
La pravastatine représente la forme active de la substance thérapeutique. Après l'administration par voie orale, le sel de pravastatine est rapidement absorbé, les taux sanguins maximaux étant atteints 1 à 1,5 h après l'application. Sur la base du taux de récupération urinaire de substance marquée avec un traceur radioactif, on a calculé qu'en moyenne 34% de la pravastatine administrée par voie orale sont absorbés; la biodisponibilité absolue est d'environ 17%.
L'effet hypolipémiant de la pravastatine ne dépend pas de la présence ou de l'absence d'aliments dans le tube digestif. C'est pourquoi la diminution de la biodisponibilité de la pravastatine (observée dans les études de pharmacocinétique) est sans signification clinique.
Les taux sériques de la pravastatine (AUC = area under the curve, Cmax = concentration sérique maximale et Cmin = concentration minimale au steady-state) sont directement proportionnels à la dose administrée.
Une seule prise quotidienne de pravastatine avant le coucher, malgré une biodisponibilité systémique diminuée, est légèrement plus efficace qu'une prise quotidienne matinale.
Distribution
Le volume de distribution de la pravastatine au steady-state est de 0,5 l/kg (VDss). En raison de l'absorption hépatique extensive de la pravastatine et de sa métabolisation, les valeurs des concentrations plasmatiques ne reflètent que de façon limitée l'effet hypolipémiant du médicament.
Le taux de liaison aux protéines plasmatiques est d'environ 50%; une petite quantité de la dose administrée par voie orale passe dans le lait maternel.
Des études in vitro ont démontré que la pravastatine est absorbée de façon plus significative par les hépatocytes que par d'autres cellules.
Métabolisme
Dans le foie, la pravastatine subit un effet de premier passage extensif (env. 66% de la dose absorbée par voie orale).
Le métabolite principal de la pravastatine est le 3-alpha-hydroxy-isomère. Celui-ci développe 1/10 à 1/40 de l'activité inhibitrice de la pravastatine sur la HMG-CoA réductase.
La pravastatine n'est pas significativement métabolisée par le système du cytochrome P450 et n'est pas un substrat ni un inhibiteur de la P-glycoprotéine.
Élimination
La demi-vie d'élimination plasmatique (T½β) de la pravastatine, après administration par voie orale, est de 1,5 à 2 h. Environ 20% de substance marquée avec un traceur radioactif sont éliminés dans les urines et 70% dans les selles. Après l'application (par voie intraveineuse) de principe actif marqué avec un traceur radioactif aux sujets bien portants, la clairance corporelle totale s'est répartie comme suit: excrétion rénale 47% et voies d'élimination non rénales 53% (p.ex. excrétion biliaire et biotransformation).
Aucune accumulation des taux sanguins n'a été observée lorsque la substance a été administrée une ou deux fois par jour.
Cinétique pour certains groupes de patients
Lors d'insuffisance rénale ou hépatique, une accumulation du principe actif ne peut être exclue, bien que les deux voies d'élimination de la pravastatine semblent permettre une excrétion suffisante par un mécanisme compensatoire.
Les patients souffrant de cirrhose du foie d'origine alcoolique ont présenté une diminution de la clairance hépatique et une augmentation de l'AUC et des taux des métabolites de la pravastatine; par effet compensatoire, l'excrétion rénale a été augmentée.
Une augmentation de l'AUC a également été constatée chez les patients âgés (>65 ans).
En ce qui concerne les patients souffrant d'insuffisance rénale, il n'existe que des données limitées. Dans une étude de pharmacocinétique, les patients avec une insuffisance modérée (n= 8) et sévère (n= 6) ont montré des taux de l'AUC et de la Cmax de plus de 2 fois élevés.
Données précliniques
Chez les souris, la pravastatine n'a montré aucun potentiel cancérigène aux doses de 10 à 100 mg/kg/jour, alors que des doses de 250 et de 500 mg/kg/jour (environ 310 fois la dose humaine maximale en mg/kg) ont augmenté de façon statistiquement significative l'incidence des carcinomes hépatocellulaires chez les femelles et les mâles. De plus, l'incidence des adénomes pulmonaires a été significativement augmentée chez les femelles lorsqu'elles ont reçu ces dernières doses.
Chez les rats mâles, la pravastatine a augmenté de façon statistiquement significative l'incidence des carcinomes hépatocellulaires aux doses de 100 mg/kg/jour (environ 125 fois la dose humaine maximale en mg/kg). De telles altérations n'ont pas été observées chez les mâles recevant la pravastatine aux doses de ≤40 mg/kg/jour (50 fois la dose humaine maximale en mg/kg) ou chez les femelles recevant la pravastatine à n'importe quelle dose.
Des études génotoxicologiques avec la pravastatine n'ont montré aucun potentiel mutagène.
Une étude chez les rats n'a pas montré d'effets indésirables sur la fertilité ou la reproduction à des doses de pravastatine jusqu'à 500 mg/kg/jour (625 fois la dose humaine maximale en mg/kg).
Une étude portant sur des rates ayant reçu, durant les jours 7 à 17 de la gestation, une dose jusqu'à 1000 mg/kg/jour (1250 fois la dose humaine maximale en mg/kg) n'a révélé aucun signe de toxicité embryo-fœtale ou de tératogénicité.
Une étude chez des lapines ayant reçu, durant les jours 6 à 18 de la gestation, une dose jusqu'à 50 mg/kg/jour (environ 60 fois la dose humaine maximale en mg/kg), n'a révélé aucun signe de toxicité embryo-fœtale ou de tératogénicité.
Remarques particulières
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver dans l'emballage original, à température ambiante (15−25 °C), à l'abri de la lumière et de l'humidité et hors de la portée des enfants.
Numéro d’autorisation
57535 (Swissmedic).
Titulaire de l’autorisation
Helvepharm AG, Frauenfeld.
Mise à jour de l’information
Mars 2020.
Відгуки (0)

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.

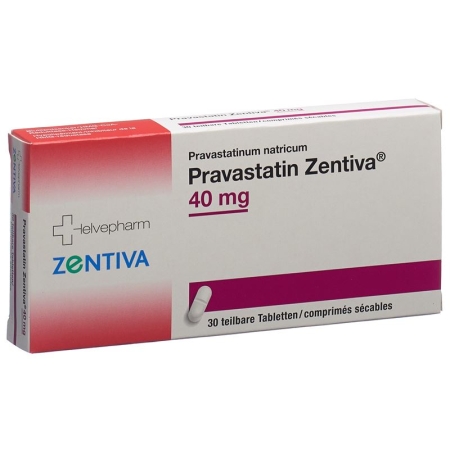
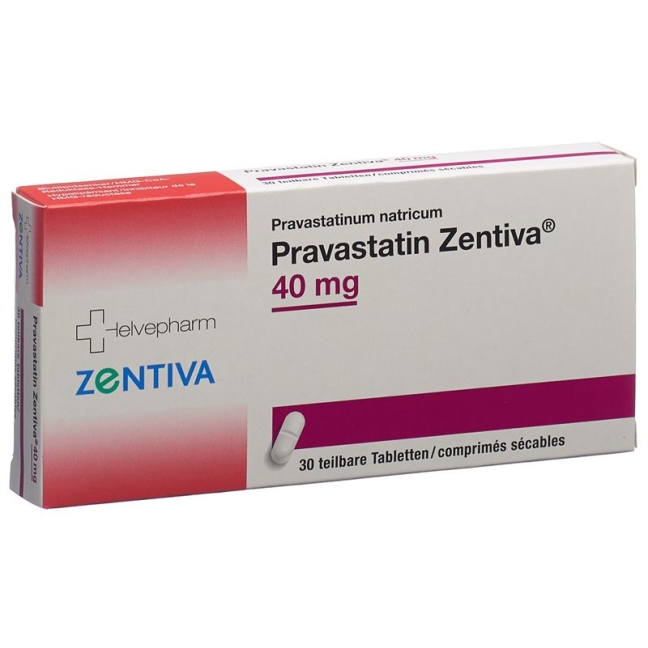


 Deutsch
Deutsch French
French Italian
Italian























