Прогінова Драг 2 мг 28 шт
Progynova Drag 2 mg 28 Stk
-
4710.81 RUB
Дата доставки:
29.12.2025 - 12.01.2026
При оплате криптовалютой:
Ваша прибыль 471.08 RUB / 5.31 USDT
- Наявність: В наявності
- Виробник: Bayer (SCHWEIZ) AG
- Модель: 7771140
- ATC-код G03CA03
- EAN 7680331490010
Склад:
Опис
Was ist Progynova/Progynova mite und wann wird es angewendet?
Progynova/Progynova mite enthält das weibliche Sexualhormon Estradiol, das zu den sogenannten Östrogenen gehört. Seine Eigenschaften sind mit denen des natürlichen Hormons Estradiol, das während der fruchtbaren Jahre der Frau bis zum Eintritt der Menopause (Wechseljahre) von den Eierstöcken produziert wird, identisch.
Die Menopause ist ein natürlicher Vorgang. Sie tritt bei der Frau gewöhnlich zwischen dem 45. und 55. Lebensjahr ein. Sie kann aber auch bei jüngeren Frauen eintreten, nämlich wenn deren Eierstöcke durch einen chirurgischen Eingriff entfernt wurden. Nach der Menopause produzieren die Eierstöcke viel weniger Östrogen als vorher.
Progynova/Progynova mite wird zur Behandlung von Östrogen-Mangelerscheinungen als Folge der natürlichen oder künstlichen Menopause, wie nach dem Erlöschen der Monatsblutungen oder nach operativer Entfernung der Eierstöcke zur Behandlung von Beschwerden der Wechseljahre angewendet. Eine solche Behandlung wird als Hormonersatztherapie (HRT) bezeichnet.
Wechseljahrbeschwerden können sich äussern durch Hitzewallungen, Schweissausbrüche, Schlafstörungen, depressive Verstimmungen, nervöse Reizbarkeit, Kopfschmerzen, Schwindelgefühl. Bei Patientinnen ohne Symptome wie Hitzewallungen, Schweissausbrüche oder Schlafstörungen beseitigt Progynova/Progynova mite jedoch weder Stimmungsschwankungen noch depressive Zustände.
Mit Progynova/Progynova mite lassen sich auch die in den Wechseljahren recht häufig bestehenden Reizzustände der Harnblase sowie die normalerweise im Alter auftretenden Rückbildungserscheinungen der Schleimhäute im Bereich der Harn- und Geschlechtsorgane günstig beeinflussen.
Bei Frauen mit intakter Gebärmutter wird der Arzt oder die Ärztin zusätzlich zu Progynova/Progynova mite ein zweites Hormonpräparat verschreiben, dessen Wirkstoff als Gestagen bezeichnet wird. Das Gestagen verhindert ein unerwünschtes Wachstum der Gebärmutterschleimhaut und schützt somit die Gebärmutter vor einer möglichen Wucherung. Zu diesem Zweck muss es an mindestens 12–14 Tagen pro Monat eingenommen werden. Die Dosierung des Gestagens und die Behandlungsdauer erfolgen nach Anweisung des Arztes oder der Ärztin. Am Ende der Gestagenbehandlungsperiode kommt es zu einer menstruationsähnlichen Blutung.
Progynova/Progynova mite darf nur auf Verschreibung und unter ständiger Kontrolle eines Arztes oder einer Ärztin verwendet werden.
Was sollte dazu beachtet werden?
Progynova/Progynova mite ist kein Mittel zur Empfängnisverhütung (siehe: «Wann ist bei der Einnahme von Progynova/Progynova mite Vorsicht geboten?»).
Eine Hormonersatztherapie kann mit höheren Risiken gewisser Krankheiten, wie Brustkrebs, Herz-Kreislaufkrankheiten (Herzinfarkt, Schlaganfall, venösen Thrombosen und Lungenembolien – Bildung von Blutgerinnseln in den Gefässen) verbunden werden (siehe: «Wann ist bei der Einnahme von Progynova/Progynova mite Vorsicht geboten?»).
Ihr Arzt bzw. Ihre Ärztin wird mit Ihnen die Risiken einer Hormontherapie gegenüber dem erwarteten Nutzen abwägen.
Wann darf Progynova/Progynova mite nicht angewendet werden?
Progynova/Progynova mite darf nicht angewendet werden, wenn Sie:
- an Brustkrebs leiden oder bei Ihnen ein Verdacht auf Brustkrebs besteht,
- an einem hormonabhängigen Tumor wie Gebärmutter- oder Eierstockkrebs leiden oder bei Ihnen ein solcher Verdacht besteht,
- eine unbehandelte, übermässige Verdickung der Gebärmutterschleimhaut (Endometriumhyperplasie) haben,
- nicht abgeklärte vaginale Blutungen haben,
- einen Lebertumor (gut- und bösartiger) haben oder hatten,
- eine schwere Lebererkrankung haben oder hatten, solange sich die Leberfunktionswerte nicht normalisiert haben,
- an einer Erkrankung der Blutgefässe, die auf Gerinnselbildung beruht (Venenthrombose, Thrombose, Embolie) leiden oder gelitten haben,
- vor kurzem einen Herzinfarkt und/oder Schlaganfall hatten,
- Risikofaktoren für die Entstehung einer arteriellen oder venösen Thrombose (Blutgerinnsel) haben (z.B. Mangel an Antithrombin, Protein S oder Protein C),
- erhöhte Triglyzerid-Blutwerte (spezieller Typ von Blutfetten) haben,
- an der Stoffwechselerkrankung Porphyrie leiden,
- schwanger sind oder stillen,
- eine Überempfindlichkeit (Allergie) gegenüber den Bestandteilen von Progynova/Progynova mite haben.
Wenn eines der oben aufgeführten Ereignisse während der Therapie mit Progynova/Progynova mite zum ersten Mal bei Ihnen auftritt, sollten Sie die Behandlung unverzüglich abbrechen und Ihren Arzt bzw. Ihre Ärztin aufsuchen.
Wann ist bei der Anwendung von Progynova/Progynova mite Vorsicht geboten?
Ihr Arzt oder Ihre Ärztin wird vor Beginn der Behandlung Nutzen und Risiken einer Behandlung mit Progynova/Progynova mite besprechen.
Vor Beginn der Einnahme von Progynova/Progynova mite wird Sie der Arzt oder die Ärztin gründlich allgemein und gynäkologisch untersuchen, und er wird Ihnen die Selbstuntersuchung der Brust empfehlen und Sie dementsprechend unterrichten.
Bei Langzeitanwendung von Progynova/Progynova mite sollten vorsorglich jährliche Kontrolluntersuchungen erfolgen.
Während der Behandlung mit Progynova/Progynova mite darf es nicht zu einer Schwangerschaft kommen (siehe: «Darf Progynova/Progynova mite während einer Schwangerschaft oder in der Stillzeit eingenommen werden?»). Zur Empfängnisverhütung sind gegebenenfalls nichthormonale Methoden (mit Ausnahme der Kalendermethode nach Knaus-Ogino und der Temperaturmethode) anzuwenden. Bleiben unter der Behandlung Entzugsblutungen in regelmässigen Abständen von etwa 28 Tagen aus, muss trotz der Verhütungsmassnahmen eine Schwangerschaft in Betracht gezogen werden. Die Behandlung ist dann bis zur Klärung durch den Arzt oder die Ärztin zu unterbrechen.
Gründe für den sofortigen Abbruch der Behandlung mit Progynova/Progynova mite sind:
- Erstmaliges Auftreten migräneartiger oder häufigeres Auftreten ungewohnt starker Kopfschmerzen,
- plötzliche Wahrnehmungsstörungen (z.B. Sehstörungen, Hörstörungen),
- erste Anzeichen von Venenentzündung mit Blutpfropfbildung (Thrombose) oder von Erkrankungen als Folge von Blutgerinnsel (Embolie) (z.B. ungewohnte Schmerzen in den Beinen oder Schwellungen der Beine, stechende Schmerzen beim Atmen oder Husten unklarer Ursache, Ohnmacht),
- Schmerz- und Engegefühl im Brustraum,
- Auftreten von Gelbsucht,
- Auftreten von Leberentzündung,
- Juckreiz am ganzen Körper,
- Wachstum von Myomen (gutartigen Geschwülsten der Gebärmutter),
- Zunahme epileptischer Anfälle,
- stärkerer Blutdruckanstieg,
- Schwangerschaft.
Gründe für häufigere ärztliche Kontrolluntersuchungen:
Es ist wichtig, dass Sie Ihren Arzt oder Ihre Ärztin informieren, wenn Sie eine der nachfolgenden Erkrankungen haben oder in der Vergangenheit hatten. In diesen Fällen können häufigere ärztliche Kontrolluntersuchungen notwendig sein:
- Wenn Sie unregelmässige Monatsblutungen, Brustveränderungen, Brustkrebs in der Familie oder gutartige Geschwülste der Gebärmutter (sogenannte Myome) haben,
- wenn Sie eine übermässige Verdickung der Gebärmutterschleimhaut (Endometriumhyperplasie) in der Vorgeschichte haben,
- wenn Sie eine Endometriose (Vorliegen von Gewebe der Gebärmutterschleimhaut an Orten im Körper, wo es normalerweise nicht gefunden wird) haben oder jemals hatten,
- wenn Sie Risikofaktoren für Blutgerinnselbildung (thromboembolische Erkrankungen) haben (Siehe auch Abschnitt «Erhöhtes Risiko für die Bildung einer Thrombose (Blutgerinnsel)» unten),
- wenn Sie an Migräne leiden,
- wenn Sie einen zu hohen Blutdruck haben,
- wenn Sie an Zuckerkrankheit (Diabetes) leiden,
- wenn Sie erhöhte Blutfettspiegel (Hypertriglyceridämie) haben oder diese Erkrankung in Ihrer Familie vorgekommen ist,
- wenn Sie an einer Leber- (z.B. gutartige Lebergeschwulst, Leberadenom) oder Gallenblasenerkrankung (v.a. Gallensteinen) leiden,
- wenn Sie an Asthma leiden,
- wenn Sie an Epilepsie oder Veitstanz (Chorea minor) leiden,
- wenn Sie an systemischem Lupus erythematosus (SLE; eine chronisch entzündliche Erkrankung) leiden,
- wenn bei Ihnen zuweilen anhaltende, bräunliche Flecken im Gesicht (Chloasma) auftreten oder aufgetreten sind. In diesem Fall sollten Sie sich nicht zu sehr der Sonne oder ultravioletter Strahlung aussetzen,
- wenn Sie an vererbbarer Taubheit leiden (Otosklerose).
- wenn Sie an einem erblich bedingten Angioödem leiden (in Episoden auftretendes Anschwellen von Körperteilen wie Händen, Füssen, Gesicht oder Atemwegen),
- wenn Sie an einem Prolaktinom (ein Tumor) des Hypophysenvorderlappens (Vorderlappen der Hirnanhangdrüse) leiden, ist eine engmaschige ärztliche Überwachung (einschliesslich regelmässiger Bestimmungen des Prolaktinspiegels) erforderlich.
Brustkrebs
In gewissen Studien wurde Brustkrebs bei Frauen, die während mehreren Jahren eine HRT erhielten, etwas häufiger diagnostiziert. Dieses Risiko nimmt mit der Dauer der Behandlung zu. Bei Produkten, welche nur Östrogene enthalten, könnte diese Risikoerhöhung möglicherweise neutral sein. Wenn Frauen die HRT abbrechen, verschwindet das erhöhte Risiko innerhalb von wenigen Jahren.
Die HRT kann das Erscheinungsbild der Brust in Mammografieaufnahmen verändern (erhöht die Dichte in mammografischen Bildern). Dies kann den mammografischen Nachweis von Brustkrebs in gewissen Fällen erschweren. Aus diesem Grund wird Ihr Arzt bzw. Ihre Ärztin möglicherweise entscheiden, für die Brustkrebs-Vorsorgeuntersuchung auch andere Methoden heranzuziehen.
Wenn Brustkrebs früher in der Familie (z.B. bei Ihrer Mutter oder deren Schwestern) aufgetreten ist, könnte auch bei Ihnen ein erhöhtes Risiko für diese Erkrankung bestehen. Sie sollten den Arzt oder die Ärztin darüber informieren.
Gebärmutterschleimhautkrebs
Wenn Östrogene, wie in Progynova/Progynova mite enthalten, über längere Zeit alleine eingenommen werden, nimmt das Risiko für eine Wucherung der Gebärmutterschleimhaut (Endometriumhyperplasie) oder der Entstehung von Gebärmutterschleimhautkrebs (Endometriumkarzinom) zu. Nach Absetzen der Östrogen-Therapie könnte das Risiko für mindestens 10 Jahre erhöht bleiben. Patientinnen, denen die Gebärmutter nicht entfernt worden ist, sollten Östrogene deshalb nicht alleine einnehmen. Wenn Sie Progynova/Progynova mite einnehmen und Ihre Gebärmutter nicht entfernt wurde, wird Ihr Arzt oder Ihre Ärztin Ihnen ein zusätzliches Hormon (Gestagen) für mindestens 12 Tage pro Behandlungszyklus verschreiben und Sie diesbezüglich informieren.
Informieren Sie Ihren Arzt bzw. Ihre Ärztin falls bei Ihnen Fälle abnormaler Blutungen (unregelmässige, starke oder andauernde Blutungen, einschliesslich Schmierblutungen) auftreten. Ihr Arzt bzw. Ihre Ärztin wird diese mittels geeigneter diagnostischer Massnahmen abklären.
Eierstockkrebs
Mehrere Studien deuten darauf hin, dass eine HRT (sowohl für eine Östrogen-Monotherapie als auch für eine kombinierte HRT) mit einem gering erhöhten Risiko für die Entwicklung von Eierstockkrebs verbunden sein könnte.
Lebertumoren
In seltenen Fällen sind nach Anwendung hormonaler Wirkstoffe, wie sie Progynova/Progynova mite enthält gutartige, noch seltener bösartige Veränderungen an der Leber beobachtet worden, die vereinzelt zu lebensgefährlichen Blutungen in die Bauchhöhle geführt haben. Deshalb ist der Arzt oder die Ärztin zu informieren, wenn ungewohnte Oberbauchbeschwerden auftreten, die nicht von selbst bald vorübergehen.
Koronare Herzkrankheit und Schlaganfall
Zwei grosse klinische Studien mit konjugierten Östrogenen und Medroxyprogesteronacetat (ein Gestagen), die beide zur HRT verwendet werden, lassen den Schluss zu, dass das Risiko für einen Herzinfarkt im ersten Anwendungsjahr leicht erhöht sein kann. Dieses Risiko wurde mit konjugierten Östrogenen allein nicht beobachtet.
In zwei grossen Studien mit diesen Hormonen war das Risiko für einen Schlaganfall sowohl für Östrogene alleine als auch für das kombinierte Präparat um 30–40% erhöht.
Obwohl derartige Daten für Progynova/Progynova mite nicht vorliegen, sollte es nicht zur Vorbeugung von Herzerkrankungen und/oder Schlaganfall verwendet werden.
Zu einer HRT mit Therapiebeginn in relativ frühem Lebensalter (beispielsweise vor dem 55. Lebensjahr) liegen nur wenige Daten vor. Diese deuten darauf hin, dass die Erhöhung des Herzinfarktrisikos bei jüngeren Patientinnen mit kurzem Zeitabstand zur Menopause geringer sein könnte als bei älteren. Dies gilt jedoch nicht für Schlaganfälle.
Das Risiko für Schlaganfälle ist unabhängig vom Alter oder der Zeit seit der Menopause. Es erhöht sich bei Frauen unter einer HRT mit zunehmendem Alter.
Erhöhtes Risiko für die Bildung einer Thrombose (Blutgerinnsel)
Eine HRT kann das Risiko einer Thrombosebildung (Blutgerinnsel in den Gefässen) erhöhen.
Ihr Arzt bzw. Ihre Ärztin wird prüfen, ob bei Ihnen z.B. aufgrund einer Kombination von Risikofaktoren oder vielleicht aufgrund eines sehr starken Risikofaktors ein erhöhtes Risiko für die Entstehung einer Thrombose besteht. Im Fall einer Kombination von Risikofaktoren kann das Risiko höher als die einfache Addition zweier einzelner Risiken sein. Wenn das Risiko zu hoch ist, wird Ihr Arzt bzw. Ihre Ärztin keine Hormonersatztherapie verschreiben.
Das Risiko erhöht sich mit dem Alter und kann ebenfalls grösser sein,
- wenn Sie oder jemand in Ihrer nächsten Verwandtschaft eine Thrombose in den Blutgefässen der Beine oder der Lunge gehabt hat,
- wenn Sie übergewichtig sind,
- wenn Sie an Krampfadern leiden,
- wenn Sie rauchen,
- wenn Sie an systemischem Lupus erythematodes (chronisch entzündliche Erkrankung) leiden,
- wenn Sie unter einer bösartigen Tumorerkrankung leiden.
Wenn Sie Progynova/Progynova mite bereits einnehmen, informieren Sie Ihren Arzt bzw. Ihre Ärztin rechtzeitig im Voraus über einen geplanten Spitalaufenthalt oder einen chirurgischen Eingriff. Das Risiko, eine tiefe Venenthrombose zu erleiden, kann aufgrund einer Operation, einer schweren Verletzung oder Bettruhe sowie eingeschränkter Bewegung vorübergehend erhöht sein.
Demenz
Bei einer längeren HRT mit einem anderen Hormonpräparat wurden bei älteren Patientinnen in sehr seltenen Fällen eine Abnahme des Erinnerungsvermögens und der geistigen Leistungsfähigkeit beobachtet. Es ist nicht bekannt, ob dasselbe Risiko mit Progynova/Progynova mite besteht.
Sonstige Vorsichtsmassnahmen
Östrogene können eine Flüssigkeitsretention (Wassereinlagerung im Gewebe) verursachen. Patientinnen mit Herz- oder Nierenfunktionsstörungen sollten daher sorgfältig überwacht werden.
Jedes Dragee von Progynova/Progynova mite enthält ungefähr 46 bzw. 47 mg Laktose. Patientinnen mit der seltenen hereditären Galaktose-Intoleranz, Lapp-Laktase-Mangel oder Glukose-Galaktose-Malabsorption, die eine laktosefreie Diät einhalten, sollten diese Menge beachten.
Wechselwirkungen mit Labortests
Eine HRT wie Progynova/Progynova mite kann gewisse Laboruntersuchungen beeinflussen. Teilen Sie deshalb Ihrem Arzt bzw. Ihrer Ärztin oder dem Laborpersonal mit, dass Sie Progynova/Progynova mite einnehmen.
Wechselwirkungen mit anderen Arzneimitteln
Gewisse Arzneimittel können bei gleichzeitiger Einnahme die Wirkung von Progynova/Progynova mite beeinträchtigen oder zu Blutungsunregelmässigkeiten führen: z.B. Arzneimittel zur Behandlung der Epilepsie (Barbiturate, Phenytoin, Carbamazepin, Oxcarbazepin, Topiramat, Felbamat, Primidon), von HIV- und Hepatitis C-Infektionen (Proteaseinhibitoren und Nichtnukleosidische Reverse-Transkriptase-Inhibitoren), von Tuberkulose (Rifampicin, Rifabutin), von hohem Blutdruck in den Lungen (Bosentan), von einer speziellen Art der übermässigen Schläfrigkeit (Modafinil) sowie bei längerfristiger Einnahme (über 10 Tage) gewisser Antibiotika zur Behandlung bestimmter Infektionen (Tetracycline) und bei Einnahme von Johanniskrautpräparaten (siehe unten).
Bitte informieren Sie sich bei Ihrem Arzt oder Ihrer Ärztin oder Apotheker bzw. Apothekerin über das weitere Vorgehen, falls Sie längerfristig (d.h. über mehr als 10-14 Tage) Antibiotika einnehmen müssen (z.B. bei Entzündungen der Knochen oder bei Borreliose).
Einige Arzneimittel sowie Grapefruitsaft können die Wirkstoffkonzentration von Progynova/Progynova mite im Blut erhöhen. Informieren Sie Ihren Arzt oder Ihre Ärztin, wenn Sie eines der folgenden Arzneimittel oder Grapefruitsaft einnehmen:
- Antipilzmittel, die Wirkstoffe wie z.B. Itraconazol, Voriconazol, oder Fluconazol enthalten,
- bestimmte Antibiotika (sogenannte Makrolide), die als Wirkstoff Clarithromycin oder Erythromycin enthalten,
- bestimmte Arzneimittel zur Behandlung von Herz-Kreislauferkrankungen (mit den Wirkstoffen Diltiazem oder Verapamil).
Wenn Sie zuckerkrank sind, dann könnte sich durch die Einnahme von Progynova/Progynova mite Ihr Bedarf an blutzuckersenkenden Arzneimitteln (inklusive Insulin) ändern.
Progynova/Progynova mite kann auch die Wirkung anderer Arzneimittel beeinflussen, und deren Wirkung entweder verstärken oder vermindern. Dies betrifft z.B. Cyclosporin und das Antiepileptikum Lamotrigin (dies könnte zu einer erhöhten Häufigkeit von Krampfanfällen führen, weshalb Ihr Arzt/Ihre Ärztin zu Beginn der Anwendung von Progynova/Progynova mite und wenn Sie Progynova/Progynova mite absetzen die Lamotrigin-Blutspiegel überwachen wird).
Sexualhormone können ausserdem die Wirkung von Blutgerinnungshemmern beeinflussen.
Teilen Sie Ihrem Arzt bzw. Ihrer Ärztin mit, ob Sie mit Arzneimitteln zur Behandlung von Hepatitis C-Infektionen behandelt werden (Arzneimittel mit Wirksubstanzen wie Ombitasvir, Paritaprevir, Ritonavir, Dasabuvir). Arzneimittel mit Östrogenen wie Progynova/Progynova mite könnten gegebenenfalls die Wirkung dieser Arzneimittel beeinflussen.
Informieren Sie Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin, wenn Sie an anderen Krankheiten leiden, Allergien haben oder andere Arzneimittel (auch selbstgekaufte!) einnehmen oder äusserlich anwenden! Ebenso ist es wichtig, dass Sie Ihren Arzt oder Zahnarzt bzw. Ihre Ärztin oder Zahnärztin über die Einnahme von Progynova/Progynova mite informieren, wenn er bzw. sie Ihnen neue Arzneimittel verschreibt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Für Progynova/Progynova mite ist kein Einfluss auf die Fahrtüchtigkeit oder Fähigkeit, Maschinen zu bedienen, bekannt. Es wurden diesbezüglich keine Studien durchgeführt. Bitte beachten Sie die unerwünschten Wirkungen.
Darf Progynova/Progynova mite während einer Schwangerschaft oder in der Stillzeit angewendet werden?
Progynova/Progynova mite darf während der Schwangerschaft oder in der Stillzeit grundsätzlich nicht eingenommen werden. Geringe Mengen an Geschlechtshormonen können in die Muttermilch ausgeschieden werden. Während der Schwangerschaft und in der Stillzeit gibt es für dieses Arzneimittel auch keine medizinisch begründete Anwendung.
Sollten Sie während der Behandlung mit Progynova/Progynova mite dennoch schwanger werden oder dieses Präparat unbeabsichtigt während der Schwangerschaft eingenommen haben, müssen Sie sofort den Arzt oder die Ärztin benachrichtigen.
Wie verwenden Sie Progynova/Progynova mite?
Wie und wann sollte Progynova/Progynova mite eingenommen werden?
Wenn Sie zurzeit kein anderes Präparat zur HRT anwenden oder einnehmen und keine Monatsblutung haben, können Sie sofort mit der Anwendung von Progynova/Progynova mite beginnen.
Wenn Sie bereits ein anderes Präparat anwenden oder einnehmen, beginnen Sie die Therapie mit Progynova/Progynova mite am ersten Tag nach Absetzen der Therapie mit dem anderen Präparat oder gemäss ärztlicher Anweisung.
Wenn Sie eine intakte Gebärmutter haben, wird Ihnen Ihr Arzt oder Ihre Ärztin ein zusätzliches Hormon (Gestagen) verschreiben und Sie diesbezüglich informieren.
Eine Durchdrückpackung Progynova/Progynova mite enthält 28 Dragees, auf der Rückseite der Packung ist für jedes Dragee der entsprechende Wochentag vermerkt. Beginnen Sie die Einnahme von Progynova/Progynova mite z.B. an einem Mittwoch, so entnehmen Sie ein mit «MI» beschriftetes Dragee und fahren nachher wie angegeben in Pfeilrichtung mit der Einnahme weiter.
Falls vom Arzt oder der Ärztin nicht anders verordnet, wird täglich 1 Dragee Progynova (2 mg) nach dem Essen unzerkaut mit Flüssigkeit eingenommen. Wenn versäumt wurde, das Dragee zur gewohnten Zeit einzunehmen, sollte die Einnahme innerhalb der nächsten 24 Stunden nachgeholt werden.
Die Dragee-Einnahme erfolgt kontinuierlich, d.h. wenn Ihre erste Packung aufgebraucht ist, beginnen Sie am nächsten Tag sofort mit der nächsten Packung. Im Verlauf der weiteren Behandlung kann der Arzt oder die Ärztin die Dosis auf 1 Dragee Progynova mite (1 mg) täglich reduzieren.
Auch bei der reduzierten Dosis erfolgt die Dragee-Einnahme kontinuierlich, d.h. wenn Ihre erste Packung aufgebraucht ist, beginnen Sie am nächsten Tag sofort mit der nächsten Packung.
Falls Sie Ihren Uterus noch haben, wird der Arzt oder die Ärztin Ihnen zusätzlich zu Progynova/Progynova mite ein Gestagenpräparat verschreiben. Er/Sie wird Ihnen genau erklären, wann, in welcher Menge und wie lange Sie ein solches Präparat einnehmen müssen.
Was tun, wenn Sie zu viele Progynova/Progynova mite Dragees eingenommen haben?
Es liegen keine Berichte über eine Überdosierung vor. Es könnten aber Kopfschmerzen, Übelkeit, Erbrechen, Spannungsgefühl in den Brüsten und Blutungen in der Gebärmutter auftreten. Eine spezifische Behandlung ist nicht nötig, aber Sie sollten Ihren Arzt bzw. Ihre Ärztin aufsuchen.
Was tun, wenn Ihr Arzt oder Ärztin ein zusätzliches Gestagen-Präparat verschreibt?
Wenn Ihnen Ihr Arzt oder Ihre Ärztin zusätzlich zu Progynova/Progynova mite ein Gestagen-Präparat verschreibt - dies ist notwendig bei Frauen mit intakter Gebärmutter - so muss das Gestagen während 12–14 Tagen pro Monat eingenommen werden (bei zyklischer Anwendung während der letzten 12–14 Tage des Behandlungszyklus). In der Regel tritt nach jeder Gestagen-Behandlungsperiode nach 2–3 Tagen eine Entzugsblutung auf. Die Dosierung des Gestagens und die Behandlungsdauer werden vom Arzt oder von der Ärztin festgelegt.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin.
Spezielle Dosierungsanweisungen
Kinder und Jugendliche
Progynova/Progynova mite ist nicht für die Anwendung bei Kindern und Jugendlichen indiziert.
Ältere Patientinnen
Es liegen keine Daten vor, die darauf hindeuten, dass bei älteren Patientinnen eine Anpassung der Dosis erforderlich ist.
Leberfunktionsstörungen
Progynova/Progynova mite wurde bei Patientinnen mit Leberfunktionsstörung nicht speziell untersucht. Frauen mit einer schweren Lebererkrankung dürfen Progynova/Progynova mite nicht anwenden (siehe: «Wann darf Progynova/Progynova mite nicht angewendet werden?»).
Nierenfunktionsstörungen
Progynova/Progynova mite wurde bei Patientinnen mit Nierenfunktionsstörung nicht spezifisch untersucht. Eine Dosierungsanpassung ist wahrscheinlich nicht nötig.
Welche Nebenwirkungen kann Progynova/Progynova mite haben?
Die schwerwiegenden Nebenwirkungen, welche im Zusammenhang mit einer HRT auftreten können, sind im vorangegangenen Abschnitt, «Wann ist bei der Anwendung von Progynova/Progynova mite Vorsicht geboten?» beschrieben. Bitte lesen Sie diesen Abschnitt für weitere Informationen.
Folgende weitere Nebenwirkungen können bei der Einnahme von Progynova/Progynova mite Dragees auftreten:
Häufig
Gewichtszunahme oder -abnahme, Kopfschmerzen, Schwindel, Blähungen, Übelkeit, Hautausschlag, Juckreiz, Blutungsanomalien (einschliesslich Durchbruchblutungen und Schmierblutungen), Spannungsgefühl in den Brüsten, Unterleibsschmerzen, Ödeme (Wassereinlagerung).
Gelegentlich
Überempfindlichkeitsreaktionen, Migräne, entzündliche Hautveränderung mit rötlichen Papeln (Erythema nodosum), Nesselsucht (Urtikaria), Muskelkrämpfe, Vergrösserung der Brüste.
Selten
Übermässige Behaarung (Hirsutismus), Akne.
Über andere unerwünschte Wirkungen wurde bei Anwenderinnen von HRT berichtet, der Zusammenhang mit Progynova/Progynova mite wurde jedoch weder bestätigt noch widerlegt:
Erstmaliges Auftreten oder Verschlechterung eines hereditären Angioödems (in Episoden auftretendes Anschwellen von Körperteilen wie Händen, Füssen, Gesicht oder Atemwege), Erhöhung der Blutfettwerte, Ängstlichkeit, Nervosität, Stimmungsschwankungen, Veränderungen des Sexualtriebes, Depression, Sehstörungen, Herzklopfen, Blutdruckanstieg, Erbrechen, Magenübersäuerung, abnormale Leberfunktionswerte, Gallensteinleiden, Gelbsucht, Verschlechterung von Porphyrie (eine seltene Krankheit des Stoffwechsels), braune Flecken im Gesicht (Chloasma), Haarausfall, entzündliche Hautveränderung mit oder ohne Blasenbildung (Erythema multiforme), geplatzte Äderchen unter der Haut (vaskuläre Purpura), Rückenschmerzen, Brustschmerzen, vermehrter Scheidenausfluss, Vergrösserungen von Uterusmyomen (gutartiges Geschwür der Gebärmutter), Vergrösserung der Gebärmutterschleimhaut (Endometriumhyperplasie), arterielle oder venöse Thrombose (Blutgerinnsel).
Wenn Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind, sollten Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin informieren.
Was ist ferner zu beachten?
Progynova/Progynova mite soll für Kinder unerreichbar aufbewahrt werden.
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Bei Raumtemperatur (15-25 °C) lagern.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Progynova/Progynova mite enthalten?
Progynova
Jedes weisse Dragee enthält:
Wirkstoff: 2 mg Estradiolvalerat.
Hilfsstoffe: 46 mg Laktose, weitere Hilfsstoffe.
Progynova mite
Jedes beige Dragee enthält:
Wirkstoff: 1 mg Estradiolvalerat.
Hilfsstoffe: 47 mg Laktose, weitere Hilfsstoffe.
Zulassungsnummer
33149 (Swissmedic).
Wo erhalten Sie Progynova/Progynova mite? Welche Packungen sind erhältlich?
Progynova/Progynova mite erhalten Sie in Apotheken nur gegen ärztliche Verschreibung.
Von Progynova gibt es Packungen mit 1× 28 und 3× 28 Dragees, von Progynova mite Packungen mit 3× 28 Dragees.
Zulassungsinhaberin
Bayer (Schweiz) AG, Zürich.
Diese Packungsbeilage wurde im Mai 2019 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Qu’est-ce que le Progynova/Progynova mite et quand doit-il être utilisé?
Progynova/Progynova mite contient de l'estradiol, une hormone sexuelle féminine faisant partie des estrogènes. Ses propriétés sont identiques à celles de l'estradiol naturel, hormone produite par les ovaires pendant les années fertiles de la femme jusqu'au début de la ménopause (retour d'âge).
La ménopause est un processus naturel qui se manifeste habituellement chez la femme entre l'âge de 45 et 55 ans, mais qui peut aussi survenir chez des femmes plus jeunes, notamment si elles ont subi une ablation chirurgicale des ovaires. Après la ménopause, les ovaires produisent beaucoup moins d'estrogènes qu'avant.
Progynova/Progynova mite est utilisé pour traiter les symptômes de carence estrogénique consécutifs à la ménopause naturelle ou artificielle, comme après l'arrêt des règles ou l'ablation chirurgicale des ovaires pour traiter les troubles de la ménopause. Un tel traitement est qualifié de traitement hormonal substitutif (THS).
Les troubles de la ménopause peuvent se traduire par des bouffées de chaleur, des accès de sueur, des troubles du sommeil, un état dépressif, une irritabilité, des maux de tête ou une sensation de vertige. Toutefois, Progynova/Progynova mite ne fait pas disparaître les sautes d'humeur et les états dépressifs chez les patientes ne présentant pas de symptômes tels que bouffées de chaleur, sueurs ou troubles du sommeil.
Progynova/Progynova mite a aussi un effet favorable sur les irritations de la vessie, fréquentes à la ménopause, et sur l'involution (régression) des muqueuses des organes génitaux et urinaires qui survient normalement avec l'âge.
Chez les femmes ayant encore un utérus intact, le médecin prescrira, en plus de Progynova/Progynova mite, une deuxième préparation hormonale dont le principe actif est un progestatif. Le progestatif empêche la croissance intempestive de la muqueuse de l'utérus et prévient ainsi une éventuelle tumeur utérine. À cette fin, il faut le prendre au moins 12 à 14 jours par mois. La dose du progestatif et la durée du traitement vous seront précisées par votre médecin, dont vous devrez observer les instructions. À la fin de la phase du traitement par le progestatif, il se produit une hémorragie similaire aux règles.
Progynova/Progynova mite ne doit être utilisé que sur prescription et sous contrôle constant d'un médecin.
De quoi faut-il tenir compte en dehors du traitement?
Progynova/Progynova mite n'est pas un contraceptif (voir «Quelles sont les précautions à observer lors de la prise de Progynova/Progynova mite?»).
Un traitement hormonal substitutif peut être lié à une augmentation du risque de certaines maladies, notamment de cancer du sein et de maladies cardiovasculaires (infarctus du myocarde, accident vasculaire cérébral, thromboses veineuses et embolie pulmonaire – formation de caillots dans les vaisseaux) (voir «Quelles sont les précautions à observer lors de la prise de Progynova/Progynova mite?»).
Votre médecin discutera avec vous des différents aspects d'une substitution hormonale pour vous aider à mieux peser les risques et les bénéfices d'un tel traitement.
Quand Progynova/Progynova mite ne doit-il pas être utilisé?
Vous ne devez pas utiliser Progynova/Progynova mite
- si vous êtes atteinte – ou en cas de suspicion – d'un cancer du sein,
- si vous êtes atteinte – ou en cas de suspicion – d'une tumeur dite «hormonodépendante», p.ex. cancer de l'utérus ou cancer des ovaires,
- si vous présentez un épaississement exagéré non traité de la muqueuse utérine (hyperplasie de l'endomètre),
- si vous avez des saignements vaginaux non élucidés,
- si vous souffrez ou avez souffert d'une tumeur du foie (bénigne ou maligne),
- si vous souffrez ou avez souffert d'une maladie grave du foie, tant que les valeurs hépatiques n'ont pas été complètement normalisées,
- si vous souffrez ou avez souffert d'une affection des vaisseaux sanguins due à la formation de caillots (thrombose veineuse, thrombose, embolie),
- si vous avez eu récemment un infarctus du myocarde ou un accident vasculaire cérébral,
- si vous présentez des facteurs de risque d'apparition d'une thrombose veineuse ou artérielle (caillots sanguins) (p.ex. déficit en antithrombine, en protéine S ou en protéine C),
- si vous présentez des élévations des taux sanguins de triglycérides (un type particulier de lipides sanguins),
- si vous souffrez de porphyrie, une maladie métabolique,
- si vous êtes enceinte ou si vous allaitez,
- si vous êtes hypersensible (allergique) à l'un des composants de Progynova/Progynova mite.
Au cas où vous constateriez pour la première fois l'un des événements susmentionnés pendant le traitement par Progynova/Progynova mite, vous devrez cesser immédiatement le traitement et consulter votre médecin.
Quelles sont les précautions à observer lors de la prise de Progynova/Progynova mite?
Votre médecin discutera avec vous des bénéfices et des risques d'un traitement avec Progynova/Progynova mite avant le début du traitement.
Avant de vous prescrire Progynova/Progynova mite, votre médecin procédera à un examen général et gynécologique approfondi; il vous recommandera de procéder régulièrement à l'auto-examen de vos seins et vous enseignera une technique de palpation adéquate.
En cas d'utilisation prolongée de Progynova/Progynova mite, votre médecin procédera annuellement à des examens de contrôle préventifs.
Il faut absolument éviter une grossesse durant le traitement par Progynova/Progynova mite (voir «Progynova/Progynova mite peut-il être pris pendant la grossesse ou l'allaitement?»). Pour la contraception, on recourra à des méthodes non hormonales (à l'exclusion de l'abstinence périodique selon Ogino-Knaus et de la méthode des températures). Si des hémorragies de privation ne se produisent pas à intervalles réguliers de l'ordre de 28 jours sous traitement avec Progynova/Progynova mite, il faudra considérer l'éventualité d'une grossesse malgré l'application de mesures contraceptives. Vous devrez alors interrompre le traitement jusqu'à ce que votre médecin ait tiré la situation au clair.
Motifs pour un arrêt immédiat du traitement avec Progynova/Progynova mite:
- Première apparition de maux de tête de type migraineux ou survenue plus fréquente de maux de tête d'intensité inhabituelle,
- troubles soudains de la perception (p.ex. troubles de la vision, de l'ouïe),
- premiers signes d'une inflammation des veines avec formation d'un caillot (thrombose) ou de maladies consécutives à l'apparition de caillots (embolie) (p.ex. douleurs inhabituelles aux jambes ou gonflement des jambes, douleurs aiguës lors de la respiration ou toux d'origine peu claire, évanouissement),
- sensation de douleur et d'oppression dans la cage thoracique,
- survenue d'une jaunisse,
- apparition d'une inflammation du foie (hépatite),
- démangeaisons sur l'ensemble du corps,
- augmentation du volume de myomes (tumeurs bénignes de l'utérus),
- augmentation de crises d'épilepsie,
- forte élévation de la tension artérielle,
- grossesse.
Motifs pour des contrôles médicaux plus fréquents:
Il est important que vous informiez votre médecin si vous souffrez ou avez souffert par le passé de l'une des maladies suivantes (auxquels cas des contrôles médicaux plus fréquents pourront être nécessaires):
- si vous avez des règles irrégulières, des modifications au niveau des seins, des cas de cancer du sein dans la famille ou des tumeurs bénignes de l'utérus (appelées myomes),
- si vous avez des antécédents d'épaississement exagéré de la muqueuse utérine (hyperplasie de l'endomètre),
- si vous souffrez, ou avez souffert une fois, d'une endométriose (présence de tissus de la muqueuse utérine dans des zones du corps où ils sont normalement absents),
- si vous présentez des facteurs de risque de formation d'un caillot sanguin (maladies thromboemboliques) (voir rubrique «Risque accru de thrombose (caillots sanguins)» ci-dessous),
- si vous souffrez de migraines,
- si votre pression artérielle est trop élevée,
- si vous souffrez de diabète,
- si votre taux de graisses dans le sang est élevé (hypertriglycéridémie) ou si cette maladie est survenue dans votre famille,
- si vous souffrez d'une affection du foie (p.ex. tumeur bénigne du foie - adénome du foie) ou de la vésicule biliaire (surtout des calculs biliaires),
- si vous souffrez d'asthme,
- si vous souffrez d'épilepsie ou de danse de Saint-Guy (chorée mineure);
- si vous souffrez de lupus érythémateux disséminé (LED; une maladie inflammatoire chronique),
- si des taches brunâtres persistantes apparaissent ou sont apparues parfois sur votre visage (chloasma, appelé aussi «masque de grossesse»); dans ce cas, vous ne devriez pas trop vous exposer au soleil ou au rayonnement ultraviolet,
- si vous souffrez de surdité héréditaire (otosclérose),
- si vous souffrez d'un angio-œdème héréditaire (survenue épisodique d'un gonflement de parties du corps, telles que mains, pieds, visage ou voies respiratoires),
- si vous souffrez d'un prolactinome (une tumeur) du lobe antérieur de l'hypophyse, une surveillance médicale étroite (y compris une détermination du taux de prolactine à intervalles réguliers) est nécessaire.
Cancer du sein
Dans certaines études, les diagnostics de cancer du sein ont été un peu plus fréquents chez des femmes ayant reçu pendant plusieurs années un THS. Ce risque augmente avec la durée du traitement. Il est possible que cette hausse du risque soit inexistante dans le cas de produits ne contenant que des estrogènes. Cette augmentation du risque disparaît en quelques années chez les femmes qui ont arrêté le THS.
Le THS peut modifier l'aspect des seins sur les mammographies (augmentation de la densité de l'image sur les mammographies), ce qui peut, dans certains cas, compliquer la détection mammographique d'un cancer du sein. Pour cette raison, votre médecin pourra décider de faire appel à d'autres méthodes d'examen de dépistage du cancer du sein.
Si un cancer du sein est apparu précédemment dans votre famille (p.ex. chez votre mère ou chez l'une de ses sœurs), vous pourriez aussi être exposée à un risque accru de souffrir d'un tel cancer. Vous devez en informer votre médecin.
Cancer de la muqueuse utérine
Lorsque des estrogènes comme ceux contenus dans Progynova/Progynova mite sont utilisés seuls sur une période prolongée, le risque de prolifération de la muqueuse utérine (hyperplasie de l'endomètre) ou de développement d'un cancer de la muqueuse utérine (carcinome de l'endomètre) augmente. Après l'arrêt du traitement estrogénique, le risque pourrait être accru pendant au moins 10 ans. Pour cette raison, les patientes dont l'utérus n'a pas été enlevé ne doivent pas prendre des estrogènes seuls. Si vous prenez Progynova/Progynova mite et que votre utérus n'a pas été enlevé, votre médecin vous prescrira une hormone supplémentaire (un progestatif) pendant au moins 12 jours par cycle de traitement et vous informera à ce sujet.
Informez votre médecin en cas de saignements utérins anormaux (règles irrégulières, abondantes ou prolongées, y compris spotting). Votre médecin les clarifiera au moyen de mesures diagnostiques appropriées.
Cancer des ovaires
Plusieurs études suggèrent qu'un THS (aussi bien une monothérapie estrogénique qu'un THS combiné) pourrait être associé à un risque légèrement accru d'apparition de cancer des ovaires.
Tumeurs du foie
Après utilisation de principes actifs hormonaux du type de ceux contenus dans Progynova/Progynova mite, on a observé dans de rares cas des modifications bénignes – encore plus rarement malignes – au niveau du foie; celles-ci ont conduit dans des cas isolés à des hémorragies intra-abdominales potentiellement mortelles. Aussi est-il important d'aviser le médecin en cas de douleurs épigastriques inhabituelles qui ne disparaissent pas spontanément rapidement.
Cardiopathie coronarienne et accident vasculaire cérébral
Deux grandes études cliniques utilisant les estrogènes conjugués et l'acétate de médroxyprogestérone (un progestatif), deux hormones utilisées dans le THS, suggèrent que le risque d'infarctus du myocarde peut être légèrement augmenté durant la première année d'utilisation. Ce risque n'est pas observé avec les estrogènes conjugués seuls.
Dans deux grandes études portant sur ces hormones, le risque d'accident vasculaire cérébral était augmenté de 30 à 40% aussi bien pour les estrogènes seuls que pour la préparation combinée.
Bien que l'on ne dispose pas de telles données pour Progynova/Progynova mite, le médicament ne doit pas être utilisé pour la prévention des maladies cardiaques et/ou des accidents vasculaires cérébraux.
Peu de données sont disponibles en ce qui concerne le THS débuté à un âge relativement jeune (p.ex. avant 55 ans). Elles suggèrent que l'augmentation du risque d'infarctus du myocarde pourrait être plus faible chez les patientes jeunes proches de la ménopause que chez les patientes plus âgées. Cela n'est toutefois pas le cas pour les accidents vasculaires cérébraux.
Le risque d'accidents vasculaires cérébraux est indépendant de l'âge ou du temps écoulé depuis la ménopause. Le risque des femmes sous THS augmente avec l'âge.
Risque accru de thrombose (caillots sanguins)
Un THS peut accroître le risque de thrombose (caillot de sang dans les vaisseaux).
Votre médecin vérifiera s'il existe chez vous un risque accru de formation d'une thrombose, par exemple en raison d'une combinaison de facteurs de risque ou peut-être en raison d'un facteur de risque très puissant. Dans le cas d'une combinaison de facteurs de risque, le risque peut s'avérer plus élevé que la simple addition de deux risques individuels. Si le risque est trop élevé, votre médecin ne prescrira pas de traitement hormonal substitutif.
Le risque de thrombose s'accroît avec l'âge et peut également se trouver augmenté si,
- vous, ou l'un de vos proches parents, avez souffert d'une thrombose des vaisseaux des jambes ou des poumons,
- vous êtes en surpoids,
- vous souffrez de varices,
- vous fumez,
- vous souffrez de lupus érythémateux disséminé (une maladie inflammatoire chronique),
- vous souffrez d'une tumeur maligne.
Si vous prenez déjà Progynova/Progynova mite, veuillez avertir votre médecin suffisamment à l'avance si vous prévoyez une hospitalisation ou une intervention chirurgicale. Le risque de thrombose veineuse profonde peut augmenter passagèrement à la suite d'une opération, d'une blessure sévère, d'un alitement ou d'une limitation des mouvements.
Démence
Lors d'un THS prolongé par un autre produit, de très rares cas de baisse de la mémoire et des capacités mentales ont été observés chez des patientes âgées. On ignore si le même risque existe avec Progynova/Progynova mite.
Autres mesures de précaution
Les estrogènes peuvent provoquer une rétention liquidienne (rétention d'eau ans les tissus). Les patientes souffrant de troubles de la fonction cardiaque ou rénale doivent donc faire l'objet d'une surveillance particulière.
Chaque dragée de Progynova/Progynova mite contient environ 46 mg respectivement 47 mg de lactose. Les patientes qui sont atteintes d'une intolérance au galactose, une maladie héréditaire rare, d'un déficit en Lapp-lactase ou d'une malabsorption du glucose-galactose et qui suivent un régime sans lactose, doivent tenir compte de ces quantités.
Interactions avec des tests de laboratoire
Un THS tel que Progynova/Progynova mite peut influencer les résultats de certains tests de laboratoire. Veuillez donc informer votre médecin ou le personnel du laboratoire que vous prenez Progynova/Progynova mite.
Interactions avec d'autres médicaments
L'effet de Progynova/Progynova mite peut être diminué par la prise simultanée de certains médicaments ou conduire à des irrégularités des règles: p.ex. médicaments destinés au traitement de l'épilepsie (barbituriques, phénytoïne, carbamazépine, oxcarbazépine, topiramate, felbamate, primidone), au traitement de l'infection par le VIH et de l'hépatite C (inhibiteurs de protéase et inhibiteurs non nucléosidiques de la transcriptase inverse), au traitement de la tuberculose (rifampicine, rifabutine), de l'hypertension pulmonaire (bosentan) et de certains types particuliers de somnolence excessive (modafinil), par la prise prolongée (plus de 10 jours) de certains antibiotiques (tétracycline) utilisés pour le traitement de certaines infections et par la prise de préparations à base de millepertuis (cf. ci-dessous).
Si vous devez prendre un antibiotique sur une longue durée (c'est-à-dire plus de 10 à 14 jours pour une infection des os ou une borréliose p.ex.), veuillez vous informer auprès de votre médecin ou de votre pharmacien sur la procédure à suivre par la suite.
Certains médicaments ainsi que le jus de pamplemousse peuvent entraîner une augmentation de la concentration sanguine de Progynova/Progynova mite. Informez votre médecin si vous prenez l'un des médicaments suivants ou du jus de pamplemousse:
- antifongiques contenant p.ex. de l'itraconazole, du voriconazole ou du fluconazole,
- certains antibiotiques (appelés macrolides) contenant de la clarithromycine ou de l'érythromycine,
- certains médicaments pour le traitement de maladies cardiovasculaires (contenant du diltiazem ou du vérapamil).
Si vous êtes diabétique, la prise de Progynova/Progynova mite pourrait modifier votre besoin en médicaments hypoglycémiants (y compris l'insuline).
Progynova/Progynova mite peut également modifier, en l'augmentant ou en la diminuant, l'efficacité d'autres médicaments, par exemple de la ciclosporine et de la lamotrigine, un antiépileptique (cela pourrait augmenter la fréquence des épisodes convulsifs. C'est pourquoi votre médecin doit surveiller le taux sanguin de lamotrigine au début de la prise du traitement par Progynova/Progynova mite et lorsque vous arrêtez la prise de Progynova/Progynova mite).
Les hormones sexuelles peuvent également modifier l'efficacité des anticoagulants.
Signalez à votre médecin si vous êtes traitée par des médicaments destinés au traitement d'infections par le virus de l'hépatite C (médicaments contenant des substances actives telles qu'ombitasvir, paritaprévir, ritonavir, dasabuvir). Les médicaments contenant des estrogènes, tels que Progynova/Progynova mite, pourraient le cas échéant influencer l'action de ces médicaments.
Veuillez informer votre médecin ou votre pharmacien si vous souffrez d'autres maladies, vous êtes allergique, vous prenez d'autres médicaments en usage interne ou externe (même en automédication)! Il est également important d'informer votre médecin ou votre dentiste que vous prenez Progynova/Progynova mite, lorsque ceux-ci vous prescrivent un nouveau médicament.
Effet sur l'aptitude à la conduite et l'utilisation de machines
Progynova/Progynova mite n'a aucun effet connu sur l'aptitude à la conduite et à l'utilisation de machines. Aucune étude correspondante n'a été effectuée. Veuillez cependant tenir compte des effets secondaires possibles.
Progynova/Progynova mite peut-il être pris pendant la grossesse ou l’allaitement?
Progynova/Progynova mite ne doit être pris en principe pendant la grossesse ni pendant l'allaitement. De faibles quantités d'hormones sexuelles peuvent passer dans le lait maternel. Il n'existe du reste pas d'utilisation fondée pour ce médicament pendant la grossesse et l'allaitement.
Si vous deviez malgré tout devenir enceinte au cours du traitement par Progynova/Progynova mite, ou si vous avez pris ce médicament par mégarde alors que vous étiez enceinte, informez-en immédiatement votre médecin.
Comment utiliser Progynova/Progynova mite?
Quand et comment devez-vous prendre Progynova/Progynova mite?
Si vous ne prenez ou n'utilisez actuellement aucun autre THS et n'avez plus de règles, vous pouvez commencer immédiatement à utiliser Progynova/Progynova mite.
Si vous prenez ou utilisez déjà un autre produit, commencez le traitement avec Progynova/Progynova mite le premier jour après l'arrêt de l'autre traitement ou en vous conformant aux instructions du médecin.
Si votre utérus est intact, votre médecin vous prescrira une hormone supplémentaire (progestatif) et vous donnera les informations nécessaires.
Une plaquette thermoformée (blister) de Progynova/Progynova mite contient 28 dragées. Le jour de la semaine est indiqué pour chaque dragée au verso de l'emballage. Un exemple: si vous commencez à prendre Progynova/Progynova mite un mercredi, prenez la dragée d'une alvéole pourvue de l'abréviation «MER» et suivez les flèches pour prendre les dragées suivantes.
Sauf prescription contraire du médecin, prendre 1 dragée de Progynova (2 mg) une fois par jour après un repas, sans la croquer, avec un peu de liquide. S'il vous arrivait un jour d'oublier de prendre la dragée à l'heure habituelle, il faudrait remédier à cette omission en prenant la dragée oubliée dans les 24 heures suivantes.
Les dragées se prennent sans interruption, ce qui veut dire que lorsque vous aurez terminé la première plaquette, vous entamerez la suivante dès le lendemain. Au cours de ce traitement, votre médecin pourra réduire la dose à 1 dragée de Progynova mite (1 mg) par jour.
Même à dose réduite, la prise des dragées se fait en continu, c.-à-d. lorsque vous aurez terminé une plaquette, vous entamerez la suivante dès le lendemain.
Si votre utérus est intact, votre médecin vous prescrira, en plus de Progynova/Progynova mite, une préparation contenant un progestatif. Il vous expliquera en détail quand, à quelle dose et combien de temps vous devrez prendre cet autre médicament.
Que faire si vous avez pris trop de dragées Progynova/Progynova mite?
Aucun cas de surdosage n'a été rapporté à ce jour. Des maux de tête des nausées, des vomissements, une tension dans les seins et des saignements utérins peuvent cependant apparaître. Aucun traitement spécifique n'est nécessaire, mais vous devez néanmoins consulter votre médecin dans un tel cas.
Que faire si votre médecin vous prescrit un progestatif supplémentaire?
Au cas où le médecin vous prescrit un progestatif en plus de Progynova/Progynova mite - nécessaire chez les femmes ayant un utérus intact - le progestatif devra être pris pendant 12 à 14 jours par mois (en cas de thérapie cyclique, pendant les 12 à 14 derniers jours d'un cycle de traitement). En règle générale, il se produit un saignement léger 2 à 3 jours après la fin de chaque période de traitement par le progestatif. Le dosage du progestatif et la durée du traitement sont déterminés par le médecin.
Ne changez pas le dosage prescrit de votre propre chef. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Instructions spéciales pour la posologie
Enfants et adolescentes
Progynova/Progynova mite n'est pas indiqué pour une utilisation chez les enfants et les adolescentes.
Patientes âgées
On ne dispose pas de données suggérant qu'une adaptation de la dose est nécessaire chez les patientes âgées.
Insuffisance hépatique
Progynova/Progynova mite n'a pas été spécifiquement étudié chez les patientes atteintes d'insuffisance hépatique. Les femmes atteintes d'une affection hépatique sévère ne doivent pas utiliser Progynova/Progynova mite(voir «Quand Progynova/Progynova mite ne doit-il pas être utilisé?»)
Insuffisance rénale
Progynova/Progynova mite n'a pas été spécifiquement étudié chez les patientes atteintes d'insuffisance rénale. Un ajustement de la dose n'est probablement pas nécessaire.
Quels effets secondaires Progynova/Progynova mite peut-il provoquer?
Les effets secondaires graves pouvant survenir en relation avec un THS sont décrits au chapitre «Quelles sont les précautions à observer lors de la prise de Progynova/Progynova mite?». Veuillez lire ce chapitre pour de plus amples informations.
La prise de dragées Progynova/Progynova mite peut provoquer les effets secondaires suivants:
Fréquents
Prise ou perte de poids, maux de tête, vertige, ballonnements, nausées, éruptions cutanées, démangeaisons, saignements anormaux (y compris saignements intermenstruels et spotting), sensation de tension dans les seins, douleurs au bas-ventre, œdèmes (accumulation de liquide dans les tissus).
Occasionnels
Réactions d'hypersensibilité, migraine, réaction cutanée inflammatoire associée à des papules rouges (érythème noueux), urticaire, crampes musculaires, augmentation du volume des seins.
Rares
Pilosité excessive (hirsutisme), acné.
Des utilisatrices de THS ont rapporté d'autres effets indésirables, pour lesquels l'existence d'un lien avec Progynova/Progynova mite n'est toutefois ni confirmée ni infirmée:
Première apparition ou aggravation d'un angio-œdème héréditaire (épisodes pendant lesquels apparaissent des enflures de parties du corps telles que les mains, les pieds, le visage ou les voies respiratoires), valeurs élevées de lipides sanguins, anxiété, nervosité, sautes d'humeur, modifications de la libido, dépression, troubles de la vue, palpitations, augmentation de la pression artérielle, vomissements, hyperacidité gastrique, valeurs anormales des tests de la fonction hépatique, calculs biliaires, jaunisse, aggravation d'une porphyrie (une maladie rare du métabolisme), taches brunes sur le visage (chloasma), chute de cheveux, réaction cutanée inflammatoire associée ou non à la formation de vésicules (érythème polymorphe), petits vaisseaux éclatés sous la peau (purpura vasculaire), maux de dos, douleurs aux seins, pertes vaginales accrues, augmentation du volume de myomes (tumeurs bénignes de l'utérus), augmentation du volume de la muqueuse utérine (hyperplasie endométriale), thrombose artérielle et veineuse (caillots sanguins).
Si vous remarquez d'autres effets secondaires, qui ne sont pas mentionnés dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
À quoi faut-il encore faire attention?
Tenir Progynova/Progynova mite hors de portée des enfants.
Le médicament ne doit pas être utilisé au-delà de la date imprimée sur le récipient avec la mention «EXP».
Conserver à température ambiante (15–25 °C).
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Progynova/Progynova mite?
Progynova
Chaque dragée blanche contient:
Principe actif: 2 mg de valérate d'estradiol.
Excipients: 46 mg de lactose, autres excipients.
Progynova mite
Chaque dragée beige contient:
Principe actif: 1 mg de valérate d'estradiol.
Excipients: 47 mg de lactose, autres excipients.
Numéro d’autorisation
33149 (Swissmedic).
Où obtenez-vous Progynova/Progynova mite? Quels sont les emballages à disposition sur le marché?
Progynova/Progynova mite est disponible en pharmacie, sur ordonnance médicale.
Progynova: emballages de 1× 28 et de 3× 28 dragées; Progynova mite: emballages de 3× 28 dragées.
Titulaire de l’autorisation
Bayer (Schweiz) AG, Zurich.
Cette notice d'emballage a été vérifiée pour la dernière fois en mai 2019 par l'autorité de contrôle des médicaments (Swissmedic).
Che cos'è Progynova/Progynova mite e quando si usa?
Progynova/Progynova mite contiene l'ormone sessuale femminile estradiolo, che appartiene alla famiglia dei cosiddetti estrogeni. Le sue proprietà sono identiche a quelle dell'ormone naturale estradiolo, prodotto dalle ovaie durante l'età fertile della donna fino alla menopausa (climaterio).
La menopausa è un processo naturale. Nella donna subentra in genere tra i 45 e i 55 anni di età, ma può anche sopraggiungere in età più giovane, per esempio a seguito della rimozione chirurgica delle ovaie. Dopo la menopausa, le ovaie producono molto meno estrogeni di prima.
Progynova/Progynova mite si usa per il trattamento degli stati di carenza di estrogeno dovuti a menopausa naturale o artificiale, come dopo la scomparsa del ciclo mestruale o a seguito di rimozione chirurgica delle ovaie per il trattamento dei disturbi del climaterio. Un trattamento di questo tipo è definito terapia ormonale sostitutiva (TOS).
I disturbi climaterici si possono manifestare sotto forma di vampate di calore, attacchi di sudore, disturbi del sonno, stati depressivi, irritabilità nervosa, mal di testa, vertigini. Tuttavia, nelle pazienti che non presentano sintomi come vampate di calore, attacchi di sudore o disturbi del sonno, Progynova/Progynova mite non è efficace contro gli sbalzi d'umore né contro gli stati depressivi.
Progynova/Progynova mite ha effetti positivi anche sulle irritazioni della vescica, molto frequenti nel periodo della menopausa, e sui fenomeni regressivi (atrofia) a danno delle mucose del tratto urogenitale, che insorgono normalmente con l'età.
Alle donne con un utero intatto, oltre a Progynova/Progynova mite il medico prescriverà un secondo preparato ormonale a base di un principio attivo cosiddetto progestinico. Il progestinico previene una crescita indesiderata della mucosa uterina proteggendo così l'utero da possibili tumori. A questo scopo deve essere preso per almeno 12-14 giorni al mese. Il dosaggio del progestinico e la durata della terapia sono prescritti dal medico. Al termine del periodo di trattamento con il progestinico compaiono perdite simili alle mestruazioni.
Progynova/Progynova mite può essere usato solo su prescrizione medica e sotto continuo controllo del medico.
Di che cosa occorre inoltre tener conto durante il trattamento?
Progynova/Progynova mite non è un anticoncezionale (vedere «Quando è richiesta prudenza nell'uso di Progynova/Progynova mite?»).
Una terapia ormonale sostitutiva può essere associata a un rischio più elevato di determinate malattie, come cancro al seno e malattie cardiovascolari (infarto, ictus cerebrale, trombosi venose ed embolie polmonari, disturbi caratterizzati dalla formazione di coaguli nei vasi sanguigni) (vedere «Quando è richiesta prudenza nell'uso di Progynova/Progynova mite?»).
Il medico valuterà insieme a lei i benefici attesi e i rischi legati a una terapia ormonale.
Quando non si può usare Progynova/Progynova mite?
Non può utilizzare Progynova/Progynova mite nei seguenti casi:
- se ha un cancro al seno o in caso di sospetto cancro al seno,
- se ha un tumore ormono-dipendente come il cancro dell'utero e delle ovaie, o in caso di sospetto cancro dell'utero o delle ovaie,
- se presenta un ispessimento eccessivo, non trattato, della mucosa uterina (iperplasia dell'endometrio),
- se ha perdite vaginali di sangue di origine non chiara,
- se ha o ha avuto in passato un tumore al fegato (benigno o maligno),
- se ha o ha avuto in passato una grave malattia al fegato, fintanto che i valori indicativi della funzionalità epatica non si sono normalizzati,
- se ha o ha avuto in passato una malattia dei vasi sanguigni causata dalla formazione di coaguli (trombosi venosa, trombosi, embolia polmonare),
- se ha avuto di recente un infarto e/o un ictus cerebrale,
- se presenta fattori di rischio per l'insorgenza di una trombosi arteriosa o venosa (coagulo di sangue) (p. es. deficit di antitrombina, proteina S o proteina C),
- se i suoi valori dei trigliceridi (un particolare tipo di grassi presenti nel sangue) sono elevati,
- se soffre di porfiria, un disturbo del metabolismo,
- se è in gravidanza o allatta al seno,
- se presenta ipersensibilità (allergia) a uno dei componenti di Progynova/Progynova mite.
Se uno dei suddetti eventi dovesse manifestarsi per la prima volta durante il trattamento con Progynova/Progynova mite, deve interrompere immediatamente la terapia e rivolgersi al suo medico.
Quando è richiesta prudenza nell'uso di Progynova/Progynova mite?
Prima di iniziare trattamento, il medico discuterà con lei i benefici e i rischi di una terapia con Progynova/Progynova mite.
Prima di iniziare il trattamento con Progynova/Progynova mite, il medico la sottoporrà a un'approfondita visita generale e ginecologica e le raccomanderà di praticare l'autopalpazione del seno, istruendola a riguardo.
In caso di terapia prolungata con Progynova/Progynova mite, per precauzione dovrà sottoporsi a visite annuali di controllo.
Nel corso del trattamento con Progynova/Progynova mite non deve instaurarsi una gravidanza (vedere «Si può utilizzare Progynova/Progynova mite durante la gravidanza o l'allattamento?»). A scopo di contraccezione dovrà eventualmente utilizzare metodi non ormonali (ad eccezione del metodo del calendario di Ogino-Knaus e il metodo della misurazione della temperatura basale). Se durante il trattamento non dovessero comparire sanguinamenti da sospensione a intervalli regolari di circa 28 giorni, nonostante l'uso di un anticoncezionale va considerata la possibilità di una gravidanza e il trattamento va interrotto fino all'accertamento da parte del medico.
Motivi alla base dell'interruzione immediata del trattamento con Progynova/Progynova mite:
- prima comparsa di mal di testa di tipo emicranico o frequente comparsa di mal di testa insolitamente forti,
- improvvisi disturbi della percezione (p.es. disturbi della vista o dell'udito),
- primi segni di flebite (infiammazione di una vena) con formazione di un trombo (trombosi) oppure di malattie dovute alla formazione di coaguli di sangue (embolia) (p.es. dolori insoliti alle gambe o gonfiore delle gambe, dolori lancinanti alla respirazione o tosse di origine poco chiara, perdita di conoscenza),
- dolori e senso di costrizione al petto,
- comparsa di ittero,
- comparsa di un'epatite,
- prurito in tutto il corpo,
- sviluppo di miomi (tumori benigni dell'utero),
- aumento degli attacchi epilettici,
- marcato aumento della pressione arteriosa,
- gravidanza.
Motivi per sottoporsi a controlli medici più frequenti:
È importante che lei informi il medico se ha o ha avuto in passato una delle seguenti malattie. In questi casi può essere necessario aumentare la frequenza dei controlli:
- se ha mestruazioni irregolari, alterazioni del seno, cancro al seno in famiglia o un tumore benigno dell'utero (cosiddetto mioma),
- se nella sua storia medica ha un eccessivo ispessimento della mucosa uterina (iperplasia dell'endometrio),
- se ha o ha avuto in passato un'endometriosi (presenza di tessuto della mucosa uterina in altre aree del corpo dove normalmente non dovrebbe trovarsi),
- se presenta fattori di rischio per la formazione di coaguli di sangue (malattie tromboemboliche) (vedere anche il capitolo «Aumento del rischio di trombosi (formazione di coaguli di sangue)»,
- se soffre di emicrania,
- se è affetta da pressione alta,
- se soffre di diabete
- se presenta valori elevati dei grassi nel sangue (ipertrigliceridemia) o se questa malattia è presente nella sua famiglia,
- se soffre di una malattia del fegato (per es. tumore benigno del fegato – adenoma epatico) o della cistifellea (soprattutto calcoli biliari),
- se soffre di asma,
- se soffre di epilessia o ballo di San Vito (chorea minor),
- se soffre di lupus eritematoso sistemico (LES, una malattia cronica di natura infiammatoria),
- se talvolta le compaiono o le sono comparse delle macchie brunastre persistenti sul viso (cloasma). In questo caso deve evitare un'esposizione eccessiva al sole o alla luce ultravioletta,
- se soffre di sordità ereditaria (otosclerosi),
- se è affetta da angioedema ereditario (caratterizzato da tumefazioni episodiche di parti del corpo come mani, piedi, volto o vie respiratorie),
- se soffre di un prolattinoma (un tumore) del lobo anteriore dell'ipofisi (lobo anteriore della ghiandola pituitaria) è necessaria una stretta sorveglianza medica (incluse misurazioni regolari del livello di prolattina).
Cancro al seno
In determinati studi è stato osservato un lieve aumento delle diagnosi di tumori al seno nelle donne che hanno ricevuto per anni una TOS. È un rischio che cresce in proporzione alla durata della terapia. Con prodotti che contengono solo estrogeni questo aumento del rischio potrebbe essere possibilmente neutrale. Nelle donne che interrompono la TOS il rischio di cancro al seno ritorna a valori normali entro pochi anni.
La TOS può alterare le immagini mammografiche (aumentandone la densità), il che può ostacolare in alcuni casi l'individuazione del cancro al seno. Per questo motivo, il medico potrà ritenere opportuno ricorrere anche ad altri metodi di screening (indagine preventiva) del cancro al seno.
Se in precedenza ha avuto casi di cancro al seno in famiglia (per esempio sua madre o le sue sorelle), anche lei potrebbe essere esposta a un rischio più elevato di sviluppare questa malattia. Informi a riguardo il suo medico.
Cancro della mucosa uterina
L'uso di soli estrogeni, come quelli contenuti in Progynova/Progynova mite, per un periodo di tempo prolungato determina un aumento del rischio di sviluppare una proliferazione della mucosa uterina (iperplasia dell'endometrio) o di insorgenza di un tumore dell'endometrio (carcinoma dell'endometrio). Dopo l'interruzione della terapia a base di estrogeni, il rischio potrebbe rimanere elevato per almeno 10 anni. Le donne che hanno ancora l'utero non dovrebbero perciò prendere estrogeni da soli. Se lei prende Progynova/Progynova mite e ha ancora l'utero, il suo medico le prescriverà un ulteriore ormone (progestinico) da assumere per almeno 12 giorni per ciclo di trattamento e la informerà a riguardo.
Informi il medico se nota la comparsa di sanguinamenti anomali (sanguinamenti irregolari, intensi o persistenti, incl. spotting). Il medico la sottoporrà ad accertamenti con procedure diagnostiche appropriate.
Cancro delle ovaie
Diversi studi suggeriscono che una TOS (sia monoterapia a base di estrogeni sia TOS combinata) potrebbe essere associata a un minore aumento del rischio di sviluppare un cancro delle ovaie.
Tumori del fegato
In rari casi, dopo l'uso di principi attivi ormonali come quelli contenuti in Progynova/Progynova mite, è stata osservata la comparsa di alterazioni benigne, e ancora più raramente maligne, a carico del fegato, che sporadicamente hanno causato emorragie nella cavità addominale potenzialmente fatali. Occorre quindi informare il medico se si manifestano insoliti disturbi nella parte alta dell'addome che non scompaiono rapidamente da soli.
Malattia coronarica e ictus cerebrale
Da due ampi studi clinici sull'uso combinato di estrogeni coniugati e medrossiprogesterone acetato (un progestinico) per la TOS è emerso un possibile lieve aumento del rischio di infarto nel primo anno di trattamento. Tale rischio non è stato riscontrato con i soli estrogeni coniugati.
In due ampi studi su questi ormoni, il rischio di ictus cerebrale è risultato aumentato del 30-40%, sia con i soli estrogeni sia con il preparato combinato.
Sebbene non siano disponibili dati di questo tipo per Progynova/Progynova mite, Progynova/Progynova mite non va utilizzato per la prevenzione delle malattie cardiache e/o dell'ictus cerebrale.
I dati sull'avvio di una TOS in età relativamente precoce (p. es. prima dei 55 anni) sono limitati. Questi dati suggeriscono che l'aumento del rischio di infarto in pazienti più giovani prossime alla menopausa potrebbe essere più ridotto rispetto a quello di pazienti in età più avanzata. Ciò però non vale per gli ictus cerebrali.
Il rischio di ictus è indipendente dall'età o dal tempo trascorso dalla menopausa. Nelle donne che seguono una TOS aumenta all'aumentare dell'età.
Aumento del rischio di trombosi (formazione di coaguli di sangue)
Una TOS può aumentare il rischio di trombosi (formazione di coaguli all'interno dei vasi sanguigni).
Il suo medico verificherà se nel suo caso, p.es. a causa di una combinazione di fattori di rischio o eventualmente di un fattore di rischio molto forte, sussista un maggiore rischio di trombosi. In presenza di una combinazione di fattori di rischio, il rischio risultante può essere maggiore della semplice somma di due rischi singoli. Se il rischio fosse troppo elevato, il suo medico non le prescriverà alcuna TOS.
Il rischio cresce con l'età e può aumentare nei seguenti casi:
- se lei o uno dei suoi parenti stretti ha già avuto una trombosi dei vasi sanguigni delle gambe o dei polmoni,
- se lei è in sovrappeso,
- se soffre di vene varicose,
- se fuma,
- se soffre di lupus eritematoso sistemico (una malattia cronica di natura infiammatoria),
- se soffre di una malattia tumorale maligna.
Se sta già prendendo Progynova/Progynova mite, informi il medico con ragionevole anticipo se ha in programma una degenza ospedaliera o un intervento chirurgico. Il rischio di sviluppare una trombosi venosa profonda può aumentare temporaneamente a causa di operazioni, gravi lesioni traumatiche, degenza a letto o limitazioni dell'attività motoria.
Demenza
Durante una TOS prolungata con un altro preparato ormonale è stata osservata, in casi molto rari, una diminuzione della capacità di memoria e delle facoltà mentali in pazienti in età avanzata. Non è noto se con Progynova/Progynova mite sussista lo stesso rischio.
Ulteriori misure precauzionali
Gli estrogeni possono provocare ritenzione di fluidi (accumuli di acqua nel tessuto). Pertanto, le pazienti con disturbi della funzionalità cardiaca o renale devono essere monitorate attentamente.
Ogni confetto di Progynova/Progynova mite contiene circa 46 mg rispettivamente 47 mg di lattosio. Le pazienti affette da rara intolleranza ereditaria al galattosio, carenza di Lapp lattasi o da malassorbimento del glucosio-galattosio che seguono una dieta priva di lattosio, devono tenere conto di questa quantità.
Interazioni con test di laboratorio
Una TOS come Progynova/Progynova mite può influenzare gli esiti di determinati esami di laboratorio. Deve pertanto avvisare il medico o il personale di laboratorio che prende Progynova/Progynova mite.
Interazioni con altri medicamenti
Se assunti in concomitanza, determinati medicamenti possono interferire con l'azione di Progynova/Progynova mite o provocare disturbi di sanguinamento: per es. medicamenti per il trattamento dell'epilessia (barbiturici, fenitoina, carbamazepina, oxcarbazepina, topiramato, felbamato, primidone), medicamenti per il trattamento dell'infezione da HIV e da epatite C (inibitori delle proteasi e inibitori non nucleosidici della trascrittasi inversa), della tubercolosi (rifampicina, rifabutina), dell'ipertensione polmonare (bosentan), di un tipo particolare di sonnolenza eccessiva (modanafil), nonché in caso di assunzione a lungo termine (per 10 giorni) di determinati antibiotici (tetracicline) per il trattamento di determinate infezioni e in caso di assunzione di preparati a base di erba di San Giovanni (vedere sotto).
Si informi presso il suo medico o il suo farmacista su come procedere qualora debba assumere antibiotici (per es. in caso di infezioni delle ossa o di borreliosi) per un periodo di tempo prolungato (ovvero per più di 10-14 giorni).
Alcuni medicamenti come pure il succo di pompelmo possono aumentare la concentrazione del principio attivo di Progynova/Progynova mite nel sangue. Informi il suo medico se assume uno dei medicamenti seguenti o succo di pompelmo:
- antimicotici contenenti principi attivi come, per esempio, itraconazolo, voriconazolo o fluconazolo,
- determinati antibiotici (cosiddetti macrolidi), contenenti come principio attivo claritromicina o eritromicina,
- determinati medicamenti per il trattamento di malattie cardiocircolatorie (a base dei principi attivi diltiazem o verapamil).
Se soffre di diabete, con l'assunzione di Progynova/Progynova mite potrebbe cambiare il suo fabbisogno di medicamenti ipoglicemizzanti (incl. l'insulina).
Progynova/Progynova mite può influenzare anche l'azione di altri medicamenti, potenziandola o riducendola. Ciò riguarda, per esempio, la ciclosporina e l'antiepilettico lamotrigina (poiché la frequenza degli attacchi epilettici potrebbe aumentare, il suo medico monitorerà il livello di lamotrigina nel suo sangue quando inizierà ad assumere Progynova/Progynova mite e se interromperà Progynova/Progynova mite).
Inoltre, gli ormoni sessuali possono interferire con l'azione di medicamenti anticoagulanti.
Informi il suo medico se è in terapia con medicamenti per il trattamento di infezioni da epatite C (medicamenti contenenti principi attivi come ombitasvir, paritaprevir, ritonavir, dasabuvir). I medicamenti contenenti estrogeni come Progynova/Progynova mite potrebbero influire anche sull'azione di questi medicamenti.
Informi il suo medico o il suo farmacista nel caso in cui soffre di altre malattie, soffre di allergie o assume o applica esternamente altri medicamenti (anche se acquistati di sua iniziativa!). È importante che lei informi anche il suo medico o dentista che assume, qualora questi le prescriva nuovi medicamenti.
Effetti sulla capacità di condurre veicoli e di utilizzare macchine
Non è noto alcun influsso di Progynova/Progynova mite sulla capacità di condurre veicoli o di utilizzare macchine. Non sono stati condotti studi a riguardo. Tenga presente i possibili effetti indesiderati.
Si può assumere/usare Progynova/Progynova mite durante la gravidanza o l'allattamento?
In linea di massima, Progynova/Progynova mite non può essere assunto durante la gravidanza o il periodo dell'allattamento. Quantità molto piccole di ormoni sessuali possono essere escrete nel latte materno. Oltretutto, non esistono valide ragioni mediche per l'uso di questo medicamento durante la gravidanza e l'allattamento.
Se tuttavia dovesse restare incinta durante il trattamento con Progynova/Progynova mite o assumere inavvertitamente il preparato durante una gravidanza, deve informare immediatamente il medico.
Come usare Progynova/Progynova mite?
Come e quando deve prendere Progynova/Progynova mite?
Se al momento non assume o usa altri preparati per la TOS e non ha più le mestruazioni, può iniziare immediatamente a usare Progynova/Progynova mite.
Se sta già assumendo o usando un altro preparato, attenda il primo giorno dopo aver cessato il trattamento con l'altro preparato per iniziare la terapia con Progynova/Progynova mite o osservi le indicazioni del suo medico.
Se ha un utero intatto, il medico le prescriverà un ulteriore ormone (un progestinico), dandole le istruzioni necessarie.
Una confezione blister di Progynova/Progynova mite contiene 28 confetti. Sul retro del blister è segnato per ogni confetto il giorno della settimana corrispondente. Se inizia il trattamento con Progynova/Progynova mite, per esempio, di mercoledì, prenda un confetto contrassegnato con «MER» e continui ad assumere i confetti seguendo la direzione della freccia.
Salvo diversa prescrizione del medico, la dose è di 1 confetto di Progynova (2 mg) al giorno, da prendere dopo un pasto con un po' d'acqua senza masticarlo. Se dimentica di prendere il confetto all'ora abituale, deve prenderlo entro le successive 24 ore.
L'assunzione dei confetti deve essere continuativa, vale a dire che una volta terminata la prima confezione, dovrà iniziare quella seguente il giorno immediatamente successivo. Nel corso del trattamento il medico potrà ridurre la dose a 1 confetto di Progynova mite (1 mg) al giorno.
L'assunzione dei confetti rimane continuativa anche dopo una riduzione della dose: quando la prima confezione è terminata, quella seguente va sempre iniziata il giorno immediatamente successivo.
Se ha ancora l'utero, oltre a Progynova/Progynova mite il medico le prescriverà anche un preparato progestinico e le spiegherà nel dettaglio quando, in che quantità e per quanto tempo assumere tale preparato.
Cosa deve fare se prende troppi confetti di Progynova/Progynova mite?
Non sono stati segnalati casi di sovradosaggio. Potrebbero però comparire mal di testa, nausea, vomito, tensione al seno e sanguinamenti uterini. Non è necessaria una terapia specifica, ma deve comunque consultare il medico.
Cosa deve fare se il suo medico le prescrive un preparato progestinico aggiuntivo?
Se, in aggiunta a Progynova/Progynova mite, il medico le prescrive un preparato progestinico – cosa necessaria nelle donne con utero intatto – il progestinico va preso per 12-14 giorni al mese (in caso di utilizzo ciclico, durante gli ultimi 12-14 giorni del ciclo di trattamento). Generalmente, 2-3 giorni dopo la fine del ciclo di trattamento con il progestinico compare un sanguinamento da sospensione. Il dosaggio del progestinico e la durata del trattamento sono stabiliti dal medico.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al medico o al farmacista.
Istruzioni particolari per la posologia:
Bambine e ragazze
Progynova/Progynova mite non è indicato per l'uso in bambine e ragazze.
Pazienti anziane
Non sono disponibili dati che indichino la necessità di un aggiustamento della dose in pazienti anziane.
Compromissioni della funzionalità epatica
Non sono stati condotti studi specifici su Progynova/Progynova mite in pazienti con compromissioni della funzionalità epatica. Le donne con gravi malattie epatiche non devono assumere Progynova/Progynova mite (vedere «Quando non si può usare Progynova/Progynova mite?»).
Compromissioni della funzionalità renale
Non sono stati condotti studi specifici su Progynova/Progynova mite in pazienti con compromissioni della funzionalità renale. Probabilmente non occorrono aggiustamenti della dose.
Quali effetti collaterali può avere Progynova/Progynova mite?
Gli effetti collaterali gravi associati a una TOS sono stati descritti in precedenza al capitolo «Quando è richiesta prudenza nell'uso di Progynova/Progynova mite?». Lo legga per ulteriori informazioni.
Con l'assunzione di Progynova/Progynova mite confetti possono manifestarsi i seguenti ulteriori effetti collaterali:
Frequenti
Aumento o diminuzione del peso corporeo, mal di testa, vertigini, flatulenza, nausea, eruzione cutanea, prurito, sanguinamenti anomali (compresi perdite intermestruali e spotting), tensione al seno, dolori al basso ventre, edemi (accumulo di liquidi).
Occasionali
Reazioni di ipersensibilità, emicrania, alterazioni cutanee infiammatorie con papule rossastre (eritema nodoso), orticaria, crampi muscolari, ingrossamento del seno.
Rari
Eccesso di peluria (irsutismo), acne.
Nelle donne che seguono una TOS sono stati riscontrati altri effetti indesiderati, la cui correlazione con Progynova/Progynova mite, tuttavia, non è stata dimostrata né smentita:
prima comparsa o peggioramento di un angioedema ereditario (tumefazioni episodiche di parti del corpo come mani, piedi, volto o vie aeree), aumento dei grassi nel sangue, ansia, nervosismo, alterazioni dell'umore, alterazioni dell'istinto sessuale, depressione, disturbi della vista, palpitazioni, aumento della pressione arteriosa (ipertensione), vomito, iperacidità gastrica, risultati anomali ai test della funzionalità epatica, calcolosi biliare, ittero, peggioramento di una porfiria (una rara malattia metabolica), chiazze brune sulla pelle del viso (cloasma), caduta dei capelli, alterazioni cutanee infiammatorie con o senza formazione di vescicole (eritema multiforme), venuzze esplose sotto pelle (porpora vascolare), mal di schiena, dolore al petto, aumento delle secrezioni vaginali, ingrossamento di miomi uterini (tumori benigni dell'utero), ingrossamento della mucosa dell'endometrio (iperplasia dell'endometrio), trombosi arteriose o venose (formazione di coaguli di sangue).
Se osserva effetti collaterali qui non descritti dovrebbe informare il suo medico o il suo farmacista.
Di che altro occorre tener conto?
Progynova/Progynova mite va tenuto fuori dalla portata dei bambini.
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore confezione.
Conservare a temperatura ambiente (15-25 °C).
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Progynova/Progynova mite?
Progynova
Ogni confetto bianco contiene:
Principio attivo: 2 mg di estradiolo valerato.
Sostanze ausiliarie: 46 mg di lattosio, altre sostanze ausiliarie.
Progynova mite
Ogni confetto beige contiene:
Principio attivo: 1 mg di estradiolo valerato.
Sostanze ausiliarie: 47 mg di lattosio, altre sostanze ausiliarie.
Numero dell'omologazione
33149 (Swissmedic).
Dove è ottenibile Progynova/Progynova mite? Quali confezioni sono disponibili?
Progynova/Progynova mite è ottenibile in farmacia, dietro presentazione della prescrizione medica.
Progynova è disponibile in confezioni da 1× 28 e da 3× 28 confetti, Progynova mite in confezioni da 3× 28 confetti.
Titolare dell’omologazione
Bayer (Schweiz) AG, Zurigo.
Questo foglietto illustrativo è stato controllato l'ultima volta nel maggio 2019 dall'autorità competente in materia di medicamenti (Swissmedic).
Zusammensetzung
Progynova
Wirkstoff: Estradioli valeras.
Hilfsstoffe: Lactosum monohydricum 46 mg, excipiens pro compresso obducto.
Progynova mite
Wirkstoff: Estradioli valeras.
Hilfsstoffe: Lactosum monohydricum 47 mg, excipiens pro compresso obducto.
Galenische Form und Wirkstoffmenge pro Einheit
Progynova
Jedes weisse Dragee enthält 2 mg Estradiolvalerat.
Progynova mite
Jedes beige Dragee enthält 1 mg Estradiolvalerat.
Indikationen/Anwendungsmöglichkeiten
Behandlung von Östrogen-Mangelerscheinungen als Folge der natürlichen oder künstlichen Menopause.
Bei nicht-hysterektomierten Patientinnen muss die Östrogensubstitution stets durch eine Gestagentherapie ergänzt werden.
Bei Patientinnen, bei welchen ausschliesslich urogenitale Beschwerden ohne gleichzeitige andere behandlungsbedürftige Östrogenmangelerscheinungen vorliegen, sollte eine topische Östrogentherapie durchgeführt und auf eine systemische HRT verzichtet werden.
Dosierung/Anwendung
Für alle Indikationen soll immer die niedrigste wirksame Dosierung angewendet und so kurz als möglich behandelt werden. Die Hormonsubstitution sollte nur fortgesetzt werden, solange der Nutzen das Risiko für die einzelne Patientin überwiegt.
Normalerweise wird die Behandlung mit der Einnahme von täglich 1 Dragee Progynova (2 mg) nach dem Essen begonnen. Die Dragee-Einnahme erfolgt kontinuierlich, d.h. die nächste Packung von Progynova folgt sofort ohne Unterbrechung. Im Verlauf der weiteren Behandlung kann die Dosis auf 1 Dragee Progynova mite (1 mg) täglich reduziert werden. Auch bei der reduzierten Dosis erfolgt die Einnahme kontinuierlich.
Das für nicht-hysterektomierte Patientinnen erforderliche Gestagen sollte jeweils an mindestens 12-14 Tagen pro Behandlungszyklus eingenommen werden. Es wird auf die Fachinformation der entsprechenden Gestagenpräparate verwiesen.
Vergessene Einnahme
Wenn die Einnahme eines Dragees zur gewohnten Zeit vergessen wurde, sollte sie innerhalb von 24 Stunden nachgeholt werden, um das Auftreten von Zwischenblutungen zu vermeiden.
Spezielle Dosierungsanweisungen
Kinder und Jugendliche
Bei Kindern und Jugendlichen besteht keine Indikation.
Ältere Patientinnen
Es liegen keine Daten vor, die darauf hindeuten, dass bei älteren Patientinnen eine Anpassung der Dosis erforderlich ist.
Leberfunktionsstörungen
Progynova/Progynova mite wurde bei Patientinnen mit Leberfunktionsstörung nicht untersucht. Bei Frauen mit schwerer Lebererkrankung ist Progynova/Progynova mite kontraindiziert.
Nierenfunktionsstörungen
Progynova/Progynova mite wurde bei Patientinnen mit Nierenfunktionsstörung nicht untersucht. Eine Dosisanpassung ist wahrscheinlich nicht erforderlich.
Kontraindikationen
- bestehendes oder bei Verdacht auf ein Mammakarzinom,
- bestehende oder Verdacht auf Sexualhormon-abhängige premaligne oder maligne Erkrankung,
- unbehandelte Endometriumhyperplasie,
- nicht abgeklärte abnormale genitale Blutung,
- bestehende oder vorausgegangene benigne oder maligne Lebertumore,
- schwere Lebererkrankungen (auch in der Anamnese), solange sich die Leberfunktionswerte nicht normalisiert haben,
- bestehende oder vorausgegangene venöse thromboembolische Ereignisse (z.B. tiefe Beinvenenthrombose, Lungenembolie),
- akute oder kürzlich aufgetretene arterielle thromboembolische Ereignisse (Hirninfarkt, Myokardinfarkt),
- Vorliegen von Risikofaktoren für arterielle oder venöse thromboembolische Ereignisse (z.B. Mangel an Antithrombin, Protein S oder Protein C),
- schwere Hypertriglyzeridämie,
- Porphyrie,
- Schwangerschaft und Stillzeit,
- bekannte Überempfindlichkeit gegenüber einer Komponente von Progynova/Progynova mite.
Warnhinweise und Vorsichtsmassnahmen
Jeder Hormonersatztherapie (HRT) soll eine Untersuchung des klinischen Allgemeinzustandes und eine gründliche gynäkologische Untersuchung vorangehen, die mindestens jährlich zu wiederholen sind. Die Eigen- und Familienanamnese sollten ebenfalls berücksichtigt werden. Das Nutzen-Risiko-Verhältnis muss vor jeder Therapie und für jede Patientin individuell sorgfältig abgewogen werden. Es sollte immer die niedrigste wirksame Dosis und die kürzestmögliche Behandlungdauer gewählt werden.
Gründe für einen sofortigen Therapieabbruch
Falls während einer HRT-Behandlung eine der oben genannten Kontraindikationen auftritt, oder bei einer der folgenden Situationen, muss die Behandlung sofort abgebrochen werden:
- Symptome eines venösen oder arteriellen thromboembolischen Ereignisses bzw. bei Verdacht hierauf; hierzu gehören auch:
- erstmaliges Auftreten migräneartiger oder häufigeres Auftreten ungewohnt starker Kopfschmerzen;
- plötzlicher partieller oder vollständiger Visusverlust
- plötzliche Hörstörungen;
- klinisch relevanter Blutdruckanstieg
- Verschlechterung der Leberfunktion oder Auftreten von Ikterus oder Hepatitis
- erkennbares Wachstum von Myomen
- Zunahme epileptischer Anfälle
- Schwangerschaft
Umstände, die eine besondere Überwachung erfordern
Wenn folgende Beschwerden bestehen, vor kurzem aufgetreten sind und/oder sich während einer Schwangerschaft oder während einer früheren Hormonbehandlung verschlechtert haben, sollte die Patientin sorgfältig überwacht werden. Es sollte in Betracht gezogen werden, dass diese Beschwerden während der Behandlung mit Progynova/Progynova mite wieder auftreten bzw. sich verschlechtern können:
- Risikofaktoren für östrogenabhängige Tumoren (z.B. Mammakarzinom bei Verwandten 1. Grades)
- benigne Brustveränderungen
- Endometriumhyperplasie (auch in der Anamnese)
- Leiomyome oder Endometriose
- Risikofaktoren für thromboembolische Erkrankungen
- Migräne
- Hypertonie
- Diabetes mellitus
- Hypertriglyzeridämie
- Erkrankungen der Leber oder der Gallenblase
- Asthma
- Epilepsie
- systemischer Lupus erythematodes
- Chorea minor
- Otosklerose
Bei Risikofaktoren bezüglich folgender Zustände sollten die Vorteile der Anwendung von Progynova/Progynova mite gegenüber den möglichen Risiken abgewogen werden.
Tumorerkrankungen
Brustkrebs
Randomisierte kontrollierte Studien und epidemiologische Studien ergaben bei Frauen, die eine HRT über mehrere Jahre anwendeten, ein erhöhtes Brustkrebsrisiko. Bei allen Frauen sollten daher vor Beginn einer HRT sowie jährlich Brustuntersuchungen durch den Arzt und monatliche Selbstuntersuchungen der Brust durchgeführt werden. Die Anwenderinnen sollten darüber aufgeklärt werden, welche Veränderungen der Brust sie ihrem Arzt I ihrer Ärztin mitteilen müssen. Abhängig vom Alter und den jeweiligen Risikofaktoren kann zusätzlich eine Mammographie indiziert sein.
Eine Metaanalyse von 51 epidemiologischen Studien zeigte, dass das Risiko, an Brustkrebs zu erkranken, mit der Dauer der HRT zunimmt und nach Absetzen der HRT abnimmt. Das relative Risiko (RR), an Brustkrebs zu erkranken, war 1,35 (95% Konfidenz-Intervall (CI) 1,21–1,49) für Frauen, die eine HRT während 5 Jahren oder länger anwendeten.
Die Women's Health Initiative (WHI)-Studie, eine grosse, prospektive, Placebo-kontrollierte, randomisierte Studie, zeigte bei mehr als 8'000 älteren, postmenopausalen Frauen (Alter bei Studienbeginn 50–79 Jahre, mittleres Alter 63 Jahre), im Vergleich zu Placebo unter kombinierter HRT mit konjugierten Östrogenen und Medroxyprogesteronacetat (MPA) nach einer durchschnittlichen Behandlungszeit von 5,6 Jahren eine Zunahme von invasiven Mammakarzinomen in der Östrogen/Gestagen-Gruppe (RR 1,24 [95% CI 1,02–1,50]). Es ist nicht bekannt, ob für andere kombinierte HRT-Präparate ein vergleichbares Risiko besteht. Für die Östrogen-Monotherapie war das Risiko hingegen nicht erhöht (RR 0,77 [95% CI 0,59–1,01]).
Die Million Women Study, eine nicht randomisierte Kohortenstudie, rekrutierte 1'084'110 Frauen. Das durchschnittliche Alter der Frauen bei Eintritt in die Studie war 55,9 Jahre. Die Hälfte der Frauen erhielt vor und/oder zum Zeitpunkt des Studienantritts eine HRT, die übrigen Frauen wurden nie mit HRT behandelt. Es wurden 9'364 Fälle von invasivem Mammakarzinom und 637 Todesfälle infolge von Brustkrebs registriert, nach einer durchschnittlichen Beobachtungszeit von 2,6 bzw. 4,1 Jahren. Frauen, die bei der Aufnahme in die Studie eine HRT anwendeten, zeigten verglichen mit Frauen, die nie eine solche Behandlung erhalten hatten, ein höheres Risiko in Bezug auf Morbidität (RR 1,66 [95% CI 1,58–1,75]) und möglicherweise in geringerem Ausmass auch für die Mortalität infolge Brustkrebs (RR 1,22 [95% CI 1,00–1,48]). Das höchste Risiko wurde unter kombinierter Östrogen-Gestagen-Therapie gesehen (RR 2,00 [95% CI 1,88–2,12]). Für eine Östrogen-Monotherapie betrug das relative Risiko 1,30 (95% CI 1,21–1,40). Die Resultate fielen für verschiedene Östrogene und Gestagene, für unterschiedliche Dosierungen und Verabreichungswege sowie für kontinuierliche und sequentielle Therapien ähnlich aus. Bei allen Arten der HRT stieg das Risiko mit zunehmender Dauer der Anwendung. Nach Absetzen der Therapie war das Risiko rückläufig (letzte Anwendung vor >5 Jahren, RR 1,04 [95% CI 0,95–1,12]).
Eine HRT erhöht die Dichte der mammographischen Bilder, was die radiologische Detektion von Mammakarzinomen in einigen Fällen beeinträchtigen kann.
Endometriumkarzinom
Die länger dauernde Einnahme von Östrogen erhöht das Risiko für die Entwicklung einer Endometriumhyperplasie oder eines Karzinoms. Nach Absetzen der Therapie könnte das Risiko für mindestens 10 Jahre erhöht bleiben. Studien deuten darauf hin, dass der Anstieg dieses Risikos durch die zusätzliche Gabe eines Gestagens für mindestens 12 Tage pro Behandlungszyklus weitgehend reduziert wird.
Eine ärztliche Überwachung aller Frauen, die eine HRT anwenden, ist erforderlich. Alle Fälle abnormaler Blutungen (unregelmässige, starke oder persistierende Blutungen, einschliesslich Schmierblutungen) müssen mittels geeigneter diagnostischer Massnahmen (ggf. einschliesslich einer histologischen Untersuchung des Endometriums) abgeklärt werden, um eine organische Ursache bzw. einen malignen Befund auszuschliessen.
Ovarialkarzinom
Mehrere epidemiologische Studien deuten darauf hin, dass eine HRT mit einem erhöhten Risiko für die Entwicklung eines epithelialen Ovarialkarzinomes verbunden sein könnte. Eine Risikoerhöhung wurde sowohl für eine östrogen-Monotherapie als auch für eine kombinierte HRT gefunden. Während die meisten Studien eine Risikoerhöhung erst bei einer Langzeitanwendung (d.h. mindestens 5 Jahre) zeigten, fand sich in einer 2015 publizierten Metaanalyse (unter Berücksichtigung von insgesamt 17 prospektiven und 35 retrospektiven Studien) kein solcher Zusammenhang mit der Anwendungsdauer.
In der prospektiven, randomisierten, Placebo-kontrollierten WHl-Studie fand sich eine statistisch nicht signifikante Risikoerhöhung (HR 1.41; 95%-KI 0. 75-2.66).
Da Ovarialkarzinome sehr viel seltener sind als Brustkrebs, ist die absolute Risikoerhöhung bei Frauen, welche eine HRT anwenden oder bis vor kurzem angewendet haben, gering.
Lebertumoren
In seltenen Fällen wurden nach Anwendung hormonaler Wirkstoffe, wie sie Progynova/Progynova mite enthält, gutartige, noch seltener bösartige Veränderungen an der Leber beobachtet, die vereinzelt zu lebensgefährlichen Blutungen in der Bauchhöhle geführt haben. Wenn starke Oberbauchbeschwerden, eine Lebervergrösserung oder Anzeichen einer intraabdominalen Blutung auftreten, sollte ein Lebertumor in die differentialdiagnostischen Überlegungen einbezogen werden.
Koronare Herzkrankheit und Schlaganfall
Eine HRT sollte nicht eingesetzt werden zur Prävention kardiovaskulärer Erkrankungen.
Grosse klinische Studien zeigten keinen günstigen Effekt in der Primärprophylaxe (WHI-Studie) oder Sekundärprophylaxe (HERS-Studie) kardiovaskulärer Erkrankungen.
Die WHI-Studie zeigte bei postmenopausalen Frauen, welche eine orale HRT mit konjugierten Östrogenen und MPA während durchschnittlich 5,2 Jahren erhielten, ein gegenüber Placebo erhöhtes Risiko für kardiovaskuläre Ereignisse (RR 1,24 [95% CI 1,00–1,54], absolute Risikoerhöhung 6 Fälle pro 10'000 Personenjahre). Das Risiko war am höchsten im ersten Jahr nach Beginn der HRT (RR 1,81 [95% CI 1,09–3,01]). Mit zunehmendem Abstand zur Menopause nahm das Risiko zu (Menopause <10 Jahre: RR 0,89; Menopause 10–19 Jahre: RR 1,22; Menopause ≥20 Jahre: RR 1,71).
Ebenso war in der WHI-Studie das zerebrovaskuläre Risiko unter kombinierter Östrogen-Gestagen-Therapie erhöht (RR 1,31 [95% CI 1,02–1,68]).
Im Östrogen-Monotherapie-Arm der WHI-Studie war kein signifikanter Einfluss auf das kardiovaskuläre Risiko erkennbar (RR 0,91 [95% CI 0,75–1,12]). Hingegen war das Risiko für zerebrovaskuläre Insulte erhöht (RR 1,39 [95% CI 1,10–1,77]).
Die Heart and Estrogen/Progestin Replacement Study (HERS und HERS II), eine prospektive, Placebo-kontrollierte, randomisierte Studie, zeigte bei mehr als 1'300 postmenopausalen Frauen mit vorbestehender koronarer Herzkrankheit (mittleres Alter bei Studieneinschluss 67 Jahre), welche eine orale HRT mit konjugierten Östrogenen und MPA während durchschnittlich 4,1 Jahren (HERS) bzw. 2,7 Jahren (HERS II) erhielten, keine Reduktion des kardiovaskulären Risikos. Das relative Risiko war 0,99 (95% CI 0,84–1,17). Das Risiko war am höchsten im ersten Jahr nach Beginn der HRT (RR 1,52 [95% CI 1,01–2,29]).
Zu einer HRT mit Therapiebeginn in relativ frühem Lebensalter (beispielsweise vor dem 55. Lebensjahr) liegen nur limitierte Daten vor. Diese deuten darauf hin, dass die Erhöhung des kardiovaskulären Risikos unter einer HRT bei jüngeren Patientinnen mit kurzem Zeitabstand zur Menopause geringer sein könnte als in der in den o. g. Studien untersuchten (tendenziell älteren) Population. Dies gilt jedoch nicht für zerebrovaskuläre Ereignisse.
Das relative Risiko für zerebrovaskuläre Insulte ist unabhängig vom Alter oder der Zeit seit der Menopause. Da das Grundrisiko für einen Schlaganfall jedoch stark vom Alter abhängt, erhöht sich das Gesamtrisiko bei Frauen unter einer HRT mit zunehmendem Alter.
Bei Frauen, welche bereits Risikofaktoren für das Auftreten kardiovaskulärer oder zerebrovaskulärer Ereignisse aufweisen, sollten alternative Therapien in Betracht gezogen werden.
Venöse Thromboembolien (VTE)
Eine HRT ist mit einem erhöhten Risiko für VTE (z.B. tiefe Venenthrombose, Lungenembolie) verbunden.
Zwei kontrollierte randomisierte Studien (HERS und WHI) und mehrere epidemiologische Studien ergaben ein 2–3fach erhöhtes Risiko bei Frauen, die eine HRT anwendeten, im Vergleich zu Frauen, die nie eine solche Therapie erhalten hatten. Die WHI-Studie zeigte insbesondere eine erhöhte Inzidenz von Lungenembolien. Die absolute Risikoerhöhung bei den mit HRT behandelten Frauen betrug 8 Fälle auf 10'000 Personenjahre (15 vs 7), das relative Risiko 2,13 (95% CI 1,39–3,25).
Das erhöhte Risiko wurde nur bei Frauen unter HRT gefunden und bestand nicht bei Frauen, die früher eine HRT angewendet hatten. Das Risiko scheint in den ersten Jahren der Anwendung höher zu sein.
Für Nicht-Anwenderinnen wird die Anzahl der VTE-Fälle während eines Zeitraums von 5 Jahren für die Altersgruppe 50–59 Jahre auf 3 von 1'000 Frauen und für die Altersgruppe 60–69 Jahre auf 8 von 1'000 Frauen geschätzt. Bei gesunden Frauen, die eine HRT über 5 Jahre durchführen, treten pro 1'000 Frauen 2–6 zusätzliche Fälle in der Altersgruppe 50–59 Jahre und 5–15 zusätzliche Fälle in der Altersgruppe 60–69 Jahre auf.
Bei Auftreten entsprechender Symptome oder Verdacht auf eine VTE muss das Präparat sofort abgesetzt werden. Patientinnen mit Risikofaktoren für thromboembolische Ereignisse sollen sorgfältig überwacht werden. Bei diesen Frauen muss das Nutzen-Risiko-Verhältnis sorgfältig abgewogen und wenn möglich andere Therapien in Betracht gezogen werden.
Zu den bekannten Risikofaktoren für das Auftreten von VTE gehören eine entsprechende Eigen- oder Familienanamnese (das Auftreten von VTE bei einem nahen Verwandten in einem relativ frühen Alter kann auf eine genetische Veranlagung hindeuten), Rauchen, erhebliches Übergewicht, systemischer Lupus erythematodes und maligne Erkrankungen.
Bei Frauen, welche eine Kombination von Risikofaktoren oder einen höheren Schweregrad eines einzelnen Risikofaktors aufweisen, sollte berücksichtigt werden, dass das Risiko überadditiv erhöht sein kann. Daraus kann sich unter Umständen eine Kontraindikation für eine HRT ergeben.
Das Risiko venöser thromboembolischer Ereignisse kann vorübergehend erhöht sein bei längerer Immobilisierung, grösseren operativen Eingriffen oder nach einem schweren Trauma. Bei Frauen unter Hormonsubstitution ist grösste Beachtung auf prophylaktische Massnahmen zu legen, um venöse Thromboembolien nach chirurgischen Eingriffen zu vermeiden. Abhängig von der Art des Eingriffs und der Dauer der Immobilisierung sollte eine vorübergehende Unterbrechung der HRT erwogen werden, im Falle elektiver Eingriffe möglichst einige Wochen (4-6 Wochen) vor dem Eingriff. Die Behandlung sollte erst dann wieder aufgenommen werden, wenn die Frau vollständig mobilisiert ist.
Demenz
In der Women's Health Initiative Memory Study (WHIMS), einer randomisierten, placebokontrollierten, der WHI untergeordneten Studie, wurden mehr als 2'000 Frauen im Alter von >65 Jahren (Durchschnittsalter 71 Jahre) mit oralen konjugierten equinen Östrogenen und Medroxyprogesteronacetat behandelt und während durchschnittlich 4 Jahren überwacht.
Zudem wurden 1'464 hysterektomierte Frauen im Alter von 65 bis 79 Jahren mit oralen konjugierten equinen Östrogenen allein behandelt und während durchschnittlich 5,2 Jahren überwacht. Weder die Behandlung mit konjugierten Östrogenen und Medroxyprogesteronacetat noch die Östrogen-Monotherapie zeigte einen günstigen Effekt auf die kognitive Funktion. Das Risiko für das Auftreten einer Hirnleistungsstörung (wahrscheinliche Demenz) war für die kombinierte HRT sogar erhöht (RR 2,05 [95% Cl 1,21–3,48]). Dies bedeutet in absoluten Zahlen pro Jahr 23 zusätzliche Fälle pro 10'000 behandelte Frauen.
Obschon unklar ist, inwieweit diese Resultate auf eine jüngere Population oder auf HRT Präparate mit anderen Wirkstoffen extrapoliert werden können, sollten vom Arzt bei der Beurteilung des Nutzen-Risiko-Verhältnisses einer HRT berücksichtigt werden.
Sonstige Vorsichtsmassnahmen
Östrogene können eine Flüssigkeitsretention verursachen. Patientinnen mit Erkrankungen, welche sich dadurch verschlimmern können (wie Herz- oder Nierenfunktionsstörungen, Asthma, Epilepsie oder Migräne), sollten daher sorgfältig überwacht werden.
Bei Patientinnen mit vorbestehender (insbesondere familiärer) Hypertriglyzeridämie kann es zu einem weiteren Anstieg der Triglyzeride kommen, wodurch das Risiko für eine Pankreatitis erhöht ist.
Ein definitiver Zusammenhang zwischen der Anwendung einer HRT und dem Entstehen einer klinischen Hypertonie wurde bisher nicht dokumentiert. Eine leichte Erhöhung des Blutdruckes wurde bei Frauen unter einer HRT beobachtet, eine klinisch relevante Erhöhung ist jedoch selten. Wenn es während der HRT zu dauerhaft erhöhten Blutdruckwerten kommt, sollte ein Abbruch der HRT in Erwägung gezogen werden.
Bei Patientinnen, die neben Progynova/Progynova mite gleichzeitig blutdrucksenkende Arzneimittel einnehmen, sollte der Blutdruck regelmässig kontrolliert werden.
Klinische Studien zeigten einen Einfluss einer HRT auf die periphere Insulinresistenz und die Glukosetoleranz. Im Allgemeinen ist jedoch trotzdem keine Anpassung der antidiabetischen Therapie erforderlich. Bei Diabetikerinnen unter einer HRT sollten aber die Blutzuckerspiegel sorgfältig überwacht werden.
Bei Patientinnen mit Leberfunktionsstörungen (einschliesslich Hyperbilirubinämie, Dubin-Johnson-Syndrom oder Rotor-Syndrom) ist eine engmaschige Kontrolle der Leberparameter erforderlich. Im Falle einer Verschlechterung der Leberwerte sollte die HRT abgebrochen werden.
Nach Abklingen einer Virushepatitis sollten etwa 6 Monate vergehen, bevor man Sexualhormone anwendet. Auch hier sind die Leberenzyme zu kontrollieren.
Es ist bekannt, dass Östrogene die Lithogenität der Galle erhöhen können. Dadurch ist bei einigen Frauen das Risiko für Gallenblasenerkrankungen (v.a. Cholelithiasis) unter einer Östrogentherapie erhöht.
Bei Patientinnen mit vorbestehendem Prolaktinom ist eine engmaschige ärztliche Überwachung erforderlich (einschliesslich regelmässiger Bestimmung des Prolaktinspiegels), da in Einzelfällen unter einer Östrogentherapie über eine Grössenzunahme von Prolaktinomen berichtet wurde.
Bei Patientinnen mit Niereninsuffizienz oder mit metabolischen Knochenerkrankungen, die von einer Hyperkalziämie begleitet sind, sollte Progynova/Progynova mite wie alle östrogenhaltigen Präparate nur nach sorgfältiger Abschätzung von Nutzen und Risiko angewendet werden.
Während einer HRT können bei einigen Patientinnen infolge der Östrogenstimulation unerwünschte Wirkungen auftreten, wie ungewöhnlich starke Blutungen. Häufige und anhaltende irreguläre Blutungen sind Zeichen einer endometrialen Aktivität und müssen durch geeignete diagnostische Massnahmen abgeklärt werden, um organische Erkrankungen auszuschliessen.
Uterine Myome können unter einer Östrogen-Therapie an Grösse zunehmen. Falls dies beobachtet wird, sollte die Therapie abgebrochen werden.
Sollte unter einer HRT eine Endometriose wieder reaktiviert werden, wird empfohlen, die Therapie abzubrechen.
Eine Exposition gegenüber einer Östrogen-Monotherapie kann in Restherden einer Endometriose zur prämalignen oder malignen Veränderungen führen. Bei Patientinnen, bei welchen eine Hysterektomie aufgrund einer Endometriose erfolgte und bei denen Restherde der Endometriose vermutet werden, sollte daher die Kombination der Östrogentherapie mit einem Gestagen erwogen werden.
Bei Frauen mit hereditärem Angioödem können exogen zugeführte Östrogene die Symptome des Angioödems induzieren oder verschlimmern.
Gelegentlich kann ein Chloasma auftreten, v.a. bei Frauen mit Chloasma gravidarum in der Anamnese. Frauen mit einer Tendenz zu Chloasma sollten sich während der HRT nicht der Sonne oder anderer ultravioletter Strahlung aussetzen.
Progynova/Progynova mite hat keine kontrazeptive Wirkung. Ggf. sind nicht-hormonale Kontrazeptionsmethoden einzusetzen.
Jedes Dragée von Progynova/Progynova mite enthält ungefähr 46 mg bzw. 47 mg Laktose. Patientinnen mit der seltenen hereditären Galaktose-Intoleranz, Lapp-Laktase-Mangel oder Glukose-Galaktose-Malabsorption, die eine laktosefreie Diät einhalten, sollten diese Menge beachten.
Interaktionen
Um potentielle Interaktionen zu erkennen, sollte auch die Fachinformation der gleichzeitig verabreichten Arzneimittel konsultiert werden.
Pharmakokinetische Interaktionen
Einfluss anderer Arzneimittel auf die Pharmakokinetik von Progynova/Progynova mite
Enzyminduktoren
Eine erhöhte Clearance von Sexualhormonen infolge einer Induktion hepatischer Enzyme kann zu reduzierten Plasmakonzentrationen von Östrogenen führen und dadurch die klinische Wirksamkeit vermindern sowie eventuell Blutungsunregelmässigkeiten verursachen. Dies gilt z.B. für Barbiturate, Bosentan, Carbamazepin, Felbamat, Modafinil, Oxcarbazepin, Phenytoin, Primidon, Rifabutin, Rifampicin und Topiramat, sowie für Arzneimittel, welche Johanniskraut (Hypericum perforatum) enthalten. Eine Enzyminduktion kann bereits nach wenigen Tagen beobachtet werden und kann während mindestens 4 oder mehr Wochen nach dem Absetzen dieser Arzneimittel andauern. Die maximale Enzyminduktion zeigt sich im Allgemeinen nach wenigen Wochen.
Enzyminhibitoren
Starke und moderate CYP3A4 Inhibitoren wie Azol-Antimykotika (z.B. Itraconazol, Voriconazol, Fluconazol), Makrolid-Antibiotika (z.B. Clarithromycin, Erythromycin), Diltiazem, Verapamil und Grapefruitsaft können die Plasmakonzentrationen von Östrogenen erhöhen.
Wirkstoffe mit unterschiedlichem Einfluss auf die Clearance von Sexualhormonen
Verschiedene Inhibitoren der HIV/HCV Protease und der Nichtnukleosidischen Reverse-Transkriptase sowie Kombinationen von beiden können die Plasmakonzentration von Östrogen erhöhen oder erniedrigen wenn sie gleichzeitig mit einer HRT angewendet werden. Diese Veränderungen können in manchen Fällen klinisch relevant sein.
Enterohepatischer Kreislauf
Bei gleichzeitiger kurzdauernder (bis zu 10 Tagen) Anwendung von Antibiotika, welche keine Interaktionen mit dem CYP3A4-Enzymsystem aufweisen, ist nicht mit pharmakokinetischen Interaktionen zu rechnen. Über mögliche Interaktionen bei längerfristiger Komedikation mit Antibiotika (z.B. bei Borreliose oder Osteomyelitis) liegen keine ausreichenden Daten vor. Eine Reduktion der Wirkstoffspiegel infolge einer Beeinflussung des enterohepatischen Kreislaufs ist hier nicht auszuschliessen.
Einfluss von Progynova/Progynova mite auf die Pharmakokinetik anderer Arzneimittel
Sexualhormone können auch die Pharmakokinetik anderer Arzneimittel beeinflussen. Entsprechend können deren Plasmakonzentrationen entweder erhöht (z.B. Cyclosporin) oder reduziert (z.B. Lamotrigin, siehe unten) werden.
Eine lnteraktionsstudie mit Lamotrigin, einem Antiepileptikum, und einem kombinierten oralen Kontrazeptivum (30 μg Ethinylestradiol/150 μg Levonorgestrel) zeigte eine klinisch relevante Steigerung der Lamotrigin-Clearance mit einer entsprechenden signifikanten Abnahme der Lamotrigin-Piasmaspiegel, wenn diese Arzneimittel gleichzeitig verabreicht wurden. Eine derartige Senkung der Plasmakonzentrationen kann mit einer reduzierten Anfallskontrolle einhergehen. Eine Anpassung der Lamotrigindosis kann erforderlich sein.
Andere hormonale Kontrazeptiva und HRT wurden nicht untersucht. Es wird jedoch erwartet, dass solche Präparate ein vergleichbares lnteraktionspotential aufweisen. Wird bei einer Patientin, welche Lamotrigin einnimmt, eine Behandlung mit Progynova/Progynova mite neu begonnen, kann daher eine Anpassung der Lamotrigindosis erforderlich sein, und die Lamotriginkonzentrationen sollten zu Beginn der Therapie engmaschig überwacht werden.
Beim Absetzen von Progynova/Progynova mite können die Lamotriginspiegel wieder ansteigen, sodass die Patientin auch in dieser Phase überwacht und ggf. die Lamotrigindosis reduziert werden sollte.
Sexualhormone können ausserdem die Wirkung oraler Antikoagulantien beeinflussen.
Interaktionen mit unbekanntem Mechanismus
In klinischen Studien kam es bei gleichzeitiger Gabe Ethinylestradiol-haltiger kombinierter Kontrazeptiva zusammen mit der in der Therapie von HCV-Infektionen eingesetzten Wirkstoffkombination Ombitasvir/Paritaprevir/Ritonavir mit oder ohne Dasabuvir gegenüber Patientinnen, welche ausschliesslich mit den antiviralen Wirkstoffen behandelt wurden, signifikant häufiger zu einer klinisch relevanten Erhöhung der ALT (einschliesslich Fällen eines Anstiegs auf über das Fünffache der oberen Grenze des Normbereiches). Bei Anwendung anderer Östrogene (insbesondere Estradiol und Estradiolvalerat) war hingegen die Inzidenz einer Transaminasenerhöhung nicht höher als bei Patientinnen ohne Östrogentherapie. Aufgrund der begrenzten Anzahl Frauen, welche derartige andere östrogenhaltige Arzneimittel einnahmen, ist jedoch bei gleichzeitiger Verabreichung von Östrogenen mit der Wirkstoffkombination Ombitasvir/Paritaprevir/Ritonavir mit oder ohne Dasabuvir grundsätzlich Vorsicht geboten.
Schwangerschaft/Stillzeit
Die Anwendung von Progynova/Progynova mite ist während einer Schwangerschaft kontraindiziert. Sollte unter der Anwendung eine Schwangerschaft eintreten oder wird eine solche vermutet, ist das Arzneimittel sofort abzusetzen und der Arzt zu konsultieren.
Es gibt Hinweise auf foetale Risiken, basierend auf tierexperimentellen Untersuchungen. Die meisten bis heute durchgeführten epidemiologischen Studien haben jedoch keine eindeutigen Hinweise auf eine embryotoxische oder teratogene Wirkung ergeben, wenn Östrogene versehentlich während der Schwangerschaft verabreicht wurden.
Während der Stillzeit hat Progynova/Progynova mite keine Indikation.
Das Arzneimittel darf während der Stillzeit nicht angewendet werden, da die Milchproduktion reduziert und die Milchqualität verändert sein kann und geringe Konzentrationen der Substanz in der Milch gemessen werden können.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine diesbezüglichen Studien durchgeführt. Es wird nicht erwartet, dass Progynova/Progynova mite einen Einfluss auf die Fahrtüchtigkeit oder Fähigkeit Maschinen zu bedienen hat, vgl. jedoch Rubrik «Unerwünschte Wirkungen».
Unerwünschte Wirkungen
Die schwerwiegendsten unerwünschten Wirkungen im Zusammenhang mit der Anwendung einer HRT werden auch in der Rubrik «Warnhinweise und Vorsichtsmassnahmen» beschrieben (siehe dort).
Nachfolgend sind die unerwünschten Wirkungen, welche in den klinischen Studien und/oder während der Marktüberwachung unter Progynova bzw. Progynova mite beobachtet wurden, nach Organsystem und Häufigkeit angegeben. Die Häufigkeitskategorien sind dabei wie folgt definiert: häufig (≥1/100 bis <1/10); gelegentlich (≥1/1'000 bis <1/100); selten (≥1/10'000 bis <1/1000); nicht bekannt (basierend überwiegend auf Spontanmeldungen aus der Marktüberwachung, genaue Häufigkeit kann nicht abgeschätzt werden).
Erkrankungen des Immunsystems
Gelegentlich: Überempfindlichkeitsreaktionen.
Stoffwechsel- und Ernährungsstörungen
Häufig: Gewichtszunahme oder –abnahme.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen, Schwindel.
Gelegentlich: Migräne.
Erkrankungen der Gefässe
Nicht bekannt: venöse und arterielle thromboembolische Ereignisse.
Erkrankungen des Gastrointestinaltrakts
Häufig: Blähungen, Übelkeit.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Hautausschlag, Pruritus.
Gelegentlich: Erythema nodosum, Urtikaria.
Selten: Hirsutismus, Akne.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Muskelkrämpfe.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Häufig: Blutungsanomalien (einschliesslich Durchbruchblutungen und Spotting), Spannungsgefühl in den Brüsten, Unterleibsschmerzen.
Gelegentlich: Vergrösserung der Brüste.
Allgemeine Erkrankungen
Häufig: Ödeme.
Unter anderen HRT-Präparaten wurde ausserdem über folgende unerwünschte Wirkungen berichtet:
Induktion oder Verschlechterung eines hereditären Angioödems, Hypertriglyzeridämie, Ängstlichkeit, Nervosität, Stimmungsschwankungen, Libidoveränderungen, Depression, Sehstörungen, Palpitationen, Blutdruckanstieg, Erbrechen, Dyspepsie, abnormale Leberfunktionstests, Cholelithiasis, cholestatischer Ikterus, Verschlechterung einer Porphyrie, Chloasma (eventuell persistierend), Alopezie, Erythema multiforme, vaskuläre Purpura, Rückenschmerzen, Brustschmerzen, Fluor vaginalis, Grössenzunahme von Uterusmyomen, Endometriumhyperplasie.
Überdosierung
Wegen der geringen Toxizität von Estradiol ist selbst bei versehentlicher einmaliger Einnahme eines Vielfachen der therapeutischen Dosis nicht mit dem Auftreten einer akuten Vergiftung zu rechnen.
Eine akute Überdosierung kann mit Kopfschmerzen, Übelkeit, Erbrechen, Spannungsgefühl in den Brüsten und uterinen Blutungen einhergehen.
Bei einer chronischen Überdosierung ist mit einer Zunahme der unerwünschten Wirkungen und einer Erhöhung der unter «Warnhinweise und Vorsichtsmassnahmen» beschriebenen Risiken zu rechnen.
Es existiert kein spezifisches Antidot, die Behandlung muss ggf. symptomatisch erfolgen.
Eigenschaften/Wirkungen
ATC-Code: G03CA03
Wirkungsmechanismus
In der Postmenopause verstärkt sich der Abfall des Östrogenspiegels. Das klinische Bild des Östrogenmangelsyndroms ist durch vegetative, psychische und organische Symptome (z.B. Hitzewallungen, Schweissausbrüche, Herzjagen, Schwindel, Schlaflosigkeit und depressive Verstimmungen) gekennzeichnet. Die wichtigsten organischen Veränderungen sind Haut- und Schleimhautatrophien und Osteoporose.
Die atrophischen Veränderungen können z.B. an den Genitalien zu erhöhter Vulnerabilität und im Urogenitaltrakt zu Blasenentleerungsstörungen beitragen. Mit einer systemischen Östrogentherapie können vegetative, psychische und organische Beschwerden wirksam behandelt werden. Durch zytologische Untersuchungen des Vaginalepithels konnte gezeigt werden, dass mit Progynova eine ausreichende Substitution des Östrogendefizits erreicht werden kann.
Bei Patientinnen ohne vasomotorische Symptomatik beseitigen Östrogenpräparate jedoch weder Stimmungsschwankungen noch depressive Zustände.
Unabhängig vom Verabreichungsweg üben Östrogene in Dosierungen, die eine Besserung menopausaler Beschwerden bewirken, eine stark stimulierende Wirkung auf Mitose und Proliferation des Endometriums aus. Eine Monotherapie mit Östrogenen erhöht die Häufigkeit von Endometriumhyperplasien und das Risiko eines Endometriumkarzinoms. Eine Hyperplasie des Endometriums kann vermieden werden, wenn das Endometrium durch Zugabe eines Gestagens in genügender Dosis und für mindestens 12 Tage pro Monat geschützt wird.
Pharmakokinetik
Estradiolvalerat
Absorption
Estradiolvalerat wird nach oraler Gabe schnell und vollständig resorbiert. Bereits in der Darmwand sowie während der ersten Leberpassage erfolgt eine Spaltung des Steroidesters in Estradiol und Valeriansäure. Aufgrund des First pass-Metabolismus beträgt die Bioverfügbarkeit von Estradiol nur etwa 3%.
In der Regel werden die maximalen Estradiolkonzentrationen (ca. 30 pg/ml) im Plasma 4-9 Stunden nach Einnahme eines Dragees erreicht.
Steady State
Im Vergleich zur Einzeldosis werden nach mehrfacher Gabe etwa doppelt so hohe Serumspiegel von Estradiol beobachtet. Im Durchschnitt liegt die Konzentration von Estradiol zwischen 30 (minimaler Spiegel) und 60 pg/ml (maximaler Spiegel).
Distribution
Im Plasma sind rund 60% des Estradiols an Albumin und knapp 40% an SHBG gebunden. Nur 1-1 ,5% des Estradiols liegt im Plasma als freie Substanz vor.
Das apparente Verteilungsvolumen von Estradiol nach einmaliger intravenöser Verabreichung beträgt etwa 1 l/kg.
Estradiol ist placentagängig. Estradiol und seine Metaboliten treten nur zu einem geringen Anteil in die Muttermilch über.
Metabolismus
Nach der Ester-Spaltung von Estradiolvalerat erfolgt in Leber und Darmwand, unter Beteiligung von CYP3A4, ein ausgedehnter Metabolismus des Estradiols vor allem zu Estron, Estriol und Estronsulfat, welcher den Biotransformationswegen des endogenen Estradiols folgt. Der aktive Hauptmetabolit Estron erreicht etwa 8-mal, Estronsulfat etwa 150-mal höhere Plasmakonzentrationen als Estradiol.
Die metabolische Clearance von Estradiol liegt bei etwa 10-30 ml/min/kg.
Elimination
Die Estradiol-Metaboliten werden zu etwa 90% mit Glucuronid oder Sulfat konjugiert und mit einer Halbwertszeit von etwa einem Tag über den Urin ausgeschieden. Nur etwa 10% der Metaboliten werden über die Faeces eliminiert und unterliegen einem enterohepatischen Kreislauf.
Nach Beendigung der Therapie werden innerhalb von 2–3 Tagen Estradiolspiegel erreicht, welche jenen vor der Therapie entsprechen.
Kinetik spezieller Patientengruppen
Eingeschränkte Nierenfunktion: Die Pharmakokinetik von Progynova/Progynova mite wurde bei Patientinnen mit Niereninsuffizienz nicht untersucht.
Eingeschränkte Leberfunktion: Die Pharmakokinetik von Progynova/Progynova mite wurde bei Patientinnen mit Leberinsuffizienz nicht untersucht. Es ist jedoch bekannt, dass der metabolische Abbau von Estradiol bei Leberfunktionsstörungen verlangsamt ist (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
Präklinische Daten
Karzinogenität
Präklinische Untersuchungen mit Estradiol zur Toxizität nach wiederholter Gabe, zur Genotoxizität und zum karzinogenen Potential ergaben keine eindeutigen Hinweise auf besondere Risiken für den Menschen, wenn auch in epidemiologischen Studien sowie in Tierstudien mit Estradiol ein erhöhtes Karzinogenitäts-Risiko nachgewiesen werden konnte.
Embryotoxizität/Teratogenität
Reproduktionstoxikologische Studien in Ratten, Mäusen und Kaninchen ergaben keinen Hinweis auf eine teratogene Wirkung. Für Risiken beim Menschen siehe Rubrik «Schwangerschaft/Stillzeit».
Mutagenität
In-vitro und in-vivo Studien mit 17β-Estradiol ergaben keinen Hinweis auf ein mutagenes Potential.
Sonstige Hinweise
Beeinflussung diagnostischer Methoden
Sexualhormone können die Ergebnisse gewisser Labortests beeinflussen wie biochemische Parameter der Leber, Schilddrüse, Nebennieren- und Nierenfunktion, Plasmaspiegel von Bindungsproteinen und Lipid/Lipoprotein-Fraktion, Parameter des Kohlehydratstoffwechsels, der Koagulation und der Fibrinolyse. Die Veränderungen bleiben im Allgemeinen innerhalb des Referenzbereichs.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Bei Raumtemperatur (15–25 °C) aufbewahren.
Vor Kinderhand schützen.
Zulassungsnummer
33149 (Swissmedic).
Zulassungsinhaberin
Bayer (Schweiz) AG, Zürich.
Stand der Information
Mai 2019.
Composizione
Progynova
Principio attivo: estradioli valeras.
Eccipienti: lactosum monohydricum 46 mg, excipiens pro compresso obducto.
Progynova mite
Principio attivo: estradioli valeras.
Eccipienti: lactosum monohydricum 47 mg, excipiens pro compresso obducto.
Forma farmaceutica e quantità di principio attivo per unità
Progynova
Ogni confetto bianco contiene 2 mg di estradiolo valerato.
Progynova mite
Ogni confetto beige contiene 1 mg di estradiolo valerato.
Indicazioni/Possibilità d'impiego
Trattamento dei sintomi da carenza estrogenica in seguito a menopausa naturale o artificiale.
In pazienti non isterectomizzate, la terapia sostitutiva estrogenica deve sempre essere completata da una terapia progestinica.
In pazienti che presentano esclusivamente disturbi urogenitali in assenza di altri sintomi da carenza estrogenica concomitanti che necessitano di trattamento, si dovrebbe effettuare una terapia estrogenica topica rinunciando a una TOS sistemica.
Posologia/Impiego
Per tutte le indicazioni si deve sempre utilizzare la più bassa posologia efficace e per la durata di trattamento più breve possibile. La terapia ormonale sostitutiva deve proseguire solamente fintanto che il beneficio supera il rischio per la singola paziente.
Normalmente il trattamento viene iniziato con l'assunzione di 1 confetto di Progynova (2 mg) al giorno, dopo un pasto. L'assunzione dei confetti avviene su base continua, ovvero iniziando subito, senza interruzioni, la confezione successiva di Progynova. Nel prosieguo del trattamento la dose può essere ridotta a 1 confetto di Progynova mite (1 mg) al giorno. Anche con la dose ridotta, l'assunzione è continuativa.
Il progestinico necessario per le pazienti non isterectomizzate dovrebbe essere assunto per almeno 12-14 giorni di ogni ciclo di trattamento. Per i dettagli si rimanda all'Informazione professionale dei relativi preparati progestinici.
Assunzione dimenticata
Se l'assunzione di un confetto all'ora abituale è stata dimenticata, questa deve essere recuperata entro 24 ore per evitare l'insorgenza di sanguinamenti intermestruali.
Istruzioni posologiche speciali
Bambine e adolescenti
Non sussistono indicazioni nelle bambini e nelle adolescenti.
Pazienti anziane
Non sono disponibili dati che indichino la necessità di un aggiustamento della dose nelle pazienti anziane.
Disturbi della funzionalità epatica
Progynova/Progynova mite non è stato esaminato in pazienti con disturbo della funzionalità epatica. In donne con malattia epatica grave Progynova/Progynova mite è controindicato.
Disturbi della funzionalità renale
Progynova/Progynova mite non è stato esaminato in pazienti con disturbo della funzionalità renale. Non sono probabilmente necessari aggiustamenti della dose.
Controindicazioni
- Presenza o sospetto di carcinoma mammario
- Presenza o sospetto di malattia maligna o premaligna dipendente da ormoni sessuali
- Iperplasia endometriale non trattata
- Sanguinamento genitale anomalo, di natura non accertata
- Tumori epatici (benigni o maligni) in corso o pregressi
- Malattie epatiche gravi (anche in anamnesi) fino a quando i valori della funzionalità epatica non si sono normalizzati
- Eventi tromboembolici venosi in atto o pregressi (ad es. trombosi venosa profonda della gamba, embolia polmonare)
- Eventi tromboembolici arteriosi acuti o recenti (ad es. infarto cerebrale, infarto miocardico)
- Presenza di fattori di rischio per eventi tromboembolici arteriosi o venosi (ad es. deficit di antitrombina, di proteina S o di proteina C)
- Ipertrigliceridemia grave
- Porfiria
- Gravidanza e allattamento
- Ipersensibilità nota a uno dei componenti di Progynova/Progynova mite.
Avvertenze e misure precauzionali
Prima di qualsiasi terapia sostitutiva ormonale (TOS) devono essere effettuate una visita per valutare lo stato generale clinico e una visita ginecologica approfondita, da ripetere quantomeno una volta all'anno. Si dovrebbe considerare anche l'anamnesi personale e familiare. Prima di qualunque terapia e per ogni singola paziente, è necessario soppesare attentamente il rapporto rischio-beneficio. Si dovrebbe sempre scegliere la più bassa dose efficace e la durata di trattamento più breve possibile.
Motivi per un'interruzione immediata della terapia
Qualora nel corso di un trattamento TOS dovesse presentarsi una delle sopraccitate controindicazioni, o in una delle situazioni seguenti, il trattamento deve essere interrotto immediatamente:
- sintomi o sospetto di un evento tromboembolico venoso o arterioso, tra cui anche:
- prima insorgenza di cefalea emicranica o insorgenza più frequente di una cefalea insolitamente forte
- improvvisa perdita, parziale o completa, della capacità visiva
- improvvisi disturbi dell'udito
- aumento clinicamente rilevante della pressione arteriosa
- peggioramento della funzionalità epatica o insorgenza di ittero o epatite
- crescita riconoscibile di miomi
- aumento delle crisi epilettiche
- gravidanza
Situazioni che richiedono un particolare monitoraggio
Qualora i seguenti disturbi siano in atto, si siano verificati di recente e/o siano peggiorati durante una gravidanza o un precedente trattamento ormonale, la paziente dovrebbe essere monitorata attentamente. Si dovrebbe tenere presente che durante il trattamento con Progynova/Progynova mite questi disturbi possono ripresentarsi o aggravarsi:
- fattori di rischio per tumori estrogeno-dipendenti (ad es. carcinoma mammario in parenti di 1° grado)
- alterazioni benigne della mammella
- iperplasia endometriale (anche in anamnesi)
- leiomioma o endometriosi
- fattori di rischio per malattie tromboemboliche
- emicrania
- ipertensione
- diabete mellito
- ipertrigliceridemia
- patologie epatobiliari
- asma
- epilessia
- lupus eritematoso sistemico
- corea minore
- otosclerosi
Se sussistono fattori di rischio per le seguenti condizioni, si dovrebbero soppesare i vantaggi dell'utilizzo di Progynova/Progynova mite rispetto ai possibili rischi.
Patologie tumorali
Tumore della mammella
Studi randomizzati controllati e studi epidemiologici hanno evidenziato un aumentato rischio di tumore della mammella in donne che hanno utilizzato una TOS per diversi anni. Pertanto, prima di iniziare una TOS e successivamente ogni anno tutte le donne devono sottoporsi a visite senologiche dal medico e ripetere mensilmente l'autopalpazione del seno. Le utilizzatrici devono essere informate di quali alterazioni della mammella devono comunicare al proprio medico. A seconda dell'età e dei fattori di rischio presenti, può essere indicata anche una mammografia.
Una meta-analisi di 51 studi epidemiologici ha dimostrato che il rischio di ammalarsi di tumore della mammella aumenta con la durata della TOS e diminuisce una volta interrotta la TOS. Il rischio relativo (RR) di ammalarsi di tumore della mammella è risultato pari a 1,35 (intervallo di confidenza (IC) al 95% 1,21-1,49) per le donne che hanno utilizzato una TOS per 5 o più anni.
Lo studio Women's Health Initiative (WHI), un ampio studio prospettico, randomizzato, controllato con placebo, ha evidenziato, in oltre 8'000 donne anziane in post-menopausa (età all'inizio dello studio 50-79 anni, età media 63 anni) che hanno ricevuto una TOS combinata con estrogeni coniugati e medrossiprogesterone acetato (MPA), un aumento dei carcinomi mammari invasivi nel gruppo trattato con estroprogestinici (RR 1,24 [IC al 95% 1,02-1,50]) rispetto a placebo dopo una durata media del trattamento di 5,6 anni. Non è noto se per altri preparati TOS combinati sussista un rischio comparabile. Per la monoterapia estrogenica, invece, il rischio non è aumentato (RR 0,77 [IC al 95% 0,59-1,01]).
Nel Million Women Study, uno studio di coorte non randomizzato, sono state arruolate 1'084'110 donne con età media all'ingresso nello studio di 55,9 anni. La metà delle donne ha ricevuto una TOS prima e/o al momento dell'ingresso nello studio, le restanti donne non sono/erano mai state trattate con una TOS. Dopo un tempo di osservazione medio di 2,6 o 4,1 anni, sono stati registrati 9'364 casi di tumore mammario invasivo e 637 decessi a causa di tumore della mammella. Le donne che all'inclusione nello studio utilizzavano una TOS hanno evidenziato un aumentato rischio in relazione alla morbilità (RR 1,66 [IC al 95% 1,58-1,75]) e possibilmente in misura inferiore anche per la mortalità a seguito di tumore della mammella (RR 1,22 [IC al 95% 1,00-1,48]) rispetto a donne che non avevano mai utilizzato tale trattamento. Il rischio massimo è stato osservato durante la terapia combinata estroprogestinica (RR 2,00 [IC al 95% 1,88-2,12]). Nel caso di una monoterapia estrogenica, il rischio relativo è risultato pari a 1,30 [IC al 95% 1,21-1,40]). I risultati sono stati simili per diversi estrogeni e progestinici, per diverse posologie e vie di somministrazione nonché per la terapia continua e quella sequenziale. Per tutte le tipologie di TOS il rischio è aumentato all'aumentare della durata di utilizzo. Una volta interrotta la terapia, il rischio ha iniziato a scendere (ultimo utilizzo precedente >5 anni: RR 1,04 [IC al 95% 0,95-1,12]).
Una TOS aumenta la densità delle immagini mammografiche, il che può in alcuni casi compromettere la rilevazione radiologica di carcinomi mammari.
Carcinoma dell'endometrio
L'assunzione prolungata di estrogeni aumenta il rischio di sviluppare un'iperplasia endometriale o un carcinoma. Una volta conclusa la terapia, il rischio potrebbe restare elevato per almeno 10 anni. Studi indicano che l'aumento di questo rischio può essere notevolmente ridotto mediante la somministrazione aggiuntiva di un progestinico per almeno 12 giorni di ogni ciclo di trattamento.
È necessario un monitoraggio medico di tutte le donne che utilizzano una TOS. Per tutti i casi di sanguinamenti anomali (irregolari, abbondanti o persistenti, incluse perdite mestruali) si devono effettuare accertamenti mediante misure diagnostiche appropriate (ev. anche un esame istologico dell'endometrio), per escludere una causa organica o un reperto maligno.
Carcinoma ovarico
Diversi studi epidemiologici suggeriscono che una TOS potrebbe essere associata a un aumentato rischio di sviluppare un carcinoma ovarico epiteliale. Un aumento del rischio è stato riscontrato sia per una monoterapia estrogenica sia per una TOS combinata. Mentre la maggioranza degli studi ha evidenziato un aumento del rischio solo con un utilizzo a lungo termine (ovvero per almeno 5 anni), in una meta-analisi pubblicata nel 2015 (che in totale ha preso in esame 17 studi prospettici e 35 studi retrospettivi) tale associazione con la durata di utilizzo non è emersa.
Nello studio WHI prospettico, randomizzato, controllato con placebo è stato osservato un aumento del rischio non statisticamente significativo (HR 1,41; IC al 95% 0,75-2,66).
Poiché i carcinomi ovarici sono molto più rari del tumore della mammella, l'aumento assoluto del rischio in donne che utilizzano una TOS o l'hanno utilizzata di recente, è minimo.
Tumori epatici
In rari casi, dopo l'utilizzo di principi attivi ormonali come quelli presenti in Progynova/Progynova mite, sono state osservate alterazioni benigne, ancor più raramente maligne, del fegato che in casi sporadici hanno determinato sanguinamenti intraddominali potenzialmente fatali. Se si presentano un forte dolore addominale superiore, un ingrossamento epatico o segni indicativi di un sanguinamento intraddominale, nella diagnosi differenziale deve essere presa in considerazione anche la possibilità di un tumore epatico.
Malattia coronarica e ictus
Non si dovrebbe usare una TOS per la prevenzione di malattie cardiovascolari.
Ampi studi clinici non hanno evidenziato effetti favorevoli nella profilassi primaria (studio WHI) o secondaria (studio HERS) delle malattie cardiovascolari.
In donne in post-menopausa che hanno ricevuto una TOS orale con estrogeni coniugati e MPA per una media di 5,2 anni, lo studio WHI ha evidenziato un aumentato rischio di eventi cardiovascolari (RR 1,24 [IC al 95% 1,00-1,54], aumento del rischio assoluto pari a 6 casi ogni 10'000 anni-persona) rispetto a placebo. Il rischio è stato massimo nel primo anno dopo l'inizio della TOS (RR 1,81 [IC al 95% 1,09-3,01]). All'aumentare del tempo intercorso dalla menopausa, il rischio aumentava (menopausa <10 anni, RR 0,89; menopausa 10-19 anni: RR 1,22; menopausa ≥20 anni: RR 1,71).
Nello studio WHI, anche il rischio cerebrovascolare durante la terapia combinata estroprogestinica è risultato aumentato (RR 1,31 [IC al 95% 1,02-1,68]).
Nel braccio in monoterapia estrogenica dello studio WHI non sono stati riscontrati effetti significativi sul rischio cardiovascolare (RR 0,91 [IC al 95% 0,75-1,12]). Per contro, il rischio di accidenti cerebrovascolari è risultato aumentato (RR 1,39 [IC al 95% 1,10-1,77]).
Lo Heart and Estrogen/Progestin Replacement Study (HERS e HERS II), uno studio prospettico, randomizzato, controllato con placebo non ha evidenziato alcuna riduzione del rischio cardiovascolare in oltre 1'300 donne in postmenopausa con malattia coronarica preesistente (età media all'inclusione nello studio 67 anni), in trattamento con una TOS orale a base di estrogeni coniugati e MPA per una media di 4,1 anni (HERS) o 2,7 anni (HERS II). Il rischio relativo è risultato pari a 0,99 (IC al 95% 0,84-1,17). Il rischio è stato massimo nel primo anno dopo l'inizio della TOS (RR 1,52 [IC al 95% 1,01-2,29]).
I dati relativi a una TOS iniziata a un'età relativamente giovane (ad es. prima dei 55°anni) sono limitati. Indicano che l'aumento del rischio cardiovascolare durante una TOS in pazienti più giovani a breve distanza dalla menopausa potrebbe essere inferiore rispetto a quello osservato nella popolazione (tendenzialmente più anziana) esaminata nei suddetti studi. Ciò non vale tuttavia per gli eventi cerebrovascolari.
Il rischio relativo di accidenti cerebrovascolari è indipendente dall'età o dal tempo intercorso dalla menopausa. Poiché il rischio base di ictus è tuttavia fortemente dipendente dall'età, nelle donne sotto TOS il rischio globale aumenta all'aumentare dell'età.
In donne che già presentano fattori di rischio per l'insorgenza di eventi cardiovascolari o cerebrovascolari, si dovrebbero prendere in considerazione terapie alternative.
Rischio di tromboembolie venose (TEV)
Una TOS è associata a un aumentato rischio di TEV (ad es. trombosi venosa profonda, embolia polmonare).
Due studi randomizzati controllati (HERS e WHI) e diversi studi epidemiologici hanno evidenziato un aumento del rischio di 2-3 volte in donne utilizzatrici di una TOS rispetto a donne che non avevano mai usato tale trattamento. Lo studio WHI ha dimostrato in particolare un'aumentata incidenza di embolie polmonari. L'aumento assoluto del rischio in donne trattate con una TOS è stato di 8 casi per 10'000 anni-persona (15 vs. 7), rischio relativo 2,13 (IC al 95% 1,39-3,25).
L'aumento del rischio è stato riscontrato solo in donne sotto TOS e non in donne che avevano utilizzato in precedenza una TOS. Il rischio sembra essere più alto nei primi anni di utilizzo.
Per le non utilizzatrici il numero di casi di TEV in un periodo di 5 anni è stato stimato a 3 ogni 1'000 donne per il gruppo di età dei 50-59 anni a 8 ogni 1'000 donne per il gruppo di età dei 60-69 anni. In donne in salute che seguono una TOS per 5 anni si manifestano, ogni 1'000 donne, da 2 a 6 casi aggiuntivi di TEV nel gruppo di età dei 50-59 anni e da 5 a 15 casi aggiuntivi di TEV nel gruppo di età dei 60-69 anni.
Qualora insorgano sintomi di TEV o in caso di sospetta TEV, il preparato deve essere interrotto immediatamente. Le pazienti con fattori di rischio per l'insorgenza di eventi tromboembolici devono essere monitorate attentamente. In queste donne, il rapporto rischio-beneficio deve essere valutato attentamente e, se possibile, devono essere prese in considerazione altre terapie.
I fattori di rischio noti per l'insorgenza di TEV comprendono una corrispondente anamnesi personale o familiare (l'insorgenza di TEV in un parente prossimo a un'età relativamente giovane può indicare una predisposizione genetica), fumo, notevole sovrappeso, lupus eritematoso sistemico e malattie maligne.
In donne che presentano una combinazione di fattori di rischio o una maggiore gravità di un singolo fattore di rischio si dovrebbe considerare che il rischio può risultare aumentato in misura sovradditiva, il che può in alcuni casi costituire una controindicazione a una TOS.
Il rischio di eventi tromboembolici venosi può risultare temporaneamente aumentato in caso di immobilizzazione prolungata, interventi di chirurgia maggiore o in seguito a un trauma grave. Nelle donne sotto terapia ormonale sostitutiva occorre prestare la massima attenzione a misure profilattiche al fine di evitare tromboembolie venose dopo interventi chirurgici. A seconda del tipo di intervento e della durata dell'immobilizzazione si dovrebbe considerare un'interruzione temporanea della TOS, in caso di interventi d'elezione possibilmente alcune (4-6) settimane prima dell'intervento. Il trattamento dovrebbe essere ripreso solo dopo che la donna ha recuperato la piena mobilità.
Demenza
Nel Women's Health Initiative Memory Study (WHIMS), un sottostudio del WHI, randomizzato, controllato con placebo, oltre 2'000 donne di età >65 anni (età media 71 anni) sono state trattate per via orale con estrogeni equini coniugati e medrossiprogesterone acetato e monitorate per una media di 4 anni.
Inoltre, 1'464 donne isterectomizzate di età compresa tra 65 e 79 anni sono state trattate con una monoterapia orale a base di estrogeni equini coniugati e monitorate per un periodo di 5,2 anni. Né il trattamento con estrogeni coniugati e medrossiprogesterone acetato né la monoterapia estrogenica hanno evidenziato un effetto favorevole sulla funzione cognitiva. Il rischio di insorgenza di un disturbo delle funzioni cerebrali (probabile demenza) è risultato persino aumentato per la TOS combinata (RR 2,05 [IC al 95% 1,21-3,48]). In termini assoluti, ciò corrisponde su base annuale a 23 casi aggiuntivi ogni 10'000 donne trattate.
Benché non sia chiaro in che misura questi risultati possano essere estrapolati per una popolazione più giovane o per preparati TOS con altri principi attivi, dovrebbero essere tenuti in considerazione dal medico nella valutazione del rapporto rischio-beneficio di una TOS.
Ulteriori misure precauzionali
Gli estrogeni possono provocare ritenzione idrica. Pertanto le pazienti con malattie che a causa di ciò possono aggravarsi (come disturbi della funzionalità cardiaca o renale, asma, epilessia o emicrania) dovrebbero essere attentamente monitorate.
In pazienti con ipertrigliceridemia (soprattutto familiare) preesistente può verificarsi un ulteriore aumento dei trigliceridi, per cui il rischio di pancreatite aumenta.
Una relazione definitiva tra l'utilizzo di una TOS e l'insorgenza di un'ipertensione clinica finora non è stata documentata. In donne che seguono una TOS è stato riferito un lieve aumento della pressione arteriosa; è raro tuttavia che si verifichi un aumento clinicamente rilevante. Qualora nel corso di una TOS si dovessero registrare valori pressori costantemente elevati, si dovrebbe prendere in considerazione un'interruzione della TOS.
In pazienti che oltre a Progynova/Progynova mite assumono contemporaneamente medicamenti antipertensivi si dovrebbe controllare regolarmente la pressione arteriosa.
Studi clinici hanno dimostrato un effetto di una TOS sull'insulinoresistenza periferica e sulla tolleranza al glucosio. Ciò nonostante, tuttavia, non sono generalmente necessari aggiustamenti della terapia antidiabetica, ma nelle diabetiche sotto TOS i livelli della glicemia dovrebbero essere attentamente monitorati.
In pazienti con disturbi della funzionalità epatica (incl. iperbilirubinemia, sindrome di Dubin-Johnson o sindrome di Rotor) è necessario uno stretto controllo dei parametri epatici. Se i valori epatici peggiorano, la TOS dovrebbe essere interrotta.
Dopo la risoluzione di un'epatite virale si dovrebbero attendere circa 6 mesi prima di utilizzare ormoni sessuali. Anche in questo caso occorre controllare i parametri epatici.
È noto che gli estrogeni possono aumentare la litogenicità della bile, il che, durante una terapia estrogenica, determina in alcune donne un aumento del rischio di patologie biliari (soprattutto colelitiasi).
In pazienti con prolattinoma preesistente è necessario uno stretto monitoraggio medico (inclusa la determinazione regolare del livello di prolattina), poiché in casi sporadici nel corso di una terapia estrogenica è stato segnalato un aumento di volume dei prolattinomi.
In pazienti con insufficienza renale o con disturbi metabolici delle ossa accompagnati da un'ipercalcemia, Progynova/Progynova mite dovrebbe essere utilizzato, come tutti i preparati estrogenici, solo dopo un'attenta valutazione dei benefici e dei rischi.
Durante una TOS, in seguito alla stimolazione estrogenica, alcune pazienti possono manifestare effetti indesiderati come sanguinamenti insolitamente forti. Sanguinamenti irregolari persistenti e frequenti sono segni di un'attività endometriale e devono essere accertati mediante misure diagnostiche appropriate al fine di escludere patologie organiche.
I miomi uterini possono aumentare di volume durante una terapia estrogenica. In tal caso la terapia dovrebbe essere interrotta.
Se nel corso di una TOS dovesse riattivarsi un'endometriosi, si raccomanda di interrompere la terapia.
Un'esposizione a una monoterapia estrogenica può provocare modificazioni pre-maligne o maligne in focolai residui di un'endometriosi. In pazienti sottoposte a isterectomia a causa di un'endometriosi, nelle quali si sospettano focolai residui di un'endometriosi, si dovrebbe pertanto valutare la combinazione della terapia estrogenica con un progestinico.
In donne con angioedema ereditario, gli estrogeni per via esogena possono indurre o aggravare i sintomi dell'angioedema.
Occasionalmente può presentarsi un cloasma, soprattutto in donne con cloasma gravidico in anamnesi. Le donne con tendenza al cloasma non dovrebbero esporsi al sole o ad altri raggi ultravioletti durante la TOS.
Progynova/Progynova mite non ha un'azione contraccettiva. Occorre ev. impiegare metodi contraccettivi non ormonali.
Ogni confetto di Progynova/Progynova mite contiene circa 46 mg o 47 mg di lattosio. Le pazienti affette dalla rara intolleranza ereditaria al galattosio, da deficit di Lapp lattasi o da malassorbimento del glucosio-galattosio, che seguono un regime alimentare privo di lattosio, dovrebbero tenere presente questa quantità.
Interazioni
Al fine di individuare potenziali interazioni, si dovrebbe consultare anche l'Informazione professionale dei medicamenti somministrati in concomitanza.
Interazioni farmacodinamiche
Effetti di altri medicamenti sulla farmacocinetica di Progynova/Progynova mite
Induttori enzimatici
Un'aumentata clearance degli ormoni sessuali a seguito di un'induzione di enzimi epatici può ridurre le concentrazioni plasmatiche degli estrogeni e in tal modo diminuire l'efficacia clinica nonché provocare eventualmente sanguinamenti irregolari. Ciò vale, ad es., per barbiturici, bosentan, carbamazepina, felbamato, modanafil, oxcarbazepina, fenitoina, primidone, rifabutina, rifampicina e topiramato nonché per medicamenti contenenti erba di San Giovanni (Hypericum perforatum). Un'induzione enzimatica può essere osservata già dopo alcuni giorni e può persistere per un minimo di 4 settimane o più dopo l'interruzione di questi medicamenti. L'induzione enzimatica massima viene raggiunta generalmente dopo alcune settimane.
Inibitori enzimatici
Inibitori potenti e moderati del CYP3A4 come antimicotici azolici (ad es. itraconazolo, voriconazolo, fluconazolo), antibiotici macrolidi (ad es. claritromicina, eritromicina), diltiazem, verapamil e succo di pompelmo possono aumentare le concentrazioni plasmatiche degli estrogeni.
Principi attivi con differenti effetti sulla clearance degli ormoni sessuali
Diversi inibitori delle proteasi dell'HIV/HCV e della trascrittasi inversa non nucleosidica nonché combinazioni di entrambi possono indurre un aumento o una riduzione della concentrazione plasmatica degli estrogeni, se utilizzati in concomitanza con una TOS. In alcuni casi queste variazioni possono essere clinicamente rilevanti.
Ricircolo enteroepatico
Con l'uso concomitante di breve durata (fino a 10 giorni) di antibiotici che non presentano interazioni con il sistema enzimatico CYP3A4 non si prevedono interazioni farmacocinetiche. Non sono disponibili dati sufficienti sulle possibili interazioni in caso di terapia concomitante a lungo termine con antibiotici (ad es. in caso di borreliosi o osteomielite). In questo caso non si deve escludere una riduzione del livello del principio attivo a seguito di un effetto del ricircolo enteroepatico.
Effetti di Progynova/Progynova mite sulla farmacocinetica di altri medicamenti
Gli ormoni sessuali possono influenzare anche la farmacocinetica di altri medicamenti. Pertanto le loro concentrazioni plasmatiche possono aumentare (ad es. ciclosporina) o diminuire (ad es. lamotrigina, vedere sotto).
Uno studio d'interazione con lamotrigina, un antiepilettico, e un contraccettivo orale combinato (30 µg di etinilestradiolo/150 µg di levonorgestrel) ha evidenziato un aumento clinicamente rilevante della clearance di lamotrigina con un corrispondente calo significativo del livello plasmatico di lamotrigina, se questo medicamento viene somministrato in concomitanza. Una simile riduzione delle concentrazioni plasmatiche può accompagnarsi a un minore controllo delle convulsioni. Può essere necessario un aggiustamento della dose di lamotrigina.
Altri contraccettivi ormonali e altre TOS non sono stati esaminati. Ci si attende tuttavia che tali preparati presentino un potenziale d'interazione comparabile. Pertanto, se una paziente che assume lamotrigina inizia ex novo un trattamento con Progynova/Progynova mite, può rendersi necessario un aggiustamento della dose di lamotrigina, e all'inizio della terapia si dovrebbero monitorare attentamente le concentrazioni di lamotrigina.
Con l'interruzione di Progynova/Progynova mite, i livelli di lamotrigina possono tornare ad aumentare, pertanto anche in questa fase occorre monitorare la paziente riducendo eventualmente la dose di lamotrigina.
Inoltre, gli ormoni sessuali possono avere un effetto sull'azione degli anticoagulanti orali.
Interazioni con meccanismo non noto
Nell'ambito di studi clinici, con la somministrazione concomitante di contraccettivi combinati contenenti etinilestradiolo insieme alla combinazione di principi attivi ombitasvir/paritaprevir/ritonavir con o senza dasabuvir impiegata nella terapia delle infezioni da HCV è stato osservato un aumento dell'ALT con frequenza significativamente maggiore (incl. i casi di un aumento fino a più di cinque volte il limite superiore della norma) rispetto a pazienti trattate esclusivamente con i principi attivi antivirali. mentre con l'utilizzo di altri estrogeni (in particolare estradiolo ed estradiolo valerato) l'incidenza di un aumento delle transaminasi non è risultata superiore rispetto a pazienti non in terapia estrogenica. Considerato il numero limitato di donne che assumevano altri medicamenti estrogenici di questo tipo, in linea di generale è richiesta tuttavia cautela nella somministrazione concomitante di estrogeni con la combinazione di principi attivi ombitasvir/paritaprevir/ritonavir con o senza dasabuvir.
Gravidanza/Allattamento
L'utilizzo di Progynova/Progynova mite è controindicato durante una gravidanza. Se durante l'utilizzo dovesse insorgere una gravidanza o se si sospetta una gravidanza, il medicamento deve essere interrotto immediatamente consultando il medico.
Gli studi di sperimentazione animale non indicano rischi per lo sviluppo fetale. La maggioranza degli studi epidemiologici condotti finora non ha tuttavia fornito evidenze univoche di embriotossicità o teratogenicità, quando gli estrogeni sono stati accidentalmente somministrati durante la gravidanza.
Progynova/Progynova mite non trova indicazione durante l'allattamento.
Il medicamento non deve essere usato nel periodo dell'allattamento, poiché la produzione di latte può risultare ridotta e la qualità del latte alterata, e nel latte materno possono essere rilevate minime concentrazioni della sostanza.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Non sono stati effettuati studi a riguardo. Non si prevede che Progynova/Progynova mite abbia un effetto sulla capacità di guidare veicoli o sulla capacità di utilizzare macchine. Cfr. tuttavia la rubrica «Effetti indesiderati».
Effetti indesiderati
Gli effetti indesiderati più gravi osservati in relazione all'uso di una TOS vengono descritti anche nella rubrica «Avvertenze e misure precauzionali» (vedere rubrica).
Di seguito sono riportati gli effetti indesiderati osservati con Progynova o Progynova mite nell'ambito di studi clinici e durante la sorveglianza sul mercato, elencati secondo la classificazione sistemico-organica e per frequenza. Le categorie di frequenza sono definite come segue: comune (≥1/100, <1/10); non comune (≥1/1'000, <1/100); raro (≥1/10'000, <1/1'000); non nota (sulla base prevalentemente di segnalazioni spontanee nella sorveglianza sul mercato, la frequenza esatta non può essere stimata).
Disturbi del sistema immunitario
Non comune: reazioni di ipersensibilità.
Disturbi del metabolismo e della nutrizione
Comune: aumento o calo ponderale.
Patologie del sistema nervoso
Comune: cefalea, capogiri.
Non comune: emicrania.
Patologie vascolari
Non nota: eventi tromboembolici arteriosi e venosi.
Patologie gastrointestinali
Comune: flatulenza, nausea.
Patologie della cute e del tessuto sottocutaneo
Comune: eruzioni, prurito.
Non comune: eritema nodoso, orticaria.
Raro: irsutismo, acne.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Non comune: crampi muscolari.
Patologie dell'apparato riproduttivo e della mammella
Comune: anomalie del sanguinamento (inclusi metrorragie da interruzione e spotting), sensazione di tensione mammaria, dolori pelvici.
Non comune: ingrossamento della mammella.
Patologie sistemiche
Comune: edemi.
Con altri preparati TOS sono stati inoltre riferiti i seguenti effetti indesiderati:
induzione o peggioramento di un angioedema ereditario, ipertrigliceridemia, ansia, nervosismo, sbalzi di umore, alterazioni della libido, depressione, disturbi della vista, palpitazioni, aumento della pressione arteriosa, vomito, dispepsia, prove della funzionalità epatica anormali, colelitiasi, ittero colestatico, peggioramento di una porfiria, cloasma (eventualmente persistente), alopecia, eritema multiforme, porpora vascolare, dolore dorsale, dolore mammario, fluor vaginale, aumento di volume di miomi uterini, iperplasia endometriale.
Posologia eccessiva
A causa della bassa tossicità dell'estradiolo, anche in caso di singola assunzione accidentale di un multiplo della dose terapeutica non si prevede l'insorgenza di un'intossicazione acuta.
Un sovradosaggio avuto può accompagnarsi a cefalea, nausea, vomito, sensazione di tensione mammaria e sanguinamenti uterini.
In caso di sovradosaggio cronico occorre attendersi un aumento degli effetti indesiderati e dei rischi descritti in «Avvertenze e misure precauzionali».
Non esiste alcun antidoto specifico, il trattamento deve essere eventualmente diretto ai sintomi.
Proprietà/Effetti
Codice ATC: G03CA03
Meccanismo d'azione
Nella post-menopausa la riduzione del livello di estrogeni diventa più marcata. Il quadro clinico di una sindrome da carenza di estrogeni è caratterizzato da sintomi vegetativi, psichici e organici (ad es. vampate di calore, sudorazioni, tachicardia, capogiri, insonnia e umore depresso). Le principali modificazioni organiche sono atrofie cutanea e della mucosa e osteoporosi.
Le modificazioni atrofiche possono concorrere ad es. a un aumento della vulnerabilità negli organi genitali e a disturbi dello svuotamento vescicale nel tratto urogenitale. Con una terapia estrogenica sistemica è possibile trattare efficacemente disturbi vegetativi, psichici e organici. Esami citologici dell'epitelio vaginale hanno mostrato che Progynova permette di conseguire una sostituzione sufficiente del deficit estrogenico.
In pazienti che non presentano una sintomatologia vasomotoria, i preparati estrogenici non eliminano tuttavia né gli sbalzi di umore né gli stati depressivi.
Indipendentemente dalla via di somministrazione, a posologie che determinano un miglioramento dei disturbi della menopausa, gli estrogeni esplicano un effetto fortemente stimolante sulla mitosi e sulla proliferazione dell'endometrio. Una monoterapia estrogenica aumenta la frequenza i iperplasie endometriali e il rischio di un carcinoma dell'endometrio. È possibile evitare un'iperplasia dell'endometrio proteggendolo con la somministrazione di un progestinico a una dose sufficiente e per almeno 12 giorni al mese.
Farmacocinetica
Estradiolo valerato
Assorbimento
L'estradiolo valerato viene assorbito rapidamente e quasi completamente dopo somministrazione orale. Già nella parete intestinale nonché durante il primo passaggio epatico si verifica una divisione dell'estere steroideo in estradiolo e acido valerico. Per via del metabolismo first-pass, la biodisponibilità dell'estradiolo è soltanto pari al 3% circa.
Di regola le concentrazioni massime di estradiolo (ca. 30 pg/ml) nel plasma vengono raggiunte dopo 4-9 ore dall'assunzione di un confetto.
Steady state
Rispetto alla dose singola, dopo somministrazione ripetuta si osserva un aumento quasi doppio del livello sierico di estradiolo. La concentrazione di estradiolo è mediamente compresa tra 30 (livello minimo) e 60 pg/ml (livello massimo).
Distribuzione
Nel plasma, circa il 60% dell'estradiolo è legato all'albumina e quasi il 40% a SHBG. Solo l'1-1,5% dell'estradiolo è presente nel plasma come sostanza libera.
Il volume di distribuzione apparente dell'estradiolo dopo singola somministrazione endovenosa è di circa 1 l/kg.
L'estradiolo attraversa la barriera placentare. L'estradiolo e i suoi metaboliti vengono escreti nel latte materno solo in minima percentuale.
Metabolismo
Dopo la prima divisione dell'estradiolo valerato, l'estradiolo viene, con il coinvolgimento del CYP3A4, ampiamente metabolizzato nel fegato e nella parete intestinale principalmente in estrone, estriolo ed estrone solfato, che segue le vie di biotrasformazione dell'estradiolo estrogeno. Le concentrazioni plasmatiche raggiunte dall'estrone, il principale metabolita attivo, e dall'estrone solfato sono rispettivamente circa 8 volte e 150 volte superiori a quelle dell'estradiolo.
La clearance metabolica dell'estradiolo è di circa 10-30 ml/min/kg.
Eliminazione
I metaboliti dell'estradiolo vengono coniugati per quasi il 90% con glucuronide o solfato ed escreti per via urinaria con un'emivita di circa un giorno. Solo circa il 10% dei metaboliti viene eliminato tramite le feci ed è soggetto a ricircolo enteroepatico.
Una volta conclusa la terapia, entro 2-3 giorni vengono raggiunti livelli di estradiolo corrispondenti a quelli precedenti la terapia.
Cinetica di gruppi di pazienti speciali
Compromissione della funzionalità renale: la farmacocinetica di Progynova/Progynova mite in pazienti con insufficienza renale non è stata esaminata.
Compromissione della funzionalità epatica: la farmacocinetica Progynova/Progynova mite in pazienti con insufficienza epatica non è stata esaminata. È tuttavia noto che in presenza di disturbi della funzionalità epatica la degradazione metabolica dell'estradiolo è rallentata (vedere anche «Avvertenze e misure precauzionali»).
Dati preclinici
Cancerogenicità
Studi preclinici con estradiolo su tossicità dopo somministrazione ripetuta, genotossicità e potenziale cancerogeno non hanno fornito evidenze univoche di rischi particolari per l'essere umano, benché studi epidemiologici e studi sugli animali condotti con estriolo abbiano evidenziato un aumentato rischio di cancerogenicità.
Embriotossicità/teratogenicità
Da studi di tossicità per la riproduzione su ratti, topi e conigli non sono emerse evidenze di un effetto teratogeno. Per i rischi nell'essere umano vedere la rubrica «Gravidanza, allattamento».
Mutagenicità
Da studi in vitro e in vivo con 17β-estradiolo non sono emerse evidenze di potenziale mutagenico.
Altre indicazioni
Influenza sui metodi diagnostici
Gli ormoni sessuali possono influenzare i risultati di determinati esami di laboratorio come parametri biochimici del fegato, della tiroide, della funzionalità renale e surrenale, livelli plasmatici delle proteine di legame e frazione lipidica/lipoproteica, parametri del metabolismo dei carboidrati, della coagulazione e della fibrinolisi. Le variazioni si mantengono generalmente entro l'intervallo di riferimento.
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sulla confezione.
Indicazioni particolari concernenti l'immagazzinamento
Conservare a temperatura ambiente (15-25 °C).
Conservare fuori dalla portata dei bambini.
Numero dell'omologazione
33149 (Swissmedic)
Titolare dell’omologazione
Bayer (Schweiz) AG, Zurigo.
Stato dell'informazione
Maggio 2019.
Composition
Progynova
Principe actif: Estradioli valeras.
Excipients: Lactosum monohydricum 46 mg, excipiens pro compresso obducto.
Progynova mite
Principe actif: Estradioli valeras.
Excipients: Lactosum monohydricum 47 mg, excipiens pro compresso obducto.
Forme galénique et quantité de principe actif par unité
Progynova
Chaque dragée blanche contient 2 mg de valérate d'estradiol.
Progynova mite
Chaque dragée beige contient 1 mg de valérate d'estradiol.
Indications/Possibilités d’emploi
Traitement des symptômes de carence estrogénique consécutifs à la ménopause naturelle ou artificielle.
Chez les patientes non hystérectomisées, l'estrogénothérapie substitutive doit toujours être complétée par un traitement progestatif.
Chez les patientes souffrant uniquement de troubles urogénitaux sans autre symptôme de carence estrogénique nécessitant un traitement, il convient de réaliser une estrogénothérapie topique et de renoncer à un THS systémique.
Posologie/Mode d’emploi
Dans toutes les indications, on utilisera toujours la dose minimum efficace et la durée de traitement la plus courte possible. La substitution hormonale ne doit être poursuivie que tant que le bénéfice l'emporte sur le risque encouru par la patiente.
Normalement, le traitement est initié avec 1 dragée de Progynova (2 mg) par jour, à prendre après le repas. Les dragées se prennent en continu, ce qui veut dire que la prochaine plaquette-calendrier sera entamée sans interruption. Au cours de la suite du traitement, la dose peut être réduite à 1 dragée de Progynova mite (1 mg) par jour.
Même à dose réduite, la prise des dragées doit se faire en continu.
Le progestatif nécessaire chez les patientes non hystérectomisées sera pris 12 à 14 jours au minimum par cycle de traitement. Consulter l'information professionnelle des préparations de progestatifs correspondants.
Prise oubliée
Si la patiente oublie de prendre une dragée à l'heure habituelle, elle devra réparer cet oubli, en prenant la dragée dans les 24 heures afin d'éviter l'apparition de saignements intermenstruels.
Instructions spéciales pour la posologie
Enfants et adolescentes
Il n'existe aucune indication chez l'enfant et l'adolescente.
Patientes âgées
On ne dispose pas de données suggérant qu'une adaptation de la dose est nécessaire chez les patientes âgées.
Insuffisance hépatique
Progynova/Progynova mite n'a pas été étudié chez des patientes atteintes d'insuffisance hépatique, Progynova/Progynova mite est contre-indiqué chez les patientes atteintes d'insuffisance hépatique sévère.
Insuffisance rénale
Progynova/Progynova mite n'a pas été étudié chez des patientes atteintes d'insuffisance rénale. Une adaptation de la dose n'est probablement pas nécessaire.
Contre-indications
- existence ou suspicion de cancer mammaire,
- existence ou suspicion d'une lésion hormonodépendante prémaligne ou maligne,
- hyperplasie endométriale non traitée,
- hémorragie vaginale non élucidée,
- tumeurs hépatiques (bénignes ou malignes) dans les antécédents ou actuellement présentes,
- affections hépatiques sévères ou antécédent d'affection hépatique sévère, en l'absence de normalisation des tests fonctionnels hépatiques,
- événements thromboemboliques veineux dans les antécédents ou actuellement présents (par ex. thrombose veineuse profonde ou embolie pulmonaire),
- événements thromboemboliques veineux aigus ou récemment survenus (infarctus cérébral, infarctus du myocarde),
- existence de facteurs de risque de thromboembolie artérielle ou veineuse (p.ex. déficit en antithrombine, en protéine S ou en protéine C),
- hypertriglycéridémie sévère,
- porphyrie,
- grossesse et allaitement,
- hypersensibilité connue à l'un des composants de Progynova/Progynova mite.
Mises en garde et précautions
Tout traitement hormonal substitutif (THS) sera précédé d'un examen général et d'un examen gynécologique approfondi, qui devront être répétés au moins une fois par an. L'anamnèse personnelle et familiale de la patiente devra également être prise en compte. Avant tout traitement, le rapport bénéfice/risque doit être soigneusement évalué chez chaque patiente. On choisira toujours la dose minimum efficace et la durée de traitement la plus courte possible.
Motifs imposant l'arrêt immédiat du traitement
Si l'une des contre-indications mentionnées ci-dessus survient au cours d'un THS, ou si l'une des situations suivantes se produit, le traitement doit être immédiatement interrompu:
- symptômes d'une affection thromboembolique veineuse ou artérielle, avérée ou suspectée; en font aussi partie:
- première apparition de céphalées de type migraineux ou survenue plus fréquente de céphalées inhabituellement intenses;
- perte soudaine de la vision, partielle ou complète;
- troubles soudains de l'audition;
- augmentation de la pression artérielle cliniquement pertinente;
- dégradation de la fonction hépatique ou survenue d'un ictère ou d'une hépatite;
- croissance manifeste de myomes;
- augmentation de crises épileptiques;
- grossesse.
Circonstances nécessitant une surveillance particulière
La patiente doit être étroitement surveillée si les symptômes suivants sont présents, sont apparus récemment et/ou se sont aggravés pendant une grossesse ou pendant un traitement hormonal antérieur. Il faut tenir compte du fait que ces symptômes peuvent réapparaître ou s'aggraver pendant le traitement par Progynova/Progynova mite:
- facteurs de risque de tumeurs estrogéno-dépendantes (p.ex. cancer du sein chez des parents du 1er degré);
- modifications mammaires bénignes;
- hyperplasie de l'endomètre (aussi dans les antécédents);
- léiomyomes ou endométriose;
- facteurs de risque de maladies thromboemboliques;
- migraine;
- hypertension;
- diabète sucré;
- hypertriglycéridémie;
- affections du foie ou de la vésicule biliaire;
- asthme;
- épilepsie;
- lupus érythémateux disséminé;
- chorée de Sydenham;
- otosclérose.
Les avantages et les risques possibles liés à l'utilisation de Progynova/Progynova mite seront évalués chez les patientes présentant des facteurs de risque.
Maladies tumorales
Cancer du sein
Des études randomisées contrôlées et des études épidémiologiques ont mis en évidence un risque accru de cancer du sein chez des femmes qui recevaient un THS sur plusieurs années. Par conséquent, avant d'initier un THS et chaque année par la suite, le médecin devra effectuer un examen des seins et la femme procéder à un auto-examen de ses seins. Les utilisatrices doivent être informées des modifications mammaires à signaler impérativement à leur médecin. Selon l'âge et les facteurs de risque individuels, une mammographie additionnelle peut être indiquée.
Une méta-analyse de 51 études épidémiologiques a montré que le risque de survenue d'un cancer du sein augmente avec la durée du THS et diminue après l'arrêt du THS. Le risque relatif (RR) de survenue d'un cancer du sein était de 1,35 (intervalle de confiance (IC) à 95%: 1,21 à 1,49) pour les femmes qui recevaient un THS pendant 5 ans ou plus.
L'étude Women's Health Initiative (WHI), une vaste étude prospective, randomisée, contrôlée par placebo, a montré chez plus de 8'000 femmes âgées ménopausées (âge au début de l'étude 50 à 79 ans, âge moyen 63 ans), sous THS combiné à base d'estrogènes conjugués et d'acétate de médroxyprogestérone (AMP) une augmentation de la fréquence des carcinomes mammaires invasifs par rapport au placebo après une durée moyenne de traitement de 5,6 ans dans le groupe sous estrogènes/progestatif (RR 1,24 [IC à 95%: 1,02 à 1,50]). On ignore si le risque est comparable pour d'autres produits combinés de THS. En revanche, pour la monothérapie d'estrogènes, le risque n'était pas augmenté (RR 0,77 [IC à 95%: 0,59 à 1,01]).
L'étude Million Women, une étude de cohorte non randomisée, a recruté 1'084'110 femmes. L'âge moyen des femmes à leur inclusion dans l'étude était de 55,9 ans. La moitié des femmes recevaient un THS avant et/ou au moment de leur inclusion dans l'étude, les autres femmes n'avaient jamais reçu de THS. On a enregistré 9'364 cas de cancer invasif du sein et 637 cas de décès des suites d'un cancer du sein, après une période moyenne d'observation respective de 2,6 et 4,1 ans. En comparaison avec les femmes qui n'avaient jamais reçu de THS, les femmes qui recevaient un THS au moment de leur inclusion dans l'étude présentaient un risque accru en termes de morbidité (RR 1,66 [IC à 95%: 1,58 à 1,75]) et peut-être, dans une moindre mesure, également en termes de mortalité des suites d'un cancer du sein (RR 1,22 [IC à 95%: 1,00 à 1,48]). Le risque le plus élevé a été observé sous traitement combiné d'estrogènes et de progestatif (RR 2,00 [IC à 95%: 1,88 à 2,12]). Pour la monothérapie d'estrogènes, le risque relatif était de 1,30 (IC à 95%: 1,21 à 1,40). Les résultats ont été semblables pour divers estrogènes et progestatifs, pour divers dosages et voies d'administration et pour les traitements continus ou séquentiels. Avec tous les types de THS, le risque s'est accru avec la durée de l'application. Après l'arrêt du traitement, le risque a régressé (dernière application il y a plus de 5 ans: RR 1,04 [IC à 95%: 0,95 à 1,12]).
Le THS augmente la densité des images mammographiques, ce qui peut compromettre la détection radiologique de cancers du sein dans quelques cas.
Cancer de l'endomètre
La prise prolongée d'estrogènes augmente le risque de développement d'une hyperplasie ou d'un carcinome de l'endomètre. Après l'arrêt du traitement, le risque pourrait être accru pendant au moins 10 ans. Des études indiquent que l'augmentation de ce risque peut être largement réduite par l'administration complémentaire d'un progestatif pendant au moins 12 jours par cycle de traitement.
Une surveillance médicale de toutes les femmes utilisant un THS est nécessaire. Tous les cas de saignements anormaux (saignements irréguliers, intenses ou persistants, y compris spotting) doivent faire l'objet d'investigations au moyen de méthodes diagnostiques adéquates (comprenant le cas échéant un examen histologique de l'endomètre), afin d'exclure une cause organique ou une origine maligne.
Cancer de l'ovaire
Plusieurs études épidémiologiques indiquent qu'un THS pourrait être associé à un risque accru de développer un cancer épithélial de l'ovaire. Une augmentation du risque a été observée avec une monothérapie estrogénique comme avec un THS combiné. Bien que la plupart des études aient montré une augmentation du risque seulement en cas d'utilisation prolongée (au moins cinq ans), une méta-analyse publiée en 2015, portant sur 17 études prospectives et 35 études rétrospectives, n'a mis en évidence aucune corrélation avec la durée d'utilisation.
Dans l'étude prospective, randomisée, contrôlée par placebo WHI, une augmentation du risque statistiquement non significative a été observée (HR 1,41 [IC à 95%: 0,75 à 2,66]).
Le cancer de l'ovaire étant nettement plus rare que le cancer du sein, l'augmentation absolue du risque chez les femmes suivant ou ayant suivi récemment un THS est faible.
Tumeurs hépatiques
Après utilisation de principes actifs hormonaux du type de ceux contenus dans Progynova/Progynova mite, on a observé dans de rares cas des transformations hépatiques bénignes – plus rarement malignes – qui ont sporadiquement entraîné des hémorragies intra-abdominales représentant une menace vitale. Si de fortes douleurs épigastriques, une hépatomégalie ou des signes d'hémorragie intra-abdominale se manifestent, il faudra envisager la possibilité d'une tumeur du foie dans le diagnostic différentiel.
Cardiopathie coronarienne et accident vasculaire cérébral
Un THS ne doit pas être appliqué pour la prévention de maladies cardiovasculaires.
De grandes études cliniques n'ont pas montré d'effet bénéfique sur la prévention primaire (étude WHI) ou secondaire (étude HERS) de maladies cardiovasculaires.
L'étude WHI, a montré, chez des femmes ménopausées qui ont reçu un THS oral avec des estrogènes conjugués et de l'AMP pendant 5,2 ans en moyenne, un risque accru d'événements cardiovasculaires par rapport au placebo (RR 1,24 [IC à 95%: 1,00 à 1,54], augmentation absolue du risque: 6 cas par 10'000 années-personnes). Le risque était le plus élevé durant la première année qui suivait le début du THS (RR 1,81 [IC à 95%: 1,09 à 3,01]). Plus le temps écoulé depuis la ménopause était important, plus le risque était élevé (ménopause <10 ans: RR 0,89; ménopause 10–19 ans: RR 1,22; ménopause ≥20 ans: RR 1,71).
De même, le risque cérébro-vasculaire était aussi accru dans l'étude WHI sous traitement combiné d'estrogènes et de progestatif (RR 1,31 [IC à 95%: 1,02 à 1,68]).
Dans le bras de la monothérapie sous estrogène de l'étude WHI, aucun effet significatif sur le risque cardiovasculaire n'a été observé (RR 0,91 [IC à 95%: 0,75 à 1,12]). En revanche, le risque d'atteintes cérébro-vasculaires était accru (RR 1,39 [IC à 95%: 1,10 à 1,77]).
L'étude Heart and Estrogen/Progestin Replacement Study (HERS et HERS II), une étude prospective, randomisée, contrôlée par placebo a montré, chez plus de 1'300 femmes ménopausées souffrant déjà d'une cardiopathie coronarienne (âge moyen à l'inclusion dans l'étude: 67 ans) qui avaient reçu un THS oral avec des estrogènes conjugués et de l'AMP pendant 4,1 ans (HERS) et 2,7 ans (HERS II) en moyenne, qu'il n'y avait aucune réduction du risque cardiovasculaire. Le risque relatif était de 0,99 (IC à 95%: 0,84 à 1,17). Le risque était le plus élevé durant la première année qui suivait le début du THS (RR 1,52 [IC à 95%: 1,01 à 2,29]).
On ne dispose que de données limitées concernant le THS débuté à un âge relativement jeune (p.ex. avant 55 ans). Celles-ci indiquent que l'augmentation du risque cardio-vasculaire sous THS chez les patientes plus jeunes ménopausées depuis peu pourrait être plus faible que dans la population (généralement plus âgée) étudiée dans le cadre des études mentionnées ci-dessus. Cela n'est toutefois pas le cas pour les événements cérébro-vasculaires.
Le risque relatif d'accidents cérébro-vasculaires est indépendant de l'âge ou du temps écoulé depuis la ménopause. Le risque de base d'AVC étant cependant fortement corrélé à l'âge, le risque global augmente chez les femmes sous THS à mesure qu'elles avancent en âge.
Chez les femmes qui présentent déjà des facteurs de risque de survenue d'événements cardiovasculaires ou cérébro-vasculaires, on envisagera des traitements alternatifs.
Thromboembolies veineuses (TEV)
Le THS est associé à un risque accru de TEV, p.ex. de thrombose veineuse profonde ou d'embolie pulmonaire.
Deux études randomisées contrôlées (HERS et WHI) et plusieurs études épidémiologiques ont montré que le risque est 2 à 3 fois plus élevé chez les femmes utilisant un THS que chez les femmes n'ayant jamais reçu un tel traitement. L'étude WHI a révélé en particulier une augmentation de l'incidence des embolies pulmonaires. L'augmentation du risque absolu chez les femmes traitées par le THS a été de 8 cas pour 10'000 années-personnes (15 vs 7) et le risque relatif s'est élevé à 2,13 (IC 95% 1,39 à 3,25).
L'augmentation du risque n'a été retrouvée que chez les femmes sous THS et n'existait pas chez les femmes ayant utilisé antérieurement un THS. Le risque semble plus élevé dans les premières années de l'utilisation.
Pour les non-utilisatrices, on estime que le nombre de cas de TEV survenant pendant une période de 5 ans est de 3 cas pour 1'000 femmes pour le groupe d'âge des 50–59 ans et de 8 cas pour 1'000 femmes pour le groupe d'âge des 60–69 ans. Chez les femmes saines qui ont utilisé un THS pendant 5 ans, 2 à 6 cas supplémentaires pour 1'000 femmes surviennent dans le groupe d'âge des 50–59 ans et 5 à 15 cas supplémentaires dans le groupe d'âge des 60–69 ans.
Le produit devra être immédiatement arrêté en cas d'apparition de symptômes évocateurs ou d'une suspicion de TEV. Les patientes présentant des facteurs de risque d'événements thromboemboliques devront être surveillées attentivement. Chez ces femmes, le rapport bénéfice/risque devra être soigneusement évalué et d'autres traitements devront, si possible, être envisagés.
Les facteurs de risque connus de thromboembolies veineuses comprennent des antécédents personnels ou familiaux positifs (la survenue d'une TEV chez un proche parent d'âge relativement jeune peut suggérer une prédisposition génétique), un tabagisme, un surpoids important, un lupus érythémateux disséminé et des affections malignes.
Chez les femmes qui présentent une combinaison de facteurs de risque ou un degré de gravité assez élevé d'un facteur de risque individuel, on tiendra compte du fait que le risque peut être augmenté de façon plus qu'additive. Selon les circonstances, il peut en résulter une contre-indication au THS.
Le risque de survenue d'un événement thromboembolique veineux peut temporairement s'accroître lors d'une immobilisation prolongée, d'une intervention chirurgicale majeure ou après un traumatisme grave. Chez les femmes sous substitution hormonale, il convient d'accorder une grande attention aux mesures prophylactiques afin d'éviter des thromboembolies veineuses postopératoires. Selon la nature de l'intervention et la durée de l'immobilisation, il faut envisager une interruption temporaire du THS, si possible quelques semaines (4 à 6 semaines) avant l'intervention en cas d'opération élective. Le traitement ne sera repris qu'une fois que la patiente aura retrouvé une mobilité complète.
Démence
Dans l'étude Women's Health Initiative Memory Study (WHIMS), une sous-étude de l'étude WHI, randomisée, contrôlée par placebo, plus de 2'000 femmes âgées de >65 ans (âge moyen: 71 ans) ont été traitées par voie orale avec des estrogènes équins conjugués et l'acétate de médroxyprogestérone et suivies pendant 4 ans en moyenne.
En outre, 1'464 femmes hystérectomisées âgées de 65 à 79 ans ont été traitées avec des estrogènes équins conjugués seuls oraux et suivies pendant 5,2 ans en moyenne. Ni le traitement avec les estrogènes conjugués et l'acétate de médroxyprogestérone ni la monothérapie d'estrogènes n'ont exercé un effet bénéfique sur la fonction cognitive. Le risque de survenue d'un trouble des performances cérébrales (démence probable) était même augmenté pour le THS combiné (RR 2,05 [IC à 95%: 1,21 à 3,48]). En chiffres absolus, cela signifie par année 23 cas supplémentaires pour 10'000 femmes traitées.
Bien que l'on ignore dans quelle mesure ces résultats peuvent être extrapolés à une population plus jeune ou à des préparations de THS à base d'autres principes actifs, ils doivent être pris en compte par le médecin lors de l'évaluation du rapport bénéfice/risque d'un THS.
Autres précautions
Les estrogènes peuvent provoquer une rétention liquidienne. Les patientes atteintes d'affections susceptibles de s'aggraver lors d'une rétention liquidienne (telles qu'insuffisance cardiaque ou rénale, asthme, épilepsie ou migraine) doivent donc être étroitement surveillées.
Chez les patientes qui présentent déjà une hypertriglycéridémie (en particulier familiale), une nouvelle augmentation des triglycérides peut se produire ce qui augmente le risque de pancréatite.
Il n'y a pas de relation définitive, documentée jusqu'à présent, entre l'utilisation d'un THS et l'apparition d'une hypertension clinique. Une légère élévation de la tension artérielle a été observée chez des femmes sous THS; les hausses d'importance clinique sont cependant rares. En cas d'élévation durable des valeurs de la pression artérielle dans le cadre d'un THS, il faut envisager d'arrêter le traitement.
On contrôlera régulièrement la tension artérielle des patientes traitées simultanément par Progynova/Progynova mite et par des médicaments antihypertenseurs.
Des études cliniques ont montré que le THS a une influence sur la résistance périphérique à l'insuline et la tolérance au glucose. Néanmoins, il n'est généralement pas nécessaire d'ajuster le traitement antidiabétique. Une surveillance étroite de la glycémie est cependant nécessaire chez les femmes diabétiques recevant un THS.
Les femmes présentant des dysfonctions hépatiques, par exemple une hyperbilirubinémie, telle que dans le syndrome de Dubin-Johnson ou le syndrome de Rotor, doivent faire l'objet d'une surveillance attentive avec contrôle des paramètres hépatiques. Le THS doit être arrêté en cas de détérioration des valeurs hépatiques.
Après la disparition d'une hépatite virale, il faut attendre 6 mois environ avant d'utiliser des hormones sexuelles. Dans ce cas également, on contrôlera les paramètres hépatiques.
On sait que les estrogènes peuvent augmenter la lithogénicité de la bile. Chez certaines femmes, le risque de maladies vésiculaires (surtout cholélithiase) est de ce fait augmenté sous une estrogénothérapie.
Chez les femmes atteintes d'un prolactinome, une surveillance médicale étroite est requise (y compris une détermination du taux de prolactine à intervalles réguliers) car des cas isolés d'augmentation de la taille du prolactinome ont été rapportés sous traitement d'estrogènes.
Chez les patientes en insuffisance rénale, ou souffrant de maladies osseuses métaboliques accompagnées d'une hypercalcémie, n'utiliser Progynova/Progynova mite qu'après avoir soigneusement évalué les bénéfices et les risques. Ceci vaut par ailleurs pour toutes les spécialités à base d'estrogènes.
Quelques patientes sous THS peuvent connaître des effets indésirables consécutifs à la stimulation estrogénique, tels que des saignements anormalement abondants. Des saignements irréguliers persistants ou fréquents sont les signes d'une activité endométriale et doivent être élucidés à l'aide de moyens diagnostics appropriés, afin d'exclure des maladies organiques.
Les myomes utérins peuvent augmenter de volume sous une estrogénothérapie. Dans un tel cas, le traitement doit être arrêté.
L'arrêt du traitement est recommandé si une endométriose est réactivée au cours d'un THS.
Une exposition à la monothérapie estrogénique peut entraîner des modifications précancéreuses ou cancéreuses dans des foyers endométriosiques résiduels. Chez les patientes ayant subi une hystérectomie en raison d'une endométriose et soupçonnées de présenter des foyers endométriosiques résiduels, l'association de l'estrogénothérapie à un progestatif doit donc être envisagée.
Chez les femmes souffrant d'un angio-œdème héréditaire, les estrogènes exogènes peuvent induire ou aggraver les symptômes de l'angio-œdème.
Un chloasma peut apparaître occasionnellement, surtout chez les femmes ayant une anamnèse de chloasma gravidique. Les patientes ayant une tendance au chloasma devraient s'abstenir de s'exposer au soleil ou à un autre rayonnement ultraviolet pendant le traitement.
Progynova/Progynova mite n'a pas d'effet contraceptif. Le cas échéant, des méthodes de contraception non hormonales doivent être utilisées.
Chaque dragée de Progynova/Progynova mite contient environ 46 mg respectivement 47 mg de lactose. Les patientes qui sont atteintes d'une intolérance au galactose, une maladie héréditaire rare, d'un déficit en Lapp-lactase ou d'une malabsorption du glucose-galactose et qui suivent un régime sans lactose doivent tenir compte de ces quantités.
Interactions
Afin de connaître les éventuelles interactions, il est recommandé de consulter également l'information professionnelle des médicaments co-administrés.
Interactions pharmacocinétiques
Effets d'autres médicaments sur la pharmacocinétique de Progynova/Progynova mite
Inducteurs enzymatiques
Une augmentation de la clairance des hormones sexuelles due à une induction des enzymes hépatiques peut entraîner une baisse des concentrations plasmatiques d'estrogènes, ce qui diminue l'efficacité clinique et provoque éventuellement des saignements intermittents. Ces substances comprennent entre autres les barbituriques, le bosentan, la carbamazépine, le felbamate, le modafinil, l'oxcarbazépine, la phénytoïne, la primidone, la rifabutine, la rifampicine, le topiramate et les médicaments contenant du millepertuis (Hypericum perforatum). Une induction enzymatique peut déjà être observée après quelques jours seulement et persister pendant au moins 4 semaines ou plus après l'arrêt de ces médicaments. L'induction enzymatique maximale intervient généralement après quelques semaines.
Inhibiteurs enzymatiques
Inhibiteurs forts et modérés du CYP3A4 comme les antifongiques azolés (p.ex. itraconazole, voriconazole, fluconazole), les macrolides (clarithromycine, érythromycine), le diltiazem, le vérapamil et le jus de pamplemousse peuvent augmenter les taux plasmatiques des estrogènes.
Substances actives ayant une influence variable sur la clairance des hormones sexuelles
Divers inhibiteurs de la protéase du VIH/VHC et inhibiteurs non nucléosidiques de la transcriptase inverse peuvent augmenter ou abaisser les concentrations plasmatiques d'estrogènes s'ils sont utilisés en concomitance avec un THS. Dans certains cas, ces modifications peuvent être cliniquement significatives.
Cycle entéro-hépatique
En cas de prise simultanée et sur une courte durée (jusqu'à 10 jours) d'antibiotiques qui n'interagissent pas avec le système enzymatique du CYP3A4, aucune interaction pharmacocinétique n'est à prévoir. En cas de co-médication de longue durée avec des antibiotiques (p.ex. en cas de borréliose ou d'ostéomyélite), les données d'interaction actuellement disponibles sont insuffisantes. Dans ce cas, une réduction des taux de substances actives due une action sur le cycle entéro-hépatique n'est pas à exclure.
Influence de Progynova/Progynova mite sur la pharmacocinétique d'autres médicaments
Les hormones sexuelles peuvent également influencer la pharmacocinétique d'autres médicaments. Leurs concentrations plasmatiques peuvent donc être soit augmentées (p.ex. cyclosporine) soit diminuées (p.ex. lamotrigine, voir ci-dessous).
Une étude d'interactions avec la lamotrigine, un antiépileptique, et un contraceptif oral combiné (30 µg d'éthinylestradiol/150 µg de lévonorgestrel) a montré une augmentation cliniquement significative de la clearance de la lamotrigine, accompagnée d'une diminution significative correspondante de la concentration plasmatique de lamotrigine, lors d'une administration concomitante de ces médicaments. Une telle diminution des concentrations plasmatiques peut s'accompagner d'une réduction du contrôle des crises. Un ajustement de la dose de lamotrigine peut donc s'avérer nécessaire.
Aucun autre contraceptif hormonal ou THS n'a été évalué. On s'attend cependant à ce que de telles préparations présentent un potentiel d'interactions comparable. Lorsqu'un traitement par Progynova/Progynova mite est nouvellement instauré chez une patiente prenant de la lamotrigine, un ajustement de la dose de lamotrigine peut donc s'avérer nécessaire et les concentrations de lamotrigine doivent être surveillées étroitement au début du traitement.
Il faut notamment tenir compte du fait que la concentration de lamotrigine peut à nouveau augmenter à l'arrêt du traitement par Progynova/Progynova mite. La patiente doit donc également être surveillée durant cette phase, et la dose de lamotrigine doit éventuellement être réduite.
L'action d'anticoagulants oraux administrés simultanément peut se trouver renforcée.
Interactions dont le mécanisme n'est pas connu
Dans les études cliniques, la co-administration de contraceptifs combinés à base d'éthinylestradiol et de l'association ombitasvir/paritaprévir/ritonavir avec ou sans dasabuvir, utilisée dans le traitement des infections par le VHC, a entraîné nettement plus souvent une augmentation cliniquement significative des ALAT (pouvant atteindre plus de cinq fois la limite supérieure de la normale dans certains cas) par rapport aux patientes traitées exclusivement par des antiviraux. Lors de l'utilisation d'autres estrogènes (notamment l'estradiol et le valérate d'estradiol), l'incidence d'augmentation des transaminases n'a pas été en revanche plus élevée que chez les patientes non traitées par estrogénothérapie. En raison du nombre restreint de patientes ayant pris d'autres médicaments de ce type à base d'estrogènes, la prudence est de mise en cas de co-administration d'estrogènes et de l'association ombitasvir/paritaprévir/ritonavir, avec ou sans dasabuvir.
Grossesse/Allaitement
L'utilisation de Progynova/Progynova mite est contre-indiquée pendant la grossesse. En cas de survenue ou de suspicion d'une grossesse pendant le traitement, la patiente devra arrêter immédiatement le médicament et consulter le médecin.
Des expérimentations animales indiquent l'existence de risques fœtaux. La plupart des études épidémiologiques effectuées à ce jour n'ont toutefois pas clairement mis en évidence d'effet embryotoxique ou tératogène qui résulterait de l'administration accidentelle d'estrogènes pendant la grossesse.
Progynova/Progynova mite n'a aucune indication en période d'allaitement.
Le médicament ne doit pas être pris pendant la période d'allaitement, car il peut réduire la production de lait et altérer sa qualité; en outre, de faibles concentrations du principe actif peuvent être mesurées dans le lait.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude correspondante n'a été effectuée. Une influence de Progynova/Progynova mite sur l'aptitude à la conduite ou à l'utilisation de machines est improbable, voir cependant la rubrique «Effets indésirables».
Effets indésirables
Les effets indésirables graves en rapport avec l'administration d'un THS sont également décrits dans la rubrique (à lire) «Mises en garde et précautions».
Ci-après sont mentionnés les effets indésirables qui ont été observés sous Progynova ou Progynova mite dans le cadre des études cliniques et/ou de la surveillance postcommercialisation, par système d'organe et par fréquence. Les catégories de fréquence sont définies comme suit: fréquent (≥1/100 à <1/10); occasionnel (≥1/1'000 à <1/100), rares (≥1/10'000 et <1/1'000); fréquence inconnue (la fréquence exacte ne peut être estimée essentiellement sur la base des rapports spontanés issus de la surveillance postcommercialisation).
Affections du système immunitaire
Occasionnels: réactions d'hypersensibilité.
Troubles du métabolisme et de la nutrition
Fréquents: prise ou perte de poids.
Affections du système nerveux
Fréquents: céphalées, vertiges.
Occasionnel: migraine.
Affections vasculaires
Fréquence inconnue: événements thromboemboliques veineux et artériels.
Affections gastro-intestinales
Fréquents: ballonnements, nausées.
Affections de la peau et du tissu sous-cutané
Fréquents: éruptions cutanées, prurit.
Occasionnels: érythème noueux, urticaire.
Rares: hirsutisme, acné.
Affections musculo-squelettiques et systémiques
Occasionnels: crampes musculaires.
Affections des organes de reproduction et du sein
Fréquents: saignements anormaux (y compris hémorragies de rupture et spotting), sensation de tension dans les seins, douleurs du bas-ventre.
Occasionnels: augmentation du volume des seins.
Troubles généraux
Fréquents: œdèmes.
Les effets indésirables suivants ont en outre été rapportés avec d'autres préparations de THS: induction ou aggravation d'un angio-œdème héréditaire, hypertriglycéridémie, anxiété, nervosité, sautes d'humeur, modifications de la libido, dépression, troubles de la vue, palpitations, augmentation de la pression artérielle, vomissements, dyspepsie, valeurs anormales des tests de la fonction hépatique, cholélithiase, ictère cholestatique, aggravation d'une porphyrie, chloasma (éventuellement persistant), alopécie, érythème polymorphe, purpura vasculaire, douleurs dorsales, douleurs mammaires, leucorrhée, augmentation de la taille de myomes utérins, hyperplasie endométriale.
Surdosage
En raison de la faible toxicité de l'estradiol, on ne doit pas craindre une intoxication même en cas de prise unique accidentelle d'une dose multiple de la dose thérapeutique.
Un surdosage aigu peut entraîner des céphalées, des nausées, des vomissements, une tension mammaire et des saignements utérins.
En cas de surdosage chronique, il faut s'attendre à une augmentation des effets indésirables et des risques décrits sous «Mises en garde et précautions».
Il n'existe pas d'antidote spécifique. Le cas échéant, le traitement doit être symptomatique.
Propriétés/Effets
Code ATC: G03CA03
Mécanisme d'action
La baisse du taux d'estrogènes s'accentue après la ménopause. Le tableau clinique du syndrome de carence estrogénique se caractérise par des symptômes végétatifs, psychiques et organiques (p.ex. des bouffées de chaleur, des crises sudorales, une tachycardie, des vertiges, des insomnies et une humeur dépressive). Les modifications organiques les plus importantes sont une atrophie de la peau et des muqueuses et l'ostéoporose.
Les altérations atrophiques peuvent, p.ex., contribuer à une vulnérabilité accrue des organes génitaux et, au niveau du tractus urogénital, à des troubles de la miction. Une estrogénothérapie systémique permet de traiter efficacement les troubles végétatifs, psychiques et organiques. Des examens cytologiques de l'épithélium vaginal ont permis d'établir que Progynova entraîne une substitution suffisante du déficit estrogénique.
Chez les patientes ne présentant aucune symptomatologie vasomotrice, les estrogènes n'éliminent ni les variations d'humeur ni les états dépressifs.
Indépendamment de la voie d'administration, les estrogènes exercent, à la posologie provoquant une amélioration des symptômes climatériques, une forte action stimulante sur la mitose et la prolifération de l'endomètre. Une monothérapie estrogénique augmente la fréquence des hyperplasies de l'endomètre et le risque de cancer de l'endomètre. Une telle hyperplasie peut être évitée en protégeant l'endomètre par l'administration d'un progestatif suffisamment dosé pendant au moins 12 jours par mois.
Pharmacocinétique
Valérate d'estradiol
Absorption
Le valérate d'estradiol est absorbé rapidement et complètement après une administration orale. Le clivage de l'ester stéroïdien en estradiol et en acide valérianique a lieu déjà dans la paroi intestinale et lors du premier passage hépatique. En raison du métabolisme de premier passage, la biodisponibilité de l'estradiol n'est que d'environ 3%.
Les concentrations plasmatiques maximales d'estradiol sont en général atteintes 4 à 9 heures après la prise du comprimé.
État stationnaire (steady state)
On a observé des taux sériques d'estradiol environ deux fois plus élevés après une prise répétée qu'après une dose unique. À l'état stationnaire, la Cmin est d'environ 30 pg/ml, la Cmax d'environ 60 pg/ml en moyenne.
Distribution
Dans le plasma, environ 60% de l'estradiol sont liés à l'albumine et près de 40% sont liés à la SHBG. Seulement 1 à 1,5% de l'estradiol se trouve dans le plasma sous forme de substance libre.
Le volume apparent de distribution de l'estradiol après une administration intraveineuse unique est d'environ 1 l/kg.
L'estradiol traverse la barrière placentaire. Seul un faible pourcentage de l'estradiol et de ses métabolites passe dans le lait maternel.
Métabolisme
Après le clivage de l'ester du valérate d'estradiol a lieu un important métabolisme de l'estradiol, impliquant le CYP34A, dans le foie et la paroi intestinale, principalement en estrone, estriol et sulfate d'estrone, qui suit les voies de biotransformation de l'estradiol endogène.L'estrone, principal métabolite actif, atteint des concentrations plasmatiques 8 fois supérieures à celles de l'estradiol, et le sulfate d'estrone des concentrations plasmatiques 150 fois supérieures.
La clairance métabolique de l'estradiol est d'environ 10 à 30 ml/min/kg.
Élimination
Les métabolites de l'estradiol sont conjugués à environ 90% en glucuronides ou en sulfates et sont excrétés par voie urinaire, avec une demi-vie d'environ un jour. Seuls environ 10% des métabolites sont éliminés par les fèces et sont soumis à un cycle entéro-hépatique.
Après la fin du traitement, des taux d'estradiol correspondant à ceux d'avant le traitement sont atteints en 2 à 3 jours.
Cinétique pour certains groupes de patients
Altération de la fonction rénale: la pharmacocinétique de Progynova/Progynova mite n'a pas été étudiée chez des patientes souffrant d'insuffisance rénale.
Altération de la fonction hépatique: la pharmacocinétique de Progynova/Progynova mite n'a pas été étudiée chez des patientes souffrant d'insuffisance hépatique. On sait toutefois que la dégradation métabolique de l'estradiol est ralentie en cas de troubles de la fonction hépatique (voir également «Mises en garde et précautions»).
Données précliniques
Cancérogénicité
Des études précliniques examinant la toxicité après des doses répétées, la génotoxicité et le potentiel carcinogène de l'estradiol n'ont pas démontré clairement un risque particulier pour l'être humain, quand bien même des études épidémiologiques et des études chez l'animal ont démontré un risque accru de carcinogénicité sous estradiol.
Embryotoxicité/tératogénicité
Les études toxicologiques de reproduction réalisées chez le rat, la souris et le lapin n'ont pas mis en évidence de potentiel tératogène. Concernant les risques pour l'être humain, voir «Grossesse/Allaitement».
Mutagénicité
Des études in vitro et in vivo effectuées avec le 17β-estradiol n'ont pas mis en évidence de potentiel mutagène.
Remarques particulières
Influence sur les méthodes de diagnostic
Les hormones sexuelles peuvent modifier les résultats de certains examens de laboratoire, tels que les paramètres biochimiques hépatiques et thyroïdiens, de la fonction cortico-surrénalienne et rénale, les taux plasmatiques des protéines de liaison et des fractions lipidiques ou lipoprotéiniques, ainsi que les paramètres du métabolisme glucidique, de la coagulation et de la fibrinolyse. Les modifications demeurent généralement dans la plage de référence.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques concernant le stockage
Conserver à température ambiante (15–25 °C).
Tenir hors de portée des enfants.
Numéro d’autorisation
33149 (Swissmedic).
Titulaire de l’autorisation
Bayer (Schweiz) AG, Zurich.
Mise à jour de l’information
Mai 2019.
Відгуки (0)
Ви переглядали

Безкоштовна консультація досвідченого спеціаліста
Опишіть симптоми або потрібний продукт - ми допоможемо підібрати його дозування або аналог, оформити замовлення з доставкою додому або просто проконсультуємо.
Нас 14 спеціалістів і 0 ботів. Ми завжди будемо з вами на зв'язку і зможемо зв'язатися в будь-який час.




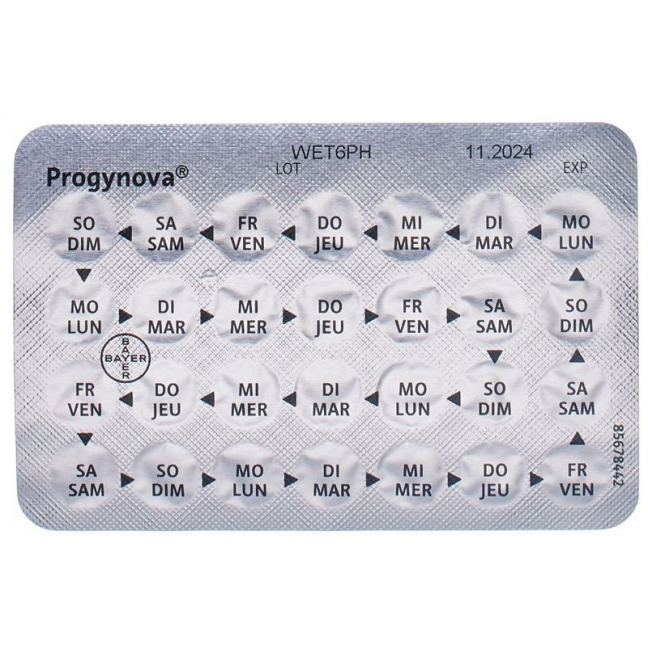


 Deutsch
Deutsch French
French Italian
Italian




























