Филграстим Тева раствор для инъекций 30 млн ЕД / 0,5 мл 1 предварительно наполненный шприц 0,5 мл
Filgrastim-Teva Injektionslösung 30 Mio E / 0.5 ml 1 Fertigsprit
-
23977.20 RUB
При оплате криптовалютой:
Ваша прибыль 2397.72 RUB / 27.02 USDT
- Наличие: Нет в наличии
- Производитель: Mepha Schweiz AG
- Модель: 4494766
- ATC-код L03AA02
- EAN 7680607220013
Описание
состав
активные ингредиенты
Филграстим (Г-КСФ). Производится биотехнологически из бактерий кишечной палочки.
Г-КСФ расшифровывается как: рекомбинантный негликозилированный человеческий метионин гранулоцитарный колониестимулирующий фактор.
вспомогательные вещества
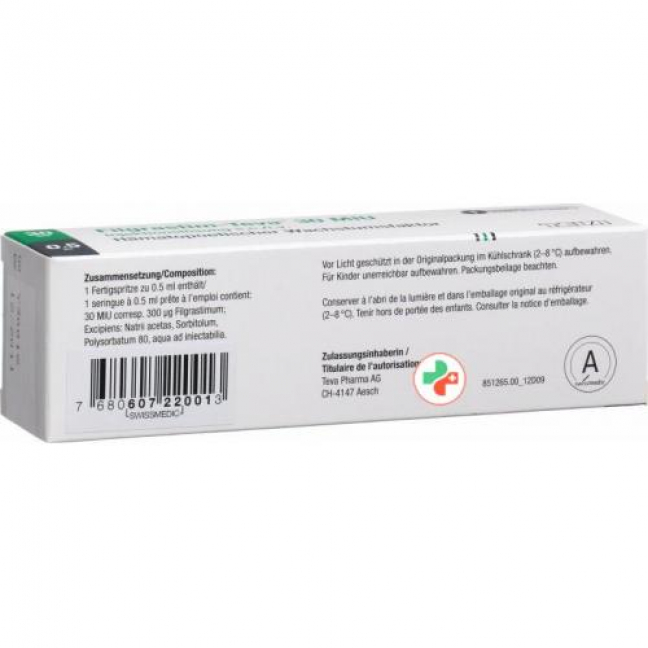
Филграстим Тева 30: натрия ацетат* (максимум 0,026 мг натрия), сорбитол (Е420) 25 мг, полисорбат 80, вода для инъекций.
Филграстим Тева 48: натрия ацетат* (максимум 0,042 мг натрия), сорбитол (Е420) 40 мг, полисорбат 80, вода для инъекций.
*Ацетат натрия получают титрованием 99% уксусной кислоты гидроксидом натрия.
Лекарственная форма и количество действующего вещества на единицу
Раствор для инъекций в предварительно наполненных шприцах.
Филграстим-Тева 30: 1 предварительно наполненный шприц (0,5 мл раствора для инъекций) содержит 30 млн ЕД (эквивалентно 300 мкг) филграстима.
Филграстим-Тева 48: 1 предварительно наполненный шприц (0,8 мл раствора для инъекций) содержит 48 млн ЕД (эквивалентно 480 мкг) филграстима.
Показания/Возможные области применения
Филграстим Тева показан при:
- Сокращение продолжительности и уменьшение тяжести нейтропении у пациентов (взрослых и детей), получавших по поводу злокачественных новообразований высокоэффективную миелосупрессивную цитотоксическую химиотерапию (исключая хронический миелоидный лейкоз и миелодиспластический синдром).
- Рандомизированных исследований у детей с острым миелоидным лейкозом не проводилось, но есть последовательные неконтролируемые или нерандомизированные исследования.
- Сокращение продолжительности нейтропении при высокодозной цитотоксической химиотерапии с последующей аутологичной или аллогенной трансплантацией костного мозга.
- Мобилизация клеток-предшественников периферической крови (ПКПК).
- Длительное применение для увеличения числа нейтрофилов и снижения инфекций у детей и взрослых с клинически значимыми инфекциями в течение последних 12 мес и нейтропенией ANC <0,5×10 9 / л трижды документировано при тяжелой врожденной нейтропении, циклической нейтропении и идиопатической нейтропении.
- Лечение персистирующей нейтропении (ANC ≤1,0 x 10 9 /л) у пациентов с прогрессирующей ВИЧ-инфекцией для снижения риска бактериальной инфекции, когда другие варианты лечения нейтропении не подходят.
Дозировка/применение
Только для использования врачами-специалистами.
Пациенты, получающие цитотоксическую химиотерапию по поводу злокачественных новообразований
дозировка
Рекомендуемая доза Филграстима Тева составляет 0,5 МЕ. (5 мкг) на килограмм массы тела в сутки. Лечение Филграстимом Тева следует начинать не менее чем через 24 часа после проведения цитотоксической химиотерапии.
Содержимое одного предварительно наполненного шприца Филграстима Тева 30 (60 млн ЕД/мл) соответствует суточной дозе, необходимой для пациента с массой тела 60 кг. Содержимое одного предварительно наполненного шприца Филграстим-Тева 48 соответствует необходимой суточной дозе для пациента с массой тела 96 кг.
продолжительность лечения
Ежедневное введение Филграстима Тева следует продолжать до тех пор, пока ожидаемое количество нейтрофилов не вернется к нормальному диапазону после надира. После проверенной стандартной химиотерапии солидных опухолей, лимфом и лимфатической лейкемии можно ожидать период лечения до 14 дней. После индукционной и консолидирующей терапии острого миелоидного лейкоза продолжительность лечения может быть значительно больше (до 38 дней) в зависимости от типа, дозы и режима дозирования используемой цитотоксической химиотерапии.
У пациентов, получающих цитотоксическую химиотерапию, транзиторное увеличение количества нейтрофилов обычно наблюдается через 1–2 дня после начала лечения. Однако для достижения устойчивого терапевтического эффекта прием Филграстима Тева не следует прекращать до тех пор, пока не пройдет ожидаемый минимум и количество нейтрофилов не вернется к нормальному диапазону. Прекращение лечения Филграстимом Тева до достижения ожидаемого минимума не рекомендуется. Если количество нейтрофилов достигло 1,0×10 9 /л после прохождения надира (наименьшее падение), лечение следует прекратить.
Способы введения
Филграстим Тева можно вводить в виде ежедневной подкожной инъекции или ежедневной внутривенной инфузии в течение 30 минут после разведения 5% раствором глюкозы (см. «Инструкции по разведению» в разделе «Дополнительная информация»).
В большинстве случаев предпочтительно подкожное введение. Имеются данные исследования однократной дозы, что внутривенное введение может сократить продолжительность действия. Клиническое значение этого наблюдения в отношении многократного введения не выяснено.
Пациенты, получавшие цитотоксическую химиотерапию с последующей трансплантацией костного мозга
дозировка
Рекомендуемая начальная доза Филграстима Тева составляет 1,0 МЕ. (10 мкг) на килограмм массы тела в сутки. Первое лечение препаратом Филграстим-Тева следует проводить не ранее чем через 24 часа после введения цитотоксической химиотерапии и не позднее чем через 24 часа после трансплантации костного мозга.
продолжительность лечения
Эффективность и безопасность филграстима при применении по этому показанию более 28 дней не установлены.
коррекция дозы
После того, как количество нейтрофилов превысит надир (минимально возможное падение), суточную дозу Филграстима Тева следует скорректировать в соответствии с изменениями показателей крови следующим образом:
количество нейтрофилов | Коррекция дозы Филграстима Тева |
|---|---|
>1,0×10 9 /л в течение 3 дней подряд | Снизить дозу до 0,5 МЕ. |
Если АЧН >1,0×10 9 /л еще 3 дня | Прекратить прием Филграстима Тева. |
Если во время курса лечения АЧН падает ниже 1,0 x 10 9 /л , дозу Филграстима Тева следует снова увеличить в соответствии с описанными выше шагами. | |
ANC = абсолютное количество нейтрофилов
Введение
Филграстим Тева вводят в виде внутривенной инфузии в течение 30 минут или 24 часов или в виде непрерывной подкожной капельницы в течение 24 часов. Филграстим Тева следует разводить 20 мл 5% раствора глюкозы (см. «Примечания по разведению» в разделе «Прочая информация»).
Мобилизация клеток-предшественников периферической крови (ПКПК)
Мобилизация стволовых клеток периферической крови у пациентов, получающих миелосупрессивную терапию с последующей аутологичной трансфузией ПКГМП с трансплантацией костного мозга или без нее, или у пациентов, проходящих апластическую терапию с последующей инфузией ПКГПК
дозировка
Рекомендуемая доза Филграстима Тева составляет 1,0 МЕ. (10 мкг) на килограмм массы тела в сутки в течение 5–7 дней подряд.
продолжительность лечения
Обычно бывает достаточно одного-двух сеансов лейкафереза на 5-й и 6-й дни. При определенных обстоятельствах может потребоваться дополнительный лейкаферез. Лечение Филграстимом Тева следует продолжать до последнего лейкафереза.
Тип заявления
Филграстим Тева можно вводить либо в виде непрерывной подкожной инфузии в течение 24 часов, либо в виде однократной подкожной инъекции. Для инфузий Филграстим Тева следует развести в 20 мл 5% раствора глюкозы (см. «Инструкции по разведению» в разделе «Дополнительная информация»).
Мобилизация ПБПК после миелосупрессивной химиотерапии
дозировка
Рекомендуемая доза Филграстима Тева составляет 0,5 МЕ. (5 мкг) на килограмм массы тела в день с первого дня после окончания химиотерапии до тех пор, пока не будет пройден ожидаемый надир (минимальное падение) и количество нейтрофилов не вернется к нормальным значениям. Лейкаферез следует проводить в период, когда абсолютное число нейтрофилов (АНЧ) увеличивается от <0,5×10 9 /л до >5,0×10 9 /л. Лейкафереза часто бывает достаточно для пациентов, ранее не подвергавшихся обширной химиотерапии. В противном случае рекомендуется дополнительный лейкаферез.
У пациентов, ранее получавших обширную миелосупрессивную терапию и получавших Филграстим Тева для мобилизации ПСКГ, может быть недостаточно ПСКПК для получения минимального рекомендуемого выхода (минимальный общий выход из образцов лейкафереза: от ≥10 до 30 × 10 4 GM-CFC/кг или от ≥1 до 2,5×10 6 CD34 + клеток/кг).
Тип заявления
Филграстим Тева вводится подкожно.
Мобилизация ПКГПК здоровых доноров для аллогенной трансплантации
Мобилизация клеток-предшественников должна проводиться только под наблюдением центров, имеющих опыт получения клеток-предшественников от здоровых доноров.
дозировка
Рекомендуемая доза Филграстима Тева составляет 1,0 МЕ. (10 мкг) на килограмм массы тела в сутки в течение 4–5 дней подряд. Лейкаферез следует начинать на 5-й день и продолжать до 6-го дня, если необходимо собрать 4×10 6 CD34 + клеток на кг массы тела реципиента.
Безопасность и эффективность Филграстима Тева у здоровых доноров младше 16 лет или старше 60 лет не установлены.
Тип заявления
Филграстим Тева вводится подкожно.
Пациенты с тяжелой врожденной нейтропенией, циклической нейтропенией и идиопатической нейтропенией
дозировка
Врожденная нейтропения: рекомендуемая начальная доза Филграстима Тева составляет 1,2 МЕ. (12 мкг) на килограмм массы тела в сутки в виде однократной или разделенной дозы.
Идиопатическая или циклическая нейтропения: рекомендуемая начальная доза Филграстима Тева составляет 0,5 МЕ. (5 мкг) на килограмм массы тела в сутки в виде однократной или разделенной дозы.
коррекция дозы
Доза должна подбираться индивидуально для каждого пациента таким образом, чтобы было достигнуто минимальное значение КЧН 1,5×10 9 /л.
Длительное ежедневное дозирование показано для поддержания адекватного количества нейтрофилов. Дозу следует удвоить, если целевой АЧН 1,5 × 10 9 /л не достигается через 1–2 недели, и уменьшить вдвое, если АЧН превышает 10,0 × 10 9 /л. Пациентам с тяжелыми инфекциями показано более быстрое увеличение дозы. Дозы более 14,5 МЕ. (145 мкг) на килограмм массы тела в день безопасно и хорошо переносится.
Тип заявления
Филграстим Тева вводится подкожно.
Больные ВИЧ-инфекцией
дозировка
Для коррекции нейтропении
Рекомендуемая начальная доза Филграстима Тева составляет 0,1 МЕ. (1 мкг) на килограмм массы тела в сутки с титрованием максимально до 0,4 млн ЕД. (4 мкг) на килограмм массы тела в день до тех пор, пока количество нейтрофилов не нормализуется и не сможет поддерживаться на этом уровне (ANC>2,0×10 9 /л). В клинических испытаниях >90% пациентов ответили на эту дозу и достигли нормального числа нейтрофилов в среднем в течение 2 дней.
У небольшого числа пациентов (<10%) дозы до 1,0 МЕ. (10 мкг) на килограмм массы тела в сутки требуется для устранения нейтропении.
Для поддержания нормального количества нейтрофилов
После устранения нейтропении следует определить минимальную дозу, наиболее эффективную для поддержания нормального числа нейтрофилов. Рекомендуется коррекция начальной дозы, направленная на подкожное введение 300 мкг/сут через день путем подкожной инъекции. В зависимости от АЧН пациента может потребоваться дальнейшая коррекция дозы для поддержания количества нейтрофилов >2,0 × 10 9 /л. В клинических испытаниях необходимо было принимать 300 мкг в день от 1 до 7 дней в неделю, чтобы поддерживать АЧН >2,0 × 10 9 / л ; введение имело место в среднем 3 дня в неделю. Для поддержания ANC на уровне 2,0×10 9 /л может потребоваться длительное лечение .
Тип заявления
Филграстим Тева вводится подкожно.
Специальные инструкции по дозировке
Пожилые пациенты
Поскольку в настоящее время имеется небольшой опыт лечения пациентов пожилого возраста, невозможно дать специальные рекомендации по дозировке для этой группы пациентов.
Пациенты с почечной или печеночной недостаточностью
Исследования филграстима у пациентов с почечной или печеночной недостаточностью показали, что фармакокинетический или фармакодинамический профиль мало отличается от такового у здоровых добровольцев (см. Фармакокинетика). Таким образом, у таких пациентов нет необходимости в коррекции дозы.
дети и молодые люди
Рекомендации по дозированию на кг массы тела для детей, получающих миелосупрессивную цитотоксическую химиотерапию, или детей с тяжелой врожденной нейтропенией, циклической нейтропенией и идиопатической нейтропенией такие же, как и для взрослых.
Данные клинических исследований у детей показывают, что безопасность и эффективность филграстима сопоставимы у взрослых и детей, получающих миелосупрессивную химиотерапию.
65% пациентов, получавших лечение в клинических исследованиях по поводу тяжелой хронической нейтропении, были моложе 18 лет. Показана эффективность лечения в этой возрастной группе, состоящей преимущественно из больных с врожденной нейтропенией. Не было различий в профиле безопасности препарата у детей, получавших лечение по поводу тяжелой хронической нейтропении, по сравнению со взрослыми.
Для обеспечения прослеживаемости биотехнологически изготовленных лекарственных средств рекомендуется документировать торговое наименование и номер серии для каждого лечения.
противопоказания
Филграстим Тева нельзя применять у пациентов с известной повышенной чувствительностью к действующему веществу или к любому из вспомогательных веществ в соответствии с составом.
Предупреждения и меры предосторожности
ПРЕДУПРЕЖДЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ ОТНОСИТЕЛЬНО ОБЩИХ РИСКОВ И ПОБОЧНЫХ ЭФФЕКТОВ
гиперчувствительность
Сообщалось о реакциях гиперчувствительности, включая анафилаксию, у пациентов, получавших филграстим в начале или последующем лечении. Применение Филграстима Тева следует прекратить у пациентов с клинически значимой гиперчувствительностью. Филграстим Тева не следует применять у пациентов с известной гиперчувствительностью к филграстиму или пегфилграстиму.
Легочные побочные эффекты
Сообщалось о побочных реакциях со стороны легких, особенно интерстициальной пневмонии, после введения Г-КСФ. Пациенты с недавними легочными инфильтратами или пневмонией могут подвергаться повышенному риску. Возникновение таких легочных симптомов, как кашель, лихорадка и одышка в связи с рентгенологическими признаками легочных инфильтратов и ухудшением функции легких, может быть первым признаком острого респираторного дистресс-синдрома (ОРДС). Лечение Филграстимом Тева следует прекратить и начать соответствующую терапию.
гломерулонефрит
Сообщалось о развитии гломерулонефрита у пациентов, получавших филграстим и пегфилграстим. Как правило, случаи гломерулонефрита разрешались после снижения дозы или прекращения лечения филграстимом и пегфилграстимом. Рекомендуется контролировать уровень мочи.
Синдром капиллярной утечки
Синдром капиллярной утечки, который может быть опасным для жизни при задержке лечения, был описан после введения гранулоцитарных колониестимулирующих факторов и характеризуется гипотензией, гипоальбуминемией, отеком и гемоконцентрацией. Пациенты, у которых развиваются симптомы синдрома капиллярной утечки, должны находиться под тщательным наблюдением и получать стандартное симптоматическое лечение, которое может включать необходимость лечения в отделении интенсивной терапии (см. раздел «Побочные реакции»).
Спленомегалия и разрыв селезенки
Сообщалось о случаях спленомегалии, обычно бессимптомной, и случаях разрыва селезенки у пациентов и здоровых доноров после введения филграстима. Некоторые случаи разрыва селезенки заканчивались летальным исходом. Поэтому размер селезенки следует тщательно контролировать (например, при клиническом осмотре, УЗИ). Диагноз разрыва селезенки следует рассматривать у доноров и/или пациентов, жалующихся на боль в левой верхней части живота или в плече. Было обнаружено, что снижение дозы филграстима замедляет или предотвращает прогрессирование увеличения селезенки у пациентов с тяжелой хронической нейтропенией. Спленэктомия потребовалась у 3% больных.
рост злокачественных клеток
Гранулоцитарные колониестимулирующие факторы могут аналогичным образом стимулировать рост клеток немиелоидного происхождения в дополнение к росту клеток миелоидного происхождения in vitro. Поскольку клетки немиелоидных опухолей также могут экспрессировать рецепторы Г-КСФ, следует рассмотреть вопрос о прекращении лечения Г-КСФ у пациентов с недостаточным ответом на химиотерапию.
Хронический миелоидный лейкоз или миелодиспластический синдром
Безопасность и эффективность применения Филграстима Тева у пациентов с миелодиспластическим синдромом или хроническим миелоидным лейкозом не установлены. Филграстим Тева не показан для использования в этих условиях. Особая осторожность требуется при диагностическом различении бластной трансформации при хроническом миелоидном лейкозе и остром миелоидном лейкозе.
тромбоцитопения
Сообщалось о тромбоцитопении у пациентов, получавших филграстим.
Необходимо тщательно контролировать количество тромбоцитов, особенно в течение первых нескольких недель лечения Филграстимом Тева. Следует рассмотреть вопрос о временном прекращении лечения или снижении дозы Филграстима Тева у пациентов с тяжелой хронической нейтропенией, у которых развивается тромбоцитопения (количество тромбоцитов < 100 x 10 9 / л ).
лейкоцитоз
Во время лечения филграстимом в дозах более 0,3 МЕ. (3 мкг) на килограмм в сутки, изредка наблюдался лейкоцитоз 100×10 9 /л и выше. О побочных эффектах, непосредственно связанных с такой степенью лейкоцитоза, не сообщалось. Из-за возможного риска, связанного с лейкоцитозом, следует регулярно проверять количество лейкоцитов. Применение Филграстима Тева следует немедленно прекратить, если число лейкоцитов превышает 50×10 9 /л после ожидаемого наименьшего значения (наименьшее падение). Если количество лейкоцитов превышает 70 x 10 9 /л во время введения Филграстима Тева для мобилизации ПСКЖ, прием Филграстима Тева необходимо прекратить.
Транзиторный лейкоцитоз (лейкоциты >50×10 9 /л) наблюдался у 41% обследованных здоровых доноров. Число лейкоцитов >75×10 9 /л наблюдалось у 2% здоровых доноров.
иммуногенность
Как и все терапевтические белки, существует потенциальная иммуногенность.
Данные о потенциальной иммуногенности 677 пациентов доступны в исследованиях эффективности и безопасности Филграстима-Тева. После устранения ранее существовавших положительных тестов на антитела в анализе были идентифицированы только изолированные связывающие антитела.
аортит
Сообщалось об аортите у пациентов, получавших Г-КСФ (например, филграстим). Появившиеся симптомы включали лихорадку, боль в животе, недомогание, боль в спине и повышенные маркеры воспаления (например, С-реактивный белок и количество лейкоцитов). В большинстве случаев аортит был диагностирован с помощью компьютерной томографии и обычно разрешался после прекращения приема Г-КСФ (см. также раздел «Побочные реакции»).
гематурия/протеинурия
Гематурия/протеинурия возникает у небольшого числа пациентов. Поэтому показаны регулярные анализы мочи.
Вспомогательные вещества:
ацетат натрия:
Этот лекарственный препарат содержит менее 1 ммоль натрия (23 мг) на предварительно заполненный шприц, т.е. практически не содержит натрия.
Сорбитол:
Пациенты с наследственной непереносимостью фруктозы (HFI) не должны получать это лекарство, если в этом нет крайней необходимости.
У младенцев и детей младшего возраста (младше 2 лет) может еще не быть диагностирована наследственная непереносимость фруктозы (HFI). Внутривенные препараты (содержащие фруктозу) могут быть опасными для жизни и противопоказаны этой популяции, за исключением случаев крайней клинической необходимости и отсутствия альтернатив.
Перед применением этого лекарственного средства у каждого пациента следует собрать подробный анамнез симптомов HFI.
ПРЕДУПРЕЖДЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ В ОТНОШЕНИИ СОПУТСТВУЮЩИХ ЗАБОЛЕВАНИЙ
остеопороз
Рекомендуется контроль минеральной плотности костной ткани у пациентов с ранее существовавшим остеопорозом после непрерывного лечения филграстимом в течение более шести месяцев, поскольку при длительной терапии наблюдались случаи остеопороза.
Особые меры предосторожности для пациентов с серповидноклеточной анемией
Согласно публикациям, высокий уровень лейкоцитов неблагоприятен для больных серповидноклеточной анемией. По этой причине врач должен проявлять осторожность при назначении Филграстима Тева таким пациентам и внимательно следить за соответствующими лабораторными показателями. Он должен учитывать возможную связь со спленомегалией и вазоокклюзионными кризами.
У пациентов с серповидно-клеточной анемией, получавших филграстим, были зарегистрированы кризы серповидно-клеточной анемии, в том числе с летальным исходом. Поэтому следует соблюдать осторожность при лечении пациентов с серповидноклеточной анемией или серповидноклеточной анемией с помощью Филграстима Тева.
ПРЕДУПРЕЖДЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ ОТНОСИТЕЛЬНО ХИМИОТЕРАПИИ
Риски высокодозной химиотерапии
Филграстим Тева не следует применять для увеличения дозы цитотоксических химиотерапевтических средств сверх рекомендуемого режима дозирования. Особую осторожность следует проявлять при лечении больных высокодозной химиотерапией, во-первых, потому, что улучшенный ответ опухоли на такое лечение еще не продемонстрирован, а во-вторых, потому, что высокие дозы химиотерапевтических средств приводят к усилению токсических эффектов, включая кардиальные, легочные, неврологические и дерматологические эффекты (см. также техническую информацию об используемых химиотерапевтических средствах).
химиотерапия с отсроченной миелосупрессией
Эффективность филграстима при химиотерапии с отсроченной миелосупрессией, например, с азотистой мочевиной или митомицином С, или с миелосупрессивными дозами антиметаболитов, таких как 5-ФУ или цитозинарабинозид, недостаточно документирована.
Влияние химиотерапии на эритроциты и тромбоциты
Филграстим Тева значительно снижает частоту тяжелой и фебрильной нейтропении.
Тем не менее, пациент, получающий миелотоксическую химиотерапию, остается подверженным риску развития тромбоцитопении и анемии. Поэтому рекомендуется регулярно проверять количество тромбоцитов и гематокрит. Особая осторожность требуется при применении химиотерапевтических средств (самостоятельных средств и комбинаций), которые, как известно, вызывают тяжелую тромбоцитопению.
Миелодиспластический синдром и острый миелоидный лейкоз у больных раком молочной железы и легких
В постмаркетинговых обсервационных исследованиях применение филграстима в сочетании с химиотерапией и/или лучевой терапией было связано с развитием миелодиспластического синдрома (МДС) и острого миелоидного лейкоза (ОМЛ) у пациентов с раком молочной железы и легких (см. раздел «Побочные реакции»). Мониторинг пациентов для признаков и симптомов МДС / ОМЛ в этих случаях.
тромбоцитопения
Пациенты, получающие Филграстим Тева после более высоких доз миелосупрессивных химиотерапевтических средств, могут подвергаться большему риску развития тромбоцитопении.
РЕКОМЕНДАЦИИ ПО МОНИТОРИНГУ КРОВИ
Лечение только Филграстимом Тева не предотвращает тромбоцитопению и анемию, связанные с приемом миелодепрессантов.
Поскольку пациенты, получающие Филграстим Тева, могут, в принципе, получать такие препараты в более высоких дозах или в больших количествах, риск тромбоцитопении и анемии также может увеличиваться. Рекомендуется регулярный контроль анализа крови. Анемия и временное повышение уровня миелоидных стволовых клеток являются другими нарушениями анализа крови, которые также требуют тщательного наблюдения (см. также главы ПРЕДУПРЕЖДЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ ОТНОСИТЕЛЬНО ОБЩИХ РИСКОВ И ПОБОЧНЫХ ЭФФЕКТОВ Тромбоцитопения и ПРЕДУПРЕЖДЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ ОТНОСИТЕЛЬНО ХИМИОТЕРАПИИ ) .
Инфекции, вызывающие миелосупрессию
Нейтропения может быть вызвана оппортунистической инфекцией, например, вызванной вторжением комплекса Mycobacterium avium в костный мозг, или злокачественным новообразованием, таким как лимфома. У пациентов с инфильтрирующей инфекцией или злокачественным новообразованием костного мозга в дополнение к лечению нейтропении препаратом Филграстим Тева следует рассмотреть возможность соответствующего лечения основного заболевания. Механизм действия филграстима на нейтропению, связанную с вышеуказанными состояниями, изучен недостаточно.
ОСОБЫЕ ГРУППЫ ПАЦИЕНТОВ/ОСОБЫЕ ПОКАЗАНИЯ
Особые меры предосторожности для пациентов, перенесших мобилизацию ПСКПК.
Проверка выхода клеток-предшественников
При количественном определении клеток-предшественников у пациентов, получавших филграстим, особое внимание следует уделять используемому методу. Результаты определения количества клеток CD34 + с помощью проточной цитометрии зависят от точности используемой методологии. Поэтому рекомендации по цифрам, основанные на исследованиях других лабораторий, следует интерпретировать с осторожностью.
Статистические анализы указывают на сложную, но последовательную связь между количеством реинфузированных CD34 + клеток и скоростью регенерации тромбоцитов после химиотерапии высокими дозами.
Рекомендация минимального количества ≥2,0×10 6 CD34 + клеток на кг массы тела основана на опубликованном опыте, приводящем к адекватному гематологическому восстановлению. Количества, превышающие это значение, по-видимому, коррелируют с более быстрым восстановлением, меньшие количества — с более медленным восстановлением.
мобилизация
Проспективных рандомизированных сравнительных исследований двух рекомендуемых методов мобилизации периферических стволовых клеток (филграстим отдельно или в сочетании с миелосупрессивной химиотерапией) в одной и той же популяции пациентов не проводилось. Степень вариации между отдельными пациентами и между лабораторными определениями числа клеток CD34 + затрудняет прямое сравнение между различными исследованиями. Из-за этого сложно рекомендовать оптимальный метод, поэтому выбор подходящего метода мобилизации должен производиться с учетом общих целей лечения для конкретного пациента.
Предшествующее лечение веществами, повреждающими клетки, и мобилизация ПБПК.
У пациентов, ранее получавших очень экстенсивную миелосупрессивную терапию, у которых филграстим впоследствии используется для мобилизации стволовых клеток периферической крови, мобилизация этих клеток крови может быть недостаточной для получения рекомендуемого минимального количества ≥2,0×10 6 CD34 + клеток на килограмм массы тела . масса тела.
Некоторые цитотоксические вещества особенно токсичны для стволовых клеток крови и могут негативно влиять на мобилизацию этих клеток. Если такие вещества, как мелфалан, кармустин (BCNU) и карбоплатин используются в течение более длительного периода времени до предполагаемой мобилизации стволовых клеток, они могут снизить выход стволовых клеток. Напротив, было показано, что введение мелфалана, карбоплатина или BCNU в сочетании с филграстимом способствует мобилизации стволовых клеток. Если предполагается трансплантация стволовых клеток периферической крови, стволовые клетки должны быть мобилизованы на ранней стадии лечения пациента. У пациентов, пролеченных таким образом, следует уделять особое внимание количеству мобилизованных стволовых клеток перед проведением высокодозной химиотерапии.
Особые меры предосторожности для здоровых доноров , подвергающихся мобилизации ПКМП
Мобилизация стволовых клеток периферической крови не имеет прямой клинической пользы для здоровых доноров и должна рассматриваться только в целях аллогенной трансплантации стволовых клеток.
Мобилизацию ПСКЖ следует рассматривать только у доноров, которые соответствуют критериям приемлемости для донорства стволовых клеток с точки зрения нормальных лабораторных параметров с особым упором на гематологию.
Если показано более одного лейкафереза, особое внимание следует уделить донорам с числом тромбоцитов <100 × 10 9 /л до афереза .
Как правило, аферез не следует проводить, если число тромбоцитов <75 × 10 9 /л.
Транзиторная тромбоцитопения (количество тромбоцитов <100 x 10 9 /л) была зарегистрирована у 35% обследованных здоровых доноров после введения филграстима и лейкафереза . Также наблюдались единичные случаи со значениями <50×10 9 /л.
Лейкаферез не следует проводить донорам, принимающим антикоагулянты или имеющим известные нарушения гемостаза.
Применение Филграстима Тева следует прекратить или уменьшить дозу, если количество лейкоцитов повышается до >70 × 10 9 /л.
Доноры, получающие гранулоцитарные колониестимулирующие факторы для мобилизации стволовых клеток периферической крови, должны находиться под наблюдением до нормализации показателей крови.
У здоровых доноров данные о длительном применении ограничены.
В пострегистрационном опыте сообщалось о нежелательных реакциях со стороны легких (кровохарканье, инфильтраты в легких) у здоровых доноров.
Продолжаются данные о долгосрочной безопасности доноров.
Сообщений о нарушениях кроветворения у здоровых доноров на сроках до 4 лет не поступало. Тем не менее нельзя исключать риск стимуляции злокачественного миелоидного клона.
Рекомендуется, чтобы центры афереза проводили систематическую отчетность и перепись доноров стволовых клеток для обеспечения долгосрочного мониторинга безопасности.
Особые меры предосторожности для реципиентов аллогенных стволовых клеток периферической крови, мобилизованных филграстимом
Сообщалось о РТПХ и смертельных исходах у пациентов, получавших Г-КСФ после аллогенной трансплантации костного мозга (см. раздел 4.4).
Особые меры предосторожности у пациентов с тяжелой врожденной, циклической и идиопатической нейтропенией
Переносимость и эффективность филграстима у новорожденных и при нейтропении аутоиммунного происхождения не установлены.
Филграстим Тева не следует применять у пациентов с тяжелой врожденной нейтропенией, у которых развивается лейкемия, или у которых имеются признаки развития лейкемии.
Трансформация в лейкемию или предлейкемию
Особое внимание следует уделить дифференциальной диагностике тяжелой хронической нейтропении, чтобы отличить ее от других гематологических заболеваний, таких как апластическая анемия, миелоидная дисплазия и миелоидный лейкоз.
Полный анализ крови с дифференциальным анализом крови и количеством тромбоцитов, оценка морфологии костного мозга и кариотипирование должны быть выполнены до начала терапии.
Миелоидная дисплазия или лейкемия возникали у пациентов с врожденной нейтропенией, получавших длительное лечение филграстимом (12,1% в течение 5 лет). Эти наблюдения были сделаны только у больных с врожденной нейтропенией. Это нормальные осложнения заболевания, и их связь с терапией филграстимом неясна. В подгруппе примерно 12% пациентов, которые были цитогенетически нормальными на исходном уровне, последующее рутинное наблюдение выявило аномальные изменения, включая моносомию 7. В настоящее время неясно, предрасполагает ли продолжение терапии у пациентов с аномальным цитогенезом к цитогенетическим аномалиям, миелоидной дисплазии или лейкемической трансформации. Рекомендуется ок.
Другие особые меры предосторожности для пациентов с ВИЧ-инфекцией
анализ крови
Необходимо тщательно контролировать абсолютное число нейтрофилов (АНЧ), особенно в течение первых нескольких недель лечения Филграстимом Тева. Некоторые пациенты могут очень быстро реагировать на первые дозы филграстима со значительным увеличением количества нейтрофилов. Рекомендуется ежедневно оценивать АНК в течение первых нескольких дней приема Филграстима Тева. В течение первых 2 недель рекомендуется измерять АЧН не менее двух раз в неделю, а затем, во время поддерживающей терапии, один раз в неделю или один раз в две недели. При прерывистом приеме филграстима в дозе 300 мкг/сут АЧН у пациентов может значительно меняться с течением времени. Для определения минимальных значений АЧН пациента рекомендуется
Особые группы пациентов
Опыт применения у пациентов с тяжелой печеночной и/или почечной недостаточностью ограничен (см. разделы «Фармакокинетика» и «Способ применения и дозы»).
Эффект филграстима у пациентов с резко сниженным количеством миелоидных клеток-предшественников не изучался. Поскольку Филграстим Тева действует в основном на созревание нейтрофильных клеток-предшественников с соответствующим повышением уровня нейтрофилов в крови, эффект может быть снижен у пациентов с меньшим количеством клеток-предшественников (например, у тех, кто ранее получил обширную лучевую терапию или химиотерапию). .
ПРЕДУПРЕЖДЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ ОТНОСИТЕЛЬНО ДИАГНОСТИЧЕСКИХ ПРОЦЕДУР
визуализация костей
Увеличение гемопоэтической активности костного мозга в ответ на терапию факторами роста было связано с преходящими отклонениями от нормы при сканировании костей. Это следует учитывать при интерпретации результатов рентгенологического исследования костей.
взаимодействия
Эффективность и безопасность Филграстима Тева при назначении в один день с миелодепрессивными цитотоксическими химиотерапевтическими средствами точно не установлены. Из-за чувствительности групп быстроделящихся миелоидных клеток к миелосупрессивной цитотоксической химиотерапии Филграстим Тева не следует назначать в течение 24 часов до или после соответствующей химиотерапии. Имеются данные о том, что одновременный прием филграстима и 5-фторурацила может резко ухудшить тяжесть нейтропении.
Взаимодействия с другими гемопоэтическими факторами роста и цитокинами, которые могут возникать, в клинических исследованиях до настоящего времени не изучались (см. также раздел «Несовместимость» в главе «Прочая информация»).
Поскольку литий способствует высвобождению нейтрофилов, литий, вероятно, потенцирует эффекты филграстима. Хотя это взаимодействие напрямую не изучалось, нет никаких доказательств того, что такое взаимодействие вредно.
беременность/грудное вскармливание
беременность
Опыта безопасности применения Филграстима Тева во время беременности нет. Имеются сообщения в литературе, показывающие, что филграстим проникает через плаценту у беременных женщин. Исследования на животных показали репродуктивную токсичность.
Повышенная частота эмбриональной гибели наблюдалась у кроликов при высоких дозах, когда экспозиция во много раз превышала обычную клиническую экспозицию, а также при наличии материнской токсичности. Филграстим Тева не следует применять во время беременности, за исключением случаев крайней необходимости.
лактация
Поскольку неизвестно, сколько Филграстима Тева выделяется с грудным молоком, Филграстим Тева не следует применять в период грудного вскармливания. Нельзя исключить риск для новорожденного/младенца. Необходимо принять решение о прекращении грудного вскармливания, воздержании от лечения Филграстимом Тева или прекращении лечения Филграстимом Тева. Необходимо учитывать как пользу грудного вскармливания для ребенка, так и пользу терапии для женщины.
Влияние на способность управлять автомобилем и работать с механизмами
Филграстим Тева может незначительно влиять на способность управлять автомобилем и работать с механизмами. После приема Филграстима Тева может возникнуть головокружение (см. Побочные эффекты).
Соответствующие исследования не проводились.
нежелательные эффекты
Резюме побочных эффектов
В ходе клинических исследований Филграстим Тева был назначен 541 больному раком и 188 здоровым добровольцам. Профили безопасности, наблюдаемые в этих исследованиях между Филграстимом Тева и эталонным лекарственным средством, используемым в исследованиях, были одинаковыми.
Приведенные ниже данные включают побочные реакции, полученные в результате клинических испытаний, а также из спонтанных сообщений. В каждой частотной группе нежелательные эффекты представлены в порядке убывания серьезности.
Классы систем органов по MedDRA | нежелательные эффекты | |||
|---|---|---|---|---|
Очень часто | Часто | Нечасто | Редко | |
Инфекции и паразитарные заболевания | сепсис бронхит Инфекция верхних дыхательных путей инфекции мочевыводящих путей | |||
Новообразования доброкачественные, злокачественные и неуточненные (включая кисты и полипы) | Миелодиспластический синдром А. острый миелоидный лейкоз а | |||
Нарушения со стороны крови и лимфатической системы | Анемия (21,1%) | Спленомегалия a | лейкоцитоз а | Разрыв селезенки Серповидноклеточная |
заболевания иммунной системы | лекарственная гиперчувствительность Гиперчувствительность _ Реакция «трансплантат против хозяина» b | Анафилактическая реакция | ||
Нарушения обмена веществ и питания | Снижение аппетита Повышение лактатдегидрогеназы | Гиперурикемия | падение сахара в крови Хондрокальциноз Нарушения объема жидкости | |
Психиатрические заболевания | бессонница | |||
Заболевания нервной системы | Головная боль (13,9%) | головокружение гипестезия парестезия | ||
сосудистые заболевания | гипертония гипотония | веноокклюзионная болезнь | ангиопатия Синдром капиллярной утечки аортит | |
Заболевания органов дыхания, грудной клетки и средостения | кровохарканье одышка Кашель Орофарингеальная боль носовое кровотечение | Несердечная боль в груди Легочное кровотечение Интерстициальное заболевание легких гипоксия | Легочный фиброз a | |
Заболевания желудочно-кишечного тракта | Рвота (21,2%) | боль во рту д запор д | ||
Заболевания печени и желчевыводящих путей | гепатомегалия Повышенная щелочная фосфатаза | Повышенный уровень аспартатаминотрансферазы Повышенный уровень γ-глутамилтрансферазы | ||
Заболевания кожи и подкожной клетчатки | Алопеция (13,6%) | эритема сыпь | Макулопапулезная сыпь | Острый фебрильный нейтрофильный дерматоз (синдром Свита) Кожный васкулит А. |
Заболевания опорно-двигательного аппарата, соединительной ткани и костей | Скелетно-мышечная боль c (27,7%) | мышечные спазмы | остеопороз | снижение плотности костной ткани Обострение ревматоидного артрита |
Заболевания почек и мочевыводящих путей | гематурия дизурия | протеинурия | нарушения мочеиспускания гломерулонефрит нарушения мочеиспускания | |
Общие расстройства и состояния в месте введения | Усталость (11,9%) Лихорадка (28,9%) | астения недомогание д периферический отек д | реакции в месте инъекции | |
Травмы, отравления и процедурные осложнения | трансфузионная реакция д | |||
a см. «Описание некоторых побочных эффектов »
б Имеются сообщения о РТПХ и летальных исходах у пациентов после аллогенной трансплантации костного мозга.
c включает боль в костях, боль в спине, артралгию, миалгию, боль в конечностях, мышечно-скелетную боль, мышечно-скелетную боль в груди, боль в шее
d Нежелательные явления с более высокой частотой встречаемости у пациентов, получавших филграстим, по сравнению с плацебо и связанные с поздними последствиями основного рака или цитотоксической химиотерапией.
Описание отдельных побочных эффектов
Реакции гиперчувствительности к лекарственным средствам
Реакции гиперчувствительности, включая анафилаксию, сыпь, крапивницу, ангионевротический отек, одышку и гипотензию, были зарегистрированы во время начального и последующего лечения в клинических исследованиях и постмаркетинговых исследованиях. В целом, эти симптомы чаще отмечались после внутривенного введения. В некоторых случаях симптомы повторялись при повторном воздействии, что свидетельствует о причинно-следственной связи. При возникновении серьезной аллергической реакции прием Филграстима Тева следует окончательно прекратить.
Легочные побочные эффекты
Легочные побочные реакции, включая интерстициальное заболевание легких, отек легких и легочную инфильтрацию, были зарегистрированы в ходе клинических испытаний и постмаркетинговых исследований, в некоторых случаях приводивших к дыхательной дисфункции или острому респираторному дистресс-синдрому (ОРДС), которые могут быть фатальными (см. раздел «Особые указания и меры предосторожности»). .
Синдром капиллярной утечки
Сообщалось о случаях синдрома капиллярной утечки после применения гранулоцитарных колониестимулирующих факторов. Как правило, они возникали у пациентов с запущенными злокачественными новообразованиями, сепсисом, у пациентов, получавших несколько химиотерапевтических режимов, или у пациентов, подвергшихся аферезу после мобилизации ПСКЖ (см. раздел «Предупреждения и меры предосторожности»).
Спленомегалия и разрыв селезенки
Сообщалось о случаях спленомегалии и разрыва селезенки после применения филграстима. Некоторые случаи разрыва селезенки заканчивались летальным исходом (см. раздел «Предупреждения и меры предосторожности»).
Лейкоцитоз и тромбоцитопения
Сообщалось о лейкоцитозе и тромбоцитопении после приема филграстима (см. раздел «Побочное действие»).
серповидноклеточный кризис
Имеются отдельные постмаркетинговые сообщения о кризах серповидноклеточной анемии у пациентов с признаками серповидноклеточной анемии или серповидноклеточной анемией (см. раздел «Предупреждения и меры предосторожности»).
Кожный васкулит
Сообщалось о кожном васкулите у пациентов, получавших филграстим.
Миелодиспластический синдром и острый миелоидный лейкоз
Сообщалось о редких случаях миелодиспластического синдрома [МДС] и острого миелоидного лейкоза [ОМЛ] у пациентов с раком молочной железы и легких (см. раздел «Особые указания и меры предосторожности»).
дети и молодые люди
Данные клинических исследований у детей и подростков показывают, что безопасность и эффективность филграстима одинаковы как у взрослых, так и у детей, получающих цитотоксическую химиотерапию. Предполагается отсутствие возрастных различий в фармакокинетике филграстима. Единственным нежелательным явлением, о котором постоянно сообщалось, была мышечно-скелетная боль, которая не отличалась от таковой у взрослых.
Данных для дальнейшей оценки применения филграстима у детей и подростков недостаточно.
Другие особые группы пациентов
Пожилые пациенты
В целом, не наблюдалось различий в безопасности и эффективности у пациентов старше 65 лет по сравнению с более молодыми взрослыми (> 18 лет), получающими цитотоксическую химиотерапию. Клинический опыт также не показывает разницы в реакции между пожилыми и молодыми пациентами. Недостаточно данных для оценки применения филграстима у пожилых пациентов по другим одобренным показаниям к применению филграстима.
Дети и подростки с СХН
Сообщалось о случаях снижения минеральной плотности костной ткани и остеопороза у детей и подростков с тяжелой хронической нейтропенией, получающих длительное лечение филграстимом.
Пострегистрационное сообщение о подозреваемых нежелательных реакциях имеет важное значение. Это позволяет осуществлять постоянный мониторинг соотношения польза/риск лекарственного средства. Медицинских работников просят сообщать о любых подозрениях на новый или серьезный побочный эффект через онлайн-портал ЭлВиС (Электронная система бдительности). Информацию об этом можно найти на сайте www.swissmedic.ch.
передозировка
Последствия передозировки филграстима еще не известны. У пациентов с тяжелой хронической нейтропенией при дозах выше 14,5 МЕ (145 мкг) на кг массы тела в сутки симптомы заболевания не проявлялись. У больных, получавших цитотоксическую химиотерапию с последующей трансплантацией костного мозга, дозы до 7,0 млн ЕД. (70 мкг) на килограмм массы тела оказались переносимыми.
В случае передозировки отмена филграстима обычно приводит к уменьшению количества нейтрофилов вдвое в течение 1–2 дней и к нормализации в течение 1–7 дней.
Свойства/Эффекты
Код УВД
L03AA02
механизм действия
Филграстим представляет собой высокоочищенный негликозилированный белок из 175 аминокислот, полученный из бактерий E. coli, в геном которых был внесен биоинженерный ген, кодирующий колониестимулирующий фактор гранулоцитов человека.
Гранулоцитарный колониестимулирующий фактор человека представляет собой гликопротеин, регулирующий продукцию функциональных нейтрофилов и их высвобождение из костного мозга.
фармакодинамика
Г-КСФ в составе Филграстима Тева вызывает заметное увеличение количества нейтрофилов в кровотоке в течение 24 часов после введения, что сопровождается небольшим увеличением количества моноцитов. У некоторых пациентов с тяжелой хронической нейтропенией филграстим может также незначительно повышать количество циркулирующих эозинофилов и базофилов до нормы. У некоторых из этих пациентов уже до начала терапии выявляют эозинофилию или базофилию. Это увеличение уровня нейтрофилов в крови зависит от дозы в рекомендуемом диапазоне доз. Клинические исследования показали, что нейтрофилы, вырабатываемые организмом человека в ответ на лечение филграстимом, имеют нормальную или повышенную способность к фагоцитозу и продукции супероксида.
Применение филграстима отдельно или после химиотерапии способствует высвобождению гемопоэтических клеток-предшественников в периферическую кровь. Эти клетки-предшественники периферической крови (PBPC) могут быть выделены и введены после аплазии, цитотоксической терапии либо вместо, либо в дополнение к трансплантации костного мозга. PBPC также можно назначать после (сильной) миелосупрессивной цитотоксической терапии. Инфузия ПБПК ускоряет восстановление кроветворения, сокращает продолжительность риска геморрагических осложнений и снижает потребность в трансфузиях тромбоцитов.
У здоровых доноров доза 10 мкг/кг массы тела в день, вводимая подкожно в течение 4–5 дней подряд, приводит к восстановлению ≥ 4 × 10 6 CD34 + клеток на кг массы тела реципиента после двух лейкаферезов у большинства доноров.
После прекращения лечения филграстимом уровни нейтрофилов в крови падают примерно наполовину в течение 1–2 дней и возвращаются к норме примерно через 1–7 дней. Терапия филграстимом значительно снижает частоту, тяжесть и продолжительность нейтропении и фебрильной нейтропении, которые обычно наблюдаются после введения цитостатической химиотерапии или химиотерапии аплазии с последующей трансплантацией костного мозга. Пациенты, получающие филграстим в дополнение к химиотерапии, нуждаются в госпитализации реже и на меньшее время. Им также требуется меньше доз антибиотиков по сравнению с пациентами, прошедшими химиотерапию без дополнительного лечения.
Лечение филграстимом значительно сокращает продолжительность фебрильной нейтропении, использование антибиотиков и частоту госпитализаций после индукционной химиотерапии у пациентов с острым миелоидным лейкозом. Заболеваемость лихорадкой и документально подтвержденными инфекциями в этих условиях не снизилась. Эффект Г-КСФ еще не доказан у пациентов с низкими значениями лейкоцитов даже до начала терапии из-за сниженных резервов костного мозга (например, после обширной лучевой терапии и/или после повторных курсов химиотерапии). В настоящее время терапия Г-КСФ не может заменить обычную коррекцию дозы химиотерапевтических препаратов у этих пациентов.
В ретроспективном европейском исследовании оценивалось использование Г-КСФ после аллогенной трансплантации костного мозга у пациентов с острым лейкозом. Это исследование показало, что существует повышенный риск реакции «трансплантат против хозяина» (РТПХ), связанной с лечением смертности (TRM) и смертности при использовании G-CSF. В отдельном ретроспективном международном исследовании у пациентов с острым и хроническим миелоидным лейкозом влияния на РТПХ, ТРМ и смертность не наблюдалось. Метаанализ исследований аллогенных трансплантаций, который включал результаты девяти проспективных рандомизированных исследований, восьми ретроспективных исследований и одного исследования случай-контроль.
Относительный риск (95% ДИ) реакции «трансплантат против хозяина» (РТПХ) и связанная с лечением смертность (TRM) после лечения Г-КСФ после трансплантации костного мозга | |||||
|---|---|---|---|---|---|
публикация | период обучения | Н | Острая | Хроническая | ТРМ |
Метаанализ | 1986-2001 гг . | 1198 | 1,08 | 1,02 | 0,70 |
Европейское ретроспективное | 1992-2002 годы б | 1789 г. | 1,33 | 1,29 | 1,73 |
Международное ретроспективное | 1995-2000 б | 2110 | 1,11 | 1,10 | 1,26 |
a Анализ включал исследования, включавшие трансплантацию костного мозга в этот период; в некоторых исследованиях использовали GM-CSF (гранулоцитарно-макрофагальный колониестимулирующий фактор)
б В анализ включены пациенты, перенесшие трансплантацию костного мозга в этот период.
Лечение Филграстимом Тева у детей или взрослых с тяжелой хронической нейтропенией (тяжелая врожденная нейтропения, циклическая нейтропения, идиопатическая нейтропения) приводит к увеличению абсолютного количества нейтрофилов в периферической крови и уменьшению инфекций и связанных с ними исходов.
Применение Филграстима-Тева у больных ВИЧ поддерживает количество нейтрофилов в пределах нормы, что позволяет применять противовирусные и/или другие миелодепрессанты в обычных дозах. Нет никаких доказательств того, что пролиферация вируса ВИЧ стимулируется у пациентов с ВИЧ, получающих филграстим.
Как и в случае других гемопоэтических факторов роста, Г-КСФ оказывает стимулирующее действие на рост эндотелиальных клеток человека in vitro .
Клиническая эффективность
Эффективность и безопасность Филграстима-Тева были продемонстрированы в ходе рандомизированных контролируемых исследований III фазы у пациентов с раком молочной железы, раком легких и неходжкинской лимфомой.
В опорном исследовании с участием 348 пациентов с раком молочной железы продолжительность тяжелой нейтропении во время первого цикла химиотерапии рассматривалась как основной параметр эффективности по сравнению с эталоном и по сравнению с плацебо. В то время как продолжительность тяжелой нейтропении в обеих группах активного препарата составляла в среднем 1,1 дня, продолжительность тяжелой нейтропении была значительно больше в группе плацебо, в среднем 3,8 дня.
В первом цикле химиотерапии количество нейтрофилов (ЧЧН) при лечении плацебо снизилось после 2-го дня и достигло надира на 11-й день.
В группах филграстим-тева и контрольной группе значения АЧН увеличивались до максимума на 3-й день, достигали надира на 7-й день, а затем снова увеличивались до второго максимума на 11-й день.
Во время первого цикла химиотерапии средний надир АЧН в группе плацебо составил 0,16×10 9 /л, что ниже, чем в двух активных группах (0,66×10 9 /л).
Время до восстановления АЧН во время 1-го курса химиотерапии было сопоставимо для Филграстима Тева и препарата сравнения и составляло примерно 8 дней, в то время как АЧН восстанавливался через 14 дней в группе плацебо.
В дальнейшем исследовании с участием 240 пациентов с раком легкого безопасность и переносимость Филграстима Тева изучали по сравнению с эталоном в течение максимум 6 курсов химиотерапии. Со второго цикла пациенты группы сравнения были переведены на Филграстим-Тева.
На фоне 1-го курса химиотерапии средняя продолжительность тяжелой нейтропении (ДСН) составила 0,5 дня в группе филграстима Тева и 0,3 дня в группе сравнения. Во время 1-го курса химиотерапии АЧН достигла первого максимума через 5 дней как для Филграстима-Тева, так и для сравнения. Минимальное значение было достигнуто через 11 дней после приема Филграстима-Тева и через 12 дней после начала лечения.
В третьем исследовании у 90 пациентов с неходжкинской лимфомой эффективность и переносимость Филграстима-Тева сравнивали с эталоном в течение периода до 6 циклов химиотерапии. Со второго цикла пациенты группы сравнения были переведены на Филграстим-Тева.
Средняя продолжительность тяжелой нейтропении на 1-м курсе химиотерапии составила 0,5 дня в группе филграстима Тева и 0,9 дня в группе сравнения.
АЧН достигла первого максимума через 4 дня и второго максимума через 11 дней как для Филграстима-Тева, так и для эталона во время 1-го цикла химиотерапии. Надир был достигнут через 9 дней в обеих группах лечения.
Среднее значение АЧН на 1-м курсе химиотерапии составило 1,7×10 9 /л в группе филграстима-Тева и 1,1×10 9 /л в группе сравнения.
В среднем значение АЧН восстанавливалось через 6 дней (Филграстим-Тева) или через 6,7 дня (контроль) при 1-м цикле химиотерапии.
фармакокинетика
поглощение
Линейная зависимость между дозой и концентрацией филграстима в сыворотке наблюдалась после подкожного и внутривенного введения Филграстима Тева. После однократного введения филграстима в дозах от 1,7 до 69,0 мкг/кг массы тела (короткая внутривенная инфузия в течение 30 минут) были обнаружены пиковые концентрации в сыворотке от 5 до 1840 нг/мл. После подкожного введения рекомендуемой дозы концентрации в сыворотке крови достигают 118 нг/мл и остаются выше 10 нг/мл в течение периода от 8 до 16 часов. Определенный объем распределения в крови составил около 150 мл/кг.
выведение
Клиренс филграстима соответствовал кинетике первого порядка после подкожного и внутривенного введения. Определяемый общий клиренс составил 0,6 мл в минуту и кг. Средний период полувыведения составляет примерно 3,5 часа.
Два рандомизированных перекрестных исследования однократной дозы с участием 196 здоровых добровольцев показали, что фармакокинетический профиль Филграстима Тева и эталонного препарата сопоставим после подкожного и внутривенного введения. После однократного внутривенного введения 5 или 10 мкг/кг массы тела были достигнуты средние максимальные концентрации 130 и 231 нг/мл (контрольный препарат: 126 и 222 нг/мл). После подкожного применения 5 или 10 мкг/кг массы тела были измерены средние максимальные концентрации в сыворотке 18 и 46 нг/мл (референтный препарат: 18 и 43 нг/мл). Концентрации в сыворотке превышали 10 нг/мл в течение приблизительно 8-16 часов (референтный лекарственный препарат: 8-16 часов). Период полувыведения составляет в среднем около 3,5 часов.
При непрерывной инфузии филграстима в течение 28 дней у пациентов с аутологичной трансплантацией костного мозга периоды полувыведения были сопоставимы без признаков кумуляции.
Фармакокинетический профиль при концентрации 0,96 мг/мл показывает незначительное, связанное с концентрацией отличие от более низких концентраций 0,6 мг/мл и 0,3 мг/мл. Это различие не влияет на общий фармакодинамический ответ (измеряемый по ответу нейтрофилов).
Кинетика особых групп пациентов
Пациенты с нарушением функции печени и почек
В исследовании с участием 12 пациентов с разным уровнем почечной функции у пациентов с терминальной стадией почечной недостаточности было продемонстрировано увеличение Cmax по сравнению со здоровыми субъектами и субъектами с умеренной почечной недостаточностью.и AUC, а также уменьшения объема распределения и клиренса. Поскольку средние профили АЧН были одинаковыми на разных стадиях почечной недостаточности, включая терминальную стадию почечной недостаточности, коррекция дозы Филграстима Тева у пациентов с почечной недостаточностью не требуется. Результаты исследования у 12 пациентов с печеночной недостаточностью показывают, что фармакокинетика и фармакодинамика филграстима сходны у пациентов с печеночной недостаточностью и у здоровых лиц. Поэтому коррекции дозы у пациентов с печеночной недостаточностью не требуется.
Доклинические данные
Экспрессия рецептора G-CSF (гранулоцитарный колониестимулирующий фактор) была продемонстрирована в некоторых злокачественных клетках. Нельзя исключать возможность того, что филграстим действует как фактор роста при некоторых типах опухолей.
Канцерогенный потенциал филграстима не оценивался. Филграстим не вызывал генных мутаций у бактерий ни в присутствии, ни в отсутствие системы ферментов, метаболизирующих лекарственные средства. Филграстим не оказывал заметного влияния на фертильность или течение беременности самцов и самок крыс в дозах до 500 мкг/кг.
Другие примечания
несовместимости
Филграстим Тева не следует разбавлять физиологическим раствором. О совместимости Филграстима Тева с пластмассами после разведения для инфузий см. «Инструкцию по применению».
долговечность
Предварительно заполненные шприцы Филграстим-Тева предназначены только для одноразового использования. Любой неиспользованный раствор следует выбросить.
Лекарственный препарат можно использовать только до даты, отмеченной «EXP» на упаковке.
Особые указания по хранению
Хранить в оригинальной упаковке в защищенном от света месте в холодильнике (2-8°С). Храните в недоступном для детей месте.
В течение срока годности и для амбулаторного применения препарат допускается извлекать из холодильника (2°С - 8°С) и хранить при температуре до 25°С однократно до 4 суток. Если продукт не используется в течение 4 дней, его можно снова поместить в холодильник (2°C - 8°C) до окончания срока годности. Шприцы, хранившиеся при температуре выше 8°C более 4 дней, следует утилизировать.
Случайное воздействие отрицательных температур на Филграстим Тева не оказывает неблагоприятного воздействия на стабильность препарата.
После разбавления: Химическая и физическая стабильность разбавленного раствора для инфузий при использовании была продемонстрирована в течение 24 часов при температуре от 2°C до 8°C. С микробиологической точки зрения препарат следует использовать немедленно. В случае неиспользования немедленно пользователь несет ответственность за сроки хранения и условия перед использованием. Если разведение не выполняется в контролируемых и валидированных асептических условиях, срок хранения при температуре от 2°C до 8°C не должен превышать 24 часов.
Инструкции по обращению
Инструкция по разведению Филграстима Тева для инфузий
При необходимости Филграстим Тева можно развести в 5% растворе глюкозы для инъекций. Из разведенного раствора филграстим можно адсорбировать на стекле или пластике. Однако при правильном разбавлении для инфузии раствор совместим с полипропиленом. Если концентрация филграстима после разведения менее 1,5 МЕ. (15 мкг) на мл инфузионного раствора следует добавить человеческий альбумин (конечная концентрация 2 мг альбумина/мл инфузионного раствора).
Пример разведения: Если желаемый объем разводимого раствора составляет 20 мл, но содержание в нем филграстима менее 30 МЕ. (300 мкг), следует добавить 0,2 мл 20% раствора человеческого альбумина.
Однако ни при каких обстоятельствах не следует снижать концентрацию Филграстима Тева до концентрации ниже 0,2 МЕ. (2 мкг) на мл раствора для инфузий.
Использование предварительно наполненного шприца с системой защиты иглы
Система защиты иглы закрывает иглу после инъекции, чтобы предотвратить травмы от укола иглой. Это не влияет на нормальную работу шприца. Медленно и устойчиво нажимайте на поршень до тех пор, пока не будет введена вся доза, и поршень нельзя будет нажимать дальше. При нажатом поршне вытащите шприц. Система защиты иглы закрывает иглу при отпускании поршня.
регистрационный номер
60722 (Свиссмедик).
Владелец регистрационного удостоверения
Тева Фарма АГ, Базель.
Отзывов (0)
Похожие товары

Бесплатная консультация опытного специалиста
Опишите симптомы или нужный препарат – мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой на дом или просто проконсультируем.
Нас 14 специалистов и 0 ботов. Мы всегда будем с вами на связи и сможем связаться в любое время.