Превенар 13 суспензия для инъекций 1 предварительно заполненный шприц 0,5 мл
Prevenar 13 Fertigspritze 0,5 ml
-
19609.55 RUB
Предполагаемая дата доставки:
31.12.2025 - 14.01.2026
При оплате криптовалютой:
Ваша прибыль 1960.96 RUB / 22.24 USDT
Состав:
Янтарная кислота, Дифтерийный белок crm197, Натрия хлорид, Натрия хлорид, Натрия хлорид, Натрия хлорид, Натрия хлорид, Пневмококковой полисахаридной, Серотип, Пневмококковой полисахаридной, Серотип 14, Пневмококковой полисахаридной, Серотип 18с, Пневмококковой полисахаридной, Серотип 19а, Пневмококковой полисахаридной, Серотип 19f, Пневмококковой полисахаридной, Серотип 23f, Пневмококковой полисахаридной, Серотип 3, Пневмококковой полисахаридной, Серотип 4, Пневмококковой полисахаридной, Серотип 5, Пневмококковой полисахаридной, Серотип 6a, Пневмококковой полисахаридной, Серотип 6b, Пневмококковой полисахаридной, Серотип 7f, Пневмококковой полисахаридной, Серотип 9v, Пневмококковая полисахаридно-crm конъюгатная вакцина, 13-валентный, Полисорбат 80
Bernsteinsäure,
Diphtherie CRM197 Protein,
Natriumchlorid,
Pneumokokken-Polysaccharid,
Serotyp 1,
Pneumokokken-Polysaccharid,
Serotyp 14,
Pneumokokken-Polysaccharid,
Serotyp 18C,
Pneumokokken-Polysaccharid,
Serotyp 19A,
Pneumokokken-Polysaccharid,
Serotyp 19F,
Pneumokokken-Polysaccharid,
Serotyp 23F,
Pneumokokken-Polysaccharid,
Serotyp 3,
Pneumokokken-Polysaccharid,
Serotyp 4,
Pneumokokken-Polysaccharid,
Serotyp 5,
Pneumokokken-Polysaccharid,
Serotyp 6A,
Pneumokokken-Polysaccharid,
Serotyp 6B,
Pneumokokken-Polysaccharid,
Serotyp 7F,
Pneumokokken-Polysaccharid,
Serotyp 9V,
Pneumokokken-Polysaccharid-CRM-Konjugat-Impfstoff,
13-valent,
Polysorbat 80,
Описание
состав
Активные ингредиенты: Полисахарид стрептококка пневмонии (серотип 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 23F) конъюгат с белком коринебактерий дифтерии CRM-197 .
Адъювант: алюминий фосфат.
Вспомогательные вещества: натрия хлорид, полисорбат 80, кислота янтарная, вода для инъекций.
Галеновая форма и количество активного ингредиента на единицу
Суспензия для инъекций в предварительно заполненном шприце для инъекций. После встряхивания вакцина представляет собой белую гомогенную суспензию.
Одна доза вакцины (0,5 мл суспензии) содержит: 2,2 мкг пневмококковых полисахаридов серотипов 1, 3, 4, 5, 6A, 7F, 9V, 14, 18C, 19A, 19F и 23F, а также 4,4 мкг серотипа 6B (всего: 30,8 мкг полисахаридов). ) и около 32 мкг белка-носителя CRM 197 .
Показания / возможные применения
Активная иммунизация для предотвращения инвазивных заболеваний, пневмонии и острого среднего отита, вызванных Streptococcus pneumoniae, у младенцев и детей в возрасте от 6 недель до 5 лет.
См. Главы «Предупреждения и меры предосторожности» и «Свойства / эффекты» для получения информации о защите от определенных пневмококковых серотипов.
Превенар 13 следует использовать на основе официальных рекомендаций и учитывать степень инвазивных заболеваний в разных возрастных группах и эпидемиологическую изменчивость серотипов в разных географических районах.
Дозировка / применение
дозировка
Графики вакцинации Превенаром 13 должны соответствовать официальным рекомендациям по вакцинации. Рекомендуется, чтобы младенцы, которые получают Превенар 13, получили серию прививок Превенаром 13.
Младенцы в возрасте от 6 недель до 6 месяцев
Базовая вакцинация тремя дозами
Рекомендуемая схема вакцинации состоит из четырех доз по 0,5 мл каждая. Базовая вакцина состоит из трех доз, причем первая доза обычно вводится в возрасте 2 месяцев, а интервал между приемами составляет не менее 1 месяца. Первая доза также может быть назначена в возрасте 6 недель. Четвертая (бустерная) вакцинация рекомендуется в возрасте 11-15 месяцев.
Основная вакцинация двумя дозами
Если Превенар 13 используется как часть стандартной программы вакцинации для детей, может использоваться альтернативная схема вакцинации с тремя дозами по 0,5 мл. Первая доза может быть введена в возрасте 2 месяца, вторая доза через 2 месяца. Третья (бустерная) доза рекомендуется в возрасте 11-15 месяцев (см. Главу «Свойства / эффекты»).
Недоношенные дети (<37 недель беременности)
Для недоношенных детей рекомендуемая схема вакцинации составляет четыре дозы по 0,5 мл. Базовая вакцина состоит из трех доз, причем первая доза вводится в возрасте 2 месяцев, а интервал между приемами составляет не менее 1 месяца. Первая доза также может быть назначена в возрасте 6 недель. Четвертая (бустерная) вакцинация рекомендуется в возрасте 11-15 месяцев (см. Главы «Предупреждения и меры предосторожности» и «Свойства / последствия»).
Невакцинированные дети и дети в возрасте от 7 месяцев
Младенцы в возрасте 7-11 месяцев
Две дозы по 0,5 мл с интервалом не менее 1 месяца. Третья доза рекомендуется на втором году жизни.
Дети в возрасте 12-23 месяцев
Две дозы по 0,5 мл с интервалом не менее 2 месяцев.
Дети в возрасте 2-5 лет
Разовая доза 0,5 мл.
Схема вакцинации Превенаром13 для младенцев и детей, ранее вакцинированных Превенаром (7-валентная) (Streptococcus pneumoniae серотипов 4, 6B, 9V, 14, 18C, 19F и 23F)
Превенар 13 содержит те же 7 серотипов, что и Превенар, и использует тот же белок-носитель CRM 197 . Младенцы и дети, которые начали получать Превенар, могут быть переключены на Превенар 13 в любое время.
Дети в возрасте 12-23 месяцев
Дети, получившие менее 2 прививок Превенар 13 во время первичной прививки, должны получить две дозы вакцины (с интервалом не менее 2 месяцев между дозами) для полной защиты от шести дополнительных серотипов. В качестве альтернативы, завершение серии вакцинации должно следовать официальным рекомендациям.
Дети в возрасте 2-5 лет
Разовая доза.
Тип заявления
Вакцина должна вводиться внутримышечно. Предпочтительными участками являются переднелатеральная сторона бедра (vastus lateralis мышца) у детей или дельтовидная мышца плеча у маленьких детей.
Противопоказания
Повышенная чувствительность к любому из активных веществ, к любому из других ингредиентов или к анатоксину дифтерии.
Как и в случае с другими вакцинами, прием препарата Превенар 13 младенцам и детям с тяжелой острой лихорадочной болезнью следует отложить. Если инфекция легкая, например простуда, вакцинация не должна откладываться.
Предупреждения и меры предосторожности
Превенар 13 не следует вводить внутрисосудисто.
Как и в случае всех инъекционных вакцин, в редких случаях анафилактической реакции после введения вакцины необходимо обеспечить соответствующую медицинскую помощь и мониторинг.
Эту вакцину не следует вводить в виде внутримышечной инъекции младенцам или детям, страдающим тромбоцитопенией или другим нарушением свертываемости крови, при которых внутримышечная инъекция будет противопоказана, но ее можно вводить подкожно, если потенциальная польза явно превышает риски (см. Раздел «Свойства / эффекты - иммунный ответ после подкожного введения»).
Превенар 13 защищает только от серотипов Streptococcus pneumoniae, содержащихся в вакцине. Он не обеспечивает защиту от других микроорганизмов, которые вызывают инвазивные заболевания, пневмонию или средний отит. Как и все вакцины, Превенар 13 не может защитить всех людей, которые получают эту вакцину от пневмококковой инфекции.
Дети с ограниченным иммунным ответом, будь то из-за иммуносупрессивной терапии, генетического дефекта, ВИЧ-инфекции или других причин, могут реагировать на активную иммунизацию сниженным ответом антител.
Нет данных о безопасности и иммуногенности для детей из других специфических групп высокого риска инвазивного пневмококкового заболевания (таких как дети с другой врожденной или приобретенной дисфункцией селезенки, ВИЧ-инфекция, рак, нефротический синдром). Вакцинация в группах высокого риска должна решаться индивидуально. Для Превенара 13 пока нет конкретных данных.
В клинических исследованиях Превенар 13 индуцировал иммунный ответ на все тринадцать серотипов в вакцине. Иммунный ответ на серотип 3 после бустерной дозы не был выше, чем у детей после серии прививок; Клиническая значимость этого наблюдения в отношении индукции иммунологической памяти для серотипа 3 не известна (см. главу «Свойства / эффекты»).
Доля респондеров в отношении функциональных антител (титры ОРА ≥1: 8) была высокой для серотипов 1, 3 и 5 соответственно. Однако средние геометрические значения титров ОРА были ниже, чем у других серотипов дополнительных вакцин; Клиническая значимость этого наблюдения для защитного эффекта неизвестна (см. главу «Свойства / эффекты»).
Имеются ограниченные данные, чтобы продемонстрировать, что 7-валентная профилактическая вакцина (первичная вакцинация из трех доз) вызывает приемлемый иммунный ответ у детей с серповидно-клеточной анемией; Наблюдаемый профиль безопасности был одинаковым для детей с серповидно-клеточной анемией и детей без высокого риска (см. главу «Свойства / эффекты»).
Дети в возрасте до 2 лет должны пройти соответствующую иммунизацию Превенаром 13 в соответствии с возрастом (см. Главу «Дозировка / применение»). Применение пневмококковой конъюгатной вакцины не заменяет применение 23-валентных пневмококковых полисахаридных вакцин у детей в возрасте от 2 лет с заболеваниями, которые делают их более подверженными риску инвазивного заболевания от Streptococcus pneumoniae.есть (например, серповидно-клеточная анемия, аспления, ВИЧ-инфекция, хронические заболевания или нарушения иммунной системы). Всякий раз, когда рекомендуется, детям в возрасте от 24 месяцев, которые уже получили Превенар 13, должны получить 23-валентную пневмококковую полисахаридную вакцину. Интервал между 13-валентной пневмококковой конъюгатной вакциной (Превенар13) и 23-валентной пневмококковой полисахаридной вакциной должен составлять не менее 8 недель. Нет доступных данных, чтобы показать, может ли введение 23-валентной пневмококковой полисахаридной вакцины непривитым детям или детям, привитым Превенаром 13, привести к снижению иммунного ответа по сравнению с дальнейшими дозами Превнара 13.
Потенциальный риск апноэ и необходимость 48-72-часового респираторного мониторинга следует учитывать, когда первичная иммунизация проводится крайне недоношенным детям (родившимся на 28-й неделе или раньше) и особенно детям с анамнестически незрелой дыхательной системой. Поскольку польза от вакцинации в этой группе детей высока, вакцинацию не следует откладывать или откладывать.
Что касается серотипов вакцины, ожидается, что защита от среднего отита будет меньше защиты от инвазивных заболеваний. Поскольку средний отит вызван не только пневмококковыми серотипами вакцины, но также и многими другими патогенными микроорганизмами, защита, которую следует ожидать от всех заболеваний среднего отита, является низкой (см. Главу «Свойства / эффекты»).
Не было проведено исследований по изучению частоты лихорадки, общей безопасности и иммуногенности после одновременного введения конъюгированной 13-валентной пневмококковой вакцины (Превенар 13) и Infanrix hexa (DTPa-HepB-IPV + Hib) по сравнению с введением только Infanrix hexa , Данные клинического испытания с использованием конъюгированной 7-валентной пневмококковой вакцины (Превенар) показали более высокую частоту лихорадки при одновременном введении Инфанрикса гекса с Превенаром (7-валентным) по сравнению с одним Инфанриксом гекса. Реакции лихорадки были в основном умеренными (39 ° C или ниже) и переходными (см. Также в разделе «Нежелательные эффекты»). Лечение антипиретиками можно рассмотреть.
Жаропонижающие средства следует назначать в соответствии с национальными стандартами лечения детям с судорогами в анамнезе или фебрильными судорогами, а также всем детям, которым вводят Превенар-13 одновременно с вакцинами, содержащими цельный микроб коклюша.
взаимодействия
Различные инъекционные вакцины всегда должны вводиться в разных местах инъекций.
Превенар 13 можно вводить с любым из следующих вакцинных антигенов (в виде моновалентной или комбинированной вакцины): дифтерия, столбняк, бесклеточный или цельный коклюш, Haemophilus influenzae типа B, инактивированный полиомиелит, гепатит B, менингококковая серогруппа C- Антиген кори, эпидемического паротита, краснухи и ветряной оспы. Клинические исследования показали, что иммунный ответ и профиль безопасности введенных вакцин не были затронуты. Никаких изменений в профиле безопасности этих вакцин не наблюдалось в клинических исследованиях с Превенаром 13 и ротавирусной вакциной.
В 5-ти клиническом исследовании после выхода на рынок - по сравнению с контрольной группой - влияние профилактического применения жаропонижающих средств (2 или 3 дозы парацетамола, 2 или 3 дозы ибупрофена) на иммунный ответ на Превенар 13 с одновременным введением Инфанрикс гекса осмотрен. Уровень значимости ранее был установлен на р <0,0125. После первичной вакцинации уровень значимости р <0,0125 привел к значительному снижению иммунного ответа на Превенар 13 у серотипов 3, 4, 5, 6B и 23F из-за парацетамола. Иммунный ответ на бустерную дозу, введенную в возрасте 12 месяцев, не был затронут при уровне значимости p <0,0125. Клиническая значимость этого наблюдения неизвестна.
Беременность / кормление грудью
Информация о безопасности Превенара 13 во время беременности и кормления грудью недоступна.
Влияние на способность управлять автомобилем и использовать машины
Не подходит.
нежелательные эффекты
Неблагоприятные реакции, о которых сообщалось во время клинических испытаний или после маркетинга, перечислены в обзоре ниже для всех возрастных групп по системам органов и частоте. Частоты определяются следующим образом: очень часто (≥1 / 10), часто (от ≥1 / 100 до <1/10), редко (от ≥1 / 1000 до <1/100), редко (≥1 / 10) От 000 до <1/1000), очень редко (<1/10000).
В пределах каждой частотной группы побочные эффекты даны в соответствии с уменьшением серьезности.
Безопасность вакцины изучалась в контролируемых клинических испытаниях, в которых 4429 здоровым детям вводили 14,267 доз с 6-недельного возраста при первой вакцинации и до 11-16-месячного возраста при повторной прививке. Во всех исследованиях у детей Превенар-13 вводили вместе со стандартными вакцинами для детей (см. Главу «Взаимодействия»).
Безопасность была также оценена у 354 ранее непривитых детей (в возрасте от 7 месяцев до 5 лет).
Наиболее частыми побочными эффектами были реакции в месте инъекции, лихорадка, раздражительность, снижение аппетита и увеличение и / или снижение уровня сна.
Не было исследований, оценивающих частоту лихорадки, общую безопасность и иммуногенность после одновременного введения Превенара 13 и Инфанрикса гекса по сравнению с одним Инфанриксом гекса. В клинических испытаниях с Превенар (7-валентным) у детей, вакцинированных в возрасте 2, 3 и 4 месяцев, лихорадка ≥38 ° C чаще отмечалась у детей, получавших 7-валентный Превенар вместе с Infanrix hexa вводили (от 28,3% до 42,3%), чем у детей, получавших только Инфанрикс гекса (15,6% до 23,1%). После бустерной дозы в возрасте 12-15 месяцев у 50,0% детей, получавших 7-валентный Превенар с Инфанриксом гекса, была лихорадка ≥38 ° C по сравнению с 33,6% детей, которым давали только Инфанрикс гекса. Лихорадка> 39. 5,6 ° С наблюдали у 2,6% вакцинированных при введении Инфанрикс гекса и 7-валентного Превенара и у 1,5% вакцины при введении Инфанрикса гекса. Большинство из этих реакций были умеренными и временными.
Реакции в месте инъекции чаще регистрировались у детей старше 12 месяцев, чем у детей во время первичной вакцинации Превнаром 13.
Побочные эффекты от клинических испытаний
В клинических исследованиях профиль безопасности Превенара 13 был похож на Превенар. Частоты, перечисленные ниже, основаны на побочных эффектах, которые считались связанными с вакцинацией в исследованиях Превенар 13:
Расстройства иммунной системы
Редко: реакция гиперчувствительности, включая отек лица, одышка, бронхоспазм.
Расстройства нервной системы
Нечасто: судороги (включая фебрильные судороги).
Редкий: гипотонически-гипореактивный эпизод.
Желудочно-кишечные расстройства
Очень часто: снижение аппетита (42%).
Общие: рвота; Диарея.
Заболевания кожи и подкожной клетчатки
Общее: сыпь.
Нечасто: крапивница или крапивница
Общие расстройства и жалобы администрации сайта
Очень часто: лихорадка (43%); Раздражительность (69%); Эритема (44%), затвердевание / припухлость (33%) или боль / нежность (52%) в месте инъекции; Сонливость (59%); плохое качество сна (36%), эритема 2,5-7,0 см (12% или 38%) или затвердевание / припухлость 2,5-7,0 см (12% или 25%) в месте инъекции (после бустерной дозы или у пожилых людей [ От 2 до 5 лет] дети).
Общий: лихорадка> 39 ° C; Ограничение движения в месте инъекции (из-за боли); Эритема или отвердение / припухлость 2,5-7,0 см в месте инъекции (после базовой иммунизации у детей).
Нечасто: эритема, уплотнение / отек> 7,0 см в месте инъекции; Плач.
Побочные эффекты от спонтанной записи после запуска Превенара
Хотя в исследованиях с Превенаром 13 не наблюдалось следующих побочных эффектов, они считаются побочными эффектами как Превенар, так и Превенар 13. Частоты основаны на частоте спонтанных сообщений с Превенаром.
Расстройства крови и лимфатической системы
Очень редко: лимфаденопатия (локализуется вокруг места инъекции).
Расстройства иммунной системы
Редко: анафилактическая / анафилактоидная реакция, включая шок; Отек Квинке.
Заболевания кожи и подкожной клетчатки
Очень редко: мультиформная эритема.
Общие расстройства и жалобы администрации сайта
Редкие: крапивница, дерматит, зуд в месте введения; Промывка.
С Превенаром 13, следующие побочные эффекты были зарегистрированы спонтанно после выхода на рынок, хотя из-за более низкого воздействия не может быть получена информация об относительной частоте: лимфаденопатия, анафилактические и анафилактоидные реакции, включая шок, ангионевротический отек, мультиформная эритема, крапивница, дерматит, зуд в месте инъекции Промывка лица и / или тела.
Дополнительная информация для особых групп людей
Апноэ у чрезвычайно недоношенных детей (до или на 28-й неделе беременности, см. Главу «Предупреждения и меры предосторожности»).
В исследовании, сравнивавшем приблизительно 100 недоношенных детей и приблизительно 100 детей, родившихся вовремя, первичная вакцинация с 3 дозами после 1-й и 2-й дозы снизила аппетит и после 2-й дозы раздражительность / плохое качество сна были значительно более частыми у недоношенных детей ( см. главу «Свойства / Эффекты»).
При сравнении приблизительно 100 недоношенных детей с приблизительно 100 новорожденными, родившимися вовремя, серьезные нежелательные явления, наблюдаемые в исследовании, были распределены, как показано в таблице 1 ниже.
Таблица 1: Серьезные побочные эффекты - первичная иммунизация:
Группа (как включено в исследование) | ||||||||
|---|---|---|---|---|---|---|---|---|
Группа 1 | Группа 2 | |||||||
Системные классы органов / Предпочитаемое название | Количество | % | Количество | Количество | % | Количество | р-значение с | |
Все события | 14 | 14,0 | двадцатый | 5 | 5.0 | 6 | 0,051 | |
Желудочно-кишечные расстройства | третий | 3.0 | третий | 0 | 0.0 | 0 | 0,246 | |
| второй | 2,0 | второй | 0 | 0.0 | 0 | 0,497 | |
| 1 | 1,0 | 1 | 0 | 0.0 | 0 | > 0,99 | |
Инфекции и паразитарные болезни | 12 | 12,0 | 14 | 5 | 5.0 | 6 | 0,126 | |
| 0 | 0.0 | 0 | 1 | 1,0 | 1 | > 0,99 | |
| четвёртый | 4,0 | четвёртый | второй | 2,0 | второй | 0,683 | |
| 0 | 0.0 | 0 | 1 | 1,0 | 1 | > 0,99 | |
| 1 | 1,0 | 1 | 0 | 0.0 | 0 | > 0,99 | |
| второй | 2,0 | второй | 1 | 1,0 | 1 | > 0,99 | |
| второй | 2,0 | второй | 0 | 0.0 | 0 | 0,497 | |
| 1 | 1,0 | 1 | 0 | 0.0 | 0 | > 0,99 | |
| второй | 2,0 | второй | 1 | 1,0 | 1 | > 0,99 | |
| второй | 2,0 | второй | 0 | 0.0 | 0 | 0,497 | |
Нарушения обмена веществ и питания | 1 | 1,0 | 1 | 0 | 0.0 | 0 | > 0,99 | |
| 1 | 1,0 | 1 | 0 | 0.0 | 0 | > 0,99 | |
Репродуктивная система и заболевания молочной железы | 1 | 1,0 | 1 | 0 | 0.0 | 0 | > 0,99 | |
| 1 | 1,0 | 1 | 0 | 0.0 | 0 | > 0,99 | |
Респираторные, грудной и средостения расстройства | 1 | 1,0 | 1 | 0 | 0.0 | 0 | > 0,99 | |
| 1 | 1,0 | 1 | 0 | 0.0 | 0 | > 0,99 | |
Количество предметов , для которых было сообщено по крайней мере , одно событие.
b Для одного субъекта можно сообщить о нескольких событиях.
c Точный критерий Фишера, двусторонний, используется для расчета разницы между группами вакцин в процентах от субъектов, для которых было сообщено о событии.
передозировка
Передозировка Превенара 13 маловероятна из-за его лекарственной формы в виде предварительно заполненного шприца. Тем не менее, были сообщения о передозировках с Превенаром 13, которые были определены как таковые, если рекомендуемое минимальное расстояние между последующей дозой и предыдущей дозой не было достигнуто. В целом, побочные эффекты, о которых сообщалось после передозировки, были сопоставимы с побочными эффектами, о которых сообщалось в Превенаре 13 согласно рекомендуемым схемам вакцинации.
Свойства / эффекты
Код ATC: J07AL02
Превенар 13 содержит 7 полисахаридов пневмококковых капсул, содержащихся в Превнаре (4, 6В, 9В, 14, 18С, 19F, 23F) и 6 других полисахаридах (1, 3, 5, 6А, 7F, 19А), все конъюгированные к белку-носителю CRM 197 .
Бремя болезней у младенцев и детей в возрасте от 6 недель до 5 лет
Превенар 13 охват серотипов варьируется от страны к стране и меняется со временем. На основании мониторинга серотипа в Европе до введения препарата Превенар было подсчитано, что 73-100% (в зависимости от страны) серотипа, вызывающего инвазивное пневмококковое заболевание (ИПД) у детей в возрасте до 5 лет , были покрыты Превнар 13.
Острый средний отит (АОМ) является распространенным заболеванием у детей с различной этиологией. Бактерии несут ответственность за 60-70% клинических эпизодов АОМ. S. pneumoniae является одной из наиболее распространенных причин бактериального АОМ во всем мире.
Введение Превенара и впоследствии Превенара 13 в Европе значительно сократило долю пневмококковых заболеваний из-за вакцинных серотипов. Однако из-за различных базовых эпидемиологических показателей, официальных рекомендаций и показателей вакцинации в каждой стране уменьшение общего числа всех инвазивных и неинвазивных пневмококковых инфекций до сих пор не было продемонстрировано последовательно для всех европейских стран и всех возрастных групп. Наибольшее относительное снижение инвазивных пневмококковых инфекций в целом наблюдается в возрастной группе <2 года. Более поздние эпидемиологические данные из Европы (2013 г.) показывают, что охват серотипом вакцины Превенар 13 составляет примерно 26-68% среди детей в возрасте 5 лет и моложе.
Превенар 13 следует использовать на основе официальных рекомендаций и учитывать риск возникновения пневмококковой инфекции в разных возрастных группах и эпидемиологию серотипа в разных географических зонах.
Клинические исследования иммуногенности с Превенаром 13
Защитный эффект Превенара 13 против IPD не был клинически проверен. В соответствии с рекомендацией Всемирной организации здравоохранения (ВОЗ) оценка потенциальной эффективности против IPD основана на сравнении иммунных ответов на семь распространенных серотипов, которые содержатся как в «Превнаре 13», так и «Превнаре» и для которых был продемонстрирован защитный эффект. Иммунные ответы на 6 дополнительных серотипов были также измерены.
Иммунные реакции у детей после первичной иммунизации с тремя дозами
Клинические исследования были проведены в нескольких европейских странах и в США с различными графиками вакцинации; в том числе два рандомизированных исследования не неполноценности (в Германии с использованием первичной вакцинации через 2, 3 и 4 месяца [006] и в США с использованием первичной вакцинации через 2, 4 и 6 месяцев [004]). В этих двух исследованиях сравнивали пневмококковые иммунные ответы с использованием различных критериев, не связанных с неполноценностью, например, процент участников исследования с серотип-специфическим антиполисахаридным сывороточным IgG ≥0,35 мкг / мл через один месяц после базовой иммунизации и сравнение среднего геометрического. Концентрации IgG (ELISA GMCs); Кроме того, функциональные титры антител (OPA) участников исследования, получавших Превенар 13, сравнивали с таковыми кто получал превенар по сравнению. Для шести дополнительных серотипов эти значения сравнивались с наименьшим иммунным ответом среди всех семи распространенных серотипов у ревенарных реципиентов.
Сравнение иммунных ответов на неполноценность из исследования 006, основанное на доле детей, достигших концентрации антиполисахаридного IgG ≥0,35 мкг / мл, показано в таблице 2. Результаты исследования 004 были схожими. Non-неполноценность Превенара 13 (нижний предел 95% ДИ для процентного различия респондеров при 0,35 мкг / мл между группами был> -10%) был показан для всех 7 распространенных серотипов, но для серотипа 6B в исследовании 006 и для серотипов 6B и 9V в исследовании 004 просто не хватало. Все 7 распространенных серотипов соответствовали заранее определенным критериям неполноценности для IgG ELISA GMC. Превенар-13 индуцировал сопоставимые, но немного более низкие уровни антител, чем Превенар, для 7 распространенных серотипов.
Неполноценность была достигнута для 6 дополнительных серотипов в исследовании 006 на основе доли младенцев, достигающих уровней антител ≥0,35 мкг / мл, и сравнения ГМС IgG ELISA; аналогично для 5 из 6 серотипов в исследовании 004, за исключением серотипа 3. Для серотипа 3 процент получателей Превенара 13 с сывороточным IgG ≥0,35 мкг / мл составил 98,2% (исследование 006) и 63,5% (исследование 004 ).
Таблица 2: Сравнение доли участников исследования, которые достигли концентрации пневмококкового антиполисахаридного антитела IgG ≥0,35 мкг / мл после 3-й дозы серии вакцинации детей - исследование 006:
Серотипы | Превенар 13 | Превенар (7-валентный) | Разница |
Серотипы в Превнаре (7-валентный) | |||
четвёртый | 98,2 | 98,2 | 0,0 (-2,5, 2,6) |
6B | 77,5 | 87,1 | -9,6 (-16,0, -3,3) |
9В | 98,6 | 96,4 | 2,2 (-0,4, 5,2) |
14 | 98,9 | 97,5 | 1,5 (-0,9, 4,1) |
18C | 97,2 | 98,6 | -1,4 (-4,2, 1,2) |
19F | 95,8 | 96,0 | -0,3 (-3,8, 3,3) |
23F | 88,7 | 89,5 | -0,8 (-6,0, 4,5) |
Дополнительные серотипы в Превнар 13 | |||
1 | 96,1 | 87,1 * | 9,1 (4,5, 13,9) |
третий | 98,2 | 87,1 | 11,2 (7,0, 15,8) |
5 | 93,0 | 87,1 | 5,9 (0,8, 11,1) |
6A | 91,9 | 87,1 | 4,8 (-0,3, 10,1) |
7F | 98,6 | 87,1 | 11,5 (7,4, 16,1) |
19А | 99,3 | 87,1 | 12,2 (8,3, 16,8) |
* Серотип 6В был серотипом в Превнаре с самым низким процентным процентом ответов в исследовании 006 (87,1%).
Превенар 13 индуцировал функциональные антитела против всех 13 вакцинных серотипов в исследованиях 004 и 006 Для 7 распространенных серотипов не было различий между группами в отношении доли участников исследования с титрами ОРА ≥1: 8. Для каждого из 7 распространенных серотипов> 96% и> 90% реципиентов Превенар 13 в исследованиях 006 и 004 достигли титра OPA ≥1: 8 через месяц после первичной иммунизации.
В каждом из 6 дополнительных серотипов Превенара 13 в исследованиях 004/006 индуцировали через один месяц после первичной вакцинации у 91,4-100% вакцинированных титров ОРА ≥1: 8. Среднее геометрическое значение титров функциональных антител (ОРА) было ниже для серотипов 1, 3 и 5, чем соответствующие титры для других дополнительных серотипов; Клиническое значение этого открытия для защитного эффекта неизвестно.
Иммунные ответы после первичной иммунизации с двумя дозами
Иммуногенность после введения двух доз детям была задокументирована в четырех исследованиях. Доля детей, достигших концентрации пневмококкового антикапсулированного полисахаридного IgG ≥0,35 мкг / мл через месяц после введения второй дозы, составляла от 79,6% до 98,5% в 11 из 13 серотипов вакцины. Меньшая доля младенцев достигла этого предела концентрации антител для серотипов 6B (27,9-57,3%) и 23F (55,8-68,1%) во всех исследованиях с графиком вакцинации на 2 и 4 месяца по сравнению с 58,4% (6B) или 68,6% (23F) в исследовании с графиком вакцинации на 3 и 5 месяцев. После бустерной дозы все серотипы вакцины, включая 6B и 23F, получали иммунные ответы, которые соответствовали адекватной первичной иммунизации с использованием схемы первичной иммунизации с 2 дозами. В исследовании, проведенном в Великобритании, ответы на функциональные антитела (OPA) были сопоставимы для всех серотипов, включая 6B и 23F в группах Превенара и Превенар 13 после исходного уровня в возрасте двух и четырех месяцев и после бустерной дозы в возрасте 12 месяцев. У получателей Превенара 13 доля респондеров с титром OPA ≥1: 8 после серии вакцинации детей составляла не менее 87% и не менее 93% после бустерной дозы. Среднегеометрические значения титра для серотипов 1, 3 и 5 были ниже, чем соответствующий титр для других дополнительных серотипов; Клиническая значимость этого открытия неизвестна.
Вспомогательные реакции после базовой вакцинации двумя и тремя дозами
После введения бустерной дозы концентрации антител были выше для всех 13 серотипов, чем до бустерной дозы. Концентрации антител были выше после бустерной вакцинации для 12 серотипов, чем после первичной иммунизации. Эти наблюдения соответствуют адекватному праймированию (индукция иммунологической памяти). Иммунный ответ после введения бустерной вакцины для серотипа 3 не был сильнее, чем после первичной вакцинации; Клиническая значимость этого наблюдения в отношении индукции иммунологической памяти для серотипа 3 неизвестна.
Ответы антител на бустерные дозы были сопоставимы для всех 13 серотипов вакцины после первичной вакцинации двумя дозами или тремя дозами.
У детей в возрасте от 7 месяцев до 5 лет соответствующие возрасту схемы вакцинации (как описано в главе «Дозировка / применение») генерируют ответы антикапсульного полисахаридного антитела IgG для каждого из 13 серотипов, которые по крайней мере сопоставимы с таковыми после первичной иммунизации тремя Банки у младенцев.
Стойкая стойкость антител не изучалась после использования Превенара 13 в качестве первичной вакцины плюс бустерной вакцины или после введения однократной дозы детям более старшего возраста. Со времени введения 7-валентного Превенара в 2000 году данные мониторинга пневмококковой инфекции не позволяют предположить, что иммунитет, выработанный Превенаром в младенчестве, со временем снизился.
Недоношенные дети
Безопасность и иммуногенность Превенара 13, вводимого в возрасте 2, 3, 4 и 12 месяцев, оценивали примерно у 100 недоношенных детей (предполагаемый гестационный возраст (EGA) 31 неделя; диапазон 26-36 недель) и приблизительно 100 детей, рожденных вовремя (среднее значение EGA 39 недель; диапазон 37-42 недели).
Сравнение иммунных ответов у недоношенных детей и детей, родившихся вовремя, было основано на доле детей, достигших концентрации пневмококкового полисахарид-связывающего антитела IgG ≥0,35 мкг / мл через 1 месяц после первичной иммунизации. Это соответствует процедуре, используемой в сравнениях иммуногенности Превенара 13 и Превенара, и основано на руководящих принципах ВОЗ.
Более 85% недоношенных детей достигли концентрации пневмококкового полисахаридсвязывающего антитела IgG ≥0,35 мкг / мл через 1 месяц после первичной иммунизации, за исключением серотипов 5 (71,7%), 6А (82,7%) и 6В (72,7%). Для этих 3 серотипов доля респондеров среди недоношенных детей была значительно ниже, чем среди детей, родившихся вовремя. Приблизительно через 1 месяц после бустерной дозы доля субъектов в каждой группе, которые достигли этого же предела концентрации антител, составляла> 97%, за исключением серотипа 3 (71% у недоношенных детей и 79% у своевременных детей). Неизвестно, индуцируется ли иммунологическая память для всех серотипов у недоношенных детей.
После первичной иммунизации OPA-GMT были одинаковыми у недоношенных и своевременных детей, за исключением серотипа 5, который был ниже у недоношенных детей. После бустерной дозы OPA-GMT были сходными или ниже для 4 серотипов (4, 14, 18C, 19F) по сравнению с таковыми после первичной иммунизации и были статистически значимо выше для 6 из 13 серотипов (1, 3, 5, 7F, 9V). и 19A) у недоношенных детей по сравнению с 10 из 13 серотипов (1, 3, 4, 5, 6A, 7F, 9V, 18C, 19A и 23F) у своевременных детей.
Иммунный ответ после подкожного введения
Превенар 13 подкожного введения был исследован в не сравнительном исследовании у 185 здоровых японских младенцев и детей, получавших 4 дозы в возрасте 2, 4, 6 и 12-15 месяцев. Исследование показало, что безопасность и иммуногенность в целом сопоставимы с наблюдениями исследований внутримышечного введения.
Защитный эффект Превенар (7-валентная вакцина)
Эффективность 7-валентного Превенара была изучена в двух масштабных исследованиях - исследование Kaiser Permanente (NCKP) в Северной Калифорнии и исследование Finitis Media Otitis Media (FinOM). Оба были рандомизированными, двойными слепыми, контролируемыми лекарственными средствами исследованиями у детей, которые получали либо Превенар, либо контрольную вакцину (NCKP: менингококковая конъюгатная серогруппа C-CRM [MnCC], FinOM: вакцина против гепатита B) в соответствии с графиком вакцинации с 4 Получены дозы в возрасте 2, 4, 6 и 12-15 месяцев. Результаты эффективности этих исследований (для инвазивного пневмококкового заболевания, пневмонии и острого среднего отита) показаны ниже (таблица 3).
Таблица 3: Сводка эффективности 7-валентного Превенара 1 :
экспертиза | N | VE 2 | 95% AI |
|---|---|---|---|
NCKP: вакцина серотипа IPD 3 | 30258 | 97% | 85, 100 |
NCKP: клиническая пневмония с патологическим рентгеном грудной клетки | 23746 | 35% | 4, 56 |
NCKP: Острый средний отит (АОМ) 4 | 23746 | ||
| 7% | 4, 10 | |
| 9% | 3, 15 | |
| 23% | 7, 36 | |
| 20% | 2, 35 | |
ФинОМ: АОМ | 1662 | ||
| 6% | -4, 16 | |
| 34% | 21, 45 | |
| 57% | 44, 67 |
1 на протокол
2 «Эффективность вакцин»
С 3 октября 1995 года по 20 апреля 1999 года
С 4 октября 1995 г. по 30 апреля 1998 г.
Эффективность Превенар (7-валентный)
Эффективность (прямые и непрямые эффекты) 7-валентного Превенара против пневмококкового заболевания была исследована в программах первичной иммунизации с тремя и двумя дозами, каждая из которых сопровождалась бустерной дозой (таблица 4). После повсеместного использования препарата Превенар частота ИБП постоянно и значительно снижается. В некоторых странах сообщалось об увеличении частоты случаев IPD, вызванных серотипами, не обнаруженными в Превенаре, такими как 1, 7F и 19A. Мониторинг продолжается в рамках Превенара 13; информация в этой таблице может измениться, поскольку страны обновляют свои данные наблюдений.
Используя метод скрининга, оценки серотип-специфической эффективности при введении 2 доз в возрасте до 1 года в Великобритании составили 66% (-29, 91%) и 100% (25, 100%) для серотипов 6B и 6B соответственно 23F.
Таблица 4: Сводка данных об эффективности 7-валентного Превенара при инвазивных пневмококковых заболеваниях
Страна | Рекомендуемый график вакцинации | % Снижение заболеваемости | 95% AI |
Великобритания (Англия и Уэльс) 1 | 2, 4, + 13 месяцев | Серотипы вакцины: | 49,95% |
США (2000) | 2, 4, 6, + 12-15 месяцев | ||
Дети <5 2 | Серотипы вакцин: 98% | 97, 99% | |
Все серотипы: 77% | 73, 79% | ||
Люди ≥65 3 | Серотипы вакцины: 76% | - | |
Все серотипы: 38% | - | ||
Канада (Квебек) 4 | 2, 4, + 12 месяцев | Все серотипы: 73% | |
Вакцина серотипов: | |||
Базовая вакцинация с 2 дозами: 99% | 92, 100% | ||
Заполненный график вакцинации: 100% | 82, 100% |
1 ребенок до 2 лет. Расчетная эффективность вакцины на июнь 2008 года (метод Брума).
2 2005 данные.
3 данные 2004 года.
4 детей до 5 лет. С января 2005 года по декабрь 2007 года. Полных данных об эффективности стандартного графика вакцинации 2 + 1 пока нет.
Эффективность Превенара в схеме вакцинации 3 + 1 также наблюдалась при остром среднем отите и пневмонии с момента его введения в национальную программу вакцинации. В ретроспективном анализе большой страховой базы данных США число посещений врача из-за АОМ у детей в возрасте до 2 лет снизилось на 42,7% (95% ДИ, 42,4-43,1%), а количество рецептов на АОМ - на 41,9% по сравнению с частотой до поступления. (2004 г. по сравнению с 1997-1999 гг.). В аналогичном анализе число госпитализаций и посещений клиники сократилось на 52,4% и 41,1% соответственно по любой причине. При заболеваниях, которые были специально идентифицированы как пневмококковая пневмония, дети в возрасте до 2 лет сократили количество обращений в больницу и посещения офиса на 57,6% и 46 соответственно. 9% по сравнению с частотой до поступления (2004 г. по сравнению с 1997-1999 гг.). Наблюдательный анализ этого типа не может определить непосредственную причину и следствие, но эти результаты позволяют предположить, что Превенар играет важную роль в снижении бремени болезней, вызываемых заболеваниями слизистой оболочки (АОМ и пневмония) в целевой популяции.
Дополнительные данные об иммуногенности Превенар (7-валентный): дети с серповидноклеточной анемией
Иммуногенность Превенара была оценена в открытом многоцентровом исследовании у 49 детей с серповидно-клеточной анемией. Детей вакцинировали Превенаром (3 дозы в месяц с интервалом в 2 месяца), 46 из этих детей дополнительно получили 23-валентную пневмококковую полисахаридную вакцину в возрасте 15-18 месяцев. После первичной иммунизации 95,6% субъектов имели уровни антител по меньшей мере 0,35 мкг / мл против всех семи серотипов, содержащихся в Превенаре. После вакцинации полисахаридом наблюдалось значительное повышение уровня антител против семи серотипов, что указывает на хорошо установленную иммунологическую память.
Фармакокинетика
Оценка фармакокинетических свойств не требуется для вакцин.
Доклинические данные
Традиционные исследования с применением вакцины Превенар 13 по фармакологии безопасности, токсичности при повторных дозах, токсичности для несовершеннолетних и местной толерантности не привели к какому-либо особому риску для людей.
Другие уведомления
Несовместимость
Превенар 13 нельзя смешивать с другими вакцинами / лекарствами в одном шприце.
долговечность
Лекарственное средство следует использовать только до даты, указанной на упаковке «EXP».
Специальные инструкции по хранению
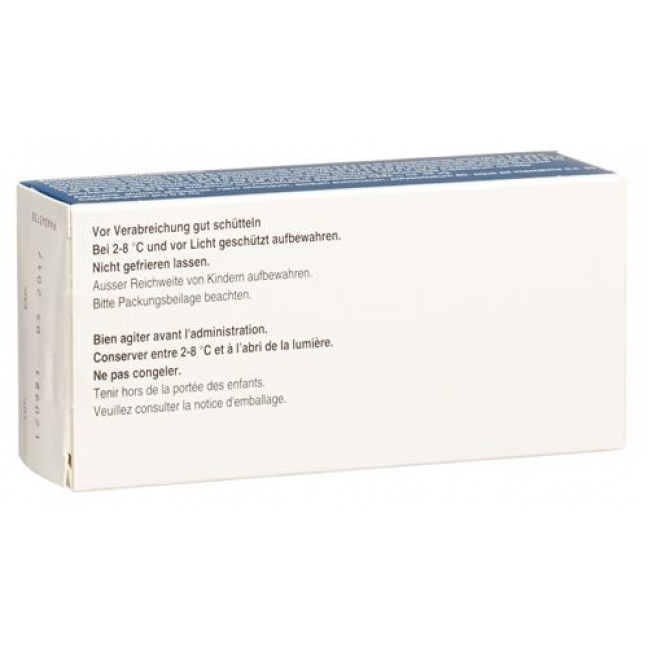
Хранить в холодильнике (2-8 ° C) и вдали от света.
Не замораживать. Замороженную вакцину следует выбросить.
Белый осадок и прозрачный супернатант могут наблюдаться во время хранения.
Превенар 13 стабилен в течение 4 дней при температуре до 25 ° С. Однако в конце этого периода, Превенар 13 должен быть использован или утилизирован. Эта информация не является рекомендацией для транспортировки или хранения, а служит только для руководства медицинского персонала в случаях, когда температура хранения временно превышена.
Храните в недоступном для детей месте.
Инструкция по обращению
Вакцина должна быть взболтана задолго до администрации, чтобы получить гомогенную белую суспензию. Это следует проверить визуально на наличие посторонних частиц и / или изменения внешнего вида перед использованием. Не используйте контент, если он выглядит иначе.
Любой неиспользованный продукт или отходы должны быть утилизированы в соответствии с местными правилами.
Номер одобрения
60129 (Swissmedic).
Владелец маркетинговой авторизации
Pfizer AG, Цюрих.
Отзывов (0)
Похожие товары

Бесплатная консультация опытного специалиста
Опишите симптомы или нужный препарат – мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой на дом или просто проконсультируем.
Нас 14 специалистов и 0 ботов. Мы всегда будем с вами на связи и сможем связаться в любое время.