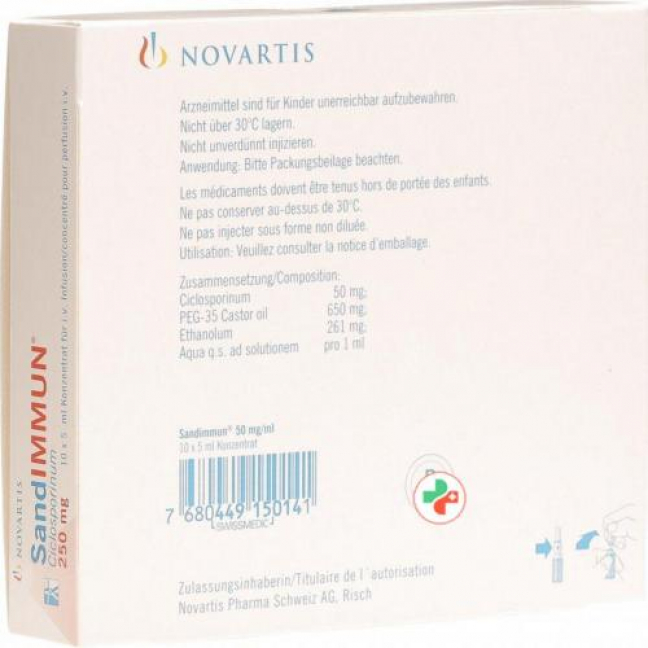
Sandimmun 250 mg/5 ml 10 Ampullen 5 ml
Sandimmun 250 mg/5 ml 10 Ampullen 5 ml
-
35118.93 RUB
Предполагаемая дата доставки:
25.12.2025 - 08.01.2026
При оплате криптовалютой:
Ваша прибыль 3511.89 RUB / 41.45 USDT
- Наличие: В наличии
- Производитель: NOVARTIS SCHWEIZ AG
- Модель: 1117827
- ATC-код L04AD01
- EAN 7680449150141
Состав:
Описание
AMZV
Zusammensetzung
Wirkstoff: Ciclosporinum.
Hilfsstoffe: PEG-35 Castor oil (polyoxyäthyliertes Rizinusöl) 650 mg, Ethanolum 261 mg, Aqua q.s. ad sol.
Galenische Form und Wirkstoffmenge pro Einheit
i.v. Infusionskonzentrat zu 50 mg/ml.
Indikationen/Anwendungsmöglichkeiten
Organtransplantation
- Prophylaxe der Abstossung allogener Nieren-, Leber-, Herz-, kombinierter Herz-Lungen-, Lungen- und Pankreas-Transplantate.
- Behandlung von Abstossungserscheinungen bei Patienten, die bereits mit anderen Immunsuppressiva behandelt wurden.
Wegen des Anaphylaxie-Risikos (s. «Warnhinweise und Vorsichtsmassnahmen») soll die i.v. Infusion von Sandimmun nur bei Patienten angewendet werden, die nicht in der Lage sind, das Präparat oral einzunehmen (z.B. kurz nach der Operation), oder bei denen die enterale Resorption infolge gastrointestinaler Störungen vermindert ist. In solchen Fällen wird empfohlen, so bald als möglich auf die orale Behandlung mit Sandimmun Neoral überzugehen.
Knochenmarktransplantation
- Prophylaxe der Transplantatabstossung bei Knochenmarktransplantation.
- Initialtherapie der Prophylaxe oder Behandlung der Graft-versus-host-disease (GvHD).
Dosierung/Anwendung
Die nachstehenden Dosierungsempfehlungen sollen lediglich als Richtlinien gelten. Die empfohlene Dosis beträgt 3-5 mg/kg, was ca. einem Drittel der entsprechenden oralen Dosis entspricht. Die Ciclosporin-Blutspiegel müssen regelmässig kontrolliert werden (sie können mit einer RIA-Methode auf der Basis von monoklonalen Antikörpern bestimmt werden). Die erhaltenen Ergebnisse dienen als Richtlinie für die Bestimmung der für die einzelnen Patienten erforderlichen Dosierung, mit der die erwünschten Zielkonzentrationen erreicht werden.
Organtransplantation
Wird Sandimmun zusammen mit anderen Immunsuppressiva (z.B. mit Kortikosteroiden oder im Rahmen einer drei- oder vierfachen Arzneimitteltherapie) verabreicht, kann niedriger dosiert werden (z.B. 1-2 mg/kg/d i.v., gefolgt von 3-6 mg/kg/d p.o. zur Initialbehandlung). Es empfiehlt sich, die Patienten so früh wie möglich auf die orale Behandlung mit Sandimmun Neoral umzustellen.
Knochenmarktransplantation
Die Initialdosis ist am Tag vor der Transplantation zu verabreichen. In den meisten Fällen empfiehlt sich zu diesem Zweck die i.v. Infusion in einer Dosierung von 3-5 mg/kg/d. In der unmittelbar postoperativen Phase ist diese Dosierung täglich während maximal 2 Wochen beizubehalten, bis zur oralen Erhaltungstherapie in einer Tagesdosis von ca. 12.5 mg/kg übergegangen wird.
Bei Magen-Darm-Beschwerden, welche die Resorption beeinträchtigen können, kann die Anwendung von i.v. Infusionen notwendig werden.
Bei einigen Patienten kann es nach Absetzen von Sandimmun zu einer GvHD kommen, welche in der Regel auf die Wiederaufnahme der Therapie gut anspricht.
Anwendung in der Pädiatrie
Bei Kindern sind die Erfahrungen mit Ciclosporin immer noch limitiert. Erfahrungen mit Sandimmun in der Behandlung von Säuglingen liegen nicht vor. Bei über einjährigen Kindern, die Sandimmun in der Standarddosierung erhielten, zeigten sich keine besonderen Probleme. In mehreren Studien mit pädiatrischen Patienten benötigten und tolerierten diese höhere Dosen von Ciclosporin pro kg Körpergewicht als Erwachsene. Falls indessen schwere Leberfunktionsstörungen vorliegen, sind die Serum-Kreatininwerte (und wenn möglich der Ciclosporinspiegel) engmaschig zu überwachen und die Dosierung gegebenenfalls entsprechend anzupassen.
Anwendung bei älteren Patienten
In klinischen Studien zur rheumatoiden Arthritis mit oralem Ciclosporin waren 17.5% der Patienten 65 Jahre alt oder älter. Diese Patienten hatten unter der Therapie nach 3 bis 4 Monaten eine höhere Wahrscheinlichkeit eine systolische Hypertension zu entwickeln und einen Anstieg des Serum-Creatinins auf ≥50% über dem Ausgangswert zu zeigen.
Klinische Studien mit Sandimmun bei Transplantations- und Psoriasispatienten wiesen keine genügend grosse Zahl von Probanden im Alter von 65 Jahren oder älter auf, um darüber Aufschluss zu geben, ob sie im Vergleich zu jüngeren Probanden unterschiedlich reagieren. Im Allgemeinen sollte die Dosis bei älteren Patienten mit Vorsicht gewählt werden, unter Berücksichtigung der höheren Häufigkeit herabgesetzter Leber-, Nieren- oder Herzfunktion und gleichzeitig bestehender Erkrankungen oder Arzneimitteltherapien. Üblicherweise sollte die Therapie mit einer Dosis am unteren Ende des Dosierungsbereiches begonnen werden.
Behälter: s. «Sonstige Hinweise».
Kontraindikationen
Überempfindlichkeit gegenüber Ciclosporin oder einem Hilfsstoff von Sandimmun inklusive Überempfindlichkeit gegenüber polyoxyäthyliertem Rizinusöl.
Warnhinweise und Vorsichtsmassnahmen
Sandimmun sollte nur von Ärzten verordnet werden, die auf dem Gebiet der immunsuppressiven Therapie Erfahrung haben und die ausreichende Nachuntersuchungen (regelmässige vollständige Allgemeinuntersuchung, Blutdruckmessung und Kontrolle der Laborsicherheitswerte) vornehmen können. Mit Sandimmun behandelte Transplantationspatienten sind in Zentren zu betreuen, die über entsprechende Labor- und medizinische Ausrüstung verfügen. Der für die Erhaltungstherapie zuständige Arzt muss eingehende Informationen zur guten Betreuung des Patienten erhalten.
Das i.v. Infusionskonzentrat enthält polyoxyäthyliertes Rizinusöl. Es wurde berichtet, dass dieses anaphylaktoide Reaktionen auslösen kann. Diese Reaktionen können aus Erröten (flushing) des Gesichts und des oberen Thorax und nicht kardiogenem Lungenoedem mit akuten Atembeschwerden, Atemnot und Keuchen, sowie Blutdruckveränderungen und erhöhter Herzfrequenz bestehen.
Bei Patienten, die früher mittels i.v. Injektion oder Infusion Arzneimittel erhielten, welche polyoxyäthyliertes Rizinusöl enthielten (z.B. Cremophor-EL-haltige Arzneimittel) oder bei Patienten mit einer allergischen Veranlagung ist deshalb besondere Vorsicht geboten. Folglich sollten Patienten, die Sandimmun i.v. verabreicht erhalten, zumindest während der ersten 30 Min nach Anlegen der Infusion ständig und nachher in kurzen Abständen überwacht werden. Bei Auftreten einer Anaphylaxie soll die Infusion abgesetzt werden. Eine wässrige Lösung von Adrenalin 1:1000 sowie eine Sauerstoffflasche sollten im Zimmer des Patienten zur Verfügung stehen.
Wegen des Anaphylaxie-Risikos sollte Sandimmun i.v. Infusionskonzentrat für Patienten reserviert bleiben, die nicht in der Lage sind, das Arzneimittel oral einzunehmen. In solchen Fällen wird empfohlen, sobald wie möglich auf die orale Behandlung mit Sandimmun Neoral überzugehen.
Die vorbeugende Verabreichung eines Antihistaminikums (H1- und H2-Blocker) vor der i.v. Sandimmun-Infusion konnte das Auftreten anaphylaktoider Reaktionen verhüten.
Wie andere Immunsuppressiva erhöht Ciclosporin das Risiko der Entwicklung von Lymphomen und anderen Malignomen insbesondere derjenigen der Haut.
Das erhöhte Risiko scheint eher im Zusammenhang zu stehen mit dem Grad und der Dauer der Immunsuppression als mit der Anwendung von spezifischen Arzneimitteln.
Zudem ist ein Behandlungsschema, das mehrere Immunsuppressiva enthält (einschliesslich Ciclosporin), mit Vorsicht anzuwenden, da dies zu lymphoproliferativen Störungen und soliden Tumoren anderer Organe führen kann, die tödlich verlaufen können.
Angesichts des potentiellen Risikos maligner Hautveränderungen sollten Patienten, die Sandimmun erhalten, insbesondere jene, die gegen Psoriasis oder atopische Dermatitis behandelt werden, vor übermässiger, ungeschützter Sonnenbestrahlung gewarnt und nicht gleichzeitig mit UV-B-Strahlen oder einer PUVA-Photochemotherapie behandelt werden (s. «Interaktionen»).
Wie bei anderen Immunsuppressiva werden Patienten unter Ciclosporin anfällig auf eine Vielzahl bakterieller, Pilz-, Parasiten- und viraler Infektionen, oft mit opportunistischen Krankheitserregern. Bei Patienten unter Ciclosporin wurde eine Aktivierung latenter Polyomavirus-Infektionen, die zu einer Polyomavirus assoziierten Nephropathie (PVAN), insbesondere einer BK-Virus Nephropathie (BKVN), oder zu einer JC-Virus assoziierten progressiven, multifokalen Leukoenzephalopathie (PML) führen kann, beobachtet. Diese Zustände sind oft Folge einer starken Immunsuppression und sollten bei immunsupprimierten Patienten mit sich verschlechternder Nierenfunktion oder neurologischen Symptomen in die Differentialdiagnose einbezogen werden. Schwerwiegende und/oder tödliche Verläufe wurden berichtet. BKVN kann zu Transplantatverlust führen. Es sollten wirksame präventive und therapeutische Vorkehrungen getroffen werden, insbesondere bei Patienten unter Langzeitbehandlung mit mehreren Immunsuppressiva. Bei Patienten mit einer PVAN oder PML sollte eine Reduktion der totalen Immunsuppression in Erwägung gezogen werden. Eine reduzierte Immunsuppression kann jedoch auch zu einer Transplantatgefährdung führen.
Als häufige und potentiell schwerwiegende Komplikation kann es in den ersten paar Wochen einer Sandimmun-Behandlung zu einem Anstieg der Serumkreatinin- und -Harnstoffwerte kommen. Diese funktionellen Veränderungen sind dosisabhängig und reversibel und normalisieren sich gewöhnlich bei einer Dosisreduktion. Bei einer Langzeitbehandlung können sich in einigen Fällen Strukturveränderungen der Nieren (z.B. eine interstitielle Fibrose) entwickeln, welche bei Patienten mit einer Nierentransplantation von Veränderungen infolge chronischer Abstossung zu unterscheiden sind.
Sandimmun kann auch einen dosisabhängigen, reversiblen Anstieg der Serumwerte von Bilirubin und Leberenzymen hervorrufen (s. «Unerwünschte Wirkungen»).
Die entsprechenden Leber- und Nierenfunktionsparameter sind regelmässig zu kontrollieren. Abnorme Werte können eine Dosisreduktion erforderlich machen.
Bei älteren Patienten sollte die Nierenfunktion mit spezieller Sorgfalt überwacht werden.
Ciclosporin-Blutspiegel werden vorzugsweise durch Bestimmung des unveränderten Wirkstoffes unter Verwendung des spezifischen monoklonalen Antikörpers oder mittels einer HPLC-basierten Analysemethode kontrolliert. Wird Plasma oder Serum verwendet, sollte nach einem Standard-Trennungsprotokoll mit definierten Werten für Zeit und Temperatur vorgegangen werden. Für die anfängliche Überwachung von Lebertransplantationspatienten ist entweder der spezifische monoklonale Antikörper zu verwenden oder es sind parallele Messungen unter Verwendung des spezifischen monoklonalen Antikörpers und des unspezifischen monoklonalen Antikörpers vorzunehmen, um eine angemessene Immunsuppression zu ermöglichen.
Es muss auch daran erinnert werden, dass die Ciclosporinkonzentration im Blut, Plasma oder Serum nur einer von vielen Faktoren ist, welche zum klinischen Status des Patienten beitragen. Die Ergebnisse sollten daher lediglich als Richtlinie für die Therapie im Gesamtzusammenhang mit anderen klinischen und biochemischen Parametern dienen (s. auch «Organtransplantation» Rubrik «Dosierung/Anwendung»).
Während einer Sandimmun-Behandlung sind regelmässige Blutdruckkontrollen erforderlich. Entwickelt sich eine Hypertonie, ist eine geeignete blutdrucksenkende Behandlung aufzunehmen. Bevorzugt soll ein Antihypertensivum gewählt werden, das keine pharmakokinetische Interaktion mit Ciclosporin zeigt (s. «Interaktionen»).
Da im Zusammenhang mit Sandimmun Behandlungen über Fälle eines reversiblen, leichten Anstiegs der Blutlipide berichtet wurde, werden vor der Behandlung sowie nach dem ersten Behandlungsmonat Blutlipidbestimmungen empfohlen. Bei erhöhten Lipidwerten ist eine Reduktion der Fettzufuhr in der Nahrung und allenfalls eine Dosisreduktion in Betracht zu ziehen.
Ciclosporin erhöht das Risiko von Hyperkaliämie, insbesondere bei Patienten mit Nierenfunktionsstörungen. Vorsicht ist geboten, wenn Ciclosporin verabreicht wird zusammen mit kaliumsparenden Arzneimitteln (z.B. kaliumsparenden Diuretika, Hemmern des Angiotensin umwandelnden Enzyms, Angiotensin II Rezeptor Antagonisten) und mit Arzneimitteln, die Kalium enthalten sowie bei Patienten unter kaliumreicher Ernährung (s. «Interaktionen»). In diesen Situationen ist die Überprüfung der Kaliumspiegel ratsam.
Besondere Vorsicht ist angezeigt bei der gleichzeitigen Verabreichung von Lercanidipin mit Ciclosporin (s. «Interaktionen»).
Ciclosporin kann die Plasmakonzentrationen und damit die dosisabhängigen Nebenwirkungsrisiken gleichzeitig eingenommener Arzneimittel erhöhen, die Substrate des Multidrug Efflux Transporters P-Glycoprotein oder des organischen Anion Transporter Proteinen (OAPT) sind, wie z.B. Aliskiren, Dabigatran oder Bosentan. Die gleichzeitige Einnahme von Ciclosporin und Aliskiren, oder Dabigatran, oder Bosentan sollte vermieden werden. (s. «Interaktionen»)
Ciclosporin erhöht die Ausscheidung von Magnesium. Dies kann zu symptomatischer Hypomagnesiämie führen, vor allem in der Peritransplantationszeit. Zudem sind während der Peritransplantationszeit Kontrollen der Magnesiumspiegel im Serum empfohlen, vor allem bei Auftreten von neurologischen Symptomen. Falls es als notwendig erachtet wird, soll zusätzlich Magnesium verabreicht werden.
Bei der Behandlung von Patienten mit Hyperurikämie ist Vorsicht geboten.
Während der Behandlung mit Ciclosporin kann eine Impfung weniger wirksam sein, und die Verabreichung von Lebendimpfstoffen sollte vermieden werden.
Interaktionen
Nahrungsmittelinteraktionen
Die gleichzeitige Einnahme von Grapefruit-Saft erhöht die Bioverfügbarkeit von Ciclosporin.
Arzneimittelinteraktionen
Von den zahlreichen Arzneimitteln, von denen über Interaktionen mit Ciclosporin berichtet wurde, werden jene nachstehend aufgeführt, für welche die Interaktionen genügend fundiert sind und als klinisch relevant erachtet werden.
Arzneimittel, die jene Leberenzyme, welche am Metabolismus und der Ausscheidung von Ciclosporin mitwirken, insbesondere CYP3A4, hemmen oder induzieren, beeinflussen die Plasma- oder Gesamtblutspiegel von Ciclosporin entsprechend. Ciclosporin ist ein Hemmer des CYP3A4 und ein hochpotenter Hemmer des P-Glycoproteins (P-gp/multidrug efflux transporter). Es kann die Plasmaspiegel der gleichzeitig verabreichten Arzneimittel, die Substrate von CYP3A4 oder P-gp sind, erhöhen.
Arzneimittel, welche die Ciclosporin-Spiegel herabsetzen
Barbiturate, Carbamazepin, Oxcarbazepin, Phenytoin, Nafcillin, Sulfadimidin i.v., Rifampicin, Octreotid, Probucol, Orlistat, Hypericum-Präparate, Ticlopidin, Sulfinpyrazon, Terbinafin, Bosentan.
Arzneimittel, welche die Ciclosporin-Spiegel erhöhen
Makrolid-Antibiotika (Erythromycin, Azithromycin und Clarithromycin), Ketoconazol, Fluconazol, Itraconazol, Voriconazol, Diltiazem, Nicardipin, Verapamil, Metoclopramid, orale Kontrazeptiva, Danazol, Methylprednisolon (hohe Dosis), Allopurinol, Amiodaron, Cholsäure und Derivate, sowie Proteasen-Hemmer, Imatinib, Colchicin, Nefazodon.
Andere relevante Arzneimittelinteraktionen
Vorsicht ist geboten bei der Anwendung von Ciclosporin zusammen mit anderen Arzneimitteln mit nephrotoxischen Eigenschaften: Aminoglykoside (inkl. Gentamycin, Tobramycin), Amphotericin B, Ciprofloxacin, Vancomycin, Trimethoprim (+ Sulfamethoxazol), nicht steroidale Antirheumatika (inkl. Diclofenac, Indometacin, Naproxen, Sulindac), Melphalan, Histamin H2-Rezeptor-Antagonisten (z.B. Cimetidin, Ranitidin), Methotrexat, Tacrolimus.
Im Vergleich zur alleinigen Verabreichung von Ciclosporin kann die gleichzeitige Gabe mit Nifedipin zu einem häufigeren Auftreten von Gingiva-Hyperplasie führen.
Nach gleichzeitiger Verabreichung von Ciclosporin und Lercanidipin war die AUC von Lercanidipin dreifach und diejenige von Ciclosporin um 21% erhöht. Bevorzugt soll ein Antihypertensivum gewählt werden, das keine pharmakokinetische Interaktion mit Ciclosporin zeigt.
Die gleichzeitige Verabreichung von Diclofenac und Ciclosporin führt zu einem signifikanten Anstieg der Bioverfügbarkeit von Diclofenac, mit der möglichen Folge einer reversiblen Niereninsuffizienz. Die erhöhte Bioverfügbarkeit von Diclofenac wird höchstwahrscheinlich durch eine Abnahme seines hohen «First-pass»-Effektes verursacht. Wenn nicht-steroidale Antirheumatika mit einem niedrigen «First-pass»-Effekt (z.B. Acetylsalizylsäure) zusammen mit Ciclosporin verabreicht werden, ist kein Anstieg derer Bioverfügbarkeit zu erwarten.
Ciclosporin kann auch die Clearance von Digoxin, Colchicin, Prednisolon und HMG-CoA Reduktase-Inhibitoren (Statinen), Etoposid, Aliskiren, Bosentan oder Dabigatran herabsetzen.
Eine schwere Digitalis-Intoxikation wurde bei einigen Patienten unter Digoxin innerhalb von Tagen nach Behandlungsbeginn mit Ciclosporin beobachtet. Es liegen auch Berichte über das Potential von Ciclosporin vor, die toxischen Effekte von Colchicin, wie Myopathie und Neuropathie, speziell bei Patienten mit renaler Dysfunktion, zu verstärken. Wenn Digoxin oder Colchicin gleichzeitig mit Ciclosporin angewendet werden, ist eine sorgfältige klinische Überwachung erforderlich, um toxische Manifestationen von Digoxin oder Colchicin frühzeitig erkennen zu können und gegebenenfalls die Dosis zu reduzieren oder das Präparat abzusetzen.
Eine signifikant erhöhte Aufnahme von Anthracyclin-Antibiotika (z.B. Doxorubicin, Mitoxantron, Daunorubicin) wurde bei Onkologie-Patienten bei intravenöser Co-Administration von Anthracyclin-Antibiotika mit Ciclosporin beobachtet.
In der Literatur und in Postmarketing-Studien wurden Fälle von Myotoxizität einschliesslich Muskelschmerz und –schwäche, Myositis und Rhabdomyolyse bei gleichzeitiger Anwendung von Ciclosporin mit Lovastatin, Simvastatin, Atorvastatin, Pravastatin und in selten Fällen Fluvastatin beschrieben. Bei gleichzeitiger Anwendung mit Ciclosporin sollte die Dosis dieser Statine entsprechend den Angaben der jeweiligen Fachinformation reduziert werden. Die Therapie mit Statinen muss bei Patienten mit Symptomen von Myopathie, oder bei solchen mit Risikofaktoren, die für schwere Nierenschädigungen predisponieren, einschliesslich sekundäres Nierenversagen nach Rhabdomyolyse, zeitweilig unterbrochen oder abgebrochen werden.
In Kombination mit Everolimus oder Sirolimus wurden Erhöhungen des Serum-Kreatinins beobachtet. Dieser Effekt ist bei einer Reduktion der Ciclosporin-Dosis oft reversibel. Everolimus und Sirolimus hatten nur einen geringen Einfluss auf die Pharmakokinetik von Ciclosporin. Umgekehrt waren die Blutwerte von Everolimus und Sirolimus signifikant erhöht.
Vorsicht ist angezeigt bei der gleichzeitigen Anwendung von Kalium-sparenden Arzneimitteln (z.B. Kalium-sparende Diuretika, Angiotensin-umwandelnde Enzymhemmer, Angiotensin II Rezeptor-Antagonisten, oder Arzneimittel, die Kalium enthalten, da sie zu einem signifikanten Anstieg des Kaliumspiegels im Serum führen kann.
Ciclosporin kann die Plasmakonzentration von Repaglinid und damit das Risiko einer Hypoglykämie erhöhen.
In pharmakokinetischen Interaktionsstudien mit gesunden Probanden wurde gezeigt, dass Bosentan die Ciclosporin-Spiegel um rund 35% vermindern kann, und umgekehrt die Bosentan-Exposition rund 2-fach erhöht ist.
Bei gleichzeitiger Verabreichung von Ciclosporin und Aliskiren erhöht sich die Konzentration Cmax des Aliskiren um das 2.5-fache und die AUC um das 5-fache. Jedoch wird dabei das pharmakokinetische Profil von Ciclosporin nicht signifikant verändert.
Die gleichzeitige Verabreichung von Dabigatran und Ciclosporin führt aufgrund der P-gp inhibierenden Wirkung des Ciclosporin zu einem Anstieg der Plasmakonzentration von Dabigatran (s. «Warnhinweise und Vorsichtsmassnahmen»). Dabigatran hat eine enge therapeutische Breite und ein Anstieg der Plasmakonzentration geht mit einem erhöhten Risiko von Blutungen einher.
Die gleichzeitige Anwendung von Ambrisentan und Ciclosporin führte zu 2-fach erhöhter Ambrisentan-Exposition und zu 10% höherer Ciclosporin-Exposition.
Empfehlungen
Wenn die gleichzeitige Anwendung von Arzneimitteln, von denen über Wechselwirkungen mit Ciclosporin berichtet wurde, nicht vermieden werden kann, sollten die folgenden grundlegenden Empfehlungen befolgt werden:
Während der gleichzeitigen Anwendung eines Mittels, welches eine nephrotoxische Synergie aufzeigen kann, sollte eine sorgfältige Überwachung der Nierenfunktion (insbesondere der Serum-Kreatininwerte) vorgenommen werden. Falls eine signifikante Beeinträchtigung der Nierenfunktion eintritt, sollte die Dosierung des gleichzeitig verabreichten Mittels reduziert oder eine andere Behandlung in Betracht gezogen werden.
Bei Transplantat-Empfängern gab es isolierte Fälle erheblicher, aber reversibler Nierenfunktionsstörungen (mit entsprechender Erhöhung des Serum-Kreatinins) nach gleichzeitiger Gabe von Fibraten (z.B. Bezafibrat, Fenofibrat). Die Nierenfunktion muss deshalb bei solchen Patienten sorgfältig überwacht werden. Im Falle einer signifikanten Nierenfunktionsstörung sollte die Komedikation abgesetzt werden.
Arzneimittel, von denen bekannt ist, dass sie die Bioverfügbarkeit von Ciclosporin herabsetzen oder erhöhen:
Bei Transplantationspatienten sind insbesondere zu Beginn und bei Beendung der Behandlung mit einem solchen Mittel häufige Ciclosporin-Blutspiegelbestimmungen und nötigenfalls eine Anpassung der Ciclosporin-Dosierung erforderlich.
Werden gleichzeitig Mittel verabreicht, von denen bekannt ist, dass sie die Ciclosporinspiegel erhöhen, können eine häufige Kontrolle der Nierenfunktion und eine sorgfältige Überwachung von durch Ciclosporin verursachten unerwünschten Wirkungen eher angebracht sein als Blutspiegelkontrollen.
Bei Patienten, bei denen unter Ciclosporin eine Gingiva-Hyperplasie aufgetreten ist, sollte die gleichzeitige Verabreichung von Nifedipin vermieden werden.
Nichtsteroidale Antirheumatika, die einem starken «First-pass»-Metabolismus unterliegen (z.B. Diclofenac), sollten in niedrigeren Dosen gegeben werden als wenn sie Patienten verabreicht werden, die kein Ciclosporin erhalten.
Bei gleichzeitiger Verabreichung von Digoxin, Colchicin, Lovastatin oder HMG-CoA Reduktase-Inhibitoren (Statine) mit Ciclosporin ist eine sorgfältige klinische Beobachtung erforderlich, um toxische Manifestationen frühzeitig erkennen zu können, um dann die Dosis zu reduzieren, oder das Präparat abzusetzen.
Bei älteren Patienten sind eher medikamentöse Interaktionen zu erwarten.
Schwangerschaft/Stillzeit
In Tierstudien wurde bei Ratten und Kaninchen Reproduktionstoxizität gezeigt (s. «Präklinische Daten»).
Die Daten zur Anwendung von Sandimmun bei schwangeren Frauen sind begrenzt. Schwangere Frauen, welche nach einer Transplantation mit Immunsuppressiva einschliesslich Ciclosporin und Ciclosporin-enthaltenden Therapieschemen behandelt werden, haben ein erhöhtes Risiko für eine Frühgeburt (<37 Wochen).
Es liegt eine limitierte Anzahl Beobachtungen von Kindern bis zum Alter von 7 Jahren vor, welche in utero Ciclosporin ausgesetzt waren (Angaben bei 12 Kindern erhoben). Nierenfunktion und Blutdruck bei diesen Kindern waren normal.
Aufgrund der Datenlage sollte Sandimmun während der Schwangerschaft nicht angewendet werden, es sei denn, der erwartete Nutzen überwiegt das potentielle Risiko.
Ciclosporin geht in die Muttermilch über. Da Sandimmun bei Säuglingen zu schweren unerwünschten Wirkungen führen kann, sollen Frauen, die mit Sandimmun behandelt werden, nicht stillen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es gibt keine Daten über die Auswirkung von Sandimmun auf die Fähigkeit, Fahrzeuge zu führen und Maschinen zu bedienen.
Unerwünschte Wirkungen
Viele unerwünschte Wirkungen, die im Zusammenhang mit der Ciclosporin-Behandlung stehen, sind dosisabhängig. Das Gesamtspektrum der unerwünschten Wirkungen ist bei den verschiedenen Indikationen im Wesentlichen dasselbe.
Anaphylaktoide Reaktionen wurden nach i.v.-Verabreichung beobachtet (s. «Warnhinweise und Vorsichtsmassnahmen»).
Infektionen
Patienten, die immunsuppressive Behandlungen einschliesslich Ciclosporin und Ciclosporin-enthaltende Therapieschemen erhalten, haben ein erhöhtes Risiko für Infektionen (Viren, Bakterien, Pilze, Parasiten) (s. Warnhinweise und Vorsichtsmassnahmen). Generalisierte wie auch lokalisierte Infektionen können auftreten, und bereits bestehende Infektionen sich verstärken. Reaktivierung von Polyomavirus-Infektionen kann zu einer Polyomavirus assoziierten Nephropathie (PVAN) oder zu einer JC-Virus assoziierten progressiven, multifokalen Leukoenzephalopathie (PML) führen. Schwerwiegende und/oder tödliche Verläufe wurden berichtet.
Benigne, maligne und unspezifizierte Neoplasmen (einschliesslich Zysten und Polypen)
Patienten unter immunsuppressiven Behandlungen einschliesslich Ciclosporin und Ciclosporin-enthaltenden Therapieschemen haben ein erhöhtes Risiko für die Entwicklung von Lymphomen oder lymphoproliferativen Erkrankungen und anderen bösartigen Tumoren, insbesondere der Haut. Die Häufigkeit von bösartigen Tumoren erhöht sich mit der Intensität und der Dauer der Behandlung (s. Warnhinweise und Vorsichtsmassnahmen). Gewisse bösartige Tumore können tödlich sein.
Die unerwünschten Wirkungen wurden entsprechend ihrer Häufigkeit (die häufigsten zuerst) aufgeführt, welche definiert ist als: «Sehr häufig» (≥1/10), «häufig» (<1/10, ≥1/100), «gelegentlich» (1/100, ≥1/1‘000), «selten» (<1/1‘000, >1/10'000), «sehr selten» (<1/10'000).
Erkrankungen des Blutes und des Lymphsystems Häufig: Leukopenie.
Gelegentlich: Anämie, Thrombozytopenie.
Selten: thrombotische Mikroangiopathie (einschliesslich thrombotisch-thrombozytopenische Purpura, hämolytisch-urämisches Syndrom).
Stoffwechsel und Ernährungsstörungen
Sehr häufig: Hyperlipidämie.
Häufig: Anorexie, Hyperurikämie, Hyperkaliämie, Hypomagnesiämie.
Selten: Hyperglykämie.
Erkrankungen des Nervensystem
Sehr häufig: Tremor (10-20%), Kopfschmerzen (bis ca. 15%) einschliesslich Migräne.
Häufig: Parästhesien.
Gelegentlich: Anzeichen einer Enzephalopathie inkl. posteriores reversibles Enzephalopathie-Syndrom (PRES): Konvulsionen, geistige Verwirrung, Desorientiertheit, verminderte Reaktionsfähigkeit, Agitiertheit, Schlaflosigkeit, Sehstörungen, kortikale Blindheit, Koma, Parese, zerebelläre Ataxie.
Selten: motorische Polyneuropathie.
Sehr selten: Sehnerven-Papillenoedem, einschliesslich Papillenoedem mit möglicher Verschlechterung des Sehvermögens, als Folge einer gutartigen intrakranialen Hypertonie.
Gefässerkrankungen
Sehr häufig: Hypertonie (15-40%).
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Übelkeit, Erbrechen, Abdominalschmerzen, Durchfall, Gingiva-Hyperplasie.
Häufig: Magengeschwür.
Selten: Pankreatitis.
Leber- und Gallenerkrankungen
Häufig: Leberschädigung (s. «Warnhinweise und Vorsichtsmassnahmen»).
Haut
Sehr häufig: Hypertrichosis.
Häufig: Akne, Rash.
Gelegentlich: allergische Hautreaktionen.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Muskelkrämpfe, Myalgie.
Selten: Muskelschwäche, Myopathie, Gliederschmerzen.
Erkrankungen der Nieren und Harnwege
Sehr häufig: Nierenfunktionsstörungen (Inzidenz je nach Indikation 10-50%).
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Selten: Menstruationsbeschwerden, Gynäkomastie.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Müdigkeit, Fieber, Oedem.
Gelegentlich: Gewichtszunahme.
Andere unerwünschte Wirkungen aus Erfahrung nach Markteinführung
Es liegen erhobene und spontane Post-Marketing-Berichte über Hepatoxizität und Leberschädigung einschliesslich Cholestase, Ikterus, Hepatitis und Leberversagen bei mit Ciclosporin behandelten Patienten vor. Die meisten Berichte beinhalteten Patienten mit signifikanten Komorbiditäten, Grunderkrankungen und anderen Störgrössen einschliesslich infektiösen Komplikationen und Begleitmedikationen mit hepatotoxischem Potential. In einigen Fällen, hauptsächlich bei Transplantationspatienten, wurde ein tödlicher Ausgang berichtet (s. «Warnhinweise und Vorsichtsmassnahmen»).
Überdosierung
Die Erfahrung mit akuter Ciclosporin-Überdosierung ist begrenzt. In allen Fällen von Überdosierung ist eine symptomatische Therapie einzuleiten und sind allgemeine unterstützende Massnahmen zu ergreifen. Es ist zu erwarten, dass sich allfällige Anzeichen von Nierenfunktionsstörung nach Absetzen des Arzneimittels zurückbilden.
Ciclosporin ist nicht in nennenswertem Ausmass dialysierbar und wird auch durch Kohlehämoperfusion nicht genügend ausgewaschen.
Eigenschaften/Wirkungen
ATC-Code: L04AD01
Wirkungsmechanismus/Pharmakodynamik
Ciclosporin ist ein zyklisches Polypeptid, bestehend aus 11 Aminosäuren. Ciclosporin ist ein hochwirksames Immunsuppressivum, das im Tierversuch die Lebensdauer allogener Transplantate (Haut, Herz, Niere, Pankreas, Knochenmark, Dünndarm und Lunge) verlängert. Untersuchungen zeigen, dass Ciclosporin zellgebundene Reaktionen - inklusive Immunität des Allotransplantats, verzögerte Hypersensibilität der Haut, experimentell allergische Enzephalomyelitis, Freund-Adjuvans-Arthritis, Graft-versus-host-disease (GvHD, Transplantat-gegen-Wirt-Reaktion) und T-Zell-abhängige Antikörperproduktion - sowie die Produktion und Freisetzung von Lymphokinen, inklusive Interleukin 2 (T-Zell-Wachstumsfaktor, TCGF), hemmt.
Es gibt Hinweise dafür, dass Ciclosporin die ruhenden Lymphozyten in der G0- oder der frühen G1-Phase des Zellzyklus blockiert und die durch Kontakt mit einem Antigen ausgelöste Freisetzung von Lymphokinen durch aktivierte T-Zellen hemmt.
Alle verfügbaren Unterlagen deuten darauf hin, dass Ciclosporin eine spezifische und reversible Wirkung auf die Lymphozyten ausübt. Im Gegensatz zu den Zytostatika beeinträchtigt Ciclosporin die Hämopoese nicht und hat keinen Einfluss auf die Funktion der Phagozyten. Mit Ciclosporin behandelte Transplantationspatienten sind weniger infektionsgefährdet als solche unter anderer (immunsuppressiver) Therapie.
Organ- und Knochenmarktransplantationen am Menschen unter Anwendung von Sandimmun zur Prophylaxe und Behandlung von Abstossung und GvHD sind erfolgreich durchgeführt worden.
Ciclosporin wurde sowohl bei Hepatitis C-positiven als auch bei Hepatitis C-negativen Transplantatempfängern erfolgreich angewendet.
Zudem hat Sandimmun auch bei einigen Zuständen Wirkung gezeigt, von denen bekannt ist bzw. angenommen werden kann, dass sie einen autoimmunen Ursprung haben.
Pharmakokinetik
Distribution
Ciclosporin verteilt sich weitgehend ausserhalb des Blutvolumens, mit einem scheinbaren Verteilungsvolumen von durchschnittlich 3.5 l/kg. Im Blut ist die Verteilung von der Wirkstoffkonzentration abhängig: Plasma 33-47%; Lymphozyten 4-9%; Granulozyten 5-12%; Erythrozyten 41-58%. Bei hohen Konzentrationen wird die Aufnahme in die Leukozyten und Erythrozyten gesättigt. Im Plasma wird Ciclosporin zu ca. 90% an Proteine, hauptsächlich Lipoproteine, gebunden.
Metabolismus
Ciclosporin wird zu einem Grossteil metabolisiert, weitgehend über das Cytochrom P450 (CYP4503A4) abhängige Monooxygenasesystem. Bisher sind über 15 Metaboliten bekannt. Die Metaboliten entstehen vor allem durch Mono- und Dihydroxylierung sowie N-Demethylierung an verschiedenen Stellen des Moleküls. Es wurde festgestellt, dass Arzneimittel, welche das Cytochrom P450 (CYP4503A4) abhängige Enzymsystem beeinflussen, die Ciclosporin-Spiegel erhöhen oder herabsetzen (siehe «Interaktionen»). Alle bis anhin identifizierten Metaboliten enthalten die intakte Peptidstruktur der unveränderten Substanz. Einige Metaboliten besitzen eine schwache immunsuppressive Wirkung (bis zu 10%, verglichen mit Ciclosporin).
Elimination
Die vorliegenden Daten für die terminale Halbwertszeit von Ciclosporin sind sehr unterschiedlich, abhängig von der angewendeten Bestimmungsmethode und der Zielpopulation. Die Werte reichen von 6.3 h bei gesunden Freiwilligen bis zu 7-16 h bei Patienten mit Nierentransplantation bzw. 20.4 h bei Patienten mit schweren Lebererkrankungen. Die Elimination erfolgt hauptsächlich über die Galle. Nur 6% einer peroral verabreichten Dosis erscheinen im Urin und weniger als 1% als unveränderte Substanz.
Kinetik spezieller Patientengruppen
Ältere Patienten
Die Verteilung von Ciclosporin bei Alterspatienten unterscheidet sich nicht von derjenigen bei Erwachsenen mittleren Alters.
Kinder
Bei Kindern wird Ciclosporin im Durchschnitt etwas schneller eliminiert als bei Erwachsenen. Zur Erzielung gleicher Blutspiegel können deshalb höhere Dosierungen (bezogen auf das Körpergewicht) notwendig sein.
Niereninsuffizienz
Da Ciclosporin hauptsächlich über die Galle ausgeschieden wird, hat eine Niereninsuffizienz keine klinisch relevante Auswirkung auf die Pharmakokinetik.
Leberinsuffizienz
Die Elimination von Ciclosporin wird durch eine Leberinsuffizienz verlangsamt. Bei Patienten mit schwerer Leberdysfunktion sind deshalb die Serumkreatininwerte und die Ciclosporinwerte im Blut engmaschig zu überwachen und die Dosierung entsprechend anzupassen.
Präklinische Daten
Ciclosporin zeigte in Standardtestsystemen bei oraler Anwendung keine mutagenen oder teratogenen Effekte (Ratten bis zu 17 mg/kg/d oral und Kaninchen bis zu 30 mg/kg/d oral). Es wirkt jedoch in Dosen, die für die Muttertiere toxisch sind (100 mg/kg/d bei Kaninchen, 30 mg/kg/d bei Ratten), embryo- und fötotoxisch, was sich durch erhöhte prä- und postnatale Mortalität sowie durch ein reduziertes Geburtsgewicht gepaart mit Wachstumsverzögerung zeigte.
In zwei publizierten Studien zeigten Kaninchen, welche in utero Ciclosporin (10 mg/kg KG/d) ausgesetzt waren, eine reduzierte Anzahl Nephronen, renale Hypertophie, systemische Hypertonie und progressive renale Insuffizienz bis zum Alter von 35 Wochen.
Trächtige Ratten, welchen 12 mg/kg KG/d Ciclosporin i.v. verabreicht wurden (die doppelte für den Menschen empfohlene i.v.-Dosierung) gebaren Föten mit einer erhöhten Inzidenz für Ventrikelseptumdefekte.
Dieser Befund ist bei anderen Spezies nicht aufgetreten und die Relevanz für den Menschen ist unklar.
Karzinogenitätsstudien wurden bei männlichen und weiblichen Ratten und Mäusen durchgeführt. In einer 78-Wochen-Studie bei Mäusen wurden bei Dosen von 1, 4 und 16 mg/kg pro Tag Hinweise auf einen statistisch signifikanten Trend zur Bildung von lymphozytischen Lymphomen in weiblichen Tieren gesehen und die Inzidenz hepatozellulärer Karzinome bei männlichen Tieren überstieg bei mittlerer Dosierung den Kontrollwert signifikant.
In einer 24-Monats-Studie bei Ratten mit einer Dosierung von 0.5, 2 und 8 mg/kg pro Tag, überstieg die Inzidenz von Pankreas-Inselzell-Adenomen signifikant diejenige der Kontrollen bei tiefer Dosierung. Die hepatozellulären Karzinome und Pankreas-Inselzell-Adenome waren nicht dosisabhängig.
Die Fertilität männlicher und weiblicher Ratten wurde durch Dosen bis 5 mg/kg KG/d nicht beeinträchtigt.
Eine erhöhte Inzidenz von Malignitäten ist eine anerkannte Komplikation der Immunsuppression in Transplantatempfängern. Die häufigsten Formen von Neoplasien sind Non-Hodgkin's Lymphome und Karzinome der Haut (betreffend Risiko der Entwicklung von Lymphomen und anderen Malignitäten s. «Warnhinweise und Vorsichtsmassnahmen»). Das Risiko von Malignitäten während der Behandlung mit Ciclosporin ist höher als in der normalen gesunden Population, aber ähnlich wie bei Patienten, die eine andere immunsuppressive Therapie erhalten. Es wurde berichtet, dass durch eine Reduktion oder durch einen Abbruch der Immunosuppression die krankhafte Veränderung zurückgehen kann.
Sonstige Hinweise
Inkompatibilitäten
Polyoxyäthyliertes Rizinusöl, das im Infusionskonzentrat enthalten ist, kann das Phthalat aus PVC in Lösung bringen. Wenn verfügbar sollten daher Glasflaschen verwendet werden. Plastikflaschen kommen nur in Frage, wenn sie kein phthalathaltiges PVC enthalten und den Vorschriften über «sterile Kunststoffbehältnisse für Blut und Blutprodukte vom Menschen» respektiv den Vorschriften «sterile PVC-Behältnisse für Blut und Blutprodukte vom Menschen» der jeweils gültigen Fassung der Europäischen Pharmakopoe entsprechen. Dasselbe gilt auch für die Transfusionsbestecke.
Behälter und Stopfen sollten frei von Siliconöl und fettigen Substanzen sein.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Stabilität
Stabilität der verdünnten Lösung: Nach aseptischer Zugabe des Konzentrates zum Infusionsmedium sollte die Sandimmun-Infusion wenn möglich unverzüglich angewendet werden. Die Dauer zwischen Verdünnen mit dem Infusionsmedium und der Anwendung sollte bei Lagerung im Kühlschrank (2-8 °C) nicht mehr als 24 h betragen.
Nicht gebrauchte Lösung muss weggeworfen werden.
Besondere Lagerungshinweise
Sandimmun i.v. Infusionskonzentrat soll nicht über 30 °C aufbewahrt werden.
Arzneimittel sollen für Kinder unerreichbar aufbewahrt werden.
Hinweise für die Handhabung
Das Konzentrat soll mit physiologischer Kochsalzlösung oder 5%iger Glukoselösung auf 1:20 bis 1:100 verdünnt und über ca. 2-6 h langsam i.v. infundiert werden. Verdünnte Infusionslösungen dürfen nach 24 h nicht mehr verwendet werden.
Behälter: s. «Sonstige Hinweise; Inkompatibilitäten».
Zulassungsnummer
44915 (Swissmedic).
Zulassungsinhaberin
Novartis Pharma Schweiz AG, Risch; Domizil: 6343 Rotkreuz.
Sandimmun Neoral steht als Kapseln und Trinklösung zur Verfügung; s. hierzu die separate Arzneimittel-Fachinformation.
Stand der Information
Juni 2018.
OEMéd
Composition
Principe actif: Ciclosporinum.
Excipients: PEG-35 Castor oil (huile de ricin polyoxyéthylénée) 650 mg, Ethanolum 261 mg, Aqua q.s. ad sol.
Forme galénique et quantité de principe actif par unité
Concentré pour perfusion i.v. à 50 mg/ml.
Indications/Possibilités d’emploi
Transplantation d'organe
- Prévention des rejets de l'allogreffe après transplantation de rein, de foie, de cœur, de cœur-poumon, de poumon et de pancréas.
- Traitement des rejets chez les patients ayant précédemment été traités avec d'autres immunosuppresseurs.
En raison du risque d'anaphylaxie (cf. «Mises en garde et précautions»), le concentré pour perfusion i.v. ne devrait être utilisé que chez les patients qui ne sont pas en mesure de prendre le médicament sous ses formes orales (par ex. juste après l'opération), ou chez les patients dont la résorption entérale est diminuée à la suite de désordres gastro-intestinaux. Dans de tels cas il est recommandé de passer à Sandimmun Néoral dès que possible.
Transplantation de moelle osseuse
- Prévention des rejets de greffe après transplantation de moelle osseuse.
- Pour initier la prévention ou le traitement de la réaction du greffon contre l'hôte (GvHD).
Posologie/Mode d’emploi
Les recommandations posologiques ci-après sont données uniquement à titre indicatif. La dose recommandée est de 3-5 mg/kg, ce qui représente environ un tiers de la dose orale appropriée. Un contrôle régulier des taux sanguins de ciclosporine est recommandé (ils peuvent être déterminés au moyen d'un dosage radio-immunologique (RIA) à l'aide d'anticorps monoclonaux). Les résultats obtenus servent d'indicateur pour la détermination de la posologie nécessaire pour atteindre les concentrations recherchées chez le patient concerné.
Transplantation d'organe
Lorsque Sandimmun est administré en association avec d'autres immunosuppresseurs (avec des corticostéroïdes ou dans une association de trois ou quatre médicaments par ex.), on peut administrer des doses plus faibles (par ex. 1-2 mg/kg/d i. v., suivi de 3-6 mg/kg/d per os en traitement d'attaque). Il est recommandé de faire passer les patients le plus rapidement possible au traitement par voie orale avec Sandimmun Neoral.
Transplantation de moelle osseuse
La dose initiale doit être administrée un jour avant la transplantation. A cet effet, la perfusion i. v. est généralement recommandée dans ce cas à la dose de 3-5 mg/kg/d. Dans la phase postopératoire immédiate, cette dose sera maintenue pendant 2 semaines au maximum avant de passer au traitement oral d'entretien avec une dose d'environ 12.5 mg/kg/d.
En présence de troubles gastro-intestinaux susceptibles de diminuer l'absorption, il peut être nécessaire de recourir au traitement par voie i.v.
Chez certains patients, une GvHD se développe après l'arrêt du traitement par Sandimmun. On obtient généralement une réponse favorable en réinstaurant le traitement.
Utilisation en pédiatrie
Les expériences avec la ciclosporine chez les enfants sont encore limitées. On ne dispose d'aucune expérience de traitement de nourrissons avec Sandimmun. Des enfants âgés de plus d'un an ont reçu Sandimmun à la posologie usuelle sans présenter de problème particulier. Plusieurs études révèlent que des sujets pédiatriques ont nécessité et bien supporté des doses (par kg de poids corporel) de ciclosporine plus élevées que les doses utilisées chez les adultes. Au cas où des dysfonctions hépatiques sévères préexistent, une surveillance étroite des taux sériques de créatinine (et si possible de ciclosporine) est impérative, de même que l'adaptation de la posologie en conséquence.
Utilisation chez le patient âgé
Dans des études cliniques sur l'emploi de la ciclosporine dans la polyarthrite rhumatoïde, 17.5% des patients étaient âgés de 65 ans ou plus. Après 3 à 4 mois de traitement, ces patients avaient une plus forte probabilité de développer une hypertension systolique et de présenter une hausse de la créatinine sérique de ≥50% par rapport à la valeur d'origine.
Les études cliniques sur Sandimmun chez les patients transplantés et les patients psoriasiques ne totalisaient pas un nombre suffisant de participants âgés de 65 ans ou plus pour conclure à une éventuelle différence de réaction chez ces patients par rapport à des patients plus jeunes. De manière générale, la posologie doit être fixée avec prudence chez les patients âgés, compte tenu du fait qu'une diminution de la fonction rénale, hépatique ou cardiaque, que la coexistence d'autres maladies ou que des traitements médicamenteux simultanés sont plus fréquents chez ces patients. Habituellement, on recommande d'initier le traitement par une dose choisie vers la limite inférieure de l'éventail posologique.
Récipients: cf. «Remarques particulières».
Contre-indications
Hypersensibilité à la ciclosporine ou à l'un des excipients de Sandimmun, y compris l'hypersensibilité à l'huile de ricin polyoxyéthylénée.
Mises en garde et précautions
Sandimmun ne doit être utilisé que par des médecins ayant l'expérience du traitement immunosuppresseur et pouvant assurer le suivi nécessaire, qui comporte, à intervalles réguliers, un examen physique général, la mesure de la pression artérielle et le contrôle des données de laboratoire destinées à vérifier la sécurité. Le suivi des patients transplantés traités avec Sandimmun doit s'effectuer dans des locaux dotés d'un équipement de laboratoire adéquat et d'un personnel médical compétent. Le médecin responsable du traitement d'entretien doit recevoir toutes les informations requises pour le suivi de son patient.
Le concentré pour perfusion i.v. contient de l'huile de ricin polyoxyéthylénée susceptible de provoquer des réactions anaphylactoïdes se manifestant par des rougeurs (flushing) de la face et de la poitrine et un œdème pulmonaire non cardiogène avec détresse respiratoire aiguë, dyspnée et sibilances, ainsi que des modifications tensionnelles et de la tachycardie.
Par conséquent, il convient d'être particulièrement prudent chez les patients qui ont déjà reçu par injection ou perfusion i.v. des préparations contenant de l'huile de ricin polyoxyéthylénée (par ex. une préparation contenant du Cremophor EL), ou chez les patients ayant un terrain allergique. Il faut donc placer les patients recevant Sandimmun par voie i.v. sous surveillance continue au moins pendant les 30 premières min de la perfusion et à intervalles fréquents par la suite. Il faut arrêter la perfusion en cas d'anaphylaxie. Une solution aqueuse d'adrénaline à 1:1000 ainsi que de l'oxygène doivent être disponibles dans la chambre du patient.
En raison du risque de choc anaphylactique, Sandimmun concentré pour perfusion i. v. doit être réservé aux patients qui ne peuvent pas prendre le médicament par voie orale. Il est recommandé en pareil cas de passer à l'administration orale avec Sandimmun Néoral dès que possible.
L'administration prophylactique d'un antihistaminique (H1- et H2-bloquant) avant la perfusion a été employée avec succès pour prévenir de telles réactions anaphylactoïdes.
Comme d'autres immunosuppresseurs, la ciclosporine entraîne une augmentation du risque de développement de lymphomes et d'autres tumeurs malignes, notamment cutanées.
Cette augmentation du risque semble toutefois plutôt dépendre du degré et de la durée de l'immunosuppression que de l'utilisation de médicaments spécifiques.
De plus, un schéma thérapeutique comprenant plusieurs immunosuppresseurs (y compris la ciclosporine) doit être mis en œuvre avec prudence, car il peut provoquer des troubles lymphoprolifératifs ou des tumeurs solides d'autres organes, aux conséquences parfois mortelles.
En raison du risque potentiel de modifications cutanées malignes, les patients recevant Sandimmun, et notamment ceux qui sont traités pour un psoriasis ou une dermatite atopique, doivent être avertis des dangers d'une exposition au soleil excessive et sans protection et ne doivent pas être traités en même temps par des rayons UV-B ou PUVA (cf. «Interactions»).
Comme avec d'autres immunosuppresseurs, les patients sous ciclosporine sont sujets à diverses infections bactériennes, fongiques, parasitaires ou virales, souvent causées par des agents pathogènes opportunistes. Chez les patients sous ciclosporine, on a observé une réactivation d'infections latentes à polyomavirus pouvant entraîner une néphropathie associée à polyomavirus (PVAN), notamment une néphropathie à virus BK (BKVN), ou une leuco-encéphalopathie multifocale progressive (LEMP) associée au virus JC. Ces états sont souvent la conséquence d'une forte immunosuppression et doivent être inclus dans le diagnostic différentiel chez les patients immunodéprimés présentant une aggravation de la fonction rénale ou des symptômes neurologiques. Des issues sévères et/ou mortelles ont été rapportées. Une BKVN peut entraîner la perte du greffon. Des mesures préventives et thérapeutiques efficaces doivent être prises, notamment chez les patients traités à long terme par plusieurs immunosuppresseurs. Chez les patients présentant une PVAN ou une LEMP, il faut envisager une réduction de l'immunosuppression totale. Une réduction de l'immunosuppression peut cependant aussi mettre en danger le greffon.
L'augmentation de la créatinine et de l'urée sériques est une complication fréquente et potentiellement grave, qui peut se manifester durant les premières semaines de traitement par Sandimmun. Ces modifications fonctionnelles, qui sont liées à la dose et réversibles, répondent généralement à une réduction posologique. Au cours d'un traitement à long terme, certains patients peuvent présenter des altérations structurelles des reins (fibrose interstitielle par ex.) qui, chez un transplanté rénal, doivent être différenciées d'altérations dues à un rejet chronique.
Sandimmun peut aussi entraîner une augmentation, liée à la dose et réversible, de la bilirubine sérique et des enzymes hépatiques (cf. «Effets indésirables»).
Il est indispensable de surveiller attentivement les paramètres des fonctions hépatique et rénale. Des valeurs anormales peuvent exiger une réduction posologique.
Surveiller avec un soin particulier la fonction rénale chez le patient âgé.
Les taux sanguins de ciclosporine seront contrôlés de préférence en mesurant la substance mère, à l'aide d'une méthode basée sur l'emploi d'un anticorps monoclonal spécifique ou d'une méthode de détermination par chromatographie liquide à haute pression (HPLC). Si l'on utilise le plasma ou le sérum, un protocole standard de séparation doit être suivi, comportant des valeurs définies pour la durée et la température. Pour le contrôle initial après une transplantation du foie, on aura recours soit à l'anticorps monoclonal spécifique soit à des mesures en parallèle de l'anticorps monoclonal spécifique et de l'anticorps monoclonal non spécifique afin d'assurer une immunosuppression adéquate.
Il faut aussi savoir que la concentration de ciclosporine dans le sang, le plasma ou le sérum n'est qu'un des nombreux facteurs intervenant dans l'état clinique du patient. Les résultats sont donc à considérer comme guide de posologie et doivent être mis en parallèle avec d'autres données cliniques et biologiques (cf. «Transplantation d'organe» dans la rubrique «Posologie/mode d'emploi»).
Le traitement par Sandimmun nécessite un contrôle régulier de la pression artérielle; si une hypertension se développe, un traitement antihypertenseur adéquat doit être instauré. On choisira de préférence un médicament antihypertenseur qui ne montre pas d'interaction pharmacologique avec la ciclosporine (cf. «Interactions»).
Des cas de légère augmentation réversible des lipides sanguins ont été rapportés sous Sandimmun, c'est pourquoi une détermination des lipides sanguins avant l'instauration du traitement ainsi qu'après le premier mois de traitement est recommandée. En cas d'élévation des valeurs lipidiques, une réduction de l'apport en lipides dans l'alimentation et éventuellement une réduction de la dose seront envisagées.
La ciclosporine accroît le risque d'hyperkaliémie, notamment chez les patients atteints de troubles de la fonction rénale. La prudence est de rigueur lorsque la ciclosporine est administrée simultanément à des médicaments épargnant le potassium (par ex. diurétiques d'épargne potassique, inhibiteurs de l'enzyme de conversion de l'angiotensine, antagonistes des récepteurs de l'angiotensine II) et à des médicaments contenant du potassium, ou donnée à des patients consommant des aliments riches en potassium (cf. «Interactions»). Dans de telles situations, un contrôle de la kaliémie est recommandé.
Une prudence particulière est de mise lors de l'administration simultanée de lercanidipine et de ciclosporine (cf. «Interactions»).
La ciclosporine peut augmenter les concentrations plasmatiques et ainsi les risques d'effets secondaires dose-dépendants de médicaments pris simultanément qui sont des substrats de la P-gp/multidrug efflux transporter (glycoprotéine P de transport de Multidrug Efflux) ou des protéines de transport d'anions organiques (OAPT) , tels que l'aliskirène, le dabigatran ou le bosentan. Il convient d'éviter une prise simultanée de ciclosporine et d'aliskirène, de dabigatran ou de bosentan «Interactions»).
La ciclosporine augmente l'élimination du magnésium. Ceci peut conduire à une hypomagnésiémie symptomatique, surtout dans la période suivant immédiatement une transplantation. Durant cette période, des contrôles des taux sériques de magnésium sont également recommandés, surtout en cas de survenue de symptômes neurologiques. Si cela s'avère nécessaire, une préparation à base de magnésium doit être administrée.
La prudence est de rigueur chez les patients hyperuricémiques.
Durant le traitement par la ciclosporine, la vaccination peut se révéler moins efficace, et il est recommandé d'éviter les vaccins vivants.
Interactions
Interactions avec les aliments
La prise concomitante de jus de pamplemousse entraîne une augmentation de la biodisponibilité de la ciclosporine.
Interactions médicamenteuses
Parmi les nombreux médicaments pour lesquels des interactions avec la ciclosporine ont été rapportées, seuls ceux pour lesquels les interactions sont bien documentées et présentant une importance clinique sont présentés ci-après.
Les agents intervenant dans le métabolisme et l'excrétion de la ciclosporine par inhibition ou induction des enzymes hépatiques, en particulier le CYP3A4, modifient conformément la concentration de ciclosporine dans le plasma ou le sang complet. La ciclosporine est un inhibiteur du CYP3A4 et un inhibiteur très puissant de la glycoprotéine P (P-gp/multidrug efflux transporter). Elle peut augmenter les taux plasmatiques des médicaments administrés simultanément et qui sont des substrats du CYP3A4 ou de la P-gp.
Médicaments qui diminuent le taux de ciclosporine
Barbituriques, carbamazépine, oxcarbazépine, phénytoïne, nafcilline, sulfadimidine i.v., rifampicine, octréotide, probucol, orlistat, préparations à base de millepertuis (Hypericum perforatum), ticlopidine, sulfinpyrazone, terbinafine, bosentan.
Médicaments qui augmentent le taux de ciclosporine
Antibiotiques macrolides (érythromycine, azithromycine et clarithromycine), kétoconazole, fluconazole, itraconazole, voriconazole, diltiazem, nicardipine, vérapamil, métoclopramide, contraceptifs oraux, danazol, méthylprednisolone (à fortes doses), allopurinol, amiodarone, acide cholique et ses dérivés, inhibiteurs de protéase, imatinib, colchicine, néfazodone.
Autres interactions notables
La prudence est de rigueur lorsque la ciclosporine est associée à d'autres composés aux propriétés néphrotoxiques tels que aminoglycosides (y compris gentamycine, tobramycine), amphotéricine B, ciprofloxacine, vancomycine, triméthoprime (+ sulfaméthoxazole), anti-inflammatoires non stéroïdiens (y compris diclofénac, indométacine, naproxène, sulindac), melphalan, antagonistes des récepteurs H2 de l'histamine (par ex. cimétidine, ranitidine), méthotrexate, tacrolimus.
L'administration concomitante de nifédipine et de ciclosporine peut se traduire par un taux d'hyperplasie gingivale plus élevé que celui observé avec la ciclosporine administrée seule.
Après l'administration concomitante de ciclosporine et de lercanidipine, l'AUC de la lercanidipine avait triplé et l'AUC de la ciclosporine était augmentée de 21%. On choisira de préférence un médicament antihypertenseur qui ne montre pas d'interaction pharmacologique avec la ciclosporine.
Une administration concomitante de diclofénac et de ciclosporine conduit à une augmentation significative de la biodisponibilité du diclofénac pouvant entraîner des troubles réversibles de la fonction rénale. Il est fort probable que l'augmentation de la biodisponibilité du diclofénac soit due à une baisse de son effet de premier passage très important. Si des anti-inflammatoires non stéroïdiens ayant un faible effet de premier passage (acide acétylsalicylique par ex.) sont administrés en même temps que la ciclosporine, une augmentation de leur biodisponibilité n'est pas à craindre.
La ciclosporine peut aussi réduire la clairance de la digoxine, de la colchicine, de la prednisolone, des inhibiteurs de l'HMG-CoA réductase (statines) de l'étoposide, de l'aliskirène, du bosentan ou du dabigatran.
Chez quelques patients sous digoxine, une grave intoxication digitalique a été observée dans les jours qui ont suivi le début d'un traitement par la ciclosporine. Il existe également des rapports sur le potentiel de la ciclosporine de renforcer les effets toxiques de la colchicine tels que myopathie et neuropathie, en particulier chez les patients atteints de dysfonction rénale. En cas d'administration concomitante de digoxine ou de colchicine avec la ciclosporine, une surveillance clinique stricte est nécessaire afin de déceler rapidement les manifestations toxiques de la digoxine ou de la colchicine, et d'en réduire les doses ou d'arrêter leur administration le cas échéant.
Une absorption significativement accrue des antibiotiques de type anthracycline (par ex. doxorubicine, mitoxantrone, daunorubicine) a été observée chez les patients oncologiques en cas d'administration intraveineuse concomitante d'anthracyclines et de cyclosporine.
Des cas de myotoxicité (y compris myalgies et faiblesse musculaire, myosite et rhabdomyolyse) lors de l'administration concomitante de lovastatine, de simvastatine, d'atorvastatine, de pravastatine et, rarement, de fluvastatine avec la ciclosporine ont été décrits dans la littérature et dans les études post-marketing. La dose de ces statines devrait être réduite conformément aux indications de l'information professionnelle respective lorsqu'elles sont administrées simultanément avec la ciclosporine. Un traitement par des statines doit être interrompu temporairement ou arrêté chez des patients qui présenteraient des symptômes de myopathie ou ont des facteurs de risque prédisposant à des lésions rénales graves, y compris une défaillance rénale secondaire à une rhabdomyolyse.
Des élévations de la créatinine sérique ont été observées lors d'administration concomitante à l'évérolimus ou au sirolimus. Cet effet est souvent réversible après réduction de la dose de ciclosporine. L'évérolimus et le sirolimus n'ont qu'une faible influence sur la pharmacocinétique de la ciclosporine. En revanche, les taux sanguins d'évérolimus et de sirolimus étaient significativement augmentés.
La prudence est recommandée lors de l'administration concomitante de médicaments d'épargne potassique (par ex. diurétiques d'épargne potassique, inhibiteurs de l'enzyme de conversion de l'angiotensine, antagonistes du récepteur de l'angiotensine II) ou de médicaments contenant du potassium, car ils peuvent entraîner une augmentation significative du taux sérique de potassium.
La ciclosporine peut augmenter la concentration plasmatique du répaglinide et ainsi le risque d'une hypoglycémie.
Des études d'interactions pharmacocinétiques chez des volontaires sains ont montré que le bosentan peut diminuer les valeurs sanguines de ciclosporine d'environ 35%, alors qu'à l'inverse celles du bosentan sont environ doublées.
L'administration concomitante de ciclosporine et d'aliskirène provoque une augmentation 2,5 fois supérieure de la concentration Cmax de l'aliskirène et 5 fois supérieure de l'AUC. Toutefois, le profil pharmacocinétique de la ciclosporine ne s'en trouve pas modifié de façon significative.
L'administration concomitante de dabigatran et de ciclosporine provoque une hausse de la concentration plasmatique de dabigatran en raison de l'effet inhibiteur de la P-gp de la ciclosporine (voir «Mises en garde et précautions»). Le dabigatran a une marge thérapeutique étroite et une augmentation de la concentration plasmatique est associée à un risque accru d'hémorragie.
L'administration concomitante d'ambrisentan et de ciclosporine a doublé les valeurs de l'ambrisentan, et une exposition à la ciclosporine de 10% plus élevée.
Recommandations
Si l'utilisation concomitante de médicaments connus pour présenter un potentiel d'interaction avec la ciclosporine ne peut pas être évitée, les recommandations de base suivantes devraient être observées:
Durant l'utilisation concomitante d'un médicament susceptible d'une synergie néphrotoxique, la fonction rénale (en particulier la créatinine sérique) doit être contrôlée attentivement. En cas d'apparition d'un trouble significatif de la fonction rénale, les doses du médicament administré simultanément doivent être réduites ou un autre traitement doit être envisagé.
Chez des patients transplantés, il y a eu des cas isolés de troubles importants (avec augmentation en conséquence de la créatinine sérique), mais réversibles, de la fonction rénale après administration simultanée de fibrates (par ex. bézafibrate, fénofibrate). La fonction rénale doit par conséquent être attentivement surveillée chez de tels patients. La comédication doit être arrêtée en cas d'insuffisance rénale significative.
Médicaments connus pour diminuer ou augmenter la biodisponibilité de la ciclosporine:
Chez les patients transplantés, les taux de ciclosporine doivent être mesurés fréquemment et, si nécessaire, la posologie de la ciclosporine doit être ajustée, notamment lors de l'introduction ou de l'arrêt du médicament administré simultanément.
En cas d'administration concomitante de médicaments connus pour augmenter les taux de ciclosporine, une évaluation plus fréquente de la fonction rénale et la surveillance attentive des effets indésirables liés à la ciclosporine est préférable à la mesure des taux sanguins.
Éviter l'utilisation concomitante de nifédipine chez les patients qui présentent une hyperplasie gingivale consécutive au traitement avec la ciclosporine.
Les anti-inflammatoires non stéroïdiens dont le métabolisme de premier passage est important (diclofénac par ex.) doivent être administrés à des doses plus faibles que celles qui seraient utilisées chez les patients ne recevant pas de ciclosporine.
En cas d'administration concomitante de digoxine, de colchicine, de lovastatine ou d'un inhibiteur de l'HMG-CoA réductase avec la ciclosporine, une surveillance clinique stricte est nécessaire afin de déceler rapidement les manifestations toxiques du médicament associé et d'en réduire les doses ou d'arrêter son administration.
La probabilité d'interactions médicamenteuses est plus élevée chez les patients âgés.
Grossesse/Allaitement
Les études chez le rat et le lapin ont montré une toxicité de reproduction (cf. «Données précliniques»).
Les données concernant l'utilisation de Sandimmun chez les femmes enceintes sont limitées. Les femmes enceintes qui sont traitées par des immunosuppresseurs, y compris la ciclosporine et les schémas thérapeutiques comprenant la ciclosporine, après une transplantation présentent un risque élevé d'accouchement prématuré (<37 semaines).
On dispose d'un nombre limité d'observations chez les enfants jusqu'à l'âge de 7 ans qui ont été exposés in utero à la ciclosporine (données récoltées sur 12 enfants). La pression artérielle et la fonction rénale étaient normales chez ces enfants.
Compte tenu des données disponibles, Sandimmun ne devrait pas être utilisé durant la grossesse, à moins que le bénéfice escompté ne dépasse les risques potentiels.
La ciclosporine passe dans le lait maternel. Par conséquent, les mères recevant Sandimmun ne devraient pas allaiter, car Sandimmun peut provoquer des effets indésirables graves chez les nourrissons.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune donnée concernant l'effet sur l'aptitude à la conduite et à l'utilisation de machines n'est disponible.
Effets indésirables
De nombreux effets indésirables liés à l'emploi de la ciclosporine sont dépendants de la dose. L'éventail complet des effets indésirables est essentiellement le même pour les différentes indications.
Des réactions anaphylactoïdes ont été observées après administration i.v. (cf. «Mises en garde et précautions»).
Infections
Les patients sous traitements immunosuppresseurs, y compris la ciclosporine et les schémas thérapeutiques comprenant la ciclosporine, présentent un risque infectieux plus élevé (virus, bactéries, champignons, parasites) (cf. «Mises en garde et précautions»). Des infections généralisées de même que des infections localisées peuvent survenir et des infections déjà présentes peuvent s'aggraver. La réactivation d'infections latentes à polyomavirus peut entraîner une néphropathie associée à polyomavirus (PVAN), notamment une néphropathie à virus BK (BKVN), ou une leuco-encéphalopathie multifocale progressive (LEMP) associée au virus JC. Des issues sévères et/ou mortelles ont été rapportées.
Néoplasies bénignes, malignes et non spécifiques(y compris kystes et polypes)
Les patients sous traitements immunosuppresseurs, y compris la ciclosporine et les schémas thérapeutiques comprenant la ciclosporine, présentent un risque plus élevé de développer des lymphomes ou des affections lymphoprolifératives et d'autres tumeurs malignes, notamment de la peau. La fréquence des tumeurs malignes augmente avec l'intensité et la durée du traitement (cf. «Mises en garde et précautions»). Certaines tumeurs malignes peuvent être mortelles.
Les effets indésirables sont énumérés par ordre décroissant de leur fréquence, définie comme suit: «très fréquent» (≥1/10), «fréquent» (<1/10, ≥1/100), «occasionnel» (1/100, ≥1/1’000), «rare» (<1/1'000, >1/10'000), «très rare» (<1/10'000).
Affections hématologiques et du système lymphatique
Fréquent: leucopénie.
Occasionnels: anémie, thrombopénie.
Rare: microangiopathie thrombotique (y compris purpura thrombocytopénique thrombotique et syndrome hémolytique et urémique).
Troubles du métabolisme et de la nutrition
Très fréquent: hyperlipidémie.
Fréquents: anorexie, hyperuricémie, hyperkaliémie, hypomagnésiémie.
Rare: hyperglycémie.
Affections du système nerveux
Très fréquents: tremblements (10-20%), céphalées (jusqu’à env. 15%), y compris migraine.
Fréquents: paresthésies.
Occasionnels: signes d’encéphalopathie dont le syndrome d’encéphalopathie postérieure réversible (SEPR): convulsions, confusion mentale, désorientation, diminution des réflexes, agitation, insomnie, troubles de la vision, cécité corticale, coma, parésie, ataxie cérébelleuse.
Rare: polyneuropathie motrice.
Très rares: œdème papillaire du nerf optique, y compris œdème papillaire avec péjoration potentielle de la vue à la suite d’une hypertension intracrânienne bénigne.
Affections vasculaires
Très fréquent: hypertension (15-40%).
Affections gastro-intestinales
Très fréquents: nausées, vomissements, douleurs abdominales, diarrhée, hyperplasie gingivale.
Fréquent: ulcère gastrique.
Rare: pancréatite.
Affections hépatobiliaires
Fréquent: atteinte hépatique (cf. «Mises en garde et précautions»).
Troubles cutanés
Très fréquent: hypertrichose.
Fréquents: acné, éruption.
Occasionnel: réactions cutanées allergiques.
Affections musculo-squelettiques et du tissu conjonctif
Fréquents: crampes musculaires, myalgie.
Rares: faiblesse musculaire, myopathie, douleurs articulaires.
Affections du rein et des voies urinaires
Très fréquent: trouble de la fonction rénale (incidence selon l’indication: 10-50%).
Affections des organes de reproduction et du sein
Rares: troubles menstruels, gynécomastie.
Troubles généraux et anomalies au site d’administration
Fréquents: fatigue, fièvre, œdème.
Occasionnel: prise pondérale.
Autres effets indésirables rapportés au cours de l’expérience après commercialisation
Des rapports post-marketing, sur requête et spontanés, font état d’une hépatotoxicité et d’une atteinte hépatique incluant cholestase, ictère, hépatite et défaillance hépatique, chez des patients traités par la ciclosporine. La plupart des cas se rapportaient à des patients présentant des comorbidités significatives, des maladies de fond et d’autres facteurs perturbateurs incluant complications infectieuses et médicaments associés potentiellement hépatotoxiques. Une issue fatale a été rapportée dans quelques cas, essentiellement chez des patients transplantés (cf. «Mises en garde et précautions»).
Surdosage
Seule une expérience limitée du surdosage aigu de ciclosporine est disponible. Un traitement symptomatique et des mesures générales de soutien devraient être institués dans tous les cas. Des signes de dysfonctionnement rénal peuvent se manifester et devraient régresser après arrêt de l'administration du médicament.
La ciclosporine ne peut être éliminée totalement ni par dialyse péritonéale ni par hémoperfusion sur charbon.
Propriétés/Effets
Code ATC: L04AD01
Mécanisme d'action/données pharmacodynamiques
La ciclosporine est un polypeptide cyclique formé de 11 acides aminés. Chez l'animal la ciclosporine est un immunosuppresseur puissant qui prolonge la survie des allogreffes (peau, cœur, rein, pancréas, moelle osseuse, intestin grêle et poumon). Les études montrent que la ciclosporine empêche la survenue de réponses immunitaires à médiation cellulaire telles que l'immunisation contre l'allogreffe, l'hypersensibilité cutanée retardée, l'encéphalomyélite allergique expérimentale, l'arthrite provoquée par l'adjuvant de Freund, la réaction du greffon contre l'hôte (graft-versus-host disease, GvHD) et la production d'anticorps favorisée par les cellules T. La ciclosporine inhibe également la production et la libération de lymphokines, y compris l'interleukine-2 (facteur de croissance des cellules T (TCGF).
Il semble que la ciclosporine bloque les lymphocytes quiescents en phase G0 ou G1 précoce du cycle cellulaire et inhibe la libération - d'induction antigénique - de lymphokines par les cellules T activées.
Les données à disposition indiquent que la ciclosporine agit de manière spécifique et réversible sur les lymphocytes. Contrairement aux cytostatiques, elle ne déprime pas l'hématopoïèse et n'exerce aucun effet sur la fonction des phagocytes. Les patients transplantés traités par la ciclosporine sont moins exposés aux infections que ceux qui reçoivent un autre traitement (immunosuppresseur).
Des transplantations d'organes et de moelle osseuse ont été effectuées avec succès chez l'homme lorsque Sandimmun a été utilisé pour prévenir et traiter le rejet et la réaction du greffon contre l'hôte (GvHD).
La ciclosporine a été utilisée avec succès non seulement chez des receveurs de greffons porteurs du virus de l'hépatite C, mais aussi chez des receveurs de greffons non porteurs du virus de l'hépatite C.
De plus, le traitement par Sandimmun a également des effets favorables dans diverses affections dont l'origine auto-immune est établie ou possible.
Pharmacocinétique
Distribution
La ciclosporine est largement distribuée en dehors de la masse sanguine avec un volume apparent de distribution de 3.5 l/kg en moyenne. Dans le sang, la distribution est fonction de la concentration en substance active: 33-47% dans le plasma, 4-9% dans les lymphocytes, 5-12% dans les granulocytes et 41-58% dans les érythrocytes. Aux concentrations élevées, l'absorption par les leucocytes et les érythrocytes est saturée. Dans le plasma, la ciclosporine se fixe à environ 90% aux protéines, surtout aux lipoprotéines.
Métabolisme
La ciclosporine est, en grande partie, métabolisée, principalement par le système cytochrome P450 (CYP4503A4) dépendant de la monoxygénase. À ce jour, plus d'une quinzaine de métabolites sont connus. La plupart des métabolites proviennent de la mono ou di-hydroxylation ainsi que de la N-déméthylation sur différents sites de la molécule. Il est établi que les médicaments qui influencent le système enzymatique dépendant du cytochrome P450 (CYP4503A4), augmentent ou diminuent les concentrations de ciclosporine (cf. «Interactions»). Tous les métabolites identifiés aujourd'hui contiennent la structure peptidique intacte de la substance inchangée. Quelques métabolites ont une faible activité immunosuppressive (jusqu'à 10%, comparé à la ciclosporine).
Élimination
Les données à disposition concernant la demi-vie d'élimination varient beaucoup en fonction de la méthode de détermination utilisée ainsi que de la population cible. Les valeurs sont de 6.3 h chez les volontaires sains et jusqu'à 7-16 h chez les patients ayant reçu une transplantation rénale, resp. de 20.4 h chez les patients atteints d'insuffisance hépatique grave. L'élimination est essentiellement biliaire, et seuls 6% de la dose orale sont excrétés dans l'urine et moins de 1% est excrété dans l'urine sous forme inchangée.
Cinétique pour certains groupes de patients
Patients âgés
La distribution de la ciclosporine chez les patients âgés ne se différencie pas de celles des patients d'âge moyen.
Enfants
Chez les enfants, la ciclosporine est en moyenne éliminée un peu plus rapidement que chez les adultes. Afin d'atteindre des concentrations sanguines équivalentes, des doses plus élevées (par rapport à la masse corporelle) peuvent par conséquent être nécessaires.
Insuffisance rénale
La ciclosporine étant éliminée principalement par la bile, une insuffisance rénale n'a aucun effet cliniquement notable sur la pharmacocinétique.
Insuffisance hépatique
Lors d'une insuffisance hépatique, l'élimination de la ciclosporine est ralentie. Chez les patients souffrant d'une dysfonction hépatique grave, les valeurs sanguines de la ciclosporine ainsi que les valeurs de la créatinine sérique doivent être surveillées étroitement et la posologie doit être adaptée en conséquence.
Données précliniques
Dans des tests standard, la ciclosporine administrée oralement n'a entraîné aucun effet mutagène ou tératogène (rats jusqu'à des doses orales de 17 mg/kg/d et lapins jusqu'à des doses orales de 30 mg/kg/d). Elle a toutefois une action embryotoxique et fœtotoxique à des doses qui sont toxiques pour les mères (100 mg/kg/d chez la lapine, 30 mg/kg/d chez la ratte), ce qui se manifeste par une augmentation de la mortalité pré- et postnatale et par une diminution du poids à la naissance accompagnée d'un retard de croissance.
Dans deux études publiées, des lapins exposés in utero à la ciclosporine (10 mg/kg PC/d) ont présenté une diminution du nombre de néphrons, une hypertrophie rénale, une hypertension systémique et une insuffisance rénale progressive jusqu'à l'âge de 35 semaines.
Des rattes portantes qui ont reçu de la ciclosporine i.v. à raison de 12 mg/kg PC/d (le double de la dose i.v. recommandée chez l'homme) ont donné naissance à des fœtus avec une forte incidence de malformations du septum interventriculaire.
Ce phénomène n'a pas été observé chez d'autres espèces et son importance pour l'homme n'a pas été établie.
Des études de carcinogénicité ont été effectuées sur des souris et des rats mâles et femelles. Au cours d'une étude de 78 semaines sur des souris, des indices ont été observés révélant d'une tendance statistiquement significative pour la formation de lymphomes lymphocytaires pour des doses de 1, 4 et 16 mg/kg par jour chez les femelles et l'incidence de carcinomes hépatocellulaires chez les mâles a dépassé de manière significative la valeur de contrôle pour une posologie moyenne.
Dans une étude de 24 mois chez des rats soumis à des doses de 0.5, 2 et 8 mg/kg par jour, l'incidence des adénomes des îlots pancréatiques a dépassé de manière significative celle des contrôles aux doses plus faibles. Les carcinomes hépatocellulaires et les adénomes des îlots pancréatiques n'étaient pas dose-dépendants.
La fertilité des rats mâles et femelles n'a pas été entravée à des doses allant jusqu'à 5 mg/kg PC/d.
Une incidence élevée de malignités est une complication reconnue des immunosuppresseurs chez les receveurs d'organes. Les formes de néoplasie les plus fréquentes sont les lymphomes non hodgkiniens et les cancers de la peau (sur le risque de développement de lymphomes et d'autres malignités, cf. «Mises en garde et précautions»). Le risque de malignités au cours d'un traitement par la ciclosporine est plus élevé qu'au sein de la population saine normale, mais analogue à celui de patients sous un autre traitement immunosuppressif. Il a été rapporté qu'une diminution ou une interruption de l'immunosuppresseur pouvait faire régresser l'altération pathologique.
Remarques particulières
Incompatibilités
L'huile de ricin polyoxyéthylénée contenue dans le concentré pour perfusion i.v. est susceptible d'extraire le phtalate du PVC. Des récipients en verre devraient être utilisés dans la mesure de leur disponibilité. Les récipients en matière plastique ne peuvent être employés que s'ils ne contiennent pas de PVC à base de phtalate et s'ils sont conformes à la prescription: «Récipients stériles en matière plastique pour le sang et les produits sanguins d'origine humaine» et respectivement à la prescription «Récipients en PVC pour le sang et les produits sanguins d'origine humaine», toutes deux figurant dans l'édition en vigueur de la Pharmacopée Européenne. Les mêmes prescriptions s'appliquent aux tubulures de perfusion. Les récipients et les bouchons utilisés doivent être exempts d'huile de silicone et de matières grasses.
Conservation
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Stabilité
Stabilité de la solution diluée: la perfusion de Sandimmun devrait si possible être utilisée aussitôt après l'adjonction, dans des conditions aseptiques, du concentré à la solution de perfusion. Entre la dilution avec la solution de perfusion et son utilisation, la solution doit être conservée au réfrigérateur (2-8 °C) et pendant au maximum 24 h.
Une solution non utilisée doit être éliminée.
Remarques concernant le stockage
Sandimmun concentré pour perfusion i.v. ne doit pas être conservé au-dessus de 30 °C.
Les médicaments doivent être tenus hors de portée des enfants.
Remarques concernant la manipulation
Le concentré doit être dilué à raison de 1:20 à 1:100 dans une solution physiologique de chlorure de sodium ou dans une solution à 5% de glucose, puis être administré en perfusion i.v. lente en environ 2-6 h. Une fois diluée, la solution pour perfusion ne doit pas être utilisée après plus de 24 h.
Récipients: cf. «Incompatibilités», rubrique «Remarques particulières».
Numéro d’autorisation
44915 (Swissmedic).
Titulaire de l’autorisation
Novartis Pharma Schweiz AG, Risch; Domizil: 6343 Rotkreuz.
Pour les formes orales, Sandimmun Neoral capsules et solution buvable, prière de vous référer à l'information professionnelle séparée.
Mise à jour de l’information
Juin 2018.
Отзывов (0)
Похожие товары
Вы смотрели

Бесплатная консультация опытного специалиста
Опишите симптомы или нужный препарат – мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой на дом или просто проконсультируем.
Нас 14 специалистов и 0 ботов. Мы всегда будем с вами на связи и сможем связаться в любое время.





 Deutsch
Deutsch French
French