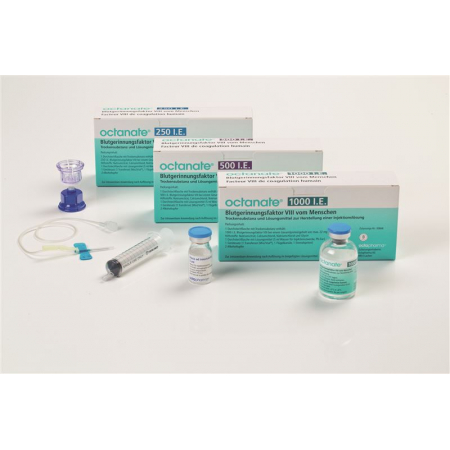
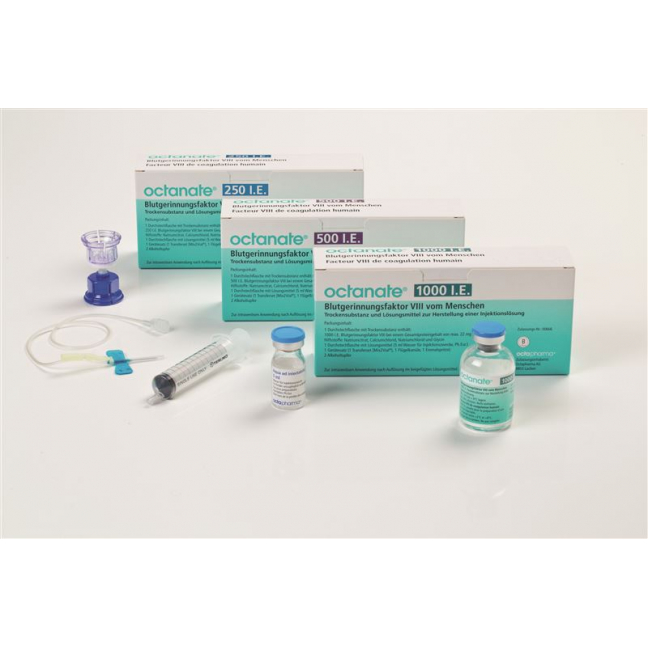
Octanate Trockensub 1000 IU cum solvent + application set
Octanate Trockensub 1000 IE cum Solvens + Applikationsset
-
179850.11 RUB

- Наличие: Нет в наличии
- Производитель: OCTAPHARMA AG
- Модель: 6656351
- ATC-код B02BD02
- EAN 7680006660069
Описание
Zusammensetzung
1 Flasche mit Trockensubstanz, enthaltend an Blutgerinnungsfaktor VIII angereicherte Humanplasmafraktion mit einer Aktivität von:
Octanate | 250 | 500 | 1000 |
|---|---|---|---|
Wirkstoffe: | |||
Gerinnungsfaktor VIII vom Menschen | 250 I.E. | 500 I.E. | 1000 I.E. |
(Gesamtproteingehalt) | (max. 5,5 mg) | (max. 11 mg) | (max. 22 mg) |
Hilfsstoffe: | |||
Natriumcitrat | 14,7 mg | 29,4 mg | 29,4 mg |
Natriumchlorid | 33 mg | 66 mg | 66 mg |
Kalziumchlorid | 0,7 mg | 1,4 mg | 1,4 mg |
Glycin | 45 mg | 90 mg | 90 mg |
Lösungsmittel: | |||
Wasser für Injektionszwecke | 5 ml | 5 ml | 5 ml |
Nach Auflösung mit der beigepackten Menge an Lösungsmittel enthält die Lösung 50 I.E. F VIII/ml (250 I.E.), 100 I.E. F VIII/ml (500 I.E.) bzw. 200 I.E. F VIII/ml (1000 I.E.).
Octanate 250 enthält weniger als 1 mmol (23 mg) Natrium pro Flasche.
Octanate 500/1000 enthält bis zu 1,75 mmol (40 mg) Natrium pro Flasche. Dies ist bei Patienten zu berücksichtigen, die auf eine natriumarme Ernährung achten müssen.
Galenische Form und Wirkstoffmenge pro Einheit
Eine Flasche mit Trockensubstanz, enthaltend Blutgerinnungsfaktor VIII vom Menschen, zur intravenösen Anwendung nach Auflösung im beigefügten Lösungsmittel (Wasser für Injektionszwecke).
Eine Flasche Octanate 250 enthält: 250 I.E. Gerinnungsfaktor VIII vom Menschen.
Eine Flasche Octanate 500 enthält: 500 I.E. Gerinnungsfaktor VIII vom Menschen.
Eine Flasche Octanate 1000 enthält: 1000 I.E. Gerinnungsfaktor VIII vom Menschen.
Indikationen/Anwendungsmöglichkeiten
Octanate wird zur Prophylaxe (vorbeugende Dauerbehandlung) und Therapie von Blutungen bei
- Hämophilie A (angeborener Faktor-VIII-Mangel),
- Allen Formen von erworbenem Faktor-VIII-Mangel,
- Hemmkörperhämophilie mit Faktor-VIII-Inhibitor
eingesetzt.
Dosierung/Anwendung
Die Behandlung sollte unter der Aufsicht eines/r in der Hämophilie-Behandlung erfahrenen Arztes/Ärztin erfolgen.
Dosierung
Dosis und Dauer der Substitutionstherapie hängen vom Schweregrad des Faktor-VIII-Mangels sowie von Ort und Ausmass der Blutung und dem klinischen Zustandsbild des Patienten ab.
Die zu verabreichenden Faktor-VIII-Einheiten werden in Internationalen Einheiten (I.E.) angegeben, die sich auf den derzeitigen WHO Standard für Faktor-VIII-Präparate beziehen. Die Faktor-VIII-Aktivität im Plasma ist entweder in Prozent (im Bezug auf normales Humanplasma) oder in Internationalen Einheiten (im Bezug auf den internationalen Standard für Faktor VIII im Plasma) angegeben.
Eine I.E. an Faktor-VIII-Aktivität ist äquivalent zu dieser Menge an Faktor VIII in 1 ml normalen Humanplasmas. Die Berechnung der erforderlichen Dosis an Faktor VIII beruht auf der Erfahrung, dass eine I.E. Faktor VIII pro kg Körpergewicht die Faktor-VIII-Aktivität um 1,5% bis 2% im Vergleich zum Normalwert erhöht.
Die erforderliche Dosis wird durch die folgende Formel bestimmt:
Erforderliche Einheiten = Körpergewicht (kg) x gewünschter Faktor-VIII-Anstieg (%) x 0.5
Die erforderliche Menge und Anzahl der Verabreichungen sollte sich immer an der klinischen Wirksamkeit im Individualfall orientieren.
Im Fall der folgenden Blutungssituationen sollte die Faktor-VIII-Aktivität während der entsprechenden Behandlungsperiode nicht unter das angegebene Faktor-VIII-Aktivitätsniveau (in %) fallen. Die folgende Tabelle kann als Dosierungsrichtlinie bei Blutungen und operativen Eingriffen dienen:
Schweregrad der Blutung/ | Erforderlicher Faktor-VIII-Spiegel (%) | Dosierungsfrequenz |
|---|---|---|
Blutungen | ||
Frühstadien von Gelenks- oder Muskelblutungen, oder Blutungen im oralen Bereich | 20–40 | Im Abstand von 12 bis 24 Stunden wiederholen. Zumindest für 1 Tag, bis die Blutung (angezeigt durch Schmerzen) beseitigt, oder Heilung eingetreten ist. |
schwerere Gelenks-, Muskelblutungen, oder Hämatome | 30–60 | Im Abstand von 12 bis 24 Stunden, für 3 bis 4 Tage oder länger, bis Schmerzen und Bewegungseinschränkung beseitigt sind. |
lebensbedrohliche Blutungen | 60–100 | Infusion im Abstand von 8 bis 24 Stunden wiederholen, bis die Gefahr beseitigt ist. |
Chirurgische Eingriffe | ||
kleinere Eingriffe einschliesslich Zahnextraktion | 30–60 | Im Abstand von 24 Stunden, mindestens 1 Tag lang, bis die Heilung eingetreten ist. |
Grössere Eingriffe | 80–100 | Im Abstand von 8 bis 24 Stunden bis zur adäquaten Wundheilung; dann für mindestens weitere 7 Tage um eine FVIII-Aktivität von 30% bis 60% zu erhalten. |
Während der Behandlung sollte der Faktor-VIII-Spiegel regelmässig bestimmt werden, um die erforderliche Dosis und die Dosierungsfrequenz anpassen zu können. Vor allem bei grossen chirurgischen Eingriffen ist eine genaue Kontrolle der Substitutionstherapie mit Hilfe der Gerinnungsanalyse (Faktor-VIII-Aktivität) unverzichtbar. Der Therapieerfolg, die in-vivo-Wiederfindungsrate (in vivo Recovery) und die Halbwertszeit können von Patient zu Patient variieren.
Zur vorbeugenden Dauerbehandlung (Prophylaxe) sollten bei Patienten mit schwerer Hämophilie A 20 bis 40 I.E. Faktor VIII/kg Körpergewicht in 2 bis 3-tägigen Abständen verabreicht werden. In einigen Fällen, vor allem bei jüngeren Patienten, können kürzere Intervalle oder höhere Dosen notwendig sein.
Klinische Daten zur Anwendung bei Kindern liegen vor. Insgesamt wurden 15 Kinder im Alter von unter 6 Jahren behandelt. Die verabreichte Dosis lag durchschnittlich bei 25 ± 6 I.E. pro kg Körpergewicht.
Die Patienten sollten auf die Entwicklung von Hemmkörpern gegen Faktor VIII überprüft werden. Falls die erwartete Faktor-VIII-Aktivität im Plasma nicht erreicht wird, oder Blutungen mit üblichen Dosierungen nicht unter Kontrolle gebracht werden können, sollte ein geeigneter Test auf Faktor-VIII-Hemmkörper veranlasst werden. Bei Patienten mit hohen Hemmfaktorspiegeln bleibt die Faktor-VIII-Therapie möglicherweise wirkungslos und es müssen andere Therapiemöglichkeiten in Betracht gezogen werden. Die Behandlung solcher Patienten sollte von Ärzten, die in der Behandlung von Hämophilie-Patienten erfahren sind, geleitet werden. Siehe auch «Warnhinweise und Vorsichtsmassnahmen».
Art der Anwendung
Nach Auflösung wie unter «Hinweise für die Handhabung» beschrieben, ist Octanate intravenös mit geringer Geschwindigkeit zu verabreichen. Es wird empfohlen, nicht mehr als 2-3 ml pro Minute zu verabreichen.
Kontraindikationen
Octanate darf nicht angewendet werden bei Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Octanate enthält den von Willebrand- Faktor zur physiologischen Stabilisierung des Faktor VIIIs, jedoch nicht in pharmazeutisch wirksamer Menge. Octanate ist nicht für die Behandlung des von Willebrand-Syndroms indiziert.
Warnhinweise und Vorsichtsmassnahmen
Wie bei jedem intravenös verabreichten Proteinpräparat können allergische Überempfindlichkeitsreaktionen auftreten. Das Präparat enthält zusätzlich zu Faktor VIII Spuren anderer Humanproteine. Die Patienten sollten über die möglichen Frühzeichen von Unverträglichkeitsreaktionen aufgeklärt werden, wie zum Beispiel Nesselausschlag, generalisierte Urtikaria, Engegefühl in der Brust, Atemnot, und Blutdruckabfall bis hin zum allergischen Schock. Die Patienten sollten angewiesen werden, beim Auftreten dieser Symptome die Behandlung abzubrechen und sofort ihren Arzt zu konsultieren.
Die Behandlung von Schocks erfolgt nach den Regeln der modernen Schocktherapie.
Bei der Anwendung von aus menschlichem Plasma hergestellten Arzneimitteln ist die Übertragung von Infektionskrankheiten durch Übertragung von Erregern nicht völlig auszuschliessen. Dies bezieht sich auch auf unbekannte Erreger.
Das Risiko der Übertragung ist jedoch durch die folgenden Massnahmen reduziert:
- sorgfältige Auswahl der Spender mittels einer ärztlichen Befragung und Kontrolle der Spenden und des Plasmapools auf HBsAg und Antikörper gegen HIV und HCV.
- Plasmapool-Testung auf HCV-Genommaterial;
- bei der Herstellung durchgeführte Inaktivierungs-/Eliminierungsverfahren, die unter Verwendung von Modellviren validiert wurden; diese Verfahren gelten als wirksam für HIV, HCV, HAV und HBV; Die Verfahren zur Inaktivierung/Beseitigung von Viren können bei hüllenlosen Viren wie z.B. Parvovirus B 19 von begrenzter Wirksamkeit sein. Der Parvovirus B 19 kann bei schwangeren Frauen, die serum-negativ sind, und bei Personen mit Immunschwächen oder erhöhter Produktion roter Blutkörperchen (z.B. bei hämolytischer Anämie) zu schweren Reaktionen führen (bei ersteren Infektion des Fötus).
Bei Patienten, die aus Plasma hergestellte Faktor-VIII-Präparate erhalten, wird generell eine Hepatitis-A und B-Impfung empfohlen.
Die Bildung von neutralisierenden Antikörpern (Inhibitoren) gegen Faktor VIII ist eine bekannte Komplikation in der Behandlung der Hämophilie A. Diese Inhibitoren sind IgG Immunglobuline und direkt gegen die gerinnungsfördernde Aktivität des Faktor VIII gerichtet. Ihre Menge wird in Bethesda Einheiten (BE) pro ml Plasma gemessen. Das Risiko zur Hemmkörperentwicklung korreliert mit der Dauer der Faktor-VIII-Behandlung, wobei es innerhalb der ersten 20 Behandlungstage am grössten ist.
Nicht vorbehandelte Patienten
Die Bildung von Hemmkörpern gegen FVIII wird überwiegend bei nicht vorbehandelten Patienten (PUPs) beobachtet. In eine prospektive, unverblindete Studie zur Beurteilung der Immunogenität von Octanate bei PUPs wurden 51 Patienten aufgenommen. 44 Patienten erfüllten die Kriterien zur Beurteilung der Immunogenität (d.h. >50 Expositionstage und FVIII:C ≤1%). 39 der 44 Patienten (88.6%) entwickelten keine Inhibitoren. Bei zwei (4.5%) der fünf Patienten mit Hemmkörpern (jeweils einer mit hohem bzw. niedrigem Titer) verschwanden die Hemmkörper während der weiteren Behandlung mit Octanate ohne Änderung der Dosis oder Behandlungshäufigkeit wieder. Alle Hemmkörper wurden bei Patienten unter Bedarfsbehandlung festgestellt. Die mittlere Zeit bis zur Ausbildung von Hemmkörpern mit hohem Titer betrug 10 Expositionstage (Bereich: 3-19) und von niedrigtitrigen Hemmkörpern 48 Expositionstage.
Selten entwickeln sich Inhibitoren nach 100 Behandlungstagen. Patienten, die mit Faktor VIII behandelt werden, sollten daher klinisch und mittels geeigneter Labortests sorgfältig auf die Bildung von Hemmkörpern untersucht werden. Siehe auch «Unerwünschte Wirkungen».
Im Interesse der Patienten wird empfohlen, dass bei jeder Verabreichung von Octanate der Name und die Chargennummer des Präparates aufgezeichnet werden.
Interaktionen
Interaktionen mit anderen Medikamenten sind bisher nicht bekannt geworden.
Octanate sollte dennoch nicht mit anderen Medikamenten gemischt oder gleichzeitig mit anderen intravenösen Zubereitungen im gleichen Schlauchsystem verabreicht werden.
Schwangerschaft/Stillzeit
Es wurden mit Faktor VIII keine Reproduktionsstudien an Tieren durchgeführt. Aufgrund der Tatsache, dass Hämophilie A bei Frauen nur selten auftritt, stehen keine Erfahrungen bezüglich der Anwendung von Faktor VIII während der Schwangerschaft und Stillzeit zur Verfügung. Daher sollte Faktor VIII bei schwangeren oder stillenden Frauen nur angewendet werden, wenn dies unbedingt erforderlich ist.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Octanate hat keinen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen.
Unerwünschte Wirkungen
Die Häufigkeit der einzelnen Nebenwirkungen wurde anhand folgender Kriterien bestimmt:
Sehr häufig (≥1/10)
Häufig (≥1/100 bis <1/10)
Gelegentlich (≥1/1'000 bis <1/100)
Selten (≥1/10'000 bis <1/1'000)
Sehr selten (<1/10'000).
Überempfindlichkeitsreaktionen oder allergische Reaktionen (die auch Angioödem, Brennen und Stechen an der Infusionsstelle, Schüttelfrost, Hautrötung mit Hitzegefühl, generalisierte Nesselsucht, Kopfschmerzen, Nesselausschlag, Hypotonie, Antriebslosigkeit, Übelkeit, Unruhe, Tachykardie, Engegefühl in der Brust, Zittern, Erbrechen und Stridor mit einschliessen können) wurden bei Faktor-VIII-Präparaten mit seltener Häufigkeit beobachtet und können sich in einigen Fällen zu schwerer Anaphylaxie (einschliesslich Schock) entwickeln.
Systemorganklasse | Selten | Sehr selten |
|---|---|---|
Erkrankungen des Immunsystems | Überempfindlichkeitsreaktionen | Anaphylaktischer Schock |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | Fieber | |
Untersuchungen | Faktor-VIII-Antikörper |
Patienten mit Hämophilie A können neutralisierende Antikörper (Hemmkörper) gegen Faktor VIII entwickeln. Wenn solche Hemmkörper auftreten, manifestiert sich der Zustand als unzureichende klinische Antwort. In solchen Fällen wird empfohlen, ein spezialisiertes Hämophiliezentrum aufzusuchen.
In klinischen Prüfungen mit Octanate bei 77 vorbehandelten Studienpatienten mit schwerer Hämophilie A trat kein Hemmkörper auf. Spontanberichte über den Verdacht der Hemmkörperbildung liegen nicht vor.
Überdosierung
Es wurden keine Symptome einer Überdosierung mit dem Humangerinnungsfaktor VIII gemeldet.
Eigenschaften/Wirkungen
ATC-Code: B02BD02
Wirkungsmechanismus, Pharmakodynamik, klinische Wirksamkeit
Pharmakotherapeutische Gruppe: Antihaemorrhagika: Blutgerinnungsfaktor VIII
Der Faktor VIII/Von Willebrand-Faktor-Komplex besteht aus zwei Molekülen (FVIII und vWF) mit unterschiedlichen physiologischen Wirkungen. Bei der Verabreichung von Faktor VIII verbindet sich dieser mit dem von-Willebrand-Faktor des Patienten.
Als Cofaktor für den aktivierten Faktor IX beschleunigt der aktivierte Faktor VIII die Umwandlung von Faktor X in den aktivierten Faktor X. Der aktivierte Faktor X wandelt Prothrombin um in Thrombin. Thrombin wiederum wandelt Fibrinogen in Fibrin um, wodurch ein Gerinnsel entstehen kann.
Hämophilie A ist eine angeborene geschlechtsspezifische Blutgerinnungsstörung, die durch einen Mangel an Faktor VIII:C entsteht, wodurch spontan oder traumatisch bedingte profuse Blutungen in Gelenken, Muskeln oder inneren Organen auftreten. Durch die entsprechende Substitution wird der Faktor-VIII-Spiegel erhöht, wodurch eine zeitlich begrenzte Korrektur des Faktor-VIII-Mangels sowie der Blutungsneigung erreicht wird.
Pharmakokinetik
Faktor VIII (im Konzentrat) ist ein normaler Bestandteil des menschlichen Plasmas und verhält sich wie körpereigener Faktor VIII. Nach Injektion des Produktes bleiben ungefähr 2/3 bis 3/4 des Faktor VIII in Zirkulation. Die Faktor-VIII-Aktivität im Plasma sollte zwischen 80%-120% der erwarteten Faktor-VIII-Aktivität liegen.
Die Faktor-VIII-Aktivität verringert sich exponential in zwei Phasen. Zunächst wird der Faktor VIII in den Körperflüssigkeiten verteilt und wird mit einer Halbwertzeit von 3 bis 6 Stunden aus dem Plasma abgebaut. In der folgenden langsameren Phase, variiert die Halbwertzeit zwischen 8 und 20 Stunden, mit einem Durchschnitt von 12 Stunden. Dies entspricht der biologischen Halbwertzeit.
Für Octanate wurden in
zwei Pharmakokinetikstudien die folgenden Resultate mit 10 und 14 Patienten ermittelt:
Median | Mittelwert | SD1 | Minimum | Maximum | ||
|---|---|---|---|---|---|---|
Recovery | Studie 1, n= 10 | 2,4 | 2,4 | 0,36 | 1,8 | 3,1 |
Studie 2, n= 14 | 2,4 | 2,4 | 0,25 | 2,1 | 2,8 | |
AUC2norm | Studie 1, n= 10 | 45,9 | 45,5 | 17,2 | 19,0 | 65,3 |
Studie 2, n= 14 | 34,0 | 33,4 | 8,50 | 19,5 | 50,2 | |
Halbwertzeit (h) | Studie 1, n= 10 | 15,1 | 14,3 | 4,01 | 7,7 | 19,1 |
Studie 2, n= 14 | 12,4 | 12,6 | 3,03 | 7,2 | 17,7 | |
MRT3 (h) | Studie 1, n= 10 | 20,9 | 19,6 | 6,05 | 9,2 | 27,0 |
Studie 2, n= 14 | 16,4 | 16,6 | 3,73 | 10,3 | 22,3 | |
Clearance | Studie 1, n= 10 | 2,2 | 2,6 | 1,21 | 1,5 | 5,3 |
Studie 2, n= 14 | 2,9 | 3,2 | 0,88 | 2,0 | 5,1 |
1 SD = Standardabweichung,
2 AUC (area under the curve) = Fläche unter der Konzentrations-Zeit-Kurve bezogen auf das Körpergewicht;
3 MRT mean residence time = Mittlere Verweildauer
Präklinische Daten
Faktor VIII (aus dem Konzentrat) ist ein normaler Bestandteil des menschlichen Plasmas und verhält sich wie körpereigener Faktor VIII.
Toxikologische Daten, die zu Tri-n-Butylphosphat (TNBP) und Polysorbat 80 (Tween 80), den beim SD-Verfahren zur Virusinaktivierung bei der Herstellung von Octanate verwendeten Lösungsmitteln/Detergentien, zur Verfügung stehen, zeigen trotz einer Beschränkung für letzteres, dass bei den vorgesehenen Anwendungen beim Menschen nachteilige Auswirkungen unwahrscheinlich sind.
Selbst Dosen dieser Reagenzien, die ein Mehrfaches der für den Menschen empfohlenen Dosis pro Kilogramm Körpergewicht darstellen, zeigten bei Labortieren keine toxische Wirkung. Für keine der beiden Substanzen wurden mutagene Wirkungen beobachtet.
Sonstige Hinweise
Inkompatibilitäten
Interaktionen mit anderen Mitteln sind nicht bekannt.
Da keine Verträglichkeitsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Es sollte nur der mitgelieferte Gerätesatz verwendet werden, da die Therapie aufgrund der Folge von Adsorption des humanen Gerinnungsfaktors VIII an der Innenoberfläche einiger Infusionssets versagen kann.
Beeinflussung diagnostischer Methoden
Eine Beeinflussung diagnostischer Methoden ist nicht bekannt.
Haltbarkeit
Das Verfalldatum ist auf dem Behältnis und der Verpackung aufgedruckt. Octanate darf nach diesem Datum nicht mehr verwendet werden.
Das gebrauchsfertige Präparat soll unmittelbar nach dem Auflösen verwendet werden.
Besondere Lagerungshinweise
Bei +2 °C bis +8 °C lagern. Vor Licht schützen. Nicht einfrieren. Wird gebrauchsfertige Lösung nicht vollständig verbraucht, muss sie verworfen werden.
Arzneimittel sorgfältig und für Kinder unzugänglich aufbewahren!
Hinweise für die Handhabung
Zur intravenösen Injektion nach Auflösen im beigefügten Lösungsmittel (Wasser für Injektionszwecke).
Bitte lesen Sie diese Anweisungen vollständig durch und befolgen Sie sie sorgfältig!
Das im Folgenden beschriebene Verfahren muss unter aseptischen Bedingungen durchgeführt werden.
Anweisungen für die Herstellung der Lösung:
 |
|
  |
|
 |
|
 |
|
Die Lösung sollte klar oder leicht opaleszent sein. Verwenden Sie keine Lösungen, in denen sich Schlieren oder Ablagerungen gebildet haben. Vor der Verwendung sind Lösungspräparate visuell auf Partikel und Verfärbungen zu prüfen.Die gebrauchsfertige Lösung ist unmittelbar nach der Auflösung und nur einmal zu verwenden.Anweisungen für die InjektionAls vorbeugende Sicherheitsmassnahme sollte der Puls des Patienten vor und während der Faktor-VIII-Injektion gemessen werden. Bei merklichem Anstieg der Pulsrate muss die Injektionsgeschwindigkeit verringert oder die Verabreichung unterbrochen werden. | |
  |
|
| Wenn Sie mehr als eine Flasche des Konzentrates benötigen, kann die Flügelkanüle in der Vene belassen werden. Zum Herstellen der gebrauchsfertigen Lösung immer ein neues Mix2Vial-Set benutzen. | |
Zulassungsnummer
00666 (Swissmedic)
Zulassungsinhaberin
Octapharma AG, CH-8853 Lachen
Stand der Information
November 2019
Composition
1 flacon de substance sèche contenant une fraction de plasma humain enrichie en facteur VIII de coagulation et dotée de l'activité suivante:
Octanate | 250 | 500 | 1000 |
|---|---|---|---|
Principe actif | |||
Facteur VIII de coagulation humain | 250 U.I. | 500 U.I. | 1000 U.I. |
Excipients | |||
Citrate de sodium | 14,7 mg | 29,4 mg | 29,4 mg |
Chlorure de sodium | 33 mg | 66 mg | 66 mg |
Chlorure de calcium | 0,7 mg | 1,4 mg | 1,4 mg |
Glycine | 45 mg | 90 mg | 90 mg |
Solvant | |||
Eau pour préparations injectables | 5 ml | 5 ml | 5 ml |
Une fois reconstituée dans la quantité fournie de solvant, la solution contient 50 U.I. F VIII/ml (250 U.I.), 100 U.I. F VIII/ml (500 U.I.) ou 200 U.I. FVIII/ml (1000 U.I.).
Octanate 250 contient moins d'1 mmol de sodium (23 mg) par flacon.
Octanate 500/1000 contient jusqu'à 1,75 mmol de sodium (40 mg) par flacon. Cette information est à prendre en compte chez les patients suivant un régime pauvre en sodium.
Forme galénique et quantité de principe actif par unité
Un flacon de substance sèche contient le facteur VIII de coagulation humain pour administration intraveineuse après dissolution dans le solvant fourni (eau pour préparations injectables).
Un flacon de Octanate 250 contient: 250 U.I. de facteur VIII de coagulation humain.
Un flacon de Octanate 500 contient: 500 U.I. de facteur VIII de coagulation humain.
Un flacon de Octanate 1000 contient: 1000 U.I. de facteur VIII de coagulation humain.
Indications/Possibilités d’emploi
Prophylaxie (traitement prophylactique à long terme) et traitement des hémorragies chez les patients atteints de:
hémophilie A (déficience congénitale en facteur VIII),
toutes les formes de déficience acquise en facteur VIII,
hémophilie due à la présence d'inhibiteur du facteur VIII.
Posologie/Mode d’emploi
Le traitement doit être instauré sous la surveillance d'un médecin expérimenté dans le traitement de l'hémophilie.
Posologie
La dose et la durée du traitement de substitution dépendent de la gravité du déficit en facteur VIII, de la localisation et de l'ampleur de l'hémorragie, ainsi que de l'état clinique du patient.
Le nombre d'unités de facteur VIII à administrer est exprimé en unités internationales (U.I.), définies selon le standard OMS valable pour les préparations de facteur VIII. L'activité plasmatique du facteur VIII est exprimée soit en pourcentage (par rapport au plasma humain normal), soit en unités internationales (par rapport au standard international applicable pour le facteur VIII dans le plasma).
Une U.I. d'activité de facteur VIII correspond à la quantité de facteur VIII dans 1 ml de plasma humain normal. Le calcul de la dose requise de facteur VIII repose sur l'observation empirique qu'une U.I. de facteur VIII par kg de poids corporel augmente l'activité du facteur VIII de 1,5% à 2% par rapport à l'activité normale.
La dose requise est calculée selon la formule suivante:
Nombre d'unités requises = poids corporel (kg) × augmentation souhaitée du facteur VIII (%) × 0,5.
Le nombre d'unités à administrer et la fréquence de l'administration doivent toujours se baser sur l'efficacité clinique individuelle.
En présence d'événements hémorragiques tels que ceux cités ci-dessous, l'activité du facteur VIII ne doit pas descendre en dessous du niveau indiqué (en %) pendant la période de traitement correspondante. Le tableau suivant peut servir de guide pour déterminer la posologie en cas d'épisodes hémorragiques et en chirurgie.
Degré de l'hémorragie/type d'intervention chirurgicale | Taux de facteur VIII requis (%) | Fréquence d'administration (heures) et durée du traitement (jours) |
|---|---|---|
Hémorragies | ||
Stades précoces d'hémarthroses et d'hémorragies musculaires ou hémorragies de la cavité buccale | 20–40 | Répéter toutes les 12 à 24 h, minimum 1 jour, jusqu'à l'arrêt de l'hémorragie (signalisée par des douleurs) ou jusqu'à guérison |
Hémarthroses ou hémorragies musculaires plus graves ou hématomes | 30–60 | Répéter toutes les 12 à 24 h pendant 3 à 4 jours ou davantage jusqu'à disparition des douleurs et de l'invalidité |
Hémorragies menaçant le pronostic vital | 60–100 | Répéter la perfusion toutes les 8 à 24 h jusqu'à disparition du risque vital |
Opérations chirurgicales | ||
Interventions mineures, y compris extraction dentaire | 30–60 | Répéter toutes les 24 h, minimum 1 jour, jusqu'à cicatrisation |
Interventions majeures | 80–100 (pré- et postopératoire) | Répéter toutes les 8 à 24 h, jusqu'à cicatrisation suffisante, puis pour- suivre pendant au moins 7 jours pour maintenir une activité de facteur VIII de 30 à 60% |
Pendant le traitement, le taux de facteur VIII doit être régulièrement déterminé afin d'ajuster les doses nécessaires et la fréquence des perfusions. Une surveillance rigoureuse du traitement substitutif au moyen de bilans de la coagulation (activité plasmatique du facteur VIII) est indispensable, surtout en cas d'interventions chirurgicales majeures. Le succès du traitement, le taux de récupération in vivo (in vivo Recovery) et la demi-vie peuvent varier d'un patient à l'autre.
Le traitement prophylactique à long terme des patients atteints d'hémophilie A grave comprend l'administration de 20–40 U.I. de facteur VIII par kg de poids corporel à intervalles de 2 à 3 jours. Dans certains cas, en particulier chez les patients jeunes, des intervalles posologiques plus courts ou des doses plus élevées peuvent être nécessaires.
Les données cliniques sur l'utilisation chez l'enfant sont disponibles. En tout, 15 enfants âgés de moins de 6 ans ont été traités. La dose administrée était en moyenne de 25 ± 6 U.I. par kg de poids corporel.
Le développement d'anticorps contre le facteur VIII (inhibiteurs) doit être surveillé. Si l'activité plasmatique souhaitée de facteur VIII n'est pas atteinte ou si l'hémorragie n'est pas maîtrisée avec la dose habituelle, un test spécifique de détection des inhibiteurs du facteur VIII doit être réalisé. Le traitement à base de facteur VIII est probablement inefficace chez les patients présentant des taux élevés d'inhibiteurs et des alternatives thérapeutiques doivent être envisagées. Ces traitements doivent être effectués par des médecins expérimentés dans la prise en charge des patients hémophiles. Voir aussi «Mises en garde et précautions».
Mode d'emploi
Après dissolution du produit comme indiqué sous la rubrique «Remarques concernant la manipulation», Octanate est administré lentement par voie intraveineuse. Il est recommandé de ne pas dépasser la vitesse d'injection de 2 à 3 ml par minute.
Contre-indications
Octanate ne doit pas être utilisé en cas d'hypersensibilité au principe actif ou à l'un des excipients conformément à la composition.
Octanate contient du facteur de Willebrand en quantité permettant la stabilisation physiologique du facteur VIII, cette quantité n'est toutefois pas pharmacologiquement active.
Octanate n'est pas indiqué pour le traitement du syndrome de von Willebrand.
Mises en garde et précautions
Comme avec toute préparation intraveineuse à base de protéine, une réaction d'hypersensibilité allergique est possible. En plus du facteur VIII, le produit contient des traces d'autres protéines humaines. Les patients doivent être informés des signes précoces possibles d'une réaction d'intolérance, comme par ex. urticaire, urticaire généralisée, sensation d'oppression dans la poitrine, dyspnée et chute de la pression artérielle, pouvant aller jusqu'au choc anaphylactique. Si de tels symptômes apparaissent, le patient doit être informé d'interrompre le traitement et de consulter immédiatement son médecin.
Le traitement du choc doit se faire selon les directives médicales actuelles sur le traitement du choc.
L'utilisation de médicaments fabriqués à partir de plasma humain implique un risque résiduel de transmission de maladies infectieuses dues à la transmission d'agents pathogènes. Ce risque existe aussi pour des agents encore inconnus à ce jour.
Toutefois, le risque de transmission est limité par les mesures suivantes:
- sélection minutieuse des donneurs sur entrevue médicale et contrôle des dons individuels et du pool de plasma pour l'antigène de surface de l'hépatite (AgHBs) et pour les anticorps anti-VIH et anti-VHC;
- recherche du matériel génomique du VHC sur les pools de plasma;
- validation à l'aide de virus modèles des étapes d'inactivation/élimination incluses dans les procédés de fabrication; ces étapes sont considérées comme efficaces pour le VIH, le VHC, le VHA et le VHB. Les procédés d'inactivation/élimination virales ne sont probablement pas totalement efficaces contre les virus nus (sans couche lipidique externe), comme par ex. le parvovirus B19. Le parvovirus B19 peut déclencher des réactions sévères chez les femmes enceintes séronégatives (infection foetale) et chez les sujets immunodéprimés ou présentant une production accrue d'érythrocytes (par ex. lors d'anémie hémolytique).
La vaccination contre l'hépatite A et l'hépatite B est généralement recommandée aux patients recevant des produits à base de facteur VIII fabriqués à partir de plasma humain.
La formation d'anticorps neutralisants (inhibiteurs) contre le facteur VIII est une complication connue du traitement de l'hémophilie A. Ces inhibiteurs sont des immunoglobulines G; elles sont directement dirigées contre l'activité antihémorragique du facteur VIII. Leur concentration est mesurée en unités Bethesda (UB) par ml de plasma. Le risque de formation d'inhibiteurs est en relation avec la durée du traitement par le facteur VIII, ce risque étant maximal pendant les 20 premiers jours de traitement.
Patients précédemment non traités
Le développement d'inhibiteurs contre le FVIII survient principalement chez les patients précédemment non traités (PUPs). Dans une étude prospective ouverte évaluant l'immunogénicité d'Octanate chez des patients précédemment non traités, 51 patients ont été inclus. 44 patients ont rempli le critère pour l'évaluation de l'immunogénicité (c.-à-d. >50 jours d'exposition et FVIII: C ≤1%). 39 des 44 patients (88.6%) n'ont pas développé d'inhibiteurs. Chez deux (4.5%) des cinq patients avec inhibiteurs (un présentant un titre élevé d'inhibiteurs et un présentant un titre faible d'inhibiteurs) les inhibiteurs ont disparu pendant le traitement régulier par Octanate sans modification de la dose ou de la fréquence du traitement. Tous les inhibiteurs ont été décelés chez des patients traités à la demande. Les délais moyens jusqu'à l'apparition d'un titre élevé d'inhibiteurs étaient de 10 jours d'exposition (fourchette 3-19) et d'un titre faible d'inhibiteurs de 48 jours d'exposition.
Il est rare que des inhibiteurs se forment après 100 jours de traitement. C'est pourquoi les patients traités par le facteur VIII doivent être étroitement surveillés quant à l'apparition d'anticorps inhibiteurs (observation clinique et tests biologiques). Voir aussi «Effets indésirables».
Dans l'intérêt des patients, il est recommandé d'enregistrer le nom et le numéro de lot du produit à chaque administration d'Octanate.
Interactions
Aucune interaction avec d'autres médicaments n'est connue à ce jour.
Toutefois, Octanate ne doit pas être mélangé à d'autres médicaments ou administré en même temps que d'autres préparations intraveineuses dans la même tubulure.
Grossesse/Allaitement
Aucune étude de reproduction n'a été effectuée chez l'animal avec le facteur VIII. Parce que l'hémophilie A est très rare chez la femme, aucune expérience relative à l'emploi du facteur VIII pendant la grossesse et l'allaitement n'est disponible. C'est pourquoi le facteur VIII ne doit être utilisé chez la femme enceinte ou allaitant sauf en cas de nécessité absolue.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Octanate n'a aucune influence sur l'aptitude à la conduite ou à l'utilisation de machines.
Effets indésirables
La fréquence des effets indésirables isolés a été déterminée selon les critères suivants:
Très fréquent (≥1/10).
Fréquent (≥1/100, <1/10).
Peu fréquent (≥1/1'000, <1/100).
Rare (≥1/10'000, <1/1'000).
Très rare (<1/10'000), y compris cas isolés.
Des réactions d'hypersensibilité ou allergiques (qui peuvent inclure angio-oedème, sensation de brûlure et de piqûre au site d'injection, frissons, rougeurs avec impression de chaleur, urticaire généralisée, céphalées, urticaire, hypotension, léthargie, nausées, agitation, tachycardie, oppression thoracique, tremblement, vomissement, respiration sifflante) ont été rarement observées lors de l'utilisation de préparations à base de facteur VIII, et peuvent dans certains cas évoluer vers une réaction anaphylactique sévère (voire un état de choc).
Affections du système immunitaire
Rare: réaction d'hypersensibilité.
Très rare: choc anaphylactique.
Troubles généraux et anomalies au site d'administration
Rare: fièvre.
Investigations
Rare: inhibiteurs du FVIII.
Les patients atteints d'hémophilie A peuvent développer des anticorps neutralisants (inhibiteurs) contre le facteur VIII. Si de tels inhibiteurs apparaissent, la réaction se manifeste sous forme d'une réponse clinique insuffisante. Dans ce cas, il est recommandé de contacter un centre spécialisé en hémophilie.
Dans une étude clinique avec Octanate menée sur 77 patients atteints d'hémophilie A sévère préalablement traités, il n'y a pas d'anticorps qui sont apparus. Il n'existe aucun rapport spontané pouvant soupçonner l'apparition d'anticorps inhibiteurs.
Surdosage
Aucun symptôme de surdosage avec le facteur VIII de coagulation humain n'a été rapporté à ce jour.
Propriétés/Effets
Code ATC: B02BD02
Mécanisme d'action, pharmacodynamie, efficacité clinique
Groupe pharmacothérapeutique: antihémorragiques, facteur VIII de coagulation.
Le complexe facteur VIII/facteur de Willebrand comprend deux molécules (FVIII et vWF) dotées d'effets physiologiques différents. A l'administration du facteur VIII, celui-ci se lie au facteur de Willebrand du patient.
En tant que co-facteur du facteur IX activé, le facteur VIII activé accélère la transformation du facteur X en facteur X activé. Le facteur X activé convertit la prothrombine en thrombine, qui convertit alors le fibrinogène en fibrine, et permet ainsi la formation d'un caillot.
L'hémophilie A est une affection héréditaire de la coagulation sanguine liée au sexe, due à un déficit en facteur VIII: C et qui entraîne des hémorragies importantes dans les articulations, les muscles et les organes internes, ces hémorragies étant soit spontanées, soit consécutives à des blessures. Un traitement de substitution permet d'augmenter le taux de facteur VIII et de corriger ainsi temporairement le déficit en facteur VIII et la tendance hémorragique.
Pharmacocinétique
Le facteur VIII (présent dans le concentré) est un constituant normal du plasma humain et se comporte comme le facteur VIII endogène.
Après injection du produit, environ 2⁄3 à ¾ du facteur VIII restent en circulation. L'activité plasmatique du facteur VIII devrait se situer entre 80 et 120% de l'activité escomptée du facteur VIII.
L'activité du facteur VIII diminue de manière exponentielle en deux phases. Dans un premier temps, le facteur VIII est distribué dans les liquides corporels et est éliminé du plasma avec une demi-vie de 3 à 6 heures. Dans la deuxième phase plus lente, la demi-vie varie entre 8 et 20 heures, avec une moyenne de 12 heures. Ceci correspond à la demi-vie biologique.
Les résultats suivants ont été obtenus dans deux études pharmacocinétiques réalisées avec Octanate chez 10 et 14 patients:
Médiane | Moyenne | SD* | Minimum | Maxium | ||
|---|---|---|---|---|---|---|
Récupération (% × UI–¹ × kg) | Étude 1 | 2,4 | 2,4 | 0,36 | 1,8 | 3,1 |
Étude 2 | 2,4 | 2,4 | 0,25 | 2,1 | 2,8 | |
AUC* norm (% × h × UI–¹ × kg) | Étude 1 | 45,9 | 45,5 | 17,2 | 19,0 | 65,3 |
Étude 2 | 34,0 | 33,4 | 8,5 | 19,5 | 50,2 | |
Demi-vie (h) | Étude 1 | 15,1 | 14,3 | 4,01 | 7,7 | 19,1 |
Étude 2 | 12,4 | 12,6 | 3,03 | 7,2 | 17,7 | |
MRT* (h) | Étude 1 | 20,9 | 19,6 | 6,05 | 9,2 | 27,0 |
Étude 2 | 16,4 | 16,6 | 3,73 | 10,3 | 22,3 | |
Clairance (ml × h-¹ × kg) | Étude 1 | 2,2 | 2,6 | 1,21 | 1,5 | 5,3 |
Étude 2 | 2,9 | 3,2 | 0,88 | 2,0 | 5,1 |
* SD = standard deviation = écart-type.
* AUC (area under the curve) = aire sous la courbe concentration-temps en fonction du poids corporel.
* MRT mean residence time = durée de séjour moyenne.
Données précliniques
Le facteur VIII (présent dans le concentré) est un constituant normal du plasma humain et se comporte comme le facteur VIII endogène.
Les données toxicologiques disponibles pour le tri-n-butyl-phosphate (TNBP) et, dans une moindre mesure, pour le polysorbate 80 (Tween 80), solvants/détergents utilisés dans le procédé SD d'inactivation virale lors de la fabrication d'Octanate, révèlent que des effets défavorables sont improbables dans le cadre de l'utilisation prévue chez l'homme.
Même utilisés à des doses par kilo de poids corporel plusieurs fois supérieures à celles recommandées chez l'homme, ces réactifs n'ont pas révélé d'effet toxique chez les animaux de laboratoire. Aucun effet mutagène n'a été observé pour ces deux substances.
Remarques particulières
Incompatibilités
Aucune interaction avec d'autres médicaments n'est connue.
Aucune étude de compatibilité n'ayant été effectuée, ce médicament ne doit pas être mélangé à d'autres médicaments.
N'utiliser que le set de préparation/injection fourni dans l'emballage, car la réussite du traitement peut être compromise suite à l'adsorption du facteur VIII de coagulation humain à la surface interne de certains sets de perfusion.
Influence sur les méthodes de diagnostic
Aucune influence connue.
Stabilité
La date de péremption est indiquée sur le récipient et sur l'emballage. Octanate ne doit pas être utilisé au-delà de cette date.
Utiliser le produit immédiatement après sa reconstitution.
Remarques concernant le stockage
Conserver entre +2 °C et +8 °C. Conserver à l'abri de la lumière. Ne pas congeler. Les éventuels restes de solution prête à l'emploi doivent être éliminés.
Conserver avec précaution et hors de portée des enfants.
Remarques concernant la manipulation
Solution pour administration intraveineuse après dissolution dans le solvant fourni (eau pour préparations injectables).
Veuillez lire attentivement les instructions suivantes et les suivre scrupuleusement!
La procédure décrite ci-dessous doit être effectuée dans des conditions aseptiques.
Instructions pour la reconstitution de la solution
|
|
|
|
|
|
|
|
La solution doit être limpide à légèrement opalescente. Ne pas utiliser la solution si des traînées sont visibles ou s'il y a formation d'agrégats. Avant administration, vérifier visuellement l'absence de particules et de coloration dans la solution obtenue. Utiliser la solution immédiatement après sa reconstitution. La solution reconstituée ne peut servir qu'à une seule administration. Instructions pour l'injectionPar mesure de précaution, contrôler le pouls du patient avant et pendant l'injection de facteur VIII. Si le pouls augmente de manière sensible, réduire la vitesse d'injection ou interrompre l'administration. | |
|
|
Si vous utilisez plus d'un flacon de concentré d'Octanate, l'aiguille à ailettes peut être laissée dans la veine. Pour préparer la solution prête-à-l'emploi, utiliser toujours un nouveau dispositif Mix2vial. | |
Numéro d’autorisation
00666 (Swissmedic).
Titulaire de l’autorisation
Octapharma AG, 8853 Lachen.
Mise à jour de l’information
Novembre 2019.
Отзывов (0)

Бесплатная консультация опытного специалиста
Опишите симптомы или нужный препарат – мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой на дом или просто проконсультируем.
Нас 14 специалистов и 0 ботов. Мы всегда будем с вами на связи и сможем связаться в любое время.


 Deutsch
Deutsch French
French





