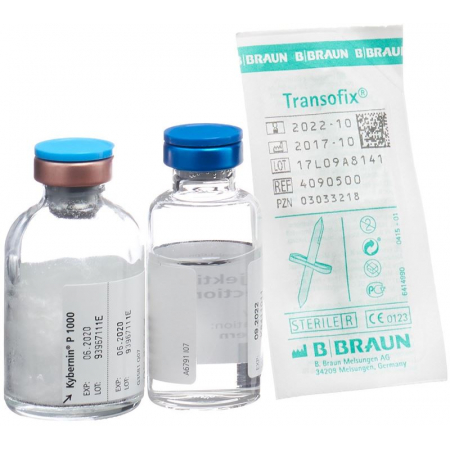
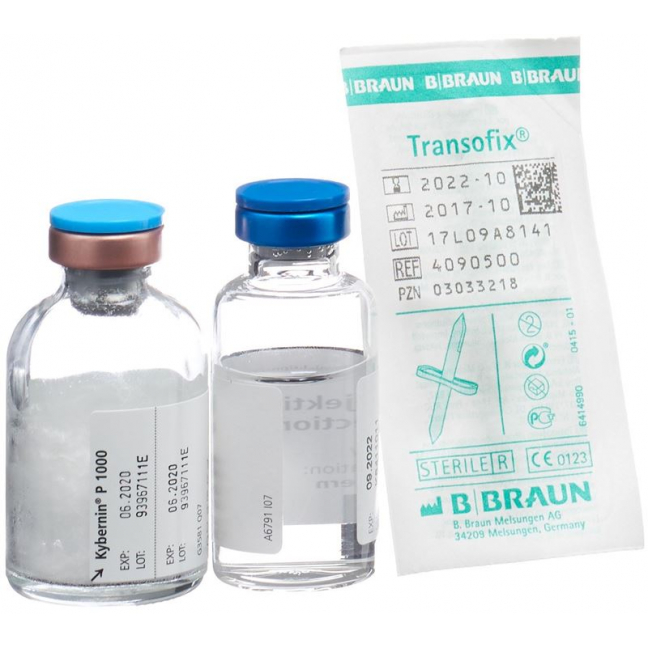
Kybernin P Trockensubstanz 1000 Ie C Solv Flasche
Kybernin P Trockensub 1000 IE mit Solvens Fl
-
110906.07 RUB

- Наличие: Нет в наличии
- Производитель: CSL BEHRING AG
- Модель: 7534727
- ATC-код B01AB02
- EAN 7680469280026
Описание
AMZV
Zusammensetzung
Wirkstoff: Antithrombin III, aus Humanplasma.
Hilfsstoffe: Glycin, Natriumchlorid, Natriumcitrat.
Galenische Form und Wirkstoffmenge pro Einheit
Trockensubstanz und Lösungsmittel zur i.v. Injektion/Infusion
- Durchstechflasche mit Trockensubstanz (weisses Lyophilisat): 500 IE bzw. 1000 IE Antithrombin III
- Durchstechflasche mit Lösungsmittel: 10 ml bzw. 20 ml Wasser für Injektionszwecke
Nach Rekonstitution mit 10/20 ml enthält Kybernin P 50 IE Antithrombin III pro ml.
Die Aktivität (IE) wird mittels chromogenem Test gemäss Europäischem Arzneibuch bestimmt. Die spezifische Aktivität von Kybernin P beträgt ca. 5 IE/mg Protein.Sonstiger Bestandteil mit bekannter Wirkung:
Eine Durchstechflasche Kybernin P 500 enthält bis zu 44.76 mg Natrium . Das entspricht 2% der empfohlenen, maximalen, täglichen Aufnahme von Natrium für einen Erwachsenen.
Eine Durchstechflasche Kybernin P 1000 enthält bis zu 89.52 mg Natrium . Das entspricht 4.5% der empfohlenen, maximalen, täglichen Aufnahme von Natrium für einen Erwachsenen.
Indikationen/Anwendungsmöglichkeiten
Substitutionstherapie bei Patienten mit angeborenem Antithrombin-III-Mangel:
- zur Thromboseprophylaxe in Situationen, in denen die Verabreichung von oralen Antikoagulantien bzw. von Heparin kontraindiziert ist, insbesondere perioperativ und peripartal.
- zur Thrombosetherapie bei ausgedehnten Thrombosen zusammen mit Heparin sowie bei einer Verbrauchskoagulopathie.
Dosierung/Anwendung
Die rekonstituierte Lösung von Antithrombin III wird langsam intravenös injiziert oder infundiert.
Bei angeborenem Mangel sollte die Dosierung bei jedem Patienten individuell erfolgen. Dabei sollten die Familiengeschichte bezüglich thromboembolischer Ereignisse, die aktuellen klinischen Risikofaktoren und die Laborbeurteilung berücksichtigt werden.
Übliche Dosierung:
Die Dosierung und Dauer der Substitutionstherapie bei erworbenem Mangel hängt vom Antithrombin-Plasmaspiegel, von Anzeichen erhöhten Verbrauchs, der zu Grunde liegenden Erkrankung und der Schwere der klinischen Symptome ab. Die zu verabreichende Dosis und Häufigkeit der Gabe sollten stets individuell, entsprechend der klinischen Wirksamkeit und den Laborbefunden angepasst werden.
Die Menge der verabreichten Antithrombin-Einheiten wird in Internationalen Einheiten (I.E.) angegeben, die vom aktuellen WHO-Standard für Antithrombin-Produkte abgeleitet sind. Die Antithrombin-Aktivität im Plasma wird entweder als Prozentsatz (relativ zu normalem menschlichen Plasma) oder in Internationalen Einheiten (relativ zum Internationalen Standard für Antithrombin im Plasma) angegeben.
Eine internationale Einheit (IE) Antithrombin-Aktivität entspricht dem Antithrombin-Gehalt in 1 ml normalem Humanplasma. Die Berechnung der notwendigen Dosierung basiert auf dem empirischen Befund, dass 1 IE Antithrombin/kg Körpergewicht die Antithrombin-Aktivität im Plasma um ca. 1,5% erhöht.
Die Initialdosis wird nach folgender Formel berechnet:
Erforderliche Einheiten = Körpergewicht [kg] × (100 - aktuelle Antithrombin-Aktivität [%]) × 2/3.
Der initiale Zielwert der Antithrombin-Aktivität hängt von der klinischen Situation ab. Zur Substitution von Antithrombin sollte die Dosierung so gewählt werden, dass der gewünschte Antithrombin-Spiegel erreicht und aufrecht erhalten wird. Dies sollte anhand von Labormessungen der Antithrombin-Aktivität überwacht werden. Diese Antithrombin Bestimmungen sollten mindestens zweimal täglich bis zur Stabilisierung des Patienten durchgeführt werden, anschliessend einmal täglich und insbesondere unmittelbar vor der nächsten Gabe.
Für eine Dosisanpassung sollten sowohl Laborwerte mit möglichen Hinweisen auf erhöhten Antithrombin-Verbrauch, als auch klinische Parameter berücksichtigt werden. Die Antithrombin-Aktivität sollte während der Therapie mindestens 80% der Norm betragen, ausser die klinische Situation spricht für einen anderen effektiven Spiegel.
Die übliche Anfangsdosis bei angeborenem Mangel liegt bei 30-50 IE/kg.
Im weiteren Verlauf sollte die Dosierung sowie die Häufigkeit und die Dauer der Behandlung den biologischen Daten und der klinischen Situation angepasst werden.
Kinder und Jugendliche
40-60 IE Antithrombin/kg Körpergewicht/Tag abhängig vom Gerinnungsstatus.
Abhängig vom klinischen Bild können im Einzelfall höhere Dosen notwendig sein. Die Antithrombin-Akitvität muss dann häufiger kontrolliert werden und soll nicht mehr als 120% betragen.
Aufgrund von Erfahrungen aus klinischen Prüfungen kann die Anwendung von Antithrombin zur Behandlung von IRDS (Infant Respiratory Distress Syndrome) bei Frühgeborenen nicht empfohlen werden (vgl. «Warnhinweise und Vorsichtsmassnahmen»).
Anwendungshinweise:
Die Lösung wird langsam intravenös injiziert oder infundiert (max. 4 ml/Min). Hinweise zum Auflösen finden sich im Kapitel «Sonstige Hinweise» im Abschnitt «Hinweise für die Handhabung».
Kontraindikationen
Überempfindlichkeit gegen die aktive Substanz oder einen der Hilfstoffe.
Warnhinweise und Vorsichtsmassnahmen
Daten aus klinischen Studien und systematischen Übersichtsarbeiten über die Verwendung von Antithrombin III bei der Behandlung von Frühgeborenen in der nicht genehmigten Indikation «Atemnotsyndrom des Neugeborenen (IRDS)» deuten auf ein erhöhtes Risiko für intrakranielle Blutungen und Mortalität hin, bei gleichzeitig fehlendem Nachweis einer positiven Wirkung in dieser Patientenpopulation. Die Behandlung von Patienten mit hereditärem Antithrombin-Mangel sowie von deren Nachkommen sollte individuell entsprechend dem Ansprechen des Patienten und unter Hinzuziehung eines Gerinnungsspezialisten durchgeführt werden.
Die Substitutionstherapie wird mit einem Funktionstest überwacht. Bei Patienten mit akutem Verbrauch kann die Halbwertszeit von Antithrombin bis auf wenige Stunden verkürzt sein. Bei diesen Patienten ist eine Bestimmung der Antithrombin-Aktivität mehrmals täglich erforderlich. Dazu eignet sich am besten die Bestimmung mittels chromogenem Substrat.
Aufgrund des intravenösen Applikationsweges des Glykoproteins sind allergische Überempfindlichkeitsreaktionen möglich. Die Patienten müssen während der Infusion engmaschig überwacht und sorgfältig auf allfällige Symptome beobachtet werden. Patienten sollen über Frühzeichen von Überempfindlichkeitsreaktionen informiert werden, wie Hautausschlag, generalisierte Nesselsucht, Engegefühl in der Brust, Stridor, Hypotonie und Anaphylaxie. Falls diese Symptome nach der Anwendung auftreten, sollen die Patienten sofort ihren Arzt kontaktieren. Die aktuellen medizinischen Richtlinien zur Schockbehandlung sind zu beachten.
Es wird empfohlen, Patienten mit hereditärem Antithrombin-Mangel über die Erblichkeit dieser Krankheit und über das Thromboserisiko während einer Schwangerschaft zu informieren.
Virale Sicherheit
Wenn medizinische Produkte aus humanem Blut oder Plasma angewendet werden, können Infektionskrankheiten bedingt durch die Übertragung infektiöser Agentien nicht vollständig ausgeschlossen werden. Dies gilt auch für Pathogene bisher unbekannter Natur. Standardmassnahmen zur Verhinderung von Infektionen durch den Einsatz von aus Blut oder Blutplasma hergestellten Arzneimitteln schliessen die Auswahl der Spender und das Screening der einzelnen Spenden und Plasmapools auf spezifische Infektionsmarker (HBsAg und Antikörper gegen HIV und HCV) sowie effektive und mit Modellviren validierte Schritte zur Inaktivierung/Eliminierung von Viren im Herstellverfahren ein. Die getroffenen Massnahmen werden als wirksam angesehen für umhüllte Viren wie z.B. das humane Immundefizienzenvirus (HIV), das Hepatitis-B Virus (HBV) und das Hepatitis C Virus (HCV) sowie für die nicht umhüllten Viren Hepatitis A Virus (HAV) und Parvovirus B19. Bei Patienten mit angeborenem Mangel, die regelmässig Antithrombin-Konzentrate aus menschlichem Plasma erhalten, sollte eine Impfung gegen Hepatitis A und B in Erwägung gezogen werden. Es wird eindringlich empfohlen, bei jeder Verabreichung von Kybernin P an einen Patienten Name und Chargennummer des Produktes zu dokumentieren, um einen Zusammenhang zwischen Produktcharge und Patient herzustellen.
Klinische und biologische Überwachung bei der Anwendung von Antithrombin zusammen mit Heparin
Um die Dosierung von Heparin anzupassen und um eine exzessive Hypokoagualität zu vermeiden, sollten Kontrollen des Ausmasses der Antikoagulation (APPT, und wo angemessen anti-FXa Aktivität) regelmässig, in kurzen Intervallen und besonders in den ersten Minuten und Stunden nach Beginn der Anwendung von Antithrombin III erfolgen.
Da bei Langzeitbehandlung mit nicht fraktioniertem Heparin das Risiko der Abnahme der Antithrombin-III-Spiegel besteht, sollte unter diesen Bedingungen eine tägliche Messung der Antithrombin-III-Spiegel erfolgen, und die individuelle Dosis ggf. angepasst werden.
Interaktionen
Heparin: Antithrombin-Ersatz während der Anwendung von Heparin in therapeutischer Dosierung erhöht das Blutungsrisiko. Die gerinnungshemmende Wirkung von Antithrombin wird durch gleichzeitige Verabreichung von Heparin wesentlich verstärkt. Dies kann bedingt durch einen beschleunigten Antithrombin Umsatz zu einer beträchtlichen Verkürzung der Halbwertszeit von Antithrombin führen.Daher muss die gleichzeitige Gabe von Heparin und Antithrombin bei Patienten mit einem erhöhten Blutungsrisiko klinisch und biologisch überwacht werden.
Schwangerschaft/Stillzeit
Die Erfahrungen zur Sicherheit von Antithrombin-Produkten während der Schwangerschaft sind begrenzt.
Klinische Prüfungen mit Kybernin P in der Schwangerschaft oder Stillzeit wurden bislang nicht durchgeführt. Untersuchungen am Tier sind ungeeignet für die Beurteilung der Auswirkungen auf die Reproduktionsfähigkeit, die Entwicklung des Embryos oder Foetus, den Schwangerschaftsverlauf und die prä-/postnatale Entwicklung. Bisher liegen keine negativen Erfahrungen hinsichtlich Behandlung während der Schwangerschaft und Stillzeit vor. Kybernin P soll daher bei schwangeren oder stillenden antithrombin-defizienten Frauen nur bei zwingender Indikation unter Berücksichtigung des erhöhten Thromboserisikos angewendet werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Einschränkungen in Bezug auf das Führen von Kraftfahrzeugen oder Bedienen von Maschinen sind nicht bekannt.
Unerwünschte Wirkungen
Überempfindlichkeit oder allergische Reaktionen (einschliesslich Angioödem, Brennen und Stechen an der Infusionsstelle, Schüttelfrost, Hautrötung, generalisierte Nesselsucht, Kopfschmerzen, quaddelartiger Hautausschlag, Hypotonie, Lethargie, Brechreiz, Ruhelosigkeit, Tachykardie, Engegefühl in der Brust, Kribbeln, Erbrechen, Niesen) wurden selten beobachtet. Diese können sich in einzelnen Fällen zu schwerer Anaphylaxie einschliesslich Schock entwickeln. Selten wurde Fieber beobachtet.
Die folgenden unerwünschten Arzneimittelwirkungen (UAW) basieren auf den Anwendungserfahrungen nach der Markteinführung. Sofern Daten vorliegen, sind die Häufigkeiten gemäss folgender Standardkonvention beurteilt:
Sehr häufig ≥1/10
Häufig ≥1/100 und <1/10
Gelegentlich ≥1/1'000 und <1/100
Selten ≥1/10'000 und <1/1'000
Sehr selten ≥1/10'000
MedDra-Systemorganklasse | Unerwünschte Wirkung | Häufigkeit |
Erkrankungen des Immunsystems | Überempfindlichkeit/anaphylaktische Reaktionen (inklusive schwerer Anaphylaxie und Schock) | Selten |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | Fieber | Selten |
Informationen zur Virensicherheit siehe auch Kapitel «Warnhinweise und Vorsichtsmassnahmen».
Überdosierung
Symptome bei Überdosierung wurden bisher nicht beobachtet.
Eigenschaften/Wirkungen
ATC-Code: B01AB02
Kybernin P wird aus gepooltem, humanem Plasma gesunder Spender gewonnen. Information über die Testung von Plasma und Plasmapools sind unter Kapitel «Warnhinweise und Vorsichtsmassnahmen» beschrieben. Der Herstellungsprozess von Kybernin P beinhaltet verschiedene Schritte, die zur Eliminierung/Inaktivierung von Viren beitragen. Die Hitzebehandlung des Präparates in wässriger Lösung bei 60 °C über 10 Stunden wurde zur Virusinaktivierung eingeführt.
Wirkungsmechanismus
Antithrombin, ein Glykoprotein mit einem Molekulargewicht von 58 kD und 432 Aminosäuren, gehört in die Gruppe der Serpine (Serin Protease Inhibitor). Es ist einer der wichtigsten physiologischen Hemmer der Blutgerinnung. Die am stärksten gehemmten Faktoren sind Thrombin und Faktor Xa, aber auch die Faktoren der Kontaktaktivierung, des intrinsischen Systems und der Faktor VIIa/Tissue Faktor Komplex. Die Antithrombin-Aktivität wird durch Heparin stark erhöht und der gerinnungshemmende Effekt von Heparin hängt von der Anwesenheit von Antithrombin ab.
Antithrombin enthält zwei funktionell wichtige Domänen.
Die eine enthält das reaktive Zentrum und stellt die Spaltungsstelle für Proteinasen wie Thrombin, eine Vorbedingung zur Bildung eines stabilen Proteinase-Inhibitor Komplexes, dar. Die zweite ist eine Glykosaminoglykan-bindende Domäne und ist für die Interaktion mit Heparin und ähnlichen Substanzen, die die Hemmung von Thrombin beschleunigen, verantwortlich.
Die Komplexe aus Antithrombin und Gerinnungsfaktoren werden durch das retikuloendotheliale System abgebaut.Die normale AntithrombinAktivität beträgt bei Erwachsenen 80-120%, der Spiegel bei Neugeborenen beträgt etwa 40–60%.
Pharmakokinetik
Kybernin P ist nach intravenöser Applikation sofort in der Dosierung entsprechenden Plasmakonzentration verfügbar und bindet Thrombin, Faktor Xa und andere aktivierte Gerinnungsfaktoren.
Die biologische Halbwertszeit von Antithrombin beträgt 2,5 Tage, kann aber bei akutem Verbrauch bis auf wenige Stunden verkürzt sein. Bei diesen Patienten ist eine mehrmalige Bestimmung der Antithrombin-Aktivität pro Tag erforderlich. Für diesen Zweck ist die Analyse mit der chromogenen Substratmethode geeignet. Auch bei gleichzeitiger Heparin-Therapie verkürzt sich diese Halbwertszeit (siehe Kap. «Interaktionen»). Kybernin P verhält sich bei Verteilung und Abbau im Organismus wie der körpereigene Inhibitor AT III. Die in-vivo Recovery lag bei 5 gesunden Probanden im Mittel bei 65% (gemessen bei tmax = 1.15 Stunden).
Präklinische Daten
Humanes Antithrombin ist ein normaler Bestandteil des menschlichen Plasmas. Die Toxizitätsprüfungen mit Einzeldosen sind von geringer Aussagekraft und erlauben keine Einschätzung der toxischen oder letalen Dosis.
Untersuchungen an Labortieren haben keine akute Toxizität gezeigt.
Toxizitätsuntersuchungen mit wiederholten Dosen sind im Tierversuch wegen der Antikörperbildung gegen heterologes Protein bei den Versuchstieren nicht durchführbar.
Die bisherigen klinischen Erfahrungen geben keinerlei Hinweise auf embryofetale Toxizität. Es wurden weder onkogene noch mutagene Wirkungen beobachtet
Sonstige Hinweise
Inkompatibilitäten
Hydroxyaethylstärke (HES) kann nicht als Verdünnungsmittel (für Infusionszwecke) empfohlen werden, da ein Aktivitätsverlust an Antithrombin zu beobachten ist.
Kybernin P sollte in der Spritze/dem Infusionsbesteck nicht mit anderen Arzneimitteln gemischt werden. Dopamin, Dobutamin und Furosemid sollten nicht gleichzeitig über denselben venösen Zugang appliziert werden. Für Hinweise zur Verdünnung vgl. «Hinweise für die Handhabung».
Haltbarkeit
Kybernin P darf nach Ablauf des auf Packung und Behältnis angegebenen Verfalldatums nicht mehr angewendet werden.
Besondere Lagerungshinweise
Kybernin P nicht über 25 °C lagern. Vor Licht schützen. Nicht einfrieren! Arzneimittel für Kinder unzugänglich aufbewahren.
Nach Rekonstitution ist die physiko-chemische Stabilität für 8 Stunden bei Raumtemperatur (max. +25 °C) belegt. Aus mikrobiologischer Sicht und da Kybernin P keine Konservierungsmittel enthält, sollte das gelöste Produkt sofort verbraucht werden. Falls es nicht sofort angewendet wird, soll eine Aufbewahrung 8 Stunden bei +25 °C nicht überschreiten.
Nach Öffnen des Behältnisses ist dessen Inhalt sofort zu verwenden.
Hinweise für die Handhabung
Die Trockensubstanz wird mit 10 bzw. 20 ml Wasser für Injektionszwecke unter aseptischen Bedingungen vollständig gelöst. Es entsteht eine klare bis leicht opaleszente Lösung. Zur Verabreichung als Infusion eignet sich als Verdünnungsmittel insbesondere 5%ige Human-Albumin-Lösung. Bei Verdünnungen bis 1:5 können folgende Infusionslösungen verwendet werden: Ringer-Lactat-Lösung, physiologische Kochsalzlösung, 5%ige Glukose-Lösung oder Polygeline.
Das rekonstituierte Produkt sollte vor der Anwendung visuell auf Partikel und Verfärbungen geprüft werden. Die Lösung sollte klar oder leicht opaleszent sein. Lösungen, die trübe sind oder einen Niederschlag aufweisen, nicht verwenden.
Zubereitung
Für die korrekte Handhabung des Transofix®-Transfersets gehen Sie wie folgt vor:
 | 1. Nach Entfernung einer der beiden Schutzkappen den ungeschützten Einstichdorn senkrecht durch den Gummistopfen der Durchstechflasche stechen. |
 | 2. Die Schutzkappe vom zweiten Einstichdorn abnehmen. |
 | 3. Die Durchstechflasche mit dem Produkt kopfüber auf diesen Einstichdorn drücken. |
 | 4. Die Durchstechflasche um 180° drehen. |
 | 5. Die Durchstechflasche mit dem Produkt auf eine ebene Fläche stellen. Das Lösungsmittel fliesst jetzt in die Durchstechflasche mit dem Produkt. |
 | 6. Die Transofix®-Transfervorrichtung zusammen mit der Lösungsmittel-Durchstechflasche aus der Durchstechflasche mit dem Produkt entfernen. Das Kybernin-Pulver löst sich auf. Das rekonstituierte Kybernin kann in eine Spritze aufgezogen und verabreicht werden. |
Nicht verwendetes Produkt und Abfallmaterial muss vorschriftsgemäss entsorgt werden.
Zulassungsnummer
46928 (Swissmedic).
Zulassungsinhaberin
CSL Behring AG, Bern.
Stand der Information
Juli 2017.
OEMéd
Composition
Principe actif: antithrombine III, préparée à partir de plasma humain.
Excipients: glycine, chlorure de sodium, citrate de sodium.
Forme galénique et quantité de principe actif par unité
Substance lyophilisée et solution à diluer pour injection/perfusion iv.
- Flacon avec substance lyophilisée (lyophilisat blanc): 500 UI ou 1000 UI d'antithrombine III
- Flacon avec solution à diluer: 10 ml ou 20 ml d'eau pour injection
Après la reconstitution avec 10/20 ml, Kybernin P contient 50 UI d'antithrombine III par ml.
L'activité (UI) est définie d'après le dosage chromogène de la pharmacopée européenne. L'activitié spécifique de Kybernin P est d'environ 5 UI/mg de protéine.
Excipient particulier dont l'efficacité est connue:
Un flacon de Kybernin P 500 contient jusqu'à 44,76 mg de sodium, ce qui correspond à 2% de la dose journalière maximale recommandée de sodium pour un adulte.
Un flacon de Kybernin P 1000 contient jusqu'à 89,52 mg de sodium, ce qui correspond à 4,5% de la dose journalière maximale recommandée de sodium pour un adulte.
Indications/Possibilités d’emploi
Traitement de substitution chez les patients souffrant d'une déficience héréditaire en Antithrombine III:
- prophylaxie antithrombotique dans les situations où l'administration d'anticoagulants oraux ou d'héparine est contre-indiquée, particulièrement en période périopératoire et péripartale;
- traitement antithrombotique en cas de thromboses étendues, en association à l'héparine, ainsi qu'en cas de coagulopathie de consommation.
Posologie/Mode d’emploi
La solution reconstituée d'antithrombine III est injectée ou perfusée lentement.
En cas de déficience congénitale, la posologie doit être adaptée individuellement à chaque patient. C'est pourquoi, il convient de tenir compte des antécédents familiaux relatifs aux événements thromboemboliques, des facteurs de risque clinique réels et des examens biologiques.
Posologie usuelle
En cas de déficience héréditaire, la posologie et la durée du traitement de substitution dépendent du taux plasmatique de l'antithrombine, des symptômes d'une utilisation accrue, de la maladie sous-jacente et de la sévérité des symptômes cliniques. La dose et la fréquence de l'administration doivent toujours être adaptées individuellement, en fonction de l'efficacité clinique et des résultats de laboratoire.
Le nombre d'unités d'antithrombine administrées est exprimé en unités internationales (UI), conformément à la norme OMS actuelle applicable aux produits à base d'antithrombine. L'activité de l'antithrombine dans le plasma est exprimée soit en pourcentage (par rapport au plasma humain normal) soit en unités internationales (conformément à la norme internationale de l'antithrombine dans le plasma).
Une unité internationale (UI) de l'activité de l'antithrombine correspond à la teneur en antithrombine dans 1 ml de plasma normal humain. Le calcul de la posologie requise est basé sur le résultat empirique suivant lequel 1 UI d'antithrombine/kg de poids corporel augmente l'activité de l'antithrombine dans le plasma d'environ 1,5%.
La dose initiale est calculée selon la formule suivante:
Dose nécessaire = poids corporel [kg] × (100 – l'activité d'Antithrombine actuelle [%] × 2/3.
La valeur cible initiale de l'activité de l'antithrombine dépend de l'état clinique. Pour la substitution de l'antithrombine, la posologie doit être choisie de manière à atteindre et maintenir la concentration d'antithrombine souhaitée. Elle doit être surveillée en fonction des valeurs biologiques de l'activité de l'antithrombine. Ces déterminations de l'antithrombine doivent être faites au minimum deux fois par jour jusqu'à la stabilisation du patient, puis avec un suivi d'une fois par jour et en particulier, immédiatement avant la prochaine administration.
Lors de l'ajustement posologique, il convient aussi bien de tenir compte des résultats biologiques indiquant potentiellement une consommation accrue d'antithrombine ainsi que les paramètres cliniques. L'activité de l'antithrombine doit être d'au moins 80% de la norme pendant la durée du traitement, à moins que la situation clinique indique un niveau efficace différent.
La dose initiale habituelle en cas de déficience congénitale est de 30 à 50 UI/kg.
Par la suite, la posologie ainsi que la fréquence et la durée du traitement doivent être adaptées aux données biologiques et à la situation clinique.
Enfants et adolescents
40-60 UI d'antithrombine/kg de poids corporel/jour dépendant du statut de coagulation. Une plus haute dose peut s'avérer nécessaire dans des cas isolés et en fonction du tableau clinique. L'activité de l'antithrombine doit alors être souvent contrôlée et elle ne doit pas dépasser le taux de 120%.
Les expériences d'études cliniques montrent que l'utilisation de l'antithrombine n'est pas indiquée pour la traitement de l'IRDS (Infant Respiratory Distress Syndrome) chez les prématurés (voir «Mises en garde et précautions»).
Mode d'emploi
La solution sera injectée par voie i.v. ou lentement perfusée (max. 4 ml/min).
Voir indications pour la dissolution au chapitre «Remarques particulières» sous section «Remarques concernant la manipulation».
Contre-indications
Hypersensibilité à la substance active ou à l'un des excipients.
Mises en garde et précautions
Les expériences d'études cliniques et les évaluations systématiques de l'utilisation de l'antithrombine III pour le traitement des prématurés dans l'indication non homologuée de l'IRDS (Infant Respiratory Distress Syndrome) indiquent un risque accru d'hémorragies intracrâniennes et de mortalité, en l'absence d'un effet bénéfique démontré dans cette population de patients.
Le traitement des patients ayant une déficience héréditaire en antithrombine, ainsi que de leurs descendants, doit se faire individuellement, selon le besoin de chaque patient. Il doit être effectué par un spécialiste de la coagulation.
Le traitement de substitution est contrôlé par un test de fonction. Chez les patients ayant une consommation aiguë, la demi-vie de l'antithrombine peut être réduite à quelques heures. Chez ces patients, il devient alors nécessaire de déterminer plusieurs fois par jour l'activité de l'antithrombine. La détermination avec un substrat chromogène est la plus adéquate.
Des réactions d'hypersensibilité sont possibles en raison de la voie d'administration intraveineuse de la glycoprotéine. Il convient de suivre étroitement et soigneusement les patients pendant la perfusion afin de détecter d'éventuels symptômes. Il convient d'informer les patients des signes précoces de réactions d'hypersensibilité telles qu'éruption cutanée, urticaire généralisé, sentiment d'oppression thoracique, stridor, hypotension et anaphylaxie. En cas de survenue de ces syptômes après l'administration, les patients doivent immédiatement contacter leur médecin. Les directives médicales actuelles pour traiter le choc doivent être suivies.
Il est conseillé d'informer les patients atteints d'une déficience héréditaire en anthithrombine sur le caractère héréditaire de cette maladie ainsi que du risque de thrombose pendant la grossesse.
Sécurité virale
Lorsque des médicaments préparés à partir de sang ou de plasma humains sont utilisés, les maladies infectieuses causées par la transmission d'agents infectieux ne peuvent pas être totalement exclues. Ceci s'applique également aux agents pathogènes inconnus jusqu'à présent.
Les mesures habituelles de prévention du risque de transmission d'agents infectieux par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection clinique des donneurs, la recherche des marqueurs spécifiques d'infection (HbsAg et anticorps dirigés contre le VIH et le VHC) sur chaque don et sur les pools de plasma et l'inclusion dans le procédé de fabrication d'étapes efficaces et validées au moyen de virus enveloppés pour l'inactivation/l'élimination virale. Les mesures mises en place sont considérées comme efficaces vis-à-vis des virus enveloppés comme par exemple le virus de l'immunodéficience humaine (VIH), le virus de l'hépatite B (VHB) et le virus de l'hépatite C (VHC) ainsi que vis-à-vis des virus non enveloppés tels que le virus de l'hépatite (VHA) et le parvovirus B19.
Chez les patients présentant une déficience congénitale qui reçoivent régulièrement un concentré d'antithrombine préparé à partir de plasma humain, il convient d'envisager une vaccination contre l'hépatite A et B. Il est fortement recommandé d'enregistrer le nom de la préparation et le numéro du lot lors de chaque administration de Kybernin P à un patient, pour établir un rapport entre le patient et le numéro du lot de la préparation.
Surveillance clinique et biologique en cas d'utilisation concomitante d'antithrombine et d'héparine
Pour ajuster la posologie de l'héparine et éviter une hypocoagulabilité excessive, des contrôles de l'étendue de l'anti-coagulation (TCA et le cas échéant activité anti-facteur xa) doivent être réalisés régulièrement, à intervalles rapprochés et en particulier dans les premières minutes et heures qui suivent le début de l'administration de l'antithrombine III.
Un traitement prolongé par l'héparine non fractionnée induisant un risque de diminution des taux d'antithrombine III, une mesure quotidienne de la concentration de l'antithrombine III devra être effectué dans ces circonstances et la dose individuelle adaptée si besoin.
Interactions
Héparine: le remplacement de l'antithrombine pendant l'administration d'héparine en doses thérapeutiques augmente le risque d'hémorragie. Par l'apport simultané d'héparine, l'effet inhibiteur de coagulation de l'antithrombine est considérablement augmenté. Cela a pour conséquence de diminuer fortement la demi-vie de l'antithrombine en raison de la potentialisation de l'activité de l'antithrombine. C'est pourquoi l'administration simultanée d'héparine avec de l'antithrombine aux patients présentant un risque accru d'hémorragie doit faire l'objet d'une surveillance clinique et biologique.
Grossesse/Allaitement
Les données relatives à la sécurité des produits contenant de l'antithrombine pendant la grossesse sont limitées.
Aucune étude clinique n'a été menée à ce jour quant à la sécurité de Kybernin P pendant la grossesse et l'allaitement. Les examens effectués chez l'animal sont jusqu'ici peu significatifs et ne permettent pas de juger des effets sur l'aptitude de reproduction, sur le développement de l'embryon ou du fœtus, sur le cours de la grossesse ainsi que sur le développement pré- ou postnatal. Aucun effet négatif n'a été reporté jusqu'à présent lors de traitement pendant la grossesse ou l'allaitement. Kybernin P peut ainsi être administré aux femmes enceintes ou allaitant présentant une déficience en antithrombine en cas d'indication majeure uniquement en tenant compte du risque augmenté de thromboses.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune restriction sur l'aptitude à la conduite ou à l'utilisation de machines n'est connue à ce jour.
Effets indésirables
Hypersensibilité ou réactions allergiques (y compris angioedème, brûlures et piqûres au point de perfusion, frissons, rougeur de la peau, urticaire généralisé, céphalées, éruption cutanée de type urticaire, hypotension, léthargie, nausées, agitation, tachycardie, sentiment d'oppression thoracique, fourmillements, vomissements, éternuements) sont rarement observés. Dans des cas isolés, ils peuvent conduire à une anaphylaxie sévère y compris un choc. Une fièvre est rarement observée.
Les effets indésirables suivants sont basés sur l'expérience d'administration après de la mise sur le marché. Sur base des résultats disponibles les fréquences ont été évaluées selon les critères suivants:
Très fréquent: ≥1/10
Fréquent: ≥1/100 à <1/10
Peu fréquent: ≥1/1000 à <1/100
Rare: ≥1/10'000 à <1/1000
Très rare: ≥1/10'000
Classe MedDra de systèmes d'organes | Effet indésirable | Fréquence |
|---|---|---|
Affections du système immunitaire | Hypersensibilité/réactions anaphylactiques (y compris anaphylaxie sévère et choc) | Rare |
Troubles généraux et anomalies au site d'administration | Fièvre | Rare |
Information sur la sécurité virale: voir également le chapitre «Mises en garde et précautions».
Surdosage
Aucun symptôme dû à un surdosage n'a été observé jusqu'à présent.
Propriétés/Effets
Code ATC: B01AB02
Kybernin P est produit à partir de pools de plasma humain de donneurs sains. L'information sur le dépistage du plasma et des lots de plasma se trouve au chapitre «Mises en garde et précautions».
Le procédé de fabrication de Kybernin P comporte plusieurs étapes contribuant à éliminer ou inactiver les virus. Pour l'inactivation virale, un traitement de la préparation par la chaleur en solution aqueuse pendant 10 heures à 60 °C a été mis en place.
Mécanisme d'action:
L'antithrombine, une glycoprotéine composée de 432 acides aminés dont le poids moléculaire est de 58 kD, appartient à la famille des serpines (inhibiteur de la protéase sérine). C'est l'un des inhibiteurs physiologiques les plus importants de la coagulation sanguine. Les facteurs les plus fortement inhibés sont la thrombine et le facteur Xa, mais aussi les facteurs d'activation de contact, du système intrinsèque, et du complexe facteur VIIa/facteur tissulaire. L'activité de l'antithrombine est largement potentialisée par l'héparine et les effets anticoagulants de l'héparine dépendent de la présence de l'antithrombine.
L'antithrombine contient deux domaines fonctionnellement importants.
Le premier renferme le centre réactif qui constitue le site de clivage pour les protéinases telles que la thrombine, condition préalable pour la formation d'un complexe inhibiteur de protéinase stable. Le second est un domaine de liaison aux glycosaminoglycanes responsable de l'interaction avec l'héparine et les substances apparentées, laquelle accélère l'inhibition de la thrombine.
Les complexes antithrombine et facteurs de coagulation sont dégradés par le système réticulo-endothélial. L'activité normale de l'antithrombine est de 80 à 120% chez l'adulte. Chez les nouveau-nés, le taux d'activité est de 40 à 60%.
Pharmacocinétique
Kybernin P est appliqué par voie intraveineuse et est immédiatement disponible à une concentration plasmatique correspondant à la posologie. Il se lie à la thrombine, au facteur Xa et à d'autres facteurs activés de la coagulation.
La demi-vie biologique de l'antithrombine est de 2,5 jours, mais peut être réduite à quelques heures lors d'une consommation aiguë. Chez ces patients, il est conseillé de mesurer l'activité de l'antithrombine plusieurs fois par jour. Dans ce but, la méthode d'analyse par un substrat chromogène est appropriée. La demi-vie est également diminuée lors d'un traitement simultané à l'héparine (voir chap. «Interactions»). Kybernin P a un comportement comparable à l'inhibiteur AT III endogène en ce qui concerne la distribution et le métabolisme dans l'organisme.
Le taux de récupération in vivo était en moyenne de 65% chez 5 volontaires sains (mesuré à tmax = 1.15 heure).
Données précliniques
L'antithrombine humaine est un constituant physiologique du corps humain.
Des études de toxicité de la dose unique ne sont pas significatives et ne permettent pas déterminer la dose toxique ou létale. Des études dans le modèle animal n'ont démontré aucune toxicité aiguë.
Des études de toxicité après l'apport de doses répétées dans le modèle animal ne sont pas réalisables parce que les animaux développent des anticorps contre les protéines hétérologues (humaines).
Jusqu'à présent, l'expérience clinique n'a rapporté aucun indice d'effets de toxicité embryo-fœtale, ni d'effets oncogéniques ou mutagènes.
Remarques particulières
Incompatibilités
L'utilisation d'une solution d'hydroxyéthylamidon (HEA) comme diluant (pour perfusion) n'est pas à recommander, car on a pu observer une perte de l'activité de l'antithrombine.
Kybernin P ne doit pas être mélangé à d'autres médicaments dans la seringue ou dans le matériel de perfusion. La dopamine, la dobutamine et le furosémide ne doivent pas être administrés simultanément dans la même veine. Pour des indications sur la dissolution, voir sous «Remarques concernant la manipulation».
Stabilité
Kybernin P ne peut être utilisé au-delà de la date de péremption indiquée sur l'emballage et le récipient.
Remarques concernant le stockage
Kybernin P ne doit pas être conservé au-delà de +25 °C. Tenir à l'abri de la lumière. Ne pas surgeler! Tenir les médicaments hors de portée des enfants.
Une stabilité physico-chimique de 8 heures est justifiée après reconstitution à température ambiante (au maximum +25 °C). Du point de vue microbiologique et parce que Kybernin P ne contient aucun agent conservateur, il est impératif d'utiliser immédiatement le produit reconstitué. Ne pas le conserver au-delà de 8 heures à une température ambiante de +25 °C s'il n'est pas utilisé immédiatement.
Utiliser le contenu immédiatement après ouverture du récipient.
Remarques pour la manipulation
La substance lyophilisée doit être complètement dissoute, dans des conditions aseptiques, dans 10 ou 20 ml d'eau pour injection. On obtiendra une solution limpide à légèrement opalescente. Dans le cas de perfusion, une solution à 5% d'albumine humaine convient également comme solution de dilution du lyophilisat. Pour des dilutions jusqu'à 1:5, les solutions suivantes de perfusion peuvent être employées: une solution de lactate de Ringer, une solution physiologique de NaCl, une solution de glucose à 5% ou une solution de polygéline.
Le produit reconstitué doit être inspecté visuellement avant l'administration afin de détecter toute particule ou décoloration. La solution doit être transparente ou légèrement opalescente. Des solutions troubles ou des solutions contenant un sédiment ou des particules ne doivent pas être utilisées.
Préparation
Pour garantir la manipulation correcte du kit de transfert pour liquides stériles Transofix®, veuillez procéder comme suit:
 | 1. Après avoir retiré l'un des deux capuchons de protection, planter le perforateur mis à nu à la verticale à travers le bouchon en caoutchouc du flacon. |
 | 2. Retirer le capuchon de protection du second perforateur. |
 | 3. Enfoncer tête en bas le flacon contenant le produit sur ce même perforateur. |
 | 4. Renverser le flacon à 180°. |
 | 5. Placer le flacon contenant le produit sur une surface plane. La solution passe à présent dans le flacon qui contient le produit. |
 | 6. Retirer du flacon contenant le produit le dispositif de transfert pour liquides stériles Transofix® avec le flacon de solution. Kybernin en poudre se dissout. Kybernin reconstitué peut maintenant être prélevé dans une seringue et administré. |
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Numéro d’autorisation
46928 (Swissmedic).
Titulaire de l’autorisation
CSL Behring AG, Bern.
Mise à jour de l’information
Juillet 2017.
Отзывов (0)

Бесплатная консультация опытного специалиста
Опишите симптомы или нужный препарат – мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой на дом или просто проконсультируем.
Нас 14 специалистов и 0 ботов. Мы всегда будем с вами на связи и сможем связаться в любое время.


 Deutsch
Deutsch French
French