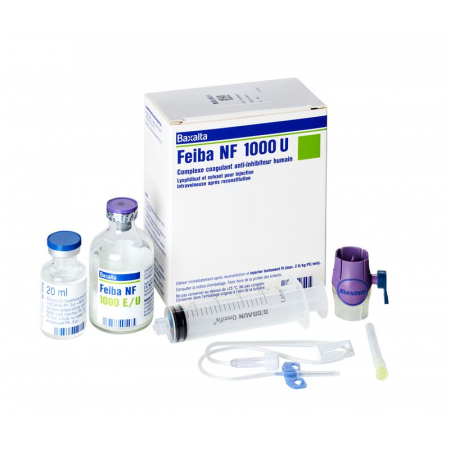
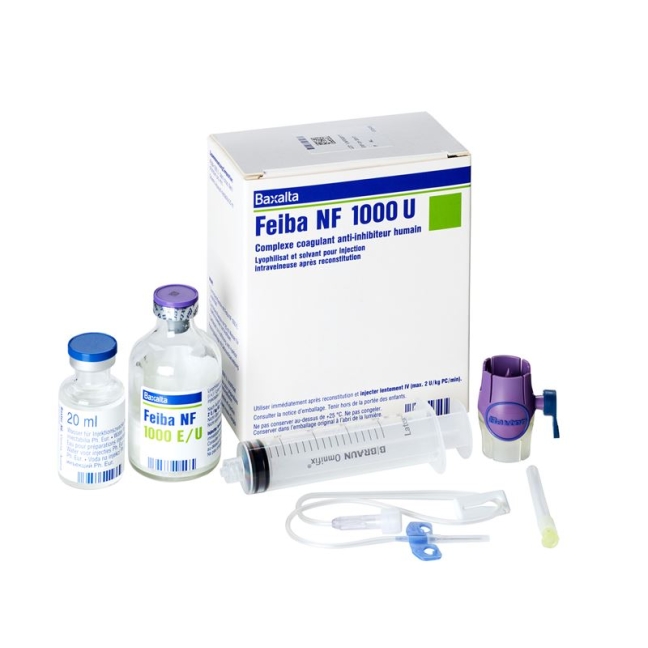
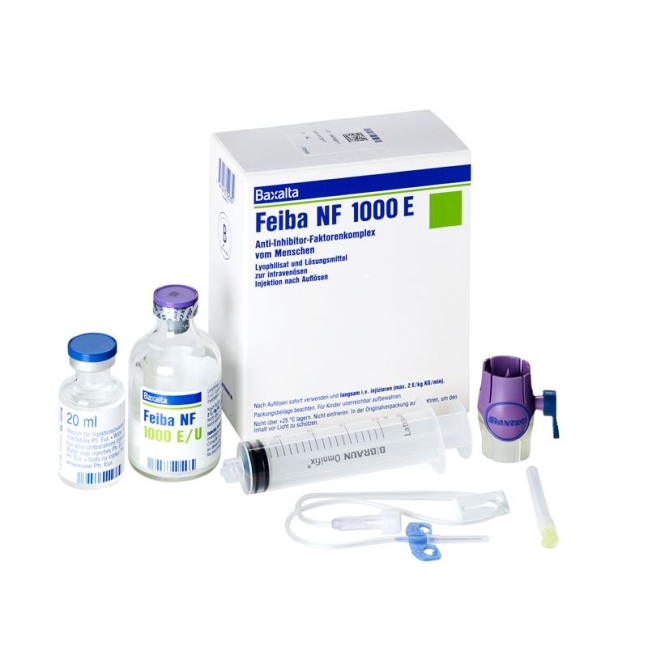
Feiba NF Trockensub 1000 E с проникновением растворителя
Feiba NF Trockensub 1000 E mit Solvens Durchstf
-
316470.22 RUB

- Наличие: Нет в наличии
- Производитель: Takeda Pharma AG
- Модель: 3755986
- ATC-код B02BD03
- EAN 7680413520352
Описание
Zusammensetzung
Wirkstoff: FEIBA (Factor Eight Inhibitor Bypassing Activity)
Hilfsstoffe: Natrii citras, Natrii chloridum
Lösungsmittel: Aqua ad iniectabilia
Galenische Form und Wirkstoffmenge pro Einheit
Lyophilisat und Lösungsmittel (Wasser für Injektionszwecke) zur intravenösen Injektion nach Auflösen.
1 Durchstechflasche Feiba NF 1000 E enthält:
1000 E* FEIBA, enthalten in 400 – 1200 mg humanem Plasma Protein.
Das Präparat wird vor der Verabreichung in 20 ml Wasser für Injektionszwecke aufgelöst; pro mg Protein sind 0,8 bis 2,5 FEIBA-Einheiten enthalten.
1 Durchstechflasche Feiba NF 2500 E enthält:
2500 E* FEIBA, enthalten in 1000 – 3000 mg humanem Plasma Protein.
Das Präparat wird vor der Verabreichung in 50 ml Wasser für Injektionszwecke aufgelöst; pro mg Protein sind 0,8 bis 2,5 FEIBA-Einheiten enthalten.
Feiba NF enthält zudem die Gerinnungsfaktoren II, IX und X in vorwiegend nicht aktivierter Form sowie aktivierten Faktor VII; Faktor VIII-Gerinnungs-Antigen (F VIII C:Ag) ist in einer Konzentration von bis zu 0,1 E/E FEIBA enthalten. Faktoren des Kallikrein-Kinin Systems sind, wenn überhaupt, nur in Spuren nachweisbar.
* 1 Einheit (E) FEIBA verkürzt die aktivierte partielle Thromboplastinzeit (aPTT) eines Faktor VIII-Inhibitorplasmas auf 50% des Pufferwertes (Leerwertes).
Indikationen/Anwendungsmöglichkeiten
Therapie und Prophylaxe von Blutungen bei Hämophilie A-Patienten mit Faktor VIII-Inhibitor,
Therapie und Prophylaxe von Blutungen bei Hämophilie B-Patienten mit Faktor IX-Inhibitor;
Bei schweren Blutungen kann Feiba NF auch zur Behandlung von nichthämophilen Patienten mit erworbenen Inhibitoren gegen die Faktoren VIII, IX oder XI eingesetzt werden.
Dosierung/Anwendung
Empfehlung zur Behandlung von Inhibitorpatienten: Die Behandlung mit Feiba NF sollte grundsätzlich nur in Zusammenarbeit mit einem Behandlungszentrum für Hämophilie durchgeführt werden.
Die Dosierung und die Therapiedauer richten sich nach dem Schweregrad der Gerinnungsstörung, Ort und Ausmass der Blutung sowie nach dem klinischen Zustand des Patienten. Die Dosierung und Frequenz der Verabreichung sollte sich immer nach der klinischen Wirksamkeit im Einzelfall ausrichten.
Als allgemeine Richtlinie wird eine Dosis von 50 – 100 E/kg Körpergewicht (KG) empfohlen. Eine Einzeldosis von 100 E/kg KG und eine Tagesdosis von 200 E/kg KG sollte jedoch nicht überschritten werden es sei denn, die Anwendung von höheren Dosen ist durch die Schwere der Blutung erforderlich und gerechtfertigt (siehe Warnhinweise und Vorsichtsmassnahmen).
Spontane Blutungen
Gelenk-, Muskel- und Weichteilblutungen:
Bei leichten bis mittelschweren Blutungen sollte eine Dosis von 50 – 75 E/kg KG alle 12 Stunden verabreicht werden. Die Behandlung sollte bis zum Eintreten einer eindeutigen Besserung der klinischen Symptome, wie Nachlassen der Schmerzen, Abnahme der Schwellung oder Mobilisierung des Gelenkes, fortgesetzt werden.
Bei schweren Muskel- und Weichteilblutungen, wie retroperitonealen Blutungen, wird eine Dosis von 100 E/kg KG alle 12 Stunden empfohlen.
Schleimhautblutungen
Es wird eine Dosis von 50 E/kg KG alle 6 Stunden unter sorgfältiger Überwachung des Patienten (Sichtkontrolle der Blutungsstelle, wiederholte Hämatokritbestimmung) empfohlen. Falls die Blutung nicht aufhört, kann die Dosis auf 100 E/kg KG erhöht werden. (Die Tageshöchstdosis von 200 E/kg KG darf nicht überschritten werden.)
Andere schwere Blutungen
Schwere Blutungen, wie ZNS-Blutungen, wurden erfolgreich mit Dosen von 100 E/kg KG alle 12 Stunden behandelt. In Einzelfällen kann eine Verkürzung der Verabreichungsintervalle auf 6 Stunden erforderlich sein, bis eine eindeutige klinische Besserung erreicht wird. Die Tageshöchstdosis von 200 E/kg KG darf dabei nicht überschritten werden.
Chirurgische Eingriffe
Bei chirurgischen Eingriffen wird – unter Berücksichtigung der Tageshöchstdosis – eine Dosis von 50 – 100 E/kg KG in bis zu 6-stündigen Abständen empfohlen.
Prophylaxe
-Prophylaxe von Blutungen bei Patienten mit hohen Inhibitortitern und häufigen Blutungen bei welchen die Immuntoleranztherapie (ITT) gescheitert ist oder nicht in Betracht gezogen wird:
Es wird eine Dosis von 70 – 100 E/kg KG alle 2 Tage empfohlen. Diese Dosis kann bis auf 100 E/kg KG täglich erhöht werden wenn die Blutungen des Patienten anhalten oder kann schrittweise vermindert werden.
-Prophylaxe von Blutungen bei Patienten mit hohen Inhibitortitern während der Immuntoleranztherapie (ITT)
Feiba NF kann gleichzeitig mit Faktor VIII Konzentraten bei Dosierungen von 50 – 100 E/kg KG zweimal täglich verabreicht werden, bis der Faktor-VIII-Inhibitor auf <2 B.E.** reduziert wurde.
**1 Bethesda-Einheit ist definiert als die Menge an Antikörpern, die 50% der FVIII-Aktivität von frischem durchschnittlichem Humanplasma nach einer zweistündigen Inkubation bei 37 °C hemmt.
Anwendung
Das Auflösen erfolgt wie im Abschnitt Auflösung des Lyophilisates beschrieben (siehe Hinweise für die Handhabung). Feiba NF muss langsam intravenös verabreicht werden. Die Verabreichungsgeschwindigkeit sollte nicht mehr als 2 E/kg KG/min betragen.
Spezielle Dosierungsanweisungen
Zur Anwendung bei Jugendlichen und Kindern liegen keine systematischen Untersuchungen vor, wohl aber zahlreiche Fallstudien. Es sei darauf hingewiesen, dass Patienten mit schwerer Hämophilie und high-responder Status typischerweise bereits ab dem Kindesalter mit aktivierten Faktorkonzentraten behandelt werden.
Wegen des komplexen Wirkmechanismus ist eine unmittelbare Überwachung der Wirkstoffe nicht möglich. Gerinnungstests wie die Vollblutgerinnungszeit (WBCT), das Thromboelastogramm (TEG, r-Wert) und die aktivierte partielle Thromboplastinzeit (aPTT) zeigen meist nur eine geringe Verkürzung und korrelieren häufig nicht mit der klinischen Wirksamkeit. Sie können daher nur in beschränktem Umfang zur Überwachung der Feiba NF-Therapie verwendet werden (siehe „Warnhinweise und Vorsichtsmassnahmen“).
Kontraindikationen
In folgenden Situationen darf Feiba NF nicht angewendet werden, falls therapeutische Alternativen zu FEIBA vorhanden sind:
-Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
-Disseminierte intravaskuläre Gerinnung (DIC)
-Myokardinfarkt, akute Thrombose und/oder Embolie
Warnhinweise und Vorsichtsmassnahmen
Warnhinweise
Thromboembolische Ereignisse
Thromboembolische Ereignisse, einschliesslich disseminierte intravaskuläre Gerinnung (DIC), Venenthrombose, Lungenembolie, Myokardinfarkt und Schlaganfall, sind im Verlauf der Behandlung mit FEIBA aufgetreten.
Einige dieser Ereignisse traten bei Dosen über 200 E/kg pro Tag oder bei Patienten mit anderen Risikofaktoren (einschliesslich DIC, fortgeschrittene atherosklerotische Erkrankung, Quetschung, Septikaemie) für thromboembolische Ereignisse auf. Gleichzeitige Behandlung mit rekombinantem Faktor VIIa kann das Risiko zur Entwickung von thromboembolischen Ereignisse erhöhen. Bei Patienten mit angeborener oder erworbener Hämophilie sollte stets in Betracht gezogen werden, dass möglicherweise solche Risikofaktoren bestehen.
In klinischen Studien traten keine Fälle thrombotischer Mikroangiopathie (TMA) mit FEIBA auf. In einer klinischen Studie mit Emicizumab, in welcher die Patienten FEIBA als Teil der Behandlung von Zwischenblutungen erhielten, wurden Fälle von TMA beobachtet (Arzneimittel-Fachinformation Emicizumab). Die Sicherheit und Wirksamkeit von FEIBA zur Behandlung von Zwischenblutungen in Patienten, welche Emicizumab erhalten, wurde nicht untersucht. Falls FEIBA in Patienten, die eine Prophylaxe mit Emicizumab erhalten, verabreicht werden muss, sind Nutzen und Risiko abzuwägen.
Wenn die Verabreichung von FEIBA als notwendig angesehen wird, ist in Patienten, welche Emicizumab erhalten eine engmaschige Überwachung durch den Arzt erforderlich.
Patienten die mehr als 100 E / kg KG erhalten, müssen bezüglich der Entwicklung von DIC und/oder akuter koronarer Ischämie überwacht werden. Wenn zur Blutstillung eingesetzt sollte das Präparat nur solang als absolut nötig verabreicht werden, um das therapeutische Ziel zu erreichen.
In den folgenden Situationen darf Feiba NF nur gegeben werden, wenn keine Reaktion auf eine Behandlung mit geeigneten Gerinnungsfaktor-Konzentraten zu erwarten ist, z.B. bei einem hohen Hemmkörper-Titer oder bei einer Blutung oder einem Blutungsrisiko mit Lebensgefahr (z.B. posttraumatisch oder postoperativ):
-Disseminierte intravaskuläre Gerinnung (DIC): Laborbefunde und/oder klinische Symptome
-Leberschädigung: Wegen der verzögerten Clearance der aktivierten Gerinnungsfaktoren besteht für Patienten mit Leberfunktionsstörungen ein erhöhtes Risiko einer DIC
-Koronare Herzkrankheit
Allergische Überempfindlichkeitsreaktionen
Wie bei allen intravenös verabreichten Plasmapräparaten können allergische Überempfindlichkeitsreaktionen auftreten. Die Patienten sollten über erste Anzeichen einer Überempfindlichkeitsreaktion wie Quaddeln, generalisierte Urtikaria, Engegefühl in der Brust, Giemen, Blutdruckabfall und anaphylaktischer Schock aufgeklärt werden. Wenn diese Symptome auftreten, sollen die Patienten aufgefordert werden, die Behandlung abzubrechen und unverzüglich ihren Arzt zu kontaktieren.
Leichtere Reaktionen können mit Antihistaminika beherrscht werden. Bei Schock muss die Behandlung den Regeln der modernen Schocktherapie folgen.
Wenn bei Patienten mit Verdacht auf Überempfindlichkeit gegen das Produkt eine Re-Exposition gegenüber Feiba NF in Betracht gezogen wird, ist eine sorgfältige Abwägung des erwarteten Nutzens einer Re-Exposition gegenüber den Risiken erforderlich. In diese Überlegungen muss die Art der bekannten oder vermuteten Überempfindlichkeit des Patienten (allergisch oder nicht-allergisch) ebenso einfliessen wie die potenziellen Massnahmen zur Behandlung und/oder Prävention sowie alternative Therapeutika.
Überwachung der Therapie
Einzeldosen von 100 E/kg KG und Tagesdosen von 200 E/kg KG sollten nicht überschritten werden. Patienten, denen Einzeldosen von 100 E/kg KG verabreicht werden, sollten hinsichtlich der Entwicklung einer Verbrauchskoagulopathie sowie auf Symptome einer akuten koronaren Ischämie überwacht werden. Hohe Dosen von Feiba NF sollten nur so lange verabreicht werden, wie dies zur Blutstillung unbedingt erforderlich ist.
Bei Auftreten von klinischen Anzeichen, wie Blutdruck- und Pulsschwankungen, Atemnot, Schmerzen im Thoraxbereich oder Husten, sollte die Verabreichung von Feiba NF sofort gestoppt sowie entsprechende diagnostische und therapeutische Massnahmen eingeleitet werden.
Auf eine Verbrauchskoagulopathie hinweisende Laborparameter sind erniedrigte Fibrinogenwerte, Thrombozytenabfall und/oder der Nachweis von Fibrin/Fibrinogen-Spaltprodukten. Andere Anzeichen einer Verbrauchskoagulopathie schliessen deutlich verlängerte Thrombinzeit, Prothrombinzeit oder aktivierte partielle Thromboplastinzeit (aPTT) ein.
Erworbene Hämophilie
Nicht-hämophile Patienten mit erworbenen Inhibitoren gegen die Faktoren VIII, IX oder XI, können gleichzeitig eine Blutungstendenz und ein erhöhtes Thromboserisiko aufweisen.
Labortests und klinische Wirksamkeit
In vitro-Gerinnungstests zur Kontrolle der Wirksamkeit wie die aktivierte partielle Thromboplastinzeit (aPTT), die Vollblutgerinnungszeit (WBCT) und das Thromboelastogramm (TEG) müssen nicht mit der klinischen Besserung korrelieren. Versuche, diese Werte durch Erhöhen der Feiba NF-Dosis zu normalisieren, können daher nicht erfolgreich sein und es wird dringend davon abgeraten aufgrund des potentiellen Risikos durch Überdosierung eine DIC zu induzieren.
Im Falle einer inadäquaten Wirkung einer Behandlung mit Feiba NF wird eine Thrombozytenzählung empfohlen, da eine ausreichende Zahl von funktionell intakten Thrombozyten für die Wirksamkeit von Feiba NF als nötig erachtet wird.
Virale Sicherheit
Feiba NF wird aus humanem Plasma hergestellt. Standardmassnahmen zur Verhinderung von Infektionen, die sich durch den Einsatz von Arzneimitteln ergeben, die aus Blut oder Blutplasma hergestellt werden, schliessen die Auswahl der Spender und das Screening der einzelnen Spenden und Plasmapools auf spezifische Infektionsmarker sowie den Einsatz effektiver Schritte zur Inaktivierung / Entfernung von Viren im Herstellungsverfahren ein. Dennoch kann bei der Verabreichung von Arzneimitteln aus menschlichem Blut oder Blutplasma die Möglichkeit der Übertragung von Krankheitserregern nicht völlig ausgeschlossen werden. Dies gilt auch für bislang unbekannte oder neu aufgetretene Viren und andere Pathogene.
Die ergriffenen Sicherheitsmassnahmen werden als wirksam gegen umhüllte Viren wie z.B. HIV, HBV und HCV sowie gegen das unbehüllte Hepatitis A Virus (HAV) betrachtet. Für nicht umhüllte Viren wie Parvovirus B19 können die getroffenen Massnahmen von eingeschränktem Wert sein.
Parvovirus B19 Infektionen können schwerwiegende Folgen für schwangere Frauen (fötale Infektion) und für Personen mit Immunmangelkrankheiten oder gesteigerter Erythropoese (z.B. hämolytische Anämie) haben.
Für Patienten, die regelmässig Präparate aus menschlichem Blut oder Plasma erhalten, wird grundsätzlich eine Impfung gegen Hepatitis A und Hepatitis B empfohlen.
Es wird empfohlen, bei jeder Verabreichung von Feiba NF an einen Patienten den Namen und die Chargennummer des Präparates zu dokumentieren, um einen Zusammenhang zwischen Patient und Produktcharge herzustellen.
Vorsichtsmassnahmen
Wegen patientenspezifischer Faktoren können die Reaktionen auf ein Bypassing-Präparat unterschiedlich ausfallen. Patienten, die in einer Blutungssituation keine ausreichende Reaktion auf ein bestimmtes Präparat zeigen, können eventuell auf ein anderes Präparat ansprechen. Spricht ein Patient nicht ausreichend auf ein Bypassing-Präparat an, sollte ein anderes Präparat in Betracht gezogen werden.
Die Gabe von Feiba NF an Hemmkörper-Patienten kann zu einem vorübergehenden anamnestischen Anstieg des Hemmkörper-Titers führen. Im Verlauf der fortgesetzten Feiba NF-Gabe kann der Hemmkörper-Titer wieder sinken. Die klinischen und publizierten Daten lassen darauf schliessen, dass die Wirksamkeit von Feiba NF dadurch nicht beeinträchtigt wird.
Beeinflussung von Labortests
Feiba enthält Blutgruppen Isohämagglutinine (Anti-A und Anti-B). Passiv übertragene Antikörper gegen Erythrozytenantigene (z.B. A, B, D) können einige serologische Tests für Erythrozytenantikörper, wie zum Beispiel den Antihumanglobulin Test (Coombs Test), stören.
Feiba NF 1000 E enthält etwa 80 mg Natrium (berechnet) per Durchstechflasche. Feiba NF 2500 E enthält etwa 200 mg Natrium (berechnet) per Durchstechflasche. Dies muss bei Patienten mit einer niedrigen Natriumdiät berücksichtigt werden.
Interaktionen
Es wurden keine hinreichenden und gut-kontrollierten Studien mit kombinierter oder sequenzieller Anwendung von FEIBA und rekombinantem Faktor VIIa (rFVIIa), Antifibrinolitika oder Emicizumab durchgeführt.
Antifibrinolytika wie Tranexamsäure oder ε-Aminocapronsäure sollten nicht gleichzeitig mit Feiba NF angewendet werden.
Ist eine Behandlung mit Antifibrinolytika und Feiba NF dennoch indiziert, sollten zwischen der Verabreichung beider Präparate mindesten 6 Stunden liegen.
Im Fall einer gleichzeitigen Verabreichung von rFVIIa, kann gemäss verfügbaren in-vitro Daten und klinischen Beobachtungen eine poteintielle medikamentöse Interaktion auftreten (potentiell resultierend in einer Nebenwirkung wie einem thromboembolischen Ereignis).
Erfahrungen aus einer klinischen Studie mit Emicizumab weisen auf eine potenzielle Arzneimittelinteraktion mit Emicizumab hin, wenn FEIBA als Teil der Behandlung von Zwischenblutungen eingesetzt worden ist (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Schwangerschaft/Stillzeit
Es liegen keine klinischen Daten zur Sicherheit von Feiba NF bei Schwangeren und während der Stillzeit vor. Tierexperimentelle Studien sind nicht geeignet um die Sicherheit in Bezug auf Schwangerschaft, Embryonalentwicklung, Entwicklung des Föten und/oder die postnatale Entwicklung abzuklären. Daher wurden keine Reproduktionsstudien am Tier mit FEIBA durchgeführt.
Das potentielle Risiko für Menschen ist nicht bekannt.
Während der Schwangerschaft und der postpartalen Phase besteht ein erhöhtes Thromboserisiko, und einige Komplikationen der Schwangerschaft sind mit einem erhöhten DIC-Risiko verbunden.
Der Arzt muss vor Verordnung von Feiba NF die möglichen Risiken und Vorteile für die jeweilige Patientin sorgfältig gegeneinander abwägen.
Bezüglich einer Parvovirus B19 Infektion, siehe unter „Warnhinweise und Vorsichtsmassnahmen“
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es gibt keinen Hinweis darauf, dass Feiba NF einen Einfluss auf die Verkehrstüchtigkeit oder die Fähigkeit, Maschinen zu bedienen haben könnte.
Unerwünschte Wirkungen
FEIBA kann allergische Überempfindlichkeitsreaktionen hervorrufen, welche Urtikaria, Angiooedem, gastrointestinale Erscheinungen, Bronchspasmus und einen Abfall des Blutdruckes einschliessen. Diese Reaktionen können schwerwiegend und systemisch (z.B. Anaphylaxis mit Urtikaria und Angiooedem, Bronchospasmus, Kreislaufschock) sein. Über andere Reaktionen auf die Infusion, wie Schüttelfrost, Fieber und Hypertonie wurde ebenfalls berichtet.
Die Nebenwirkungen welche in dieser Rubrik aufgeführt sind, wurden im Rahmen der Spontanmeldungen nach der Zulassung (Pharmacovigilance) und von 2 klinischen Studien mit FEIBA zur Behandlung von Blutungen in mindestens 9 pediatrischen und 55 erwachsenen Patienten mit Hemophilie A oder B und Faktor VIII- oder Faktor IX-Inhibitoren berichtet. Eine Studie schloss auch Patienten mit erworbener Hemophilie und Faktor VIII Inhibitoren ein (2 von 49 Patienten). Die Nebenwirkungen einer dritten Studie welche Prophylaxe mit einer «on-demand» Behandlung in 9 pediatrischen und 27 erwachsenen Patienten verglich, wurden hier aufgenommen.
Ihre Häufigkeit wurde unter Verwendung folgender Kriterien bestimmt: sehr häufig (≥10%), häufig (≥1%, <10%), gelegentlich (≥0,1%, <1%), selten (≥0,01%, <0,1%) und sehr selten (<0,01%)
Erkrankungen des Blutes und des Lymphsystems
Häufig: Anstieg des Hemmkörper-Titers (anamnestische Reaktion)*
* Unter einem Anstieg des Hemmkörper-Titers (anamnestische Reaktion) [keine von MedDRA bevorzugte Bezeichnung] versteht man den Anstieg eines vorbestehenden Hemmkörper-Titers im Anschluss an die Gabe von FEIBA. Siehe Warnhinweise und Vorsichtsmassnahmen.
Einzelfälle: Disseminierte intravaskuläre Gerinnung (DIC)
Erkrankungen des Immunsystems
Häufig: Überempfindlichkeitsreaktionen
Einzelfälle: Urtikaria, anaphylaktische Reaktion
Erkrankungen des Nervensystems
Häufig: Kopfschmerz, Schwindelgefühl, Somnolenz, Geschmackstörung
Einzelfälle: Taubheitsgefühl in Gesicht und Extremitäten (Hypoästhesie), Parästhesie,
thrombotischer Schlaganfall, embolischer Schlaganfall
Herzerkrankungen
Einzelfälle: Myokardinfarkt, Tachykardie
Gefässerkrankungen
Häufig: Hypotonie
Einzelfälle: Thrombose, Venenthrombose, Arterienthrombose, Hypertonie, Hitzegefühl
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Dyspnoe
Einzelfälle: Lungenembolie, Bronchospasmus, Giemen, Husten
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit
Einzelfälle: Erbrechen, Diarrhoe, abdominale Beschwerden
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Ausschlag
Einzelfälle: Gesichtshypaesthesie, Angiooedem, Urtikaria, Pruritus
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Schüttelfrost, Fieber, Brustkorbschmerz, Brustkorbbeschwerden
Einzelfälle: Schmerzen an der Injektionsstelle, Unwohlsein, Wärmegefühl
Untersuchungen
Häufig: Hepatitis-Oberflächen-Antikörper positiv
Einzelfälle: Blutdruck erniedrigt
Klasseneffekte
Häufigkeit nicht bekannt: Andere Symptome von Überempfindlichkeitsreaktionen auf plasmatische Präparate schliessen Lethargie und Unruhe ein.
Für Informationen zur Virussicherheit siehe Warnhinweise und Vorsichtsmassnahmen.
Überdosierung
Einige der gemeldeten thromboembolischen Ereignisse traten bei Dosen über 200 E/kg auf. Bei Anzeichen oder Symptomen eines thromboembolischen Ereignisses müssen sofort die Infusion abgebrochen und entsprechende diagnostische und therapeutische Massnahmen eingeleitet werden (siehe Warnhinweise und Vorsichtsmassnahmen).
Eigenschaften/Wirkungen
ATC-Code: B02BD03
Obwohl Feiba NF in den frühen 1970er Jahren entwickelt und seine Faktor VIII-Inhibitor-Bypass-Aktivität in vitro und in vivo nachgewiesen wurde, sind seine Wirkkomponenten immer noch Thema wissenschaftlicher Debatten. Eine vor kurzem erschienene wissenschaftliche Arbeit zeigt jedoch, dass spezifische Komponenten des aktivierten Prothrombinkomplexes, das Zymogen Prothrombin (Faktor II) und der aktivierte Faktor X (Faktor Xa), im Wirkungsmechanismus von Feiba NF eine Rolle spielen.
In einem Fall wurde Feiba NF erfolgreich bei einem Patienten mit einem Inhibitor eingesetzt, der an von Willebrand-Jürgens-Syndrom litt.
Feiba NF wurde auch in Kombination mit Faktor VIII-Konzentrat zur Langzeittherapie angewendet, mit dem Ziel eine komplette und permanente Elimination des Faktor VIII-Inhibitors zu erreichen, um eine reguläre Behandlung mit FVIII-Konzentrat zu ermöglichen, wie bei Patienten ohne Inhibitor.
Pharmakokinetik
Da die Wirkkomponenten immer noch diskutiert werden, ist eine definitive Aussage zu den pharmakokinetischen Eigenschaften von Feiba NF nicht möglich.
Präklinische Daten
Aufgrund akuter Toxizitätsstudien bei Faktor VIII knock-out Mäusen, normalen Mäusen und Ratten mit Dosen, die die Tageshöchstdosis für den Menschen überschreiten (d.h. >200 E/kg KG), kann der Schluss gezogen werden, dass die unerwünschten Wirkungen in Zusammenhang mit Feiba NF primär die Folge einer Hyperkoagulation sind, die durch die pharmakologischen Eigenschaften des Präparates hervorgerufen wird.
Toxizitätsstudien bei Tieren mit mehrmaliger Verabreichung sind wegen der Interferenz mit sich entwickelnden Antikörpern gegen heterologes Protein nicht durchführbar.
Da es keinen Hinweis auf tumorigene und mutagene Wirkungen von humanen Plasmaproteinen gibt, wurden experimentelle Untersuchungen, insbesondere bei heterologen Spezies, nicht als notwendig angesehen.
Sonstige Hinweise
Inkompatibilitäten
Um die Wirksamkeit und Verträglichkeit dieses Präparates nicht zu beeinträchtigen, darf Feiba NF, wie alle anderen Faktorkonzentrate, vor der Verabreichung nicht mit anderen Arzneimitteln gemischt bzw. mit Infusionslösungen verdünnt werden. Gegebenenfalls empfiehlt es sich, einen gemeinsamen venösen Zugang vor und nach der Anwendung von Feiba NF mit physiologischer Kochsalzlösung zu spülen.
Gerinnungsfaktoren aus Humanplasma können von den inneren Oberflächen bestimmter Arten von Injektions-/Infusionssets adsorbiert werden. In diesem Fall könnte es zu einem Versagen der Therapie kommen. Aus diesem Grund dürfen für Feiba NF nur zugelassene Infusionssets aus Kunststoff verwendet werden.
Beeinflussung diagnostischer Verfahren
Nach der Verabreichung hoher Dosen von Feiba NF, kann ein vorübergehender Anstieg von passiv übertragbarer Hepatitis B Oberflächenantikörper zu einer irreführenden Interpretation von positiven Resultaten in serologischen Tests führen.
Haltbarkeit
Das Medikament darf nur bis zu dem auf dem Behälter mit «Exp» bezeichneten Datum verwendet werden.
Für das rekonstituierte Feiba NF wurde eine chemische und physikalische Stabilität von 3 Stunden bei 20 – 25 °C nachgewiesen. Aus mikrobiologischen Gründen sollte das Präparat sofort nach der Rekonstitution verwendet werden.
Rekonstituierte Lösungen nicht im Kühlschrank lagern und nicht einfrieren.
Besondere Lagerungshinweise
Nicht über +25 °C lagern. Nicht einfrieren.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Arzneimittel für Kinder unerreichbar aufbewahren.
Hinweise für die Handhabung
Feiba NF erst unmittelbar vor der Verabreichung auflösen. Danach ist die Lösung sofort zu verwenden (die Lösung enthält kein Konservierungsmittel). Lösungen, die trübe sind oder einen Niederschlag aufweisen, dürfen nicht verwendet werden.
Vorsichtig schwenken, bis das gesamte Pulver gelöst ist. Sicherstellen, dass Feiba NF vollständig gelöst ist, da sonst ein Teil des FEIBA-Wirkstoffs im Filter des Transfersystems zurückgehalten wird.
Die Lösung vor der Anwendung auf sichtbare Partikel und Verfärbung prüfen. Lösungen, die trüb sind oder Ablagerungen aufweisen, nicht verwenden.
Nicht verwenden wenn das Transfersystem, die Transfernadel, deren steriles Barrieresystem oder deren Verpackung beschädigt ist. Nicht verwendete Lösung sowie Abfallmaterial sachgemäss entsorgen.
Der Gerätesatz kann entweder BAXJECT II Hi-Flow oder eine doppelseitige Kanüle und einen Filterdorn enthalten.
Für das Auflösen und Verabreichen mit BAXJECT II Hi-Flow siehe unter «Variante A».
Für das Auflösen und Verabreichen mit doppelseitiger Kanüle und Filterdorn siehe unten unter «Variante B».
Variante A (wenn das Produkt mit BAXJECT II Hi-Flow geliefert wird)
Auflösung des Lyophilisates:
1.Falls erforderlich, ungeöffnete Durchstechflasche mit Lösungsmittel (Wasser für Injektionszwecke) auf Raumtemperatur (15 °C – 25 °C) erwärmen, z.B. durch Benützung eines Wasserbades während einiger Minuten (max. 37 °C).
2.Schutzkappen von Lyophilisat- und Lösungsmittel-Durchstechflaschen entfernen und die Gummistopfen beider Flaschen desinfizieren. Beide Durchstechflaschen auf eine flache Unterlage stellen.
3.Die Verpackung des BAXJECTs II Hi-Flow öffnen, indem die Schutzfolie abgezogen wird, ohne dabei den Packungsinhalt zu berühren (Fig. a). Das Transfersystem nicht aus der Verpackung nehmen.
4.Die Packung nach unten drehen und den klaren Plastikdorn durch den Gummistopfen des Lösungsmittelfläschchens drücken (Fig. b). Nun die Verpackung vom BAXJECT II Hi-Flow durch Ergreifen der Verpackung an den Ecken abnehmen (Fig. c). Die blaue Schutzkappe nicht vom BAXJECT II Hi-Flow entfernen.
5.Das System, bestehend aus dem BAXJECT II Hi-Flow und dem Lösungsmittelfläschchen, nun wenden, so dass sich das Lösungsmittelfläschchen oben befindet. Den anderen, violetten Dorn des BAXJECTs II Hi-Flow durch den Gummistopfen des Feiba NF-Fläschchens drücken. Durch das Vakuum wird das Lösungsmittel in das Feiba NF-Fläschchen gezogen (Fig. d).
6.Vorsichtiges schwenken (nicht schütteln) des ganzen Systems bis Feiba NF gelöst ist. Vergewissern, dass Feiba NF vollständig gelöst ist, da sonst wirksame Substanz durch den Filter im BAXJECT II Hi-Flow zurückgehalten wird.
Verabreichung:
1.Die blaue Schutzkappe des BAXJECTs II Hi-Flow entfernen. Die Spritze fest an den BAXJECT II Hi-Flow anschliessen (KEINE LUFT IN DIE SPRITZE AUFZIEHEN) (Fig. e). Der Gebrauch einer Luer-Lock Spritze wird sehr empfohlen, um eine feste Verbindung zwischen der Spritze und dem BAXJECT II Hi-Flow zu gewährleisten (bei der Befestigung, Spritze im Uhrzeigersinn drehen bis zur Stopp Position).
2.Das System umdrehen, so dass das aufgelöste Feiba NF-Fläschchen oben ist). Die Feiba NF-Lösung durch langsames Zurückziehen des Kolbens in die Spritze aufziehen und sicherstellen, dass die feste Verbindung zwischen dem Baxject II Hi-Flow und der Spritze während dem ganzen Prozess aufrechterhalten wird. (Fig. f).
3.Die Spritze entfernen.
4.Falls ein Schäumen des Produktes erfolgt, soll solange gewartet werden, bis der Schaum zusammengefallen ist. Mit einem Flügel-Injektionssystem die Lösung mit dem beigepackten Infusionsset (oder einer Einmalnadel) langsam intravenös injizieren
Eine Verabreichungsgeschwindigkeit von 2 E Feiba NF / kg KG / min darf nicht überschritten werden.
Figure a | Figure b | Figure c |
|
|
|
Figure d | Figure e | Figure f |
|
|
|
Variante B (wenn das Produkt mit Filter-, Transfer- und Belüftungsnadel geliefert wird anstelle des BAXJECT II Hi-Flow)
Auflösen des Lyophilisates:
1.Falls erforderlich, ungeöffnete Durchstechflasche mit Lösungsmittel (Wasser für Injektionszwecke) auf Raumtemperatur (max. 37 °C) erwärmen.
2.Schutzkappen von Lyophilisat- und Lösungsmittel-Durchstechflaschen entfernen (Abb. A) und die Gummistopfen beider Flaschen desinfizieren.
3.Schutzkappe von einem Ende der beigepackten Transfernadel durch Drehen und Ziehen entfernen und mit der Nadel in den Gummistopfen der Lösungsmittel-Durchstechflasche einstechen (Abb. B und C).
4.Schutzkappe vom anderen Ende der Transfernadel entfernen. Freies Nadelende nicht berühren!
5.Lösungsmittel-Durchstechflasche umdrehen und mit der aufgesetzten Transfernadel durch das Zentrum des Gummistopfens der Lyophilisat-Durchstechflasche einstechen (Abb. D). Durch das Vakuum in der Lyophilisat-Durchstechflasche wird das Lösungsmittel angesaugt.
6.Lösungsmittel-Durchstechflasche samt Transfernadel von der Lyophilisat-Durchstechflasche abziehen (Abb. E). Lösungsvorgang durch leichtes Schwenken der Lyophilisat-Durchstechflasche beschleunigen.
7.Nach vollständiger Auflösung des Lyophilisats die beigepackte Belüftungsnadel einstechen (Abb. F), wodurch eventuell entstandener Schaum zusammenfällt. Belüftungsnadel entfernen.
Verabreichung:
1.Ein Ende der Schutzkappe der beigepackten Filternadel durch Drehen und Ziehen entfernen, die Nadel auf die sterile Einmalspritze setzen und die Lösung in die Spritze aufziehen (Abb. G).
2.Spritze von der Filternadel trennen und die Lösung mit dem beigepackten Infusionsset bzw. Einmalnadel langsam intravenös injizieren.
Eine Verabreichungsgeschwindigkeit von 2 E Feiba NF/ kg KG / min darf nicht überschritten werden.

Falls andere Geräte verwendet werden als solche, die mit Feiba NF mitgeliefert werden, soll eine Porengrösse von mindestens 149 μm gewährleistet werden.
Zulassungsnummer
41352 (Swissmedic)
Zulassungsinhaberin
Takeda Pharma AG, 8152 Opfikon
Stand der Information
April 2019
Composition
Principe actif: FEIBA (Factor Eight Inhibitor Bypassing Activity)
Adjuvants: Natrii citras, Natrii chloridum
Solvant: Aqua ad iniectabilia
Forme galénique et quantité de principe actif par unité
Lyophilisat et solvant (eau pour injection) pour injection intraveineuse après dissolution
1 flacon à percer Feiba NF 1000 U contient:
1000 U* de FEIBA, contenues dans 400 – 1200 mg de protéine plasmatique humaine.
La préparation est dissoute avant administration, dans 20 ml d'eau pour injection; elle contient 0,8 à 2,5 d'unités de FEIBA par mg de protéine.
1 flacon à percer Feiba NF 2500 U contient:
2500 U* de FEIBA, contenues dans 1000 – 3000 mg de protéine plasmatique humaine.
La préparation est dissoute avant administration, dans 50 ml d'eau pour injection; elle contient 0,8 à 2,5 d'unités de FEIBA par mg de protéine.
Feiba NF contient en outre les facteurs de coagulation II, IX et X, principalement sous forme non activée, et le facteur VII activé; l'antigène du facteur VIII de coagulation (F VIII C:Ag) est contenu en une concentration allant jusqu'à 0,1 U/U FEIBA. Les facteurs du système kallicréine-kinine ne sont éventuellement présents qu'à l'état de traces.
* 1 unité (U) FEIBA réduit le temps partiel de thromboplastine activée (aPTT) d'un plasma inhibiteur du facteur VIII de 50% de la valeur tampon (valeur à vide).
Indications/Possibilités d’emploi
Traitement et prévention des hémorragies chez les patients atteints d'hémophilie A avec inhibiteur du facteur VIII,
Traitement et prévention des hémorragies chez les patients atteints d'hémophilie B avec inhibiteur du facteur IX;
En cas d'hémorragies sévères, Feiba NF peut également être utilisé pour le traitement de patients non hémophiles présentant des inhibiteurs acquis contre les facteurs VIII, IX ou XI.
Posologie/Mode d’emploi
Recommandations pour le traitement des patients porteurs d'un inhibiteur: par principe, le traitement par Feiba NF ne doit être entrepris qu'en collaboration avec un centre de traitement d'hémophilie.
La posologie et la durée du traitement sont fonction de la sévérité du trouble de la coagulation, du site et de l'ampleur de l'hémorragie et de l'état clinique du patient. La posologie et la fréquence d'administration doivent toujours s'orienter au cas par cas en fonction de l'efficacité clinique.
En règle générale, on recommande une dose de 50 à 100 U/kg poids corporel (PC). On ne dépassera cependant pas la dose individuelle de 100 U/kg PC et la dose journalière de 200 U/kg PC, sauf si la gravité des saignements nécessite et justifie l'utilisation de doses plus importantes (voir Mises en garde et précautions).
Hémorragies spontanées
Hémorragies articulaires, musculaires et des parties molles:
Lors d'hémorragies légères à moyennes, il convient d'administrer une dose de 50 à 75 U/kg PC toutes les 12 heures. Le traitement doit être poursuivi jusqu'à ce qu'une nette amélioration des symptômes cliniques soit observée, telle qu'une diminution de la douleur, une réduction des gonflements ou une mobilisation de l'articulation.
En cas de hémorragies musculaires ou des parties molles graves telles que les hémorragies rétro-péritonéales, une dose de 100 U/kg PC est recommandée toutes les 12 heures.
Hémorragies des muqueuses
Une dose de 50 U/kg PC toutes les 6 heures est recommandée sous surveillance stricte du patient (contrôle visuel du site hémorragique, déterminations répétées de l'hématocrite). Si l'hémorragie ne cesse pas, la dose peut être portée à 100 U/kg PC (sans dépasser la dose maximale journalière de 200 U/kg PC).
Autres hémorragies graves
Les hémorragies graves telles que les hémorragies du SNC ont été traitées avec succès par des doses de 100 U/kg PC toutes les 12 heures. Dans des cas particuliers, une réduction des intervalles d'administration à 6 heures peut s'avérer nécessaire jusqu'à obtention d'une amélioration clinique nette. La dose journalière maximale de 200 U/kg PC ne doit toutefois pas être dépassée.
Interventions chirurgicales
Lors d'interventions chirurgicales, on recommande l'administration de 50 à 100 U/kg PC à des intervalles minimaux de 6 heures, sous réserve de la dose maximale journalière autorisée.
Prophylaxie
-Prophylaxie des hémorragies chez les patients présentant un titre élevé d'inhibiteur et des saignements fréquents chez qui une induction de tolérance immune a échouée ou n'est pas envisagée: Une dose de 70 – 100 U/kg de poids corporel tous les deux jours est recommandée. Cette dose peut être augmentée jusqu'à 100 U/kg de poids corporel par jour si le patient continue à saigner, ou peut être progressivement diminuée.
-Prophylaxie des hémorragies chez les patients présentant un titre élevé d'inhibiteur en cours d'induction de tolérance immune:
Feiba NF peut être administré simultanément au concentré de facteur VIII, à des doses de 50 - 100 U/kg de poids corporel, deux fois par jour jusqu'à ce que l'inhibiteur du facteur VIII soit réduit à <2 U.B.**
**1 Unité Bethesda est définie comme la quantité d'inhibiteur capable de neutraliser 50% de l'activité du facteur VIII du plasma humain après incubation de 2 h à 37 °C.
Mode d'administration
La dissolution est décrite au paragraphe Mise en solution du lyophilisat (voir Remarques de manipulation). Feiba NF doit être injecté lentement par voie intraveineuse. La vitesse d'administration ne devrait pas dépasser 2 U/kg PC/min.
Instructions spéciales pour la posologie
On ne dispose pas d'analyses systématiques concernant l'utilisation chez l'adolescent et l'enfant mais de nombreuses études de cas existent. Il convient de noter que les patients souffrant d'hémophilie sévère et présentant un statut hautement répondeur sont habituellement déjà traités dès l'enfance par des concentrés de facteur activé.
Vu la complexité du mécanisme d'action, aucune surveillance directe des ingrédients actifs n'est disponible. Des tests de la coagulation tels que le temps de coagulation du sang complet (WBCT), le thrombo-élastogramme (TEG, valeur r) et le temps de thromboplastine partielle activée (aPTT) ne mettent la plupart du temps en évidence qu'un faible raccourcissement et ne correspondent souvent pas à l'efficacité clinique. Par conséquent, ils ne peuvent être utilisés que dans une certaine limite dans le cadre de la surveillance du traitement par Feiba NF (voir Mises en garde et précautions).
Contre-indications
Feiba NF ne doit pas être utilisé dans les situations suivantes, si des thérapies alternatives à FEIBA existent:
-Hypersensibilité au principe actif ou à l'un des composants conformément à la composition
-Coagulation intravasculaire disséminée (CIVD)
-Infarctus du myocarde, thrombose aiguë et/ou embolie
Mises en garde et précautions
Mises en garde
Incidents thromboemboliques
Incidents - thromboemboliques, y compris la coagulation intravasculaire disséminée (CIVD), la thrombose veineuse, l'embolie pulmonaire, l'infarctus du myocarde et l'accident vasculaire cérébral ayant eu lieu pendant le traitement avec FEIBA.
Certains de ces incidents apparaissent à des doses supérieures à 200 U/kg/jour ou chez des patients présentant d'autres facteurs de risque pour des incidents thromboemboliques (y compris CIVD, athérosclérose à un stade avancé, blessure par écrasement, septicémie). Un traitement en association avec un facteur VIIa recombinant peut augmenter le risque de survenue d'événements thromboemboliques. La présence éventuelle de tels facteurs de risque doit toujours être prise en considération chez les patients atteints d'hémophilie congénitale ou acquise.
Aucun cas de microangiopathie thrombotique (MAT) n'a été rapporté dans les études cliniques avec FEIBA. Des cas de MAT ont néanmoins été rapportés dans un essai clinique avec l'emicizumab dans lequel les sujets ont reçu une administration concomitante de FEIBA pour le traitement de saignements intercurrents (information professionnelle de l'emicizumab). La sécurité et l'efficacité de FEIBA n'ont pas été établies pour les saignements intercurrents des patients traités par l'emicizumab. Les bénéfices et les risques doivent être évalués si FEIBA doit être utilisé chez un patient recevant de l'emicizumab en prophylaxie.
Si un traitement avec FEIBA est considéré comme nécessaire pour des patients recevant également de l'emicizumab, ceux-ci devront être étroitement suivis par le médecin.
Les patients ayant reçu plus de 100 U/kg PC doivent être surveillés concernant le développement d'une CIVD et/ou une ischémie coronarienne aiguë. Si utilisé pour l'hémostase, le produit devrait être administré seulement aussi longtemps qu'il est absolument nécessaire d'atteindre le but thérapeutique.
Dans les situations suivantes, Feiba NF ne devrait être administré que dans les cas où un traitement par le concentré de facteur de la coagulation correspondant risque d'échouer par exemple en cas d'un titre élevé de l'inhibiteur ou un saignement ou en cas de risque de saignements qui met en jeu le pronostic vital (p.ex. post-traumatique ou postopératoire):
-la coagulation intravasculaire disséminée (CIVD): résultats sérologiques et/ou symptômes cliniques
-Hépatopathie: En raison de la clairance retardée des facteurs de la coagulation activés, le risque de développement de CIVD chez des patients présentant une insuffisance hépatique est accru
-Cardiopathies coronariennes
Hypersensibilité de type allergique
Comme avec tout produit intraveineux de plasma, des réactions d'hypersensibilité de type allergique peuvent apparaître. Les patients doivent être informés des signes précoces des réactions d'hypersensibilité tels éruptions urticariennes, urticaire généralisée, oppression thoracique, sibilances, hypotension et choc anaphylactique. Si ces symptômes surviennent, il faut conseiller aux patients d'arrêter l'utilisation du produit et de contacter immédiatement leur médecin.
Des réactions plus légères peuvent être maîtrisées par l'utilisation d'anti-histaminiques. En cas d'état de choc, le traitement doit suivre les règles de traitement modernes de l'état de choc.
Lorsqu'une réexposition de patients avec une hypersensibilité supposée au produit est prise en considération, l'avantage attendu et le risque de réexposition doivent être soigneusement sous-pesés en tenant compte du type d'hypersensibilité connue ou supposée du patient (allergique ou non-allergique), y compris une éventuelle thérapie corrective et/ou prophylactique ou des agents thérapeutiques alternatifs.
Surveillance de la thérapie
Ne pas dépasser 100 U/kg PC en dose individuelle et 200 U/kg PC par jour. Les patients ayant reçu une dose individuelle de 100 U/kg PC doivent faire l'objet d'une surveillance relative au développement d'une coagulopathie de consommation et aux symptômes d'une ischémie coronarienne aiguë. Des doses élevées de Feiba NF ne doivent être administrées que dans la mesure où leur administration est impérative jusqu'à l'hémostase.
En cas de survenue de signes cliniques tels que variations de la tension artérielle et du pouls irrégulier, dyspnée, douleurs thoraciques ou toux, arrêter immédiatement l'administration de Feiba NF et prendre des mesures diagnostiques et thérapeutiques spécifiques.
Les paramètres biologiques indiquant une coagulopathie de consommation se traduisent par une diminution du taux de fibrinogène, une thrombopénie et/ou la présence de produits de dégradation de la fibrine et/ou du fibrinogène. Les autres signes révélateurs d'une coagulopathie de consommation sont des temps de thrombine, de prothrombine et de thromboplastine partielle activée (aPTT) significativement allongés.
Hémophilie acquise
Les patients non hémophiles présentant des inhibiteurs acquis contre les facteurs VIII, IX ou XI, peuvent présenter en même temps une tendance hémorragique et un risque de thrombose accrus.
Tests sérologiques et efficacité clinique
Les tests de coagulation réalisés in vitro pour le contrôle de l'efficacité ainsi que le temps de thromboplastine partielle activée (aPTT), le temps de coagulation du sang complet (WBCT) et le thrombo-élastogramme (TEG) ne correspondent pas forcément à l'amélioration clinique. Des tentatives visant à normaliser ces valeurs en augmentant la dose de Feiba NF peuvent échouer et sont expressément déconseillées en raison du risque potentiel d'induction d'une CID par surdosage.
En cas d'effet inadéquat d'un traitement par Feiba NF, une numération plaquettaire est recommandée car un nombre suffisant de thrombocytes fonctionnels intacts est considéré comme nécessaire pour établir l'efficacité de Feiba NF.
Sécurité virale
Feiba NF est produit à partir de plasma humain. Les mesures habituelles de prévention du risque de transmission d'agents infectieux par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection des donneurs, la recherche de marqueurs spécifiques d'infection sur chaque don et sur les pools de plasma et l'inclusion dans le procédé de fabrication d'étapes efficaces pour l'inactivation/élimination virale. Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d'agents infectieux ne peut pas être totalement exclu. Ceci s'applique également aux virus inconnus ou émergents ou autres types d'agents infectieux.
Les mesures de sécurité prises sont considérées comme efficaces contre les virus enveloppés tels que VIH, VHB et VHC ainsi que contre le virus non enveloppé de l'hépatite A (VHA).
Les mesures prises peuvent être d'efficacité limitée vis-à-vis des virus non enveloppés tels que parvovirus B19.
L'infection par le parvovirus B19 peut être grave chez les femmes enceintes (infection foetale) et chez les sujets immunodéprimés ou présentant une augmentation de la production de globules rouges (par ex. anémie hémolytique).
Pour les patients qui reçoivent régulièrement des préparations dérivées de sang ou de plasmas humains, une vaccination contre l'hépatite A et l'hépatite B est recommandée par principe.
Lors de chaque administration de Feiba NF à un patient, il est recommandé de documenter le nom et le numéro de lot de la préparation pour pouvoir établir un rapport entre le patient et le lot du produit.
Précautions
Vu les facteurs spécifiques de chaque patient, la réaction à un agent bypassant peut varier. Ainsi en cas d'hémorragies, les patients rencontrant une réaction insuffisante à un agent peuvent réagir éventuellement à un autre agent. En cas de réaction insuffisante à un agent bypassant, l'utilisation d'un autre agent doit être prise en considération.
L'administration de Feiba NF à des patients porteurs d'inhibiteurs peut entraîner une augmentation anamnestique initiale du titre d'inhibiteurs. Si Feiba NF continue à être administré, le titre d'inhibiteurs devrait diminuer avec le temps. Des données cliniques et publiées suggèrent que l'efficacité de Feiba NF n'est pas réduite.
Interférence avec les tests de laboratoire
FEIBA contient des iso-hémagglutinines (anti-A et anti-B). Une transmission passive d'anticorps aux antigènes érythrocytaires, par exemple A, B, D peut interférer avec des tests sérologiques pour les anticorps érythrocytaires, tels que le test à l'antiglobuline (ou test de Coombs).
Feiba NF 1000 U contient env. 80 mg de sodium (calculé) par flacon à percer. Feiba NF 2500 U contient env. 200 mg de sodium (calculé) par flacon à percer. En tenir compte en cas de régime hyposodé.
Interactions
Aucune étude suffisante ou bien-contrôlée n'a été menée sur l'utilisation de FEIBA en association ou consécutive à un facteur VIIa recombinant (rFVIIa), à des antifibrinolytiques ou à emicizumab.
Ne pas utiliser de manière concomitante les anti-fibrinolytiques tels que l'acide tranexamique ou l'acide ε-aminocapronique avec Feiba NF.
Si un traitement par anti-fibrinolytique et Feiba NF est malgré tout indiqué, il convient de respecter un intervalle au moins de 6 heures entre l'administration des deux préparations.
En association avec un facteur VIIa recombinant, selon les données in vitro et observations cliniques disponibles, une interaction médicamenteuse peut survenir (entraînant potentiellement des effets indésirables tel qu'un événement thromboembolique).
L'expérience d'un essai clinique avec l'emicizumab suggère qu'une interaction médicamenteuse potentielle pourrait exister avec l'emicizumab lorsque Feiba a été utilisé de façon concomitante pour le traitement de saignements intercurrents (voir « Mises en garde et précautions »).
Grossesse/Allaitement
On ne dispose pas d'études cliniques sur la sécurité d'emploi de Feiba NF chez la femme enceinte et pendant l'allaitement. Les expérimentations animales ne sont pas appropriées pour déterminer la sécurité sur la grossesse, le développement de l'embryon, le développement du fœtus et/ou le développement post-natal. En conséquence aucune étude sur la reproduction animale n'a été réalisée avec FEIBA.
Le risque potentiel pour l'être humain n'est pas connu.
La grossesse et la période post-partum se caractérisent par un risque accru de thrombose et plusieurs complications de grossesse sont associées à un risque accru de CIVD.
Le médecin doit soigneusement sous-peser les risques et avantages potentiels pour chaque patient avant de prescrire Feiba NF.
Informations sur les infections par le parvovirus B19 cf. „Mises en garde et précautions”.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucun élément ne permet de mettre en évidence un effet éventuel de Feiba NF sur la capacité à conduire ou à utiliser des machines.
Effets indésirables
FEIBA peut provoquer des réactions d'hypersensibilité allergiques incluant une urticaire, un angioœdème, des manifestations gastro-intestinales, des bronchospasmes, et une chute de tension. Ces reactions peuvent être sevères et systémiques (p.e. anaphylaxie avec urticaire et angioœdème, bronchospasme, choc circulatoire). D'autres réactions à la perfusion ont également été rapportées telles que frissons, fièvre et hypertension.
Les effets indésirables indiqués dans cette rubrique ont été rapportées dans le cadre des rapports de cas spontanés après autorisation du médicament (pharmacovigilance) et de 2 essais cliniques avec FEIBA pour le traitement des hémorragies chez au moins 9 patients pédiatriques et 55 adultes avec hémophilie A ou B et avec inhibiteurs du facteur VIII ou IX. Dans une étude des patients avec une hémophilie acquise et inhibiteurs du facteur VIII (2 de 49 patients) étaient également inclus. Les effets indésirables d'une troisième étude qui a comparé la prévention avec un traitement «on-demand» chez 9 patients pediatriques et 27 adultes sont integrés ici.
La fréquence a été définie selon les critères suivants: très fréquent (≥10%), fréquent (≥1% à <10%), occasionnel (≥0.1% à <1%), rare (≥0.01% à <0.1%), très rare (<0.01%).
Affections hématologiques et du système lymphatique
Fréquent: augmentation du titre d'inhibiteurs (réponse anamnestique)*
*L'augmentation du titrage de l'inhibiteur (réponse anamnestique) [n'est pas un terme MedDRA] est l'augmentation des précédents titrages de l'inhibiteur se produisant après
l'administration de FEIBA. Voir Mises en garde et précautions
Cas isolés: coagulation intravasculaire disséminée (CIVD)
Affections du système immunitaire
Fréquent: réactions d'hypersensibilité
Cas isolés: urticaire, réaction anaphylactique
Affections du système nerveux
Fréquent: céphalée, vertiges, somnolence, dysgueusie
Cas isolés: insensibilité au niveau du visage et des membres (hypoesthésie), paresthésie, accident vasculaire cérébral thrombotique, accident vasculaire cérébral embolique
Affections cardiaques
Cas isolés: infarctus du myocarde, tachycardie
Affections vasculaires
Fréquent: hypotension
Cas isolés: thrombose, thrombose veineuse, thrombose artérielle, hypertension, bouffée congestive
Affections respiratoires, thoraciques et médiastinales
Fréquent: dyspnée
Cas isolée: embolie pulmonaire, bronchospasme, sibilances, toux
Affections gastro-intestinales
Fréquent: nausées
Cas isolés: vomissement, diarrhée, gêne abdominal
Affections de la peau et du tissu sous-cutané
Fréquent: éruption cutanée
Cas isolés: hypoesthésie faciale, angioœdème, urticaire, prurit
Troubles généraux et anomalies au site d'administration
Fréquent: frissons, pyrexie, douleur thoracique, gêne thoracique
Cas isolés: douleur au site d'injection, malaise, sensation de chaleur
Investigations
Fréquent: anticorps de surface anti-hépatite B positifs
Cas isolés: diminution de la pression sanguine
Réactions de classe
Fréquence inconnue: d'autres symptômes de réaction d'hypersensibilité aux médicaments dérivés du sang incluent léthargie et agitation.
Pour d'informations concernant la sécurité virale, voir Mises en garde et précautions.
Surdosage
Certains évènements thromboemboliques rapportés sont survenues avec des doses supérieures à 200 U/kg. En cas de signes ou symptômes d'incident thromboembolique, la perfusion doit être arrêtée immédiatement et des mesures diagnostiques et thérapeutiques spécifiques doivent être prises (voir Mises en garde et précautions).
Propriétés/Effets
Code ATC: B02BD03
Bien que Feiba NF ait été développé au début des années 1970 et que son activité de contournement de l'inhibiteur du facteur VIII ait été attestée in vitro et in vivo, ses composants actifs font toujours l'objet de débats scientifiques. Des travaux scientifiques publiés récemment ont toutefois montré que des composants spécifiques du complexe de prothrombine activée, la prothrombine zymogène (facteur II) et le facteur X activé (facteur Xa) jouent un rôle dans le mécanisme d'action de Feiba NF.
Feiba NF a été utilisé avec succès dans le cas d'un patient présentant un inhibiteur, qui souffrait du syndrome de von Willebrand-Jürgens.
Feiba NF a également été utilisé en association avec le concentré de facteur VIII en traitement à long terme dans le but de parvenir à une élimination complète et permanente de l'inhibiteur du facteur VIII pour permettre un traitement normal par un concentré de F VIII comme c'est le cas chez les patients qui ne présentent pas d'inhibiteur.
Pharmacocinétique
Dans la mesure où les composants actifs font encore l'objet de discussions, il n'est pas possible d'établir des affirmations définitives sur les propriétés pharmacocinétiques de Feiba NF.
Données précliniques
Compte tenu d'études de toxicité aiguë chez les souris chez lesquelles le facteur VIII est inhibé, chez les souris normales et chez le rat, utilisant des doses supérieures à la dose journalière maximale chez l'être humain (c'est-à-dire >200 U/kg PC), on peut en conclure que les effets indésirables associés à Feiba NF sont principalement la conséquence d'une hypercoagulation entraînée par les propriétés pharmacologiques de la préparation.
Des études de toxicité réalisées chez l'animal avec administrations multiples ne sont pas réalisables compte tenu de l'interférence associée aux anticorps se développant contre la protéine hétérologue.
En l'absence de signes d'effets oncogènes et mutagènes des protéines plasmatiques humaines, des analyses expérimentales, en particulier dans le cas d'espèces hétérologues, n'ont pas été considérées nécessaires.
Remarques particulières
Incompatibilités
Pour préserver l'efficacité et la tolérance de cette préparation, Feiba NF, comme tous les autres concentrés coagulants, ne doit pas être mélangé à d'autres médicaments avant administration ni dilué avec des solutions pour perfusion. Il est éventuellement recommandé de rincer avec une solution physiologique, une voie d'accès commune, avant et après l'utilisation de Feiba NF.
Des facteurs de coagulation dérivés du plasma humain peuvent être adsorbés par les surfaces internes de certains types de systèmes d'injection/de perfusion. Le cas échéant, la thérapie pourrait être un échec. L'utilisation de Feiba NF doit donc être associée à des systèmes de perfusion en plastique approuvés.
Influence sur les méthodes de diagnostic
Après l'administration de doses élevées de Feiba NF, une augmentation passagère d'anticorps de surface de l'hépatite B passivement transférés peut mener à une interprétation ambigüe des résultats positifs dans les tests sérologiques.
Stabilité
Le médicament ne peut être utilisé que jusqu'à la date de péremption figurant sur l'emballage, indiquée par «Exp».
Une stabilité chimique et physique de 3 heures, de 20 à 25 °C a été démontrée pour Feiba NF une fois reconstitué. Pour des considérations microbiologiques, la préparation doit être utilisée immédiatement après reconstitution.
Ne pas conserver au réfrigérateur ni congeler les solutions reconstituées.
Remarques concernant le stockage
Ne pas conserver au-dessus de +25 °C. Ne pas congeler.
Conserver dans l'emballage d'origine pour préserver le contenu contre la lumière.
Tenir hors de portée des enfants.
Remarques concernant la manipulation
Diluer Feiba NF immédiatement avant utilisation. Ensuite, la solution doit être utilisée immédiatement (la solution ne contient pas de conservateur). Les solutions qui sont troubles ou présentent un précipité ne doivent pas être utilisées.
Agiter doucement jusqu'à ce que toute la solution soit dissoute. Bien vérifier que Feiba NF est complètement dissout, sinon une part de la substance active FEIBA ne passera pas au travers du filtre.
Avant l'utilisation la solution doit être inspectée visuellement pour mettre en évidence la présence de particules ou un changement de coloration avant l'administration. Ne pas employer de solutions troubles ou présentant des dépôts
Ne pas utiliser le dispositif de transfert ou l'aiguille de transfert si l'emballage stérile ou le conditionnement est abîmé. Eliminer la solution non utilisée et les déchets de manière spécifique.
L'appareil peut contenir soit un système BAXJECT II Hi-Flow soit une canule bilatérale et une aiguille de filtrage.
Pour la dissolution et l'administration avec BAXJECT II Hi-Flow, voir «Variante A».
Pour la dissolution et l'administration par une canule bilatérale et une aiguille de filtrage, voir «Variante B».
Variante A (si le produit est livré avec le système BAXJECT II Hi-Flow)
Dissolution du lyophilisat:
1.Réchauffer le flacon à percer du solvant (eau pour injection) non ouvert à la température ambiante (15 – 25 °C), p.ex. à l'aide d'un bain d'eau à quelques minutes (max. 37 °C) si nécessaire.
2.Retirer le capuchon de protection des flacons à percer de lyophilisat et de solvant et désinfecter les deux bouchons en caoutchouc. Placer les deux flacons sur une surface plane.
3.Ouvrir l'emballage de BAXJECT II Hi-Flow en retirant le film protecteur sans toucher l'intérieur de l'emballage (Fig. a). Ne pas sortir le système de transfert de l'emballage.
4. Retourner l'emballage vers le bas et insérer la pointe en plastique transparent dans le bouchon en caoutchouc du flacon de solvant (Fig. b). Saisir l'emballage par les rebords puis retirer l'emballage de BAXJECT II Hi-Flow (Fig.c). Ne pas retirer le bouchon bleu de BAXJECT II Hi-Flow. Retourner le flacon de solvant connecté à BAXJECT II Hi-Flow sur lui-même, de sorte que le flacon de solvant se trouve en haut.
5.Insérer la pointe en plastique violet de BAXJECT II Hi-Flow dans le bouchon en caoutchouc du flacon de Feiba NF. Le vide va aspirer le solvant dans le flacon de Feiba NF (Fig. d).
6.Agiter doucement, sans secouer, le système complet jusqu'à dissolution de Feiba NF. S'assurer que Feiba NF est entièrement dissous, afin d'éviter que la substance active soit retenue par le filtre de BAXJECT II Hi-Flow.
Administration:
1.Retirer le bouchon bleu de BAXJECT II Hi-Flow. Prenez la seringue et connectez-la bien à BAXJECT II Hi-Flow (NE PAS ASPIRER D'AIR DANS LA SERINGUE) (Fig.e). Afin de garantir une bonne connexion entre la seringue et le dispositif BAXJECT II Hi-Flow, l'utilisation d'une seringue luer lock est fortement recommandée (à l'assemblage, tourner la seringue dans le sens des aiguilles d'une montre jusqu'à atteindre la position d'arrêt).
2.Retourner le système de sorte que la solution dissoute se trouve en haut. Remplir la seringue de solution reconstituée de Feiba NF en tirant doucement le piston en arrière et en s'assurant du maintien d'une bonne connexion entre le dispositif BAXJECT II Hi-Flow et la seringue tout au long de l'aspiration (Fig.f).
3.Retirer la seringue.
4.En cas de formation de mousse dans la seringue, attendre la disparition de la mousse. Injecter lentement par voie intraveineuse à l'aide du dispositif de perfusion emballée (ou aiguille à usage unique).
Ne pas dépasser une vitesse d'administration de 2 U de Feiba NF / kg PC / min.
Figure a | Figure b | Figure c |
|
|
|
Figure d | Figure e | Figure f |
|
|
|
Variante B (si le produit est livré avec aiguille de filtrage, de transfert et d'aération au lieu du système BAXJECT II Hi-Flow)
Dissolution du lyophilisat:
1.Réchauffer le flacon à percer du solvant (eau pour injection) non ouvert à la température ambiante (max. 37 °C), si nécessaire.
2.Enlever le capuchon de protection des flacons à percer du lyophilisat et du solvant (Fig. A) et désinfecter les deux bouchons en caoutchouc.
3.Retirer en tournant et tirant le capuchon protecteur d'une extrémité de l'aiguille de transfert emballée et percer à l'aide de l'aiguille, le bouchon en caoutchouc du flacon à percer du solvant (Fig. B et C).
4.Retirer le bouchon protecteur de l'autre extrémité de l'aiguille de transfert. Ne pas toucher l'extrémité libre de l'aiguille!
5.Retourner le flacon à percer du solvant et percer le centre du bouchon de caoutchouc du flacon de lyophilisat avec l'aiguille de transfert (Fig. D). Le vide existant dans le flacon du lyophilisat entraîne l'aspiration du solvant.
6.Retirer ensemble l'aiguille et le flacon à percer du solvant du flacon de lyophilisat (Fig. E). Accélérer la dissolution en agitant légèrement le flacon de lyophilisat.
7.Après dissolution complète du lyophilisat, enfoncer l'aiguille d'aération jointe à l'emballage (Fig. F), ce qui permet de faire disparaître la mousse qui s'était éventuellement formée. Retirer l'aiguille d'aération.
Administration:
1.Retirer en tournant et en tirant l'extrémité du bouchon protecteur de l'aiguille de filtrage jointe, l'adapter à la seringue à usage unique stérile et aspirer la solution dans la seringue (Fig. G).
2.Retirer l'aiguille de filtrage et injecter la solution avec le nécessaire de perfusion ou l'aiguille à usage unique jointe, lentement, par voie intraveineuse.
Ne pas dépasser une vitesse d'administration de 2 U de Feiba NF / kg PC / min.

Si des dispositifs autres que ceux fournis avec Feiba NF devaient être utilisés, s'assurer de l'utilisation d'un filtre ayant des pores d'au moins 149 µm.
Numéro d’autorisation
41352 (Swissmedic)
Titulaire de l’autorisation
Takeda Pharma AG, 8152 Opfikon
Mise à jour de l’information
Avril 2019
Отзывов (0)
Вы смотрели

Бесплатная консультация опытного специалиста
Опишите симптомы или нужный препарат – мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой на дом или просто проконсультируем.
Нас 14 специалистов и 0 ботов. Мы всегда будем с вами на связи и сможем связаться в любое время.


 Deutsch
Deutsch French
French