Alutard Sq Phleum Pratense Anf Be 4x 5ml
Alutard SQ Phleum pratense Inj Susp Anfangsbehandlung 4 Durchstf
-
98138.93 RUB
Предполагаемая дата доставки:
22.05. - 05.06.2024

- Наличие: В наличии
- Производитель: ALK-ABELLO AG
- Модель: 5095502
- ATC-код V01AA02
- EAN 7680607020019
Состав:
Состав:
Natriumchlorid, Natriumhydroxid, Phenol 5 mg, Natrium 2.64 mg, Natriumhydrogencarbonat, Aluminium, Wasser für Injektionszwecke 1 ml, Allergen-Extrakt aus Wiesenlieschgras-Pollen 100 U, Allergen-Extrakt aus Wiesenlieschgras-Pollen 1000 U, Aluminiumhydroxid zur Adsorption, wasserhaltiges (Ph.Eur.).Описание
Zusammensetzung
Wirkstoffe
Gräser
•Alutard SQ 6-Gräsermischung und Roggen:
Pollen-Allergenextrakt: Gräserblüten (Avena elatior, Dactylis glomerata, Festuca pratensis, Phleum pratense, Poa pratensis, Lolium perenne) und Roggen
•Alutard SQ Phleum Pratense: Pollen-Allergenextrakt (Phleum pratense)
Bäume
•Alutard SQ Frühblühermischung: Pollen-Allergenextrakt (Alnus glutinosa, Betula verrucosa, Corylus avellana)
•Alutard SQ Betula verrucosa: Pollen-Allergenextrakt (Betula verrucosa)
Hilfsstoffe
Aluminium ut Aluminii hydroxidum hydricum ad adsorptionem, Natrii chloridum, Natrii hydrogenocarbonas, Natrii hydroxidum q.s., Phenolum 5.0 mg, Aqua ad iniectabilia q.s. ad suspensionem pro 1 ml, corresp. Natrium 2.18 – 2.64 mg.
Darreichungsform und Wirkstoffmenge pro Einheit
Depot-Injektionssuspension zur subkutanen Anwendung.
Die Injektionssuspension enthält Allergenextrakte aus Gräser- oder Baumpollen.
Durchstechflasche Nr. (Etikettenfarbe) | Konzentration (SQ-U/ml) |
1 (grau) | 100 |
2 (grün) | 1'000 |
3 (orange) | 10'000 |
4 (rot) | 100'000 |
Eine Durchstechflasche enthält 5 ml Injektionssuspension.
Die Potenz wird in SQ-Einheiten (SQ-U) ausgedrückt, die mit der absoluten Menge (ng) an sogenannten Majorallergenen korrelieren. Darüber hinaus wird eine gleichförmige biologische Aktivität von Charge zu Charge garantiert.
Alutard SQ ist je nach Allergenzusammensetzung unterschiedlich getrübt.
Indikationen/Anwendungsmöglichkeiten
Alutard SQ ist eine spezifische Immuntherapie zur Behandlung von Gräser-, Getreide- oder Baumpollen bedingter allergischer Rhinitis und Konjunktivitis mit positivem Prick-Test und/oder positivem spezifischem IgE-Test auf relevante Allergene entsprechender Pollen.
Dosierung/Anwendung
Die Behandlung wird in eine Anfangs- und eine Fortsetzungsbehandlung unterteilt. Die Beurteilung und Indikationsstellung sollte durch einen entsprechend allergologisch geschulten Arzt erfolgen. Der Arzt muss die üblichen Reanimationsmassnahmen beherrschen.
Nach jeder Injektion muss der Patient für mindestens 30 Minuten unter Beobachtung bleiben, stark sensitive Patienten während der Anfangsbehandlung für mindestens 60 Minuten.
Notfallmedikamente zur Behandlung eines anaphylaktischen Schocks müssen stets in Griffnähe sein.
Die Dosis von Alutard SQ muss individuell angepasst werden. Die Dosierung sollte immer vom Allgemeinzustand des Patienten, von der Allergieanamnese und der Sensitivität des Patienten auf das entsprechende Allergen abhängig sein.
Bei der Aufdosierung ist der individuelle Patient zu berücksichtigen (siehe auch Abschnitt «Dosisanpassung aufgrund unerwünschter Wirkungen/Interaktionen»). Die Injektion erfolgt tief subkutan eine Handbreite oberhalb des Olecranons.
Intrakutane, intramuskuläre oder intravasale Injektionen sind wegen der Gefahr eines anaphylaktischen Schocks streng zu vermeiden. Aspirationskontrolle!
Um eine intravasale Injektion zu vermeiden, ist jeweils vor der Injektion vorsichtig zu aspirieren, ebenso während der Injektion nach je 0.2 ml verabreichter Lösung. Die Injektion soll langsam erfolgen, zum Beispiel 1 ml über 1 Minute injizieren.
Dosierungsrichtlinien
Die jeweilige Dosierung muss der individuellen Reaktionslage des Patienten angepasst werden und darf nur bei einwandfreier Verträglichkeit der vorausgegangenen Injektion gesteigert werden. Andernfalls und auch bei längerem Therapieunterbruch infolge Infekt, Impfung, Urlaub etc. ist die Dosis entsprechend zu reduzieren (siehe Abschnitt «Dosisanpassung aufgrund unerwünschter Wirkungen/Interaktionen» und „Verspätete Dosisgabe").
Die Injektionen werden in der Regel während der Aufbauphase bei der 16-stufigen und der 11-stufigen Aufdosierung in 7- bis 14-tägigen Abständen verabreicht. Ein Injektionsintervall von 7 Tagen sollte zur Vermeidung von Kumulationen nicht unterschritten werden.
Bei Erwachsenen und Jugendlichen wurde die Sicherheit eines dritten Schemas mit einer 7-stufigen Aufdosierung mit einem Dosierungsintervall von 7 Tagen ebenfalls untersucht (weitere Informationen zum Sicherheitsprofil dieses Schemas können in der Rubrik «Unerwünschte Wirkungen» gefunden werden).
In der Fortsetzungsbehandlung werden die Injektionen in 4- bis 8-wöchigen Intervallen verabreicht.
Das Ziel ist, die Dosis schrittweise zu steigern, bis die höchste tolerierte Dosis erreicht ist, jedoch ohne 100'000 SQ-U (1 ml von Flasche 4) zu überschreiten. Die folgenden Dosierungsempfehlungen sind jedoch nur als allgemeine Richtlinie gedacht.
Therapieeinleitung
Anfangsbehandlung
Üblicher Therapiebeginn
Der Therapiebeginn soll ausserhalb der relevanten Pollensaison erfolgen und die Anfangsbehandlung möglichst vor Beginn des Pollenflugs abgeschlossen werden, d.h.
•Bäume: Juni-September.
•Gräser: Oktober-Dezember.
16-stufige Aufdosierung
Durchstechflasche Nr. | Konzentration | Inj.-Nr. | SQ-U | ml |
1 | 100 SQ-U/ml 100 SQ-U/ml 100 SQ-U/ml | 1 2 3 | 20 40 80 | 0.2 0.4 0.8 |
2 | 1'000 SQ-U/ml 1'000 SQ-U/ml 1'000 SQ-U/ml | 4 5 6 | 200 400 800 | 0.2 0.4 0.8 |
3 | 10'000 SQ-U/ml 10'000 SQ-U/ml 10'000 SQ-U/ml 10'000 SQ-U/ml 10'000 SQ-U/ml | 7 8 9 10 11 | 2'000 4'000 6'000 8'000 10'000 | 0.2 0.4 0.6 0.8 1.0 |
4 | 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml | 12 13 14 15 16 | 20'000 40'000 60'000 80'000 100'000 | 0.2 0.4 0.6 0.8 1.0 |
11-stufige Aufdosierung
Durchstechflasche Nr. | Konzentration | Inj.-Nr. | SQ-U | ml |
2 | 1'000 SQ-U/ml 1'000 SQ-U/ml | 1 2 | 100 300 | 0.1 0.3 |
3 | 10'000 SQ-U/ml 10'000 SQ-U/ml 10'000 SQ-U/ml | 3 4 5 | 1'000 3'000 6'000 | 0.1 0.3 0.6 |
4 | 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml | 6 7 8 9 10 11 | 10'000 20'000 40'000 60'000 80'000 100'000 | 0.1 0.2 0.4 0.6 0.8 1.0 |
Erhaltungstherapie
Fortsetzungsbehandlung
Um die optimale Wirkung zu erhalten, sollte die Erhaltungsdosis die höchste tolerierte Dosis betragen, d.h. die höchste Dosis, bei der keine klinisch relevanten Nebenwirkungen auftreten. Diese Dosis sollte 100'000 SQ-U nicht überschreiten. Die optimale Erhaltungsdosis ist individuell und ist abhängig von der Sensitivität des Patienten auf das Allergen.
Die Injektionen werden in 4- bis 8-wöchigen Intervallen verabreicht, wobei empfohlen wird, nach Erreichen der Erhaltungsdosis das Injektionsintervall schrittweise jeweils um 2 Wochen zu verlängern und so auf ein Intervall zwischen 4 und 8 Wochen auszudehnen.
Reagiert der Patient während der Fortsetzungsbehandlung mit schwerwiegenden allergischen Reaktionen muss die Dosis angepasst werden (siehe Abschnitt «Dosisanpassung aufgrund unerwünschter Wirkungen/Interaktionen»).
Dosisanpassungen während der Fortsetzungsbehandlung
Je nach Allergenquelle werden verschiedene Behandlungsmethoden angewandt:
1. Perenniale Behandlung mit kosaisonal reduzierter Erhaltungsdosis: Sie kommt für alle Pollenarten in Betracht, wobei nach Erreichen der Erhaltungsdosis diese während der Pollensaison auf 1/5 reduziert und nach der Saison wieder bis zur vorher erreichten Erhaltungsdosis gemäss Dosierungsschema (siehe Anfangsbehandlung) gesteigert wird.
2. Präsaisonale Behandlung: Sie kommt ebenfalls für alle Pollenarten in Betracht, wobei die Behandlung während der Zeit des Pollenflugs unterbrochen wird. Nach der Saison wird die Behandlung wieder von vorne begonnen und gemäss Dosierungsschema (siehe Anfangsbehandlung) bis zu der bisher erreichten Erhaltungsdosis gesteigert.
Übergang auf nachbestellte Packung
Beim Übergang auf eine nachbestellte Durchstechflasche zur Fortsetzungsbehandlung sollten zuerst 2/3 der bisher erreichten Dosis verabreicht und – bei guter Verträglichkeit – nach 15 Minuten der Rest verabreicht werden, um evtl. lagerungsbedingten Potenzschwankungen vorzubeugen. Eine generelle Dosisreduktion ist bei SQ-Allergenen nicht erforderlich.
Gleichzeitige Behandlung mit 2 verschiedenen Hyposensibilisierungslösungen
Das mögliche Risiko für allergische Reaktionen bei gleichzeitigem Behandlungsbeginn mit mehr als einem Allergen muss individuell beurteilt werden.
Bei gleichzeitiger Behandlung mit mehr als einer spezifischen Allergenlösung sind die Injektionen örtlich getrennt in einem Intervall von mindestens 30 Minuten zu verabreichen, um die lokalen Reaktionen richtig interpretieren zu können.
Therapiedauer
Die Behandlung mit Alutard SQ-Präparaten sollte über mindestens 3 Jahre erfolgen.
Dosisanpassung aufgrund unerwünschter Wirkungen/Interaktionen
Falls während der Anfangs- oder Fortsetzungsbehandlung eine Reaktion an der Injektionsstelle länger als 6 Stunden nach der Injektion andauert, sollte die nächste Dosis in Abhängigkeit der Grösse der Schwellung gemäss den Empfehlungen in der Tabelle «Dosisreduktion bei Schwellung an der Injektionsstelle» reduziert werden.
Dosisreduktion bei Schwellung an der Injektionsstelle
Maximaler Durchmesser der Schwellung | Nächste Dosis | |
Kinder | Erwachsene | |
<5 cm | < 8 cm | Anfangsbehandlung: Dosis gemäss Dosierungsschema erhöhen Fortsetzungsbehandlung: zuletzt verabreichte Dosis wiederholen |
5-7 cm | 8-12 cm | zuletzt verabreichte Dosis wiederholen |
7-12 cm | 12-20 cm | Dosis um 1 Schritt reduzieren |
12-17 cm | >20 cm | Dosis um 2 Schritte reduzieren |
>17 cm | Dosis um 3 Schritte reduzieren | |
Tritt während der Anfangs- oder Fortsetzungsbehandlung nach einer Injektion eine schwerwiegende systemische Reaktion auf, sollte die Behandlung nur nach sorgfältiger Überprüfung weitergeführt werden. Wird die Behandlung weitergeführt, so sollte die nächste Dosis auf 10% der Dosis, die die Reaktion hervorgerufen hatte, reduziert werden. Diese reduzierte Dosis kann in zwei Einzeldosen aufgeteilt und diese in einem 30-Minuten-Intervall verabreicht werden. Der Patient muss nach der Injektion überwacht werden und die Dosis gemäss den Dosierungsrichtlinien für die Anfangsbehandlung gesteigert werden, bis die maximal tolerierte Dosis erreicht ist.
Verspätete Dosisgabe
Während der Anfangsbehandlung
Wird in Ausnahmefällen ein Injektionsintervall von 14 Tagen überschritten, so kann die Dosis zunächst nicht weiter gesteigert, sondern muss wie folgt angepasst werden.
Dosisreduktion nach Therapieunterbruch
Intervalldauer | empfohlene Dosisreduktion |
<2 Wochen | Dosis gemäss Dosierungsschema erhöhen |
2-3 Wochen | zuletzt verabreichte Dosis wiederholen |
3-4 Wochen | Dosis auf 50% der zuletzt verabreichten Dosis reduzieren |
>4 Wochen | Neubeginn der Behandlung |
Während der Fortsetzungsbehandlung
Dosisreduktion bei Überschreitung des Zeitintervalls zwischen zwei Injektionen während der Fortsetzungsbehandlung
Intervalldauer | Empfohlene Dosisreduktion |
<8 Wochen | Keine Änderung |
8-10 Wochen | Dosis auf 75% der zuletzt verabreichten Dosis reduzieren |
10-12 Wochen | Dosis auf 50% der zuletzt verabreichten Dosis reduzieren |
12-14 Wochen | Dosis auf 25% der zuletzt verabreichten Dosis reduzieren |
14-16 Wochen | Dosis auf 10% der zuletzt verabreichten Dosis reduzieren |
>16 Wochen | Neubeginn der Behandlung |
Im Falle einer Dosisreduktion während der Fortsetzungsbehandlung muss der Patient sorgfältig nach der Injektion überwacht werden. Die Dosis wird anschliessend gemäss den Dosierungsrichtlinien für die Anfangsbehandlung gesteigert, bis die Erhaltungsdosis erreicht wird.
Kinder und Jugendliche
Kinder im Alter unter 5 Jahren sind normalerweise nicht für eine Allergie-Immuntherapie geeignet, da Akzeptanz- und Kooperationsprobleme in dieser Altersgruppe eher wahrscheinlich sind als bei Erwachsenen.
Zur Wirksamkeit bei Kindern im Alter von >5 Jahren sind nur wenige klinische Daten vorhanden, die Wirksamkeit ist nicht belegt. Daten zur Sicherheit zeigen jedoch kein grösseres Risiko als für Erwachsene.
Kontraindikationen
•Überempfindlichkeit gegenüber einem der Hilfsstoffe gemäss Zusammensetzung.
•Patienten mit aktiven systemischen Autoimmunerkrankungen und Patienten mit Immundefekten oder Immunschwächen.
•Schwere chronisch-entzündliche Erkrankungen.
•Patienten mit bösartigen Tumorerkrankungen mit aktuellem Krankheitswert.
•Irreversible Sekundärveränderungen am Reaktionsorgan (z.B. Emphysem, Bronchiektasen).
•Schwere chronische Niereninsuffizienz (Aluminiumbelastung).
•Patienten mit unkontrolliertem Asthma oder FEV1< 70 % des Vorhersagewertes bei Erwachsenen (nach adäquater pharmakologischer Therapie) und FEV1< 80 % des Vorhersagewertes bei Kindern und Jugendlichen (nach adäquater pharmakologischer Therapie).
•Patienten, die in den letzten 3 Monaten eine schwere Asthma-Exazerbation hatten.
Warnhinweise und Vorsichtsmassnahmen
Nach jeder Injektion muss der Patient für mindestens 30 Minuten überwacht werden mit anschliessender ärztlicher Beurteilung. Schwere systemische allergische Reaktionen Aufgrund des Risikos schwerer anaphylaktischer Reaktionen muss eine umfassende apparative und medikamentöse Ausstattung zur Wiederbelebung sofort verfügbar sein. Dies schliesst Adrenalin zur Injektion und entsprechend geschultes Personal ein. Treten Symptome einer systemischen Reaktion wie z.B. Urtikaria, Angioödem oder schweres Asthma auf, sollte die symptomatische Behandlung unverzüglich eingeleitet werden. |
Die Behandlung sollte nur von Ärzten ausgeübt werden, die Erfahrung in der Durchführung einer spezifischen Immuntherapie haben.
Bei einer Behandlung mit Alulard SQ werden die Patienten Allergenen ausgesetzt, die lokale und/oder systemische allergische Reaktionen auslösen können. Für die Behandlung von schweren systemischen allergischen Reaktionen ist Adrenalin die erste Wahl (in der Regel von 0.01 mg/kg in die Muskulatur des Oberschenkels).
Da Adrenalin zur Behandlung von allergischen Nebenreaktionen empfohlen wird, müssen Warnhinweise und Vorsichtsmassnahmen sowie Kontraindikationen für Adrenalin beachtet werden.
Dauerbehandlung mit Medikamenten:
Die Wirkung von Adrenalin kann bei Patienten, die mit trizyklischen Antidepressiva, Monoaminooxidasehemmern (MAO-Hemmern) und/oder COMT-Inhibitoren behandelt werden, verstärkt werden, was möglicherweise lebensbedrohliche Folgen haben kann. Die Wirkung von Adrenalin kann bei Patienten, die mit Betablockern behandelt werden, reduziert sein. Während einer Behandlung des Patienten mit blutdrucksenkenden Mitteln kann die gefässerweiternde Wirkung von Histamin verstärkt werden, wodurch anaphylaktische Reaktionen verstärkt werden. Es sollte für den einzelnen Patienten geprüft werden, ob die Behandlung mit ACE-Hemmern vor einer Injektion beendet werden sollte, da aufgrund der Hemmung des Angiotensinmetabolismus ein theoretisches Risiko einer Vasodilatation besteht, was der Behandlung mit Adrenalin entgegenwirken kann.
Behandlung von unerwünschten Wirkungen (Empfehlungen gemäss EAACI Richtlinie zur Immuntherapie 2006):
Symptome | Therapie Erwachsene | Therapie Kinder |
Ausgedehnte Lokalreaktion (>12 cm nach 30 Min.) | Antihistaminikum oral; topische Kortikosteroide; Beobachtung über mindestens 60 Min. | Antihistaminikum oral; topische Kortikosteroide; Beobachtung über mindestens 60 Min. |
Rhinitis | Antihistaminikum oral; Beobachtung über mindestens 60 Min. und Wiederholung Peak flow. | Antihistaminikum oral; Beobachtung über mindestens 60 Min. und Wiederholung Peak flow. |
Leichte Urtikaria | Antihistaminikum oral oder parenteral; Beobachtung über mindestens 60 Min. | Antihistaminikum oral oder parenteral; Beobachtung über mindestens 60 Min. |
Asthma | β-2 Agonist inhalativ; β-2 Agonist i.v./s.c.; Sauerstoff; Kortikosteroide (Prednisolon 50 mg oder Methylprednisolon 40 mg i.v.); Theophyllin; Hospitalisierung in Betracht ziehen. | β-2 Agonist inhalativ; β-2 Agonist i.v./s.c.; Sauerstoff; Kortikosteroide (Methylprednisolon 2 mg/kg i.v.); Theophyllin; Hospitalisierung in Betracht ziehen. |
Systemische Reaktionen | Adrenalin (1 mg/ml) 0.3-0.5 mg tief i.m.. | Adrenalin (1 mg/ml) 0.005 mg/kg tief i.m.. |
Generalisierte Urtikaria, Angioödem | i.v. Zugang (0.9% Kochsalzlösung); Blutdruck und Puls kontrollieren; Antihistaminikum i.m.; Kortikosteroide (Prednisolon 50 mg oder Methylprednisolon 40 mg i.v.); Hospitalisierung in Betracht ziehen. | i.v. Zugang (0.9% Kochsalzlösung); Blutdruck und Puls kontrollieren; Antihistaminikum i.m.; Kortikosteroide (Methylprednisolon 2 mg/kg i.v.); Hospitalisierung in Betracht ziehen. |
Anaphylaktischer Schock | Adrenalin (1 mg/ml)0.5-0.8 mg tief i.m. oder (verdünnt 0.1 mg/ml) 0.3-0.5 mg i.v. (langsam in fraktionierten Dosen) kann nach 10-20 Min. wiederholt werden; i.v. Zugang (0.9% Kochsalzlösung); Patient in Rückenlage bringen; Sauerstoff 5-10 l/Min.; Blutdruck, Puls und Sauerstoffsättigung überprüfen; Antihistaminikum i.v.; Methylprednisolon 80 mg i.v.; Hospitalisierung notwendig aufgrund des Risikos eines verzögerten Schocks. | Adrenalin (1 mg/ml) 0.01 mg/kg (entspricht 0.01 ml/kg) tief i.m. oder wenn nötig (verdünnt 0.1 mg/ml) i.v. (langsam in fraktionierten Dosen); i.v. Zugang (0.9% Kochsalzlösung); Patient in Rückenlage bringen; Sauerstoff; Blutdruck, Puls und Sauerstoffsättigung überprüfen; Antihistaminikum i.m.; Kortikosteroide (Methylprednisolon 2 mg/kg i.v.); Hospitalisierung notwendig aufgrund des Risikos eines verzögerten Schocks. |
Patienten mit Herzerkrankungen können im Falle von schweren systemischen allergischen Reaktionen möglicherweise ein erhöhtes Risiko haben. Klinische Erfahrungen mit Alutard SQ bei Patienten mit Herzerkrankungen sind begrenzt. Dies sollte vor Beginn einer spezifischen Allergie-Immuntherapie berücksichtigt werden.
Asthma
Asthma ist ein bekannter Risikofaktor für schwere systemische allergische Reaktionen.
Klinische Erfahrungen mit Alutard SQ bei Patienten mit Asthma sind begrenzt.
Bei Patienten mit Asthma in der Anamnese sollten die Asthmasymptome innerhalb der letzten 3 Monate vor Beginn der Behandlung mit Alutard SQ adäquat kontrolliert gewesen sein.
Vor jeder Injektion muss der Zustand des Asthmapatienten überprüft werden. Die Therapieallergen-Injektion sollte verschoben werden, wenn der Asthmastatus des Patienten in der letzten Woche vor der geplanten Injektion nicht vollständig kontrolliert war.
Patienten mit Asthma in der Anamnese müssen über die Notwendigkeit informiert werden, unverzüglich einen Arzt aufzusuchen, wenn sich ihr Asthma plötzlich verschlechtert.
Bei Patienten mit Asthma in der Anamnese und akuter Atemwegsinfektion sollte die Einleitung der Therapie mit Alutard SQ bis zum Abklingen der Infektion verschoben werden.
Autoimmunerkrankungen in Remission
Es gibt nur begrenzt Daten zur Allergie-Immuntherapie bei Patienten mit Autoimmunerkrankungen in Remission. Alutard SQ sollte daher bei diesen Patienten mit Vorsicht verschrieben werden.
Aluminiumbelastung
Alutard SQ enthält Aluminium. Daher besteht eine theoretische Gefahr der Aluminium-Anreicherung bei Patienten mit einem hohen Risiko (z.B. bei Patienten mit eingeschränkter Nierenfunktion und bei Patienten, die gleichzeitig mit Aluminium-haltigen Präparaten behandelt werden (z.B. Antazida)). Dies sollte vor Beginn der Behandlung mit Alutard SQ berücksichtigt werden.
Kinder und Jugendliche
Kinder unter 5 Jahren gelten in der Regel nicht als geeignete Kandidaten für eine Allergie-Immuntherapie und sollten nur in speziellen Ausnahmen und nicht routinemässig behandelt werden. Besondere Aufmerksamkeit sollte der Nutzen-Risiko-Bewertung bei der Behandlung von Kindern unter 5 Jahren gewidmet werden. Für Kinder ab 5 Jahren gibt es wenige klinische Daten zur Wirksamkeit. Daten zur Sicherheit deuten jedoch nicht auf ein grösseres Risiko im Vergleich zu Erwachsenen hin. Das 7-stufige Aufdosierungsschema ist nicht bei Kindern unter 12 Jahren untersucht worden.
Gleichzeitige Anwendung mit anderen spezifischen Allergie-Immuntherapien
Es liegen keine klinischen Daten zur gleichzeitigen Anwendung mit anderen spezifischen Allergie-Immuntherapien vor.
Unter laufender Therapie:
Die Injektion sollte verschoben werden, wenn:
•der Patient Fieber hat oder Anzeichen einer akuten oder chronischen Infektion hat.
•der Patient eine deutlich reduzierte Lungenfunktion hat (Peak flow FEV1<70% des Normalwertes des Patienten bei Erwachsenen und FEV1< 80% des Normalwertes des Patienten bei Kindern und Jugendlichen) oder Symptome hat, die auf eine Asthmaexazerbation hindeuten.
•der Patient eine Verschlechterung einer atopischen Dermatitis hat.
•innerhalb der letzten Woche eine Schutzimpfung erfolgte bzw. in der Woche nach der Injektion von Alutard SQ erfolgen wird.
Vor der Injektion:
•Am Injektionstag muss der Patient körperliche Belastung, heisses Duschen, Saunabesuche und Alkohol vermeiden, da diese Begleitfaktoren eine Anaphylaxie möglicherweise verstärken können.
•Der Asthmastatus bei Patienten mit Asthma in der Anamnese muss vor jeder Injektion durch Messung des Peak flows und der Lungenfunktion beurteilt werden (siehe Abschnitt «Kontraindikationen»).
•Der Gesundheitszustand und der Allergiestatus des Patienten müssen ebenso beurteilt werden wie jede Änderung in der Einnahme anderer Medikamente seit der letzten Injektion.
•Allergische Reaktionen (lokal und/oder systemisch), die nach der vorangegangenen Injektion aufgetreten sind, sollten vermerkt und die Dosis entsprechend angepasst werden (siehe Abschnitt «Dosierung/Anwendung»).
•Vor jeder Injektion muss das angegebene Allergen, die Konzentration, das Volumen und das letzte Injektionsdatum (Dosisintervall) zweifach überprüft werden.
•Alutard SQ muss subkutan verabreicht werden. Eine intravasale Verabreichung muss wegen des erhöhten Risikos für allergische Reaktionen vermieden werden (Aspirieren).
Nach jeder Injektion:
•Der Patient ist darüber zu informieren, dass er im Falle einer schweren systemischen Spätreaktion sofort einen Arzt oder eine Notaufnahme aufsuchen muss.
•Der Patient ist darüber zu informieren, dass er jede verzögert auftretende lokale oder systemische Reaktion beobachten und dem behandelnden Arzt beim nächsten Besuch mitteilen muss.
•Jede allergische Reaktion (lokal und/oder systemisch) sollte dokumentiert werden, bevor der Patient die Einrichtung verlässt.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Injektion, d.h. es ist nahezu «natriumfrei».
Interaktionen
Es wurden keine Studien zu Wechselwirkungen beim Menschen durchgeführt. Es ist nicht bekannt, ob eine Alutard SQ-Behandlung mit Schutzimpfungen interagiert.
Eine gleichzeitige Behandlung mit symptomatisch wirksamen Antiallergika, Kortikosteroiden oder Mastzellstabilisatoren kann die Toleranzgrenze des Patienten gegenüber der spezifischen Allergie-Immuntherapie erhöhen. Dies sollte beim Absetzen solcher Medikamente beachtet werden.
Für Informationen zur gleichzeitigen Anwendung von MAO-Hemmern, COMT-Inhibitoren, Betablockern und Antazida, siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen».
Schwangerschaft/Stillzeit
Schwangerschaft
Es gibt keine hinreichenden Daten zur Anwendung bei Schwangeren. Es liegen keine hinreichenden tierexperimentellen Daten vor. Das potentielle Risiko für den Menschen ist nicht bekannt.
Während der Schwangerschaft darf das Arzneimittel nicht verabreicht werden, es sei denn dies ist eindeutig erforderlich. Stillzeit
Es liegen keine klinischen Daten zur Anwendung während der Stillzeit vor. Alutard SQ sollte während der Stillzeit nur nach sorgfältiger individueller Nutzen-Risiko-Abwägung angewendet werden.
Fertilität
Es gibt für die Anwendung von Alutard SQ keine klinischen Daten hinsichtlich der Fertilität.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Gelegentlich kann bei einigen Patienten nach der Injektion leichte Müdigkeit auftreten, welche die Fahrtüchtigkeit sowie die Fähigkeit, Maschinen zu bedienen, beeinträchtigen kann.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Reaktionen im Zusammenhang mit Alutard SQ-Behandlungen werden im Allgemeinen durch immunologische Reaktionen (lokale und/oder systemische) auf das entsprechende Allergen verursacht. Symptome einer frühen Reaktion treten innerhalb der ersten 30 Minuten nach der Injektion auf. Symptome einer Spätreaktion treten normalerweise innerhalb von 24 Stunden nach der Injektion auf.
Sehr häufig berichtete unerwünschte Wirkungen bei Patienten, die mit Alutard SQ behandelt werden, sind lokale Reaktionen an der Einstichstelle.
Auflistung der Nebenwirkungen
Unerwünschte Wirkungen werden gemäss MedDRA-Konvention nach Häufigkeiten unterteilt: Sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1'000, <1/100), selten (≥1/10'000, <1/1'000), sehr selten (<1/10'000). Die Häufigkeiten basieren auf einer klinischen Studie mit Alutard SQ Phleum pratense und einer klinischen Studie mit Alutard SQ 6-Gräsermischung und Roggen, Hausstaubmilbe und Birke, da das allgemeine Sicherheitsprofil für Alutard-SQ Präparate ähnlich ist.
Erkrankungen des Immunsystems
Häufig: Anaphylaktische Reaktion
Gelegentlich: Anaphylaktischer Schock
Augenerkrankungen
Häufig: Konjunktivitis
Gelegentlich: Augenlidödem
Gefässerkrankungen
Häufig: Flush
Erkrankungen des Ohrs und des Labyrinths
Häufig: Ohrenjucken, Vertigo
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Giemen, Husten, Dyspnoe, Asthma, Nasenverstopfung, allergische Rhinitis, Niesen, Rachenreizung, Rhinorrhoe, nasaler Pruritus
Erkrankungen des Gastrointestinaltrakts
Häufig: Abdominalschmerz, Diarrhoe, Erbrechen, Übelkeit, Dyspepsie
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Urtikaria, Pruritus, Ausschlag, Erythem, Ekzem
Gelegentlich: Schwellung des Gesichts
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Reaktionen an der Injektionsstelle*
Häufig: Unbehagen, Ermüdung, Schüttelfrost, Wärmegefühl, Fremdkörpergefühl
* Reaktionen an der Injektionsstelle stellen Ereignisse dar wie z.B. Pruritus/ Schwellung/ Urtikaria/ Erythem/ Knötchen/ Schmerzen/ Blaue Flecken/ Hämatom/ Induration/ Entzündung/ Ödem/ Ausschlag/ Wärme/ Verfärbung/ Papel an der Injektionsstelle, lokalisiertes Ödem, Schmerzen an der Verabreichungsstelle.
Daten aus einer Studie zur 7-stufigen Aufdosierung zeigten ein leicht erhöhtes Risiko für Augensymptome wie Schwellung des Auges und Augenjucken sowie für Hautreaktionen wie Erythem, Ausschlag und Urtikaria bei schneller Aufdosierung (7 Schritte gegenüber 11 Schritten).
Unerwünschte Wirkungen nach Markteinführung
Daten aus der Erfahrung nach Marktzulassung sind in der folgenden Auflistung mit der Häufigkeit „Nicht bekannt" aufgeführt (kann nicht aus den verfügbaren Daten abgeschätzt werden).
Erkrankungen des Nervensystems
Nicht bekannt: Schwindelgefühl, Parästhesie
Herzerkrankungen
Nicht bekannt: Palpitationen, Tachykardie, Zyanose
Gefässerkrankungen
Nicht bekannt: Hypotonie, Blässe
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Nicht bekannt: Bronchospasmus, Engegefühl des Halses
Erkrankungen der Haut und des Unterhautgewebes
Nicht bekannt: Angioödem
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Nicht bekannt: Gelenkschwellung, Arthralgie
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Nicht bekannt: Brustkorbbeschwerden, Hypertrichose an der Injektionsstelle
Beschreibung ausgewählter Nebenwirkungen
Lokale Reaktionen
Lokale Reaktionen treten an der Injektionsstelle auf und beinhalten Schwellung an der Injektionsstelle, Rötung, Schmerzen, Juckreiz, Verfärbung und Hämatome. Lokale Reaktionen können mit symptomatischen Arzneimitteln wie z.B. Antihistaminika behandelt werden.
Der Aluminiumgehalt kann zum Auftreten von lokalen Nebenwirkungen, inkl. positivem Haut-Patch-test für Aluminium, beitragen.
Systemische allergische Reaktionen
Systemische Reaktionen umfassen jedes Symptom an Organen abseits der Injektionsstelle.
Systemische allergische Reaktionen sind in der Regel mild bis mässig stark und können mit symptomatischen Arzneimitteln wie z.B. Antihistaminika behandelt werden. Systemische allergische Reaktionen können von allergischer Rhinitis bis hin zu einem anaphylaktischen Schock reichen. Die Behandlung einer schweren systemischen Reaktion muss sofort eingeleitet werden.
Die Symptome können Urtikaria, Angioödem, Bronchospasmus, Müdigkeit, Atemnot, Engegefühl der Brust und Flush beinhalten, sind aber nicht begrenzt auf diese. Weitere Sofortreaktionen können sein: Rhinitis, Rhinorrhoe, Husten, Niesen, Konjunktivitis und Asthma. Diese Reaktionen können auch als Spätreaktionen auftreten. Weitere Spätreaktionen sind: Kopfschmerzen, Juckreiz, allgemeines Unwohlsein.
Sind diese Reaktionen stärkerer und allgemeiner Art, muss der Patient umgehend seinen Arzt oder notfalls dessen Vertretung benachrichtigen. Auf alle Fälle sollte der Patient vor der nächsten Injektion den behandelnden Arzt über nachträglich aufgetretene Reaktionen informieren.
Schwere systemische allergische Reaktionen
Eine schwere systemische allergische Reaktion ist eine potentiell lebensbedrohliche Reaktion, die meist innerhalb von einigen Minuten auftritt, nachdem der Patient dem Allergen ausgesetzt wurde. Symptome, die auf eine schwere systemische allergische Reaktion hinweisen, können Hitzegefühl, allgemeine Beschwerden, Hypotonie, Tachykardie, Dyspnoe, Husten, Giemen, Flush, Brustkorbbeschwerden, Abdominalschmerz, Erbrechen, Diarrhoe, Ausschlag, Pruritus und Urtikaria beinhalten, sind aber nicht begrenzt auf diese.
Eine schwere systemische allergische Reaktion wie z.B. ein anaphylaktischer Schock entwickelt sich meist schnell innerhalb von Minuten nach der Injektion und verlangt nach einer schnellen Behandlung z.B. mit Adrenalin und/oder einer anderen anaphylaktischen Behandlung. Eine Therapie gemäss den aktuellen Richtlinien zur Schockbehandlung muss eingeleitet werden.
Beim Auftreten ausgedehnter lokaler Reaktionen und systemischer Reaktionen muss eine Evaluation der Behandlung vorgenommen werden (siehe «Dosierung / Anwendung»).
Während der Behandlung kann sich eine atopische Dermatitis verschlimmern.
Kinder und Jugendliche
Für Kinder ab 5 Jahren gibt es wenige klinischen Daten zur Wirksamkeit. Daten zur Sicherheit deuten jedoch nicht auf ein grösseres Risiko im Vergleich zu Erwachsenen hin. Kinder unter 5 Jahren gelten in der Regel nicht als geeignete Kandidaten für eine Allergie-Immuntherapie. Besondere Aufmerksamkeit sollte der Nutzen-Risiko-Bewertung bei der Behandlung von Kindern unter 5 Jahren gewidmet werden.
Andere besondere Patientengruppen
Es sind keine Daten aus klinischen Studien zu Nebenwirkungen in anderen Patientengruppen verfügbar.
Sicherheit bei verkürzter Aufdosierung
Für Erwachsene und Jugendliche wurde die Sicherheit eines verkürzten Aufdosierungsschema mit 7 Injektionen untersucht. Dabei wurden die 7 Injektionen in Abständen von jeweils 7 ± 2 Tagen verabreicht.
Durchstechflasche Nr. | Konzentration | Inj.-Nr. | SQ-U | ml |
2 | 1'000 SQ-U/ml | 1 | 300 | 0.3 |
3 | 10'000 SQ-U/ml 10'000 SQ-U/ml | 2 3 | 2'000 5'000 | 0.2 0.5 |
4 | 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml | 4 5 6 7 | 10'000 30'000 60'000 100'000 | 0.1 0.3 0.6 1.0 |
Bei dieser 7-stufigen Aufdosierung zeigten sich keine neuartigen Sicherheitssignale.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Wenn eine höhere als die vorgesehene Dosis injiziert wurde, erhöht sich das Risiko von Nebenwirkungen, einschliesslich des Risikos einer systemischen allergischen Reaktion oder schwerer lokaler allergischer Reaktionen. Der Patient muss überwacht und diese Reaktionen sollten mit entsprechenden symptomatischen Medikamenten behandelt werden.
Eigenschaften/Wirkungen
ATC-Code
V01AA
Wirkungsmechanismus
Alutard SQ bewirkt in steigenden Dosen – laut Dosierungsrichtlinie – verabreicht eine dauernde Unempfindlichkeit oder herabgesetzte Empfindlichkeit gegenüber den spezifisch auslösenden Allergenen.
Die Adsorption an Aluminiumhydroxid bewirkt bei subkutaner Injektion eine langsame Resorption des Allergenextraktes und dadurch eine schonende und gut verträgliche Hyposensibilisierung.
Pharmakodynamik
Das Produkt bewirkt eine Hyposensibilisierung allergischer Patienten. Der detaillierte Mechanismus ist noch unbekannt. Die pharmakodynamische Wirkung zielt auf das Immunsystem wobei insbesondere eine verzögerte Reaktion gegenüber dem entsprechenden Allergen, nicht jedoch gegenüber anderen Allergenen erzielt wird. Alutard SQ dient zur Behandlung von Patienten mit IgE-vermittelten Allergien. Die pharmakodynamische Wirkung zielt auf das Immunsystem mit spezifisch verminderter Reaktion gegenüber den Allergenen, mit welchen der Patient behandelt wird. Alutard SQ tangiert und beeinträchtigt die Wanderung von T-Lymphozyten und eosinophilen Granulozyten zu den Zielorganen. Das Verhältnis zwischen Th2- und Th1-Zytokinen wird zugunsten der Th1-Zytokine verschoben. Des Weiteren steigt die Syntheserate von IL-10, das unter anderem eine Anergie von T-Lymphozyten bewirkt. Auf Grund der geringeren Anzahl rezirkulierender basophiler Granulozyten im peripheren Blut wird ausserdem die Freisetzung von Histamin reduziert.
Klinische Wirksamkeit
Eine doppelblinde, randomisierte Placebo kontrollierte Studie zeigte bei einer ko-saisonalen Behandlung mit vorheriger 15-stufiger Aufdosierung für die Behandlung mit Alutard SQ-Gräserpollen 100'000SQ gegenüber Placebo eine Reduktion sowohl ko-saisonaler Symptome wie auch des ko-saisonalen Medikamentenverbrauchs. Eine offene klinische Studie mit Alutard SQ Gräser und Alutard SQ Betula verrucosa weist darauf hin, dass Alutard SQ möglicherweise einen Langzeiteffekt haben und das Fortschreiten von allergischer Rhinitis zu allergischem Asthma bei Kindern verhindern kann (klinische Evidenz nicht gesichert). Ein 7-jähriges Nachverfolgen deutet ebenfalls auf einen möglichen Langzeiteffekt bei Alutard SQ Gräser hin (klinische Evidenz nicht gesichert).
Pharmakokinetik
Absorption
Der Hauptanteil der Allergene in Alutard SQ sind Polypeptide und Proteine. Es wird erwartet, dass diese zu kurzen Polypeptiden und Aminosäuren abgebaut werden. Man geht davon aus, dass die Allergene, die in Alutard SQ enthalten sind, nicht in signifikanter Menge in das vaskuläre System absorbiert werden. Es wurden keine pharmakokinetischen Studien an Tieren oder klinische Studien, welche das pharmakokinetische Profil und den Metabolismus von Alutard SQ untersucht haben, durchgeführt.
Die Adsorption des Allergens an Aluminiumhydroxid kann zu einer langsamen Freisetzung an der Injektionsstelle führen. Bei subkutaner Injektion wird das Allergen langsam freigesetzt, was die Allergenität reduziert und eine verlängerte Stimulation des Immunsystems zur Folge haben kann.
Distribution
Keine Daten.
Metabolismus
Keine Daten.
Elimination
Keine Daten.
Präklinische Daten
Präklinische Daten sind begrenzt. Basierend auf den konventionellen Studien zur Toxizität an Nagetieren bei wiederholter Gabe, Genotoxizität und zur Reproduktionsstoxizität (embryo-fötale Entwicklung) lassen diese keine besonderen Gefahren für den Menschen erkennen. Die Studien wurden mit dem Wirkstoff ohne Formulierung, d.h. dem Allergenextrakt ohne Adjuvans und Hilfsstoffen durchgeführt. Es sind keine Interaktionen der Hilfsstoffe mit den Wirkstoffen zu erwarten. Es wurden keine Karzinogenitätsstudien durchgeführt.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2-8°C) lagern. Nicht einfrieren.
Den Behälter im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Ausser Reichweite von Kindern aufbewahren.
Gefrorene und wieder aufgetaute Lösungen oder solche mit Niederschlag (grobflockige, irreversible Ausfällungen) nicht verwenden!
Hinweise für die Handhabung
Durchstechflasche vor Gebrauch behutsam 10-20 Mal invertieren.
Nicht intravasal injizieren! Aspirieren!
Hinweise für die Handhabung der Durchstechflaschen und Durchführung der Injektion, siehe am Ende der Fachinformation.
Zulassungsnummer
60695, 60702, 60708, 60711 (Swissmedic).
Zulassungsinhaberin
ALK-Abelló AG, Volketswil.
Stand der Information
Mai 2020
Hinweise für die Handhabung der Durchstechflaschen und Durchführung der Injektion
Vor Verwendung «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen» beachten. | ||
1 |
| Entsprechende Durchstechflasche aus der Packung entnehmen. Das angegebene Allergen, die Konzentration, das Volumen und das letzte Injektionsdatum (Dosisintervall) müssen vor jeder Injektion zweifach überprüft werden. Kontrollieren Sie: •Patientendaten •Allergenzusammensetzung •Konzentration (Stärke) •Verfalldatum |
2 |
| Durchstechflasche behutsam 10-20 Mal invertieren. Gefrorene und wieder aufgetaute Lösungen oder solche mit Niederschlag (grobflockige, irreversible Ausfällungen) nicht verwenden! |
3 |
| Gummistopfen desinfizieren und mit steriler 1-ml-Einmalspritze durchstechen. Fragen an Patient/Patientin: •Allgemeinzustand •Einnahme von Medikamenten •aktuelle allergische Symptomatik •Verträglichkeit der vorangegangenen Injektion |
4 |
| Injektion gut vertragen: Steigerung bzw. Beibehaltung der Dosis gemäss Dosierungsrichtlinien Injektion nicht gut vertragen oder andere Einschränkungen: Reduktion der Dosis gemäss Dosierungsrichtlinien |
5 |
| Entsprechendes Volumen entnehmen. Injektionsdosis exakt justieren (Luftblasen vermeiden!). |
6 |
| Injektionsstelle reinigen und desinfizieren, dann: •Eine Hautfalte eine Handbreite oberhalb des Olecranons abheben •Intravasale Injektion vermeiden! Aspirieren! •Langsam subkutan injizieren. |
7 | Patienten nach der Injektion mindestens 30 Minuten überwachen! Eventuell Arzneimittel (z.B. Antihistaminika) zur Behandlung von Spätreaktionen mitgeben. | |
Composizione
Principi attivi
Graminacee
•Alutard SQ Miscela di 6 graminacee e segale:
estratto allergenico di polline: fiori di graminacee (Avena elatior, Dactylis glomerata, Festuca pratensis, Phleum pratense, Poa pratensis, Lolium perenne) e segale
•Alutard SQ Phleum Pratense: estratto allergenico di polline (Phleum pratense)
Alberi
•Alutard SQ Miscela di alberi a fioritura precoce: estratto allergenico di polline (Alnus glutinosa, Betula verrucosa, Corylus avellana)
•Alutard SQ Betula verrucosa: estratto allergenico di polline (Betula verrucosa)
Sostanze ausiliarie
Aluminium ut Aluminii hydroxidum hydricum ad adsorptionem, Natrii chloridum, Natrii hydrogenocarbonas, Natrii hydroxidum q.s., Phenolum 5,0 mg, Aqua ad iniectabilia q.s. ad suspensionem pro 1 ml corresp. Natrium 2,18-2,64 mg.
Forma farmaceutica e quantità di principio attivo per unità
Sospensione iniettabile a rilascio prolungato per uso sottocutaneo.
La sospensione iniettabile contiene estratti allergenici di pollini di graminacee o di alberi.
Flaconcino n. (colore etichetta) | Concentrazione (SQ-U/ml) |
1 (grigio) | 100 |
2 (verde) | 1'000 |
3 (arancione) | 10'000 |
4 (rosso) | 100'000 |
Un flaconcino contiene 5 ml di sospensione iniettabile.
La potenza è espressa in unità SQ (SQ-U) correlate alla quantità assoluta (ng) dei cosiddetti allergeni principali. Viene inoltre garantita un'attività biologica uniforme da lotto a lotto.
In base alla composizione allergenica, Alutard SQ presenta una torbidità variabile.
Indicazioni/Possibilità d'impiego
Alutard SQ è un'immunoterapia specifica per il trattamento della rinite allergica e della congiuntivite dovute a pollini di graminacee, frumento o alberi in presenza di positività al prick test e/o positività al test delle IgE specifiche per gli allergeni rilevanti dei relativi pollini.
Posologia/Impiego
Il trattamento viene suddiviso in trattamento iniziale e di proseguimento. La valutazione e le indicazioni devono essere effettuate da un medico con specifica formazione in ambito allergologico. Il medico deve conoscere le comuni misure di rianimazione.
Dopo ogni iniezione, il paziente deve rimanere sotto osservazione per almeno 30 minuti; i pazienti altamente sensibili per almeno 60 minuti durante il trattamento iniziale.
Devono inoltre essere a portata di mano i medicamenti d'emergenza per il trattamento dello shock anafilattico.
La dose di Alutard SQ deve essere adeguata individualmente. La posologia deve sempre dipendere dalle condizioni generali del paziente, dall'anamnesi allergica e dalla sensibilità del paziente ai rispettivi allergeni.
Per l'incremento posologico va tenuto conto dell'individualità del paziente (vedere anche la rubrica «Aggiustamento della dose a causa di effetti indesiderati/interazioni»). L'iniezione è effettuata a livello sottocutaneo profondo, circa un palmo sopra l'olecrano.
Le iniezioni intracutanee, intramuscolari o intravascolari sono rigorosamente da evitare a causa del pericolo di shock anafilattico. Controllo tramite aspirazione!
Per evitare un'iniezione intravascolare, procedere a una cauta aspirazione prima dell'iniezione e durante l'iniezione dopo circa ogni 0,2 ml di soluzione somministrata. L'iniezione deve avvenire lentamente. Iniettare ad esempio 1 ml in 1 minuto.
Indicazioni posologiche
Il rispettivo dosaggio deve essere adeguato alla reazione del paziente e deve essere aumentato solo se la precedente iniezione è stata ben tollerata. In caso contrario e anche in caso di prolungata interruzione della terapia a causa di infezioni, vaccinazione, vacanze ecc., la dose deve essere ridotta (vedere i paragrafi «Aggiustamento della dose a causa di effetti indesiderati/interazioni» e «Somministrazione ritardata della dose»).
Durante la fase di avviamento, le iniezioni vengono di norma somministrate a distanza di 7-14 giorni nell'ambito dell'incremento posologico in 16 e 11 livelli. Per evitare accumuli, non effettuare iniezioni a un intervallo inferiore a 7 giorni.
Negli adulti e negli adolescenti è stata inoltre esaminata la sicurezza di un terzo schema con 7 livelli di incremento posologico e un intervallo di 7 giorni tra una somministrazione e l'altra (maggiori informazioni sul profilo di sicurezza di questo schema sono consultabili nella rubrica «Effetti indesiderati»).
Durante il trattamento di proseguimento, le iniezioni devono essere effettuate a intervalli di 4-8 settimane.
Lo scopo è aumentare gradualmente la dose fino al raggiungimento della dose massima tollerata, senza tuttavia superare 100'000 SQ-U (1 ml del flaconcino 4). Le seguenti raccomandazioni posologiche sono tuttavia da intendersi come direttiva generale.
Inizio della terapia
Trattamento iniziale
Comune avvio della terapia
L'avvio della terapia deve avvenire al di fuori della relativa stagione dei pollini e il trattamento iniziale deve essere possibilmente concluso prima dell'inizio della diffusione aerea dei pollini, cioè
•Alberi: giugno-settembre.
•Graminacee: ottobre-dicembre.
Incremento posologico in 16 livelli
Flaconcino n. | Concentrazione | N. iniezione | SQ-U | ml |
1 | 100 SQ-U/ml 100 SQ-U/ml 100 SQ-U/ml | 1 2 3 | 20 40 80 | 0,2 0,4 0,8 |
2 | 1'000 SQ-U/ml 1'000 SQ-U/ml 1'000 SQ-U/ml | 4 5 6 | 200 400 800 | 0,2 0,4 0,8 |
3 | 10'000 SQ-U/ml 10'000 SQ-U/ml 10'000 SQ-U/ml 10'000 SQ-U/ml 10'000 SQ-U/ml | 7 8 9 10 11 | 2'000 4'000 6'000 8'000 10'000 | 0,2 0,4 0,6 0,8 1,0 |
4 | 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml | 12 13 14 15 16 | 20'000 40'000 60'000 80'000 100'000 | 0,2 0,4 0,6 0,8 1,0 |
Incremento posologico in 11 livelli
Flaconcino n. | Concentrazione | N. iniezione | SQ-U | ml |
2 | 1'000 SQ-U/ml 1'000 SQ-U/ml | 1 2 | 100 300 | 0,1 0,3 |
3 | 10'000 SQ-U/ml 10'000 SQ-U/ml 10'000 SQ-U/ml | 3 4 5 | 1'000 3'000 6'000 | 0,1 0,3 0,6 |
4 | 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml | 6 7 8 9 10 11 | 10'000 20'000 40'000 60'000 80'000 100'000 | 0,1 0,2 0,4 0,6 0,8 1,0 |
Terapia di mantenimento
Trattamento di proseguimento
Per ottenere l'efficacia ottimale, la dose di mantenimento dovrebbe essere la massima dose tollerata, cioè la massima dose alla quale non si manifestano effetti indesiderati clinicamente rilevanti. Tale dose non deve superare 100'000 SQ-U. La dose di mantenimento ottimale è individuale e dipende dalla sensibilità del paziente all'allergene.
Le iniezioni vengono somministrate a intervalli di 4-8 settimane. Dopo il raggiungimento della dose di mantenimento, si consiglia di prolungare gradualmente l'intervallo di iniezione di 2 settimane e quindi di estendere l'intervallo a un periodo compreso tra 4 e 8 settimane.
Se, durante il trattamento di proseguimento, il paziente reagisce con reazioni allergiche serie, la dose deve essere adeguata (vedere il paragrafo «Aggiustamento della dose a causa di effetti indesiderati/interazioni»).
Adattamenti della dose durante il trattamento di proseguimento
In base alla fonte allergenica vengono impiegati diversi metodi di trattamento:
1. Trattamento perenne con dose di mantenimento costagionale ridotta: viene preso in considerazione per tutti i tipi di polline e consiste nel ridurre la dose dopo il raggiungimento della dose di mantenimento durante la stagione dei pollini a 1/5, riportandola alla dose di mantenimento precedentemente raggiunta dopo la stagione seguendo lo schema di dosaggio (vedere trattamento iniziale).
2. Trattamento prestagionale: anch'esso viene preso in considerazione per tutti i tipi di polline e consiste nell'interrompere il trattamento durante la stagione dei pollini. Dopo la stagione, il trattamento viene ripreso da capo e aumentato secondo lo schema di dosaggio (vedere trattamento iniziale) fino alla dose di mantenimento precedentemente raggiunta.
Passaggio a una nuova confezione ordinata
Al passaggio a un nuovo flaconcino ordinato per il trattamento di proseguimento, devono inizialmente essere somministrati 2/3 della dose precedentemente raggiunta e, in caso di buona tollerabilità, somministrare il resto della dose dopo 15 minuti, per evitare eventuali oscillazioni di potenza dovute alla conservazione. Nel caso di allergeni SQ non è necessaria una riduzione generale della dose.
Trattamento simultaneo con 2 diverse soluzioni di iposensibilizzazione
Il possibile rischio di reazioni allergiche iniziando il trattamento simultaneo con più di un allergene deve essere valutato individualmente.
Nel trattamento simultaneo con più di una specifica soluzione allergenica, le iniezioni devono essere somministrate in punti separati a un intervallo di almeno 30 minuti per poter interpretare correttamente le reazioni locali.
Durata della terapia
Il trattamento con i preparati Alutard SQ deve essere eseguito per almeno 3 anni.
Aggiustamento della dose a causa di effetti indesiderati/interazioni
Se, durante il trattamento iniziale o di proseguimento, una reazione nel sito di iniezione permane per oltre 6 ore dopo l'iniezione, la dose successiva deve essere ridotta in base alle dimensioni del gonfiore secondo le raccomandazioni della tabella «Riduzione della dose in caso di gonfiore nel sito di iniezione».
Riduzione della dose in caso di gonfiore nel sito di iniezione
Diametro massimo del gonfiore | Dose successiva | |||
Bambini | Adulti | |||
<5 cm | <8 cm | Trattamento iniziale: aumentare la dose in base allo schema posologico Trattamento di proseguimento: ripetere l'ultima dose somministrata | ||
5-7 cm | 8-12 cm | ripetere l'ultima dose somministrata | ||
7-12 cm | 12-20 cm | ridurre la dose di 1 gradino | ||
12-17 cm | >20 cm | ridurre la dose di 2 gradini | ||
>17 cm | ridurre la dose di 3 gradini | |||
Se, durante il trattamento iniziale o di proseguimento, dopo un'iniezione si verifica una reazione sistemica seria, il trattamento deve essere proseguito solo dopo attenta verifica. Se si prosegue il trattamento, la dose successiva deve essere ridotta al 10% della dose che ha provocato la reazione. Questa dose ridotta può essere suddivisa in due singole dosi da somministrare a un intervallo di 30 minuti. Dopo l'iniezione, il paziente deve essere sorvegliato e la dose deve essere aumentata in base alle linee guida di dosaggio per il trattamento iniziale, fino al raggiungimento della dose massima tollerata.
Somministrazione ritardata della dose
Durante il trattamento iniziale
Se, in casi eccezionali, viene superato un intervallo di 14 giorni tra le iniezioni, la dose non deve essere ulteriormente aumentata, ma adeguata come indicato di seguito.
Riduzione della dose dopo interruzione della terapia
Durata dell'intervallo | Riduzione consigliata della dose |
<2 settimane | aumentare la dose in base allo schema posologico |
2-3 settimane | ripetere l'ultima dose somministrata |
3-4 settimane | ridurre la dose al 50% dell'ultima dose somministrata |
>4 settimane | iniziare il trattamento da capo |
Durante il trattamento di proseguimento
Riduzione della dose in caso di superamento dell'intervallo temporale tra due iniezioni durante il trattamento di proseguimento
Durata dell'intervallo | Riduzione consigliata della dose |
<8 settimane | nessuna variazione |
8-10 settimane | ridurre la dose al 75% dell'ultima dose somministrata |
10-12 settimane | ridurre la dose al 50% dell'ultima dose somministrata |
12-14 settimane | ridurre la dose al 25% dell'ultima dose somministrata |
14-16 settimane | ridurre la dose al 10% dell'ultima dose somministrata |
>16 settimane | iniziare il trattamento da capo |
In caso di riduzione della dose durante il trattamento di proseguimento, il paziente deve essere attentamente sorvegliato dopo l'iniezione. La dose deve quindi essere aumentata in base alle linee guida di dosaggio per il trattamento iniziale, fino al raggiungimento della dose di mantenimento.
Bambini e adolescenti
I bambini di età inferiore a 5 anni non sono di norma idonei all'immunoterapia allergene specifica, in quanto in questa fascia di età sono più probabili problemi di accettazione e cooperazione rispetto agli adulti.
Per quanto riguarda l'efficacia nei bambini >5 anni, sono disponibili solo pochi dati clinici e l'efficacia non è dimostrata. I dati relativi alla sicurezza non mostrano tuttavia un rischio maggiore rispetto agli adulti.
Controindicazioni
•Ipersensibilità a una qualsiasi delle sostanze ausiliarie secondo la composizione.
•Pazienti con malattie autoimmuni sistemiche in atto e pazienti con difetti immunitari o immunodeficienze.
•Patologie infiammatorie croniche gravi.
•Pazienti con patologie tumorali maligne con valore di malattia.
•Cambiamenti secondari irreversibili dell'organo interessato dalla reazione (ad es. enfisema, bronchiectasia).
•Insufficienza renale cronica grave (accumulo di alluminio).
•Pazienti con asma non controllata o FEV1<70% del valore predittivo negli adulti (a seguito di adeguata terapia farmacologica) e FEV1<80% del valore predittivo nei bambini e negli adolescenti (a seguito di adeguata terapia farmacologica).
•Pazienti che hanno avuto una grave esacerbazione dell'asma negli ultimi 3 mesi.
Avvertenze e misure precauzionali
Dopo ogni iniezione, il paziente deve rimanere sotto osservazione per almeno 30 minuti, per poi essere sottoposto a valutazione medica. Reazioni allergiche sistemiche gravi A causa del rischio di reazioni anafilattiche gravi, deve essere immediatamente disponibile un ampio equipaggiamento strumentale e farmaceutico atto alla rianimazione. Ciò include adrenalina da iniettare e personale con adeguata formazione. Se si presentano i sintomi di una reazione sistemica, come ad es. orticaria, angioedema o asma grave, il trattamento sintomatico va avviato immediatamente. |
Il trattamento deve essere esclusivamente eseguito da un medico che abbia esperienza nell'applicazione di una immunoterapia specifica.
Durante il trattamento con Alutard SQ i pazienti vengono esposti ad allergeni che possono indurre reazioni allergiche locali e/o sistemiche. Nel trattamento delle reazioni allergiche sistemiche gravi l'adrenalina è la prima scelta (di norma iniezione di 0,01 mg/kg nella muscolatura della coscia).
Poiché l'adrenalina è raccomandata per il trattamento delle reazioni collaterali di tipo allergico, è necessario rispettare le avvertenze e le misure precauzionali nonché le controindicazioni che la riguardano.
Trattamento a lungo termine con medicamenti:
L'effetto dell'adrenalina può essere potenziato nei pazienti trattati con antidepressivi triciclici, inibitori delle monoaminossidasi (inibitori MAO) e/o inibitori delle COMT, con conseguenze potenzialmente fatali. L'efficacia dell'adrenalina può risultare ridotta nei pazienti trattati con betabloccanti. Durante un trattamento del paziente con antipertensivi, l'effetto vasodilatatore dell'istamina può essere potenziato, con conseguente aumento delle reazioni anafilattiche. Prima di un'iniezione, verificare per il singolo paziente la necessità di interrompere un eventuale trattamento con ACE-inibitori, in quanto sussiste un rischio teorico di vasodilatazione a causa dell'inibizione del metabolismo dell'angiotensina, il che può ostacolare il trattamento con l'adrenalina.
Trattamento degli effetti indesiderati (raccomandazioni in base alla direttiva EAACI sull'immunoterapia del 2006):
Sintomi | Terapia adulti | Terapia bambini |
Estesa reazione locale (>12 cm dopo 30 min.) | antistaminico orale; corticosteroidi topici; osservazione per almeno 60 minuti | antistaminico orale; corticosteroidi topici; osservazione per almeno 60 minuti |
rinite | antistaminico orale; osservazione per almeno 60 minuti e ripetizione peak flow. | antistaminico orale; osservazione per almeno 60 minuti e ripetizione peak flow. |
lieve orticaria | antistaminico orale o parenterale; osservazione per almeno 60 minuti | antistaminico orale o parenterale; osservazione per almeno 60 minuti |
asma | β-2 agonista per inalazione; β-2 agonista e.v./s.c.; ossigeno; corticosteroidi (prednisolone 50 mg o metilprednisolone 40 mg e.v.); teofillina; prendere in considerazione l'ospedalizzazione. | β-2 agonista per inalazione; β-2 agonista e.v./s.c.; ossigeno; corticosteroidi (metilprednisolone 2 mg/kg e.v.); teofillina; prendere in considerazione l'ospedalizzazione. |
reazioni sistemiche | adrenalina (1 mg/ml) 0,3-0,5 mg i.m. in profondità. | adrenalina (1 mg/ml) 0,005 mg/kg i.m. in profondità. |
orticaria generalizzata, angioedema | accesso e.v. (soluzione fisiologica 0,9%); controllare la pressione sanguigna e il polso; antistaminico i.m.; corticosteroidi (prednisolone 50 mg o metilprednisolone 40 mg e.v.); prendere in considerazione l'ospedalizzazione. | accesso e.v. (soluzione fisiologica 0,9%); controllare la pressione sanguigna e il polso; antistaminico i.m.; corticosteroidi (metilprednisolone 2 mg/kg e.v.); prendere in considerazione l'ospedalizzazione. |
shock anafilattico | adrenalina (1 mg/ml) 0,5-0,8 mg i.m. in profondità o (diluita a 0,1 mg/ml) 0,3-0,5 mg e.v. (lentamente a dosi frazionate), può essere ripetuta dopo 10-20 min.; accesso e.v. (soluzione fisiologica 0,9%); portare il paziente in posizione supina; ossigeno 5-10 l/min.; controllare la pressione sanguigna, il polso e la saturazione di ossigeno; antistaminico e.v.; metilprednisolone 80 mg e.v.; ospedalizzazione necessaria a causa del rischio di shock ritardato. | adrenalina (1 mg/ml) 0,01 mg/kg (corrispondente a 0,01 mg/kg) i.m. in profondità o se necessario (diluita a 0,1 mg/ml) e.v. (lentamente a dosi frazionate); accesso e.v. (soluzione fisiologica 0,9%); portare il paziente in posizione supina; ossigeno; controllare la pressione sanguigna, il polso e la saturazione di ossigeno; antistaminico i.m.; corticosteroidi (metilprednisolone 2 mg/kg e.v.); ospedalizzazione necessaria a causa del rischio di shock ritardato. |
I pazienti affetti da patologie cardiache possono eventualmente presentare un rischio aumentato in caso di reazioni allergiche sistemiche gravi. Le esperienze cliniche con l'uso di Alutard SQ nei pazienti cardiopatici sono limitate. Questo fattore deve essere preso in considerazione prima dell'inizio di un'immunoterapia allergene specifica.
Asma
L'asma è un noto fattore di rischio per le reazioni allergiche sistemiche gravi.
Le esperienze cliniche con l'uso di Alutard SQ nei pazienti asmatici sono limitate.
Nei pazienti con storia di asma i sintomi dell'asma devono essere stati adeguatamente controllati negli ultimi 3 mesi prima dell'inizio del trattamento con Alutard SQ.
Lo stato del paziente asmatico deve essere esaminato prima di ogni iniezione. L'iniezione dell'allergene prescelto per la terapia deve essere rimandata se nella settimana precedente alla data prevista per l'iniezione lo stato asmatico del paziente non era completamente controllato.
I pazienti con storia di asma devono essere informati della necessità di consultare immediatamente un medico in caso di improvviso peggioramento dell'asma.
Nei pazienti con storia di asma e infezione acuta alle vie respiratorie l'avvio della terapia con Alutard SQ deve essere posticipato fino alla risoluzione dell'infezione.
Patologie autoimmuni in remissione
Sono disponibili solo dati limitati sull'immunoterapia allergene specifica in pazienti affetti da patologie autoimmuni in remissione. Alutard SQ dovrebbe quindi essere prescritto con cautela in questi pazienti.
Accumulo di alluminio
Poiché Alutard SQ contiene alluminio, esiste teoricamente un rischio di accumulo di alluminio in pazienti ad alto rischio (ad es. nei pazienti con compromissione della funzionalità renale e nei pazienti sottoposti a trattamento concomitante con preparati contenenti alluminio (ad es. antiacidi)). Questo deve essere preso in considerazione quando si inizia una terapia con Alutard SQ.
Bambini e adolescenti
I bambini di età inferiore a 5 anni di norma non sono considerati candidati idonei a un'immunoterapia allergene specifica e devono essere trattati soltanto in particolari eccezioni e non di routine. Un'attenzione particolare deve essere rivolta alla valutazione del rischio-beneficio nel trattamento di bambini di età inferiore a 5 anni. Per quanto riguarda l'efficacia nei bambini a partire dai 5 anni, sono disponibili pochi dati clinici. I dati relativi alla sicurezza non suggeriscono un rischio maggiore rispetto a quello rilevato negli adulti. Lo schema di incremento posologico in 7 livelli non è stato esaminato nei bambini di età inferiore a 12 anni.
Uso concomitante di altre immunoterapie allergene specifiche
Non sono disponibili dati clinici sull'uso concomitante di altre immunoterapie allergene specifiche.
Terapia in corso:
L'iniezione deve essere differita se:
•il paziente presenta febbre o segni di infezione acuta o cronica.
•il paziente presenta una funzione polmonare chiaramente ridotta (peak flow o FEV1 ≤70% del valore normale del paziente negli adulti e FEV1<80% del valore normale del paziente nei bambini e negli adolescenti) o presenta sintomi indicatori di un'esacerbazione dell'asma.
•il paziente presenta un peggioramento della dermatite atopica di cui soffre.
•nel corso dell'ultima settimana è stato effettuato un vaccino protettivo o se questo verrà effettuato nella settimana successiva all'iniezione di Alutard SQ.
Prima dell'iniezione:
•Nel giorno dell'iniezione il paziente deve evitare sollecitazioni fisiche, docce molto calde, saune e alcool, poiché questi fattori concomitanti potrebbero aggravare un'eventuale anafilassi.
•Lo stato asmatico dei pazienti con storia di asma deve essere valutato prima di ogni iniezione attraverso la misurazione del peak flow e della funzionalità polmonare (vedere la rubrica «Controindicazioni»).
•Devono essere valutati anche lo stato di salute e lo stato allergico del paziente, così come qualsiasi modifica nell'assunzione di altri medicamenti avvenuta dopo l'iniezione precedente.
•Le reazioni allergiche (locali e/o sistemiche) manifestatesi dopo l'iniezione precedente devono essere annotate e la dose va aggiustata di conseguenza (vedere la rubrica «Posologia/impiego»).
•Prima di ogni iniezione è necessario controllare due volte l'allergene indicato, la concentrazione, il volume e l'ultima data di iniezione (intervallo di dose).
•Alutard SQ deve essere somministrato per via sottocutanea. Evitare la somministrazione intravascolare (aspirazione) a causa del rischio aumentato di reazioni allergiche.
Dopo ogni iniezione:
•Il paziente deve essere informato che, in caso di reazione ritardata sistemica grave, deve rivolgersi immediatamente a un medico o al pronto soccorso.
•Il paziente deve essere informato della necessità di informare il medico curante durante la visita successiva in merito a qualsiasi reazione ritardata locale o sistemica.
•Ogni reazione allergica (locale e/o sistemica) deve essere documentata prima che il paziente lasci la struttura medica.
Questo medicamento contiene meno di 1 mmol (23 mg) di sodio per iniezione, cioè è essenzialmente «senza sodio».
Interazioni
Non sono stati condotti studi di interazione nell'uomo. Non è noto se il trattamento con Alutard SQ interagisca con vaccini protettivi.
Il trattamento concomitante con medicinali sintomatici antiallergici, corticosteroidi o stabilizzatori dei mastociti può aumentare il livello di tolleranza del paziente nei confronti del trattamento dell'immunoterapia specifica. Questo dovrebbe essere tenuto in considerazione al momento dell'interruzione di questi medicamenti.
Per informazioni sull'uso concomitante di inibitori MAO, inibitori delle COMPT, betabloccanti e antiacidi, vedere la rubrica «Avvertenze e misure precauzionali».
Gravidanza/Allattamento
Gravidanza
Non sono disponibili dati sufficienti sull'utilizzo in gravidanza. Non sono disponibili sufficienti dati sperimentali sugli animali. I rischi potenziali per l'uomo non sono noti.
È vietato somministrare il medicamento durante la gravidanza, a meno che non ciò non sia inequivocabilmente necessario.
Allattamento
Non sono disponibili dati clinici sull'uso durante l'allattamento. Durante l'allattamento Alutard SQ deve essere usato solo a seguito di un'attenta valutazione individuale del rischio-beneficio.
Fertilità
Non sono disponibili dati clinici sull'effetto di Alutard SQ sulla fertilità.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Dopo l'iniezione, in alcuni pazienti può occasionalmente manifestarsi una leggera stanchezza che può compromettere la capacità di guidare veicoli e la capacità di utilizzare macchine.
Effetti indesiderati
Riassunto del profilo di sicurezza
Generalmente le reazioni associate a trattamenti con Alutard SQ sono reazioni immunologiche (locali e/o sistemiche) ai rispettivi allergeni. I sintomi di una reazione precoce si manifestano entro i primi 30 minuti dall'iniezione. I sintomi di una reazione ritardata si manifestano di norma entro 24 ore dall'iniezione.
Effetti indesiderati riportati molto comunemente nei pazienti trattati con Alutard SQ sono reazioni locali nel sito di iniezione.
Elenco degli effetti collaterali
Gli effetti indesiderati vengono suddivisi in base alla frequenza secondo la convenzione MedDRA: molto comune (≥1/10), comune (≥1/100, <1/10), non comune (≥1/1'000, <1/100), raro (≥1/10'000, <1/1'000), molto raro (<1/10'000). Le frequenze si basano su uno studio clinico con Alutard SQ Phleum pratense e su uno studio clinico con Alutard SQ miscela di 6 graminacee e segale, acari della polvere e betulla, essendo il profilo di sicurezza generale simile per i diversi preparati di Alutard SQ.
Disturbi del sistema immunitario | |
Comune: | Reazione anafilattica |
Non comune: | Shock anafilattico |
Patologie dell'occhio | |
Comune: | Congiuntivite |
Non comune: | Edema della palpebra |
Patologie vascolari | |
Comune: | Rossore |
Patologie dell'orecchio e del labirinto | |
Comune: | Prurito auricolare, vertigini |
Patologie respiratorie, toraciche e mediastiniche | |
Comune: | Respiro sibilante, tosse, dispnea, asma, congestione nasale, rinite allergica, starnuti, irritazione della gola, rinorrea, prurito nasale |
Patologie gastrointestinali | |
Comune: | Dolore addominale, diarrea, vomito, nausea, dispepsia |
Patologie della cute e del tessuto sottocutaneo | |
Comune: | Orticaria, prurito, eruzione cutanea, eritema, eczema |
Non comune: | Tumefazione del viso |
Patologie sistemiche e condizioni relative alla sede di somministrazione | |
Molto comune: | Reazioni nella sede di iniezione* |
Comune: | Malessere, stanchezza, brividi, sensazione di calore, sensazione di corpo estraneo |
* Le reazioni in sede di iniezione includono eventi quali prurito/ tumefazione/ orticaria/ eritema/ noduli/ dolore/ lividi/ ematoma/ indurimento/ infiammazione/ edema/ eruzione cutanea/ calore/ alterazione del colore/ papula in sede di iniezione, edema localizzato, dolore in sede di somministrazione.
Dai dati di uno studio sull'incremento posologico in 7 livelli emerge un lieve aumento del rischio di sintomi oculari quali tumefazione degli occhi e prurito oculare, nonché di reazioni cutanee quali eritema, eruzione cutanea e orticaria nell'incremento posologico rapido (7 livelli rispetto a 11).
Effetti indesiderati dopo l'introduzione sul mercato
I dati provenienti dall'esperienza dopo l'introduzione sul mercato sono inclusi nel seguente elenco con la frequenza «Non nota» (la frequenza non può essere definita sulla base dei dati disponibili).
Patologie del sistema nervoso | |
Non nota: | Capogiro, parestesia |
Patologie cardiache | |
Non nota: | Palpitazioni, tachicardia, cianosi |
Patologie vascolari | |
Non nota: | Ipotensione, pallore |
Patologie respiratorie, toraciche e mediastiniche | |
Non nota: | Broncospasmo, sensazione di costrizione alla gola |
Patologie della cute e del tessuto sottocutaneo | |
Non nota: | Angioedema |
Patologie del sistema muscoloscheletrico e del tessuto connettivo | |
Non nota: | Tumefazione articolare, artralgia |
Patologie sistemiche e condizioni relative alla sede di somministrazione | |
Non nota: | Fastidio al torace, ipertricosi in sede di iniezione |
Descrizione di alcuni effetti collaterali
Reazioni locali
Le reazioni locali si manifestano nel sito di iniezione e includono gonfiore nel sito di iniezione, arrossamento, dolore, prurito, alterazione del colore ed ematomi. Le reazioni locali possono essere trattate con medicamenti sintomatici, come ad es. gli antistaminici.
Il contenuto di alluminio può contribuire al manifestarsi di effetti collaterali locali, tra cui un patch test cutaneo positivo per l'alluminio.
Reazioni allergiche sistemiche
Le reazioni sistemiche comprendono qualsiasi sintomo a carico di organi lontani dalla sede di iniezione.
Le reazioni allergiche sistemiche sono di norma da lievi a moderate e possono essere trattate con medicamenti sintomatici, come ad es. gli antistaminici. Le reazioni allergiche sistemiche possono andare dalla rinite allergica fino allo shock anafilattico. Il trattamento di una reazione sistemica grave deve essere avviato immediatamente.
I sintomi possono comprendere orticaria, angioedema, broncospasmo, stanchezza, dispnea, senso di costrizione toracica e rossore, ma non si limitano a questi. Altre reazioni immediate possono essere: rinite, rinorrea, tosse, starnuti, congiuntivite e asma. Queste reazioni possono anche manifestarsi come reazioni ritardate. Ulteriori reazioni ritardate sono: cefalea, prurito, malessere generale.
Se queste reazioni sono forti e di tipo generalizzato, il paziente deve immediatamente rivolgersi al proprio medico o a chi ne fa le veci. In ogni caso, prima dell'iniezione successiva, il paziente deve informare il medico curante delle reazioni manifestatesi successivamente.
Reazioni allergiche sistemiche gravi
Una reazione allergica sistemica grave è una reazione potenzialmente fatale che generalmente si manifesta entro pochi minuti dall'esposizione del paziente all'allergene. I sintomi indicatori di una reazione allergica sistemica grave possono includere sensazione di calore, fastidio diffuso, ipotonia, tachicardia, dispnea, tosse, respiro sibilante, rossore, fastidio al torace, dolore addominale, vomito, diarrea, eruzione cutanea, prurito e orticaria, ma non si limitano a questi.
Una reazione allergica sistemica grave, quale uno shock anafilattico, generalmente si sviluppa rapidamente entro pochi minuti dall'iniezione e richiede un trattamento immediato ad es. con adrenalina e/o un altro trattamento anafilattico. Deve essere avviata una terapia conforme alle linee guida attuali relative al trattamento dello shock.
Se si manifestano estese reazioni locali e reazioni sistemiche è necessario effettuare una valutazione del trattamento (vedere «Posologia/impiego»).
Durante il trattamento può verificarsi il peggioramento di una dermatite atopica pre-esistente.
Bambini e adolescenti
Per quanto riguarda l'efficacia nei bambini a partire dai 5 anni, sono disponibili pochi dati clinici. I dati relativi alla sicurezza non suggeriscono un rischio maggiore rispetto a quello rilevato negli adulti. I bambini di età inferiore a 5 anni di norma non sono considerati candidati idonei a un'immunoterapia allergene specifica. Un'attenzione particolare deve essere rivolta alla valutazione del rischio-beneficio nel trattamento di bambini di età inferiore a 5 anni.
Altri gruppi di pazienti speciali
Non sono disponibili dati di studi clinici relativi agli effetti collaterali in altri gruppi di pazienti.
Sicurezza dell'incremento posologico più rapido
Per gli adulti e gli adolescenti è stato esaminato uno schema di incremento posologico più rapido con 7 iniezioni. Le 7 iniezioni sono state somministrate a intervalli di 7 ± 2 giorni.
Flaconcino n. | Concentrazione | N. iniezione | SQ-U | ml |
2 | 1'000 SQ-U/ml | 1 | 300 | 0,3 |
3 | 10'000 SQ-U/ml 10'000 SQ-U/ml | 2 3 | 2'000 5'000 | 0,2 0,5 |
4 | 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml 100'000 SQ-U/ml | 4 5 6 7 | 10'000 30'000 60'000 100'000 | 0,1 0,3 0,6 1,0 |
Nell'ambito di questo incremento posologico in 7 livelli non sono emersi nuovi segnali di sicurezza.
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-benefico del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o serio effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Se è stata iniettata una dose superiore a quella prevista, aumenta il rischio di effetti collaterali, tra cui il rischio di una reazione allergica sistemica o di reazioni allergiche locali gravi. Il paziente deve essere monitorato e queste reazioni vanno trattate con adeguati medicamenti sintomatici.
Proprietà/Effetti
Codice ATC
V01AA
Meccanismo d'azione
Alutard SQ agisce a incrementi della dose – in base alle linee guida per il dosaggio – inducendo una prolungata insensibilità o sensibilità ridotta nei confronti di uno specifico allergene scatenante.
L'adsorbimento su idrossido di alluminio produce per iniezione sottocutanea un lento assorbimento dell'estratto allergenico, determinando una iposensibilizzazione cauta e ben tollerata.
Farmacodinamica
Il prodotto determina una iposensibilizzazione dei pazienti allergici. Il meccanismo non è ancora noto in dettaglio. L'effetto farmacodinamico mira al sistema immunitario, dove si ottiene in particolare una reazione ritardata nei confronti del rispettivo allergene, ma non nei confronti di altri allergeni. Alutard SQ serve per il trattamento di pazienti con allergie mediate dalle IgE. L'effetto farmacodinamico mira al sistema immunitario, con riduzione specifica della reazione nei confronti dell'allergene con cui il paziente viene trattato. Alutard SQ interessa e compromette la migrazione dei linfociti T e dei granulociti eosinofili verso gli organi target. Il rapporto tra le citochine Th2 e Th1 viene spostato in favore delle citochine Th1. Aumenta, inoltre, la velocità di sintesi dell'IL-10, che produce tra l'altro un'anergia dei linfociti T. A causa della minore quantità di granulociti basofili ricircolanti nel sangue periferico, viene inoltre ridotto il rilascio di istamina.
Efficacia clinica
Nell'ambito di un trattamento costagionale con precedente incremento posologico in 15 livelli, uno studio randomizzato in doppio cieco, controllato con placebo ha evidenziato per il trattamento con 100'000 SQ di pollini di graminacee di Alutard SQ una riduzione sia dei sintomi costagionali sia del consumo costagionale di medicamenti rispetto al placebo. Uno studio clinico aperto con Alutard SQ graminacee e Alutard SQ Betula verrucosa indica che Alutard SQ potrebbe avere un effetto a lungo termine e che il medicamento sia in grado di impedire la progressione della rinite allergica in asma allergica nei bambini (evidenza clinica non confermata). Anche un'indagine di follow-up di 7 anni indica un possibile effetto a lungo termine di Alutard SQ graminacee (evidenza clinica non confermata).
Farmacocinetica
Assorbimento
Per la maggior parte, gli allergeni in Alutard SQ sono polipeptidi e proteine. È previsto che vengano scomposti in polipeptidi corti e aminoacidi. Ne consegue che gli allergeni contenuti in Alutard SQ non vengono assorbiti in quantità significativa nel sistema vascolare. Non sono stati effettuati studi farmacocinetici su animali o studi clinici che abbiano studiato il profilo farmacocinetico e il metabolismo di Alutard SQ.
L'adsorbimento dell'allergene all'idrossido di allumino può provocare un lento rilascio nel sito di iniezione. Nel caso di iniezione sottocutanea, l'allergene viene rilasciato lentamente, riducendo l'allergenicità e avendo come conseguenza una stimolazione prolungata del sistema immunitario.
Distribuzione
Nessun dato.
Metabolismo
Nessun dato.
Eliminazione
Nessun dato.
Dati preclinici
I dati preclinici sono limitati. Gli studi convenzionali sulla tossicità per somministrazione ripetuta a roditori, sulla genotossicità e sulla tossicità per la riproduzione (sviluppo embrio-fetale) non evidenziano alcun rischio particolare per l'essere umano. Gli studi sono stati condotti con il principio attivo senza formulazione, ossia con l'estratto allergenico senza adiuvanti e sostanze ausiliarie. Non sono attese interazioni delle sostanze ausiliarie con i principi attivi. Non sono stati effettuati studi di cancerogenicità.
Altre indicazioni
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazioni particolari concernenti l'immagazzinamento
Conservare in frigorifero (2-8°C). Non congelare.
Conservare il contenitore nella scatola originale per proteggere il contenuto dalla luce.
Conservare fuori dalla portata dei bambini.
Non utilizzare soluzioni congelate e poi scongelate o con presenza di precipitato (precipitazione irreversibile a grandi fiocchi)!
Indicazioni per la manipolazione
Prima dell'uso, capovolgere delicatamente il flaconcino per 10-20 volte.
Non iniettare per via intravascolare! Aspirare!
Le indicazioni per la manipolazione dei flaconcini ed esecuzione dell'iniezione sono disponibili alla fine dell'Informazione professionale.
Numero dell'omologazione
60695, 60702, 60708, 60711 (Swissmedic).
Titolare dell’omologazione
ALK-Abelló AG, Volketswil.
Stato dell'informazione
Maggio 2020
Indicazioni per la manipolazione dei flaconcini ed esecuzione dell'iniezione
Prima dell'uso, osservare «Posologia/impiego» e «Avvertenze e misure precauzionali». | ||
1 |
| Prelevare il flaconcino dalla confezione. Prima di ogni iniezione, controllare due volte l'allergene indicato, la concentrazione, il volume e l'ultima data di iniezione (intervallo di dose). Controllare: •I dati del paziente •La composizione allergenica •La concentrazione (potenza) •La data di scadenza |
2 |
| Capovolgere delicatamente il flaconcino per 10-20 volte. Non utilizzare soluzioni congelate e poi scongelate o con presenza di precipitato (precipitazione irreversibile a grandi fiocchi)! |
3 |
| Disinfettare il tappo in gomma e perforarlo con una siringa monouso sterile da 1 ml. Chiedere al/alla paziente: •Stato generale •Assunzione di medicamenti •Sintomatologia allergica attuale •Tollerabilità dell'iniezione precedente |
4 |
| Iniezione ben tollerata: Incremento o mantenimento della dose in base alle linee guida di dosaggio Iniezione mal tollerata o altre restrizioni: Riduzione della dose in base alle linee guida di dosaggio |
5 |
| Prelevare il volume corrispondente. Regolare in modo esatto la dose di iniezione (evitare bolle d'aria!). |
6 |
| Pulire e disinfettare il sito di infezione, quindi: •Sollevare un lembo di cute circa un palmo sopra l'olecrano. •Evitare l'iniezione intravascolare! Aspirare! •Iniettare lentamente per via sottocutanea. |
7 | Sorvegliare i pazienti per almeno 30 minuti dopo l'iniezione! Eventualmente consegnare medicamenti (ad es. antistaminici) per il trattamento delle reazioni ritardate. | |
Composition
Principes actifs
Graminées
•Alutard SQ Mélange de 6 graminées et seigle:
extrait allergénique de pollen: fleurs de graminées (Avena elatior, Dactylis glomerata, Festuca pratensis, Phleum pratense, Poa pratensis, Lolium perenne) et seigle
•Alutard SQ Phleum pratense: extrait allergénique de pollen (Phleum pratense)
Arbres
•Alutard SQ mélange d'arbres précoces: extrait allergénique de pollen (Alnus glutinosa, Betula verrucosa, Corylus avellana)
•Alutard SQ Betula verrucosa: extrait allergénique de pollen (Betula verrucosa)
Excipients
Aluminium ut Aluminii hydroxidum hydricum ad adsorptionem, Natrii chloridum, Natrii hydrogenocarbonas, Natrii hydroxidum q.s., Phenolum 5,0 mg, Aqua ad iniectabilia q.s. ad suspensionem pro 1 ml corresp. Natrium 2,18-2,64 mg.
Forme pharmaceutique et quantité de principe actif par unité
Suspension injectable dépôt par voie sous-cutanée.
La suspension injectable contient des extraits allergéniques de pollen de graminées ou de pollen d'arbres.
Flacon n° (couleur de l'étiquette) | Concentration (SQ-U/ml) |
1 (grise) | 100 |
2 (verte) | 1 000 |
3 (orange) | 10 000 |
4 (rouge) | 100 000 |
Un flacon contient 5 ml de suspension injectable.
La puissance est exprimée en unités-SQ (SQ-U) qui correspond à la quantité absolue (ng) d'allergènes dits majeurs. En outre, une activité biologique homogène est garantie d'un lot à l'autre.
La turbidité d'Alutard SQ est différente en fonction de la composition en allergènes de chaque extrait.
Indications/Possibilités d’emploi
Alutard SQ est une immunothérapie spécifique pour le traitement de la rhinite allergique et la conjonctivite allergique causées par le pollen de graminées, de céréales ou d'arbres, avec un prick-test positif et/ou un test IgE spécifique positif pour les allergènes pertinents du pollen correspondant.
Posologie/Mode d’emploi
Le traitement est composé d'un traitement initial et d'un traitement d'entretien. L'évaluation et la pose de l'indication doivent être effectuées par un médecin formé en allergologie. Le médecin doit maîtriser les mesures usuelles de réanimation.
Après chaque injection, surveillez le patient pendant au moins 30 minutes, et les patients très sensibles pendant au moins 60 minutes durant le traitement initial.
Il faut toujours garder à portée de main des médicaments d'urgence pour le traitement d'un choc anaphylactique.
La dose d'Alutard SQ doit être adaptée individuellement. La posologie est à déterminer en fonction de l'état général, des antécédents allergiques et de la sensibilité du patient à l'allergène employé.
Le patient doit être pris en compte lors de l'augmentation posologique (voir également la section « Ajustement de la posologie du fait d'effets indésirables / d'interactions »). L'injection est administrée par voie sous-cutanée en profondeur dans le bras, une largeur de main au-dessus de l'olécrâne.
En raison du risque de choc anaphylactique, il faut absolument éviter les injections intracutanées, intramusculaires ou intravasales. Contrôler par aspiration!
Pour éviter une injection intravasale, il faut aspirer attentivement avant l'injection et de même pendant l'injection, chaque fois après l'administration de 0,2 ml de solution. L'injection doit être administrée lentement, injecter 1 ml pendant 1 minute par exemple.
Directives posologiques
La posologie doit être adaptée aux réactions individuelles du patient et ne peut être augmentée qu'en cas de parfaite tolérance à l'injection précédente. Autrement et en cas d'interruption du traitement (p.ex. pour cause d'infection, de vaccination, de vacances), la dose doit être réduite (voir rubriques «Ajustement de la posologie du fait d'effets indésirables / d'interactions» et «Prise retardée»).
Les injections sont généralement administrées à des intervalles de 7 à 14 jours durant la phase de titration avec augmentation posologique à 16 paliers et à 11 paliers. Pour éviter le risque de cumulation, un intervalle de moins de 7 jours ne doit pas être dépassé.
Chez les adultes et les adolescents, la sécurité d'un troisième schéma avec augmentation posologique à 7 paliers et intervalle posologique de 7 jours a également été étudiée (de plus amples informations sur le profil de sécurité de ce schéma posologique sont disponibles dans la section « Effets indésirables »).
Durant le traitement d'entretien, les injections sont pratiquées à intervalles de 4 à 8 semaines.
L'objectif est d'augmenter progressivement la dose jusqu'à ce que la dose maximale tolérée soit atteinte, sans toutefois dépasser 100 000 SQ-U (1 ml du flacon 4). Les recommandations posologiques suivantes sont à considérer comme des recommandations générales.
Instauration du traitement
Traitement initial
Instauration habituelle du traitement
Le traitement ne doit être instauré qu'après la saison des pollens responsables de l'allergie. Si possible, le traitement initial doit être terminé avant le vol pollinique, soit:
•Arbres: juin–septembre
•Graminées: octobre–décembre
Augmentation posologique à 16 paliers
Flacon n° | Concentration | Injection n° | SQ-U | ml |
1 | 100 SQ-U/ml 100 SQ-U/ml 100 SQ-U/ml | 1 2 3 | 20 40 80 | 0,2 0,4 0,8 |
2 | 1 000 SQ-U/ml 1 000 SQ-U/ml 1 000 SQ-U/ml | 4 5 6 | 200 400 800 | 0,2 0,4 0,8 |
3 | 10 000 SQ-U/ml 10 000 SQ-U/ml 10 000 SQ-U/ml 10 000 SQ-U/ml 10 000 SQ-U/ml | 7 8 9 10 11 | 2 000 4 000 6 000 8 000 10 000 | 0,2 0,4 0,6 0,8 1,0 |
4 | 100 000 SQ-U/ml 100 000 SQ-U/ml 100 000 SQ-U/ml 100 000 SQ-U/ml 100 000 SQ-U/ml | 12 13 14 15 16 | 20 000 40 000 60 000 80 000 100 000 | 0,2 0,4 0,6 0,8 1,0 |
Augmentation posologique à 11 paliers
Flacon n° | Concentration | Injection n° | SQ-U | ml |
2 | 1 000 SQ-U/ml 1 000 SQ-U/ml | 1 2 | 100 300 | 0,1 0,3 |
3 | 10 000 SQ-U/ml 10 000 SQ-U/ml 10 000 SQ-U/ml | 3 4 5 | 1 000 3 000 6 000 | 0,1 0,3 0,6 |
4 | 100 000 SQ-U/ml 100 000 SQ-U/ml 100 000 SQ-U/ml 100 000 SQ-U/ml 100 000 SQ-U/ml 100 000 SQ-U/ml | 6 7 8 9 10 11 | 10 000 20 000 40 000 60 000 80 000 100 000 | 0,1 0,2 0,4 0,6 0,8 1,0 |
Traitement d'entretien
Afin d'obtenir un effet optimal, le traitement d'entretien est poursuivi avec la dose bien tolérée la plus forte, c'est-à-dire celle à laquelle aucun effet indésirable significatif n'est survenu, sans toutefois dépasser 100 000 SQ-U. La dose d'entretien optimale est individuelle et dépend de la sensibilité du patient à l'allergène employé.
Les injections sont administrées à intervalles de 4 à 8 semaines. Une fois la dose d'entretien atteinte, il est conseillé d'allonger progressivement l'intervalle d'injection de 2 semaines pour atteindre un intervalle de 4 à 8 semaines.
Si le patient présente des réactions allergiques graves pendant le traitement d'entretien, il faut ajuster la dose (voir paragraphe «Ajustement de la posologie du fait d'effets indésirables / d'interactions»).
Adaptations de la dose durant le traitement d'entretien
Selon le type d'allergène, différentes méthodes de traitement peuvent être utilisées:
1. Traitement perannuel avec réduction de la dose d'entretien durant la saison: Pour toutes les espèces de pollen. Après obtention de la dose d'entretien celle-ci est réduite à 1/5 durant la saison puis, après celle-ci, la dose est reportée au niveau d'entretien selon le schéma posologique (voir traitement initial).
2. Traitement présaisonnier: Pour toutes les espèces de pollen, le traitement étant interrompu durant la saison. Après la saison, le traitement est recommencé depuis le début et augmenté selon le schéma posologique (voir traitement initial) à la dose d'entretien atteinte jusqu'à présent.
Changement de flacon à la suite d'un réapprovisionnement
Lors d'un changement de flacon à la suite d'un réapprovisionnement pour le traitement d'entretien, seulement 2/3 de la dose atteinte jusque-là doivent être injectés et si la tolérance est bonne, le reste est injecté 15 minutes plus tard, ceci afin de prévenir une éventuelle diminution de la puissance de l'extrait lors du stockage. En général, une réduction de la dose n'est pas requise avec les allergènes SQ.
Traitement concomitant par 2 solutions d'hyposensibilisation différentes
Le risque éventuel de réactions allergiques en cas d'instauration de plusieurs traitements concomitants par plusieurs allergènes doit être évalué individuellement.
En cas de traitement concomitant par plusieurs solutions d'allergènes spécifiques, il convient d'administrer chaque solution sur un site d'injection différent et de respecter un intervalle d'au moins 30 minutes entre 2 injections afin de pouvoir interpréter correctement les réactions locales.
Durée du traitement
Le traitement par des préparations Alutard SQ doit être suivi sur au moins 3 ans.
Ajustement de la posologie du fait d'effets indésirables / d'interactions
Pendant le traitement initial ou le traitement d'entretien, si une réaction au site d'injection persiste pendant plus de 6 heures après l'injection, la dose suivante doit être réduite en fonction de la taille du gonflement et conformément aux recommandations du tableau «Réduction posologique en cas de papule au site d'injection».
Réduction posologique en cas de papule au site d'injection
Diamètre maximal de la papule | Dose suivante | |
Enfants | Adultes | |
<5 cm | <8 cm | Traitement initial: Augmenter la dose selon le schéma posologique Traitement d'entretien: Répétition de la dernière dose administrée |
5-7 cm | 8-12 cm | Répétition de la dernière dose administrée |
7-12 cm | 12-20 cm | Réduction de la dose d'un palier dans le schéma posologique |
12-17 cm | >20 cm | Réduction de la dose de 2 paliers dans le schéma posologique |
>17 cm | Réduction de la dose de 3 paliers dans le schéma posologique | |
Si une réaction systémique grave survient après une injection pendant le traitement initial ou pendant le traitement d'entretien, il convient de poursuivre le traitement uniquement après une évaluation minutieuse. Si le traitement est poursuivi, la dose suivante doit être réduite à 10% de la dose ayant provoqué la réaction. Cette dose réduite peut être divisée en 2 doses unitaires qui sont à administrer à 30 minutes d'intervalle. Il faut de placer le patient sous surveillance après l'injection. La dose doit être augmentée conformément aux recommandations posologiques pour le traitement initial jusqu'à ce que la dose maximale tolérée soit atteinte.
Prise retardée
Pendant le traitement initial
Si exceptionnellement un intervalle d'injection de 14 jours est dépassé, la dose ne doit pas être augmentée et doit être adaptée selon le tableau ci-dessous.
Réduction de la dose après interruption du traitement
Intervalle | Réduction de la dose recommandée |
<2 semaines | Augmenter la dose selon le schéma posologique |
2-3 semaines | Répétition de la dernière dose administrée |
3-4 semaines | Réduction à 50% de la dernière dose administrée |
>4 semaines | Réinitiation du traitement |
Pendant le traitement d'entretien
Réduction de la dose après dépassement de l'intervalle de temps entre deux injections pendant le traitement d'entretien
Intervalle | Réduction de la dose recommandée |
<8 semaines | Aucune modification |
8-10 semaines | Réduction à 75% de la dernière dose administrée |
10-12 semaines | Réduction à 50% de la dernière dose administrée |
12-14 semaines | Réduction à 25% de la dernière dose administrée |
14-16 semaines | Réduction à 10% de la dernière dose administrée |
>16 semaines | Réinitiation du traitement |
En cas de réduction de la dose pendant le traitement d'entretien, il faut placer le patient sous surveillance étroite après l'injection. La dose est ensuite augmentée conformément aux recommandations posologiques pour le traitement initial jusqu'à ce que la dose d'entretien soit atteinte.
Enfants et adolescents
En principe, le traitement d'immunothérapie allergénique ne convient pas aux enfants de moins de 5 ans, car les problèmes d'acceptation et de coopération sont plus probables dans cette tranche d'âge que chez les adultes.
Les données cliniques sur l'efficacité du produit chez les enfants de plus de 5 ans ne sont disponibles qu'en nombre limité, l'efficacité n'est pas démontrée. Les données sur l'innocuité n'indiquent pas de risque plus important que chez l'adulte.
Contre-indications
•Hypersensibilité à l'un des excipients selon la composition.
•Les patients atteints de maladies auto-immunes systémiques actives et les patients présentant des défauts ou des déficiences immunitaires.
•Affections inflammatoires chroniques sévères.
•Les patients atteints de tumeurs malignes ayant valeur de maladie actuelle.
•Altérations secondaires irréversibles au niveau de l'organe atteint (p.ex. emphysème, bronchectasies).
•Insuffisance rénale chronique sévère (exposition à l'aluminium).
•Patients dont l'asthme n'est pas contrôlé ou dont le VEMS est inférieur à 70 % de la valeur prédictive chez les adultes (après un traitement pharmacologique adéquat) et dont le VEMS est inférieur à 80 % de la valeur prédictive chez les enfants et les adolescents (après un traitement pharmacologique adéquat).
•Les patients qui ont eu une exacerbation sévère de l'asthme au cours des 3 derniers mois.
Mises en garde et précautions
Après chaque injection, surveillez le patient pendant au moins 30 minutes, puis faire l'objet d'une évaluation médicale. Réactions allergiques systémiques sévères En raison du risque de réactions anaphylactiques sévères, tous les équipements et médicaments destinés à la réanimation doivent être en permanence à disposition, notamment de l'adrénaline pour injection, et un personnel qualifié doit être prêt à intervenir. Si des signes d'une réaction systémique tels que l'urticaire, l'angio-œdème ou l'asthme sévère surviennent, un traitement symptomatique doit être immédiatement mis en place. |
Le traitement ne devrait être instauré que par des médecins sachant mettre en œuvre une immunothérapie spécifique.
Pendant le traitement par Alutard SQ, les patients sont exposés à des allergènes qui peuvent provoquer des réactions allergiques locales et/ou systémiques. L'adrénaline est le traitement de choix en cas de réactions allergiques systémiques sévères (en règle générale, à la dose minimale de 0,01 mg/kg en intramusculaire dans la cuisse).
Étant donné que l'adrénaline est recommandée pour le traitement des réactions secondaires allergiques, les mises en garde et précautions ainsi que les contre-indications de l'adrénaline doivent être respectées.
Traitement médicamenteux au long cours:
L'effet de l'adrénaline peut être renforcé chez les patients traités avec des antidépresseurs tricycliques, des inhibiteurs de la monoaminooxydase (MAO) et/ou des inhibiteurs de la COMT, ce qui peut avoir des conséquences potentiellement fatales. L'effet de l'adrénaline peut être réduit chez les patients traités par des bêta-bloquants. Pendant un traitement par des agents antihypertenseurs, l'effet vasodilatateur de l'histamine peut être renforcé, ce qui augmente les réactions anaphylactiques. Il convient d'examiner pour chaque patient si le traitement par inhibiteurs de l'ECA doit être interrompu avant l'injection, car il existe un risque théorique de vasodilatation due à l'inhibition du métabolisme de l'angiotensine, qui peut contrecarrer le traitement par l'adrénaline.
Traitement des effets indésirables (recommandations conformes à la directive de l'EAACI sur l'immunothérapie de 2006):
Symptômes | Traitement de l'adulte | Traitement de l'enfant |
Réaction locale étendue (>12 cm au bout de 30 min.) | Antihistaminique oral; corticostéroïde topique; observation pendant au moins 60 min. | Antihistaminique oral; corticostéroïde topique; observation pendant au moins 60 min. |
Rhinite | Antihistaminique oral; observation pendant au moins 60 min. et répétition du débit expiratoire de pointe (DEP). | Antihistaminique oral; observation pendant au moins 60 min. et répétition du débit expiratoire de pointe (DEP). |
Urticaire légère | Antihistaminique oral ou parentéral; observation pendant au moins 60 min. | Antihistaminique oral ou parentéral; observation pendant au moins 60 min. |
Asthme | β-2-agoniste par inhalation; β-2-agoniste IV/SC; oxygène; corticostéroïde (prednisolone 50 mg ou méthylprednisolone 40 mg IV); théophylline; envisager une hospitalisation. | β-2-agoniste par inhalation; β-2-agoniste IV/SC; oxygène; corticostéroïde (méthylprednisolone 2 mg/kg IV); théophylline; envisager une hospitalisation. |
Réactions systémiques | Adrénaline (1 mg/ml) 0,3-0,5 mg en IM profonde. | Adrénaline (1 mg/ml) 0,005 mg/kg en IM profonde. |
Urticaire généralisée Angio-œdème | Accès IV (0,9% de solution saline); contrôle de la tension artérielle et du pouls; antihistaminique IM; corticostéroïde (prednisolone 50 mg ou méthylprednisolone 40 mg IV); envisager une hospitalisation. | Accès IV (0,9% de solution saline); contrôle de la tension artérielle et du pouls; antihistaminique IM; corticostéroïde (méthylprednisolone 2 mg/kg IV); envisager une hospitalisation. |
Choc anaphylactique | Adrénaline (1 mg/ml) 0,5-0,8 mg en IM profonde ou (diluée à 0,1 mg/ml) 0,3-0,5 mg IV (lentement en doses fractionnées) peut être répétée après 10 à 20 min.; Accès IV (0,9% de solution saline); mettre le patient en décubitus dorsal; oxygène 5-10 l/min.; contrôle de la tension artérielle, du pouls et de la saturation en oxygène; antihistaminique IV; méthylprednisolone 80 mg IV; hospitalisation nécessaire en raison du risque de choc retardé. | Adrénaline (1 mg/ml) 0,01 mg/kg (équivaut à 0,01 ml/kg) en IM profonde ou si nécessaire (diluée à 0,1 mg/ml) IV (lentement en doses fractionnées); Accès IV (0,9% de solution saline); mettre le patient en décubitus dorsal; oxygène; contrôle de la tension artérielle, du pouls et de la saturation en oxygène; antihistaminique IM; corticostéroïde (méthylprednisolone 2 mg/kg IV); hospitalisation nécessaire en raison du risque de choc retardé. |
Les patients présentant une cardiopathie peuvent éventuellement être exposés à un risque accru lors de réactions allergiques systémiques sévères. L'expérience clinique concernant l'utilisation d'Alutard SQ chez les patients atteints d'affections cardiaques est limitée. Cet élément doit être pris en compte avant de démarrer un traitement spécifique d'immunothérapie allergénique.
Asthme
L'on sait que l'asthme est un facteur de risque prédisposant à des réactions allergiques systémiques sévères.
L'expérience clinique concernant l'utilisation d'Alutard SQ chez les patients asthmatiques est limitée.
Chez les patients ayant des antécédents d'asthme, les symptômes d'asthme doivent avoir été adéquatement contrôlés dans les 3 mois précédant le début du traitement par Alutard SQ.
L'état du patient asthmatique doit être vérifié avant chaque injection. L'injection d'allergènes thérapeutiques doit être reportée si l'asthme du patient n'a pas été entièrement contrôlé au cours de la dernière semaine précédant l'injection prévue.
Les patients ayant des antécédents d'asthme doivent être informés de la nécessité de consulter immédiatement un médecin si leur asthme s'aggrave soudainement.
Les patients ayant des antécédents médicaux d'asthme et d'infection respiratoire aiguë doivent reporter le début du traitement par Alutard SQ jusqu'à la résolution de l'infection.
Maladies auto-immunes en rémission
Les données concernant le traitement d'immunothérapie allergénique chez les patients présentant une maladie auto-immune en rémission sont limitées. Alutard SQ doit donc être prescrit avec prudence chez ce type de patients.
Exposition à l'aluminium
Alutard SQ contient de l'aluminium. Il existe donc un risque théorique d'accumulation d'aluminium chez les patients à haut risque (p.ex. les patients dont la fonction rénale est altérée et les patients traités en concomitance avec des préparations à base d'aluminium, telles que des antiacides). Il faut en tenir compte avant de commencer le traitement par Alutard SQ.
Enfants et adolescents
Les enfants de moins de 5 ans ne sont généralement pas considérés comme de bons candidats au traitement d'immunothérapie allergénique et ne doivent recevoir ce traitement que dans des cas exceptionnels et non de façon systématique. Une attention particulière doit être accordée à l'évaluation de la balance bénéfice-risque dans le traitement des enfants de moins de 5 ans. Il existe peu de données cliniques concernant l'efficacité chez les enfants de plus de 5 ans. Cependant, les données sur la sécurité n'indiquent pas de risque plus important que chez l'adulte. Le schéma d'augmentation posologique à 7 paliers n'a pas été étudié chez les enfants de moins de 12 ans.
Utilisation concomitante avec d'autres traitements spécifiques d'immunothérapie allergénique
Il n'existe pas de données cliniques concernant l'utilisation concomitante avec d'autres traitements d'immunothérapie allergénique.
Pendant le traitement:
L'injection doit être reportée si:
•le patient a de la fièvre ou présente des signes d'infection aiguë ou chronique.
•le patient a une fonction pulmonaire significativement réduite (VEMS de pointe inférieur à 70 % de la valeur normale du patient chez les adultes et VEMS inférieur à 80 % de la valeur normale du patient chez les enfants et les adolescents) ou présente des symptômes évocateurs d'une exacerbation de l'asthme.
•le patient présente une aggravation de la dermatite atopique.
•une vaccination a été administrée au cours de la semaine précédente ou sera administrée au cours de la semaine suivant l'injection d'Alutard SQ.
Avant l'injection:
•Le jour de l'injection, le patient doit éviter tout effort physique, les douches chaudes, les séances de sauna et la consommation d'alcool, car ces facteurs concomitants peuvent augmenter l'anaphylaxie.
•Le statut asthmatique des patients ayant des antécédents d'asthme doit être évalué avant chaque injection en mesurant le débit de pointe et la fonction pulmonaire (voir la section «Contre-indications»).
•L'état de santé du patient et ses allergies doivent également être évalués, ainsi que tout changement dans la prise d'autres médicaments depuis la dernière injection.
•Les réactions allergiques (locales et/ou systémiques) survenant après l'injection précédente doivent être notées et la dose doit être ajustée en conséquence (voir la section « Posologie/Mode d'emploi »).
•Avant chaque injection, l'allergène spécifié, la concentration, le volume et la date de la dernière injection (intervalle de dose) doivent être vérifiés deux fois.
•Alutard SQ doit être administré par voie sous-cutanée. L'administration intravasculaire doit être évitée en raison du risque accru de réactions allergiques (aspiration).
Après chaque injection:
•Le patient doit être informé qu'en cas de réaction systémique sévère tardive, il doit immédiatement consulter un médecin ou se rendre aux urgences.
•Le patient doit être informé qu'il doit surveiller l'apparition de toute réaction locale ou systémique retardée et en avertir le médecin traitant lors de la prochaine visite.
•Toute réaction allergique (locale et/ou systémique) doit être documentée avant que le patient ne quitte l'établissement.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par injection, c.-à-d. qu'il est essentiellement « sans sodium ».
Interactions
Aucune étude sur les interactions humaines n'a été menée. On ne sait pas si un traitement par Alutard SQ interagit avec les vaccinations.
Un traitement symptomatique concomitant efficace par des antiallergiques, des corticostéroïdes ou des stabilisateurs des mastocytes peut augmenter le niveau de tolérance du patient à un traitement spécifique d'immunothérapie allergénique. Cet aspect doit être pris en considération lors de l'arrêt de ces médicaments.
Pour des informations sur l'utilisation concomitante des IMAO, des inhibiteurs de la COMT, des bêta-bloquants et des antiacides, voir la rubrique « Mises en garde et précautions ».
Grossesse/Allaitement
Grossesse
Il n'existe pas de données suffisantes concernant l'emploi chez la femme enceinte. Il n'existe pas de données expérimentales animales suffisantes. Le risque potentiel pour l'être humain n'est pas connu.
Le médicament ne doit pas être administré pendant la grossesse, sauf en cas de nécessité absolue.
Allaitement
Il n'existe pas de données cliniques sur l'emploi pendant l'allaitement. Alutard SQ ne doit être utilisé pendant l'allaitement qu'après une évaluation individuelle scrupuleuse de la balance bénéfice-risque.
Fertilité
On ne dispose pas de données cliniques concernant l'influence d'Alutard SQ sur la fertilité.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Occasionnellement, une légère fatigue peut survenir chez certains patients; elle peut altérer l'aptitude à la conduite et la capacité à utiliser des machines.
Effets indésirables
Résumé du profil de sécurité
Les réactions associées aux traitements par Alutard SQ sont généralement causées par des réactions immunologiques (locales et/ou systémiques) à l'allergène en cause. Les symptômes d'une réaction précoce surviennent dans les 30 premières minutes suivant l'injection. Les symptômes d'une réaction tardive se manifestent normalement au cours des 24 heures suivant l'injection.
Les effets indésirables très fréquemment rapportés chez les patients traités par Alutard SQ sont des réactions locales au site d'injection.
Liste des effets indésirables
Les effets indésirables sont classés par fréquence selon la convention MedDRA: très fréquents (≥1/10), fréquents (≥1/100, <1/10), occasionnels (≥1/1 000, <1/100), rares (≥1/10 000, <1/1 000), très rares (<1/10 000). Les fréquences sont basées sur une étude clinique avec Alutard SQ Phleum pratense et une étude clinique avec Alutard SQ 6 mélange de graminées et de seigle, d'acariens de la poussière de maison et de bouleau, car le profil de sécurité général des préparations Alutard SQ est similaire.
Affections du système immunitaire | |
Fréquent: | Réaction anaphylactique |
Occasionnel: | Choc anaphylactique |
Affections oculaires | |
Fréquents: | Conjonctivite |
Occasionnel: | Œdème des paupières |
Affections vasculaires | |
Fréquents: | Bouffée congestive |
Affections de l'oreille et du labyrinthe | |
Fréquent: | Prurit auriculaire, vertiges |
Affections respiratoires, thoraciques et médiastinales | |
Fréquents: | Sibilances, toux, dyspnée, asthme, congestion nasale, rhinite allergique, éternuements, irritation de la gorge, rhinorrhée, prurit nasal |
Affections gastro-intestinales | |
Fréquents: | Douleurs abdominales, diarrhée, vomissements, nausées, dyspepsie |
Affections de la peau et du tissu sous-cutané | |
Fréquents: | Urticaire, prurit, éruptions cutanées, érythème, eczéma |
Occasionnel: | Gonflement du visage |
Troubles généraux et anomalies au site d'administration | |
Très fréquents: | Réactions au site d'injection* |
Fréquents: | Malaises, fatigue, frissons, sensation de chaleur, sensation de corps étranger |
* Les réactions au site d'injection incluent des événements tels que: prurit/ gonflement/ urticaire/ érythème/ nodules/ douleur/ ecchymoses/ hématome/ induration/ inflammation/ œdème/ éruption cutanée/ chaleur/décoloration/ papule au site d'injection, œdème localisé, douleur au site d'administration.
Les données d'une étude d'augmentation posologique à 7 paliers ont montré un risque légèrement accru de symptômes oculaires tels que le gonflement et le prurit oculaires, et de réactions cutanées telles que l'érythème, les éruptions cutanées et l'urticaire en cas d'augmentation posologique rapide (7 paliers vs 11 paliers).
Effets indésirables après commercialisation
Les données issues de l'expérience acquise après l'autorisation de mise sur le marché sont énumérées ci-dessous avec la fréquence «inconnue» (ne peut être estimée à partir des données disponibles).
Affections du système nerveux | |
Inconnus: | Sensations vertigineuses, paresthésie |
Affections cardiaques | |
Inconnus: | Palpitations, tachycardie, cyanose |
Affections vasculaires | |
Inconnus: | Hypotension, pâleur |
Affections respiratoires, thoraciques et médiastinales | |
Inconnus: | Bronchospasme, sensation de gorge serrée |
Affections de la peau et du tissu sous-cutané | |
Inconnus: | Angio-œdème |
Affections musculo-squelettiques et systémiques | |
Inconnus: | Gonflement articulaire, arthralgie |
Troubles généraux et anomalies au site d'administration | |
Inconnus: | Gêne thoracique, hypertrichose au site d'injection |
Description de certains effets indésirables
Réactions locales
Les réactions locales surviennent au site d'injection et comprennent gonflement au site d'injection, rougeurs, douleurs, prurit, décoloration et hématome. Les réactions locales peuvent être traitées par des médicaments symptomatiques tels que des antihistaminiques. La teneur en aluminium peut contribuer à l'apparition d'effets secondaires locaux, notamment un patch-test cutané positif pour l'aluminium.
Réactions allergiques systémiques
Les réactions systémiques comprennent tout symptôme affectant des organes éloignés du site d'injection.
Les réactions allergiques systémiques sont en général légères à modérées et peuvent être traitées par des médicaments symptomatiques tels que des antihistaminiques. Les réactions allergiques systémiques peuvent aller de la rhinite allergique au choc anaphylactique. Le traitement d'une réaction systémique sévère doit être démarré immédiatement.
Les symptômes peuvent comprendre, mais ne sont pas limités à un urticaire, un angio-œdème, une bronchospasme, une fatigue, une essoufflement, une oppression thoracique et une bouffée congestive. Les autres réactions immédiates peuvent être: rhinite, rhinorrhée, toux, éternuements, conjonctivite et asthme. Ces réactions peuvent également survenir tardivement. Autres réactions tardives: céphalées, prurit, malaise général.
Si ces réactions sont plus importantes et générales, le patient doit immédiatement informer son médecin ou à défaut son remplaçant. Dans tous les cas, le patient doit informer le médecin traitant avant l'injection suivante des réactions ultérieures survenues.
Réactions allergiques systémiques sévères
Une réaction allergique systémique sévère est une réaction potentiellement fatale qui survient généralement dans les minutes qui suivent l'exposition à l'allergène. Les symptômes qui indiquent une réaction allergique systémique sévère peuvent inclure, mais ne sont pas limités à, une sensation de chaleur, un malaise général, une hypotension, une tachycardie, une dyspnée, une toux, une sibilance, une bouffée congestive, une gêne thoracique, une douleur abdominale, un vomissement, une diarrhée, une éruption cutanée, un prurit et une urticaire.
Une réaction allergique systémique sévère telle que le choc anaphylactique se développe généralement rapidement, dans les minutes qui suivent l'injection, et nécessite un traitement rapide avec, par exemple, de l'adrénaline et/ou un autre traitement anaphylactique. Un traitement en accord avec les directives actuelles en matière de traitement de choc doit être instauré.
En cas de réactions locales étendues et de réactions systémiques, il faut évaluer le traitement (voir «Posologie/Mode d'emploi»).
Une dermatite atopique préexistante peut s'aggraver pendant le traitement.
Enfants et adolescents
Il existe peu de données cliniques concernant l'efficacité chez les enfants de plus de 5 ans. Cependant, les données sur la sécurité n'indiquent pas de risque plus important que chez l'adulte. Les enfants de moins de 5 ans ne sont généralement pas considérés comme de bons candidats au traitement d'immunothérapie allergénique. Une attention particulière doit être accordée à l'évaluation de la balance bénéfice-risque dans le traitement des enfants de moins de 5 ans.
Groupes de patients particuliers
Il n'existe pas de données provenant d'études cliniques concernant les effets secondaires chez d'autres groupes de patients.
Sécurité en cas d'augmentation posologique à paliers réduits
Pour les adultes et les adolescents la sécurité d'un schéma d'augmentation posologique à paliers réduits à 7 injections a été étudiée. Les 7 injections ont été administrées à des intervalles de 7 ± 2 jours.
Flacon n° | Concentration | Injection n° | SQ-U | ml |
2 | 1 000 SQ-U/ml | 1 | 300 | 0,3 |
3 | 10 000 SQ-U/ml 10 000 SQ-U/ml | 2 3 | 2 000 5 000 | 0,2 0,5 |
4 | 100 000 SQ-U/ml 100 000 SQ-U/ml 100 000 SQ-U/ml 100 000 SQ-U/ml | 4 5 6 7 | 10 000 30 000 60 000 100 000 | 0,1 0,3 0,6 1,0 |
Aucun nouvel signal de sécurité n'a été observé avec ce schéma d'augmentation posologique à 7 paliers.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Si une dose supérieure à la dose prévue a été injectée, le risque d'effets secondaires augmente, y compris le risque de réaction allergique systémique ou de réactions allergiques locales sévères. Le patient doit être surveillé et ces réactions doivent être traitées par des médicaments symptomatiques appropriés.
Propriétés/Effets
Code ATC:
V01AA
Mécanisme d'action
Administré en doses croissantes selon les prescriptions posologiques, Alutard SQ provoque une insensibilité ou une sensibilité diminuée durable contre les allergènes spécifiques en cause.
Lors d'injection sous-cutanée, l'adsorption de l'hydroxyde d'aluminium entraîne une libération lente de l'extrait allergénique et, par conséquent, une hyposensibilisation bien supportée.
Pharmacodynamique
Le produit entraîne une hyposensibilisation des patients allergiques. Le mécanisme d'action exact est encore inexpliqué. L'effet pharmacodynamique cible le système immunitaire, l'objectif étant de retarder la réaction à l'allergène considéré, mais pas aux autres allergènes. Alutard SQ est indiqué pour le traitement de patients souffrant d'une allergie médiée par IgE. L'effet pharmacodynamique cible le système immunitaire en réduisant la réaction spécifique aux allergènes utilisés pour traiter le patient. Alutard SQ affecte et altère la migration des lymphocytes T et des granulocytes éosinophiles vers les organes cibles. Le rapport entre les cytokines Th2 et Th1 est modifié en faveur des cytokines Th1. Par ailleurs, le taux de synthèse de l'IL-10 qui provoque entre autres une anergie de lymphocytes T augmente. En raison du nombre réduit de granulocytes basophiles recirculants dans le sang périphérique, la libération de l'histamine est en outre réduite.
Efficacité clinique
Une étude en double aveugle, randomisée et contrôlée par placebo a montré une réduction à la fois des symptômes co-saisonniers et de la consommation de médicaments co-saisonniers lorsqu'ils sont traités par une augmentation posologique préalable à 15 paliers du traitement avec Alutard SQ pollen de graminées 100 000 SQ par rapport au placebo. Une étude clinique ouverte avec Alutard SQ graminées et Alutard SQ Betula verrucosa indique que Alutard SQ peut avoir un effet à long terme et peut prévenir la progression de la rhinite allergique vers l'asthme allergique chez les enfants (preuve clinique non établie). Un suivi de 7 ans indique également un effet possible à long terme avec Alutard SQ graminées (preuve clinique non établie).
Pharmacocinétique
Absorption
Les allergènes contenus principalement dans Alutard SQ sont les polypeptides et les protéines. On estime qu'elles se décomposent en polypeptides et acides aminés courts. On suppose que les allergènes d'Alutard SQ ne sont pas absorbés en quantité significative dans le système vasculaire. Ni des études pharmacocinétiques sur l'animal ni des études cliniques n'ont été menées pour déterminer le profil pharmacocinétique et le métabolisme de Alutard SQ.
L'adsorption de l'allergène avec l'hydroxyde d'aluminium peut entraîner une libération lente au site d'injection. En cas d'injection sous-cutanée, l'allergène est libéré lentement, ce qui réduit son allergénicité et peut prolonger la stimulation du système immunitaire.
Distribution
Aucune donnée disponible.
Métabolisme
Aucune donnée disponible.
Élimination
Aucune donnée disponible.
Données précliniques
Les données précliniques sont limitées. Les études conventionnelles sur la sécurité, la toxicité en administration répétée chez les rongeurs, la toxicité pour la reproduction (développement embryo-fœtal) n'ont pas révélé de risque particulier pour l'homme. Les études ont été menées avec le principe actif sans formulation, c'est-à-dire l'extrait d'allergène sans adjuvant ni excipients. Aucune interaction des excipients avec les principes actifs n'est attendue. Aucune étude de carcinogénicité n'a été réalisée.
Remarques particulières
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8 °C). Ne pas congeler.
Conserver le récipient dans son carton pour le protéger de la lumière.
Conserver hors de portée des enfants.
Ne pas utiliser les préparations qui ont été congelées et décongelées ni celles contenant des précipités floconneux irréversibles!
Remarques concernant la manipulation
Retourner le flacon avec soin 10-20 fois avant l'utilisation.
Ne pas injecter par voie intravasculaire! Aspirer.
Voir les remarques concernant la manipulation des flacons et réalisation de l'injection à la fin de l'information professionnelle.
Numéro d’autorisation
60695, 60702, 60708, 60711 (Swissmedic).
Titulaire de l’autorisation
ALK-Abelló AG, Volketswil.
Mise à jour de l’information
Mai 2020
Remarques concernant la manipulation des flacons et réalisation de l'injection
Avant l'injection, toujours observer les rubriques „Posologie/Mode d'emploi“ et „Mises en garde et précautions“. | ||
1 |
| Prendre le flacon de l'emballage. L'allergène spécifié, la concentration, le volume et la date de la dernière injection (intervalle de dose) doivent être vérifiés deux fois avant chaque injection. Contrôler: •Données du patient •Composition d'allergènes •Concentration (dosage) •Date de péremption |
2 |
| Retourner le flacon avec soin 10-20 fois. Ne pas utiliser les préparations qui ont été congelées et décongelées ni celles contenant des précipités floconneux irréversibles! |
3 |
| Désinfecter et percer le bouchon de caoutchouc avec une seringue stérile de 1 ml à usage unique. Questions au patient/à la patiente: •État général •Prise de médicaments •Symptomatologie allergique actuelle •Tolérance de l'injection précédente |
4 |
| Injection bien tolérée: Augmentation ou poursuite de la dose conformément aux directives posologiques. Injection mal tolérée ou autres limitations: Réduction de la dose conformément aux directives posologiques. |
5 |
| Prélever le volume requis. Ajustage exact de la dose à injecter (éviter les bulles d'air). |
6 |
| Purification et désinfection du site d'injection et après: •Soulever un pli de peau à une largeur de main au-dessus de l'olécrâne. •Éviter l'injection intravasculaire. Aspirer! •Injecter lentement par voie sous-cutanée |
7 | Surveillance du patient jusqu'à 30 minutes après l'injection! Donner éventuellement des médicaments pour le traitement des réactions tardives (p.ex. antihistaminiques). | |
Отзывов (0)

Бесплатная консультация опытного специалиста
Опишите симптомы или нужный препарат – мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой на дом или просто проконсультируем.
Нас 14 специалистов и 0 ботов. Мы всегда будем с вами на связи и сможем связаться в любое время.

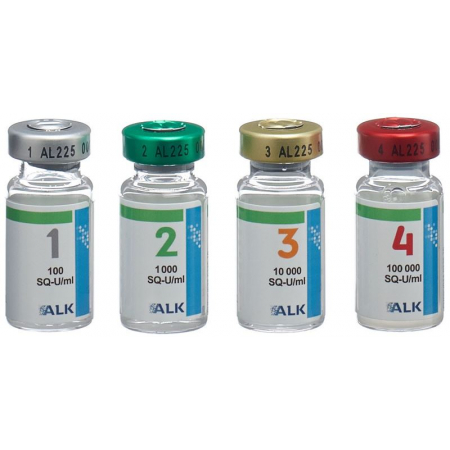

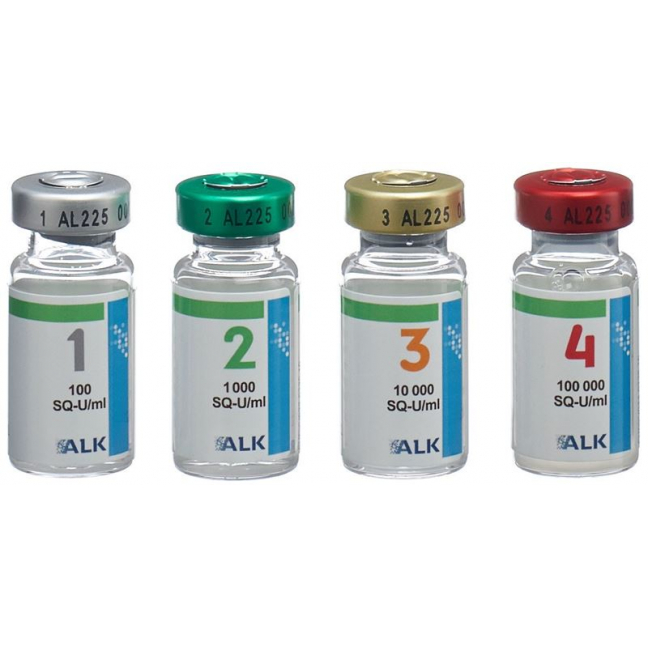


 Deutsch
Deutsch French
French Italian
Italian
















