BYDUREON BCise Depot 2 мг автоинжектор
BYDUREON BCise Depot Inj Susp 2 mg Autoinjektor 4 Stk
-
29707.69 RUB
Предполагаемая дата доставки:
29.05. - 12.06.2024

- Наличие: В наличии
- Производитель: ASTRAZENECA AG
- Модель: 7787000
- ATC-код A10BJ01
- EAN 7680675030019
Состав:
Описание
Was ist Bydureon BCise und wann wird es angewendet?
Auf Verschreibung des Arztes oder der Ärztin.
Bydureon BCise ist ein Arzneimittel zur Injektion mit dem Wirkstoff Exenatid, welches zur Verbesserung der Blutzuckerkontrolle bei Erwachsenen mit (nicht insulinabhängigem) Diabetes mellitus Typ 2 angewendet wird.
Sie haben Diabetes, weil Ihr Körper nicht genügend Insulin produziert, um den Zucker in Ihrem Blut zu kontrollieren, oder weil Ihr Körper nicht in der Lage ist, das von ihm produzierte Insulin richtig zu nutzen. Bydureon BCise hilft Ihrem Körper, dass mehr Insulin ausgeschüttet wird, wenn Ihr Blutzuckerspiegel hoch ist. Sie nehmen bereits Tabletten gegen Ihren Diabetes und sollten sich an einen bestimmten Ernährungs- und Bewegungsplan halten. Weil diese Massnahmen Ihren Blutzucker nicht genügend kontrollieren, verschreibt Ihnen Ihr Arzt resp. Ihre Ärztin Bydureon BCise als zusätzliches Medikament, mit dem Sie Ihren Blutzuckerspiegel unter Kontrolle bringen können.
Während der Bydureon BCise-Therapie brauchen Sie Ihren Blutzuckerspiegel nicht zu messen. Sollte Ihnen allerdings ein Arzneimittel vom Typ Sulfonylharnstoff verschrieben worden sein, kann Ihr Arzt bzw. Ihre Ärztin Sie auffordern, Ihren Blutzuckerspiegel zu messen.
Bydureon BCise ist kein Insulinersatz für Patienten, deren Diabetes eine Insulinbehandlung erfordert.
Wann darf der Bydureon BCise nicht angewendet werden?
Bydureon BCise darf nicht angewendet werden bei bekannter Überempfindlichkeit auf den Wirkstoff oder einen der Hilfsstoffe.
Wann ist bei der Anwendung von Bydureon BCise Vorsicht geboten?
Bei der Anwendung von Bydureon BCise ist Vorsicht geboten,
- wenn Sie schwerwiegende Probleme mit der Magenentleerung (einschliesslich einer Gastroparese) oder der Nahrungsverdauung haben. In diesem Fall fragen Sie bitte Ihren Arzt resp. Ihre Ärztin um Rat, bevor Sie Bydureon BCise anwenden. Bydureon verzögert die Magenentleerung, so dass die Nahrung Ihren Magen langsamer passiert;
- wenn Sie Bydureon BCise in Kombination mit einem Sulfonylharnstoff verwenden, weil es zu einem niedrigen Blutzuckerspiegel (Hypoglykämie) kommen kann. Fragen Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, falls Sie nicht sicher sind, ob ein anderes der von Ihnen verwendeten Arzneimittel Metformin oder einen Sulfonylharnstoff enthält.
- Falls Sie unter einer Nierenerkrankung leiden, informieren Sie Ihren Arzt resp. Ihre Ärztin. Er resp. sie wird entscheiden, ob Sie Bydureon BCise anwenden dürfen.
- Es wurden Fälle von Bauchspeicheldrüsenentzündungen (Pankreatitis) bei Patienten, die Bydureon anwenden, beobachtet. Eine Pankreatitis ist eine schwerwiegende, potenziell lebensbedrohende Krankheit. Beenden Sie die Anwendung von Bydureon BCise und suchen Sie Ihren Arzt bzw. Ihre Ärztin auf, falls Sie starke und anhaltende Bauchschmerzen mit oder ohne Erbrechen bekommen, da Sie an einer Pankreatitis leiden könnten.
Es gibt keine Erfahrungen zur Anwendung von Bydureon BCise bei Kindern und Jugendlichen unter 18 Jahren, daher sollte Bydureon BCise bei Patienten dieser Altersgruppe nicht angewendet werden.
Wenn Sie Bydureon BCise in Kombination mit einem Sulfonylharnstoff anwenden, kann es zu einem niedrigen Blutzuckerspiegel (einer Hypoglykämie) kommen. Dieser beeinträchtigt möglicherweise Ihre Konzentrationsfähigkeit. Bitte berücksichtigen Sie Ihre potenziell herabgesetzte Konzentrationsfähigkeit in allen Situationen, in denen Sie sich und andere Personen einer Gefahr aussetzen könnten (also etwa beim Autofahren oder beim Bedienen von Maschinen). Aufgrund der Nebenwirkungen wie Übelkeit, Schwindelgefühl und Müdigkeit können die Verkehrstüchtigkeit und das Bedienen von Maschinen beeinträchtigt sein.
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbst gekaufte!) einnehmen.
Darf Bydureon BCise während einer Schwangerschaft oder in der Stillzeit angewendet werden?
Es ist nicht bekannt, ob Bydureon BCise Ihr ungeborenes Kind schädigen kann. Sprechen Sie mit Ihrem Arzt bzw. Ihrer Ärztin, wenn Sie schwanger sind, wenn Sie denken, Sie könnten schwanger sein, oder wenn Sie planen, schwanger zu werden, da Bydureon BCise während der Schwangerschaft und während mindestens 3 Monaten vor einer geplanten Schwangerschaft nicht angewendet werden sollte.
Frauen im gebärfähigen Alter sollten eine wirksame Empfängnisverhütung anwenden.
Es ist nicht bekannt, ob Bydureon BCise in die Muttermilch gelangt. Daher sollte Bydureon BCise während der Stillzeit nicht angewendet werden, oder es sollte abgestillt werden.
Wie verwenden Sie Bydureon BCise?
Wenden Sie Bydureon BCise immer genau so an, wie es Ihnen Ihr Arzt oder Diabetesfachberater bzw. Ihre Ärztin oder Diabetesfachberaterin empfohlen hat.
Bydureon wird einmal wöchentlich injiziert. Die Injektion kann zu einer beliebigen Tageszeit und unabhängig von den Mahlzeiten erfolgen.
Bydureon wird unter die Haut (subkutane Injektion) Ihres Oberschenkels, im Bauchbereich oder in die Rückseite des Oberarmes injiziert. NICHT in eine Vene oder einen Muskel injizieren!
Ihr Arzt bzw. Ihre Ärztin hat Ihnen möglicherweise empfohlen, dass Sie Ihren Blutzuckerwert regelmässig selbst bestimmen; dies ist insbesondere dann wichtig, wenn Sie gleichzeitig einen Sulfonylharnstoff anwenden.
Bitte lesen Sie die beiliegende Bedienungsanleitung vor der Anwendung von Bydureon BCise durch.
Ihr Arzt oder Ihr Diabetesfachberater bzw. Ihre Ärztin oder Diabetesfachberaterin wird Ihnen vor der ersten Anwendung zeigen, wie dieses Arzneimittel vorzubereiten und anzuwenden ist.
Nehmen Sie einen Bydureon BCise, Autoinjektor aus dem Kühlschrank und lassen Sie ihn mindestens 15 Minuten flach liegen. Mischen Sie die Suspension, indem Sie den Bydureon BCise, Autoinjektor mindestens 15 Sekunden kräftig schütteln. Wenden Sie die Suspension erst an, wenn sie gleichmässig gemischt, weiss bis cremefarben und milchig ist. Sollten Sie weisses Arzneimittelpulver im Fenster des Autoinjektors an den Seiten, unten oder oben sehen, ist das Arzneimittel NICHT ausreichend gemischt. Schütteln Sie noch einmal kräftig, bis alles gut gemischt ist. Sie sollten dieses Arzneimittel unmittelbar nach dem Mischen der Suspension injizieren.
Wenn Sie eine grössere Menge von Bydureon BCise angewendet haben, als Sie sollten
Wenn Sie zu viel Bydureon BCise injiziert haben, wenden Sie sich an Ihren Arzt resp. Ihre Ärztin. Eine Überdosis Bydureon BCise kann Übelkeit, Erbrechen, Schwindelgefühl oder die Symptome einer Unterzuckerung auslösen.
Wenn Sie die Anwendung von Bydureon BCise vergessen haben
Wählen Sie einen Wochentag aus, an dem Sie immer planmässig Ihre Bydureon BCise-Injektion vornehmen möchten.
Falls eine Injektion versäumt wurde und die nächste Dosis erst in 3 Tagen oder später fällig ist, sollten Sie sie so bald wie möglich nachholen. Die nächste Injektion können Sie am gewohnten Injektionstag spritzen. Falls eine Injektion versäumt wurde und die nächste Dosis schon in 1 oder 2 Tagen fällig ist, überspringen Sie die versäumte Injektion und spritzen Sie die nächste an dem Tag, an dem sie fällig ist. Sie können auch den von Ihnen gewählten Injektionstag wechseln, solange die letzte Dosis vor 3 Tagen oder früher gespritzt wurde.
Spritzen Sie nicht 2 Bydureon BCise-Dosen innerhalb von 3 aufeinanderfolgenden Tagen.
Wenn Sie sich nicht sicher sind, ob Sie die volle Dosis Bydureon BCise erhalten haben
Wenn Sie sich nicht sicher sind, ob Sie die gesamte Dosis injiziert haben, injizieren Sie keine weitere Bydureon BCise-Dosis, sondern injizieren Sie die nächste Dosis wie geplant eine Woche später.
Brechen Sie die Behandlung nicht ohne ausdrückliche Verordnung Ihres Arztes resp. Ihrer Ärztin ab. Der Abbruch der Bydureon BCise-Behandlung kann schwerwiegende Auswirkungen auf Ihren Blutzuckerspiegel haben.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin.
Welche Nebenwirkungen kann Bydureon BCise haben?
Bydureon BCise, Autoinjektor
Selten wurde über schwerwiegende allergische Reaktionen (Anaphylaxie) berichtet.
Sie müssen sofort Ihren Arzt aufsuchen, wenn Sie folgende Symptome bekommen: Schwellung von Gesicht, Zunge oder Kehle (Angioödem), Überempfindlichkeit (Ausschlag, Jucken und schnelles Anschwellen des Halses, Gesichts, Mundes oder der Kehle), Schluckbeschwerden, Nesselsucht und Atemnot.
Bei Patienten, die Bydureon BCise, Autoinjektor anwendeten, wurde gelegentlich über Fälle einer Entzündung der Bauchspeicheldrüse (Pankreatitis) berichtet. Eine Pankreatitis ist eine schwerwiegende, potenziell lebensbedrohende Erkrankung.
Informieren Sie Ihren Arzt, falls Sie jemals unter einer Pankreatitis, Gallensteinen oder Alkoholismus litten oder sehr hohe Blutfett-Werte hatten. All dies kann Ihr Risiko, eine Pankreatitis zu bekommen oder wieder zu bekommen, erhöhen. Rufen Sie Ihren Arzt resp. Ihre Ärztin umgehend an, falls Sie starke und anhaltende Bauchschmerzen, mit oder ohne Erbrechen, bekommen, da Sie eine Pankreatitis haben könnten.
Sehr häufige Nebenwirkung von Bydureon BCise, Autoinjektor ist Hypoglykämie (Unterzuckerung) bei Anwendung zusammen mit einem Arzneimittel, das einen Sulfonylharnstoff enthält.
Zu den Anzeichen und Symptomen einer Unterzuckerung gehören Kopfschmerzen, Schwindelgefühle, Schwäche, Benommenheit, Verwirrung, Reizbarkeit, Hunger, beschleunigter Herzschlag, Schwitzen und Nervosität. Ihr Arzt resp. Ihre Ärztin sollte Sie über die Methoden zur Behandlung eines niedrigen Blutzuckerspiegels informieren.
Weitere mögliche häufige Nebenwirkungen sind Hypoglykämie (Unterzuckerung) bei Anwendung mit Insulin, Kopfschmerzen, Schwindelgefühl, Übelkeit (Übelkeit tritt zu Beginn der Behandlung mit diesem Arzneimittel häufig auf, nimmt aber mit der Zeit bei den meisten Patienten ab), Durchfall, Erbrechen, Verstopfung, Verdauungsstörung, Sodbrennen, Blähbauch, Schmerzen im Magenbereich und Müdigkeit.
Gelegentliche Nebenwirkungen sind Unterzuckerung (Hypoglykämie, die auch auftreten kann wenn Bydureon BCise nicht zusammen mit einem Sulfonylharnstoff oder Insulin angewendet wird) und verminderter Appetit aufgrund von Übelkeit. Informieren Sie Ihren Arzt, wenn Sie zu schnell abnehmen (mehr als 1,5 kg wöchentlich). Weitere gelegentliche Nebenwirkungen sind Austrocknen (Dehydratation), ungewohnter Geschmack im Mund, Schläfrigkeit, Blähungen, Aufstossen, Darmverschluss, Nesselsucht, vermehrtes Schwitzen, Ausschlag, Jucken, Haarausfall, Verschlechterung der Nierenfunktion, Energie- und Kraftlosigkeit sowie Reaktionen an der Injektionsstelle.
Sollten Sie Reaktionen an der Injektionsstelle (Rötung, Ausschlag oder Juckreiz) haben, fragen Sie Ihren Arzt bzw. Ihre Ärztin, was Ihnen zur Linderung der Symptome helfen kann. Möglicherweise kann es nach der Injektion an der Einstichstelle kleine Knötchen geben; ca. 50 % davon verschwinden innerhalb von 4 bis 8 Wochen, teilweise sind sie aber über Monate spürbar. Sie sollten deshalb nicht mit der Behandlung aufhören.
Selten wurde über ein zitteriges Gefühl berichtet.
Zusätzlich wurde über schwerwiegende Reaktionen an der Injektionsstelle wie z.B. Abszesse oder bakterielle Entzündungen (selten) sowie über eine Änderung der Blutgerinnung bei gleichzeitiger Anwendung von Arzneimitteln zur Blutverdünnung berichtet.
Bei Patienten, die Bydureon anwenden, wurden Fälle einer durch das Arzneimittel hervorgerufenen Verminderung der Anzahl an Blutplättchen (Thrombozytopenie) berichtet.
Tritt eine der genannten Nebenwirkungen auf oder wenn Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind, sollten Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin informieren.
Was ist ferner zu beachten?
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Lagerungshinweis
Bydureon BCise, Autoinjektor
Flach und im Kühlschrank lagern (2 °C – 8 °C).
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Bydureon BCise kann vor der Anwendung bis zu 4 Wochen bei Temperaturen von nicht über 30 °C gelagert werden.
Befolgen Sie die Bedienungsanleitung.
Bydureon BCise muss direkt nach der Zubereitung injiziert werden.
Ausser Reichweite von Kindern aufbewahren.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker bzw. Ihre Apothekerin, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Bydureon BCise enthalten?
Wirkstoffe
Der Wirkstoff ist Exenatid. Jeder Bydureon BCise, Autoinjektor gibt 2 mg Exenatid pro Injektion ab.
Hilfsstoffe
Die Hilfsstoffe eines Bydureon BCise, Autoinjektors sind: Poly-(D,L-Laktid-Co-Glycolid), Saccharose und mittelkettige Triglyceride.
Bydureon BCise, Autoinjektor
Optische Eigenschaften
Weisse bis cremefarbene, milchige Suspension in einem Autoinjektor.
Zulassungsnummer
67503 (Swissmedic)
Wo erhalten Sie Bydureon BCise? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Bydureon BCise, Autoinjektor
Packungen mit 4 Autoinjektoren.
Zulassungsinhaberin
AstraZeneca AG, 6340 Baar
Diese Packungsbeilage wurde im Februar 2021 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
BEDIENUNGSANLEITUNG
Lesen Sie diese Anleitung sorgfältig vor der Anwendung.
Nur zur subkutanen Anwendung
Einzeldosis-Autoinjektor einmal wöchentlich
BCise ist die Bezeichnung des Autoinjektor-Gerätes, das zur Injektion Ihres Arzneimittels
Bydureon verwendet wird.

Bevor Sie mit der Anwendung beginnen
Der Bydureon BCise, Autoinjektor:
- ist ein Autoinjektor mit einer festgelegten Dosis zur einmaligen Anwendung, der automatisch Ihr Arzneimittel injiziert.
- befindet sich in einer Sperrposition, bevor Sie ihn benutzen. Entsperren Sie den Autoinjektor erst dann, wenn Sie für die Injektion bereit sind.
- hat eine verdeckte Nadel. Diese ist für Sie vor, während und nach Anwendung des Autoinjektors nicht sichtbar.
- Wenden Sie den Autoinjektor nicht an, wenn Teile beschädigt oder kaputt aussehen.
- Lagern Sie ihn flach im Kühlschrank zwischen 2 °C und 8 °C.
- Der Bydureon BCise, Autoinjektor sollte nicht von Personen angewendet werden, die blind sind oder schlecht sehen können, es sei denn, eine andere Person, die mit der Anwendung dieses Gerätes vertraut ist, kann Hilfestellung leisten.
- Bewahren Sie den Autoinjektor für Kinder unzugänglich auf.
Vor der Anwendung
Ihr Arzt oder Ihre Ärztin zeigt Ihnen, wie dieses Arzneimittel zu injizieren ist, bevor Sie es das erste Mal anwenden.

Was Sie für Ihre Injektion benötigen:
• Bydureon BCise Autoinjektor • Alkohol-Tupfer • eine saubere, ebene Oberfläche • durchstechsicheres Behältnis (siehe Hinweise zur «Entsorgung» am Ende dieser Bedienungsanleitung).
SCHRITT 1: Vorbereitung der Injektion | |
|
|
an Ihrem Bauch, Oberschenkel oder der Rückseite des Oberarms (siehe Abbildung 4). Sie können jede Woche denselben Körperbereich nutzen, müssen dann aber eine andere Injektionsstelle in diesem Bereich wählen. Reinigen Sie den Bereich mit einem Alkohol-Tupfer.
| |
SCHRITT 2: Arzneimittel mischen
Sie sehen unter Umständen an den Seiten, oben oder unten weisses Arzneimittelpulver. Dies bedeutet, dass das Arzneimittel nicht gleichmässig gemischt ist. |
|
in einer Auf- und Abwärtsbewegung, bis das Arzneimittel gleichmässig vermischt ist und Sie kein weisses Arzneimittelpulver mehr an den Seiten, oben oder unten sehen können. Schütteln Sie mindestens 15 Sekunden lang. |
|
Halten Sie den Autoinjektor gegen das Licht und sehen Sie durch beide Fenster nach unten auf den Boden. Sollte nicht gut gemischt sein, wiederholen Sie Schritt 2 und überprüfen Sie nochmals.
Gehen Sie erst weiter zum nächsten Schritt, wenn Ihr Arzneimittel gut gemischt ist. Um die volle Dosis zu erhalten, muss das Arzneimittel gut gemischt sein und milchig aussehen. Sollte es noch nicht gut gemischt sein, schütteln Sie weiter kräftig. | |
SCHRITT 3: Autoinjektor-Vorbereitung Wichtig: Sobald Ihr Arzneimittel vollständig gemischt ist, müssen Sie die Vorbereitungsschritte sofort durchführen und injizieren, um die volle Dosis zu erhalten. Bewahren Sie es nicht für eine spätere Anwendung auf. Entsperren Sie den Autoinjektor erst, wenn Sie für die Injektion bereit sind.
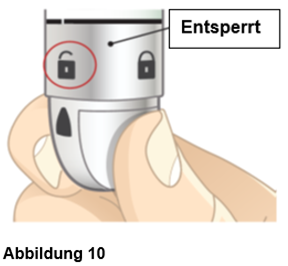
Halten Sie den Autoinjektor senkrecht. Die orange Kappe zeigt nach oben. Drehen Sie den Drehknopf von der Sperr- in die Entsperrungsposition, bis Sie ein Klickgeräusch hören.
Es ist normal, wenn man einige Tropfen Flüssigkeit innerhalb der Kappe sieht. Setzen Sie die Kappe nicht wieder auf den Autoinjektor auf. Entsorgen Sie die Kappe.
| |
SCHRITT 4: Injizieren der Dosis
Nachdem Sie Ihre Injektion beendet haben, sehen Sie ein oranges Stäbchen im Fenster. Wenn Sie den Autoinjektor von der Haut weggenommen haben, geht die grüne Blende wieder zurück, um die Nadel zu sichern. Siehe «Häufig gestellte Fragen & Antworten» wie vorzugehen ist, wenn nach der Injektion kein oranges Stäbchen im Fenster erscheint.
| |
Entsorgen Sie Ihren Autoinjektor ordnungsgemäss unmittelbar nach Anwendung, wie es Ihnen von Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin erklärt wurde. Sie benötigen ein durchstechsicheres Behältnis, das:
Sie können Hartplastik-Behälter oder einen Metall-Behälter verwenden. |
|
Häufige Fragen und Antworten
1. Wo ist die Nadel?
Die Nadel ist fest mit dem Autoinjektor verbunden und wird von der orangen Kappe bedeckt. Wenn Sie die orange Kappe abdrehen, wird die Nadel durch die grüne Blende verdeckt, bis Sie die Injektion vornehmen. Für weitere Informationen, siehe Abbildung 14 in Schritt 3B in der Bedienungsanleitung.
2. Wie weiss ich, dass das Arzneimittel vollständig gemischt ist?
Sehen Sie durch beide Seiten des Fensters hindurch, nachdem Sie den Autoinjektor geschüttelt haben. Sie sollten kein weisses Arzneimittelpulver unten, oben oder an den Seiten sehen. Sollten Sie weisses Arzneimittelpulver sehen, ist es noch nicht gemischt. Um es zu mischen, schütteln Sie den Autoinjektor kräftig, bis kein Arzneimittel mehr unten, oben oder an den Seiten zu sehen ist. Die Mischung sollte überall gleichmässig aussehen (siehe Bilder in den Abbildungen 7 und 8, Schritt 2C).
3. Warum muss ich den Autoinjektor aufrecht halten, wenn ich die orange Kappe löse?
Die aufrechte Position des Autoinjektors beim Entfernen der orangen Kappe verhindert, dass Arzneimittel austritt. Es ist aber normal, wenn Sie einige Tropfen Arzneimittel in der orangen Kappe sehen, nachdem Sie sie abgedreht haben.
4. Warum muss ich mein Arzneimittel unmittelbar nach dem Mischen injizieren?
Wenn Sie Ihr Arzneimittel nicht unmittelbar nach dem Mischen spritzen, könnte sich Ihre Arzneimittelmischung wieder trennen und Sie bekommen nicht die volle Dosis. Sie können Ihr Arzneimittel nochmals mischen, wenn Ihr Autoinjektor sich in der Sperrposition befindet. Nachdem Sie ihn entsperrt haben, müssen Sie jedoch die Vorbereitungsschritte unverzüglich vornehmen und injizieren, um die volle Dosis zu erhalten. Sie können ihn nicht für eine spätere Anwendung aufheben.
5. Woher weiss ich, dass ich mir die vollständige Dosis meines Arzneimittels gegeben habe?
Um sicherzustellen, dass Sie Ihre vollständige Dosis erhalten, drücken und halten Sie den Autoinjektor gegen Ihre Haut. Sie werden es spüren, wenn die Nadel in Ihre Haut sticht. Halten Sie die Nadel 15 Sekunden lang gegen Ihre Haut. Das ist genügend Zeit für das Arzneimittel, um vom Autoinjektor bis unter Ihre Haut zu gelangen. Nachdem Sie die Nadel herausgezogen haben, überprüfen Sie, ob Sie das orange Stäbchen im Fenster sehen als Zeichen dafür, dass die Dosis abgegeben wurde.
6. Warum muss ich meinen Autoinjektor flach im Kühlschrank lagern?
Autoinjektoren, die senkrecht (mit der Nadel nach oben oder unten) gelagert werden, sind schwerer zu mischen. Das Arzneimittel kann dann zwar noch immer gemischt werden, aber dafür muss man mehr schütteln und es dauert länger.
7. Wie kann ich meinen Bydureon BCise Autoinjektor entsorgen?
Entsorgen Sie Ihren Autoinjektor nicht im Haushaltsabfall. Sie benötigen ein durchstechsicheres Behältnis, das gross genug für den ganzen Autoinjektor ist. Stellen Sie sicher, dass das Behältnis einen Deckel hat. Sie können einen Behälter für biologische Risikostoffe verwenden, einen anderen Hartplastik-Behälter oder einen Metall-Behälter. Ein Behälter ist im Umkarton nicht enthalten.
Recyceln Sie das Behältnis mit den benutzten Autoinjektoren nicht. Fragen Sie Ihren Apotheker, wie man es sicher entsorgen kann. Entsorgen sie den Behälter nicht in Ihrem Haushaltsabfall.
8. Was ist zu tun, wenn das Gerät nicht funktioniert und ich es nicht entsperren kann?
Lesen Sie noch einmal Schritt 3 der Bedienungsanleitung für Anwender durch, um zu überprüfen, ob Sie die Reihenfolge der Schritte befolgt haben. Versuchen Sie nicht, den Autoinjektor durch grosse Krafteinwirkung oder mit Werkzeugen zu entsperren, sondern wenden Sie sich an Ihren Arzt resp. Ärztin.
9. Was ist zu tun, wenn das Gerät nicht funktioniert und ich die orange Kappe nicht entfernen
kann?
Lesen Sie noch einmal Schritt 3 der Bedienungsanleitung für Anwender durch, um zu überprüfen, ob Sie die Reihenfolge der Schritte befolgt haben und stellen Sie auch sicher, dass der Drehknopf sich vollständig in der Entsperrungsposition befindet. Versuchen Sie nicht, die Kappe mit Werkzeugen oder durch grosse Krafteinwirkung zu lösen, sondern wenden Sie sich an Ihren Arzt resp. Ärztin.
10. Wo ich mehr über Bydureon BCise erfahren kann
- Fragen Sie Ihren Arzt, Apotheker oder das medizinisches Fachpersonal
- Lesen Sie die Packungsbeilage sorgfältig durch.
Wie der Bydureon BCise Autoinjektor aufzubewahren ist
- Flach und im Kühlschrank lagern (2 °C – 8 °C).
- In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
- Bydureon BCise kann vor der Anwendung bis zu 4 Wochen bei Temperaturen von nicht über 30 °C gelagert werden.
- Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
- Halten Sie den Autoinjektor sauber und fern von Verschmutzungen.
- Ausser Reichweite von Kindern aufbewahren.
Qu'est-ce que Bydureon BCise et quand doit-il être utilisé?
Selon prescription du médecin.
Bydureon BCise est un médicament injectable contenant le principe actif exénatide, qui est utilisé pour améliorer le contrôle du taux de sucre dans le sang (glycémie) chez les patients adultes atteints de diabète de type 2 (non insulinodépendant).
Vous avez un diabète parce que votre corps ne produit pas suffisamment d'insuline pour contrôler votre glycémie ou parce que votre corps n'est pas en mesure d'utiliser correctement l'insuline qu'il produit. Bydureon BCise aide votre corps à produire plus d'insuline lorsque votre glycémie est élevée. Vous prenez déjà des comprimés pour traiter votre diabète et vous devez observer un régime alimentaire et un programme d'activité physique bien définis. Comme ces mesures ne permettent pas de contrôler suffisamment votre glycémie, votre médecin vous a prescrit Bydureon BCise comme médicament complémentaire pour vous permettre de garder votre glycémie sous contrôle.
Vous n'avez pas besoin de mesurer votre glycémie pendant le traitement avec Bydureon BCise. Toutefois, si un médicament de type sulfonylurée vous a été prescrit, votre médecin peut vous demander de mesurer votre glycémie.
Bydureon BCise n'est pas un substitut à l'insuline chez les patients nécessitant un traitement par l'insuline.
Quand Bydureon BCise ne doit-il pas être utilisé?
Bydureon BCise ne doit pas être utilisé en cas d'hypersensibilité connue au principe actif ou à l'un des excipients.
Quelles sont les précautions à observer lors de l'utilisation de Bydureon BCise?
Bydureon BCise est à utiliser avec prudence,
- si vous souffrez de troubles sévères de la vidange gastrique (gastroparésie inclue) ou de la digestion. Dans ce cas, demandez conseil à votre médecin avant d'utiliser Bydureon BCise. Bydureon ralentit la vidange gastrique, de sorte que la nourriture transite plus lentement par votre estomac.
- si vous utilisez Bydureon BCise en association avec une sulfonylurée, car cela peut entraîner un taux de sucre sanguin trop bas (hypoglycémie). En cas de doutes, demandez à votre médecin ou à votre pharmacien si l'un des médicaments que vous prenez contient de la metformine ou une sulfonylurée.
- Si vous souffrez d'une maladie rénale, veuillez en informer votre médecin qui décidera si vous pouvez utiliser Bydureon BCise.
- Des cas d'inflammation du pancréas (pancréatite) ont été rapportés chez des patients utilisant Bydureon BCise. Une pancréatite est une maladie grave pouvant mettre la vie en danger. Arrêtez l'utilisation de Bydureon BCise et consultez votre médecin si vous éprouvez des maux de ventre violents et persistants, avec ou sans vomissements, car il se peut que vous souffriez d'une pancréatite.
On ne dispose pas d'expérience sur l'utilisation de Bydureon BCise chez les enfants et les adolescents de moins de 18 ans. L'utilisation de Bydureon BCise n'est donc pas recommandée chez les patients de ce groupe d'âge.
Si vous utilisez Bydureon BCise en association avec une sulfonylurée, il se peut que votre taux de sucre sanguin devienne trop bas (hypoglycémie). L'hypoglycémie peut altérer votre capacité de concentration. Veuillez tenir compte de l'éventualité d'une baisse de la capacité de concentration dans toutes les situations où vous pourriez vous exposer, vous-même et d'autres personnes, à un danger (c'est-à-dire lors de la conduite d'un véhicule ou de l'utilisation de machines). En raison d'effets indésirables tels que nausées, vertiges et fatigue, la capacité de conduire un véhicule et d'utiliser des machines peut être altérée.
Veuillez informer votre médecin ou votre pharmacien si:
- vous souffrez d'une autre maladie
- vous êtes allergique
- vous prenez déjà d'autres médicaments (même en automédication !).
Bydureon BCise peut-il être utilisé pendant la grossesse ou l'allaitement?
On ignore si Bydureon BCise peut porter atteinte à l'enfant à naître. Consultez votre médecin si vous êtes enceinte, si vous pensez l'être ou si vous planifiez une grossesse, car Bydureon BCise ne doit pas être utilisé pendant la grossesse et au moins 3 mois avant une grossesse planifiée.
Les femmes en âge de procréer doivent utiliser une méthode de contraception efficace.
On ignore si Bydureon BCise passe dans le lait maternel. Par conséquent, Bydureon BCise ne doit pas être utilisé pendant l'allaitement ou l'allaitement doit être interrompu.
Comment utiliser Bydureon BCise?
Utilisez toujours Bydureon BCise en suivant exactement les recommandations de votre médecin ou de votre conseiller/ère en diabétologie.
Bydureon est injecté une fois par semaine. L'injection peut se faire à n'importe quel moment de la journée et indépendamment des repas.
Bydureon s'injecte sous la peau (injection sous-cutanée) au niveau de la cuisse, du ventre ou à l'arrière de la partie supérieure du bras. NE PAS injecter dans une veine ou dans un muscle !
Il se peut que votre médecin vous ait recommandé de mesurer régulièrement vous-même votre glycémie; cela est particulièrement important si vous prenez en même temps une sulfonylurée.
Veuillez lire le Manuel d'utilisation ci-joint avant d'utiliser Bydureon BCise.
Avant la première utilisation, votre médecin ou votre conseiller/ère en diabétologie vous montrera comment préparer et utiliser ce médicament.
Sortez Bydureon BCise, auto-injecteur du réfrigérateur et laissez-le à plat pendant au moins 15 minutes. Mélangez la suspension en secouant vigoureusement Bydureon BCise, auto-injecteur pendant au moins 15 secondes. Utilisez la suspension seulement si elle est mélangée uniformément, si elle est de couleur blanche à blanc cassé et d'aspect laiteux. Si de la poudre blanche du médicament est visible au niveau des côtés, le haut ou le bas de la fenêtre de l'auto-injecteur, le médicament N'est PAS suffisamment mélangé. Secouez à nouveau vigoureusement jusqu'à ce que tout soit bien mélangé. Vous devez injecter ce médicament immédiatement après le mélange de la suspension.
Si vous avez utilisé plus de Bydureon BCise que vous n'auriez dû
Si vous vous êtes injecté trop de Bydureon BCise, adressez-vous à votre médecin. Un surdosage de Bydureon BCise peut provoquer des nausées, des vomissements, une sensation de vertige ou des symptômes d'hypoglycémie.
Si vous avez oublié d'utiliser Bydureon BCise
Choisissez un jour de la semaine où vous souhaitez effectuer votre injection de Bydureon BCise de manière systématique.
Si vous oubliez une injection et qu'il reste au moins 3 jours avant la prochaine dose prévue, prenez la dose oubliée dès que possible. Vous pouvez ensuite effectuer la prochaine injection le jour habituel. Si vous oubliez une injection et qu'il ne reste que 1 ou 2 jours avant la prochaine dose, n'effectuez pas l'injection oubliée et effectuez la suivante comme d'habitude, le jour prévu. Vous pouvez également changer le jour que vous aviez choisi pour effectuer votre injection, à condition que la dernière dose ait été administrée au moins 3 jours avant.
N'injectez pas 2 doses de Bydureon BCise à moins de 3 jours d'intervalle.
Si vous n'êtes pas certain(e) d'avoir injecté la totalité de la dose de Bydureon BCise
Si vous n'êtes pas certain(e) d'avoir injecté la dose complète, n'injectez pas une nouvelle dose de Bydureon BCise, mais injectez la dose suivante une semaine plus tard comme prévu.
N'arrêtez pas le traitement sans que votre médecin vous l'ait expressément prescrit. L'arrêt du traitement par Bydureon BCise peut avoir de graves répercussions sur votre glycémie.
Ne changez pas le dosage prescrit de votre propre chef. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Quels effets secondaires Bydureon BCise peut-il provoquer?
L'auto-injecteur Bydureon BCise
Des réactions allergiques graves (anaphylaxie) ont été rapportées dans de rares cas.
Consultez votre médecin immédiatement si vous ressentez les symptômes suivants: gonflement du visage, de la langue ou de la gorge (angio-œdème), hypersensibilité (éruption cutanée, démangeaisons et gonflement rapide du cou, du visage, de la bouche ou de la gorge), difficultés à avaler, urticaire et difficultés à respirer.
Des cas d'inflammation du pancréas (pancréatite) ont été rapportés occasionnellement chez des patients qui utilisaient l'auto-injecteur Bydureon BCise. Une pancréatite est une maladie grave pouvant mettre la vie en danger.
Informez votre médecin si vous avez souffert par le passé d'une pancréatite, de calculs biliaires ou d'alcoolisme ou si vous avez eu des taux de lipides sanguins très élevés. Tous ces antécédents peuvent augmenter le risque de voir apparaître ou réapparaître une pancréatite. Contactez immédiatement votre médecin si vous ressentez des maux de ventre violents et persistants, avec ou sans vomissements, car il se peut que vous souffriez d'une pancréatite.
L'hypoglycémie (faible taux de sucre sanguin) est un effet secondaire très fréquent de l'auto-injecteur Bydureon BCise en cas d'utilisation avec un médicament contenant une sulfonylurée. Les signes et symptômes d'un faible taux de sucre sanguin incluent: maux de tête, sensations de vertige, faiblesse, hébétude, confusion, irritabilité, sensation de faim, accélération du rythme cardiaque, transpiration et nervosité. Votre médecin vous informera des méthodes de traitement d'une hypoglycémie.
D'autres effets secondaires fréquents possibles sont l'hypoglycémie (faible taux de sucre dans le sang) en cas d'association avec de l'insuline, les maux de tête, les sensations de vertige, les nausées (les nausées sont fréquentes au début du traitement avec ce médicament, mais diminuent avec le temps chez la plupart des patients), les diarrhées, les vomissements, la constipation, les troubles digestifs, les brûlures d'estomac, le gonflement du ventre, les douleurs dans la région de l'estomac et la fatigue.
Les effets secondaires occasionnels sont l'hypoglycémie (faible taux de sucre dans le sang, qui peut également se produire lorsque Bydureon BCise n'est pas utilisé en association avec une sulfonylurée ou de l'insuline) et la diminution de l'appétit en raison de nausées. Informez votre médecin si vous perdez du poids trop rapidement (plus de 1,5 kg par semaine). D'autres effets secondaires occasionnels sont la déshydratation, un goût inhabituel dans la bouche, une somnolence, des ballonnements, des renvois, une occlusion intestinale (blocage au niveau des intestins), une urticaire, une augmentation de la transpiration, une éruption cutanée, des démangeaisons, une chute de cheveux, une détérioration de la fonction rénale, un manque d'énergie et de force et des réactions au site d'injection.
Si vous présentez des réactions au site d'injection (rougeur, éruption cutanée ou démangeaisons), demandez à votre médecin ce qui peut soulager les symptômes. Après l'injection, de petits nodules peuvent apparaître au site d'injection; environ 50 % de ces nodules disparaissent sous 4 à 8 semaines, mais certains restent perceptibles pendant des mois. Vous ne devez pas arrêter le traitement.
Dans des cas rares, une sensation de tremblement a été rapportée.
En outre, des réactions graves au site d'injection telles qu'abcès ou inflammations bactériennes (rares) et des modifications de la coagulation du sang lors de l'utilisation simultanée de médicaments destinés à fluidifier le sang ont été rapportées.
Chez les patients utilisant Bydureon, des cas de réduction du nombre de plaquettes sanguines (thrombocytopénie) causée par le médicament ont été rapportés.
Si l'un des effets secondaires mentionnés survient ou si vous remarquez des effets secondaires qui ne sont pas mentionnés dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
À quoi faut-il encore faire attention?
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
L'auto-injecteur Bydureon BCise
Conserver à plat et au réfrigérateur (2 °C - 8 °C).
Conserver dans l'emballage d'origine pour protéger le contenu de la lumière.
Bydureon BCise peut être conservé jusqu'à 4 semaines avant utilisation à une température ne dépassant pas 30 °C.
Suivez le Manuel d'utilisation.
Bydureon BCise doit être injecté directement après la préparation du médicament.
Conserver hors de portée des enfants.
Ne jetez aucun médicament au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien d'éliminer les médicaments que vous n'utilisez plus. Vous contribuerez ainsi à protéger l'environnement.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Bydureon BCise?
Principes actifs
Le principe actif est l'exénatide. Chaqu'auto-injecteur Bydureon BCise délivre 2 mg d'exénatide par injection.
Excipients
Les excipients de l'auto-injecteur Bydureon BCise sont: acide poly-D,L-lactique-co-glycolique, saccharose et triglycérides à chaîne moyenne.
L'auto-injecteur Bydureon BCise
Propriétés optiques
Suspension d'aspect laiteux, de couleur blanche à blanc cassé dans un auto-injecteur.
Numéro d'autorisation
67503 (Swissmedic)
Où obtenez-vous Bydureon BCise? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
L'auto-injecteur Bydureon BCise
Emballages de 4 auto-injecteurs.
Titulaire de l'autorisation
AstraZeneca AG, 6340 Baar
Cette notice d'emballage a été vérifiée pour la dernière fois en février 2021 par l'autorité de contrôle des médicaments (Swissmedic).
MANUEL D’UTILISATION
Lisez attentivement ce manuel avant utilisation.
Voie sous-cutanée exclusivement
Auto-injecteur unidose une fois par semaine
BCise est le nom du dispositif de l’auto-injecteur utilisé pour injecter votre médicament
Bydureon.

Avant de commencer
L’auto-injecteur Bydureon BCise:
- est un auto-injecteur à dose fixe et à usage unique qui injecte automatiquement votre médicament.
- est en position verrouillée avant l’utilisation. Déverrouillez l’auto-injecteur seulement lorsque vous êtes prêt à réaliser l’injection.
- dispose d’une aiguille recouverte. Elle n’est pas visible avant, pendant, ni après l’utilisation de l’auto-injecteur.
- N’utilisez pas l’auto-injecteur si l’un des composants semble endommagé ou cassé.
- Conservez-le à plat au réfrigérateur, à une température comprise entre 2 °C et 8 °C.
- L’auto-injecteur Bydureon BCise ne doit pas être utilisé par des personnes aveugles ou malvoyantes, à moins qu’une autre personne formée à l’utilisation de ce dispositif puisse vous apporter son aide.
- Conserver l’auto-injecteur hors de portée des enfants.
Avant l’utilisation
Votre médecin vous montrera comment injecter ce médicament avant de l’utiliser pour la première fois.

Pour réaliser l’injection, il vous faut:
• L’auto-injecteur Bydureon BCise • Un tampon imbibé d’alcool • Une surface propre et plane • Un récipient sécurisé résistant à la perforation (voir rubrique «Élimination» à la fin de ce Manuel d’utilisation).
ÉTAPE 1: préparation de l’injection | |
|
|
au niveau du ventre, de la cuisse ou de l’arrière de la partie supérieure du bras (voir Figure 4). Vous pouvez utiliser la même zone du corps chaque semaine, mais vous devez chaque fois choisir un site d’injection différent dans cette zone. Nettoyez la zone avec un tampon imbibé d’alcool.
| |
ÉTAPE 2: mélangez le médicament
Il est possible que vous voyiez de la poudre de médicament de couleur blanche au niveau des côtés, le haut ou le bas de la fenêtre. Cela signifie que le médicament n’est pas mélangé uniformément. |
|
de haut en bas et de bas en haut, jusqu’à ce que le médicament soit mélangé uniformément et que vous ne voyiez plus de poudre de médicament de couleur blanche au niveau des côtés, le haut ou le bas de la fenêtre. Secouez pendant au moins 15 secondes. |
|
Tenez l’auto-injecteur à contre-jour et regardez au niveau des deux côtés et de la partie inférieure de la fenêtre. Si le médicament n’est pas bien mélangé, répétez l’étape 2 et vérifiez à nouveau.
Passez à l’étape suivante seulement si votre médicament est bien mélangé. Pour administrer une dose complète, le médicament doit être bien mélangé et avoir un aspect laiteux. S’il n’est pas bien mélangé, continuez à secouer vigoureusement. | |
ÉTAPE 3: préparation de l’auto-injecteur Important: Une fois votre médicament est complètement mélangé, vous devez procéder immédiatement aux étapes de préparation et à l’injection pour administrer la dose complète. Ne le conservez pas pour un usage ultérieur. Déverrouillez l’auto-injecteur seulement lorsque vous êtes prêt à réaliser l’injection.
Tenez l’auto-injecteur en position verticale, avec le capuchon orange vers le haut. Tournez la molette pour passer de la position verrouillée à la position déverrouillée, jusqu’à ce que vous entendiez un clic.
Il est normal de voir quelques gouttes de liquide à l’intérieur du capuchon. Ne remettez pas le capuchon sur l’auto-injecteur. Jetez le capuchon.
| |
ÉTAPE 4: injection de la dose
Quand vous aurez terminé votre injection, vous verrez une tige orange à travers la fenêtre. Après avoir retiré l’auto-injecteur de votre peau, le couvre-aiguille vert viendra recouvrir l’aiguille. Consultez «Questions et réponses fréquentes» pour connaître la marche à suivre si vous ne voyez pas la tige orange à travers la fenêtre après l’injection.
| |
Éliminez votre auto-injecteur de manière adéquate immédiatement après utilisation, comme votre médecin ou votre pharmacien vous l’a indiqué. Vous devez disposer d’un récipient sécurisé résistant à la perforation:
Vous pouvez utiliser un récipient en plastique dur ou un récipient en métal. |
|
Questions et réponses fréquentes
1. Où se trouve l’aiguille ?
L’aiguille est fixée à l’auto-injecteur et recouverte par le capuchon orange. Lorsque vous dévissez le capuchon orange, le couvre-aiguille vert recouvre l’aiguille jusqu’au moment de l’injection. Pour plus d’informations, consultez la Figure 14 à l’étape 3B du Manuel d’utilisation.
2. Comment puis-je savoir que le médicament est complètement mélangé ?
Après avoir secoué l’auto-injecteur, regardez au niveau des deux côtés de la fenêtre. Vous ne devez pas voir de poudre de médicament de couleur blanche en bas, en haut ou au niveau des côtés. Si vous voyez de la poudre de médicament de couleur blanche, le médicament n’est pas bien mélangé. Pour le mélanger, secouez vigoureusement l’auto-injecteur jusqu’à ce qu’il n’y ait plus de médicament visible en bas, en haut ou au niveau des côtés. Le médicament doit avoir un aspect uniforme (voir les schémas des Figures 7 et 8 à l’étape 2C).
3. Pourquoi dois-je tenir l’auto-injecteur en position verticale lors du retrait du capuchon orange ?
Le fait de tenir l’auto-injecteur en position verticale lors du retrait du capuchon orange permet d’éviter toute fuite de médicament. Il est cependant normal de voir quelques gouttes de médicament à l’intérieur du capuchon orange après l’avoir dévissé.
4. Pourquoi dois-je injecter mon médicament tout de suite après l’avoir mélangé ?
Si vous n’injectez pas votre médicament tout de suite après l’avoir mélangé, une séparation des phases du mélange peut se produire et la dose complète ne sera pas administrée. Vous pouvez mélanger à nouveau votre médicament si votre auto-injecteur est en position verrouillée. Cependant, une fois que vous l’avez déverrouillé, vous devez procéder immédiatement aux étapes de préparation et à l’injection pour assurer que la dose complète soit administrée. Vous ne pouvez pas conserver le médicament pour une utilisation ultérieure.
5. Comment puis-je savoir si j’ai administré la dose complète de médicament ?
Afin de s’assurer d’administrer la dose complète, appuyez et maintenez l’auto-injecteur contre votre peau. Vous sentirez l’aiguille pénétrer dans votre peau. Maintenez l’aiguille dans la peau pendant 15 secondes. Cela laissera suffisamment de temps pour que tout le médicament passe de l’auto-injecteur dans votre peau. Après avoir retiré l’aiguille, vérifiez que vous voyez la tige orange à travers la fenêtre, qui indique que la dose a été administrée.
6. Pourquoi dois-je conserver mon auto-injecteur à plat au réfrigérateur ?
Quand l’auto-injecteur est conservé en position verticale (avec l’aiguille vers le haut ou vers le bas), le médicament est plus difficile à mélanger. Il peut certes être mélangé complètement, mais il faut davantage secouer l’auto-injecteur et cela prend plus de temps.
7. Comment dois-je éliminer l’auto-injecteur Bydureon BCise ?
Ne jetez pas l’auto-injecteur avec vos déchets ménagers. Vous devez disposer d’un récipient sécurisé résistant à la perforation suffisamment grand pour contenir l’auto-injecteur en entier. Assurez-vous que le récipient est muni d’un couvercle. Vous pouvez utiliser un récipient pour déchets biologiques, un récipient en plastique dur ou un récipient en métal. L’emballage ne contient pas de récipient pour déchets.
Ne recyclez pas le récipient avec les auto-injecteurs usagés. Demandez à votre pharmacien comment l’éliminer en toute sécurité. Ne jetez pas le récipient avec vos déchets ménagers.
8. Que dois-je faire si le dispositif ne fonctionne pas et que je ne peux pas le déverrouiller ?
Relisez l’étape 3 du Manuel d’utilisation afin de vérifier que vous avez effectué les étapes dans l’ordre indiqué. N’essayez pas de déverrouiller l’auto-injecteur en forçant ou en utilisant des outils, mais adressez-vous à votre médecin.
9. Que dois-je faire si le dispositif ne fonctionne pas et si je n’arrive pas à retirer le capuchon orange ?
Relisez l’étape 3 du Manuel d’utilisation afin de vérifier que vous avez effectué les étapes dans l’ordre indiqué et assurez-vous que la molette est bien en position déverrouillée. N’essayez pas de retirer le capuchon en forçant ou en utilisant des outils, mais adressez-vous à votre médecin.
10. Pour en savoir davantage au sujet de Bydureon BCise
- Adressez-vous à votre médecin, à votre pharmacien ou à un professionnel de santé
- Lisez attentivement la notice d’emballage.
Comment conserver l’auto-injecteur Bydureon BCise
- Conserver à plat et au réfrigérateur (2 °C - 8 °C).
- Conserver dans l’emballage d’origine afin de protéger le contenu de la lumière.
- Bydureon BCise peut être conservé jusqu’à 4 semaines avant utilisation à une température ne dépassant pas 30 °C.
- Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
- Maintenez l’auto-injecteur propre et à l’abri des impuretés.
- Conserver hors de portée des enfants.
Che cos'è Bydureon BCise e quando si usa?
Su prescrizione medica.
Bydureon BCise è un medicamento a base del principio attivo exenatide da somministrare mediante iniezione per migliorare il controllo glicemico negli adulti con diabete mellito di tipo 2 (non insulino-dipendente).
Lei ha il diabete perché il suo organismo non produce insulina in quantità adeguata per controllare lo zucchero nel sangue oppure perché l'organismo non è in grado di utilizzare correttamente l'insulina prodotta. Bydureon BCise aiuta l'organismo a produrre più insulina quando il livello di glucosio nel sangue è elevato. Lei assume già compresse contro il diabete e dovrebbe seguire un determinato programma alimentare e fare movimento. Siccome queste misure non sono sufficienti per tenere sotto controllo il suo tasso di zucchero nel sangue, il suo medico le ha prescritto Bydureon BCise come ulteriore medicamento per aiutarla a tenere sotto controllo il livello glicemico.
Durante la terapia con Bydureon BCise non è necessario misurare il livello glicemico. Qualora tuttavia le fosse prescritto un medicamento appartenente alla classe delle sulfoniluree, il suo medico potrà chiederle di misurare il suo livello glicemico.
Bydureon BCise non è un sostituto dell'insulina per pazienti il cui diabete richiede un trattamento con insulina.
Quando non si può usare Bydureon BCise?
Bydureon BCise non può essere usato in caso di ipersensibilità nota al principio attivo o a una qualsiasi delle sostanze ausiliarie.
Quando è richiesta prudenza nell'uso di Bydureon BCise?
È richiesta prudenza nell'uso di Bydureon BCise nei seguenti casi:
- Se ha problemi gravi di svuotamento dello stomaco (inclusa la gastroparesi) o di digestione. In questo caso, chieda consiglio al suo medico prima di utilizzare Bydureon BCise. Bydureon rallenta lo svuotamento gastrico pertanto il cibo attraversa lo stomaco più lentamente.
- Se utilizza Bydureon BCise in associazione ad una sulfonilurea, poiché può verificarsi una riduzione dei livelli di zucchero nel sangue (ipoglicemia). Chieda al medico o al farmacista qualora lei non sia certo/a se uno degli altri medicamenti che sta usando contiene metformina o una sulfonilurea.
- Se soffre di una malattia renale, informi il suo medico, il quale deciderà se lei possa usare Bydureon BCise.
- Sono stati osservati casi d'infiammazione del pancreas (pancreatite) nei pazienti che usano Bydureon. La pancreatite è una malattia grave, potenzialmente mortale. Interrompa l'uso di Bydureon BCise e consulti il suo medico in presenza di un forte e persistente dolore addominale con o senza vomito, poiché potrebbe soffrire di pancreatite.
Non c'è esperienza sull'uso di Bydureon BCise nei bambini e negli adolescenti sotto i 18 anni e pertanto si sconsiglia l'uso di Bydureon BCise nei pazienti in questa fascia d'età.
Se utilizza Bydureon BCise in associazione a una sulfonilurea, può verificarsi una riduzione dei livelli di zucchero nel sangue (ipoglicemia), che può ridurre la sua capacità di concentrazione. Tenga presente questa potenziale riduzione della sua capacità di concentrazione in tutte le situazioni in cui potrebbe mettere a rischio se stesso e gli altri (per esempio guidare un veicolo o utilizzare macchinari). Effetti collaterali come nausea, capogiri e stanchezza possono alterare la sua capacità di guidare o di utilizzare macchinari.
Informi il suo medico o il suo farmacista, nel caso in cui:
- soffre di altre malattie
- soffre di allergie o
- assume altri medicamenti (anche se acquistati di sua iniziativa!).
Si può usare Bydureon BCise durante la gravidanza o l'allattamento?
Non è noto se Bydureon BCise può avere effetti dannosi sul feto. Parli con il suo medico se è in gravidanza, se sospetta di esserlo o se programma una gravidanza poiché è sconsigliato l'uso di Bydureon BCise durante la gravidanza e per un periodo di almeno 3 mesi prima di una gravidanza programmata.
Le donne in età fertile devono adottare metodi contraccettivi efficaci.
Non è noto se Bydureon passa nel latte materno, pertanto è sconsigliato l'uso di Bydureon BCise durante l'allattamento, oppure è necessario interrompere l'allattamento.
Come usare Bydureon BCise?
Usi Bydureon BCise sempre esattamente come prescritto dal suo medico o dal suo consulente specializzato in diabetologia.
Bydureon deve essere iniettato una volta alla settimana. L'iniezione può essere effettuata in qualsiasi momento della giornata, indipendentemente dai pasti.
Bydureon deve essere iniettato sotto la cute (iniezione sottocutanea) della coscia, nella zona addominale o nella zona posteriore della parte superiore del braccio. NON iniettare in una vena o in un muscolo!
Probabilmente il medico le ha consigliato di misurarsi regolarmente il livello di zucchero nel sangue, in particolare se utilizza contemporaneamente una sulfonilurea.
Legga le istruzioni per l'uso allegate prima di usare Bydureon BCise.
Prima del primo utilizzo, il suo medico o il suo consulente specializzato in diabetologia le mostrerà come preparare e usare questo medicamento.
Prelevi dal frigorifero un autoiniettore Bydureon BCise e lo lasci in posizione orizzontale per almeno 15 minuti. Mescoli la sospensione agitando con forza l'autoiniettore Bydureon BCise per almeno 15 secondi. Usi la sospensione solo se risulta uniformemente miscelata, di colore da bianco a bianco crema e di aspetto lattiginoso. Se lungo i lati della finestra dell'autoiniettore, in basso o in alto dovesse vedere della polvere bianca, il medicamento NON è stato miscelato a sufficienza. Lo agiti ancora una volta con forza fino a mescolare bene il tutto. Il medicamento deve essere iniettato immediatamente dopo aver miscelato la sospensione.
Se ha usato più Bydureon BCise di quanto doveva
Se si è iniettato una quantità eccessiva di Bydureon BCise, si rivolga al suo medico. Una dose eccessiva di Bydureon BCise può provocare nausea, vomito, capogiro o i sintomi causati dalla riduzione del livello di zucchero nel sangue.
Se ha dimenticato di usare Bydureon BCise
Scelga un giorno della settimana in cui desidera eseguire sempre regolarmente l'iniezione di Bydureon BCise.
Se ha dimenticato un'iniezione e la dose successiva è prevista solo dopo 3 giorni o più, la esegua non appena se ne accorge. L'iniezione successiva può essere eseguita nel giorno d'iniezione consueto. Se ha dimenticato un'iniezione e la dose successiva è prevista già dopo 1 o 2 giorni, salti l'iniezione dimenticata ed esegua quella successiva nel giorno previsto. Lei può anche cambiare il giorno che ha scelto per l'iniezione, purché l'ultima dose sia stata iniettata 3 giorni prima o in precedenza.
Non si inietti 2 dosi di Bydureon BCise nell'arco di 3 giorni consecutivi.
Se non è sicuro di essersi somministrato l'intera dose di Bydureon BCise
Se non è sicuro di essersi iniettato la dose completa, non si inietti un'altra dose di Bydureon BCise, ma si inietti la dose successiva a una settimana di distanza come previsto.
Non interrompa il trattamento senza che sia espressamente il suo medico a prescriverglielo. L'interruzione del trattamento con Bydureon BCise può causare gravi conseguenze sul suo livello di zucchero nel sangue.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte, ne parli al suo medico o farmacista.
Quali effetti collaterali può avere Bydureon BCise?
Autoiniettore Bydureon BCise
In rari casi sono state segnalate reazioni allergiche (anafilassi) gravi.
Deve consultare immediatamente il suo medico se manifesta i seguenti sintomi: gonfiore del viso, della lingua e della gola (angioedema), ipersensibilità (eruzione cutanea, prurito e rapido gonfiore del collo, del viso, della bocca o della gola), disturbi della deglutizione, orticaria e affanno.
In pazienti che hanno usato l'autoiniettore Bydureon BCise sono stati segnalati occasionalmente casi di infiammazione del pancreas (pancreatite). La pancreatite è una malattia grave, potenzialmente fatale.
Informi il suo medico se ha già sofferto in passato di pancreatite, calcoli biliari o alcolismo o ha presentato valori molto elevati di grassi nel sangue. Tutto ciò può aumentare il rischio di comparsa o ricomparsa di una pancreatite. Contatti immediatamente il suo medico qualora manifesti dolori addominali forti e persistenti, con o senza vomito, poiché potrebbe soffrire di pancreatite.
L'effetto collaterale molto comune dell'autoiniettore Bydureon BCise è l'ipoglicemia (riduzione del livello di zucchero nel sangue) che si presenta in caso di utilizzo concomitante con un medicamento contenente una sulfanilurea.
Tra i segni e i sintomi di una riduzione del livello di zucchero nel sangue vi sono mal di testa, capogiro, debolezza, stordimento, stato confusionale, irritabilità, fame, battito cardiaco accelerato, sudorazione e nervosismo. Il suo medico la informerà sui metodi per trattare una riduzione del livello di zucchero nel sangue.
Altri possibili effetti collaterali comuni includono ipoglicemia (riduzione del livello di zucchero nel sangue) in caso di utilizzo con insulina, mal di testa, capogiro, nausea (che si manifesta comunemente all'inizio del trattamento con questo medicamento, ma diminuisce con il tempo nella maggior parte dei pazienti), diarrea, vomito, stitichezza, disturbo della digestione, bruciore di stomaco, gonfiore addominale, dolori allo stomaco e stanchezza.
Gli effetti collaterali non comuni sono riduzione del livello di zucchero nel sangue (ipoglicemia, che può anche verificarsi quando Bydureon BCise non viene utilizzato con una sulfonilurea o insulina) e appetito ridotto a causa della nausea. Informi il suo medico se cala di peso troppo rapidamente (calo superiore a 1,5 kg alla settimana). Altri effetti collaterali non comuni sono disidratazione, sapore strano in bocca, sonnolenza, flatulenze, eruttazione, occlusione intestinale, orticaria, sudorazione aumentata, eruzione cutanea, prurito, perdita di capelli, peggioramento della funzionalità renale, mancanza di forza e di energia e reazioni nella sede di iniezione.
Qualora dovesse manifestare reazioni nella sede di iniezione (arrossamento, eruzione cutanea o prurito) chieda al medico cosa può aiutarla ad attenuare i sintomi. È possibile che dopo l'iniezione lei noti dei piccoli noduli nel punto di inserimento dell'ago; il 50% circa di questi noduli scompare entro 4-8 settimane, a volte però si avvertono per mesi. Non deve pertanto interrompere il trattamento.
In rari casi è stata riferita una sensazione di tremore.
Inoltre sono state riferite reazioni gravi nella sede di iniezione, come ad es. ascessi o infiammazioni batteriche (rare) nonché un'alterazione della coagulazione del sangue in caso di utilizzo concomitante con medicamenti anticoagulanti.
In pazienti che utilizzano Bydureon sono stati riferiti casi di una riduzione del numero delle piastrine (trombocitopenia) provocata dal medicamento.
Se si manifesta uno degli effetti collaterali indicati o se osserva effetti collaterali non descritti in questo foglietto illustrativo, si rivolga al suo medico o al suo farmacista.
Di che altro occorre tener conto?
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazione di stoccaggio
Autoiniettore Bydureon BCise
Conservare in frigorifero in posizione orizzontale (2 °C - 8 °C).
Conservare nella confezione originale per proteggere il contenuto dalla luce.
Bydureon BCise può essere conservato prima dell'uso a temperature non superiori a 30 °C per un massimo di 4 settimane.
Osservare le istruzioni per l'uso.
Bydureon BCise deve essere iniettato immediatamente dopo essere stato preparato.
Conservare fuori dalla portata dei bambini.
Non smaltisca il medicamento nell'acqua di scarico e nei rifiuti domestici. Chieda al suo farmacista come smaltire il medicamento quando non lo userà più. In questo modo contribuirà a proteggere l'ambiente.
Il suo medico e il suo farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Bydureon BCise?
Principi attivi
Il principio attivo è exenatide. Ogni autoiniettore Bydureon BCise rilascia 2 mg di exenatide per iniezione.
Sostanze ausiliarie
Le sostanze ausiliarie di un autoiniettore Bydureon BCise sono: poli-(D,L-lattide-co-glicolide), saccarosio e trigliceridi a catena media.
Autoiniettore Bydureon BCise
Caratteristiche ottiche
Sospensione lattiginosa, di colore da bianco a bianco crema, in un autoiniettore.
Numero dell'omologazione
67503 (Swissmedic)
Dove è ottenibile Bydureon BCise? Quali confezioni sono disponibili?
In farmacia, dietro presentazione della prescrizione medica.
Autoiniettore Bydureon BCise
Confezioni con 4 autoiniettori.
Titolare dell'omologazione
AstraZeneca AG, 6340 Baar
Questo foglietto illustrativo è stato controllato l'ultima volta nel febbraio 2021 dall'autorità competente in materia di medicamenti (Swissmedic).
ISTRUZIONI PER L’USO
Legga attentamente queste istruzioni prima dell’uso
Solo per uso sottocutaneo
Autoiniettore a dose singola una volta alla settimana
BCise è la designazione del dispositivo dell’autoiniettore che si usa per iniettare il medicamento Bydureon.

Prima di iniziare
L’autoiniettore Bydureon BCise
- è un autoiniettore a dose fissa monouso che inietta automaticamente il medicamento.
- si trova in posizione di blocco prima dell’uso. Sbloccare l’autoiniettore soltanto quando si è pronti per l’iniezione.
- ha un ago nascosto, che non è visibile prima, durante e dopo l’uso dell’autoiniettore stesso.
- Non usare l’autoiniettore se presenta parti danneggiate o rotte.
- Conservarlo in frigorifero in posizione orizzontale a temperatura compresa tra 2°C e 8°C.
- L’autoiniettore Bydureon BCise non deve essere usato da persone cieche o che non vedono bene, a meno che possano essere aiutate da un’altra persona che sa usare il dispositivo.
- Conservare l’autoiniettore fuori dalla portata dei bambini.
Prima dell’uso
Il suo medico le mostrerà come effettuare l’iniezione di questo medicamento prima che lei lo usi per la prima volta.

Occorrente per l’iniezione
• Autoiniettore Bydureon BCise • Tampone imbevuto di alcool • Superficie piana e pulita • Contenitore resistente alla puntura (vedere le indicazioni per lo «smaltimento» alla fine di queste istruzioni per l’uso).
FASE 1: preparazione dell’iniezione | |
|
|
nella pancia, nella coscia o nella parte superiore del braccio (vedere Figura 4). Ogni settimana può usare la stessa area del corpo, ma deve scegliere un punto di iniezione diverso in questa zona. Pulire l’area con un tampone imbevuto di alcool.
| |
FASE 2: miscelare il medicamento
Se vede della polvere bianca del medicamento lungo i lati, in alto o in basso, significa che il medicamento non è stato miscelato in modo uniforme. |
|
con un movimento su e giù, finché il medicamento non è miscelato uniformemente e non si vede più la polvere bianca lungo i lati, in alto o in basso. Agitare per almeno 15 secondi. |
|
Tenere l’autoiniettore in controluce e guardare attraverso entrambi i lati e la parte inferiore della finestra. Se il medicamento non dovesse essere ben miscelato, ripetere la fase 2 e ricontrollare.
Passare alla fase successiva solo quando il medicamento è ben miscelato. Per poter somministrare la dose completa, il medicamento deve essere miscelato bene e avere un aspetto lattiginoso. Se non dovesse essere miscelato bene, continuare ad agitare con forza. | |
FASE 3: preparazione dell’autoiniettore Importante: Dopo che il medicamento è stato completamente miscelato, è necessario completare immediatamente i passaggi di preparazione e iniettare per somministrare la dose completa. Non conservare il medicamento per un uso successivo. Sbloccare l’autoiniettore solo quando si è pronti per l’iniezione.
Tenere l’autoiniettore in posizione verticale con il cappuccio arancione rivolto verso l’alto. Ruotare la manopola dalla posizione di blocco alla posizione di sblocco fino a sentire un clic.
È normale vedere alcune gocce di liquido all’interno del cappuccio. Non riporre il cappuccio sull’autoiniettore. Gettar via il cappuccio.
| |
FASE 4: iniettare la dose
Una volta completata l’iniezione, appare una barra arancione nella finestra. Dopo aver allontanato l’autoiniettore dalla pelle, la protezione verde ritorna in sede per coprire l’ago. Veda «Domande e risposte frequenti» per sapere cosa fare se dopo l’iniezione non vede la barra arancione nella finestra.
| |
Subito dopo l’uso, smaltire correttamente l’autoiniettore come spiegato dal medico o dal farmacista. Occorre un contenitore a prova di perforazione che:
È possibile utilizzare un contenitore in plastica dura o di metallo. |
|
Domande e risposte frequenti
1. Dove è l’ago?
L’ago è fissato all’autoiniettore ed è coperto dal cappuccio arancione. Quando si svita il cappuccio arancione, l’ago viene coperto dalla protezione verde fino al momento dell’iniezione. Per ulteriori informazioni, si osservi la figura 14 nel fase 3B delle Istruzioni per l’uso.
2. Come so se il medicamento è completamente miscelato?
Dopo aver agitato l’autoiniettore, guardare attraverso entrambi i lati della finestra. Non deve esserci polvere bianca visibile in basso, in alto né lungo i lati. Se vede della polvere bianca, il medicamento non è ancora miscelato. Per miscelarlo, agitare l’autoiniettore con forza finché non si vede più medicamento in basso, in alto o lungo i lati. La miscela deve apparire completamente uniforme (vederele immagini nelle Figure 7 e 8, Fase 2C).
3. Perché devo tenere l’autoiniettore in posizione verticale se stacco il cappuccio arancione?
Tenendo l’autoiniettore in posizione verticale mentre si rimuove il cappuccio arancione si evita la fuoriuscita del medicamento. Tuttavia è normale vedere alcune gocce di medicamento nel cappuccio arancione dopo averlo svitato.
4. Perché devo iniettare il medicamento immediatamente dopo averlo miscelato?
Se il medicamento non viene iniettato subito dopo averlo miscelato, la miscela potrebbe separarsi nuovamente e potrebbe non venire iniettata la dose completa. È possibile miscelare nuovamente il medicamento se l’autoiniettore si trova in posizione di blocco. Tuttavia, se l’autoiniettore è stato sbloccato, per poter somministrare la dose completa è necessario eseguire subito i passaggi di preparazione e l’iniezione. Non è possibile conservare il medicamento per un uso successivo.
5. Come so di aver iniettato la dose completa del medicamento?
Per assicurarsi di aver somministrato la dose completa, si deve premere l’autoiniettore contro la pelle e tenerlo in quella posizione. Si avvertirà l’ingresso dell’ago nella pelle. Tenere l’ago premuto contro la pelle per 15 secondi. Questo è un tempo sufficiente per consentire al medicamento di fluire dall’autoiniettore ed entrare sotto pelle. Una volta estratto l’ago, guardare la finestra per verificare che sia presente la barra arancione, la quale indica che la dose è stata rilasciata.
6. Perché devo conservare l’autoiniettore in frigorifero in posizione orizzontale?
Gli autoiniettori conservati in posizione verticale (con l’ago rivolto verso l’alto o verso il basso) sono più difficili da miscelare. Il medicamento può comunque essere miscelato, ma dovrà essere agitato di più e per più tempo.
7. In che modo posso smaltire il mio autoiniettore Bydureon BCise?
Non smaltire l’autoiniettore nei rifiuti domestici. Occorre un contenitore a prova di perforazione sufficientemente capiente da contenere l’intero autoiniettore. Assicurarsi che il contenitore abbia un coperchio. È possibile usare un contenitore per sostanze a rischio biologico, un altro contenitore in plastica dura o in metallo. La confezione non include un tale contenitore.
Il contenitore con gli autoiniettori usati non va riciclato. Chiedere al farmacista come smaltirlo in sicurezza. Non smaltire il contenitore con i rifiuti domestici.
8. Cosa devo fare se il dispositivo non funziona e se non riesco a sbloccarlo?
Leggere nuovamente il fase 3 delle Istruzioni per l’uso per l’utilizzatore per controllare di avere eseguito i passaggi nella giusta sequenza. Non cercare di sbloccare l’autoiniettore con la forza o usando degli utensili, ma rivolgersi al proprio medico.
9. Cosa devo fare se il dispositivo non funziona e se non riesco a rimuovere
il cappuccio arancione?
Leggere nuovamente il fase 3 delle Istruzioni per l’uso per l’utilizzatore per controllare di avere eseguito i passaggi nella giusta sequenza e assicurarsi anche che la manopola si trovi completamente in posizione di sblocco. Non cercare di staccare il cappuccio con utensili o con la forza, ma rivolgersi al proprio medico.
10. Dove posso trovare maggiori informazioni su Bydureon BCise?
- Rivolgersi al proprio medico, al farmacista o al personale medico specializzato.
- Leggere attentamente il foglietto illustrativo.
Come conservare l’autoiniettore Bydureon BCise
- Conservare in frigorifero in posizione orizzontale (2 °C – 8 °C).
- Conservare nella confezione originale per proteggere il contenuto dalla luce.
- Prima dell’uso Bydureon BCise può essere conservato a temperature non superiori a 30 °C per un massimo di 4 settimane.
- Il medicamento non dev’essere utilizzato oltre la data indicata con «EXP» sul contenitore.
- Tenere l’autoiniettore pulito e lontano da fonti di sporcizia.
- Conservare fuori dalla portata dei bambini.
Zusammensetzung
Bydureon Pen
Wirkstoffe
Exenatid.
Hilfsstoffe
Poly-(D,L-Lactid-Co-Glycolid) 50:50, Saccharose.
Lösungsmittel
Carmellose-Natrium, Natriumchlorid, Polysorbat 20, Natriumdihydrogenphosphat Monohydrat, Natriummonohydrogenphosphat Heptahydrat, Natriumhydroxid, Wasser für Injektionszwecke.
Gesamtnatriumgehalt pro Dosis: 4.39 mg.
Bydureon BCise, Autoinjektor
Wirkstoffe
Exenatid.
Hilfsstoffe
Poly-(D,L-Lactid-Co-Glycolid) 50:50, Saccharose, mittelkettige Triglyceride.
Darreichungsform und Wirkstoffmenge pro Einheit
Bydureon Pen
Pulver und Lösungsmittel zur Herstellung einer Depot-Injektionssuspension im Fertigpen: Die Dosis pro Pen nach Rekonstitution beträgt 2 mg Exenatid in 0,65ml.
Bydureon BCise, Autoinjektor
Depot-Injektionssuspension im Fertigpen: 2 mg Exenatid in 0,85 ml Depot-Injektionssuspension.
Indikationen/Anwendungsmöglichkeiten
Bydureon ist zur Behandlung von Erwachsenen mit einem Diabetes mellitus Typ 2 als Kombinationstherapie mit
Metformin;
einem Sulfonylharnstoff;
einem Thiazolidindion;
Metformin und einem Sulfonylharnstoff;
Metformin und einem Thiazolidindion;
indiziert, wenn durch diese oralen Antidiabetika in maximal verträglicher Dosis keine ausreichende Blutzuckerkontrolle erreicht wird.
Dosierung/Anwendung
Die empfohlene Bydureon-Dosis beträgt 2 mg Exenatid einmal wöchentlich.
Die Umstellung der Therapie von zweimal täglich Exenatid (Byetta) auf einmal wöchentlich Exenatid (Bydureon Pen oder Bydureon BCise, Autoinjektor) kann zu einem temporären Anstieg der Blutglukosekonzentration führen. Dieser beschränkt sich in der Regel auf die ersten zwei (bei Bydureon Pen) bzw. vier (Bydureon BCise, Autoinjektor) Wochen nach Therapieumstellung.
Patienten können zwischen den Depot-Exenatid-Arzneimitteln (Bydureon Pen und Bydureon BCise, Autoinjektor) wechseln, ohne dass relevante Auswirkungen auf die Blutzuckerwerte zu erwarten sind.
Bydureon wird für Patienten mit Diabetes mellitus Typ 2 empfohlen, die bereits Metformin, einen Sulfonylharnstoff oder ein Thiazolidindion in Monotherapie erhalten, oder mit einer Kombination aus Metformin und Sulfonylharnstoff oder aus Metformin und Thiazolidindion therapiert werden. Wird eine bestehende Metformin und/oder Thiazolidindion-Therapie mit Bydureon ergänzt, kann die jeweilige Dosis beibehalten werden, ohne dass deshalb ein erhöhtes Hypoglykämierisiko gegenüber der Monotherapie mit Metformin oder Thiazolidindion zu befürchten ist. Wird Bydureon zusätzlich zur Sulfonylharnstofftherapie verabreicht, sollte zur Senkung des Hypoglykämierisikos eine Dosisreduktion des Sulfonylharnstoffs erwogen werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Bydureon sollte einmal wöchentlich am gleichen Wochentag gegeben werden. Der Tag der wöchentlichen Gabe kann bei Bedarf geändert werden, sofern die letzte Dosis mindestens drei Tage zuvor gegeben wurde. Bydureon kann zu einer beliebigen Tageszeit und unabhängig von den Mahlzeiten angewendet werden.
Wenn eine Dosis vergessen wurde, sollte sie umgehend nachgeholt werden, vorausgesetzt die nächste regulär geplante Dosis ist in 3 Tagen oder später fällig. Danach können die Patienten ihren üblichen, einmal wöchentlichen Dosierungsplan wieder aufnehmen.
Falls eine Injektion versäumt wurde und die nächste regulär geplante Dosis in 1 oder 2 Tagen fällig ist, sollte sich der Patient die versäumte Dosis nicht verabreichen, sondern stattdessen Depot-Exenatid am nächsten regulären Injektionstag fortsetzen.
Die Anwendung von Bydureon erfordert keine zusätzliche Blutzuckermessung durch den Patienten. Eine Eigenkontrolle des Blutzuckers durch den Patienten ist erforderlich, um die Dosis des Sulfonylharnstoffs oder des Insulins anzupassen. Dies gilt insbesondere bei Beginn der Behandlung mit Bydureon und bei einer Reduktion der Insulindosis. Es wird empfohlen, die Insulindosis schrittweise zu senken.
Bei Beendigung der Therapie sollte die verzögerte Freisetzung von Bydureon berücksichtigt werden (siehe «Pharmakokinetik»).
Patienten mit Leberfunktionsstörungen
Basierend auf präklinischen Daten wird nicht erwartet, dass eine eingeschränkte Leberfunktion die Pharmakokinetik von Bydureon beeinflusst. Daher ist keine Dosisanpassung bei Patienten mit eingeschränkter Leberfunktion erforderlich. Es wurden keine pharmakokinetischen Studien bei Patienten durchgeführt, bei denen eine akute oder chronische hepatische Insuffizienz diagnostiziert wurde (siehe «Pharmakokinetik»).
Patienten mit Nierenfunktionsstörungen
Bydureon kann bei Patienten mit einer leichten oder mässigen Nierenfunktionsstörung (Kreatinin-Clearance 30 bis 80 ml/min) angewendet werden (siehe «Pharmakokinetik»). Bei mässiger Nierenfunktionsstörung steigen die mittleren steady state Konzentrationen von Exenatid um 74 %. Bei diesen Patienten ist deshalb Vorsicht geboten.
Bydureon wird bei Patienten mit terminaler Niereninsuffizienz oder einer schweren Nierenfunktionsstörung (Kreatinin-Clearance <30 ml/min) nicht empfohlen (siehe «Warnhinweise und Vorsichtsmassnahmen» sowie «Pharmakokinetik»).
Ältere Patienten
Bydureon kann bei Erwachsenen jeden Alters, einschliesslich bei älteren Patienten (Alter > 65 Jahre) angewendet werden. Bei Patienten > 75 Jahren ist die klinische Erfahrung sehr begrenzt (siehe «Pharmakokinetik»).
Kinder und Jugendliche
Die Verträglichkeit und Wirksamkeit von Depot-Exenatid ist bei Patienten unter 18 Jahren nicht untersucht worden (siehe «Pharmakokinetik»).
Geschlecht, ethnische Zugehörigkeit oder Übergewicht
Im Zusammenhang mit Geschlecht, ethnischer Zugehörigkeit oder Übergewicht (BMI > 30 kg/m²) ist keine Anpassung der Dosierung erforderlich (siehe «Pharmakokinetik»).
Art der Anwendung
Depot-Exenatid kann vom Patienten selbst subkutan appliziert werden. Jedes Set darf nur von einer Person benutzt werden und ist zur einmaligen Anwendung bestimmt.
Die Bedienungsanleitung muss sorgfältig befolgt werden.
Unmittelbar nachdem das Arzneimittel vollständig gemischt wurde, ist jede Dosis als subkutane Injektion in Abdomen, Oberschenkel oder die Rückseite des Oberarms zu geben.
Bei Anwendung mit Insulin müssen Depot-Exenatid und Insulin als zwei getrennte Injektionen gegeben werden.
Für Anweisungen zum Suspendieren des Arzneimittels vor der Anwendung siehe «Sonstige Hinweise».
Bydureon Pen
Nach dem Mischen darf Bydureon nur verabreicht werden, wenn die Mischung weiss bis gebrochen weiss und gleichmässig trüb ist.
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und Vorsichtsmassnahmen
Bydureon darf nicht bei Patienten mit Typ 1 Diabetes mellitus oder zur Behandlung der diabetischen Ketoazidose eingesetzt werden.
Bydureon ist kein Ersatz für lnsulin. Es liegen Berichte über diabetische Ketoazidose bei insulinabhängigen Patienten nach raschem Absetzen oder einer schnellen Dosisreduktion von lnsulin vor (siehe Rubrik »Dosierung/Anwendung»).
Bydureon darf nicht intravenös oder intramuskulär injiziert werden.
Nierenfunktionsstörung
Bei dialysepflichtigen Patienten mit terminaler Niereninsuffizienz führten Einzeldosen von 5 µg Exenatid (Byetta) zu häufigeren und stärker ausgeprägten gastrointestinalen Nebenwirkungen. Bydureon wird bei Patienten mit einer terminalen Niereninsuffizienz oder einer schweren Nierenfunktionsstörung (Kreatinin-Clearance <30 ml/min) nicht empfohlen.
Die klinische Erfahrung bei Patienten mit einer mässigen Einschränkung der Nierenfunktion ist sehr begrenzt. Es gibt Spontanberichte über Veränderungen der Nierenfunktion. Diese beinhalten eine Erhöhung der Serumkreatininwerte, eine Beeinträchtigung der Nierenfunktion, eine Verschlechterung eines chronischen Nierenversagens sowie ein akutes Nierenversagen, das in manchen Fällen eine Hämodialyse erforderlich machte. Einige dieser Ereignisse traten bei Patienten auf, die ein oder mehrere Medikamente erhielten, die bekanntermassen Auswirkung auf die Nierenfunktion oder den Flüssigkeitshaushalt haben können und/oder bei Patienten, die gleichzeitig andere Vorkommnisse mit Auswirkung auf den Flüssigkeitshaushalt erlitten; dazu zählten Übelkeit, Erbrechen und/oder Diarrhö. Zu den begleitend angewendeten Pharmaka gehörten ACE-Hemmer, nichtsteroidale Antiphlogistika (NSAID) und Diuretika. Die beobachteten Änderungen der Nierenfunktion waren unter einer symptomatischen Behandlung und einem Absetzen der potenziell das Ereignis auslösenden Substanzen, einschliesslich Exenatid, in den meisten Fällen reversibel. Präklinische und klinische Studien mit Exenatid gaben keine Hinweise auf direkte nephrotoxische Effekte.
Schwere gastrointestinale Erkrankungen
Die Wirkung von Bydureon bei Patienten mit schweren Magen-Darmerkrankungen, darunter diabetischer Gastroparese, ist nicht erforscht. Im Allgemeinen ist die Anwendung mit gastrointestinalen Nebenwirkungen, darunter Übelkeit, Erbrechen und Durchfall, assoziiert. Aus diesem Grund wird von der Anwendung von Bydureon bei Patienten mit schweren Magen-Darmerkrankungen abgeraten.
Akute Pankreatitis
Es gibt Spontanberichte über akute Pankreatitis. Patienten sollten über die charakteristischen Symptome einer akuten Pankreatitis informiert werden: anhaltende, starke Bauchschmerzen, die ausstrahlen können und die teils von Erbrechen begleitet sind. Wird eine Pankreatitis vermutet, sollte die Behandlung mit Bydureon gestoppt werden. In sehr seltenen Fällen wurden nekrotisierende oder hämorrhagische Pankreatitis und/oder Todesfälle berichtet. Eine Wiederaufnahme der Exenatid-Behandlung kann nicht empfohlen werden, wenn bei gesicherter Diagnose eine alternative Ätiologie der Pankreatitis nicht ausreichend zuverlässig identifiziert werden konnte.
Begleitmedikation
Die gleichzeitige Anwendung von Bydureon mit Insulin, D-Phenylalaninderivaten (Meglitiniden), Alpha-Glukosidaseinhibitoren, Dipeptidyl-Peptidase-4-Inhibitoren (DPP-4-Inhibitoren) oder anderen GLP-1 Rezeptoragonisten wurde nicht untersucht und wird nicht empfohlen.
Die gleichzeitige Anwendung von Bydureon mit Exenatid zweimal täglich (Byetta) wurde nicht untersucht und wird nicht empfohlen.
Hypoglykämie
Wenn Bydureon in Kombination mit einem Sulfonylharnstoff gegeben wurde, war die Inzidenz von Hypoglykämien im Vergleich zur Gabe von Placebo in Kombination mit Sulfonylharnstoff erhöht. In klinischen Studien hatten Patienten mit einer leichten Einschränkung der Nierenfunktion, die in Kombination mit Sulfonylharnstoffen behandelt wurden, im Vergleich zu Patienten mit normaler Nierenfunktion eine erhöhte Hypoglykämie-Inzidenz. Um das mit der gleichzeitigen Gabe von Sulfonylharnstoffen verbundene Risiko einer Hypoglykämie zu verringern, kann eine Reduktion der Sulfonylharnstoff-Dosis in Betracht gezogen werden.
Wechselwirkungen mit Warfarin
Bei gleichzeitiger Anwendung von Warfarin und Exenatid wurde in einigen Fällen über einen Anstieg der Thromboplastinzeit (INR, International Normalized Ratio) berichtet, teilweise war dies mit Blutungsereignissen assoziiert (siehe «Interaktionen»). Keine Erfahrung besteht mit der gleichzeitigen Anwendung von Acenocoumarol oder Phenprocumon mit Exenatid.
Hilfsstoffe
Der Bydureon Pen enthält weniger als 1 mmol Natrium (23 mg) pro Dosiereinheit, d.h. es ist nahezu «natriumfrei».
Interaktionen
Die Ergebnisse einer Studie, bei der Paracetamol als Marker der Magenentleerung eingesetzt wurde, lassen vermuten, dass die Wirkung von Bydureon auf die Verzögerung der Magenentleerung keine klinisch signifikanten relevanten Veränderungen der Cmax oder der AUC von gleichzeitig oral angewendeten Arzneimitteln erwarten lässt. Bei oral anzuwendenden Arzneimitteln, die begleitend zu Bydureon gegeben werden, ist eine Dosisanpassung daher nicht erforderlich. Jedoch kann bei gleichzeitiger Gabe eines Sulfonylharnstoffs aufgrund des erhöhten Hypoglykämierisikos eine Anpassung der Sulfonylharnstoffdosis erforderlich sein (siehe «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
Paracetamol
Paracetamol wurde beispielhaft als Arzneimittel benutzt, um die Wirkung von Exenatid auf die Magenentleerung zu messen.
Wurden nach 14 Wochen Therapie mit Bydureon 1000 mg Paracetamol Tabletten mit oder ohne Mahlzeit angewendet, war die AUC von Paracetamol im Vergleich zum Kontrollzeitraum nicht signifikant verändert. Die Cmax von Paracetamol war um 16 % (Einnahme nüchtern) bzw. 5 % (Einnahme zum Essen) vermindert, die tmax stieg von etwa 1 Stunde im Kontrollzeitraum auf 1,4 Stunden (Einnahme nüchtern) bzw. 1,3 Stunden (Einnahme zum Essen). In derselben Studie führte die Anwendung von Paracetamol (Einnahme zum Essen) 15 Minuten nach Exenatid zweimal täglich (10 µg Byetta) zu einer Verminderung der AUC um 20 % und der Cmax um 21 %, sowie einem Anstieg von tmax auf 2 Stunden. Diese Ergebnisse zeigen einen nur geringen Einfluss von Exenatid auf die Magenentleerung.
Sulfonylharnstoffe
Da eine Therapie mit Sulfonylharnstoffen das Risiko von Hypoglykämien erhöht, kann eine Dosisanpassung des Sulfonylharnstoffs erforderlich sein (siehe «Dosierung/Anwendung», «Warnhinweise und Vorsichtsmassnahmen»).
Die nachfolgenden Interaktionsstudien wurden unter Verwendung von 10 µg Exenatid zweimal täglich (Byetta) durchgeführt, jedoch nicht mit Bydureon.
HMG CoA Reduktase Inhibitoren
Wenn 10 µg Exenatid zweimal täglich (Byetta) zusammen mit einer Einzeldosis Lovastatin (40 mg) gegeben wurde, waren im Vergleich zu alleiniger Lovastatin-Gabe AUC und Cmax für Lovastatin um etwa 40 % bzw. 28 % verringert und tmax um 4 Stunden verzögert. Während den 30-wöchigen placebokontrollierten klinischen Prüfungen war die gleichzeitige Gabe von Exenatid zweimal täglich (Byetta) und HMG CoA Reduktase Inhibitoren nicht mit einheitlichen Veränderungen der Blutfettwerte verbunden. Eine Dosisanpassung ist nicht erforderlich, jedoch sollten die Blutfettwerte angemessen kontrolliert werden.
Warfarin
Wenn Warfarin 35 Minuten nach Exenatid angewendet wurde, verzögerte sich tmax um etwa 2 h. Es wurden keine klinisch relevanten Veränderungen der Cmax oder AUC beobachtet. Bei gleichzeitiger Anwendung von Warfarin und Exenatid zweimal täglich (Byetta) sind Fälle von erhöhter Thromboplastinzeit bekannt geworden. Bei Patienten, die mit Warfarin und/oder Kumarinderivaten wie Acenocoumarol oder Phenprocoumon behandelt werden, sollte bei Beginn der Therapie mit Bydureon die Thromboplastinzeit überwacht werden (siehe «Unerwünschte Wirkungen»).
Digoxin, Lisinopril
In Interaktionsstudien, in denen man die Wirkung von Exenatid auf Digoxin und Lisinopril untersuchte, wurde eine Verzögerung der tmax von etwa 2 h beobachtet. Es wurden jedoch keine klinisch relevanten Veränderungen der Cmax oder AUC beobachtet.
Kinder und Jugendliche
Interaktionsstudien wurden nur bei Erwachsenen durchgeführt.
Schwangerschaft/Stillzeit
Schwangerschaft
Aufgrund der langen Washout-Phase von Bydureon müssen Frauen im gebärfähigen Alter während der Bydureon-Behandlung Massnahmen zur Empfängnisverhütung ergreifen.
Möchte eine Patientin schwanger werden oder tritt eine Schwangerschaft ein, sollte die Bydureon-Behandlung abgebrochen werden. Bei einer geplanten Schwangerschaft sollte die Therapie mit Bydureon mindestens 3 Monate zuvor beendet werden.
Es gibt keine ausreichenden Daten zur Anwendung von Bydureon während der Schwangerschaft. In Tierstudien gab es Hinweise auf Reproduktionstoxizität (siehe «Präklinische Daten»). Das mögliche Risiko für den Menschen ist nicht bekannt. Bydureon sollte während der Schwangerschaft nicht angewendet werden, hier ist die Anwendung von Insulin zu empfehlen.
Stillzeit
Es ist nicht bekannt, ob Exenatid in die Muttermilch ausgeschieden wird. Bydureon sollte von stillenden Müttern nicht angewendet werden oder es sollte abgestillt werden.
Fertilität
Es wurden keine Fertilitätsstudien beim Menschen durchgeführt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Wird Bydureon in Kombination mit Sulfonylharnstoffen angewendet, müssen Patienten angewiesen werden, Massnahmen zur Hypoglykämievermeidung bei der Teilnahme am Strassenverkehr oder während des Bedienens von Maschinen zu ergreifen.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Bydureon
Bei Therapie mit Bydureon waren die häufigsten unerwünschten Wirkungen ≥5 % vorwiegend gastrointestinale Nebenwirkungen (Übelkeit, Erbrechen, Durchfall und Obstipation). Die am häufigsten berichtete unerwünschte Wirkung war Übelkeit, welche vor allem zu Therapiebeginn auftrat und mit der Zeit nachliess. Zudem waren Juckreiz an der Injektionsstelle, Hypoglykämie und Kopfschmerzen häufig. Die meisten unerwünschten Wirkungen, die im Zusammenhang mit Bydureon auftraten, waren von leichter bis mässiger Intensität.
Nach Markteinführung von Exenatid zweimal täglich (Byetta) wurde selten über akute Pankreatitis und akutes Nierenversagen berichtet (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Bydureon BCise, Autoinjektor
Die häufigsten Nebenwirkungen während der klinischen Studien waren gastrointestinaler Natur (hauptsächlich Übelkeit (8 %), die im Laufe der Behandlung abnahm), Kopfschmerzen (4 %) sowie Reaktionen an der Injektionsstelle, wie Knötchen an der Injektionsstelle (11 %), Pruritus an der Injektionsstelle (3 %) und Erythem an der Injektionsstelle (2 %). Darüber hinaus trat Hypoglykämie bei Kombination mit einem Sulfonylharnstoff sehr häufig auf (siehe unten Beschreibung ausgewählter Nebenwirkungen). Die meisten Nebenwirkungen waren leicht bis mässig im Schweregrad.
Tabellarische Zusammenfassung der unerwünschten Ereignisse
In der nachfolgenden Tabelle 1 werden unerwünschte Ereignisse von Bydureon, Bydureon BCise und Exenatid zweimal täglich (Byetta) zusammengefasst, die in klinischen Studien mit einer Häufigkeit ≥1 % auftraten.
Berücksichtigt wurden für Bydureon die Daten aus zwei placebokontrollierten Studien (10 und 15 Wochen), sowie aus 3 Studien, die Bydureon entweder mit Exenatid zweimal täglich (Byetta) verglichen (eine 30-wöchige Studie), mit Sitagliptin und Pioglitazon (eine 26-wöchige Studie) sowie mit Insulin Glargin (eine 26-wöchige Studie). Zu den begleitenden Therapien gehörten Diät und Bewegung, Metformin, ein Sulfonylharnstoff, ein Thiazolidindion oder eine Kombination oraler Antidiabetika.
Die Tabelle enthält ebenfalls unerwünschte Ereignisse, die eine Häufigkeit von ≥1 % nicht erreichten, die jedoch nach der Markteinführung bzw. aus klinischen Studien mit Exenatid zweimal täglich (Byetta) bekannt wurden.
Der gepoolte, klinische Studien-Datensatz von Bydureon BCise umfasst zwei Komparator-kontrollierte Phase-3-Studien mit einer Dauer von 6 bis 12 Monaten. Die Nachbeobachtungs- und Verlängerungsphasen der Studien sind in dem Datenpool enthalten. Begleitende Behandlungen umfassten Diät und Bewegung allein oder mit Metformin, einem Sulfonylharnstoff, einem Thiazolidindion oder einer Kombination aus oralen blutzuckersenkenden Arzneimitteln. Nebenwirkungen, die mit Depot-Exenatid nach der Markteinführung, aber nicht in klinischen Studien mit Bydureon BCise, Autoinjektor, beobachtet wurden, sind ebenfalls in der Tabelle aufgeführt.
Die Ereignisse sind nachfolgend in MedDRA Terminologie nach Systemorganklasse und absoluter Häufigkeit aufgeführt. Die Patienten-Häufigkeit ist definiert als: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1'000, <1/100), selten (≥1/10'000, <1/1'000) und sehr selten (<1/10'000).
Tabelle 1. Nebenwirkungen von Exenatid, identifiziert in klinischen Studien und Spontanberichten
Bydureon Daten aus N = 592 (Patienten mit | Exenatide 10 µg Daten aus N = 145 (Patienten mit | Exenatide Daten aus der Zeit | Bydureon | Bydureon Daten aus der Zeit | |||
|---|---|---|---|---|---|---|---|
Sehr häufig | Häufig | Sehr häufig | Häufig | Häufigkeit (siehe Fussnote) | Häufigkeit (siehe Fussnote) | Häufigkeit (siehe Fussnote) | |
Erkrankungen des Blutes und des Lymphsystems | |||||||
Arzneimittelinduzierte Thrombozytopenie (unbekannt)4 | Arzneimittelinduzierte Thrombozytopenie (unbekannt)4 | ||||||
Erkrankungen des Immunsystems | |||||||
Anaphylaktische Reaktion (sehr selten) 2 | |||||||
Stoffwechsel- und Ernährungsstörungen | |||||||
Hypoglykämie (mit einem Sulfonylharnstoff) (32 %) | Hypoglykämie (mit einem Sulfonylharnstoff) | Hypoglykämie (mit einem Sulfonylharnstoff)9,10 (sehr häufig) (26.1 %) | |||||
Hypoglykämie (mit Insulin)7,8 (häufig) | |||||||
Verminderter Appetit | Verminderter Appetit | ||||||
Dehydratation, im Allgemeinen verbunden mit Übelkeit, Erbrechen und/oder Durchfall. (selten)2 | |||||||
Erkrankungen des Nervensystems | |||||||
Schwindel | Schwindel | Schwindel (häufig) | |||||
Kopfschmerzen | Kopfschmerzen | Kopfschmerzen (häufig) | |||||
Störung des Geschmacksempfindens (gelegentlich) 2 | |||||||
Erkrankungen des Gastrointestinaltrakts | |||||||
Obstipation (6 %) | Obstipation | Obstipation (häufig) | |||||
Durchfall (13 %) | Durchfall | Diarrhoe (häufig) | |||||
Übelkeit (20 %) | Übelkeit | Übelkeit (häufig) | |||||
Erbrechen (8 %) | Erbrechen | Erbrechen (häufig) | |||||
Bauchblähung | Bauchblähung (häufig) 1 | Bauchblähung (häufig) | |||||
Abdominal-schmerzen | Abdominal-schmerzen | Abdominal- (häufig) | |||||
Dyspepsie | Dyspepsie | Dyspepsie (häufig) | |||||
Aufstossen | Aufstossen (gelegentlich) 2 | ||||||
Blähungen | Blähungen | ||||||
gastroösophagealer Reflux | gastroösophagealer Reflux | gastroösophagealer Reflux (häufig) | |||||
Akute Pankreatitis (siehe Warnhinweise und Vorsichtsmassnahmen). (gelegentlich)1 3 | |||||||
Erkrankungen der Haut und des Unterhautgewebes | |||||||
Makulärer oder papulöser Ausschlag (selten)2 | |||||||
Pruritus und/oder Urticaria (selten)2 | |||||||
angioneurotische Ödeme (selten)2 | Angioödem (unbekannt)6 | ||||||
Alopezie (selten)2 | |||||||
Vermehrtes Schwitzen (häufig)1 | |||||||
Abszesse an der Injektionsstelle und Zellulitis (unbekannt)6 | |||||||
Erkrankungen der Nieren und Harnwege | |||||||
Veränderungen der Nierenfunktion, einschliesslich akutes Nierenversagen, Verschlechterung eines chronischen Nierenversagens, Beeinträchtigung der Nierenfunktion, Erhöhung der Serumkreatininwerte (selten)2 (siehe Warnhinweise und Vorsichtsmassnahmen). | |||||||
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | |||||||
Juckreiz an der Injektionsstelle | Juckreiz an der Injektionsstelle | Juckreiz an der Injektionsstelle (häufig) | |||||
Müdigkeit | Müdigkeit | Müdigkeit (häufig) | |||||
Erythem an der Injektionsstelle | Reaktionen an der Injektionsstelle (häufig)1 | Erythem an der Injektionsstelle (häufig) | |||||
Ausschlag an der Injektionsstelle | |||||||
Schläfrigkeit | Schläfrigkeit (selten)2 | ||||||
Schwäche (häufig)1 | |||||||
Gefühl der inneren Unruhe (häufig)1 | |||||||
Untersuchungen | |||||||
Thromboplastinzeit-Erhöhung bei gleichzeitiger Warfarinbehandlung, bei einigen Berichten in Verbindung mit Blutungen (siehe Warnhinweise und Vorsichtsmassnahmen). (selten)1 | INR erhöht (unbekannt)6 (siehe Warnhinweise und Vorsichtsmassnahmen). | ||||||
¹ Die Häufigkeit basiert auf Daten aus klinischen Studien mit Exenatid zweimal täglich (Byetta).
² Die Häufigkeit basiert auf Spontanberichten zu Exenatid zweimal täglich (Byetta).
³ Die Ereignisse traten in allen Therapiegruppen gelegentlich auf.
4 Bezieht sich auf Postmarketing-Daten, kann anhand der verfügbaren Daten nicht geschätzt werden.
5 Häufigkeitsangabe basierend auf abgeschlossenen Langzeitstudien zur Sicherheit und Wirksamkeit (N = 526), sofern nicht anders gekennzeichnet. Schliesst eine Nachbeobachtung innerhalb von siebzig Tagen nach Erhalt der letzten Dosis und Verlängerungsphase ein.
6 Häufigkeitsangabe beruht auf Daten von Spontanberichten mit Depot-Exenatid (unbekannter Nenner).
7 Basierend auf hypoglykämischen Ereignissen, die 1. zu Bewusstlosigkeit, Krampfanfällen oder Koma führen, welche nach Anwendung von Glukagon oder Glucose rückläufig sind, ODER die 2. Zur Behebung der Unterstützung Dritter bedürfen aufgrund von Bewusstseins- oder Verhaltensstörungen und einem Glucosewert von < 54 mg/dl (3 mmol/l), ODER die 3. zu Symptomen entsprechend einer Hypoglykämie führen mit einem gleichzeitigen Glucosewert von < 54 mg/dl (3 mmol/l) vor der Behandlung.
8 Häufigkeit berichtet in der 28-wöchigen, kontrollierten Behandlungsperiode der Studie mit Depot-Exenatid als Add-on zu Insulin Glargin (N = 231).
9 Häufigkeitsangaben aus gepoolten Daten der Kontrollperioden der beiden klinischen Phase-3-Studien (N = 410).
10 Basierend auf hypoglykämischen Ereignissen mit Symptomen entsprechend einer Hypoglykämie mit einem gleichzeitigen Glucosewert von < 54 mg/dl (3 mmol/l) vor der Behandlung.
Beschreibung ausgewählter Nebenwirkungen
Arzneimittelinduzierte Thrombozytopenie
Nach Markteinführung wurde von arzneimittelinduzierter Thrombozytopenie durch Exenatid-abhängige Thrombozytenantikörper berichtet. Die arzneimittelinduzierte Thrombozytopenie ist eine immunvermittelte Reaktion, die durch arzneimittelbedingte Antikörper gegen Thrombozyten verursacht wird. Diese Antikörper verursachen bei Anwesenheit des sensibilisierenden Arzneimittels die Zerstörung von Thrombozyten.
Hypoglykämie
Bydureon
Die Inzidenz von Hypoglykämien war erhöht, wenn Bydureon in Kombination mit einem Sulfonylharnstoff angewendet wurde (siehe «Warnhinweise und Vorsichtsmassnahmen»). Um das mit der gleichzeitigen Gabe von Sulfonylharnstoff verbundene Risiko einer Hypoglykämie zu verringern, muss eine Reduktion der Sulfonylharnstoff-Dosis in Betracht gezogen werden. Die meisten Hypoglykämien waren leicht bis mässig schwer und alle konnten durch orale Gabe von Kohlenhydraten behoben werden.
Bei Patienten, die Bydureon in Kombination mit Metformin erhielten, traten Hypoglykämien signifikant seltener auf als bei Patienten, die Insulin Glargin in Kombination mit Metformin erhielten (3 % im Vergleich zu 19 %). Auch bei Patienten, die Bydureon in Kombination mit Metformin und einen Sulfonylharnstoff erhielten, war die Häufigkeit von Hypoglykämien niedriger als unter Therapie mit Insulin Glargin in Kombination mit Metformin und einen Sulfonylharnstoff (20 % im Vergleich zu 42 %).
Bydureon BCise, Autoinjektor
Es traten keine Fälle von schwerer Hypoglykämie mit Bydureon BCise, Autoinjektor auf. Die Häufigkeit von leichter Hypoglykämie betrug insgesamt 6,3 %. Diese Häufigkeit war erhöht, wenn es in Kombination mit einem Sulfonylharnstoff angewendet wurde (26,1 %), verglichen mit der Anwendung ohne Sulfonylharnstoff (0,9 %) (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»). Um das Risiko des Auftretens einer Hypoglykämie im Zusammenhang mit der Anwendung eines Sulfonylharnstoffs zu reduzieren, kann eine Dosisreduktion des Sulfonylharnstoffs erwogen werden (siehe Rubriken «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
Bei Anwendung von Depot-Exenatid als Add-on zu Basalinsulin war keine initiale Anpassung der Insulindosis erforderlich. In Kombination mit Basalinsulin zeigte Depot-Exenatid keine klinisch signifikanten Unterschiede bezüglich der Inzidenz hypoglykämischer Episoden im Vergleich zu Insulin. Es traten keine Episoden einer schweren Hypoglykämie in der Gruppe mit Depot-Exenatid mit Insulin auf.
Übelkeit
Bydureon
Die am häufigsten berichtete Nebenwirkung war Übelkeit. Im Allgemeinen berichteten 20 % der Patienten, die mit Bydureon behandelt wurden, über ein mindestens einmaliges Auftreten von Übelkeit, im Vergleich zu 34 % der Patienten unter Exenatid zweimal täglich (Byetta). Die Übelkeit war meist leicht bis mässig ausgeprägt. Bei den meisten Patienten, bei denen zunächst Übelkeit auftrat, nahm die Häufigkeit unter fortgesetzter Behandlung ab.
In kontrollierten Studien über 30 Wochen brachen 6 % der mit Bydureon und 5 % der mit Exenatid zweimal täglich (Byetta) behandelten Patienten die Therapie aufgrund von unerwünschten Ereignissen ab. Die unerwünschten Ereignisse, die am häufigsten zu einem Abbruch führten, waren in beiden Therapiegruppen Übelkeit und Erbrechen. Bei Bydureon-behandelten Patienten brachen jeweils < 1 % aufgrund von Übelkeit oder Erbrechen ab, unter Exenatid zweimal täglich (Byetta) 1 %.
Bydureon BCise, Autoinjektor
Die am häufigsten berichtete gastrointestinale Nebenwirkung war Übelkeit. Während der kontrollierten Phase der klinischen Studie, in der Bydureon BCise, Autoinjektor mit Exenatid zweimal täglich (Byetta) verglichen wurde, wurde Übelkeit von 9,6 % bzw. 20,5 % der Patienten in jeder Gruppe berichtet. Insgesamt berichteten 9,3 % der Patienten, die mit Bydureon BCise, Autoinjektor behandelt wurden, Übelkeit in der kontrollierten Phase beider klinischer Studien. Die Übelkeit war meist leicht bis mässig, stand im Zusammenhang mit dem Behandlungsbeginn und nahm mit der Zeit ab.
Reaktionen an der Injektionsstelle
Bydureon
Reaktionen an der Injektionsstelle wurden bei Bydureon-behandelten Patienten häufiger beobachtet als bei Patienten, die eine aktive Vergleichsmedikation erhalten hatten (etwa zweimal häufiger). Die Reaktionen an der Injektionsstelle waren im Allgemeinen leicht und führten in der Regel nicht zum Studienabbruch.
In klinischen Studien wurden an der Injektionsstelle subkutan sehr häufig kleine Knötchen beobachtet, die aus der Verabreichung von anderen Präparaten mit Poly-(D,L-lactid Co-glycolid) Mikrosphären bekannt sind. Die Mehrzahl der einzelnen Knötchen war asymptomatisch, sie hatten in der Regel keinen Einfluss auf die Studienteilnahme und verschwanden im Verlauf von 4 bis 8 Wochen. Bei etwa 50 % der Patienten mit symptomatischen Knötchen verschwanden in den Phase 3 Studien die Knötchen innerhalb von 10 Wochen, während dies bei den verbleibenden Patienten länger dauerte.
Nach Markteinführung wurde über Fälle von Abszessen und bakteriellen Entzündungen an der Injektionsstelle berichtet.
Bydureon BCise, Autoinjektor
Reaktionen an der Injektionsstelle traten während der Kontrollphase der klinischen Studien bei mit Bydureon BCise, Autoinjektor behandelten Patienten häufiger auf als bei Patienten, die mit dem Vergleichspräparat behandelt wurden (24 % gegenüber 4 % mit Exenatid zweimal täglich (Byetta)). Diese Reaktionen waren üblicherweise gering ausgeprägt und führten normalerweise nicht zu einem Absetzen der Studienmedikation. Patienten können behandelt werden, um die Symptome zu lindern, während die Behandlung fortgesetzt wird. Weitere Injektionen sollten dann jede Woche an anderen Injektionsstellen verabreicht werden. Erfahrungen mit Depot-Exenatid nach Markteinführung beinhalten berichtete Fälle von Abszessen und bakteriellen Entzündungen an der Injektionsstelle.
An der Injektionsstelle wurden in klinischen Studien häufig subkutane Knötchen beobachtet; dies ist eine bekannte Eigenschaft von Darreichungsformen mit Poly(glycolsäure-co-milchsäure) Polymermikrosphären. Die meisten Knötchen hatten keinen Einfluss auf die Studienteilnahme und verschwanden mit der Zeit.
Immunogenität
Entsprechend der potentiell immunogenen Eigenschaften von protein- und peptidhaltigen Arzneimitteln können Patienten aufgrund der Behandlung mit Bydureon gegen Exenatid gerichtete Antikörper bilden. Bei den meisten Patienten, die Antikörper entwickelten, gingen die Antikörpertiter im Laufe der Zeit zurück.
Bydureon
Am Ende der 30-wöchigen Studie mit Bydureon hatten 43 % der Patienten einen niedrigen Titer von gegen Exenatid gerichteten Antikörpern. Entsprechend der Ergebnisse klinischer Studien mit Exenatid zweimal täglich (Byetta) war das Ausmass der glykämischen Stoffwechselkontrolle (HbA1c) im Allgemeinen vergleichbar zu der bei Patienten ohne Antikörpertiter (51 % der Patienten). Weitere 6 % der Patienten hatten nach 30 Wochen höhere Antikörpertiter. Bei einem Drittel dieser Patienten (2 % der Patienten insgesamt) war das glykämische Ansprechen auf Bydureon abgeschwächt; bei den verbleibenden 4 % war das glykämische Ansprechen vergleichbar zum Ansprechen von Patienten, die keine Antikörpertiter gebildet hatten.
Der Prozentsatz von Antikörpertiter-positiven Patienten war in allen Studien etwa gleich.
Bei Patienten, die gegen Exenatid gerichtete Antikörper entwickelten, traten Reaktionen an der Injektionsstelle (z.B. Hautrötung oder Juckreiz) tendenziell häufiger auf, die Häufigkeit und Art anderer unerwünschter Ereignisse war bei diesen Patienten vergleichbar zu jenen ohne Antikörper gegen Exenatid.
Bei 9 % der Patienten, die mit Bydureon behandelt wurden, traten während der 30-wöchigen Studie und den zwei 26-wöchigen Studien potentiell immunologische Reaktionen an der Injektionsstelle auf (am häufigsten Juckreiz, mit oder ohne Erythem). Bei Patienten ohne Antikörper waren solche Reaktionen weniger häufig (4 %) als bei Patienten mit Antikörpern (13 %), mit einer grösseren Inzidenz bei höheren Antikörpertitern.
Die Untersuchung antikörperpositiver Proben ergab keine signifikante Kreuzreaktivität mit ähnlichen endogenen Peptiden (Glucagon oder GLP-1).
Bydureon BCise, Autoinjektor
Ungefähr 42 % der Patienten entwickelten einen niedrigen Antikörpertiter gegen Exenatid und 32 % der Patienten entwickelten einen hohen Antikörpertiter zu jeder Zeit während der Studien. Der Prozentsatz von diesen Antikörper-positiven Patienten, insbesondere von solchen mit hohen Titern, gipfelte nach etwa 8 bis 16 Wochen unter der Dosierung und nahm dann mit der Zeit ab. Zu Studienende hatten etwa 43 % der Patienten niedrige gegen Exenatid gerichtete Antikörpertiter und 14 % der Patienten hatten hohe Antikörpertiter. Das Ausmass der glykämischen Stoffwechselkontrolle (HbA1c) war im Allgemeinen bei mit Bydureon BCise, Autoinjektor behandelten Patienten mit niedrigen Antikörpertitern beim letzten Besuch (-1,1 % bis -1,5 %) vergleichbar zu dem bei Patienten ohne Antikörpertiter (-1,1 % bis -1,4 %). Während Patienten mit hohen Antikörpertitern beim letzten Besuch eine abgeschwächte HbA1c-Antwort zeigten, waren die HbA1c-Senkungen bei diesen Patienten klinisch relevant (-0,6 % bis -0,7 %).
Bei mit Bydureon BCise, Autoinjektor behandelten Patienten mit auswertbaren Antikörpern (N = 393) betrug die Häufigkeit von möglicherweise immunogen-bedingten Reaktionen an der Injektionsstelle (meist Knötchen an der Injektionsstelle) während der beiden Studien etwa 20 %. Diese Reaktionen wurden bei Antikörper-negativen Patienten (16 %) und bei Patienten mit niedrigem Antikörpertiter (16 %) seltener beobachtet als bei Patienten mit hohen Antikörpertitern (27 %).
Rascher Gewichtsverlust
In einer 30-wöchigen Studie zeigten etwa 3 % (N = 4/148) der Patienten, die mit Depot-Exenatid behandelt wurden, zumindest eine Periode eines raschen Gewichtsverlusts (dokumentierter Gewichtsverlust zwischen zwei aufeinanderfolgenden Studienvisiten von mehr als 1,5 kg wöchentlich).
Erhöhte Herzfrequenz
Eine mittlere Erhöhung der Herzfrequenz (HF) um 2,4 Schläge pro Minute gegenüber dem Ausgangswert (74/min) wurde in der kontrollierten Phase der klinischen Studien mit Bydureon BCise, Autoinjektor beobachtet. Fünfzehn Prozent der mit Depot-Exenatid behandelten Patienten wiesen mittlere Erhöhungen der HF um ≥10 Schläge pro Minute auf; ungefähr 5 % bis 10 % der Personen in der anderen Behandlungsgruppe wiesen mittlere Anstiege der HF um ≥10 Schläge pro Minute auf.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Anzeichen und Symptome
Zu den Wirkungen einer Überdosierung (basierend auf Studien mit Exenatid zweimal täglich, Byetta) gehörten schwere Übelkeit, schweres Erbrechen und schnell sinkende Blutzuckerwerte.
Behandlung
Im Fall einer Überdosierung ist eine angemessene, unterstützende Behandlung einzuleiten, die sich an der klinischen Symptomatik des Patienten orientiert.
Eigenschaften/Wirkungen
ATC-Code
A10BJ01
Wirkungsmechanismus
Exenatid ist ein Glukagon-like Peptide-1 (GLP-1) Rezeptoragonist und zeigt verschiedene antihyperglykämische Wirkungen des Glukagon-like Peptide-1 (GLP-1). Die Aminosäuresequenz von Exenatid ist teilweise mit der von humanem GLP-1 identisch. In in vitro Untersuchungen wurde für Exenatid gezeigt, dass es an den bekannten humanen GLP-1 Rezeptor bindet und ihn aktiviert. Zyklisches AMP und/oder andere intrazelluläre Signalbahnen vermitteln die Wirkung.
Exenatid erhöht glucoseabhängig die Synthese und Sekretion von Insulin durch die Betazellen des Pankreas. Bei sinkender Blutzuckerkonzentration geht dadurch die Insulinsekretion zurück und daher ist auch das potentielle Hypoglykämierisiko reduziert (siehe «Warnhinweise und Vorsichtsmassnahmen»). Wenn Exenatid in Kombination mit Metformin und/oder einem Thiazolidindion gegeben wird, wurde im Vergleich zu Metformin und/oder Thiazolidindion plus Placebo kein Anstieg der Hypoglykämieinzidenz beobachtet. Dies kann auf einen Glucose-abhängigen insulinotropen Mechanismus zurückgeführt werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Exenatid unterdrückt die Glucagonsekretion, die beim Diabetes mellitus Typ 2 bekanntermassen unangemessen erhöht ist. Geringere Glucagonkonzentrationen führen zu einer erniedrigten Glucoseabgabe der Leber. Exenatid beeinträchtigt jedoch nicht die normale Glucagonwirkung und die Wirkung anderer Hormone als Reaktion auf eine Hypoglykämie.
Für Exenatid wurde gezeigt, dass es die Magenentleerung geringfügig verlangsamt und dadurch die Geschwindigkeit, in der mit der Nahrung aufgenommene Glucose in die Blutbahn gelangt, reduziert. Die klinische Relevanz dieser Beobachtung ist unklar.
Es wurde gezeigt, dass die Gabe von Exenatid die Nahrungsaufnahme über einen verringerten Appetit sowie über ein erhöhtes Sättigungsgefühl reduziert, welches von Übelkeit unabhängig ist.
Pharmakodynamik
Exenatid verbessert bei Patienten mit Diabetes mellitus Typ 2 die glykämische Kontrolle mittels eines Sofort- und Langzeiteffekts durch Senkung sowohl des postprandialen als auch des Nüchternblutzuckers. Bydureon hat beim Menschen ein pharmakokinetisches Profil, das eine einmal wöchentliche Anwendung ermöglicht.
Klinische Wirksamkeit
Die Wirksamkeit von 5 µg und 10 µg Exenatid zweimal täglich (Byetta) wurde belegt. Die Ergebnisse von 5 klinischen Langzeitstudien mit Bydureon werden nachfolgend dargestellt. In die klinischen Studien waren 1'628 Patienten eingeschlossen (davon wurden 804 mit Bydureon behandelt), 54 % waren männlich und 46 % weiblich, 281 Personen waren 65 Jahre oder älter (davon wurden 141 mit Bydureon behandelt). In zwei zusätzlichen kontrollierten Studien mit Bydureon BCise, Autoinjektor wurden 739 Patienten eingeschlossen (davon wurden 410 mit Bydureon BCise behandelt), 58,5 % Männer und 41,5 % Frauen, 125 Personen (16,9%) waren 65 Jahre oder älter.
Glykämische Kontrolle
Bydureon (Wässriges Depot-Exenatid)
Zwei Studien verglichen Bydureon 2 mg mit Exenatid zweimal täglich (Byetta, zunächst zweimal täglich 5 µg über 4 Wochen, anschliessend 10 µg zweimal täglich).
Die Dauer der einen Studie betrug 24 Wochen (N = 252), die der anderen 30 Wochen (N = 295). In der Studienverlängerung («open labelled extension») erhielten alle Patienten für weitere 22 Wochen Bydureon 2 mg (N = 243). In beiden Studien war bereits nach der ersten HbA1c-Messung (Woche 4 bzw. 6) in beiden Therapiegruppen eine Verringerung der HbA1c Werte offensichtlich.
Im Vergleich zu Patienten, die zweimal täglich Exenatid erhalten hatten (Byetta), führte Bydureon zu einer statistisch signifikanten Verminderung des HbA1c, p < 0,0001 in der 24-wöchigen Studie bzw. p < 0,05 in der 30-wöchigen Studie (Tabelle 2).
Bei Patienten, die Bydureon oder Exenatid zweimal täglich (Byetta) erhalten hatten, wurde ein beständiger, positiver Effekt auf den HbA1c gesehen, der in beiden Studien unabhängig von der begleitenden antidiabetischen Therapie war.
Im Vergleich zu Exenatid zweimal täglich (Byetta) erreichten in den beiden Studien unter Bydureon statistisch signifikant mehr Patienten eine Verminderung des HbA1c auf ≤7 % in der einen Studie, < 7 % in der anderen Studie (p < 0,05 bzw. p ≤0,0001).
Unter beiden Therapien, Bydureon und Exenatid zweimal täglich (Byetta), erreichten die Patienten eine Verminderung des Ausgangsgewichts; der Unterschied zwischen den beiden Therapien war dabei nicht signifikant.
Bei Patienten, die die kontrollierte 30-wöchige Studie und auch die nachfolgende unkontrollierte Beobachtung abschlossen, wurde eine weitere Verminderung des HbA1c und ein anhaltender Gewichtsverlust über mindestens 52 Wochen festgestellt.
Bydureon BCise, Autoinjektor
Eine 28-wöchige offene Studie verglich Bydureon BCise mit Exenatid zweimal täglich (Byetta) bei Patienten mit Diabetes mellitus Typ 2, welche zuvor entweder ausschliesslich ein Diät- und Bewegungsprogramm durchführten oder bereits stabil auf orale blutzuckersenkende Arzneimittel eingestellt waren. Bydureon BCise war Exenatid zweimal täglich (Byetta) hinsichtlich der Senkung des HbA1c vom Ausgangswert bis zur Woche 28 überlegen (Tabelle 2).
Sowohl Patienten, die Bydureon BCise erhielten, als auch Patienten, die mit Exenatid zweimal täglich (Byetta) behandelt wurden, erzielten eine Gewichtsreduktion in Woche 28 im Vergleich zum Ausgangswert (Tabelle 2). Die Differenz zwischen den beiden Behandlungsgruppen war nicht signifikant. Die Gewichtsreduktionen wurden bis Woche 52 beibehalten.
Tabelle 2. Ergebnisse des Vergleichs von Bydureon (wässriges Depot Exenatid) bzw. Bydureon BCise Autoinjektor mit Exenatid zweimal täglich (Byetta) («intent to treat»-Patienten)
24-wöchige Studie | 30-wöchige Studie | 28-wöchige Studie | ||||
|---|---|---|---|---|---|---|
Bydureon 2 mg | Exenatid 10 µg zweimal täglich (Byetta) | Bydureon 2 mg | Exenatid 10 µg zweimal täglich (Byetta) | Bydureon BCise 2 mg | Exenatid 10 µg zweimal täglich (Byetta) | |
N1 | 129 | 123 | 148 | 147 | 229 | 146 |
Mittlerer HbA1c (%) | ||||||
Ausgangswert | 8.5 | 8.4 | 8.3 | 8.3 | 8.5 | 8.5 |
Änderung gg Ausgangswert (± SE)2 | -1.6 (±0.1)** | -0.9 (±0.1) | -1.9 (±0.1)* | -1.5 (±0.1) | -1.4 (±0.1) | -1.0 (±0.1) |
Mittlere Differenz der Änderung gg Ausgangswert gg. Exenatid zweimal täglich (95 % CI)2 | -0.67 (-0.94, -0.39)** | -0.33 (-0.54, -0.12)* | -0.37*** (-0.63, -0.10) | |||
Patienten (%), die HbA1c < 7 % erreichten3 | 58 | 30 | 73 | 57 | 493 | 433 |
Mittlere Änderung des Nüchternblutzucker- spiegels gg Ausgangswert (mmol/l) (± SE) | -1.4 (±0.2) | -0.3 (±0.2) | -2.3 (±0.2) | -1.4 (±0.2) | -1.8 (±0.2) | -1.3 (±0.3) |
Mittleres Körpergewicht (kg) | ||||||
Ausgangswert | 97 | 94 | 102 | 102 | 97 | 97 |
Änderung gg Ausgangswert (± SE)2 | -2.3 (±0.4) | -1.4 (±0.4) | -3.7 (±0.5) | -3.6 (±0.5) | -1.5 (±0.3) | -1.9 (±0.4) |
Mittlere Differenz der Änderung gg Ausgangswert gg. Exenatid zweimal täglich (95 % CI)2 | -0.95 (-1.91, 0.01) | -0.08 (-1.29, 1.12) | +0.40 (-0.48, 1.28) | |||
SE= standard error = Standardfehler, N = Anzahl Patienten pro Behandlungsgruppe, CI = Konfidenzintervall
* p <0,05.
** p <0,0001 statistisch signifikant versus Exenatid 10 µg 2× täglich.
*** p-Wert < 0,01
1 Alle randomisierten Patienten, die mindestens eine Dosis der Studienmedikation erhielten.
2 Least-Square-Mittelwerte.
3 Last Observation Carried Forward (LOCF) (zuletzt erhobene Beobachtung).
Es wurde eine 26-wöchige Studie zum Vergleich von Bydureon (wässriges Depot-Exenatid) 2 mg mit Insulin Glargin einmal täglich in Patienten mit ungenügender glykämischer Kontrolle mit Metformin alleine oder mit Metformin und Sulfonylharnstoff durchgeführt. Unter beiden Therapien wurde eine signifikante Verminderung des HbA1c beobachtet (p < 0,001), wobei die HbA1c Veränderung unter Bydureon grösser war als unter Insulin Glargin (p = 0,017).
Im Vergleich zu einer Therapie mit Insulin Glargin war die Therapie mit Bydureon mit einer signifikanten Gewichtsabnahme (p < 0,001) und weniger Hypoglykämien verbunden (Tabelle 3).
Tabelle 3. Ergebnisse einer 26-wöchigen Studie mit Bydureon (wässriges Depot-Exenatid) versus Insulin Glargin («intent to treat»-Patienten)
Bydureon 2 mg | Insulin Glargin1 | |
|---|---|---|
N | 233 | 223 |
Mittlerer HbA1c (%) | ||
Ausgangswert | 8,3 | 8,3 |
Veränderung LS Mean (SE) | ‑1,5 (0,1)* | ‑1,3 (0,1) |
Anteil der Patienten (%), die HbA1c ≤7 % erreichen | 62 | 54 |
Plasmaglucose nüchtern (mmol/l) | ||
Veränderung LS Mean (SE) | -2,1 (0,2) | -2,8 (0,2) |
Mittleres Körpergewicht (kg) | ||
Ausgangswert | 91 | 91 |
Veränderung LS Mean (SE) | -2,6 (0,2)* | +1,4 (0,2) |
SE= standard error = Standardfehler.
* p < 0,05, statistisch signifikant versus Insulin Glargin.
¹ Insulin Glargin wurde entsprechend einer Glukosezielkonzentration von 4,0–5,5 mmol/l (72 – 100 mg/dl) dosiert. Die mittlere Dosis von Insulin Glargin zu Therapiebeginn war 10.1 IE/Tag. Die in Woche 26 erreichte mittlere Insulindosis betrug 31,1 IE/Tag bei Patienten, die Insulin Glargin erhielten.
In einer 26-wöchigen, doppelblinden Studie wurde Bydureon (wässriges Depot-Exenatid) mit maximaler Dosierung von Sitagliptin und Pioglitazon bei Patienten verglichen, die auch Metformin erhielten. In allen Therapiegruppen nahm der HbA1c gegenüber dem Ausgangswert signifikant ab. Bydureon war Sitagliptin (p < 0,0001) und Pioglitazon (p < 0,0165) hinsichtlich der HbA1c Veränderung ab Studienbeginn überlegen.
Unter Bydureon zeigte sich eine signifikant grössere Gewichtsabnahme als unter Sitagliptin (p = 0,0002). Patienten der Pioglitazon-Gruppe nahmen an Gewicht zu (p < 0,0001) (Tabelle 4).
In einer 26-wöchigen Studie erhielten N = 134 Patienten Bydureon zusätzlich zu einer bestehenden Thiazolidindion-Therapie, mit oder ohne Metformin. Es wurde eine HbA1c Veränderung beobachtet, die der in vorherigen Studien entsprach.
Ähnliche Resultate sind für Bydureon BCise verfügbar: In einer 28-wöchigen offenen Studie (verblindete orale Medikation) wurde Bydureon BCise mit Sitagliptin und Placebo bei Patienten verglichen, die auch täglich Metformin ≥1500 mg einnahmen. Bydureon BCise zeigte Überlegenheit sowohl gegenüber Sitagliptin als auch gegenüber Placebo in Bezug auf die Reduktion des HbA1c-Wertes, ausgehend vom Ausgangswert bis Woche 28 (Tabelle 5).
Tabelle 4. Ergebnisse einer 26-wöchigen Studie mit Bydureon (wässriges Depot-Exenatid) versus Sitagliptin und versus Pioglitazon in Kombination mit Metformin («intent to treat»-Patienten)
Bydureon 2 mg | Sitagliptin 100 mg | Pioglitazon 45 mg | |
|---|---|---|---|
N | 160 | 166 | 165 |
Mittlerer HbA1c (%) | |||
Ausgangswert | 8,6 | 8,5 | 8,5 |
Veränderung LS Mean (SE) | -1,55 (0,10) | -0,92(0,10) | -1,23(0,10) |
Anteil der Patienten (%), die HbA1c ≤7 % erreichen | 62 | 36 | 49 |
Plasmaglucose nüchtern (mmol/l) (SE) | -1,8 (0,2) | -0,9 (0,2) | -1,5 (0,2) |
Mittleres Körpergewicht (kg) | |||
Ausgangswert | 89 | 87 | 88 |
Veränderung LS Mean (SE) | -2,3 (0,3) | -0,8 (0,3) | +2,8 (0,3) |
SE= standard error = Standardfehler.
Tabelle 5. Ergebnisse einer 28-wöchigen Studie mit Bydureon BCise versus Sitagliptin und Placebo in Kombination mit Metformin (Intent-to-treat-Patienten modifiziert1)
Bydureon BCise 2 mg | Sitagliptin 100 mg | Placebo | |
|---|---|---|---|
N | 141 | 98 | 38 |
Mittlerer HbA1c (%) | |||
Ausgangswert | 8,4 | 8,5 | 8,5 |
Änderung gegenüber Ausgangswert (± SE)2 | -1,1 (±0,1) | -0,8 (±0,1) | -0,4 (±0,2) |
Mittlere Differenz der Änderung gegenüber dem Ausgangswert versus Sitagliptin (95 % CI)2 | -0,38* (-0,70; -0,06) | ||
Mittlere Differenz der Änderung gegenüber dem Ausgangswert versus Placebo (95 % CI)2 | -0,72** (-1,15; -0,30) | ||
Patienten (%), die HbA1c < 7 % erreichten3 | 43* | 32 | 25 |
Mittleres Körpergewicht (kg) | |||
Ausgangswert | 89 | 88 | 89 |
Änderung gegenüber dem Ausgangswert (± SE)2 | -1,1 (±0,3) | -1,2 (±0,3) | +0,2 (±0,5) |
Mittlere Differenz der Änderung gegenüber dem Ausgangswert versus Sitagliptin (95 % CI)2 | +0,07 (-0,73; 0,87) | ||
Mittlere Differenz der Änderung gegenüber dem Ausgangswert versus Placebo (95 % CI)2 | -1,27# (-2,34; -0,20) | ||
Mittlere Änderung des Nüchternblutzuckerspiegels gegenüber dem Ausgangswert (mmol/l) (± SE)2 | -1,2 (±0,2) | -0,6 (±0,3) | +0,5 (±0,4) |
Mittlere Differenz der Änderung gegenüber dem Ausgangswert versus Sitagliptin (95 % CI)2 | -0,56 (-1,21; 0,09) | ||
Mittlere Differenz der Änderung gegenüber dem Ausgangswert versus Placebo (95 % CI)2 | -1,71§ (-2,59; -0,83) | ||
N = Anzahl Patienten pro Behandlungsgruppe, SE (standard error) = Standardfehler, CI = Konfidenzintervall.
* p-Wert < 0,05,
** p-Wert < 0,01,
# Nominaler p-Wert < 0,05,
§ Nominaler p-Wert < 0,001.
1 Alle randomisierten Patienten, die mindestens eine Dosis der Studienmedikation erhielten.
2 Least-Square-Mittelwerte.
3 Last Observation Carried Forward (LOCF) (zuletzt erhobene Beobachtung).
Körpergewicht
In allen Studien mit Depot-Exenatid wurde eine Abnahme des Körpergewichts gegenüber dem Ausgangswert beobachtet. Diese Gewichtsabnahme bei mit Depot-Exenatid behandelten Patienten wurde unabhängig vom Auftreten von Übelkeit beobachtet, wenngleich die Gewichtsabnahme bei Patienten mit begleitender Übelkeit grösser war (mittlere Gewichtsabnahme für Bydureon -2,9 kg bis -5,2 kg bei begleitender Übelkeit, im Vergleich zu -2,2 kg bis -2,9 kg ohne begleitende Übelkeit und für Bydureon BCise -1,9 kg bis -5,2 kg mit Übelkeit gegenüber -1,0 kg bis -2,9 kg ohne Übelkeit).
Der Anteil der Patienten, bei denen zugleich eine Gewichtsabnahme und eine Verminderung des HbA1c-Wertes beobachtet wurde, bewegte sich im Bereich von 70 % bis 79 % (der Anteil der Patienten, bei dem eine Verminderung des HbA1c-Wertes beobachtet wurde, bewegte sich im Bereich von 88 % bis 96 %).
Plasma-/Serumglucose
Die Therapie mit Depot-Exenatid führte zu einer signifikanten Verminderung des Nüchternblutzuckers. Diese Verminderungen wurden bereits nach 4 Wochen beobachtet. Darüber hinaus wurden Verminderungen der postprandialen Konzentrationen beobachtet. Die Verbesserung der nüchtern gemessenen Plasmaglucose-Konzentrationen hielt über 52 Wochen an.
Pharmakokinetik
Absorption
Nach wöchentlicher Gabe von 2 mg Bydureon überschreiten die mittleren Plasmakonzentrationen die wirksamen Mindestkonzentrationen (~50 pg/ml) innerhalb von 2 Wochen, bei einem allmählichen Anstieg der mittleren Exenatid-Plasmakonzentrationen über 6 bis 7 Wochen. Im Steady-State werden Exenatid-Konzentrationen von etwa 300 pg/ml (Bydureon Pen) bzw. 208 pg/ml (Bydureon BCise, Autoinjektor) beibehalten. Die Steady-state Konzentrationen werden bei einwöchigem Dosisintervall aufrechterhalten, mit minimaler Fluktuation von den Spitzen- bzw. Talspiegeln.
Distribution
Das mittlere scheinbare Verteilungsvolumen von Exenatid nach subkutaner Gabe einer Einzeldosis beträgt 28,3 l.
Metabolismus
Exenatid wird nicht metabolisiert.
Elimination
Nichtklinische Studien haben gezeigt, dass Exenatid überwiegend durch glomeruläre Filtration mit nachfolgender proteolytischer Degradation eliminiert wird. Die sich ergebende mittlere scheinbare Exenatid-Clearance beim Menschen beträgt 9,1 l/h.
Diese pharmakokinetischen Eigenschaften von Exenatid sind dosisunabhängig. Etwa 10 Wochen nach Beendigung der Bydureon-Therapie sind die Exenatid-Plasmakonzentrationen nicht mehr nachweisbar.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Pharmakokinetische Studien bei Patienten mit akuter oder chronischer Leberinsuffizienz wurden nicht durchgeführt. Exenatid wird hauptsächlich durch die Niere ausgeschieden, daher ist nicht zu erwarten, dass eine Leberfunktionsstörung die Blutkonzentration von Exenatid beeinflusst.
Nierenfunktionsstörungen
Bei Patienten mit leichter bis mässiger Einschränkung der Nierenfunktion (Kreatinin-Clearance 30 bis 80 ml/min) wurden im Vergleich zu Patienten mit normaler Nierenfunktion Unterschiede der Steady-state Konzentrationen beobachtet. Die mittlere Steady State-Konzentration steigt um ca. 23 % resp. 74 %. Bei Patienten mit mässiger Einschränkung der Nierenfunktion ist deshalb Vorsicht geboten. Bei Patienten mit leichter bis mässiger Einschränkung der Nierenfunktion ist eine Anpassung der Bydureon-Dosis nicht erforderlich. Bei Patienten mit schwerer Einschränkung der Nierenfunktion (Kreatinin-Clearance <30 ml/min) sowie bei Dialysepatienten mit terminaler Niereninsuffizienz wird Bydureon nicht empfohlen (siehe «Dosierung/Anwendung»).
Ältere Patienten
Daten zu älteren Patienten liegen nur begrenzt vor, sie lassen allerdings auch bei einem fortgeschrittenen Alter bis zu etwa 75 Jahren keine markanten Veränderungen der Bioverfügbarkeit von Exenatid vermuten.
In einer Studie zur Pharmakokinetik von Exenatid zweimal täglich (Byetta) bei Patienten mit Diabetes mellitus Typ 2 führte die Anwendung von Exenatid (10 µg) bei 15 älteren Patienten im Alter zwischen 75 und 85 Jahren im Vergleich zu 15 Patienten im Alter zwischen 45 und 65 Jahren zu einem mittleren Anstieg der Bioverfügbarkeit von Exenatid um 36 %, was wahrscheinlich auf die bei älteren Patienten verminderte Nierenfunktion zurückgeführt werden kann (siehe «Dosierung/Anwendung»).
Kinder und Jugendliche
In einer Pharmakokinetik Studie erhielten 13 Patienten mit Diabetes mellitus Typ 2 im Alter zwischen 12 und 16 Jahren eine Einzeldosis von 5 µg Exenatid. Es zeigte sich eine leichte Verringerung der mittleren AUC (16 % niedriger) und Cmax (25 % niedriger) im Vergleich zu den bei Erwachsenen ermittelten Werten.
Pharmakokinetische Studien mit Bydureon bei Kindern und Jugendlichen wurden nicht durchgeführt.
Geschlecht, ethnische Zugehörigkeit, Übergewicht
Geschlecht, ethnische Zugehörigkeit oder Übergewicht der Patienten haben keinen signifikanten Einfluss auf die Exenatid-Pharmakokinetik.
Präklinische Daten
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, allgemeinen oder Genotoxizität lassen die nicht-klinischen Daten mit Exenatid zweimal täglich (Byetta) oder Bydureon keine besonderen Gefahren für den Menschen erkennen.
Karzinogenität
Im Rahmen einer 104-wöchigen Studie zur Karzinogenität von Bydureon wurde bei Ratten unter allen Dosierungen (1,4- bis 26-fache der humanen Exposititon während der Behandlung mit Bydureon) ein statistisch signifikanter Anstieg der Inzidenz von C-Zell-Tumoren der Schilddrüse (Adenome und/oder Karzinome) beobachtet. Die Relevanz dieser Ergebnisse für den Menschen ist bislang nicht bekannt.
Reproduktionstoxizität
Bydureon zeigt in Studien zur Entwicklungstoxizität ähnliche Effekte wie Exenatid zweimal täglich (Byetta). Bei trächtigen Ratten, die in der Mitte der Trächtigkeit Bydureon-Dosierungen erhielten, die Expositionen entsprachen, welche 2- bis 15-fach höher waren als die Exposition beim Menschen, war das fetale Wachstum in Abhängigkeit der maternalen Effekte vermindert (verminderte Essensaufnahme und verminderte Körpergewichtszunahme). Es gab keine Hinweise auf Fehlbildungen.
Studien mit Exenatid zweimal täglich (Byetta) bei Mäusen und Kaninchen wiesen nicht auf direkte schädigende Wirkungen bezüglich Fertilität oder Trächtigkeit hin; Dosierungen von Exenatid zweimal täglich (Byetta), welche Expositionen ähnlich wie mit Bydureon oder höher entsprachen, hatten Auswirkungen auf das Skelett und verringerten das Wachstum der Föten sowie das neonatale Wachstum.
Sonstige Hinweise
Inkompatibilitäten
Bydureon darf nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Bydureon muss direkt nach der Zubereitung injiziert werden.
Besondere Lagerungshinweise
Bydureon Pen
Im Kühlschrank 2 °C –8 °C lagern.
Nicht einfrieren. Bydureon, das eingefroren war, darf nicht mehr verwendet werden und muss fachgerecht entsorgt werden.
Die Pens können vor Anbruch bis zu 4 Wochen bei bis zu 30 °C gelagert werden.
Im Originalkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Arzneimittel für Kinder unzugänglich aufbewahren.
Bydureon BCise, Autoinjektor
Flach und im Kühlschrank lagern (2 °C – 8 °C).
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Bydureon BCise kann vor der Anwendung bis zu 4 Wochen bei Temperaturen von nicht über 30 °C gelagert werden.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Bydureon darf nur von einer Person angewendet werden.
Die genauen Bedienungsanleitungen liegen der Packung von Bydureon Pen respektive Bydureon BCise, Autoinjektor bei.
Bydureon ist nur zur einmaligen Anwendung bestimmt.
Patienten und Betreuungspersonen müssen von medizinischem Fachpersonal geschult werden.
Der Patient sollte angewiesen werden, nach jeder Injektion den Pen und die Nadel resp. den Autoinjektor fachgerecht und sicher zu entsorgen.
Bydureon Pen
Das Pulver, das sich in der einen Kammer des Pens befindet, muss mit dem Lösungsmittel in der andern Kammer des Pens gemischt werden. Das Lösungsmittel soll vor dem Mischen visuell geprüft werden. Das Lösungsmittel darf nur verwendet werden, wenn es klar und frei von Partikeln ist. Nach dem Suspendieren darf der Bydureon Pen nur verwendet werden, wenn die Mischung weiss bis gebrochen weiss und gleichmässig trüb ist. Es dürfen nur die mitgelieferten passenden Nadeln mit dem Pen verwendet werden.
Bydureon BCise, Autoinjektor
Der Autoinjektor muss aus dem Kühlschrank genommen werden und vor der Injektion mindestens 15 Minuten flach gelagert werden. Die Suspension wird gemischt, indem sie mindestens 15 Sekunden kräftig geschüttelt wird. Die Suspension sollte vor dem Gebrauch visuell beurteilt werden. Die Suspension darf erst angewendet werden, wenn sie gleichmässig gemischt wurde und weiss bis cremefarben ist und ein milchiges Aussehen hat, ohne dass weisses Arzneimittelpulver im Fenster des Pens an den Seiten, unten oder oben sichtbar sind. Nachdem die Suspension vollständig gemischt wurde, müssen die Vorbereitungsschritte unverzüglich vorgenommen und die Suspension subkutan injiziert werden.
Zulassungsnummer
65389, 67503 (Swissmedic)
Zulassungsinhaberin
AstraZeneca AG, 6340 Baar
Stand der Information
September 2020
Composizione
Bydureon Pen
Principi attivi
Exenatide.
Sostanze ausiliarie
Poli-(D,L-lattide-co-glicolide) 50:50, saccarosio.
Solvente
Carmellosa sodica, sodio cloruro, polisorbato 20, sodio fosfato monobasico monoidrato, sodio fosfato dibasico eptaidrato, sodio idrossido, acqua per preparazioni iniettabili.
Contenuto totale di sodio per dose: 4,39 mg.
Bydureon BCise, autoiniettore
Principi attivi
Exenatide.
Sostanze ausiliarie
Poli-(D,L-lattide-co-glicolide) 50:50, saccarosio, trigliceridi a catena media.
Forma farmaceutica e quantità di principio attivo per unità
Bydureon Pen
Polvere e solvente per sospensione iniettabile depot in penna preriempita: la dose per penna dopo la ricostituzione è di 2 mg di exenatide in 0,65 ml.
Bydureon BCise, autoiniettore
Sospensione iniettabile depot in penna preriempita: 2 mg di exenatide in 0,85 ml di sospensione iniettabile depot.
Indicazioni/Possibilità d'impiego
Bydureon è indicato per il trattamento di adulti con diabete mellito di tipo 2 in terapia combinata con
metformina;
una sulfonilurea;
un tiazolidindione;
metformina e una sulfonilurea;
metformina e un tiazolidindione;
quando con questi antidiabetici orali alla dose massima tollerabile non si ottiene un sufficiente controllo glicemico.
Posologia/Impiego
La dose raccomandata di Bydureon è di 2 mg di exenatide una volta alla settimana.
Il passaggio dalla terapia con exenatide due volte al giorno (Byetta) a exenatide una volta alla settimana (Bydureon Pen o Bydureon BCise, autoiniettore) può determinare un aumento temporaneo della concentrazione di glucosio ematico. Questo fenomeno è in genere limitato alle prime due settimane (con Bydureon Pen) o quattro settimane (con Bydureon BCise, autoiniettore) successive al cambio di terapia.
I pazienti possono cambiare medicamento a base di exenatide depot (Bydureon Pen e Bydureon BCise, autoiniettore) senza che ciò comporti prevedibilmente effetti rilevanti sui valori della glicemia.
Bydureon è raccomandato per pazienti con diabete mellito di tipo 2 che già ricevono metformina, una sulfonilurea o un tiazolidindione in monoterapia o che sono in terapia con una combinazione di metformina e una sulfonilurea o metformina e un tiazolidindione. Se Bydureon viene aggiunto a una terapia in atto con metformina e/o un tiazolidindione, la dose corrente di metformina e/o del tiazolidindione può essere mantenuta senza temere quindi un aumento del rischio di ipoglicemia rispetto alla monoterapia con metformina o un tiazolindione. Se Bydureon viene somministrato in aggiunta alla terapia con una sulfonilurea, si deve prendere in considerazione una riduzione della dose della sulfonilurea al fine di ridurre il rischio di ipoglicemia (cfr. «Avvertenze e misure precauzionali»).
Bydureon deve essere somministrato una volta alla settimana, lo stesso giorno della settimana. È possibile cambiare il giorno di somministrazione settimanale purché l'ultima dose sia stata somministrata almeno tre giorni prima. Bydureon può essere usato in qualunque momento della giornata e indipendentemente dai pasti.
Se è stata dimenticata una dose, questa deve essere assunta immediatamente a condizione che la successiva dose regolarmente programmata sia prevista dopo 3 o più giorni. Successivamente i pazienti possono riprendere il consueto piano posologico con assunzione una volta alla settimana.
Se è stata dimenticata un'iniezione e la successiva dose regolarmente programmata è prevista dopo 1 o 2 giorni, il paziente non deve somministrarsi la dose saltata bensì attendere di somministrarsi exenatide depot il successivo giorno di iniezione regolare.
L'uso di Bydureon non richiede un'automisurazione aggiuntiva della glicemia. Un automonitoraggio della glicemia è necessario per aggiustare la dose di sulfonilurea o di insulina. Ciò vale in particolare all'inizio del trattamento con Bydureon e in caso di riduzione della dose di insulina. Si raccomanda di ridurre gradualmente la dose di insulina.
Al termine della terapia si deve tenere conto del rilascio ritardato di Bydureon (cfr. «Farmacocinetica»).
Pazienti con disturbi della funzionalità epatica
Sulla base di dati preclinici non si prevede che la farmacocinetica di Bydureon venga influenzata da una compromissione della funzionalità epatica. Pertanto, non sono necessari aggiustamenti della dose in pazienti con compromissione della funzionalità epatica. Nei pazienti con diagnosi di insufficienza epatica acuta o cronica non sono stati effettuati studi di farmacocinetica (cfr. «Farmacocinetica»).
Pazienti con disturbi della funzionalità renale
Bydureon può essere utilizzato in pazienti con disturbo lieve o moderato della funzionalità renale (clearance della creatinina 30-80 ml/min) (cfr. «Farmacocinetica»). In caso di disturbo moderato della funzionalità renale, le concentrazioni medie allo stato stazionario di exenatide aumentano del 74%. Si consiglia pertanto cautela in questi pazienti.
Bydureon non è raccomandato in pazienti con insufficienza renale terminale o con un grave disturbo della funzionalità renale (clearance della creatinina <30 ml/min) (cfr. «Avvertenze e misure precauzionali» e «Farmacocinetica»).
Pazienti anziani
Bydureon può essere usato negli adulti di qualunque età, inclusi i pazienti anziani (età >65 anni). Nei pazienti di età >75 anni l'esperienza clinica è molto limitata (cfr. «Farmacocinetica»).
Bambini e adolescenti
La tollerabilità e l'efficacia di exenatide depot non sono state esaminate nei pazienti sotto i 18 anni (cfr. «Farmacocinetica»).
Sesso, appartenenza etnica o condizione di sovrappeso
Non sono necessari aggiustamenti della posologia in funzione del sesso, dell'appartenenza etnica o di una condizione di sovrappeso (IMC >30 kg/m²) (cfr. «Farmacocinetica»).
Modo di somministrazione
Exenatide depot può essere autosomministrato direttamente dal paziente per via sottocutanea. Ogni set deve essere usato esclusivamente da una persona ed è monouso.
Occorre osservare scrupolosamente le istruzioni per l'uso.
Ogni dose deve essere somministrata mediante iniezione sottocutanea nell'addome, nella coscia o nella parte superiore posteriore del braccio immediatamente dopo la miscelazione completa del medicamento.
Se usato con insulina, exenatide depot e insulina devono essere somministrati in due iniezioni separate.
Per le istruzioni sulla sospensione del medicamento prima dell'uso, cfr. «Altre indicazioni».
Bydureon Pen
Dopo la miscelazione, Bydureon può essere somministrato soltanto se la miscela appare di colore da bianco a bianco sporco e risulta uniformemente torbida.
Controindicazioni
Ipersensibilità al principio attivo o a una qualsiasi delle sostanze ausiliarie secondo la composizione.
Avvertenze e misure precauzionali
Bydureon non deve essere impiegato in pazienti con diabete mellito di tipo 1 o per il trattamento della chetoacidosi diabetica.
Bydureon non è un sostituto dell'insulina. Casi di chetoacidosi diabetica sono stati riferiti in pazienti insulino-dipendenti dopo rapida interruzione o riduzione della dose di insulina (cfr. rubrica «Posologia/impiego»).
Bydureon non deve essere iniettato per via endovenosa o intramuscolare.
Disturbo della funzionalità renale
In pazienti dializzati con insufficienza renale terminale, singole dosi da 5 µg di exenatide (Byetta) hanno determinato un aumento della frequenza e dell'intensità degli effetti collaterali gastrointestinali. Bydureon non è raccomandato in pazienti con insufficienza renale terminale o con un grave disturbo della funzionalità renale (clearance della creatinina <30 ml/min).
L'esperienza clinica nei pazienti con compromissione moderata della funzionalità renale è molto limitata. Vi sono segnalazioni spontanee di alterazioni della funzionalità renale, che comprendono un aumento dei valori della creatinina sierica, una compromissione della funzionalità renale, un peggioramento dell'insufficienza renale cronica nonché insufficienza renale acuta che in alcuni casi ha richiesto un'emodialisi. Alcuni di questi eventi si sono verificati in pazienti che ricevevano uno o più medicamenti noti per essere in grado di esplicare un effetto sulla funzionalità renale o sull'equilibrio idrico e/o in pazienti che presentavano contemporaneamente altri eventi con effetto sull'equilibrio idrico, compresi nausea, vomito e/o diarrea. Gli agenti farmacologici utilizzati in concomitanza includevano ACE-inibitori, antiflogistici non steroidei (FANS) e diuretici. Nella maggior parte dei casi, le alterazioni della funzionalità renale osservate sono risultate reversibili con un trattamento sintomatico e l'interruzione delle sostanze potenzialmente scatenanti l'evento, incluso exenatide. Studi clinici e preclinici con exenatide non hanno fornito evidenze di effetti nefrotossici diretti.
Gravi patologie gastrointestinali
L'effetto di Bydureon in pazienti con gravi malattie gastrointestinali, tra cui la gastroparesi diabetica, non è stato studiato. In generale l'uso è associato a effetti collaterali gastrointestinali tra cui nausea, vomito e diarrea. Per questo motivo l'utilizzo di Bydureon in pazienti con gravi malattie gastrointestinali è sconsigliato.
Pancreatite acuta
Vi sono segnalazioni spontanee di pancreatite acuta. I pazienti devono essere informati dei sintomi caratteristici di una pancreatite acuta: dolore addominale intenso, persistente, che può irradiare e talvolta è accompagnato da vomito. Nel sospetto di una pancreatite, il trattamento con Bydureon deve essere interrotto. In casi molto rari sono state riferite pancreatite necrotizzante o emorragica e/o decessi. Non è possibile raccomandare una ripresa del trattamento con exenatide se, una volta stabilita la diagnosi di pancreatite, non è stato possibile individuare in maniera sufficientemente affidabile un'eziologia alternativa.
Terapia concomitante
L'uso concomitante di Bydureon con insulina, derivati della D-fenilalanina (meglitinidi), inibitori dell'alfa-glucosidasi, inibitori della dipeptidil peptidasi-4 (inibitori della DPP-4) o altri agonisti del recettore di GLP-1 non è stato esaminato e non è raccomandato.
L'uso concomitante di Bydureon con exenatide due volte al giorno (Byetta) non è stato esaminato e non è raccomandato.
Ipoglicemia
Quando Bydureon è stato somministrato in combinazione con una sulfonilurea, l'incidenza di ipoglicemia è risultata maggiore rispetto alla somministrazione di placebo in combinazione con una sulfonilurea. Negli studi clinici i pazienti con una lieve compromissione della funzionalità renale, trattati in concomitanza con sulfoniluree, hanno presentato un'aumentata incidenza di ipoglicemia rispetto ai pazienti con normale funzionalità renale. Per ridurre il rischio di ipoglicemia associato alla somministrazione concomitante di sulfoniluree, è possibile prendere in considerazione una riduzione della dose della sulfonilurea.
Interazioni con warfarin
Con l'uso concomitante di warfarin ed exenatide è stato riportato in alcuni casi un aumento del tempo di tromboplastina (INR, rapporto normalizzato internazionale), talvolta associato a eventi di sanguinamento (cfr. «Interazioni»). Non esistono esperienze con l'uso concomitante di acenocumarolo o fenprocumone ed exenatide.
Sostanze ausiliarie
Bydureon Pen contiene meno di 1 mmol (23 mg) di sodio per unità di dose, cioè è essenzialmente «senza sodio».
Interazioni
I risultati di uno studio che ha impiegato paracetamolo come marcatore dello svuotamento gastrico suggeriscono che l'effetto di Bydureon sul ritardo dello svuotamento gastrico non lascia prevedere variazioni clinicamente significative della Cmax o della AUC di medicamenti per via orale usati in concomitanza. Pertanto, nel caso di medicamenti per uso orale somministrati in concomitanza con Bydureon non sono necessari aggiustamenti della dose. Tuttavia, in caso di somministrazione concomitante con una sulfonilurea può rendersi necessario un aggiustamento della dose della sulfonilurea a causa dell'aumentato rischio di ipoglicemia (cfr. «Posologia/impiego» e «Avvertenze e misure precauzionali»).
Paracetamolo
Il paracetamolo è stato usato come esempio di medicamento per misurare l'effetto di exenatide sullo svuotamento gastrico.
Quando, dopo 14 settimane di terapia con Bydureon sono stati utilizzati 1000 mg di paracetamolo in compresse, indipendentemente dai pasti, l'AUC del paracetamolo rispetto al periodo di controllo non ha mostrato variazioni significative. La Cmax del paracetamolo è risultata ridotta del 16% (assunzione a digiuno) e del 5% (assunzione ai pasti); il tmax è aumentato di circa 1 ora nel periodo di controllo salendo a 1,4 ore (assunzione a digiuno) e a 1,3 ore (assunzione ai pasti). Nello stesso studio, l'utilizzo di paracetamolo (assunzione ai pasti) 15 minuti dopo exenatide due volte al giorno (10 µg di Byetta) ha determinato una riduzione del 20% dell'AUC e del 21% della Cmax nonché un aumento del tmax a 2 ore. Questi risultati mostrano che l'effetto di exenatide sullo svuotamento gastrico è minimo.
Sulfoniluree
Poiché una terapia con sulfoniluree aumenta il rischio di ipoglicemia, può rendersi necessario un aggiustamento della dose della sulfonilurea (cfr. «Posologia/impiego» e «Avvertenze e misure precauzionali»).
I seguenti studi d'interazione sono stati effettuati con 10 µg di exenatide due volte al giorno (Byetta) ma non con Bydureon.
Inibitori della HMG-CoA reduttasi
Quando 10 µg di exenatide due volte al giorno (Byetta) sono stati somministrati con una singola dose di lovastatina (40 mg), l'AUC e la Cmax di lovastatina sono diminuite di circa il 40% e il 28% e il tmax ha mostrato un ritardo di 4 ore rispetto alla somministrazione della sola lovastatina. Negli studi clinici controllati con placebo della durata di 30 settimane, la somministrazione concomitante di exenatide due volte al giorno (Byetta) e di inibitori della HMG-CoA reduttasi non è stata associata a variazione omogenee dei valori dei lipidi ematici. Non è necessario effettuare un aggiustamento della dose, ma i valori dei lipidi ematici devono essere controllati in maniera appropriata.
Warfarin
Quando warfarin è stato utilizzato 35 minuti dopo exenatide, il tmax ha mostrato un ritardo di circa 2 ore. Non sono state osservate variazioni clinicamente significative della Cmax o dell'AUC. Con l'uso concomitante di warfarin ed exenatide due volte al giorno (Byetta) sono noti casi di aumento del tempo di tromboplastina. All'inizio della terapia con Bydureon occorre monitorare il tempo di tromboplastina nei pazienti trattati con warfarin e/o derivati cumarinici quali acenocumarolo o fenprocumone (cfr. «Effetti indesiderati»).
Digossina, lisinopril
In studi d'interazione che hanno esaminato l'effetto di exenatide su digossina e lisinopril è stato osservato un ritardo del tmax di circa 2 ore, ma non sono state osservate variazioni clinicamente rilevanti della Cmax o dell'AUC.
Bambini e adolescenti
Sono stati effettuati studi d'interazione solo negli adulti.
Gravidanza/Allattamento
Gravidanza
A causa della lunga fase di washout di Bydureon, le donne in età fertile devono usare misure contraccettive durante il trattamento con Bydureon.
Se una paziente desidera iniziare una gravidanza o se insorge una gravidanza, il trattamento con Bydureon deve essere interrotto. In caso di gravidanza pianificata, la terapia con Bydureon deve essere cessata almeno 3 mesi prima.
Non sono disponibili dati sufficienti sull'utilizzo di Bydureon in gravidanza. Negli studi sugli animali non sono emerse evidenze di tossicità per la riproduzione (cfr. «Dati preclinici»). I possibili rischi per l'uomo non sono noti. Bydureon non deve essere utilizzato durante la gravidanza, in questo caso va raccomandato l'uso di insulina.
Allattamento
Non è noto se exenatide venga escreto nel latte materno. Bydureon non deve essere usato durante l'allattamento o si deve interrompere l'allattamento.
Fertilità
Non sono stati effettuati studi sulla fertilità nell'essere umano.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Non sono stati effettuati studi per valutare gli effetti sulla capacità di guidare veicoli o sulla capacità di utilizzare macchine. Se Bydureon viene utilizzato in combinazione con sulfoniluree, occorre avvisare i pazienti che devono adottare misure atte a evitare ipoglicemie durante la circolazione stradale o l'impiego di macchine.
Effetti indesiderati
Riassunto del profilo di sicurezza
Bydureon
Durante la terapia con Bydureon gli effetti indesiderati più frequenti (≥5%) sono stati prevalentemente effetti collaterali gastrointestinali (nausea, vomito, diarrea e stitichezza ostinata). L'effetto indesiderato segnalato più frequentemente è stato la nausea, che si è manifestata principalmente all'inizio della terapia ed è diminuita con il tempo. Sono risultati frequenti anche prurito in sede di iniezione, ipoglicemia e cefalea. La maggior parte degli effetti indesiderati insorti in associazione con Bydureon è risultata di intensità da lieve a moderata.
Dopo l'introduzione sul mercato di exenatide due volte al giorno (Byetta) vi sono state rare segnalazioni di pancreatite acuta e insufficienza renale acuta (cfr. «Avvertenze e misure precauzionali»).
Bydureon BCise, autoiniettore
Gli effetti collaterali più frequenti nel corso degli studi clinici sono stati di natura gastrointestinale (principalmente nausea (8%), che è diminuita durante il trattamento), cefalea (4%) nonché reazioni in sede di iniezione, quali noduli in sede di iniezione (11%), prurito in sede di iniezione (3%) ed eritema in sede di iniezione (2%). Inoltre l'ipoglicemia è stata molto frequente in combinazione con una sulfonilurea (cfr. Descrizione di alcuni effetti collaterali più avanti). La maggior parte degli eventi collaterali è risultata di gravità da lieve a moderata.
Riepilogo in formato tabellare degli eventi indesiderati
Nella tabella 1 seguente vengono riepilogati gli eventi indesiderati di Bydureon, Bydureon BCise ed exenatide due volte al giorno (Byetta) che si sono verificati con frequenza ≥1% durante gli studi clinici.
Per Bydureon sono stati considerati i dati di due studi controllati con placebo (della durata di 10 e 15 settimane) nonché di 3 studi in cui Bydureon è stato confrontato con exenatide due volte al giorno (Byetta) (uno studio di 30 settimane), con sitagliptin e pioglitazone (uno studio di 26 settimane) e con insulina glargine (uno studio di 26 settimane). Le terapie concomitanti includevano dieta e movimento, metformina, una sulfonilurea, un tiazolidindione o una combinazione di antidiabetici orali.
La tabella include anche gli eventi indesiderati che non hanno raggiunto una frequenza ≥1% e che tuttavia sono stati segnalati dopo l'introduzione sul mercato o nell'ambito di studi clinici con exenatide due volte al giorno (Byetta).
Il set di dati aggregato degli studi clinici di Bydureon BCise comprende due studi di fase 3, controllati con comparatore, della durata di 6-12 mesi. Nel pool di dati sono comprese le fasi di follow-up ed estensione degli studi. I trattamenti concomitanti comprendevano dieta e movimento da soli o con metformina, una sulfonilurea, un tiazolindidione o una combinazione di ipoglicemizzanti orali. Nella tabella sono riportati anche gli effetti collaterali osservati con exenatide depot dopo l'introduzione sul mercato, ma non nell'ambito degli studi clinici con Bydureon BCise, autoiniettore.
Gli eventi sono elencati di seguito per classe sistemico-organica e frequenza assoluta nella terminologia MedDRA. La frequenza di comparsa nei pazienti è definita come segue: molto comune (≥1/10), comune (≥1/100, <1/10), non comune (≥1/1000, <1/100), raro (≥1/10'000, <1/1000) e molto raro (<1/10'000).
Tabella 1. Effetti collaterali di exenatide identificati nell'ambito di studi clinici e segnalazioni spontanee
Bydureon Dati di studi clinici N = 592 in totale (Pazienti in terapia n = 135) | Exenatide 10 µg Dati dello N = 145 (Pazienti n = 52) | Exenatide Dati raccolti dopo l'introduzione sul mercato e nell'ambito di studi clinici | Bydureon | Bydureon Dati raccolti dopo l'introduzione sul mercato | |||
|---|---|---|---|---|---|---|---|
Molto comune | Comune | Molto | Comune | Frequenza (cfr. nota in calce) | Frequenza (cfr. nota in calce) | Frequenza (cfr. nota in calce) | |
Patologie del sistema emolinfopoietico | |||||||
Trombocitopenia indotta da farmaco (non nota)4 | Trombocitopenia indotta da farmaco (non nota)4 | ||||||
Disturbi del sistema immunitario | |||||||
Reazione anafilattica (molto raro) 2 | |||||||
Disturbi del metabolismo e della nutrizione | |||||||
Ipoglicemia (con una sulfonilurea) (32%) | Ipoglicemia (con una sulfonilurea) | Ipoglicemia (con una sulfonilurea)9,10 (molto comune) (26,1%) | |||||
Ipoglicemia (con insulina)7,8 (comune) | |||||||
Appetito ridotto | Appetito ridotto | ||||||
Disidratazione generalmente associata a nausea, vomito e/o diarrea. (raro) 2 | |||||||
Patologie del sistema nervoso | |||||||
Capogiro | Capogiro | Capogiro (comune) | |||||
Cefalea | Cefalea | Cefalea (comune) | |||||
Patologia del gusto (non comune) 2 | |||||||
Patologie gastrointestinali | |||||||
Stitichezza ostinata (6%) | Stitichezza ostinata | Stitichezza ostinata (comune) | |||||
Diarrea (13%) | Diarrea | Diarrea (comune) | |||||
Nausea (20%) | Nausea | Nausea (comune) | |||||
Vomito (8%) | Vomito | Vomito (comune) | |||||
Gonfiore addominale | Gonfiore addominale (comune) 1 | Gonfiore addominale (comune) | |||||
Dolore addominale | Dolore addominale | Dolore addominale (comune) | |||||
Dispepsia | Dispepsia | Dispepsia (comune) | |||||
Eruttazione | Eruttazione (non comune) 2 | ||||||
Flatulenze | Flatulenze | ||||||
Reflusso gastroesofageo | Reflusso gastroesofageo | Reflusso gastroesofageo (comune) | |||||
Pancreatite acuta (cfr. Avvertenze e misure precauzionali) (non comune) 1 3 | |||||||
Patologie della cute e del tessuto sottocutaneo | |||||||
Eruzione cutanea maculare o papulare (raro) 2 | |||||||
Prurito e/o orticaria (raro) 2 | |||||||
Edemi angioneurotici (raro) 2 | Angioedema (non nota)6 | ||||||
Alopecia (raro) 2 | |||||||
Sudorazione aumentata (comune) 1 | |||||||
Ascessi in sede di iniezione e cellulite (non nota)6 | |||||||
Patologie renali e urinarie | |||||||
Alterazioni della funzionalità renale, inclusi insufficienza renale acuta, peggioramento di un'insufficienza renale cronica, compromissione della funzionalità renale, aumento dei valori della creatinina sierica (raro) 2 (cfr. Avvertenze e misure precauzionali). | |||||||
Patologie sistemiche e condizioni relative alla sede di somministrazione | |||||||
Prurito in sede di iniezione | Prurito in sede di iniezione | Prurito in sede di iniezione (comune) | |||||
Stanchezza | Stanchezza | Stanchezza (comune) | |||||
Eritema in sede di iniezione | Reazioni in sede di iniezione (comune) 1 | Eritema in sede di iniezione (comune) | |||||
Eruzione cutanea in sede di iniezione | |||||||
Sonnolenza | Sonnolenza (raro) 2 | ||||||
Debolezza (comune) 1 | |||||||
Sensazione di irrequietezza interna (comune) 1 | |||||||
Esami diagnostici | |||||||
Aumento del tempo di tromboplastina in caso di trattamento concomitante con warfarin, in associazione a sanguinamenti in alcune segnalazioni (cfr. Avvertenze e misure precauzionali). (raro) 1 | INR aumentato (non nota)6 (cfr. Avvertenze e misure precauzionali). | ||||||
¹ Frequenza basata sui dati degli studi clinici con exenatide due volte al giorno (Byetta).
² Frequenza basata su segnalazioni spontanee riguardanti exenatide due volte al giorno (Byetta).
³ Eventi verificatisi con frequenza non comune in tutti i gruppi di trattamento.
4 Riferita ai dati post-marketing, non può essere definita sulla base dei dati disponibili.
5 Indicazione della frequenza sulla base degli studi a lungo termine completati per la valutazione della sicurezza e dell'efficacia (N = 526), salvo diversamente specificato. Include un follow-up entro 70 giorni dall'ultima dose somministrata e una fase di estensione.
6 Indicazione della frequenza basata sui dati di segnalazioni spontanee con exenatide depot (denominatore non noto).
7 Sulla base di eventi di ipoglicemia che 1. determinano perdita di coscienza, crisi convulsive o coma che regrediscono dopo l'uso di glucagone o glucosio, OPPURE 2. necessitano dell'aiuto di terzi per superare la crisi a causa di disturbi della coscienza e del comportamento e di un valore di glucosio <54 mg/dl (3 mmol/l), OPPURE 3. causano sintomi compatibili con un'ipoglicemia con concomitante valore di glucosio <54 mg/dl (3 mmol/l) prima del trattamento.
8 Frequenza riportata nel periodo di trattamento controllato di 28 settimane dello studio con exenatide depot come add-on all'insulina glargine (N = 231).
9 Indicazioni della frequenza risultanti dai dati aggregati dei periodi di controllo di entrambi gli studi clinici di fase 3 (N = 410).
10 Sulla base di eventi di ipoglicemia con sintomi compatibili con un'ipoglicemia con concomitante valore di glucosio <54 mg/dl (3 mmol/l) prima del trattamento.
Descrizione di alcuni effetti collaterali
Trombocitopenia indotta da farmaco
Dopo l'introduzione sul mercato è stata segnalata trombocitopenia indotta da farmaco dovuta ad anticorpi antipiastrine dipendenti da exenatide. La trombocitopenia indotta da farmaco è una reazione immuno-mediata causata da anticorpi anti-piastrine dovuti al medicamento. In assenza del medicamento sensibilizzante, questi anticorpi causano la distruzione delle piastrine.
Ipoglicemia
Bydureon
L'incidenza di ipoglicemia è risultata elevata quando Bydureon è stato usato in combinazione con una sulfonilurea (cfr. «Avvertenze e misure precauzionali»). Per ridurre il rischio di ipoglicemia associato alla somministrazione concomitante della sulfonilurea, si deve prendere in considerazione una riduzione della dose della sulfonilurea. Per la maggior parte, gli eventi di ipoglicemia sono risultati di grado da lieve a moderato e tutti si sono risolti con la somministrazione orale di carboidrati.
Nei pazienti che hanno ricevuto Bydureon in combinazione con metformina gli episodi di ipoglicemia sono stati significativamente più rari che nei pazienti che hanno ricevuto insulina glargine in combinazione con metformina (3% vs 19%). Anche nei pazienti che hanno ricevuto Bydureon in combinazione con metformina e una sulfonilurea la frequenza degli episodi di ipoglicemia è risultata inferiore a quella osservata con la terapia con insulina glargine in combinazione con metformina e una sulfonilurea (20% vs 42%).
Bydureon BCise, autoiniettore
Con Bydureon BCise, autoiniettore non si sono verificati casi di ipoglicemia grave. La frequenza di ipoglicemia lieve è risultata complessivamente del 6,3%. Questa frequenza è risultata elevata nell'uso combinato con una sulfonilurea (26,1%) rispetto all'uso senza sulfonilurea (0,9%) (cfr. rubrica «Avvertenze e misure precauzionali»). Per ridurre il rischio di insorgenza di ipoglicemia in associazione all'uso di una sulfonilurea è possibile prendere in considerazione una riduzione della dose della sulfonilurea (cfr. le rubriche «Posologia/impiego» e «Avvertenze e misure precauzionali»).
Con l'uso di exenatide depot come add-on all'insulina basale non sono stati necessari aggiustamenti iniziali della dose di insulina. Exenatide depot in combinazione con insulina basale non ha mostrato differenze clinicamente significative nell'incidenza degli episodi di ipoglicemia rispetto all'insulina. Non si sono verificati episodi di ipoglicemia grave nel gruppo trattato con exenatide depot e insulina.
Nausea
Bydureon
L'effetto collaterale più frequentemente segnalato è stato la nausea. In generale, il 20% dei pazienti trattati con Bydureon ha riportato almeno un episodio di nausea rispetto al 34% dei pazienti in trattamento con exenatide due volte al giorno (Byetta). La nausea è risultata perlopiù di grado da lieve a moderato. Nella maggior parte dei pazienti che inizialmente hanno manifestato nausea la frequenza è diminuita con la prosecuzione del trattamento.
In studi controllati della durata di 30 settimane, la terapia è stata interrotta a causa di eventi indesiderati dal 6% dei pazienti trattati con Bydureon e dal 5% dei pazienti trattati con exenatide due volte al giorno (Byetta). Gli eventi indesiderati che più frequentemente hanno determinato l'interruzione del trattamento in entrambi i gruppi di pazienti sono stati nausea e vomito. Il trattamento è stato interrotto a causa di nausea o vomito in <1% dei pazienti trattati con Bydureon e nell'1% dei pazienti trattati con exenatide due volte al giorno (Byetta).
Bydureon BCise, autoiniettore
L'effetto collaterale gastrointestinale più frequentemente segnalato è stato la nausea. Durante la fase controllata dello studio clinico che ha confrontato Bydureon BCise, autoiniettore con exenatide due volte al giorno (Byetta), la nausea è stata riferita dal 9,6% e dal 20,5% dei pazienti in ciascun gruppo. Complessivamente il 9,3% dei pazienti trattati con Bydureon BCise, autoiniettore ha riferito nausea nella fase controllata di entrambi gli studi clinici. La nausea è stata perlopiù di grado da lieve a moderata, è risultata associata all'inizio del trattamento ed è diminuita con il tempo.
Reazioni in sede di iniezione
Bydureon
Le reazioni in sede di iniezione sono state osservate con frequenza maggiore (di circa due volte) nei pazienti trattati con Bydureon rispetto ai pazienti che avevano ricevuto un comparatore attivo. Le reazioni in sede di iniezione sono state generalmente lievi e non hanno normalmente comportato l'interruzione dello studio.
Nell'ambito degli studi clinici, nella sede di iniezione sono stati osservati molto frequentemente piccoli noduli a localizzazione sottocutanea, già noti a seguito della somministrazione di altri preparati contenenti microsfere di poli-(D,L-lattide-co-glicolide). Per la maggior parte, i singoli noduli sono risultati asintomatici, non hanno generalmente avuto effetti sulla partecipazione allo studio e sono scomparsi nell'arco di 4-8 settimane. In circa il 50% dei pazienti con noduli sintomatici, negli studi di fase 3 i noduli sono scomparsi nell'arco di 10 settimane, mentre negli altri pazienti sono durati più a lungo.
Dopo l'introduzione sul mercato sono stati segnalati casi di ascessi e infiammazioni batteriche in sede di iniezione.
Bydureon BCise, autoiniettore
La frequenza delle reazioni in sede di iniezione durante la fase di controllo degli studi clinici è risultata maggiore nei pazienti trattati con Bydureon BCise, autoiniettore rispetto ai pazienti trattati con il preparato comparatore (24% vs 4% con exenatide due volte al giorno (Byetta)). Queste reazioni sono state generalmente deboli e normalmente non hanno portato all'interruzione della terapia in studio. È possibile trattare i pazienti per alleviare i sintomi mentre il trattamento viene continuato. Le iniezioni successive devono poi essere somministrate ogni settimana in altre sedi. Le esperienze con exenatide depot dopo l'introduzione sul mercato includono segnalazioni di ascessi e infiammazioni batteriche in sede di iniezione.
Nell'ambito degli studi clinici sono stati osservati di frequente noduli sottocutanei in sede di iniezione; questa è una proprietà nota delle forme farmaceutiche contenenti microsfere polimeriche a base di acido poli(lattico-co-glicolico). La maggior parte dei noduli non ha avuto effetti sulla partecipazione agli studi ed è scomparsa con il tempo.
Immunogenicità
In linea con le proprietà potenzialmente immunogeniche di medicamenti a base di proteine e peptidi, a causa del trattamento con Bydureon i pazienti possono sviluppare anticorpi anti-exenatide. Nella maggior parte dei pazienti che hanno sviluppato anticorpi i titoli anticorpali sono diminuiti nel tempo.
Bydureon
Al termine dello studio di 30 settimane con Bydureon, il 43% dei pazienti presentava un basso titolo di anticorpi anti-exenatide. In linea con i risultati degli studi clinici condotti con exenatide due volte al giorno (Byetta), l'entità del controllo metabolico della glicemia (HbA1c) è risultata generalmente comparabile con quella dei pazienti senza titoli anticorpali (51% dei pazienti). Dopo 30 settimane, un ulteriore 6% di pazienti presentava titoli anticorpali elevati. In un terzo di questi pazienti (il 2% dei pazienti in totale) la risposta glicemica a Bydureon è risultata attenuata; nel restante 4% la risposta glicemica è risultata comparabile a quella dei pazienti che non avevano sviluppato titoli anticorpali.
La percentuale dei pazienti con positività anticorpali è risultata all'incirca identica in tutti gli studi.
Nei pazienti che hanno sviluppato anticorpi anti-exenatide le reazioni in sede di iniezione (ad es. arrossamento cutaneo o prurito) si sono manifestate tendenzialmente con frequenza maggiore; in questi pazienti la frequenza e il tipo di altri eventi indesiderati sono risultati comparabili a quelli dei pazienti senza anticorpi anti-exenatide.
Nel 9% dei pazienti trattati con Bydureon, durante lo studio di 30 settimane e i due studi di 26 settimane si sono manifestate reazioni potenzialmente immunologiche in sede di iniezione (il prurito, con o senza eritema, è stata la reazione più frequente). In pazienti senza anticorpi, tali reazioni sono risultate meno frequenti (4%) che nei pazienti con anticorpi (13%), con incidenza maggiore in presenza di titoli anticorpali elevati.
Dall'esame di campioni con positività anticorpale non sono emerse reattività crociate significative con simili peptidi endogeni (glucagone o GLP-1).
Bydureon BCise, autoiniettore
Circa il 42% dei pazienti ha sviluppato un basso titolo anticorpale anti-exenatide e il 32% dei pazienti ha sviluppato un alto titolo anticorpale in qualsiasi momento nel corso degli studi. La percentuale di questi pazienti con positività anticorpale, in particolare di quelli con titoli elevati, ha raggiunto il picco dopo circa 8-16 settimane di somministrazione ed è poi diminuita nel tempo. A fine studio, il 43% circa dei pazienti presentava bassi titoli anticorpali anti-exenatide e il 14% dei pazienti presentava alti titoli anticorpali. Nei pazienti trattati con Bydureon BCise, autoiniettore che all'ultima visita presentavano bassi titoli anticorpali (intervallo da -1,1% a -1,5%) l'entità del controllo metabolico della glicemia (HbA1c) è risultata generalmente comparabile a quella dei pazienti senza titoli anticorpali (intervallo da -1,1% a -1,4%). Mentre i pazienti che all'ultima visita presentavano alti titoli anticorpali hanno mostrato una ridotta risposta dell'HbA1c, in questi pazienti le riduzioni dell'HbA1c sono risultate clinicamente rilevanti (intervallo da -0,6% a -0,7%).
Nei pazienti trattati con Bydureon BCise, autoiniettore che presentavano anticorpi valutabili (N = 393) la frequenza delle reazioni in sede di iniezione di natura verosimilmente immunogenica (perlopiù noduli in sede di iniezione) nel corso dei due studi è stata del 20% circa. Queste reazioni sono state osservate più raramente nei pazienti con negatività anticorpale (16%) e nei pazienti con bassi titoli anticorpali (16%) rispetto ai pazienti con alti titoli anticorpali (27%).
Rapido calo ponderale
In uno studio di 30 settimane, circa il 3% (N = 4/148) dei pazienti trattati con exenatide depot ha mostrato quantomeno un periodo di rapido calo ponderale (documentato, di più di 1,5 kg alla settimana tra due visite di studio consecutive).
Aumentata frequenza cardiaca
Un aumento medio della frequenza cardiaca (FC) di 2,4 battiti al minuto rispetto al basale (74 al minuto) è stato osservato nella fase controllata degli studi clinici con Bydureon BCise, autoiniettore. Il 15% dei pazienti trattati con exenatide depot ha mostrato incrementi medi della FC ≥10 battiti al minuto; circa il 5-10% delle persone nell'altro gruppo di trattamento ha mostrato incrementi medi della FC ≥10 battiti al minuto.
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-beneficio del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Segni e sintomi
Tra gli effetti di un sovradosaggio (sulla base di studi con exenatide due volte al giorno (Byetta)) vi sono nausea grave, vomito grave e rapido abbassamento dei valori della glicemia.
Trattamento
In caso di sovradosaggio, si deve avviare un trattamento di supporto adeguato in base alla sintomatologia clinica del paziente.
Proprietà/Effetti
Codice ATC
A10BJ01
Meccanismo d'azione
Exenatide è un agonista del recettore del peptide-1 glucagone-simile (GLP-1) e mostra diversi effetti antiperglicemici del GLP-1. La sequenza aminoacidica di exenatide è in parte identica a quella del GLP-1 umano. Studi in vitro hanno mostrato che exenatide si lega al recettore noto del GLP-1 umano attivandolo. L'effetto è mediato dalla AMP ciclica e/o da altre vie di segnalazione intracellulare.
Exenatide aumenta la sintesi e la secrezione di insulina da parte delle cellule beta del pancreas in maniera glucosio-dipendente. Con la diminuzione della concentrazione di glucosio ematico diminuisce la secrezione di insulina e si riduce pertanto anche il potenziale rischio di ipoglicemia (cfr. «Avvertenze e misure precauzionali»). Quando exenatide è stato somministrato in combinazione con metformina e/o un tiazolidindione non è stato osservato alcun aumento dell'incidenza di ipoglicemia rispetto a metformina e/o un tiazolidindione più placebo. Ciò può essere dovuto a un meccanismo insulinotropico glucosio-dipendente (cfr. «Avvertenze e misure precauzionali»).
Exenatide sopprime la secrezione di glucagone, nota per essere inappropriatamente elevata nel diabete mellito di tipo 2. Concentrazioni più basse di glucagone determinano un più basso output epatico di glucosio. Tuttavia, exenatide non altera il normale effetto del glucagone e l'effetto di altri ormoni in risposta all'ipoglicemia.
Per exenatide è stato dimostrato che rallenta in misura minima lo svuotamento gastrico e di conseguenza riduce la velocità con cui il glucosio assunto con l'alimentazione entra in circolo. La rilevanza clinica di questa osservazione non è chiara.
È stato dimostrato che la somministrazione di exenatide riduce l'assunzione di cibo a seguito di una riduzione dell'appetito e di un aumentato senso di sazietà, che è indipendente dalla nausea.
Farmacodinamica
Nei pazienti con diabete mellito di tipo 2 exenatide migliora il controllo glicemico attraverso un effetto immediato e prolungato, riducendo sia la glicemia a digiuno sia quella postprandiale. Nell'essere umano, Bydureon ha un profilo farmacocinetico che consente l'utilizzo una volta alla settimana.
Efficacia clinica
L'efficacia di 5 µg e 10 µg di exenatide due volte al giorno (Byetta) è stata dimostrata. Di seguito vengono riportati i risultati di 5 studi clinici a lungo termine con Bydureon. Negli studi clinici sono stati inclusi 1628 pazienti (di cui 804 trattati con Bydureon), al 54% di sesso maschile e al 46% di sesso femminile; 281 persone avevano un'età pari o superiore a 65 anni (di cui 141 trattate con Bydureon). In altri due studi controllati con Bydureon BCise, autoiniettore sono stati inclusi 739 pazienti (di cui 410 trattati con Bydureon BCise), al 58,5% di sesso maschile e al 41,5% di sesso femminile; 125 persone (16,9%) avevano un'età pari o superiore a 65 anni.
Controllo della glicemia
Bydureon (exenatide depot in sospensione acquosa)
Due studi hanno confrontato Bydureon 2 mg con exenatide due volte al giorno (Byetta, inizialmente 5 µg due volte al giorno per 4 settimane, quindi 10 µg due volte al giorno).
La durata di uno studio è stata di 24 settimane (N = 252), dell'altro di 30 settimane (N = 295). Nell'estensione degli studi («open labeled extension») tutti i pazienti hanno ricevuto Bydureon 2 mg per altre 22 settimane (N = 243). In entrambi gli studi, già dopo la prima misurazione dell'HbA1c (settimana 4 e 6), entrambi i gruppi di trattamento hanno mostrato una riduzione dei valori di HbA1c.
Rispetto ai pazienti che avevano ricevuto exenatide due volte al giorno (Byetta), Bydureon ha determinato una riduzione statisticamente significativa dell'HbA1c, p <0,0001 nello studio di 24 settimane e p <0,05 nello studio di 30 settimane (tabella 2).
In pazienti che avevano ricevuto Bydureon o exenatide due volte al giorno (Byetta) è stato osservato un effetto positivo duraturo su HbA1c, che in entrambi gli studi è risultato indipendente dalla terapia antidiabetica concomitante.
Rispetto a exenatide due volte al giorno (Byetta), in entrambi gli studi un numero maggiore, statisticamente significativo, di pazienti trattati con Bydureon ha ottenuto una riduzione dell'HbA1c a ≤7% in uno studio, <7% nell'altro (p <0,05 e p ≤0,0001).
Con entrambe le terapie, Bydureon ed exenatide due volte al giorno (Byetta), i pazienti hanno conseguito una riduzione del peso basale; la differenza tra le due terapie non è risultata significativa.
In pazienti che hanno completato lo studio controllato di 30 settimane e anche il successivo follow-up non controllato, sono state riscontrate un'ulteriore riduzione dell'HbA1c e un calo ponderale persistente per almeno 52 settimane.
Bydureon BCise, autoiniettore
Uno studio in aperto della durata di 28 settimane ha confrontato Bydureon BCise con exenatide due volte al giorno (Byetta) in pazienti con diabete mellito di tipo 2 che in precedenza avevano seguito esclusivamente un programma di dieta e movimento o erano già in terapia stabile con medicamenti ipoglicemizzanti orali. Bydureon BCise è risultato superiore a exenatide due volte al giorno (Byetta) relativamente alla riduzione dell'HbA1c dal basale alla settimana 28 (tabella 2).
Sia i pazienti che hanno ricevuto Bydureon BCise sia i pazienti trattati con exenatide due volte al giorno (Byetta) hanno conseguito una riduzione di peso alla settimana 28 rispetto al basale (tabella 2). La differenza tra i due gruppi di trattamento non è risultata significativa. Queste riduzioni di peso si sono mantenute fino alla settimana 52.
Tabella 2. Risultati del confronto tra Bydureon (exenatide depot in sospensione acquosa) o Bydureon BCise, autoiniettore ed exenatide due volte al giorno (Byetta) (pazienti «intent to treat»)
Studio di 24 settimane | Studio di 30 settimane | Studio di 28 settimane | ||||
|---|---|---|---|---|---|---|
Bydureon 2 mg | Exenatide 10 µg due volte al giorno (Byetta) | Bydureon 2 mg | Exenatide 10 µg due volte al giorno (Byetta) | Bydureon BCise 2 mg | Exenatide 10 µg due volte al giorno (Byetta) | |
N1 | 129 | 123 | 148 | 147 | 229 | 146 |
HbA1c (%) media | ||||||
Basale | 8,5 | 8,4 | 8,3 | 8,3 | 8,5 | 8,5 |
Variazione rispetto al basale (± SE)2 | -1,6 (±0,1)** | -0,9 (±0,1) | -1,9 (±0,1)* | -1,5 (±0,1) | -1,4 (±0,1) | -1,0 (±0,1) |
Differenza media della variazione rispetto al basale vs exenatide due volte al giorno (IC 95%)2 | -0,67 (-0,94, -0,39)** | -0,33 (-0,54, -0,12)* | -0,37*** (-0,63, -0,10) | |||
Pazienti (%) che hanno raggiunto una HbA1c <7%3 | 58 | 30 | 73 | 57 | 493 | 433 |
Variazione media della glicemia a digiuno rispetto al basale (mmol/l) (± SE) | -1,4 (±0,2) | -0,3 (±0,2) | -2,3 (±0,2) | -1,4 (±0,2) | -1,8 (±0,2) | -1,3 (±0,3) |
Peso corporeo medio (kg) | ||||||
Basale | 97 | 94 | 102 | 102 | 97 | 97 |
Variazione rispetto al basale (± SE)2 | -2,3 (±0,4) | -1,4 (±0,4) | -3,7 (±0,5) | -3,6 (±0,5) | -1,5 (±0,3) | -1,9 (±0,4) |
Differenza media della variazione rispetto al basale vs exenatide due volte al giorno (IC 95%)2 | -0,95 (-1,91, 0,01) | -0,08 (-1,29, 1,12) | +0,40 (-0,48, 1,28) | |||
SE = standard error = errore standard, N = numero di pazienti per gruppo di trattamento, IC = intervallo di confidenza
* p <0,05.
** p <0,0001 statisticamente significativo vs exenatide 10 µg 2 volte al giorno.
*** Valore di p <0,01.
1 Tutti i pazienti randomizzati che hanno ricevuto almeno una dose della terapia in studio.
2 Medie Least-Square.
3 Last Observation Carried Forward (LOCF) (ultima osservazione effettuata).
È stato effettuato uno studio di 26 settimane per confrontare Bydureon (exenatide depot in sospensione acquosa) 2 mg con insulina glargine una volta al giorno in pazienti con controllo glicemico insufficiente con la sola metformina o con metformina e una sulfonilurea. Con entrambe le terapie è stata osservata una riduzione significativa dell'HbA1c (p <0,001), per cui la variazione dell'HbA1c è stata maggiore con Bydureon rispetto a insulina glargine (p = 0,017).
Rispetto a una terapia con insulina glargine, la terapia con Bydureon è risultata associata a una significativa perdita di peso (p <0,001) e a un minor numero di ipoglicemie (tabella 3).
Tabella 3. Risultati di uno studio di 26 settimane con Bydureon (exenatide depot in sospensione acquosa) versus insulina glargine (pazienti «intent-to-treat»)
Bydureon 2 mg | Insulina glargine1 | |
|---|---|---|
N | 233 | 223 |
HbA1c (%) media | ||
Basale | 8,3 | 8,3 |
Variazione media LS (SE) | ‑1,5 (0,1)* | ‑1,3 (0,1) |
Percentuale di pazienti (%), che raggiungono una HbA1c ≤7% | 62 | 54 |
Glucosio plasmatico a digiuno (mmol/l) | ||
Variazione media LS (SE) | -2,1 (0,2) | -2,8 (0,2) |
Peso corporeo medio (kg) | ||
Basale | 91 | 91 |
Variazione media LS (SE) | -2,6 (0,2)* | +1,4 (0,2) |
SE = standard error = errore standard.
* p <0,05, statisticamente significativo versus insulina glargine.
¹ Insulina glargine è stata titolata per raggiungere una concentrazione target di glucosio di 4,0-5,5 mmol/l (72-100 mg/dl). La dose media di insulina glargine all'inizio della terapia era di 10,1 UI/giorno. Nei pazienti che hanno ricevuto insulina glargine la dose media di insulina raggiunta alla settimana 26 è stata di 31,1 UI/giorno.
Uno studio in doppio cieco di 26 settimane ha confrontato Bydureon (exenatide depot in sospensione acquosa) con la posologia massima di sitagliptin e pioglitazone in pazienti che ricevevano anche metformina. In tutti i gruppi di trattamento, la HbA1c è diminuita in misura significativa rispetto al basale. Bydureon è risultato superiore a sitagliptin (p <0,0001) e a pioglitazone (p <0,0165) relativamente alle variazioni dell'HbA1c dall'inizio dello studio.
Con Bydureon è emersa una perdita di peso significativamente più marcata rispetto a sitagliptin (p = 0,0002). I pazienti del gruppo trattato con pioglitazone hanno mostrato un incremento ponderale (p <0,0001) (tabella 4).
In uno studio di 26 settimane, N = 134 pazienti hanno ricevuto Bydureon in aggiunta alla terapia in atto con un tiazolidindione, con e senza metformina. È stata osservata una variazione dell'HbA1c in linea con gli studi precedenti.
Simili risultati sono disponibili per Bydureon BCise: in uno studio in aperto di 28 settimane (somministrazione orale in cieco) Bydureon BCise è stato confrontato con sitagliptin e placebo in pazienti che assumevano anche metformina ≥1500 mg al giorno. Bydureon BCise ha mostrato superiorità sia rispetto a sitagliptin sia rispetto a placebo in termini di riduzione del valore di HbA1c, dal basale alla settimana 28 (tabella 5).
Tabella 4. Risultati di uno studio di 26 settimane con Bydureon (exenatide depot in sospensione acquosa) versus sitagliptin e versus la combinazione di pioglitazione con metformina (pazienti «intent-to-treat»)
Bydureon 2 mg | Sitagliptin 100 mg | Pioglitazone 45 mg | |
|---|---|---|---|
N | 160 | 166 | 165 |
HbA1c (%) media | |||
Basale | 8,6 | 8,5 | 8,5 |
Variazione media LS (SE) | -1,55 (0,10) | -0,92 (0,10) | -1,23 (0,10) |
Percentuale di pazienti (%), che raggiungono una HbA1c ≤7% | 62 | 36 | 49 |
Glucosio plasmatico a digiuno (mmol/l) (SE) | -1,8 (0,2) | -0,9 (0,2) | -1,5 (0,2) |
Peso corporeo medio (kg) | |||
Basale | 89 | 87 | 88 |
Variazione media LS (SE) | -2,3 (0,3) | -0,8 (0,3) | +2,8 (0,3) |
SE = standard error = errore standard.
Tabella 5. Risultati di uno studio di 28 settimane con Bydureon BCise versus sitagliptin e placebo in combinazione con metformina (popolazione intent-to-treat modificata1)
Bydureon BCise 2 mg | Sitagliptin 100 mg | Placebo | |
|---|---|---|---|
N | 141 | 98 | 38 |
HbA1c (%) media | |||
Basale | 8,4 | 8,5 | 8,5 |
Variazione rispetto al basale (± SE)2 | -1,1 (±0,1) | -0,8 (±0,1) | -0,4 (±0,2) |
Differenza media della variazione rispetto al basale vs sitagliptin (IC 95%)2 | -0,38* (-0,70; -0,06) | ||
Differenza media della variazione rispetto al basale vs placebo (IC 95%)2 | -0,72** (-1,15; -0,30) | ||
Pazienti (%) che hanno raggiunto una HbA1c <7%3 | 43* | 32 | 25 |
Peso corporeo medio (kg) | |||
Basale | 89 | 88 | 89 |
Variazione rispetto al basale (± SE)2 | -1,1 (±0,3) | -1,2 (±0,3) | +0,2 (±0,5) |
Differenza media della variazione rispetto al basale vs sitagliptin (IC 95%)2 | +0,07 (-0,73; 0,87) | ||
Differenza media della variazione rispetto al basale vs placebo (IC 95%)2 | -1,27# (-2,34; -0,20) | ||
Variazione media della glicemia a digiuno rispetto al basale (mmol/l) (± SE)2 | -1,2 (±0,2) | -0,6 (±0,3) | +0,5 (±0,4) |
Differenza media della variazione rispetto al basale vs sitagliptin (IC 95%)2 | -0,56 (-1,21; 0,09) | ||
Differenza media della variazione rispetto al basale vs placebo (IC 95%)2 | -1,71§ (-2,59; -0,83) | ||
N = numero di pazienti per gruppo di trattamento, SE (standard error) = errore standard, IC = intervallo di confidenza.
* Valore di p <0,05,
** Valore di p <0,01,
# Valore di p nominale <0,05,
§ Valore di p nominale <0,001.
1 Tutti i pazienti randomizzati che hanno ricevuto almeno una dose della terapia in studio.
2 Medie Least-Square.
3 Last Observation Carried Forward (LOCF) (ultima osservazione effettuata).
Peso corporeo
In tutti gli studi con exenatide depot è stato osservato un calo del peso corporeo rispetto al basale. Questa perdita di peso nei pazienti trattati con exenatide depot è stata osservata indipendentemente dalla comparsa di nausea, benché nei pazienti con nausea concomitante fosse più marcata (perdita di peso media per Bydureon nell'intervallo tra -2,9 kg e -5,2 kg con nausea concomitante rispetto all'intervallo tra -2,2 kg e -2,9 kg senza nausea concomitante e per Bydureon BCise nell'intervallo tra -1,9 kg e -5,2 kg con nausea rispetto all'intervallo tra -1,0 kg e -2,9 kg senza nausea).
La percentuale di pazienti nei quali sono state contemporaneamente osservate una perdita di peso e una riduzione del valore di HbA1c è risultata compresa nell'intervallo del 70-79% (la percentuale di pazienti nei quali è stata osservata una riduzione del valore di HbA1c è risultata compresa nell'intervallo dell'88-96%).
Glucosio plasmatico/sierico
La terapia con exenatide depot ha determinato una riduzione significativa della glicemia a digiuno. Queste riduzioni sono state osservate già dopo 4 settimane. Inoltre sono state osservate riduzioni delle concentrazioni postprandiali. Il miglioramento delle concentrazioni di glucosio plasmatico misurate a digiuno si è mantenuto per 52 settimane.
Farmacocinetica
Assorbimento
Dopo somministrazione settimanale di 2 mg di Bydureon, le concentrazioni plasmatiche medie superano le concentrazioni minime efficaci (~50 pg/ml) nell'arco di 2 settimane, con un incremento graduale delle concentrazioni plasmatiche medie di exenatide per 6-7 settimane. Allo stato stazionario vengono mantenute concentrazioni di exenatide di circa 300 pg/ml (Bydureon Pen) e 208 pg/ml (Bydureon BCise, autoiniettore). Con l'intervallo di dose settimanale le concentrazioni allo stato stazionario vengono mantenute con fluttuazione minima dei livelli di valle e picco.
Distribuzione
Il volume apparente medio di distribuzione di exenatide dopo somministrazione sottocutanea di una singola dose è di 28,3 l.
Metabolismo
Exenatide non viene metabolizzato.
Eliminazione
Studi non clinici hanno mostrato che exenatide viene eliminato prevalentemente per filtrazione glomerulare con successiva degradazione proteolitica. La risultante clearance media apparente di exenatide nell'uomo è di 9,1 l/h.
Queste proprietà farmacocinetiche di exenatide sono indipendenti dalla dose. Circa 10 settimane dopo la fine della terapia con Bydureon, le concentrazioni plasmatiche di exenatide non sono più rilevabili.
Cinetica di gruppi di pazienti speciali
Disturbi della funzionalità epatica
Non sono stati effettuati studi di farmacocinetica in pazienti con insufficienza epatica acuta o cronica. Exenatide viene escreto principalmente per via renale, pertanto non si prevede che un disturbo della funzionalità epatica influenzi la concentrazione ematica di exenatide.
Disturbi della funzionalità renale
In pazienti con compromissione della funzionalità renale da lieve a moderata (clearance della creatinina 30-80 ml/min) sono state osservate differenze nelle concentrazioni allo stato stazionario rispetto a pazienti con funzionalità renale normale. La concentrazione media allo stato stazionario aumenta di circa il 23% e il 74%. Si consiglia pertanto cautela nei pazienti con compromissione moderata della funzionalità renale. Non sono necessari aggiustamenti della dose di Bydureon nei pazienti con compromissione della funzionalità renale da lieve a moderata. Bydureon non è raccomandato nei pazienti con grave compromissione della funzionalità renale (clearance della creatinina <30 ml/min) e nei pazienti dializzati con insufficienza renale terminale (cfr. «Posologia/impiego»).
Pazienti anziani
I dati disponibili sui pazienti anziani sono limitati, ma non suggeriscono variazioni marcate della biodisponibilità di exenatide anche a un'età avanzata fino a circa 75 anni.
In uno studio sulla farmacocinetica di exenatide due volte al giorno (Byetta) in pazienti con diabete mellito di tipo 2, l'uso di exenatide (10 µg) in 15 pazienti anziani di età compresa tra 75 e 85 anni ha determinato un aumento medio della biodisponibilità di exenatide del 36% rispetto a 15 pazienti di età tra 45 e 65 anni, il che è probabilmente riconducibile a una ridotta funzionalità renale nei pazienti più anziani (cfr. «Posologia/impiego»).
Bambini e adolescenti
In uno studio di farmacocinetica, 13 pazienti con diabete mellito di tipo 2 di età compresa tra 12 e 16 anni hanno ricevuto una singola dose di 5 µg di exenatide. È emersa una lieve diminuzione dell'AUC media (-16%) e della Cmax (-25%) rispetto ai valori rilevati negli adulti.
Non sono stati effettuati studi di farmacocinetica con Bydureon nei bambini e negli adolescenti.
Sesso, appartenenza etnica, condizione di sovrappeso
Il sesso, l'appartenenza etnica o una condizione di sovrappeso dei pazienti non hanno effetti significativi sulla farmacocinetica di exenatide.
Dati preclinici
I dati non clinici degli studi convenzionali con exenatide due volte al giorno (Byetta) su farmacologia di sicurezza, tossicità generale o genotossicità non evidenziano alcun rischio particolare per l'essere umano.
Cancerogenicità
Nell'ambito di uno studio di 104 settimane sulla cancerogenità di Bydureon nei ratti, a tutte le posologie (1,4-26 volte l'esposizione umana durante il trattamento con Bydureon) è stato osservato un aumento statisticamente significativo dell'incidenza dei carcinomi midollari della tiroide (adenomi e/o carcinomi). La rilevanza di questi risultati per l'essere umano non è ancora nota.
Tossicità per la riproduzione
In studi sulla tossicità per lo sviluppo Bydureon mostra effetti simili a exenatide due volte al giorno (Byetta). In femmine di ratto gravide che a metà gravidanza avevano ricevuto posologie di Bydureon corrispondenti a esposizioni da 2 a 15 volte l'esposizione nell'essere umano, la crescita fetale è risultata ridotta in funzione degli effetti sulla madre (ridotta assunzione di cibo e ridotto aumento del peso corporeo). Non sono emerse evidenze di malformazioni.
Studi con exenatide due volte al giorno (Byetta) nei topi e nei conigli non hanno indicato effetti dannosi diretti in rapporto alla fertilità o alla gravidanza; posologie di exenatide due volte al giorno (Byetta) corrispondenti a esposizioni analoghe o superiori a Bydureon, hanno avuto effetti a livello scheletrico e hanno ridotto sia la crescita fetale sia quella neonatale.
Altre indicazioni
Incompatibilità
Bydureon non deve essere miscelato con altri medicamenti.
Stabilità
Bydureon deve essere iniettato immediatamente dopo essere stato preparato.
Indicazioni particolari concernenti l'immagazzinamento
Bydureon Pen
Conservare in frigorifero (2-8 °C).
Non congelare. Se congelato, Bydureon non deve essere più utilizzato e deve essere smaltito in modo appropriato.
Le penne possono essere conservate prima dell'apertura a temperature fino a 30 °C per un massimo di 4 settimane.
Conservare nella scatola originale per proteggere il contenuto dalla luce.
Conservare il medicamento fuori dalla portata dei bambini.
Bydureon BCise, autoiniettore
Conservare in frigorifero in posizione orizzontale (2-8 °C).
Conservare nella confezione originale per proteggere il contenuto dalla luce.
Bydureon BCise può essere conservato prima dell'uso a temperature non superiori a 30 °C per un massimo di 4 settimane.
Conservare fuori dalla portata dei bambini.
Indicazioni per la manipolazione
Bydureon deve essere utilizzato solo da una persona.
Le esatte istruzioni per l'uso sono allegate alla confezione di Bydureon Pen o di Bydureon BCise, autoiniettore.
Bydureon è esclusivamente monouso.
I pazienti e le persone che forniscono assistenza devono ricevere un'adeguata formazione da parte del personale medico specializzato.
Occorre informare il paziente che la penna e l'ago o l'autoiniettore devono essere smaltiti in modo sicuro e appropriato dopo ogni iniezione.
Bydureon Pen
La polvere contenuta all'interno di una camera della penna deve essere miscelata con il solvente presente nell'altra camera della penna. Il solvente deve essere ispezionato visivamente prima della miscelazione. Il solvente può essere utilizzato solo se limpido e privo di particelle. Dopo la sospensione, Bydureon Pen può essere usato soltanto se la miscela appare di colore da bianco a bianco sporco e risulta uniformemente torbida. Con la penna si devono utilizzare solo gli aghi adatti inclusi nella confezione.
Bydureon BCise, autoiniettore
L'autoiniettore deve essere prelevato dal frigorifero e posto in posizione orizzontale per almeno 15 minuti prima dell'iniezione. La sospensione va miscelata agitandola energicamente per almeno 15 secondi. La sospensione deve essere ispezionata visivamente prima dell'uso. La sospensione può essere utilizzata solo se è stata uniformemente miscelata e appare di colore da bianco a crema e di aspetto lattescente, senza la polvere bianca visibile nella finestrella della penna, ai lati o in basso o in alto. Dopo che la sospensione è stata completamente miscelata, le fasi di preparazione devono essere effettuate immediatamente e la sospensione deve essere iniettata per via sottocutanea.
Numero dell'omologazione
65389, 67503 (Swissmedic)
Titolare dell’omologazione
AstraZeneca AG, 6340 Baar
Stato dell'informazione
Settembre 2020
Composition
Bydureon Pen
Principes actifs
Exénatide.
Excipients
Poly-(D,L-lactide-co-glycolide) 50:50, saccharose.
Solvant
Carmellose sodique, chlorure de sodium, polysorbate 20, dihydrogéno-phosphate de sodium monohydraté, phosphate de disodium heptahydraté, hydroxyde de sodium, eau pour injection.
Teneur totale en sodium par dose: 4,39 mg.
Bydureon BCise, auto-injecteur
Principes actifs
Exénatide.
Excipients
Poly-(D,L-lactide-co-glycolide) 50:50, saccharose, triglycérides à chaîne moyenne.
Forme pharmaceutique et quantité de principe actif par unité
Bydureon Pen
Poudre et solvant pour suspension injectable à libération prolongée en stylo prérempli: la dose du stylo injecteur est de 2 mg d'exénatide dans 0,65 ml.
Bydureon BCise, auto-injecteur
Suspension injectable à libération prolongée en stylo prérempli: 2 mg d'exénatide dans 0,85 ml de suspension injectable à libération prolongée.
Indications/Possibilités d’emploi
Bydureon est indiqué dans le traitement du diabète de type 2 en association avec:
la metformine;
une sulfonylurée;
une thiazolidinedione;
la metformine et une sulfonylurée;
la metformine et une thiazolidinedione;
chez les adultes n'ayant pas obtenu un contrôle glycémique adéquat aux doses maximales tolérées de ces antidiabétiques oraux.
Posologie/Mode d’emploi
La dose recommandée de Bydureon est de 2 mg d'exénatide une fois par semaine.
Le passage du traitement par l'exénatide deux fois par jour (Byetta) à l'exénatide une fois par semaine (Bydureon Pen ou Bydureon Bcise, auto-injecteur) peut entraîner une élévation temporaire de la glycémie. Elle est généralement limitée aux deux (Bydureon Pen) ou quatre premières semaines (Bydureon BCise, auto-injecteur) qui suivent le changement de traitement.
Les patients peuvent permuter entre les médicaments contenant de l'exénatide à libération prolongée (Bydureon Pen et Bydureon Bcise, auto-injecteur) sans devoir s'attendre à un impact pertinent sur les taux de glycémie.
Bydureon est recommandé pour les patients souffrant de diabète de type 2 qui reçoivent déjà de la metformine, une sulfonylurée ou une thiazolodinedione en monothérapie, ou qui sont traités par une association de metformine et d'une sulfonylurée ou de metformine et d'une thiazolidinedione. Quand Bydureon est associé à un traitement par la metformine et/ou une thiazolidinedione, le traitement par la metformine et/ou une thiazolidinedione peut être poursuivi à la même posologie, sans que l'on ait à redouter un risque d'hypoglycémie par rapport à la monothérapie de metformine ou de thiazolidinedione. Quand Bydureon est associé à un traitement par une sulfonylurée, une diminution de la posologie de la sulfonylurée doit être envisagée afin de diminuer le risque d'hypoglycémie (voir «Mises en garde et précautions»).
Bydureon doit être administré une fois par semaine toujours le même jour. Le jour de l'administration hebdomadaire peut être modifié si nécessaire, dans la mesure où la dernière dose a été administrée au moins trois jours auparavant. Bydureon peut être administré à n'importe quel moment de la journée, avec ou sans repas.
Une dose oubliée doit être prise immédiatement, à condition que la prise de la dose suivante normalement planifiée soit prévue dans les 3 jours, voire plus tard. Les patients peuvent ensuite reprendre leur schéma posologique hebdomadaire habituel.
Lorsqu'une injection a été oubliée et que la dose normalement planifiée est prévue 1 ou 2 jours plus tard, le patient ne doit pas s'administrer la dose oubliée, mais poursuivre l'administration de l'exénatide à libération prolongée le jour de l'injection suivante prévue.
L'utilisation de Bydureon n'exige pas de mesure supplémentaire de la glycémie par le patient. L'autosurveillance glycémique est indispensable pour ajuster la dose de la sulfonylurée ou de l'insuline, notamment au début du traitement par Bydureon et en cas de réduction de la dose d'insuline. Il est recommandé de réduire progressivement la dose d'insuline.
Au terme du traitement, la libération prolongée de Bydureon doit être prise en compte (voir «Pharmacocinétique»).
Patients présentant des troubles de la fonction hépatique
Sur la base des données précliniques, il ne faut pas s'attendre à ce qu'une altération de la fonction hépatique influe sur la pharmacocinétique de Bydureon. Aucun ajustement de la dose n'est donc nécessaire chez les patients présentant des troubles de la fonction hépatique. Aucune étude pharmacocinétique n'a été réalisée chez les patients présentant un diagnostic d'insuffisance hépatique aiguë ou chronique (voir «Pharmacocinétique»).
Patients présentant des troubles de la fonction rénale
Bydureon peut être utilisé chez les patients souffrant d'insuffisance rénale légère à modérée (clairance de la créatinine de 30 à 80 ml/min). (voir «Pharmacocinétique»). En cas d'insuffisance rénale modérée, les concentrations moyennes d'exénatide à l'état stationnaire augmentent de 74 %. La prudence est donc de rigueur chez ces patients.
Bydureon n'est pas recommandé chez les patients ayant une insuffisance rénale terminale ou sévère (clairance de la créatinine <30 ml/min) (voir «Mises en garde et précautions» et «Pharmacocinétique»).
Patients âgés
Bydureon peut être utilisé chez des patients de tout âge, y compris des patients âgés (>65 ans). L'expérience clinique chez les patients de plus de 75 ans est très limitée (voir «Pharmacocinétique»).
Enfants et adolescents
La sécurité et l'efficacité de l'exénatide à libération prolongée chez des patients âgés de moins de 18 ans n'ont pas été étudiées (voir «Pharmacocinétique»).
Sexe, appartenance ethnique ou obésité
Aucune adaptation de la posologie n'est nécessaire en fonction du sexe, de l'appartenance ethnique ou de la présence d'une obésité (BMI >30 kg/m²) (voir «Pharmacocinétique»).
Mode d'administration
Le patient peut s'administrer lui-même l'exénatide à libération prolongée par voie sous-cutanée. Chaque set est à usage unique et destiné à être utilisé par une seule personne.
Le mode d'emploi doit être soigneusement suivi.
Immédiatement après le mélange complet du médicament, chaque dose doit être injectée par voie sous-cutanée dans l'abdomen, la cuisse ou l'arrière de la partie supérieure du bras.
En cas d'utilisation avec l'insuline, l'exénatide à libération prolongée et l'insuline doivent être administrés en deux injections séparées.
Pour des instructions sur la mise en suspension du médicament avant l'utilisation, voir «Remarques particulières».
Bydureon Pen
Après mise en suspension, Bydureon doit être utilisé uniquement si le mélange est blanc à blanc cassé et uniformément trouble.
Contre-indications
Hypersensibilité à la substance active ou à l'un des excipients selon la composition.
Mises en garde et précautions
Bydureon ne doit pas être utilisé chez les patients ayant un diabète de type 1 ou pour le traitement d'une acidocétose diabétique.
Bydureon n'est pas un substitut de l'insuline. Des cas d'acidocétose diabétique ont été rapportés chez des patients insulino-dépendants après un arrêt rapide ou une réduction posologique rapide de l'insuline (voir «Posologie/Mode d'emploi»).
Bydureon ne doit pas être administré par voie intraveineuse ou intramusculaire.
Troubles de la fonction rénale
Chez les patients dialysés ayant une insuffisance rénale terminale, la fréquence et la sévérité des effets indésirables gastro-intestinaux sont augmentées par des doses uniques de 5 µg d'exénatide (Byetta). Bydureon n'est pas recommandé chez les patients ayant une insuffisance rénale terminale ou sévère (clairance de la créatinine <30 ml/min). L'expérience clinique chez les patients ayant une insuffisance rénale modérée est très limitée.
Il y a eu de rares notifications spontanées d'altération de la fonction rénale, incluant des cas d'augmentation de la créatinine sérique, de dépréciation de la fonction rénale, d'aggravation d'une insuffisance rénale chronique et d'insuffisance rénale aiguë, nécessitant parfois une hémodialyse. Certains de ces événements sont survenus chez des patients qui prenaient un ou plusieurs médicaments connus pour exercer une influence sur la fonction rénale ou l'état d'hydratation et/ou chez des patients qui présentaient par ailleurs d'autres conditions pouvant entraîner une déshydratation, parmi lesquelles des nausées, des vomissements et/ou des diarrhées. Ces médicaments pouvaient être: les inhibiteurs de l'enzyme de conversion de l'angiotensine, les anti-inflammatoires non stéroïdiens (AINS) et les diurétiques. Dans la plupart des cas, l'altération observée de la fonction rénale a été réversible sous traitement symptomatique et après l'arrêt des médicaments potentiellement en cause, dont l'exénatide. Des études précliniques et cliniques avec l'exénatide n'ont relevé aucun signe d'effets néphrotoxiques directs.
Affections gastro-intestinales sévères
L'effet de Bydureon n'a pas été étudié chez les patients ayant une pathologie gastro-intestinale sévère, dont la gastroparésie diabétique. En général, son utilisation est associée à des effets indésirables gastro-intestinaux tels que, notamment, des nausées, des vomissements et des diarrhées. L'utilisation de Bydureon n'est donc pas recommandée chez les patients atteints d'une maladie gastro-intestinale sévère.
Pancréatite aiguë
Il y a eu des notifications spontanées de pancréatites aiguës. Les patients doivent être informés des symptômes caractéristiques des pancréatites aiguës: douleurs abdominales sévères et persistantes pouvant irradier et parfois accompagnées de vomissements. Si une pancréatite est suspectée, le traitement de Bydureon doit être arrêté. Dans de très rares cas, une pancréatite nécrosante ou hémorragique et/ou un décès ont été rapportés. Une fois le diagnostic de pancréatite établi, la reprise du traitement par l'exénatide est déconseillée si une étiologie alternative de la pancréatite n'a pas pu être identifiée de façon suffisamment fiable.
Traitement concomitant
L'utilisation de Bydureon en association avec l'insuline, les dérivés de la D-phénylalanine (les méglitinides), les inhibiteurs de l'alpha-glucosidase, les inhibiteurs de la dipeptidyl peptidase-4 (inhibiteurs de DPP-4) ou d'autres agonistes des récepteurs du GLP-1, n'a pas été étudiée et n'est pas recommandée.
L'utilisation de Bydureon en association avec l'exénatide deux fois par jour (Byetta) n'a pas été étudiée et n'est pas recommandée.
Hypoglycémie
L'incidence d'hypoglycémies était augmentée lorsque Bydureon était utilisé en association avec une sulfonylurée, par rapport à l'administration d'un placebo en association avec une sulfonylurée. Dans des études cliniques, l'incidence des hypoglycémies était augmentée chez les patients ayant une insuffisance rénale légère et traités par une association de Bydureon et d'une sulfonylurée, par rapport aux patients qui avaient une fonction rénale normale. Afin de diminuer le risque d'hypoglycémie associé à l'utilisation d'une sulfonylurée, on peut envisager une diminution de la dose de sulfonylurée.
Interactions avec la warfarine
Des cas d'augmentation de l'INR (International Normalized Ratio) ont été observés, parfois associés à des saignements, lors de l'utilisation de la warfarine en association avec l'exénatide (voir «Interactions»). On ne dispose d'aucune expérience concernant l'utilisation simultanée d'exénatide et d'acénocoumarol ou de phenprocoumone.
Excipients
Bydureon Pen contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu'il est essentiellement «sans sodium».
Interactions
Les résultats d'une étude utilisant le paracétamol comme marqueur de la vidange gastrique suggèrent que le ralentissement de la vidange gastrique induit par Bydureon est mineur et qu'il n'est pas attendu que cet effet entraîne des réductions cliniquement significatives de la Cmax ou de l'AUC de médicaments pris simultanément par voie orale. Par conséquent, aucun ajustement posologique n'est nécessaire pour les médicaments pris en même temps que Bydureon par voie orale. Toutefois, lors de l'administration concomitante d'une sulfonylurée, un ajustement de la dose peut s'avérer nécessaire en raison du risque accru d'hypoglycémie (voir «Posologie/Mode d'emploi» et «Mises en garde et précautions»).
Paracétamol
Le paracétamol a été utilisé comme exemple de médicament pour mesurer l'effet de l'exénatide sur la vidange gastrique.
Lorsque 1000 mg de paracétamol en comprimés ont été administrés, avec ou sans repas, après 14 semaines de traitement par Bydureon, aucun changement significatif de l'AUC du paracétamol n'a été observé par rapport à la période contrôle. La Cmax du paracétamol a diminué de 16 % (à jeun) respectivement de 5 % (post-prandial) et le tmax était augmenté approximativement de 1 heure au cours de la période contrôle, à 1,4 heure (à jeun) respectivement 1,3 heure (post-prandial). Dans la même étude, la prise de paracétamol (post-prandial) 15 minutes après l'exénatide deux fois par jour (10 µg Byetta) a entraîné une diminution de l'AUC de 20 % et de la Cmax de 21 %, ainsi qu'un allongement du tmax à 2 heures. Ces résultats montrent que l'effet de l'exénatide sur la vidange gastrique n'est que minime.
Sulfonylurées
Un ajustement de la dose de la sulfonylurée peut être nécessaire du fait de l'augmentation du risque d'hypoglycémie associée à un traitement par une sulfonylurée (voir «Posologie/Mode d'emploi» et «Mises en garde et précautions»).
Les études d'interaction suivantes ont été conduites en utilisant 10 µg d'exénatide deux fois par jour (Byetta); elles n'ont pas été réalisées avec Bydureon.
Inhibiteurs de la HMG CoA réductase
Lorsque l'exénatide 10 µg deux fois par jour (Byetta) était associé à une dose unique de lovastatine (40 mg), l'AUC et la Cmax de la lovastatine étaient respectivement diminuées d'environ 40 % et 28 %, le tmax étant allongé d'environ 4 heures par rapport à la lovastatine administrée seule. Durant les études cliniques contrôlées de 30 semaines, l'administration concomitante d'exénatide deux fois par jour (Byetta) et d'inhibiteurs de la HMG-CoA réductase n'a pas été associée à des modifications significatives des lipides sanguins. Aucune modification de la posologie n'est nécessaire; cependant les lipides sanguins doivent être contrôlés de façon appropriée.
Warfarine
Un allongement du tmax d'environ 2 h a été observé quand la warfarine était administrée 35 min après l'exénatide. Aucun effet cliniquement significatif n'a été observé sur la Cmax ou l'AUC. Des cas d'augmentation de l'INR ont été rapportés lors d'une utilisation concomitante de warfarine et d'exénatide deux fois par jour (Byetta). Chez les patients traités par la warfarine et/ou des dérivés de la coumarine tels que l'acénocoumarol ou la phenprocoumone, l'INR devra être étroitement surveillé lors de l'initiation du traitement par Bydureon (voir «Effets indésirables»).
Digoxine, lisinopril
Au cours des études d'interaction sur l'effet de l'exénatide sur la digoxine ou le lisinopril, un allongement du tmax d'environ 2 h a été observé. Il n'y a eu toutefois aucun effet cliniquement significatif sur la Cmax ou l'AUC.
Enfants et adolescents
Les études d'interaction n'ont été menées que chez des sujets adultes.
Grossesse/Allaitement
Grossesse
En raison de la longue période d'élimination de Bydureon, les femmes en âge de procréer doivent utiliser une contraception pendant le traitement par Bydureon.
Si une patiente envisage une grossesse ou si une grossesse survient, le traitement de Bydureon sera interrompu. Le traitement par Bydureon sera arrêté au moins 3 mois avant une grossesse planifiée.
Il n'existe pas de données suffisamment pertinentes concernant l'utilisation de Bydureon chez la femme enceinte. Des études effectuées chez l'animal ont mis en évidence une toxicité sur la reproduction (voir «Données précliniques»). Le risque potentiel chez l'être humain n'est pas connu. Bydureon ne doit pas être utilisé pendant la grossesse et l'utilisation d'insuline est alors recommandée.
Allaitement
On ignore si l'exénatide est excrété dans le lait maternel. Bydureon ne doit pas être utilisé pendant l'allaitement ou la mère doit cesser d'allaiter.
Fertilité
Aucune étude n'a été réalisée concernant l'effet de Bydureon sur la fertilité humaine.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Les effets sur l'aptitude à conduire des véhicules et à utiliser des machines n'ont pas été étudiés. Lorsque Bydureon est utilisé en association avec une sulfonylurée, les patients doivent être informés des précautions à prendre afin d'éviter une hypoglycémie lors de la conduite de véhicules ou l'utilisation de machines.
Effets indésirables
Résumé du profil de sécurité
Bydureon
Les effets indésirables les plus fréquents (≥5 % sous traitement par Bydureon) étaient principalement gastro-intestinaux (nausées, vomissements, diarrhée et constipation). Les nausées étaient l'effet indésirable rapporté le plus fréquemment ; elles étaient surtout associées à l'initiation du traitement et diminuaient avec le temps. Par ailleurs, le prurit au site d'injection, l'hypoglycémie et les céphalées ont été fréquents. La plupart des effets indésirables associés à l'utilisation de Bydureon étaient d'intensité légère à modérée.
Après la commercialisation de l'exénatide deux fois par jour (Byetta), de rares cas de pancréatite aiguë et d'insuffisance rénale aiguë ont été rapportés (voir « Mises en garde et précautions »).
Bydureon BCise, auto-injecteur
Les effets indésirables les plus fréquents survenus pendant les études cliniques étaient de nature gastro-intestinale (principalement des nausées [8 %] qui ont régressé au cours du traitement), des céphalées (4 %) ainsi que des réactions au site d'injection comme des nodules au site d'injection (11 %), un prurit au site d'injection (3 %) et un érythème au site d'injection (2 %). Une hypoglycémie était survenue en outre très fréquemment en cas d'association à une sulfonylurée (voir ci-dessous « Description de certains effets indésirables »). La plupart des effets indésirables étaient de gravité légère à moyenne.
Tableau résumé des effets indésirables
Le tableau ci-dessous résume les effets indésirables de Bydureon, Bydureon BCise et de l'exénatide deux fois par jour (Byetta) survenus dans le cadre des études cliniques avec une fréquence ≥1 %.
Les données sources pour Bydureon comprennent deux études contrôlées versus placebo (10 et 15 semaines) et 3 études comparant Bydureon soit à l'exénatide deux fois par jour (Byetta) (une étude de 30 semaines), soit à la sitagliptine et à la pioglitazone (une étude de 26 semaines), soit à l'insuline glargine (une étude de 26 semaines). Les traitements de fond incluaient un régime alimentaire et une activité physique, la metformine, une sulfonylurée, une thiazolidinedione ou une association d'antidiabétiques oraux.
Le tableau contient également des effets indésirables qui n'ont pas atteint une fréquence de ≥1 %, mais qui ont été néanmoins rapportés après commercialisation et au cours d'essais cliniques avec l'exénatide deux fois par jour (Byetta).
Les données regroupées des études cliniques sur Bydureon Bcise comprennent celles de deux études de phase 3 contrôlées contre comparateur d'une durée de 6 à 12 mois. Le pool de données comprend les phases de suivi et d'extension des études. Les traitements concomitants incluaient un régime alimentaire et une activité physique seuls ou associés à la metformine, une sulfonylurée, une thiazolidinedione ou une association d'hypoglycémiants oraux. Le tableau présente également les effets indésirables observés avec l'exénatide à libération prolongée après la commercialisation, mais pas au cours des études cliniques réalisées avec Bydureon BCise, auto-injecteur.
Les effets indésirables sont listés ci-dessous selon la terminologie MedDRA par classe de système d'organe et par fréquence absolue. Les fréquences sont définies de la manière suivante: très fréquents (≥1/10), fréquents (≥1/100, <1/10), occasionnels (≥1/1 000, <1/100), rares (≥1/10'000, <1/1 000) et très rares (<1/10'000).
Tableau 1. Effets indésirables de l'exénatide identifiés dans les études cliniques et les notifications spontanées
Bydureon Données N = 592 au total (patients traités N = 135) | Exénatide 10 µg Données N = 145 au total (patients traités par N = 52) | Exénatide Données post-commercialisation | Bydureon BCise, auto-injecteur | Bydureon et Bydureon BCise, auto-injecteur Données | |||
|---|---|---|---|---|---|---|---|
Très fréquents | Fréquents | Très fréquents | Fréquents | Fréquence (voir note de bas de page) | Fréquence (voir note de bas de page) | Fréquence (voir note de bas de page) | |
Affections hématologiques et du système lymphatique | |||||||
Thrombopénie médicamenteuse (fréquence indéterminée)4 | Thrombopénie médicamenteuse (fréquence indéterminée)4 | ||||||
Affections du système immunitaire | |||||||
Réaction anaphylactique (très rare)2 | |||||||
Troubles du métabolisme et de la nutrition | |||||||
Hypoglycémie (avec une sulfonylurée) (32 %) | Hypoglycémie (avec une sulfonylurée) | Hypoglycémie (avec une sulfonylurée)9,10 (très fréquent) (26,1 %) | |||||
Hypoglycémie (avec insuline)7,8 (fréquent) | |||||||
Diminution de l'appétit | Diminution de l'appétit | ||||||
Déshydratation, généralement associée à des nausées, des vomissements (rare)2 | |||||||
Affections du système nerveux | |||||||
Sensations vertigineuses | Sensations vertigineuses | Sensations vertigineuses (fréquent) | |||||
Céphalées | Céphalées | Céphalées (fréquent) | |||||
Dysgueusie (occasionnel)2 | |||||||
Affections gastro-intestinales | |||||||
Constipation (6 %) | Constipation | Constipation (fréquent) | |||||
Diarrhée (13 %) | Diarrhée | Diarrhée (fréquent) | |||||
Nausées (20 %) | Nausées | Nausées (fréquent) | |||||
Vomissements (8 %) | Vomissements | Vomissements (fréquent) | |||||
Distension abdominale | Distension abdominale (fréquent)1 | Distension abdominale (fréquent) | |||||
Douleurs abdominales | Douleurs abdominales | Douleurs abdominales (fréquent) | |||||
Dyspepsie | Dyspepsie | Dyspepsie (fréquent) | |||||
Éructations | Éructations (occasionnel)2 | ||||||
Flatulences | Flatulences | ||||||
Reflux gastro-œsophagien | Reflux gastro-œsophagien | Reflux gastro-œsophagien (fréquent) | |||||
Pancréatite aiguë (voir Mises en garde et précautions). (occasionnel)1 3 | |||||||
Affections de la peau et du tissu sous-cutané | |||||||
Rash maculaire ou papulaire (rare) 2 | |||||||
Prurit et/ou urticaire (rare) 2 | |||||||
Œdèmes angioneurotiques | Angio-œdème (fréquence indéterminée)6 | ||||||
Alopécie (rare)2 | |||||||
Sueurs profuses (fréquent)1 | |||||||
Abcès au site d'injection et cellulite (fréquence indéterminée)6 | |||||||
Affections du rein et des voies urinaires | |||||||
Modifications de la fonction rénale incluant insuffisance rénale aiguë, aggravation d'une insuffisance rénale chronique, altération de la fonction rénale, élévation de la créatinine sérique (rare)2 (voir Mises | |||||||
Troubles généraux et anomalies au site d'administration | |||||||
Prurit au site d'injection | Prurit au site d'injection | Prurit au site d'injection (fréquent) | |||||
Fatigue | Fatigue | Fatigue (fréquent) | |||||
Érythème au site d'injection | Réactions au site d'injection | Érythème au site d'injection (fréquent) | |||||
Éruption au site d'injection | |||||||
Somnolence | Somnolence (rare)2 | ||||||
Faiblesse (fréquent)1 | |||||||
Sensation d'agitation interne (fréquent)1 | |||||||
Investigations | |||||||
Augmentation du temps de thromboplastine en cas de traitement concomitant par la warfarine, (voir Mises (rare)1 | Augmentation de l'INR (fréquence indéterminée)6 (voir Mises | ||||||
¹ La fréquence est basée sur les données des études cliniques réalisées avec l'exénatide deux fois par jour (Byetta).
² La fréquence est basée sur les notifications spontanées concernant l'exénatide deux fois par jour (Byetta).
³ Ces évènements sont apparus occasionnellement dans tous les groupes de traitement.
4 Concerne les données post-commercialisation, ne peut être estimé sur la base des données disponibles.
5 Sauf indication contraire, taux de fréquence basés sur les études à long terme relatives à la sécurité et l'efficacité achevées (N = 526). Inclut un suivi dans les septante jours qui suivent l'administration de la dernière dose et une phase d'extension.
6 Taux de fréquence basés sur les données des notifications spontanées concernant l'exénatide à libération prolongée (dénominateur inconnu).
7 Basé sur les évènements hypoglycémiques, menant 1. à une perte de conscience, des convulsions ou un coma régressant après l'utilisation de glucagon ou de glucose OU 2. nécessitant l'intervention de tiers en raison de troubles de la conscience ou du comportement et un taux de glucose < 54 mg/dl (3 mmol/l) OU 3. menant à des symptômes correspondant à une hypoglycémie avec parallèlement un taux de glucose < 54 mg/dl (3 mmol/l) avant le traitement.
8 Fréquence rapportée au cours de la période contrôlée du traitement de 28 semaines de l'étude sur l'exénatide à libération prolongée en association avec l'insuline glargine (N = 231).
9 Taux de fréquence basés sur les données regroupées des périodes contrôle des deux études cliniques de phase 3 (N = 410).
10 Basé sur les évènements hypoglycémiques avec des symptômes correspondant à une hypoglycémie avec parallèlement un taux de glucose < 54 mg/dl (3 mmol/l) avant le traitement.
Description de certains effets indésirables
Thrombocytopénie induite par les médicaments
Après la commercialisation, des cas de thrombocytopénie induite par les médicaments qui était causée par des anticorps plaquettaires dépendant de l'exenatide ont été rapportés. La thrombocytopénie induite par les médicaments est une réaction à médiation immunitaire provoquée par des anticorps induits par les médicaments dirigés contre les plaquettes. Ces anticorps provoquent la destruction des plaquettes en présence du médicament sensibilisateur.
Hypoglycémie
Bydureon
L'incidence des hypoglycémies était augmentée quand Bydureon était associé à une sulfonylurée (voir « Mises en garde et précautions »). Afin de réduire le risque d'hypoglycémie associé à l'utilisation d'une sulfonylurée, une réduction de la dose de sulfonylurée doit être envisagée. Les hypoglycémies étaient généralement légères à modérées et toutes ont pu être corrigées par l'administration orale de glucides.
Bydureon chez les patients recevant également un traitement de metformine était associé à une incidence des épisodes d'hypoglycémie significativement plus faible que l'insuline glargine associée à la metformine (3 % versus 19 %). De même, chez les patients recevant Bydureon associé à un traitement de metformine plus sulfonylurée la fréquence des épisodes d'hypoglycémie était plus faible que lors de traitement à l'insuline glargine en association avec metformine plus sulfonylurée (20 % versus 42 %).
Bydureon BCise, auto-injecteur
Aucun cas d'hypoglycémie sévère n'est survenu avec Bydureon Bcise, auto-injecteur. La fréquence d'une hypoglycémie légère était de 6,3 %. Cette fréquence était accrue en cas d'utilisation en association avec une sulfonylurée (26,1 %) en comparaison avec une administration sans sulfonylurée (0,9 %) (voir rubrique « Mise en garde et précautions »). Une réduction de la dose de la sulfonylurée peut être envisagée afin de réduire le risque d'apparition d'une hypoglycémie en lien avec l'utilisation d'une sulfonylurée (voir rubriques « Posologie/Mode d'emploi » et « Mises en garde et précautions »).
Aucun ajustement initial de la dose d'insuline n'était nécessaire lors de l'utilisation de l'exénatide à libération prolongée en association avec l'insuline basale. Associé à l'insuline basale, l'exénatide à libération prolongée n'a pas mis en évidence de différences cliniquement significatives concernant l'incidence des épisodes hypoglycémiques par rapport à l'insuline. Aucun épisode d'hypoglycémie sévère n'est survenu dans le groupe recevant l'exénatide à libération prolongée avec l'insuline.
Nausées
Bydureon
Les nausées ont été l'effet indésirable rapporté le plus fréquemment. D'une façon générale, 20 % des patients traités avec Bydureon ont présenté au moins un épisode de nausées, par rapport à 34 % des patients traités avec l'exénatide deux fois par jour (Byetta). La plupart des épisodes de nausées étaient d'intensité légère à modérée. Chez la plupart des patients ayant présenté des nausées lors de l'initiation du traitement, la fréquence des nausées a diminué avec la poursuite du traitement.
Dans des études contrôlées sur 30 semaines, l'incidence des sorties d'étude pour effets indésirables était de 6 % chez les patients traités par Bydureon et de 5 % chez les patients traités par l'exénatide deux fois par jour (Byetta). Dans les deux groupes de traitement, les effets indésirables ayant le plus fréquemment conduit à une sortie d'étude ont été des nausées et des vomissements. Les sorties d'étude liées aux nausées ou aux vomissements concernaient respectivement <1 % des patients traités par Bydureon et 1 % des patients traités par l'exénatide deux fois par jour (Byetta).
Bydureon BCise, auto-injecteur
L'effet indésirable gastro-intestinal le plus fréquemment rapporté était les nausées. Au cours de la phase contrôlée de l'étude clinique comparant Bydureon Bcise, auto-injecteur à l'exénatide deux fois par jour (Byetta), des nausées (9,6 % vs 20,5 %) ont été rapportées dans chaque groupe. Au total, 9,3 % des patients traités par Bydureon Bcise, auto-injecteur ont rapporté des nausées pendant la phase contrôlée des deux études cliniques. Les nausées étaient généralement de gravité légère à modérée; elles étaient en lien avec le début du traitement et ont régressé avec le temps.
Réactions au site d'injection
Bydureon
Des réactions au site d'injection ont été observées plus fréquemment chez les patients traités par Bydureon que chez les patients traités par un comparateur actif (environ deux fois plus souvent). Ces réactions au site d'injection ont généralement été d'intensité légère et n'ont d'ordinaire pas conduit à une sortie d'étude.
Au cours d'essais cliniques, on a observé très fréquemment au site d'injection de petits nodules sous-cutanés, déjà connus pour se manifester lors de l'administration d'autres préparations à base de microsphères de poly-(D,L-lactide-co-glycolide). La plupart de ces nodules étaient asymptomatiques, ils n'influaient généralement pas sur la participation à l'étude et ils disparaissaient au bout de 4 à 8 semaines. Chez environ 50 % des patients qui présentaient des nodules symptomatiques, les nodules ont disparu en l'espace de 10 semaines dans les études de phase 3, tandis que cela a duré plus longtemps chez les autres patients.
En post-commercialisation, des cas d'abcès et de cellulite au site d'injection ont été rapportés.
Bydureon BCise, auto-injecteur
Pendant la phase contrôlée des études cliniques, les réactions au site d'injection étaient plus fréquentes chez les patients traités par Bydureon Bcise, auto-injecteur que chez les patients traités par le comparateur (24 % par rapport à 4 % pour l'exénatide deux fois par jour [Byetta]). Ces réactions étaient généralement peu marquées et n'ont normalement pas mené à l'arrêt du médicament à l'étude. Les patients peuvent recevoir un traitement soulageant leurs symptômes pendant la poursuite du traitement. Un autre site d'injection doit alors être choisi chaque semaine pour les injections suivantes. L'expérience post-commercialisation avec l'exénatide à libération prolongée comprend des rapports de cas d'abcès et d'inflammations bactériennes au site d'injection.
Des nodules sous-cutanés au site d'injection ont été observés fréquemment au cours des études cliniques ; ceci est une propriété connue des formes pharmaceutiques comportant des microsphères de polymère contenant du poly-(D,L-lactide- co-glycolide). La plupart de ces nodules n'ont pas influé sur la participation à l'étude et ont disparu avec le temps.
Immunogénicité
Compte tenu des propriétés potentiellement immunogènes des médicaments à base de protéines et de peptides, les patients traités par Bydureon peuvent développer des anticorps dirigés contre l'exénatide à la suite du traitement par Bydureon. Chez la plupart des patients qui ont développé des anticorps, le titre d'anticorps a diminué au cours du temps.
Bydureon
Au terme de l'étude de 30 semaines avec Bydureon, 43 % des patients avaient un faible titre d'anticorps dirigés contre l'exénatide. Selon les résultats d'études cliniques avec l'exénatide deux fois par jour (Byetta), le contrôle glycémique (HbA1c) était en général comparable à celui observé chez les patients sans anticorps (51 % des patients). 6 % des patients avaient un titre plus élevé d'anticorps après 30 semaines. Chez un tiers de ces patients (2 % des patients au total), la réponse glycémique à Bydureon était affaiblie ; chez les 4 % restants de patients, la réponse glycémique était comparable à la réponse de patients qui n'avaient pas formé d'anticorps.
Le pourcentage de patients avec des anticorps dirigés contre l'exénatide a été à peu près le même dans toutes les études.
Les patients avec des anticorps anti-exénatide ont eu tendance à présenter plus de réactions au site d'injection (par exemple: rougeur de la peau et démangeaison) ; en revanche, les fréquences et les types d'autres effets indésirables ont été comparables à ceux observés chez les patients sans anticorps anti-exénatide.
Au cours de l'étude de 30 semaines et des deux études de 26 semaines, l'incidence des réactions potentiellement immunologiques au site d'injection (le plus souvent prurit avec ou sans érythème) était de 9 % chez les patients traités par Bydureon. Ces réactions étaient moins fréquentes chez les patients sans anticorps (4 %) que chez les patients avec anticorps (13 %), avec une incidence plus grande chez ceux qui avaient un titre d'anticorps plus élevé.
L'étude d'échantillons sanguins avec anticorps anti-exénatide n'a montré aucune réaction croisée significative avec des peptides endogènes similaires (glucagon ou GLP-1).
Bydureon BCise, auto-injecteur
Environ 42 % des patients ont développé de faibles titres d'anticorps dirigés contre l'exénatide et 32 % des patients ont développé un titre d'anticorps élevé à tout moment pendant l'étude. Le pourcentage de ces patients positifs aux anticorps, notamment de ceux ayant des titres élevés, a culminé après 8 à 16 semaines à cette posologie pour ensuite diminuer avec le temps. À la fin de l'étude, environ 43 % des patients avaient de faibles titres d'anticorps dirigés contre l'exénatide et 14 % des titres d'anticorps élevés. Lors de la dernière visite, l'importance du contrôle métabolique de la glycémie (HbA1c) était généralement comparable chez les patients traités par Bydureon Bcise, auto-injecteur (-1,1 % à -1,5 %) et les patients sans titres d'anticorps (-1,1 % à -1,4 %). Tandis que les patients ayant des titres d'anticorps élevés présentaient un affaiblissement de la réponse HbA1c à la dernière visite, les baisses de l'HbA1c étaient cliniquement significatives chez ces patients (-0,6 % à -0,7 %).
Chez les patients traités par Bydureon Bcise, auto-injecteur ayant des anticorps évaluables (N = 393), la fréquence des réactions éventuellement immunogènes au site d'injection (généralement des nodules au site d'injection) était de 20 % pendant les deux études. Ces réactions ont été observées plus rarement chez les patients négatifs aux anticorps (16 %) et les patients ayant un faible titre d'anticorps (16 %) par rapport aux patients ayant un titre d'anticorps élevé (27 %).
Perte de poids rapide
Au cours d'une étude de 30 semaines, environ 3 % (N = 4/148) des patients traités par l'exénatide à libération prolongée ont présenté au moins une période de perte de poids rapide (perte de poids de plus de 1,5 kg par semaine documentée entre deux visites d'étude consécutives).
Augmentation de la fréquence cardiaque
Une augmentation moyenne de la fréquence cardiaque (FC) de 2,4 battements par minute par rapport à la valeur initiale (74/min) a été observée au cours de la phase contrôlée des études cliniques portant sur Bydureon Bcise, auto-injecteur. Quinze pour cent des patients traités par l'exénatide à libération prolongée ont présenté des augmentations moyennes de la FC de ≥10 battements par minute; environ 5 % à 10 % des personnes dans l'autre groupe de traitement présentaient une augmentation moyenne de la FC ≥10 battements par minute.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Signes et symptômes
Les effets d'un surdosage d'exénatide (sur la base des études cliniques avec l'exénatide deux fois par jour, Byetta) comportaient des nausées importantes, des vomissements importants et des baisses rapides de la glycémie.
Traitement
En cas de surdosage, un traitement de soutien adéquat doit être initié en fonction des signes et des symptômes cliniques du patient.
Propriétés/Effets
Code ATC
A10BJ01
Mécanisme d'action
L'exénatide est un agoniste du récepteur du glucagon-like peptide-1 (GLP-1) présentant plusieurs des actions anti-hyperglycémiantes du glucagon-like peptide-1 (GLP-1). La séquence d'acides aminés de l'exénatide est partiellement identique à celle du GLP-1 humain. In vitro, l'exénatide se lie au récepteur humain connu du GLP-1 et l'active. Son mécanisme d'action implique l'AMP cyclique et/ou d'autres voies de signalisation intracellulaire.
L'exénatide augmente de façon dépendante du glucose la synthèse et la sécrétion d'insuline par les cellules bêta pancréatiques. Lorsque la glycémie baisse, la sécrétion d'insuline diminue et, de ce fait, le risque potentiel d'hypoglycémie est réduit (voir «Mises en garde et précautions»). Quand l'exénatide était associé à la metformine et/ou à une thiazolidinedione, aucune augmentation de l'incidence des hypoglycémies n'a été observée en comparaison au placebo associé à la metformine et/ou à une thiazolidinedione. Ceci peut être dû à un mécanisme insulinotrope dépendant du glucose (voir «Mises en garde et précautions»).
L'exénatide inhibe la sécrétion de glucagon, connue pour être anormalement élevée dans le diabète de type 2. Des concentrations plus faibles de glucagon conduisent à une diminution de la production hépatique de glucose. En réponse à une hypoglycémie, l'exénatide n'inhibe cependant pas la réponse normale du glucagon ni l'action d'autres hormones.
Il a été montré que l'exénatide ralentit quelque peu la vidange gastrique, diminuant ainsi la vitesse avec laquelle le glucose alimentaire parvient dans la circulation. L'importance clinique de cette observation n'est pas claire.
Une diminution de la prise alimentaire due à une diminution de l'appétit et à une augmentation de la sensation de satiété a été montrée lors de l'administration d'exénatide. Cet effet est indépendant des nausées.
Pharmacodynamique
L'exénatide améliore le contrôle glycémique des patients souffrant de diabète de type 2 en diminuant de façon immédiate et à long terme la glycémie post-prandiale et la glycémie à jeun. Bydureon a un profil pharmacocinétique approprié pour une administration hebdomadaire.
Efficacité clinique
L'efficacité de 5 µg et 10 µg d'exénatide deux fois par jour (Byetta) a été démontrée. Les résultats de 5 études cliniques à long terme de Bydureon sont présentés ci-dessous. Ces études ont inclus 1628 sujets (804 traités par Bydureon), 54 % étaient des hommes et 46 % des femmes, 281 sujets (dont 141 traités par Bydureon) étaient âgés de 65 ans et plus. Deux études contrôlées supplémentaires réalisées avec Bydureon BCise, auto-injecteur incluaient 739 patients (dont 410 traités par Bydureon BCise); 58,5 % étaient des hommes et 41,5 % des femmes, 125 sujets (16,9 %) étaient âgés de 65 ans ou plus.
Contrôle glycémique
Bydureon (formulation aqueuse d'exénatide à libération prolongée)
Dans deux études, Bydureon 2 mg hebdomadaire a été comparé à l'exénatide 5 µg deux fois par jour (Byetta, initialement 5 µg deux fois par jour pendant 4 semaines, puis 10 µg deux fois par jour).
Une des études a duré 24 semaines (N = 252) et l'autre étude a duré 30 semaines (N = 295). Durant la période d'extension ouverte, tous les patients ont reçu Bydureon 2 mg hebdomadaire pour une période supplémentaire de 22 semaines (N = 243). Dans ces deux études, des baisses de l'HbA1c ont été manifestes dans les deux groupes de traitement dès la première mesure de l'HbA1c (semaine 4 ou 6).
Bydureon a entraîné une réduction statistiquement significative de l'HbA1c par rapport aux patients qui avaient reçu l'exénatide deux fois par jour (Byetta), avec p <0,0001 dans l'étude de 24 semaines et p <0,05 dans l'étude de 30 semaines (Tableau 2).
Un effet cliniquement significatif sur l'HbA1c a été observé chez les patients traités par Bydureon ou par l'exénatide deux fois par jour (Byetta), indépendamment du traitement antidiabétique de fond dans les deux études.
Dans les deux études, un nombre statistiquement significativement plus élevé de patients traités par Bydureon que de patients traités par l'exénatide deux fois par jour (Byetta) ont obtenu une réduction de l'HbA1c, à ≤7 % dans une étude et à <7 % dans l'autre (respectivement p <0,05 et p ≤0,0001).
Les patients traités par Bydureon et ceux traités par l'exénatide deux fois par jour (Byetta) ont tous présenté une perte de poids par rapport au poids initial. La différence entre les deux bras de traitement n'était pas significative.
Des réductions supplémentaires d'HbA1c et une perte de poids durable ont été observées sur au moins 52 semaines chez les patients ayant terminé l'étude contrôlée de 30 semaines et l'extension d'étude non contrôlée.
Bydureon BCise, auto-injecteur
Une étude ouverte de 28 semaines a comparé Bydureon Bcise à l'exénatide deux fois par jour (Byetta) chez des patients souffrant de diabète de type 2 qui avaient suivi au préalable uniquement un programme incluant régime alimentaire et activité physique ou dont la glycémie était déjà stabilisée par un traitement hypoglycémiant oral. Bydureon Bcise était supérieur à l'exénatide deux fois par jour (Byetta) en ce qui concerne la baisse de l'HbA1c de la valeur initiale à la semaine 28 (Tableau 2).
Tant les patients ayant reçu Bydureon BCise que les patients traités par l'exénatide deux fois par jour (Byetta) ont atteint une réduction du poids à la semaine 28 comparée à la valeur initiale (Tableau 2). La différence entre les deux groupes de traitement n'était pas significative. Les réductions de poids se sont maintenues jusqu'à la semaine 52.
Tableau 2. Résultats de la comparaison de Bydureon (formulation aqueuse d'exénatide à libération prolongée) ou Bydureon BCise auto-injecteur avec l'exénatide deux fois par jour (Byetta) (patients en intention de traiter)
Étude de 24 semaines | Étude de 30 semaines | Étude de 28 semaines | ||||
|---|---|---|---|---|---|---|
Bydureon 2 mg | Exénatide 10 µg 2x/j (Byetta) | Bydureon 2 mg | Exénatide 10 µg 2x/j (Byetta) | Bydureon BCise 2 mg | Exenatid 10 µg 2x/j (Byetta) | |
N1 | 129 | 123 | 148 | 147 | 229 | 146 |
HbA1c moyenne (%) | ||||||
Valeur initiale | 8,5 | 8,4 | 8,3 | 8,3 | 8,5 | 8,5 |
Variation par rapport à la valeur initiale (± SE)2 | -1,6 (± 0,1)** | -0,9 (± 0,1) | -1,9 (± 0,1)* | -1,5 (± 0,1) | -1,4 (±0,1) | -1,0 (±0,1) |
Différence moyenne de la variation par rapport à la valeur initiale vs exénatide deux fois par jour (IC à 95 %)2 | -0,67 (-0,94, -0,39)** | -0,33 (-0,54, -0,12)* | -0,37*** (-0,63, -0,10) | |||
Patients (%) ayant atteint une HbA1c < 7 % 3 | 58 | 30 | 73 | 57 | 493 | 433 |
Variation moyenne de la glycémie à jeun vs valeur initiale (mmol/l) (± SE) | -1,4 (±0,2) | -0,3 (±0,2) | -2,3 (± 0,2) | -1,4 (± 0,2) | -1,8 (±0,2) | -1,3 (±0,3) |
Poids corporel moyen (kg) | ||||||
Valeur initiale | 97 | 94 | 102 | 102 | 97 | 97 |
Variation par rapport à la valeur initiale (± SE)2 | -2,3 (± 0,4) | -1,4 (±0,4) | -3,7 (± 0,5) | -3,6 (± 0,5) | -1,5 (±0,3) | -1,9 (±0,4) |
Différence moyenne de la variation par rapport à la valeur initiale vs exénatide deux fois par jour (IC à 95 %)2 | -0,95 (-1,91, 0,01) | -0,08 (-1,29, 1,12) | +0,40 (-0,48, 1,28) | |||
SE= standard error = erreur type, N = nombre de patients par groupe de traitement, IC = intervalle de confiance
* p< 0,05.
** p <0,0001 statistiquement significatif versus exénatide 10 µg 2×/j.
*** Valeur de p < 0,01
1 Tous les patients randomisés ayant reçu au moins une dose du médicament à l'étude.
2 Valeurs moyennes des moindres carrés.
3 Last Observation Carried Forward (LOCF) (dernière observation relevée).
Une étude d'une durée de 26 semaines au cours de laquelle Bydureon (formulation aqueuse d'exénatide à libération prolongée) 2 mg a été comparé à l'insuline glargine une fois par jour chez des patients ayant un contrôle glycémique insuffisant avec la metformine seule ou la metformine et une sulfonylurée. Une diminution significative de l'HbA1c a été observée sous les deux traitements (p <0,001); la variation de l'HbA1c a cependant été plus importante sous Bydureon que sous l'insuline glargine (p= 0,017).
En comparaison avec le traitement par l'insuline glargine, le traitement par Bydureon s'est accompagné d'une baisse significative du poids corporel (p <0,001) et a été associé à moins d'épisodes hypoglycémiques (Tableau 3).
Tableau 3. Résultats d'une étude de 26 semaines avec Bydureon (formulation aqueuse d'exénatide à libération prolongée) versus insuline glargine (patients en intention de traiter)
Bydureon 2 mg | Insuline glargine¹ | |
|---|---|---|
N | 233 | 223 |
Taux moyen d'HbA1c (%) | ||
À l'inclusion | 8,3 | 8,3 |
Variation de la moyenne des moindres carrés (SE) | -1,5 (0,1)* | -1,3 (0,1) |
Pourcentage de patients (%), ayant atteint une HbA1c ≤7 % | 62 | 54 |
Glycémie à jeun (mmol/l) | ||
Variation de la moyenne des moindres carrés (SE) | -2,1 (0,2) | -2,8 (0,2) |
Poids corporel moyen (kg) | ||
À l'inclusion | 91 | 91 |
Variation de la moyenne des moindres carrés (SE) | -2,6 (0,2)* | +1,4 (0,2) |
SE= standard error = erreur standard.
* p <0,05, différence statistiquement significative versus insuline glargine.
¹ La dose d'insuline glargine était titrée pour obtenir une glycémie cible de 4,0 à 5,5 mmol/l (72 à 100 mg/dl). La dose moyenne d'insuline glargine en début de traitement était de 10,1 UI/jour. La dose moyenne d'insuline atteinte à la semaine 26 était de 31,1 UI/jour pour les patients qui recevaient de l'insuline glargine.
Dans une étude de 26 semaines en double aveugle, Bydureon (formulation aqueuse d'exénatide à libération prolongée) était comparé aux doses maximales quotidiennes de sitagliptine et de pioglitazone chez des patients traités également par la metformine. Tous les groupes de traitement présentaient une réduction significative de l'HbA1c par rapport à la valeur initiale. Bydureon s'est révélé supérieur à la sitagliptine (p <0,0001) comme à la pioglitazone (p <0,0165) en termes de variation de l'HbA1c par rapport à la valeur initiale.
Bydureon a entraîné des réductions de poids significativement plus importantes que la sitagliptine (p= 0,000 2). Les patients traités par la pioglitazone ont pris du poids (p <0,0001) (Tableau 4).
Dans le cadre d'une étude de 26 semaines, N = 134 patients ont reçu Bydureon en plus d'un traitement existant par une thiazolidinedione, avec ou sans metformine. La variation de l'HbA1c observée correspondait à celle observée au cours des études antérieures.
Des résultats comparables sont disponibles pour Bydureon BCise: dans le cadre d'une étude ouverte de 28 semaines (traitement oral, en aveugle) Bydureon Bcise a été comparé à la sitagliptine et à un placebo chez des patients qui prenaient également tous les jours de la metformine ≥1500 mg. Bydureon BCise était supérieur aussi bien à la sitagliptine qu'au placebo en ce qui concerne la réduction de la valeur de l'HbA1c, de la valeur initiale à la semaine 28 (Tableau 5).
Tableau 4. Résultats d'une étude de 26 semaines avec Bydureon (formulation aqueuse d'exénatide à libération prolongée) versus sitagliptine et versus pioglitazone en association avec la metformine (patients en intention de traiter)
Bydureon 2 mg | Sitagliptine 100 mg | Pioglitazone 45 mg | |
|---|---|---|---|
N | 160 | 166 | 165 |
Taux moyen d'HbA1c (%) | |||
À l'inclusion | 8,6 | 8,5 | 8,5 |
Variation de la moyenne des moindres carrés (SE) | -1,55 (0,10) | -0,92 (0,10) | -1,23 (0,10) |
Pourcentage de patients (%), ayant atteint une HbA1c ≤7 % | 62 | 36 | 49 |
Glycémie à jeun mmol/l) (SE) | -1,8 (0,2) | -0,9 (0,2) | -1,5 (0,2) |
Poids corporel moyen (kg) | |||
À l'inclusion | 89 | 87 | 88 |
Variation de la moyenne des moindres carrés (SE) | -2,3 (0,3) | -0,8 (0,3) | +2,8 (0,3) |
SE= standard error = erreur standard.
Tableau 5. Résultats d'une étude de 28 semaines avec Bydureon BCise versus sitagliptine et placebo en association avec la metformine (patients en intention de traiter modifiée1)
Bydureon BCise 2 mg | Sitagliptine 100 mg | Placebo | |
|---|---|---|---|
N | 141 | 98 | 38 |
HbA1c moyen (%) | |||
Valeur initiale | 8,4 | 8,5 | 8,5 |
Variation par rapport à la valeur initiale (± SE)2 | -1,1 (± 0,1) | -0,8 (± 0,1) | -0,4 (± 0,2) |
Différence moyenne de la variation par rapport à la valeur initiale versus sitagliptine (IC à 95 %)2 | -0,38* (-0,70; -0,06) | ||
Différence moyenne de la variation par rapport à la valeur initiale versus placebo (IC à 95 %)2 | -0,72** (-1,15; -0,30) | ||
Patients (%) ayant atteint une HbA1c < 7 %3 | 43* | 32 | 25 |
Poids corporel moyen (kg) | |||
Valeur initiale | 89 | 88 | 89 |
Variation par rapport à la valeur initiale (± SE)2 | -1,1 (± 0,3) | -1,2 (± 0,3) | +0,2 (± 0,5) |
Différence moyenne de la variation par rapport à la valeur initiale versus sitagliptine (IC à 95 %)2 | +0,07 (-0,73; 0,87) | ||
Différence moyenne de la variation par rapport à la valeur initiale versus placebo (IC à 95 %)2 | -1,27# (-2,34; -0,20) | ||
Variation moyenne de la glycémie à jeun par rapport à la valeur initiale (mmol/l) (± SE)2 | -1,2 (± 0,2) | -0,6 (± 0,3) | +0,5 (± 0,4) |
Différence moyenne de la variation par rapport à la valeur initiale versus sitagliptine (IC à 95 %)2 | -0,56 (-1,21; 0,09) | ||
Différence moyenne de la variation par rapport à la valeur initiale versus placebo (IC à 95 %)2 | -1,71§ (-2,59; -0,83) | ||
N = nombre de patients par groupe de traitement, SE (standard error) = erreur type, IC = intervalle de confiance.
* Valeur de p < 0,05,
** Valeur de p < 0,01,
# Valeur de p nominale < 0,05,
§ Valeur de p nominale < 0,001.
1 Tous les patients randomisés ayant reçu au moins une dose du médicament à l'étude.
2 Valeurs moyennes des moindres carrés.
3 Last Observation Carried Forward (LOCF) (dernière observation relevée).
Poids corporel
Une réduction du poids corporel par rapport au poids à l'inclusion a été observée dans toutes les études avec l'exénatide à libération prolongée. Cette réduction du poids a été observée chez les patients traités par exénatide à libération prolongée indépendamment de la présence de nausées, bien que la réduction ait été plus importante dans le groupe ayant des nausées (réduction moyenne pour Bydureon de –2,9 kg à –5,2 kg pour les patients ayant des nausées, par rapport à une réduction de –2,2 kg à –2,9 kg pour ceux qui n'avaient pas de nausées et pour Bydureon BCise -1,9 kg à ‑5,2 kg avec des nausées par rapport à -1,0 kg à -2,9 kg sans nausées).
Le pourcentage de patients ayant présenté une perte de poids associée à une diminution de l'HbA1c était compris entre 70 % et 79 % (le pourcentage de patients ayant présenté une diminution de l'HbA1c était compris entre 88 % et 96 %).
Glucose plasmatique/sérique
Le traitement avec l'exénatide à libération prolongée a conduit à des diminutions significatives de la glycémie à jeun. Ces diminutions ont été observées dès 4 semaines. De plus, des diminutions des concentrations postprandiales ont également été observées. L'amélioration des concentrations plasmatiques de glucose mesurées à jeun s'est maintenue sur 52 semaines.
Pharmacocinétique
Absorption
Après administration hebdomadaire de 2 mg de Bydureon, les concentrations plasmatiques moyennes d'exénatide dépassent les concentrations moyennes efficaces (~50 pg/ml) en l'espace de 2 semaines, avec une augmentation graduelle de la concentration plasmatique moyenne d'exénatide pendant 6 à 7 semaines. À l'état stationnaire, des concentrations d'exénatide d'environ 300 pg/ml (Bydureon Pen) ou 208 pg/ml (Bydureon BCise, auto-injecteur) se sont maintenues. Les concentrations d'exénatide à l'état stationnaires sont maintenues pendant l'intervalle d'une semaine entre les doses, avec des fluctuations minimes des concentrations maximales et minimales.
Distribution
Après administration sous-cutanée d'une dose unique d'exénatide, le volume de distribution moyen apparent de l'exénatide est de 28,3 l.
Métabolisme
L'exénatide n'est pas métabolisée.
Élimination
Des études non cliniques ont montré que l'exénatide est principalement éliminé par filtration glomérulaire, suivie d'une dégradation protéolytique. La clairance apparente moyenne de l'exénatide est de 9,1 l/h chez l'être humain.
Ces caractéristiques pharmacocinétiques de l'exénatide sont indépendantes de la dose. Approximativement 10 semaines après l'arrêt du traitement par Bydureon, les concentrations plasmatiques moyennes d'exénatide sont inférieures au seul de détection.
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique
Aucune étude pharmacocinétique n'a été effectuée chez les patients ayant une insuffisance hépatique aiguë ou chronique. L'exénatide étant principalement éliminé par le rein, l'insuffisance hépatique ne devrait pas modifier les concentrations sanguines de l'exénatide.
Troubles de la fonction rénale
Chez des patients souffrant d'insuffisance rénale légère à modérée (clairance de la créatinine de 30 à 80 ml/min), des différences dans les concentrations à l'état stationnaire ont été observées par rapport aux patients dont la fonction rénale était normale. La concentration moyenne à l'état stationnaire s'élève respectivement d'environ 23 % et 74 %. La prudence est donc de mise chez les patients souffrant d'insuffisance rénale modérée. Chez les patients souffrant d'insuffisance rénale légère à modérée, aucun ajustement de la dose n'est nécessaire. Chez les patients en insuffisance rénale sévère (clairance de la créatinine <30 ml/min) ainsi que chez les patients sous dialyse en insuffisance rénale terminale, Bydureon n'est pas recommandé (voir «Posologie/Mode d'emploi»).
Patients âgés
Les données chez les patients âgés sont limitées, mais suggèrent que jusqu'à un âge d'environ 75 ans, il n'y a pas de modifications importantes de la biodisponibilité de l'exénatide.
Dans une étude de pharmacocinétique avec l'exénatide deux fois par jour (Byetta) chez des patients ayant un diabète de type 2, l'administration d'exénatide (10 µg) a entraîné une augmentation moyenne de la biodisponibilité de l'exénatide de 36 % chez 15 sujets âgés de 75 à 85 ans, par rapport à la biodisponibilité mesurée chez 15 sujets âgés de 45 à 65 ans. Cette augmentation de la biodisponibilité de l'exénatide est probablement imputable à une diminution de la fonction rénale chez les patients plus âgés (voir «Posologie/Mode d'emploi»).
Enfants et adolescents
Lors d'une étude de pharmacocinétique réalisée chez 13 patients souffrant de diabète de type 2 âgés de 12 à 16 ans, l'administration d'une dose unique d'exénatide (5 µg) s'est traduite par une légère diminution de l'AUC et de la Cmax (de 16 % pour l'AUC et de 25 % pour la Cmax) par rapport aux valeurs observées chez l'adulte.
Aucune étude de pharmacocinétique avec Bydureon n'a été conduite chez des enfants et des adolescents.
Sexe, appartenance ethnique, poids
Le sexe, l'appartenance ethnique et le poids des patients n'ont aucune influence significative sur la pharmacocinétique de l'exénatide.
Données précliniques
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, de toxicologie générale ou de génotoxicité conduites avec l'exénatide deux fois par jour (Byetta) ou Bydureon n'ont pas révélé de risque particulier pour l'être humain.
Carcinogénicité
Dans une étude de carcinogénicité de 104 semaines avec Bydureon, une augmentation statistiquement significative de l'incidence des tumeurs des cellules thyroïdiennes C (adénomes et/ou carcinomes) a été observée chez les rats à toutes les doses (de 1,4 à 26 fois supérieures à l'exposition humaine lors d'un traitement avec Bydureon). La pertinence de ces résultats pour l'être humain n'est actuellement pas connue.
Toxicité sur la reproduction
Dans des études de toxicité sur le développement, Bydureon manifeste des effets similaires à ceux de l'exénatide deux fois par jour (Byetta). Chez des rattes gravides qui ont reçu des doses de Bydureon au milieu de la gestation correspondant à des expositions 2 à 15 fois supérieures à l'exposition chez l'être humain, la croissance fœtale a été diminuée en proportion des effets chez la mère (diminution de la prise de nourriture et diminution de l'augmentation de poids). Il n'y a pas eu de signes de malformations.
Des études avec l'exénatide deux fois par jour (Byetta) chez la souris et le lapin n'ont pas montré d'effet délétère sur la fertilité ou la gestation; des doses élevées d'exénatide deux fois par jour (Byetta) correspondant à des expositions similaires ou supérieures à celles obtenues avec Bydureon ont entrainé des effets sur le squelette ainsi qu'une diminution de la croissance fœtale et néonatale.
Remarques particulières
Incompatibilités
Bydureon ne doit pas être mélangé avec d'autres médicaments.
Stabilité
Bydureon doit être injecté immédiatement après reconstitution.
Remarques particulières concernant le stockage
Bydureon Pen
Conserver au réfrigérateur (2 °C -8 °C).
Ne pas congeler. Bydureon ne doit pas être utilisé s'il a été congelé et doit être éliminé selon les règles.
Les stylos peuvent être conservés jusqu'à 4 semaines avant l'ouverture à une température ne dépassant pas 30 °C.
Conserver dans l'emballage original afin de protéger le contenu de la lumière.
Conserver hors de portée des enfants.
Bydureon BCise, auto-injecteur
Conserver à plat et au réfrigérateur (2 °C – 8 °C).
Conserver le récipient dans l'emballage d'origine pour le protéger de la lumière.
Avant utilisation, Bydureon BCise peut être conservé jusqu'à 4 semaines à des températures ne dépassant pas 30 °C.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Bydureon ne doit être utilisé que par une seule personne.
Le mode d'emploi exact est joint à l'emballage de Bydureon Pen respectivement de Bydureon Bcise, auto-injecteur.
Bydureon est destiné à un usage unique.
Les patients et les aidants doivent être formés par des professionnels de santé.
Le patient doit être avisé d'éliminer, après chaque injection, le stylo et l'aiguille resp. l'auto-injecteur de façon appropriée et sûre.
Bydureon Pen
La poudre contenue dans un compartiment doit être mélangée au solvant contenu dans l'autre compartiment. Le solvant doit être inspecté visuellement avant d'être utilisé pour le mélange. Le solvant doit être utilisé uniquement s'il est limpide et sans particule. Après mise en suspension, Bydureon Pen doit être utilisé uniquement si le mélange est blanc à blanc cassé et uniformément trouble. Utiliser uniquement les aiguilles fournies avec le stylo.
Bydureon BCise, auto-injecteur
L'auto-injecteur doit être sorti du réfrigérateur et conservé à plat pendant au moins 15 minutes avant l'injection. La suspension est mélangée en l'agitant vigoureusement pendant 15 secondes au moins. La suspension doit être contrôlée visuellement avant l'utilisation. La suspension ne doit être utilisée qu'après avoir été mélangée uniformément; elle doit être de couleur blanche à blanc cassé et avoir un aspect laiteux et aucune poudre blanche du médicament ne doit être visible sur les côtés, le haut ou le bas de la fenêtre du stylo. Dès que la suspension a été entièrement mélangée, il faut procéder immédiatement aux étapes de préparation et à l'injection de la suspension par voie sous-cutanée.
Numéro d’autorisation
65389, 67503 (Swissmedic)
Titulaire de l’autorisation
AstraZeneca SA, 6340 Baar
Mise à jour de l’information
Septembre 2020
Отзывов (0)

Бесплатная консультация опытного специалиста
Опишите симптомы или нужный препарат – мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой на дом или просто проконсультируем.
Нас 14 специалистов и 0 ботов. Мы всегда будем с вами на связи и сможем связаться в любое время.


 Deutsch
Deutsch French
French Italian
Italian