Прамипексол Зентива Табл. 0,25 мг 30 шт.
Pramipexol Zentiva Tabl 0.25 mg 30 Stk
-
4604.02 RUB
Предполагаемая дата доставки:
14.05. - 28.05.2024

- Наличие: В наличии
- Производитель: HELVEPHARM AG
- Модель: 7771670
- ATC-код N04BC05
- EAN 7680600890091
Состав:
Варианты
Pramipexol Zentiva Tabletten 0.25mg 30 Stück
4604.02 RUB
Описание
Was ist Pramipexol Zentiva und wann wird es angewendet?
Pramipexol Zentiva gehört zur Gruppe der Dopaminagonisten, die die Dopaminrezeptoren im Gehirn stimulieren. Es enthält den Wirkstoff Pramipexol-Dihydrochlorid-Monohydrat und wird zur Behandlung von Beschwerden, die bei Parkinson-Krankheit auftreten, von Ihrem Arzt bzw. Ihrer Ärztin verschrieben.
Pramipexol Zentiva kann allein oder in Kombination mit Levodopa oder anderen Arzneimitteln gegen die Parkinson-Krankheit verabreicht werden.
Pramipexol Zentiva wird auch zur Behandlung des Syndroms der unruhigen Beine (idiopathischen Restless Legs Syndroms) eingesetzt.
Das Arzneimittel soll nur auf Verschreibung des Arztes bzw. der Ärztin eingenommen werden.
Wann darf Pramipexol Zentiva nicht angewendet werden?
Bei Überempfindlichkeit gegenüber Pramipexol oder einem anderen Bestandteil des Präparates.
Wann ist bei der Einnahme von Pramipexol Zentiva Vorsicht geboten?
Wenn die Nierenfunktion beeinträchtigt ist, wenn Sie andere Arzneimittel einnehmen, insbesondere Arzneimittel, die die Nierenfunktion beeinflussen, oder Arzneimittel, die über die Nieren ausgeschieden werden, z.B. Magensäuresekretionshemmer, Arzneimittel zur Behandlung des erworbenen Immundefektsyndroms (AIDS) mit dem Wirkstoff Zidovudin, Arzneimittel zur Behandlung von Krebserkrankungen mit dem Wirkstoff Cisplatin, oder wenn Sie andere Arzneimittel zur Behandlung der Parkinson-Krankheit oder Arzneimittel, die Müdigkeit (Somnolenz) hervorrufen können, einnehmen, sollten Sie Ihren Arzt bzw. Ihre Ärztin davon in Kenntnis setzen. Die Einnahme von antipsychotischen Arzneimitteln während einer Behandlung mit Pramipexol Zentiva sollte vermieden werden.
Informieren Sie Ihren Arzt bzw. Ihre Ärztin, wenn Sie an einer Herzkrankheit leiden. Ihr Blutdruck sollte regelmässig überprüft werden, besonders zu Beginn der Behandlung. Damit soll ein Abfall des Blutdrucks beim Aufstehen (orthostatische Hypotonie) vermieden werden.
Pramipexol Zentiva kann bei manchen Patienten und Patientinnen Verhaltensänderungen, z.B. Spielsucht (pathologisches Spielen), Kaufsucht sowie gesteigertes sexuelles Verlangen (erhöhte Libido), Essattacken sowie Sinnestäuschungen und Schläfrigkeit hervorrufen. Informieren Sie Ihren Arzt bzw. Ärztin, wenn Sie oder Ihre Familie/Betreuungspersonen solche ungewöhnlichen Verhaltensweisen an Ihnen bemerken. Möglicherweise muss Ihr Arzt/Ihre Ärztin dann die Dosis anpassen oder die Behandlung abbrechen.
Informieren Sie Ihren Arzt bzw. Ihre Ärztin, wenn Sie oder Ihre Familie/Ihre Betreuungspersonen bemerken, dass Sie manisches Verhalten (Unruhe, euphorische Stimmung oder Übererregtheit) oder Delir (verminderte Aufmerksamkeit, Verwirrtheit, Realitätsverlust) entwickeln. Möglicherweise muss Ihr Arzt bzw. Ihre Ärztin dann die Dosis anpassen oder die Behandlung abbrechen.
Patienten und Patientinnen mit einer Parkinson-Krankheit haben gegenüber der Gesamtbevölkerung ein erhöhtes Risiko, einen schwarzen Hautkrebs (Melanom) zu entwickeln. Daher sollten Sie in regelmässigen Abständen eine Hautuntersuchung durch einen erfahrenen Hautarzt resp. eine erfahrene Hautärztin unternehmen und unter anderem auf eine Vergrösserung, eine Farbänderung sowie auf ein Jucken von Hautbereichen (z.B. Leberflecken) achten und Ihren Arzt bzw. Ihre Ärztin unverzüglich darüber informieren.
Pramipexol Zentiva kann bei manchen Patienten und Patientinnen zu Schläfrigkeit führen. Alkoholgenuss kann ebenfalls müde machen und daher durch Pramipexol Zentiva ausgelöste Müdigkeit noch verstärken. Seien Sie besonders vorsichtig, wenn Sie plötzliche übermässige Schläfrigkeit verspüren. Auch darüber sollten Sie Ihren Arzt bzw. Ihre Ärztin informieren, ebenso wenn Sie feststellen, dass Sie während der Ausübung von Alltagsaktivitäten plötzlich eingeschlafen sind. In seltenen Fällen wurde, wie bei anderen Parkinsonmitteln, über plötzliches Einschlafen berichtet, das ohne Vorwarnung jederzeit während der Behandlung auftreten kann. Falls Sie an plötzlichem Einschlafen oder an starker Müdigkeit tagsüber leiden, dürfen Sie daher während der Einnahme von Pramipexol Zentiva kein Motorfahrzeug führen oder andere Aktivitäten ausüben (z.B. Bedienen von Maschinen), bei denen eine verminderte Aufmerksamkeit Sie selbst oder andere gefährdet.
Informieren Sie ebenfalls Ihren Arzt bzw. Ihre Ärztin, wenn Sie folgende Beschwerden oder Symptome haben oder entwickeln:
- Halluzinationen (Dinge sehen, hören oder fühlen, die gar nicht da sind). Die meisten Halluzinationen sind visueller Art.
- Motorische Fehlfunktionen (Dyskinesien; z.B. abnorme, unkontrollierte Bewegungen der Gliedmassen). Wenn Sie an fortgeschrittener Parkinson-Krankheit leiden und auch Levodopa einnehmen, könnten Sie während der schrittweisen Erhöhung der Dosierung von Pramipexol Zentiva motorische Fehlfunktionen (Dyskinesien) entwickeln.
- Unfähigkeit, den Körper und den Hals gerade und aufrecht zu halten (axiale Dystonie). Insbesondere kann bei Ihnen eine Beugung des Kopfes und Halses nach vorn (Antecollis), eine Vorwärtsneigung des Rumpfes (Kamptokormie) oder eine seitliche Beugung des Rückens (auch als Pleurothotonus oder Pisa-Syndrom bezeichnet) auftreten.
- Sehstörungen. Lassen Sie während der Behandlung mit Pramipexol Zentiva Ihre Augen in regelmässigen Abständen untersuchen.
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie an anderen Krankheiten leiden, Allergien haben oder andere Arzneimittel (auch selbstgekaufte!) einnehmen oder äusserlich anwenden.
Darf Pramipexol Zentiva während einer Schwangerschaft oder in der Stillzeit eingenommen werden?
Wenn Sie schwanger sind oder es werden möchten, informieren Sie Ihren Arzt bzw. Ihre Ärztin. Pramipexol Zentiva sollte während der Schwangerschaft nur verwendet werden, wenn dies absolut notwendig ist. Nur Ihr Arzt bzw. Ihre Ärztin kann entscheiden, ob Sie während der Schwangerschaft Pramipexol Zentiva anwenden dürfen.
Pramipexol Zentiva sollte in der Stillzeit nicht eingenommen werden. Ist eine Behandlung notwendig, sollte abgestillt werden. Kontaktieren Sie auf jeden Fall Ihren Arzt oder Ihre Ärztin.
Wie verwenden Sie Pramipexol Zentiva?
Pramipexol Zentiva sollte während oder ausserhalb der Mahlzeiten mit Wasser eingenommen werden. Die Dosierung wird nur von Ihrem Arzt bzw. Ihrer Ärztin festgelegt.
Pramipexol Zentiva Tabletten sind nur für Erwachsene und sollten nicht von Kindern oder Jugendlichen bis zu 18 Jahren eingenommen werden.
Parkinson-Krankheit
Die Behandlung beginnt mit der Einnahme von 1 Tablette (0,125 mg) Pramipexol Zentiva 3× täglich. Die Tagesdosis wird dann schrittweise im Abstand von 5-7 Tagen von Ihrem Arzt bzw. Ihrer Ärztin erhöht, bis die für Sie geeignete Dosis erreicht ist.
Mit dieser Dosierung, sie liegt zwischen 0,375 mg und 4,5 mg Pramipexol Zentiva pro Tag, erfolgt dann Ihre weitere Behandlung. Nehmen Sie diese Tagesdosis in drei gleich grossen Teilen ein. Besteht eine Nierenfunktionsstörung, so kann Ihr Arzt bzw. Ihre Ärztin auch eine niedrigere Dosis verschreiben.
Restless Legs Syndrom
Die Behandlung beginnt mit der Einnahme von 1 Tablette (0,125 mg) Pramipexol Zentiva einmal täglich 2-3 Stunden vor dem Zubettgehen. Falls diese Dosis zur Symptomlinderung nicht ausreicht, kann Ihr Arzt bzw. Ihre Ärztin empfehlen, die Dosis alle 4-7 Tage schrittweise auf 0,25 mg, 0,5 mg oder 0,75 mg pro Tag zu erhöhen.
Bitte informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Ihre Nierenfunktion beeinträchtigt ist.
Falls Sie einmal die Einnahme von Pramipexol Zentiva vergessen haben, setzen Sie Ihre Behandlung so früh wie möglich fort. Nehmen Sie also nie mehr als eine Dosis auf einmal.
Sollten Sie versehentlich zu viele Tabletten genommen haben, nehmen Sie sofort Kontakt zu Ihrem Arzt bzw. Ihrer Ärztin auf oder seiner/ihrer Stellvertretung. Nehmen Sie die Arzneimittelpackung mit und fahren Sie nicht selbst Auto.
Brechen Sie die Einnahme von Pramipexol Zentiva nicht ab, ohne zuerst mit Ihrem Arzt bzw. Ihrer Ärztin gesprochen zu haben.
Wenn Sie die Einnahme dieses Arzneimittels abbrechen müssen, wird Ihr Arzt bzw. Ihre Ärztin die Dosis schrittweise verringern. Bei einem plötzlichen Absetzen besteht ein hohes Risiko zur Verschlechterung der Symptome.
Zudem kann der plötzliche Abbruch, wenn Sie an der Parkinson-Krankheit leiden, einen Krankheitszustand hervorrufen, der malignes neuroleptisches Syndrom genannt wird und ein erhebliches Gesundheitsrisiko darstellen kann. Zu den Symptomen zählen: herabgesetzte oder fehlende Muskelbewegungen (Akinesie), Muskelsteifheit, Fieber, instabiler Blutdruck, erhöhte Herzfrequenz (Tachykardie), Verwirrtheit, eingeschränktes Bewusstsein (z.B. Koma).
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Welche Nebenwirkungen kann Pramipexol Zentiva haben?
Folgende Nebenwirkungen können bei der Einnahme von Pramipexol Zentiva auftreten:
Übelkeit, Erbrechen, Verstopfung, Schwindel, unwillkürliche Bewegungen, übermässiger Bewegungsdrang, Schläfrigkeit, Schlafstörungen, Erinnerungsverlust, Ohnmachtsanfall, Beugung des Kopfes und Halses nach vorn (Antecollis), Herzschwäche einschliesslich Herzversagen, Sinnestäuschungen, Unruhe, Verwirrtheit, ungewöhnliche Träume, Wahnvorstellungen, Kopfschmerzen, Schluckauf, Müdigkeit, Doppeltsehen, Verschwommensehen, schlechteres Sehen, Flüssigkeitsansammlung z.B. in den Armen oder in den Beinen (peripheres Ödem), niedriger Blutdruck, Gewichtszunahme bzw. –abnahme einschliesslich vermindertem Appetit, Hautsymptome wie Hautausschlag, Juckreiz und weitere allergische Reaktionen, Lungenentzündung oder Atemnot.
Es kann zu einer gestörten Ausschüttung von antidiuretischem Hormon (ADH) kommen, mit Zeichen der Überwässerung des Körpers/Abfall der Blutsalze (mit z.B. Störungen des Bewusstseins inkl. Koma, von Gedächtnis und Konzentration, Krampfanfällen, Sinnestäuschungen (Halluzinationen), Kopfschmerzen, Muskelkrämpfen).
Krankhafte Spielsucht, insbesondere bei der Einnahme von hohen Dosen von Pramipexol gegen die Parkinson-Krankheit, erhöhtes sexuelles Verlangen (z.B. gesteigerte Libido), Hypersexualität (übermässige sexuelle Aktivität), abnormes Verhalten, Kaufsucht und vermehrtes Essen (Essattacken) wurden bei manchen Patienten und Patientinnen beobachtet, waren aber im Allgemeinen nach Reduktion der Dosis oder Abbruch der Behandlung rückläufig. Delir (verminderte Aufmerksamkeit, Verwirrtheit, Realitätsverlust) sowie manisches Verhalten (Unruhe, euphorische Stimmung oder Übererregtheit) können ebenfalls auftreten. Vor allem zu Beginn der Behandlung kann es zu Blutdruckabfall kommen.
Es kann plötzliches Einschlafen mit und ohne vorhergehender Müdigkeit (Somnolenz) auftreten (siehe auch «Wann ist bei der Einnahme von Pramipexol Zentiva Vorsicht geboten?»).
Wenn Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind, sollten Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin informieren.
Was ist ferner zu beachten?
Das Arzneimittel ist ausserhalb der Reichweite von Kindern aufzubewahren. Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Pramipexol Zentiva Tabletten sollen bis zum Gebrauch in den Originalblisterstreifen aufbewahrt werden.Bei Raumtemperatur (15–25 °C) und vor Licht geschützt in der Originalpackung lagern.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Pramipexol Zentiva enthalten?
1 Tablette zu 0,125 mg enthält: 0,125 mg Pramipexol-Dihydrochlorid-Monohydrat (entsprechend 0,088 mg Pramipexol-Base) und Hilfsstoffe.
1 teilbare Tablette zu 0,25 mg enthält: 0,25 mg Pramipexol-Dihydrochlorid-Monohydrat (entsprechend 0,18 mg Pramipexol-Base) und Hilfsstoffe.
1 teilbare Tablette zu 0,5 mg enthält: 0,5 mg Pramipexol-Dihydrochlorid-Monohydrat (entsprechend 0,35 mg Pramipexol-Base) und Hilfsstoffe.
1 teilbare Tablette zu 1,0 mg enthält: 1,0 mg Pramipexol-Dihydrochlorid-Monohydrat (entsprechend 0,7 mg Pramipexol-Base) und Hilfsstoffe.
Zulassungsnummer
60089 (Swissmedic).
Wo erhalten Sie Pramipexol Zentiva? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Tabletten zu 0,125 mg: Packung zu 30 Tabletten.
Tabletten zu 0,25 mg: Packungen zu 30 und 100 Tabletten (mit Bruchrille).
Tabletten zu 0,5 mg: Packung zu 100 Tabletten (mit Bruchrille).
Tabletten zu 1,0 mg: Packung zu 100 Tabletten (mit Bruchrille).
Zulassungsinhaberin
Helvepharm AG, Frauenfeld.
Diese Packungsbeilage wurde im April 2018 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Qu'est-ce que le Pramipexol Zentiva et quand est-il utilisé?
Pramipexol Zentiva appartient au groupe des agonistes dopaminergiques, qui stimulent les récepteurs de la dopamine situés dans le cerveau. Il contient comme principe actif du dichlorhydrate de pramipexole monohydraté; il vous est prescrit par votre médecin dans le traitement de troubles liés à la maladie de Parkinson.
Pramipexol Zentiva peut être administré seul ou en association avec la lévodopa ou d'autres médicaments contre la maladie de Parkinson.
Pramipexol Zentiva est utilisé également pour le traitement du syndrome des jambes sans repos (Restless Legs Syndrome idiopathique).
Ce médicament ne doit être pris que sur prescription médicale.
Quand Pramipexol Zentiva ne doit-il pas être utilisé?
En cas d'hypersensibilité au pramipexole ou à un autre composant de la préparation.
Quelles sont les précautions à observer lors de la prise de Pramipexol Zentiva?
Si votre fonction rénale est atteinte, si vous prenez d'autres médicaments, en particulier des médicaments qui influencent la fonction rénale ou des médicaments excrétés par les reins, p.ex. inhibiteurs de la sécrétion acide gastrique, médicaments pour traiter le syndrome de l'immunodéficience acquise (SIDA) contenant le principe actif zidovudine, médicaments pour traiter les affections cancéreuses contenant le principe actif cisplatine ou encore si vous prenez d'autres médicaments pour traiter la maladie de Parkinson ou des médicaments pouvant induire de la fatigue (somnolence), vous devez en informer votre médecin. La prise de médicaments antipsychotiques pendant un traitement par Pramipexol Zentiva est à éviter.
Veuillez informer votre médecin si vous souffrez d'une maladie du cœur. Votre tension artérielle doit être contrôlée régulièrement, surtout au début du traitement, ceci permettant d'éviter une chute de la tension artérielle en vous levant (hypotension orthostatique).
Pramipexol Zentiva peut provoquer chez certains patients des changements du comportement tels qu'une dépendance pathologique au jeu, des achats compulsifs ainsi qu'une augmentation du désir sexuel (libido accrue), une surconsommation de nourriture ainsi que des hallucinations sensorielles et une somnolence.
Informez votre médecin si vous ou votre famille/des personnes vous soignant remarquent que vous présentez de tels comportements inhabituels. Votre médecin doit alors éventuellement ajuster ou arrêter le traitement.
Informez votre médecin si vous ou votre famille/des personnes vous soignant remarquent que vous présentez un comportement maniaque (agitation, humeur euphorique ou surexcitation) ou un délire (attention diminuée, confusion, perte de réalité). Votre médecin doit alors éventuellement ajuster la dose ou arrêter le traitement.
Les patients atteints de maladie de Parkinson ont un risque plus élevé de développer un mélanome, une tumeur de la peau caractérisée par une forte pigmentation, que la population générale. Par conséquent, il est recommandé de faire un examen de la peau à intervalles réguliers, par un(e) dermatologue expérimenté(e). Vous devrez entre autres porter attention à un grossissement, un changement de couleur ainsi qu'à des démangeaisons de parties de la peau (grains de beauté par exemple) et en avertir votre médecin sans attendre.
Pramipexol Zentiva peut entraîner une somnolence chez certains patients. La consommation d'alcool peut également fatiguer et de ce fait renforcer la fatigue induite par le Pramipexol Zentiva.
Soyez particulièrement vigilant lorsque vous ressentez une somnolence soudaine et excessive. Vous devez informer votre médecin de ce fait, de même que si vous constatez que vous vous êtes soudain endormi lors de l'exercice d'activités quotidiennes.
Comme pour d'autres médicaments contre la maladie de Parkinson, de rares cas d'endormissement subit ont été rapportés, ces cas pouvant survenir à chaque instant du traitement sans signes avant-coureurs. De ce fait, si vous souffrez d'endormissement subit ou d'une importante fatigue durant la journée lorsque vous prenez du Pramipexol Zentiva, vous ne devez pas conduire de véhicule ou exercer d'autres activités (par exemple l'utilisation de machines) où une altération de votre vigilance pourrait vous mettre en danger ainsi que d'autres personnes.
Informez également votre médecin si vous avez ou développez les troubles ou les symptômes suivants:
- hallucinations (voir, entendre ou sentir des choses qui n'existent pas). La plupart des hallucinations sont de nature visuelle.
- dysfonctions motrices (dyskinésies; p.ex. mouvements anormaux, incontrôlés des membres). Si vous souffrez de la maladie de Parkinson à un stade avancé et que vous prenez également de la lévodopa, vous pourriez développer des dysfonctions motrices (dyskinésies) pendant l'augmentation progressive de la posologie de Pramipexol Zentiva.
- incapacité de maintenir le corps et le cou en position debout et droite (dystonie axiale). En particulier, une flexion de la tête et du cou vers l'avant (antécolis), une inclinaison du tronc vers l'avant (camptocormie) ou une flexion latérale du dos (également désignée par le terme de pleurothotonus ou syndrome de la tour de Pise) peuvent survenir.
- troubles visuels. Faites examiner vos yeux régulièrement pendant le traitement par Pramipexol Zentiva.
Veuillez informer votre médecin ou votre pharmacien si vous souffrez d'une autre maladie, vous êtes allergique, vous prenez déjà d'autres médicaments en usage interne ou externe (même en automédication!).
Pramipexol Zentiva peut-il être pris pendant la grossesse ou l'allaitement?
Si vous êtes enceinte ou si vous souhaitez le devenir, informez-en votre médecin. Pramipexol Zentiva ne devrait être utilisé pendant la grossesse qu'en cas de nécessité absolue. Seul votre médecin peut décider si vous pouvez utiliser Pramipexol Zentiva pendant la grossesse.
Pramipexol Zentiva ne devrait pas être pris pendant la période d'allaitement. Si un traitement s'avère nécessaire, il conviendra de stopper l'allaitement. Veuillez, en tout cas, contacter votre médecin.
Comment utiliser Pramipexol Zentiva?
Prendre Pramipexol Zentiva pendant les repas ou en dehors des repas avec un peu d'eau.
Votre médecin déterminera la posologie.
Les comprimés de Pramipexol Zentiva sont réservés à l'adulte et ne doivent pas être pris par les enfants ou les adolescents de moins de 18 ans.
Maladie de Parkinson
Commencer le traitement par la prise d'un comprimé de Pramipexol Zentiva 0,125 mg, 3 fois par jour. Votre médecin décidera ensuite d'augmenter progressivement la dose journalière tous les 5 à 7 jours, jusqu'à ce que la dose qui vous convienne soit atteinte.
Votre traitement se poursuivra ensuite à cette posologie, située entre 0,375 mg et 4,5 mg par jour. Répartissez cette dose journalière en trois prises égales. Si vous souffrez de troubles de la fonction rénale, il est possible que votre médecin vous prescrive une dose plus faible.
Syndrome des jambes sans repos (RLS)
Commencer le traitement par la prise d'un comprimé de Pramipexol Zentiva (0,125 mg), une fois par jour, 2 à 3 heures avant le coucher. Si cette dose ne suffit pas à soulager vos symptômes, votre médecin peut vous recommander d'augmenter graduellement la dose quotidienne, tous les 4 à 7 jours, jusqu'à 0,25 mg, 0,5 mg ou 0,75 mg.
Veuillez informer votre médecin ou pharmacien si vous souffrez d'insuffisance rénale.
Si vous avez oublié de prendre Pramipexol Zentiva une seule fois, continuez votre traitement dès que possible. Ne prenez ainsi jamais plus d'une dose à la fois.
Si par mégarde vous avez ingéré trop de comprimés, prenez immédiatement contact avec votre médecin ou son remplaçant. Emmenez l'emballage du médicament avec vous et ne conduisez pas le véhicule vous-même.
N'interrompez pas la prise de Pramipexol Zentiva sans en avoir parlé au préalable à votre médecin.
Si vous devez arrêter de prendre ce médicament, votre médecin réduira progressivement la dose. En cas d'arrêt brutal, il y a un risque élevé d'aggravation des symptômes.
Si vous souffrez de la maladie de Parkinson, l'arrêt brutal du traitement peut de plus déclencher un état pathologique appelé syndrome neuroleptique malin, et représenter un risque considérale pour la santé.
Les symptômes sont les suivants: diminution ou absence de mouvements musculaires (akinésie), raideur musculaire, fièvre, tension artérielle instable, augmentation de la fréquence cardiaque (tachycardie), confusions, baisse de l'état de conscience (par ex. coma).
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Quels effets secondaires Pramipexol Zentiva peut-il provoquer?
Les effets indésirables suivants peuvent survenir lors de la prise de Pramipexol Zentiva:
Nausées, vomissements, constipation, vertiges, mouvements involontaires, besoin accru de bouger, somnolence, troubles du sommeil, perte de mémoire, perte de connaissance, flexion de la tête et du cou vers l'avant (antécolis), faiblesse cardiaque y compris défaillance cardiaque, hallucinations sensorielles, agitation, confusion, rêves inhabituels, idées délirantes, maux de tête, hoquet, fatigue, vision double, vue trouble, perturbation de la vue, rétention d'eau par ex. dans les bras ou les jambes (œdème périphérique), tension artérielle faible, prise ou perte de poids y compris baisse de l'appétit, symptômes au niveau de la peau tels qu'une éruption cutanée, des démangeaisons et autres réactions allergiques, pneumonie ou gêne respiratoire.
Une perturbation de la libération de l'hormone antidiurétique (ADH) peut apparaître, avec des signes d'hyperhydratation/chute des électrolytes sanguins (avec par exemple des troubles de la conscience y compris le coma, de la mémoire et de la concentration, des convulsions, des hallucinations, des maux de tête et des crampes musculaires).
Une dépendance pathologique au jeu, en particulier lors de la prise de hautes doses de pramipexole pour traiter la maladie de Parkinson, une augmentation du désir sexuel (par ex. libido accrue), une hypersexualité (activité sexuelle excessive), un comportement anormal, des achats compulsifs et une augmentation de la prise de nourriture (surconsommation d'aliments) ont été observés chez certains patients, mais ont généralement régressé après réduction de la dose ou interruption du traitement. Un délire (attention diminuée, confusion, perte de réalité) ainsi qu'un comportement maniaque (agitation, humeur euphorique ou surexcitation) peuvent également survenir.
Une hypotension peut survenir, en particulier au début du traitement.
Des cas d'endormissement subit avec ou sans fatigue préalable (somnolence) peuvent apparaître (voir aussi «Quelles sont les mesures de précaution à observer lors de la prise de Pramipexol Zentiva?»).
Si vous remarquez des effets secondaires qui ne sont pas mentionnés dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
A quoi faut-il encore faire attention?
Le médicament doit être conservé hors de portée des enfants. Le médicament ne doit être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Les comprimés Pramipexol Zentiva doivent être conservés dans les blisters originaux jusqu'au moment de leur utilisation.
Conserver à température ambiante (15-25 °C) dans l'emballage d'origine et à l'abri de la lumière.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Pramipexol Zentiva?
1 comprimé à 0,125 mg contient: 0,125 mg de dichlorhydrate de pramipexole monohydraté (correspondant à 0,088 mg de pramipexole base), ainsi que des excipients.
1 comprimé sécable à 0,25 mg contient: 0,25 mg de dichlorhydrate de pramipexole monohydraté (correspondant à 0,18 mg de pramipexole base), ainsi que des excipients.
1 comprimé sécable à 0,5 mg contient: 0,5 mg de dichlorhydrate de pramipexole monohydraté (correspondant à 0,35 mg de pramipexole base), ainsi que des excipients.
1 comprimé sécable à 1,0 mg contient: 1,0 mg de dichlorhydrate de pramipexole monohydraté (correspondant à 0,7 mg de pramipexole base), ainsi que des excipients.
Numéro d’autorisation
60089 (Swissmedic).
Où obtenez-vous Pramipexol Zentiva? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Comprimés à 0,125 mg: emballage à 30 comprimés.
Comprimés à 0,25 mg: emballages à 30 et 100 comprimés (sécables).
Comprimés à 0,5 mg: emballage à 100 comprimés (sécables).
Comprimés à 1,0 mg: emballage à 100 comprimés (sécables).
Titulaire de l’autorisation
Helvepharm AG, Frauenfeld.
Cette notice d'emballage a été vérifiée pour la dernière fois en avril 2018 par l'autorité de contrôle des médicaments (Swissmedic).
Che cos'è il Pramipexol Zentiva e quando si usa?
Il Pramipexol Zentiva fa parte del gruppo degli agonisti della dopamina, sostanze che stimolano i ricettori dopaminergici a livello cerebrale. Contiene il principio attivo pramipexolo dicloridrato monoidrato ed è prescritto dal medico per la terapia di disturbi che si manifestano nel morbo di Parkinson.
Il Pramipexol Zentiva si può somministrare da solo o in associazione alla levodopa o ad altri medicamenti contro il morbo di Parkinson.
Il Pramipexol Zentiva si usa anche per il trattamento della sindrome cosiddetta delle gambe irrequiete (sindrome «restless legs» idiopatica).
Il medicamento si deve prendere solo su prescrizione medica.
Quando non si può assumere il Pramipexol Zentiva?
In caso di ipersensibilità al pramipexolo o ad un altro costituente del preparato.
Quando è richiesta prudenza nella somministrazione del Pramipexol Zentiva?
Se la funzionalità renale è compromessa, se prende altri medicamenti, specialmente farmaci che influiscono sulla funzionalità renale o che vengono eliminati attraverso i reni, come per esempio gli inibitori della secrezione di acido nello stomaco, medicamenti per il trattamento della sindrome da immunodeficienza acquisita (AIDS) contenenti il principio attivo zidovudina, medicamenti per il trattamento di neoplasie contenenti il principio attivo cisplatino oppure altri medicamenti per la cura del morbo di Parkinson o farmaci che possono provocare stanchezza (sonnolenza) deve informarne il medico. Evitare di assumere medicamenti antipsicotici durante il trattamento con Pramipexol Zentiva.
Informi il medico se soffre di una cardiopatia (malattia del cuore). Soprattutto all'inizio del trattamento sarà necessario che la sua pressione sanguigna sia controllata regolarmente. Ciò per evitare l'ipotensione posturale (il calo di pressione sanguigna alzandosi in piedi).
In alcuni pazienti il Pramipexol Zentiva può provocare cambiamenti del comportamento, p. es. dipendenza dal gioco (dipendenza patologica dal gioco d'azzardo), oniomania (impulso morboso agli acquisti), aumento del desiderio sessuale (aumento della libido), attacchi di bulimia (bisogno patologico di mangiare) come pure allucinazioni e sonnolenza.
Informi il medico se lei o un familiare o chiunque la accudisce osserva in lei tali forme comportamentali insolite. Il medico può ritenere necessario aggiustare la dose o interrompere la terapia.
Informi il medico se lei o un familiare o chiunque la accudisce nota che sta sviluppando mania (agitazione, sensazione di euforia o di sovraeccitazione) o delirium (calo di attenzione, confusione, perdita del senso di realtà). Il medico può ritenere necessario aggiustare la dose o interrompere la terapia.
Rispetto alla popolazione complessiva, i pazienti che soffrono del morbo di Parkinson hanno un maggior rischio di sviluppare un melanoma (cancro della pelle caratterizzato da forte pigmentazione). Perciò faccia effettuare a intervalli regolari un esame della pelle da parte di un dermatologo esperto e tra l'altro presti attenzione a gonfiore, cambiamento di colore e prurito in zone della pelle (p. es. lentiggini), informandone se del caso senza indugio il medico.
In alcuni pazienti il Pramipexol Zentiva può provocare sonnolenza. Anche il consumo di alcool può causare stanchezza e quindi potenziare ulteriormente quella dovuta al Pramipexol Zentiva.
Sia particolarmente prudente se avverte un'improvvisa eccessiva sonnolenza. Anche di questo fatto deve informare il medico, come pure se constata che svolgendo attività della vita di tutti i giorni si è improvvisamente addormentato.
Come con altri farmaci contro il morbo di Parkinson, sono stati riferiti rari casi in cui il paziente si è addormentato improvvisamente, cosa che può succedere in qualsiasi momento nel corso della terapia, senza segni premonitori. Se si addormenta improvvisamente o avverte grande stanchezza durante il giorno, durante la terapia col Pramipexol Zentiva non deve quindi condurre dei veicoli a motore o svolgere altre attività (per esempio operare su delle macchine) in cui una diminuzione dell'attenzione potrebbe mettere in pericolo lei stesso o altre persone.
Informi il medico anche se ha o sviluppa uno dei seguenti disturbi o sintomi:
- Allucinazioni (vedere, sentire o percepire cose inesistenti). La maggior parte delle allucinazioni è di tipo visivo.
- Disfunzioni motorie (discinesie; ad es. movimenti anomali e incontrollati degli arti). Se soffre di una malattia di Parkinson in stadio avanzato e assume anche levodopa, potrebbe sviluppare disfunzioni motorie (discinesie) durante l'aumento graduale della posologia di Pramipexol Zentiva.
- Incapacità di mantenere corpo e collo dritti e in posizione eretta (distonia assiale). In particolare, potrebbe manifestarsi una flessione in avanti di testa e collo (torcicollo anteriore), una flessione in avanti del tronco (camptocormia) o una flessione laterale della schiena (nota anche come pleurototono o sindrome di Pisa).
- Disturbi della vista. Durante il trattamento con Pramipexol Zentiva si sottoponga a regolari controlli della vista.
Informi il suo medico o il suo farmacista nel caso in cui soffra di altre malattie, soffra di allergie oppure assuma o applichi esternamente altri medicamenti (anche se acquistati di sua iniziativa!).
Si può assumere il Pramipexol Zentiva durante la gravidanza o l'allattamento?
Se è incinta o prevede una gravidanza ne informi il medico. Durante la gravidanza il Pramipexol Zentiva si può usare solo in caso di assoluta necessità. Spetta soltanto al suo medico decidere se lei può assumere il Pramipexol Zentiva durante la gravidanza.
Durante l'allattamento il Pramipexol Zentiva non si può prendere. Se è necessario un trattamento con questo farmaco bisogna smettere di allattare. In ogni caso contatti il suo medico.
Come usare il Pramipexol Zentiva?
Il Pramipexol Zentiva va preso durante i pasti o fuori degli stessi, con acqua.
La posologia è stabilita soltanto dal medico.
Le compresse Pramipexol Zentiva sono destinate soltanto agli adulti e non si devono somministrare a bambini o adolescenti fino a 18 anni.
Morbo di Parkinson
La terapia inizia con l'assunzione di 1 compressa (0,125 mg) di Pramipexol Zentiva 3 volte al giorno. Il medico aumenterà poi gradualmente la dose giornaliera a intervalli di 5-7 giorni, fino a raggiungere la dose adatta al suo caso.
L'ulteriore terapia avviene a questa dose, che varia tra 0,375 mg e 4,5 mg di Pramipexol Zentiva al giorno. Prenda questa dose giornaliera suddividendola in tre porzioni uguali. In caso di disfunzione renale è possibile che il medico prescriva anche una dose più bassa.
Sindrome «restless legs»
Il trattamento inizia prendendo 1 compressa (0,125 mg) di Pramipexol Zentiva una volta al giorno, 2-3 ore prima di coricarsi. Se questa dose non basta ad alleviare i sintomi il medico potrà consigliarle di aumentare gradualmente la dose, ogni 4-7 giorni, a 0,25 mg, 0,5 mg o 0,75 mg al giorno.
Se la sua funzionalità renale è compromessa ne informi il medico.
Se per una volta ha dimenticato di prendere il Pramipexol Zentiva, continui la terapia il più presto possibile. Non prenda quindi mai più di una dose per volta.
Se per sbaglio avesse preso troppe compresse, prenda subito contatto col medico o col suo supplente. Porti con sé la confezione del medicamento e non guidi personalmente l'automobile.
Non smetta di assumere il Pramipexol Zentiva senza averne prima parlato col suo medico.
Se deve smettere di assumere questo medicamento il medico le diminuirà la dose gradualmente. Cessando di colpo v'è un alto rischio di aggravamento dei sintomi.
Inoltre, se soffre del morbo di Parkinson, interrompere improvvisamente l'assunzione del farmaco può provocare uno stato morboso chiamato sindrome neurolettica maligna che può costituire un notevole rischio per la salute. Fra i suoi sintomi vi sono: diminuzione o assenza dei movimenti muscolari (acinesia), rigidità muscolare, febbre, pressione arteriosa instabile, aumento della frequenza cardiaca (tachicardia), confusione, riduzione o perdita della conoscenza (p.es. coma).
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Quali effetti collaterali può avere il Pramipexol Zentiva?
In seguito all'assunzione del Pramipexol Zentiva possono manifestarsi i seguenti effetti collaterali:
nausea, vomito, stitichezza, vertigini, movimenti involontari, bisogno eccessivo di muoversi, sonnolenza, disturbi del sonno, amnesia, svenimento improvviso, flessione in avanti di testa e collo (torcicollo anteriore), insufficienza cardiaca (debolezza di cuore) compreso il collasso cardiaco, allucinazioni, agitazione, confusione, sogni inconsueti, idee deliranti, mal di testa, singhiozzo, stanchezza, diplopia (veder doppio), offuscamento della vista, peggioramento della vista, accumulo di liquido p.es. nelle braccia o nelle gambe (edema periferico), pressione arteriosa bassa (ipotensione), aumento o diminuzione di peso compresa diminuzione dell'appetito, sintomi a livello della pelle quali eruzione cutanea, prurito e altre reazioni allergiche, polmonite o respirazione difficoltosa.
Può verificarsi un disturbo della secrezione dell'ormone antidiuretico (ADH) con sintomi di eccessiva presenza d'acqua nel corpo/caduta dei tassi sanguigni dei sali (con p.es. disturbi della coscienza compreso il coma, della memoria e della concentrazione, convulsioni, allucinazioni, mal di testa, crampi muscolari).
Dipendenza patologica dal gioco d'azzardo, specialmente in caso di assunzione di dosi elevate di pramipexolo contro il morbo di Parkinson, aumento del desiderio sessuale (p.es. aumento della libido), ipersessualità (attività sessuale eccessiva), comportamento anormale, oniomania (impulso morboso agli acquisti) e maggior assunzione di cibo (attacchi di bulimia) sono stati osservati in diversi pazienti, ma in generale sono regrediti dopo riduzione della dose o cessazione della terapia. Possono altresì manifestarsi delirium (calo di attenzione, confusione, perdita del senso di realtà) o mania (agitazione, sensazione di euforia o di sovraeccitazione). Soprattutto all'inizio del trattamento può verificarsi un calo della pressione sanguigna.
Possono verificarsi casi in cui il paziente si addormenta improvvisamente con o senza precedente stanchezza (sonnolenza) (vedi anche «Quando è richiesta prudenza nella somministrazione del Pramipexol Zentiva?»).
Se osserva effetti collaterali qui non descritti dovrebbe informare il suo medico o il suo farmacista.
Di che altro occorre tener conto?
Il medicamento va conservato fuori della portata dei bambini.
Non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Le compresse Pramipexol Zentiva devono essere conservate nella striscia blister originale fino al momento dell'uso.
Tenere a temperatura ambiente (15-25 °C), al riparo dalla luce, nella confezione originale.
Il medico o il farmacista, che sono in possesso di documentazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Pramipexol Zentiva?
1 compressa da 0,125 mg contiene: 0,125 mg di pramipexolo dicloridrato monoidrato (corrispondenti a 0,088 mg di pramipexolo base) e sostanze ausiliarie.
1 compressa divisibile da 0,25 mg contiene: 0,25 mg di pramipexolo dicloridrato monoidrato (corrispondenti a 0,18 mg di pramipexolo base) e sostanze ausiliarie.
1 compressa divisibile da 0,5 mg contiene: 0,5 mg di pramipexolo dicloridrato monoidrato (corrispondenti a 0,35 mg di pramipexolo base) e sostanze ausiliarie.
1 compressa divisibile da 1,0 mg contiene: 1,0 mg di pramipexolo dicloridrato monoidrato (corrispondenti a 0,7 mg di pramipexolo base) e sostanze ausiliarie.
Numero dell’omologazione
60089 (Swissmedic).
Dov'è ottenibile il Pramipexol Zentiva? Quali confezioni sono disponibili?
In farmacia dietro presentazione della prescrizione medica.
Compresse da 0,125 mg: confezione da 30 compresse.
Compresse (divisibile) da 0,25 mg: confezioni da 30 e 100 compresse.
Compresse (divisibile) da 0,5 mg: confezione da 100 compresse.
Compresse (divisibile) da 1,0 mg: confezione da 100 compresse.
Titolare dell’omologazione
Helvepharm AG, Frauenfeld.
Questo foglietto illustrativo è stato controllato l'ultima volta nell'aprile 2018 dall'autorità competente in materia di medicamenti (Swissmedic).
Zusammensetzung
Wirkstoffe: Pramipexolum ut Pramipexoli dihydrochloridum monohydricum.
Hilfsstoffe: Excip. pro compresso.
Galenische Form und Wirkstoffmenge pro Einheit
1 Tablette zu 0,125 mg enthält: 0,125 mg Pramipexol-Dihydrochlorid-Monohydrat (entsprechend 0,088 mg Pramipexol-Base).
1 teilbare Tablette zu 0,25 mg enthält: 0,25 mg Pramipexol-Dihydrochlorid-Monohydrat (entsprechend 0,18 mg Pramipexol-Base).
1 teilbare Tablette zu 0,5 mg enthält: 0,5 mg Pramipexol-Dihydrochlorid-Monohydrat (entsprechend 0,35 mg Pramipexol-Base).
1 teilbare Tablette zu 1,0 mg enthält: 1,0 mg Pramipexol-Dihydrochlorid-Monohydrat (entsprechend 0,7 mg Pramipexol-Base).
Indikationen/Anwendungsmöglichkeiten
Symptomatische Behandlung der idiopathischen Parkinson-Erkrankung, als Monotherapie oder in Kombination mit Levodopa.
Symptomatische Behandlung des idiopathischen Restless Legs Syndroms (RLS).
Dosierung/Anwendung
Die Tabletten sollten oral mit oder ohne Nahrung mit etwas Wasser eingenommen werden. Die Tagesdosis wird, aufgeteilt in gleiche Dosen, dreimal täglich eingenommen.
Parkinsonerkrankung
Anfangsbehandlung
Beginnend mit einer Initialdosis von 0,375 mg/Tag sollte die Dosierung von Pramipexol Zentiva in Abständen von 5-7 Tagen schrittweise erhöht werden.
Unter der Voraussetzung, dass keine schwerwiegenden unerwünschten Wirkungen auftreten, sollte die Dosis bis zum Erreichen eines maximalen Behandlungserfolgs erhöht werden.
Im ersten Schritt (frühestens nach einer Woche) kann die Dosis um 0.375 mg erhöht werden.
Ist eine weitere Dosissteigerung erforderlich, sollte die Tagesdosis in wöchentlichen Abständen um 0,75 mg bis zu einer Höchstdosis von 4,5 mg/Tag erhöht werden.
Dauerbehandlung
Die individuelle Dosierung von Pramipexol Zentiva sollte zwischen 0,375 mg bis maximal 4,5 mg/Tag liegen.
In den klinischen Studien, sowohl an Patienten mit frühen als auch mit fortgeschrittenen Erkrankungsstadien, wurde die Wirksamkeit bereits ab einer Tagesdosis von 1,5 mg nachgewiesen. Bei einzelnen Patienten kann durch eine höhere Tagesdosis als 1,5 mg ein zusätzlicher therapeutischer Nutzen erzielt werden.
Das betrifft vor allem Patienten mit fortgeschrittener Erkrankung, bei denen eine Verringerung der Levodopa-Dosierung angestrebt wird. Es ist jedoch zu beachten, dass die Inzidenz und der Schweregrad von Somnolenz bei Dosierungen über 1,5 mg/Tag ansteigen.
Dosierung bei Patienten mit zusätzlicher Levodopa-Behandlung
Bei Patienten mit gleichzeitiger Levodopa-Therapie ist eine Verringerung der Levodopa-Dosis, sowohl während der Anfangs- als auch der Dauerbehandlung mit Pramipexol Zentiva angezeigt, um die Möglichkeit einer überschiessenden dopaminergen Stimulation zu vermeiden. Auf Grund von Daten aus einer kontrollierten Studie an Patienten im fortgeschrittenen Krankheitsstadium ist eine Reduktion der Levodopa-Dosis um 25% (oder mehr) zu empfehlen.
Absetzen der Therapie
Ein plötzlicher Abbruch einer dopaminergen Therapie kann zur Entwicklung eines malignen neuroleptischen Syndroms führen.
Pramipexol Zentiva sollte schrittweise um 0.75 mg Pramipexol (entspricht 0.54 mg der Pramipexol-Base) pro Tag reduziert werden, bis zu einer Tagesdosis von 0.75 mg Pramipexol (entspricht 0.54 mg der Pramipexol-Base). Anschliessend sollte die Dosis um 0.375 mg Pramipexol (entspricht 0.26 mg der Pramipexol-Base) pro Tag reduziert werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Restless Legs Syndrom
Die empfohlene Initialdosis von Pramipexol Zentiva beträgt 0,125 mg einmal täglich, 2-3 Stunden vor dem Zubettgehen. Bei Patienten, die eine zusätzliche symptomatische Linderung benötigen, kann die Dosis alle 4-7 Tage stufenweise um 0.125 mg bis zu einer Höchstdosis von 0,75 mg/Tag erhöht werden.
Absetzen der Therapie
Pramipexol Zentiva kann ohne schrittweise Dosisreduktion abgesetzt werden. Nach abrupter Beendigung der Behandlung wurde bei 10% der Patienten ein Rebound der RLS-Symptome beobachtet. Dieser Effekt trat über alle Dosisstufen hinweg ähnlich ausgeprägt auf.
Spezielle Dosierungsanweisungen
Dosierung bei Parkinson-Patienten mit beeinträchtigter Nierenfunktion
Die Ausscheidung von Pramipexol hängt von der Nierenfunktion ab. Für die Anfangsbehandlung wird folgendes Dosierungsschema empfohlen:
Bei Patienten mit einer Kreatinin-Clearance >50 ml/min ist keine Reduzierung der Tagesdosis bzw. der Einnahmefrequenz erforderlich.
Bei Patienten mit einer Kreatinin-Clearance von 20-50 ml/min sollte die initiale Tagesdosis von Pramipexol Zentiva Tabletten auf zwei getrennte Einnahmen beginnend mit je 0,125 mg beschränkt werden (0,25 mg/Tag).
Eine Höchstdosis von 2,25 mg Pramipexol pro Tag sollte nicht überschritten werden.
Bei Patienten mit einer Kreatinin-Clearance <20 ml/min sollte die Tagesdosis von Pramipexol Zentiva Tabletten, beginnend mit 0,125 mg/Tag, auf einmal verabreicht werden.
Eine Höchstdosis von 1,5 mg Pramipexol pro Tag sollte nicht überschritten werden.
Tritt während der Dauerbehandlung eine Abnahme der Nierenfunktion auf, ist die Tagesdosis von Pramipexol Zentiva um denselben Prozentsatz zu reduzieren, um den die Kreatinin-Clearance abnimmt. Verringert sich beispielsweise die Kreatinin-Clearance um 30%, so ist die Tagesdosis Pramipexol Zentiva um 30% zu reduzieren. Beträgt die Kreatinin-Clearance 20-50 ml/min kann die Tagesdosis auf zwei Einnahmen verteilt werden, beträgt sie weniger als 20 ml/min kann die Tagesdosis auf einmal verabreicht werden.
Dosierung bei RLS-Patienten mit beeinträchtigter Nierenfunktion
Die Verwendung von Pramipexol bei RLS-Patienten mit beeinträchtigter Nierenfunktion wurde nicht untersucht.
Die Ausscheidung von Pramipexol hängt von der Nierenfunktion ab und ist eng mit der Kreatinin-Clearance verbunden.
Bei Patienten mit einer Kreatinin-Clearance >20 ml/min ist keine Reduzierung der Tagesdosis erforderlich.
Bei schwerer Niereninsuffizienz (Kreatinin-Clearance <20 ml/min) ist entsprechend der Dosierungsempfehlung bei Parkinson-Erkrankung die Tagesdosis um denselben Prozentsatz zu reduzieren, um den die Kreatinin-Clearance abnimmt.
Dosierung bei Patienten mit beeinträchtigter Leberfunktion
Der mögliche Einfluss einer Leberinsuffizienz auf die Pharmakokinetik von Pramipexol wurde nicht untersucht.
Bei Beeinträchtigung der Leberfunktion ist eine Reduktion der Dosis nicht erforderlich, da ca. 90% des absorbierten Wirkstoffs über die Nieren ausgeschieden werden.
Dosierung bei Kindern und Jugendlichen
Die Sicherheit und Wirksamkeit von Pramipexol bei Kindern und Jugendlichen bis zu 18 Jahren wurde nicht untersucht.
Kontraindikationen
Überempfindlichkeit gegenüber Pramipexol oder einem anderen Bestandteil des Arzneimittels, Hämodialyse.
Warnhinweise und Vorsichtsmassnahmen
Beeinträchtigte Nierenfunktion
Wird Pramipexol Zentiva einem Patienten mit beeinträchtigter Nierenfunktion verschrieben, sollte die Dosierung entsprechend der Angaben im Kapitel «Dosierung/Anwendung» reduziert werden.
Halluzinationen und Desorientiertheit
Halluzinationen und Verwirrtheit sind bekannte unerwünschte Wirkungen bei einer Behandlung mit Dopamin-Agonisten und Levodopa. Halluzinationen traten bei Patienten mit fortgeschrittener Parkinson-Erkrankung, die Pramipexol zusammen mit Levodopa erhielten, häufiger auf als bei Pramipexol-Monotherapie in frühen Erkrankungsstadien. Während des klinischen Entwicklungsprogramms für die Zulassung des Restless-Legs-Syndroms wurde ein Fall von Halluzinationen berichtet. Die Patienten sollten informiert werden, dass (vor allem visuelle) Halluzinationen auftreten können.
Dyskinesien
Während der Initialbehandlung mit Pramipexol Zentiva können Dyskinesien vorkommen, insbesondere bei der Anwendung von Pramipexol Zentiva als Zusatztherapie zu Levodopa. Wenn sie auftreten, sollte die Levodopa-Dosis reduziert werden.
Plötzliches Einschlafen und Somnolenz
Wie bei der Behandlung mit anderen Dopaminagonisten und Levodopa selber, wurde bei Behandlung mit Pramipexol über Somnolenz (sehr häufig) und über plötzliches Einschlafen (gelegentlich) berichtet, insbesondere bei Parkinson-Patienten. Dies hat bei gefährlichen Tätigkeiten wie z.B. Autofahren zu Unfällen oder Beinahe-Unfällen geführt, und kann sowohl für den Patienten als auch für andere Personen lebensbedrohlich sein. In der Regel trat dieses plötzliche Einschlafen ohne Wahrnehmung von Warnanzeichen auf. Werden derartige Fälle von plötzlichem Einschlafen beobachtet, sollte eine Dosisreduktion oder eine Beendigung der Behandlung erwogen werden. Mit Pramipexol behandelte Patienten sollten davor gewarnt werden, dass ihre Sicherheit und die anderer Personen gefährdet ist, wenn diese unerwünschten Wirkungen während des Führens von Fahrzeugen oder der Bedienung von Maschinen eintreten. Den Patienten ist von solchen Aktivitäten abzuraten, falls sie unter Somnolenz und/oder plötzlichem Einschlafen leiden. Wegen möglicher additiver Effekte wird zu erhöhter Vorsicht geraten, wenn Patienten andere sedierende Arzneimittel oder Alkohol in Kombination mit Pramipexol einnehmen (siehe auch «Interaktionen», «Wirkungen auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen», «Unerwünschte Wirkungen»).
Impulskontrollstörungen und zwanghafte Verhaltensweisen
Spielsucht, gesteigerte Libido und Hypersexualität wurde bei Parkinson-Patienten berichtet, die mit Dopaminagonisten einschliesslich Pramipexol behandelt wurden. Patienten und Betreuende sollten informiert werden, dass darüber hinaus weitere Symptome einer Impulskontrollstörung oder zwanghaften Verhaltens wie Essattacken, Hyperphagie und Kaufsucht auftreten können. Eine Dosisreduktion oder ein schrittweises Absetzen der Behandlung sollte in Betracht gezogen werden.
Manisches Verhalten und Delir
Die Patienten sollten regelmässig im Hinblick auf die Entwicklung von Manie und Delir überwacht werden. Patienten und Betreuende sollten darauf aufmerksam gemacht werden, dass bei Patienten, die mit Pramipexol behandelt werden, Manie und Delir auftreten können. Eine Dosisreduktion oder ein schrittweises Absetzen sollte in Betracht gezogen werden, wenn solche Symptome auftreten.
Patienten mit psychotischen Störungen
Patienten mit psychotischen Störungen sollten mit Dopaminagonisten nur behandelt werden, wenn der mögliche Nutzen die Risiken überwiegt. Die gleichzeitige Verabreichung von antipsychotischen Arzneimitteln und Pramipexol wird nicht empfohlen (siehe «Interaktionen»).
Patienten mit schwerer kardiovaskulärer Erkrankung
Im Falle einer schweren kardiovaskulären Erkrankung ist Vorsicht geboten. Wegen des allgemeinen Risikos einer orthostatischen Hypotonie bei dopaminerger Therapie ist es empfehlenswert, den Blutdruck besonders am Anfang der Therapie zu kontrollieren.
Dystonie
Patienten mit Morbus Parkinson können mit axialer Dystonie wie Antecollis, Kamptokormie oder Pleurothotonus (Pisa-Syndrom) vorstellig werden. Eine Dystonie wurde gelegentlich nach der Einleitung einer Behandlung mit Dopaminagonisten einschliesslich Pramipexol berichtet, jedoch konnte ein eindeutiger Kausalzusammenhang nicht nachgewiesen werden. Eine Dystonie kann auch mehrere Monate nach Aufnahme oder Anpassung der medikamentösen Behandlung auftreten. Bei Auftreten von Dystonie sollte die dopaminerge Therapie überprüft und gegebenenfalls angepasst werden.
Augenärztliche Kontrollen
In Karzinogenitätsstudien wurde bei Albinoratten unter einer Pramipexol-Überdosierung eine Netzhautdegeneration mit Verlust von Photorezeptoren festgestellt. Diese pathologischen Veränderungen wurden in keiner der anderen untersuchten Spezies (Albinomäuse, pigmentierte Ratten, Affen, Minischweinen) beobachtet. Auf Grund des betroffenen universellen Mechanismus darf dies im Hinblick auf den Menschen nicht ignoriert werden. Allerdings ergaben Untersuchungen beim Menschen bisher keine Hinweise auf das Vorkommen ähnlicher Prozesse.
Augenärztliche Untersuchungen werden in regelmässigen Abständen empfohlen oder bei Auftreten von Sehstörungen (siehe «Unerwünschte Wirkungen» und «Präklinische Daten»).
Melanom
Epidemiologische Studien haben gezeigt, dass Patienten mit Morbus Parkinson gegenüber der Gesamtbevölkerung ein erhöhtes Risiko (2- bis ca. 6-fach) haben, ein Melanom zu entwickeln. Ob das festgestellte erhöhte Risiko auf Morbus Parkinson oder auf andere Faktoren zurückzuführen ist, wie Arzneimittel zur Behandlung von Morbus Parkinson, ist nicht klar. Aus diesen erwähnten Gründen sollten Patienten und die behandelnden Ärzte beraten sein, bei der Anwendung von Pramipexol bzw. anderen dopaminergen Arzneimitteln auf Melanome zu achten.
Malignes neuroleptisches Syndrom
Nach plötzlichem Absetzen der dopaminergen Therapie wurden Symptome eines malignen neuroleptischen Syndroms beobachtet (siehe «Dosierung/Anwendung, Parkinsonerkrankung, Absetzen der Therapie»).
Zunahme des Restless Legs Syndroms (Augmentation)
Literaturberichte weisen auf eine mögliche Zunahme des RLS nach einer dopaminergen Behandlung hin.
Dies äussert sich in einem früheren Auftreten der Symptome am Abend (oder sogar am Nachmittag), einer Verstärkung der Symptome, und/oder einem Ausbreiten der Symptome auf andere Extremitäten. Gegebenenfalls ist ein Absetzen von Pramipexol Zentiva oder eine Umstellung der medikamentösen Therapie erforderlich.
Das Phänomen der Augmentation wurde in einer kontrollierten klinischen Studie über 26 Wochen gesondert untersucht. Eine Augmentation wurde bei 11,8% der Patienten der Pramipexol-Gruppe (N = 152) und bei 9,4% der Patienten der Placebo-Gruppe (N = 149) beobachtet. Die Kaplan-Meier-Analyse der Zeit bis zum Auftreten einer Augmentation zeigte zwischen der Pramipexol- und der Placebo-Gruppe keinen signifikanten Unterschied.
Fertilität
Es liegen keine klinischen Studien zur Auswirkung auf die Fertilität beim Menschen vor. Tierexperimentelle Studien haben zwar keine direkte oder indirekte schädliche Wirkung auf die männliche Fertilität ergeben, jedoch eine verringerte weibliche Fertilität durch die Beeinflussung des weiblichen Zyklus, wie von einem Dopaminagonisten zu erwarten ist (siehe auch «Präklinische Daten»).
Interaktionen
Plasmaproteinbindung
Eine Wechselwirkung mit anderen Arzneimitteln, die die Plasmaproteinbindung oder den Metabolismus beeinflussen, ist unwahrscheinlich.
Inhibitoren bzw. Kompetitoren der aktiven renalen Ausscheidung
Cimetidin reduziert die renale Clearance von Pramipexol um annähernd 34%, wahrscheinlich durch Hemmung des kationischen sekretorischen Transportsystems der renalen Tubuli. Deshalb können Pramipexol und Arzneimittel, die die aktive renale Tubulussekretion hemmen oder auf diesem Wege ausgeschieden werden, sich gegenseitig beeinflussen und zu einer reduzierten Clearance von einem oder beiden Arzneimitteln führen. Arzneimittel, die neben Cimetidin in diese Kategorie gehören sind Amantadin, Diltiazem, Chinidin, Chinin, Ranitidin, Triamteren, Verapamil, Digoxin, Procainamid, Zidovudin, Cisplatin und Trimethoprim. Wird eines dieser Arzneimittel zusammen mit Pramipexol Zentiva verabreicht, sollte auf Zeichen einer Dopaminüberstimulation, wie Dyskinesien, Agitiertheit oder Halluzinationen geachtet werden. In solchen Fällen ist eine Dosisreduktion erforderlich.
Kombination mit Selegilin und Levodopa
Selegilin und Levodopa beeinflussen die Pharmakokinetik von Pramipexol nicht. In einer kleinen pharmakokinetischen Studie (n = 9) wurde das Ausmass der Gesamtresorption und Elimination von Levodopa durch die gleichzeitige Verabreichung von Pramipexol nicht verändert. Bei einer Kombinationstherapie kann es aber trotzdem zu einer überschiessenden dopaminergen Stimulation kommen.
Die initiale Resorptionsrate von Levodopa war bei 4 von 9 Probanden erhöht, die alle weiblich waren.
Es wird empfohlen, während der Dosissteigerung von Pramipexol Zentiva bei Parkinson-Patienten, die Dosierung von Levodopa zu verringern und die Dosierung anderer Anti-Parkinson-Therapeutika konstant zu halten (siehe «Dosierung bei Patienten mit zusätzlicher Levodopa-Behandlung»).
Anticholinergika und Amantadin
Die Wechselwirkung mit Anticholinergika und Amantadin wurde nicht geprüft.
Da die Ausscheidung von Anticholinergika überwiegend über den hepatischen Metabolismus erfolgt, ist eine pharmakokinetische Wechselwirkung mit Pramipexol eher unwahrscheinlich.
Antipsychotische Arzneimittel
Die gleichzeitige Verabreichung von antipsychotischen Arzneimitteln mit Pramipexol wird nicht empfohlen, z.B. wenn Dopamin-antagonistische Wirkungen zu erwarten sind (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Andere Arzneimittel/Alkohol
Wegen möglicher additiver Effekte wird zu erhöhter Vorsicht geraten, wenn Patienten andere sedierende Arzneimittel oder Alkohol in Kombination mit Pramipexol einnehmen sowie bei gleichzeitiger Anwendung von Arzneimitteln, welche den Plasmaspiegel von Pramipexol erhöhen (z.B. Cimetidin).
Schwangerschaft/Stillzeit
Schwangerschaft
Der Einfluss auf Schwangerschaft wurde beim Menschen nicht untersucht. Untersuchungen an Nagetieren und Kaninchen ergaben keinen Hinweis auf teratogene Wirkungen. In maternal toxischen Dosen war Pramipexol bei der Ratte auch für den Embryo toxisch (siehe «Präklinische Daten»). Pramipexol Zentiva sollte während der Schwangerschaft nicht verwendet werden, es sei denn, dies ist absolut notwendig.
Stillzeit
Der Übertritt von Pramipexol in die Muttermilch wurde beim Menschen nicht geprüft. Bei Ratten war die Konzentration von Pramipexol und seinen Metaboliten (gemessen als 14C-Radioaktivität) in der Milch höher als im Plasma.
Da Pramipexol beim Menschen die Prolaktinsekretion inhibiert, ist eine Hemmung der Laktation zu erwarten.
Da keine Daten aus klinischen Studien am Menschen vorliegen, sollte Pramipexol Zentiva während der Stillzeit möglichst nicht eingenommen werden. Ist eine Anwendung unvermeidbar, sollte abgestillt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Dem Patienten sollte bewusst sein, dass Halluzinationen auftreten können und die Verkehrstüchtigkeit beeinflussen können.
Patienten sollen vor den möglichen sedierenden Wirkungen (einschliesslich Somnolenz und plötzliches Einschlafen während den täglichen Aktivitäten), welche mit Pramipexol Zentiva assoziiert sind gewarnt werden. Da die Somnolenz und plötzliches Einschlafen potentiell gefährliche Auswirkungen haben können, sollten die Patienten angewiesen werden, weder Kraftfahrzeuge zu führen, Maschinen zu bedienen noch andere potenziell gefährliche Tätigkeiten auszuführen. Dies gilt bis genügend Erfahrung mit der Einnahme von Pramipexol Zentiva vorhanden ist, um abschätzen zu können, ob die mentalen und/oder motorischen Fähigkeiten durch Pramipexol Zentiva negativ beeinflusst werden. Die Patienten sollen bei Somnolenz und Fällen von plötzlichem Einschlafen während täglicher Aktivitäten (z.B. Gespräche, Essen, usw.), welche zu jedem Zeitpunkt der Behandlung auftreten können, ihren Arzt aufsuchen (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
Unerwünschte Wirkungen
Definition der verwendeten Häufigkeitskategorien: sehr häufig (≥10%), häufig (≥1%, <10%), gelegentlich (≥0,1%, <1%), selten (>0,01%, <0,1%).
Parkinson-Erkrankung
Die unten aufgeführten unerwünschten Wirkungen basieren auf der Analyse von gepoolten, Placebo-kontrollierten Studien, sowie von Post-Marketing Studien.
Infektionen und parasitäre Erkrankungen
Gelegentlich: Pneumonie.
Endokrine Erkrankungen
Gelegentlich: Inadäquate ADH-Sekretion*.
Bei Auftreten einer Hyponatriämie sollte differentialdiagnostisch an das Vorliegen eines Syndroms der inadäquaten ADH-Sektretion (SIADH) gedacht werden und weitere mögliche Ursachen ausgeschlossen werden. Ein SIADH kann sich klinisch äussern durch z.B. Störungen des Bewusstseins einschliesslich Koma, Halluzinationen, Krampfanfälle, Kopfschmerzen, Störungen der Konzentration und des Gedächtnisses, Muskelkrämpfe.
Psychiatrische Erkrankungen
Häufig: Insomnia, Halluzinationen, Verwirrtheit, ungewöhnliche Träume, Verhaltensauffälligkeiten im Sinne von Impulskontrollstörungen und zwanghaftem Verhalten.
Gelegentlich: Störung der Libido, Hypersexualität, Wahnvorstellungen, Paranoia, Spielsucht, Kaufsucht, Unruhe, Essattacken*, Hyperphagie*, Delir.
Selten: Manie.
Erkrankungen des Nervensystems
Sehr häufig: Schwindel (18,4%), Dyskinesie (16,8%), Somnolenz (11,7%).
Häufig: Kopfschmerzen.
Gelegentlich: Hyperkinesie, plötzliches Einschlafen, Synkope, Amnesie, Antecollis*.
Die Inzidenz von Somnolenz steigt in Dosierungen über 1,5 mg an (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
Augenerkrankungen
Häufig: Sehstörungen einschliesslich Diplopie, verschwommenes Sehen, verminderte Sehschärfe.
Herzerkrankungen
Gelegentlich: Herzversagen*.
In klinischen Studien und der Post-Marketing Erfahrung wurde bei Patienten, die Pramipexol erhielten, über Herzinsuffizienz berichtet. In einer pharmaepidemiologischen Studie wurde beim Einsatz von Pramipexol ein erhöhtes Risiko einer Herzinsuffizienz im Vergleich zu Nicht-Verwendung von Pramipexol gefunden.
Gefässerkrankungen
Häufig: Hypotonie.
Am Behandlungsbeginn kann eine Hypotonie auftreten, besonders dann, wenn Pramipexol zu schnell in höheren Dosen verabreicht wird.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Dyspnoe, Schluckauf.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Übelkeit (17,8%).
Häufig: Erbrechen, Obstipation.
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Exanthem, Pruritus und weitere Überempfindlichkeitsreaktionen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: periphere Ödeme, Müdigkeit.
Untersuchungen
Häufig: Gewichtsabnahme einschliesslich vermindertem Appetit.
Gelegentlich: Gewichtszunahme.
* Diese unerwünschte Wirkung wurde nach der Markteinführung beobachtet. Mit 95%iger Wahrscheinlichkeit ist die Häufigkeitskategorie nicht höher als gelegentlich, sondern kann niedriger sein. Eine präzise Häufigkeitseinschätzung ist nicht möglich, da diese unerwünschte Wirkung nicht in klinischen Studien bei n=2762 mit Pramipexol behandelten Parkinson-Patienten dokumentiert worden ist.
Von Patienten, die mit Dopaminagonisten zur Behandlung von Morbus Parkinson, einschliesslich Pramipexol, behandelt wurden, wurde – insbesondere bei hohen Dosierungen – über Anzeichen von pathologischem Spielen (Spielsucht), gesteigerter Libido und Hypersexualität berichtet. Diese Anzeichen waren im Allgemeinen nach Dosisreduktion oder Absetzen reversibel. Fälle von erhöhter Nahrungseinnahme (Hyperphagie) wurden ebenfalls berichtet.
Restless-Legs-Syndrom
Die unten aufgeführten unerwünschten Wirkungen basieren auf der Analyse von gepoolten, Placebo-kontrollierten Studien mit insgesamt 1036 Patienten unter Pramipexol und 610 Patienten unter Placebo, sowie von Post-Marketing Studien.
Infektionen und parasitäre Erkrankungen
Gelegentlich: Pneumonie*.
Endokrine Erkrankungen
Gelegentlich: Inadäquate ADH-Sekretion*.
Bei Auftreten einer Hyponatriämie sollte differentialdiagnostisch an das Vorliegen eines Syndroms der inadäquaten ADH-Sektretion (SIADH) gedacht werden und weitere mögliche Ursachen ausgeschlossen werden. Ein SIADH kann sich klinisch äussern durch z.B. Störungen des Bewusstseins einschliesslich Koma, Halluzinationen, Krampfanfälle, Kopfschmerzen, Störungen der Konzentration und des Gedächtnisses, Muskelkrämpfe.
Psychiatrische Erkrankungen
Häufig: Insomnia, ungewöhnliche Träume.
Gelegentlich: Halluzinationen, Verwirrtheit, Unruhe, Störung der Libido.
Wahnvorstellungen*, Paranoia*, Verhaltensauffälligkeiten* im Sinne von Impulskontrollstörungen und zwanghaftem Verhalten wie z.B. Essattacken*, Hyperphagie*, Kaufsucht*, Hypersexualität* und Spielsucht*, Manie*, Delir*.
Erkrankungen des Nervensystems
Häufig: Schwindel, Somnolenz, Kopfschmerzen.
Gelegentlich: Dyskinesie, plötzliches Einschlafen (siehe auch «Warnhinweise und Vorsichtsmassnahmen»), Synkope, Amnesie*, Hyperkinesie*, Antecollis*.
Augenerkrankungen
Gelegentlich: Sehstörungen einschliesslich Diplopie, verschwommenes Sehen, verminderte Sehschärfe.
Herzerkrankungen
Gelegentlich: Herzversagen*.
In klinischen Studien und der Post-Marketing Erfahrung wurde bei Patienten, die Pramipexol erhielten, über Herzinsuffizienz berichtet. In einer pharmaepidemiologischen Studie wurde beim Einsatz von Pramipexol ein erhöhtes Risiko einer Herzinsuffizienz im Vergleich zu Nicht-Verwendung von Pramipexol gefunden.
Gefässerkrankungen
Gelegentlich: Hypotonie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Dyspnoe, Schluckauf.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Übelkeit (12,3%).
Häufig: Erbrechen, Obstipation.
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Exanthem, Pruritus und weitere Überempfindlichkeitsreaktionen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Müdigkeit.
Gelegentlich: periphere Ödeme.
Untersuchungen
Gelegentlich: Gewichtszunahme bzw. Gewichtsabnahme einschliesslich vermindertem Appetit.
* Diese unerwünschte Wirkung wurde nach der Markteinführung beobachtet. Mit 95%iger Wahrscheinlichkeit ist die Häufigkeitskategorie nicht höher als gelegentlich, sondern kann niedriger sein. Eine präzisere Häufigkeitseinschätzung ist nicht möglich, da diese unerwünschte Wirkung nicht in klinischen Studien bei n=1395 mit Pramipexol behandelten Patienten mit Restless-Legs-Syndrom dokumentiert worden ist.
Überdosierung
Symptome
Klinische Erfahrungen mit starker Überdosierung liegen nicht vor. Zu erwarten sind Nebenwirkungen, die mit dem pharmakodynamischen Profil von Dopamin-Agonisten zusammenhängen, z.B. Übelkeit, Erbrechen, Hyperkinesie, Halluzinationen, Agitation und Hypotonie.
Behandlung
Ein Antidot zur Behandlung einer Überdosierung von Dopamin-Agonisten ist nicht bekannt. Liegen Zeichen einer zentral-nervösen Stimulation vor, kann die Gabe eines Neuroleptikums angezeigt sein. Die Behandlung einer Überdosierung kann allgemein unterstützende Massnahmen, zusammen mit Magenspülung, intravenöser Flüssigkeitszufuhr, die Gabe von Aktivkohle sowie EKG-Überwachung, erfordern.
Pramipexol ist nur in geringem Mass dialysierbar.
Eigenschaften/Wirkungen
ATC-Code: N04BC05
Pramipexol, der Wirkstoff von Pramipexol Zentiva, ist ein nicht-ergoliner Dopamin-Agonist, der mit hoher Selektivität und Spezifität an Dopaminrezeptoren der D2-Subfamilie, hier vorzugsweise an die D3-Rezeptoren, bindet. Pramipexol besitzt eine volle intrinsische Wirksamkeit.
Pramipexol verringert motorische Ausfälle bei Parkinson, indem es die Dopaminrezeptoren im Corpus striatum stimuliert. Tierversuche zeigten, dass Pramipexol die Synthese, Freisetzung und den Turnover von Dopamin hemmt.
In Tierversuchen schützt Pramipexol dopaminerge Neurone vor einer Degeneration aufgrund von Ischämie oder der Neurotoxizität von Metamphetamin.
Der genaue Wirkungsmechanismus von Pramipexol in der Behandlung des Restless Legs Syndroms (RLS) ist nicht bekannt. Obwohl die Pathophysiologie des RLS weitgehend unbekannt ist, weisen neuropharmakologische Daten auf eine Einwirkung des primären dopaminergen Systems hin.
Positronenemissionstomographische (PET) Studien lassen auf eine milde präsynaptische dopaminerge Fehlfunktion in der Pathogenese des RLS schliessen.
In-vitro-Studien zeigen, dass Pramipexol Neuronen vor der neurotoxischen Wirkung von Levodopa schützt.
An Probanden wurde eine dosisabhängige Verringerung der Prolaktinkonzentration beobachtet.
Parkinson-Erkrankung
In kontrollierten, klinischen Studien wurde die Wirksamkeit von Pramipexol über 6 Monate untersucht. In Langzeitstudien liegen Erfahrungen bis zu 4 Jahren vor.
Restless Legs Syndrom
Die Wirksamkeit von Pramipexol wurde in vier Placebo-kontrollierten Studien bei ca. 1000 Patienten mit mildem bis sehr schwerem RLS untersucht. In kontrollierten Studien bei Patienten, welche bis zu 12 Wochen behandelt wurden, war Pramipexol wirksam und eine anhaltende Wirksamkeit über einen Zeitraum von 9 Monaten konnte gezeigt werden. Die Wirksamkeit von Pramipexol hielt nach Weiterführung der Studien im open-label Modus über ein Jahr an. In einer weiteren plazebokontrollierten klinischen Studie wurde die Wirksamkeit von Pramipexol über 26 Wochen bei Patienten mit mässigem bis schwerem RLS bestätigt.
Pharmakokinetik
Absorption
Pramipexol wird nach oraler Einnahme rasch und vollständig resorbiert. Die absolute Bioverfügbarkeit ist grösser als 90%.
Maximale Plasmakonzentrationen treten nach Einnahme von Pramipexol Tabletten nach 1-3 Stunden auf.
Bei Einnahme mit Nahrung wird die Bioverfügbarkeit nicht klinisch relevant verändert.
Pramipexol verfügt über eine lineare Kinetik im therapeutischen Dosisbereich.
Die Plasmaspiegel weisen relativ geringe individuelle Schwankungen auf.
Distribution
Im Menschen ist die Proteinbindung von Pramipexol gering (<20%). Das Verteilungsvolumen ist gross (400 l). In Ratten wurde eine hohe Wirkstoff-Konzentration im Gehirn festgestellt (sie betrug ca. das 8-fache der Plasmakonzentration).
Metabolismus
Pramipexol wird im Menschen nur in geringem Ausmass metabolisiert.
Elimination
Die renale Exkretion von unverändertem Pramipexol stellt den wesentlichsten Eliminationsweg dar und gilt für ca. 80% der Dosis. Etwa 90% einer 14C markierten Dosis wird über die Nieren ausgeschieden, weniger als 2% werden im Stuhl nachgewiesen. Die Gesamt-Clearance von Pramipexol beträgt ca. 500 ml/min, die renale Clearance ca. 400 ml/min. Die Eliminationshalbwertszeit (t½) reicht von 8 Stunden bei jungen Patienten bis 12 Stunden bei älteren Patienten.
Kinetik spezieller Patientengruppen
Bei Patienten mit Niereninsuffizienz unterschiedlichen Schweregrades war die Pramipexol-Clearance gut mit der Kreatinin-Clearance korreliert. Bei Patienten mit schwerer Niereninsuffizienz (Kreatinin-Clearance ca. 20 ml/min) war die Pramipexol-Clearance um etwa 75%, bei Patienten mit mässiggradiger Niereninsuffizienz (Kreatinin-Clearance ca. 40 ml/min) um etwa 60% herabgesetzt. Bei Dialyse-Patienten ist die Pramipexol-Clearance extrem niedrig, da Pramipexol durch die Dialyse nur in vernachlässigbar geringem Ausmass eliminiert wird.
Bezüglich der empfohlenen niedrigeren Anfangs- und Erhaltungsdosen wird auf den Abschnitt «Dosierung bei Patienten mit beeinträchtigter Nierenfunktion» verwiesen.
Präklinische Daten
Toxizität nach wiederholter Verabreichung
Studien zur Toxizität bei wiederholter Verabreichung zeigten, dass Pramipexol hauptsächlich auf das ZNS und die weiblichen Fortpflanzungsorgane eine funktionale Wirkung ausübte, die wahrscheinlich aus einem überschiessenden pharmakodynamischen Effekt des Arzneimittels resultierte.
Eine Abnahme des diastolischen und systolischen Blutdrucks und der Herzfrequenz wurden beim Minischwein beobachtet. Eine Tendenz zur Blutdruck senkenden Wirkung wurde beim Affen festgestellt.
Reproduktions- und Entwicklungstoxizität
Die potenziellen Wirkungen von Pramipexol auf die Reproduktion und Entwicklung wurden an Ratten und Kaninchen untersucht. Bei Ratten und Kaninchen erwies sich Pramipexol als nicht teratogen, war aber in maternal-toxischen Dosen bei der Ratte für den Embryo toxisch.
Aufgrund des hypoprolaktinämischen Effektes der Substanz und der besonderen Rolle von Prolaktin in der Fortpflanzungsfunktion bei weiblichen Ratten, sind die Wirkungen von Pramipexol auf die Schwangerschaft und weibliche Fertilität noch nicht vollständig aufgeklärt.
Eine Verzögerung in der sexuellen Entwicklung (d.h. präputiale Trennung und vaginale Öffnung) wurde bei Ratten beobachtet. Die Relevanz für den Menschen ist nicht bekannt.
Genotoxizität und Kanzerogenität
Pramipexol zeigte keine Genotoxizität. In einer Karzinogenitätsstudie entwickelten männliche Ratten Hyperplasien und Adenome der Leydig-Zellen, was mit dem prolaktinhemmenden Effekt von Pramipexol erklärt werden kann. Der Befund ist für den Menschen nicht klinisch relevant. Dieselbe Studie zeigte auch, dass Pramipexol bei einer Dosierung von 2 mg/kg (der Salzform) und höher mit einer Retinadegeneration bei Albinoratten assoziiert war. Letzteres wurde bei pigmentierten Ratten nicht beobachtet, auch nicht in einer 2 Jahre dauernden Karzinogenitätsstudie bei Albinomäusen oder anderen untersuchten Spezies.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Pramipexol Zentiva Tabletten sind bis zur Verwendung in den Original-Blisterstreifen aufzubewahren.
Bei Raumtemperatur (15-25 °C) vor Licht geschützt in der Originalpackung lagern. Das Arzneimittel ist ausserhalb der Reichweite von Kindern aufzubewahren.
Zulassungsnummer
60089 (Swissmedic).
Zulassungsinhaberin
Helvepharm AG, Frauenfeld.
Stand der Information
April 2018.
Composition
Principe actif: Pramipexolum ut Pramipexoli dihydrochloridum monohydricum.
Excipients: Excip. pro compresso.
Forme galénique et quantité de principe actif par unité
1 comprimé à 0,125 mg contient: 0,125 mg de dichlorhydrate de pramipexole monohydraté (correspondant à 0,088 mg de pramipexole base).
1 comprimé sécable à 0,25 mg contient: 0,25 mg de dichlorhydrate de pramipexole monohydraté (correspondant à 0,18 mg de pramipexole base).
1 comprimé sécable à 0,5 mg contient: 0,5 mg de dichlorhydrate de pramipexole monohydraté (correspondant à 0,35 mg de pramipexole base).
1 comprimé sécable à 1,0 mg contient: 1,0 mg de dichlorhydrate de pramipexole monohydraté (correspondant à 0,7 mg de pramipexole base).
Indications/Possibilités d’emploi
Traitement symptomatique de la maladie de Parkinson idiopathique en monothérapie ou en association avec la lévodopa.
Traitement symptomatique du syndrome idiopathique des jambes sans repos (Restless Legs Syndrom = RLS).
Posologie/Mode d’emploi
Les comprimés sont à prendre par voie orale avec un peu d'eau, au cours ou en dehors des repas. La dose journalière, répartie en fractions égales, est à prendre 3 fois par jour.
Maladie de Parkinson
Traitement de départ
En commençant avec une dose initiale de 0,375 mg/jour, augmenter progressivement la posologie de Pramipexol Zentiva tous les 5 à 7 jours.
A condition qu'aucun effet indésirable grave ne se manifeste, la dose sera augmentée jusqu'à l'obtention d'un succès thérapeutique maximal.
Dans une première étape (au plus tôt après une semaine), la dose peut être augmentée de 0,375 mg.
S'il s'avère nécessaire de continuer à augmenter la posologie, la dose journalière peut être augmentée de 0,75 mg par semaine jusqu'à la dose maximale de 4,5 mg/jour.
Traitement d'entretien
La dose individuelle de Pramipexol Zentiva devrait être comprise entre 0,375 et 4,5 mg/jour au maximum.
L'efficacité d'une dose journalière dès 1,5 mg a pu être démontrée au cours des études cliniques, tant chez les patients à un stade précoce qu'à un stade avancé de la maladie. Chez certains patients, un bénéfice thérapeutique supplémentaire peut être recherché en administrant une dose journalière supérieure à 1,5 mg.
Ceci concerne avant tout des patients à un stade avancé de la maladie, chez lesquels on cherche à diminuer la posologie de la lévodopa. Il faut cependant noter que l'incidence et la gravité de la somnolence augmentent pour des dosages supérieurs à 1,5 mg par jour.
Posologie chez les patients traités en association avec la lévodopa
Chez les patients recevant simultanément de la lévodopa, il est conseillé de réduire la dose de lévodopa, aussi bien en phase de traitement initial que pendant la phase d'entretien avec Pramipexol Zentiva, et ce afin d'éviter la possibilité de toute stimulation dopaminergique excessive. Sur la base des données d'une étude contrôlée chez des patients à un stade avancé de la maladie, une réduction de la dose de lévodopa de 25% (ou plus) est conseillée.
Interruption du traitement
Un arrêt brutal du traitement dopaminergique peut conduire au développement d'un syndrome neuroleptique malin.
Pramipexol Zentiva doit être arrêté progressivement, par paliers de 0,75 mg de pramipexole (correspondant à 0,54 mg de la forme base) par jour, jusqu'à la dose journalière de 0,75 mg de de pramipexole (correspondant à 0,54 mg de la forme base). La dose doit ensuite être diminuée de 0,375 mg de pramipexole (correspondant à 0,26 mg de la forme base) par jour (voir la rubrique «Mises en garde et précautions»).
Restless Legs Syndrom
La dose initiale recommandée de Pramipexol Zentiva est de 0,125 mg à prendre une fois par jour 2 à 3 heures avant le coucher. Pour les patients nécessitant un soulagement supplémentaire de leurs symptômes, la dose peut être augmentée tous les 4 à 7 jours, par paliers de 0,125 mg jusqu'à la dose maximale de 0,75 mg par jour.
Arrêt du traitement
Pramipexol Zentiva peut être arrêté sans diminution progressive des doses. Après interruption brutale du traitement, 10% des patients ont présenté un phénomène de rebond des symptômes du RLS. Cet effet est identique pour toutes les doses.
Instructions spéciales pour le dosage
Posologie chez les patients parkinsoniens dont la fonction rénale est réduite
L'élimination du pramipexole est dépendante de la fonction rénale. Le schéma posologique recommandé en début de traitement est le suivant:
Chez les patients dont la clairance de la créatinine est supérieure à 50 ml/min, aucune diminution de la dose journalière ou de la fréquence des prises n'est nécessaire.
Chez les patients dont la clairance de la créatinine est de 20 à 50 ml/min, la dose journalière initiale de Pramipexol Zentiva comprimés doit être réduite à deux prises distinctes en commençant par 0,125 mg chacune (0,25 mg/jour).
La dose maximale de 2,25 mg de pramipexole par jour ne doit pas être dépassée.
Si la clairance de la créatinine est inférieure à 20 ml/min, la dose journalière de Pramipexol Zentiva comprimés doit être administrée en une fois, en commençant par 0,125 mg/jour.
La dose maximale de 1,5 mg de pramipexole par jour ne doit pas être dépassée.
En cas de diminution de la fonction rénale au cours du traitement d'entretien, la dose journalière de Pramipexol Zentiva doit être réduite d'autant de pour-cent que la clairance de la créatinine diminue. Si la clairance de la créatinine diminue par exemple de 30%, la dose journalière de Pramipexol Zentiva doit être réduite de 30%. Lorsque la clairance de la créatinine est de 20 à 50 ml/min, la dose journalière peut être répartie en deux prises; si elle est inférieure à 20 ml/min, la dose journalière peut être administrée en une fois.
Posologie chez les patients RLS dont la fonction rénale est réduite
L'utilisation de pramipexole n'a pas été étudiée chez les patients atteints du syndrome des jambes sans repos et dont la fonction rénale est réduite.
L'élimination du pramipexole est dépendante de la fonction rénale et est étroitement liée à la clairance de la créatinine.
Chez les patients dont la clairance de la créatinine est supérieure à 20 ml/min, aucune diminution de la dose journalière n'est nécessaire.
Lors d'insuffisance rénale sévère (clairance de la créatinine inférieure à 20 ml/min.) et conformément aux recommandations posologiques pour la maladie de Parkinson, la dose journalière de pramipexole doit être réduite d'autant de pour-cent que la clairance de la créatinine diminue.
Posologie chez les patients dont la fonction hépatique est réduite
L'influence possible d'une insuffisance hépatique sur la pharmacocinétique de pramipexole n'a pas été étudiée.
Lors d'une insuffisance hépatique, une diminution de la posologie n'est pas nécessaire, puisqu'environ 90% de la dose absorbée est éliminée par voie rénale.
Posologie chez les enfants et les adolescents
L'efficacité et la sécurité d'emploi du pramipexole n'ont pas été établies chez les enfants et adolescents de moins de 18 ans.
Contre-indications
Hypersensibilité au pramipexole ou à l'un des composants du médicament, hémodialyse.
Mises en garde et précautions
Insuffisance rénale
En cas de prescription de Pramipexol Zentiva à un patient atteint d'insuffisance rénale, il est recommandé de réduire la posologie selon les recommandations formulées dans le chapitre «Posologie/Mode d'emploi».
Hallucinations et confusion
Les hallucinations et la confusion sont des effets indésirables connus lors d'un traitement par des agonistes dopaminergiques et par la lévodopa. Des hallucinations se sont manifestées plus fréquemment chez les patients à un stade avancé de la maladie, recevant pramipexole en même temps que la lévodopa, que chez ceux qui reçoivent pramipexole en monothérapie à un stade précoce de la maladie. Durant le programme de développement clinique pour l'autorisation du syndrome des jambes sans repos, un cas d'hallucination a été rapporté. Il faut informer les patients que des hallucinations (le plus souvent visuelles) peuvent se manifester.
Dyskinésies
Des dyskinésies peuvent se produire au cours du traitement initial par Pramipexol Zentiva, surtout lors de l'utilisation de Pramipexol Zentiva en association avec la lévodopa. Si elles surviennent, il faut réduire la dose de lévodopa.
Endormissement subit et somnolence
Comme lors du traitement par d'autres agonistes de la dopamine et la lévodopa, une somnolence (très fréquente) et un endormissement subit (occasionnel) ont été rapportés sous le traitement par pramipexole, surtout chez les patients souffrant de la maladie de Parkinson. Ces manifestations ont conduit à des accidents ou des accidents manqués de peu lors d'activités dangereuses comme la conduite automobile et peut mettre la vie du patient et d'autres personnes en danger. Généralement, cet endormissement subit survient sans signe annonciateur. Si de tels cas d'endormissement subit sont observés, une réduction de la posologie ou un arrêt du traitement doit être envisagé(e). Les patients sous pramipexole doivent être informés de la mise en danger éventuelle de leur sécurité et de celle d'autrui en cas d'apparition de ces effets indésirables lors de la conduite automobile ou l'utilisation de machines. Il convient de déconseiller ces activités aux patients souffrant de somnolence ou d'endormissement subit. En raison des éventuels effets additifs, il faut recommander une vigilance toute particulière lorsque les patients prennent d'autres médicaments sédatifs ou de l'alcool en même temps que le pramipexole (voir également les rubriques «Interactions», «Effet sur l'aptitude à la conduite et l'utilisation de machines», «Effets indésirables»).
Troubles du contrôle des pulsions et comportements compulsifs
L'addiction au jeu, une augmentation de la libido et une hypersexualité ont été rapportées en cas de maladie de Parkinson traitée par des agonistes de la dopamine, y compris le pramipexole. Les patients et les personnes soignantes doivent être informés que des manifestations supplémentaires sont possibles comme des troubles du contrôle des pulsions ou des comportements compulsifs comme la boulimie, l'hyperphagie et l'achat compulsif. Une réduction de la posologie ou un arrêt progressif du traitement doit être envisagé(e).
Comportement maniaque et délire
Les patients doivent être surveillés régulièrement à la recherche du développement d'une manie et d'un délire. L'attention des patients et des personnes soignantes doit être attirée sur le fait qu'une manie et un délire peuvent survenir chez les patients traités par le pramipexole. Une réduction de la dose ou un arrêt progressif peuvent être envisagés lorsque de tels symptômes surviennent.
Patients avec troubles psychotiques
Les patients atteints de troubles psychotiques ne doivent être traités par des agonistes dopaminergiques que si le bénéfice potentiel domine les risques. L'administration concomitante de médicaments antipsychotiques et de pramipexole est déconseillée (voir «Interactions»).
Patients avec une pathologie cardiaque sévère
La prudence est de rigueur en cas de maladie cardiovasculaire sévère. En raison du risque général d'hypotension orthostatique au cours d'un traitement dopaminergique, il est recommandé de contrôler la pression, particulièrement en début de traitement.
Dystonie
Des patients atteints de la maladie de Parkinson peuvent présenter une dystonie axiale telle que antécolis, camptocormie ou pleurothotonus (syndrome de la tour de Pise). Une dystonie a été rapportée occasionnellement après instauration d'un traitement par antagonistes dopaminergiques, y compris le pramipexole. Cependant, une relation causale claire n'a pas pu être mise en évidence. Une dystonie peut également survenir plusieurs mois après l'initiation ou l'ajustement du traitement médicamenteux. Lors de la survenue d'une dystonie, le traitement dopaminergique doit être contrôlé et, le cas échéant, ajusté.
Contrôles oculaires
Une dégénération de la rétine avec perte de photorécepteurs a été observée chez le rat albinos soumis à un surdosage de pramipexole au cours d'études de cancérogénicité. Ces modifications pathologiques n'ont été observées dans aucune des autres espèces examinées (souris albinos, rats pigmentés, singes, minipigs). Sur la base du mécanisme universel concerné, il convient de ne pas négliger ces informations eu égard à l'homme. Toutefois, les études menées jusqu'ici chez l'homme n'ont pas donné d'indications quant à la survenue de processus semblables.
Des examens oculaires sont recommandés à des intervalles réguliers ou en cas d'apparition de troubles de la vue (voir les rubriques «Effets indésirables» et «Données précliniques»).
Mélanome
Des études épidémiologiques ont montré que les patients atteints de maladie de Parkinson ont un risque plus élevé (2 à 6 fois) de développer un mélanome que la population générale. Il n'est pas encore clair si l'augmentation du risque est à imputer à la maladie de Parkinson ou à d'autres facteurs tels que des médicaments pour le traitement de la maladie. Pour ces raisons évoquées, il est conseillé aux patients et aux médecins traitants de porter attention aux mélanomes lors de l'administration du pramipexole ou d'autres médicaments dopaminergiques.
Syndrome neuroleptique malin
Les symptômes d'un syndrome malin neuroleptique ont été observés suite à l'interruption brusque d'un traitement dopaminergique (voir la rubrique «Posologie/Mode d'emploi, maladie de Parkinson, interruption du traitement»).
Augmentation du syndrome des jambes sans repos
Des rapports de la littérature indiquent que le traitement du syndrome des jambes sans repos par des médicaments dopaminergiques peut provoquer un phénomène d'augmentation des symptômes.
Ceci se manifeste par une apparition plus précoce des symptômes le soir (voire même dans l'après-midi), une aggravation des symptômes et/ou leur propagation à d'autres extrémités. Le cas échéant, un arrêt du traitement par Pramipexol Zentiva ou une adaptation de la thérapie médicamenteuse est alors nécessaire.
Le phénomène d'augmentation a été spécialement examiné au cours d'une étude clinique contrôlée pendant 26 semaines. Une augmentation a été notée chez 11,8% des patients dans le groupe sous pramipexole (n=152) et chez 9,4% des patients dans le groupe sous placebo (n=149). L'analyse de Kaplan-Meier de la durée jusqu'à l'apparition d'une augmentation n'a pas montré de différence significative entre le groupe sous pramipexole et le groupe sous placebo.
Fertilité
Aucune étude sur l'effet du pramipexole sur la fécondité chez l'homme n'a été conduite. Dans les études chez l'animal, le pramipexole a affecté les cycles œstraux et réduit la fertilité des femelles comme cela est attendu avec un agoniste dopaminergique. Cependant, ces études n'ont pas montré d'effets nocifs directs ou indirects sur la fécondité des mâles (voir aussi «Données précliniques»).
Interactions
Liaison aux protéines plasmatiques
Une interaction avec d'autres médicaments influençant la liaison aux protéines ou le métabolisme est improbable.
Inhibiteurs, resp. compétiteurs de l'élimination rénale active
La cimétidine réduit la clairance rénale du pramipexole d'environ 34%, probablement par inhibition du système de transport sécrétoire cationique des tubules rénaux. Le pramipexole et les médicaments qui inhibent la sécrétion tubulaire rénale active ou qui sont excrétés par cette voie peuvent s'influencer mutuellement et conduire à une diminution de la clairance de l'un ou des deux médicaments. Les médicaments qui, outre la cimétidine, appartiennent à cette catégorie sont l'amantatine, le diltiazem, la quinidine, la quinine, la ranitidine, le triamtérène, le vérapamil, la digoxine, le procaïnamide, la zidovudine, le cisplatine et le triméthoprime. Si l'un de ces médicaments est administré conjointement avec Pramipexol Zentiva, il faut prendre garde à tout signe d'hyperstimulation dopaminergique tels que dyskinésies, agitation ou hallucinations. Dans de tels cas, une réduction posologique est indispensable.
Association à la sélégiline et à la lévodopa
La sélégiline et la lévodopa ne modifient pas la pharmacocinétique du pramipexole. Dans une petite étude pharmacocinétique (n = 9) on a constaté que l'étendue de la résorption totale et de l'élimination de la lévodopa n'était pas modifiée par l'administration simultanée de pramipexole. Un traitement combiné peut cependant provoquer une stimulation dopaminergique excessive.
La vitesse d'absorption initiale de la lévodopa a augmenté chez 4 des 9 sujets de l'étude, tous féminins.
Chez les patients atteints de la maladie de Parkinson, il est recommandé de diminuer la posologie de la lévodopa lorsque l'on augmente les doses de Pramipexol Zentiva et de maintenir constante la posologie d'autres antiparkinsoniens (voir «Posologie chez les patients traités en association avec la lévodopa»).
Anticholinergiques et amantadine
On n'a pas testé l'interaction avec les anticholinergiques et l'amantadine.
Etant donné que l'élimination des anticholinergiques a lieu principalement par le métabolisme hépatique, une interaction pharmacocinétique avec le pramipexole est plutôt improblable.
Médicaments antipsychotiques
L'administration concomitante de médicaments antipsychotiques avec le pramipexole est déconseillée, p.ex. lorsqu'il faut s'attendre à des effets antagonistes de la dopamine (voir «Mises en garde et précautions»).
Autres médicaments/Alcool
En raison de possibles effets additifs, la plus grande prudence est de mise lorsque les patients prennent d'autres médicaments sédatifs ou de l'alcool en combinaison avec pramipexole ainsi que lors de l'utilisation concomitante de médicaments augmentant les concentrations plasmatiques du pramipexole (p.ex. la cimétidine).
Grossesse/Allaitement
Grossesse
L'effet du pramipexole sur la grossesse n'a pas été étudié chez l'être humain. Des études réalisées sur des lapins et des rongeurs n'ont pas mis en évidence d'effets tératogènes. Aux doses toxiques pour la mère, le pramipexole s'est également montré toxique pour l'embryon chez le rat (voir la rubrique «Données précliniques»). Pramipexol Zentiva ne doit pas être utilisé durant la grossesse, sauf en cas de nécessité absolue.
Allaitement
Le passage du pramipexole dans le lait maternel n'a pas étudié chez l'être humain. Chez les rats, la concentration du pramipexole et de ses métabolites (mesurée par la radioactivité du 14C) dans le lait maternel était supérieure à celle du plasma.
Le pramipexole inhibant la sécrétion de la prolactine chez l'être humain, il faut s'attendre à une inhibition de la lactation.
En l'absence de données cliniques chez l'homme, Pramipexol Zentiva ne doit, si possible, pas être administré pendant l'allaitement. Si l'utilisation du médicament est inévitable, il convient de cesser l'allaitement.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Le patient doit être conscient du fait que des hallucinations peuvent survenir et influencer l'aptitude à la conduite.
Les patients doivent être prévenus des éventuels effets sédatifs (y compris somnolence et endormissement subit durant les activités quotidiennes) qui ont été associés à Pramipexol Zentiva. Une somnolence et un endormissement subit pouvant avoir des conséquences potentiellement dangereuses, les patients doivent être informés qu'ils devront s'abstenir de conduire, d'utiliser des machines ou d'effectuer d'autres activités à risque. Ceci est valable jusqu'à ce que l'on dispose d'une expérience suffisante avec Pramipexol Zentiva pour pouvoir évaluer si les capacités mentales et/ou motrices sont influencées négativement par Pramipexol Zentiva. En cas de somnolence et d'épisodes d'endormissement subit pendant les activités quotidiennes (par ex. conversations, repas, etc.) qui peuvent survenir à tout moment du traitement, les patients doivent contacter leur médecin (voir aussi «Mises en garde et précautions»).
Effets indésirables
Définition des catégories de fréquence utilisées: très fréquent (≥10%), fréquent (≥1%, <10%), occasionnel (≥0,1%, <1%), rare (>0,01%, <0,1%).
Maladie de Parkinson
Les effets indésirables mentionnés ci-dessous reposent sur l'analyse d'études regroupées, contrôlées contre placebo, ainsi que d'études post-marketing.
Infections et infestations
Occasionnel: pneumonie.
Affections endocriniennes
Occasionnel: sécrétion d'ADH inadéquate*.
En cas d'apparition d'une hyponatrémie, un diagnostic différentiel est recommandé en raison de l'éventualité d'un syndrome caractérisé par une sécrétion d'ADH inadéquate (SIADH) et les autres causes doivent être exclues. Un SIADH peut se manifester cliniquement par exemple par des troubles de la conscience y compris le coma, des hallucinations, des convulsions, des maux de tête, des troubles de la concentration et de la mémoire, des crampes musculaires.
Affections psychiatriques
Fréquent: insomnie, hallucinations, confusion, rêves inhabituels, troubles du comportement se traduisant par des perturbations du contrôle des pulsions et un comportement compulsif.
Occasionnel: troubles de la libido, hypersexualité, idées délirantes, paranoïa, jeu pathologique, achat compulsif, agitation, épisodes boulimiques*, hyperphagie*, délire.
Rare: manie.
Affections du système nerveux
Très fréquent: vertiges (18,4%), dyskinésie (16,8%), somnolence (11,7%).
Fréquent: céphalées.
Occasionnel: hyperkinésie, endormissement subit, syncope, amnésie, antécolis*.
L'incidence de la somnolence augmente pour des dosages supérieurs à 1,5 mg (voir également la rubrique «Mises en garde et précautions»).
Affections oculaires
Fréquent: troubles de la vue incluant la diplopie, vision floue, diminution de l'acuité visuelle.
Affections cardiaques
Occasionnel: défaillance cardiaque*.
Au cours des études cliniques et de l'acquisition de l'expérience suivant sa commercialisation, une insuffisance cardiaque a été rapportée chez des patients sous pramipexole. Au cours d'une étude pharma-épidémiologique, une augmentation du risque d'insuffisance cardiaque a été constatée sous pramipexole par rapport à la non utilisation de ce médicament.
Affections vasculaires
Fréquent: hypotension.
Une hypotension peut apparaître au début du traitement, en particulier lorsque le pramipexole est administré trop rapidement à des doses élevées.
Affections respiratoires, thoraciques et médiastinales
Occasionnel: dyspnée, hoquet.
Affections gastro-intestinales
Très fréquent: nausées (17,8%).
Fréquent: vomissements, constipation.
Affections de la peau et du tissu sous-cutané
Occasionnel: exanthème, prurit et autres réactions d'hypersensibilité.
Troubles généraux et anomalies au site d'administration
Fréquent: œdèmes périphériques, fatigue.
Investigations
Fréquent: perte de poids y compris baisse de l'appétit.
Occasionnel: prise de poids.
* Cet effet indésirable a été observé après la mise du médicament sur le marché. Il y a 95% de chances que sa catégorie de fréquence ne soit pas plus élevée qu'«occasionnelle» mais elle peut être plus faible. Une estimation plus précise de sa fréquence n'est pas possible car cet effet indésirable n'est pas documenté dans les études cliniques avec n=2762 patients traités par le pramipexole et souffrant de la maladie de Parkinson.
Des signes de dépendance pathologique au jeu (jeu pathologique), de libido accrue et d'hypersexualité ont été observés chez des patients traités par des agonistes dopaminergiques, y compris pramipexole, dans le traitement de la maladie de Parkinson, particulièrement à des doses élevées. Ces signes ont généralement régressé après réduction de la dose ou arrêt du traitement. Des cas d'augmentation de la prise de nourriture (hyperphagie) ont également été rapportés.
Syndrome des jambes sans repos
Les effets indésirables mentionnés ci-dessous reposent sur l'analyse d'études regroupées, contrôlées contre placebo avec un total de 1036 patients sous pramipexole et 610 patients sous placebo, ainsi que d'études post-marketing.
Infections et infestations
Occasionnel: pneumonie*.
Affections endocriniennes
Occasionnel: sécrétion d'ADH inadéquate*.
En cas d'apparition d'une hyponatrémie, un diagnostic différentiel est recommandé en raison de l'éventualité d'un syndrome caractérisé par une sécrétion d'ADH inadéquate (SIADH) et les autres causes doivent être exclues. Un SIADH peut se manifester cliniquement par exemple par des troubles de la conscience y compris le coma, des hallucinations, des convulsions, des maux de tête, des troubles de la concentration et de la mémoire, des crampes musculaires.
Affections psychiatriques
Fréquent: insomnie, rêves inhabituels.
Occasionnel: hallucinations, confusion, agitation, troubles de la libido, idées délirantes*, paranoïa*, troubles du comportement* se traduisant par des perturbations du contrôle des pulsions et un comportement compulsif comme les épisodes boulimiques*, l'hyperphagie*, les achats compulsifs*, l'hypersexualité* et le jeu pathologique*, manie* et délire*.
Affections du système nerveux
Fréquent: vertiges, somnolence, céphalées.
Occasionnel: dyskinésie, endormissement subit (voir aussi «Mises en garde et précautions»), syncope, amnésie*, hyperkinésie*, antécolis*.
Affections oculaires
Occasionnel: troubles de la vue incluant la diplopie, vision floue, diminution de l'acuité visuelle.
Affections cardiaques
Occasionnel: défaillance cardiaque*.
Au cours des études cliniques et de l'acquisition de l'expérience suivant sa commercialisation, une insuffisance cardiaque a été rapportée chez des patients sous pramipexole. Au cours d'une étude pharma-épidémiologique, une augmentation du risque d'insuffisance cardiaque a été constatée sous pramipexole par rapport à la non utilisation de ce médicament*.
Affections vasculaires
Occasionnel: hypotension.
Affections respiratoires, thoraciques et médiastinales
Occasionnel: dyspnée, hoquet.
Affections gastro-intestinales
Très fréquent: nausées (12,3%).
Fréquent: vomissements, constipation.
Affections de la peau et du tissu sous-cutané
Occasionnel: exanthème, prurit et autres réactions d'hypersensibilité.
Troubles généraux et anomalies au site d'administration
Fréquent: fatigue.
Occasionnel: œdèmes périphériques.
Investigations
Occasionnel: prise ou perte de poids y compris baisse de l'appétit.
* Cet effet indésirable a été observé après la mise du médicament sur le marché. Il y a 95% de chances que sa catégorie de fréquence ne soit pas plus élevée qu'«occasionnelle» mais elle peut être plus faible. Une estimation plus précise de sa fréquence n'est pas possible car cet effet indésirable n'est pas documenté dans les études cliniques avec n=1395 patients traités par le pramipexole et souffrant du syndrome des jambes sans repos.
Surdosage
Symptômes
On ne dispose pas d'expériences cliniques mentionnant d'importants surdosages. Il faut s'attendre à des effets indésirables en rapport avec le profil pharmacodynamique des agonistes dopaminergiques, par exemple nausées, vomissements, hyperkinésie, hallucinations, agitation et hypotension.
Traitement
On ne connaît aucun antidote pour traiter un surdosage en agonistes dopaminergiques. L'administration d'un neuroleptique peut être indiquée en présence de signes de stimulation nerveuse centrale. Le traitement d'un surdosage peut nécessiter des mesures générales de soutien, ainsi qu'un lavage gastrique, un apport liquidien intraveineux, l'administration de charbon actif et une surveillance de l'ECG.
Le pramipexole n'est éliminé par la dialyse qu'en faible proportion.
Propriétés/Effets
Code ATC: N04BC05
Le pramipexole, substance active de Pramipexol Zentiva, est un agoniste dopaminergique non ergolin qui se lie très sélectivement et spécifiquement aux récepteurs de la dopamine de la sous-famille D2, et préférentiellement aux récepteurs D3. Le pramipexole possède une efficacité intrinsèque complète.
En cas de maladie de Parkinson, le pramipexole diminue les crises motrices en stimulant les récepteurs dopaminergiques situés dans le corps strié.
Les études animales ont montré que le pramipexole inhibe la synthèse, la libération et le turnover de la dopamine. Dans les études animales, le pramipexole protège les neurones dopaminergiques d'une dégénérescence ischémique ou de la neurotoxicité de la métamphétamine.
Le mécanisme d'action exact du pramipexole dans le traitement du syndrome des jambes sans repos (RLS) n'est pas connu. Bien que la physiopathologie du syndrome des jambes sans repos soit largement inconnue, des données neuropharmacologiques suggèrent que le système dopaminergique primaire est impliqué dans ce syndrome.
Des études tomographiques d'émission de positrons (PET) suggèrent qu'un léger dysfonctionnement dopaminergique présynaptique puisse être impliqué dans la pathogénie du syndrome des jambes sans repos.
Les études in vitro montrent que le pramipexole protège les neurones de l'effet neurotoxique de la lévodopa.
On a observé chez les sujets testés une diminution dose-dépendante de la concentration de prolactine.
Maladie de Parkinson
L'efficacité de pramipexole a été étudiée durant 6 mois dans le cadre d'études cliniques contrôlées. Dans les études à long terme, on dispose d'une expérience allant jusqu'à 4 ans.
Syndrome des jambes sans repos (RLS)
L'efficacité du pramipexole a été évaluée dans quatre essais cliniques contrôlés contre placebo chez environ 1000 patients atteints de syndrome idiopathique des jambes sans repos, d'intensité modérée à très sévère. Le traitement s'est avéré efficace dans des études contrôlées chez des patients traités jusqu'à 12 semaines et une efficacité continue sur une période de 9 mois a pu être montré. L'efficacité du pramipexole a persisté lors de la poursuite des études en mode open-label pendant un an. Dans une autre étude contrôlée contre placebo, l'efficacité du pramipexole a été confirmée sur une période de 26 semaines chez des patients souffrant de RLS, de modéré à sévère.
Pharmacocinétique
Absorption
L'absorption du pramipexole administré par voie orale est rapide et complète. La biodisponibilité absolue est supérieure à 90%.
Les concentrations plasmatiques maximales sont atteintes après 1 à 3 heures après la prise de pramipexole comprimés.
La prise avec des aliments ne modifie pas la biodisponibilité de manière cliniquement significative.
La cinétique du pramipexole est linéaire dans le domaine thérapeutique.
Les taux plasmatiques présentent relativement peu de variations individuelles.
Distribution
Chez l'homme, la liaison protéique du pramipexole est faible (<20%). Le volume de distribution est important (400 l). On a mesuré chez les rats des concentrations de principe actif importantes au niveau du cerveau (elles atteignaient environ 8 fois la concentration plasmatique).
Métabolisme
Le pramipexole n'est que faiblement métabolisé chez l'homme.
Elimination
L'excrétion rénale de pramipexole sous forme inchangée représente la principale voie d'élimination; environ 80% de la dose sont ainsi éliminés. Près de 90% d'une dose marquée au 14C sont excrétés par voie rénale, alors que l'on en retrouve moins de 2% dans les fèces. La clairance totale du pramipexole est d'environ 500 ml/min et la clairance rénale d'environ 400 ml/min. La demi-vie d'élimination (t½) va de 8 heures chez les jeunes patients à 12 heures chez les patients âgés.
Cinétique pour certains groupes de patients
Chez les patients souffrant d'insuffisance rénale de sévérité variable, la clairance du pramipexole présentait une bonne corrélation avec la clairance de la créatinine. Chez les patients atteints d'insuffisance rénale grave (clairance de la créatinine d'environ 20 ml/min), la clairance du pramipexole diminuait d'environ 75%; elle s'abaissait d'environ 60% chez les patients souffrant d'insuffisance rénale modérée (clairance de la créatinine d'environ 40 ml/min). La clairance du pramipexole est extrêmement faible chez les patients dialysés, car le pramipexole n'est éliminé par la dialyse qu'en proportion négligeable.
Pour savoir quelles sont les diminutions recommandées pour les doses de départ et les doses d'entretien, veuillez vous référer au paragraphe «Posologie chez les patients dont la fonction rénale est réduite».
Données précliniques
Toxicité après doses réitérées
Les études de toxicité après doses réitérées ont montré que le pramipexole exerce des effets fonctionnels principalement au niveau du système nerveux central et du système génital femelle, probablement par exacerbation de son activité pharmacodynamique.
Une diminution des pressions systolique et diastolique et de la fréquence cardiaque a été observée chez le cobaye; et chez le singe, il a été noté un effet hypotenseur.
Toxicité pour la reproduction et le développement
Les effets potentiels du pramipexole sur la reproduction et le développement ont été étudiés chez le rat et le lapin. Le pramipexole n'a pas montré d'effet tératogène pour ces deux espèces, mais des effets embryotoxiques ont été mis en évidence chez le rat à des doses maternotoxiques.
En raison de l'effet hypoprolactinémiant de la substance et du rôle particulier de la prolactine dans la fonction reproductrice chez le rat femelle, les effets du pramipexole sur la grossesse et la fertilité femelle n'ont pas été entièrement élucidés. Un retard du développement sexuel (séparation préputiale et ouverture du vagin) a été observé chez les rats. La pertinence de ces données chez l'homme n'est pas connue.
Génotoxicité et cancérogénicité
Le pramipexole n'a pas montré d'effet génotoxique. Dans une étude de carcinogénèse, des rats mâles ont développé des hyperplasies et des adénomes des cellules de Leydig, dus à l'effet inhibiteur du pramipexole sur la prolactine. Cette observation n'apparaît pas cliniquement pertinente pour l'homme. Au cours de la même étude, il a été observé que l'administration de pramipexole à des doses supérieures ou égales à 2 mg/kg (de la forme sel) était associée à des dégénérescences de la rétine chez le rat albinos. Cette dernière manifestation n'a pas été mise en évidence chez le rat pigmenté, ni lors d'une étude de carcinogénèse de deux ans chez la souris albinos, ni chez les autres espèces étudiées.
Remarques particulières
Conservation
Le médicament ne peut être utilisé que jusqu'à la date indiquée sur l'emballage par la mention «EXP».
Remarques concernant le stockage
Les comprimés de Pramipexol Zentiva doivent être conservés dans les blisters originaux jusqu'au moment de leur utilisation.
Conserver dans l'emballage original à l'abri de la lumière et à température ambiante (15-25 °C). Conserver le médicament hors de portée des enfants.
Numéro d’autorisation
60089 (Swissmedic).
Titulaire de l’autorisation
Helvepharm AG, Frauenfeld.
Mise à jour de l’information
Avril 2018.
Отзывов (0)

Бесплатная консультация опытного специалиста
Опишите симптомы или нужный препарат – мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой на дом или просто проконсультируем.
Нас 14 специалистов и 0 ботов. Мы всегда будем с вами на связи и сможем связаться в любое время.

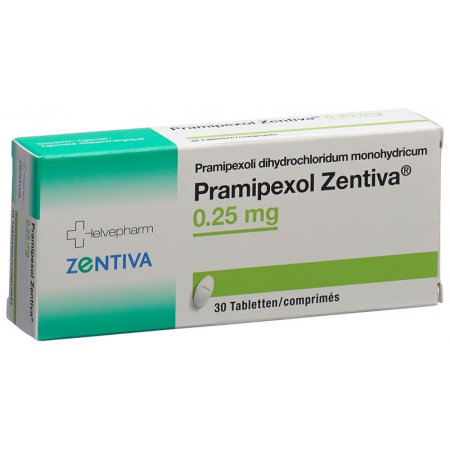
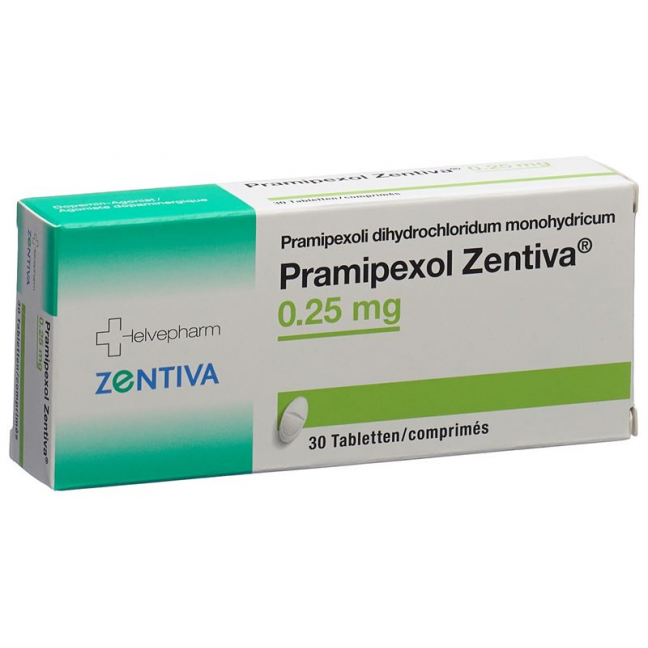

 Deutsch
Deutsch French
French Italian
Italian