ВАЛСАРТАН HCT Зентива фильм таблетка 160/25 мг
VALSARTAN HCT Zentiva Filmtabl 160/25mg
-
11219.89 RUB
При оплате криптовалютой:
Ваша прибыль 1121.99 RUB / 12.94 USDT
- Наличие: Нет в наличии
- Производитель: HELVEPHARM AG
- Модель: 7805693
- ATC-код C09DA03
- EAN 7680614720179
Состав:
Valsartan,
Hydrochlorothiazid,
Cellulose,
mikrokristalline,
Siliciumdioxid,
hochdisperses,
Sorbitol,
Magnesium carbonat,
Stärke vorverkleistert,
Povidon K30,
Natriumstearylfumarat,
Natrium laurylsulfat,
Crospovidon,
Überzug:,
Lactose-1-Wasser,
Hypromellose,
Talkum,
Macrogol 6000,
Eisen(III)-oxid (E172),
Indigocarmin (E132),
Natrium
Варианты
ВАЛСАРТАН HCT Зентива фильм таблетка 160/25 мг
7427.25 RUB
ВАЛСАРТАН HCT Зентива Фильмтаблетка 160/25 мг
7427.25 RUB
Описание
Was ist Valsartan HCT Zentiva und wann wird es angewendet?
Valsartan HCT Zentiva enthält zwei sich ergänzende Wirksubstanzen, die das blutdruckregulierende System des Körpers beeinflussen: Valsartan, das in erster Linie zu einer Erweiterung der Blutgefässe führt und damit den Blutdruck senkt, und Hydrochlorothiazid, welches den Natriumchlorid- und Wassergehalt im Körper vermindert, indem es die Urinausscheidung erhöht.
Valsartan HCT Zentiva wird zur Behandlung des leichten und mittelschweren Bluthochdrucks eingesetzt, bei Patienten, deren Bluthochdruck ein Kombinationspräparat erfordert.
Ihr Arzt oder Ihre Ärztin kann die Wirkung mittels Blutdruckmessung kontrollieren und nachweisen.
Valsartan HCT Zentiva darf nur auf Verschreibung des Arztes oder der Ärztin angewendet werden.
Was sollte dazu beachtet werden?
Wieso sollte ein hoher Blutdruck (Hypertonie) behandelt werden?
Wenn ein hoher Blutdruck nicht behandelt wird, können lebenswichtige Organe wie das Herz, die Nieren und das Hirn geschädigt werden. Sie können sich wohl fühlen und keine Symptome haben, aber die unbehandelte Hypertonie kann zu Spätfolgen wie z.B. Hirnschlag, Herzinfarkt, Herzschwäche, Nierenfunktionsstörungen oder Erblinden führen.
Wann darf Valsartan HCT Zentiva nicht eingenommen / angewendet werden?
Sie dürfen Valsartan HCT Zentiva nicht einnehmen, wenn Sie jemals überempfindlich oder allergisch auf Valsartan, Hydrochlorothiazid oder einen anderen Bestandteil dieses Arzneimittels reagiert haben. Wenn Sie schwanger sind, planen schwanger zu werden oder stillen, oder wenn Sie an einer Zerstörung der kleinen Gallengänge innerhalb der Leber (biliäre Zirrhose), die zu Gallenstauung führt leiden, wenn Sie an Diabetes (Typ 1 und 2) oder eingeschränkter Nierenfunktion leiden, während Sie den blutdrucksenkenden Wirkstoff Aliskiren einnehmen, oder wenn Sie an stark verminderter Harnmenge leiden (Anurie), dürfen Sie Valsartan HCT Zentiva nicht einnehmen. Falls Sie an einem hereditären Angioödem leiden. Falls früher anlässlich der Einnahme eines blutdrucksenkenden Medikamentes Schwellungen im Gesicht, Lippen, Zunge oder im Rachen (Schluck- oder Atembeschwerden) auftraten, dürfen Sie Valsartan HCT Zentiva nicht einnehmen.
Wann ist bei der Einnahme / Anwendung von Valsartan HCT Zentiva Vorsicht geboten?
Wie jedes andere blutdrucksenkende Mittel kann auch Valsartan HCT Zentiva Ihre Aufmerksamkeit und Konzentration herabsetzen. Daher ist Vorsicht im Strassenverkehr und beim Bedienen von Werkzeugen oder Maschinen geboten.
Vorsicht ist geboten,
- wenn Sie an einer Nieren- oder Lebererkrankung, an Allergien oder Asthma leiden.
- Falls bei Ihnen nach der Einnahme von Valsartan HCT Zentiva Reaktionen wie Schwellung im Gesicht, der Arme und Beine, Augen, Lippen oder Zunge (Anzeichen eines Angioödem) auftreten. Sie müssen in diesen Fällen überwacht und eventuell entsprechend behandelt werden.
Ein eventuell bestehender Salz-/Flüssigkeitsmangel - verursacht z.B. durch übermässiges Erbrechen, Durchfall oder Diuretika (harntreibende Mittel) - ist vor Beginn der Behandlung auszugleichen. Möglicherweise wird Ihr Arzt bzw. Ihre Ärztin auch Ihre Nierenfunktion überprüfen.
Vorsicht ist geboten, wenn Sie mit einem ACE-Hemmer oder Aliskiren (Arzneimittel gegen Bluthochdruck) behandelt werden.
Falls Sie einen Sehkraftverlust bemerken oder Augenschmerzen auftreten, kann dies auf eine Flüssigkeitsansammlung im Gefässbett des Auges zurückführbarsein (Aderhauterguss) oder auf eine Druckzunahme im Auge. Dies kann nach Einnahme von Valsartan HCT Zentiva innerhalb von Stunden bis Wochen Zentivaauftreten und kann zu einem permanenten Sehkraftverlust führen, falls nicht rechtzeitig eine Behandlung eingeleitet wird. Falls sie eine Penicillin- oder Sulfonamid-Allergie haben, ist das Risiko einen Aderhauterguss zu erleiden möglicherweise erhöht.
Wenn Sie an Herzschwäche leiden oder einen Herzinfarkt hatten ist ebenfalls Vorsicht geboten. Befolgen Sie die ärztliche Anweisung für die Anfangsdosierung sorgfältig. Ihr Arzt bzw. Ihre Ärztin wird möglicherweise auch Ihre Nierenfunktion überprüfen.
Informieren Sie Ihren Arzt oder Ihre Ärztin vor Beginn der Behandlung mit Valsartan HCT Zentiva wenn Sie an:
- einer leichten bis mittelschweren Nieren- oder Lebererkrankung,
- einem akuten Hautausschlag (Lupus erythematodes),
- Hyperurikämie, Gicht oder Diabetes (Zuckerkrankheit),
- zu tiefem Blut-Kalium- oder Natriumspiegel, oder zu hohem Blut Kalziumspiegel, leiden oder einmal gelitten haben.
- Wenn Sie schon einmal Hautkrebs hatten oder wenn bei Sie im Verlauf der Behandlung eine unerwartete Hautveränderung bemerken. Die Behandlung mit Hydrochlorothiazid (einem der Wirkstoffe von Valsartan HCT Zentiva), insbesondere über längere Zeit und in höherer Dosierung, kann zu einem erhöhten Risiko für bestimmte Arten von Haut- und Lippenkrebs (nicht-melanozytärer, «weisser» Hautkrebs) führen, möglicherweise aufgrund einer Erhöhung der Empfindlichkeit der Haut gegenüber UV-Strahlung. Schützen Sie Ihre Haut während der Behandlung mit Valsartan HCT Zentiva vor Sonnenlicht und UV-Strahlen. Lassen Sie Ihre Haut regelmässig auf neu aufgetretene Hautveränderungen untersuchen und weisen Sie Ihren Arzt bzw. Ihre Ärztin unverzüglich darauf hin, wenn bei Ihnen verdächtige Hautveränderungen aufgetreten sind.
Wechselwirkungen mit anderen Arzneimitteln
Bei gleichzeitiger Anwendung von Valsartan HCT Zentiva mit anderen Arzneimitteln kann es zu Wechselwirkungen kommen (Verstärkung oder Abschwächung der Wirkung von Valsartan HCT Zentiva oder des anderen Arzneimittels oder vermehrte Nebenwirkungen). Dazu gehören: Kaliumhaltige Arzneimittel, kaliumhaltige Salzersatzmittel oder andere Arzneimittel, die das Kalium im Blut erhöhen können (z.B. Heparin zur Blutverdünnung). Ihr Arzt bzw. Ihre Ärztin wird möglicherweise die Menge an Kalium im Blut periodisch überprüfen; Entzündungs- und Schmerzmittel (sogenannte nicht-steroidale Antirheumatika einschliesslich COX-2 Hemmer), Lithium (ein Arzneimittel zur Behandlung gewisser psychischer Erkrankungen), wasserausschwemmende Arzneimittel, ACE-Hemmer oder Aliskiren, kortisonartige Arzneimittel (Steroide), Antiarrhythmika (zur Behandlung von Herzrhythmusstörungen), gewisse Arzneimittel zur Behandlung von Infektionen (Amphotericin B, Penicillin G, Rifamycin-Gruppe), andere blutdrucksenkende Arzneimittel, Digoxin oder andere Digitalis-Glykoside (Herzmittel), Insulin oder antidiabetische Arzneimittel zum Einnehmen, Allopurinol (Gichtmittel), Amantadin (zur Behandlung der Parkinson-Krankheit, auch bei gewissen Virus-Erkrankungen), gewisse Krebs-Arzneimittel, anticholinerge Wirkstoffe (zur Behandlung verschiedener Störungen wie z.B. Magen-Darm-Krämpfe, Krämpfe der Harnblase, Asthma, Reisekrankheit, Muskelkrämpfe, Parkinson-Krankheit und als Hilfsmittel zur Narkose), Colestyramin, Colestipol und andere Harze (zur Behandlung hoher Blutfette), muskelentspannende Arzneimittel, Vitamin D und Kalziumsalze, Ciclosporin (zur Verhinderung der Organabstossung nach Transplantation oder bei anderen Krankheiten wie rheumatoide Arthritis oder Neurodermitis), Ritonavir (antiretrovirales Arzneimittel zur Behandlung von HIV/AIDS Infektionen), Arzneimittel gegen Epilepsie wie Carbamazepin, Diazoxid (Bluthochdruck oder zu tiefem Blutzucker), Lithium, Antidepressiva, Antipsychotika (zur Behandlung bestimmter psychiatrischer Störungen), blutdrucksteigernde Amine (wie Noradrenalin), Barbiturate, Narkotika (einschläfernde Mittel) und Alkohol.
Teilen Sie Ihrem Arzt bzw. Ihrer Ärztin mit, wenn Sie andere Arzneimittel anwenden. Er bzw. sie wird entscheiden, welches Arzneimittel Sie gleichzeitig mit Valsartan HCT Zentiva anwenden können, und eventuell die Dosis eines der Arzneimittel anpassen.
Lactose
Valsartan HCT Zentiva enthält Lactose.Bitte nehmen Sie Valsartan HCT Zentiva erst nach Rücksprache mit Ihrem Arzt bzw. Ihrer Ärztin ein, wenn Ihnen bekannt ist, dass Sie unter einer Zuckerunverträglichkeit leiden.
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Filmtablette, d.h. es ist nahezu «natriumfrei».
Sorbitol (E 420)
Valsartan Zentiva Filmtabletten zu 80/12.5 mg enthalten 9.25 mg Sorbitol, diejenigen zu 160/12.5 mg und 160/25 mg enthalten 18.5 mg Sorbitol pro Filmtablette.
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbstgekaufte!) einnehmen, kürzlich eingenommen haben oder äusserlich anwenden.
Darf Valsartan HCT Zentiva während einer Schwangerschaft oder in der Stillzeit eingenommen / angewendet werden?
Sie dürfen Valsartan HCT Zentiva nicht einnehmen, wenn Sie schwanger sind oder planen, schwanger zu werden.
Ähnliche Arzneimittel wurden mit schweren Schädigungen des ungeborenen Kindes in Verbindung gebracht, vor allem, wenn sie nach dem dritten Schwangerschaftsmonat eingenommen werden. Für Valsartan HCT Zentiva liegen zurzeit noch keine Erfahrungen vor. Deshalb ist es wichtig, dass Sie sofort Ihren Arzt oder Ihre Ärztin aufsuchen, wenn Sie glauben, Sie könnten schwanger sein. Informieren Sie Ihren Arzt oder Ihre Ärztin auch, wenn Sie eine Schwangerschaft planen.
Ist eine Behandlung während der Stillzeit erforderlich, sollte abgestillt werden.
Wie verwenden Sie Valsartan HCT Zentiva?
Ihr Arzt oder Ihre Ärztin entscheidet über die für Sie richtige Dosierung.
Die übliche Dosierung beträgt einmal täglich 1 Filmtablette Valsartan HCT Zentiva 80/12.5 mg (entspricht 80 mg Valsartan und 12.5 mg Hydrochlorothiazid). Bei ungenügender Blutdrucksenkung nach 3-4 Wochen Behandlung, kann zunächst auf Valsartan HCT Zentiva 160/12.5 mg (entspricht 160 mg Valsartan und 12.5 mg Hydrochlorothiazid) und dann anschliessend auf Valsartan HCT Zentiva 160/25 mg (entspricht 160 mg Valsartan und 25 mg Hydrochlorothiazid) erhöht werden.
Die Dosierung ist unabhängig vom Alter. Die Wirksamkeit und Sicherheit der Behandlung bei Kindern und Jugendlichen unter 18 Jahren wurden jedoch nicht überprüft. Deshalb ist die Anwendung von Valsartan HCT Zentiva bei Kindern und Jugendlichen nicht empfohlen.
Valsartan HCT Zentiva wird mit Flüssigkeit eingenommen. Die Einnahme kann unabhängig von einer Mahlzeit erfolgen. Es empfiehlt sich jedoch, Valsartan HCT Zentiva täglich zur selben Zeit (z.B. morgens) einzunehmen.
Haben Sie einmal eine Einnahme vergessen, nehmen Sie die nächste Dosis zur üblichen Zeit ein. Verdoppeln Sie die Dosis nicht!
Unterbrechen Sie nicht von sich aus die Behandlung, ohne dass Ihr Arzt dies angeordnet hat.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin.
Welche Nebenwirkungen kann Valsartan HCT Zentiva haben?
Folgende Nebenwirkungen können bei der Einnahme von Valsartan HCT Zentiva auftreten:
Zu den häufiger genannten unerwünschten Wirkungen gehören Kopfschmerzen, Müdigkeit, Benommenheit, Blutdruckabfall beim Aufstehen, Husten, Schnupfen, Entzündung des Rachens, Infektionen der oberen Atemwege, Appetitlosigkeit, Durchfall, Hautausschlag, Rückenschmerzen, Gelenkschmerzen, Impotenz.
Gelegentlich wurden Virusinfektionen, Fieber, Kraftlosigkeit, Schwindel, Schlaflosigkeit, Angstzustände, Sensibilitätsstörungen, Sehstörungen, Mittelohrentzündung, Ohrensausen, Herzklopfen, schneller Herzschlag, Ödeme, tiefer Blutdruck, übermässiges Schwitzen, Bronchitis, Atemnot, Entzündung der Nasennebenhöhlen, Halsschmerzen, Mundtrockenheit, Austrocknen, Bauchschmerzen, Verdauungsstörungen, Übelkeit und Erbrechen, Schmerzen in den Armen, in den Beinen, im Brustbereich sowie im Nacken, Gelenkentzündung, Verstauchungen und Zerrungen, Muskelkrämpfe, häufiges Wasserlassen, Harnwegsinfekte oder verminderte Libido genannt.
Selten wurden eine Verschlechterung der diabetischen Stoffwechsellage, Depression, Verstopfung, Gelbsucht, Lichtempfindlichkeit, Bindehautentzündungen, Sehschwäche oder Schmerzen in den Augen (hoher Augendruck), Herzrhythmusstörungen, Muskel- oder Nervenschmerzen, stark verminderte Harnmenge (Nierenerkrankung oder Nierenversagen) beobachtet.
Sehr selten kann es zu Ohnmacht, allergischen Überempfindlichkeitsreaktionen mit Schwellung im Gesicht, Rötung oder Juckreiz, zu einer Reaktivierung eines kutanen Lupus erythematodes sowie zu Nierenfunktionsstörungen oder zu Atembeschwerden einschliesslich Lungenentzündung und Lungenödem sowie zu Nasenbluten oder zu starken Oberbauchschmerzen (Pankreatitis) kommen.
Ferner wurde über Blasenbildung auf der Haut, Muskelkrämpfe Schwäche (Asthenie) berichtet sowie über Haut- und Lippenkrebs (nicht-melanozytärer, «weisser» Hautkrebs: Auftreten eines Knotens oder verfärbten Fleckens auf der Haut, der sich auch nach einigen Wochen nicht zurückgebildet hat und über Monate und manchmal Jahre langsam wächst bzw. von rötlichen bis rosafarbenen, festen, krebsbedingten Knoten, die sich zu Geschwüren entwickeln können; krebsbedingte Flecken hingegen sind in der Regel flach und schuppig; tritt häufig an Hautstellen auf, die regelmässig der Sonne ausgesetzt sind, wie z.B. im Gesicht, an den Ohren, Händen, Schultern, am Oberkörper oder Rücken).
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Dies gilt insbesondere auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Darüber hinaus sollten Sie Ihrem Arzt bzw. Ihrer Ärztin umgehend jegliche unerwarteten Veränderungen der Haut zeigen, die Sie während der Behandlung mit Valsartan HCT Zentiva beobachten.
Was ist ferner zu beachten?
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Lagerungshinweis
Das Arzneimittel in der Originalpackung vor Feuchtigkeit geschützt, unterhalb von 25 oC und ausser Reichweite von Kindern aufbewahren.
Weitere Auskünfte
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Valsartan HCT Zentiva enthalten?
Wirkstoffe
Valsartan HCT Zentiva 80/12.5 mg Filmtabletten enthalten 80 mg Valsartan und 12.5 mg Hydrochlorothiazid. Runde, nicht teilbare, rosa Filmtabletten.
Valsartan HCT Zentiva 160/12.5 mg Filmtabletten enthalten 160 mg Valsartan und 12.5 mg Hydrochlorothiazid. Runde, nicht teilbare, braun-rote Filmtabletten.
Valsartan HCT Zentiva 160/25 mg Filmtabletten enthalten 160 mg Valsartan und 25 mg Hydrochlorothiazid. Runde, nicht teilbare, braun-orange Filmtabletten.
Hilfsstoffe
Valsartan HCT Zentiva 80/12.5 mg Filmtabletten: mikrokristalline Cellulose, hochdisperses Siliciumdioxid, Sorbitol (E 420), Magnesiumcarbonat, vorverkleisterte Stärke, Povidon K 30, Natriumstearylfumarat, Natriumdodecylsulfat, Crospovidon.
Überzug: Lactose-Monohydrat, Hypromellose, Macrogol 6000; Talkum, rotes Eisenoxid (E 172), Indigocarmin (E 132).
Valsartan HCT Zentiva 160/12.5 mg Filmtabletten: mikrokristalline Cellulose, hochdisperses Siliciumdioxid, Sorbitol (E 420), Magnesiumcarbonat, vorverkleisterte Stärke, Povidon K 30, Natriumstearylfumarat, Natriumdodecylsulfat, Crospovidon.
Überzug: Lactose-Monohydrat, Hypromellose, Macrogol 6000; Talkum, rotes Eisenoxid (E 172), Indigocarmin (E 132).
Valsartan HCT Zentiva 160/25 mg Filmtabletten: mikrokristalline Cellulose, hochdisperses Siliciumdioxid, Sorbitol (E 420), Magnesiumcarbonat, vorverkleisterte Stärke, Povidon K 30, Natriumstearylfumarat, Natriumdodecylsulfat, Crospovidon.
Überzug: Lactose-Monohydrat, Hypromellose, Macrogol 6000; Talkum, gelbes Eisenoxid (E 172), braunes Eisenoxid (E 172), Indigocarmin (E 132).
Zulassungsnummer
61472 (Swissmedic).
Wo erhalten Sie Valsartan HCT Zentiva? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Valsartan HCT Zentiva 80 mg/12.5 mg: Filmtabletten zu 28 und 98.
Valsartan HCT Zentiva 160 mg/12.5 mg: Filmtabletten zu 28 und 98.
Valsartan HCT Zentiva 160 mg/25 mg: Filmtabletten zu 28 und 98.
Zulassungsinhaberin
Helvepharm AG, Frauenfeld.
Diese Packungsbeilage wurde im September 2020 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Qu'est-ce que Valsartan HCT Zentiva et quand doit-il être utilisé?
Valsartan HCT Zentiva contient deux substances actives complémentaires, qui influencent le système régulant la pression artérielle dans l'organisme. Il s'agit d'une part du valsartan qui produit une baisse de la pression en dilatant les vaisseaux sanguins, et de l'hydrochlorothiazide qui réduit la teneur de l'organisme en chlorure de sodium (sel) et en eau en augmentant l'excrétion urinaire.
Valsartan HCT Zentiva s'utilise pour traiter l'hypertension légère ou modérée, chez des patients lorsqu'un traitement combinant deux substances actives est nécessaire.
Votre médecin en mesurera et en contrôlera l'effet en prenant votre pression artérielle.
Valsartan HCT Zentiva ne doit être pris que sur prescription médicale.
De quoi faut-il tenir compte en dehors du traitement?
Pourquoi faut-il traiter une hypertension artérielle?
Une hypertension artérielle non traitée peut endommager des organes vitaux tels que le cœur, les reins et le cerveau. Vous pouvez vous sentir aujourd'hui en parfaite santé, sans aucune manifestation de maladie – mais une hypertension non traitée peut entraîner des séquelles ultérieures telles qu'un accident vasculaire cérébral, un infarctus du myocarde, une insuffisance cardiaque, une insuffisance rénale ou la cécité.
Quand Valsartan HCT Zentiva ne doit-il pas être utilisé?
Vous ne devez pas prendre Valsartan HCT Zentiva si vous avez eu dans le passé une hypersensibilité ou une allergie au valsartan, à l'hydrochlorothiazide ou à un autre composant du médicament.
De même, vous ne devez pas prendre Valsartan HCT Zentiva pendant la grossesse, si vous programmez une grossesse ou en période d'allaitement, si vous souffrez d'une destruction des voies biliaires de petit calibre dans le foie (cirrhose biliaire) conduisant à un arrêt de l'écoulement de la bile, si vous souffrez d'un diabète (de type 1 ou 2) ou d'une insuffisance rénale, si vous prenez de l'aliskirène, un principe actif abaissant la pression artérielle, ou encore si vous souffrez d'une forte diminution de la quantité d'urine (anurie). Si vous souffrez d'un angio-œdème héréditaire.
Si la prise par le passé de médicaments antihypertenseurs a provoqué chez vous un gonflement du visage, des lèvres, de la langue ou du larynx (troubles de la déglutition ou de la respiration), vous ne devez pas prendre Valsartan HCT Zentiva.
Quelles sont les précautions à observer lors de la prise de Valsartan HCT Zentiva?
Comme tout médicament abaissant la pression artérielle, Valsartan HCT Zentiva peut diminuer votre vigilance et votre concentration. C'est pourquoi la prudence est recommandée dans le trafic routier ou lors du maniement d'outils ou de machines.
La prudence est recommandée
- si vous souffrez d'une maladie des reins, d'une maladie du foie, d'allergies ou d'asthme.
- si vous présentez des réactions telles qu'un gonflement du visage, des bras et des jambes, des yeux, des lèvres ou de la langue (signes d'un angio-œdème) après la prise de Valsartan HCT Zentiva. Dans ces cas, vous devez être surveillé et recevoir éventuellement un traitement approprié.
Un éventuel manque en eau et en électrolytes (sels minéraux) dû par ex. à des vomissements excessifs, à des diarrhées ou à l'emploi de diurétiques, devra être compensé avant le début du traitement. Votre médecin surveillera éventuellement aussi votre fonction rénale.
La prudence est recommandée si vous êtes traité par un inhibiteur de l'ECA ou l'aliskirène (médicaments contre l'hypertension artérielle).
Si vous remarquez une perte de l'acuité visuelle ou des douleurs oculaires, ces symptômes peuvent être dus à une accumulation de liquide dans le lit vasculaire de l'œil (effusion choroïdienne) ou à une augmentation de la pression dans l'œil. Ils peuvent survenir dans les heures ou semaines suivant la prise de Valsartan HCT Zentiva et peuvent mener à une perte d'acuité visuelle permanente s'ils ne sont pas traités à temps. Si vous souffrez d'une allergie à la pénicilline ou aux sulfonamides, le risque d'effusion choroïdienne est éventuellement plus élevé.
La prudence est également recommandée si vous souffrez d'une insuffisance cardiaque ou si vous avez eu un infarctus du myocarde. Suivez attentivement les instructions de votre médecin en ce qui concerne la dose initiale. Votre médecin contrôlera éventuellement aussi votre fonction rénale.
Avant de commencer un traitement par Valsartan HCT Zentiva, veuillez informer votre médecin si vous souffrez ou avez souffert dans le passé:
- d'une maladie des reins ou du foie légère à modérée,
- d'une éruption cutanée aiguë (lupus érythémateux),
- d'hyperuricémie (concentration trop élevée d'acide urique dans le sang), de goutte ou de diabète,
- de taux sanguins de potassium ou de sodium trop bas ou de taux sanguin de calcium trop élevé.
- Si vous avez déjà eu un cancer de la peau ou si vous remarquez une modification inattendue de la peau au cours du traitement. Le traitement par hydrochlorothiazide (un des principes actifs de Valsartan HCT Zentiva), surtout lorsqu'il est administré pendant une longue période et à des doses élevées, peut engendrer un risque accru de certaines formes de cancer de la peau et des lèvres (cancer «blanc» de la peau non mélanome), probablement en raison de l'augmentation de la sensibilité de la peau aux rayons UV. Pendant le traitement par Valsartan HCT Zentiva, protégez votre peau de la lumière du soleil et des rayons UV. Faites régulièrement examiner votre peau et contrôler l'apparition de nouvelles modifications de la peau et signalez immédiatement à votre médecin l'apparition de modifications suspectes de la peau.
Interactions avec d'autres médicaments
L'utilisation simultanée de Valsartan HCT Zentiva et d'autres médicaments peut provoquer des interactions (amplification ou diminution de l'effet de Valsartan HCT Zentiva ou des autres médicaments ou effets indésirables accrus). Il s'agit de: médicaments contenant du potassium, substituts des sels contenant du potassium et autres médicaments qui peuvent élever le taux de potassium sanguin (par ex. héparine pour fluidifier le sang). Votre médecin contrôlera éventuellement la quantité de potassium dans votre sang de manière périodique; médicaments contre l'inflammation ou la douleur (appelés anti-inflammatoires non stéroïdiens y compris inhibiteurs de la COX-2), lithium (un médicament pour le traitement de certaines maladies mentales), médicaments favorisant l'excrétion de l'eau, inhibiteurs de l'ECA ou aliskirène, médicaments à base de cortisone (stéroïdes), antiarythmiques (pour traiter des troubles du rythme cardiaque), certains médicaments pour traiter les infections (amphotéricine B, pénicilline G, groupe des rifamycines), autres médicaments antihypertenseurs, digoxine ou autres glucosides digitaliques (pour le cœur), insuline ou autres antidiabétiques oraux, allopurinol (goutte), amantadine (traitement de la maladie de Parkinson ou de certaines maladies virales), certains médicaments contre le cancer, principes actifs anticholinergiques (traitement de différents troubles comme par ex. les crampes de l'estomac et de l'intestin, les spasmes de la vessie, l'asthme, le mal des transports, les crampes musculaires, la maladie de Parkinson et des narcotiques), coléstyramine, colestipol et autres résines (traitement des taux élevés de graisses dans le sang), myorelaxants (décontractants musculaires), vitamine D et sels de calcium, ciclosporine (pour prévenir un rejet en cas de transplantation ou lors d'autres maladies comme l'arthrite rhumatoïde ou la neurodermite), ritonavir (médicament antirétroviral pour le traitement des infections à VIH (SIDA)), antiépileptiques comme la carbamazépine, diazoxide (hypertension artérielle ou taux sanguin de sucre trop bas), lithium, antidépresseurs, antipsychotiques (traitement de certains troubles psychiatriques), amines augmentant la pression artérielle (comme la noradrénaline), barbituriques (tranquillisants), narcotiques (médicaments induisant le sommeil) et alcool.
Veuillez informer votre médecin, si vous prenez d'autres médicaments. Il décidera des médicaments que vous pourrez prendre en même temps que Valsartan HCT Zentiva, et le cas échéant en adaptera éventuellement les doses.
Lactose
Valsartan HCT Zentiva contient du lactose. Si votre médecin vous a informé(e) d'une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé pelliculé, c.-à-d. qu'il est essentiellement «sans sodium»
Sorbitol (E 420)
Les comprimés pelliculés Valsartan HCT Zentiva à 80/12.5 mg contiennent 9.25 mg de sorbitol, ceux à 160/12.5 mg et 160/25 mg contiennent 18.5 mg de sorbitol.
Veuillez informer votre médecin ou votre pharmacien si
- vous souffrez d'autres maladies,
- vous avez des allergies ou
- vous prenez déjà d'autres médicaments en usage interne ou externe (même en automédication!).
Valsartan HCT Zentiva peut-il être pris pendant la grossesse ou l'allaitement?
Valsartan HCT Zentiva ne doit pas être utilisé pendant la grossesse ou si vous prévoyez de devenir enceinte.
Des médicaments semblables ont été associés à des lésions graves chez le fœtus, notamment lors d'une prise après le troisième mois de la grossesse. Aucune donnée n'est actuellement disponible avec Valsartan HCT Zentiva. Il est donc urgent de consulter votre médecin si vous pensez être enceinte. Signalez également à votre médecin si vous planifiez une grossesse.
Si un traitement s'avère indispensable en période d'allaitement, il faudra arrêter l'allaitement.
Comment utiliser Valsartan HCT Zentiva?
Le médecin fixera la dose qui vous convient.
La posologie habituelle est d'un comprimé pelliculé de Valsartan HCT Zentiva 80/12.5 mg par jour (correspondant à 80 mg de valsartan et 12.5 mg d'hydrochlorothiazide). En cas d'une baisse de la pression insuffisante après 3 à 4 semaines de traitement, le médecin peut vous prescrire Valsartan HCT Zentiva 160/12.5 mg (correspondant à 160 mg de valsartan et 12.5 mg d'hydrochlorothiazide), puis Valsartan HCT Zentiva 160/25 mg (correspondant à 160 mg de valsartan et 25 mg d'hydrochlorothiazide).
La posologie est indépendante de l'âge. L'efficacité et la sécurité du traitement n'ont cependant pas été évaluées chez les enfants et les adolescents de moins de 18 ans. Aussi l'utilisation de Valsartan HCT Zentiva n'est-elle pas recommandée chez les enfants et les adolescents.
Valsartan HCT Zentiva doit être avalé avec un peu de liquide indépendamment des repas. Il est toutefois préférable de prendre Valsartan HCT Zentiva toujours au même moment de la journée (par ex. le matin).
Si vous avez oublié de prendre votre médicament, prenez la prochaine dose comme d'habitude; ne doublez pas la dose!
N'interrompez pas le traitement de votre propre chef, sans que le médecin ne l'ait ordonné.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Quels effets secondaires Valsartan HCT Zentiva peut-il provoquer?
La prise de Valsartan HCT Zentiva peut provoquer des effets secondaires:
Les plus fréquents sont: maux de tête, fatigue, torpeur, chute de tension lors du passage à la station debout, toux, rhume, inflammation de la gorge, infections des voies respiratoires supérieures, manque d'appétit, diarrhée, éruptions cutanées, douleurs dorsales, douleurs articulaires, impuissance.
Occasionnellement, on a rapporté les effets: infections virales, fièvre, manque de force, vertiges, insomnie, angoisses, troubles de la sensibilité, troubles de la vision, otites, bourdonnement d'oreille, palpitations, fréquence cardiaque accélérée, œdèmes, tension artérielle basse, transpiration excessive, bronchite, détresse respiratoire, inflammation des sinus, maux de gorge, sécheresse de la bouche, déshydratation, maux de ventre, troubles de la digestion, nausées et vomissements, douleurs dans les bras, dans les jambes, dans la région de la poitrine et dans la nuque, inflammation articulaire, foulures et claquages, crampes musculaires, mictions fréquentes, infections des voies urinaires ou diminution de la libido.
Dans de rares cas, on a observé une aggravation des troubles métaboliques chez le diabétique, dépression, constipation, jaunisse, sensibilité à la lumière, conjonctivite, faiblesse de la vue ou douleurs dans les yeux (augmentation de la pression intraoculaire), troubles du rythme cardiaque, douleurs musculaires ou des nerfs, forte diminution de la quantité d'urine (maladie des reins ou défaillance rénale).
Dans de très rares cas, un évanouissement, des réactions d'hypersensibilité avec gonflement du visage, rougeurs ou démangeaisons, une réactivation d'un lupus érythémateux cutané, ainsi que des troubles de la fonction rénale ou des difficultés respiratoires allant jusqu'à la pneumonie et l'œdème pulmonaire ainsi que des saignements du nez ou de fortes douleurs épigastriques (pancréatite) peuvent apparaître.
Des cas de cloques sur la peau, de crampes musculaires, de faiblesse (asthénie) ont aussi été rapportés, ainsi que des cas de cancer de la peau et des lèvres (cancer «blanc» de la peau non mélanome: apparition d'un nodule ou d'une tache colorée sur la peau qui ne se résorbe pas au bout de plusieurs semaines et qui s'étend lentement pendant plusieurs mois, voire plusieurs années, ou de nodules rougeâtres à rosâtres solides dus au cancer et pouvant évoluer en ulcères; en revanche, les taches cutanées dues au cancer sont généralement plates et squameuses; elles apparaissent souvent à des endroits de la peau régulièrement exposés au soleil, comme le visage, les oreilles, les mains, les épaules, le torse ou le dos).
Si vous remarquez des effets secondaires qui ne sont pas mentionnés dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
Par ailleurs, vous devez immédiatement montrer à votre médecin d'éventuelles modifications inattendues de la peau que vous observez pendant le traitement avec Valsartan HCT Zentiva.
A quoi faut-il encore faire attention?
Stabilité
Le médicament ne doit être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
Conserver le médicament dans l'emballage original à l'abri de l'humidité, au-dessous de 25 °C et hors de portée des enfants.
Remarques complémentaires
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Valsartan HCT Zentiva?
Principes actifs
Valsartan HCT Zentiva 80/12.5 mg
Comprimés pelliculés à 80 mg de valsartan et 12.5 mg d'hydrochlorothiazide.
Comprimés pelliculés ronds, non sécables, rosés.
Valsartan HCT Zentiva 160/12.5 mg
Comprimés pelliculés à 160 mg de valsartan et 12.5 mg d'hydrochlorothiazide. Comprimés pelliculés ronds, non sécables, brun rouge.
Valsartan HCT Zentiva 160/25 mg
Comprimés pelliculés à 160 mg de valsartan et 25 mg d'hydrochlorothiazide.
Comprimés pelliculés ronds, non sécables, brun orange.
Excipients
Valsartan HCT Zentiva 80/12.5 mg comprimés pelliculés: cellulose microcristalline, silice colloïdale anhydre, sorbitol (E 420), carbonate de magnésium, amidon prégélatinisé, povidone K 30, stéarylfumarate de sodium, laurilsulfate de sodium, crospovidone.
Enrobage: lactose monohydraté, hypromellose, macrogol 6000, talc, oxyde de fer rouge (E 172), carmin d'indigo (E 132).
Valsartan HCT Zentiva 160/12.5 mg comprimés pelliculés: cellulose microcristalline, silice colloïdale anhydre, sorbitol (E 420), carbonate de magnésium, amidon prégélatinisé, povidone K 30, stéarylfumarate de sodium, laurilsulfate de sodium, crospovidone.
Enrobage: lactose monohydraté, hypromellose, macrogol 6000, talc, oxyde de fer rouge (E 172), carmin d'indigo (E 132).
Valsartan HCT Zentiva 160/25 mg comprimés pelliculés: cellulose microcristalline, silice colloïdale anhydre, sorbitol (E 420), carbonate de magnésium, amidon prégélatinisé, povidone K 30, stéarylfumarate de sodium, laurilsulfate de sodium, crospovidone.
Enrobage: lactose monohydraté, hypromellose, macrogol 6000, talc, oxyde de fer jaune (E 172), oxyde de fer brun (E 172), carmin d'indigo (E 132)
Numéro d'autorisation
61472 (Swissmedic).
Où obtenez-vous Valsartan HCT Zentiva? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Valsartan HCT Zentiva 80 mg/12,5 mg: emballages de de 28 et 98 comprimés pelliculés.
Valsartan HCT Zentiva 160 mg/12,5 mg: emballages de de 28 et 98 comprimés pelliculés.
Valsartan HCT Zentiva 160 mg/25 mg: emballages de de 28 et 98 comprimés pelliculés.
Titulaire de l'autorisation
Helvepharm AG, Frauenfeld.
Cette notice d'emballage a été vérifiée pour la dernière fois en septembre 2020 par l'autorité de contrôle des médicaments (Swissmedic).
Che cos'è Valsartan HCT Zentiva e quando si usa?
Valsartan HCT Zentiva contiene due principi attivi che si completano a vicenda e che hanno un influsso sul sistema di regolazione della pressione sanguigna nel corpo: il valsartan, che prima di tutto provoca una dilatazione dei vasi sanguigni e quindi una diminuzione della pressione, e l'idroclorotiazide, che aumenta l'eliminazione di urina, riducendo così il tenore di cloruro di sodio e di acqua nel corpo.
Valsartan HCT Zentiva viene utilizzato per il trattamento dell'ipertensione leggera e media, in pazienti che presentano un'ipertensione che necessita di una terapia con un preparato combinato.
Il suo medico può controllare e documentare l'effetto del medicamento attraverso la misurazione della pressione sanguigna.
Valsartan HCT Zentiva deve essere utilizzato soltanto su prescrizione medica.
Di che cosa occorre inoltre tener conto durante il trattamento?
Perché la pressione troppo elevata (ipertensione) deve essere trattata?
Un'ipertensione trascurata può provocare danni agli organi vitali quali il cuore, i reni o il cervello. Anche se oggi non avverte alcun sintomo e si sente bene, le conseguenze tardive di un'ipertensione trascurata possono essere per esempio il colpo apoplettico, l'infarto miocardico, l'insufficienza cardiaca, le disfunzioni renali o la perdita della vista.
Quando non si può assumere Valsartan HCT Zentiva?
Non deve assumere Valsartan HCT Zentiva nel caso in cui avesse presentato in passato ipersensibilità o allergia al valsartan, all'idroclorotiazide o ad un'altra costituente di questo medicamento. Se è incinta, se sta pianificando una gravidanza, se sta allattando, se soffre di una distruzione dei canalicoli biliari all'interno del fegato (cirrosi biliare) con conseguente ristagno di bile, se soffre di diabete mellito (di tipo 1 o di tipo 2) o di ridotta funzione renale e assume il principio attivo ipotensivo aliskiren o se soffre di una diminuzione eccessiva della quantità di urina (anuria) non deve assumere Valsartan HCT Zentiva. Se soffre di angioedema ereditario. Se ha preso in passato altri medicamenti contro l'ipertensione e se questi medicamenti hanno provocato un edema del viso, delle labbra, della lingua oppure della faringe (disturbi della deglutizione o del respiro) non deve assumere Valsartan HCT Zentiva.
Quando è richiesta prudenza nella somministrazione di Valsartan HCT Zentiva?
Come ogni medicamento antipertensivo, anche Valsartan HCT Zentiva può ridurre l'attenzione e la concentrazione. Perciò si consiglia prudenza nel traffico stradale e nell'impiego di attrezzi o macchinari.
È richiesta prudenza,
- nel caso in cui soffra di malattie renali o epatiche, di allergie o di asma;
- nel caso in cui dopo l'assunzione di Valsartan HCT Zentiva presentasse reazioni quali gonfiore nel viso, delle braccia e delle gambe, degli occhi, delle labbra o della lingua (segni di angioedema). In questi casi è necessario tenerla sotto osservazione ed eventualmente trattarla di conseguenza.
Prima di iniziare il trattamento, è necessario riequilibrare un'eventuale carenza di sali o di liquidi, causata da eccessivo vomito, diarrea o diuretici (farmaci che promuovono l'emissione di urine). È possibile che il medico esamini anche la funzione dei reni.
È richiesta prudenza se è in trattamento con un ACE-inibitore o con aliskiren (medicamento contro l'ipertensione arteriosa).
Se nota una perdita della vista o dolore oculare, ciò può essere dovuto a una raccolta di liquido nel letto vascolare dell'occhio (versamento coroidale) o a un aumento della pressione nell'occhio. Ciò può accadere entro poche ore o settimane dall'assunzione di Valsartan HCT Zentiva e può causare una perdita permanente della vista se il trattamento non è tempestivo. Se soffre di allergia alla penicillina o alla sulfonamide, il rischio di versamento coroidale può aumentare.
Occorre prudenza anche se soffre di insufficienza cardiaca o se ha avuto un infarto cardiaco. Segua scrupolosamente le istruzioni del medico relative al dosaggio iniziale. È possibile che il suo medico controlli anche la sua funzione renale.
Informi il suo medico prima di iniziare il trattamento con Valsartan HCT Zentiva, se soffre o se ha sofferto di:
- un'affezione renale o epatica da leggera a media,
- un'eruzione cutanea acuta (Lupus eritematoso),
- iperuricemia, gotta o diabete,
- ipokaliemia o iponatriemia (concentrazione del potassio o del sodio nel sangue troppo bassa) e di ipercalcemia (concentrazione del calcio nel sangue troppo elevata).
- Se ha già avuto un tumore della pelle in passato o se nota un'alterazione inattesa della pelle durante il trattamento. Il trattamento con idroclorotiazide (uno dei principi attivi di Valsartan HCT Zentiva), soprattutto per periodi di tempo prolungati e a dosaggi elevati, può aumentare il rischio di sviluppare alcuni tipi di tumore della pelle e delle labbra (tumore «bianco» non melanoma), probabilmente a causa della maggiore sensibilità della pelle alle radiazioni UV. Protegga la sua pelle dalla luce solare e dai raggi UV durante il trattamento con Valsartan HCT Zentiva. Faccia controllare regolarmente la sua pelle per eventuali alterazioni cutanee di nuova insorgenza e informi immediatamente il medico se ha sviluppato alterazioni cutanee sospette.
Interazioni con altri farmaci
Durante l'uso concomitante di Valsartan HCT Zentiva con altri farmaci si possono verificare delle interazioni (rinforzo o attenuazione dell'effetto di Valsartan HCT Zentiva o dell'altro farmaco o un aumento degli effetti collaterali). Tra questi farmaci si annoverano: farmaci contenenti potassio, sostitutivi del sale contenenti potassio o altri farmaci che possono aumentare il potassio nel sangue (per es. eparina per diluire il sangue). È possibile che il suo medico controlli periodicamente il livello del potassio nel sangue; farmaci antinfiammatori o analgesici (cosiddetti antireumatici non steroidei, compresi gli inibitori della COX-2), litio (un medicamento per il trattamento di determinate malattie psichiche), farmaci diuretici, ACE-inibitori o aliskiren, farmaci analoghi al cortisone (steroidi), antiaritmici (per trattare i disturbi del ritmo cardiaco), alcuni farmaci usati per il trattamento di infezioni, (amfotericina B, penicillina G, gruppo della rifamicina), altri farmaci ipotensivi, digossina o altri glicosidi digitalici (farmaci per il cuore), insulina o farmaci antidiabetici orali, allopurinolo (farmaco contro la gotta), amantadina (per il trattamento della malattia di Parkinson e anche per alcune patologie virali), alcuni farmaci antineoplastici, principi attivi anticolinergici (per il trattamento di vari disturbi quali per es. spasmi gastro-intestinali, spasmi vescicali, asma, malattia da viaggio (chinetosi), crampi muscolari, malattia di Parkinson e come farmaco ausiliario per la narcosi), colestiramina, colestipolo e altre resine (per il trattamento dei grassi elevati nel sangue), miorilassanti (farmaci per rilassare i muscoli), vitamina D e sali di calcio, ciclosporina (per la prevenzione del rigetto di un organo dopo trapianto o per altre malattie quali l'artrite reumatoide o la neurodermite), ritonavir (medicamento antiretrovirale per il trattamento delle infezioni da HIV (AIDS)), farmaci contro l'epilessia come la carbamazepina (per il trattamento dell'epilessia), diazossido (ipertensione o glicemia troppo bassa), litio, farmaci antidepressivi e antipsicotici (per il trattamento di alcuni disturbi psichiatrici), ammine per aumentare la pressione arteriosa (come ad esempio la noradrenalina), barbiturici, anestetici (farmaci per far addormentare) e alcool.
Nel caso in cui impiegasse altri farmaci, ne informi il suo medico che deciderà quali farmaci potrà impiegare contemporaneamente a Valsartan HCT Zentiva ed eventualmente adeguerà la posologia di uno dei farmaci.
Lattosio
Valsartan HCT Zentiva contiene lattosio. Se il medico le ha diagnosticato una intolleranza ad alcuni zuccheri, lo contatti prima di prendere questo medicamento.
Sodio
Questo medicamento contiene meno di 1 mmol (23 mg) di sodio per compressa pelliculata, cioè essenzialmente «senza sodio».
Sorbitolo (E 420)
Le compresse pelliculate Valsartan HCT Zentiva 80/12.5 mg contengono 9.25 mg di sorbitolo, quelle da 160/12.5 mg e 160/25 mg contengono 18.5 mg di sorbitolo.
Informi il suo medico o il suo farmacista nel caso in cui
- soffre di altre malattie,
- soffre di allergie o
- assume o applica esternamente altri medicamenti (anche se acquistati di sua iniziativa!).
Si può somministrare HCT Zentiva durante la gravidanza o l'allattamento?
Se è incinta o sta pianificando una gravidanza, non deve prendere Valsartan HCT Zentiva.
Medicamenti analoghi sono stati associati a gravi lesioni del nascituro, in particolare se assunti dopo il terzo mese di gravidanza. Fino ad oggi, non sono ancora disponibili esperienze riguardanti Valsartan HCT Zentiva. Perciò è importante che informi immediatamente il suo medico se pensa di essere incinta. Informi il suo medico anche nel caso in cui pianificasse una gravidanza.
Se si rendesse necessario un trattamento durante l'allattamento, occorrerà svezzare il bambino.
Come usare Valsartan HCT Zentiva?
Il suo medico decide sul dosaggio adatto al suo caso.
Il dosaggio abituale è di una compressa pellicolata di Valsartan HCT Zentiva 80/12.5 mg (corrispondente a 80 mg di valsartan e 12.5 mg di idroclorotiazide), una volta al giorno. Nel caso di una diminuzione insufficiente della pressione dopo 3-4 settimane di trattamento si può aumentare il dosaggio dapprima usando Valsartan HCT Zentiva 160/12.5 mg (corrispondente a 160 mg di valsartan e 12.5 mg di idroclorotiazide) e poi Valsartan HCT Zentiva 160/25 mg (corrispondente a 160 mg di valsartan e 25 mg di idroclorotiazide).
La posologia è indipendente dall'età. Tuttavia, l'efficacia e la sicurezza non sono state esaminate nei bambini e negli adolescenti con età inferiore ai 18 anni. Pertanto, l'impiego di Valsartan HCT Zentiva nei bambini e negli adolescenti non è raccomandato.
Valsartan HCT Zentiva va assunto insieme a un liquido. L'assunzione può avvenire indipendentemente dai pasti. Si consiglia tuttavia di assumere Valsartan HCT Zentiva ogni giorno alla stessa ora (per esempio al mattino).
Se una volta avesse dimenticato una compressa, prenda la prossima all'ora stabilita. Non raddoppi la dose!
Non interrompa il trattamento di sua iniziativa, senza che glielo abbia ordinato il medico.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Quali effetti collaterali può avere Valsartan HCT Zentiva?
In seguito all'assunzione di Valsartan HCT Zentiva possono manifestarsi i seguenti effetti collaterali:
fanno parte degli effetti indesiderati più frequentemente menzionati: mal di testa, stanchezza, stordimento, abbassamento della pressione arteriosa nell'alzarsi in piedi, tosse, raffreddore, infiammazione della faringe, infezioni delle vie respiratorie superiori, inappetenza, diarrea, eruzioni cutanee, mal di schiena, dolori articolari, impotenza.
In casi occasionali sono stati osservati infezioni virali, febbre, debolezza, vertigini, insonnia, stati d'ansia, disturbi della sensibilità, disturbi della vista, otite media, ronzio auricolare, palpitazioni, battito cardiaco accelerato, edemi, ipotensione arteriosa, sudorazione eccessiva, bronchite, affanno, sinusiti, mal di gola, secchezza delle fauci, disidratazione, dolori addominali, disturbi della digestione, nausea e vomito, dolori alle braccia, alle gambe, al torace e alla nuca, artrite, distorsioni e stiramenti, crampi muscolari, minzioni frequenti, infezioni delle vie urinarie o diminuzione della libido.
In casi rari sono stati osservati peggioramento del compenso metabolico nei diabetici, depressione, stitichezza, ittero, sensibilità alla luce, congiuntivite, debolezza delle capacità visive o dolori agli occhi (aumento della pressione intraoculare), disturbi del ritmo cardiaco, dolori muscolari, nevralgie e diminuzione eccessiva della quantità di urina (patologia renale o blocco renale).
In casi molto rari possono manifestarsi perdita di coscienza, reazioni di ipersensibilità di origine allergica con gonfiori del viso, arrossamento e prurito, riattivazione di un Lupus eritematoso cutaneo come anche disfunzioni renali o disturbi del respiro inclusa polmonite ed edema polmonare, come anche emorragie dal naso e forti dolori alla parte superiore dell'addome (pancreatite).
Inoltre sono stati documentati formazione di vesciche sulla pelle, crampi muscolari, debolezza (astenia), come pure tumore della pelle e delle labbra (tumore «bianco» non melanoma): comparsa sulla pelle di un nodulo o di una macchia di colore alterato che non scompare nell'arco di qualche settimana e che lentamente, nel corso di mesi e a volte anni, cresce oppure di noduli tumorali solidi, da rossastri a rosa, che possono evolvere in ulcere; le macchie tumorali di norma sono invece piatte e desquamate, per es. in viso, su orecchie, mani, spalle, nella parte alta del corpo o sulla schiena).
Se osserva effetti collaterali qui non descritti dovrebbe informare il suo medico o il suo farmacista.
Inoltre dovrebbe mostrare immediatamente al suo medico o al suo farmacista qualsiasi alterazione inattesa della pelle che dovesse osservare durante il trattamento con Valsartan HCT Zentiva.
Di che altro occorre tener conto?
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazioni per la conservazione
Conservare il medicamento nella confezione originale, al riparo dall'umidità al di sotto dei 25 °C e fuori dalla portata dei bambini.
Ulteriori indicazioni
Il suo medico o il suo farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Valsartan HCT Zentiva?
Principi attivi
Le compresse pellicolate di Valsartan HCT Zentiva 80/12.5 mg contengono 80 mg di valsartan et 12.5 mg di idroclorotiazide.
Compresse rivestite con film di forma rotonda, non divisibili, di colore rosa.
Le compresse pellicolate di Valsartan HCT Zentiva 160/12.5 mg contengono 160 mg di valsartan et 12.5 mg di idroclorotiazide.
Compresse rivestite con film di forma rotonda, non divisibili, di colore marrone-rosso.
Le compresse pellicolate di Valsartan HCT Zentiva 160/25 mg contengono 160 mg di valsartan et 25 mg di idroclorotiazide.
Compresse rivestite con film di forma rotonda, non divisibili, di colore marrone-arancio.
Sostanze ausiliarie
Valsartan HCT Zentiva 80/12.5 mg: Cellulosa microcristallina, silice colloidale anidra, sorbitolo (E 420), magnesio carbonato, amido pregelatinizzato, povidone K 30, sodio stearilfumarato, sodio laurilsolfato, crospovidone.
Rivestimento della compressa: lattosio monoidrato, ipromellosa, macrogol 6000, talco, ossido di ferro rosso (E 172), carminio d'indaco (E 132).
Valsartan HCT Zentiva 160/12.5 mg: Cellulosa microcristallina, silice colloidale anidra, sorbitolo (E 420), magnesio carbonato, amido pregelatinizzato, povidone K 30, sodio stearilfumarato, sodio laurilsolfato, crospovidone.
Rivestimento della compressa: lattosio monoidrato, ipromellosa, macrogol 6000, talco, ossido di ferro rosso (E 172), carminio d'indaco (E 132).
Valsartan HCT Zentiva 160/25 mg: Cellulosa microcristallina, silice colloidale anidra, sorbitolo (E 420), magnesio carbonato, amido pregelatinizzato, povidone K 30, sodio stearilfumarato, sodio laurilsolfato, crospovidone.
Rivestimento della compressa: lattosio monoidrato, ipromellosa, macrogol 6000, talco, ossido di ferro giallo (E 172), ossido di ferro bruno (E 172), carminio d'indaco (E 132).
Numero dell'omologazione
61472 (Swissmedic).
Dove è ottenibile Valsartan HCT Zentiva? Quali confezioni sono disponibili?
In farmacia solo dietro presentazione della prescrizione medica.
Valsartan HCT Zentiva 80 mg/12.5 mg: confezioni da 28 e 98 compresse pellicolate.
Valsartan HCT Zentiva 160 mg/12.5 mg: confezioni da 28 e 98 compresse pellicolate.
Valsartan HCT Zentiva 160 mg/25 mg: confezioni da 28 e 98 compresse pellicolate.
Titolare dell'omologazione
Helvepharm AG, Frauenfeld.
Questo foglietto illustrativo è stato controllato l'ultima volta nel settembre 2020 dall'autorità competente in materia di medicamenti (Swissmedic).
Zusammensetzung
Wirkstoffe
Valsartanum, Hydrochlorothiazidum.
Hilfsstoffe
80/12.5 mg: Cellulosum microcristallinum, Silica colloidalis anhydrica, Sorbitolum 9.25 mg (E 420), Magnesii carbonas, Amylum pregelificatum, Povidonum K 30, Natrii stearylis fumaras, Natrii laurilsulfas, Crospovidonum.
Überzug: Lactosum monohydricum 0.168 mg, Hypromellosum, Talcum, Macrogolum 6000, Ferri oxidum rubrum (E 172), Indigocarminum (E 132).
1 Filmtablette Valsartan HCT Zentiva 80/12.5 mg enthält 0.316 mg Natrium.
160/12.5 mg: Cellulosum microcristallinum, Silica colloidalis anhydrica, Sorbitolum 18.5 mg (E 420), Magnesii carbonas, Amylum pregelificatum, Povidonum K 30, Natrii stearylis fumaras, Natrii laurilsulfas, Crospovidonum.
Überzug: Lactosum monohydricum 0.887 mg, Hypromellosum, Talcum, Macrogolum 6000, Ferri oxidum rubrum (E 172), Indigocarminum (E 132).
1 Filmtablette Valsartan HCT Zentiva 160/12.5 mg enthält 0.623 mg Natrium.
160/25 mg: Cellulosum microcristallinum, Silica colloidalis anhydrica, Sorbitolum 18.5 mg (E 420), Magnesii carbonas, Amylum pregelificatum, Povidonum K 30, Natrii stearylis fumaras, Natrii laurilsulfas, Crospovidonum.
Überzug: Lactosum monohydricum 0.942 mg, Hypromellosum, Talcum, Macrogolum 6000, Ferri oxidum flavum (E 172), Ferri oxidum fuscum (E 172), Indigocarminum (E 132).
1 Filmtablette Valsartan HCT Zentiva 160/25 mg enthält 0.623 mg Natrium.
Darreichungsform und Wirkstoffmenge pro Einheit
Valsartan HCT Zentiva 80/12.5 mg
Filmtabletten zu 80 mg Valsartanum und 12.5 mg Hydrochlorothiazidum.
Runde, nicht teilbare, rosa Filmtabletten.
Valsartan HCT Zentiva 160/12.5 mg
Filmtabletten zu 160 mg Valsartanum und 12.5 mg Hydrochlorothiazidum.
Runde, nicht teilbare, braun-rote Filmtabletten.
Valsartan HCT Zentiva 160/25 mg
Filmtabletten zu 160 mg Valsartanum und 25 mg Hydrochlorothiazidum.
Runde, nicht teilbare, braun-orange Filmtabletten.
Indikationen/Anwendungsmöglichkeiten
Behandlung der essentiellen Hypertonie leichten und mässigen Grades bei Patienten, deren Blutdruck durch eine Monotherapie nicht ausreichend kontrolliert ist.
Dosierung/Anwendung
Die empfohlene Dosierung beträgt 1 Filmtablette Valsartan HCT Zentiva 80/12.5 mg pro Tag. Bei ungenügender Blutdrucksenkung nach 3-4 Wochen Therapie kann eine Fortsetzung der Therapie mit 1 Filmtablette Valsartan HCT Zentiva 160/12.5 mg pro Tag erforderlich sein. Die Behandlung mit 1 Filmtablette Valsartan HCT Zentiva 160/25 mg pro Tag ist auf diejenigen Patienten beschränkt, die unter Valsartan HCT Zentiva 160/12.5 mg keine ausreichende Blutdrucksenkung aufweisen. Der maximale blutdrucksenkende Effekt wird innerhalb von 2 bis 4 Wochen beobachtet.
Die Einnahme von Valsartan HCT Zentiva kann unabhängig von einer Mahlzeit erfolgen. Valsartan HCT Zentiva sollte mit etwas Flüssigkeit eingenommen werden.
Anwendung bei älteren Patienten (über 65 Jahren)
Valsartan HCT Zentiva kann unabhängig vom Alter angewendet werden.
Anwendung bei eingeschränkter Nierenfunktion
Bei Patienten mit eingeschränkter Nierenfunktion kann eine Dosisreduktion erforderlich sein. Wegen des Wirkstoffes Hydrochlorothiazid ist Valsartan HCT Zentiva bei Patienten mit Anurie kontraindiziert (s. «Kontraindikationen») und sollte bei Patienten mit schwerer Niereninsuffizienz (GFR <30 ml/min) mit besonderer Vorsicht angewendet werden (s. «Warnhinweise und Vorsichtsmassnahmen»).
Für die Anwendung bei terminaler Niereninsuffizienz (GFR <10 ml/min) oder Dialysebehandlung liegen keine Erfahrungen für die Anwendung von Valsartan vor.
Anwendung bei eingeschränkter Leberfunktion
Bei Patienten mit eingeschränkter Leberfunktion kann eine Dosisreduktion erforderlich sein. Wegen der Wirkstoffkomponente Hydrochlorothiazid sollte Valsartan HCT Zentiva bei Patienten mit eingeschränkter Leberfunktion mit Vorsicht angewendet werden (s. «Warnhinweise und Vorsichtsmassnahmen»). Wegen der Wirkstoffkomponente Valsartan ist Valsartan HCT Zentiva bei Patienten mit biliärer Zirrhose und Cholestase kontraindiziert.
Anwendung bei Kindern und Jugendlichen
Die Wirksamkeit und Sicherheit von Valsartan HCT Zentiva in der Behandlung von Kindern und Jugendlichen unterhalb von 18 Jahren wurde nicht überprüft.
Kontraindikationen
- Überempfindlichkeit gegenüber Valsartan oder Hydrochlorothiazid, gegenüber einem der anderen Bestandteile von Valsartan HCT Zentiva oder gegenüber Sulfonamid-Derivaten.
- Valsartan HCT Zentiva ist kontraindiziert bei Patienten mit hereditärem Angioödem oder bei denen sich unter einer früheren Behandlung mit einem ACE-Hemmer oder Angiotensin-II-Rezeptor-Antagonisten ein angioneurotisches Oedem entwickelt hatte.
- Schwangerschaft und Stillzeit (s. «Schwangerschaft/Stillzeit»).
- biliäre Zirrhose oder Cholestase.
- Anurie.
- Gleichzeitige Anwendung von Angiotensin-Rezeptorantagonisten (ARB) – einschliesslich Valsartan HCT Zentiva – oder von Angiotensin-Konversionsenzym-Hemmern (ACEI) mit Aliskiren bei Patienten mit Diabetes Mellitus (Typ 1 und Typ 2) sowie Patienten mit eingeschränkter Nierenfunktion (GFR <60 ml/min) (s. Rubrik «Interaktionen», Unterabschnitt «Duale Blockade des RAAS»).
Warnhinweise und Vorsichtsmassnahmen
Elektrolyte
Kalium
Thiazid-Diuretika können eine Hypokaliämie verursachen oder eine vorbestehende Hypokäliamie verschlimmern. Bei Erkrankungen, welche mit erhöhtem Kaliumverlust einhergehen, sollten Thiazide nur mit Vorsicht und unter regelmässiger Kontrolle des Serumkaliums gegeben werden.
Vor Beginn einer Behandlung mit Thiaziden wird die Korrektur einer Hypokaliämie empfohlen. Ein gleichzeitig bestehender Magnesiummangel kann die Korrektur einer Hypokaliämie erschweren. Da Valsartan HCT Zentiva einen Angiotensin-ll-Rezeptor-Antagonisten enthält, ist jede Substitution von Kalium unter der Behandlung mit Valsartan HCT Zentiva abzuwägen und sollte mit Vorsicht erfolgen. Die Kalium-und Magnesiumkonzentrationen sollten regelmässig kontrolliert werden. Alle Patienten, die Thiazid-Diuretika erhalten, sollten hinsichtlich Imbalancen der Elektrolyte überwacht werden.
Natrium
Thiazid-Diuretika können das Neuauftreten einer Hyponatriämie auslösen oder eine vorbestehende Hyponatriämia verschlimmern. Diese kann mit neurologischen Symptomen (Erbrechen, Verwirrtheit, Apathie) einhergehen. Thiazid-Diuretika sollen nur nach Korrektur eines vorbestehenden Hyponatriämie verabreicht werden. Eine regelmässige Überwachung der Natriumkonzentration im Serum sollte erfolgen.
Kalzium
Thiazid-Diuretika verringern die Kalziumausscheidung im Urin und können eine Erhöhung des Serumkalziums verursachen. Thiazid-Diuretika sollten nur nach Korrektur einer vorbestehenden Hyperkalziämie bzw. nach Behandlung der dafür verantwortlichen Erkrankung begonnen werden. Eine regelmässige Überwachung der Kalziumkonzentration im Serum sollte erfolgen.
Volumenmangel
Bei Patienten mit relevantem Volumenmangel kann nach Beginn der Behandlung mit Valsartan HCT Zentiva eine symptomatische Hypotonie auftreten.
Ein bestehender Volumenmangel sollte vor Beginn der Behandlung ausgeglichen werden.
Nierenarterienstenose
Valsartan HCT Zentiva sollte bei Patienten mit einseitiger oder beidseitiger Nierenarterienstenose oder Stenose einer Einzelniere mit grosser Vorsicht angewendet werden, da sich bei solchen Patienten Blutharnstoff- und Serumkreatininwerte erhöhen können.
Niereninsuffizienz
Vorsicht ist geboten bei der Behandlung von Patienten mit eingeschränkter Nierenfunktion. Bei schwer eingeschränkter Nierenfunktion (GFR <30 ml/min) können Thiaziddiuretika ihre diuretische Wirksamkeit verlieren. Die Verabreichung von Valsartan HCT Zentiva bei diesen Patienten sollte deswegen nur nach genauer Prüfung des Nutzen/Risiko-Verhältnisses und unter Kontrolle klinischer und laborchemischer Parameter erfolgen.
Bei Patienten mit eingeschränkter Nierenfunktion (GFR <60 ml/min) ist die gleichzeitige Anwendung von ARB – einschliesslich Valsartan HCT Zentiva – oder ACEI mit Aliskiren kontraindiziert (s. Rubrik «Interaktionen», Unterabschnitt «Duale Blockade des RAAS»).
Für die Anwendung bei terminaler Niereninsuffizienz (GFR <10 ml/min) oder Dialysebehandlung liegen keine Erfahrungen für die Anwendung von Valsartan vor.
Leberinsuffizienz
Vorsicht ist geboten bei der Behandlung von Patienten mit eingeschränkter Leberfunktion. Thiazide können bei diesen Patienten Elektrolytimbalancen, hepatische Enzephalopathien sowie ein hepatorenales Syndrom auslösen. Die Verabreichung von Valsartan HCT Zentiva bei diesen Patienten sollte deswegen nur nach genauer Prüfung des Nutzen/Risiko-Verhältnisses und unter Kontrolle klinischer und laborchemischer Parameter erfolgen. Bei biliärer Zirrhose oder Cholestase ist die Anwendung von Valsartan HCT Zentiva kontraindiziert.
Angioödem
Bei mit Valsartan behandelten Patienten wurden Angioödeme einschliesslich von Schwellungen der Larynx und der Glottis, die zu Behinderungen des Luftstroms und/oder Schwellung des Gesichts, der Lippen, des Rachens und/oder der Zunge führten, festgestellt. Bei einigen dieser Patienten waren bereits zu einem früheren Zeitpunkt Angioödeme bei der Einnahme von anderen Medikamenten einschliesslich von ACE-Hemmern aufgetreten. Die Verabreichung von Valsartan HCT Zentiva muss bei Patienten, bei denen ein Angioödem auftritt, sofort unterbrochen werden und Valsartan HCT Zentiva darf ihnen nicht wieder verabreicht werden.
Systemischer Lupus erythematodes
Thiaziddiuretika, einschliesslich Hydrochlorothiazid, können einen systemischen Lupus erythematodes auslösen oder verschlechtern.
Metabolische Effekte
Valsartan HCT Zentiva kann auf Grund einer verminderten Harnsäure-Clearance die Serumkonzentration von Harnsäure erhöhen und Hyperurikämien verursachen bzw. verschlimmern sowie bei disponierten Patienten Gichtschübe auslösen. Deswegen wird die Anwendung von Valsartan HCT Zentiva bei Patienten mit Hyperurikämie und/oder Gicht nicht empfohlen.
Thiaziddiuretika einschliesslich Hydrochlorothiazid können die Glukosetoleranz stören und eine diabetische Stoffwechsellage verschlechtern. Die Serumspiegel von Cholesterin und Triglyzeriden können unter der Anwendung von Hydrochlorothiazid ansteigen.
Sonstiges
Überempfindlichkeitsreaktionen gegenüber Hydrochlorothiazid treten bei Patienten mit Allergien und Asthma mit grösserer Wahrscheinlichkeit auf.
Aderhauterguss (choroidal effusion), akute Myopie und sekundäres Winkelblockglaukom
Sulfonamide sowie Sulfonamid-Derivat Arzneimittel können eine idiosynkratische Reaktion auslösen, die zu Aderhauterguss (choroidal effusion) mit Gesichtsfeldausfall, vorübergehender Myopie und akutem Winkelverschlussglaukom führen kann. Die Symptome schliessen akut auftretenden Visusverlust oder Augenschmerzen ein und treten typischerweise innerhalb von Stunden bis Wochen nach Therapiebeginn auf. Das unbehandelte Winkelverschlussglaukom kann zu permanentem Visusverlust führen.
Die primäre Therapie besteht im unverzüglichen Absetzen des Arzneimittels. Falls der intraokulare Druck erhöht bleibt, muss eine sofortige medizinische Behandlung oder ein operativer Eingriff erwogen werden. Risikofaktoren für die Entwicklung eines Winkelblockglaukoms können die Anamnese einer Sulfonamid- oder Penicillinallergie sein.
Patienten mit Herzinsuffizienz und früherem Herzinfarkt
Bei Patienten, deren Nierenfunktion von der Aktivität des Renin-Angiotensin-Aldosteron-Systems abhängt (z.B. Patienten mit schwerer Herzinsuffizienz), wurde die Behandlung mit ACE-Hemmern oder Angiotensin-Rezeptor-Antagonisten mit Oligurie und/oder progressiver Azotämie und in seltenen Fällen mit akutem Nierenversagen und/oder Tod in Verbindung gebracht. Bei der Untersuchung von Patienten mit Herzinsuffizienz oder Patienten, die bereits einen Herzinfarkt erlitten haben, sollte die Nierenfunktion immer mit geprüft werden.
Fertilität
Es liegen keine Angaben zur Wirkung Valsartan auf die menschliche Fertilität vor. Bei Untersuchungen an Ratten wurden keine Auswirkungen von Valsartan auf die Fertilität festgestellt (s. «Präklinische Daten»).
Duale Blockade des Renin-Angiotensin-Aldosteron-Systems (RAAS)
(Siehe «Kontraindikationen» und «Interaktionen», Unterabschnitt «Duale Blockade des RAAS».)
Nicht-melanozytärer Hautkrebs (NMSC)
In zwei epidemiologischen Studien, die auf dem dänischen nationalen Krebsregister basierten, wurde mit zunehmender kumulativer Dosis von Hydrochlorothiazid- Exposition ein erhöhtes Risiko für nicht-melanozytären Hautkrebs (NMSC) (Basalzellkarzinom und Plattenepithel-Karzinom) festgestellt. Das Risiko für NMSC scheint bei Langzeitanwendung anzusteigen (siehe Rubrik «Eigenschaften/Wirkungen»). Die photosensibilisierende Wirkung von Hydrochlorothiazid könnte als potentieller Mechanismus an der NMSC- Entwicklung beteiligt sein.
Patienten, die Hydrochlorothiazid anwenden, sind über das NMSC-Risiko zu informieren und müssen angewiesen werden, ihre Haut regelmässig auf neue Läsionen hin zu kontrollieren und jegliche verdächtige Hautveränderungen unverzüglich zu melden. Zur Minimierung des Hautkrebsrisikos sollte den Patienten die Einhaltung von möglichen Präventionsmassnahmen angeraten werden, wie z.B. Einschränkung der Sonnenlicht-/UV-Exposition und Anwendung eines geeigneten Sonnenschutzes im Falle einer Sonnenexposition. Verdächtige Hautveränderungen sollten umgehend untersucht werden, ggf. mittels histologischer Analyse von Biopsien. Ausserdem muss bei Patienten mit einem NMSC in der Vorgeschichte die Anwendung von Hydrochlorothiazid möglicherweise noch einmal überdacht werden (siehe Rubrik «Unerwünschte Wirkungen»).
Lactose
Valsartan HCT Zentiva enthält Lactose.
Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht anwenden.
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Filmtablette, d.h. es ist nahezu «natriumfrei».
Sorbitol (E 420)
Valsartan HCT Zentiva Filmtabletten enthalten Sorbitol. Die additive Wirkung gleichzeitig angewendeter Sorbitol (oder Fructose) -haltiger Arzneimittel und die Einnahme von Sorbitol (oder Fructose) über die Nahrung ist zu berücksichtigen. Der Sorbitolgehalt oral angewendeter Arzneimittel kann die Bioverfügbarkeit von anderen gleichzeitig oral angewendeten Arzneimitteln beeinflussen.
Interaktionen
Interaktionen, die beide Komponenten betreffen
Lithium
Folgende Interaktionen können bei Anwendung beider Komponenten (Valsartan und/oder Hydrochlorothiazid) von Valsartan HCT Zentiva auftreten:
Ein reversibler Konzentrationsanstieg an Lithium im Serum und Lithium-Toxizität wurden bei gleichzeitiger Verabreichung von Lithium und ACE Inhibitoren oder Angiotensin II Rezeptor Antagonisten oder Thiaziden beobachtet. Da Thiazide die renale Lithium-Clearance reduzieren, kann die Lithium Toxizität nach der Anwendung von Valsartan HCT Zentiva erhöht sein. Die genaue Überwachung der Lithium-Konzentration im Serum bei gleichzeitiger Anwendung wird daher empfohlen.
Nicht-steroidale anti-inflammatorische Arzneimittel (NSAIDs) inklusive selektive Cyclooxygenase-2 Inhibitoren (COX2-Inhibitoren):
Die Verabreichung von NSAIDs und COX2-Inhibitoren kann zu einer Minderung des antihypertensiven Effekts von Angiotensin-II-Rezeptor-Antagonisten (AIIRAs) führen. Bei älteren Patienten, Patienten mit Nierenfunktionsstörung und solchen mit Volumenmangel (auch unter Diuretikatherapie) kann die gleichzeitige Verabreichung von NSAIDs (oder COX2-Inhibitoren) mit einem AIIRA das Risiko einer Verschlechterung der Nierenfunktion (inklusive akutem Nierenversagen) erhöhen. Bei solchen Patienten sollten diese Medikamente deswegen nur mit Vorsicht und unter Kontrolle der Nierenfunktion kombiniert werden.
Andere Antihypertensiva: Die Anwendung von Valsartan HCT Zentiva verstärkt die antihypertensive Wirkung anderen blutdrucksenkender Arzneimitteln (z.B. Betablocker, Vasodilatatoren, Kalziumkanalblocker, ACE-Hemmern, Angiotensin Rezeptorblocker (ARB) und Direkte Renin-Inhibitoren (DRIs)).
Valsartan
Duale Blockade des Renin-Angiotensin-Aldosteron-Systems mit ARB, ACEI oder Aliskiren: Die gleichzeitige Gabe von ARB, einschliesslich Valsartan HCT Zentiva, mit anderen auf das RAAS wirkenden Arzneimitteln ist gegenüber einer Monotherapie mit einer erhöhten Inzidenz von Hypotonie, Synkope, Hyperkaliämie und Nierenfunktionsstörungen (einschliesslich akutem Nierenversagen) verbunden. Eine duale Blockade des RAAS durch die gleichzeitige Anwendung von ACE Hemmern, ARB oder Aliskiren wird deshalb nicht empfohlen. Wenn die Therapie mit einer dualen Blockade als absolut notwendig erachtet wird, sollte dies unter Aufsicht eines Spezialisten und unter Durchführung engmaschiger Kontrollen von Nierenfunktion, Elektrolytwerten und Blutdruck erfolgen (s. Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Bei Patienten mit eingeschränkter Nierenfunktion (GFR <60 ml/min) ist die gleichzeitige Anwendung von ARB – einschliesslich Valsartan HCT Zentiva – oder von ACEI mit Aliskiren kontraindiziert (s. Rubrik «Warnhinweise und Vorsichtsmassnahmen» und «Kontraindikationen»).
Bei Patienten mit Diabetes Typ 1 und 2 ist die gleichzeitige Anwendung von ARB – einschliesslich Valsartan HCT Zentiva – oder von ACEI mit Aliskiren kontraindiziert (s. Rubrik «Kontraindikationen»). ACE-Hemmern – einschliesslich Valsartan HCT Zentiva – und Angiotensin-Rezeptorblockern (ARB) sollten bei Patienten mit diabetischer Nephropathie nicht gleichzeitig angewendet werden.
Kalium: Unter der Kombinationsbehandlung von Angiotensin-II-Rezeptor-Antagonisten mit anderen Arzneimitteln, die zu einer Erhöhung des Serumkaliums führen können (z.B. Kaliumsparende Diuretika, Kaliumhaltige Präparate, Heparin), kann das Risiko für eine Hyperkaliämie erhöht sein. Die Gabe von Valsartan, welches in Valsartan HCT Zentiva enthalten ist, sollte in solchen Fällen mit Vorsicht und unter Kontrolle des Kaliumspiegels erfolgen.
Transporter: In-vitro-Untersuchungen mit menschlichem Lebergewebe weisen darauf hin, dass Valsartan ein Substrat des hepatischen Aufnahmetransporters OATP1B1 und des hepatischen Auswärtstransporters MRP2 ist. Deshalb kann die systemische Valsartan-Exposition sich bei gleichzeitiger Verabreichung von Hemmern der Transporter OATP1B1 (Rifampicin, Ciclosporin) bzw. MRP2 (Ritonavir) erhöhen.
Unter Monotherapie mit Valsartan wurden keine klinisch relevanten Wechselwirkungen mit den folgenden Arzneimitteln beobachtet: Cimetidin, Warfarin, Furosemid, Digoxin, Atenolol, Indometacin, Hydrochlorothiazid, Amlodipin, Glibenclamid.
Hydrochlorothiazid
Arzneimittel mit Einfluss auf Serum-Kalium- oder Magnesiumspiegel: Kalium- und/oder Magnesiumverluste können bei gleichzeitiger Gabe von Hydrochlorothiazid mit kaliuretischen Diuretika (z.B. Furosemid), Glukokortikoiden, ACTH, Amphotericin B, Carbenoxolon, Penicillin G, Salicylaten oder Antiarrhythmika verstärkt werden.
Herzglykoside (Digitalis): Eine durch Thiazide verursachte Hypokaliämie oder Hypomagnesiämie kann das Auftreten digitalisbedingter Arrhythmien begünstigen.
Skelettmuskelrelaxantien: Thiaziddiuretika, einschliesslich Hydrochlorothiazid, potenzieren die Wirkung von Skelettmuskelrelaxantien vom Curaretyp.
Antidiabetika: Thiazide können die Glukosetoleranz stören. Eine Dosisanpassung von Insulin und oralen Antidiabetika kann erforderlich sein.
Allopurinol: Die gleichzeitige Gabe von Thiaziddiuretika, einschliesslich Hydrochlorothiazid, kann die Häufigkeit des Auftretens von Überempfindlichkeitsreaktionen auf Allopurinol erhöhen.
Amantadin: Die gleichzeitige Gabe von Thiazid-Diuretika einschliesslich Hydrochlorothiazid kann das Risiko unerwünschter Wirkungen von Amantadin vergrössern.
Diazoxid: Thiazid-Diuretika können die hyperglykämische Wirkung von Diazoxid verstärken.
Antineoplastika (z.B. Cyclophosphamid, Methotrexat): Die gleichzeitige Gabe von Thiazid-Diuretika kann die renale Ausscheidung zytotoxischer Arzneimittel verringern und ihre myelosuppressiven Wirkungen steigern.
Anticholinergika: Die Bioverfügbarkeit von Thiaziddiuretika kann bei einer gleichzeitigen Gabe von Anticholinergika (z.B. Atropin, Biperiden) erhöht werden, wahrscheinlich aufgrund einer verringerten gastrointestinalen Motilität und einer Verzögerung der Magenentleerung. Umgekehrt können prokinetische Arzneimittel wie beispielsweise Cisaprid die Bioverfügbarkeit von Thiazid-Diuretika verringern.
Methyldopa: Bei gleichzeitiger Gabe von Methyldopa mit Hydrochlorothiazid wurden Einzelfälle von hämolytischer Anämie beschrieben.
Ionenaustauscherharze: Die Absorption von Thiazid-Diuretika einschliesslich Hydrochlorothiazid wird durch Cholestyramin oder Colestipol vermindert. Deswegen sollte die Gabe von Hydrochlorothiazid und dem Ionenaustauscherharz zeitversetzt erfolgen. Dabei sollte das Zeitintervall möglichst gross gewählt werden, um die Interaktionen zu minimieren.
Vitamin D: Bei gleichzeitiger Anwendung von Thiaziddiuretika, einschliesslich Hydrochlorothiazid, mit Vitamin D oder Kalziumsalzen kann es zu einem verstärkten Anstieg des Serumkalziumspiegels kommen.
Ciclosporin: Durch die gleichzeitige Anwendung von Ciclosporin wird möglicherweise das Risiko einer Hyperurikämie erhöht und es können Symptome einer Gicht auftreten.
Kalziumsalze: Durch die Erhöhung der tubulären Rückresorption von Kalzium kann die gleichzeitige Anwendung von thiazidartigen Diuretika zu Hyperkalzämie führen.
Arzneimittel mit Einfluss auf den Serum-Natriumspiegel: Die hyponatriämische Wirkung von Diuretika kann durch die gleichzeitige Verabreichung von Arzneimitteln wie Antidepressiva, Antipsychotika, Antiepileptika etc. verstärkt werden. Beim Langzeitgebrauch dieser Arzneimittel ist Vorsicht geboten.
Alkohol, Barbiturate oder Narkotika: Die gleichzeitige Verabreichung von Thiazid-Diuretika mit Alkohol, Barbituraten oder Narkotika kann eine orthostatische Hypotonie verstärken.
Blutdrucksteigernde Amine: Hydrochlorothiazid kann das Ansprechen auf blutdrucksteigernde Amine wie beispielsweise Noradrenalin reduzieren. Die klinische Relevanz dieser Wirkung reicht jedoch für einen Ausschluss ihrer Anwendung nicht aus.
Schwangerschaft/Stillzeit
Schwangerschaft
Valsartan HCT Zentiva wirkt direkt auf die RAAS, deshalb darf Valsartan HCT Zentiva während der Schwangerschaft oder von Frauen, die planen schwanger zu werden, nicht eingenommen werden (s. «Kontraindikationen»). Fachpersonen, welche Arzneimittel verschreiben, die auf das RAAS wirken, sollten Frauen im gebärfähigen Alter über das potentielle Risiko dieser Arzneimittel während der Schwangerschaft informieren.
Aufgrund des Wirkungsmechanismus von Angiotensin-II-Rezeptor-Antagonisten kann ein Risiko für den Embryo und Fötus nicht ausgeschlossen werden. Anhand retrospektiver Daten wurde die Anwendung von ACE-Hemmern im 1. Trimenon mit einem potentiellen Risiko von Geburtsschäden assoziiert. Für Arzneimittel, die direkt auf das Renin-Angiotensin-Aldosteron-System (RAAS) wirken, sind zudem Schädigung und Tod der Föten nach Gabe während des 2. und 3. Trimenons beschrieben worden. Beim Menschen beginnt die fötale Nierenperfusion, welche von der Entwicklung des RAAS abhängig ist, im 2. Trimenon. Demzufolge nimmt das Risiko einer Behandlung mit Valsartan während der Schwangerschaft im 2. und 3. Trimenon zu. Es wurde über Spontanaborte, Oligohydramnion und neonatale Nierenfunktionsstörungen berichtet, wenn schwangere Frauen versehentlich Valsartan eingenommen hatten.
Alle Neugeborenen sollen nach Exposition in utero sorgfältig auf genügende Harnausscheidung, Hyperkaliämie und Blutdruck untersucht werden. Nötigenfalls müssen angebrachte medizinische Massnahmen ergriffen werden, wie z.B. Rehydrierung, um das Arzneimittel aus dem Kreislauf zu entfernen.
Die Exposition gegenüber Thiaziddiuretika, einschliesslich Hydrochlorothiazid, in utero kann einen fötalen oder neonatalen Ikterus oder eine Thrombozytopenie verursachen und ist möglicherweise mit anderen Nebenwirkungen verbunden, als beim Erwachsenen bekannt.
Wird im Verlauf der Behandlung eine Schwangerschaft festgestellt, ist Valsartan HCT Zentiva abzusetzen.
Stillzeit
Im Tierversuch (Ratten) trat Valsartan in die Milch über. Hydrochlorothiazid passiert die Plazenta und geht in die Muttermilch über. Untersuchungen bei Frauen während der Stillzeit liegen nicht vor, weshalb während der Stillzeit nicht mit Valsartan HCT Zentiva behandelt werden sollte.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Wie andere Antihypertonika kann Valsartan HCT Zentiva die Reaktionsfähigkeit, die Fahrtüchtigkeit und die Fähigkeit, Werkzeuge und Maschinen zu bedienen, beeinträchtigen. Es wird zur Vorsicht geraten.
Unerwünschte Wirkungen
Die folgenden unerwünschten Wirkungen wurden in 5 kontrollierten klinischen Prüfungen mit 7616 Patienten beobachtet, wovon 4372 Patienten Valsartan in Kombination mit Hydrochlorothiazid erhielten.
«Sehr häufig» (≥1/10), «häufig» (<1/10, ≥1/100), «gelegentlich» (<1/100, ≥1/1'000), «selten» (<1/1'000, ≥1/10'000), «sehr selten» (<1/10'000), «nicht bekannt» (kann mittels der verfügbaren Daten nicht beurteilt werden).
Infektionen und parasitäre Erkrankungen
Gelegentlich: Virusinfektionen, Fieber.
Stoffwechsel- und Ernährungsstörungen
Gelegentlich: Dehydration.
Nicht bekannt: Hypokaliämie, Hyponaträmie.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen, Müdigkeit, Benommenheit.
Gelegentlich: Asthenie, Schwindel, Schlaflosigkeit, Angstzustände, Parästhesie.
Selten: Depression.
Nicht bekannt: Synkope.
Augenerkrankungen
Gelegentlich: Sehstörungen.
Selten: Konjunktivitis.
Erkrankungen des Ohrs und des Labyrinths
Gelegentlich: Mittelohrentzündung, Tinnitus.
Herz
Gelegentlich: Herzklopfen, Tachykardie.
Gefässe
Gelegentlich: Oedeme, Hypotonie, Hyperhidrose.
Atmungsorgane
Häufig: Husten, Rhinitis, Pharyngitis, Infektionen der oberen Atemwege.
Gelegentlich: Bronchitis, Dyspnoe, Sinusitis, pharyngolaryngeale Schmerzen, Mundtrockenheit.
Sehr selten: Nasenbluten.
Nicht bekannt: Nicht-kardiales Lungenödem.
Gastrointestinale Störungen
Häufig: Durchfall.
Gelegentlich: Bauchschmerzen, Verdauungsstörungen, Übelkeit, Gastroenteritis.
Muskelskelettsystem
Häufig: Rückenschmerzen, Gelenkschmerzen.
Gelegentlich: Schmerzen in Armen oder Beinen, Thoraxschmerzen, Nackenschmerzen, Arthritis, Verstauchungen und Zerrungen, Muskelkrämpfe, Myalgie.
Nieren und Harnwege
Gelegentlich: häufiges Wasserlassen, Harnweginfekte.
Sehr selten: Nierenfunktionsstörungen.
Reproduktionssystem und Brust
Häufig: erektile Dysfunktion.
Allgemeine Störungen
Gelegentlich: Müdigkeit.
Laborbefunde
Nicht bekannt: Neutropenie.
Eine Abnahme des Serumkaliums von mehr als 20% wurde bei 3.7% der mit Valsartan HCT Zentiva behandelten Patienten und bei 3.1% der Patienten, die Plazebo erhielten, gesehen.
Eine Erhöhung des Kreatinins und eine Erhöhung des Stickstoffs aus Blut-Harnstoff (BUN) wurde bei 1.9% resp. 14.7% der mit Valsartan HCT Zentiva behandelten Patienten und bei 0.4% resp. 6.3% der Patienten, die in kontrollierten, klinischen Studien Plazebo erhielten, gesehen.
Die folgenden Ereignisse wurden ebenfalls in klinischen Studien bei Patienten mit Hypertonie unabhängig ihres Kausalzusammenhangs mit der Studienmedikation beobachtet: Hypoästhesie, Grippe, Schlaflosigkeit, Ligamentverrenkung, Muskelzerrung, Nasenverstopfung, Nasopharyngitis, Nackenschmerzen, peripheres Oedem, Nebenhöhlenverstopfung.
Folgende Befunde sind im Zusammenhang mit der Valsartan-Monotherapie aufgetreten, wurden unter Valsartan HCT Zentiva hingegen nicht beobachtet:
In seltenen Fällen kann die Behandlung mit Valsartan mit einem Abfall des Hämoglobins und des Hämatokrits einhergehen. In kontrollierten klinischen Studien wurde eine signifikante Abnahme (>20%) des Hämatokrits bei 0.8% und des Hämoglobins bei 0.4% der Patienten beobachtet. Demgegenüber nahmen unter Placebo die Werte des Hämatokrits oder des Hämoglobins bei 0.1% der Patienten ab.
Neutropenie wurde bei 1.9% der mit Valsartan behandelten Patienten und bei 1.6% der mit ACE-Hemmern behandelten Patienten festgestellt.
In kontrollierten klinischen Studien wurden signifikante Erhöhungen der Blutkonzentrationen von Kreatinin, Kalium und Gesamtbilirubin bei 0.8%, 4.4% bzw. 6% der mit Valsartan behandelten Patienten und bei 1.6%, 6.4% bzw. 12.9% der mit einem ACE-Hemmer behandelten Patienten beobachtet.
Gelegentlich wurde unter Valsartan eine Erhöhung der Leberfunktionswerte festgestellt.
Bei essentieller Hypertonie ist unter der Behandlung mit Valsartan keine spezielle Überwachung der Laborwerte erforderlich.
Seit Markteinführung des Präparates wurde über das Auftreten von Synkope, über sehr seltene Fälle von Angioödem, Rash, Pruritus sowie andere Überempfindlichkeitsreaktionen wie Serumkrankheit und Vaskulitis berichtet. Sehr seltene Fälle von Nierenfunktionsstörungen wurden ebenfalls beobachtet.
Mit unbekannter Häufigkeit wurde über Dermatitis bullous berichtet.
Valsartan
Andere unerwünschte Ereignisse, über die in klinischen Studien mit Valsartan unabhängig von einem kausalen Zusammenhang berichtet wurde, waren:
Häufig: Gelenkschmerzen.
Gelegentlich: Oedeme, Asthenie, Schlaflosigkeit, Rash, verminderte Libido, Schwindel.
Selten: Gastroenteritis, Neuralgie.
Sehr selten: Thrombozytopenie, Herzrhythmusstörung, akutes Nierenversagen.
Ein Einzelfall eines Angioödems wurde beschrieben.
Hydrochlorothiazid
Gutartige, bösartige und unspezifische Neubildungen (einschl. Zysten und Polypen)
Häufigkeit nicht bekannt: nicht-melanozytärer Hautkrebs (Basalzellkarzinom und Plattenepithelkarzinom).
Blut- und Lymphsystem
Selten: Thrombozytopenie, vereinzelt mit Purpura.
Sehr selten: Leukopenie, Agranulozytose, Knochenmarkinsuffizienz, hämolytische Anämie.
Immunsystem
Sehr selten: Nekrotisierende Vaskulitis, Überempfindlichkeitsreaktionen.
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Hypokaliämie, erhöhte Blutlipide.
Häufig: Hyponatriämie, Hypomagnesiämie und Hyperurikämie, Appetitmangel.
Selten: Hyperkalzämie, Hyperglykämie, Glykosurie, Verschlechterung der diabetischen Stoffwechsellage.
Sehr selten: Hypochlorämische Alkalose.
Psychiatrische Störungen
Selten: Schlafstörungen.
Nervensystem
Selten: Kopfschmerzen, Schwindel oder Benommenheit, Depression und Parästhesien.
Augen
Selten: Visusstörungen, besonders in den ersten Behandlungswochen.
Häufigkeit unbekannt: Aderhauterguss (Choroidal effusion).
Herz
Selten: Herzrhythmusstörungen.
Gefässe
Häufig: Orthostatische Hypotonie, die durch Alkohol, Anästhetika oder Sedativa verstärkt werden kann.
Atmungsorgane
Sehr selten: Atembeschwerden einschliesslich Pneumonitis und Lungenödem.
Gastrointestinale Störungen
Häufig: leichte Übelkeit und Erbrechen.
Selten: Abdominalbeschwerden, Obstipation, Diarrhoe.
Sehr selten: Pankreatitis.
Leber und Galle
Selten: Cholestase oder Ikterus.
Haut
Häufig: Urtikaria und andere Formen von Hautausschlag.
Selten: Photosensibilisierung.
Sehr selten: toxisch epidermale Nekrolyse, Lupus erythematodes-ähnliche Reaktionen der Haut, Reaktivierung eines kutanen Lupus erythematodes.
Reproduktionssystem und Brust
Häufig: Impotenz.
Unerwünschte Wirkungen aus den Erfahrungen nach der Markteinführung
Die folgenden unerwünschten Wirkungen wurden im Rahmen der Erfahrungen nach der Markteinführung identifiziert. Da diese Wirkungen freiwillig von einer Population unbekannter Grösse gemeldet werden, ist es nicht immer möglich, die Häufigkeit zuverlässig abzuschätzen.
Häufigkeit unbekannt: Akutes Nierenversagen, Nierenfunktionsstörung, aplastische Anämie, Erythema multiforme, Pyrexie, Muskelspasmen, Schwächegefühl, akute Myopie und akutes Winkelblockglaukom.
Beschreibung ausgewählter unerwünschter Wirkungen
Nicht-melanozytäre Malignome der Haut (NMSC) (Basalzellkarzinom und Plattenepithelkarzinom): Basierend auf den verfügbaren Daten aus epidemiologischen Studien wurde ein von der kumulativen Dosis abhängiger Zusammenhang zwischen Hydrochlorothiazid-Exposition und NMSC-Entwicklung beobachtet (siehe die Rubriken «Warnhinweise und Vorsichtsmassnahmen» und «Eigenschaften/Wirkungen»).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Überdosierung mit Valsartan kann sich in einer ausgeprägten Hypotonie äussern, welche wiederum zu Bewusstseinseinschränkung, Kreislaufkollaps und/oder Schock führen kann.
Ausserdem können die folgenden Anzeichen und Symptome aufgrund einer Überdosierung mit Hydrochlorothiazid auftreten: Übelkeit, Schläfrigkeit, Hypovolämie, Elektrolytstörungen, verbunden mit Arrhythmien und Muskelspasmen.
In allen Fällen einer Überdosierung sollten allgemeine unterstützende Massnahmen eingeleitet werden. Diese können eine engmaschige Überwachung der Herz-Kreislauf-Funktion und Massnahmen zu deren Stabilisierung umfassen.
Valsartan kann aufgrund der starken Plasmaproteinbindung durch Hämodialyse nicht entfernt werden. Hydrochlorothiazid dagegen kann durch Dialyse entfernt werden.
Eigenschaften/Wirkungen
ATC-Code
C09DA03
Valsartan
Das aktive Hormon des Renin-Angiotensin-Aldosteron-Systems (RAAS) ist Angiotensin II, das durch das Angiotensin-Converting-Enzym (ACE) aus Angiotensin I gebildet wird. Angiotensin II bindet an spezifische Rezeptoren, die sich in den Zellmembranen verschiedener Gewebe befinden. Es besitzt eine Vielzahl physiologischer Wirkungen, insbesondere beeinflusst es direkt und indirekt die Regulierung des Blutdrucks. Angiotensin II ist ein starker Vasokonstriktor und hat eine direkte pressorische Wirkung. Ausserdem fördert es die Natriumretention und stimuliert die Aldosteron-Sekretion.
Valsartan ist ein oral wirksamer und spezifischer Angiotensin-II-Antagonist. Valsartan besitzt eine selektive Wirkung auf den AT1-Rezeptor-Subtyp, der für die bekannten Effekte von Angiotensin II verantwortlich ist. Die erhöhten Plasmaspiegel von Angiotensin II nach AT1-Rezeptor-Blockade durch Valsartan können die freien AT2-Rezeptoren stimulieren. Dies scheint der Wirkung des AT1-Rezeptors zusätzlich entgegenzuwirken. Valsartan übt keinerlei partiell agonistische Aktivität am AT1-Rezeptor aus. Seine Affinität für den AT1-Rezeptor ist ungefähr 20'000-fach stärker als für den AT2-Rezeptor.
Valsartan hemmt das ACE (= Kininase II), das Enzym, welches Angiotensin I zu Angiotensin II konvertiert und Bradykinin abbaut, nicht. Es ist unwahrscheinlich, dass Angiotensin-II-Antagonisten Hustenreiz verursachen, da sie weder auf ACE wirken noch Bradykinin oder Substanz P verstärken.
In vergleichenden klinischen Studien mit Valsartan und einem ACE-Hemmer war die Häufigkeit von trockenem Husten bei Patienten, die mit Valsartan behandelt wurden, signifikant geringer (p <0.05) als bei denen, die mit einem ACE-Hemmer behandelt wurden (2.6% vs. 7.9%). In einer klinischen Studie an Patienten, bei denen zuvor unter der Therapie mit einem ACE-Hemmer trockener Husten aufgetreten war, kam es unter Valsartan bei 19.5%, unter einem Thiaziddiuretikum bei 19.0% und unter einem ACE-Hemmer bei 68.5% der Patienten zu Husten (p <0.05). In kontrollierten klinischen Studien betrug die Häufigkeit von Husten bei Patienten, die mit einer Kombination von Valsartan und Hydrochlorothiazid behandelt wurden, 2.9%.
Valsartan hat keine Wirkung auf andere Hormonrezeptoren oder Ionenkanäle mit bekannter Bedeutung für die kardiovaskuläre Regulation.
Valsartan senkt bei Patienten mit Hypertonie den Blutdruck, ohne die Pulsfrequenz zu beeinflussen.
Bei den meisten Patienten setzt die antihypertensive Wirkung innerhalb von 2 h nach Verabreichung einer oralen Einzeldosis ein; die maximale Blutdrucksenkung wird nach 4-6 h erreicht. Die antihypertensive Wirkung hält nach Einnahme über 24 h an. Die maximale Blutdrucksenkung wird im Allgemeinen 2-4 Wochen nach Therapiebeginn erreicht und bei Langzeittherapie aufrechterhalten. Die Kombination mit Hydrochlorothiazid führt zu einer signifikanten zusätzlichen Blutdrucksenkung.
Absetzen von Valsartan führt zu keinem schnellen Blutdruckanstieg (Rebound) oder anderen unerwünschten Ereignissen.
Valsartan verändert die Nüchternwerte von Gesamtcholesterin, Triglyceriden, Serumglukose oder Harnsäurespiegel bei Hypertonikern nicht.
Hydrochlorothiazid
Der hauptsächliche Wirkort von Thiaziddiuretika ist der frühdistale Tubulus. Es konnte gezeigt werden, dass sich in der Nierenrinde ein Rezeptor mit hoher Affinität befindet, der die primäre Bindungsstelle und den Wirkort von Thiaziddiuretika, die den NaCl-Transport im frühdistalen Tubulus hemmen, darstellt. Die Wirkung der Thiazide erfolgt durch Hemmung des Na+Cl--Symports. Möglicherweise erfolgt durch eine kompetitive Besetzung der Cl--Bindungsstelle eine Beeinflussung der Elektrolytreabsorption: Direkt kommt es dadurch zu einer Zunahme der Ausscheidung von Natrium und Chlorid in äquivalenten Mengen. Indirekt kommt es zu einer Reduktion des Plasmavolumens und nachfolgend zu einer Zunahme der Plasma-Renin-Aktivität, einer Zunahme der Aldosteronsekretion, einer verstärkten Ausscheidung von Kalium und einer verminderten Serumkalium-Konzentration.
Die Verbindung Renin-Aldosteron ist Angiotensin II vermittelt, so dass die gleichzeitige Gabe eines Angiotensin-II-Rezeptor-Antagonisten dazu führt, den mit Thiaziden verbundenen Kaliumverlust zu vermindern.
Nicht-melanozytärer Hautkrebs
Vorliegende Daten aus epidemiologischen Studien weisen auf einen von der kumulativen Dosis abhängigen Zusammenhang zwischen Hydrochlorothiazid- Exposition und NMSC-Entwicklung hin. Eine Studie umfasste eine Population mit 71'533 Fällen von Basalzellkarzinom und 8'629 Fällen von Plattenepithelkarzinom sowie 1'430'833 bzw. 172'462 entsprechende Populationskontrollen. Eine starke Exposition von Hydrochlorothiazid (kumulative Dosis ≥50'000 mg) war mit einer adjustierten OR von 1.29 (95% KI: 1.23-1.35) für ein Basalzellkarzinom und 3.98 (95% KI: 3.68-4.31) für ein Plattenepithelkarzinom assoziiert. Sowohl beim Basalzellkarzinom als auch beim Plattenepithelkarzinom wurde eine eindeutige kumulative Dosis-Wirkungs-Beziehung festgestellt. In einer weiteren Studie wurde ein möglicher Zusammenhang zwischen Lippenkarzinom (Plattenepithelkarzinom) und der Exposition gegenüber Hydrochlorothiazid aufgezeigt: 633 Fälle von Lippenkarzinom und 63'067 entsprechende Populationskontrollen wurden unter Verwendung einer «Risk-Set-Sampling»-Strategie miteinander verglichen. Es konnte eine eindeutige kumulative Dosis-Wirkungs-Beziehung mit einer Zunahme der adjustierten OR von 2.1 (95% KI: 1.7-2.6) auf 3.9 (3.0-4.9) bei hoher kumulativer Dosis (≥25'000 mg) bzw. auf eine OR von 7.7 (5.7-10.5) bei der höchsten kumulativen Dosis (≥100'000 mg) nachgewiesen werden. Beispiel: Eine kumulative Dosis von 100'000 mg entspricht der täglichen Anwendung einer definierten Tagesdosis von 25 mg über einen Zeitraum von >10 Jahren (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen» und «Unerwünschte Wirkungen»)
Pharmakokinetik
Valsartan
Absorption
Nach oraler Einnahme von Valsartan wird die Peak-Plasmakonzentration (Cmax) innerhalb von 2-4 Stunden erreicht. Die mittlere absolute Bioverfügbarkeit von Valsartan beträgt 23% (Streubereich 23 ± 7). Im untersuchten Dosierungsbereich ist die Pharmakokinetik von Valsartan linear. Bei einmal täglicher Einnahme akkumuliert Valsartan nur gering. Die Plasmakonzentrationen waren bei Männern und Frauen ähnlich.
Durch die Einnahme während einer Mahlzeit wird die Fläche unter der Plasmakonzentrationskurve (AUC) von Valsartan um 48% und Cmax um 59% verringert. Allerdings sind die Plasmakonzentrationen ab 8 h nach Einnahme von Valsartan nüchtern oder mit einer Mahlzeit vergleichbar. Die Verringerung von AUC und Cmax bewirkt keine klinisch signifikante Verminderung der therapeutischen Wirkung, so dass die Einnahme von Valsartan unabhängig von einer Mahlzeit erfolgen kann.
Distribution
Valsartan wird stark (zu 94-97%) an Serumproteine, vor allem an Albumin, gebunden. Der Steady-state wird innerhalb 1 Woche erreicht. Das Verteilungsvolumen im Steady-state nach intravenöser Verabreichung von Valsartan beträgt ungefähr 17 l, was darauf hinweist, dass Valsartan sich nicht extensiv in die Gewebe verteilt.
Verglichen mit der Leberdurchblutung (ungefähr 30 l/h) erfolgt die Plasma-Clearance relativ langsam (ungefähr 2 l/h).
Metabolismus
Valsartan wird nicht in hohem Ausmass biologisch umgewandelt, da nur ungefähr 20% der Dosis als Metaboliten wiedergefunden wird. Ein Hydroxymetabolit wurde im Plasma in tiefen Konzentrationen identifiziert (weniger als 10% der Valsartan AUC). Dieser Metabolit ist pharmakologisch inaktiv.
Elimination
Valsartan zeigt eine multiexponentielle Abbaukinetik (primäre Halbwertszeit <1 h und terminale Halbwertszeit Beta etwa 9 h). Valsartan wird vorwiegend in die Faeces (ungefähr 83% der Dosis) und in den Urin (ungefähr 13% der Dosis) ausgeschieden, hauptsächlich in unveränderter Form. Nach intravenöser Gabe beträgt die Plasma-Clearance von Valsartan ungefähr 2 l/h und seine renale Clearance 0.62 l/h (ungefähr 30% der Gesamtclearance). Die Halbwertszeit von Valsartan beträgt 6 h.
Hydrochlorothiazid
Absorption
Nach oraler Gabe wird Hydrochlorothiazid schnell resorbiert (tmax ca. 2 h).
Innerhalb des therapeutischen Bereichs ist die Zunahme der mittleren AUC linear und proportional zur Dosis. Die Einnahme zusammen mit Essen kann im Vergleich zum nüchternen Zustand sowohl eine Zunahme als auch eine Abnahme der systemischen Verfügbarkeit von Hydrochlorothiazid bewirken. Diese Einflüsse sind gering und haben wenig klinische Bedeutung.
Die absolute Bioverfügbarkeit von Hydrochlorothiazid beträgt nach oraler Gabe ca. 70%.
Distribution, Elimination
Verteilung und Elimination wurden weitgehend als eine bi-exponentiellen Kinetik beschrieben.
Das apparente Verteilungsvolumen beträgt 4-8 l/kg. Zirkulierendes Hydrochlorothiazid ist zu 40-70% an Serumeiweiss gebunden, hauptsächlich Serumalbumin. Hydrochlorothiazid kumuliert in den Erythrozyten mit ungefähr der 3fachen Konzentration wie im Plasma.
Hydrochlorothiazid wird hauptsächlich in unveränderter Form ausgeschieden. In der terminalen Eliminationsphase wird Hydrochlorothiazid mit einer Halbwertszeit von durchschnittlich 6 bis 15 h aus dem Plasma eliminiert. Die Kinetik von Hydrochlorothiazid ändert sich bei wiederholter Gabe nicht, und bei einmal täglicher Gabe gibt es nur eine geringe Akkumulation.
Von der resorbierten Menge werden mehr als 95% unverändert über die Niere ausgeschieden.
Valsartan/Hydrochlorothiazid
Die systemische Verfügbarkeit von Hydrochlorothiazid wird bei gleichzeitiger Gabe mit Valsartan um ca. 30% reduziert. Die Kinetik von Valsartan wird bei gleichzeitiger Gabe von Hydrochlorothiazid nicht nennenswert beeinflusst. Die beobachtete Interaktion hat keinen Einfluss auf die gemeinsame Anwendung von Valsartan und Hydrochlorothiazid, weil in kontrollierten klinischen Studien eine deutliche blutdrucksenkende Wirkung gezeigt wurde, die grösser ist als jene der Einzelsubstanzen.
Kinetik spezieller Patientengruppen
Ältere Patienten
Im Vergleich zu jüngeren Freiwilligen war bei einigen älteren Patienten (>65 Jahre) eine etwas höhere systemische Verfügbarkeit von Valsartan zu beobachten, was sich jedoch als klinisch nicht relevant erwies.
Im Vergleich zu jungen, ist bei älteren Patienten die Hydrochlorothiazid-Konzentration im Steady-state höher und die systemische Clearance beträchtlich langsamer. Deshalb ist bei älteren Patienten, die mit Hydrochlorothiazid behandelt werden, eine sorgfältige Überwachung angezeigt.
Patienten mit Nierenfunktionsstörung
Valsartan
Wie bei einer Substanz mit einer renalen Ausscheidung von nur 30% der Gesamtelimination aus dem Plasma zu erwarten, wurde keine Korrelation zwischen der Nierenfunktion und der systemischen Verfügbarkeit von Valsartan festgestellt. Folglich ist bei Patienten mit Nierenfunktionsstörung keine Dosisanpassung erforderlich (schwere Niereninsuffizienz s. «Kontraindikationen»). Mit Dialyse-Patienten wurden keine Studien durchgeführt. Da aber Valsartan stark an Plasmaproteine gebunden wird, ist eine Elimination durch Dialyse nicht zu erwarten.
Hydrochlorothiazid
Die renale Clearance von Hydrochlorothiazid erfolgt sowohl durch passive Filtration als auch durch aktive Sekretion in den Tubulus. Wie für eine Substanz, die nahezu ausschliesslich über die Nieren ausgeschieden wird zu erwarten, hat die Nierenfunktion einen wesentlichen Einfluss auf die Kinetik von Hydrochlorothiazid (s. «Kontraindikationen»).
Bei Nierenfunktionsstörungen sind die mittleren Maximalkonzentrationen im Plasma und die AUC-Werte von Hydrochlorothiazid erhöht und die Ausscheidung im Urin verringert. Infolge der deutlich verringerten renalen Clearance ist bei Patienten mit leichter bis mässig starker Niereninsuffizienz die mittlere Halbwertszeit der Elimination fast verdoppelt.
Hydrochlorothiazid kann durch Dialyse eliminiert werden.
Patienten mit Leberfunktionsstörung
In einer pharmakokinetischen Studie bei Patienten mit milder bis mässiger Leberfunktionsstörung war die Konzentration an Valsartan verglichen mit gesunden Freiwilligen etwa um das Zweifache erhöht. Bei Patienten mit schwerer Leberfunktionsstörung liegen keine Daten vor (s. «Kontraindikationen»).
Lebererkrankungen mit leichter bis mässiger Leberfunktionseinschränkung beeinflussen die Pharmakokinetik von Hydrochlorothiazid im Allgemeinen nicht wesentlich.
Präklinische Daten
Valsartan:Hydrochlorothiazid
In unterschiedlichen präklinischen Studien an mehreren Tierarten gab es keine Ergebnisse, die darauf hinwiesen, dass therapeutische Dosierungen von Valsartan:Hydrochlorothiazid bei Menschen nicht angewendet werden sollten.
Valsartan
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Genotoxizität, Karzinogenität und Fertilität, und abgesehen von Fötotoxizität bei Kaninchen, lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Chronische Toxizität: In präklinischen Sicherheitsstudien wurden bei hohen Valsartan-Dosierungen (200-600 mg/kg Körpergewicht/Tag) bei Ratten eine Reduzierung der Parameter der roten Blutkörperchen (Erythrozyten, Hämoglobin, Hämatokrit) und Veränderungen der Nierenhämodynamik (leicht erhöhte Harnstoffwerte im Blut sowie renale tubuläre Hyperplasie und Basophilie bei männlichen Tieren) beobachtet. Diese Dosierungen bei Ratten (200 und 600 mg/kg/Tag) entsprechen der 6- und 18-fachen empfohlenen Dosierung für Menschen auf mg/m2-Basis (die Berechnung basiert auf einer oral verabreichten Dosis von 320 mg/Tag und einem 60 kg schweren Patienten). Bei Marmosetten und vergleichbaren Dosierungen waren die Veränderungen ähnlich, aber schwerer. Das galt insbesondere für die Niere, wo die Veränderungen in eine Nephropathie mit erhöhten Harnstoff- und Kreatininwerten mündeten. Weiterhin wurden bei beiden Arten Hypertrophien der renalen juxtaglomerulären Zellen beobachtet. Alle Veränderungen wurden vermutlich durch die pharmakologische Wirkung von Valsartan erzeugt, die insbesondere bei Marmosetten persistierende Hypotonie verursacht. Bei therapeutischen Dosen für Menschen scheint die Hypertrophie der renalen juxtaglomerulären Zellen nicht relevant zu sein.
Reproduktionstoxizität: Valsartan hatte keine unerwünschten Auswirkungen auf die reproduktive Leistung von männlichen und weiblichen Ratten bei oral verabreichten Dosen bis zu 200 mg/kg/Tag. Bei Studien zur embryofetalen Entwicklung (Segment II) bei Mäusen, Ratten und Kaninchen wurde gemeinsam mit mütterlicher Toxizität für Valsartan-Dosierungen von 600 mg/kg/Tag bei Ratten und von 10 mg/kg/Tag bei Kaninchen Fetotoxizität festgestellt. In einer Studie über die Toxizität für die peri- und postnatale Entwicklung (Segment III) zeigten sich bei Nachkommen von Ratten, deren Eltern 600 mg/kg/Tag im letzten Trimester und während der Laktation erhielten, eine leicht verringerte Überlebensrate und ein leichter Entwicklungsverzug.
Mutagenität: In verschiedenen in vitro und in vivo Standardstudien zur Genotoxizität konnte für Valsartan kein mutagenes Potenzial weder auf Gen- noch auf Chromosom-Ebene festgestellt werden.
Kanzerogenität: Bei der Verabreichung von Valsartan mit dem Futter in Dosierungen von bis zu 160 bzw. 200 mg/kg/Tag über 2 Jahre an Mäuse und Ratten ergaben sich keine Anhaltspunkte für eine Kanzerogenität.
Hydrochlorothiazid
Hydrochlorothiazid wurde mit negativen Ergebnissen auf Mutagenität, Klastogenität, Kanzerogenität und Reproduktionsleistung getestet.
Mutagenität: das mutagene Potenzial wurde anhand einer Reihe von In-vitro- und In-vivo-Tests beurteilt. Während es bei den In-vitro-Untersuchungen zu einigen positiven Testergebnissen kam, fielen alle Ergebnisse der in In-vivo-Untersuchungen negativ aus. Hydrochlorothiazid erhöhte die UVA-induzierte Bildung von Pyrimidindimeren in vitro und in der Haut von Mäusen nach oraler Verabreichung. Daraus wird der Schluss gezogen,dass in vivo kein relevantes mutagenes Potenzial besteht, wenngleich Hydrochlorothiazid die genotoxischen Effekte des UVA-Lichts verstärken könnte.
Kanzerogenität: die verfügbaren experimentellen Daten ergaben keine Anhaltspunkte für eine kanzerogene Wirkung von Hydrochlorothiazid bei Ratten und Mäusen (hepatozelluläre Tumoren bei Mäusen wurden nur bei mit hohen Dosen behandelten männlichen Mäusen beobachtet; die Häufigkeit überschritt nicht die Häufigkeit bei historischen Kontrollen).
Reproduktionstoxizität: Hydrochlorothiazid erwies sich nicht als teratogen und hatte keine Auswirkungen auf Fertilität und Konzeption. Bei 3 untersuchten Tierarten, die mindestens die 10-Fache Dosis der für den Menschen empfohlenen Dosis von ~1 mg/kg erhalten hatten, zeigte sich kein teratogenes Potenzial. Eine verminderte Gewichtszunahme bei gesäugten Rattenjungen wurde der hohen Dosis (das 15-Fache der Dosis für den Menschen) und dem diuretischen Effekt von Hydrochlorothiazid, mit den entsprechenden Folgen auf die Milchproduktion, zugeschrieben.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Valsartan HCT Zentiva in der Originalpackung vor Feuchtigkeit geschützt, unterhalb von 25 °C aufbewahren.
Arzneimittel für Kinder unerreichbar aufbewahren.
Zulassungsnummer
61472 (Swissmedic).
Zulassungsinhaberin
Helvepharm AG, Frauenfeld.
Stand der Information
September 2020.
Composizione
Principi attivi
Valsartanum, Hydrochlorothiazidum.
Sostanze ausiliarie
80/12.5 mg: Cellulosum microcristallinum, Silica colloidalis anhydrica, Sorbitolum 9.25 mg (E 420), Magnesii carbonas, Amylum pregelificatum, Povidonum K 30, Natrii stearylis fumaras, Natrii laurilsulfas, Crospovidonum.
Enrobage: Lactosum monohydricum 0.168 mg, Hypromellosum, Talcum, Macrogolum 6000, Ferri oxidum rubrum (E 172), Indigocarminum (E 132).
1 comressa rivestita con film Valsartan HCT Zentiva 80/12.5 mg contiene 0.316 mg sodio.
160/12.5 mg: Cellulosum microcristallinum, Silica colloidalis anhydrica, Sorbitolum 18.5 mg (E 420), Magnesii carbonas, Amylum pregelificatum, Povidonum K 30, Natrii stearylis fumaras, Natrii laurilsulfas, Crospovidonum.
Enrobage: Lactosum monohydricum 0.887 mg, Hypromellosum, Talcum, Macrogolum 6000, Ferri oxidum rubrum (E 172), Indigocarminum (E 132).
1 comressa rivestita con film Valsartan HCT Zentiva 160/12.5 mg contiene 0.623 mg sodio.
160/25 mg: Cellulosum microcristallinum, Silica colloidalis anhydrica, Sorbitolum 18.5 mg (E 420), Magnesii carbonas, Amylum pregelificatum, Povidonum K 30, Natrii stearylis fumaras, Natrii laurilsulfas, Crospovidonum.
Enrobage: Lactosum monohydricum 0.942 mg, Hypromellosum, Talcum, Macrogolum 6000, Ferri oxidum flavum (E 172), Ferri oxidum fuscum (E 172), Indigocarminum (E 132).
1 comressa rivestita con film Valsartan HCT Zentiva 160/25 mg contiene 0.623 mg sodio.
Forma farmaceutica e quantità di principio attivo per unità
Valsartan HCT Zentiva 80/12.5 mg
Compresse rivestite con film da 80 mg di valsartan e 12.5 mg di idroclorotiazide.
Compresse rivestite con film di forma rotonda, non divisibili, di colore rosa.
Valsartan HCT Zentiva 160/12.5 mg
Compresse rivestite con film da 160 mg di valsartan e 12.5 mg di idroclorotiazide.
Compresse rivestite con film di forma rotonda, non divisibili, di colore marrone-rosso.
Valsartan HCT Zentiva 160/25 mg
Compresse rivestite con film da 160 mg di valsartan e 25 mg di idroclorotiazide.
Compresse rivestite con film di forma rotonda, non divisibili, di colore marrone-arancio.
Indicazioni/Possibilità d'impiego
Trattamento dell'ipertensione essenziale di grado da lieve a moderato in pazienti la cui pressione arteriosa non risulta adeguatamente controllata da una monoterapia.
Posologia/Impiego
La posologia raccomandata è di 1 compressa rivestita con film di Valsartan HCT Zentiva 80/12.5 mg al giorno. In caso di riduzione insufficiente della pressione arteriosa dopo 3-4 settimane di trattamento può essere necessario proseguire la terapia con 1 compressa rivestita con film di Valsartan HCT Zentiva 160/12.5 mg al giorno. Il trattamento con 1 compressa rivestita con film di Valsartan HCT Zentiva 160/25 mg al giorno è riservata ai pazienti che mostrano una riduzione insufficiente della pressione arteriosa durante la terapia con Valsartan HCT Zentiva 160/12.5 mg. L'effetto massimo di riduzione della pressione arteriosa si osserva entro 2-4 settimane.
L'assunzione di Valsartan HCT Zentiva può avvenire indipendentemente dai pasti. Valsartan HCT Zentiva deve essere assunto insieme a dei liquidi.
Impiego nei pazienti anziani (di età superiore ai 65 anni)
Valsartan HCT Zentiva può essere assunto indipendentemente dall'età.
Impiego in caso di disturbi della funzionalità renale
Nei pazienti con disturbi della funzionalità renale può essere necessaria una riduzione della dose. A causa della presenza del principio attivo idroclorotiazide, Valsartan HCT Zentiva è controindicato in pazienti con anuria (v. «Controindicazioni») e deve essere impiegato con particolare cautela in pazienti con grave insufficienza renale (GFR <30 ml/min) (v. «Avvertenze e misure precauzionali»).
Non vi sono esperienze per quanto riguarda l'impiego di valsartan in caso di insufficienza renale terminale (GFR <10 ml/min) o trattamento dialitico.
Impiego in caso di disturbi della funzionalità epatica
Nei pazienti con disturbi della funzionalità epatica può essere necessaria una riduzione della dose. A causa della presenza del principio attivo idroclorotiazide, Valsartan HCT Zentiva deve essere impiegato con cautela in pazienti con disturbi della funzionalità epatica (v. «Avvertenze e misure precauzionali»). A causa della presenza del principio attivo valsartan, Valsartan HCT Zentiva è controindicato in pazienti con cirrosi biliare e colestasi.
Impiego nei bambini e negli adolescenti
L'efficacia e la sicurezza di Valsartan HCT Zentiva non sono state analizzate nel trattamento di bambini e adolescenti di età inferiore ai 18 anni.
Controindicazioni
- Ipersensibilità a valsartan o idroclorotiazide, a uno degli altri eccipienti di Valsartan HCT Zentiva o ai derivati sulfonamidici.
- Valsartan HCT Zentiva è controindicato in pazienti con angioedema ereditario o che hanno sviluppato edema angioneurotico durante un precedente trattamento con un ACE-inibitore o con antagonisti dei recettori dell'angiotensina II.
- Gravidanza e allattamento (v. «Gravidanza, allattamento»).
- Cirrosi biliare o colestasi.
- Anuria.
- Impiego concomitante di antagonisti dei recettori dell'angiotensina (ARB), compreso Valsartan HCT Zentiva , o di inibitori dell'enzima di conversione dell'angiotensina (ACEI) con aliskiren in pazienti con diabete mellito (tipo 1 e tipo 2), come pure in pazienti con disturbi della funzionalità renale (GFR <60 ml/min) (v. rubrica «Interazioni», sottoparagrafo «Blocco doppio del sistema renina-angiotensina-aldosterone (RAAS)»).
Avvertenze e misure precauzionali
Elettroliti
Potassio
I diuretici tiazidici possono causare ipokaliemia o peggiorare un'ipokaliemia preesistente. In caso di patologie associate a un'elevata perdita di potassio, i tiazidi devono essere somministrati solo con cautela e sotto regolare monitoraggio del potassio sierico.
Prima dell'inizio di un trattamento con tiazidi si raccomanda la correzione dell'eventuale ipokaliemia. L'eventuale compresenza di una carenza di magnesio può rendere più difficoltosa la correzione dell'ipokaliemia. Poiché Valsartan HCT Zentiva contiene un antagonista dei recettori dell'angiotensina II, ogni eventuale sostituzione di potassio durante il trattamento con Valsartan HCT Zentiva deve essere bilanciata e deve avvenire con cautela. Le concentrazioni di potassio e magnesio devono essere controllate regolarmente. Tutti i pazienti che ricevono diuretici tiazidici devono essere monitorati per eventuali squilibri elettrolitici.
Sodio
I diuretici tiazidici possono causare un'iponatremia di nuova insorgenza o peggiorare un'iponatremia preesistente. Ciò può accompagnarsi a sintomi neurologici (vomito, confusione, apatia). I diuretici tiazidici devono essere somministrati solo dopo la correzione dell'eventuale iponatremia preesistente. È necessario un monitoraggio regolare delle concentrazioni sieriche di sodio.
Calcio
I diuretici tiazidici riducono l'eliminazione del calcio nell'urina e possono causare un aumento del calcio sierico. I diuretici tiazidici devono essere avviati solo dopo la correzione dell'eventuale ipercalcemia preesistente o il trattamento della patologia che ne è all'origine. È necessario un regolare monitoraggio delle concentrazioni sieriche di calcio.
Ipovolemia
Nei pazienti con ipovolemia significativa può manifestarsi un'ipotensione sintomatica all'inizio del trattamento con Valsartan HCT Zentiva. Un'eventuale ipovolemia preesistente deve essere riequilibrata prima dell'inizio del trattamento.
Stenosi dell'arteria renale
Valsartan HCT Zentiva deve essere somministrato con grande cautela nei pazienti con stenosi dell'arteria renale monolaterale o bilaterale o stenosi di rene solitario, in quanto in questi pazienti i livelli di urea ematica e creatinina sierica possono risultare aumentati.
Insufficienza renale
Si raccomanda cautela nel trattamento di pazienti con disturbi della funzionalità renale. In caso di gravi disturbi della funzionalità renale (GFR <30 ml/min), i diuretici tiazidici possono perdere la loro efficacia diuretica. La somministrazione di Valsartan HCT Zentiva in questi pazienti deve pertanto avvenire dopo un'accurata valutazione del rapporto rischi/benefici e monitorando i parametri clinici e chimici di laboratorio.
Nei pazienti con disturbi della funzionalità renale (GFR <60 ml/min), l'impiego concomitante di ARB, compreso Valsartan HCT Zentiva, o di ACEI con aliskiren è controindicato (v. rubrica «Interazioni», sottoparagrafo «Duplice blocco del sistema renina-angiotensina-aldosterone (RAAS)»).
Non vi sono esperienze per quanto riguarda l'impiego di valsartan in caso di insufficienza renale terminale (GFR <10 ml/min) o trattamento dialitico.
Insufficienza epatica
Si raccomanda cautela nel trattamento di pazienti con disturbi della funzionalità epatica. I tiazidi possono causare squilibri elettrolitici, encefalopatie epatiche, come pure una sindrome epatorenale in questi pazienti. La somministrazione di Valsartan HCT Zentiva in questi pazienti deve pertanto avvenire dopo un'accurata valutazione del rapporto rischi/benefici e monitorando i parametri clinici e chimici di laboratorio. L'impiego di Valsartan HCT Zentiva è controindicato in caso di cirrosi biliare o colestasi.
Angioedema
In pazienti trattati con valsartan sono stati osservati angioedemi, incluse tumefazioni della laringe e della glottide, che hanno portato a limitazioni di flusso nelle vie aeree e/o tumefazione di viso, labbra, gola e/o lingua. Alcuni di questi pazienti avevano già manifestato un precedente angioedema con l'assunzione di altri medicamenti, compresi ACE-inibitori. La somministrazione di Valsartan HCT Zentiva deve essere immediatamente interrotta nei pazienti che sviluppano angioedema e non deve essere ripresa.
Lupus eritematoso sistemico
I diuretici tiazidici, compreso l'idroclorotiazide, possono causare o peggiorare un lupus eritematoso sistemico.
Effetti metabolici
A causa della ridotta clearance dell'urea, Valsartan HCT Zentiva può aumentare la concentrazione sierica di urea, causando o peggiorando un'iperuricemia, come pure può causare attacchi di gotta nei pazienti predisposti. Pertanto l'impiego di Valsartan HCT Zentiva non è raccomandato in pazienti con iperuricemia e/o gotta.
I diuretici tiazidici, compreso l'idroclorotiazide, possono alterare la resistenza al glucosio e peggiorare uno stato metabolico diabetico. I livelli sierici di colesterolo e trigliceridi possono aumentare con l'impiego di idroclorotiazide.
Altro
I pazienti con allergie e asma hanno una maggiore probabilità di manifestare reazioni di ipersensibilità a idroclorotiazide.
Versamento coroidale (effusione coroidale), miopia acuta e glaucoma ad angolo chiuso secondario
Sulfonamidi e medicamenti derivati sulfamidici possono indurre una reazione idiosincratica che può causare versamento coroidale (effusione coroidale) con perdita del campo visivo, miopia transitoria e glaucoma ad angolo chiuso. I sintomi acuti includono perdita della vista o dolore oculare, in genere compaiono entro poche ore o settimane dall'inizio della terapia. Il glaucoma ad angolo chiuso non trattato può portare a perdita permanente della vista.
La terapia primaria consiste nella sospensione immediata del medicamento. Se la pressione intraoculare rimane elevata, occorre prendere in considerazione un trattamento medico o un intervento chirurgico immediato. I fattori di rischio per lo sviluppo del glaucoma ad angolo chiuso possono essere una pregressa allergia alla sulfonamide o alla penicillina.
Pazienti con insufficienza cardiaca e pregresso infarto del miocardio
Nei pazienti la cui funzionalità renale dipende dall'attività del sistema renina-angiotensina-aldosterone (p. es. pazienti con grave insufficienza cardiaca), il trattamento con ACE-inibitori o antagonisti dei recettori dell'angiotensina è stato associato a oliguria e/o azotemia progressiva e, in rari casi, a insufficienza nella funzione renale acuta e/o morte. Nel valutare i pazienti con insufficienza cardiaca o i pazienti che hanno subito un precedente infarto del miocardio si deve sempre controllare la funzionalità renale.
Fertilità
Non esistono informazioni circa l'effetto di valsartan sulla fertilità umana. Negli studi condotti sui ratti non sono stati riscontrati effetti di valsartan sulla fertilità (v. «Dati preclinici»).
Blocco doppio del sistema renina-angiotensina-aldosterone (RAAS)
(vedere «Controindicazioni» e «Interazioni», sottoparagrafo «Blocco doppio del sistema renina-angiotensina-aldosterone (RAAS)»).
Tumore della pelle non melanoma (NMSC)
In due studi epidemiologici basati sui dati del Registro nazionale dei tumori danese è stato osservato un aumento del rischio di tumore della pelle non-melanoma (Non-Melanoma Skin Cancer, NMSC) (carcinoma basocellulare e carcinoma a cellule squamose) associato all'aumento cumulativo della dose di esposizione a idroclorotiazide. Il rischio di NMSC sembra aumentare con l'impiego a lungo termine (vedere rubrica «Proprietà/Effetti»). L'effetto fotosensibilizzante dell'idroclorotiazide potrebbe contribuire come potenziale meccanismo allo sviluppo di NMSC.
I pazienti che assumono idroclorotiazide devono essere informati del rischio di NMSC e istruiti affinché sottopongano a controllo regolare la cute per verificare la presenza di nuove lesioni e segnalino immediatamente eventuali alterazioni cutanee sospette. Al fine di ridurre al minimo il rischio di tumore della pelle, occorre consigliare ai pazienti l'adozione di possibili misure preventive quali per esempio l'esposizione limitata alla luce solare/raggi UV e, in caso di esposizione, l'impiego di una protezione solare adeguata. Eventuali alterazioni cutanee sospette devono essere esaminate immediatamente, possibilmente con l'ausilio di esami istologici su biopsie. Si deve inoltre riconsiderare l'impiego di idroclorotiazide nei pazienti con anamnesi di NMSC (vedere rubrica «Effetti indesiderati»).
Lattosio
Valsartan HCT Zentiva contiene lattosio. I pazienti affetti da rari problemi ereditari di intolleranza al galattosio, da deficit totale di Lapp lattasi o da malassorbimento glucosio-galattosio non devono assumere questo medicamento.
Sodio
Questo medicamento contiene meno di 1 mmol (23 mg) di sodio per compressa rivestita con film, cioè essenzialmente «senza sodio».
Sorbitolo (E 420)
Le compresse rivestite con film Valsartan HCT Zentiva contengono di sorbitolo.
L'effetto additivo della co-somministrazione di medicinali contenenti fruttosio (o sorbitolo) e l'assunzione di fruttosio (o sorbitolo) con la dieta deve essere considerato. Il contenuto di sorbitolo dei medicamenti somministrati per via orale può influenzare la biodisponibilità di altri medicamenti concomitanti somministrati per via orale.
Interazioni
Interazioni che riguardano entrambi i componenti
Litio
Con l'impiego di entrambi i componenti (valsartan e/o idroclorotiazide) di Valsartan HCT Zentiva possono manifestarsi le seguenti interazioni:
È stato riscontrato un aumento reversibile delle concentrazioni di litio nel siero e della tossicità del litio quando questo viene somministrato in concomitanza con ACE-inibitori o antagonisti dei recettori dell'angiotensina II o tiazidi. Dal momento che i tiazidi riducono la clearance renale del litio, la tossicità del litio può risultare aumentata dopo l'impiego di Valsartan HCT Zentiva . Si raccomanda pertanto l'attento monitoraggio della concentrazione di litio nel siero in caso di somministrazione concomitante.
Farmaci antiinfiammatori non steroidei (FANS), inclusi gli inibitori selettivi della ciclossigenasi-2 (inibitori COX-2):
La somministrazione di FANS e inibitori COX-2 può determinare una riduzione dell'effetto antipertensivo degli antagonisti dei recettori dell'angiotensina II (AIIRA). In pazienti anziani, pazienti con patologia funzionale renale e ipovolemici (anche in terapia diuretica), la somministrazione concomitante di FANS (o inibitori COX-2) con un AIIRA può aumentare il rischio di un peggioramento della funzionalità renale (inclusa l'insufficienza nella funzione renale acuta). In tali pazienti questi medicamenti devono pertanto essere combinati solo con cautela e sotto monitoraggio della funzionalità renale.
Altri antipertensivi: L'impiego di Valsartan HCT Zentiva potenzia l'effetto antipertensivo di altri medicamenti che riducono la pressione arteriosa (p. es. betabloccanti, vasodilatatori, calcioantagonisti, ACE-inibitori, antagonisti dei recettori dell'angiotensina (ARB) e inibitori diretti della renina (DRI)).
Valsartan
Blocco doppio del sistema renina-angiotensina-aldosterone (RAAS) con ARB, ACEI o aliskiren: La somministrazione concomitante di ARB, incluso Valsartan HCT Zentiva, e altri medicamenti che agiscono sul RAAS è associato a una maggiore incidenza di ipotensione, sincope, iperkaliemia e patologie funzionali renali (inclusa l'insufficienza nella funzione renale) rispetto a una monoterapia. Il blocco doppio del RAAS attraverso la somministrazione concomitante di ACE-inibitori, ARB o aliskiren non è pertanto raccomandato. Se la terapia del blocco doppio è considerata assolutamente necessaria, ciò deve avvenire solo sotto la supervisione di uno specialista e con uno stretto monitoraggio della funzionalità renale, dei livelli degli elettroliti e della pressione sanguigna (v. rubrica «Avvertenze e misure precauzionali»).
Nei pazienti con disturbi della funzionalità renale (GFR <60 ml/min), l'impiego concomitante di ARB, compreso Valsartan HCT Zentiva, o di ACEI con aliskiren è controindicato (v. rubrica «Avvertenze e misure precauzionali» e «Controindicazioni»).
Nei pazienti con diabete di tipo 1 e 2, l'impiego concomitante di ARB, compreso Valsartan HCT Zentiva, o di ACEI con aliskiren è controindicato (v. rubrica «Controindicazioni»). Gli ACE-inibitori, compreso Diovan, e gli antagonisti del recettore dell'angiotensina (ARB) non devono essere usati contemporaneamente in pazienti con nefropatia diabetica.
Potassio: Il trattamento combinato di antagonisti dei recettori dell'angiotensina II con altri medicamenti che possono portare a un aumento del potassio sierico (p. es. diuretici risparmiatori di potassio, preparati contenenti potassio, eparina) può aumentare il rischio di iperkaliemia. In questi casi, la somministrazione del valsartan contenuto in Valsartan HCT Zentiva deve avvenire con cautela e monitorando i livelli di potassio.
Trasportatori: Analisi in vitro condotte su tessuti epatici umani indicano che valsartan è un substrato del trasportatore di captazione epatica OATP1B1 e del trasportatore di efflusso epatico MRP2. Pertanto, l'esposizione sistemica al valsartan può aumentare con la somministrazione concomitante di inibitori del trasportatore OATP1B1 (rifampicina, ciclosporina) o MRP2 (ritonavir).
Con valsartan in monoterapia non sono state osservate interazioni clinicamente rilevanti con i seguenti medicamenti: cimetidina, warfarin, furosemide, digossina, atenololo, indometacina, idroclorotiazide, amlodipina, glibenclamide.
Idroclorotiazide
Medicamenti che influiscono sui livelli sierici di potassio o magnesio: la somministrazione concomitante di idroclorotiazide e diuretici potassiuretici (ad es. furosemide), glucocorticoidi, ACTH, amfotericina B, carbenoxolone, penicillina G, salicilati o altri aritmici può potenziare le perdite di potassio e/o magnesio.
Cardiocinetici (digitale): un'ipokaliemia o ipomagnesiemia da tiazidi può favorire l'insorgenza di aritmie da digitale.
Miorilassanti muscolo-scheletrici: i diuretici tiazidici, compreso l'idroclorotiazide, potenziano l'effetto dei miorilassanti muscolo-scheletrici della classe dei curari.
Antidiabetici: i tiazidi possono alterare la tolleranza al glucosio. Può essere necessario un adeguamento posologico di insulina e antidiabetici per via orale.
Allopurinolo: la somministrazione concomitante di diuretici tiazidici, compreso idroclorotiazide, può aumentare la frequenza di insorgenza di reazioni di ipersensibilità all'allopurinolo.
Amantadina: la somministrazione concomitante di diuretici tiazidici, compreso idroclorotiazide, può aumentare il rischio di effetti indesiderati da amantadina.
Diazossido: i diuretici tiazidici possono potenziare l'effetto iperglicemico del diazossido.
Antineoplastici (p. es. ciclofosfamide, metotressato): la somministrazione concomitante di diuretici tiazidici può ridurre l'escrezione renale di medicamenti citotossici e potenziarne gli effetti mielosoppressivi.
Anticolinergici: la biodisponibilità dei diuretici tiazidici può risultare aumentata in caso di somministrazione concomitante di anticolinergici (p. es. atropina, biperidene), probabilmente a causa di una ridotta motilità intestinale e di un rallentato svuotamento intestinale. Per contro, i medicamenti procinetici, come per esempio cisapride, possono ridurre la biodisponibilità dei diuretici tiazidici.
Metildopa: con la somministrazione concomitante di idroclorotiazide sono stati descritti casi isolati di anemia emolitica.
Resine a scambio ionico: l'assorbimento di diuretici tiazidici, compreso l'idroclorotiazide, risulta ridotto da colestiramina o colestipolo. Pertanto la somministrazione di idroclorotiazide e della resina a scambio ionico deve avvenire in momenti diversi, osservando l'intervallo di tempo più ampio possibile in modo da ridurre al minimo le interazioni.
Vitamina D: la somministrazione concomitante di diuretici tiazidici, compreso idroclorotiazide, con vitamina D o sali di calcio può potenziare l'aumento dei livelli sierici di calcio.
Ciclosporina: la somministrazione concomitante di ciclosporina può aumentare il rischio di iperuricemia e possono comparire sintomi di gotta.
Sali di calcio: a causa dell'aumentato riassorbimento tubulare del calcio, la somministrazione concomitante di diuretici di tipo tiazidico può portare a ipercalcemia.
Medicamenti che influiscono sui livelli sierici di sodio: l'effetto iponatriemico dei diuretici può risultare potenziato attraverso la somministrazione concomitante di medicamenti come antidepressivi, antipsicotici, antiepilettici ecc. Si raccomanda cautela in caso di somministrazione di questi medicamenti per periodi di tempo prolungati.
Alcol, barbiturici o narcotici: la somministrazione concomitante di diuretici tiazidici con alcol, barbiturici o narcotici può potenziare un'ipotensione ortostatica.
Amine pressorie: l'idroclorotiazide può ridurre la risposta alle amine pressorie, come per esempio la noradrenalina. La rilevanza clinica di questo effetto non è tuttavia sufficiente ad escluderne l'impiego.
Gravidanza/Allattamento
Gravidanza
Valsartan HCT Zentiva agisce direttamente sul RAAS, pertanto non deve essere assunto durante la gravidanza o da donne che pianificano una gravidanza (v. «Controindicazioni»). Gli specialisti che prescrivono medicamenti che agiscono sul sistema RAAS devono informare le donne in età fertile del potenziale rischio di questi medicamenti durante la gravidanza.
A causa del meccanismo di azione degli antagonisti dei recettori dell'angiotensina II non è possibile escludere un rischio per l'embrione e per il feto. Dati retrospettivi indicano che l'impiego di ACE-inibitori nel 1° trimestre è associato a un potenziale rischio di difetti congeniti. Per i medicamenti che agiscono direttamente sul sistema renina-angiotensina-aldosterone (RAAS) sono inoltre stati descritti danni e morte del feto in seguito alla somministrazione durante il 2° e il 3° trimestre. Nell'uomo, la perfusione renale fetale, dipendente dallo sviluppo del RAAS, inizia nel 2° trimestre. Di conseguenza, il rischio di un trattamento con valsartan durante la gravidanza aumenta nel 2° e 3° trimestre. Sono stati riportati casi di aborto spontaneo, oligoidramnios e patologie funzionali renali neonatali in caso di assunzione accidentale di valsartan da parte di donne in gravidanza.
In tutti i neonati esposti in utero occorre valutare con cura l'adeguatezza dell'escrezione dell'urea, la presenza di iperkaliemia e la pressione arteriosa. In caso di emergenza occorre ricorrere alle misure cliniche adeguate, come ad es. la reidratazione, al fine di eliminare il medicamento dalla circolazione.
L'esposizione ai diuretici tiazidici, compreso l'idroclorotiazide, in utero può causare itterizia fetale o neonatale o una trombocitopenia e potrebbe essere correlato ad effetti collaterali diversi rispetto agli adulti.
Se viene diagnosticata una gravidanza durante il trattamento, Valsartan HCT Zentiva deve essere interrotto.
Allattamento
Negli studi condotti sugli animali (ratti), valsartan è stato escreto nel latte. L'idroclorotiazide passa la placenta e penetra nel latte materno. Non sono stati condotti studi su donne durante l'allattamento, pertanto il trattamento con Valsartan HCT Zentiva non deve avere luogo durante l'allattamento.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Come altri ipertensivi, Valsartan HCT Zentiva può ridurre la capacità di reazione, la capacità di condurre un veicolo e la capacità di utilizzare attrezzi e macchine. Si raccomanda cautela.
Effetti indesiderati
In 5 studi clinici controllati con 7616 pazienti, 4372 dei quali hanno ricevuto valsartan in combinazione con idroclorotiazide, si sono osservati i seguenti effetti indesiderati.
«Molto comune» (≥1/10), «comune» (<1/10, ≥1/100), «non comune» (<1/100, ≥1/1'000), «raro» (<1/1'000, ≥1/10'000), «molto raro» (<1/10'000), «sconosciuto» (non può essere valutata sulla base dei dati disponibili).
Infezioni ed infestazioni
Non comune: infezioni virali, piressia.
Disturbi del metabolismo e della nutrizione
Non comune: disidratazione.
Sconosciuto: ipokaliemia, iponatremia.
Patologie del sistema nervoso
Comune: cefalea, stanchezza, stordimento.
Non comune: astenia, vertigini, insonnia, stati di ansia, parestesia.
Raro: depressione.
Sconosciuto: sincope.
Patologie dell'occhio
Non comune: disturbi della vista.
Raro: congiuntivite.
Patologie dell'orecchio e del labirinto
Non comune: infiammazione dell'orecchio medio, tinnito.
Patologie cardiache
Non comune: battito cardiaco accelerato, tachicardia.
Patologie vascolari
Non comune: edemi, ipotensione, iperidrosi.
Patologie respiratorie, toraciche e mediastiniche
Comune: tosse, rinite, faringite, infezioni delle vie respiratorie superiori.
Non comune: bronchite, dispnea, sinusite, dolore laringofaringeo, bocca secca.
Molto raro: epistassi.
Sconosciuto: edema polmonare non cardiaco.
Patologie gastrointestinali
Comune: diarrea.
Non comune: mal di pancia, disturbi della digestione, nausea, gastroenterite.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Comune: dolore dorsale, dolore articolare.
Non comune: dolore alle braccia o alle gambe, dolore toracico, dolore al collo, artrite, distorsioni e strappi, crampi muscolari, mialgia.
Patologie renali e urinarie
Non comune: minzione frequente, infezioni delle vie urinarie.
Molto raro: patologie funzionali renali.
Patologie dell'apparato riproduttivo e della mammella
Comune: disfunzione erettile.
Patologie generali e condizioni relative alla sede di somministrazione
Non comune: stanchezza.
Esami di laboratorio
Sconosciuto: neutropenia.
Una riduzione di oltre il 20% del potassio sierico è stata osservata nel 3.7% dei pazienti trattati con Valsartan HCT Zentiva e nel 3.1% dei pazienti trattati con placebo.
Un aumento della creatinina e dell'azotemia (BUN) è stata osservata rispettivamente nell'1.9% e nel 14.7% dei pazienti trattati con Valsartan HCT Zentiva e nello 0.4% e nel 6.3% dei pazienti trattati con placebo nell'ambito di studi clinici controllati.
In studi clinici condotti su pazienti con ipertensione sono stati osservati anche i seguenti risultati, indipendentemente dal loro nesso causale con il medicamento in studio: ipoestesia, influenza, insonnia, distorsione di legamento, strappo muscolare, congestione nasale, nasofaringite, dolore al collo, edema periferico, congestione dei seni paranasali.
I seguenti risultati sono emersi in correlazione a valsartan in monoterapia, ma non sono stati osservati nel trattamento con Valsartan HCT Zentiva:
In casi rari, il trattamento con valsartan può accompagnarsi a una diminuzione dell'emoglobina e dell'ematocrito. In studi clinici controllati è stata osservata una diminuzione significativa (>20%) dell'ematocrito nello 0.8% dei pazienti e dell'emoglobina nello 0.4%. Per contro, durante il trattamento con placebo i valori dell'ematocrito o dell'emoglobina sono aumentati nello 0.1% dei pazienti.
È stata osservata neutropenia nell'1.9% dei pazienti trattati con valsartan e nell'1.6% dei pazienti trattati con ACE-inibitori.
In studi clinici controllati sono stati osservati aumenti clinicamente significativi delle concentrazioni ematiche di creatinina, potassio e bilirubina totale nello 0.8%, 4.4% o 6% dei pazienti trattati con valsartan e nell'1.6%, 6.4% o 12.9% dei pazienti trattati con ACE-inibitori.
Occasionalmente, durante il trattamento con valsartan, è stato osservato un aumento dei parametri della funzionalità epatica.
In caso di ipertensione essenziale non è necessario un monitoraggio particolare dei parametri di laboratorio.
Dall'immissione in commercio del preparato sono stati riportati casi di sincope, casi molto rari di angioedema, eruzione cutanea, prurito, come pure altre reazioni di ipersensibilità, come malattia da siero e vasculite. Sono stati osservati casi molto rari di patologie funzionali renali.
Sono stati riportati casi di dermatite bollosa con frequenza sconosciuta.
Valsartan
Altri eventi indesiderati riportati in studi clinici di valsartan indipendentemente dall'esistenza di un nesso causale sono stati:
Comune: dolore articolare.
Non comune: edema, astenia, insonnia, eruzione cutanea, diminuzione della libido, vertigini.
Raro: gastroenterite, nevralgia.
Molto raro: trombocitopenia, aritmia cardiaca, insufficienza nella funzione renale acuta.
È stato descritto un singolo caso di angioedema.
Idroclorotiazide
Tumori benigni, maligni e non specificati (cisti e polipi compresi)
Frequenza non nota: tumore della pelle non melanoma (carcinoma basocellulare e carcinoma a cellule squamose)
Patologie del sistema emolinfopoietico
Raro: trombocitopenia, sporadicamente con porpora.
Molto raro: leucopenia, agranulocitosi, insufficienza del midollo osseo, anemia emolitica.
Disturbi del sistema immunitario
Molto raro: vasculite necrotizzante, reazioni di ipersensibilità.
Disturbi del metabolismo e della nutrizione
Molto comune: ipokaliemia, lipidi ematici aumentati.
Comune: iponatremia, ipomagnesiemia e iperuricemia, appetito ridotto.
Raro: ipercalcemia, iperglicemia, glicosuria, peggioramento dello stato metabolico diabetico.
Molto raro: alcalosi ipocloremica.
Disturbi psichiatrici
Raro: disturbi del sonno.
Patologie del sistema nervoso
Raro: cefalee, vertigini o stordimento, depressione e parestesie.
Patologie dell'occhio
Raro: disturbi della vista, in particolare nelle prime settimane di trattamento.
Frequenza non nota: versamento coroideale (effusione coroideale).
Patologie cardiache
Raro: aritmie cardiache.
Patologie vascolari
Comune: ipotensione ortostatica, che può essere potenziata dall'assunzione di alcol, anestetici o sedativi.
Patologie respiratorie, toraciche e mediastiniche
Molto raro: disturbi respiratori, compresi polmonite ed edema polmonare.
Patologie gastrointestinali
Comune: lieve nausea e vomito.
Raro: disturbi addominali, stipsi, diarrea.
Molto raro: pancreatite.
Patologie epatobiliari
Raro: colestasi o itterizia.
Patologie della cute e del tessuto sottocutaneo
Comune: orticaria e altre forme di esantema della cute.
Raro: fotosensibilizzazione.
Molto raro: necrolisi epidermica tossica, reazioni cutanee simili a lupus eritematoso, riattivazione di un lupus eritematoso della cute.
Patologie dell'apparato riproduttivo e della mammella
Comune: impotenza.
Effetti indesiderati dalle esperienze successive all'introduzione sul mercato
Nell'ambito delle esperienze successive all'introduzione sul mercato, sono stati identificati i seguenti effetti indesiderati. Dal momento che questi effetti vengono segnalati spontaneamente da una popolazione di dimensioni non note, non è sempre possibile stimare la frequenza in maniera affidabile.
Frequenza non nota: insufficienza nella funzione renale acuta, patologia funzionale renale, anemia aplastica, eritema multiforme, piressia, spasmi muscolari, sensazione di debolezza, miopia acuta e glaucoma acuto ad angolo chiuso.
Descrizione di alcuni effetti collaterali
Neoplasie maligne della pelle non melanoma (NMSC) (carcinoma basocellulare e carcinoma a cellule squamose): sulla base dei dati disponibili raccolti da studi epidemiologici è stata osservata una correlazione tra l'esposizione a idroclorotiazide e lo sviluppo di NMSC associato a dosi cumulative (vedere le rubriche «Avvertenze e misure precauzionali» e «Proprietà/Effetti»).
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-beneficio del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Una posologia eccessiva di valsartan può dar luogo a marcata ipotensione che a sua volta può portare a diminuzione dello stato di coscienza, collasso cardiocircolatorio e/o shock.
Inoltre possono manifestarsi i seguenti segni e sintomi conseguentemente a una posologia eccessiva di idroclorotiazide: nausea, sonnolenza, ipovolemia, disturbi elettrolitici, associati ad aritmie e spasmi muscolari.
In tutti i casi di posologia eccessiva occorre intraprendere le generali misure di supporto. Queste possono comprendere lo stretto monitoraggio della funzionalità cardiocircolatoria e misure per la relativa stabilizzazione.
A causa del forte legame proteico, valsartan non può essere rimosso per emodialisi. Al contrario, l'idroclorotiazide può essere rimosso con la dialisi.
Proprietà/Effetti
Codice ATC
C09DA03
Valsartan
L'ormone attivo del sistema renina-angiotensina, aldosterone (RAAS) è l'angiotensina II, che viene formata dall'angiotensina I attraverso l'enzima di conversione dell'angiotensina (ACE). L'angiotensina si lega a recettori specifici che si trovano sulle membrane cellulari di diversi tessuti. Possiede molteplici effetti fisiologici, in particolare influenza direttamente e indirettamente la regolazione della pressione arteriosa. L'angiotensina II è un forte vasocostrittore e ha un effetto pressorio diretto. Inoltre favorisce la ritenzione di sodio e stimola la secrezione di aldosterone.
Valsartan è un antagonista attivo per via orale e specifico per l'angiotensina II. Valsartan esercita un'azione selettiva sul recettore di sottotipo AT1, responsabile per gli effetti noti dell'angiotensina II. L'aumento dei livelli plasmatici dell'angiotensina II in seguito al blocco dei recettori AT1 da parte di valsartan può stimolare i recettori AT2 liberi. Ciò sembra contrastare ulteriormente l'effetto del recettore AT1. Valsartan non esercita alcun tipo di attività parzialmente agonistica sul recettore AT1. La sua attività per il recettore AT1 è circa 20000 volte più forte che per il recettore AT2.
Valsartan non inibisce l'ACE (= chinasi II), l'enzima che converte l'angiotensina I in angiotensina II e degrada la bradichinina. È improbabile che gli antagonisti dell'angiotensina II causino lo stimolo della tosse, in quanto non agiscono sull'ACE né potenziano la bradichinina o la sostanza P.
In studi clinici comparativi con valsartan e un ACE-inibitore, la frequenza di tosse secca era significativamente inferiore (p <0.05) nei pazienti trattati con valsartan rispetto a quelli trattati con un ACE-inibitore (2.6% contro 7.9%) In uno studio clinico condotto su pazienti che avevano precedentemente manifestato tosse secca durante la terapia con un ACE-inibitore, è stata osservata tosse nel 19.5% dei pazienti trattati con valsartan, nel 19.0% di quelli trattati con un diuretico tiazidico e nel 68.5% di quelli trattati con un ACE-inibitore (p <0.05). In studi clinici controllati, la frequenza della tosse nei pazienti trattati con una combinazione di valsartan e idroclorotiazide è stata del 2.9%.
Valsartan non ha alcun effetto su altri recettori ormonali o canali ionici con significato noto per la regolazione cardiovascolare.
Valsartan riduce la pressione arteriosa nei pazienti con ipertensione, senza influire sulla frequenza cardiaca.
Nella maggior parte dei pazienti, l'azione antipertensiva insorge nell'arco di 2 ore dalla somministrazione di una dose singola orale; la massima riduzione della pressione arteriosa si raggiunge dopo 4-6 ore. L'azione artipertensiva si mantiene per 24 ore dopo l'assunzione. La massima riduzione della pressione arteriosa generalmente si raggiunge 2-4 settimane dopo l'inizio della terapia e viene mantenuta nella terapia a lungo termine. La combinazione con idroclorotiazide porta a un'ulteriore significativa riduzione della pressione arteriosa.
L'interruzione di valsartan non determina un rapido aumento della pressione arteriosa (rebound) o altri eventi indesiderati.
Valsartan non altera i valori a digiuno di colesterolo totale, trigliceridi, glucosio sierico o i livelli di urea negli ipertesi.
Idroclorotiazide
Il principale sito di azione dei diuretici tiazidici è il tubulo renale contorto distale. Si è potuto osservare che nella corteccia renale è presente un recettore con elevata affinità che rappresenta il principale sito di legame e il sito di azione dei diuretici tiazidici, i quali inibiscono il trasporto di NaCl nel tubulo contorto distale. L'azione dei tiazidi avviene attraverso l'inibizione del simporto del Na+Cl--. È possibile che un'occupazione competitiva del sito di legame del Cl-- influenzi l'assorbimento degli elettroliti: ne deriva direttamente un aumento della escrezione di sodio e cloruro in quantità equivalenti. Indirettamente si verifica una riduzione del volume plasmatico e, successivamente, un aumento dell'attività reninica plasmatica, un aumento della secrezione di aldosterone, un aumento dell'eliminazione del potassio e una riduzione della concentrazione sierica del potassio.
Il legame renina-aldosterone è mediato dall'angiotensina II, motivo per cui la somministrazione concomitante di un altro antagonista dei recettori dell'angiotensina II determina una riduzione della perdita di potassio associata ai tiazidi.
Tumore della pelle non melanoma
I seguenti dati raccolti da studi epidemiologici indicano una correlazione tra l'esposizione a idroclorotiazide e lo sviluppo di NMSC associato a dosi cumulative. Uno studio ha incluso una popolazione con 71533 casi di carcinoma basocellulare e 8629 casi di carcinoma a cellule squamose, oltre a 1430833 e 172462 controlli corrispondenti. Una forte esposizione a idroclorotiazide (dose cumulativa ≥50000 mg) è stata associata a una risposta obiettiva (objective response, OR) di 1.29 (IC 95%: 1.23-1.35) per il carcinoma basocellulare e 3.98 (IC 95%: 3.68-4.31) per il carcinoma a cellule squamose. Sia nel carcinoma basocellulare sia nel carcinoma a cellule squamose è stata individuata una relazione dose-risposta cumulativa univoca. In un ulteriore studio è stata mostrata una possibile correlazione tra carcinoma del labbro (carcinoma a cellule squamose) ed esposizione a idroclorotiazide: 633 casi di carcinoma del labbro e 63067 controlli corrispondenti sono stati messi a confronto utilizzando una strategia di «risk-set-sampling». Si è potuto dimostrare una relazione dose-risposta cumulativa univoca con una aumento dell'OR aggiustato da 2.1 (IC 95%: 1.7-2.6) a 3.9 (3.0-4.9) con una dose cumulativa elevata (≥25000 mg) e a 7.7 (5.7-10.5) con la dose cumulativa massima (≥100000 mg). Esempio: una dose cumulativa da 100000 mg corrisponde all'assunzione quotidiana di una dose giornaliera definita pari a 25 mg per un periodo di tempo >10 anni (vedere rubrica «Avvertenze e misure precauzionali» e «Effetti indesiderati»)
Farmacocinetica
Valsartan
Assorbimento
In seguito all'assunzione orale di valsartan, le concentrazioni plasmatiche di picco (Cmax) vengono raggiunte entro 2-4 ore. La media della biodisponibilità assoluta di valsartan è del 23% (intervallo 23 ± 7). Nell'intervallo di dosi esaminato, la farmacocinetica di valsartan è lineare. Con l'assunzione una volta al giorno, valsartan si accumula in misura solo limitata. Le concentrazioni plasmatiche erano simili tra uomini e donne.
Con l'assunzione durante i pasti si osserva una riduzione del 48% dell'area sotto la curva di concentrazione plasmatica (AUC) e del 59% della Cmax di valsartan. Le concentrazioni plasmatiche sono comunque simili a partire da 8 ore dopo l'assunzione di La media della biodisponibilità valsartan a digiuno o a stomaco pieno. La riduzione dell'AUC e della Cmax non comporta una riduzione clinicamente significativa dell'effetto terapeutico, pertanto l'assunzione di valsartan può avvenire indipendentemente dai pasti.
Distribuzione
Valsartan si lega fortemente (per il 94-97%) alle proteine sieriche, soprattutto all'albumina. Lo stato stazionario viene raggiunto nell'arco di 1 settimana. Il volume di distribuzione allo stato stazionario dopo somministrazione endovenosa di valsartan è di circa 17 l, ciò indica che valsartan non si distribuisce estensivamente nei tessuti.
Rispetto alla circolazione epatica (circa 30 l/ora), la clearance plasmatica avviene in maniera relativamente lenta (circa 2 l/h).
Metabolismo
Valsartan non viene biotrasformato in misura elevata poiché solo circa il 20% della dose viene recuperato sotto forma di metaboliti. Un metabolita idrossilico è stato identificato nel plasma a basse concentrazioni (inferiori al 10% dell'AUC di valsartan). Questo metabolita è farmacologicamente inattivo.
Eliminazione
Valsartan mostra una cinetica di decadimento multiesponenziale (emivita iniziale <1 ora ed emivita terminale beta di circa 9 ore). Valsartan viene eliminato prevalentemente nelle feci (circa l'83% della dose) e nelle urine (circa il 13% della dose), principalmente in forma immodificata. In seguito a somministrazione endovenosa, la clearance plasmatica di valsartan è di circa 2 l/ora e la sua clearance renale è di circa 0,62 l/ora (circa il 30% della clearance totale). L'emivita di valsartan è di 6 ore.
Idroclorotiazide
Assorbimento
In seguito a somministrazione orale, idroclorotiazide viene assorbito rapidamente (tmax circa 2 ore).
All'interno dell'intervallo terapeutico, l'aumento dell'AUC media è lineare e proporzionale alla dose. L'assunzione con del cibo può, rispetto all'assunzione a digiuno, causare sia un aumento sia una diminuzione della disponibilità sistemica di idroclorotiazide. Gli effetti sono minimi e rivestono un'importanza clinica limitata.
La biodisponibilità assoluta di idroclorotiazide in seguito a somministrazione orale è di circa il 70%.
Distribuzione, eliminazione
Distribuzione ed eliminazione sono stati ampiamente descritte come aventi una cinetica biesponenziale.
Il volume apparente di distribuzione è di 4-8 l/kg. L'idroclorotiazide circolante è legato per il 40-70% alle proteine sieriche, soprattutto all'albumina sierica. L'idroclorotiazide si accumula negli eritrociti con una concentrazione che è circa 3 volte quella osservata nel plasma.
L'idroclorotiazide viene eliminato principalmente in forma immodificata. Nella fase di eliminazione terminale, idroclorotiazide viene eliminato dal plasma con un'emivita che va in media dalle 6 alle 15 ore. La cinetica di idroclorotiazide non cambia a somministrazioni ripetute e con la somministrazione una volta al giorno si osserva un accumulo solo limitato.
Oltre il 95% della quantità assorbita viene eliminato attraverso i reni.
Valsartan/idroclorotiazide
La disponibilità sistemica di idroclorotiazide si riduce di circa il 30% in caso si somministrazione concomitante di valsartan. La cinetica di valsartan non viene alterata in misura apprezzabile con la somministrazione concomitante di idroclorotiazide. L'interazione osservata non influisce sull'impiego concomitante di valsartan e idroclorotiazide, in quanto in studi clinici controllati è stato evidenziato un effetto pressorio significativo, maggiore rispetto a quello prodotto dalle singole sostanze.
Cinetica di gruppi di pazienti specifici
Pazienti anziani
Rispetto a volontari giovani, in alcuni pazienti anziani (>65 anni) è stata osservata una disponibilità sistemica di valsartan leggermente maggiore, che tuttavia non si è dimostrata clinicamente rilevante.
Rispetto ai pazienti giovani, nei pazienti anziani la concentrazione di idroclorotiazide allo stato stazionario è maggiore, mentre la clearance sistemica è considerevolmente più lenta. Pertanto si raccomanda un attento monitoraggio nei pazienti anziani che vengono trattati con idroclorotiazide.
Pazienti con patologia funzionale renale
Valsartan
Come prevedibile per una sostanza con un'eliminazione renale corrispondente ad appena il 30% dell'eliminazione plasmatica complessiva, non è stata individuata alcuna correlazione tra funzionalità renale e disponibilità sistemica di valsartan. Di conseguenza non è richiesto alcun adeguamento posologico per pazienti con patologia funzionale renale (per
l'insufficienza renale grave, v. «Controindicazioni»). Non sono stati condotti studi con pazienti dializzati. Tuttavia, poiché valsartan si lega fortemente alle proteine plasmatiche, non è prevedibile una sua eliminazione attraverso la dialisi.
Idroclorotiazide
La clearance renale di idroclorotiazide avviene sia per filtrazione passiva sia per secrezione attiva nei tubuli renali. Come prevedibile per una sostanza che viene eliminata quasi esclusivamente tramite i reni, la funzionalità renale influisce in maniera sostanziale sulla cinetica di idroclorotiazide (v. «Controindicazioni»).
La presenza di patologie funzionali renali determina un aumento della media delle concentrazioni massime e dei valori AUC di idroclorotiazide e la riduzione dell'escrezione nelle urine. A causa della significativa riduzione della clearance renale, nei pazienti con insufficienza renale da lieve a moderatamente grave l'emivita media di eliminazione è quasi raddoppiata.
L'idroclorotiazide può essere eliminato con la dialisi.
Pazienti con disturbi della funzionalità epatica
In uno studio di farmacocinetica condotto in pazienti con disturbi della funzionalità epatica da lievi a moderati, la concentrazione di valsartan è risultata aumentata quasi del doppio rispetto ai volontari sani. Non esistono dati per quanto riguarda i pazienti con gravi disturbi della funzionalità epatica (v. «Controindicazioni»).
Le malattie del fegato comportanti riduzioni da lievi a moderate della funzionalità epatica generalmente non influiscono in misura significativa sulla farmacocinetica di idroclorotiazide.
Dati preclinici
Valsartan:idroclorotiazide
In vari studi preclinici condotti su diversi animali non sono emersi risultati che indichino l'inopportunità dell'impiego di dosaggi terapeutici di valsartan:idroclorotiazide nell'uomo.
Valsartan
Sulla base di studi convenzionali di sicurezza farmacologica, genotossicità, cancerogenicità e fertilità e a parte la tossicità fetale osservata nei conigli, i dati preclinici non rivelano rischi particolari per l'uomo.
Tossicità cronica: in studi preclinici di sicurezza, a dosaggi elevati di valsartan (200-600 mg/kg di peso corporeo/die) sono state osservate nei ratti una riduzione dei parametri legati ai globuli rossi (eritrociti, emoglobina, ematocrito) e alterazioni dell'emodinamica renale (lieve aumento dei livelli di urea nel sangue così come iperplasia dei tubuli renali e basofilia negli animali di sesso maschile). I dosaggi somministrati ai ratti (200 e 600 mg/kg/die) corrispondono a 6 e 18 volte i dosaggi raccomandati nell'uomo su base mg/m2 (il calcolo si basa su una dose da 320 mg/die somministrata per via orale in un paziente di 60 kg di peso). Nelle marmosette, a dosaggi analoghi, le alterazioni erano simili, ma più gravi. Ciò è risultato valido soprattutto per i reni, in cui le alterazioni sono evolute in una nefropatia con livelli aumentati di urea e creatinina. Inoltre in entrambe le specie sono state osservate ipertrofie delle cellule iuxtaglomerulari renali. Tutte queste alterazioni sono state causata presumibilmente dall'azione farmacologica di valsartan, che, soprattutto nelle marmosette, provoca ipotensione persistente. A dosi terapeutiche per l'uomo, l'ipertrofia delle cellule iuxtaglomerulari renali non sembra essere rilevante.
Tossicità per la riproduzione: valsartan non ha alcun effetto indesiderato sulla capacità riproduttiva dei ratti di sesso maschile e femminile con la somministrazione orale di dosi fino a 200 mg/kg/die. In studi sullo sviluppo fetale (segmento II) condotti su topi, ratti e conigli, è stata osservata, oltre a tossicità materna, fetotossicità a dosaggi di valsartan pari a 600 mg/kg/die per i ratti e 10 mg/kg/die per i conigli. In uno studio sulla tossicità per lo sviluppo peri- e postnatale (segmento III), nei cuccioli di ratto i cui genitori avevano ricevuto 600 mg/kg/die nel terzo trimestre e durante l'allattamento sono stati osservati una leggera riduzione del tasso di sopravvivenza e un lieve ritardo dello sviluppo.
Mutagenicità: in diversi studi di genotossicità in vitro e in vivo si è potuta dimostrare l'assenza per valsartan di un potenziale mutageno a livello sia genico sia cromosomico.
Cancerogenicità: con la somministrazione di valsartan nel mangime a dosaggi fino a 160 o 200 mg/kg/die per 2 anni in topi e ratti non sono stati ravvisati segni di cancerogenicità.
Idroclorotiazide
Idroclorotiazide è stato testato per mutagenicità, clastogenicità, cancerogenicità e capacità riproduttiva, con risultati negativi.
Mutagenicità: il potenziale mutageno è stato valutato alla luce di una serie di test in vitro e in vivo. Se nelle analisi in vitro sono emersi alcuni risultati positivi, tutti gli studi in vivo hanno dato esito negativo. Idroclorotiazide ha aumentato la formazione indotta da UVA di dimeri di pirimidina in vitro e nella pelle dei topi in seguito alla somministrazione orale. Se ne conclude che non esiste in vivo alcun potenziale mutageno rilevante, anche se idroclorotiazide potrebbe potenziare gli effetti genotossici della luce UVA.
Cancerogenicità: i dati sperimentali disponibili non hanno fornito elementi a sostegno di un effetto cancerogeno di idroclorotiazide nei ratti e nei topi (tumori epatocellulari nei topi sono stati osservati solo in animali maschi trattati a dosi elevate; la frequenza non supera quella descritta dai controlli storici).
Tossicità per la riproduzione: idroclorotiazide non si è dimostrato teratogeno e non ha mostrato alcun effetto su fertilità e concepimento. In 3 specie animali esaminate che avevano ricevuto una dose almeno 10 volte quella di circa 1 mg/kg raccomandata nell'uomo non è emerso alcun potenziale teratogeno. L'aumento ponderale ridotto nei piccoli di ratto allattati è stato attribuito alla dose elevata (15 volte la dose nell'uomo) e all'effetto diuretico di idroclorotiazide, con le relative conseguenze sulla produzione di latte.
Altre indicazioni
Stabilità
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazioni particolari concernenti l'immagazzinamento
Conservare Valsartan HCT Zentiva nella confezione originale al riparo dall'umidità, al di sotto dei 25 °C.
Tenere il medicamento fuori dalla portata dei bambini.
Numero dell'omologazione
61472 (Swissmedic).
Titolare dell’omologazione
Helvepharm AG, Frauenfeld.
Stato dell'informazione
Settembre 2020.
Composition
Principes actifs
Valsartanum, Hydrochlorothiazidum.
Excipients
80/12.5 mg: Cellulosum microcristallinum, Silica colloidalis anhydrica, Sorbitolum 9.25 mg (E 420), Magnesii carbonas, Amylum pregelificatum, Povidonum K 30, Natrii stearylis fumaras, Natrii laurilsulfas, Crospovidonum.
Enrobage: Lactosum monohydricum 0.168 mg, Hypromellosum, Talcum, Macrogolum 6000, Ferri oxidum rubrum (E 172), Indigocarminum (E 132).
1 comprimé pelliculé Valsartan HCT Zentiva 80/12.5 mg contient 0.316 mg sodium.
160/12.5 mg: Cellulosum microcristallinum, Silica colloidalis anhydrica, Sorbitolum 18.5 mg (E 420), Magnesii carbonas, Amylum pregelificatum, Povidonum K 30, Natrii stearylis fumaras, Natrii laurilsulfas, Crospovidonum.
Enrobage: Lactosum monohydricum 0.887 mg, Hypromellosum, Talcum, Macrogolum 6000, Ferri oxidum rubrum (E 172), Indigocarminum (E 132).
1 comprimé pelliculé Valsartan HCT Zentiva 160/12.5 mg contient 0.623 mg sodium.
160/25 mg: Cellulosum microcristallinum, Silica colloidalis anhydrica, Sorbitolum 18.5 mg (E 420), Magnesii carbonas, Amylum pregelificatum, Povidonum K 30, Natrii stearylis fumaras, Natrii laurilsulfas, Crospovidonum.
Enrobage: Lactosum monohydricum 0.942 mg, Hypromellosum, Talcum, Macrogolum 6000, Ferri oxidum flavum (E 172), Ferri oxidum fuscum (E 172), Indigocarminum (E 132).
1 comprimé pelliculé Valsartan HCT Zentiva 160/25 mg contient 0.623 mg sodium.
Forme pharmaceutique et quantité de principe actif par unité
Valsartan HCT Zentiva 80/12.5 mg
Comprimés pelliculés à 80 mg de Valsartanum et 12.5 mg de Hydrochlorothiazidum.
Comprimés pelliculés ronds, non sécables, rosés.
Valsartan HCT Zentiva 160/12.5 mg
Comprimés pelliculés à 160 mg de Valsartanum et 12.5 mg de Hydrochlorothiazidum.
Comprimés pelliculés ronds, non sécables, brun rouge.
Valsartan HCT Zentiva 160/25 mg
Comprimés pelliculés à 160 mg de Valsartanum et 25 mg de Hydrochlorothiazidum.
Comprimés pelliculés ronds, non sécables, brun orange.
Indications/Possibilités d’emploi
Traitement de l'hypertension essentielle légère à modérée chez les patients insuffisamment contrôlés par une monothérapie.
Posologie/Mode d’emploi
La posologie recommandée est de 1 comprimé pelliculé de Valsartan HCT Zentiva 80/12.5 mg par jour. En cas de baisse insuffisante de la pression artérielle après 3 à 4 semaines de traitement, la poursuite du traitement par 1 comprimé pelliculé de Valsartan HCT Zentiva 160/12.5 mg par jour peut s'avérer nécessaire. Le traitement par 1 comprimé pelliculé de Valsartan HCT Zentiva 160/25 mg par jour est réservé aux patients qui ont présenté une baisse insuffisante de la pression artérielle sous Valsartan HCT Zentiva 160/12.5 mg. L'effet antihypertenseur maximal est observé au bout de 2-4 semaines.
Valsartan HCT Zentiva peut être pris pendant ou en dehors des repas. Avaler Valsartan HCT Zentiva avec un peu de liquide.
Utilisation chez les patients âgés (plus de 65 ans)
Valsartan HCT Zentiva peut être utilisé indépendamment de l'âge du patient.
Utilisation en cas de limitation de la fonction rénale
Une réduction posologique peut être nécessaire chez les patients présentant une limitation de la fonction rénale. Contenant comme principe actif de l'hydrochlorothiazide, Valsartan HCT Zentiva est contre-indiqué chez les patients présentant une anurie (cf. «Contre-indications») et doit être utilisé avec une prudence particulière chez les patients atteints d'insuffisance rénale sévère (TFG <30 ml/min) (cf. «Mises en garde et précautions»).
Aucune expérience n'est disponible sur l'utilisation de valsartan chez les patients atteints d'insuffisance rénale terminale (TFG <10 ml/min) ou chez les patients dialysés.
Utilisation en cas de limitation de la fonction hépatique
Une réduction posologique peut être nécessaire chez les patients présentant une limitation de la fonction hépatique. Contenant comme principe actif de l'hydrochlorothiazide, Valsartan HCT Zentiva doit être utilisé avec prudence chez les patients atteints d'insuffisance hépatique (cf. «Mises en garde et précautions»). Contenant comme principe actif du valsartan, Valsartan HCT Zentiva est contre-indiqué chez les patients avec cirrhose biliaire et cholestase.
Utilisation chez l'enfant et l'adolescent
L'efficacité et la sécurité du Valsartan HCT Zentiva n'ont pas été étudiées dans le traitement des enfants et des adolescents de moins de 18 ans.
Contre-indications
- Hypersensibilité au valsartan ou à l'hydrochlorothiazide, à l'un des composants de Valsartan HCT Zentiva ou aux dérivés des sulfamidés.
- Valsartan HCT Zentiva est contre-indiqué chez les patients présentant un angiooedème héréditaire ou chez ceux ayant développé un oedème angioneurotique lors d'un traitement antérieur par un inhibiteur de l'ECA ou un antagoniste des récepteurs de l'angiotensine II.
- Grossesse et allaitement (cf. «Grossesse/Allaitement»).
- Cirrhose biliaire ou cholestase.
- Anurie.
- Administration concomitante d'antagonistes des récepteurs de l'angiotensine (ARA), y compris Valsartan HCT Zentiva, ou d'inhibiteurs de l'enzyme de conversion de l'angiotensine (IEC) avec l'aliskirène chez les patients atteints de diabète sucré (de type 1 ou de type 2) ainsi que chez les patients atteints d'insuffisance rénale (TFG <60 ml/min) (cf. rubrique «Interactions», sous-section «Double blocage du SRAA»).
Mises en garde et précautions
Électrolytes
Potassium
Les diurétiques thiazidiques peuvent provoquer une hypokaliémie ou aggraver une hypokaliémie préexistante. En cas de maladies s'accompagnant d'une perte accrue de potassium, les thiazides doivent être administrés avec prudence et sous contrôle régulier de la kaliémie sérique.
Avant de débuter un traitement par des thiazides, il est conseillé de corriger une hypokaliémie. La présence simultanée d'une carence en magnésium peut rendre difficile la correction d'une hypokaliémie. Valsartan HCT Zentiva contenant un inhibiteur des récepteurs de l'angiotensine II, toute substitution de potassium sous traitement par Valsartan HCT Zentiva doit être soigneusement évaluée et réalisée avec prudence. Les concentrations de potassium et de magnésium doivent être contrôlées régulièrement. Tous les patients recevant des diurétiques thiazidiques doivent être surveillés à la recherche d'un déséquilibre électrolytique.
Sodium
Les diurétiques thiazidiques peuvent provoquer la survenue d'une nouvelle hyponatrémie ou aggraver une hyponatrémie préexistante. Celle-ci peut s'accompagner de symptômes neurologiques (vomissements, confusion, apathie). Les diurétiques thiazidiques ne doivent être administrés qu'après avoir corrigé une hyponatrémie préexistante. Une surveillance régulière de la concentration sérique de sodium est nécessaire.
Calcium
Les diurétiques thiazidiques diminuent l'excrétion urinaire de calcium et peuvent provoquer une augmentation du calcium sérique. Les diurétiques thiazidiques ne doivent être commencés qu'après avoir corrigé une hypercalcémie préexistante ou traité la maladie causale. Une surveillance régulière de la concentration sérique de calcium est nécessaire.
Hypovolémie
Chez les patients présentant une hypovolémie pertinente, une hypotension symptomatique peut survenir après le début du traitement par Valsartan HCT Zentiva.
Une hypovolémie préexistante doit être corrigée avant le début du traitement.
Sténose de l'artère rénale
Une grande prudence est recommandée lors de l'utilisation de Valsartan HCT Zentiva chez les patients présentant une sténose de l'artère rénale unie ou bilatérale ou sur un seul rein, car les taux d'urée dans le sang et de créatinine sérique peuvent être augmentés chez de tels patients.
Insuffisance rénale
La prudence est recommandée lors du traitement de patients atteints d'insuffisance rénale. Lors d'insuffisance rénale sévère (TFG <30 ml/min), les diurétiques thiazidiques peuvent perdre leur efficacité diurétique. L'administration de Valsartan HCT Zentiva à ces patients nécessite une évaluation préalable précise du rapport bénéfice/risque, ainsi que le contrôle des paramètres cliniques et biochimiques.
Chez les patients insuffisants rénaux (TFG <60 ml/min), l'administration concomitante d'ARA, y compris de Valsartan HCT Zentiva, ou d'IEC avec l'aliskirène est contre-indiquée (cf. rubrique «Interactions», sous-section «Double blocage du SRAA»).
Aucune expérience n'est disponible sur l'utilisation de valsartan chez les patients atteints d'insuffisance rénale terminale (TFG <10 ml/min) ou chez les patients dialysés.
Insuffisance hépatique
La prudence est recommandée lors du traitement de patients atteints d'insuffisance hépatique. Chez ces patients, les thiazides peuvent déclencher des déséquilibres électrolytiques, des encéphalopathies hépatiques ainsi qu'un syndrome hépatorénal. L'administration de Valsartan HCT Zentiva à ces patients nécessite une évaluation préalable précise du rapport bénéfice/risque, ainsi que le contrôle des paramètres cliniques et biochimiques. Valsartan HCT Zentiva est contre-indiqué chez les patients avec cirrhose biliaire et cholestase.
Angio-œdème
Des angio-œdèmes y compris des gonflements du larynx et de la glotte ayant entraîné une gêne des voies aériennes et/ou un gonflement du visage, des lèvres, du pharynx et/ou de la langue ont été observés chez des patients traités par le valsartan. Certains de ces patients avaient déjà présenté par le passé des angio-œdèmes lors de la prise d'autres médicaments, y compris des inhibiteurs de l'ECA. L'administration de Valsartan HCT Zentiva doit être immédiatement interrompue chez les patients présentant un angio-œdème et Valsartan HCT Zentiva ne doit plus jamais leur être administré.
Lupus érythémateux systémique
Les diurétiques thiazidiques, y compris l'hydrochlorothiazide, peuvent déclencher ou aggraver un lupus érythémateux systémique.
Effets métaboliques
En raison d'une diminution de la clairance de l'acide urique, Valsartan HCT Zentiva peut augmenter la concentration sérique d'acide urique, provoquer ou aggraver une hyperuricémie et déclencher des crises de goutte chez les patients prédisposés. L'utilisation de Valsartan HCT Zentiva est donc déconseillée chez les patients présentant une hyperuricémie et/ou une goutte.
Les diurétiques thiazidiques y compris l'hydrochlorothiazide peuvent modifier la tolérance au glucose et entraîner une dégradation de l'équilibre métabolique d'un diabète. Les taux sériques de cholestérol et de triglycérides peuvent augmenter lors de l'utilisation d'hydrochlorothiazide.
Effets divers
La survenue de réactions d'hypersensibilité à l'hydrochlorothiazide est plus probable chez les patients allergiques et asthmatiques.
Effusion choroïdienne, myopie aiguë et glaucome secondaire aigu par fermeture de l'angle
Les sulfonamides ainsi que les médicaments dérivés des sulfonamides peuvent provoquer une réaction idiosyncrasique susceptible d'entraîner une effusion choroïdienne accompagnée d'une dégradation du champ visuel, d'une myopie passagère et d'un glaucome aigu par fermeture de l'angle. Les symptômes comprennent une perte de l'acuité visuelle ou des douleurs oculaires aiguës et se manifestent généralement dans les heures à semaines qui suivent le début du traitement. Non traité, un glaucome aigu par fermeture de l'angle peut entraîner une perte d'acuité visuelle permanente.
Le traitement primaire consiste à arrêter immédiatement le médicament. Si la pression intraoculaire reste élevée, un traitement médical immédiat ou une intervention chirurgicale doivent être envisagés. Les facteurs de risque de développement d'un glaucome aigu par fermeture de l'angle peuvent être des antécédents d'allergie aux sulfonamides ou à la pénicilline.
Patients atteints d'insuffisance cardiaque et ayant des antécédents d'infarctus du myocarde
Chez les patients dont la fonction rénale dépend de l'activité du système rénine-angiotensine-aldostérone (p.ex. patients atteints d'insuffisance cardiaque sévère), le traitement par des inhibiteurs de l'ECA ou par des antagonistes des récepteurs de l'angiotensine a été associé à une oligurie et/ou à une azotémie progressive et, dans de rares cas, à une défaillance rénale aiguë et/ou à un décès. La fonction rénale doit toujours être contrôlée lors de l'examen de patients atteints d'insuffisance cardiaque ou ayant déjà souffert d'un infarctus du myocarde.
Fertilité
Il n'existe pas de données sur l'effet du valsartan sur la fertilité humaine. Les études chez le rat n'ont montré aucun effet du valsartan sur la fertilité (cf. «Données précliniques»).
Double blocage du système rénine-angiotensine-aldostérone (SRAA)
(cf. «Contre-indications» et «Interactions», sous-section «Double blocage du SRAA».)
Cancer de la peau non-mélanome (CPNM)
Dans deux études épidémiologiques basées sur le registre des cancers national danois, une augmentation du risque de cancer de la peau non mélanome (CPNM) (carcinome basocellulaire et carcinome épidermoïde) associée à une augmentation de l'exposition à une dose cumulée d'hydrochlorothiazide a été constatée. Le risque de CPNM semble augmenter en cas d'une utilisation sur une longue durée (voir rubrique «Propriétés/Effets»). L'effet photosensibilisant de l'hydrochlorothiazide pourrait être impliqué dans le développement du CPNM en tant que mécanisme potentiel.
Les patients qui utilisent l'hydrochlorothiazide doivent être informés du risque de CPNM et doivent être instruits sur la nécessité de contrôler régulièrement si leur peau présente de nouvelles lésions et de signaler immédiatement d'éventuelles modifications suspectes de leur peau. Afin de minimiser le risque de cancer de la peau, il faut conseiller aux patients d'adopter les mesures de prévention possibles telles que p.ex. une limitation de l'exposition à la lumière du soleil/aux UV et l'utilisation d'une protection solaire appropriée en cas d'exposition au soleil. Les modifications suspectes de la peau doivent immédiatement être examinées, le cas échéant au moyen d'une analyse histologique de biopsies. Par ailleurs, l'utilisation de l'hydrochlorothiazide doit éventuellement être reconsidérée chez les patients ayant des antécédents de CPNM (voir rubrique «Effets indésirables»).
Lactose
Valsartan HCT Zentiva contient du lactose. Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé pelliculé, c.-à-d. qu'il est essentiellement «sans sodium».
Sorbitol (E 420)
Les comprimés pelliculés Valsartan HCT Zentiva contiennent de sorbitol. L'effet additif des produits administrés concomitamment contenant du sorbitol (ou du fructose) et l'apport alimentaire de sorbitol (ou de fructose) doivent être pris en compte. La teneur en sorbitol dans les médicaments à usage oral peut affecter la biodisponibilité d'autres médicaments à usage oral administrés de façon concomitante.
Interactions
Interactions concernant les deux composants
Lithium
Les interactions susceptibles de survenir lors de l'utilisation des deux composants (valsartan et/ou hydrochlorothiazide) de Valsartan HCT Zentiva sont les suivantes:
Une augmentation réversible de la concentration sérique de lithium et une toxicité du lithium ont été observées lors de l'administration concomitante de lithium et d'inhibiteurs de l'ECA, d'antagonistes des récepteurs de l'angiotensine II ou de thiazidiques. Les thiazidiques réduisant la clairance rénale du lithium, la toxicité du lithium peut être plus élevée après l'utilisation de Valsartan HCT Zentiva. Une surveillance étroite de la concentration sérique de lithium est donc recommandée en cas d'administration concomitante.
Anti-inflammatoires non stéroïdiens (AINS), y compris inhibiteurs sélectifs de la cyclo-oxygénase 2 (inhibiteurs de la COX-2):
L'administration d'AINS et d'inhibiteurs de la COX-2 peut entraîner une diminution de l'effet antihypertenseur des antagonistes des récepteurs de l'angiotensine-ll (ARAll). Chez les patients âgés, les patients insuffisants rénaux et ceux présentant une hypovolémie (aussi sous traitement diurétique), l'administration simultanée d'AINS (ou d'inhibiteurs de la COX-2) et d'un ARAll peut augmenter le risque d'aggravation de la fonction rénale (y compris de défaillance rénale aiguë). La prudence est donc recommandée lors de l'association de ces médicaments chez de tels patients et la fonction rénale doit être contrôlée.
Autres antihypertenseurs: L'utilisation de Valsartan HCT Zentiva renforce l'effet antihypertenseur d'autres médicaments hypotenseurs (p.ex. bêtabloquants, vasodilatateurs, inhibiteurs des canaux calciques, inhibiteurs de l'ECA, antagonistes des récepteurs de l'angiotensine (ARA) et inhibiteurs directs de la rénine (IDR)).
Valsartan
Double blocage du système rénine-angiotensine-aldostérone avec des ARA, des IEC ou l'aliskirène: L'administration concomitante d'ARA, y compris de Valsartan HCT Zentiva, avec d'autres médicaments agissant sur le SRAA est associée à une augmentation de l'incidence de l'hypotension, des syncopes, de l'hyperkaliémie et de l'insuffisance rénale (y compris d'une défaillance rénale aigüe) par rapport à une monothérapie. Un double blocage du SRAA par l'utilisation concomittante d'un inhibiteur de l'ECA, d'un ARA ou de l'aliskirène n'est par conséquent pas recommandé. Lorsque le traitement avec un double blocage est considéré comme absolument nécessaire, celui-ci doit se faire sous la surveillance d'un spécialiste et en effectuant des contrôles étroits de la fonction rénale, des électrolytes et de la tension artérielle (cf. rubrique «Mises en garde et précautions»).
Chez les patients insuffisants rénaux (TFG <60 ml/min), l'utilisation concomitante d'ARA, y compris de Valsartan HCT Zentiva, ou d'IEC avec l'aliskirène est contre-indiquée (cf. rubriques «Mises en garde et précautions» et «Contre-indications»).
L'utilisation concomitante d'ARA, y compris de Valsartan HCT Zentiva, ou d'IEC avec l'aliskirène est contre-indiquée chez les patients atteints de diabète de type 1 ou de type 2 (cf. rubrique «Contre-indications»). Les inhibiteurs d'ECA – y compris le Valsartan HCT Zentiva – et les antagonistes du récepteur de l'angiotensine (ARA) ne devraient pas être utilisés de manière concomitante chez les patients présentant une néphropathie diabétique.
Potassium: L'association thérapeutique d'antagonistes des récepteurs de l'angiotensine II et d'autres médicaments susceptibles d'augmenter le potassium sérique (par ex. diurétiques d'épargne potassique, produits contenant du potassium, héparine) peut augmenter le risque d'une hyperkaliémie. L'administration de valsartan, un composant de Valsartan HCT Zentiva, doit être prudente dans de tels cas et impose le contrôle de la kaliémie.
Transporteurs: Des études in vitro avec du tissu hépatique humain indiquent que le valsartan est un substrat du transporteur hépatique d'influx OATP1B1 et du transporteur hépatique d'efflux MRP2. C'est pourquoi l'exposition systémique au valsartan peut augmenter en cas d'administration concomitante d'inhibiteurs des transporteurs OATP1B1 (rifampicine, ciclosporine) ou MRP2 (ritonavir).
Aucune interaction cliniquement significative n'a été observée entre le valsartan administré en monothérapie et les médicaments suivants: cimétidine, warfarine, furosémide, digoxine, aténolol, indométacine, hydrochlorothiazide, amlodipine, glibenclamide.
Hydrochlorothiazide
Médicaments ayant une influence sur le taux sérique de potassium ou de magnésium: Les pertes en potassium et/ou en magnésium peuvent être augmentées par l'administration simultanée d'hydrochlorothiazide et de diurétiques kaliurétiques (par ex. furosémide), de glucocorticoïdes, d'ACTH, d'amphotéricine B, de carbénoxolone, de pénicilline G, de salicylates ou d'antiarrythmiques.
Glucosides cardiotoniques (digitaliques): Une hypokaliémie ou une hypomagnésiémie provoquée par des thiazides peut favoriser l'apparition d'arythmies induites par les digitaliques.
Relaxants musculaires squelettiques: Les diurétiques thiazidiques, y compris l'hydrochlorothiazide, potentialisent l'effet des relaxants musculaires squelettiques de type curare.
Antidiabétiques: Les thiazides peuvent modifier la tolérance au glucose. Un ajustement de la posologie de l'insuline et des antidiabétiques oraux peut s'avérer nécessaire.
Allopurinol: L'administration simultanée de diurétiques thiazidiques, y compris l'hydrochlorothiazide, peut augmenter la probabilité de réactions d'hypersensibilité à l'allopurinol.
Amantadine: L'administration simultanée de diurétiques thiazidiques, y compris de l'hydrochlorothiazide, peut augmenter le risque d'effets indésirables dus à l'amantadine.
Diazoxide: Les diurétiques thiazidiques peuvent renforcer l'effet hyperglycémiant du diazoxide.
Antinéoplasiques (par ex. cyclophosphamide, méthotrexate): Le traitement simultané par des diurétiques thiazidiques peut diminuer l'excrétion rénale des médicaments cytotoxiques et augmenter leurs effets myélosuppresseurs.
Anticholinergiques: La biodisponibilité des diurétiques thiazidiques peut être augmentée par l'administration simultanée d'anticholinergiques (par ex. atropine, bipéridène), vraisemblablement suite à une diminution de la motilité gastro-intestinale et à un ralentissement de la vidange gastrique. Inversement, les médicaments prokinétiques tels que le cisapride peuvent diminuer la biodisponibilité des diurétiques thiazidiques.
Méthyldopa: Des cas isolés d'anémie hémolytique ont été décrits suite à l'association de méthyldopa et d'hydrochlorothiazide.
Résines échangeuses d'ions: La coléstyramine ou le colestipol diminuent la résorption des diurétiques thiazidiques, y compris de l'hydrochlorothiazide. C'est pourquoi il convient d'espacer la prise de l'hydrochlorothiazide de l'administration d'une résine échangeuse d'ions. L'intervalle de temps le plus long possible doit être choisi afin de minimiser les interactions.
Vitamine D: L'utilisation simultanée de diurétiques thiazidiques, y compris l'hydrochlorothiazide, et de vitamine D ou de sels de calcium peut entraîner une forte élévation de la calcémie.
Ciclosporine: Le risque d'une hyperuricémie est vraisemblablement accru par l'administration simultanée de ciclosporine et des symptômes de goutte peuvent se manifester.
Sels de calcium: En raison de l'augmentation de la réabsorption tubulaire de calcium, l'administration simultanée de diurétiques de type thiazidique peut entraîner une hypercalcémie.
Médicaments ayant une influence sur le taux sérique de sodium: L'administration simultanée de médicaments tels qu'antidépresseurs, antipsychotiques, antiépileptiques, etc. peut renforcer l'effet hyponatrémiant des diurétiques. La prudence est recommandée en cas d'utilisation à long terme de ces médicaments.
Alcool, barbituriques ou narcotiques: L'administration simultanée de diurétiques thiazidiques et d'alcool, de barbituriques ou de narcotiques peut aggraver une hypotension orthostatique.
Amines hypertensives: L'hydrochlorothiazide peut réduire la réponse aux amines hypertensives telles que la noradrénaline. La pertinence clinique de cette action ne suffit cependant pas à exclure leur utilisation.
Grossesse/Allaitement
Grossesse
Valsartan HCT Zentiva agissant directement sur le SRAA, il ne doit pas être administré aux femmes enceintes ou aux femmes envisageant une grossesse (cf. «Contre-indications»). Les professionnels prescrivant des médicaments agissant sur le SRAA doivent informer les femmes en âge de procréer des risques potentiels de ces médicaments pendant la grossesse.
En raison du mécanisme d'action des antagonistes des récepteurs de l'angiotensine II, un risque pour l'embryon et le fœtus ne peut pas être exclu. En se basant sur des données rétrospectives, l'utilisation d'inhibiteurs de l'ECA pendant le 1er trimestre a été associée à un risque potentiel de malformations du nouveau-né. Selon certains rapports, la prise de médicaments agissant directement sur le système rénine-angiotensine-aldostérone (SRAA) au cours des 2ème et 3ème trimestres de la grossesse a en outre provoqué des lésions et la mort du fœtus. La perfusion rénale, chez le fœtus humain, dépend du développement du système RAA et commence au cours du 2ème trimestre de la grossesse. C'est pourquoi les risques liés à un traitement par valsartan augmentent pendant les 2ème et 3ème trimestres de la grossesse. Des avortements spontanés, oligoamnios et troubles de la fonction rénale chez le nouveau-né ont été rapportés lorsque des femmes avaient pris du valsartan par mégarde.
Tous les nouveau-nés ayant été exposés au médicament in utero seront soigneusement surveillés pour s'assurer d'une diurèse suffisante, de l'absence d'hyperkaliémie et d'une tension artérielle normale. En cas de besoin, prendre toutes les mesures nécessaires, comme une réhydratation, pour éliminer le médicament de la circulation.
L'exposition in utero à des diurétiques thiazidiques, y compris l'hydrochlorothiazide, peut provoquer un ictère ou une thrombocytopénie chez le fœtus ou le nouveau-né et est éventuellement liée à des effets indésirables autres que ceux connus chez l'adulte.
Interrompre la prise de Valsartan HCT Zentiva si une grossesse se déclare en cours de traitement.
Allaitement
Au cours d'expérimentations animales (rates), on a montré que le valsartan passait dans le lait maternel. L'hydrochlorothiazide traverse le placenta et passe dans le lait maternel. Parce qu'aucune étude n'est disponible chez la femme pendant l'allaitement, une femme qui allaite ne sera pas traitée par Valsartan HCT Zentiva.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Comme d'autres antihypertenseurs, Valsartan HCT Zentiva peut affecter la capacité de réactions, l'aptitude à la conduite et l'aptitude à utiliser des outils ou des machines. La prudence est recommandée.
Effets indésirables
Les effets indésirables suivants ont été observés dans 5 études cliniques contrôlées incluant 7616 patients, dont 4372 ont reçu le valsartan en association à l'hydrochlorothiazide.
«Très fréquent» (≥1/10), «fréquent» (<1/10, ≥1/100), «occasionnel» (<1/100, ≥1/1000), «rare» (<1/1000, ≥1/10'000), «très rare» (<1/10'000), «fréquence inconnue» (ne peut pas être mesurer avec les dates disponibles).
Infections et infestations
Occasionnel: infections virales, fièvre.
Troubles du métabolisme et de la nutrition
Occasionnel: déshydratation.
Fréquence inconnue: hypokaliémie, hyponatrémie.
Affections du système nerveux
Fréquent: céphalée, fatigue, torpeur.
Occasionnel: asthénie, vertiges, insomnie, angoisse, paresthésie.
Rare: dépression.
Fréquence inconnue: syncope.
Affections oculaires
Occasionnel: troubles de la vision.
Rare: conjonctivite.
Affections de l'oreille et du labyrinthe
Occasionnel: otite moyenne, tinnitus/acouphènes.
Affections cardiaques
Occasionnel: palpitations, tachycardie.
Occasionnel: oedèmes, hypotension, hyperhidrose.
Affections respiratoires, thoraciques et médiastinales
Fréquent: toux, rhinite, pharyngite, infections des voies respiratoires supérieures.
Occasionnel: bronchite, dyspnée, sinusite, douleurs pharyngo-laryngées, sécheresse buccale.
Très rare: épistaxis.
Fréquence inconnue: œdème pulmonaire d'origine non cardiaque.
Affections gastro-intestinales
Fréquent: diarrhées.
Occasionnel: douleurs abdominales, troubles digestifs, nausée, gastro-entérite.
Affections musculo-squelettiques et du tissu conjonctif
Fréquent: douleurs dorsales, douleurs articulaires.
Occasionnel: douleurs dans les bras ou dans les jambes, douleurs thoraciques, douleurs de la nuque, arthrite, foulures et claquages, crampes musculaires, myalgies.
Affections du rein et des voies urinaires
Occasionnel: mictions fréquentes, infections des voies urinaires.
Très rare: troubles de la fonction rénale.
Affections des organes de reproduction et du sein
Fréquent: dysfonction érectile.
Troubles généraux et anomalies au site d'administration
Occasionnel: fatigue.
Résultats de laboratoire
Fréquence inconnue: neutropénie.
Une diminution de la kaliémie de plus de 20% a été constatée chez 3.7% des patients traités par Valsartan HCT Zentiva et chez 3.1% des patients sous placebo.
Lors d'études cliniques contrôlées, une augmentation de la créatinine et une augmentation de l'azote uréique a été observée chez 1.9% resp. 14.7% des patients traités par Valsartan HCT Zentiva et chez 0.4% resp. 6.3% des patients sous placebo.
Les événements suivants ont également été observés au cours des études cliniques menées chez des patients hypertendus, indépendamment de leur lien de causalité avec le médicament de l'étude: hypoesthésie, grippe, insomnie, entorse ligamentaire, claquage musculaire, obstruction nasale, rhinopharyngite, douleurs cervicales, œdème périphérique, obstruction des sinus paranasaux.
Les résultats suivants, observés en relation avec le valsartan en monothérapie, n'ont pas été constatés sous Valsartan HCT Zentiva:
Dans de rares cas, une diminution des taux d'hémoglobine et de l'hématocrite peuvent accompagner un traitement par valsartan. Au cours d'études cliniques contrôlées, une baisse significative de l'hématocrite (>20%) chez 0.8% des patients et une baisse des taux d'hémoglobine chez 0.4% des patients ont été observées. En comparaison, ces deux paramètres étaient abaissés chez 0.1% des patients sous placebo.
Une neutropénie est apparue chez 1.9% des patients sous valsartan contre 1.6% sous inhibiteur de l'ECA.
Dans des études cliniques contrôlées, une hausse significative de la concentration sanguine de la créatinine, du potassium et de la bilirubine totale a été observée chez respectivement 0.8%, 4.4% et 6% des patients sous valsartan contre 1.6%, 6.4% et 12.9% des patients sous inhibiteur de l'ECA.
Des augmentations des paramètres de la fonction hépatique ont été signalées occasionnellement sous valsartan.
Aucune surveillance particulière des constantes biologiques n'est nécessaire chez les patients traités par valsartan pour une hypertension essentielle.
Depuis la mise sur le marché de la préparation, la survenue de syncopes, de très rares cas d'angiooedème, rash et prurit ainsi que d'autres réactions d'hypersensibilité comme la maladie sérique et vascularite ont été rapportés. De très rares cas de troubles de la fonction rénale ont aussi été observés.
Une dermatite bulleuse a été rapportée avec une fréquence inconnue.
Valsartan
D'autres événements indésirables ont été rapportés dans le cadre d'études cliniques sur le valsartan, sans qu'une relation de causalité avec le traitement n'ait été établie:
Fréquent: douleurs articulaires.
Occasionnel: oedèmes, asthénie, insomnie, exanthème, diminution de la libido, vertiges.
Rare: gastro-entérite, névralgie.
Très rare: thrombocytopénie, troubles du rythme cardiaque, insuffisance rénale aiguë.
Un seul cas d'angiooedème a été décrit.
Hydrochlorothiazide
Tumeurs bénignes, malignes et non spécifiques (y compris kystes et polypes)
Fréquence inconnue: cancer de la peau non mélanome (carcinome basocellulaire et carcinome épidermoïde).
Affections hématologiques et du système lymphatique
Rare: thrombocytopénie, dans des cas isolés avec purpura.
Très rare: leucopénie, agranulocytose, insuffisance médullaire, anémie hémolytique.
Affections du système immunitaire
Très rare: vasculite nécrosante, réactions d'hypersensibilité.
Troubles du métabolisme et de la nutrition
Très fréquent: hypokaliémie, augmentation des lipides sanguins.
Fréquent: hyponatrémie, hypomagnésiémie, hyperuricémie et diminution de l'appétit.
Rare: hypercalcémie, hyperglycémie, glycosurie, aggravation des troubles métaboliques chez le diabétique.
Très rare: alcalose hypochlorémique.
Affections psychiatriques
Rares: insomnie.
Affections du système nerveux
Rare: céphalées, vertiges ou obnubilation, dépression et paresthésies.
Affections oculaires
Rare: troubles de la vision, surtout dans les premières semaines du traitement.
Fréquence inconnue: effusion choroïdienne.
Affections cardiaques
Rare: troubles du rythme cardiaque.
Fréquent: hypotension orthostatique, pouvant être renforcée par l'effet de l'alcool, d'anesthésiques ou de sédatifs.
Affections respiratoires, thoraciques et médiastinales
Très rare: difficulté respiratoire y compris pneumopathie inflammatoire et oedème pulmonaire.
Affections gastro-intestinales
Fréquent: légère nausée et vomissements.
Rare: douleurs abdominales, constipation, diarrhée.
Très rare: pancréatite.
Affections hépatobiliaires
Rare: cholestase ou ictère.
Affections de la peau et du tissu sous-cutané
Fréquent: urticaires et autre formes d'éruptions cutanées.
Rare: photosensibilisation.
Très rare: nécrolyse épidermique toxique, réactions cutanées semblables au lupus érythémateux, réactivation d'un lupus érythémateux cutané.
Affections des organes de reproduction et du sein
Fréquent: impuissance.
Effets indésirables issus de l'expérience post-commercialisation
Les effets indésirables suivants ont été identifiés au cours de l'expérience post-commercialisation. Ces effets ayant été rapportés de manière volontaire à partir d'une population de taille inconnue, il n'est pas toujours possible d'estimer de manière fiable leur fréquence.
Fréquence inconnue: défaillance rénale aiguë, trouble de la fonction rénale, anémie aplasique, érythème multiforme, pyrexie, spasmes musculaires, sensation de faiblesse, myopie aiguë et glaucome aigu par fermeture de l'angle.
Description d'effets indésirables sélectionnés
Cancer de la peau non mélanome (CPNM) (carcinome basocellulaire et carcinome épidermoïde): sur la base des données disponibles issues d'études épidémiologiques, un lien dépendant de la dose cumulée entre l'exposition à l'hydrochlorothiazide et le développement du CPNM a été observé (voir rubriques «Mises en garde et précautions» et «Propriétés/Effets»).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Un surdosage au valsartan peut s'exprimer sous forme d'une hypotension artérielle prononcée, qui peut à son tour déclencher des troubles de conscience, un collapsus cardio-vasculaire et/ou un choc.
En outre, un surdosage en hydrochlorothiazide peut faire apparaître les signes et symptômes suivants: nausées, somnolence, hypovolémie, déséquilibres hydro-électrolytiques associés à des arythmies et spasmes musculaires.
Des mesures de soutien générales doivent être instaurées dans tous les cas de surdosage. Celles-ci peuvent comporter une surveillance étroite de la fonction cardio-circulatoire et des mesures de stabilisation de celle-ci.
En raison de sa forte liaison aux protéines plasmatiques, le valsartan ne peut pas être éliminé par hémodialyse. En revanche, l'hydrochlorothiazide peut être éliminé par dialyse.
Propriétés/Effets
Code ATC
C09DA03
Valsartan
L'hormone active du système rénine-angiotensine-aldostérone (SRAA) est l'angiotensine II. Elle est formée à partir de l'angiotensine I par l'intermédiaire de l'enzyme de conversion de l'angiotensine (ECA). L'angiotensine II se lie à des récepteurs spécifiques situés dans les membranes cellulaires de divers tissus. Ses effets physiologiques sont variés, avec notamment une action directe et indirecte sur la régulation de la tension artérielle. L'angiotensine II est un vasoconstricteur puissant qui fait directement augmenter la tension artérielle. Elle favorise en outre la rétention sodée et stimule la sécrétion d'aldostérone.
Le valsartan, en administration orale, est un antagoniste efficace et spécifique de l'angiotensine II. Il agit de manière sélective sur le récepteur sous-type AT1 responsable des effets connus de l'angiotensine II. Après blocage des récepteurs AT1 par le valsartan, les taux plasmatiques élevés d'angiotensine II peuvent stimuler les récepteurs libres d'AT2. Ceci semble s'additionner à l'effet antagoniste des récepteurs AT1. Aucune action agoniste partielle sur le récepteur AT1 n'a été mise en évidence pour le valsartan dont l'affinité est environ 20'000 fois plus forte pour le récepteur AT1 que pour le récepteur AT2.
Le valsartan n'a pas d'action inhibitrice sur l'ECA (appelée aussi kininase II) qui convertit l'angiotensine I en angiotensine II et dégrade aussi la bradykinine. Il est peu vraisemblable que les antagonistes de l'angiotensine II provoquent une toux d'irritation dans la mesure où ils n'agissent pas sur l'ECA et ne potentialisent pas l'action de la bradykinine ou de la substance P.
Les études cliniques comparant le valsartan et un inhibiteur de l'ECA ont montré que l'incidence d'une toux sèche était significativement plus faible (p <0.05) chez les patients traités par valsartan que ceux traités par un inhibiteur de l'ECA (2.6% contre 7.9%). Au cours d'une étude clinique incluant des patients avec des antécédents de toux sèche sous inhibiteur de l'ECA, cette toux est apparue chez 19.5% des sujets sous valsartan, chez 19% des sujets sous diurétique thiazidique et chez 68.5% des patients sous inhibiteurs de l'ECA (p <0.05). Dans des études cliniques contrôlées, la fréquence de toux chez les patients traités par le valsartan et l'hydrochlorothiazide en association a été de 2.9%.
Le valsartan ne se lie à aucun autre récepteur hormonal ou canal ionique connus pour influencer la régulation cardiovasculaire.
Le valsartan diminue la tension artérielle chez les patients hypertendus, sans toutefois influencer la fréquence cardiaque.
Chez la plupart des patients, l'effet antihypertenseur se manifeste dans les 2 h après une dose orale unique, la réduction tensionnelle maximale étant obtenue dans les 4-6 h. L'effet antihypertenseur persiste pendant les 24 h qui suivent la prise. Une baisse tensionnelle maximale est généralement obtenue en 2-4 semaines après le début du traitement et se maintient pendant le traitement au long cours. L'association de valsartan et d'hydrochlorothiazide permet d'obtenir une réduction supplémentaire significative de la tension artérielle.
L'arrêt du traitement par valsartan n'entraîne pas de brusque montée de la tension artérielle (effet rebond) ou d'autres événements indésirables.
Le valsartan n'influence pas les valeurs à jeun du cholestérol total, des triglycérides ou de la glycémie ni les taux d'acide urique chez l'hypertendu.
Hydrochlorothiazide
Le site d'action principal des diurétiques thiazidiques est la partie initiale du tube contourné distal. On a pu montrer que le cortex rénal contient un récepteur de haute affinité qui représente le site de liaison primaire et d'action des diurétiques thiazidiques qui inhibent le transport du NaCl dans la partie initiale du tube contourné distal. L'action des thiazides résulte de l'inhibition du symport Na+Cl-. L'influence sur la réabsorption électrolytique résulte vraisemblablement d'une occupation du site de liaison Cl- sur un mode compétitif: celle-ci entraîne directement une augmentation de l'excrétion d'ions sodium et chlorure en quantité équivalente. Indirectement, elle provoque une diminution du volume plasmatique et, en conséquence, une élévation de l'activité rénine plasmatique et de la sécrétion d'aldostérone, une augmentation de l'excrétion potassique et une diminution du taux sérique de potassium.
La liaison rénine-aldostérone étant médiée par l'angiotensine II, l'administration simultanée d'un antagoniste du récepteur d'angiotensine II permet de diminuer les pertes potassiques liées à l'utilisation des thiazides.
Cancer de la peau non-mélanome
Les données disponibles issues d'études épidémiologiques indiquent un rapport dépendant de la dose cumulée entre l'exposition à l'hydrochlorothiazide et le développement du CPNM. L'une des études comprenant une population de 71'533 cas de carcinome basocellulaire et 8629 cas de carcinome épidermoïde, ainsi que respectivement 1'430'833 et 172'462 personnes dans les populations témoins correspondantes. Une exposition élevée à l'hydrochlorothiazide (dose cumulée ≥50'000 mg) était associée à un OR ajusté de 1.29 (IC à 95%: 1.23-1.35) pour un carcinome basocellulaire et 3.98 (IC à 95%: 3.68-4.31) pour un carcinome épidermoïde. Dans le cas du carcinome basocellulaire comme dans le cas du carcinome épidermoïde, une relation évidente entre dose cumulée et effet a été constatée. Dans une étude supplémentaire, un rapport potentiel entre le carcinome des lèvres (carcinome épidermoïde) et l'exposition à l'hydrochlorothiazide a été démontré: 633 cas de carcinome des lèvres et 63'067 personnes de la population témoin ont été comparés en utilisant une stratégie de «Risk-Set-Sampling». Une relation évidente entre dose cumulée et effet avec une augmentation de l'OR ajusté de 2.1 (IC à 95%: 1.7-2.6) à 3.9 (3.0-4.9) dans le cas d'une dose cumulée élevée (≥25'000 mg) et une augmentation de l'OR ajusté de 7.7 (5.7-10.5) dans le cas de la dose cumulée la plus élevée (≥100'000 mg) a pu être démontrée. Exemple: une dose cumulée de 100'000 mg correspond à l'utilisation quotidienne d'une dose journalière définie de 25 mg sur une période de >10 ans (voir rubrique «Mises en garde et précautions» et «Effets indésirables»).
Pharmacocinétique
Valsartan
Absorption
Après administration orale de valsartan, le pic de concentration plasmatique (Cmax) est atteint en l'espace de 2 à 4 heures. La biodisponibilité absolue moyenne du valsartan est de 23% (intervalle: 23 ± 7). La pharmacocinétique du valsartan est linéaire dans l'éventail des doses testées. L'accumulation du valsartan est faible avec une prise par jour. Les concentrations plasmatiques sont similaires chez l'homme et chez la femme.
Une prise au cours d'un repas entraîne une diminution de l'aire sous la courbe de concentration plasmatique (AUC) de 48% et de la Cmax de 59%. Toutefois, les taux plasmatiques sont similaires 8 h après la prise, que le patient ait été à jeun ou non. Cette diminution de l'AUC et de la Cmax ne s'accompagne d'aucune réduction cliniquement significative de l'effet thérapeutique, de sorte que le valsartan peut être pris indépendamment des repas.
Distribution
La liaison du valsartan aux protéines sériques est forte (94-97%) et a lieu principalement à l'albumine. L'état d'équilibre est atteint en 1 semaine. Après administration intraveineuse de valsartan, le volume de distribution à l'état d'équilibre est d'environ 17 l, ce qui indique qu'il n'y a pas de distribution importante du valsartan dans les tissus.
La clairance plasmatique est relativement lente (env. 2 l/h) par rapport au débit sanguin hépatique (env. 30 l/h).
Métabolisme
Le valsartan ne subit pas de transformation biologique importante, car seuls environ 20% de la dose sont retrouvés sous forme de métabolites. Un métabolite hydroxylé a été identifié dans le plasma à de faibles concentrations (moins de 10% de l'AUC du valsartan). Ce métabolite est inactif sur le plan pharmacologique.
Élimination
Le valsartan se caractérise par une décroissance cinétique multi-exponentielle (demi-vie plasmatique primaire <1 h et demi-vie plasmatique terminale bêta de 9 h environ). Le valsartan est essentiellement éliminé par les fèces (environ 83% de la dose) et l'urine (environ 13% de la dose), essentiellement sous forme inchangée. Après administration intraveineuse, la clairance plasmatique du valsartan est d'environ 2 l/h et sa clairance rénale de 0.62 l/h (environ 30% de la clairance totale). La demi-vie du valsartan est de 6 h.
Hydrochlorothiazide
Absorption
L'absorption de l'hydrochlorothiazide administré oralement est rapide (tmax env. 2 h).
Dans le domaine des concentrations thérapeutiques, l'augmentation de l'AUC moyenne est linéaire et proportionnelle à la dose. Par rapport à la prise à jeun, la prise concomitante d'aliments peut provoquer aussi bien une augmentation qu'une diminution de la disponibilité systémique de l'hydrochlorothiazide. Ces effets sont minimes et ont peu de signification clinique.
La biodisponibilité absolue de l'hydrochlorothiazide administré oralement s'élève à env. 70%.
Distribution, élimination
La distribution et l'élimination suivent dans une large mesure une cinétique bi-exponentielle.
Le volume apparent de distribution est de 4-8 l/kg. La liaison de l'hydrochlorothiazide circulant aux protéines sériques, essentiellement à l'albumine sérique, est de 40-70%. L'hydrochlorothiazide s'accumule dans les érythrocytes et y atteint une concentration environ 3 fois plus élevée que dans le plasma.
L'hydrochlorothiazide est essentiellement éliminé sous forme inchangée. Dans la phase d'élimination terminale, l'hydrochlorothiazide est éliminé du plasma avec une demi-vie de 6 à 15 heures en moyenne. La cinétique de l'hydrochlorothiazide est inchangée en cas de prise répétée et son accumulation est minime en prise monoquotidienne.
Plus de 95% de la quantité absorbée sont éliminés sous forme inchangée par les reins.
Valsartan/Hydrochlorothiazide
La disponibilité systémique de l'hydrochlorothiazide est diminuée d'environ 30% lors d'une association au valsartan. La cinétique du valsartan n'est pas notablement affectée par l'association à l'hydrochlorothiazide. L'interaction observée n'a pas d'influence sur l'utilisation du valsartan et de l'hydrochlorothiazide en association, les études cliniques contrôlées ayant montré un effet antihypertenseur marqué et supérieur à celui de chacune des substances prises séparément.
Cinétique pour certains groupes de patients
Patients âgés
La disponibilité systémique du valsartan est légèrement plus élevée chez certaines personnes âgées (>65 ans) que chez des volontaires plus jeunes, sans toutefois revêtir une signification clinique.
La concentration de l'hydrochlorothiazide à l'état d'équilibre est plus élevée et la clairance systémique est considérablement ralentie chez les patients âgés par rapport aux jeunes. C'est pourquoi les patients âgés traités par l'hydrochlorothiazide doivent être attentivement surveillés.
Patients avec troubles de la fonction rénale
Valsartan
Aucune corrélation entre la fonction rénale et la disponibilité systémique du valsartan n'a été mise en évidence, ce qui était prévisible pour une substance dont l'élimination rénale ne représente que 30% de l'élimination plasmatique totale. Par conséquent, une adaptation posologique chez l'insuffisant rénal n'est pas nécessaire (insuffisance rénale grave, cf. «Contre-indications»). Aucune étude n'a été conduite chez les patients dialysés. Du fait de sa forte liaison aux protéines plasmatiques, une élimination du valsartan par dialyse est peu probable.
Hydrochlorothiazide
La clairance rénale de l'hydrochlorothiazide s'effectue aussi bien par filtration passive que par sécrétion active dans le tubule rénal. Comme pour toute substance éliminée presque exclusivement par les reins, la fonction rénale a une influence essentielle sur la cinétique de l'hydrochlorothiazide (cf. «Contre-indications»).
Chez les insuffisants rénaux, les moyennes des concentrations plasmatiques maximales et les valeurs de l'AUC de l'hydrochlorothiazide sont augmentées et son excrétion urinaire est diminuée. Suite à la diminution marquée de la clairance rénale chez les patients atteints d'insuffisance rénale légère à modérée, la demi-vie moyenne d'élimination est pratiquement doublée chez ces patients.
L'hydrochlorothiazide peut être éliminée par dialyse.
Patients avec troubles de la fonction hépatique
Dans une étude pharmacocinétique chez des patients présentant une insuffisance hépatique faible à modérée, la concentration de valsartan était environ deux fois plus élevée que chez des volontaires sains. Aucune donnée n'existe pour des patients atteints d'insuffisance hépatique grave (cf. «Contre-indications»).
Les maladies hépatiques comprenant une limitation légère à modérée de la fonction hépatique n'ont en général pas d'influence notable sur la pharmacocinétique de l'hydrochlorothiazide.
Données précliniques
Valsartan:Hydrochlorothiazide
Il ne ressort des différentes études précliniques menées auprès de plusieurs espèces animales aucun résultat indiquant que les doses thérapeutiques de valsartan: hydrochlorothiazide ne doivent pas être utilisées chez l'être humain.
Valsartan
Sur base des études classiques pour la pharmacologie de sécurité, la génotoxicité, la carcinogénicité et la fertilité, et mise à part une toxicité fœtale chez le lapin, les données précliniques ne laissent présager aucun danger particulier pour l'homme.
Toxicité chronique: Lors des études précliniques de sécurité, l'administration de doses élevées de valsartan (200-600 mg/kg de poids corporel/jour) chez le rat a entraîné une diminution des paramètres relatifs aux globules rouges (érythrocytes, hémoglobine, hématocrite) et des modifications de l'hémodynamique rénale (légère augmentation des taux sanguins d'urée ainsi qu'hyperplasie tubulaire rénale et basophilie chez des animaux mâles). Ces doses chez le rat (200 et 600 mg/kg/jour) représentent environ 6 à 18 fois la dose recommandée pour l'être humain sur la base de mg/m² (le calcul repose sur une dose orale de 320 mg/jour et un patient de 60 kg). Des doses similaires chez le ouistiti ont entraîné des modifications semblables, mais plus sévères, en particulier au niveau des reins où les modifications ont évolué vers une néphropathie avec augmentation des taux d'urée et de créatinine. En outre, une hypertrophie des cellules rénales juxtaglomérulaires a été observée dans les deux espèces. Toutes ces modifications résultent probablement de l'effet pharmacologique du valsartan, qui provoque une hypotension persistante, particulièrement chez le ouisiti. L'hypertrophie des cellules rénales juxtaglomérulaires ne semble pas être pertinente aux doses thérapeutiques chez l'être humain.
Toxicité de reproduction: Le valsartan n'a aucun effet indésirable sur la performance de reproduction de rats mâles et femelles à des doses orales de jusqu'à 200 mg/kg/jour. Au cours des études sur le développement embryofœtal (segment II) menées chez la souris, le rat et le lapin, une fœtotoxicité a été observée parallèlement à une toxicité maternelle, à des doses de valsartan ≥600 mg/kg/jour chez le rat et 10 mg/kg/jour chez le lapin. Dans une étude de toxicité sur le développement périnatal et postnatal (segment III), les ratons dont les parents avaient reçu 600 mg/kg/jour durant le dernier trimestre et pendant la lactation ont présenté une légère diminution du taux de survie et un léger retard de développement.
Mutagénicité: Aucun potentiel mutagène n'a pu être établi pour le valsartan, que ce soit au niveau génique ou au niveau chromosomique dans différentes études standards in vitro et in vivo de génotoxicité.
Carcinogénicité: Il ne ressort aucun indice de carcinogénicité lors de l'administration du valsartan avec la nourriture à des dosages de jusqu'à 160 et respectivement, 200 mg/kg/jour pendant 2 ans à des souris et des rats.
Hydrochlorothiazide
Dans les études de mutagénicité, de clastogénicité, de carcinogénicité et de capacité de reproduction, les résultats se sont avérés négatifs pour l'hydrochlorothiazide.
Mutagénicité: Le potentiel mutagène a été évalué au moyen d'une série de tests in vitro et in vivo. Alors que les examens in vitro ont abouti à quelques résultats de test positifs, tous les résultats des examens in vivo ont été négatifs. L'hydrochlorothiazide a augmenté la formation de dimères de pyrimidines induite par les UVA in vitro et sur la peau de souris après administration orale. Ceci permet de conclure qu'aucun potentiel mutagène pertinent n'existe in vivo, bien que l'hydrochlorothiazide puisse renforcer les effets génotoxiques de la lumière UVA.
Carcinogénicité: D'après les données expérimentales disponibles, il ne ressort aucun indice d'un effet cancérigène de l'hydrochlorothiazide chez le rat et la souris (des tumeurs hépatocellulaires chez la souris n'ont été observées que chez des souris mâles traitées avec des doses élevées; la fréquence n'a pas dépassé la fréquence observée dans les cas témoins historiques).
Toxicité pour la reproduction: L'hydrochlorothiazide ne s'est pas avéré être tératogène et n'a pas eu d'effet sur la fertilité et la conception. Aucun potentiel tératogène n'a été mis en évidence chez trois espèces animales étudiées, qui avaient reçu au moins 10 fois la dose recommandée pour l'homme de 1 mg/kg environ. Une prise de poids réduite chez de jeunes rats allaités a été attribuée aux doses élevées (15 fois la dose pour l'homme) et à l'effet diurétique de l'hydrochlorothiazide, avec les conséquences correspondantes sur la production de lait.
Remarques particulières
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques concernant le stockage
Conserver Valsartan HCT Zentiva dans l'emballage original à l'abri de l'humidité et au-dessous de 25 °C.
Conserver les médicaments hors de portée des enfants.
Numéro d’autorisation
61472 (Swissmedic).
Titulaire de l’autorisation
Helvepharm AG, Frauenfeld.
Mise à jour de l’information
Septembre 2020.
Отзывов (0)
Вы смотрели

Бесплатная консультация опытного специалиста
Опишите симптомы или нужный препарат – мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой на дом или просто проконсультируем.
Нас 14 специалистов и 0 ботов. Мы всегда будем с вами на связи и сможем связаться в любое время.

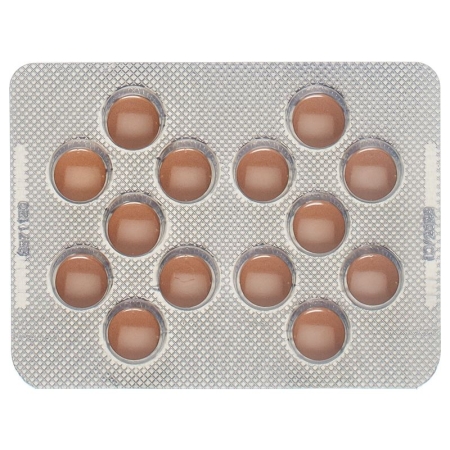

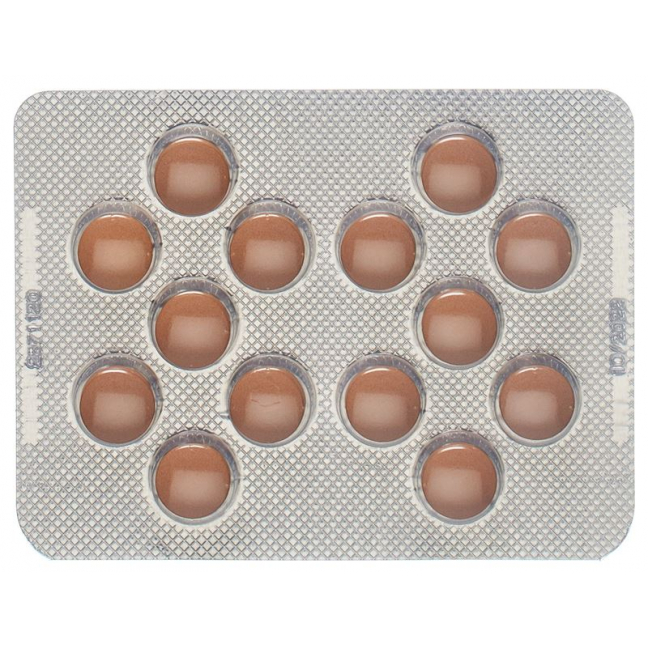


 Deutsch
Deutsch French
French Italian
Italian