Тиболон Спириг HC табл. 2,5 мг
TIBOLON Spirig HC Tabl 2.5 mg
-
9421.95 RUB
Предполагаемая дата доставки:
17.05. - 31.05.2024

- Наличие: В наличии
- Производитель: Spirig Healthcare AG
- Модель: 7805225
- ATC-код G03CX01
- EAN 7680680900017
Варианты
Тиболон Спириг HC табл. 2,5 мг
4101.12 RUB
Тиболон Спириг HC табл. 2,5 мг
4179.03 RUB
Описание
Was ist Tibolon Spirig HC und wann wird es angewendet?
Tibolon Spirig HC ist eine Hormonersatztherapie (HRT) und enthält Tibolon, eine Substanz, die bei postmenopausalen Frauen angewendet wird, die ihre letzte natürliche Periode vor mindestens 12 Monaten hatten.
Tibolon Spirig HC wird angewendet für:
Linderung der Symptome nach der Menopause:
Während der Menopause verringert sich die Menge an Östrogen, die im weiblichen Körper produziert wird. Dies kann zu Symptomen wie Hitzegefühl in Gesicht, Hals und Brust (Hitzewallungen) führen. Tibolon Spirig HC lindert diese Symptome nach der Menopause. Tibolon Spirig HC wird Ihnen nur verschrieben werden, wenn Ihre Symptome Ihren Alltag schwerwiegend beeinträchtigen.
Prävention der Osteoporose
Nach der Menopause können manche Frauen brüchige Knochen bekommen (Osteoporose).
Wenn Sie aufgrund von Osteoporose ein erhöhtes Risiko für Knochenbrüche haben und eine andere Behandlung für Sie nicht in Frage kommt, kann Tibolon Spirig HC für die Prävention der Osteoporose nach der Menopause angewendet werden. Sie sollten alle Behandlungsoptionen mit Ihrem Arzt/Ihrer Ärztin besprechen.
Tibolon Spirig HC darf nur auf Verschreibung des Arztes oder der Ärztin und unter ärztlicher Überwachung eingenommen werden.
Was sollte dazu beachtet werden?
Eine Hormonersatztherapie kann mit erhöhten Risiken, wie Brustkrebs, Geschwüren oder Krebs der Gebärmutter, Herz- Kreislaufkrankheiten wie Herzinfarkt, Schlaganfall, venöse Thrombosen und Lungenembolien verbunden sein. Ihr Arzt oder Ihre Ärztin wird mit Ihnen diese Risiken besprechen und gegenüber dem erwarteten Nutzen abwägen.
Die Erfahrung bei Frauen mit vorzeitiger Menopause (aufgrund eines Versagens der Eierstöcke oder einer Operation) ist begrenzt. Falls Sie eine vorzeitige Menopause haben, können die Risiken einer HRT oder von Tibolon Spirig HC anders sein. Bitte sprechen Sie mit Ihrem Arzt/Ihrer Ärztin.
Wann darf Tibolon Spirig HC nicht angewendet werden?
Tibolon Spirig HC darf nicht angewendet werden, falls Sie:
- Brustkrebs haben oder jemals hatten oder dies vermutet wird
- einen hormonabhängigen Tumor haben, wie beispielsweise einen Tumor der Gebärmutterschleimhaut (Endometrium), oder dies vermutet wird
- eine ungewöhnliche Verdickung der Gebärmutterschleimhaut (Endometriumhyperplasie) haben, die nicht behandelt wird
- ungeklärte Vaginalblutungen haben
- ein Blutgerinnsel in einer Vene (Thrombose) haben oder jemals hatten, wie beispielsweise in den Beinen (tiefe Venenthrombose) oder in der Lunge (Lungenembolie)
- eine durch Blutgerinnsel in den Arterien verursachte Erkrankung haben oder kürzlich hatten, wie beispielsweise Herzinfarkt, Schlaganfall oder Angina pectoris
- eine Blutgerinnungsstörung haben (wie Protein C-, Protein S- oder Antithrombin-Mangel)
- eine Lebererkrankung haben oder hatten und Ihre Leberfunktionswerte sich nicht normalisiert haben
- eine «Porphyrie» genannte, seltene Bluterkrankung haben, die innerhalb der Familie vererbt wird
- schwanger sind oder dies vermuten
- stillen
- allergisch (überempfindlich) auf Tibolon oder einen der Inhaltsstoffe sind
Falls einer der oben erwähnten Punkte während der Einnahme von Tibolon Spirig HC erstmals auftritt, beenden Sie die Einnahme sofort und konsultieren Sie Ihren Arzt/Ihre Ärztin umgehend.
Wann ist bei der Einnahme von Tibolon Spirig HC Vorsicht geboten?
Medizinische Kontrolluntersuchungen
Bevor Sie mit einer Hormonersatztherapie beginnen (oder erneut beginnen), wird Ihr Arzt bzw. Ihre Ärztin eine sorgfältige Eigen- und Familienanamnese (Vorkommnisse von eigenen Krankheiten und von Krankheiten in der Familie) erheben. Ihr Arzt bzw. Ihre Ärztin wird eine gründliche allgemeine und gynäkologische Untersuchung durchführen.
Ihr Arzt oder Ihre Ärztin wird vor Beginn der Behandlung Nutzen und Risiken einer Behandlung mit Tibolon Spirig HC mit Ihnen besprechen.
Während der Behandlung mit Tibolon Spirig HC sollten Sie Ihren Arzt bzw. Ihre Ärztin in regelmässigen Abständen (mind. einmal jährlich) aufsuchen. Im Rahmen dieser Kontrolluntersuchungen wird Ihr Arzt bzw. Ihre Ärztin entscheiden, ob angesichts des Nutzens und der Risiken die Behandlung fortgesetzt werden kann.
Beenden Sie die Einnahme von Tibolon Spirig HC und konsultieren Sie Ihren Arzt/Ihre Ärztin umgehend, wenn Sie während der Einnahme von Tibolon Spirig HC folgendes bemerken:
- eine der im Abschnitt «Wann darf Tibolon Spirig HC nicht angewendet werden?» erwähnten Punkte
- wenn Sie Anzeichen eines Blutgerinnsels bemerken wie beispielsweise:
- schmerzhafte Schwellung und Rötung der Beine
- plötzliche Schmerzen in der Brust
- Schwierigkeiten beim Atmen
Weitere Informationen siehe «Blutgerinnsel in einer Vene (Thrombose)».
- erstmaliges Auftreten von Migräne-ähnlichen Kopfschmerzen oder wiederholte, ungewöhnlich starke Kopfschmerzen
- plötzlicher teilweiser oder vollständiger Verlust des Sehvermögens
- plötzliche Hörstörung
- einen starken Anstieg Ihres Blutdrucks (Symptome können Kopfschmerzen, Müdigkeit, Schwindel sein)
- Gelbfärbung Ihrer Haut oder des weissen Teils der Augen (Gelbsucht). Dies können Anzeichen einer Lebererkrankung sein.
Gewisse Krankheiten können sich unter der Behandlung verschlechtern
Informieren Sie Ihren Arzt/Ihre Ärztin vor dem Beginn der Behandlung, falls Sie eines der folgenden Probleme jemals hatten, da diese während der Behandlung mit Tibolon Spirig HC wieder auftreten oder sich verschlimmern können. Falls dies zutrifft, sollten Sie Ihren Arzt/Ihre Ärztin öfters für Kontrolluntersuchungen sehen:
- erhöhtes Risiko von östrogenabhängigen Tumoren (z.B. wenn Ihre Mutter, Schwester oder Grossmutter Brustkrebs hatte)
- übermässiges Wachstum der Gebärmutterschleimhaut (Endometriumhyperplasie) in der Vorgeschichte oder bei nahen Verwandten
- Geschwülste (Fibroide) in der Gebärmutter oder Wachstum der Gebärmutterschleimhaut ausserhalb der Gebärmutter (Endometriose)
- erhöhtes Risiko einer Blutgerinnselbildung (siehe «Blutgerinnsel in einer Vene (Thrombose)»)
- hoher Blutdruck
- Migräne oder starke Kopfschmerzen
- Zuckerkrankheit (Diabetes mellitus)
- Leber- oder Gallenblasenfunktionsstörungen wie z.B. ein gutartiger Lebertumor oder Gallensteine
- eine Erkrankung des Immunsystems, die viele Körperorgane befällt (systemischer Lupus erythematodes, SLE)
- Epilepsie
- Asthma
- eine Erkrankung des Trommelfells und Gehörs (Otosklerose)
- ein sehr hoher Blutfettspiegel (Triglyceride)
- Flüssigkeitsretention wegen Herz- oder Nierenproblemen
Tumorerkrankungen
Brustkrebs
Es gibt Hinweise, dass eine HRT, inkl. Tibolon Spirig HC das Brustkrebs-Risiko erhöht. Das zusätzliche Risiko hängt sowohl von der Dauer der Anwendung einer HRT, als auch von der Art der HRT (Östrogen-Gestagen vs. Östrogen-Monotherapie) ab. Das zusätzliche Risiko zeigt sich innerhalb von ein paar Jahren. Es normalisiert sich jedoch wieder nach ein paar (höchstens 5) Jahren nach Absetzen der Behandlung.
Frauen, die Tibolon Spirig HC anwenden, haben ein geringeres Brustkrebs-Risiko als Frauen mit einer kombinierten Hormonsubstitutionstherapie und ein vergleichbares Risiko wie Frauen mit einer Östrogenmonotherapie.
Kontrollieren Sie regelmässig Ihre Brüste. Konsultieren Sie Ihren Arzt/Ihre Ärztin, falls Sie Änderungen bemerken wie Dellenbildung oder Absinken der Haut, Veränderungen der Brustwarze oder Knoten, die Sie fühlen oder sehen können.
Übermässige Verdickung der Gebärmutterschleimhaut (Endometriumhyperplasie) und Krebs der Gebärmutterschleimhaut (Endometriumkarzinom)
Es wurde über Fälle von erhöhtem Gebärmutterzellwachstum und -krebs während der Einnahme von Tibolon Spirig HC berichtet. Das Krebsrisiko steigt mit der Dauer der Behandlung an.
Karzinom der Eierstöcke
Mehrere Studien deuten darauf hin, dass eine Hormonersatztherapie (sowohl für eine Ösrtogen-Monotherapie als auch für eine kombinierte Hormonersatztherapie) mit einem gering erhöhten Risiko für die Entwicklung von Eierstockkrebs verbunden sein könnte.
Ein leicht erhöhtes Risiko für ein Eierstock-Karzinom wurde bei Frauen berichtet, die eine HRT, inkl. Tibolon Spirig HC während mindestens 5 bis 10 Jahren anwendeten.
Einfluss auf das Herz und den Blutkreislauf
Herzerkrankungen (Herzinfarkt)
Frauen über 60 Jahren mit einer Östrogen-Gestagen HRT bekommen etwas häufiger eine Herzerkrankung als solche ohne HRT. Da das Risiko für eine Herzerkrankung stark vom Alter abhängt, ist die Zahl von zusätzlichen Herzerkrankungen aufgrund der Einnahme einer Östrogen-Gestagen HRT bei gesunden Frauen kurz nach der Menopause sehr niedrig, steigt aber mit höherem Alter an.
Es gibt keine Hinweise, dass das Herzinfarkt-Risiko mit Tibolon Spirig HC anders wäre als mit einer anderen HRT.
Schlaganfall
Neuere klinische Studien mit Tibolon und anderen HRT-Präparaten zeigten ein erhöhtes Risiko für das Auftreten eines Schlaganfalls. Dieses erhöhte Risiko wurde unabhängig vom Alter oder der Zeit seit der Menopause beobachtet. Da das Risiko für einen Schlaganfall stark vom Alter abhängt, steigt es aber mit höherem Alter an.
Bei Frauen im Alter von 50-59 Jahren, die Tibolon Spirig HC über einen Zeitraum von 5 Jahren einnehmen, sind pro 1000 Frauen durchschnittlich 4 zusätzliche Fälle von einem Schlaganfall zu erwarten.
Bei Frauen im Alter von 60-69 Jahren, die Tibolon Spirig HC über einen Zeitraum von 5 Jahren einnehmen, sind pro 1000 Frauen durchschnittlich 13 zusätzliche Fälle von einem Schlaganfall zu erwarten.
Blutgerinnsel in einer Vene (Thrombose)
Das Risiko eines Blutgerinnsels in den Venen ist bei HRT-Anwenderinnen höher als bei Nicht-Anwenderinnen, insbesondere während des ersten Jahres der Anwendung.
Bei Frauen im Alter von 50-59 Jahren, die keine HRT anwenden, haben im Durchschnitt 3 von 1000 über einen Zeitraum von 5 Jahren ein Blutgerinnsel in einer Vene. Bei Frauen im Alter von 50-59 Jahren, die während mehr als 5 Jahren eine Östrogen-Gestagen HRT angewendet haben, tritt bei zusätzlich 2 bis 6 von 1000 Anwenderinnen ein Blutgerinnsel auf.
Blutgerinnsel können schwerwiegend sein und falls eines die Lunge erreicht, kann es Schmerzen in der Brust, Atemnot, Bewusstlosigkeit und sogar den Tod verursachen. Falls Sie diese Symptome bemerken oder Sie den Verdacht haben, dass sich bei Ihnen ein Blutgerinnsel gebildet hat (z.B. schmerzhaftes Anschwellen eines Beines) müssen Sie die Therapie abbrechen. Für weitere Anzeichen eines Blutgerinnsels siehe «Beenden Sie die Einnahme von Tibolon Spirig HC und konsultieren Sie Ihren Arzt/Ihre Ärztin umgehend».
Sie bekommen ein Blutgerinnsel in den Venen eher mit zunehmendem Alter und falls einer der folgenden Punkte auf Sie zutrifft. Informieren Sie Ihren Arzt/Ihre Ärztin, falls eine der folgenden Situationen auf Sie zutrifft:
- Jemand in Ihrer Verwandtschaft hatte ein Blutgerinnsel in Bein, Lunge oder einem anderen Organ
- Sie haben ein Blutgerinnungsproblem und benötigen eine Langzeitbehandlung mit einem Arzneimittel zur Vermeidung von Blutgerinnseln
- Sie rauchen
- Sie sind stark übergewichtig (BMI >30 kg/m2)
- Sie haben systemischen Lupus erythematodes (SLE)
- Sie sind schwanger oder haben kürzlich geboren
- Sie haben Krebs
- Sie können wegen einer grösseren Operation, Verletzung oder Krankheit während längerer Zeit nicht gehen. Falls eine Operation bevorsteht, sollten Sie Ihrem Arzt/Ihrer Ärztin sagen, dass Sie Tibolon Spirig HC einnehmen. Sie müssen möglicherweise die Einnahme von Tibolon Spirig HC 4 bis 6 Wochen vor der Operation beenden, um das Risiko eines Blutgerinnsels zu vermindern (siehe «Wann ist bei der Einnahme von Tibolon Spirig HC Vorsicht geboten?, Blutgerinnsel in einer Vene (Thrombose)»). Fragen Sie Ihren Arzt/Ihre Ärztin, wann Sie mit der Einnahme von Tibolon Spirig HC wieder beginnen können.
Unregelmässige Blutungen
Während den ersten 3-6 Monaten der Einnahme von Tibolon Spirig HC können Sie unregelmässige Blutungen oder Schmierblutungen haben.
Falls die unregelmässigen Blutungen jedoch:
- länger als während den ersten 6 Monaten andauern
- beginnen, nachdem Sie Tibolon Spirig HC während mehr als 6 Monaten eingenommen haben
- nach Beendigung der Tibolon Spirig HC-Einnahme andauern
sollten Sie Ihren Arzt/Ihre Ärztin so bald wie möglich konsultieren.
Weitere Warnhinweise bzw. Vorsichtsmassnahmen
Es gibt einige Hinweise für ein erhöhtes Risiko für Gedächtnisschwund bei Frauen, die mit einer HRT nach dem 65. Altersjahr beginnen. Fragen Sie Ihren Arzt/Ihre Ärztin um Rat.
Die Funktion Ihrer Schilddrüse muss regelmässig überwacht werden, falls Sie eine Schilddrüsenhormon-Ersatztherapie einnehmen.
Tibolon Spirig HC hat keine empfängnisverhütende Wirkung. Falls seit Ihrer letzten Periode weniger als 12 Monate vergangen sind oder Sie unter 50 Jahren alt sind, müssen Sie möglicherweise zusätzlich verhüten, um eine Schwangerschaft zu vermeiden. Fragen Sie Ihren Arzt/Ihre Ärztin um Rat.
Bitte nehmen Sie Tibolon Spirig HC erst nach Rücksprache mit Ihrem Arzt bzw. Ihrer Ärztin ein, wenn Ihnen bekannt ist, dass Sie unter einer Zuckerunverträglichkeit leiden.
Anwendung anderer Arzneimittel
Einige Arzneimittel können die Wirkung von Tibolon Spirig HC beeinflussen. Dies kann zu unregelmässigen Blutungen führen. Das gilt für die folgenden Arzneimittel:
- Arzneimittel gegen Blutgerinnung
- Arzneimittel gegen Epilepsie (z.B. Phenobarbital, Phenytoin und Carbamazepin)
- Arzneimittel gegen Tuberkulose (wie Rifampicin)
- Pflanzliche Arzneimittel, die Johanniskraut (Hypericum perforatum) enthalten
- Teilen Sie Ihrem Arzt bzw. Ihrer Ärztin mit, ob Sie mit Arzneimitteln zur Behandlung von Hepatitis C-Infektionen behandelt sind (Arzneimittel mit Wirksubstanzen wie Ombitsavir, Paritaprevir, Ritonavir, Dasabuvir). Arzneimittel mit Östrogenen könnten gegebenenfalls die Wirkung dieser Arzneimittel beeinflussen. Es ist nicht bekannt, ob Tibolon Spirig HC die Wirkung dieser Arzneimittel beeinflussen kann.
Informieren Sie ebenfalls Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Medikamente (auch selbstgekaufte) einnehmen oder äusserlich anwenden!
Darf Tibolon Spirig HC während einer Schwangerschaft oder in der Stillzeit eingenommen werden?
Tibolon Spirig HC ist ausschliesslich für post-menopausale Frauen bestimmt. Falls Sie schwanger werden, beenden Sie die Einnahme von Tibolon Spirig HC und konsultieren Sie Ihren Arzt/Ihre Ärztin.
Tibolon Spirig HC soll während der Stillzeit nicht eingenommen werden.
Wie verwenden Sie Tibolon Spirig HC?
Nehmen Sie Tibolon Spirig HC nach Vorschrift Ihres Arztes bzw. Ihrer Ärztin ein.
Die Dosierung beträgt eine Tablette pro Tag. Schlucken Sie die Tablette mit etwas Wasser oder anderer Flüssigkeit, am besten jeweils zur selben Tageszeit. Die Tibolon Spirig HC-Streifen sind mit Wochentagen gekennzeichnet. Nehmen Sie jeden Tag eine Tablette ein, d.h. wenn der Streifen leer ist, beginnen Sie ohne Unterbruch mit einem neuen Streifen. Die Behandlung kann an einem beliebigen Wochentag begonnen werden.
Tibolon Spirig HC sollte erst 12 Monate nach Ihrer letzten natürlichen Monatsblutung eingenommen werden. Falls Tibolon Spirig HC früher eingenommen wird, kann das Risiko unregelmässiger Menstruationsblutungen erhöht sein.
Ihr Arzt/Ihre Ärztin wird die niedrigste Dosierung anstreben und Ihre Symptome so kurz wie notwendig behandeln.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Medikament wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Was tun, wenn Sie einmal eine Tablette vergessen haben?
Sobald Sie feststellen, dass Sie vergessen haben, eine Tablette einzunehmen, müssen Sie dies sofort nachholen, vorausgesetzt, dass Sie mit der Einnahme der Tablette nicht mehr als 12 Stunden im Rückstand sind. Wenn mehr als 12 Stunden verstrichen sind, verzichten Sie auf diese Tablette und fahren Sie dann mit dem Rest der Packung wie üblich fort.
Nehmen Sie nicht die doppelte Dosis, um die vergessene Einzeldosis nachzuholen.
Was tun, wenn versehentlich zu viele Tabletten eingenommen wurden?
Wenn jemand mehrere Tabletten gleichzeitig genommen hat, besteht kein Anlass zu grosser Sorge. Trotzdem sollten Sie den Arzt bzw. die Ärztin befragen. Eventuell auftretende Beschwerden sind Übelkeit und Erbrechen. Es kann nach einigen Tagen zu einer Vaginalblutung kommen.
Welche Nebenwirkungen kann Tibolon Spirig HC haben?
Die folgenden Nebenwirkungen sind für Tibolon Spirig HC berichtet worden:
Häufig (betrifft 1 bis 10 von 100 Anwendern)
Gewichtszunahme, Bauchschmerzen, übermässige Behaarung, übermässiges Wachstum der Gebärmutterschleimhaut, Verdickung der Gebärmutterschleimhaut, Schmerz in den Brüsten, Juckreiz im Genitalbereich, Pilzinfektionen im Genitalbereich, Vaginalblutungen und Schmierblutungen, Unterleibsschmerzen, veränderter vaginaler Ausfluss oder Entzündung der Vagina, Veränderungen beim Gebärmutterhalsabstrich.
Gelegentlich (betrifft 1 bis 10 von 1000 Anwendern)
Akne, Beschwerden in den Brüsten oder Schmerzen in den Brustwarzen.
Selten (betrifft 1 bis 10 von 10'000 Anwendern)
Schlaganfall.
Unbekannt: Anschwellen des Gewebes, Depression, Kopfschmerzen, Schwindel, Benommenheit, Übelkeit, Migräne, Sehstörungen, Leberfunktionsstörungen, Hautausschlag, Juckreiz, Muskel- oder Gelenkschmerzen, fettige Haut.
Bei den meisten Patientinnen verschwinden einige dieser Nebenwirkungen nach den ersten Behandlungswochen (z.B. Vaginalblutungen inkl. Schmierblutungen, Bauchschmerzen und Spannungsgefühl in der Brust). Kontaktieren Sie Ihren Arzt bzw. Ihre Ärztin wenn Vaginalblutungen auftreten oder wenn irgendeine Nebenwirkung anhält.
In Zusammenhang mit einer Östrogen-Monotherapie oder einer kombinierten HRT wurden ausserdem folgende unerwünschte Wirkungen beobachtet:
Gutartige und bösartige Sexualhormon-abhängige Krebserkrankungen, Gewichtsveränderungen, Schlafstörungen, Stimmungsschwankungen, Libidoveränderungen, abnormaler Herzschlag, Blutdruckanstieg, Verstopfung von Blutgefässen (z.B. Blutgerinnsel in den Venen der Beine oder Lungen, Herzinfarkt), Gallenblasenerkrankungen, Gelbverfärbung von Haut und/oder Augen (Gelbsucht), Verfärbung der Haut speziell im Gesicht oder Nacken bekannt als Schwangerschaftsflecken (Chloasma), übermässige Behaarung, unüblicher Haarausfall oder Haarausdünnung, Nesselausschlag, Hautausschlag mit Schiessscheiben-förmigen Rötungen oder Blasen (Erythema multiforme), schmerzhafte rötliche Haut (Erythema nodosum), violette oder rot-braune, durch die Haut sichtbare Flecken (vaskuläre Purpura), Rückenschmerzen, Grössenzunahme von Wucherungen in der Gebärmutter, Grössenzunahme der Brüste.
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin. Dies gilt insbesondere auch für Nebenwirkungen n, die nicht in dieser Packungsbeilage aufgeführt sind.
Was ist ferner zu beachten?
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Lagerungshinweis
Nicht über 30 °C lagern. In der Originalverpackung vor Licht und Feuchtigkeit geschützt und ausser Reichweite von Kindern aufbewahren.
Weitere Hinweise
Weitere Auskünfte erteilt Ihnen Ihr Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin, die über die ausführliche Fachinformation verfügen.
Was ist in Tibolon Spirig HC enthalten?
Jede Tablette enthält
Wirkstoffe
2.5 mg Tibolon.
Hilfsstoffe
Lactose-Monohydrat, Mannitol, Kartoffelstärke, Magnesiumstearat, Ascorbylpalmitat (E 304).
Zulassungsnummer
68090 (Swissmedic)
Wo erhalten Sie Tibolon Spirig HC? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Tabletten (Kalenderpackungen): 28 und 84
Zulassungsinhaberin
Spirig HealthCare AG, 4622 Egerkingen.
Diese Packungsbeilage wurde im Mai 2017 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Qu'est-ce que Tibolone Spirig HC et quand doit-il être utilisé?
Tibolone Spirig HC est un traitement hormonal substitutif (THS) et contient de la tibolone, une substance utilisée chez les femmes postménopausées dont les dernières règles naturelles remontent à au moins 12 mois.
Tibolone Spirig HC est utilisé pour:
Soulagement des symptômes après la ménopause
Pendant la ménopause, la quantité d'œstrogènes produite dans le corps d'une femme diminue. Cela peut entraîner des symptômes tels que sensation de chaleur au niveau du visage, du cou et de la poitrine (bouffées de chaleur). Tibolone Spirig HC soulage ces symptômes après la ménopause. Tibolone Spirig HC ne vous sera prescrit que si vos symptômes vous handicapent gravement dans votre vie de tous les jours.
Prévention de l'ostéoporose
Après la ménopause, les os de nombreuses femmes peuvent devenir fragiles (ostéoporose).
Si vous présentez un risque accru de fractures osseuses dû à une ostéoporose et qu'un autre traitement ne peut pas être envisagé pour vous, Tibolone Spirig HC peut être utilisé pour la prévention de l'ostéoporose après la ménopause. Vous devez discuter de toutes les options thérapeutiques avec votre médecin.
Tibolone Spirig HC ne doit être pris que sur prescription du médecin et sous surveillance médicale.
De quoi faut-il tenir compte en dehors du traitement?
Un traitement hormonal substitutif peut augmenter certains risques, comme le risque de cancer du sein, d'ulcères ou de cancer de l'utérus, de maladies cardio-vasculaires telles qu'infarctus du myocarde, accident vasculaire cérébral, thromboses veineuses et embolies pulmonaires. Votre médecin discutera avec vous de ces risques et les mettra en balance avec le bénéfice attendu.
L'expérience chez des femmes qui présentent une ménopause précoce (en raison d'une insuffisance des ovaires ou d'une intervention chirurgicale) est limitée. Si vous présentez une ménopause précoce, les risques d'un THS ou de Tibolone Spirig HC peuvent être différents. Veuillez en parler avec votre médecin.
Quand Tibolone Spirig HC ne doit-il pas être utilisé?
Il ne faut pas utiliser Tibolone Spirig HC:
- si vous avez ou avez eu un cancer du sein ou si un cancer du sein est suspecté chez vous
- si vous avez une tumeur dépendante des hormones, connue ou suspectée, comme par exemple une tumeur de la muqueuse utérine (endomètre)
- si vous présentez un épaississement inhabituel de la muqueuse utérine (hyperplasie de l'endomètre), qui n'est pas traité
- si vous avez des saignements vaginaux inexpliqués
- si vous avez ou avez eu un caillot sanguin dans une veine (thrombose), comme par exemple dans les jambes (thrombose veineuse profonde) ou dans les poumons (embolie pulmonaire)
- si vous avez ou avez eu récemment une maladie causée par un caillot sanguin dans les artères, comme par exemple infarctus du myocarde, accident vasculaire cérébral ou angine de poitrine
- si vous avez un trouble de la coagulation sanguine (tel que déficit en protéine C, en protéine S ou en antithrombine)
- si vous avez ou avez eu une maladie hépatique et que vos paramètres de la fonction hépatique ne se sont pas normalisés
- si vous avez une maladie rare du sang appelée «porphyrie» transmise à la descendance (maladie héréditaire)
- si vous êtes enceinte ou pensez l'être
- si vous allaitez
- si vous êtes allergique (hypersensible) à la tibolone ou à l'un des autres composants du médicament
Si l'un des points susmentionnés apparaît pour la première fois pendant la prise de Tibolone Spirig HC, arrêtez immédiatement de prendre le médicament et consultez votre médecin sans attendre.
Quelles sont les précautions à observer lors de la prise de Tibolone Spirig HC?
Examens médicaux de contrôle
Avant le début ou la reprise d'un traitement hormonal substitutif, il faut que votre médecin relève soigneusement vos antécédents personnels et familiaux (c'est-à-dire les maladies que vous et les membres de votre famille avez eues). Votre médecin pratiquera un examen général et gynécologique approfondi.
Avant le début du traitement, votre médecin discutera avec vous du bénéfice et des risques d'un traitement par Tibolone Spirig HC.
Pendant le traitement par Tibolone Spirig HC, vous devez régulièrement consulter votre médecin (au moins une fois par an). A l'occasion de ces examens de contrôle, votre médecin déterminera si le traitement peut être poursuivi, compte tenu du rapport bénéfice/risques.
Arrêtez de prendre Tibolone Spirig HC et consultez votre médecin sans attendre si vous remarquez ce qui suit pendant la prise de Tibolone Spirig HC:
- un des points mentionnés au paragraphe «Quand Tibolone Spirig HC ne doit-il pas être utilisé?»
- si vous remarquez des signes d'un caillot sanguin, comme par exemple:
- gonflement douloureux et rougeur des jambes
- douleur soudaine dans la poitrine
- difficultés à respirer
Pour de plus amples informations, voir «Caillot sanguin dans une veine (thrombose)».
- première apparition de maux de tête de type migraineux ou maux de tête répétés d'une intensité inhabituelle
- perte soudaine, partielle ou complète, de la vision
- trouble soudain de l'audition
- forte élévation de votre tension artérielle (les symptômes peuvent en être des maux de tête, une fatigue, des vertiges)
- coloration jaune de votre peau ou du blanc de vos yeux (jaunisse). Ce peuvent être là des signes d'une maladie du foie.
Certaines maladies peuvent s'aggraver durant le traitement
Informez votre médecin avant le début du traitement si vous avez eu l'un des problèmes suivants, car ceux-ci peuvent réapparaître ou s'aggraver pendant le traitement par Tibolone Spirig HC. Dans ces cas, vous devrez consulter plus souvent votre médecin pour des examens de contrôle:
- risque accru de tumeurs dépendantes des œstrogènes (p.ex. si votre mère, votre sœur ou votre grand-mère a eu un cancer du sein)
- développement excessif de la muqueuse utérine (hyperplasie de l'endomètre) dans vos antécédents ou chez des proches parents
- tumeurs (fibroïdes) dans l'utérus ou croissance de la muqueuse utérine en dehors de l'utérus (endométriose)
- risque accru de formation d'un caillot sanguin (voir «Caillot sanguin dans une veine (thrombose)»)
- hypertension artérielle
- migraine ou forts maux de tête
- diabète sucré
- troubles du foie ou de la vésicule biliaire tels que tumeur bénigne du foie ou calculs biliaires
- une maladie du système immunitaire qui touche plusieurs organes du corps (lupus érythémateux disséminé, LED)
- épilepsie
- asthme
- une maladie du tympan et de l'ouïe (otosclérose)
- un taux très élevé de lipides sanguins (triglycérides)
- une rétention liquidienne en raison de problèmes cardiaques ou rénaux.
Maladies tumorales
Cancer du sein
Des indices laissent penser qu'un THS, y compris Tibolone Spirig HC, augmente le risque de cancer du sein. Le risque supplémentaire dépend aussi bien de la durée d'utilisation du THS que du type de THS (œstrogène-progestatif vs œstrogène en monothérapie). Ce risque supplémentaire se manifeste en l'espace de quelques années. Il se normalise toutefois au bout de quelques années (au maximum 5) après l'arrêt du traitement.
Les femmes qui utilisent Tibolone Spirig HC présentent un plus faible risque de cancer du sein que les femmes qui suivent un traitement hormonal substitutif combiné et un risque comparable à celui des femmes qui suivent une monothérapie par estrogènes.
Contrôlez régulièrement vos seins. Consultez votre médecin si vous décelez des modifications visibles ou palpables telles que formation de fossettes ou rétractions de la peau, modifications des mamelons ou nodules.
Épaississement excessif de la muqueuse utérine (hyperplasie de l'endomètre) et cancer de la muqueuse utérine (cancer de l'endomètre)
Des cas de croissance augmentée des cellules utérines et de cancer de l'utérus ont été rapportés pendant la prise de Tibolone Spirig HC. Le risque de cancer augmente avec la durée du traitement.
Cancer de l'ovaire
Plusieurs études indiquent qu'un traitement hormonal substitutif (pour la monothérapie par œstrogènes comme pour le traitement hormonal substitutif combiné) pourrait être associé à un risque légèrement accru de cancer de l'ovaire.
Un risque légèrement accru de cancer de l'ovaire a été rapporté chez des femmes qui avaient pris un THS (y compris Tibolone Spirig HC) pendant au minimum 5 à 10 ans.
Influence sur le cœur et la circulation sanguine
Maladies cardiaques (infarctus du myocarde)
Les femmes de plus de 60 ans qui reçoivent un THS combiné (œstrogène + progestatif) souffrent un peu plus fréquemment d'une maladie cardiaque que celles qui ne reçoivent pas de THS. Comme le risque de maladie cardiaque dépend fortement de l'âge, le nombre de maladies cardiaques additionnelles dues à la prise d'un THS combiné est très bas chez les femmes en bonne santé juste après la ménopause, mais il augmente avec l'âge.
Rien ne permet de penser que le risque d'infarctus du myocarde associé à Tibolone Spirig HC soit différent de celui associé à un autre THS.
Accident vasculaire cérébral
Des études cliniques récentes portant sur tibolone et d'autres produits de THS ont montré un risque accru de survenue d'un accident vasculaire cérébral. Cette augmentation du risque a été observée indépendamment de l'âge ou du temps écoulé depuis la ménopause. Comme le risque d'accident vasculaire cérébral dépend fortement de l'âge, il augmente cependant avec l'âge.
Chez les femmes âgées de 50 à 59 ans qui prennent Tibolone Spirig HC sur une période de 5 ans, on estime qu'il faut s'attendre en moyenne à 4 cas supplémentaires d'accident vasculaire cérébral pour 1000 femmes.
Dans la tranche d'âge des femmes de 60 à 69 ans qui prennent Tibolone Spirig HC pendant 5 ans, on estime qu'il faut s'attendre en moyenne à 13 cas supplémentaires d'accident vasculaire cérébral pour 1000 femmes
Caillot sanguin dans une veine (thrombose)
Le risque de formation d'un caillot sanguin dans les veines est plus élevé chez les utilisatrices d'un THS que chez les non-utilisatrices, en particulier pendant la première année du traitement.
Chez les femmes âgées de 50 à 59 ans qui ne prennent pas de THS, 3 femmes sur 1000 en moyenne ont un caillot sanguin dans une veine sur une période de 5 ans. Chez les femmes âgées de 50 à 59 ans qui ont utilisé un THS combiné (œstrogène + progestatif) pendant plus de 5 ans, un caillot sanguin survient chez 2 à 6 femmes de plus sur 1000 utilisatrices.
Les caillots sanguins peuvent être graves et si l'un d'entre eux parvient dans un poumon, cela peut causer des douleurs dans la poitrine, des difficultés respiratoires, une perte de connaissance voire la mort. Si vous présentez ces symptômes ou si vous suspectez qu'un caillot sanguin s'est formé chez vous (p.ex. gonflement douloureux d'une jambe), vous devez arrêter le traitement. Pour de plus amples informations sur les signes d'un caillot sanguin, voir «Arrêtez de prendre Tibolone Spirig HC et consultez votre médecin sans attendre».
Vous avez plus de risques d'avoir un caillot sanguin dans les veines à mesure que votre âge augmente et si l'un des points suivants vous concerne. Informez votre médecin dans les situations suivantes:
- Quelqu'un de votre parenté a eu un caillot sanguin à la jambe, au poumon ou dans un autre organe
- Vous avez un trouble de la coagulation sanguine et nécessitez un traitement au long cours par un médicament prévenant la formation de caillots sanguins
- Vous fumez
- Vous avez un surpoids important (IMC >30 kg/m2)
- Vous avez un lupus érythémateux disséminé (LED)
- Vous êtes enceinte ou avez récemment accouché
- Vous avez un cancer
- Vous ne pouvez pas marcher pendant une période prolongée en raison d'une opération majeure, d'une plaie ou d'une maladie. Si une opération est prévue, vous devez dire à votre médecin que vous prenez Tibolone Spirig HC. Il est possible que vous deviez arrêter la prise de Tibolone Spirig HC 4 à 6 semaines avant l'opération, afin de diminuer le risque de formation d'un caillot (voir sous «Quelles sont les précautions à observer lors de la prise de Tibolone Spirig HC?, Caillot sanguin dans une veine (thrombose)»). Demandez à votre médecin quand vous pouvez recommencer à prendre Tibolone Spirig HC.
Règles irrégulières
Pendant les 3 à 6 premiers mois de la prise de Tibolone Spirig HC, il est possible que vous ayez des règles irrégulières ou de petites pertes de sang.
Cependant, si les règles irrégulières:
- persistent au-delà des 6 premiers mois
- commencent après que vous avez pris Tibolone Spirig HC pendant plus de 6 mois
- persistent après l'arrêt de la prise de Tibolone Spirig HC
vous devez consulter votre médecin le plus vite possible.
Autres mises en garde et précautions
Il y a des indications d'un risque accru de perte de mémoire chez les femmes qui commencent un THS après l'âge de 65 ans. Demandez conseil à votre médecin.
La fonction de votre glande thyroïde doit être régulièrement surveillée, dans le cas où vous prenez un traitement substitutif d'hormones thyroïdiennes.
Tibolone Spirig HC n'a aucun effet contraceptif. Si moins de 12 mois se sont écoulés depuis vos dernières règles ou si vous avez moins de 50 ans, il est possible que vous deviez prendre des mesures contraceptives pour prévenir une grossesse. Demandez conseil à votre médecin.
Si votre médecin vous a informé d'une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
Utilisation d'autres médicaments
Certains médicaments peuvent influencer l'effet de Tibolone Spirig HC. Cela peut provoquer des saignements irréguliers. C'est le cas pour les médicaments suivants:
- médicaments contre la coagulation sanguine (anticoagulants)
- médicaments contre l'épilepsie (p.ex. phénobarbital, phénytoïne et carbamazépine)
- médicaments contre la tuberculose (comme la rifampicine)
- médicaments à base de plantes qui contiennent du millepertuis (Hypericum perforatum)
- Informez votre médecin si vous prenez des médicaments pour traiter les infections à hépatite C (médicaments contenant des principes actifs tels que l'ombitsavir, le paritaprévir, le ritonavir, le dasabuvir). Les médicaments contenant des œstrogènes pourraient influencer les effets de ces méficaments. On ne sait pas si Tibolone Spirig HC peut influencer l'effet de ces médicaments.
Informez également votre médecin ou votre pharmacien si
- vous souffrez d'une autre maladie,
- vous êtes allergique ou
- vous prenez ou utilisez déjà d'autres médicaments en usage interne ou externe (même en automédication!).
Tibolone Spirig HC peut-il être pris pendant la grossesse ou l'allaitement?
Tibolone Spirig HC est exclusivement destiné aux femmes ménopausées. Si vous devenez enceinte, arrêtez de prendre Tibolone Spirig HC et consultez votre médecin.
Tibolone Spirig HC ne doit pas être pris pendant l'allaitement.
Comment utiliser Tibolone Spirig HC?
Prenez Tibolone Spirig HC conformément aux instructions de votre médecin.
La posologie est d'un comprimé par jour. Avalez le comprimé avec un peu d'eau ou un autre liquide, de préférence toujours à la même heure de la journée. Les jours de la semaine sont indiqués sur les plaquettes de Tibolone Spirig HC. Prenez tous les jours un comprimé, autrement dit, une fois que la plaquette est vide, commencez la plaquette suivante sans interruption. Le traitement peut être commencé n'importe quel jour de la semaine.
Le traitement par Tibolone Spirig HC ne doit être entrepris que 12 mois après les dernières règles naturelles. Si vous prenez Tibolone Spirig HC plus tôt, le risque d'hémorragies menstruelles irrégulières peut être augmenté.
Votre médecin cherchera à vous administrer la dose la plus faible possible et à traiter vos symptômes pendant une durée aussi courte que nécessaire.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Que faire si vous avez oublié de prendre un comprimé?
Dès que vous constatez que vous avez oublié de prendre un comprimé, prenez immédiatement la dose oubliée, à condition que le retard de prise ne dépasse pas 12 heures. S'il s'est écoulé plus de 12 heures, ne prenez pas ce comprimé et continuez ensuite comme d'habitude avec le reste de la plaquette.
Ne prenez pas le double de la dose pour rattraper la dose unitaire oubliée.
Que faire si quelqu'un a pris accidentellement trop de comprimés?
Si quelqu'un a pris plusieurs comprimés en même temps, il ne faut pas trop s'inquiéter. Vous devez néanmoins consulter le médecin. On peut éventuellement noter des nausées et des vomissements. Une hémorragie vaginale est possible au bout de quelques jours.
Quels effets secondaires Tibolone Spirig HC peut-il provoquer?
Les effets secondaires suivants ont été rapportés pour Tibolone Spirig HC:
Fréquent (concerne 1 à 10 utilisateurs sur 100)
Prise de poids, douleurs abdominales, pilosité excessive, croissance excessive de la muqueuse utérine, épaississement de la muqueuse utérine, douleurs dans les seins, démangeaisons dans la région génitale, mycoses dans la région génitale, saignements vaginaux et petites pertes de sang, douleurs au bas-ventre, modifications des pertes vaginales ou inflammation du vagin, modifications du frottis du col de l'utérus.
Occasionnel (concerne 1 à 10 utilisateurs sur 1000)
Acné, troubles dans les seins ou douleurs dans les mamelons.
Rare (concerne 1 à 10 utilisateurs sur 10 000)
Accident vasculaire cérébral.
Fréquence inconnue: gonflement des tissus, dépression, maux de tête, vertige, obnubilation, nausée, migraine, troubles de la vue, troubles de la fonction du foie, éruption cutanée, démangeaison, douleurs musculaires ou articulaires, peau grasse.
Chez la plupart des patientes, certains de ces effets secondaires disparaissent après les premières semaines de traitement (p.ex. saignements vaginaux y compris petites pertes de sang, douleurs abdominales et sensation de tension dans les seins). Contactez votre médecin si des hémorragies vaginales apparaissent ou si des effets secondaires quelconques persistent.
En outre, les effets indésirables suivants ont été observés dans le cadre d'un traitement par œstrogènes seuls ou d'un THS combiné:
tumeurs dépendantes des hormones, bénignes ou malignes, variations du poids, troubles du sommeil, fluctuations de l'humeur, modifications de la libido, anomalies du rythme cardiaque, élévation de la tension artérielle, occlusion de vaisseaux sanguins (p.ex. caillot sanguin dans les veines des jambes ou des poumons, infarctus du myocarde), affections de la vésicule biliaire, coloration jaune de la peau et/ou des yeux (jaunisse), changement de couleur de la peau, en particulier du visage ou de la nuque, connu sous le nom de masque de grossesse (chloasma), pilosité excessive, chute de cheveux inhabituelle ou amincissement des cheveux, urticaire, éruption cutanée avec rougeurs ou vésicules en forme de cible (érythème polymorphe), peau rouge et douloureuse (érythème noueux), taches violettes ou rouge-brun visibles à travers la peau (purpura vasculaire), douleurs dorsales, augmentation de la taille de proliférations dans l'utérus, augmentation du volume des seins.
Si vous remarquez des effets secondaires, veuillez en informer votre médecin ou votre pharmacien. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d'emballage.
À quoi faut-il encore faire attention?
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
Conserver dans l'emballage d'origine à une température ne dépassant pas 30 °C et protéger de la lumière et de l'humidité. Tenir hors de portée des enfants.
Remarques complémentaires
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Tibolone Spirig HC?
Chaque comprimé contient
Principes actifs
2.5 mg de tibolone
Excipients
Lactose monohydraté, mannitol, amidon de pomme de terre, stéarate de magnésium, palmitate d'ascorbyle (E 304).
Numéro d'autorisation
68090 (Swissmedic)
Où obtenez-vous Tibolone Spirig HC? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Comprimés (plaquettes calendrier): 28 et 84.
Titulaire de l'autorisation
Spirig HealthCare SA, 4622 Egerkingen.
Cette notice d'emballage a été vérifiée pour la dernière fois en mai 2017 par l'autorité de contrôle des médicaments (Swissmedic).
Che cos'è Tibolone Spirig HC e quando si usa?
Tibolone Spirig HC è un medicamento per la terapia ormonale sostitutiva (TOS) che contiene come principio attivo il tibolone, una sostanza impiegata per le donne in postmenopausa, che hanno avuto la loro ultima mestruazione almeno 12 mesi prima.
Tibolone Spirig HC viene utilizzato per:
Alleviare i sintomi dopo la menopausa:
Durante la menopausa il corpo della donna produce meno estrogeni. Questo può causare una sensazione di calore al viso, al collo e al seno (vampate di calore). Tibolone Spirig HC allevia tali sintomi dopo la menopausa. Tibolone Spirig HC le viene prescritto soltanto se i suoi sintomi influiscono gravemente sulla sua vita quotidiana.
Prevenzione dell'osteoporosi
Dopo la menopausa in alcune donne le ossa diventano più fragili (osteoporosi).
Se a causa dell'osteoporosi per lei il rischio di fratture ossee risulta maggiore e nel suo caso non si può prendere in considerazione nessun altro trattamento, si può utilizzare Tibolone Spirig HC per prevenire l'osteoporosi dopo la menopausa. Dovrebbe discutere con il suo medico tutte le opzioni terapeutiche.
Tibolone Spirig HC può essere preso soltanto su prescrizione medica e sotto controllo medico.
Di che cosa occorre inoltre tener conto durante il trattamento?
Una terapia ormonale sostitutiva può comportare un maggiore rischio di cancro al seno, ulcere o cancro all'utero, nonché di malattie cardiocircolatorie, quali infarto miocardico, ictus, trombosi venosa ed embolia polmonare. Il medico discuterà con lei questi rischi, ponderandoli rispetto ai benefici attesi.
Nel caso delle donne con menopausa precoce (in seguito a insufficienza ovarica o a un intervento chirurgico) l'esperienza è limitata. In caso di menopausa precoce, i rischi di una TOS o di Tibolone Spirig HC possono essere diversi. Abbia cura di parlarne con il suo medico.
Quando non si può assumere Tibolone Spirig HC?
Non deve assumere Tibolone Spirig HC se:
- ha o ha avuto un cancro al seno o vi è il sospetto di un tale tumore
- ha un tumore ormone-dipendente accertato o sospetto, come per esempio un cancro della mucosa interna dell'utero (endometrio)
- ha un ingrossamento anomalo dell'endometrio (iperplasia endometriale) che non viene trattato
- ha emorragie vaginali di origine ignota
- ha o ha avuto un coagulo in una vena (trombosi), ad esempio nelle gambe (trombosi venosa profonda) o nei polmoni (embolia polmonare)
- ha o ha avuto recentemente una malattia causata da un coagulo nelle arterie, come ad esempio infarto miocardico, ictus o angina pectoris
- soffre di una malattia della coagulazione del sangue (come un deficit di proteina C, proteina S o antitrombina)
- ha o ha avuto una malattia del fegato e i suoi parametri epatici non si sono normalizzati
- soffre di «porfiria», una rara malattia ereditaria familiare del sangue
- è incinta o presume di esserlo
- allatta al seno
- è allergica (ipersensibile) al tibolone o a una delle sostanze ausiliarie
Se uno dei disturbi summenzionati si manifesta durante l'assunzione di Tibolone Spirig HC, sospenda immediatamente il medicamento e consulti subito il suo medico.
Quando è richiesta prudenza nella somministrazione di Tibolone Spirig HC?
Esami medici di controllo
Prima di iniziare (o iniziare nuovamente) una terapia ormonale sostitutiva, il suo medico raccoglierà un'accurata anamnesi individuale e familiare (malattie già avute da lei o dai suoi familiari). Il suo medico procederà poi a un approfondito esame generale e ginecologico.
Prima di iniziare il trattamento, il suo medico discuterà con lei i benefici e i rischi dell'assunzione di Tibolone Spirig HC.
Durante il trattamento con Tibolone Spirig HC dovrebbe recarsi dal suo medico a intervalli regolari (almeno una volta all'anno). Nel quadro di tali esami di controllo il suo medico deciderà, dopo avere considerato i benefici e i rischi, se continuare o meno il trattamento.
Interrompa l'assunzione di Tibolone Spirig HC e consulti subito il suo medico se durante l'assunzione del medicamento lei constata uno dei disturbi seguenti:
- uno dei punti menzionati nel paragrafo «Quando non si può usare Tibolone Spirig HC?»
- si manifestano i segni di un coagulo sanguigno, come per esempio:
- gonfiore dolente e arrossamento delle gambe
- improvvisi dolori al petto
- respiro difficoltoso
Per maggiori informazioni si veda «Coagulo in una vena (trombosi)».
- prima manifestazione di mal di testa simili a un'emicrania o ripetuti mal di testa insolitamente forti
- improvvisa perdita della capacità visiva, parziale o totale
- improvviso disturbo dell'udito
- forte aumento della pressione arteriosa (i sintomi possono essere mal di testa, stanchezza, vertigini)
- colorazione giallognola della pelle o della parte bianca degli occhi (itterizia). Questi possono essere indizi di una malattia epatica.
Determinate malattie possono aggravarsi in seguito al trattamento
Prima di iniziare il trattamento informi il suo medico qualora avesse mai avuto uno dei problemi seguenti, dato che durante il trattamento con Tibolone Spirig HC possono manifestarsi di nuovo o peggiorare. Se questo fosse il caso, dovrebbe recarsi più spesso dal medico per gli esami di controllo:
- maggiore rischio di tumori estrogeno-dipendenti (p.es. se sua madre, sua sorella o sua nonna avessero avuto un cancro al seno)
- crescita eccessiva dell'endometrio (iperplasia endometriale) in passato o nel caso di parenti stretti
- tumori (fibroidi) dell'utero o crescita dell'endometrio al di fuori dell'utero (endometriosi)
- maggiore rischio di formazione di coaguli (v. «Coagulo in una vena (trombosi)»)
- ipertensione
- emicrania o forte mal di testa
- diabete mellito
- disfunzioni epatiche o biliari, come p.es. un tumore benigno del fegato o calcoli biliari
- una malattia del sistema immunitario che colpisce numerosi organi (lupus eritematoso sistemico - LES)
- epilessia
- asma
- una malattia del timpano e dell'udito (otosclerosi)
- lipidemia molto elevata (trigliceridi)
- ritenzione di liquidi a causa di problemi cardiaci o renali
Malattie tumorali
Cancro al seno
Vi sono indizi, in base ai quali una TOS, Tibolone Spirig HC compreso, aumenta il rischio di cancro al seno. Il rischio supplementare dipende sia dalla durata della TOS sia dal tipo di TOS (estrogeni-progestinici o monoterapia con estrogeno). Il rischio supplementare si manifesta entro un paio di anni. Però si normalizza nuovamente entro un altro paio di anni dall'interruzione della terapia (al massimo 5).
Le donne che assumono Tibolone Spirig HC hanno un rischio minore di sviluppare un cancro al seno rispetto alle donne che ricevono una terapia ormonale sostitutiva combinata e un rischio paragonabile a quello delle donne sotto monoterapia estrogenica.
Controlli regolarmente i suoi seni. Consulti il suo medico se constata cambiamenti, come la formazione di affossamenti o un abbassamento della pelle, alterazioni del capezzolo o noduli palpabili o visibili.
Ispessimento anomalo dell'endometrio (iperplasia endometriale) e cancro endometriale
Durante l'assunzione di Tibolone Spirig HC sono stati riportati casi di maggiore proliferazione delle cellule dell'utero e di cancro all'utero. Il rischio di cancro aumenta con la durata del trattamento.
Cancro delle ovaie
Diversi studi suggeriscono che una terapia ormonale sostitutiva (sia per una monoterapia a base di estrogeni sia per una terapia ormonale sostitutiva combinata) potrebbe essere collegata a un rischio lievemente aumentato di comparsa di un carcinoma ovarico.
Nelle donne sottoposte a una TOS, Tibolone Spirig HC incluso, della durata di almeno 5-10 anni è stato osservato un leggero aumento del rischio di cancro alle ovaie.
Influsso sul cuore e la circolazione
Malattie cardiache (infarto miocardico)
Le donne di oltre 60 anni sotto TOS con estrogeni-progestinici soffrono di malattie cardiache con una frequenza leggermente maggiore rispetto a quelle che non ricevono una TOS. Dato che il rischio di malattia cardiaca dipende molto dall'età, il numero di malattie cardiache supplementari dovute a una TOS con estrogeni-progestinici è molto basso nelle donne sane poco dopo la menopausa, ma aumenta con l'avanzare degli anni.
Non vi sono indizi, in base ai quali con Tibolone Spirig HC il rischio di infarto miocardico sarebbe diverso rispetto ad altre TOS.
Ictus cerebrale
Da recenti studi clinici con tibolone e altri preparati per la TOS risulta che il rischio di ictus è maggiore. L'aumento di tale rischio è stato osservato indipendentemente dall'età e dal tempo trascorso dalla menopausa. Dato che il rischio di ictus dipende molto dall'età, aumenta con l'avanzare degli anni.
Nelle donne di 50-59 anni che prendono Tibolone Spirig HC per un periodo di 5 anni si possono prevedere in media 4 casi supplementari di ictus su 1000 donne.
Nelle donne di 60-69 anni che prendono Tibolone Spirig HC per un periodo di 5 anni si possono prevedere in media 13 casi supplementari di ictus su 1000 donne.
Coagulo in una vena (trombosi)
Il rischio di un coagulo nelle vene risulta maggiore per le donne sotto TOS, rispetto a quelle senza TOS, specialmente nel corso del primo anno di trattamento.
Nel caso delle donne di 50-59 anni che non ricevono una TOS, in media circa 3 su 1000 soffrono di un coagulo in una vena nell'arco di 5 anni. Nel caso delle donne di 50-59 anni che hanno ricevuto una TOS con estrogeni-progestinici durante più di 5 anni, i casi supplementari di formazione di un coagulo sono 2-6 donne su 1000.
I coaguli sanguigni possono avere gravi conseguenze; se un coagulo raggiunge un polmone, può causare dolori al petto, insufficienza respiratoria, perdita di conoscenza e addirittura la morte. Se notasse tali sintomi o sospettasse la formazione di un coagulo (p.es gonfiore dolente di una gamba), dovrà interrompere la terapia. Per gli ulteriori segni di un coagulo sanguigno v. «Interrompa l'assunzione di Tibolone Spirig HC e consulti subito il suo medico».
La probabilità di un coagulo nelle vene aumenta generalmente con l'età e se per lei vale uno dei punti seguenti. Informi il suo medico se per lei si verifica una delle situazioni seguenti:
- qualcuno nella sua famiglia ha già avuto un coagulo di sangue nelle gambe, nei polmoni o in un altro organo
- soffre di problemi di coagulazione e le occorre un trattamento di lunga durata con un medicamento per evitare i coaguli sanguigni
- lei fuma
- lei è molto in sovrappeso (BMI >30 kg/m2)
- soffre di lupus eritematoso sistemico (LES)
- è incinta o ha partorito di recente
- ha un cancro
- a causa di un importante intervento chirurgico, lesione o malattia non può camminare per parecchio tempo. Se dovrà sottoporsi presto a un'operazione, dica al suo medico che assume Tibolone Spirig HC. Eventualmente lei dovrà sospendere l'assunzione di Tibolone Spirig HC da 4 a 6 settimane prima dell'intervento, al fine di ridurre il rischio di coaguli sanguigni (v. «Quando è richiesta prudenza nella somministrazione di Tibolone Spirig HC?», «Coagulo in una vena (trombosi)»). Domandi al suo medico quando potrà ricominciare ad assumere Tibolone Spirig HC.
Sanguinamenti irregolari
Durante i primi 3-6 mesi di assunzione di Tibolone Spirig HC potrà notare sanguinamenti irregolari o piccole perdite ematiche (spotting).
Se però i sanguinamenti irregolari:
- persistono oltre i primi 6 mesi
- iniziano dopo che lei ha assunto Tibolone Spirig HC per più di 6 mesi
- persistono anche dopo che ha smesso di assumere Tibolone Spirig HC
dovrebbe consultare il suo medico al più presto possibile.
Ulteriori avvertenze e misure precauzionali
Vi sono alcuni indizi che indicano un maggiore rischio di perdita di memoria nelle donne che iniziano una TOS dopo i 65 anni. Domandi consiglio al suo medico.
La funzionalità della sua tiroide deve essere controllata regolarmente, se riceve una terapia ormonale sostitutiva tiroidea.
Tibolone Spirig HC non ha nessun effetto contraccettivo. Se dall'ultima mestruazione sono trascorsi meno di 12 mesi o se lei ha meno di 50 anni, eventualmente deve anche utilizzare un metodo contraccettivo per evitare una gravidanza. Domandi consiglio al suo medico.
Tibolone Spirig HC contiene lattosio. Se il suo medico le ha detto che lei ha un'intolleranza a determinati zuccheri, lo contatti prima di assumere questo medicamento.
Se il medico le ha diagnosticato una intolleranza ad alcuni zuccheri, lo contatti prima di prendere questo medicamento.
Assunzione di altri medicamenti
Alcuni medicamenti possono influire sull'effetto di Tibolone Spirig HC. Questo può causare sanguinamenti irregolari. Questo vale per i medicamenti seguenti:
- anticoagulanti
- antiepilettici (p.es. fenobarbital, fenitoina e carbamazepina)
- antitubercolotici (come la rifampicina)
- medicamenti di origine vegetale contenenti erba di S. Giovanni (Hypericum perforatum)
- Riferisca al suo medico se è in trattamento con medicamenti contro le infezioni da epatite C (medicamenti con principi attivi quali ombitsavir, paritaprevir, ritonavir, dasabuvir). I medicamenti a base di estrogeni potrebbero, in alcune condizioni, compromettere l'effetto di questi medicamenti. Non è noto se Tibolone Spirig HC possa influenzare l'effetto di questi medicamenti.
Informi il suo medico o il suo farmacista nel caso in cui
- soffre di altre malattie,
- soffre di allergie o
- assume o applica esternamente altri medicamenti (anche se acquistati di sua iniziativa)!
Si può assumere Tibolone Spirig HC durante la gravidanza o l'allattamento?
Tibolone Spirig HC è destinato esclusivamente alle donne in postmenopausa. Se dovesse restare incinta, interrompa l'assunzione di Tibolone Spirig HC e consulti il suo medico.
Non si deve assumere Tibolone Spirig HC durante l'allattamento.
Come usare Tibolone Spirig HC?
Assuma Tibolone Spirig HC come prescritto dal suo medico.
La dose è di 1 compressa al giorno. La compressa va ingerita con un po' di acqua o di altro liquido, preferibilmente sempre alla stessa ora. I blister di Tibolone Spirig HC sono contrassegnati con i giorni della settimana. Prenda ogni giorno una compressa; quando il blister è vuoto, deve iniziarne uno nuovo senza interruzioni. Il trattamento può iniziare in qualsiasi giorno della settimana.
L'assunzione di Tibolone Spirig HC dovrebbe iniziare non prima di 12 mesi dalla sua ultima mestruazione. Se il trattamento con Tibolone Spirig HC inizia prima, può aumentare il rischio di sanguinamenti irregolari.
Il suo medico cercherà di prescriverle la dose più bassa possibile e di trattare i suoi sintomi solo per il tempo strettamente necessario.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte, ne parli al suo medico o al suo farmacista.
Cosa fare se ha dimenticato di prendere una compressa?
Non appena si accorge di avere dimenticato l'assunzione di una compressa, deve prenderla immediatamente, a condizione che il ritardo dell'assunzione non superi 12 ore. Nel caso siano trascorse più di 12 ore, rinunci a questa compressa e continui con il resto della confezione come di consueto.
Non prenda una dose doppia per compensare la dose dimenticata.
Cosa fare se inavvertitamente sono state prese troppe compresse?
Se sono state prese contemporaneamente più compresse, non vi sono motivi di grosse preoccupazioni. È comunque opportuno interpellare il proprio medico. I disturbi che possono eventualmente manifestarsi sono rappresentati da nausea e vomito. Dopo qualche giorno si può manifestare un sanguinamento vaginale.
Quali effetti collaterali può avere Tibolone Spirig HC?
Per Tibolone Spirig HC sono stati riportati gli effetti collaterali seguenti:
Comune (riguarda da 1 a 10 utilizzatori su 100)
Aumento di peso, dolori addominali, eccessiva crescita di peli, eccessiva crescita della mucosa interna dell'utero (endometrio), ispessimento dell'endometrio, dolori al seno, prurito nella regione dei genitali, infezioni da funghi nella regione dei genitali, sanguinamenti vaginali e piccole perdite ematiche, dolori al basso ventre, alterazioni delle perdite vaginali o infiammazioni vaginali, alterazioni dello striscio della cervice uterina.
Non comune (riguarda da 1 a 10 utilizzatori su 1000)
Acne, disturbi al seno o dolori ai capezzoli.
Raro (riguarda da 1 a 10 utilizzatori su 10 000)
Ictus cerebrale.
Frequenza ignota: gonfiore dei tessuti, depressione, mal di testa, vertigini, stordimento, nausea, emicrania, disturbi della vista, disfunzioni epatiche, eruzioni cutanee, prurito, dolori muscolari o articolari, pelle grassa.
Nella maggior parte delle pazienti alcuni di questi effetti collaterali scompaiono dopo le prime settimane di trattamento (p.es. sanguinamenti vaginali e piccole perdite ematiche, dolori addominali e sensazione di tensione al seno). Consulti il suo medico se si manifestano sanguinamenti vaginali o se un qualsiasi effetto collaterale si protrae nel tempo.
In combinazione con una monoterapia estrogenica o una TOS combinata sono stati inoltre osservati i seguenti effetti indesiderati:
tumori benigni e maligni dipendenti dagli ormoni sessuali, aumento/diminuzione di peso, disturbi del sonno, fluttuazioni dell'umore, alterazione del desiderio sessuale, aritmie cardiache, aumento della pressione arteriosa, occlusione di vasi sanguigni (p.es. coaguli sanguigni nelle vene delle gambe o dei polmoni, infarto miocardico), malattie della cistifellea, colorazione giallognola della pelle e/o degli occhi (itterizia), comparsa di chiazze sulla pelle del viso o della nuca, note come maschera della gravidanza (cloasma), crescita eccessiva di peli, perdita o rarefazione anomala dei peli, orticaria, eruzioni cutanee con arrossamenti «a bersaglio» o vesciche (eritema multiforme), pelle arrossata e dolente (eritema nodoso), chiazze viola o brunastre, visibili attraverso la pelle (porpora vascolare), mal di schiena, crescita dei tumori presenti nell'utero, aumento del volume dei seni.
Se osserva effetti collaterali, si rivolga al suo medico o farmacista soprattutto se si tratta di effetti collaterali non descritti in questo foglietto illustrativo.
Di che altro occorre tener conto?
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Istruzioni di conservazione
Conservare a temperatura non superiore ai 30 °C, nella confezione originale, per proteggere il contenuto dalla luce e dall'umidità. Conservare fuori dalla portata dei bambini.
Ulteriori indicazioni
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Tibolone Spirig HC?
Una compressa contiene
Principi attivi
2,5 mg di tibolone
Sostanze ausiliarie
Lattosio monoidrato, mannitolo, amido di patata, magnesio stearate, ascorbile palmitato (E 304).
Numero dell'omologazione
68090 (Swissmedic).
Dove è ottenibile Tibolone Spirig HC? Quali confezioni sono disponibili?
In farmacia, dietro presentazione della prescrizione medica.
Compresse (confezione calendario): 28 e 84
Titolare dell'omologazione
Spirig HealthCare SA, 4622 Egerkingen.
Questo foglietto illustrativo è stato controllato l'ultima volta nel maggio 2017 dall'autorità competente in materia di medicamenti (Swissmedic).
Zusammensetzung
Wirkstoffe
Tibolon.
Hilfsstoffe
Lactose Monohydrat 43.15 mg, Mannitol, Kartoffelstärke, Magnesiumstearat, Ascorbylpalmitat (E 304).
Darreichungsform und Wirkstoffmenge pro Einheit
1 Tablette enthält 2,5 mg Tibolone
Indikationen/Anwendungsmöglichkeiten
Behandlung der Symptome des Östrogenmangels infolge der natürlichen oder künstlichen Menopause (mindestens 1 Jahr zurückliegend).
Vorbeugung oder Verzögerung einer durch Östrogenmangel induzierten Osteoporose bei postmenopausalen Frauen mit hohem Frakturrisiko, für die eine Behandlung mit anderen zur Prävention der Osteoporose zugelassenen Arzneimitteln nicht in Frage kommt, oder bei Frauen die gleichzeitig an behandlungsbedürftigen Symptomen des Östrogenmangels leiden.
Der Entscheidung über die Verschreibung von Tibolon Spirig HC sollte bei allen Frauen eine individuelle Untersuchung hinsichtlich des Gesamtrisikos vorangehen. Insbesondere bei über 60jährigen Frauen sollte das Schlaganfallrisiko berücksichtigt werden (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
Dosierung/Anwendung
Die Dosierung beträgt eine Tablette pro Tag.
Für alle Indikationen soll immer so kurz als möglich behandelt werden. Die Hormonsubstitution sollte nur fortgesetzt werden, solange der Nutzen für die einzelne Patientin das Risiko überwiegt.
Die Behandlung mit Tibolon Spirig HC darf nicht mit einem zusätzlichen Gestagen ergänzt werden.
Die Tabletten sollten mit etwas Wasser oder einer anderen Flüssigkeit eingenommen werden, nach Möglichkeit immer zum gleichen Zeitpunkt.
Beginn der Tibolon Spirig HC Einnahme
Die Behandlung mit Tibolon Spirig HC sollte frühestens 12 Monate nach der letzten natürlichen Menstruationsblutung beginnen. Bei einer früheren Einnahme von Tibolon Spirig HC können unregelmässige Blutungen oder Spotting häufiger auftreten. Im Falle einer Menopause infolge eines chirurgischen Eingriffs oder einer Chemotherapie kann die Behandlung mit Tibolon Spirig HC sofort beginnen.
Wechsel von einem anderen HRT-Präparat
Bei Frauen mit intaktem Uterus, die von einer Hormonsubstitution mit einem reinen Östrogen-Präparat auf Tibolon Spirig HC wechseln, sollte vor Beginn der Einnahme von Tibolon Spirig HC mittels eines Gestagen-Präparats eine Abbruchblutung eingeleitet werden. Beim Wechsel von einem sequentiellen HRT-Präparat sollte die Behandlung mit Tibolon Spirig HC direkt nach Beenden der Abbruchblutung begonnen werden. Der Wechsel von einem kombinierten HRT-Präparat zu Tibolon Spirig HC kann jederzeit stattfinden.
Vergessene Einnahme
Falls die Einnahme vergessen wurde, sollte dies sobald wie möglich nachgeholt werden, es sei denn, die letzte Einnahme liegt mehr als 12 Stunden zurück. In diesem Fall sollte auf eine nachträgliche Einnahme verzichtet und die nächste vorgeschriebene Dosis zum üblichen Zeitpunkt eingenommen werden.
Spezielle Dosierungsempfehlungen
Geriatrische Population: Eine Anpassung der Dosis bei älteren Patientinnen ist nicht erforderlich.
Niereninsuffizienz: Bei Patientinnen mit eingeschränkter Nierenfunktion ist keine Dosisanpassung erforderlich.
Leberinsuffizienz: Tibolon ist bei Patientinnen mit Leberinsuffizienz kontraindiziert.
Pädiatrische Population: Tibolon hat keine Indikation in der pädiatrischen Population.
Kontraindikationen
Tibolon Spirig HC sollte unter folgenden Umständen nicht eingenommen werden bzw. muss unverzüglich abgesetzt werden, wenn während der Einnahme folgende Situationen oder Erkrankungen auftreten:
- Bestehender oder früherer Brustkrebs bzw. ein entsprechender Verdacht
- Bestehende oder Verdacht auf hormonabhängige Tumore (z.B. Endometriumkarzinome)
- Nicht behandelte Endometriumhyperplasie
- Ungeklärte vaginale Blutungen
- Bestehende oder in der Vorgeschichte aufgetretene venöse thromboembolische Ereignisse (z.B. tiefe Venenthrombose, Lungenembolie)
- Bestehende oder in der Vorgeschichte aufgetretene arterielle thromboembolische Ereignisse (Angina pectoris, Herzinfarkt, Schlaganfall oder transitorische ischämische Attacke)
- Bekannte thrombophile Erkrankungen (z.B. Protein C-, Protein S-, oder Antithrombin-Mangel, siehe «Warnhinweise und Vorsichtsmassnahmen»)
- Akute oder vorausgegangene Lebererkrankung, solange die Leberfunktionswerte erhöht sind
- Porphyrie
- Schwangerschaft, Stillzeit
- Bekannte Überempfindlichkeit gegenüber einem der Inhaltsstoffe von Tibolon Spirig HC
Warnhinweise und Vorsichtsmassnahmen
Eine Behandlung postmenopausaler Symptome sollte nur begonnen werden, wenn dadurch die Lebensqualität beeinträchtigt ist.
Jeder Tibolon-Behandlung oder anderen Hormonersatztherapie sollte (unter Berücksichtigung der Kontraindikationen und Warnhinweise) eine Untersuchung des klinischen Allgemeinzustandes und eine gründliche gynäkologische Untersuchung (inkl. Beckenorgane und Mammae) vorangehen. Diese sind mindestens jährlich zu wiederholen. Die Eigen- und Familienanamnese sollte ebenfalls berücksichtigt werden. Das Nutzen-Risikoverhältnis muss vor jeder Therapie und für jede Patientin individuell sorgfältig abgewogen sowie im Rahmen der jährlichen Kontrolluntersuchungen erneut überprüft werden. Es sollte immer die kürzestmögliche Behandlungsdauer gewählt werden.
Wenn Tibolon Spirig HC oder eine andere Behandlung für die postmenopausale Frau in Erwägung gezogen wird, sollte folgendes individuell beachtet werden: therapeutische Indikation, Akzeptanz von Vaginalblutungen, mögliche Stimmungsschwankungen oder Libido-Probleme, Wirkungen auf das Brustgewebe und andere Nutzen und Risiken.
Jede abnorme Vaginalblutung, unabhängig ob unter einer HRT auftretend oder ohne Hormontherapie, muss vor Beginn einer Tibolon Spirig HC-Therapie abgeklärt werden, insbesondere um maligne Ursachen auszuschliessen.
Gründe für das sofortige Absetzen der Therapie
Bei Auftreten einer Kontraindikation sowie bei folgenden Situationen sollte die Therapie abgebrochen werden:
- Symptome einer venösen oder arteriellen thromboembolischen Erkrankung bzw. bei Verdacht darauf
- Erstmaliges Auftreten migräneartiger Kopfschmerzen oder wiederholte, ungewöhnlich starke Kopfschmerzen
- Plötzlicher partieller oder vollständiger Visusverlust
- Plötzliche Hörstörung
- Signifikanter Blutdruckanstieg
- Ikterus, Hepatitis oder Verschlechterung der Leberfunktion
Erkrankungen, die eine besondere Überwachung erfordern
Sollte eine der nachfolgenden Erkrankungen oder Risiken vorliegen oder in der Vergangenheit aufgetreten sein und/oder sich während einer Schwangerschaft oder einer vorausgegangenen Hormontherapie verschlechtert haben, sollte die Patientin engmaschig überwacht werden. Es ist zu beachten, dass diese Erkrankungen bei Einnahme von Tibolon Spirig HC wiederkehren oder sich verschlechtern können. Es handelt sich insbesondere um:
- Risikofaktoren für östrogenabhängige Tumore, z.B. Mammakarzinome bei Verwandten ersten Grades
- Endometriumhyperplasie in der Eigen- oder Familienanamnese (siehe unten)
- Leiomyome oder Endometriose
- Risikofaktoren für thromboembolische Erkrankungen (siehe unten)
- Hypertonie
- Migräne oder (starke) Kopfschmerzen
- Diabetes mellitus mit oder ohne vaskuläre Beteiligung
- Erkrankungen der Leber (z.B. Leberadenom) oder der Gallenblase (z.B. Cholelithiasis)
- Systemischer Lupus erythematodes
- Epilepsie
- Asthma
- Otosklerose
Tumorerkrankungen
Brustkrebs
Sowohl randomisierte, kontrollierte als auch epidemiologische Studien ergaben bei Frauen, die eine Hormonersatztherapie über mehrere Jahre anwandten, ein erhöhtes Brustkrebsrisiko. Bei allen Frauen sollten deshalb vor Beginn einer HRT sowie danach jährlich eine Brustuntersuchung durch den Arzt/die Ärztin und monatliche Selbstuntersuchungen der Brust erfolgen. Abhängig vom Alter und den jeweiligen Risikofaktoren sollte ggf. zusätzlich eine Mammographie durchgeführt werden. Frauen sollten darauf hingewiesen werden, dass sie Brustveränderungen ihrem Arzt/Ärztin unverzüglich mitteilen.
Eine Metaanalyse von 51 epidemiologischen Studien zeigte, dass das Risiko, an Brustkrebs zu erkranken, mit der Dauer der HRT zunimmt und nach Absetzen der HRT abnimmt. Das relative Risiko, an Brustkrebs zu erkranken, war 1,35 (95% CI 1,21-1,49) für Frauen, die eine HRT während 5 Jahren oder länger anwandten.
Die WHI-Studie zeigte im Vergleich zu Placebo unter kombinierter HRT mit konjugierten Östrogenen und Medroxyprogesteronacetat nach einer durchschnittlichen Behandlungsdauer von 5,6 Jahren eine Zunahme von invasiven Mammakarzinomen in der Östrogen-Gestagen-Gruppe (relatives Risiko RR 1,24 [95% CI 1,02-1,50]). Für die Östrogen-Monotherapie war das Risiko hingegen nicht erhöht (RR 0,77 [0,95% CI 0,59-1,01]).
Die Million Women Study (MWS), eine nicht-randomisierte Kohortenstudie (Durchschnittsalter bei Eintritt in die Studie 55,9 Jahre) fand unter der Dosierung von 2,5 mg Tibolon ein signifikant erhöhtes Brustkrebsrisiko. In dieser Studie erhielt eine Hälfte der Frauen vor und/oder zum Zeitpunkt des Studieneintritts eine HRT, die andere Hälfte wurde nie mit einer HRT behandelt. Bei allen Arten der HRT stieg das Risiko mit zunehmender Dauer der Anwendung. Nach Absetzen der Therapie war das Risiko regredient. Das höchste Risiko wurde unter kombinierter Östrogen-Gestagen-Therapie gesehen (2,00 [95% CI 1,88-2,12]). Für eine Östrogen-Monotherapie lag das relative Risiko bei 1,30 (95% CI 1,21-1,40) und für Tibolon bei 1,45 (95% CI 1,25-1,68). Eine epidemiologische Studie unter Verwendung der General Practice Research Database (GPRD) konnte diese Resultate nicht bestätigen.
Bei Anwenderinnen von Tibolon muss bei einer Behandlungsdauer von 5 Jahren mit 3 (95% CI 0-6) zusätzlichen Fällen pro 1000 Frauen gerechnet werden.
In einer Placebo-kontrollierten Studie (LIBERATE Studie) an n=3148 Frauen (Durchschnittsalter 52,7 Jahre) mit positiver Brustkrebs-Anamnese war das Risiko von Rezidiven des Mammakarzinoms nach dreijähriger Beobachtungsdauer unter einer Behandlung mit Tibolon (2,5 mg/Tag) gegenüber Placebo signifikant erhöht (HR 1,40, 95% CI 1,14-1,70). Tibolon ist daher bei Patientinnen mit einem Mammakarzinom in der Anamnese kontraindiziert.
Endometriumhyperplasie und -karzinom
Unter einer Östrogen-Monotherapie ist bei Frauen mit intaktem Uterus das Risiko eines Endometriumkarzinoms höher als bei unbehandelten Frauen und scheint von der Behandlungsdauer und der Östrogendosis abhängig zu sein. Das grösste Risiko scheint mit einer länger dauernden Anwendung einherzugehen. Es wurde gezeigt, dass das Risiko einer Endometriumhyperplasie, welche als Vorstufe eines Endometriumkarzinoms gilt, durch Zugabe eines Gestagens zu einer Östrogenbehandlung reduziert werden kann.
Ob die Riskoerhöhung für das Endometriumkarzinom auch für Tibolon zutrifft, ist bisher nicht abschliessend geklärt, die verfügbaren Daten aus klinischen Studien sind widersprüchlich. Epidemiologische Studien deuten jedoch darauf hin, dass auch unter Tibolon das Risiko für ein Endometriumkarzinom erhöht sein könnte. Das Risiko für maligne Endometriumveränderungen steigt mit zunehmender Anwendungsdauer.
Die stärkste Risikoerhöhung fand sich in einer randomisierten, Placebo-kontrollierten Studie (LIFT Studie) an n=3519 Frauen (Durchschnittsalter 68 Jahre) ohne regelmässige Gebärmutter-Untersuchung. In dieser Studie wurden nach 2,9 Jahren in der Placebogruppe (n=1773) keinerlei Fälle von Endometriumskarzinom diagnostiziert im Vergleich zu 4 Fällen in der Tibolon-Gruppe (n=1746). Dies entspricht 0,8 zusätzlichen Fällen pro 1000 Frauen, welche Tibolon über 1 Jahr angewendet haben.
Auch in der Million Women Study fand sich ein erhöhtes Risiko für Endometriumskarzinome bei Frauen, die Tibolon anwandten (RR 1,8, 95% CI 1,4-2,3), wobei das Risiko mit zunehmender Anwendungsdauer anstieg.
In der transvaginalen Sonographie erhöht Tibolon die endometriale Dichte.
Während der ersten Behandlungsmonate können Durchbruchsblutungen und Spotting auftreten (siehe «Eigenschaften/Wirkungen»). Die Frauen sollten aufgefordert werden, den Arzt/die Ärztin zu informieren, falls Durchbruchsblutungen oder Spotting auch noch nach sechsmonatiger Behandlungsdauer auftreten, im Laufe der Behandlung neu auftreten oder nach Abbruch der Behandlung noch anhalten. In solchen Fällen sollte eine gynäkologische Untersuchung zum Ausschluss maligner Veränderungen des Endometriums erfolgen (einschliesslich Endometriumbiopsie).
Ovarialkarzinom
Mehrere epidemiologische Studien deuten darauf hin, dass eine HRT mit einem erhöhten Risiko für die Entwicklung eines epithelialen Ovarialkarzinomes verbunden sein könnte. Eine Risikoerhöhung wurde sowohl für eine Östrogen-Monotherapie als auch für eine kombinierte HRT gefunden. Während die meisten Studien eine Risikoerhöhung erst bei einer Langzeitanwendung (d.h. mindestens 5 Jahre) zeigten, fand sich in einer 2015 publizierten Metaanalyse (unter Berücksichtigung von insgesamt 17 prospektiven und 35 retrospektiven Studien) kein solcher Zusammenhang mit der Anwendungsdauer. In der Million Women Study war das Risiko eines Ovarialkarzinoms unter Tibolon jenem unter anderen HRT-Präparaten vergleichbar.
In der prospektiven, randomisierten, Placebo-kontrollierten Studie WHI-Studie (in die keine Patientinnen unter Tibolon eingeschlossen waren) fand sich eine statistisch nicht signifikante Risikoerhöhung (HR 1,41; 95%-KI 0,75-2,66).
Da Ovarialkarzinome sehr viele seltener sind als Brustkrebs, ist die absolute Risikoerhöhung bei Frauen, welche eine HRT anwenden oder bis vor kurzem angewendet haben, gering.
Thromboembolische Erkrankungen
Koronare Herzkrankheit
Eine HRT sollte nicht eingesetzt werden zur Prävention kardiovaskulärer Erkrankungen. Grosse klinische Studien zeigten keinen günstigen Effekt in der Primärprophylaxe (WHI-Studie) oder Sekundärprophylaxe (HERS-Studie) kardiovaskulärer Erkrankungen. Auch eine epidemiologische Studie basierend auf der General Practice Research Database (GPRD) ergab keine Hinweise auf einen Schutz gegen Myokardinfarkte bei postmenopausalen Frauen, die Tibolon einnahmen.
Die Women's Health Initiative (WHI) Studie, eine grosse, prospektive, Placebo- kontrollierte, randomisierte Studie, zeigte bei mehr als 8000 älteren Frauen (Alter bei Studienbeginn 50 bis 79 Jahre, mittleres Alter 63 Jahre), welche eine orale Hormonersatztherapie mit konjugierten Östrogenen und Medroxyprogesteronacetat während durchschnittlich 5,2 Jahren erhielten, ein erhöhtes Risiko für kardiovaskuläre Ereignisse gegenüber Placebo (relatives Risiko 1,24 [95% CI 1,00-1,54], absolute Risikoerhöhung 6 Fälle pro 10'000 Frauenjahre). Das Risiko war am höchsten im ersten Jahr nach Beginn der HRT, (relatives Risiko 1,81 [95% CI 1,09-3,01]). Mit zunehmendem Abstand zur Menopause nahm das Risiko zu (Menopause <10 Jahren: relatives Risiko 0,89; Menopause 10-19 Jahre: relatives Risiko 1,22; Menopause ≥20: Jahre, relatives Risiko 1,71). Im Östrogen-Monotherapie-Arm war kein signifikanter Einfluss auf das kardiovaskuläre Risiko erkennbar (RR 0,91 [95% CI 0,75-1,12]).
Die Heart and Estrogen/Progestin Replacement Study (HERS und HERS II), eine prospektive, Placebo-kontrollierte, randomisierte Studie, zeigte bei mehr als 1300 postmenopausalen Frauen mit vorbestehender koronarer Herzkrankheit (mittleres Alter bei Studieneinschluss 67 Jahre), welche eine orale Hormonersatztherapie mit konjugierten Östrogenen und Medroxyprogesteronacetat während durchschnittlich 4,1 Jahren (HERS) und 2,7 Jahren (HERS II) erhielten, keine Reduktion des kardiovaskulären Risikos. Das relative Risiko war 0,99 [95% CI 0,84-1,17]. Das Risiko war am höchsten im ersten Jahr nach Beginn der HRT (relatives Risiko 1,52 [95% CI 1,01-2,29]).
Obwohl unklar ist, inwieweit die Resultate dieser beiden Studien auf eine jüngere Population oder auf HRT Präparate mit anderen Wirkstoffen (nebst Tibolon Spirig HC) extrapoliert werden können, sollten sie vom Arzt bzw. von der Ärztin vor der Verschreibung einer HRT berücksichtigt werden. Bei Frauen, welche bereits bestehende Risikofaktoren für das Auftreten von zerebro- oder kardiovaskulären Ereignissen aufweisen, sollten womöglich andere Therapien in Betracht gezogen werden.
Ischämischer Schlaganfall
Tibolon erhöht das Risiko eines ischämischen Schlaganfalls ab dem ersten Behandlungsjahr. Auch in der WHI-Studie war das zerebrovaskuläre Risiko sowohl unter kombinierter Östrogen-Gestagen-Therapie (RR 1.31 [95% CI 1.02-1.68] als auch unter Östrogen-Monotherapie (RR 1.39 [95% CI 1.10-1.77]) erhöht.
Eine randomisierte, kontrollierte Studie an n=4506 Frauen (Durchschnittsalter 68 Jahre) fand nach 2,9 Jahren bei Frauen, die mit Tibolon 1,25 mg behandelt wurden (28/2249), ein 2,2fach erhöhtes Schlaganfall-Risiko gegenüber Frauen unter Placebo (13/2257). In der überwiegenden Mehrzahl der Fälle (80%) handelte es sich dabei um ischämische Ereignisse. Die Dosis von 2,5 mg Tibolon wurde in dieser Studie nicht untersucht.
Das relative Risiko ist unabhängig vom Alter oder der Zeit seit der Menopause. Da das Grundrisiko für einen Schlaganfall jedoch stark vom Alter abhängt, erhöht sich das Gesamtrisiko bei Frauen unter Tibolon (oder einer anderen HRT) mit zunehmendem Alter. Bei Frauen, die Tibolon während 5 Jahren anwenden, werden in der Altersgruppe 50-59 Jahre 4 zusätzliche Fälle pro 1000 Anwenderinnen erwartet, in der Altersgruppe 60-69 Jahre 13 zusätzliche Fälle pro 1000 Anwenderinnen.
Venöse Thromboembolien
Eine Hormonersatztherapie ist mit einem erhöhten Risiko für venöse thromboembolische Ereignisse verbunden wie tiefe Venenthrombose (VTE) oder Lungenembolie. Zwei kontrollierte randomisierte Studien (WHI und HERS) und mehrere epidemiologische Studien ergaben ein 1.3 bis 3-fach erhöhtes Risiko bei Frauen, die eine HRT anwandten, verglichen mit Frauen, die nie eine solche Behandlung erhalten haben. Die WHI Studie zeigte insbesondere eine erhöhte Inzidenz von Lungenembolien. Das absolute Zusatzrisiko bei den mit kombinierter Hormonsubstitution behandelten Frauen betrug 8 Fälle auf 10'000 (15 versus 7), das relative Risiko 2,13 [95% CI 1,39-3,25]. Das erhöhte Risiko wurde nur bei Frauen unter Hormonsubstitutionstherapie gefunden und bestand nicht bei früheren Anwenderinnen. Das Risiko für ein thromboembolisches Ereignis ist im ersten Jahr einer HRT am höchsten.
Auch im Östrogen-Monotherapiearm der WHI-Studie war das Risiko einer venösen Thromboembolie tendenziell erhöht. Das relative Risiko einer tiefen Venenthrombose war 1,47 [95% CI 0,87-2,47], jenes einer Lungenembolie 1,34 [95% CI 0,70-2,55].
Für Nicht-Anwenderinnen wird die Anzahl der VTE Fälle während eines Zeitraums von 5 Jahren auf 3 von 1000 Frauen für die Altersgruppe 50-59 Jahre und 8 von 1000 Frauen für die Altersgruppe 60-69 Jahre geschätzt. Bei gesunden Frauen, die eine Hormonsubstitutionstherapie über 5 Jahre durchführen, wurden für die Altersgruppe 50-59 Jahre 2 bis 6 zusätzliche Fälle von VTE und für die Altersgruppe 60-69 Jahre 5 bis 15 zusätzliche Fälle von VTE pro 1000 Frauen geschätzt.
Bei Auftreten entsprechender Symptome (zum Beispiel schmerzhaftes Anschwellen eines Beines, plötzliche Schmerzen in der Brust, Atemnot) oder Verdacht auf eine thromboembolische Erkrankung muss das Präparat sofort abgesetzt und der Arzt bzw. die Ärztin aufgesucht werden. Patientinnen mit Risikofaktoren für thromboembolische Ereignisse sollten sorgfältig überwacht werden. Bei diesen Frauen muss das Nutzen-Risiko-Verhältnis sorgfältig abgewogen werden, und wo möglich sollten andere Therapien in Betracht gezogen werden.
Die Risikofaktoren für venöse Thromboembolien umfassen eine entsprechende Eigen- oder Familienanamnese, Rauchen, schwere Adipositas (BMI >30 kg/m2), systemischen Lupus erythematodes und maligne Erkrankungen. Das Risiko für venöse Thromboembolien erhöht sich auch mit zunehmendem Alter. Es gibt keinen Konsensus über die mögliche Rolle von Varizen bei der Entwicklung von venösen Thromboembolien.
Eine Anamnese mit wiederholten Spontanaborten sollte abgeklärt werden, um eine Thrombophilie-Prädisposition auszuschliessen. Bei Frauen mit dieser Diagnose ist die Anwendung der Hormonersatztherapie kontraindiziert.
Bei Frauen, welche eine Kombination von Risikofaktoren oder einen höheren Schweregrad eines einzelnen Risikofaktors aufweisen, sollte berücksichtigt werden, dass das Risiko überadditiv erhöht sein kann. Daraus kann sich unter Umständen eine Kontraindikation für eine Hormonersatztherapie ergeben.
Das Risiko venöser Thromboembolien kann vorübergehend erhöht sein bei längerer Immobilisierung, grösseren operativen Eingriffen oder nach einem schweren Trauma. Bei Frauen unter Hormonsubstitution ist prophylaktischen Massnahmen grösste Beachtung zu schenken, um venöse Thromboembolien nach chirurgischen Eingriffen zu vermeiden. Abhängig von der Art des Eingriffs und der Dauer der Immobilisierung sollte eine vorübergehende Unterbrechung der Hormonsubstitutionstherapie in Betracht gezogen werden, bei geplanten Operationen 4-6 Wochen vor dem Eingriff. Die Behandlung soll erst dann wieder aufgenommen werden, wenn die Frau vollständig mobil ist.
Bei Frauen ohne VTE in der Vorgeschichte, aber mit Verwandten ersten Grades, die bereits in jungen Jahren eine Thrombose hatten, kann ein Thrombophilie-Screening in Erwägung gezogen werden. Wird ein thrombophiler Defekt festgestellt und sind ausserdem Thrombosen bei Verwandten bekannt oder ist der festgestellte Defekt schwerwiegend (z.B. Antithrombin-, Protein S- oder Protein C-Mangel oder eine Kombination von Defekten), so ist Tibolon kontraindiziert.
Bei Frauen, welche bereits mit Antikoagulantien behandelt werden, ist eine sorgfältige Nutzen-Risiko-Abwägung von Tibolon notwendig.
Demenz
In der Women's Health Initiative Memory Study (WHIMS), einer randomisierten, Placebo-kontrollierten, der WHI untergeordneten Studie, wurden über 2000 Frauen im Alter von >65 Jahren (Durchschnittsalter 71 Jahre) mit oralen konjugierten equinen Östrogenen und Medroxyprogesteronacetat behandelt und während durchschnittlich 4 Jahren überwacht. Zudem wurden 1464 hysterektomierte Frauen im Alter von 65 bis 79 Jahren mit oralen konjugierten equinen Östrogenen allein behandelt und während durchschnittlich 5,2 Jahren überwacht. Weder die Behandlung mit konjugierten Östrogenen und Medroxyprogesteronacetat noch die Östrogentherapie zeigten einen günstigen Effekt auf die kognitive Funktion. Das Risiko für das Auftreten einer wahrscheinlichen Demenz war für die kombinierte HRT sogar erhöht (relatives Risiko 2,05 [95% CI 1,21-3,48]). Dies bedeutet in absoluten Zahlen pro Jahr 23 zusätzliche Fälle pro 10'000 behandelten Frauen.
Obschon noch unklar ist, inwieweit die Resultate dieser beiden Studien auf eine jüngere Population oder auf HRT Präparate mit anderen Wirkstoffen (wie Tibolon Spirig HC) extrapoliert werden können, sollten sie vom Arzt bzw. von der Ärztin bei der Beurteilung des Nutzen/Risiko Verhältnisses einer HRT berücksichtigt werden.
Andere Erkrankungen
Östrogene können eine Flüssigkeitsretention verursachen. Deshalb sollten Patientinnen mit Herz- oder Nierenerkrankungen sorgfältig überwacht werden.
Ein definitiver Zusammenhang zwischen der Anwendung einer HRT und dem Entstehen einer klinischen Hypertonie wurde bisher nicht dokumentiert. Eine leichte Erhöhung des Blutdruckes wurde bei Frauen unter einer HRT beobachtet, eine klinisch relevante Erhöhung ist jedoch selten. Wenn es während der HRT zu dauerhaft erhöhten Blutdruckwerten kommt, sollte ein Abbruch der HRT in Erwägung gezogen werden.
Tibolon beeinflusst die Serumlipide. Basierend auf den Befunden von insgesamt 18 Studien fanden sich dabei folgende Effekte: Die Behandlung mit Tibolon resultierte in einer deutlichen, dosisabhängigen Abnahme des HDL-Cholesterins. Der HDL-Spiegel nahm nach zwei Jahren unter 0,625 mg um 14,5%, unter 1,25 mg um 16,7% und unter 2,5 mg um 21,8% ab. Gleichzeitig nahmen aber auch Gesamtcholesterin, VLDL-Cholesterin, Triglyceride und Lipoprotein(a) ab, wobei hier keine klare Dosisabhängigkeit erkennbar war. Das LDL-Cholesterin blieb hingegen unverändert. Die klinische Bedeutung dieser Resultate ist bisher nicht bekannt.
Frauen mit vorbestehender Hypertriglyceridämie (insbesondere familiäre Formen) müssen während der Einnahme von östrogenhaltigen oder anderen HRT-Präparaten engmaschig überwacht werden, da bei Vorliegen dieser Erkrankung in seltenen Fällen über einen sehr starken Anstieg der Triglyceride während einer Östrogentherapie berichtet wurde, der zu einer Pankreatitis führte.
Sollte unter einer HRT eine Endometriose wieder reaktiviert werden, wird empfohlen, die Therapie abzubrechen.
Bei Patientinnen mit Hepatitis C, welche gleichzeitig ein Ethinylestradiol (EE)-haltiges Kontrazeptivum anwendeten, wurde unter Anwendung der Wirkstoffkombination Ombitasvir/Paritaprevir/Ritonavir mit oder ohne Dasabuvir signifikant häufiger eine klinisch relevante Erhöhung der ALT (einschliesslich Fällen eines Anstieg auf über das Fünffache der Obergrenze des Normbereiches) beobachtet als bei Patientinnen, welche ausschliesslich mit den antiviralen Wirkstoffen behandelt wurden. Unter Anwendung anderer Östrogene (insbesondere Estradiol und Estradiolvalerat) war hingegen die Inzidenz einer Transaminasenerhöhung nicht höher als bei Patientinnen ohne Östrogentherapie. Die limitierten Fallzahlen erlauben es jedoch nicht, ein ähnliches Risiko wie bei EE auszuschliessen. Für Tibolon liegen keine entsprechenden Daten vor. Da der Mechanismus dieser Interaktion völlig unbekannt ist, kann jedoch bisher nicht beurteilt werden, ob Tibolon – aufgrund seiner östrogenartigen Wirkung – ebenfalls von dieser Interaktion betroffen sein könnte. Bei gleichzeitiger Anwendung von Tibolon Spirig HC mit der Wirkstoffkombination Ombitasvir/Paritaprevir/Ritonavir mit oder ohne Dasabuvir wird daher zu entsprechender Vorsicht geraten.
Tibolon Spirig HC hat keine kontrazeptive Wirkung.
Patientinnen mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-Mangel oder Gluocse-Galactose-Malabsorption sollten dieses Arzneimittel nicht anwenden.
Die oben angegebenen Risiken einer HRT wurden überwiegend bei der Behandlung von Frauen im Alter ≥50 Jahren beschrieben. Über die Übertragbarkeit dieser Daten auf Patientinnen mit vorzeitiger Menopause (d.h. Ausfall der Ovarialfunktion vor Vollendung des 40. Lebensjahres infolge endokriner/genetischer Erkrankungen, Ovarektomie, Malignomtherapie etc.) bis zum Erreichen des normalen Menopausenalters liegen keine Daten vor. In dieser Altersgruppe sollte eine spezielle Nutzen-Risiko-Bewertung durchgeführt werden, wobei auch die Ätiologie der vorzeitigen Menopause (chirurgisch versus andere Ursachen) berücksichtigt werden sollte.
Diagnostik und Einleitung der Therapie sollten bei Patientinnen mit vorzeitiger Menopause möglichst in einem entsprechenden Zentrum erfolgen, welches Erfahrung mit der Behandlung dieses Krankheitsbildes besitzt.
Interaktionen
Pharmakokinetische Interaktionen
Es liegen nur limitierte Daten betreffend pharmakokinetische Interaktionen mit Tibolon vor. Gemäss in vitro-Studien beeinflusst Tibolon die P450-Enzyme nur in sehr geringem Masse. Deshalb ist es unwahrscheinlich, dass Tibolon ein klinisch relevanter Inhibitor der Cytochrome P450 ist.
In-vivo Studien haben jedoch gezeigt, dass Tibolon die Pharmakokinetik von Midazolam, welches durch CYP3A4 metabolisiert wird, in einem geringen Masse beeinflusst. Aus diesem Grund sind Wechselwirkungen mit anderen CYP3A4-Substraten möglich.
CYP3A4-induzierende Substanzen wie Barbiturate, Carbamazepin. Hydantoin und Rifampicin sowie pflanzliche Arzneimittel, die Johanniskraut (Hypericum perforatum) enthalten, können den Metabolismus von Tibolon verstärken und so dessen therapeutische Wirkung beeinflussen. In der klinischen Praxis kann dies zu verminderter Wirksamkeit und/oder zu Änderungen des uterinen Blutungsmusters führen.
Pharmakodynamische Interaktionen
Da Tibolon zu einer Steigerung der fibrinolytischen Aktivität des Blutes führen kann (verringerte Fibrinogenspiegel; höhere AT III-, Plasminogen-, und fibrinolytische Aktivitätswerte), kann es die Wirkung von Antikoagulanzien verstärken.
Eine Interaktionsstudie hat gezeigt, dass Tibolon die Wirkung von Warfarin steigert. Frauen, die Tibolon Spirig HC einnehmen und gleichzeitig einer Antikoagulation bedürfen, sollen insbesondere zu Beginn oder nach Absetzen der Tibolon Spirig HC-Einnahme entsprechend überwacht werden. Nötigenfalls sollte die Warfarin Dosis angepasst werden.
Schwangerschaft/Stillzeit
Es existieren keine Daten über die Anwendung von Tibolon bei Schwangeren. Es gibt Hinweise auf fötale Risiken beim Tier. Da das Risiko beim Menschen unbekannt ist, ist Tibolon Spirig HC in der Schwangerschaft kontraindiziert.
Das Arzneimittel sollte während der Stillzeit nicht eingenommen werden, da die Milchproduktion reduziert und die Qualität der Milch verändert sein kann.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurde keine diesbezügliche Studie durchgeführt.
Es ist nicht bekannt, ob Tibolon Spirig HC einen Einfluss auf Aufmerksamkeit und Konzentrationsfähigkeit hat.
Unerwünschte Wirkungen
Kontrollierte Studien
Die Sicherheit von Tibolon wurde in 21 Placebo-kontrollierten Studien untersucht. In diesen Studien wurden 3476 Frauen mit Placebo und 4079 Frauen mit 1,25 mg oder 2,5 mg Tibolon pro Tag behandelt. Die Behandlungsdauer reichte von 2 Monaten bis zu 4,5 Jahren. Nachfolgend sind die unerwünschten Wirkungen nach Organsystem und Häufigkeit angegeben, welche in diesen Studien sowie während der Post-Marketing-Überwachung beobachtet wurden.
Die Häufigkeiten sind dabei wie folgt definiert:
Häufig (≥1/100, <1/10), gelegentlich (≥1/1000, <1/100), selten (≥1/10'000, <1/1000), nicht bekannt (basierend überwiegend auf Spontanmeldungen aus der PMS, genaue Häufigkeit kann nicht abgeschätzt werden)
Stoffwechsel- und Ernährungsstörungen
Häufig: Gewichtszunahme.
Erkrankungen des Nervensystems
Nicht bekannt: Kopfschmerzen, Schwindel, Benommenheit, Migräne, Depression.
Augenerkrankungen
Nicht bekannt: Sehstörungen (z.B. Verschwommensehen).
Herzerkrankungen
Selten: Schlaganfall.
Erkrankungen des Gastrointestinaltrakts
Häufig: Bauchschmerzen.
Nicht bekannt: Übelkeit.
Leber- und Gallenerkrankungen
Nicht bekannt: Leberfunktionsstörung.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Hypertrichose.
Gelegentlich: Akne.
Nicht bekannt: Hautausschlag, Pruritus, Seborrhoe.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Nicht bekannt: Myalgien, Arthralgien.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Häufig: Endometriumhypertrophie bzw. sonographische Verdickung des Endometriums, Brustschmerzen, genitaler Pruritus, Vaginitiden, genitale Candidiasis, vaginale Blutungen (auch Schmierblutungen), Unterleibsschmerzen, Veränderungen im Zervixabstrich (einschliesslich Dysplasie), Leukorrhoe, Vulvovaginitis.
Gelegentlich: Brustbeschwerden, Pilzinfektion, vaginale Mykosen, Mamillarschmerzen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Nicht bekannt: Ödeme.
Von den genannten unerwünschten Wirkungen treten vaginale Blutungen bzw. Schmierblutungen, Bauchschmerzen und Spannungsgefühl in der Brust insbesondere während der ersten Behandlungsmonate auf und klingen anschliessend ab.
In Zusammenhang mit einer Östrogen-Monotherapie oder einer kombinierten HRT wurden ausserdem folgende unerwünschte Wirkungen beobachtet:
Benigne und maligne Sexualhormon-abhängige Neoplasien, Gewichtsveränderungen, Schlafstörungen, Stimmungsschwankungen, Libidoveränderungen, Palpitationen, Blutdruckanstieg, venöse und arterielle thromboembolische Ereignisse (z.B. tiefe Venenthrombose, Myokardinfarkt), Gallenblasenerkrankungen, cholestatischer Ikterus, Chloasma, Hirsutismus, Alopezie, Urtikaria, Erythema multiforme, Erythema nodosum, vaskuläre Purpura, Rückenschmerzen, Grössenzunahme uteriner Myome, Grössenzunahme der Brüste.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Bei Tieren ist die akute Toxizität von Tibolon sehr gering. Es kann daher davon ausgegangen werden, dass es auch bei gleichzeitiger Einnahme mehrerer Tabletten nicht zu Vergiftungserscheinungen kommt. Im Falle einer akuten Überdosierung kann es zu Übelkeit, Erbrechen und Abbruchblutungen kommen. Ein spezielles Antidot ist nicht bekannt. Sofern nötig, kann eine symptomatische Behandlung eingeleitet werden.
Eigenschaften/Wirkungen
ATC-Code
G03CX01
Wirkungsmechanismus
Nach oraler Verabreichung wird Tibolon rasch zu drei verschiedenen Verbindungen metabolisiert, die zum pharmakologischen Profil von Tibolon beitragen. Zwei dieser Metaboliten (3α-OH-Tibolon und 3β-OH-Tibolon) haben eine östrogenartige Wirkung während der dritte Metabolit (Δ4-Isomer von Tibolon) gestagen- und androgenartige Wirkungen besitzt. Tibolon Spirig HC ersetzt den Verlust der Östrogenproduktion bei postmenopausalen Frauen und lindert menopausale Symptome. Tibolon Spirig HC beugt dem auf die Menopause oder auf eine Ovarektomie folgenden Knochenverlust vor.
Pharmakodynamik
Siehe Rubrik «Wirkungsmechanismus»
Klinische Wirksamkeit
Linderung der östrogenmangelbedingten klimakterischen Beschwerden
- Eine Linderung der postmenopausalen Symptome tritt in der Regel in den ersten Wochen einer Behandlung auf.
Wirkungen auf das Endometrium und das Blutungsmuster
- Es gibt Berichte über Endometriumhyperplasien und Endometriumkarzinome bei Patientinnen, die mit Tibolon behandelt wurden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
- Eine Amenorrhoe wurde bei 88% der Frauen nach 12 Behandlungsmonaten mit Tibolon 2,5 mg beobachtet. Es wurde über Durchbruchblutungen und/oder Spotting bei 32,6% der Frauen während der ersten 3 Behandlungsmonate und bei 11,6% der Frauen nach 11-12 Behandlungsmonaten berichtet.
Osteoporose-Prophylaxe
- Der Östrogenmangel nach der Menopause führt zu einer Steigerung des Knochen-Turnovers und zu einem Abbau der Knochenmasse. Der Schutz durch Tibolon scheint solange gewährleistet zu sein, wie die Behandlung fortgesetzt wird. Nach Beendigung einer HRT ist der Knochenabbau mit demjenigen nicht behandelter Frauen vergleichbar.
- Nach zweijähriger Behandlung mit Tibolon stieg die Knochendichte der Wirbelsäule (BMD) auf 2,6 ± 3,8%. Bei 76% der Frauen konnte die Knochendichte im Wirbelsäulenbereich erhalten oder erhöht werden. Eine zweite Studie bestätigte diese Resultate. Tibolon (2,5 mg) wirkt auch auf die Knochendichte des Hüftknochens. In einer Studie konnte nach zwei Jahren ein Anstieg von 0,7 ± 3,9% am Schenkelhals und 1,7 ± 3,0% am ganzen Hüftknochen beobachtet werden. Im Hüftknochenbereich konnte bei 72,5% der Frauen die Knochendichte erhalten oder erhöht werden. Eine zweite Studie zeigte, dass der Anstieg nach zwei Jahren 1,3 ± 5,1% am Schenkelhals und 2,9 ± 3,4% am ganzen Hüftknochen betrug. Im Hüftknochenbereich konnte bei 84,7% der Frauen die Knochendichte erhalten oder erhöht werden.
Wirkung auf die Brust
- Klinische Studien haben gezeigt, dass die mammographische Dichte unter Tibolon im Vergleich zu Placebo nicht erhöht wird.
Pharmakokinetik
Absorption
Nach oraler Verabreichung wird Tibolon schnell und weitgehend vollständig absorbiert.
Die Resorption wird nicht durch die Nahrung beeinflusst.
Distribution
Keine Angaben.
Metabolismus
Aufgrund schneller Metabolisierung sind die Plasmakonzentrationen von Tibolon sehr niedrig. Auch die Plasmaspiegel des Δ4-Isomer von Tibolon sind sehr niedrig. Deshalb können einige pharmakokinetische Parameter nicht bestimmt werden.
Die maximalen Plasmawerte des 3-α-OH- und des 3β-Metaboliten sind höher aber eine Akkumulation tritt nicht auf.
Tibolon | 3α-OH-Metabolit | 3β-OH-Metabolit | Δ4-Isomer | |||||
|---|---|---|---|---|---|---|---|---|
SD | MD | SD | MD | SD | MD | SD | MD | |
Cmax (ng/ml) | 1,37 | 1,72 | 14,23 | 14,15 | 3,43 | 3,75 | 0,47 | 0,43 |
Caverage | -- | -- | -- | 1,88 | -- | -- | -- | -- |
Tmax (h) | 1,08 | 1,19 | 1,21 | 1,15 | 1,37 | 1,35 | 1,64 | 1,65 |
T1/2 (h) | -- | -- | 5,78 | 7,71 | 5,87 | -- | -- | -- |
Cmin (ng/ml) | -- | -- | -- | 0,23 | -- | -- | -- | -- |
AUC0-24 (ng/ml) | -- | -- | 53,23 | 44,73 | 16,23 | 9,20 | -- | -- |
SD = single dose; MD = multiple dose
Elimination
Tibolon wird hauptsächlich in Form von konjugierten Metaboliten ausgeschieden (mehrheitlich in Form von Sulfaten). Tibolon selbst wird zu einem geringen Teil mit dem Urin, zum grössten Teil jedoch über die Galle und die Faeces ausgeschieden. Die Eliminationshalbwertszeit beträgt ca. 7 Stunden.
Kinetik spezieller Patientengruppen
Ältere Patientinnen: Die Pharmakokinetik einer Einzeldosis Tibolon bei postmenopausalen Frauen zeigte keinen klinisch relevanten Einfluss des Alters (45-55 Jahre versus 65-75 Jahre).
Nierenfunktionsstörungen: Die pharmakokinetischen Parameter des Tibolons und seiner Metaboliten sind von der Nierenfunktion unabhängig.
Leberfunktionsstörungen: Die Pharmakokinetik von Tibolon bei Patienten mit schwerer Leberinsuffizienz wurde nicht untersucht.
Präklinische Daten
In Tierstudien hatte Tibolon aufgrund der hormonalen Eigenschaften antifertile und embryotoxische Aktivitäten.
Bei Mäusen und Ratten war Tibolon nicht teratogen. Experimentelle Daten beim Kaninchen ergaben Hinweise auf Missbildungen. Die beobachteten Wirkungen in chronischen Toxizitätsstudien und Studien zur Karzinogenese bei Ratten und Mäusen sind auf die östrogenen Eigenschaften von Tibolon zurückzuführen. Tibolon wirkt in-vivo nicht genotoxisch. Die klinische Relevanz dieser Angaben ist nicht sicher.
Sonstige Hinweise
Beeinflussung diagnostischer Methoden
Sexualhormone können die Ergebnisse gewisser Labortests beeinflussen wie z.B. biochemische Parameter der Leber, Schilddrüse, Nebennieren- und Nierenfunktion, Plasmaspiegel von Bindungsproteinen und Lipid/Lipoprotein-Fraktion, Parameter des Kohlehydratstoffwechsels, der Koagulation und der Fibrinolyse.
Eine Behandlung mit Tibolon führt zu einer geringen Abnahme der Konzentrationen von Thyroxin-bindendem Globulin (TBG) und Gesamt-T4. Die Gesamtkonzentration von T3 bleibt unverändert. Tibolon reduziert die Konzentration von Bindungsproteinen der Geschlechtshormone (SHBG), während die Spiegel des Cortisol-bindenden Globulins (CBG) und des zirkulierenden Cortisols nicht beeinflusst werden.
Haltbarkeit
Das Medikament darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Nicht über 30 °C lagern. In der Originalverpackung vor Licht und Feuchtigkeit geschützt und ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer
68090 (Swissmedic)
Zulassungsinhaberin
Spirig HealthCare AG, 4622 Egerkingen
Stand der Information
Mai 2017.
Composition
Principes actifs
Tibolone
Excipients
Lactose monohydraté 43.15 mg, mannitol, amidon de pomme de terre, stéarate de magnésium, palmitate d'ascorbyle (E 304).
Forme pharmaceutique et quantité de principe actif par unité
1 comprimé contient 2.5 mg de tibolone.
Indications/Possibilités d’emploi
Traitement des symptômes de la carence en œstrogènes consécutive à la ménopause naturelle ou artificielle (datant d'au moins un an).
Pour prévenir ou retarder l'apparition de l'ostéoporose induite par une carence en œstrogènes chez les femmes ménopausées encourant un risque élevé de fractures, chez lesquelles un traitement par d'autres médicaments autorisés pour la prévention de l'ostéoporose ne peut pas être envisagé ou chez les femmes qui souffrent en même temps de symptômes de carence en œstrogènes qui requièrent un traitement.
La décision de prescrire Tibolone Spirig HC doit, chez toutes les femmes, être précédée d'un examen individuel en ce qui concerne le risque global; le risque d'accident vasculaire cérébral doit être pris en considération, notamment chez des femmes de plus de 60 ans (voir aussi sous «Mises en garde et précautions»).
Posologie/Mode d’emploi
La posologie est de 1 comprimé par jour.
Dans toutes les indications, la durée du traitement doit toujours être aussi courte que possible. Le traitement hormonal substitutif (THS) ne doit être poursuivi que tant que le bénéfice l'emporte sur le risque pour la patiente considérée.
Le traitement par Tibolone Spirig HC ne doit pas être complété par un progestatif supplémentaire.
Il faut prendre les comprimés avec un peu d'eau ou un autre liquide, si possible toujours à la même heure.
Début de la prise de Tibolone Spirig HC
Le traitement par Tibolone Spirig HC doit être entrepris au plus tôt 12 mois après les dernières règles naturelles. L'instauration plus précoce d'un traitement par Tibolone Spirig HC peut augmenter la fréquence des hémorragies irrégulières ou du spotting. En cas de ménopause induite par une intervention chirurgicale ou une chimiothérapie, le traitement par Tibolone Spirig HC peut être entrepris immédiatement.
Remplacement d'un autre produit de THS par Tibolone Spirig HC
Chez les femmes à utérus intact, chez lesquelles on remplace un traitement hormonal substitutif purement œstrogénique par Tibolone Spirig HC, il faut induire une hémorragie de privation par un progestatif avant le début de la prise de Tibolone Spirig HC. Quand on utilise Tibolone Spirig HC pour remplacer un THS séquentiel, il faut entreprendre le traitement par Tibolone Spirig HC immédiatement après la fin de l'hémorragie de privation. Le remplacement d'un THS combiné par Tibolone Spirig HC est possible à tout moment.
Conduite à tenir en cas d'oubli de la prise
Si une prise a été oubliée, il faut prendre la dose omise le plus rapidement possible, sauf si la dernière prise remonte à plus de 12 heures. Dans ce cas, il ne faut pas prendre la dose oubliée et prendre la dose suivante prescrite à l'heure habituelle.
Instructions spéciales pour la posologie
Personnes âgées: aucune adaptation de la dose n'est nécessaire chez les patientes âgées.
Insuffisance rénale: il n'est pas nécessaire d'adapter la dose chez les patientes dont la fonction rénale est restreinte.
Insuffisance hépatique: la tibolone est contre-indiquée chez les patientes présentant une insuffisance hépatique.
Population pédiatrique: la tibolone n'est pas indiquée chez la population pédiatrique.
Contre-indications
Dans les situations suivantes ou en cas d'apparition des maladies suivantes pendant la prise de Tibolone Spirig HC, il ne faut pas prendre Tibolone Spirig HC ou il faut arrêter immédiatement le traitement:
- présence ou antécédents de cancer du sein, ou suspicion d'un tel cancer
- présence ou suspicion de tumeurs hormono-dépendantes (par exemple, cancers de l'endomètre)
- hyperplasie de l'endomètre non traitée
- hémorragies vaginales d'origine indéterminée
- présence ou antécédents d'événements thromboemboliques veineux (p.ex. thrombose veineuse profonde, embolie pulmonaire)
- présence ou antécédents d'événements thromboemboliques artériels (angine de poitrine, infarctus du myocarde, accident vasculaire cérébral ou accident ischémique transitoire)
- maladies thrombophiliques connues (p.ex. déficit en protéine C, en protéine S ou en antithrombine, voir sous «Mises en garde et précautions»)
- maladie hépatique aiguë ou antécédents de maladie hépatique, tant que les paramètres hépatiques sont augmentés
- porphyrie
- grossesse, allaitement
- hypersensibilité connue à l'un des composants de Tibolone Spirig HC
Mises en garde et précautions
Un traitement des symptômes de la ménopause ne doit être instauré que lorsque ceux-ci diminuent la qualité de vie.
Avant l'instauration d'un traitement par la tibolone ou d'un autre traitement hormonal substitutif, il faut (en tenant compte des contre-indications et des précautions) pratiquer un examen clinique général ainsi qu'un examen gynécologique approfondi incluant les organes pelviens et les seins. Ces examens doivent être répétés au moins une fois par an. Il faut également prendre en compte les antécédents personnels et familiaux. Il faut soigneusement peser le rapport bénéfice/risque avant chaque traitement, individuellement pour chaque patiente, et le réévaluer dans le cadre des examens de contrôle annuels. Il faut toujours opter pour la durée de traitement la plus courte possible.
Lorsque Tibolone Spirig HC ou un autre traitement est envisagé chez la femme postménopausée, les points suivants doivent être pris en compte individuellement pour chaque patiente: indication thérapeutique, acceptation d'hémorragies vaginales, éventualité de fluctuations de l'humeur ou de troubles de la libido, effets sur le tissu mammaire et autres bénéfices et risques.
Toute hémorragie vaginale anormale, qu'elle survienne sous un THS ou en l'absence de traitement hormonal, nécessite une exploration avant le début d'un traitement par Tibolone Spirig HC, notamment pour exclure des causes malignes.
Motifs imposant l'arrêt immédiat du traitement
Le traitement doit être arrêté en cas de survenue d'une contre-indication et dans les situations suivantes:
- symptômes ou suspicion d'une maladie thromboembolique veineuse ou artérielle
- première apparition de céphalées migraineuses ou céphalées répétées, inhabituellement intenses
- perte soudaine, partielle ou complète, de la vision
- trouble soudain de l'audition
- élévation significative de la pression artérielle
- ictère, hépatite ou détérioration de la fonction hépatique
Maladies qui exigent une surveillance médicale particulière
Si l'une des maladies ou l'un des risques suivants sont présents ou sont survenus par le passé et/ou se sont aggravés pendant une grossesse ou pendant des traitements hormonaux antérieurs, il faut étroitement surveiller la patiente. En effet, ces maladies peuvent récidiver ou s'aggraver pendant la prise de Tibolone Spirig HC. Cela vaut tout particulièrement pour les maladies suivantes:
- facteurs de risque de tumeurs œstrogéno-dépendantes, p.ex. cancer du sein chez des parents du premier degré
- antécédents personnels ou familiaux d'hyperplasie de l'endomètre (voir ci-dessous)
- léiomyomes ou endométriose
- facteurs de risque d'affections thromboemboliques (voir ci-dessous)
- hypertension
- migraine ou (fortes) céphalées
- diabète sucré avec ou sans atteinte vasculaire
- affections hépatiques (par exemple adénome hépatique) ou biliaires (p.ex. cholélithiase)
- lupus érythémateux disséminé
- épilepsie
- asthme
- otosclérose
Maladies tumorales
Cancer du sein
Non seulement les études randomisées contrôlées mais aussi les études épidémiologiques ont montré une augmentation du risque de cancer du sein chez les femmes utilisant un THS pendant plusieurs années. C'est pourquoi, chez toutes les femmes, le médecin doit examiner les seins avant le début d'un THS et ensuite tous les ans et les patientes doivent pratiquer des auto-examens mammaires mensuels. Selon l'âge et les facteurs de risque individuels, il faut aussi réaliser le cas échéant une mammographie. Les femmes doivent être informées de la nécessité de signaler immédiatement à leur médecin toute modification de leurs seins.
Une méta-analyse de 51 études épidémiologiques a montré que le risque de développement d'un cancer du sein augmente en fonction de la durée du THS et diminue après l'arrêt du THS. Chez les femmes qui avaient utilisé un THS pendant 5 ans ou plus, le risque relatif de développement d'un cancer du sein était de 1,35 (IC à 95%: 1,21-1,49).
L'étude WHI a montré, au bout d'une durée moyenne de traitement de 5,6 ans, une augmentation de la fréquence des cancers du sein invasifs sous THS combiné comportant des œstrogènes conjugués et de l'acétate de médroxyprogestérone, comparativement au groupe placebo (risque relatif de 1,24 [IC à 95%: 1,02-1,50]). En revanche, sous œstrogènes en monothérapie, le risque n'était pas augmenté (risque relatif 0,77 [IC à 95%: 0,59-1,01]).
L'étude Million Women Study (MWS), une étude de cohortes non randomisée (âge moyen des femmes au moment de l'inclusion dans l'étude de 55,9 ans) a mis en évidence une augmentation significative du risque de cancer du sein à la posologie de 2,5 mg de tibolone. Dans cette étude, la moitié des femmes recevait un THS avant et/ou au moment de l'inclusion dans l'étude, tandis que l'autre moitié n'avait jamais reçu de THS. Avec tous les types de THS, le risque augmentait avec la durée d'utilisation. Après l'arrêt du traitement, le risque diminuait. Le risque maximal a été observé sous le traitement combiné œstrogéno-progestatif (2,00 [IC à 95%: 1,88-2,12]). Pour la monothérapie par œstrogènes, le risque relatif se situait à 1,30 (IC à 95%: 1,21-1,40) et pour la tibolone à 1,45 (IC à 95%: 1,25-1,68). Une étude épidémiologique utilisant la General Practice Research Database (GPRD) n'a pas pu confirmer ces résultats.
Chez les utilisatrices de tibolone, il faut s'attendre à 3 cas supplémentaires (IC à 95%: 0-6) pour 1000 femmes.
Dans une étude contrôlée menée comparativement à un placebo (étude LIBERATE) réalisée auprès de n=3148 femmes (âge moyen de 52,7 ans) ayant des antécédents de cancer du sein, le risque de récidives de cancer du sein était significativement accru sous tibolone (2,5 mg par jour) par rapport au placebo au bout d'une période d'observation de trois ans (HR 1,40, IC à 95%: 1,14-1,70). La tibolone est donc contre-indiquée chez les patientes ayant un antécédent de cancer du sein.
Hyperplasie et cancer de l'endomètre
Chez les femmes à utérus intact, le risque de cancer de l'endomètre est plus élevé sous traitement par des œstrogènes en monothérapie que chez les femmes non traitées et ce risque semble dépendre de la durée du traitement et de la dose d'œstrogènes. Le risque semble être maximal en cas d'utilisation prolongée. Il a été établi que l'adjonction d'un progestatif au traitement œstrogénique permet de réduire le risque d'hyperplasie de l'endomètre, laquelle est considérée comme un stade précurseur du cancer de l'endomètre.
Jusqu'à présent, il n'est pas établi avec certitude si l'augmentation du risque de cancer de l'endomètre s'applique aussi à la tibolone. Les données disponibles émanant des études cliniques sont contradictoires. Des études épidémiologiques suggèrent cependant que le risque de cancer de l'endomètre pourrait également être accru sous tibolone. Le risque d'altérations malignes de l'endomètre augmente avec la durée d'utilisation.
L'augmentation maximale du risque a été observée dans une étude (étude LIFT) randomisée, menée comparativement à un placebo, portant sur n=3519 femmes (âge moyen de 68 ans) ne subissant pas d'examen régulier de l'utérus. Dans cette étude, au bout de 2,9 ans, aucun cas de cancer de l'endomètre n'a été diagnostiqué dans le groupe placebo (n=1773) par rapport à 4 cas dans le groupe tibolone (n=1746). Ceci correspond à 0,8 cas supplémentaire pour 1000 femmes qui ont utilisé la tibolone durant 1 an.
Dans l'étude Million Women Study, on a également observé un risque accru de cancer de l'endomètre chez les femmes qui utilisaient la tibolone (RR 1,8, IC à 95%: 1,4-2,3), le risque augmentant avec la durée d'utilisation.
A l'échographie transvaginale, la tibolone augmente la densité endométriale.
Pendant les premiers mois du traitement, des métrorragies et un spotting peuvent survenir (voir «Propriétés/Effets»). Il faut demander aux femmes d'informer leur médecin si des métrorragies ou un spotting surviennent encore après six mois de traitement, réapparaissent en cours de traitement ou persistent après l'arrêt du traitement. Dans de tels cas, un examen gynécologique doit être effectué afin d'exclure des altérations malignes de l'endomètre (y compris une biopsie de l'endomètre).
Cancer de l'ovaire
Plusieurs études épidémiologiques indiquent qu'un THS pourrait être associé à un risque accru de développement d'un cancer épithélial de l'ovaire. Une augmentation du risque a été observée aussi bien pour la monothérapie par œstrogènes que pour un THS combiné. Tandis que la plupart des études faisaient apparaître une augmentation du risque uniquement lors d'une utilisation prolongée (c'est-à-dire pendant au moins 5 ans), une méta-analyse publiée en 2015 (prenant en compte 17 études prospectives et 35 études rétrospectives) n'a pas montré un tel lien avec la durée d'utilisation. Dans la Million Women Study, le risque de cancer de l'ovaire sous tibolone était comparable à celui observé sous d'autres THS.
Dans l'étude prospective randomisée WHI, contrôlée contre placebo (dans laquelle aucune patiente sous tibolone n'avait été incluse), une augmentation statistiquement non significative du risque (HR 1,41; IC à 95%: 0,75-2,66) a été observée.
Les cancers de l'ovaire étant beaucoup plus rares que les cancers du sein, l'augmentation absolue du risque chez les femmes qui reçoivent ou qui ont reçu jusqu'à récemment un THS est faible.
Maladies thromboemboliques
Cardiopathie coronarienne
Le traitement hormonal substitutif ne doit pas être utilisé pour la prévention des maladies cardiovasculaires. De vastes études cliniques n'ont pas montré d'effets favorables pour la prévention primaire (étude WHI) ou la prévention secondaire (étude HERS) des maladies cardiovasculaires. De même, une étude épidémiologique basée sur la General Practice Research Database (GPRD) n'a pas mis en évidence de protection contre les infarctus du myocarde chez des femmes postménopausées qui prenaient de la tibolone.
L'étude Women's Health Initiative (WHI), vaste étude prospective, randomisée, menée comparativement à un placebo, a porté sur plus de 8000 femmes assez âgées (âge au début de l'étude compris entre 50 et 79 ans, âge moyen de 63 ans), qui ont reçu un traitement hormonal substitutif (THS) oral comportant des œstrogènes conjugués et de l'acétate de médroxyprogestérone pendant une durée moyenne de 5,2 ans. Cette étude a montré une augmentation du risque d'événements cardiovasculaires, comparativement au placebo (risque relatif de 1,24 [IC à 95%: 1,00-1,54], une augmentation absolue du risque de 6 cas pour 10'000 années-femmes). Le risque était maximal pendant la première année suivant le début du THS (risque relatif de 1,81 [IC à 95%: 1,09-3,01]). Plus la ménopause était ancienne, plus le risque augmentait (ménopause datant de moins de 10 ans: risque relatif de 0,89; ménopause datant de 10 à 19 ans: risque relatif de 1,22; ménopause datant de 20 ans ou plus: risque relatif de 1,71). Dans le bras ayant reçu les œstrogènes en monothérapie, aucun effet significatif sur le risque cardio-vasculaire n'a été observé (risque relatif de 0,91 [IC à 95%: 0,75-1,12]).
L'étude Heart and Estrogen/Progestin Replacement Study (HERS et HERS II) est une étude prospective, randomisée, menée comparativement à un placebo chez plus de 1300 femmes ménopausées présentant déjà une maladie coronarienne (âge moyen au moment de l'inclusion dans l'étude de 67 ans). Ces patientes ont reçu un THS oral comportant des œstrogènes conjugués et de l'acétate de médroxyprogestérone, pendant une durée moyenne de 4,1 ans (étude HERS) et de 2,7 ans (étude HERS II). Ces études n'ont pas montré de réduction du risque cardiovasculaire. Le risque relatif était de 0,99 (IC à 95%: 0,84-1,17). Le risque était maximal pendant la première année suivant le début du THS (risque relatif de 1,52 [IC à 95%: 1,01-2,29]).
Bien que nous ne sachions pas encore pour l'instant dans quelle mesure les résultats de ces deux études peuvent être extrapolés à une population plus jeune ou à des produits de THS contenant d'autres principes actifs (outre Tibolone Spirig HC), le médecin doit en tenir compte avant de prescrire un THS. Chez les femmes qui présentent déjà des facteurs de risque d'événements vasculaires cérébraux ou cardiovasculaires, il faut si possible envisager d'autres traitements
Accident vasculaire cérébral ischémique
La tibolone augmente le risque d'accident vasculaire cérébral ischémique dès la première année d'utilisation. Dans l'étude WHI, le risque cérébrovasculaire a également été augmenté, non seulement sous le traitement œstro-progestatif combiné (RR 1,31 [IC à 95%: 1,02-1,68] mais aussi sous le traitement par œstrogènes seuls (RR 1,39 [IC à 95%: 1,10-1,77]).
Une étude randomisée, contrôlée, portant sur n=4506 femmes (âge moyen de 68 ans) a mis en évidence au bout de 2,9 ans un risque d'accident vasculaire cérébral 2,2 fois plus élevé chez les femmes traitées par 1,25 mg de tibolone (28/2249) que chez les femmes sous placebo (13/2257). Dans la grande majorité des cas (80%), il s'agissait d'événements ischémiques. La dose de 2,5 mg de tibolone n'a pas été examinée au cours de cette étude.
Le risque relatif est indépendant de l'âge ou du délai écoulé depuis la ménopause. Comme le risque de base d'accident vasculaire cérébral dépend toutefois fortement de l'âge, le risque global augmente avec l'âge chez les femmes qui prennent la tibolone (ou un autre THS). Chez les femmes qui utilisent la tibolone durant 5 ans, on estime qu'il faut s'attendre à 4 cas supplémentaires pour 1000 utilisatrices dans la tranche d'âge des 50-59 ans et à 13 cas supplémentaires pour 1000 utilisatrices dans la tranche d'âge des 60-69 ans.
Thromboembolies veineuses
Le traitement hormonal substitutif est associé à un risque accru d'événements thromboemboliques veineux, tels que thrombose veineuse profonde (TEV) ou embolie pulmonaire. Deux études contrôlées randomisées (études WHI et HERS) et plusieurs études épidémiologiques ont montré que le risque était 1,3 à 3 fois plus élevé chez les femmes ayant utilisé un THS que chez les femmes n'ayant jamais reçu un tel traitement. L'étude WHI a montré en particulier une augmentation de l'incidence des embolies pulmonaires. Le risque supplémentaire absolu chez les femmes ayant reçu un THS combiné était de 8 cas pour 10 000 femmes (15 versus 7) et le risque relatif était de 2,13 (IC à 95%: 1,39-3,25). Cette augmentation du risque n'a été constatée que chez les femmes sous THS et non chez les femmes qui avaient antérieurement utilisé un THS. Le risque d'événement thromboembolique est maximal durant la première année d'un THS.
Dans le bras de l'étude WHI ayant reçu des œstrogènes en monothérapie, on a aussi constaté une tendance en faveur d'une augmentation du risque de thromboembolies veineuses. Le risque relatif de thrombose veineuse profonde était de 1,47 (IC à 95%: 0,87-2,47) et celui d'embolie pulmonaire de 1,34 (IC à 95%: 0,70-2,55).
Pour les non-utilisatrices, le nombre de cas de TEV en l'espace de 5 ans est estimé à 3 cas pour 1000 femmes dans la tranche d'âge des 50-59 ans et à 8 cas pour 1000 femmes dans la tranche d'âge des 60-69 ans. Chez les femmes en bonne santé qui utilisent un THS pendant 5 ans, le nombre de cas supplémentaires de TEV a été estimé entre 2 et 6 cas dans la tranche d'âge des 50-59 ans et entre 5 et 15 cas dans la tranche d'âge des 60-69 ans, pour 1000 femmes.
S'il apparaît des symptômes évocateurs (par exemple, gonflement douloureux d'une jambe, douleurs soudaines dans la poitrine, détresse respiratoire) ou en cas de suspicion de maladie thromboembolique, il faut immédiatement arrêter le produit et consulter le médecin. Il faut étroitement surveiller les patientes qui présentent des facteurs de risque d'événements thromboemboliques. Chez ces femmes, le rapport bénéfice/risque doit être soigneusement évalué et, dans la mesure du possible, il faut envisager d'autres traitements.
Les facteurs de risque de thromboembolies veineuses sont les suivants: antécédents personnels ou familiaux correspondants, tabagisme, obésité sévère (index de masse corporelle dépassant 30 kg/m2), lupus érythémateux disséminé et affections malignes. Le risque de thromboembolies veineuses augmente également avec l'âge. Il n'y a pas de consensus à propos du rôle éventuel des varices dans la survenue des thromboembolies veineuses.
S'il y a des antécédents d'avortements spontanés à répétition, il faut effectuer un bilan pour exclure une prédisposition à la thrombophilie. Si ce diagnostic est posé, l'utilisation d'un THS est contre-indiquée.
Chez les femmes qui présentent une combinaison de facteurs de risque ou un degré de gravité élevé d'un seul facteur de risque, on tiendra compte du fait que le risque peut être augmenté de façon plus qu'additive. Il peut en résulter, selon les circonstances, une contre-indication au traitement hormonal substitutif.
Le risque de thromboembolies veineuses peut être temporairement augmenté en cas d'immobilisation prolongée, d'interventions chirurgicales majeures ou après un traumatisme sévère. Chez les femmes recevant un THS, il convient d'accorder une grande attention aux mesures prophylactiques pour éviter les thromboembolies veineuses postopératoires. Suivant la nature de l'intervention et la durée de l'immobilisation, il faut envisager une suspension temporaire du THS, 4 à 6 semaines avant l'intervention lors d'opérations programmées. Il ne faut reprendre le traitement qu'une fois que la femme a parfaitement retrouvé sa mobilité.
Chez les femmes sans antécédents de TEV mais dont des parents du premier degré ont déjà eu une thrombose à un âge jeune, on peut envisager un dépistage de la thrombophilie. Si une anomalie thrombophilique est constatée et si, par ailleurs, des thromboses sont connues chez des parents de la patiente ou si l'anomalie constatée est grave (p.ex. déficit en antithrombine, en protéine S ou en protéine C ou une combinaison d'anomalies), la tibolone est alors contre-indiquée.
Chez les femmes qui sont déjà traitées par des anticoagulants, une évaluation minutieuse du rapport bénéfice/risque de la tibolone est nécessaire.
Démence
Dans la Women's Health Initiative Memory Study (WHIMS), une étude randomisée menée comparativement à un placebo dans le cadre de l'étude WHI, plus de 2000 femmes âgées de plus de 65 ans (âge moyen: 71 ans) ont été traitées par voie orale par des œstrogènes équins conjugués et de l'acétate de médroxyprogestérone et ont été suivies pendant 4 ans en moyenne. En outre, 1464 femmes hystérectomisées, âgées de 65 à 79 ans, ont été traitées uniquement par des œstrogènes équins conjugués par voie orale et ont été suivies pendant 5,2 ans en moyenne. Ni le traitement associant œstrogènes conjugués équins et acétate de médroxyprogestérone ni les œstrogènes en monothérapie n'ont eu d'effet favorable sur les fonctions cognitives. Le risque de survenue d'une démence probable était même augmenté avec le THS combiné (risque relatif de 2,05 [IC à 95%: 1,21-3,48]). En nombres absolus, cela représente, par an, 23 cas supplémentaires pour 10 000 femmes traitées.
Même si l'on ignore encore dans quelle mesure les résultats de ces deux études peuvent être extrapolés à une population plus jeune ou à des produits de THS contenant d'autres principes actifs (comme Tibolone Spirig HC), le médecin doit en tenir compte quand il évalue le rapport bénéfice/risque d'un THS.
Autres maladies
Les œstrogènes peuvent provoquer une rétention liquidienne. C'est pourquoi il faut étroitement surveiller les patientes présentant des maladies cardiaques ou rénales.
Aucun lien avéré entre l'utilisation d'un THS et la survenue d'une hypertension artérielle clinique n'a été documenté à ce jour. Une légère élévation de la pression artérielle a été observée chez des femmes sous THS, mais une élévation cliniquement importante est rare. Si, pendant le TSH, des valeurs durablement élevées de la pression artérielle sont mesurées, il faut envisager un arrêt du THS.
La tibolone influe sur les lipides sériques. Sur la base des résultats de 18 études au total, les effets suivants ont été observés: le traitement par la tibolone a entraîné une nette diminution dépendante de la dose du cholestérol HDL. Au bout de deux ans de traitement, le taux de HDL a baissé de 14,5% sous 0,625 mg, de 16,7% sous 1,25 mg et de 21,8% sous 2,5 mg. En même temps, le cholestérol total, le cholestérol VLDL, les triglycérides et la lipoprotéine (a) ont diminué également, bien que l'on n'ait pas pu clairement identifier ici de dépendance de la dose. En revanche, le cholestérol LDL est resté inchangé. Jusqu'à présent, l'importance clinique de ces résultats n'est pas connue.
Pendant la prise de produits contenant des œstrogènes ou d'autres préparations de THS, il faut étroitement surveiller les femmes qui présentent une hypertriglycéridémie préexistante (en particulier des formes familiales), étant donné qu'en présence de cette affection, on a signalé dans de rares cas une très forte augmentation du taux de triglycérides pendant une œstrogénothérapie, qui a conduit à une pancréatite.
Si une endométriose devait être réactivée pendant un THS, il est recommandé d'arrêter le traitement.
Sous l'association de principes actifs ombitasvir/paritaprévir/ritonavir avec ou sans dasabuvir, une hausse cliniquement significative des ALAT (y compris des cas d'augmentation de plus de 5 fois la limite supérieure à la normale) a été observée significativement plus souvent chez les patientes atteintes d'hépatite C qui utilisaient simultanément un contraceptif à l'éthinylestradiol (EE) que chez les patientes traitées exclusivement par des substances antivirales. À l'inverse, chez les patientes utilisant d'autres œstrogènes (estradiol et valérate d'estradiol, en particulier), l'incidence d'une augmentation des transaminases n'était pas supérieure à celle des patientes sans œstrogénothérapie. Le nombre limité de cas ne permet cependant pas d'exclure un risque similaire à celui de l'EE. On ne dispose d'aucune donnée correspondante pour la tibolone. Le mécanisme de cette interaction étant complètement inconnu, il n'est actuellement pas possible de déterminer si la tibolone pourrait également être concernée par cette interaction en raison de son effet de type œstrogénique. La prudence est donc de rigueur lors de l'administration concomitante de Tibolone Spirig HC avec l'association de principes actifs ombitasvir/paritaprévir/ritonavir avec ou sans dasabuvir.
Tibolone Spirig HC n'a aucun effet contraceptif.
Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Les patientes atteintes de rares problèmes héréditaires de tolérance au galactose, d'une déficience en lactase de Lapp ou de malabsorption du glucose/galactose ne doivent pas utiliser le médicament.
Les risques susmentionnés du THS ont été décrits essentiellement lors du traitement de femmes âgées de ≥50 ans. On ne dispose d'aucune donnée sur la possibilité d'extrapolation de ces données à des patientes qui présentent une ménopause précoce (c.-à-d. arrêt de la fonction ovarienne avant l'âge de 40 ans révolus à la suite de maladies endocriniennes/génétiques, d'une ovariectomie, d'un traitement anticancéreux, etc.) jusqu'à ce qu'elles arrivent à l'âge normal de la ménopause. Dans ce groupe d'âge, une évaluation minutieuse du rapport bénéfice/risque doit être effectuée, en tenant également compte de l'étiologie de la ménopause précoce (chirurgie versus autres causes).
Le diagnostic et l'instauration du traitement chez les patientes qui présentent une ménopause précoce doivent être réalisés, dans la mesure du possible, dans un centre spécialisé expérimenté dans le traitement de cette maladie.
Interactions
Interactions pharmacocinétiques
On ne dispose que de données limitées sur des interactions pharmacocinétiques avec la tibolone. D'après des études menées in vitro, la tibolone n'a qu'une très faible influence sur les enzymes du cytochrome P450. Il est donc peu probable que la tibolone soit un inhibiteur cliniquement notable du cytochrome P450.
Des études menées in vivo ont cependant montré que la tibolone modifiait légèrement la pharmacocinétique du midazolam, lequel est métabolisé par le CYP3A4. En conséquence, des interactions sont possibles avec d'autres substrats du CYP3A4.
Les inducteurs du CYP3A4 tels que barbituriques, carbamazépine, hydantoïne et rifampicine ainsi que les médicaments phytothérapeutiques contenant du millepertuis (Hypericum perforatum) peuvent augmenter le métabolisme de la tibolone et ainsi modifier son effet thérapeutique. Cliniquement, ceci peut entraîner une diminution de l'efficacité et/ou des changements du profil de saignements.
Interactions pharmacodynamiques
Comme la tibolone peut augmenter l'activité fibrinolytique du sang (diminution du taux de fibrinogène; augmentation des taux d'AT III, de plasminogène et de l'activité fibrinolytique), elle peut renforcer l'effet des anticoagulants.
Une étude d'interactions a montré que la tibolone augmentait l'effet de la warfarine. Il faut donc surveiller, de ce point de vue, les femmes qui prennent Tibolone Spirig HC et requièrent en même temps une anticoagulation, surtout au début de la prise de Tibolone Spirig HC et après la fin de ce traitement. En cas de nécessité, la dose de warfarine doit être adaptée.
Grossesse/Allaitement
Il n'existe pas de données concernant l'emploi de la tibolone chez la femme enceinte. Des données recueillies chez l'animal indiquent un risque fœtal. Etant donné que le risque pour l'être humain est inconnu, l'usage de Tibolone Spirig HC est contre-indiqué pendant la grossesse.
Il ne faut pas prendre ce médicament pendant l'allaitement car il peut réduire la production du lait et en modifier la qualité.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude correspondante n'a été effectuée.
On ignore si Tibolone Spirig HC a une influence sur l'attention et la capacité de concentration.
Effets indésirables
Etudes contrôlées
La sécurité de la tibolone a été évaluée dans 21 études menées comparativement à un placebo. Dans ces études, 3476 femmes ont reçu un placebo et 4079 femmes ont été traitées par 1,25 mg ou 2,5 mg de tibolone par jour. La durée de traitement a été comprise entre 2 mois et 4,5 ans. Les effets indésirables observés dans ces études et pendant la surveillance post-commercialisation sont indiqués ci-après par classes de systèmes d'organes et par fréquence.
Les fréquences des effets indésirables sont définies comme suit:
Fréquents (≥1/100 à <1/10), occasionnels (≥1/1000 à <1/100), rares (≥1/10 000 à <1/1000), fréquence inconnue (basée essentiellement sur des rapports spontanés issus de la surveillance post-commercialisation (PMS), la fréquence exacte ne peut donc pas être estimée).
Troubles du métabolisme et de la nutrition
Fréquents: prise de poids.
Affections du système nerveux
Fréquence inconnue: céphalées, vertige, obnubilation, migraine, dépression.
Affections oculaires:
Fréquence inconnue: troubles de la vue (p.ex. vision trouble).
Affections vasculaires
Rares: accident vasculaire cérébral.
Affections gastro-intestinales
Fréquents: douleurs abdominales.
Fréquence inconnue: nausée.
Affections hépatobiliaires:
Fréquence inconnue: trouble de la fonction hépatique.
Affections de la peau et du tissu sous-cutané
Fréquents: hypertrichose.
Occasionnels: acné.
Fréquence inconnue: éruption cutanée, prurit, séborrhée.
Troubles musculosquelettiques et du tissu conjonctif
Fréquence inconnue: myalgies, arthralgies.
Affections des organes de reproduction et du sein
Fréquents: hypertrophie de l'endomètre ou épaississement de l'endomètre à l'échographie, douleurs mammaires, prurit génital, vaginites, candidose génitale, hémorragies vaginales (également du spotting), douleurs pelviennes, modifications du frottis cervical (y compris dysplasie), leucorrhée, vulvovaginite.
Occasionnels: symptômes mammaires, mycose, mycoses vaginales, douleurs mamelonnaires.
Troubles généraux et anomalies au site d'administration
Fréquence inconnue: œdèmes.
Parmi les effets indésirables susmentionnés, les hémorragies vaginales ou du spotting, les douleurs abdominales, les sensations de tensions dans les seins surviennent principalement durant les premiers mois du traitement et disparaissent ensuite.
Les effets indésirables suivants ont en outre été observés en rapport avec des œstrogènes en monothérapie ou un THS combiné:
tumeurs hormono-dépendantes, bénignes et malignes, variations pondérales, troubles du sommeil, fluctuations de l'humeur, changements de la libido, palpitations, élévation de la pression artérielle, événements thromboemboliques veineux et artériels (p.ex. thrombose veineuse profonde, infarctus du myocarde), affections de la vésicule biliaire, ictère cholestatique, chloasma, hirsutisme, alopécie, urticaire, érythème polymorphe, érythème noueux, purpura vasculaire, douleurs dorsales, augmentation de la taille de myomes utérins, augmentation de la taille des seins.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Chez l'animal, la toxicité aiguë de la tibolone est très faible. On peut donc considérer qu'il n'y a pas de phénomènes d'intoxication, même en cas de prise concomitante de plusieurs comprimés. En cas de surdosage aigu, on peut noter des nausées, des vomissements et des hémorragies de privation. On ne connaît pas d'antidote spécifique. Si la situation l'exige, on peut instaurer un traitement symptomatique.
Propriétés/Effets
Code ATC
G03CX01
Mécanisme d'action
Après administration orale, la tibolone est rapidement transformée en trois métabolites différents qui contribuent au profil pharmacologique de tibolone. Deux de ces métabolites (3α-OH-tibolone et 3β-OH-tibolone) exercent un effet œstrogénique, tandis que le troisième métabolite (isomère Δ4 de la tibolone) possède des effets progestatifs et androgéniques. Chez les femmes ménopausées, Tibolone Spirig HC compense la disparition de la production d'œstrogènes et soulage les symptômes de la ménopause. Tibolone Spirig HC prévient la déperdition osseuse due à la ménopause ou à une ovariectomie.
Pharmacodynamique
voir sous «Mécanisme d'action».
Efficacité clinique
Soulagement des symptômes de la ménopause liés à la carence en œstrogènes
- En général, une amélioration des symptômes de la postménopause est obtenue dans les premières semaines de traitement.
Effets sur l'endomètre et sur les caractéristiques des hémorragies
- Des hyperplasies de l'endomètre et des cancers de l'endomètre ont été rapportés chez des patientes traitées par Tibolone (voir sous «Mises en garde et précautions»).
- Une aménorrhée a été observée chez 88% des femmes au bout de 12 mois de traitement par Tibolone 2,5 mg. Des métrorragies et/ou un spotting ont été rapportés chez 32,6% des femmes pendant les 3 premiers mois de traitement et chez 11,6% des femmes au bout de 11 à 12 mois de traitement.
Prophylaxie de l'ostéoporose
- La carence œstrogénique après la ménopause entraîne une augmentation du turnover osseux et une diminution de la masse osseuse. L'effet protecteur de la tibolone semble garanti aussi longtemps que le traitement est poursuivi. Après la fin d'un THS, la résorption osseuse est comparable à celle observée chez les femmes non traitées.
- Après deux ans de traitement par Tibolone, la densité minérale osseuse (DMO) du rachis a augmenté de 2,6 ± 3,8%. Chez 76% des femmes, la densité osseuse rachidienne a pu être préservée ou augmentée. Une deuxième étude a confirmé ces résultats. Tibolone (2,5 mg) agit aussi sur la densité osseuse de la hanche. Une étude a montré, au bout de 2 ans, une augmentation de 0,7 ± 3,9% au niveau du col du fémur et une augmentation de 1,7 ± 3,0% dans l'ensemble de la hanche. Chez 72,5% des femmes, la densité osseuse de la hanche a pu être préservée ou augmentée. Une deuxième étude a montré qu'au bout de 2 ans, l'augmentation était de 1,3 ± 5,1% au niveau du col du fémur et de 2,9 ± 3,4% dans l'ensemble de la hanche. Chez 84,7% des femmes, la densité osseuse au niveau de la hanche a été préservée, voire augmentée.
Effet sur les seins
- Des études cliniques ont montré que la densité mammographique n'est pas plus forte sous Tibolone que sous placebo.
Pharmacocinétique
Absorption
Après administration orale, la tibolone est rapidement et quasiment complètement absorbée. La prise d'aliments ne modifie pas l'absorption.
Distribution
Aucune donnée disponible.
Métabolisme
Du fait de la transformation métabolique rapide, les concentrations plasmatiques de tibolone sont très faibles. Les taux plasmatiques de l'isomère Δ4 de la tibolone sont également très faibles. C'est pourquoi, certains paramètres pharmacocinétiques ne peuvent pas être déterminés.
Les concentrations plasmatiques maximales des métabolites 3-α-OH et 3β-OH sont plus élevées, mais il ne se produit pas d'accumulation.
Tibolone | Métabolite 3α-OH | Métabolite 3β-OH | Isomère Δ4 | |||||
|---|---|---|---|---|---|---|---|---|
DU | DM | DU | DM | DU | DM | DU | DM | |
Cmax (ng/ml) | 1,37 | 1,72 | 14,23 | 14,15 | 3,43 | 3,75 | 0,47 | 0,43 |
C moyenne | -- | -- | -- | 1,88 | -- | -- | -- | -- |
Tmax (h) | 1,08 | 1,19 | 1,21 | 1,15 | 1,37 | 1,35 | 1,64 | 1,65 |
T1/2 (h) | -- | -- | 5,78 | 7,71 | 5,87 | -- | -- | -- |
Cmin (ng/ml) | -- | -- | -- | 0,23 | -- | -- | -- | -- |
AUC0-24 (ng/ml) | -- | -- | 53,23 | 44,73 | 16,23 | 9,20 | -- | -- |
DU = dose unique; DM = doses multiples
Élimination
La tibolone est principalement excrétée sous la forme de métabolites conjugués (essentiellement sous la forme de sulfates). La tibolone elle-même est excrétée en faible proportion dans les urines et en majorité dans la bile et les selles. La demi-vie d'élimination est d'environ 7 heures.
Cinétique pour certains groupes de patients
Patientes âgées: la pharmacocinétique d'une dose unique de tibolone chez des femmes ménopausées n'a indiqué aucune influence cliniquement significative de l'âge (45 à 55 ans versus 65 à 75 ans).
Insuffisance rénale: les paramètres pharmacocinétiques de la tibolone et de ses métabolites sont indépendants de la fonction rénale.
Insuffisance hépatique: la pharmacocinétique de la tibolone n'a pas été étudiée chez des patients atteints d'insuffisance hépatique grave.
Données précliniques
Dans les expérimentations animales, la tibolone a perturbé la fertilité et exercé des effets embryotoxiques, ce qui s'explique par ses propriétés hormonales.
Chez la souris et le rat, la tibolone n'a pas eu d'effet tératogène. Les expérimentations menées chez le lapin ont montré des signes de malformations. Les effets observés dans les études de toxicité chronique et les études de cancérogénicité menées chez le rat et la souris sont imputables aux propriétés œstrogéniques de la tibolone. In vivo, la tibolone n'a pas d'effet génotoxique. La signification clinique de ces données n'est pas formellement connue.
Remarques particulières
Influence sur les méthodes de diagnostic
Les hormones sexuelles peuvent influencer les résultats de certains examens de laboratoire tels que les paramètres biochimiques du foie, de la glande thyroïde, des glandes surrénales et de la fonction rénale, les taux plasmatiques de protéines de liaison et de la fraction lipidique/lipoprotéinique, les paramètres du métabolisme glucidique, de la coagulation et de la fibrinolyse.
Un traitement par la tibolone entraîne une faible baisse des concentrations de globuline liant la thyroxine (TBG) et de T4 totale. La concentration totale de T3 reste inchangée. La tibolone diminue la concentration totale de protéines liant les hormones sexuelles (SHBG), tandis que les taux de la globuline liant le cortisol (CBG) et du cortisol circulant ne sont pas affectés.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver dans l'emballage d'origine à une température ne dépassant pas 30 °C et protéger de la lumière et de l'humidité. Conserver hors de portée des enfants.
Numéro d’autorisation
68090 (Swissmedic).
Titulaire de l’autorisation
Spirig HealthCare SA, 4622 Egerkingen.
Mise à jour de l’information
Mai 2017.
Отзывов (0)

Бесплатная консультация опытного специалиста
Опишите симптомы или нужный препарат – мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой на дом или просто проконсультируем.
Нас 14 специалистов и 0 ботов. Мы всегда будем с вами на связи и сможем связаться в любое время.

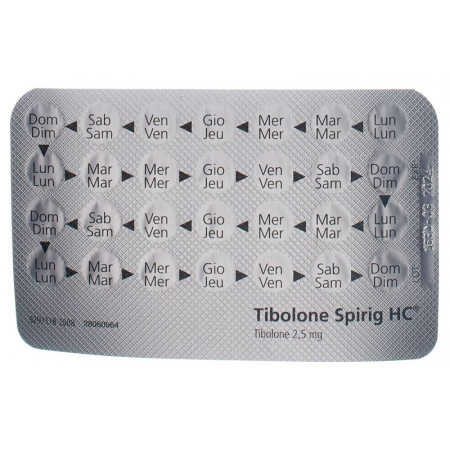
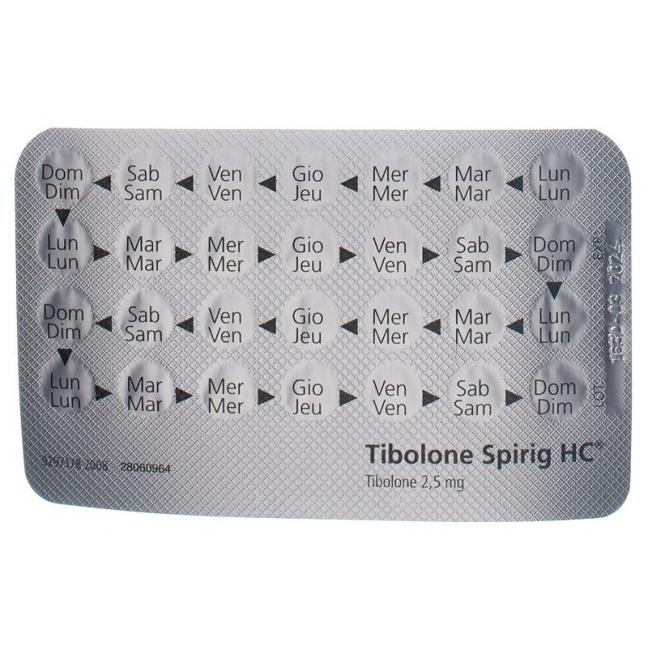

 Deutsch
Deutsch French
French Italian
Italian